Модуляторы калликреина 7, фармацевтическая композиция, содержащая эти соединения, способ лечения нарушений, опосредуемых активностью калликреина 7.
Номер патента: 18050
Опубликовано: 30.05.2013
Авторы: Флор Штефани, Берст Фредерик, Герхартц Бернд, Рандль Штефан Андреас, Остерманн Нильс, Майнгасснер Йозеф Готтфрид, Хассипен Ульрих, Марцинцик Андреас, Бодендорф Урсула, Эрхардт Клаус
Формула / Реферат
1. Соединение формулы

или его соль, в которой
R1 обозначает С2-С8алкинил или галоген,
X обозначает СН=СН или S,
Y обозначает группу формулы
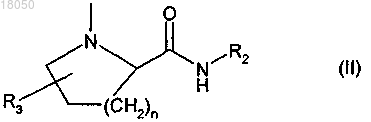
в которой
N-содержащая кольцевая система необязательно аннелирована с С3-С8циклоалкилом или C6-С18арилом,
n обозначает 1, 2 или 3,
R2 обозначает С1-С8алкил, диС1-С8алкиламино-С1-С8алкил, С1-С8алкокси-С1-С8алкил или (CH2)m-Z, где Z обозначает незамещенный или замещенный С3-С8циклоалкил, С6-С18арил или гетероциклил, имеющий 5-6 кольцевых членов и 1-2 гетероатома, выбранных из N или О, и m обозначает 0, 1 или 2,
R3 обозначает водород, С1-С8алкоксигруппу или С6-С18арил.
2. Соединение по п.1 или его соль, в котором
R1 обозначает водород, этинил, хлор или бром,
X обозначает СН=СН или S,
Y обозначает группу формулы (II), в которой
N-содержащая кольцевая система необязательно аннелирована с циклопропилом, циклопентилом или фенилом,
n обозначает 1 или 2,
R2 обозначает С1-С8алкил, С1-С4алкиламиногруппу, диС1-С4алкиламино-С1-С4алкил, C1-С4алкоксигруппу, С1-С4алкокси-С1-С4алкил или
группу (CH2)m-Z, в которой Z обозначает незамещенный циклогексил, незамещенный фенил, фенил, замещенный С1-С4алкоксигруппой, фенил, замещенный гетероциклилом, который имеет 6 кольцевых членов и 1 или 2 гетероатома, выбранных из N, О, или
незамещенный или замещенный гетероциклил, который имеет 6 кольцевых членов и 1 или 2 гетероатома, выбранных из N, О;
m обозначает 1 или 2,
R3 обозначает водород или С1-С4алкоксигруппу.
3. Соединение по п.1 или 2 или его соль, в котором
Y обозначает группу формулы (II), в которой
N-содержащая кольцевая система необязательно аннелирована с циклопропилом, циклопентилом или фенилом,
R2 обозначает метил, диметиламиноэтил, метоксиэтил или группу (CH2)m-Z, в которой Z обозначает незамещенный циклогексил, незамещенный фенил, фенил, замещенный метоксигруппой, пиперазинилом или морфолинилом; пиридинил, пиперидинил, тетрагидрофуранил, незамещенный пиперазинил или пиперазинил, замещенный метилом или фенилом, и
m, n, R1, R3 и X имеют указанные выше значения.
4. Соединение по п.1, выбранное из
2-[(2-пиридин-3-ил-этил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[(2-диметиламиноэтил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[(2-пиридин-4-илэтил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[(6-метоксипиридин-3-илметил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[(1-метилпиперидин-4-илметил)амид] 1-[(7-этинилнафталин-1-илметил)амид] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[4-(4-метилпиперазин-1-ил)бензиламид] 1-[(7-этинилнафталин-1-илметил)амид] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-(4-морфолин-4-илметилбензиламид) 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-метиламид 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
1-[(7-этинилнафталин-1-илметил)амид] 2-{[2-(4-бензилпиперазин-1-ил)этил]амида} (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[(2-метоксиэтил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[(пиридин-3-илметил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-[(пиридин-4-илметил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-{2-(4-метилпиперазин-1-ил)амид} 1-[(7-этилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-{[2-(4-метоксифенил)этил]амид} 1-[(6-хлоронафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-{[2-(4-метоксифенил)этил]амид} 1-[(7-хлоронафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-{[2-(4-метоксифенил)этил]амид} 1-[(5-бромобензо[b]тиофен-3-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-{[2-(4-метоксифенил)этил]амид} 1-[(5-хлоробензо[b]тиофен-3-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,
2-{[2-(4-метоксифенил)этил]амид} 1-[(7-этинилнафталин-1-илметил)амида] (S)-)-пирролидин-1,2-дикарбоновой кислоты,
2-[(пиридин-3-илметил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (2S,4R)-4-метоксипирролидин-1,2-дикарбоновой кислоты,
2-[(пиридин-3-илметил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-пиперидин-1,2-дикарбоновой кислоты,
1-[(пиридин-3-илметил)амид] 2-[(7-этинилнафталин-1-илметил)амида] (S)-гексагидроциклопента[с]пиррол-1,2-дикарбоновой кислоты,
2-[(пиридин-3-илметил)амид] 1-[(7-этинилнафталин-1-илметил)амида] (S)-2,3-дигидроиндол-1,2-дикарбоновой кислоты,
1-[(пиридин-3-илметил)амид] 2-[(7-этинилнафталин-1-илметил)амида] (S)-1,3-дигидроизоиндол-1,2-дикарбоновой кислоты,
2-[(пиридин-3-илметил)амид] 3-[(7-этинилнафталин-1-илметил)амида] (1R,2S,5S)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты,
2-[(пиридин-3-илметил)амид] 3-[(7-этинилнафталин-1-илметил)амида] (1S,2S,5R)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты,
2-[(пиридин-3-илметил)амид] 3-[(7-хлорнафталин-1-илметил)амида] (1S,2S,5R)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты,
2-{[2-(4-метоксифенил)этил]амид} 3-[(7-хлорнафталин-1-илметил)амида] (1S,2S,5R)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты
или их соли.
5. Соединение по любому из пп.1-4 в форме соли.
6. Соединение по любому из пп.1-5, предназначенное для применения в качестве фармацевтического средства.
7. Фармацевтическая композиция, содержащая соединение по одному из пп.1-5 в сочетании по меньшей мере с одним фармацевтическим эксципиентом, для лечения нарушений, опосредуемых активностью калликреина 7.
8. Способ лечения нарушений, опосредуемых активностью калликреина 7, при котором лечение заключается в том, что вводят индивидууму, который нуждается в таком лечении, в эффективном количестве соединение по одному из пп.1-5.
9. Способ по п.8, где указанное нарушение, которое опосредуется активностью калликреина 7, выбрано из группы, включающей воспалительные и/или гиперпролиферативные и зудящие кожные болезни, такие как келоиды, гипертрофические рубцы, угри, атопический дерматит, псориаз, пустулезный псориаз, розовые угри, синдром Нетертона или другие зудящие дерматозы, такие как узловатая почесуха Гайда, неспецифический зуд престарелых, а также другие болезни, связанные с нарушением барьерной функции эпителия, такие как состарившаяся кожа, воспалительное заболевание кишечника и болезнь Крона, а также панкреатит или рак, в частности рак яичника.
Текст
(DE), Берст Фредерик (FR), Бодендорф Урсула (CH), Герхартц Бернд, Марцинцик Андреас, Эрхардт Клаус (DE), Майнгасснер Йозеф Готтфрид (AT) В изобретении описаны также соединения, обладающие способностью специфически связываться с указанным активным сайтом калликреина 7 формулы в которой N-содержащая кольцевая система необязательно аннелирована с C3-С 8 циклоалкилом или C6-С 18 арилом, n обозначает 1, 2 или 3, R2 обозначает С 1-С 8 алкил, диС 1-С 8 алкиламино-С 1 С 8 алкил, C1-С 8 алкокси-С 1-С 8 алкил или (CH2)m-Z, где Z обозначает незамещенный или замещенный С 3-С 8 циклоалкил, C6-С 18 арил или гетероциклил, имеющий 5-6 кольцевых членов и 1-2 гетероатома, выбранных из N или О, и m обозначает 0, 1 или 2, R3 обозначает водород, С 1 С 8 алкоксигруппу или С 6-С 18 арил; содержащая их фармацевтическая композиция и способ лечения нарушений, опосредуемых активностью калликреина 7. Область техники, к которой относится изобретение Настоящее изобретение относится к кристаллической структуре сериновой протеазы, а именно калликреина 7, и к применению этой кристаллической структуры для создания лекарственных средств. Настоящее изобретение относится также к соединениям, обладающим способностью специфически связываться с указанным активным сайтом калликреина 7. Предпосылки создания изобретения Калликреин 7 представляет собой сериновую протеазу S1, относящуюся к семейству генов калликреина, которая обладает химотрипсинподобной активностью. Человеческий калликреин 7 (hK7, KLK7 или химотриптический фермент роговичного слоя (SCCE), Swissprot P49862) экспрессируется главным образом в коже и, по-видимому, он играет важную роль в физиологии кожи (1, 2, 3). hK7 участвует в расщеплении межклеточной когезивной структуры в ороговевшем сквамозном эпителии в процессе десквамации. Процесс десквамации строго регулируется и точно балансируется за счет производства denovo корнеоцитов, в результате чего поддерживается постоянная толщина роговичного слоя. Касательно этого опубликованы данные о том, что hK7 обладает способностью расщеплять корнеодесмосомальные белки корнеодесмозин и десмоколлин 1 (4, 5, 6). Кроме того, в проведенных в последние годы исследованиях продемонстрировано, что два участвующих в процессинге липидов фермента Рглюкоцереброзидаза и кислая сфингомиелиназа могут расщепляться под действием hK7 (7). Оба участвующих в процессинге липидов фермента секретируются совместно с их субстратами глюкозилцерамидами и сфингомиелином и осуществляют процессинг этих полярных липидных предшественников с образованием их менее полярных продуктов, например, церамидов, которые затем встраиваются во внеклеточные слоистые мембраны. Архитектура слоистой мембраны имеет решающее значение для функционирования кожного барьера. И, наконец, было продемонстрировано, что hK7 активирует провоспалительный цитокин про-интерлейкин-1 (IL-1) (8) и активирует/инактивирует кателицидины (hCAP18),которые регулируют важные защитные механизмы, служащие для предупреждения заражения широким разнообразием микробных патогенов (34). В современных исследованиях была выявлена связь повышенной активности hK7 с воспалительными кожным заболеваниями, такими как атопический дерматит, псориаз или синдром Нетертона. Повышенная активность hK7 может приводить к неконтролируемому расщеплению корнеодесмосом, вызывающему нарушение регуляции десквамации, усилению расщепления ферментов, участвующих в процессинге липидов, вызывающему нарушение архитектуры слоистой мембраны, или к неконтролируемой активации/инактивации провоспалительного цитокина IL-10 или катилицидина ИСАР 18. Основным результатом этого может являться нарушение барьерной функции кожи и воспаление (см. также WO-A2004/108139). Активность hK7 контролируется на нескольких уровнях. Различные факторы могут приводить к повышению активности hK7 при воспалительных кожных заболеваниях. Во-первых, на уровень экспрессируемой протеазы могут оказывать влияние генетические факторы. В современных исследованиях было выявлено одно из таких генетических звеньев, а именно, полиморфизм в 3'-UTR гена hK7 (9). Авторы выдвинули гипотезу о том, что описанная инсерция 4 пар оснований в 3'-UTR гена калликреина 7 стабилизирует мРНК hK7 и приводит к сверхэкспрессии hK7. Во-вторых, поскольку hK7 секретируется слоистыми тельцами во внеклеточное пространство роговичного слоя в виде зимогена и он не обладает способностью к аутоактивации, то для его активации требуется наличие другой протеазы, например калликреина 5 (5). Неконтролируемая активность такого активирующего фермента может вызывать сверхактивацию hK7. В-третьих, активированный hK7 может ингибироваться встречающимися в естественных условиях ингибиторами, такими как LEKTI, ALP или элафин (10, 11). Пониженная экспрессия или отсутствие таких ингибиторов может приводить к повышению активности hK7. В современных исследованиях установлено, что мутации в гене spink5, который кодирует LEKTI, являются причиной синдрома Нетертона (12), а одиночная точковая мутация в гене связана с атопическим дерматитом (13, 14). И, наконец,еще одним фактором контроля активности hK7 является значение рН. Оптимальное для hK7 значение рН находится в диапазоне от нейтрального до слабо щелочного (2) и при переходе от самых внутренних к самым наружным слоям кожи имеет место градиент значений рН от нейтральных до кислых значений. Факторы окружающей среды, такие как мыло, могут вызывать увеличение значений рН в самых наружных слоях роговичного слоя в сторону оптимального для hK7 значения рН, повышая тем самым активность hK7. Гипотеза о том, что повышенная активность hK7 связана с воспалительными кожными заболеваниями, подтверждена результатами следующих исследований: во-первых, у пациентов с синдромом Нетертона обнаружено связанное с фенотипом повышение активности сериновой протеазы, снижение уровня корнеодесмосом, снижение уровня участвующих в процессинге липидов ферментов глюкоцереброзидазы и кислой сфингомиелинидазы, и нарушение барьерной функции (15, 16). Вовторых, у трансгенных мышей, в которых имеет место сверхэкспрессия человеческого калликреина 7,обнаружен фенотип кожи, сходный с фенотипом, характерным для пациентов с атопическим дерматитом(17, 18, 19). В-третьих, в коже пациентов с атопическим дерматитом и псориазом были выявлены повы-1 018050 шенные уровни hK7 (17, 20). Таким образом, hK7 рассматривается как потенциальная мишень для лечения воспалительных кожных заболеваний, таких как атопический дерматит, псориаз или синдром Нетертона, и поэтому существует необходимость в разработке модуляторов, обладающих специфическим в отношении него действием (агонистов или ингибиторов). Структура человеческого калликреина 7, полученная с очень высоким разрешением, позволила идентифицировать активный сайт фермента и соединения, которые обладают способностью специфически связываться с указанным активным сайтом калликреина 7. Краткое изложение сущности изобретения Настоящее изобретение относится к модулятору калликреина 7, а именно к соединению формулы в которой N-содержащая кольцевая система необязательно аннелирована с С 3-С 8 циклоалкилом или С 6-С 18 арилом, n обозначает 1, 2 или 3, R2 обозначает С 1-С 8 алкил, диС 1-С 8 алкиламино-C1-С 8 алкил, C1 С 8 алкокси-С 1-С 8 алкил или (CH2)m-Z, где Z обозначает незамещенный или замещенный C3-С 8 циклоалкил,С 6-С 18 арил или гетероциклил, имеющий 5-6 кольцевых членов и 1-2 гетероатома, выбранных из N или О,и m обозначает 0, 1 или 2, R3 обозначает водород, С 1-С 8 алкоксигруппу или С 6-С 18 арил. Соединения, предлагаемые в изобретении, могут находиться в форме соли и/или их можно применять в качестве фармацевтических средств. Таким образом, настоящее изобретение относится также к фармацевтической композиции, содержащей описанное выше соединение, в сочетании по меньшей мере с одним фармацевтическим эксципиентом, и к способу лечения нарушений, опосредуемых активностью калликреина 7, в котором лечение заключается в том, что вводят индивидууму, который нуждается в таком лечении, в эффективном количестве соединение, предлагаемое в изобретении. Согласно настоящему изобретению нарушение, которое опосредуется активностью калликреина 7,можно выбирать из группы, включающей воспалительные и/или гиперпролиферативные и зудящие кожные болезни, такие как келоиды, гипертрофические рубцы, угри, атопический дерматит, псориаз, пустулезный псориаз, розовые угри, синдром Нетертона или другие зудящие дерматозы, такие как узловатая почесуха Гайда, неспецифический зуд престарелых, а также другие болезни, связанные с нарушением барьерной функции эпителия, такие как состарившаяся кожа, воспалительное заболевание кишечника и болезнь Крона, а также панкреатит или рак, в частности рак яичника. Подробное описание изобретения Перечень сокращений Калликреин 7 представляет собой сериновую протеазу S1, относящуюся к семейству генов калликреина, которая обладает химотрипсин-подобной активностью. Человеческий калликреин 7 (hK7, KLK7 или химотриптический фермент роговичного слоя (SCCE), Swissprot P49862) играет важную роль в физиологии кожи (1, 2, 3). Итак, одним из объектов настоящего изобретения является соединение формулы в которой N-содержащая кольцевая система необязательно аннелирована с С 3-С 8 циклоалкилом или С 6-С 18 арилом, n обозначает 1, 2 или 3, R2 обозначает С 1-С 8 алкил, диС 1-С 8 алкиламино-C1-С 8 алкил, C1 С 8 алкокси-С 1-С 8 алкил или (CH2)m-Z, где Z обозначает незамещенный или замещенный С 3-С 8 циклоалкил,С 6-С 18 арил или гетероциклил, имеющий 5-6 кольцевых членов и 1-2 гетероатома, выбранных из N или О,и m обозначает 0, 1 или 2, R3 обозначает водород, С 1-С 8 алкоксигруппу или С 6-С 18 арил. В предпочтительном варианте осуществления данного изобретения у соединения или его соли R1 обозначает водород, этинил, хлор или бром, X обозначает СН=СН или S,Y обозначает группу формулы(II), в которой -N-содержащая кольцевая система необязательно аннелирована с циклопропилом, циклопентилом или фенилом, n обозначает 1 или 2, -R2 обозначает С 1-С 8 алкил, C1-С 4 алкиламиногруппу, диС 1 С 4 алкиламино-C1-С 4 алкил, C1-С 4 алкоксигруппу, C1-С 4 алкокси-C1-С 4 алкил или группу (CH2)m-Z, в которой Z обозначает незамещенный циклогексил, незамещенный фенил, фенил, замещенный C1 С 4 алкоксигруппой, фенил, замещенный гетероциклилом, который имеет 6 кольцевых членов и 1 или 2 гетероатома, выбранных из N, О, или незамещенный или замещенный гетероциклил, который имеет 6 кольцевых членов и 1 или 2 гетероатома, выбранных из N, О; -m обозначает 1 или 2, -R3 обозначает водород или C1-С 4 алкоксигруппу. А также у соединения или его соли Y обозначает группу формулы (II), в которой -N-содержащая кольцевая система необязательно аннелирована с циклопропилом, циклопентилом или фенилом, - R2 обозначает метил, диметиламиноэтил, метоксиэтил или группу (CH2)m-Z, в которой Z обозначает незамещенный циклогексил, незамещенный фенил, фенил, замещенный метоксигруппой, пиперазинилом или морфолинилом; пиридинил, пиперидинил, тетрагидрофуранил, незамещенный пиреразинил или пиперазинил, замещенный метилом или фенилом, и m, n, R1, R3 и X имеют указанные выше значения. В наиболее предпочтительном варианте осуществлени данного изобретения соединение выбрано из группы, включающей 2-[(2-пиридин-3-ил-этил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[(2-диметиламиноэтил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[(2-пиридин-4-илэтил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[(6-метоксипиридин-3-илметил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пирролидин 1,2-дикарбоновой кислоты,2-[(1-метилпиперидин-4-илметил)амид]-1-[(7-этинилнафталин-1-илметил)амид](S)-пирролидин-1,2-3 018050 дикарбоновой кислоты,2-[4-(4-метилпиперазин-1-ил)бензиламид]-1-[(7-этинилнафталин-1-илметил)амид](S)-пирролидин 1,2-дикарбоновой кислоты,2-(4-морфолин-4-илметилбензиламид)-1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2 дикарбоновой кислоты,2-метиламид-1-[(7-этинилнафталин-1-илметил)амида] (S)-пирролидин-1,2-дикарбоновой кислоты,1-[(7-этинилнафталин-1-илметил)амид]-2-[2-(4-бензилпиперазин-1-ил)этил]амида(S)пирролидин-1,2-дикарбоновой кислоты,2-[(2-метоксиэтил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пирролидин-1,2-дикарбоновой кислоты,2-[(пиридин-3-илметил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[(пиридин-4-илметил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[2-(4-метилпиперазин-1-ил]амид-1-[(7-этилнафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[2-(4-метоксифенил)этил]амид-1-[(6-хлоронафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[2-(4-метоксифенил)этил]амид-1-[(7-хлоронафталин-1-илметил)амида](S)-пирролидин-1,2 дикарбоновой кислоты,2-[2-(4-метоксифенил)этил]амид-1-[(5-бромобензо[b]тиофен-3-илметил)амида](S)-пирролидин 1,2-дикарбоновой кислоты,2-[2-(4-метоксифенил)этил]амид-1-[(5-хлоробензо[b]тиофен-3-илметил)амида](S)-пирролидин 1,2-дикарбоновой кислоты,2-[2(4 метоксифенил)этил]амид-1-[(7-этинилнафталин-1-илметил)амида](S)-)-пирролидин-1,2 дикарбоновой кислоты,2-[(пиридин-3-илметил)амид]-1-[(7-этинилнафталин-1-илметил)амида](2S,4R)-4-метоксипирролидин-1,2-дикарбоновой кислоты,2-[(пиридин-3-илметил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-пиперидин-1,2 дикарбоновой кислоты,1-[(пиридин-3-илметил)амид]-2-[(7-этинилнафталин-1-илметил)амида](S)-гексагидроциклопента[с]пиррол-1,2-дикарбоновой кислоты,2-[(пиридин-3-илметил)амид]-1-[(7-этинилнафталин-1-илметил)амида](S)-2,3-дигидроиндол-1,2 дикарбоновой кислоты,1-[(пиридин-3-илметил)амид]-2-[(7-этинилнафталин-1-илметил)амида](S)-1,3-дигидроизоиндол-1,2 дикарбоновой кислоты,2-[(пиридин-3-илметил)амид]-3-[(7-этинилнафталин-1-илметил)амида](1R,2S,5S)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты,2-[(пиридин-3-илметил)амид]-3-[(7-этинилнафталин-1-илметил)амида](1S,2S,5R)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты,2-[(пиридин-3-илметил)амид]-3-[(7-хлорнафталин-1-илметил)амида](1S,2S,5R)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты,2-[2-(4-метоксифенил)этил]амид 3-[(7-хлорнафталин-1-илметил)амида](1S,2S,5R)-3-азабицикло[3.1.0]гексан-2,3-дикарбоновой кислоты или их соли. Химические названия соединений, предлагаемых в настоящем изобретении, которые использованы в настоящем описании, взяты из ISIS, версия 2.5 (AutoNom 2000 Name). Соединения, применяемые согласно настоящему изобретению, обозначены ниже в настоящем описании как соединение(я), предлагаемое(ые) в настоящем изобретении. Понятие соединение, предлагаемое в настоящем изобретении включает соединение в любой форме, например в свободной форме, в форме соли. Другой объект настоящего изобретении относится к соединению, предлагаемому в настоящем изобретении, в форме соли. Такие соли предпочтительно представляют собой фармацевтически приемлемые соли, хотя можно применять также фармацевтически неприемлемые соли, например, для целей получения/выделения/очистки. Соединение, предлагаемое в настоящем изобретении, находящееся в свободной форме, можно превращать в соответствующее соединение в форме соли и наоборот. Соединение, предлагаемое в настоящем изобретении, может находиться в форме изомеров и их смесей; например, оптических изомеров,диастереоизомеров, цис/транс-конформеров. Соединение, предлагаемое в настоящем изобретении, может содержать, например, асимметричные атомы углерода и следовательно существовать в форме энан-4 018050 тиомеров или диастереоизомеров и их смесей, например, рацематов. Соединение, предлагаемое в настоящем изобретении, могут находиться в (R)-, (S)- или (R,S)-конфигурации, предпочтительно в (R)- или(S)-конфигурации, касательно определенных положений в соединении, предлагаемом в настоящем изобретении. Соединение, предлагаемое в настоящем изобретении, которое представлено соединением формулыI, может находиться в (R)- и в (S)-конфигурации, например, включая их смеси, и предпочтительно в (R)или в (S)-конфигурации. Смеси изомеров при необходимости можно разделять, например, согласно общепринятому методу с получением чистых изомеров. Под объем настоящего изобретения подпадает соединение, предлагаемое в настоящем изобретении в любой его изомерной форме и в виде любой смеси изомеров. Под объем настоящего изобретения подпадают также таутомеры соединения, предлагаемого в настоящем изобретении, если такие таутомеры существуют. Материалы и буферы Субстрат с погашенной флуоресценцией Ac-Glu-Asp(EDANS)-Lys-Pro-Ile-Leu-PheArg-Leu-GlyLys(DABCYL)-Glu-NH2 (гдеобозначает отщепляемую метку, выявляемую с помощью МС-анализа) получают от фирмы Biosyntan (Берлин, Германия) и хранят в виде 5 мМ маточного раствора в ДМСО при-20 С. Все химические реактивы имеют аналитическую степень чистоты. Ферментативные реакции проводят в 50 мМ натрий-цитратном буфере при рН 5,6, содержащем 150 мМ NaCl и 0,05% (мас./об.) CHAPS. Все операции с растворами, содержащими белок и пептид, проводят в силиконизированных пробирках (фирма Life Systems Design, Мереншванд, Швейцария). Растворы соединения, а также растворы фермента и субстрата переносят в 384-луночные планшеты (черные планшеты Cliniplate; каталожный номер 95040020, фирма Labsystems Oy, Финляндия) с помощью 96-канальной пипетки типа CyBi-Well(фирма CyBio AG, Йена, Германия). Приборы для измерений FI Для измерений интенсивности флуоресценции (FI) применяют ридер типа Ultra Evolution (фирмаTECAN, Мэннедорф, Швейцария). Прибор оснащен комбинированным полосовым фильтром, настроенным на длины волн 350 нм (ширина полосы 20 нм) и 500 нм (ширина полосы 25 нм) для возбуждения флуоресценции и обнаружения испускаемой флуоресценции соответственно. Для повышения соотношения сигнал:фон применяют соответствующее дихроичное зеркало. Оптические фильтры и дихроичное зеркало получают от фирмы TECAN. Флуорофоры в каждой лунке возбуждают, используя по три вспышки на одно измерение. Определение величин IC50 Для определения величин IC50 анализ проводят при комнатной температуре в 384-луночных планшетах. Все конечные объемы для анализа составляют 30 мкл. Тестируемые соединения растворяют в 90 об.% смеси ДМСО/вода и разводят в воде (содержащей 0,05% (мас./об.) CHAPS) до 3-кратной по отношению к требуемой для анализа концентрации. Используют следующие 11 конечных концентраций соединений: 0,3, 1, 3, 10, 30, 100, 300 нМ, 1, 3, 10 и 30 мкМ. Для каждого анализа в каждую лунку добавляют по 10 мкл смеси вода/CHAPS ( тестируемое соединение), а затем по 10 мкл раствора протеазы (разведенного с помощью 1,5 буфера для анализа). Концентрация протеазы в конечном растворе для анализа составляет 0,2 нМ (при определении концентраций фермента по методу Брэдфорда). После инкубации в течение 1 ч при комнатной температуре начинают реакцию путем добавления 10 мкл раствора субстрата(субстрат, растворенный в 1,5 буфере для анализа, конечная концентрация 2 мкМ). Влияние соединения на ферментативную активность оценивают на основе линейной зависимости от времени и определяют по двум показаниям, первое берут сразу после добавления субстрата, а второе - спустя 1 ч. Величину IC50 рассчитывают на основе графика зависимости процента ингибирования от концентрации ингибитора с использованием пакета программ для нелинейного регрессионного анализа (XLfit, версия 4.0; фирма IDBusiness Solution Ltd., Гилфорд, графство Суррей, Великобритания). По данным указанного анализа соединения, предлагаемые в настоящем изобретении, обладают активностью и следовательно их можно применять для лечения нарушений (заболеваний), опосредуемых активностью калликреина-7. Величины IC50 для соединений, предлагаемых в настоящем изобретении, находятся в диапазоне ниже 10 мкМ, предпочтительно ниже 10 нМ, например, соединение из примера 36 характеризуется величиной IC50, составляющей 3 нМ. Нарушения, включая, например, заболевания, опосредуемые активностью калликреина-7, и которые могут поддаваться успешному лечению с применением антагонистов калликреина-7, например, с применением соединений, предлагаемых в настоящем изобретении, включают нарушения, в которых активность калликреина-7 играет основную роль (является причиной) или вносит дополнительный вклад, например, заболевания, сопровождающиеся эпителиальной дисфункцией, такие как воспалительные и/или гиперпролиферативные и зудящие кожные заболевания, такие, например, как атопический дерматит,псориаз, синдром Нетертона или другие зудящие дерматозы, такие как узловатая почесуха Гайда, неспе-5 018050 цифический зуд, а также другие заболевания, связанные с нарушением барьерной функции эпителия,такие как воспалительное заболевание кишечника или болезнь Крона. Другими объектами настоящего изобретения являются соединение, предлагаемое в настоящем изобретении, которое предназначено для применения в качестве фармацевтического средства,применение соединения, предлагаемого в настоящем изобретении, в качестве фармацевтического средства,применение соединения, предлагаемого в настоящем изобретении, для приготовления фармацевтического средства, предназначенного, например, для лечения нарушений, опосредуемых активностью калликреина-7. Для фармацевтического применения можно использовать одно или несколько соединений, предлагаемых в настоящем изобретении, например, одно или комбинацию двух или большего количества соединений, предлагаемых в настоящем изобретении, предпочтительно применяют одно соединение, предлагаемое в настоящем изобретении. Соединение, предлагаемое в настоящем изобретении, можно применять в качестве фармацевтического средства в форме фармацевтической композиции. Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение, предлагаемое в настоящем изобретении, в сочетании по меньшей мере с одним фармацевтически приемлемым эксципиентом, например, соответствующим носителем и/или разбавителем, включая,например, наполнители, связующие вещества, разрыхлители, вещества, повышающие текучесть, замасливатели, сахара или подслащивающие вещества, корригенты, консерванты, стабилизаторы, смачивающие вещества и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы. Следующим объектом настоящего изобретения являются фармацевтическая композиция, предлагаемая в настоящем изобретении, которая предназначена для лечения нарушений, опосредуемых активностью калликреина-7; применение фармацевтической композиции, предлагаемой в настоящем изобретении, для лечения нарушений, опосредуемых активностью калликреина-7. Следующим объектом настоящего изобретения является способ лечения нарушений, опосредуемых активностью калликреина-7, включая, например, указанные выше нарушения, который заключается в том, что индивидууму, нуждающемуся в таком лечении, вводят в эффективном количестве соединение,предлагаемое в настоящем изобретении; например, в форме фармацевтической композиции. Следующим объектом настоящего изобретения являются соединение, предлагаемое в настоящем изобретении, которое предназначено для приготовления лекарственного средства,применение соединения, предлагаемого в настоящем изобретении, которое предназначено для приготовления лекарственного средства, например, фармацевтической композиции, которые предназначены для лечения нарушений, опосредуемых активностью калликреина-7, например, для лечения кожных заболеваний, таких, например, как атопический дерматит, псориаз, синдром Нетертона или другие зудящие дерматозы, такие как узловатая почесуха Гайда, неспецифический зуд. Понятие лечение включает лечение и профилактику (предупреждение). Лечение можно осуществлять путем местной обработки или путем системного введения, например, с помощью кремов, мазей или суппозиториев, или путем орального, подкожного (sc) или внутривенного (iv) введения соответственно. Применяемая для такого лечения доза должна, естественно, варьироваться в зависимости, например, от химической природы и фармакокинетических характеристик используемого соединения, предлагаемого в настоящем изобретении, конкретного хозяина, пути введения и природы и серьезности состояния, подлежащего лечению. Однако в целом для достижения удовлетворительных результатов при лечении крупных млекопитающих, например, человека, используют суточные дозы, составляющие от примерно 0,001 до примерно 1,5 г, например от 0,001 до 1,5 г; от примерно 0,01 до примерно 20 мг/кг веса тела, например от 0,01 до 20 мг/кг веса тела,которые вводят, например, в виде разделенных доз вплоть до четырех раз в день. Соединение, предлагаемое в настоящем изобретении, можно вводить крупным млекопитающим,например человеку, с использованием тех же путей введения, которые обычно применяют для других медиаторов, например, низкомолекулярных ингибиторов, активности калликреина-7. Соединение, предлагаемое в настоящем изобретении, можно вводить любым общепринятым путем,например энтерально, в том числе, например, путем назального, трансбуккального, ректального, орального введения; парентерально, в том числе, например, путем внутривенной, внутриартериальной, внутримышечной, внутрисердечной, подкожной, внутрикостной инфузии, трансдермального (путем диффузии через неповрежденную (интактную) кожу), трансмукозального (путем диффузии через слизистую мембрану), ингаляционного введения; местно, в том числе, например, путем нанесения на кожу, путем интраназального, интратрахеального введения; внутрибрюшинно (путем инфузии или инъекции в брюш-6 018050 ную полость); эпидурально (перидурально) (путем инъекции или инфузии в эпидуральное пространство); интратекально (путем инъекции или инфузии в спинномозговую жидкость); интравитреально (введение через глаз); например, находящихся в форме таблеток с покрытием или без покрытия, капсул, (предназначенных для инъекции) растворов, инфузионных растворов, твердых растворов, суспензий, дисперсий,твердых дисперсий; например, содержащихся в ампулах, пузырьках, находящихся в форме кремов, гелей, паст, порошка для ингаляции, пен, настоек, губной помады, капель, спреев или в форме суппозиториев. Предпочтительно соединение, предлагаемое в настоящем изобретении, применяют местно. Для местного применения, включая, например, введение в глаз, можно достигать удовлетворительных результатов при местном применении действующего вещества в концентрации 0,5-10%, например 13%, несколько раз в день, например от 2 до 5 раз в день. Соединения, предлагаемые в настоящем изобретении, можно вводить в форме фармацевтически приемлемой соли или в свободной форме; необязательно в форме сольвата. Соединение, предлагаемое в настоящем изобретении, в форме соли и/или в форме сольвата обладает такой же (по порядку величин) активностью, что и соединение, предлагаемое в настоящем изобретении, в свободной форме. Соединение, предлагаемое в настоящем изобретении, можно применять согласно любому представленному в настоящем описании способу или применению индивидуально или в сочетании с одной или несколькими, по меньшей мере одной, второй лекарственной субстанцией. Следующим объектом настоящего изобретения является комбинация соединения, предлагаемого в настоящем изобретении, по меньшей мере с одной второй лекарственной субстанцией; фармацевтическая комбинация, включающая соединение, предлагаемое в настоящем изобретении, в сочетании по меньшей мере с одной второй лекарственной субстанцией; фармацевтическая композиция, содержащая соединение, предлагаемое в настоящем изобретении, в сочетании по меньшей мере с одной второй лекарственной субстанцией и одним или несколькими фармацевтически приемлемым(и) эксципиентом(ами); соединение, предлагаемое в настоящем изобретении, в сочетании по меньшей мере с одной второй лекарственной субстанцией, например в форме фармацевтической комбинации или композиции, предназначенное для применения согласно любому из представленных в настоящем описании способов, например комбинация, фармацевтическая комбинация или фармацевтическая композиция, содержащая соединение, предлагаемое в настоящем изобретении, и по меньшей мере одну вторую лекарственную субстанцию, предназначенную для применения в качестве фармацевтического средства; применение в качестве фармацевтического средства соединения, предлагаемого в настоящем изобретении, в сочетании по меньшей мере с одной второй лекарственной субстанцией, например в форме фармацевтической комбинации или композиции; применение соединения, предлагаемого в настоящем изобретении, для приготовления лекарственного средства, предназначенного для применения в сочетании по меньшей мере с одной второй лекарственной субстанцией; способ лечения нарушений, опосредуемых активностью калликреина-7, у индивидуума, нуждающегося в этом, заключающийся в том, что вводят совместно, одновременно или последовательно в терапевтически эффективном количестве соединение, предлагаемое в настоящем изобретении, и по меньшей мере одну вторую лекарственную субстанцию, например, в форме фармацевтической комбинации или композиции; соединение, предлагаемое в настоящем изобретении, в сочетании по меньшей мере с одной второй лекарственной субстанцией, например, в форме фармацевтической комбинации или композиции, предназначенное для приготовления лекарственного средства для применения при нарушениях, опосредуемых активностью калликреина 7. К комбинациям относятся фиксированные комбинации, в которых соединение, предлагаемое в настоящем изобретении, и по меньшей мере одна вторая лекарственная субстанция присутствуют в одной и той же лекарственной форме; наборы, в которых соединение, предлагаемое в настоящем изобретении, и по меньшей мере одна вторая лекарственная субстанция, находящиеся в виде отдельных лекарственных форм, присутствуют в одной и той же упаковке, например, вместе с инструкцией по совместному применению; и свободные комбинации, в которых соединение, предлагаемое в настоящем изобретении, и по меньшей мере одна вторая лекарственная субстанция упакованы раздельно, но сопровождаются инструкцией по одновременному или последовательному их применению. Следующим объектом настоящего изобретения является фармацевтическая упаковка, содержащая первую лекарственную субстанцию, которая представляет собой соединение, предлагаемое в настоящем изобретении, и по меньшей мере одну вторую лекарственную субстанцию, а также инструкции по совместному применению; фармацевтическая упаковка, содержащая соединение, предлагаемое в настоящем изобретении, а также инструкции по совместному применению в сочетании по меньшей мере с одной второй лекарственной субстанцией;-7 018050 фармацевтическая упаковка, содержащая по меньшей мере одну вторую лекарственную субстанцию, а также инструкции по совместному применению с соединением, предлагаемым в настоящем изобретении. Лечение с применением комбинаций, предлагаемых в настоящем изобретении, может быть более эффективным по сравнению с лечением при использовании только одной лекарственной субстанции. Следующим объектом настоящего изобретения является фармацевтическая комбинация, содержащая в определенном количестве соединение, предлагаемое в настоящем изобретении, и в определенном количестве вторую лекарственную субстанцию, где указанные количества являются достаточными для обеспечения синергетического терапевтического действия; способ повышения терапевтической эффективности соединения, предлагаемого в настоящем изобретении, заключающийся в том, что совместно вводят, например, одновременно или последовательно, в терапевтически эффективном количестве соединение, предлагаемое в настоящем изобретении, и вторую лекарственную субстанцию; способ повышения терапевтической эффективности второй лекарственной субстанции, заключающийся в том, что совместно вводят, например, одновременно или последовательно, в терапевтически эффективном количестве соединение, предлагаемое в настоящем изобретении, и вторую лекарственную субстанцию. Комбинацию, предлагаемую в настоящем изобретении, и вторую лекарственную субстанции в качестве компонента комбинации можно вводить любым общепринятым путем, например, выбранным из числа тех, которые описаны выше для соединения, предлагаемого в настоящем изобретении. Вторую лекарственную субстанцию можно вводить в дозах, которые находятся, например, в диапазоне доз, близком к тому, который применяют в случае лечения с использованием только одной лекарственной субстанции, или, например, в случае присутствия синергетического действия, даже в более низком по сравнению с общепринятым диапазоне доз. Фармацевтические композиции, предлагаемые в настоящем изобретении, можно приготавливать согласно, например, аналогично, общепринятому методу, например, с использованием процессов смешения, гранулирования, нанесения покрытия, растворения или лиофилизации. Стандартные формы лекарственного средства могут содержать, например, от примерно 0,1 до примерно 1500 мг, в частности, от 1 до примерно 1000 мг. Фармацевтические композиции, содержащие комбинацию, предлагаемую в настоящем изобретении, и фармацевтические композиции, содержащие второе лекарственное средство, описанные выше,можно приготавливать соответствующим образом, например, согласно, например, аналогично, общепринятому методу, или как указано в настоящем описании для фармацевтической композиции, предлагаемой в настоящем изобретении. Понятие вторая лекарственная субстанция обозначает противовоспалительное иммуномодуляторное лекарственное средство, противораковое лекарственной средство, анестезирующее лекарственное средство или химиотерапевтическое лекарственное средство. Вторая лекарственная субстанция может также представлять собой соединение, обладающее активностью калликреина-7, но не являться соединением, предлагаемым в настоящем изобретении. Если соединения, предлагаемые в настоящем изобретении, вводят в комбинации с другими лекарственными средствами, то дозы совместно вводимого второго лекарственного средства должны, естественно, варьироваться в зависимости от типа совместно применяемого лекарственного средства, конкретного применяемого лекарственного средства, состояния, подлежащего лечению, как это имеет место и в случае соединения, предлагаемого в настоящем изобретении. В целом, могут оказаться пригодными дозы, сходные с теми, которые рекомендованы поставщиком второго лекарственного средства. В приведенных ниже примерах все температуры даны в градусах Цельсия Использованы следующие сокращения:Ac2O - уксусный ангидрид АсОН - уксусная кислотаNMII - N-метилпирролидинон КТ - комнатная температура ТФК - трифторуксусная кислота ТГФ - тетрагидрофуран ТСХ - тонкослойная хроматография-8 018050 ТМОФ - триметилортоформиат Ингибитор калликреина 7 может представлять собой также пептид или производное пептида,при этом следует иметь ввиду, что указанные понятия включают пептидомиметики или аналог пептида, которые дополняют трехмерную структуру связывающего кармана калликреина 7 или которые могут быть созданы таким образом, чтобы они обладали улучшенными физическими или химическими способностями в отношении связывания с трехмерным связывающим карманом калликреина 7, который предложен в настоящем изобретении. Понятие мутант относится к мутантной последовательности, полученной путем делеции, инсерции или предпочтительно замены одной или нескольких выбранных аминокислот, при условии, что такая мутантная последовательность идентична по меньшей мере на 90%, более предпочтительно на 95%,и еще более предпочтительно на 99% соответствующему фрагменту последовательности после осуществления оптимального выравнивания. Методы создания мутантных белков широко известны в данной области. Например, мутанты калликреина 7 можно получать путем экспрессии ДНК калликреина 7, кодирующая область которой предварительно была модифицирована путем сайтнаправленного мутагенеза с использованием олигонуклеотидов. В контексте настоящего описания понятие связывающий карман относится к области калликреина 7, которая благодаря ее форме и физико-химическим свойствам преимущественно ассоциируется с другой химической субстанцией или соединением и которая определяется координатами, представленными в табл. 3. Предназначенный для кристаллизации белок калликреин 7 может обладать биологической активностью или быть неактивным. Такую способность можно определять с помощью морфологического, биохимического анализа или анализа жизнеспособности, которые хорошо известны в данной области. Экспрессию рекомбинантного калликреина 7 или его фрагмента можно осуществлять в эукариотических или прокариотических системах или в экспрессионных системах in vitro. Согласно предпочтительному варианту осуществления изобретения калликреин 7 связывают по меньшей мере с одним лигандом на любой стадии, предшествующей кристаллизации. Калликреин 7 может экспрессироваться в виде слитого белка, например, слитого с глутатион-Sтрансферазой (GST) или несущего гистидиновую метку слитого белка. При необходимости удаляют партнера по слиянию перед осуществлением кристаллизации. Для осуществления стадии кристаллизации в способе получения кристалла можно применять различные методы, включая метод диффузии паров, кристаллизацию методом диализа или порционную кристаллизацию которые известны в данной области (Crystallization of Biological Macromolecules, A.McPherson, изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, USA). При кристаллизации методом диффузии паров небольшой объем (а именно, несколько миллилитров) раствора белка смешивают с раствором, содержащим осаждающее средство. Этот смешанный объем суспендируют в лунке, содержащей небольшое количество, а именно, примерно 1 мл, осаждающего средства. Диффузия паров из капли в лунку приводит к формированию кристалла в капле. Метод кристаллизации с помощью диализа представляет собой метод кристаллизации, основанный на применении полупроницаемой эксклюзионной мембраны, которая удерживает белки, но позволяет диффундировать небольшим молекулам (например, молекулам буферов и осаждающих средств) как в одном, так и в другом направлении. При диализе в отличие от концентрирования белка и осаждающего средства путем выпаривания осаждающему средству дают возможность медленно диффундировать через мембрану, в результате чего растворимость белка снижается при сохранении концентрации белка на постоянном уровне. В порционном методе, как правило, осуществляют медленное добавление осаждающего вещества к водному раствору белка до тех пор пока раствор не станет мутным, в это момент времени контейнер закрывают и выдерживают, не подвергая возмущениям, в течение периода времени, требуемого для осуществления кристаллизации. В порционном методе осаждающее средство и раствор молекулы-мишени просто смешивают. Перенасыщения достигают прямым путем без использования диффузии. Часто порционный метод осуществляют в масляной среде. Масло препятствует испарению и можно применять капельки очень малого размера. Для такого варианта употребляют понятие микропорция. В одном из вариантов этого метода используют не парафиновое масло (которое полностью предупреждает испарение), а силиконовое масло или смесь силиконового и парафинового масел, в этом случае может иметь место медленное испарение. Под объем настоящего изобретения подпадает любой и все методы кристаллизации. Специалист в данной области может выбрать любой из указанных методов и варьировать параметры таким образом,чтобы выбранный метод позволял получать требуемые кристаллы. В одном из предпочтительных методов кристаллизации калликреина 7 осуществляют смешение раствора калликреина 7 с резервуарным буфером. Для формирования кристалла следует повышать концентрацию осаждающего средства в смеси, например, путем добавления осаждающего средства, на-9 018050 пример, титрованием, или позволяя концентрации осаждающего средства достигать равновесия в результате диффузии между кристаллизационным буфером и резервуарным буфером (который необязательно может представлять собой тот же буфер, что исходный резервуарный буфер). В соответствующих условиях такая диффузия осаждающего средства происходит при наличии градиента осаждающего средства,например, из резервуарного буфера, имеющего более высокую концентрацию осаждающего средства, в кристаллизационный буфер, имеющий более низкую концентрацию осаждающего средства. Диффузию можно обеспечивать, например, методами диффузии паров, позволяя происходить диффузии воды в обычную газовую фазу. Известными методами являются, например, методы диффузии паров, такие как метод висящей капли или метод сидящей капли. В методе диффузии паров каплю содержащего белок кристаллизационного буфера подвешивают над намного большим объемом резервуарного буфера или помещают рядом с ним. В альтернативном варианте уравновешивание осаждающего средства можно обеспечивать с помощью полупроницаемой мембраны, которая отделяет кристаллизационный буфер от резервуарного буфера и предотвращает разведение белка резервуарным буфером. Формирование структуры калликреина 7 можно осуществлять в различных условиях, которые в основном определяются следующими параметрами: значением рН, присутствием солей и добавок, осаждающим средством, концентрацией белка и температурой. Значение рН может составлять, например, от примерно 4,0 до 9,0. Другой конкретный вариант осуществления изобретения относится к способу получения кристалла калликреина 7 в виде комплекса с лигандом. Кристаллическую форму калликреина 7 можно применять также для обмена лиганда на пропитывающие соединения, представляющие интерес, например, для оптимизации соединения или для выявления новых каркасов с помощью подходов, основанных на скрининге фрагментов. Координаты структуры кристаллической композиции, предлагаемой в настоящем изобретении,можно хранить в пригодной для машинного считывания форме на пригодном для машинного считывания носителе накопителя, например, на компьютерном жестком диске, дискете, ленте для цифровой записи и т.д. для визуализации в виде трехмерной формы или для других целей с применением автоматизированной обработки или расчетов на основе координат структуры или определяемой ими трехмерной структуры. Например, данные, определяющие трехмерную структуру белка семейства калликреинов, или фрагментов или структурно сходных гомологов таких белков, можно хранить на пригодном для машинного считывания носителе накопителя и их можно отображать в виде трехмерного графического представления структуры белка, как правило, с помощью компьютера, способного считывать данные с указанного носителя накопителя и запрограммированного инструкциями по созданию графического представления на основе таких данных. Согласно настоящему изобретению трехмерную модель калликреина 7 можно получать на основе кристалла калликреина 7, представляющего собой калликреин 7, его фрагмент или гомолог. Настоящее изобретение относится также к пригодной для считывания компьютером среде, на которой хранится модель кристаллической структуры калликреина 7. В предпочтительном варианте осуществления изобретения указанную модель строят на основе всех или выбранной части атомных координат,представленных в табл. 3, которые получены на основе данных о дифракции рентгеновских лучей. Выбранная часть означает координаты структуры по меньшей мере 10 последовательно расположенных аминокислот, из числа представленных в табл. 3, предпочтительно по меньшей мере 50 аминокислот и более предпочтительно по меньшей мере 100 последовательно расположенных аминокислот. Сведения, полученные с помощью трехмерной модели калликреина 7, можно использовать в различных целях. Например, их можно использовать для идентификации химических субстанций, например, небольших органических и биоорганических молекул, таких как пептидомиметики и синтетические органические молекулы, которые обладают способностью связываться с калликреином 7 и предпочтительно блокируют или препятствуют опосредуемому калликреином 7 или ассоциированному с ним процессу или событию, или которые действуют в качестве агонистов калликреина 7. Кроме того, эту информацию можно использовать для конструирования и получения мутантов калликреина 7, например мутантов, обладающих измененной каталитической активностью, моделировать трехмерную структуру и определять кристаллическую структуру белков, таких как гомологи калликреина 7, мутанты калликреина 7 или включающие калликреин 7 комплексы, применяя, например, молекулярные замены или гомологичное моделирование. Понятие молекулярная замена относится к методу, который основан на создании предварительной структурной модели кристалла, структурные координаты которого неизвестны, путем ориентации и позиционирования молекулы с известными структурными координатами, например, координатами калликреина 7, в элементарной ячейке неизвестного кристалла так, чтобы это наилучшим образом соответствовало дифракционной картине, полученной для неизвестного кристалла. Затем на основе этой модели можно рассчитывать фазы и объединять полученные данные с измеренными амплитудами, что позволяет осуществлять приблизительный Фурье-синтез структуры с неизвестными координатами. Ее, в свою очередь, можно подвергать любой из нескольких форм уточнения, получая окончательную точную структу- 10018050 ру неизвестного кристалла. С использованием структурных координат, предложенных в настоящем изобретении, можно применять молекулярную замену для определения структурных координат кристаллического комплекса, неизвестного лиганда, мутанта или гомолога, или различных кристаллических форм калликреина 7. Кроме того, предложенный в настоящем изобретении кристалл и его координаты можно использовать для определения структурных координат химической субстанции, ассоциированной с калликреином 7. Гомологичное моделирование согласно настоящему изобретению представляет собой конструирование модели неизвестной структуры с использованием структурных координат одного или нескольких родственных белков, белковых доменов и/или одного из субдоменов, такого как калликреин 7. Гомологичное моделирование можно осуществлять путем подгонки общих или гомологичных частей белка или пептида, трехмерную структуру которого требуется определить, к трехмерной структуре гомологичных структурных элементов. Гомологичное моделирование может заключаться в реконструкции части или всей трехмерной структуры путем замены аминокислот или других компонентов на соответствующие элементы родственной структуры, которую требуется определить. На основе трехмерной структуры калликреина 7, предложенной в настоящем изобретении, и с использованием атомных координат, представленных в табл. 3, или выбранной их части, можно предсказывать воздействия сайтспецифических мутаций. Более конкретно, представленная в настоящем описании информация о структуре позволяет идентифицировать возможные сайты для аминокислотных модификаций, прежде всего для осуществления аминокислотных мутаций, приводящих к созданию возникающих в результате замен, инсерций или делеций вариантов. Можно конструировать такие варианты с целью придания им специальных свойств, прежде всего свойств, отличных от свойств калликреина 7 дикого типа, таких как измененная каталитическая активность. Можно объединять замены, делеции и инсерции для получения требуемого варианта. Такие варианты можно создавать методами, хорошо известными в данной области, например, на основе калликреина 7 дикого типа или путем синтеза de novo. Информацию о структуре калликреина 7, представленную в настоящем описании, можно применять для создания лигандов, обладающих способностью избирательно взаимодействовать с калликреином 7, но не с другими протеазами, отличными от калликреина 7, и в результате этого специфически модулировать биологическую активность калликреина 7, но не других отличных от калликреина 7 протеаз. Специалисты в данной области могут конструировать химические субстанции, поверхность которых имитирует доступную поверхность связывающего кармана калликреина 7. Например, специалист в данной области может осуществлять скрининг в базах данных трехмерных структур соединений для идентификации тех соединений, которые имеют сходное трехмерное расположение соответствующих функциональных групп, затем создавать на основе таких химических субстанций комбинаторные библиотеки химических соединений с целью идентификации тех из них, которые обладают высокой аффинностью к связывающему карману калликреина 7. Конкретный вариант осуществления изобретения относится к основанному на использовании клеток анализу, предназначенному для идентификации лигандов, которые ингибируют биологическую активность калликреина 7. Лиганды, представляющие собой низкомолекулярные соединения, можно идентифицировать на основе скрининга баз данных или библиотек соединений и с помощью вычислительных средств, позволяющих осуществлять операцию подгонки к сайту связывания на калликреине 7. Для этой цели можно применять трехмерную структуру калликреина 7, предложенную в настоящем изобретении, которая имеет структурные координаты, представленные в табл. 3, или выбранную ее часть, используя при этом различные стыковочные программы. Потенциальное ингибирующее или связывающее действие химической субстанции в отношении калликреина 7 можно анализировать до фактического осуществления его синтеза и тестировать с помощью методов компьютерного моделирования. Если на основе теоретической структуры конкретной химической субстанции можно сделать предположение о недостаточном взаимодействии и ассоциации между этой субстанцией и калликреином 7, то отпадает необходимость в осуществлении синтеза и тестирования рассматриваемой химической субстанции. Однако, если результаты компьютерного моделирования свидетельствуют о наличии сильного взаимодействия, то после этого молекулу можно синтезировать и тестировать в отношении ее способности связываться с калликреином 7. Тем самым можно избежать необходимости осуществлять дорогостоящий и требующий значительного времени синтез неэффективных соединений. Такой анализ методом компьютерного моделирования (in silico) можно начинать, например, с визуального изучения связывающего кармана на экране компьютера с использованием всех или части структурных координат, представленных в табл. 3. Затем выбранные фрагменты или химические субстанции можно позиционировать в различной ориентации, или осуществлять их стыковку со связывающим карманом калликреина 7. Стыковку можно осуществлять с помощью таких программ, какQuanta и SYBYL, с последующей минимизацией энергии и молекулярной динамики с использованием стандартных силовых полей молекулярной механики, с помощью таких программ, как CHARMM и AM- 11018050BER. Для выбора представляющих интерес фрагментов или химических субстанций можно использовать специализированные программы для компьютера. К таким программам относятся, например, GRID, которую можно получить от Оксфордского Университета, Оксфорд, Великобритания; 5 MCSS или CATALYST, которую можно получить от фирмы Molecular Simulations, Берлингтон, шт. Массачусетс; AUTODOCK, которую можно получить от Исследовательского Института Скриппа (Scripps Research Institute),Ла-Джолла, шт. Калифорния; DOCK, которую можно получить от Калифорнийского Университета, СанФранциско, шт. Калифорния, и XSITE, которую можно получить от Университетского Колледжа Лондона, Великобритания. Предпочтительным является способ конструирования ингибитора калликреина 7, который обладает способностью взаимодействовать со связывающимся с субстратом сайтом калликреина 7 или любыми другими сайтами связывания. Один из подходов, который можно реализовать на основе настоящего изобретения, заключается в использовании структурных координат калликреина 7 для конструирования химических субстанций, которые обладают способностью связываться или ассоциироваться с калликреином 7, и изменять физические свойства химических субстанций различными путями. Так, можно изменять и/или максимизировать, например, такие свойства, как растворимость, аффинность, специфичность,эффективность, скорости ассоциации/диссоциации или другие характеристики связывания. Можно конструировать требуемые химические субстанции, подвергая калликреин 7, который содержит связывающий карман, предлагаемый в изобретении, зондированию с использованием различных субстанций, взятых из определенной библиотеки, с целью выявления оптимальных сайтов взаимодействия химических субстанций-кандидатов и калликреина 7. Например, данные о дифракции рентгеновских лучей, полученные с высоким разрешением для кристаллов, насыщенных растворителем, позволяют определять сайты,в которых происходит присоединение молекул растворителя каждого типа. После этого можно конструировать и синтезировать небольшие молекулы, которые прочно связываются такими сайтами, и тестировать с точки зрения требуемой активности. После выявления наличия требуемой активности молекулы можно подвергать дополнительным изменениям с целью максимизации требуемых свойств. После того, как соединение было сконструировано или отобрано с помощью указанных выше методов, можно анализировать эффективность, с которой указанное соединение может связываться с калликреином 7, и подвергать его модификации с целью максимизации требуемой/требуемых характеристики/характеристик с использованием компьютерных или экспериментальных методов оценки. В зависимости от требуемого результата можно максимизировать различные параметры. Они включают, но не ограничиваясь только ими, специфичность, аффинность, скорости ассоциации/диссоциации, гидрофобность, растворимость и другие характеристики, которые легко может выявлять специалист в данной области. В предпочтительном варианте осуществления изобретения на указанной выше стадии компьютерного конструирования используют структурные координаты калликреина 7, представленные в табл. 3. Изобретение относится также к способу отбора лиганда, обладающего способностью связываться с калликреином 7, который заключается в том, что: а) осуществляют совместную кристаллизацию или инкубацию соединения-кандидата или смеси соединений-кандидатов с калликреином 7 в соответствующих условиях,б) определяют с помощью рентгеноскопических или ЯМР-методов аминокислоты калликреина 7,которые взаимодействуют с соединением-кандидатом,в) отбирают соединение, которое взаимодействует по меньшей мере с одной или несколькими аминокислотами, присутствующими в связывающем кармане. Для осуществления стадии б), как правило, осуществляют картирование сайта связывания лиганда путем регистрации ЯМР-спектров в присутствии соединения-кандидата и без него и выявляют те резонансные пики в спектрах белка, на которые оказывает влияние связывание с лигандом. Это требует определения резонансных пиков белка до анализа или сравнения со схемой изменений химических сдвигов,происходящих после связывания лигандов с известными сайтами связывания. В альтернативном варианте эквивалентную информацию можно получать с помощью экспериментов по конкурентному связыванию с использованием указанных лигандов с известными сайтами связывания. В настоящем изобретении предложены также способы конструирования новых лигандов калликреина 7 с использованием подходов на основе связывания фрагментов. Сначала отбирают соединения,которые связываются с различными связывающими областями калликреина 7. Лиганды сцепляют вместе с учетом пространственной ориентации, в результате чего создают новые соединения, которые могут присоединяться к двум сайтам связывания. Таким образом, изобретение относится к способу конструирования лигандов для калликреина 7, который заключается в том, что: а) получают первый лиганд, который связывается с одной или несколькими аминокислотами, присутствующими в первой связывающей области калликреина 7,б) получают второй лиганд, который связывается с одной или несколькими аминокислотами, присутствующими во второй связывающей области калликреина 7, и в) сцепляют первый лиганд со вторым лигандом, создавая лиганд, который связывается с первым и- 12018050 вторым связывающими карманами калликреина 7. Выбор соответствующей линкерной группы осуществляют при условии сохранения пространственной ориентации лигандов по отношению друг к другу и по отношению к калликреину 7 на основе информации о углах между связями и длинах связей, хорошо известной в области органической химии. Кроме того, антагонисты калликреина 7 можно применять для лечения пациентов или для приготовления лекарственного средства, предназначенного для лечения воспалительных и/или гиперпролиферативных и зудящих кожных болезней, таких как келоиды, гипертрофические рубцы, угри, атопический дерматит, псориаз, пустулезный псориаз, розовые угри, синдром Нетертона или другие зудящие дерматозы, такие как узловатая почесуха Гайда, неспецифический зуд престарелых, а также других болезней,связанных с нарушением барьерной функции эпителия, таких как состарившаяся кожа, воспалительное заболевание кишечника и болезнь Крона, а также панкреатит или рак, в частности рак яичника. Приведенные ниже примеры служат для иллюстрации настоящего изобретения, и их не следует рассматривать как направленные на ограничение его объема. Изобретение относится прежде всего к конкретным вариантам осуществления изобретения, описанным в указанных примерах. Примеры Клонирование Для предупреждения ауторасщепления hK7 сайт ауторасщепления, находящийся в положенииTyr180 (нумерация согласно Swiss-Prot, документ Р 49862) изменяли путем мутации на Arg с помощью сайтнаправленного мутагенеза согласно стандартному протоколу с использованием pET24His-Pro-EKKLK7(aa37-253) в качестве матрицы (набор для сайтнаправленного мутагенеза QuickChange; фирмаStratagene; праймер для мутагенеза: 5'GACTGCACGAAGGTTCGCAAGGACTTACTGGAAAATTCCATGC). Клонирование вектора pET24His-Pro-EK-KLK7(aa37-253) осуществляли методом, общепринятым в данной области. Конечный вектор обозначили как pET24c-His-ProKLK7-Enterok-KLK7(aa37253)Y180R. Экспрессия и очистка Штамм Е. coli BL21(DE3), несущий экспрессионную плазмиду pro-hK7, культивировали при 37 С в среде LB, дополненной 34 мкг/мл хлорамфеникола и 30 мкг/мл канамицина. Индукцию начинали с использованием 0,4 мМ ИПТГ при ОП 600 1,0 в течение 4 ч при 37 С. Затем клетки собирали центрифугированием. Все стадии очистки осуществляли при 4 С, если не указано иное. Клетки из выращенной в объеме 10 л культуры клеток Е. coli (25 г клеточного дебриса) ресуспендировали в 200 мл 50 мМ Трис/НС 1 буфера, рН 8,0, содержащего 1 мМ MgCl2, и хранили при -20 С в течение ночи. После оттаивания добавляли 1 мкл бензоназы (фирма ROCHE) и образец инкубировали в течение 10 мин при 37 С. Клетки разрушали облучением ультразвуком (4 раза по 20 с при 70%-ной амплитуде; устройство типа Branson Digital Sonifier W-450D) и гомогенат центрифугировали при 7000 g в течение 15 мин. Дебрис, содержащий тельца включения, отмывали трижды 50 мМ Трис-буфером, рН 8,0, содержащим 25% сахарозы, 1% Тритона 100 и 1 мкл бензоназы, и, наконец, дважды H2O, содержащей 1 мМ MgCl2. Тельца включения дополнительно очищали с помощью ЖХВР на колонке с обращенной фазой. Для этого тельца включения растворяли в 6 М GuHCl (10 мг/мл) и 100 мМ ДТТ и вносили на GE Source RPC-колонку (типа Fine line 35S),уравновешенную 0,1% ТФК и 10% ацетонитрила. Белок элюировали путем повышения концентрации ацетонитрила от 10 до 100%. Фракции, содержащие протеазу, объединяли и лиофилизировали. Высушенный белок разводили до конечной концентрации 50 мкг/мл в 50 мМ Трис/HCl-буфере, рН 8,0 (охлажденном до 10 С),который содержал 2 М мочевину, 500 мМ NaCl, 10 мМ CaCl2, 0,1 М NH4Cl, 1 мМ ЭДТК, 1,25 мМ GSH и 0,5 мМ GSSG. Затем образец подвергали диализу в противотоке 10 мМ Трис-буфера, рН 8,0, и вносили на Qсефарозную колонку (50 мл). Белок элюировали путем повышения концентрации соли от 0 до 0,5 М NaCl и фракции, содержащие pro-hK7, объединяли и концентрировали до объема примерно 5 мл. Затем образец активировали путем добавления энтерокиназы (1:100) в течение 24 ч при 8 С. В завершение hK7 вносили на хроматографическую колонку для гель-фильтрации (типа Superdex 75, HiLoad 26/60, фирма Amersham), уравновешенную 50 мМ Трис, 100 мМ NaCl, рН 8, при скорости потока 2,5 мл/мин. Для опытов по кристаллизации буфер для белка заменяли путем диализа на 50 мМ ацетат натрия при рН 5,6 и 100 мМ хлорид натрия и белок хранили при 4 С. КристаллизацияhK7 концентрировали до 24,6 мг/мл и кристаллизовали при 20 С в висящих каплях методом диффузии паров. Смешивали 0,5 мкл раствора белка, содержащего 50 мМ ацетат натрия с рН 5,6, 100 мМ хлорид натрия, 2 мМ ингибитор и 1,8 об.% ДМСО, с 0,5 мкл резервуарного раствора, содержащего 35%(мас./об.) ПЭГ 3350, 200 мМ хлорид кальция и 100 мМ ацетат натрия при рН 4,8. Капли уравновешивали в присутствии 1 мл резервуарного раствора. Кристаллы, имеющие качество, достаточное для получения дифракционной картины, появлялись в течение 1-3 дней. Сбор данных Для регистрации рентгеноспектрометрических данных кристалл быстро замораживали в жидком азоте без использования дополнительного криопротектанта. Данные о картине дифракции рентгеновских лучей получали для одиночного кристалла комплекса hK7-ингибитор при 95K с использованием осево- 13018050 го пучка X10SA от источника синхротронного излучения швейцарского института Пауля Шеррера с помощью мозаичного CCD-детектора типа MAR225 при длине волны 0,9799 . Для кристаллов hK7 в виде комплекса с ингибиторами регистрировали по 299 или 300 изображений, каждое с амплитудой колебаний 0,5. Время экспозиции составляло от 0,5 до 1 с на одно изображение. Расстояние от кристалла до детектора составляло от 100 до 120 мм. Сырые данные о картине дифракции обрабатывали и масштабировали с помощью набора программ HKL, версия 1.98.0 (21), или с помощью программыXDS/XSCALE (22) с использованием интерфейса APRV (23). Данные, характеризующие кристалл, и объединенные статистические данные обобщены в табл. 1. Таблица 1. Объединенные статистические данные Определение структуры и уточнение структуры Структуру hK7 в виде комплекса с соединением 1 определяли методом молекулярного замещения с помощью программы MOLREP, версия 9.2.10 (24), с использованием координат человеческого калликреина 1 (pdb-код (код в Банке белковых структур (Protein Data Bank 1SPJ, уточненные до уровня разрешения 1,7 (25 в качестве поисковой модели. При использовании данных, полученных с высоким разрешением с пороговым значением 4,0, было найдено непротиворечивое решение, т.е. структура, принадлежащая пространственной группе P212121, которая представляла собой один комплекс белокмодулятор, присутствующий в асимметричной единице (коэффициент корреляции 0,34, R-фактор 0,48). Был осуществлен цикл начального уточнения с использованием протоколов уточнения rigid-body, simu- 14018050(ре)конструирования модели вручную с помощью программы О, версия 9 (27), и автоматического уточнения с использованием протоколов minimize и bindividual программы CNX, версия 2005. После этого разрешающую способность повышали до уровня 1,2 , добавляли 209 молекул воды с использованием протокола water-pick программы CNX, версия 2005, и, наконец, добавляли модулятор. На конечных циклах уточнения, которые проводили при разрешающей способности на уровне 1,2 , применяли параметры анизотропного замещения с использованием протокола adp программы CNX 2005. В качестве целевой функции уточнения применяли функцию максимальной вероятности с параметрами, описанными Engh иHuber (28), с использованием амплитуд. В процессе уточнения применяли кросс-валидацию, для чего использовали 9,8% отражений, которые были исключены из уточнения. Качество конечной модели оценивали с помощью программ CNX 2005 и PROCHECK (29). Статистические данные для уточненной модели обобщены в табл. 2. Таблица 2. Статистические данные для уточненной модели Оказалось возможным отследить положение 219 из 224 аминокислот на полученной с высоким разрешением карте электронной плотности. Аминокислоты 166RKDLL170 (в документе использована нумерация аминокислот соответствующая схеме нумерации химотрипсиногена (30), если не указано иное) характеризовались недостаточной электронной плотностью и их не включали в конечные структуры.- 15018050 Остаток аргинина в этой неупорядоченной петле был встроен в результате мутации в конструкцию, которую применяли для кристаллизации (согласно нумерации Swiss-Prot, документ Р 49862, этот остаток представляет собой Tyr180). Остаток тирозина в конструкции дикого типа характеризовался тенденцией к аутокаталитическому расщеплению, которое не имело места в случае несущего аргинин мутанта, что было продемонстрировано с помощью МС-анализа. Как следовало ожидать, между остатками Cys22-Cys157, Cys42-Cys58, Cys129-Cys232, Cys136Cys201, Cys168-Cys182 и Cys191-Cys220 были выявлены шесть дисульфидных связей и cis-пептидные связи были сформированы для аминокислот Pro147 и Pro219. Благодаря высокому разрешению структуры было установлено, что боковые цепи аминокислот 30, 38, 39, 49, 50, 84, 90, 110, 138, 153, 161, 164,187, 192 и 200 были сформированы в двух конформациях. Структура hK7 Структура hK7 в целом похожа на архитектуру hK1, hK6 и hK8 (25, 31, 32) и характеризуется классической химотрипсин-подобной укладкой, которая влючает два -бочонка и С-концевую -спираль. Активный сайт, включающий каталитическую триаду His57, Asp102 и Ser195, локализован на границе раздела между двумя -бочонками. Аналогично hK5 и hK6 и в отличие от hKl в структуре hK7 отсутствует так называемая калликреиновая петля. Калликреиновая петля, которая образуется в результате встраивания вплоть до 11 аминокислотных остатков между Thr96 и Gln97, характерна для некоторых типов калликреина, прежде всего для классического типа. Она выступает над непримированным сайтом связывания подобно крышке. hK7 не имеет аминокислотных вставок в этой области и не отличим по длине от трипсина или химотрипсина. Несмотря на общее структурное сходство с другими типами калликреина, S1-карман hK7 отличается от трипсин-подобной специфичности, например, hK1, hK5, hK6 и hK8 тем, что отрицательно заряженный Asp на дне кармана заменен на полярный Asn189 и полярные остатки Ser/Thr заменены на гидрофобный Ala190. Указанные специфические структурные особенности S1-кармана хорошо согласуются с наблюдаемой химотрипсин-подобной специфичностью hK7, характеризующейся тем, что для S1 от среднего до большого размера предпочтительными являются остатки с полярным концом. hK7 характеризуется более высокой специфичностью в отношении Tyr по сравнению Ala, Met и Phe в P1 (1,33). Неупорядоченная петля локализована на дальнем конце субстратсвязывающего кармана S3/S4. В других сериновых протеазах S1, образующих комплекс с ингибиторами, связывающимися с S1-S3, гомологичная петля является упорядоченной и имеет обратную укладку, образуя часть S3/S4-связывающего кармана, оказывая тем самым влияние на связывание с ингибитором. Таким образом, возможно, что эта часть структуры калликреина 7 становится упорядоченной после связывания с ингибитором, который оккупирует S3/S4-карманы. Кроме того, вследствие ауторасщепления после остатка тирозина в этой петле в процессе очистки указанный тирозин был заменен на остаток аргинина, что также может оказывать влияние на конформацию указанной петли. Предлагаемые в настоящем изобретении модуляторы, которые связываются с активным сайтом калликреина 7, адоптируют неожиданную форму при связывании, простираясь от S1 в направлении примированного сайта связывания. В случае соединения 1 нафтильный и метоксифенильный фрагменты связываются с S- и S2'карманами соответственно. Центральное пирролидиновое кольцо связывается с S1'-карманом и индуцирует конформационное изменение боковой цепи His57, тем самым нарушая каталитическую триаду, состоящую из His57, Asp102 и Ser195. После связывания с ингибитором боковая цепь His57 поворачивается в сторону S2-кармана (поворот вокруг chil на 120 и вокруг chi2 на 90 по отношению к структуреhK6, имеющей pdb-код 1L2E) и образует вместе с дисульфидной связью между Cys42 и Cys58 гидрофобный карман, оккупированный пирролидиновым кольцом ингибитора. Атом кислорода карбонильного радикала, который входит в состав мочевины, присутствующей в качестве фрагмента в молекуле ингибитора, оккупирует оксианионную дыру и находится на расстоянии Н-связи от каркасных атомов азота, присутствующих в Gly193 и Ser195. Один атом азота мочевины осуществляет опосредуемые водой взаимодействия с боковой цепью His57 и каркасной карбонильной группой, присутствующей в Ser214. Атом азота амида, входящего в состав ингибитора, взаимодействует с каркасным атомом кислорода карбонила, присутствующего в His41. Метоксифенильный фрагмент находится в пределах действия сил Ван-дер-Ваальса относительно Val149 и Phe151, при этом фенильное кольцо осуществляет взаимодействие по типу edge-to-face с боковой цепью Phe151. В кристаллическом окружении связанная с симметрией молекула hK7 упакована в непосредственной близости от активного сайта hK7. Как указано выше, связывание с модулятором индуцирует перемещение боковой цепи каталитического His57. Один из атомов азота этой смещенной боковой цепиHis57 находится на расстоянии Н-связи относительно каркасной карбонильной группой, присутствующей в Phe151 молекулы, связанной с симметрией. Кроме того, фрагменты модуляторов, входящие в состав примированного сайта, находятся в контакте с боковыми цепями Pro21 и Asp154 той же самой связанной с симметрией молекулы. Таким образом, нельзя полностью исключить влияние формы связывания модуляторов в результате контакта с кристаллом. Однако контакты с кристаллом не препятствуют- 16018050 связыванию различных каркасов примированного сайта в различных карманах примированного сайта. Таблица 3. Трехмерная структура нового связывающего кармана калликреина 7
МПК / Метки
МПК: A61P 17/06, A61P 17/00, C07D 209/42, C07D 209/52, A61K 31/4439, C07D 211/60, C07D 405/12, A61K 31/403, C07D 401/12, C07D 207/16, A61K 31/496, A61K 31/4025, A61K 31/401, C07K 14/435, C07K 14/47, A61K 31/4035
Метки: нарушений, лечения, опосредуемых, содержащая, эти, калликреина, композиция, активностью, способ, фармацевтическая, соединения, модуляторы
Код ссылки
<a href="https://eas.patents.su/30-18050-modulyatory-kallikreina-7-farmacevticheskaya-kompoziciya-soderzhashhaya-eti-soedineniya-sposob-lecheniya-narushenijj-oposreduemyh-aktivnostyu-kallikreina-7.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы калликреина 7, фармацевтическая композиция, содержащая эти соединения, способ лечения нарушений, опосредуемых активностью калликреина 7.</a>
Предыдущий патент: Система экспрессии гетерологичных и гомологичных целлюлаз
Следующий патент: Способ и устройство для изготовления коробок из бумаги или картона
Случайный патент: Синтез бисиндолилмалеимидов












