Система экспрессии гетерологичных и гомологичных целлюлаз
Формула / Реферат
1. Нитевидный гриб, содержащий
первый полинуклеотид, кодирующий первый гетерологичный полипептид, который представляет собой экзоцеллобиогидролазу, эндоглюканазу, бета-глюкозидазу или их домен;
второй полинуклеотид, кодирующий второй гетерологичный полипептид, который представляет собой экзоцеллобиогидролазу, эндоглюканазу, бета-глюкозидазу или их домен, который отличается своей ферментной активностью от указанного выше первого гетерологичного полипептида; и
третий полинуклеотид, кодирующий гомологичный полипептид, который представляет собой целлобиогидролазу, эндоглюканазу, бета-глюкозидазу или их домен, который отличается своей ферментной активностью от указанного выше первого и второго гетерологичного полипептида,
при этом указанный нитевидный гриб может экспрессировать первый и второй гетерологичные полипептиды и гомологичный полипептид; первый и второй гетерологичные полипептиды и гомологичный полипептид образуют функционально активную смесь, где указанный нитевидный гриб является членом подотдела Eumycotina.
2. Нитевидный гриб по п.1, в котором первый полинуклеотид функционально связан с первым промотором.
3. Нитевидный гриб по п.1, в котором второй полинуклеотид слит с третьим полинуклеотидом, при этом второй и третий полинуклеотиды функционально связаны со вторым промотором.
4. Нитевидный гриб по п.1, в котором первый полинуклеотид функционально связан с промотором, нативным для гена, кодирующего гомологичный полипептид.
5. Нитевидный гриб по п.1, в котором второй полинуклеотид слит с третьим полинуклеотидом, при этом третий полинуклеотид функционально связан с промотором гена, кодирующего гомологичный полипептид.
6. Нитевидный гриб по п.1, в котором второй полинуклеотид слит с третьим полинуклеотидом с образованием полинуклеотида, кодирующего слитый белок, при этом слитый белок содержит второй гетерологичный полипептид и гомологичный полипептид, разделенные линкером.
7. Нитевидный гриб по п.6, в котором слитый белок далее включает сайт расщепления.
8. Нитевидный гриб по п.1, который далее включает четвертый полинуклеотид, кодирующий селектируемый маркер.
9. Нитевидный гриб по п.1, который далее включает четвертый полинуклеотид, кодирующий третий гетерологичный полипептид, при этом указанный нитевидный гриб может экспрессировать третий гетерологичный полипептид.
10. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является модифицированным гомологичным полипептидом.
11. Нитевидный гриб по п.1, который далее содержит четвертый полинуклеотид, кодирующий третий гетерологичный полипептид, при этом первый и второй гетерологичные полипептиды являются модифицированными гомологичными полипептидами.
12. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид, второй гетерологичный полипептид или гомологичный полипептид являются ферментом.
13. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид, второй гетерологичный полипептид или гомологичный полипептид являются целлюлазой.
14. Нитевидный гриб по п.1, в котором функционально активная смесь является смесью целлюлаз.
15. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид, второй гетерологичный полипептид или гомологичный полипептид являются целлюлазой, выбираемой из группы, состоящей из экзоцеллобиогидролаз, эндоглюканаз и бета-глюкозидаз.
16. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой и второй гетерологичный полипептид является эндоглюканазой.
17. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой, выбираемой из группы, состоящей из семейства GH 5, 6, 7, 9 и 48, и второй гетерологичный полипептид является эндоглюканазой, выбираемой из группы, состоящей из семейства GH 5, 6, 7, 8, 9, 12, 17, 31, 44, 45, 48, 51, 61, 64, 74 и 81.
18. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является экзоцеллобиогидролазой.
19. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является первой экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является второй экзоцеллобиогидролазой, при этом первая и вторая экзоцеллобиогидролазы являются одинаковыми целлобиогидролазами.
20. Нитевидный гриб по п.1, который выбран из группы, состоящей из Aspergillus, Acremonium, Aureobasidium, Beauveria, Cephalosporium, Ceriporiopsis, Chaetomium paecilomyces, Chrysosporium, Claviceps, Cochiobolus, Cryptococcus, Cyathus, Endothia, Fusarium, Gilocladium, Humicola, Magnaporthe, Myceliophthora, Myrothecium, Mucor, Neurospora, Phanerochaete, Podospora, Paecilomyces, Penicillium, Pyricularia, Rhizomucor, Rhizopus, Schizophylum, Stagonospora, Talaromyces, Trichoderma, Thermomyces, Thermoascus, Thielavia, Tolypocladium, Trichophyton и Trametes pleurotus.
21. Нитевидный гриб по п.1, который является T.reesei и в котором первый гетерологичный полипептид является cbh1 Humicola grisea, второй гетерологичный полипептид является эндоглюканазой 1 Acidothermus cellulolyticus и гомологичный полипептид является cbh1 Trichoderma reesei.
22. Нитевидный гриб по п.1, который является T.reesei и в котором первый гетерологичный полипептид или второй гетерологичный полипептид выбран из группы, состоящей из целлобиогидролазы cbh1 Penicillium funiculosum, эндоглюканаз E3 Thermobifida, эндоглюканаз Е5 Thermobifida, GH74-core и GH48 Acidothermus cellulolyticus.
23. Нитевидный гриб по п.1, который далее включает четвертый полинуклеотид, кодирующий третий гетерологичный полипептид, при этом первый полипептид является модифицированной cbh1 Trichoderma reesei, второй гетерологичный полипептид является модифицированной cbh2 Trichoderma reesei, третий гетерологичный полипептид является эндоглюканазой 1 Acidothermus cellulolyticus и гомологичный полипептид является cbh1 Trichoderma reesei.
24. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является экзоцеллобиогидролазой, при этом экспрессия первого гетерологичного полипептида, второго гетерологичного полипептида и гомологичного полипептида образует смесь термостойких целлюлаз.
25. Нитевидный гриб по п.1, в котором третий полинуклеотид является внехромосомным полинуклеотидом.
26. Нитевидный гриб по п.1, в котором первый, второй и третий полинуклеотиды являются внехромосомными полинуклеотидами.
27. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид, второй гетерологичный полипептид и гомологичный полипептид.
28. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид, второй гетерологичный полипептид и гомологичный полипептид, из которых первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является экзоцеллобиогидролазой.
29. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид, второй гетерологичный полипептид и гомологичный полипептид, из которых первый гетерологичный полипептид является первой экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является второй экзоцеллобиогидролазой, где первая и вторая экзоцеллобиогидролазы являются одинаковыми целлобиогидролазами.
30. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид, второй гетерологичный полипептид и гомологичный полипептид, где нитевидный гриб является T.reesei, первый гетерологичный полипептид является cbh1 Humicola grisea, второй гетерологичный полипептид является эндоглюканазой 1 Acidothermus cellulolyticus и гомологичный полипептид является cbh1 Trichoderma reesei.
31. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.23, при этом полипептидная смесь включает первый гетерологичный полипептид, второй гетерологичный полипептид, третий гетерологичный полипептид и гомологичный полипептид.
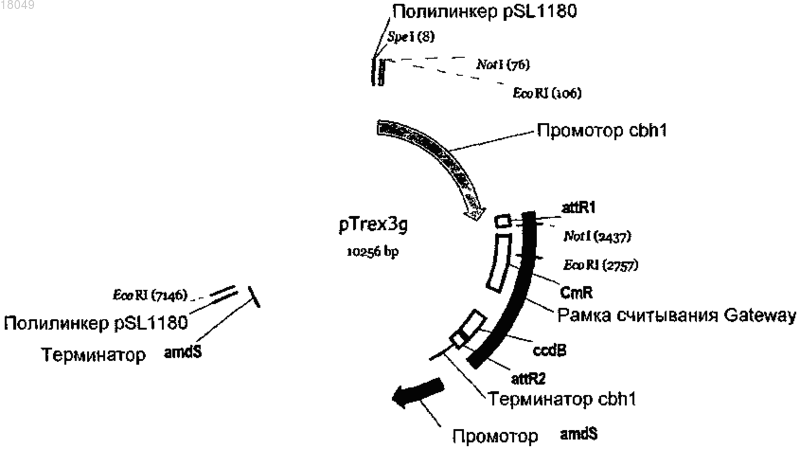
Текст
СИСТЕМА ЭКСПРЕССИИ ГЕТЕРОЛОГИЧНЫХ И ГОМОЛОГИЧНЫХ ЦЕЛЛЮЛАЗ Изобретение относится к нитевидным грибам, экспрессирующим комбинацию гетерологичных и гомологичных полипептидов, к полипептидным смесям, включающим комбинацию гетерологичных и гомологичных полипептидов, и к способам получения полипептидных смесей. Перекрестная ссылка на родственную заявку По заявке на данное изобретение испрашивается приоритет предварительной заявки на патент СШАUS 60/933894, поданной 8 июня 2007 г., которая полностью включена в настоящее описание изобретения в качестве ссылки. Заявление о финансировании научной работы на федеральном уровне Некоторые части данной научной работы финансировались Национальной лабораторией возобновляемой энергии по субдоговоруZC0-0-30017-01 на основании основного договораDE-AC36-99G010337, заключенного с Министерством энергетики США. Таким образом, правительство США может иметь определенные права на изобретение. Введение Целлюлоза и гемицеллюлоза являются наиболее распространенными растительными веществами,образующимися в результате фотосинтеза. Указанные вещества могут расщепляться и использоваться в качестве источника энергии многими микроорганизмами, включая бактерии, дрожжи и грибы, которые продуцируют внеклеточные ферменты, способные гидролизовать полимерные субстраты в мономерные сахара. Целлюлазы являются ферментами, которые гидролизуют целлюлозу (бета-1,4-глюкановые или бета-D-гликозидные связи) с образованием глюкозы, целлобиозы, целлоолигосахаридов и т.п. Целлюлазы традиционно разделены на три основных класса: эндоглюканазы (EC 3.2.1.4) ("EG"), экзоглюканазы или целлобиогидролазы (EC 3.2.1.91) ("CBH") и бета-глюкозидазы ([бета]-D-глюкозид-глюкогидролаза; ЕС 3.2.1.21) ("BG"). Эндоглюканазы действуют в основном в аморфных частях целлюлозного волокна, в то время как целлобиогидролазы способны также расщеплять кристаллическую целлюлозу. Для эффективного превращения кристаллической целлюлозы в глюкозу необходима полная система целлюлаз, включающая компоненты СВН, EG и BG, так как отдельно выделенные компоненты менее эффективно гидролизуют кристаллическую целлюлозу (Filho et al., Can. J. Microbiol. 42:1-5, 1996). Весьма перспективной является экспрессия указанных многокомпонентных систем целлюлаз в нитевидных грибах для промышленного производства целлюлаз. Сущность изобретения Таким образом, настоящее изобретение относится к нитевидным грибам, экспрессирующим комбинацию гетерологичных и гомологичных полипептидов, к полипептидным смесям, включающим комбинацию гетерологичных и гомологичных полипептидов, и к способам получения полипептидных смесей. Некоторые варианты осуществления настоящего изобретения относятся к нитевидному грибу,включающему два или более полинуклеотида, кодирующих два или более гетерологичных полипептидов, и полинуклеотид, кодирующий гомологичный полипептид. Нитевидный гриб может экспрессировать гетерологичные и гомологичные полипептиды, которые вместе образуют функционально активную смесь. Некоторые варианты осуществления настоящего изобретения относятся к культуральной среде,включающей популяцию нитевидного гриба по настоящему изобретению. Некоторые варианты осуществления настоящего изобретения относятся к полипептидной смеси,включающей два или более гетерологичных полипептида и гомологичный полипептид. Полипептидная смесь может быть получена из нитевидных грибов по настоящему изобретению. Некоторые варианты осуществления настоящего изобретения относятся к способу получения смеси целлюлаз. Указанный способ включает получение полипептидной смеси, содержащей два или более гетерологичных полипептида и гомологичный полипептид, из нитевидного гриба по настоящему изобретению. В некоторых вариантах осуществления изобретения гетерологичные полипептиды являются экзоцеллобиогидролазой и эндоглюканазой, и гомологичный полипептид является экзоцеллобиогидролазой. Гетерологичная экзоцеллобиогидролаза и гомологичная экзоцеллобиогидролаза могут быть, но не обязательно являются одинаковыми экзоцеллобиогидролазами. Ниже представлены вышеуказанные и другие признаки настоящего изобретения. Краткое описание чертежей Специалисту должно быть понятно, что чертежи приведены только в иллюстративных целях. Представленные чертежи никоим образом не ограничивают объем настоящего изобретения. На фиг. 1 показана нуклеотидная последовательность (SEQ ID NO:1) слитой конструкции гетерологичной целлюлазы, включающая 2656 оснований. На фиг. 2 показана аминокислотная последовательность (SEQ ID NO:2) слитого белка целлюлазы,прогнозируемая на основе последовательности нуклеиновой кислоты, изображенной на фиг. 1. На фиг. 3A-3F показана нуклеотидная последовательность (SEQ ID NO:14) вектора pTrex4, содержащего каталитический домен E1. На фиг. 4 показана плазмидная карта экспрессирующего вектора pTrex3g T.reesei. На фиг. 5 А показан экспрессирующий вектор pTrex3g-Hgrisea-cbh1, используемый для получения типичного трехкомпонентного штамма. На фиг. 5 В-5 Е показана нуклеотидная последовательность (SEQ ID NO:7) экспрессирующего вектора, изображенного на фиг. 5 А. На фиг. 6 показаны три ДНК-экспрессирующих фрагмента, трансфицированные в штамм с делецией cbh1 для создания четырехкомпонентного штамма. На фиг. 7 А показана нуклеотидная последовательность (SEQ ID NO:8) от инициирующего кодона до терминирующего кодона полинуклеотида, экспрессирующего генетически созданный белок cbh1. На фиг. 7 В показана последовательность генетически созданного белка cbh1 (SEQ ID NO:9). Сигнальная последовательность cbh1 подчеркнута. На фиг. 8 А показан cbh1-экспрессирующий вектор pTrex3g-cbh1. На фиг. 8B-8F показана нуклеотидная последовательность (SEQ ID NO:10) экспрессирующего вектора pTrex3g-cbh1. На фиг. 9 А показана нуклеотидная последовательность (SEQ ID NO:11) от инициирующего кодона до терминирующего кодона полинуклеотида, экспрессирующего генетически созданный белок cbh1. На фиг. 9 В показана аминокислотная последовательность генетически созданного белка cbh2(SEQ ID NO:12). Сигнальная последовательность подчеркнута. На фиг. 10 А показан cbh2-экспрессирующий вектор рЕхр-cbh2. На фиг. 10B-10G показана нуклеотидная последовательность (SEQ ID NO:13) экспрессирующего вектора pExp-cbh2. Подробное описание различных вариантов осуществления изобретения Ниже будет дано подробное описание изобретения с использованием нижеследующих определений терминов и примеров. За исключением особо оговоренных случаев все технические и научные термины,использованные в настоящем описании изобретения, имеют общепринятые значения, известные специалисту в научной области, к которой относится данное изобретение. Числовые интервалы охватывают все числа, указанные в данном интервале. Заголовки, приведенные в настоящем описании изобретения, не ограничивают разные объекты и варианты осуществления изобретения и могут рассматриваться как относящиеся к описанию изобретения в целом. Таким образом, приведенные ниже термины имеют более полное определение, относящееся ко всему описанию изобретения. Термин "полипептид", используемый в настоящем описании, означает соединение, состоящее из одной цепи аминокислотных остатков, связанных пептидными связями. Термин "белок", используемый в настоящем описании, имеет взаимозаменяемое значение с термином "полипептид". Термин "нуклеиновая кислота" и "полинуклеотид" имеют взаимозаменяемые значения и означают одноцепочечную или двухцепочечную ДНК, РНК, кДНК и их химические модификации. Так как генетический код является вырожденным, для кодирования определенной аминокислоты может быть использовано несколько кодонов, и в объем настоящего изобретения входят все полинуклеотиды, кодирующие определенную аминокислотную последовательность. Термин "рекомбинантный", используемый применительно к клетке, нуклеиновой кислоте, белку или вектору, означает, что указанная клетка, нуклеиновая кислота, белок или вектор модифицированы путем введения гетерологичной нуклеиновой кислоты или белка либо изменения нативной нуклеиновой кислоты или белка, что данная клетка получена из модифицированной таким образом клетки или что белок экспрессирован в ненативной или генетически модифицированной среде, например, в экспрессирующем векторе для прокариотической или эукариотической системы. Таким образом, например, рекомбинантные клетки экспрессируют нуклеиновые кислоты или полипептиды, не встречающиеся в естественной (нерекомбинантной) форме клетки, или экспрессируют нативные гены, которые в противном случае были бы анормально экспрессированы, недостаточно экспрессированы, сверхэкспрессированы или вообще не экспрессированы. Термин "гетерологичный" применительно к полинуклеотиду или полипептиду означает полинуклеотид или полипептид, имеющий последовательность, которая в естественных условиях отсутствует в клетке-хозяине. В одних вариантах осуществления изобретения полипептид является коммерчески важным промышленным белком, и в других вариантах осуществления изобретения гетерологичный полипептид является терапевтическим белком. Предполагается, что в определение данного термина входят белки, кодированные природными генами, мутированными генами и/или синтезированными генами. Термин "гомологичный" применительно к полинуклеотиду или полипептиду означает полинуклеотид или полипептид, имеющий последовательность, которая естественно присутствует в клетке-хозяине. В используемом в данном случае значении термин "слитая нуклеиновая кислота" означает две или большее число нуклеиновых кислот, функционально связанных друг с другом. Нуклеиновая кислота может быть ДНК, геномной ДНК и кДНК, РНК или гибридом РНК и ДНК. В конструкции последовательностей слитой нуклеиновой кислоты может быть использована нуклеиновая кислота, кодирующая всю или часть последовательности полипептида. В одних вариантах осуществления изобретения использована нуклеиновая кислота, кодирующая непроцессированные полипептиды. В других вариантах осуществления изобретения может быть использована нуклеиновая кислота, кодирующая часть полипептида. Термин "слитый полипептид" означает белок, включающий по меньшей мере две отдельные и различные области, которые могут быть получены из одного и того же белка или из разных белков. Например, слитым полипептидом или слитым белком может считаться белок, в котором сигнальный пептид,связанный с представляющим интерес белком, обычно не ассоциирован с указанным представляющим интерес белком. Термины "выделенный" и "отделенный" имеют взаимозаменяемые значения и означают белок,клетку, нуклеиновую кислоту, аминокислоту и т.д., удаленные по меньшей мере из одного компонента, с которым они ассоциированы в естественных условиях. В используемом в данном случае значении термин "ген" означает полинуклеотид (например, сегмент ДНК), участвующий в образовании полипептидной цепи, которая может включать или не включать области, предшествующие или следующие за кодирующей областью, например 5'-концевые нетранслированные (5'UTR) или "лидерные" последовательности и 3'UTR или "трейлерные" последовательности, а также вставочные последовательности (интроны) между отдельными кодирующими сегментами (экзонами). В используемом в данном случае значении термин "промотор" означает последовательность нуклеиновой кислоты, которая направляет транскрипцию гена нижней области. Промотор обычно должен соответствовать клетке-хозяину, в которой экспрессирован ген-мишень. Промотор вместе с другими последовательностями нуклеиновой кислоты, регулирующими транскрипцию и трансляцию (именуемыми также "регуляторными последовательностями"), необходим для экспрессии данного гена. Как правило,последовательности, регулирующие транскрипцию и трансляцию, включают, не ограничиваясь ими,промоторные последовательности, сайты связывания рибосом, последовательности, инициирующие и терминирующие транскрипцию, последовательности, инициирующие и терминирующие трансляцию,энхансерные или активаторные последовательности. В используемом в данном случае значении термин "функционально связанный" означает, что нуклеиновая кислота, регулирующая транскрипцию, находится по отношению к кодирующим последовательностям в положении, обеспечивающем инициацию транскрипции. Как правило, это означает, что промотор и последовательности, инициирующие транскрипцию, расположены в 5'-направлении относительно кодирующей области. Нуклеиновая кислота, регулирующая транскрипцию, обычно должна соответствовать клетке-хозяину, используемой для экспрессии указанного белка. В данной области известны соответствующие экспрессирующие векторы и приемлемые регуляторные последовательности многих типов для разных клеток-хозяев. В используемом в данном случае значении термин "экспрессия" означает процесс образования полипептида на основании последовательности нуклеиновой кислоты гена. Указанный процесс включает транскрипцию и трансляцию. В используемом в данном случае значении термин "вектор" означает полинуклеотидную конструкцию, созданную для введения нуклеиновых кислот в клетки одного или нескольких типов. Векторы включают клонирующие векторы, экспрессирующие векторы, шаттл-векторы, плазмиды, кластеры и т.п. В используемом в данном случае значении термин "экспрессирующий вектор" означает вектор,способный включать и экспрессировать фрагменты гетерологичной ДНК в чужеродной клетке. Многие прокариотические и эукариотические экспрессирующие векторы являются коммерчески доступными. В используемом в данном случае значении термины "векторная ДНК", "трансформирующая ДНК" и"экспрессирующий вектор" имеют взаимозаменяемые значения и относятся к ДНК, используемой для введения последовательностей в клетку-хозяина или организм. Указанная ДНК может быть создана invitro при помощи полимеразной цепной реакции (ПЦР) или любых других приемлемых методов, известных в данной области, например, при помощи стандартных методов молекулярной биологии, описанных в публикации Sambrook et al. Кроме того, ДНК экспрессирующей конструкции может быть синтезирована искусственно, например, химическим путем. Векторная ДНК, трансформирующая ДНК или рекомбинантный экспрессирующий кластер могут быть введены в плазмиду, хромосому, внехромосомный элемент, митохондриальную ДНК, плазмидную ДНК, вирус или фрагмент нуклеиновой кислоты. Рекомбинантный экспрессирующий кластер экспрессирующего вектора, векторной ДНК или трансформирующей ДНК обычно включает наряду с другими последовательностями транскрибируемую последовательность нуклеиновой кислоты и промотор. В предпочтительных вариантах осуществления изобретения экспрессирующие векторы способны вводить и экспрессировать фрагменты гетерологичной ДНК в клеткехозяине. Термин "введенный" применительно к введению последовательности нуклеиновой кислоты в клетку означает "трансфекцию", "трансформацию" или "трансдукцию" и относится к введению последовательности нуклеиновой кислоты в эукариотическую или прокариотическую клетку, в которой данная последовательность нуклеиновой кислоты может быть встроена в геном клетки (например, в хромосому,внехромосомный элемент, плазмиду, пластиду или митохондриальную ДНК), превращена в автономный репликон или временно экспрессирована (например, трансфицированная мРНК). Термин "клетка-хозяин" означает клетку, которая содержит вектор и поддерживает репликацию и/или транскрипцию и трансляцию (экспрессию) экспрессирующей конструкции. В используемом в данном случае значении термин "культивирование" означает выращивание популяции клеток в приемлемых условиях в жидкой, полутвердой или плотной среде. В используемом в данном случае значении термины "замещенный" и "модифицированный" имеют взаимозаменяемые значения и относятся к последовательности, такой как аминокислотная последовательность или последовательность нуклеиновой кислоты, которая включает делецию, инсерцию, замену или прерывание природной последовательности. Часто в контексте настоящего изобретения замещенная последовательность включает замену природного остатка. В используемом в данном случае значении термин "модифицированный фермент" означает фермент, который включает делецию, инсерцию, замену или прерывание природной последовательности. Термин "вариант" означает область белка, содержащую одну или несколько других аминокислот по сравнению с исходным белком, например природным белком или белком дикого типа. Термин "целлюлаза" означает категорию ферментов, способных гидролизовать полимеры целлюлозы (бета-1,4-глюкановые или бета-D-глюкозидные связи) с образованием более коротких целлоолигосахаридных олигомеров, целлобиозы и/или глюкозы. Термин "экзоцеллобиогидролаза" (СВН) означает группу целлюлазных ферментов, классифицируемых как ЕС 3.2.1.91, и/или ферментов в определенных семействах GH, которые включают, не ограничиваясь ими, ферменты в семействах GH 5, 6, 7, 9 или 48. Указанные ферменты известны также как экзоглюканазы или целлобиогидролазы. Ферменты СВН гидролизуют целлобиозу из восстанавливающегося или невосстанавливающегося конца целлюлозы. Как правило, фермент типа cbh1 предпочтительно гидролизует целлобиозу из восстанавливающегося конца целлюлозы, и фермент типа cbh2 предпочтительно гидролизует невосстанавливающийся конец целлюлозы. Термин "активность целлобиогидролазы" в используемом в данном случае значении означает активность 1,4-D-глюканцеллобиогидролазы, которая катализирует гидролиз 1,4-бета-D-глюкозидных связей в целлюлозе, целлотетриозе или любом полимере, содержащей бета-1,4-связанную глюкозу, отщепляя целлобиозу от концов цепи. В используемом в данном случае значении активность целлобиогидролазы определяется высвобождением из целлюлозы водорастворимого восстанавливающегося сахара, измеряемым методом РНВАН, описанным в публикации Lever et al., 1972, Anal. Biochem. 47:273-279. Различие между воздействием экзоглюканазы, целлобиогидролазы и эндоглюканазы определяют аналогичным образом на основании высвобождения восстанавливающегося сахара из замещенной целлюлозы, такой как карбоксиметилцеллюлоза или гидроксиэтилцеллюлоза (Ghose, 1987, PureAppl. Chem. 59:257-268). Истинная целлобиогидролаза характеризуется очень высоким уровнем активности в отношении незамещенной целлюлозы по сравнению с замещенной целлюлозой (Bailey et al., 1993, Biotechnol. Appl.Biochem. 17:65-76). Термин "эндоглюканаза" (EG) означает группу целлюлазных ферментов, классифицируемых как ЕС 3.2.1.4, и/или ферментов в определенных семействах GH, которые включают, не ограничиваясь ими,ферменты в семействах GH 5, 6, 7, 8, 9, 12, 17, 31, 44, 45, 48, 51, 61, 64, 74 или 81. Фермент EG гидролизует внутренние бета-1,4-глюкозидные связи целлюлозы. Термин "эндоглюканаза" в используемом в данном случае значении означает эндо-1,4-(1,3;1,4)-бета-D-глюкан-4-глюканогидролазу, которая катализирует эндогидролиз 1,4-бета-D-глюкозидных связей в целлюлозе, производных целлюлозы (например,карбоксиметилцеллюлозе), лихенине, бета-1,4-связи в смешанных бета-1,3-глюканах, таких как бета-D-глюканы или ксилоглюканы злаков, и в других растениях, содержащих целлюлозные компоненты. В используемом в данном случае значении активность эндоглюканазы определяют путем гидролиза карбоксиметилцеллюлозы (CMC) методом, описанным в публикации Ghose, 1987, Pure and Appl. Chem. 59:257-268. Термин "бета-глюкозидаза" в используемом в данном случае значении означает бета-D-глюкозид-глюкогидролазу, классифицируемую как ЕС 3.2.1.21, и/или ферменты в определенных семействах GH, которые включают, не ограничиваясь ими, ферменты в семействах GH 1, 3, 9 или 48,катализирующие гидролиз целлобиозы с высвобождением бета-D-глюкозы. В используемом в данном случае значении активность бета-глюкозидазы может быть измерена методами, известными в данной области, например, ВЭЖХ. Термин "разлагающая целлюлозу активность" означает активность экзоглюканазы, активность эндоглюканазы или активность ферментов обоих типов, а также активность бета-глюкозидазы. Термины "термически устойчивый" и "термостойкий" относятся к полипептидам или ферментам по настоящему изобретению, которые в определенной степени сохраняют биологическую, например, ферментативную активность после воздействия повышенной температуры, т.е. температуры выше комнатной. В некоторых вариантах осуществления изобретения полипептид или фермент считается термостойким при сохранении более 50, 60, 70, 75, 80, 85, 90, 95 или 98% биологической активности после воздействия определенной температуры, например 40, 45, 50, 55, 60, 65, 70, 75 или 80C, в течение 2, 5, 7, 10,15, 20, 30, 40, 50 или 60 мин при pH, равном, например, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5 или 8. Термин "нитевидные грибы" означает любые, а также все нитевидные грибы, известные специалистам в данной области. Как правило, нитевидные грибы являются эукариотическими микроорганизмами и включают все нитевидные формы подотдела Eumycotina. Указанные грибы характеризуются наличием вегетативного мицелия, клеточная оболочка которого состоит из хитина, бета-глюкана и других сложных полисахаридов. В некоторых вариантах осуществления изобретения нитевидные грибы по настоящему изобретению в морфологическом, физиологическом и генетическом отношении отличаются от дрожжей. В некоторых вариантах осуществления изобретения нитевидные грибы включают, не ограничиваясь ими,следующие роды: Aspergillus, Acremonium, Aureobasidium, Beauveria, Cephalosporium, Ceriporiopsis, Chaetomium paecilomyces, Chrysosporium, Claviceps, Cochiobolus, Cryptococcus, Cyathus, Endothia, Endotia mucor, Fusarium, Gilocladium, Humicola, Magnaporthe, Myceliophthora, Myrothecium, Mucor, Neurospora,Phanerochaete, Podospora, Paecilomyces, Penicillium, Pyricularia, Rhizomucor, Rhizopus, Schizophylum,Stagonospora, Talaromyces, Trichoderma, Thermomyces, Thermoascus, Thielavia, Tolypocladium, Trichophyton и Trametes pleurotus. В некоторых вариантах осуществления изобретения нитевидные грибы включают, не ограничиваясь ими, следующие виды: A.nidulans, A.niger, A.awomari, например NRRL 3112, ATCC 22342 (NRRL 3112), ATCC 44733, ATCC 14331 и штамм UVK 143f, A.oryzae, например ATCC 11490,N.crassa, Trichoderma reesei, например NRRL 15709, ATCC 13631, 56764, 56765, 56466, 56767, иTrichoderma viride, например ATCC 32098 и 32086. Термин "Trichoderma" или "вид Trichoderma" в используемом здесь значении означает любые грибы, которые ранее были классифицированы как вид или штамм Trichoderma и которые в настоящее время классифицированы как вид или штамм Trichoderma или как вид или штамм Hypocrea. В некоторых вариантах осуществления изобретения указанный вид включает Trichoderma longibrachiatum, Trichodermareesei, Trichoderma viride или Hypocrea jecorina. В качестве исходного штамма могут быть также использованы штаммы, сверхпродуцирующие целлюлазу, такие как T.longibrachiatum/reesei RL-P37 (Sheir-NeissRut-C30. В некоторых вариантах осуществления изобретения продуцирование целлюлаз в видах, предназначенных для улучшения, строго регулируется и является чувствительным к разным окружающим условиям. Настоящее изобретение относится к нитевидному грибу, включающему два или более полинуклеотида, кодирующих два или более гетерологичных полипептида, и полинуклеотид, кодирующий гомологичный полипептид. Нитевидный гриб может экспрессировать гетерологичные и гомологичные полипептиды, образующие функционально активную смесь. В некоторых вариантах осуществления изобретения нитевидный гриб содержит первый полинуклеотид и второй полинуклеотид, кодирующие соответственно первый гетерологичный полипептид и второй гетерологичный полипептид, а также третий полинуклеотид, кодирующий гомологичный полипептид. В некоторых вариантах осуществления изобретения нитевидный гриб содержит дополнительный полинуклеотид, четвертый полинуклеотид, кодирующий третий гетерологичный полипептид. В некоторых вариантах осуществления изобретения нитевидный гриб содержит четыре или более полинуклеотидов, кодирующих четыре или более гетерологичных полипептидов, и один или несколько полинуклеотидов, кодирующих один или несколько гомологичных полипептидов. В соответствии с настоящим изобретением функционально активная смесь включает любую смесь полипептидов при условии, что такая смесь выполняет по меньшей мере одну функцию, биологическую или какую-либо еще, которая является следствием активности по меньшей мере двух или трех полипептидов в смеси. Другими словами, по меньшей мере два или три полипептида в указанной смеси обеспечивают активность полипептидной смеси на детектируемом уровне. В некоторых вариантах осуществления изобретения функционально активная смесь включает по меньшей мере три полипептида и обладает функциональной активностью, обеспечиваемой по меньшей мере двумя или тремя полипептидами в указанной смеси. В некоторых других вариантах осуществления изобретения функционально активная смесь включает по меньшей мере три полипептида и выполняет ферментативную функцию, осуществляемую по меньшей мере двумя или тремя полипептидами в указанной смеси. В некоторых вариантах осуществления изобретения функционально активная смесь включает по меньшей мере три полипептида и выполняет функцию целлюлазы, обеспечиваемую по меньшей мере двумя или тремя полипептидами в указанной смеси. В некоторых вариантах осуществления изобретения функционально активная смесь включает четыре полипептида и выполняет функцию, обеспечиваемую двумя, тремя или четырьмя полипептидами в указанной смеси. В некоторых вариантах осуществления изобретения функционально активная смесь выполняет функцию, соответствующую улучшению любой активности, например активности секретируемого белка,включающей без каких-либо ограничений активность целлюлазы, активность осахаривания или термостойкость, и ассоциированной с нитевидным грибом или обеспечиваемой указанным грибом. В некоторых вариантах осуществления изобретения функционально активная смесь выполняет функцию, обеспечиваемую активностью экзоцеллобиогидролазами, эндоглюканазами, бета-глюкозидазами или любой их комбинацией. В некоторых вариантах осуществления изобретения функционально активная смесь не содержит никакого бактериального фермента в комбинации с белком-носителем нитевидного гриба. В некоторых вариантах осуществления изобретения функционально активная смесь не образует никакого антитела или функционально активных фрагментов антитела, таких как Fab, одноцепочечное антитело и т.д. В некоторых вариантах осуществления изобретения полинуклеотиды, кодирующие гетерологичные или гомологичные полипептиды, функционально связаны с одним или несколькими промоторами. Промотор может быть любым приемлемым промотором, который известен в данной области в настоящее время или будет открыт в будущем. В некоторых вариантах осуществления изобретения полинуклеотиды экспрессированы под воздействием промотора, нативного для нитевидного гриба. В некоторых вариантах осуществления изобретения полинуклеотиды экспрессированы под воздействием гетерологичного промотора. В некоторых вариантах осуществления изобретения полинуклеотиды экспрессированы под воздействием конститутивного или индуцибельного промотора. Примеры приемлемых промоторов включают, не ограничиваясь ими, промотор целлюлазы, промотор ксиланазы, промотор 1818 (который ранее был идентифицирован как высокоэкспрессированный белок при картировании EST Trichoderma). В некоторых вариантах осуществления изобретения промотор является промотором целлюлазы нитевидного гриба. В некоторых вариантах осуществления изобретения промотор является промотором экзоцеллобиогидролазы, эндоглюканазы или бета-глюкозидазы. В некоторых вариантах осуществления изобретения промотор является промотором целлобиогидролазы I (cbh1). Неограничивающие примеры промоторов включают промоторы cbh1, cbh2, egl1, egl2, egl3, egl4, egl5, pki1, gpd1, xyn1 и xyn2. Кроме того, два или более полинуклеотидов, кодирующих гетерологичные или гомологичные полипептиды или их части, могут быть слиты друг с другом с образованием слитого полинуклеотида. Слитый полинуклеотид может быть функционально связан с любым вышеописанным приемлемым промотором. В некоторых вариантах осуществления изобретения первый полинуклеотид, кодирующий первый гетерологичный полипептид, функционально связан с первым промотором. Первый промотор может отличаться, хотя и не обязательно, от одного или нескольких промоторов, с которыми функционально связан второй или третий полинуклеотид. В некоторых вариантах осуществления изобретения первый полинуклеотид функционально связан с промотором гена, кодирующего гомологичный полипептид. В некоторых вариантах осуществления изобретения полинуклеотид, например второй полинуклеотид, кодирующий второй гетерологичный полипептид, слит с другим полинуклеотидом, например с третьим полинуклеотидом, кодирующим гомологичный полипептид, с образованием слитого полинуклеотида. Слитый полинуклеотид может быть функционально связан с любым приемлемым промотором,который включает, не ограничиваясь им, промотор гена, кодирующего гомологичный полипептид. Слитый полинуклеотид кодирует слитый полипептид или слитый белок, который включает два полипептида,домена или их части. Части или домены полипептидов могут представлять собой любую часть или домен полипептидов, которые выполняют по меньшей мере одну функцию, биологическую или какую-либо еще, или становятся функционально активными, при образовании слитого полипептида или объединении с другими полипептидами функционально активной смеси. В некоторых вариантах осуществления изобретения слитый белок включает второй гетерологичный полипептид и гомологичный полипептид. В некоторых вариантах осуществления изобретения слитый полинуклеотид кодирует слитый белок,включающий два полипептида, например второй гетерологичный полипептид и гомологичный полипептид, разделенные линкером или линкерной областью. Линкер может быть любым приемлемым линкером, используемым для связывания двух полипептидов. Линкерная область обычно образует удлиненный полужесткий спейсер между доменами пептидов с независимо уложенной цепью. Линкерная область между полипептидами слитого белка является более предпочтительной, делая возможной независимую укладку цепи полипептидов. В некоторых вариантах осуществления изобретения линкер получают из глюкоамилазы вида Aspergillus и линкеров cbh1 вида Tricoderma. В некоторых вариантах осуществления изобретения линкер может быть, хотя и не обязательно, частью полипептидов, образующих слитый белок. В некоторых вариантах осуществления изобретения полипептиды слитого белка представляют собой второй гетерологичный полипептид и гомологичный полипептид. В некоторых вариантах осуществления изобретения слитый полинуклеотид кодирует слитый белок,включающий два полипептида, разделенных линкером или линкерной областью, и сайт расщепления. В некоторых вариантах осуществления изобретения полипептиды слитого белка представляют собой второй гетерологичный полипептид и гомологичный полипептид. Как правило, сайт расщепления расположен в линкерной области и разделяет последовательности, граничащие с сайтом расщепления. Сайт расщепления может включать любую последовательность, которая может быть расщеплена любым способом, который известен в настоящее время или будет открыт в будущем и включает, не ограничиваясь им,расщепление протеазой или под воздействием определенных химических веществ. Примеры таких последовательностей включают, не ограничиваясь ими, сайт расщепления кексином, например сайт узнавания KEX2, содержащий кодоны для аминокислот Lys и Arg, сайты узнавания Lys и Arg протеазы трипсина и сайт узнавания и расщепления Lys-C эндопротеиназы. В некоторых вариантах осуществления изобретения нитевидный гриб по настоящему изобретению далее включает полинуклеотид, кодирующий селектируемый маркер. Указанный маркер может быть любым приемлемым маркером, позволяющим производить отбор трансформированных клеток-хозяев. Селектируемый маркер обычно является геном, экспрессируемым в клетке-хозяине, который облегчает отбор указанных клеток-хозяев, содержащих вектор. В используемом здесь значении указанный термин обычно относится к генам, показывающим, что клетка-хозяин поглотила представляющую интерес ДНК или произошла какая-либо другая реакция. Селектируемые маркеры обычно являются генами, сообщающими бактериальную устойчивость или метаболическое преимущество клетке-хозяину, что позволяет отличить клетки, содержащие экзогенную ДНК, от клеток, которые не получили экзогенную последовательность в процессе трансформации. Примеры таких селектируемых маркеров включают, не ограничиваясь ими, антибактериальные средства (например, канамицин, эритромицин, актиномицин, хлорамфеникол и тетрациклин). Дополнительные примеры маркеров включают, не ограничиваясь ими, генAspergillus niger. В некоторых вариантах осуществления изобретения нитевидный гриб по настоящему изобретению далее включает и может экспрессировать четвертый полинуклеотид, кодирующий третий гетерологичный полипептид. Гетерологичные или гомологичные полипептиды могут быть природными полипептидами или их вариантами. В некоторых вариантах осуществления изобретения один или несколько гетерологичных полипептидов могут быть вариантами гомологичных полипептидов. Например, первый гетерологичный полипептид может быть модифицированным гомологичным полипептидом. В некоторых вариантах осуществления изобретения первый и второй гетерологичные полипептиды являются модифицированными гомологичными полипептидами. В некоторых вариантах осуществления изобретения первый и второй гетерологичные полипептиды являются модифицированными гомологичными полипептидами, и нитевидный гриб содержит четвертый полинуклеотид, кодирующий третий гетерологичный полипептид. Третий гетерологичный полипептид может быть или не быть модифицированным гомологичным полипептидом. Гетерологичные и гомологичные полипептиды по настоящему изобретению могут быть любыми требуемыми полипептидами, которые при смешивании с другими полипептидами по настоящему изобретению образуют функционально активную смесь, которая выполняет по меньшей мере одну функцию, биологическую или какую-либо еще, обеспечиваемую по меньшей мере двумя или тремя полипептидами в смеси. В некоторых вариантах осуществления изобретения смесь гетерологичных и гомологичных полипептидов позволяет функционально активной смеси лучше выполнять функцию, соответствующую активности нитевидного гриба или обеспечиваемую указанным грибом. В некоторых вариантах осуществления изобретения указанные активности включают, не ограничиваясь ими, лучшую активность секретируемого белка, лучшую активность осахаривания или термостойкость, т.е. устойчивость при более высоких температурах или при измененных значениях pH, и/или стабильную активность в течение более продолжительных периодов времени при постоянной температуре. В некоторых вариантах осуществления изобретения гетерологичные или гомологичные полипептиды не включают никакого бактериального фермента в комбинации с белком-носителем нитевидного гриба. В некоторых вариантах осуществления изобретения гетерологичные или гомологичные полипептиды не образуют никакого антитела или функционально активных фрагментов антитела, таких как Fab, одноцепочечное антитело и т.д. В некоторых вариантах осуществления изобретения один или несколько полипептидов из первого или второго гетерологичного полипептида или гомологичного полипептида являются ферментом или его частью. В некоторых вариантах осуществления изобретения первый или второй гетерологичный полипептид или гомологичный полипептид является целлюлазой, гемицеллюлазой, ксиналазой, маннаназой,их доменом или частью. В некоторых вариантах осуществления изобретения первый или второй гетерологичный полипептид или гомологичный полипептид является целлюлазой или ее частью. В некоторых вариантах осуществления изобретения первый и второй гетерологичные полипептиды и гомологичный полипептид вместе образуют функционально активную смесь целлюлаз. В некоторых вариантах осуществления изобретения первый или второй гетерологичный полипептид или гомологичный полипептид является целлюлазой, выбираемой из группы, включающей экзоцеллобиогидролазы, эндоглюканазы, бета-глюкозидазы или их части. Первый или второй гетерологичный полипептид, гомологичный полипептид и, в случае его наличия, третий гетерологичный полипептид без каких-либо ограничений могут быть выбраны из группы, включающей экзоцеллобиогидролазы,эндоглюканазы, бета-глюкозидазы или их домены. В некоторых вариантах осуществления изобретения несколько гетерологичных или гомологичных полипептидов могут относиться к одному и тому же классу или группе целлюлаз. Например, два или более полипептида могут относиться к классу экзоцеллобиогидролаз. В некоторых вариантах осуществления изобретения один из гетерологичных полипептидов относится к тому же классу целлюлаз, что и гомологичный полипептид. В некоторых вариантах осуществления изобретения гетерологичные и гомологичные полипептиды являются одинаковыми членами одного класса, но имеют последовательности разного происхождения. В некоторых вариантах осуществления изобретения нитевидный гриб по настоящему изобретению содержит первый полинуклеотид и второй полинуклеотид, кодирующие соответственно первый гетерологичный полипептид и второй гетерологичный полипептид, при этом первый гетерологичный полипептид является экзоцеллобиогидролазой и второй гетерологичный полипептид является эндоглюканазой. В некоторых вариантах осуществления изобретения первый гетерологичный полипептид является экзоцел-7 018049 лобиогидролазой, классифицируемой как ЕС 3.2.1.91, и второй гетерологичный полипептид является эндоглюканазой, классифицируемой как ЕС 3.2.1.4. В некоторых вариантах осуществления изобретения первый гетерологичный полипептид является экзоцеллобиогидролазой, выбираемой из группы, состоящей из семейства GH 5, 6, 7, 9, 48, и второй гетерологичный полипептид является эндоглюканазой, выбираемой из группы, состоящей из семейства GH 5, 6, 7, 8, 9, 12, 17, 31, 44, 45, 48, 51, 61, 64, 74 и 81. Как было указано выше, гетерологичные и гомологичные полипептиды по настоящему изобретению без каких-либо ограничений могут быть выбраны из классов целлюлазных ферментов. В настоящем описании изобретения приведены типичные комбинации ферментов. В некоторых вариантах осуществления изобретения первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является экзоцеллобиогидролазой. В некоторых вариантах осуществления изобретения первый гетерологичный полипептид является первой экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой,гомологичный полипептид является второй экзоцеллобиогидролазой, при этом первая экзоцеллобиогидролаза и вторая экзоцеллобиогидролаза являются одинаковыми целлобиогидролазами, например первая и вторая экзоцеллобиогидролазы являются cbh1 или обе являются cbh2. Нитевидные грибы по настоящему изобретению могут быть любыми нитевидными грибами, известными специалистам в данной области. В некоторых вариантах осуществления изобретения нитевидные грибы включают, не ограничиваясь ими, следующие роды: Aspergillus, Acremonium, Aureobasidium, Beauveria, Cephalosporium,Ceriporiopsis, Chaetomium paecilomyces, Chrysosporium, Claviceps, Cochiobolus, Cryptococcus, Cyathus,Endothia, Endotia mucor, Fusarium, Gilocladium, Humicola, Magnaporthe, Myceliophthora, Myrothecium,Mucor, Neurospora, Phanerochaete, Podospora, Paecilomyces, Penicillium, Pyricularia, Rhizomucor, Rhizopus,Schizophylum, Stagonospora, Talaromyces, Trichoderma, Thermomyces, Thermoascus, Thielavia,Tolypocladium, Trichophyton и Trametes pleurotus. В некоторых вариантах осуществления изобретения нитевидные грибы включают, не ограничиваясь ими, следующие виды: A.nidulans, A.niger, A.awomari, например NRRL 3112, ATCC 22342(NRRL 3112), ATCC 44733, ATCC 14331 и штамм UVK 143f, A.oryzae, например ATCC 11490, N.crassa,Trichoderma reesei, например NRRL 15709, ATCC 13631, 56764, 56765, 56466, 56767, и Trichoderma viride,например ATCC 32098 и 32086. В некоторых вариантах осуществления изобретения нитевидный гриб по настоящему изобретению является Trichoderma. В некоторых вариантах осуществления изобретения нитевидный гриб по настоящему изобретению является Trichoderma reesei. В некоторых вариантах осуществления изобретения гетерологичные полипептиды могут быть выбраны из группы, включающей Humicola grisea, Acidothermuscellulolyticus, Thermobifida fusca или Penicillium funiculosum. В некоторых вариантах осуществления изобретения гетерологичные полипептиды выбраны из Humicola grisea, Acidothermus cellulolyticus,Thermobifida, например Thermobifida fusca, или Penicillium funiculosum, и гомологичный полипептид выбран из Trichoderma reesei. В настоящем описании изобретения приведены типичные комбинации гетерологичных и гомологичных полипептидов. В некоторых вариантах осуществления изобретения гетерологичные и гомологичные полипептиды функционально активной смеси могут быть выбраны из группы, состоящей из EGI,EGII, EGIII T.reesei (соответственно CEL7B, 5 А, 12 А), вариантов CEL12A, EGIII H.grisea, E5 и E3 T.fusca и E1 и GH74 A.cellulolyticus. В некоторых вариантах осуществления изобретения гетерологичные полипептиды функционально активной смеси могут представлять собой слитую конструкцию из экзо- и эндоцеллюлаз. В некоторых вариантах осуществления изобретения слитый белок обладает разлагающей целлюлозу активностью благодаря наличию каталитического домена, выделенного из экзоцеллобиогидролазы грибов, и каталитического домена, выделенного из эндоглюканазы. Неограничивающие примеры приведены в публикации заявки на патент США 20060057672. В некоторых вариантах осуществления изобретения гетерологичные полипептиды функционально активной смеси могут быть вариантами CBH1 H.jecorina, фермента Cel7. В некоторых вариантах осуществления изобретения целлобиогидролазы, которые включают, не ограничиваясь ими, целлобиогидролазы, описанные в публикациях заявок на патент США 20050277172 и 20050054039, могут характеризоваться улучшенной термостойкостью и реверсивностью. В некоторых вариантах осуществления изобретения гетерологичные полипептиды функционально активной смеси могут быть вариантами СВН 2 Н.jecorina, фермента Cel7. В некоторых вариантах осуществления изобретения целлобиогидролазы, которые включают, не ограничиваясь ими, целлобиогидролазы, описанные в публикации заявки на патент США 20060205042, могут характеризоваться улучшенной термостойкостью и реверсивностью. В некоторых вариантах осуществления изобретения нитевидный гриб является T.reesei, первый гетерологичный полипептид является cbh1 Humicola grisea, второй гетерологичный полипептид является эндоглюканазой 1 Acidothermus cellulolyticus и гомологичный полипептид является cbh1 Trichodermareesei. В некоторых вариантах осуществления изобретения нитевидный гриб является T.reesei, первый гетерологичный полипептид или второй гетерологичный полипептид выбирают из группы, состоящей изThermobifida, GH74-core и GH48 Acidorhermus cellulolyticus. В некоторых вариантах осуществления изобретения нитевидный гриб включает четвертый полинуклеотид, кодирующий третий гетерологичный полипептид. В данном случае первый полипептид является модифицированной cbh1 T.reesei, второй гетерологичный полипептид является модифицированнойcbh2 T.reesei, третий гетерологичный полипептид является эндоглюканазой 1 Acidothermus cellulolyticus,и гомологичный полипептид является cbh1 T.reesei. Настоящее изобретение относится также к функционально активным смесям с улучшенными свойствами и/или активностями. В некоторых вариантах осуществления изобретения первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой, и гомологичный полипептид является экзоцеллобиогидролазой. В данном случае первый гетерологичный полипептид, второй гетерологичный полипептид и гомологичный полипептид образуют смесь термостойких целлюлаз. В некоторых вариантах осуществления изобретения полинуклеотиды, кодирующие гетерологичные и гомологичные полипептиды, могут быть внехромосомными, т.е. могут находиться в векторе или плазмиде, либо полинуклеотиды могут быть встроены в хромосомы нитевидного гриба-хозяина. В некоторых вариантах осуществления изобретения нитевидный гриб-хозяин содержит по меньшей мере один полинуклеотид, кодирующий первый, второй или третий гетерологичный полипептид или гомологичный полипептид, встроенный в его геном. В некоторых вариантах осуществления изобретения нитевидный гриб-хозяин содержит по меньшей мере один полинуклеотид, кодирующий первый, второй или третий гетерологичный полипептид или гомологичный полипептид, встроенный в его геном, и по меньшей мере один полинуклеотид, кодирующий гетерологичный или гомологичный полипептид, в устойчивом векторе, трансфицированном в гриб-хозяин. В некоторых вариантах осуществления изобретения хозяином является T.reesei, содержащий по меньшей мере один полинуклеотид, кодирующий первый или второй гетерологичный полипептид или гомологичный полипептид, встроенный в его геном. В некоторых вариантах осуществления изобретения хозяином является T.reesei, содержащий два полинуклеотида, встроенных в его геном. Указанные полинуклеотиды кодируют первый, второй или, в случае его наличия, третий гетерологичный полипептид или гомологичный полипептид. В некоторых вариантах осуществления изобретения один или несколько полинуклеотидов, экспрессирующих гетерологичную или гомологичную экзоцеллобиогидролазу,встроены в геном хозяина, являющегося T.reesei. В некоторых вариантах осуществления изобретения полинуклеотид, кодирующий гетерологичную эндоглюканазу, встроен в геном хозяина, являющегосяT.reesei. В некоторых вариантах осуществления изобретения полинуклеотид, кодирующий гетерологичную эндоглюканазу, и полинуклеотид, кодирующий гетерологичную или гомологичную экзоцеллобиогидролазу, встроены в геном хозяина, являющегося T.reesei. Очевидно, что, когда только один или два из трех или четырех полинуклеотидов, кодирующих полипептиды функционально активной смеси, встроены в геном хозяина, остальные полинуклеотиды трансфицированы в хозяина и присутствуют в векторе или плазмиде. В некоторых вариантах осуществления изобретения нитевидный гриб содержит первый полинуклеотид и второй полинуклеотид, кодирующие соответственно первый гетерологичный полипептид и второй гетерологичный полипептид, и третий полинуклеотид, кодирующий гомологичный полипептид, при этом все три полинуклеотида являются внехромосомными. Настоящее изобретение относится также к культуральной среде, содержащей популяцию вышеописанных нитевидных грибов. Культуральная среда может быть плотной, полутвердой или жидкой, причем среду выбирают в зависимости от хозяина, а также от экспрессируемых полипептидов. Настоящее изобретение относится также к полипептидной смеси, включающей первый гетерологичный полипептид, второй гетерологичный полипептид и гомологичный полипептид, полученные из нитевидных грибов, рассмотренных в настоящем описании изобретения. В некоторых вариантах осуществления изобретения полипептидная смесь является смесью ферментов или их доменов. В некоторых вариантах осуществления изобретения полипептидная смесь является смесью целлюлаз, гемицеллюлаз,ксиланаз, маннаназ или их доменов. Кроме того, настоящее изобретение относится к способу получения смеси полипептидов, который включает получение полипептидной смеси из нитевидных грибов по настоящему изобретению. Полипептидная смесь содержит первый гетерологичный полипептид, второй гетерологичный полипептид и гомологичный полипептид. В некоторых вариантах осуществления изобретения смесь полипептидов содержит третий гетерологичный полипептид. Как было указано выше, смесь полипептидов является функционально активной смесью. В некоторых вариантах осуществления изобретения смесь полипептидов является смесью ферментов или их доменов. В некоторых вариантах осуществления изобретения смесь полипептидов является смесью целлюлаз, гемицеллюлаз, ксиланаз, маннаназ или их доменов. В некоторых вариантах осуществления изобретения смесь полипептидов является смесью целлюлаз, включающей первый гетерологичный полипептид, который является экзоцеллобиогидролазой, второй гетерологичный полипептид, который является эндоглюканазой, и гомологичный полипептид, который является экзоцеллобиогидролазой. В некоторых вариантах осуществления изобретения смесь цел-9 018049 люлаз содержит первый гетерологичный полипептид, который является первой экзоцеллобиогидролазой,второй гетерологичный полипептид, который является эндоглюканазой, и гомологичный полипептид,который является второй экзоцеллобиогидролазой. В данном случае первая экзоцеллобиогидролаза и вторая экзоцеллобиогидролаза являются одинаковыми целлобиогидролазами. В некоторых вариантах осуществления изобретения первая и вторая экзоцеллобиогидролазы являются cbh1. В некоторых вариантах осуществления изобретения первая и вторая экзоцеллобиогидролазы являются cbh2. Как должно быть очевидно специалисту в данной области, в нитевидных грибах по настоящему изобретению может быть экспрессировано несколько других комбинаций гетерологичных и гомологичных полипептидов. Другая типичная смесь целлюлаз включает первый гетерологичный полипептид, который является cbh1 Humicola grisea, второй гетерологичный полипептид, который является эндоглюканазой 1 Acidothermus cellulolyticus, и гомологичный полипептид, который является cbh1 Trichodermareesei. Объекты настоящего изобретения могут быть лучше поняты при ознакомлении с приведенными ниже примерами, которые не ограничивают объем настоящего изобретения. Специалистам в данной области должно быть очевидно, что в пределах объема настоящего изобретения могут быть использованы многочисленные модификации как материалов, так и способов. Примеры Пример 1. Создание трехкомпонентного штамма. Трехкомпонентный штамм состоит из следующих трех частей:(iii) гибрида экзо- и эндонуклеаз гена cbh1 T.reesei с эндоглюканазой 1 Acidothermus cellulolyticus. Создание слитого вектора СВН 1-Е 1. Слитая конструкция СВН 1-Е 1 включала промотор гена cbh1 T.reesei; последовательность гена cbh1T.reesei от инициирующего кодона до конца линкера cbh1 и 12 дополнительных оснований от 5'-конца ДНК до начала кодирующей последовательности эндоглюканазы, кодирующую последовательность эндоглюканазы, терминирующий кодон и терминатор cbh1 T.reesei. Нуклеотидная последовательность(SEQ ID NO:1) слитой конструкции гетерологичной целлюлазы состоит из 2656 оснований (см. фиг. 1) и включает сигнальную последовательность cbh1 T.reesei; каталитический домен cbh1 T.reesei; линкерную последовательность cbh1 T.reesei; сайт расщепления кексином, включающий кодоны для аминокислотSKR, и последовательность, кодирующую каталитический домен GH5A-E1 Acidothermus cellulolyticus. Прогнозируемая аминокислотная последовательность (SEQ ID NO:2) слитого белка целлюлазы, созданная на основе последовательности нуклеиновой кислоты, показанной на фиг. 1, представлена на фиг. 2. 12 дополнительных оснований ДНК, ACTAGTAAGCGG (нуклеотиды 1565-1576 SEQ ID NO:1) кодируют рестрикционную эндонуклеазу SpeI и аминокислоты Thr, Ser, Lys и Arg. Плазмида E1-pUC19, содержащая открытую рамку считывания для локуса гена E1, была использована в качестве матричной ДНК при выполнении ПЦР. (Эквивалентные плазмиды описаны в патенте США 5536655, в котором также рассмотрено клонирование гена Е 1 из актиномицета Acidothermuscellulolyticus ATCC 43068, Mohagheghi A. et al., 1986). Стандартные методы работы с плазмидной ДНК и амплификации ДНК при помощи полимеразной цепной реакции (ПЦР) описаны в публикации Sambrook,et al., 2001. Приведенные ниже две затравки были использованы для амплификации кодирующей области каталитического домена эндоглюканазы Е 1. Верхняя затравка 1=EL-316 (содержащая сайт SpeI):GCTTATACTAGTAAGCGCGCGGGCGGCGGCTATTGGCACAC (SEQ ID NO:3). Нижняя затравка 2=EL-317 (содержащая сайт AscI и комплекс терминирующего кодона и нижнего комплемента):GCTTATGGCGCGCCTTAGACAGGATCGAAAATCGACGAC (SEQ ID NO:4). Обработку производили в нижеследующих условиях реакции с использованием материалов из набора ДНК-полимераз PLATINUM Pfx (Invitrogen, Carlsbad, CA): 1 мкл основной смеси dNTP (конечная концентрация 0,2 мМ); 1 мкл затравки 1 (конечная концентрация 0,5 мкМ); 1 мкл затравки 2 (конечная концентрация 0,5 мкМ); 2 мкл матричной ДНК (конечная концентрация 50-200 нг); 1 мкл 50 мМ MgSO4(конечная концентрация 1 мМ); 5 мкл 10-кратного количества буфера для амплификации Pfx; 5 мкл 10-кратного количества раствора усилителя ПЦР; 1 мкл ДНК-полимеразы Platinum Pfx (всего 2,5 ед.); 33 мкл воды до достижения общего объема реакционной смеси, равного 50 мкл. Параметры амплификации были следующими: стадия 1: 94C в течение 2 мин (1-й цикл служит только для денатурации антителосвязанной полимеразы); стадия 2: 94C в течение 45 с; стадия 3: 60C в течение 30 с; стадия 4: 68C в течение 2 мин; стадия 5: повторное выполнение стадии 2 на протяжении 24 циклов; стадия 6: 68C в течение 4 мин. Продукт ПЦР соответствующей величины клонировали в вектор ТОРО Zero Blunt и трансфицировали в химически компетентные клетки Top10 Е.coli (Invitrogen Corp., Carlsbad, Calif.), высевали на соответствующую избирательную среду (среда LA, содержащая 50 част./млн канамицина) и выращивали в течение ночи при 37C. Из среды собирали несколько колоний и выращивали их в течение ночи при 37C в избирательной среде (среда LB, содержащая 50 част./млн канамицина) в виде 5 мл культур, из которых получали плазмидные мини-препараты. Плазмидную ДНК из нескольких клонов расщепляли рестрикционными ферментами для подтверждения правильной величины вставки. Правильность последовательности подтверждали путем секвенирования ДНК. После проверки последовательности из вектора TOPO вырезали каталитический домен Е 1, расщепляя рестрикционными ферментами SpeI и AscI. Указанный фрагмент лигировали в вектор pTrex4, который был расщеплен рестрикционными ферментами SpeI иAscI, как показано на фиг. 3. Лигированную смесь трансфицировали в компетентные клетки ММ 294 Е.coli, которые высевали на соответствующую избирательную среду (среда LA, содержащая 50 част./млн карбенициллина) и выращивали в течение ночи при 37C. Из среды собирали несколько колоний и выращивали их в течение ночи при 37C в избирательной среде (среда LB, содержащая 50 част./млн карбенициллина) в виде 5 мл культур, из которых получали плазмидные мини-препараты. Правильность лигирования векторов, содержащих слитый белок СВН 1-Е 1, подтверждали путем расщепления рестрикционными ферментами. Создание вектора, экспрессирующего cbh1 H.grisea. Конструкция, экспрессирующая cbh1 H.grisea, включала промотор cbh1 R. reesei; последовательность гена cbh1 H.grisea, терминатор cbh1 T.reesei и селектируемый маркер amdS A.nidulans. Указанные последовательности могут быть собраны рядом способов, известных специалистам в данной области,один из которых описан ниже. Геномную ДНК экстрагировали из образца мицелия Humicola grisea var. thermoidea (CBS 225.63). Геномная ДНК может быть выделена любым методом, известным в данной области. Может быть выполнена следующая процедура. Клетки выращивали при 45C в 20 мл декстрозокартофельного бульона (PDB) в течение 24 ч. Клетки разводили в отношении 1:20 в свежей среде PDB и выращивали в течение ночи. 2 мл клеток центрифугировали и клеточный дебрис промывали в 1 мл KC (60 г KCl, 2 г лимонной кислоты на 1 л, рН доводили до 6,2, добавляя 1 М раствор KOH). Клеточный дебрис ресуспендировали в 900 мкл КС. Добавляли 100 мкл (20 мг/мл) новозима, осторожно перемешивали и при 37C под микроскопом следили за образованием протопластов, пока не было образовано более 90% протопластов в течение максимум 2 ч. Клетки центрифугировали со скоростью 1500 об/мин (4600g) в течение 10 мин. Добавляли 200 мкл TES/SDS(10 мМ трис, 50 мМ EDTA, 150 мМ NaCl, 1% SDS), смешивали и инкубировали при комнатной температуре в течение 5 мин. ДНК выделяли, используя набор для выделения мини-препаратов Qiagen (Qiagen). Колонку элюировали 100 мкл воды milli-Q и собирали ДНК. Альтернативным методом является метод FastPrep, служащий для выделения геномной ДНК из вида H.grisea var thermoidea, выращиваемого на планшетах PDA при 45C. Указанная система состоит из устройства FastPrep и набора FastPrep для выделения нуклеиновой кислоты. (Систему FastPrep можно приобрести в компании Qbiogene, MP Biomedicals, United States, 29525 Fountain Pkwy., Solon, OH 44139). Затравки для амплификации гена cbh1 H.grisea методом ПЦР были созданы на основе NCBI, номер доступа D63515. Указанные затравки были предназначены для амплификации гена cbh1 H.grisea от инициирующего кодона до терминатора. Последовательность верхней затравки включала 4 нуклеотида САСС для облегчения клонирования в вектор pENTR TOPO с целью использования системы клонирования Gateway (Invitrogen). Верхняя затравка: 5' CACCATGCGTACCGCCAAGTTCGC 3' (SEQ ID NO:5). Нижняя затравка: 5' TTACAGGCACTGAGAGTACCAG 3' (SEQ ID NO:6). Условия выполнения ПЦР. Продукт ПЦР клонировали в вектор pENTR/D в соответствии с процедурой для системы Gateway компании Invitrogen. Затем вектор трансфицировали в химически компетентные клетки Top10 E.coli(Invitrogen), производя отбор клеток канамицином. Плазмидную ДНК из нескольких клонов расщепляли рестрикционными ферментами для подтверждения правильной величины вставки и затем секвенировали для подтверждения правильности последовательности. Плазмидную ДНК из одного клона добавляли к реакционную среду LR, содержащую клоназу (система Gateway компании Invitrogen) с ДНК целенаправленного вектора pTrex3g/amdS. Создание вектора pTrex3g. В данном разделе описано создание основного вектора, используемого для экспрессии представляющих интерес генов. Вектор pTrex3g был описан ранее; см., например, публикацию заявки на патент США 20070015266. Указанный вектор создан на основе вектора pSL1180 E.coli (Pharmacia Inc.,Piscataway, NJ, USA), который является вектором на основе фагомида pUC118 (Brosius, J. (1989), DNA 8:759) с удлиненным сайтом множественного клонирования, содержащим 64 шестичленные последовательности, узнаваемые рестрикционными ферментами. Созданный вектор является целенаправленным вектором системы Gateway (Hartley, J.L. et al. (2000) , Genome Research. 10: 1788-1795), который при помощи метода Gateway (Invitrogen) позволяет вставлять любую требуемую открытую рамку считывания между промоторной и терминирующей областями гена cbh1 R.reesei. Ген amdS Aspergillus nidulans был вставлен для использования в качестве селектируемого маркера в процессе трансформации. Промотор и терминатор были расположены с возможностью экспрессии представляющего интерес гена. Подробное описание вектора pTrex3g. Указанный вектор имеет длину, равную 10,3 т.п.о. В полилинкерную область вектора pSL1180 вставлены следующие сегменты ДНК:(i) сегмент ДНК длиной 2,2 п.о. из промоторной области гена cbh1 T.reesei;(ii) кластер рамки считывания А Gateway длиной 1,7 т.п.о. компании Invitrogen, который включает сайты рекомбинации attR1 и attR2 у конца, фланкирующего ген устойчивости к хлорамфениколу (CmR) и ген ccdB;(iii) сегмент ДНК длиной 336 п.о. из терминирующей области гена cbh1 T.reesei;(iv) фрагмент ДНК длиной 2,7 т.п.о., содержащий ген amdS Aspergillus nidulans с нативными промоторной и терминирующей областями. На фиг. 4 показана плазмидная карта экспрессирующего вектора pTrex3g T.reesei. Клон гена cbh1 H.grisea в вышеописанном векторе pENTR использовали для рекомбинации целенаправленного вектора pTrex3g выполняемой в реакционной среде LR, содержащей клоназу, в соответствии с инструкциями изготовителя (Invitrogen). Гены CmR и ccdB целенаправленного вектора pTrex3g были заменены геном cbh1 H.grisea из вектора pENTR/D. В результате рекомбинации ген cbh1 H.grisea был вставлен непосредственно между промотором cbh1 T.reesei и терминатором cbh1 T.reesei целенаправленного вектора. В результате рекомбинации были получены последовательности AttB длиной 25 п.о., фланкирующие ген cbh1 H.grisea вверху и внизу. Аликвоту реакционной среды LR, содержащей клоназу, трансфицировали в химически компетентные клетки Top10 E.coli (Invitrogen), которые выращивали в течение ночи, производя отбор карбенициллином. Плазмидную ДНК из нескольких клонов расщепляли соответствующими рестрикционными ферментами для подтверждения правильной величины вставки и затем секвенировали для подтверждения правильности последовательности. Чтобы получить ДНК для трансформации, плазмидную ДНК из правильного клона расщепляли эндонуклеазой XbaI для высвобождения экспрессирующего фрагмента, включающего промотор cbh1 T.reesei:ген cbh1H.grisea:терминатор cbh1 T.reesei:ген amdS A.nidulans. Указанный фрагмент длиной 6,2 т.п.о. выделяли из ДНК Е.coli путем экстракции в агарозном геле при помощи стандартных методов и трансфицировали в штамм T.reesei, полученный из общедоступного штамма QM6a в соответствии с приведенным ниже описанием. Экспрессирующий вектор, включающий два сайта XbaI, схематически изображен на фиг. 5 А,и нуклеотидная последовательность (SEQ ID NO:7) экспрессирующего вектора показана на фиг. 5 В. Котрансформация и ферментация Trichoderma reesei. В качестве штамма-хозяина для трансформации конструкциями по настоящему изобретению использовали производный штамм-хозяин RL-P37 T.reesei (Sheir-Neiss, et al., 1984), который был подвергнут целому ряду стадий мутагенеза для увеличения продуцирования целлюлазы, включая делецию нативного гена cbh1 (Suominen, P.L. et al., 1993, Mol. Gen. Genet. 241:523-30). Биолитическую трансформацию T.reesei при помощи конструкции, экспрессирующей cbh1 H.grisea,и слитой конструкции cbh1 T.reesei и E1 A.cellulolyticus выполняли нижеописанным способом. Получали взвесь спор (примерно 3,5108 спор/мл) из штамма T.reesei, являющегося производным Р-37. Примерно 100-200 мкл указанной взвеси пор распределяли в центре планшетов с ацетамидной средой ММ. Ацетамидная среда ММ имеет следующий состав: 0,6 г/л ацетамида; 1,68 г/л CsCl; 20 г/л глюкозы; 20 г/л KH2PO4; 0,6 г/л CaCl22H2O; 1 мл/л 1000-кратного раствора следовых элементов; 20 г/л нобль-агара; pH 5,5. 1000-кратный раствор следовых элементов содержал 5,0 г/л FeSO47H2O, 1,6 г/лMnSO4H2O, 1,4 г/л ZnSO47H2O и 1,0 г/л CoCl26H2O. Взвесь пор оставляли сохнуть на поверхности ацетамидной среды ММ в стерильном вытяжном шкафу.T.reesei трансформировали при помощи системы доставки частиц Biolistic PDS-1000/He компанииBio-Rad (Hercules, CA) в соответствии с инструкциями изготовителя (Lorito, M. et al., 1993, Curr. Genet. 24:349-56). В микроцентрифужную пробирку вводили 60 мг частиц вольфрама М 10. Добавляли 1 мл этанола, смесь интенсивно перемешивали в течение короткого периода времени и оставляли выстаиваться в течение 15 мин. Частицы центрифугировали со скоростью 15000 об/мин в течение 15 мин. Этанол удаляли и частицы трижды промывали стерильной деионизированной Н 2 О, после чего добавляли 1 мл 50%(об./об.) стерильного глицерина. Смесь интенсивно перемешивали в течение 10 с для суспендирования вольфрама, удаляли 25 мкл суспензии частиц вольфрама в глицерине и вводили в микроцентрифужную пробирку. При непрерывном интенсивном перемешивании 25 мкл суспензии частиц вольфрама в глицерине добавляли нижеследующие вещества в указанном порядке и инкубировали смесь между добавлениями в течение 5 мин: 2 мкл (100-300 нг/мкл) вектора, экспрессирующего cbh1 H.grisea (фрагмент, вырезанныйXbaI), 2 мкл (100-300 нг/мкл) экспрессирующего вектора cbh1-E1 (фрагмент, вырезанный XbaI), 25 мкл 2,5 М раствора CaCl2 и 10 мкл 0,1 М раствора спермидина. После добавления спермидина частицы инкубировали в течение 5 мин и центрифугировали в течение 3 с. Супернатант удаляли, частицы промывали 200 мкл 70% (об./об.) этанола и центрифугировали в течение 3 с. Супернатант удаляли, частицы промывали 200 мкл 100% этанола и центрифугировали в течение 3 с. Супернатант удаляли, добавляли 24 мкл 100% этанола и смешивали пипетированием. Пробирку помещали в ванну для ультразвуковой очистки примерно на 15 с для ресуспендирования частиц в этаноле. Во время нахождения пробирки в ванне для ультразвуковой очистки удаляли 8 мкл аликвоты суспендированных частиц и помещали в центр дисков макроносителя, которые устанавливали в сушильный шкаф. Раствор вольфрама/ДНК после высушивания на макроносителе (примерно 15 мин) помещали в бомбардировочную камеру. Рядом помещали планшет с ацетамидной средой ММ со спорами, и производили бомбардировку, используя разрывные мембраны, находящиеся под давлением 77 атм(1100 фунт/кв.дюйм), в соответствии с инструкциями изготовителя. После бомбардировки культивируемых спор частицами вольфрама/ДНК планшеты инкубировали при 28C. Большие трансформированные колонии через 5 дней переносили на свежие вторичные планшеты с ацетамидной средой MM (Penttila etal. (1987), Gene 61:155-164) и инкубировали еще 3 дня при 28C. Колонии, которые характеризовались плотным, непрозрачным ростом на вторичных планшетах, переносили на отдельные планшеты с ацетамидной средой ММ. Указанные колонии выращивали еще три дня, переносили на планшеты с декстрозокартофельным агаром (PDA) и инкубировали в течение 7-10 дней при 28C для споруляции. Экспрессию ферментов трансформантами оценивали в двухкамерных встряхиваемых колбах. Трансформанты сначала выращивали во встряхиваемой колбе для инокулята, содержащей следующую среду: 22,5 г/л Proflo, 30 г/л а-лактозыН 2 О, 6,5 г/л (NH4)2SO4, 2 г/л KH2PO4, 0,3 г/л MgSO47H2O, 0,26 г/лCaCl22 Н 2 О, 0,72 г/л CaCO3, 2 мл 10% твина 80, 1 мл 1000-кратного количества следовых солей TRI(1000-кратное количество следовых солей TRI состоит из 5 г/л FeSO47H2O, 1,6 г/л MnSO4H2O, 1,4 г/лZnSO47H2O). Условия выращивания были следующими: 50 мл среды в 250-мл встряхиваемой колбе с 4 перегородками (Bellco Biotechnology, 340 Edrudo Road, Vineland, NJ 08360, USA), инкубация при 28C,скорость встряхивания 225 об/мин с диаметром вращения 2,5 см. Трансформанты инокулировали во встряхиваемых колбах для инокулята, перенося кусочки PDA размером 4 см 2, содержащие мицелий и споры трансформанта. После выращивания в колбе для инокулята в течение 2 дней 5 мл переносили во встряхиваемую колбу для экспрессии, содержащую 50 мл следующей среды: 5 г/л (NH4)2SO4, 33 г/л буфера PIPPS, 9 г/л кислот Bacto Casamino, 4,5 г/л KH2PO4, 1,32 г/л CaCl22 Н 2 О, 1 г/л MgSO47H2O, 5 мл антивспенивателяMazu DF204, 2,5 мл 400-кратного количества следовых солей T.reesei (400-кратное количество следовых солей T.reesei состоит из 175 г/л лимонной кислоты (безводной), 200 г/л FeSO47H2O, 16 г/л ZnSO47H2O,3,2 г/л CuSO45H2O, 1,4 г/л MnSO4H2O, 0,8 г/л Н 3 ВО 3, добавляемых в указанном порядке), pH доводили до 5,5, среду стерилизовали, производили постстерилизацию и добавляли 40 мл 40% лактозы. Культуру выращивали во встряхиваемой колбе для экспрессии в следующих условиях: 250-мл встряхиваемая колба с 4 перегородками, инкубация при 28C, скорость встряхивания 225 об/мин. Образец удаляли через 5 дней, супернатант анализировали на белковых гелях для SDS-PAGE и окрашивали кумасси. Пример 2. Создание четырехкомпонентного штамма. Был создан штамм, включающий четыре части:(i) штамм-хозяин, состоящий из продуцирующего штамма с делецией гена cbh1;(ii) последовательность нуклеиновой кислоты для экспрессии слитого гена cbh1-E1;(iii) последовательность нуклеиновой кислоты для экспрессии термостойкого гена cbh1 T.reesei генетически созданного белка;(iv) последовательность нуклеиновой кислоты для экспрессии термостойкого гена cbh2 T.reesei генетически созданного белка. ДНК всех трех экспрессирующих фрагментов котрансфицировали в продуцирующий штамм с делецией гена cbh1, как показано на фиг. 6. Трансформанты T.reesei исследовали в присутствии всех трех экспрессирующих фрагментов,встроенных в геном. Были созданы пары затравок для ПЦР, предназначенные для амплификации каждого из трех экспрессирующих фрагментов. Для ферментации во встряхиваемых колбах были выбраны 32 трансформанта, которые по результатам ПЦР характеризовались наличием всех трех экспрессирующих фрагментов. Культуры во встряхиваемых колбах выращивали в течение трех дней, брали образцы супернатанта и исследовали в 8% трис-глициновых гелях NuPAGE (Invitrogen) (1 мм) в разделяющем буфере для трис-глицинового геля с додецилсульфатом натрия (SDS). Образцы инкубировали при 100C в течение 7 мин, затем на льду в течение 5 мин и загружали в количестве 20 мкл/полосу за исключением особо оговоренных случаев (8 мкл супернатанта + 2 мкл восстановителя + 10 мкл 2-кратного количества буфера для трис-глицинового геля с SDS). Некоторые из 32 образцов характеризовались высоким уровнем экспрессированных генов, о чем свидетельствуют полосы белка. ДНК, кодирующую вариант аминокислотной последовательности генов cbh1 и cbh2 T.reesei, можно получить разными методами, известными в данной области. Такие методы включают, не ограничиваясь ими, синтез генов, сайт-направленный мутагенез (или сайт-направленный мутагенез с использованием олигонуклеотидов), мутагенез методом ПЦР и кластерный мутагенез ранее полученной ДНК, кодирующей последовательность кДНК T.reesei. Вектор был создан на основе вектора pTrex3g, экспрессирующего ген cbh1 T.reesei генетически созданного фермента, кодирующий генетически созданный белок со следующими мутациями в зрелой аминокислотной последовательности:T322Y+V403D+S411F. Последовательность ДНК от инициирующего кодона до терминирующего кодона имела 1545 оснований (SEQ ID NO:8), как показано на фиг. 7 А. Последовательность генетически созданного белка cbh1(SEQ ID NO:9) показана на фиг. 7 В (сигнальная последовательность cbh1 подчеркнута). cbh1 Экспрессирующий вектор pTrex3g-cbh1 схематически изображен на фиг. 8 А. Последовательность ДНК экспрессирующего вектора pTrex3g-cbh1 имела 10145 оснований (SEQ ID NO:10), как показано на фиг. 8 В. Был создан вектор для экспрессии белка cbh2 генетически созданного фермента. Указанный вектор включал промотор cbh2, генетически созданный ген cbh2, терминатор cbh2, ацетамидазу A.nidulans(amdS) в качестве селектируемого маркера и дополнительную 3'-концевую фланкирующую последовательность терминатора cbh2. Данный вектор был создан с использованием шаттл-вектора pCR-XL-TOPO(Invitrogen). Экспрессирующая часть вектора была вырезана из шаттл-вектора путем расщепления плазмиды специальными рестрикционными эндонуклеазами NotI и SrfI, образующими фрагмент длиной примерно 10,68 т.п.о., который был использован для трансформации T.reesei. Указанный вектор экспрессировал ген cbh2 T.reesei, кодирующий генетически созданный белок со следующими мутациями в аминокислотной последовательности: P98L, M134V, Т 154 А, I212V, S316P иS413Y. Последовательность ДНК от инициирующего кодона до терминирующего кодона имела 1416 оснований (SEQ ID NO:11), как показано на фиг. 9 А. Аминокислотная последовательность(SEQ ID NO:12) показана на фиг. 9 В (сигнальная последовательность подчеркнута). Вектор, экспрессирующий cbh2, схематически изображен на фиг. 10 А. Последовательность ДНК всего cbh2 экспрессирующего вектора pExp-cbh2 имела 14158 оснований (SEQ ID NO:11), как показано на фиг. 10 В. Котрансформацию штамма T.reesei с делецией cbh1 выполняли, используя три фрагмента ДНК. Генетически созданный cbh2-экспрессирующий фрагмент был вырезан из плазмиды pExp-cbh2 ферментами NotI и SrfI. Генетически созданный ген cbh1 в экспрессирующем векторе pTrex3g использовали в качестве матрицы для ПЦР с целью создания линейного фрагмента только промотора cbh1, генетически созданного гена cbh1 и терминатора cbh1 (без маркера amdS). Слитый фрагмент cbh1-E1, описанный в предыдущем примере, был использован в качестве матрицы для ПЦР с целью создания линейного фрагмента, состоящего из промотора cbh1, слитого гена cbh1-E1 и терминатора cbh1 (без маркера amdS). Три указанных фрагмента были использованы для покрытия частиц вольфрама в процессе биолитической котрансформации. Указанную процедуру выполняли в соответствии с описанием, приведенным в предыдущем примере. В процессе котрансформации каждый из трех фрагментов 1, 2 и 3 добавляли к частицам вольфрама в объеме 1,5 мкл (концентрация ДНК 100-300 нг/мкл). Отбор трансформантов производили в ацетамидной среде ММ в соответствии с приведенным описанием. Пример 3. Анализ разлагающей целлюлозу активности трансформированных клонов Trichodermareesei. Разлагающую целлюлозу активность слитого белка cbh1-EI определяли при помощи нижеследующих анализов с использованием указанных субстратов. Штаммы Tr-А и Tr-D Trichoderma reesei были получены из RL-P37 путем мутагенеза. Предварительная обработка кукурузной соломы (PCS): кукурузную солому предварительно обрабатывали 2% мас./мас. H2SO4 в соответствии с описанием, приведенным в публикации Schell, D. et al., J.Appl. Biochem. Biotechnol. 105:69-86 (2003), и затем несколько раз промывали деионизированной водой до достижения pH, равного 4,5. Добавляли ацетат натрия до конечной концентрации, равной 50 мМ, и титровали до pH 5,0. Измерение общего белка: концентрации белка измеряли методом на основе бицинхониновой кислоты, используя бычий сывороточный альбумин в качестве эталона (Smith, P.K., et al. (1985). Anal.Biochem. 150:76-85). Конверсию целлюлозы (определение растворимого сахара) оценивали при помощи ВЭЖХ методами, описанными в публикации Baker et al., Appl. Biochem. Biotechnol. 70-72:395-403 (1998). При выполнении экспериментов использовали стандартный анализ конверсии целлюлозы. В данном анализе фермент и забуференный субстрат помещали в контейнеры и инкубировали при определен- 14018049 ной температуре в течение определенного периода времени. Реакцию гасили 100 мМ глицина, pH 11,0, с целью доведения значения pH реакционной смеси по меньшей мере до pH 10. После того как реакция была погашена, аликвоту реакционной смеси фильтровали через 0,2-микронную фильтрующую мембрану для удаления твердых веществ. Фильтрованный раствор анализировали в отношении растворимых сахаров вышеописанным методом ВЭЖХ. Концентрация целлюлозы в реакционной смеси была равна примерно 7%. Фермент или смеси ферментов вводили в количестве 1-60 мг общего белка на грамм целлюлозы. В табл. 1 суммированы данные, свидетельствующие о более высокой удельной производительности четырехкомпонентного штамма по сравнению с модифицированным штаммом Tr-D. Таблица 1 В табл. 2 суммированы данные, свидетельствующие о более высокой удельной производительности трехкомпонентного штамма по сравнению со штаммом Tr-A. Таблица 2 Все ссылки и публикации, приведенные в настоящем описании изобретения, полностью включены в описание изобретения в качестве ссылки. Следует отметить, что существуют альтернативные способы осуществления настоящего изобретения. Таким образом, приведенные варианты осуществления изобретения следует рассматривать как иллюстративные и не ограничивающие объем изобретения, поэтому настоящее изобретение не ограничивается конкретными вариантами и может быть модифицировано в пределах объема и эквивалентов прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Нитевидный гриб, содержащий первый полинуклеотид, кодирующий первый гетерологичный полипептид, который представляет собой экзоцеллобиогидролазу, эндоглюканазу, бета-глюкозидазу или их домен; второй полинуклеотид, кодирующий второй гетерологичный полипептид, который представляет собой экзоцеллобиогидролазу, эндоглюканазу, бета-глюкозидазу или их домен, который отличается своей ферментной активностью от указанного выше первого гетерологичного полипептида; и третий полинуклеотид, кодирующий гомологичный полипептид, который представляет собой целлобиогидролазу, эндоглюканазу, бета-глюкозидазу или их домен, который отличается своей ферментной активностью от указанного выше первого и второго гетерологичного полипептида,при этом указанный нитевидный гриб может экспрессировать первый и второй гетерологичные полипептиды и гомологичный полипептид; первый и второй гетерологичные полипептиды и гомологичный полипептид образуют функционально активную смесь, где указанный нитевидный гриб является членом подотдела Eumycotina. 2. Нитевидный гриб по п.1, в котором первый полинуклеотид функционально связан с первым промотором. 3. Нитевидный гриб по п.1, в котором второй полинуклеотид слит с третьим полинуклеотидом, при этом второй и третий полинуклеотиды функционально связаны со вторым промотором. 4. Нитевидный гриб по п.1, в котором первый полинуклеотид функционально связан с промотором,нативным для гена, кодирующего гомологичный полипептид. 5. Нитевидный гриб по п.1, в котором второй полинуклеотид слит с третьим полинуклеотидом, при этом третий полинуклеотид функционально связан с промотором гена, кодирующего гомологичный полипептид. 6. Нитевидный гриб по п.1, в котором второй полинуклеотид слит с третьим полинуклеотидом с образованием полинуклеотида, кодирующего слитый белок, при этом слитый белок содержит второй гетерологичный полипептид и гомологичный полипептид, разделенные линкером. 7. Нитевидный гриб по п.6, в котором слитый белок далее включает сайт расщепления. 8. Нитевидный гриб по п.1, который далее включает четвертый полинуклеотид, кодирующий селектируемый маркер. 9. Нитевидный гриб по п.1, который далее включает четвертый полинуклеотид, кодирующий третий гетерологичный полипептид, при этом указанный нитевидный гриб может экспрессировать третий гетерологичный полипептид. 10. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является модифицированным гомологичным полипептидом. 11. Нитевидный гриб по п.1, который далее содержит четвертый полинуклеотид, кодирующий третий гетерологичный полипептид, при этом первый и второй гетерологичные полипептиды являются модифицированными гомологичными полипептидами. 12. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид, второй гетерологичный полипептид или гомологичный полипептид являются ферментом. 13. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид, второй гетерологичный полипептид или гомологичный полипептид являются целлюлазой. 14. Нитевидный гриб по п.1, в котором функционально активная смесь является смесью целлюлаз. 15. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид, второй гетерологичный полипептид или гомологичный полипептид являются целлюлазой, выбираемой из группы, состоящей из экзоцеллобиогидролаз, эндоглюканаз и бета-глюкозидаз. 16. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой и второй гетерологичный полипептид является эндоглюканазой. 17. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой, выбираемой из группы, состоящей из семейства GH 5, 6, 7, 9 и 48, и второй гетерологичный полипептид является эндоглюканазой, выбираемой из группы, состоящей из семейства GH 5, 6, 7, 8, 9,12, 17, 31, 44, 45, 48, 51, 61, 64, 74 и 81. 18. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является экзоцеллобиогидролазой. 19. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является первой экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является второй экзоцеллобиогидролазой, при этом первая и вторая экзоцеллобиогидролазы являются одинаковыми целлобиогидролазами. 20. Нитевидный гриб по п.1, который выбран из группы, состоящей из Aspergillus, Acremonium,Aureobasidium, Beauveria, Cephalosporium, Ceriporiopsis, Chaetomium paecilomyces, Chrysosporium,Claviceps, Cochiobolus, Cryptococcus, Cyathus, Endothia, Fusarium, Gilocladium, Humicola, Magnaporthe,Myceliophthora, Myrothecium, Mucor, Neurospora, Phanerochaete, Podospora, Paecilomyces, Penicillium,Pyricularia, Rhizomucor, Rhizopus, Schizophylum, Stagonospora, Talaromyces, Trichoderma, Thermomyces,Thermoascus, Thielavia, Tolypocladium, Trichophyton и Trametes pleurotus. 21. Нитевидный гриб по п.1, который является T.reesei и в котором первый гетерологичный полипептид является cbh1 Humicola grisea, второй гетерологичный полипептид является эндоглюканазой 1Acidothermus cellulolyticus и гомологичный полипептид является cbh1 Trichoderma reesei. 22. Нитевидный гриб по п.1, который является T.reesei и в котором первый гетерологичный полипептид или второй гетерологичный полипептид выбран из группы, состоящей из целлобиогидролазыGH48 Acidothermus cellulolyticus. 23. Нитевидный гриб по п.1, который далее включает четвертый полинуклеотид, кодирующий третий гетерологичный полипептид, при этом первый полипептид является модифицированной cbh1Trichoderma reesei, второй гетерологичный полипептид является модифицированной cbh2 Trichodermareesei, третий гетерологичный полипептид является эндоглюканазой 1 Acidothermus cellulolyticus и гомологичный полипептид является cbh1 Trichoderma reesei. 24. Нитевидный гриб по п.1, в котором первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является экзоцеллобиогидролазой, при этом экспрессия первого гетерологичного полипептида, второго гетерологичного полипептида и гомологичного полипептида образует смесь термостойких целлюлаз. 25. Нитевидный гриб по п.1, в котором третий полинуклеотид является внехромосомным полинуклеотидом. 26. Нитевидный гриб по п.1, в котором первый, второй и третий полинуклеотиды являются внехромосомными полинуклеотидами. 27. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид,второй гетерологичный полипептид и гомологичный полипептид. 28. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид,второй гетерологичный полипептид и гомологичный полипептид, из которых первый гетерологичный полипептид является экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является экзоцеллобиогидролазой. 29. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид,- 16018049 второй гетерологичный полипептид и гомологичный полипептид, из которых первый гетерологичный полипептид является первой экзоцеллобиогидролазой, второй гетерологичный полипептид является эндоглюканазой и гомологичный полипептид является второй экзоцеллобиогидролазой, где первая и вторая экзоцеллобиогидролазы являются одинаковыми целлобиогидролазами. 30. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.1, при этом полипептидная смесь включает первый гетерологичный полипептид,второй гетерологичный полипептид и гомологичный полипептид, где нитевидный гриб является T.reesei,первый гетерологичный полипептид является cbh1 Humicola grisea, второй гетерологичный полипептид является эндоглюканазой 1 Acidothermus cellulolyticus и гомологичный полипептид является cbh1Trichoderma reesei. 31. Способ получения смеси целлюлаз, который включает получение полипептидной смеси из нитевидного гриба по п.23, при этом полипептидная смесь включает первый гетерологичный полипептид,второй гетерологичный полипептид, третий гетерологичный полипептид и гомологичный полипептид.
МПК / Метки
МПК: C12P 21/02, C12N 15/80, C12N 1/15
Метки: целлюлаз, экспрессии, гомологичных, гетерологичных, система
Код ссылки
<a href="https://eas.patents.su/30-18049-sistema-ekspressii-geterologichnyh-i-gomologichnyh-cellyulaz.html" rel="bookmark" title="База патентов Евразийского Союза">Система экспрессии гетерологичных и гомологичных целлюлаз</a>












