Синтез бисиндолилмалеимидов
Формула / Реферат
1. Способ получения соединения формулы
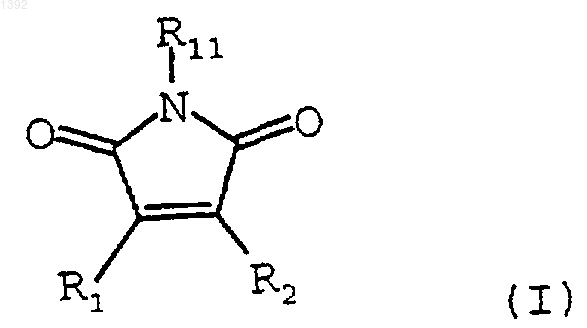
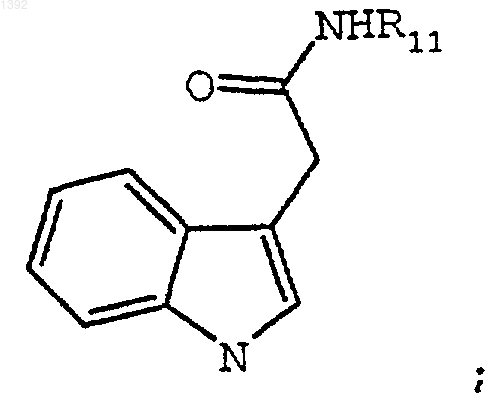
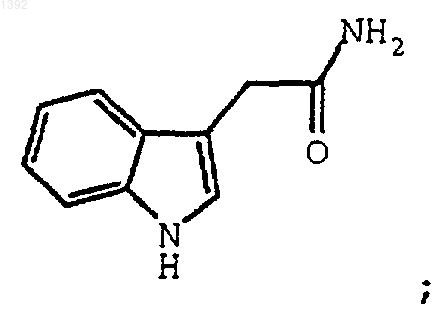
где: R1 и R2 независимо являются необязательно замещенным 3-индолилом, включающий взаимодействие необязательно замещенного индол-3-ацетамида формулы
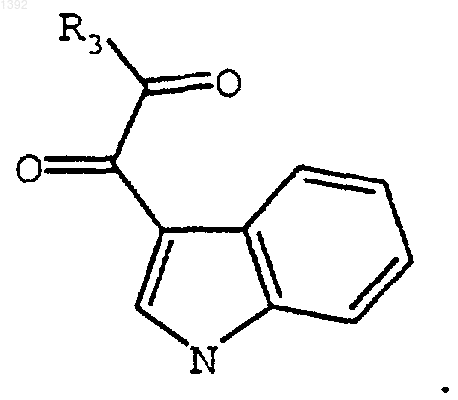
с необязательно замещенным индолил-3-глиоксильным реагентом формулы
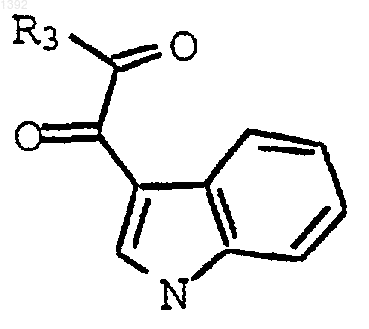
где
R3 является I, Сl, или Вr, или OR4;
R4 является С1-С4-алкилом; и
R11 является СН3 или Н;
в присутствии основания, достаточно сильного для депротонирования амида и метилена в положении С-3 индолил-3-ацетамида.
2. Способ получения соединения формулы Iа
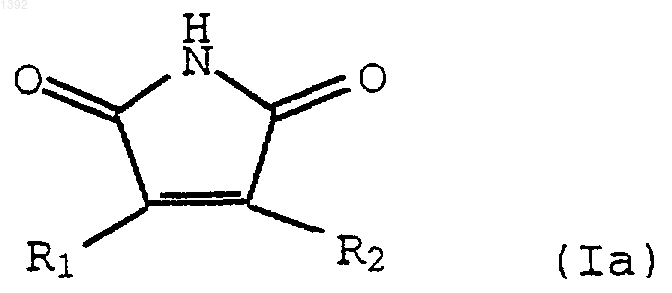
где R1 и R2 независимо являются замещенным 3-индолилом, включающий взаимодействие необязательно замещенного индол-3-ацетамида формулы
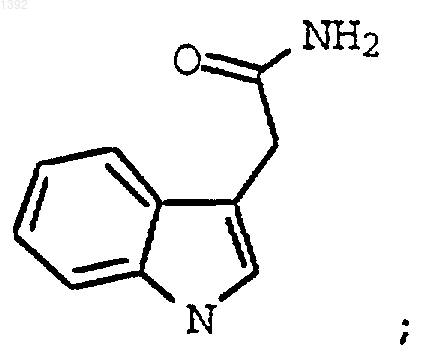
с необязательно замещенным индолил-3-глиоксильным реагентом формулы
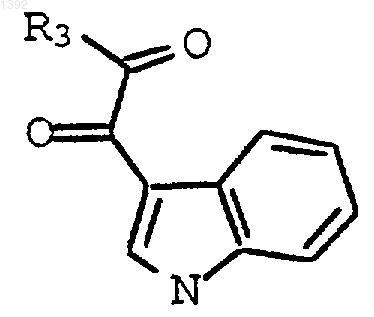
где
R3 является I, Cl, Вr или OR4; и
R4 является C1-C4 алкилом
в присутствии основания, достаточно сильного для депротонирования амида и метилена в положении С-3 индолил-3-ацетамида.
3. Способ по п.2, где необязательно замещенным индолил-3-ацетамидом является соединение формулы II
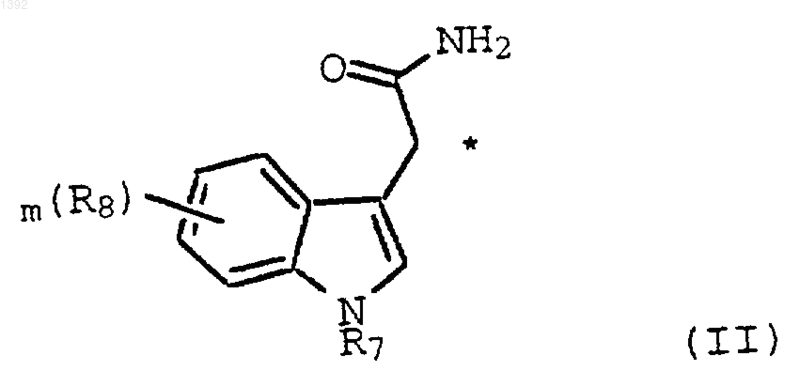
где
R7 является водородом, алкилом, галогеналкилом, арилалкилм, С1-С4-алкоксиалкилом, необязательно защищенным гидроксиалкилом, необязательно защищенным аминоалкилом, моноалкиламиноалкилом, диалкиламиноалкилом, триалкиламиноалкилом или СОО(С1-С4-алкилом);
R8 является водородом, С1-С4-алкилом, С1-С4-алкокси, (СН2)m-гидрокси, ацетилом, карбокси, галогеном, галогеналкилом, нитро и (CH2)mNR5R6; где m равно 0, 1, 2 или 3; и R5 и R6 независимо являются водородом, С1-С4-алкилом, фенилом, бензилом, или соединяясь с азотом, с которым они связаны, образуют насыщенное или ненасыщенное 5- или 6-членное кольцо.
4. Способ по п.2, где необязательно замещенным индолил-3-ацетамидом является соединение формулы (IIа)
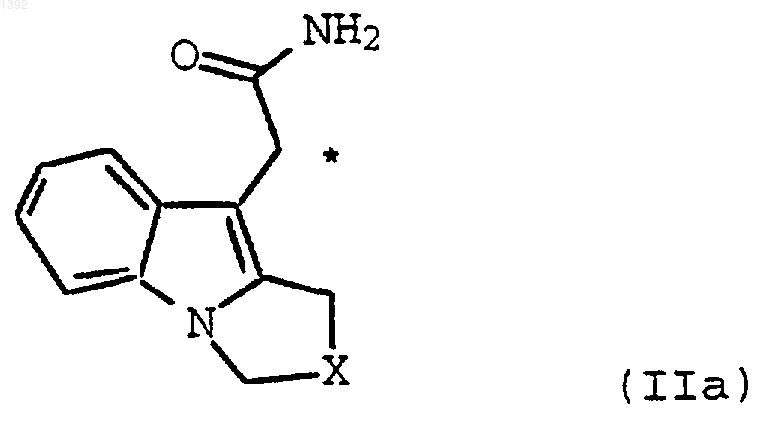
где Х является необязательно замещенным С1-С4-алкиленом.
5. Способ по п.3, где необязательно замещенным индолилглиоксильным реагентом является соединение формулы (III)
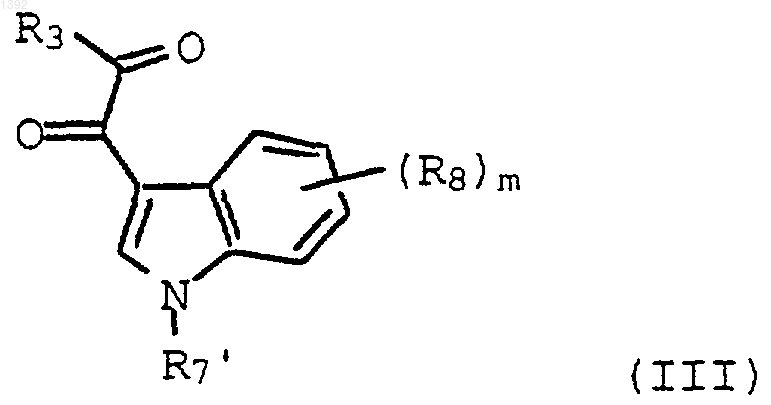
где
R3 является I, Cl, Вr или OR4;
R4 является С1-С4-алкилом;
R7¢ является водородом, алкилом, галогеналкилом, арилалкилом, алкоксиалкилом, необязательно защищенным гидроксиалкилом, необязательно защищенным аминоалкилом, моноалкиламиноалкилом, диалкиламиноалкилом или трилкиламиноалкилом или СОО(С1-С4-алкилом),
R8 является водородом, С1-С4-алкилом, С1-С4-алкокси, (CH2)m-гидрокси, ацетилом, карбокси, галогеном, галогеналкилом, нитро и (CH2)mNR5R6; и m равно 0, 1, 2 или 3.
6. Способ по п.2, где необязательно замещенный индолил-3-ацетамид и необязательно замещенный глиоксильный реагент вместе образуют соединение формулы (IV):
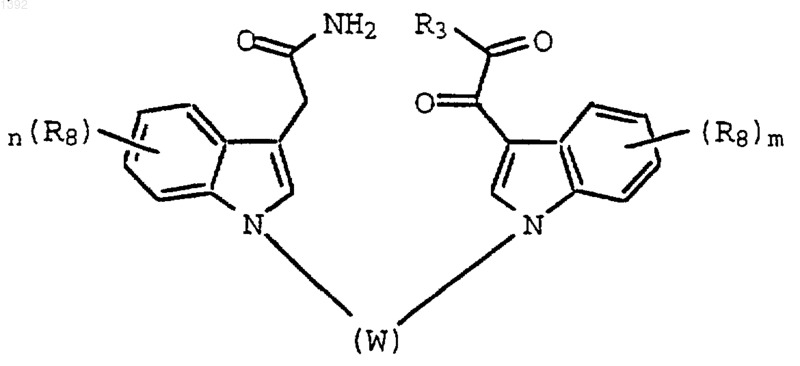
где W представляет собой необязательно замещенную С4-С8-алкиленовую группу, необязательно имеющую внутреннюю эфирную (-O-), амино- (-NH-) или амидную (-СОNН-)связь.
7. Способ по п.6, где указанное соединение имеет формулу
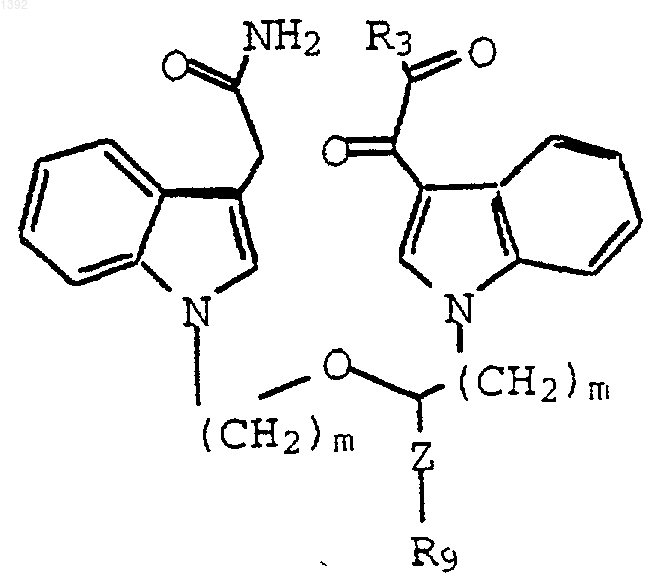
где Z является -(СН2)p-; R9 является галогеном, защищенной гидрокси, защищенной амино, NR5R6, NН(СF3) или N(СН3)(СF3);
R5 и R6 независимо являются Н или С1-С4-алкилом, где р равно 0, 1 или 2; и m независимо является 2 или 3.
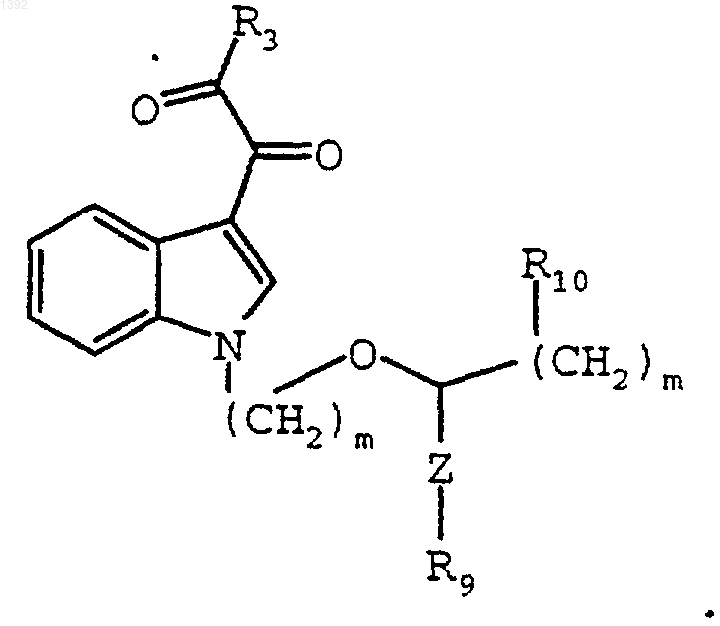
8. Способ по п.2, где индолил-3-ацетамид является соединением формулы
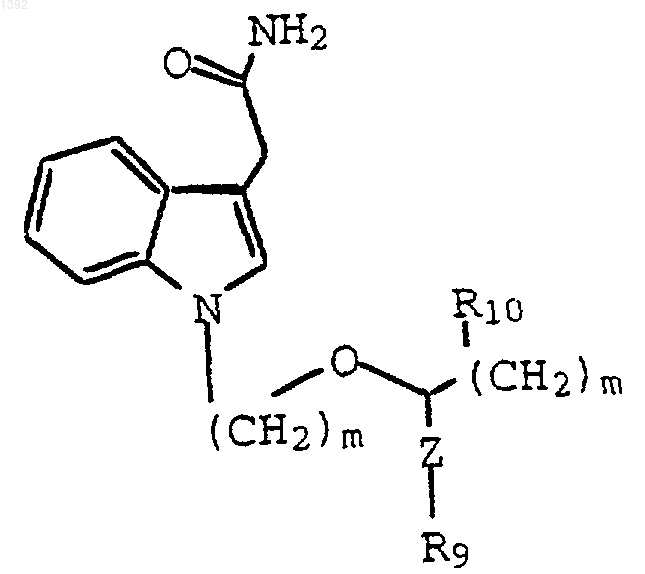
где: Z является -(СН2)p-; R9 является галогеном, защищенной гидрокси защищенной аминогруппой. NR5R6, NH(CF3) или N(СН3)(СF3); R5 и R6 независимо являются Н или С1-С4-алкилом; р равно 0, 1 или 2; и m независимо является 2 или 3; R10 является отщепляемой группой, гидрокси или защищенной гидроксигруппой; и индолил-3-гликоксильным реагентом является соединение формулы:
9. Способ по п.2, где индолил-3-ацетамидом является соединение формулы
и индолил-3-гликоксильным реагентом является соединение формулы
10. Способ по любому из пп.1-9, где основание выбирают из группы, состоящей из алкоксидов щелочного металла, гидрида натрия, диизопропиламида лития или н-бутиллития.
11. Способ по п.10, где R3 является OR4.
12. Способ по п.11, где основанием является гидрид натрия.
Текст
Настоящее изобретение относится к бисиндолилмалеимидам, которые полезны в качестве ингибиторов протеинкиназы С. Более конкретно, изобретение предлагает интенсивный и эффективный способ получения бисиндолилмалеимидов. Соединения, полученные этим способом, полезны при расстройствах, связанных с аномальными уровнями протеинкиназы С,включая сердечно-сосудистые заболевания, сахарный диабет и их осложнения, а также рак. Бисиндолилмалеимидная субъединица присутствует в ряде биологически активных метаболитов, выделенных из Streptomycetes,включая Стауроспорин (Tamaoki et al., Biochem.Chem. Int. Ed. Engl. 19: 459 (1980. Простейшими членами этого класса соединений являются арсириарубины - семейство пигментов, продуцируемых слизистыми грибами (Myxomycetes).Id. Бисиндолилмалеимиды являются селективными ингибиторами РКС и представляют собой многообещающее новое потенциальное лекарственное средство для аутоиммунных заболеваний (Bit, R. А. et al., J. Med. Chem. 361: 21(1993. В качестве селективного средства в отношении протеинкиназы С были признаны бисиндолилмалеимид CF 109303X (Bit, R, A. et al.,Tetrahedron Letters 34: 5623 (1993, который имеет соответствующий конформационно ограниченный аналог Ro 32-0432 (Wilkinson, S.E., J.Med. Chem. 36: 21 (1993, а также N,N'мостиковые бисиндолилмалеимидные макроциклы (Jirousek et al., J. Med. Chem. 39 (14): 2664-2671 (1996. Для получения бисиндолилмалеимидной основы из литературы известны несколько способов, включающих реакцию дигалогенмалеимидов с индольными реакциями Гриньяра (Faul et al., Synthesis 12: 1511 (1995) иSteglich, W. Tetrahedron 44: 2887 (1988, окислительное сочетание трианионов индол-3 уксусной кислоты (Bergman et al., Tetrahedronal., Tetrahedron Letters 34: 5623 (1993, в результате которых получают бисиндолилмалеимидный ангидрид, который затем в двухстадийном синтезе превращают в бисиндолилмалеимид. Хотя для получения бисиндолилмалеимидов можно использовать любые из этих методик,однако, для получения симметрично замещенных бисиндолилмалеимидов в отличие от несимметричных бисиндолилмалеимидов следует применять различные методики или многочисленные стадии. Поэтому сохраняется большая 2 потребность в общем и эффективном способе получения бисиндолилмалеимидов. Настоящее изобретение обеспечивает общий и очень эффективный способ синтеза этих субстратов. Синтез предусматривает гибкую и мощную методику синтеза бисиндолилмалеимидов. Это изобретение предусматривает способ получения соединений формулы I где R1 и R2 независимо являются необязательно замещенными 3-индолилом и R11 является Н или СН 3, включающий взаимодействие необязательно замещенного индол-3-ацетамида формулыR4 является С 1-С 4-алкилом,в присутствии основания достаточно сильного для депротонирования амида и метилена в положении С-3 индол-3-ацетамида. Для целей настоящего изобретения, которое раскрыто в описании и формуле изобретения, последующие термины и сокращения определены следующим образом. Термин "галоген" представляет собой фтор, хлор, бром или иод. Термин "алкил" представляет собой цикло,прямую или разветвленную группу, имеющую от одного до десяти атомов углерода, например метильную, этильную, н-пропильную, изопропильную, циклопропильную, н-бутильную, изобутильную, втор-бутильную, трет-бутильную и подобные группы. Галогеналкил представляет собой такой алкил, замещенный одним или несколькими атомами галогена, предпочтительно атомами галогена в количестве от одного до трех. Примером галогеналкила является трифторметил. С 1-С 4-алкил является алкилом, в котором атомы углерода присутствуют в количестве от одного до четырех. С 1-С 4-алкокси представляет собой С 1-С 4-алкильную группу, ковалентно связанную -О-связью. Термин "С 1-С 4-алкилен" представляет собой алкиленовую группу с прямой цепью, содержащей от одного до четырех атомов углеро 3 да. Примеры С 1-С 4-алкилена включают метилен,этилен, триметилен, тетраметилен и т.д. Аналогично "С 4-С 8-алкилен" представляет собой алкиленовую группу с прямой цепью, содержащую от 4 до 8 атомов углерода. Термин "арил" представляет собой фенил или нафтил. Термин "алкоксиды щелочного металла" относится к основаниям алкоксида, как правило,литиевым, калиевым или натриевым основаниям, обычно С 1-С 4-aлкoкcи. Таким образом алкоксиды щелочного металла включают третбутоксид калия, метоксид натрия, этоксид натрия. Термин "гетероцикл" представляет собой устойчивое, необязательно замещенное, насыщенное или ненасыщенное пяти- или шестичленное кольцо, которое имеет от одного до четырех гетероатомов, которые являются одинаковыми или разными и которые выбирают из группы, состоящей из серы, кислорода и азота; и когда гетероцикл содержит два смежных атома углерода, смежные атомы углерода могут образовывать группу формулы -СН=СН-; при условии, что (1) когда гетероциклическое кольцо содержит 5 членов, гетероатомы включают не более двух атомов серы или двух атомов кислорода, но не то и другое и (2) когда гетероциклическое кольцо содержит 6 членов и является ароматическим, сера и кислород не присутствуют. Гетероцикл может быть присоединен к любому атому углерода или азота, который дает устойчивую структуру. Термин "необязательно замещенный алкилен", "необязательно замещенный гетероцикл" или "необязательно замещенный арил" относится к замещению группами в количестве от одной до трех, независимо выбранными из группы, состоящей из водорода, C1-С 4-алкила, С 1-С 4 алкокси, (CH2)m-гидрокси, ацетила, карбокси,галогена, галогеналкила, нитро и (CH2)mNR5R6; где m равно 0, 1, 2 или 3; и R5 и R6 независимо являются водородом, С 1-С 4-алкилом, фенилом,бензилом, или соединяются с азотом, с которым они связаны, с образованием насыщенного или ненасыщенного пяти- или шестичленного кольца. Такие группы, в особенности гидрокси или амино, в ходе заявленной реакции необязательно защищают. Термин "отщепляемая группа", который используется в описании, является понятным для специалистов в данной области. Обычно отщепляемая группа представляет собой любую группу или атом, которые усиливают электрофильность атома, к которому они присоединяются при замещении. Предпочтительными отщепляемыми группами являются трифлат, мезилат, тозилат, имидат, хлорид, бромид и иодид. Термин "гидрокси защитная группа", который применяется в описании, относится к одному из производных простого или сложного эфира, применяемых обычно для блокирования 4 или защиты гидроксигруппы при осуществлении реакций других функциональных групп соединения. Вид применяемой гидроксизащитной группы не является важным до тех пор, пока дериватизированная гидроксильная группа является устойчивой к условиям последующей(их) реакции(й) и может быть удалена в соответствующий момент времени без разрыва остатка молекулы. T.W. Greene и P.Wuts в: Protective Groups in Organic Synthesis, John Wileyand Sons, New York, N.Y., 1991 представили список обычно применяемых защитных групп. Предпочтительными защитными группами для гидрокси являются трет-бутилфенилсилилокси(TBDMS), трифенилметил (тритил), метокситритил или сложный алкиловый или ариловый эфир. Родственным термином, имеющим отношение к гидроксизащитной группе является термин "защищенная гидроксигруппа". Термин "аминозащищенная группа", который используется в описании, относится к заместителям аминогруппы, обычно применяемым для блокирования или защиты функциональной аминогруппы во время взаимодействия других функциональных групп соединения. Вид применяемой защитной группы для аминогруппы не является важным до тех пор, пока дериватизированная аминогруппа соединения является устойчивой к условиям последующей(их) реакции(й) и может быть удалена в соответствующий момент времени без разрыва остатка молекулы. T.W. Greene и P. Wuts в: Protective Groupsin Organic Synthesis, Chapter 7, представили список обычно применяемых защитных групп. Смотри также J.W. Barton, Protective Groups inOrganic Chemistry, Chapter 2. Предпочтительными защитными группами для аминогруппы являются трет-бутоксикарбонильная, фталимидная, циклическая алкильная и бензилоксикарбонильная. Родственный термин "защищенная аминогруппа" определяет аминогруппу, замещенную аминозащищенной группой, которая здесь определена. Термин "-NH защищенная группа", который применяется в описании, относится к подклассу аминозащищенных групп, которые обычно применяют во время взаимодействия других функциональных групп соединения. Вид применяемой защитной группы не является важным до тех пор, пока дериватизированная аминогруппа соединения является устойчивой к условиям последующей(их) реакции(й) и может быть удалена в соответствующий момент времени без разрыва остатка молекулы. T.W.Synthesis, Chapter 7, page 362-385, представили список обычно применяемых защитных групп. Предпочтительными защитными группами для 5 группу, замещенную -NH защитной группой,которая определена здесь. Примечание: обозначение означает метилен в 3-положении индолил-3-ацетамида. Как ранее отмечалось, изобретение предусматривает способ получения соединения формулы I где R1 и R2 независимо являются необязательно замещенным 3-индолилом и R11 является Н или СН 3, который включает взаимодействие необязательно замещенного индол-3-ацетамида с необязательно замещенным индолил-3-глиоксильным реагентом в присутствии основания. Преимущество настоящего изобретения состоит в том, что реакция является интенсивной. Как индол-3-ацетамид, так и индолил-3 глиоксильный реагент могут быть необязательно замещены широким множеством заместителей, известных и раскрытых в предшествующем уровне техники в данной области, при условии,что замещение не препятствует протеканию реакции настоящего изобретения. Предпочтительными группами являются N-замещенная,замещенная в конденсированном шестичленном ароматическом кольце индолила, и/или замещенная в 2-положении индолила. Включены такие бисиндолилмалеимиды,гдеNзаместители индолила связаны вместе через описанную далее мостиковую группу. Заместители, признанные в качестве желательных в бисиндолилмалеимиде, включают, например, такие, которые представлены в патентах США 5057614,5380746, ЕР 04704901 А 1, WО 91/13071, ЕР 0397060 А 2, ЕР 0384349 А 1, ЕР 0624586, WO 94/14798, ЕР 0657458, патенте США 5481003 и патенте США 5545636, на все из которых здесь приводятся ссылки. Необязательно замещенным индолил-3 ацетамидом предпочтительно является соединение формулы II 6 алкилом, фенилом, бензилом, или объединяются с азотом, с которым они связаны, с образованием насыщенного или ненасыщенного пяти- или шестичленного кольца. Предпочтительные группы включают такие как R7, который является водородом, алкилом, необязательно защищенным гидроксиалкилом, необязательно защищенным аминоалкилом; и R8 является водородом. Другие предпочтительные соединения включают такие, где R8 присоединен в положении индолила и объединяется с R7 с образованием группы формулы IIа где X является необязательно замещенным С 1 С 4-алкиленом, Х предпочтительно является метиленом, замещенным -СН 2N(СН 3)2, защищенной гидроксигруппой или защищенной аминогруппой;R11 предпочтительно является Н. Необязательно замещенным индодил-3 глиоксильным реагентом предпочтительно является соединение формулы IIIOR4 и более предпочтительно OR4; R7' предпочтительно является водородом, алкилом, галогеналкилом, алкоксиалкилом, необязательно защищенным гидроксиалкилом, необязательно защищенным аминоалкилом, моноалкиламиноалкилом или диалкиламиноалкилом. Включены также соединения, где R7 и R7' соединяются вместе с образованием мостиковой группы, связывающей индолил глиоксалильного реагента и ацетамида. Такие соединения имеют формулу IV 7 где W представляет собой необязательно замещенную С 4-С 8-алкиленовую группу, и необязательно имеет внутреннюю эфирную (-O-), амино- (-NH-) или амидную (-CONH-) связь. Наиболее предпочтительными соединениями являются соединения, где W имеет внутреннюю эфирную связь, которые представлены формулой IVaN(СН 3)(СF3); R5 и R6 независимо являются Н или С 1-С 4-алкилом; р равно 0, 1 или 2 и m независимо является 2 или 3. Наиболее предпочтительными соединениями формулы IVa являются такие соединения, где р равно 1; R5 и R6 являются метилом. Еще одним предпочтительным индолил-3 ацетамидом является соединение формулы где m, Z и R9 являются такими, как они были определены ранее, и R10 является отщепляемой группой, гидрокси или защищенной гидроксигруппой. Соединение (IVb) препочтительно взаимодействует с глиоксильным реагентом (III) с получением соединения формулы При желании соединение IVc может быть выделено из реакционной смеси; затем посредством внутримолекулярного алкилирования R10 с помощью методик, признанных в данной области и описанных в ЕР 0657458 (14 июня 1995 г.), образуют макроцикл, предпочтительно макроцикл формулы предпочтительно получают путем взаимодействия соединения IVc в присутствии основания, 001392Cs2CO3. Реакцию можно осуществить подобным образом путем замещения в глиоксильном реагенте. То есть аналогичное соединение формулы IVb может взаимодействовать с незамещенным индолил-3-ацетамидом с образованием соединения формулы IVa. Для получения макроцикла (IVd) в одностадийной реакции можно регулировать взаимодействие глиоксильного реагента (IVb1) с индолил-3-ацетамидом или реакцию индолил-3 ацетамида (IVb) с незамещенным индолил-3 глиоксильным реагентом можно регулировать. Предпочтительно N-алкилирование промежуточного продукта (V) позволяет воспользоваться внутримолекулярной конденсацией для эффективного воздействия на образование малеимида в мягких условиях одноступенчатой реакции без димеризации образуются как бисиндолилмалеимид, так и макроцикл. Так, например,для получения соединения (IVd1) с выходом 58% следующую реакцию осуществляли при комнатной температуре с применением около 5 эквивалентов NaH примерно в 20 объемах DMF. Реакция была неудачной в том случае, когда при таких же условиях применяли NaH в THF, хотя реакцию можно также осуществить с применением третбутоксида калия в DMF. Таким образом, замещенный или незамещенный бисиндолилмалеимидный макроцикл может быть получен эффективной одностадийной реакцией. Такой интенсивный метод синтеза ранее был неизвестен в данной области. Было признано, что могут существовать различные стереоизомерные формы описанных здесь соединений; соединения формулы (IVd) могут содержать в замещенной алкиленовой группе хиральный атом углерода. Соединения обычно получают в виде рацематов и могут быть подходяще применены как таковые, но посредством описанных здесь методик по желанию могут быть разделены или синтезированы отдельные энантиомеры. Получение таких рацематов и отдельных энантиомеров и их смесей составляет часть настоящего изобретения. Настоящее изобретение основано на обнаружении того, что индолил-3-ацетамид взаимодействует с индолил-3-глиоксильным реагентом 9 при обработке основанием достаточно сильным для депротонирования индолил-3-ацетамида и для депротонирования метилена в метиленовом углероде в 3-положении индолила. Предпочтительные основания выбирают из группы, состоящей из алкоксидов щелочного металла,гидрида натрия, диизопропиламида лития или н-бутиллия,при этом наиболее предпочтительными являются алкоксиды щелочного металла, например трет-бутоксид калия (KOBut). Реакцию осуществляют при молярном избытке основания, предпочтительно при расходе основания в количестве от около 0,5 до 10,0 эквивалентов,наиболее предпочтительно от около 3,0 до 5,5 эквивалентов. Однако специалистам в данной области будет понятно, что количество эквивалентов основания зависит от числа кислотных водородов в молекулах. Реакцию можно осуществлять в органическом растворителе, который в условиях реакции является инертным. Такие растворители включают эфирные растворители, например тетрагидрофуран, трет-бутилметиловый эфир, простой эфир и диметоксиэтан; спиртовые растворители, например этанол или бутанол; или полярные растворители, например диметилформамид, диметилсульфоксид или ацетонитрил. Предпочтительным растворителем является тетрагидрофуран. Вследствие возможного "гасящего" действия растворителя на основание,спиртовые растворители являются наименее предпочтительными. Реакционная смесь обычно включает примерно эквимолярные количества двух реагентов, хотя применимы и другие количества эквивалентов реагентов. Температура реакции предпочтительно составляет от примерно 0 С до примерно температуры перегонки реакционной смеси. Применяемый в этом изобретении индолил-3-глиоксильный реагент получают при установленных в данной области условиях. Обычно глиоксильный реагент получают посредством методов, описанных Feldman P.L., et al., вSettimo JOC 35: 2546 (1970) и Rawal V.H. Tetrahedron Lett. 26: 6141 (1985), на которые здесь дается ссылка. Глиоксильный реагент предпочтительно получают из индола посредством последовательной обработки индола оксахлоридом и затем метоксидом натрия (25 вес.% раствором в метаноле) при низкой температуре (60 С). Индолил-3-ацетамид получают при принятых в данной области условиях или в условиях,приобретенных у Aldrich Chemical CompanyMilwaukee, WI, catalog, page 725 (1992-1993). Замещение в ацетамиде осуществляют посред 001392 10 ством признанных в данной области методов и описанных в: Rubottm G. et al., Synthesis 566(1972), упомянутый здесь как ссылка. Не стремясь ограничить реакцию какимлибо объяснением с технической точки зрения,заявители полагают, что механизм заявленной реакции проиллюстрирован на схеме 1. Соединения (IV) и (VII) (транс и цис) могут быть выделены из реакционной смеси. Эти промежуточные соединения охарактеризованы ЯМР, масс-спектрометрией и инфракрасной спектрометрией. С помощью кислоты или основания можно достигнуть элиминирования (дегидратации соединения (VII) до получения соединения I). Когда индол-3-ацетамид является незамещенным, предпочтительно используют НСl. Когда применяют замещенный индол-3 ацетамид, реакционную смесь предпочтительно гасят избытком основания. Таким образом, преимущество настоящего изобретения состоит в том, что индол, содержащий кислочувствительную функциональную группу, может быть легко циклизован путем размещения в индол-3 ацетамиде замещения. Соединение (VII) предпочтительно превращают в конечный продукт в той же самой реакционной емкости путем гашения реакционной смеси НСl. Когда индол-3-ацетамид (II) является замещенным, полного элиминирования достигают в течение времени от около 1 до 5 ч для получения бисиндолилмалеимида, при этом отсутствует необходимость в добавлении кислоты. Элиминирование может быть дополнительно усилено при использовании в реакции большего количества основания, предпочтительно от четырех до пяти эквивалентов, которое приведет к полной циклизации в течение времени от около 15 мин до 1 ч. Так, например, индол-3 ацетамиды, содержащие кислоточувствительный кеталь и тритил, могут быть циклизованы с соединением III в одном сосуде с получением бисиндолилмалеимидов с выходом более 90% без необходимости добавления кислоты для гашения реакционной смеси и завершения элиминирования. Неожиданно было обнаружено,что даже гидрокси- и аминозамещенные индол 3-ацетамиды могут быть циклизованы с получением бисиндолилмалеимидов, выход которых составит соответственно 98% и 84%. 11 Последующие примеры заявленного синтеза демонстрируют гибкость и силу этой методики синтеза бисиндолилмалеимидов. Примеры предложены для иллюстрации изобретения, а не для ограничения объема изобретения до приведенных примеров. В последующих примерах обозначения "ЯМР" или "МС" означают, что структура была подтверждена ЯМР или массспектрометрией. Общее Инфракрасный спектр получали на спектрометре Перкин-Элмер 781. Спектр 1 Н ЯМР записывали на спектрометре QE 300 МГц при комнатной температуре. Представленные данные были следующими: химический сдвиг на шкале d от внутреннего стандарта тетраметилсилана в м.д. мультиплетность (b = широкий, s = синглет, d = дублет, t = триплет, q = квартет, qn= квинтет и m = мультиплет), интегрирование,константа взаимодействия (Гц) и отнесение. 13C ЯМР получали на спектрометре QE 300 МГц(75,5 МГц) при комнатной температуре. Химические сдвиги на шкале d от тетраметилсилана представлены в м.д., при этом в качестве внутреннего стандарта применяли резонанс растворителя (дейтерохлороформа при 77,0 м.д. иDMSO-d6 при 39,5 м.д.). Анализы сгорания были проведены Еli LillyCompany MicroanalyticalVG 70 SE получили масс-спектры высокого разрешения. Аналитическую тонкослойную хроматографию осуществили на 0,25 мм пластинах из силикагеля 60-F с применением ЕМ реагента. Визуализацию осуществили ультрафиолетовым светом. Приготовление 1 1-Метил-индол-3-ацетамид К суспензии гидрида натрия (3,33 г, 83,3 ммоля) в DMF (50 мл) при комнатной температуре добавили по каплям раствор индол-3 ацетонитрила (10,0 г, 64,0 ммоля). Полученную смесь перемешивали в течение 30 мин и охладили до 0-5 С и по каплям добавили раствор метилиодида (13,63 г, 96,0 ммолей) в DMF (30 мл). Реакционную смесь нагрели и перемешали при комнатной температуре в течение 3 ч. Затем реакционную смесь экстрагировали с применением EtOAc (300 мл) и водного раствора 0,5 н НСl (400 мл), органический слой сушили(MgSO4) и в вакууме удалили растворитель, при этом получили 16,34 г (100%) сырого алкилированного продукта, который использовали без очистки. Перед добавлением 30%-ного водного раствора пероксида водорода (33 мл) и последующим добавлением водного 20 вес. % раствора NaOH (26 мл) масло объединили с тетрабутиламмонийбромидом (4,13 г, 12,8 ммоля) в СН 2 Сl2 (100 мл) и охладили на бане со льдом. Реакционную смесь нагрели до комнатной температуры и перед экстракцией с применением СН 2 Сl2 (650 мл), водного раствора 1 н НСl (500 мл) и воды (500 мл) ее перемешивали в течение 12 21 ч. Органический слой сушили (MgSO4), в вакууме удалили растворитель, при этом получили густую суспензию, к которой добавили гексан (100 мл). Эту смесь фильтровали с применением в качестве жидкости для промывки смеси СН 2 Сl2 и гексана (100 мл) при соотношении компонентов в смеси 1:1, при этом после сушки получили 8,45 г (70%) названного продукта. ЯМР МС (FD) m/z=188 (M+, 100%). Анализ: вычислено для C11H12N2O: С, 70,19; Н, 6,43;N, 14,88. Найдено: С, 70,02; Н, 6,17; N, 14,99. Приготовление 2 1-(2,2-Диметил-1,3-диоксаланил-4-этил)-3 индол-3-ацетамид К суспензии гидрида натрия (4,3 г, 0,109 ммоля) при 0-5 С добавили по каплям раствор индол-3-ацетамида (13,5 г, 77,55 ммоля) в DMF(50 мл). Полученную смесь перемешали в течение 1 ч на бане со льдом и затем по каплям добавили 4-[2-п-толуолсульфонилэтил]-2,2-диметил-1,3-диоксолон (Tanis, S.P. et аl., J. Org.Chem. 52: 819 (1987), 34,9 г, 0,116 моля). Реакционной смеси дали нагреться и перемешивали при комнатной температуре в течение 16 ч и затем экстрагировали с EtOAc, рассолом и 5%ным водным LiCl, органический слой сушили(MgSO4) и в вакууме удалили растворитель, при этом получили масло, к которому добавили смесь гексана и EtOA (225 мл) при соотношении компонентов в смеси 4:3. Продукт выкристаллизовали и выделили, получив после сушки 19,4 г (83%) продукта. ЯМР МС (FD) m/z=302 (M+,100%). Анализ: вычислено для C17H22N2O3: С,67,53; Н, 7,33; N, 9,26. Найдено: С, 67,72; Н,7,38; N, 9,31. Приготовление 3 1-(3-О'-трифенилметилпропил)-индол-3 ацетамид. К суспензии гидрида натрия (1,61 г, 40,3 ммоля) в DMF (25 мл) при комнатной температуре под N2 добавили раствор индол-3 ацетамида (5,0 г, 28,7 ммоля) в DMF (25 мл). Полученную смесь перемешали в течение 30 мин при комнатной температуре и затем охладили до 0-5 С. Добавили раствор 3-бром-1-(О'трифенилметил)-пропанола (16,4 г, 43,1 ммоля) в DMF (40 мл) и реакционную смесь перемешали при комнатной температуре в течение 16 ч. Реакционную смесь подвергли экстракции с применением EtOAc (700 мл), воды (2 х 500 мл) и рассола (200 мл), сушили (MgSО 4) и в вакууме удалили растворитель, получив при этом 23,1 сырого продукта, который очистили флэшхроматографией с применением смеси гексана и ацетона 1:1, получили 12,45 г (91%) продукта в виде масла. Путем растворения масла в EtOH 13 Приготовление 4 1-(1-Гидроксипропил)-индол-3-ацетамид К суспензии гидрида натрия (1,08 г, 27,0 ммоля) в DMF (10 мл) при комнатной температуре добавили по каплям раствор 3 индолилацетонитрила (3,0 г, 19,2 ммоля) в DMF(30 мл). Перед добавлением раствора 3 бромпропилацетата (4,87 г, 26,9 ммоля) в DMF(15 мл) полученную смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь перемешивали в течение еще 3 ч при комнатной температуре и экстрагировали с применением EtOAc (250 мл), водного раствора 0,5 н НСl (200 мл), воды (200 мл) и рассола (50 мл), в вакууме удалили растворитель, при этом получили 6,91 г (100%) сырого алкилированного продукта, который без очистки следующим образом превратили в 1-(1-гидроксипропил)индол-3-ацетамид. Масло растворили в третбутаноле (70 мл), обработали свежеизмельченным порошком гидроксида калия (85%, 12,7 г,192 ммоля) и полученную смесь в течение 1 ч в мягких условиях нагрели до образования флегмы. Затем реакционную смесь вылили на лед и с применением водного раствора 6N НСl (35 мл) довели рН 1. Затем реакционную смесь подвергли экстракции с применением EtOAc (300 мл), воды (200 мл), рассола (50 мл), органический слой сушили (MgSO4) и в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси ацетона и гексана при соотношении компонентов в смеси 2:1 и затем смеси ацетона и МеОН при соотношении компонентов в смеси 95:5, при этом получили 2,73 г (61%) 1(1-гидроксипропил)-индол-3-ацетамида. ЯМР МС (FD) m/z=232 (M+, 100%). Анализ: вычислено для С 13 Н 16N2 О 2: С, 67,22; Н, 6,94; N, 12,06. Найдено: С, 65,99; Н, 7,24; N, 11,0. Приготовление 5 1-(Диметиламинопропил)-индол-3-ацетамид Суспензию 1-(метансульфонилпропил)-индол-3-ацетамида (1,0 г, 3,20 ммоля) в THF (15 мл) обработали 40%-ным водным раствором диметиламина (13,5 г, 0,108 моля) и полученный реакционный раствор накрыли крышкой и перемешали при комнатной температуре в течение 18 ч. Затем реакционную смесь подвергли экстракции с применением EtOAc (50 мл), воды(2 х 500 мл) и рассола (50 мл). Объединенные водные слои три раза реэкстрагировали EtOAc(3 х 25 мл), и объединенные органические слои сушили (MgSО 4), в вакууме удалили растворитель, при этом получили 0,77 г (92%) 1(диметиламинопропил)-индол-3-ацетамида. ЯМР МС (FD) m/z=259 (М+, 100%). Приготовление 6 Метилиндолил-3-глиоксилат Раствор индола (2,0 г, 1,70 ммоля) в Et2O(20 мл) охладили в токе азота до 0-5 С и по каплям при температуре 5 С добавили оксалил 001392 14 хлорид (1,5 мл, 1,70 ммоля). Полученную желтую суспензию перемешивали в течение 30 мин на бане со льдом и затем охладили до -65 С и при температуре-58 С медленно добавили 25 вес.% раствора метоксида натрия (7,8 мл, 3,4 ммоля). Реакционную смесь нагрели до комнатной температуры, добавили воду (10 мл), и полученную смесь фильтровали. Твердое вещество сушили при комнатной температуре, при этом получили 3,21 г (93%) названного соединения. ЯМР МС (FD) m/z=203 (M+, 100%). Анализ: вычислено для С 11H9NО 3: С, 65,02; Н, 4,46;N, 6,89. Найдено: С, 64,93; Н, 4,25; N, 7,03. Приготовление 7 Метил(1-метил-индолил-3)-глиоксилат Раствор N-метилиндола (2,0 г, 1,52 ммоля) в Et2O (20 мл) охладили потоком азота до 0-5 С и по каплям добавили оксалилхлорид (1,3 мл,1,52 ммоля). Полученную желтую суспензию перемешивали в течение 30 мин на бане со льдом и затем охладили до -65 С и при температуре-58 С медленно добавили 25 вес.% раствор метоксида натрия (7,0 мл, 3,04 ммоля). После этого реакционную смесь нагрели до комнатной температуры, добавили воду (10 мл),полученную смесь фильтровали и твердое сушили при комнатной температуре, при этом получили 2,93 г (89%) названного соединения. ЯМР МС (FD) m/z=217 (M+, 100%). Анализ: вычислено для С 12 Н 11NО 3: С, 66,35; Н, 5,10; N,6,45. Найдено: С, 66,29; Н, 5,39; N, 6,65. Приготовление 8 3-Бромпропилацетат К раствору 3-бром-1-пропанола (100 г,0,720 моля) при 0-5 С и 4 диметиламинопиридина (8,79 г, 72,0 ммоля) в СН 2 Сl2 (500 мл) добавили уксусный ангидрид(74,7 мл, 0,792 моля). Реакционную смесь в течение 4 ч нагревали до комнатной температуры и затем реакционную смесь подвергли экстракции с применением CH2Cl2 (200 мл), водного раствора 1 н НСl (2300 мл), насыщенногоNаНСО 3 (2300 мл) и рассола (200 мл), в вакууме удалили растворитель, при этом получили 128,52 г (99%) вышеназванного соединения. ЯМР МС (FD) m/z=180 (M+, 100%). Аналитически вычислено для С 5 Н 9 О 2 Вr: С, 33,17; Н, 5,01. Найдено: С, 33,69; Н, 5,09. Приготовление 9 3-Бром-1-(O'-трифенилметил)пропанол В CH2Cl2 (500 мл) растворили тритилхлорид (109 г, 0,391 моля), охладили под током азота до 0-5 С и добавили триэтиламин (59,4 мл,0,426 моля) и затем раствор 3-бром-1-пропанола(49,4 г, 0,355 моля) в СН 2 Сl2 (100 мл). Реакционную смесь нагрели и перемешали при комнатной температуре в течение 4 ч. Затем реакционную смесь подвергли экстракции с применением CH2Cl2 (200 мл), воды (500 мл) и рассола (150 мл) и затем сушили (MgSO4), в вакууме удалили растворитель, при этом получили 144,6 15 г сырого продукта, который очистили флэшхроматографией с применением смеси гексана иCH2Cl2, используя градиент от 2:1 до 1:1, при этом получили 105,7 г (78%) вышеуказанного названного соединения в виде твердого вещества. ЯМР МС (FD) m/z=380 (М+, 100%). Анализ: вычислено для C22H21OBr: С, 69,30; Н, 5,55. Найдено: С, 69,10; Н, 5,48. Приготовление 10 1-(Метансульфонилпропил)-индол-3 ацетамид К раствору 1-(1-гидроксипропил)-индол-3 ацетамида (1,68 г, 7,23 ммоля) и триэтиламина(1,41 мл, 10,1 ммоля) в CH2Cl2 (20 мл) при 0-5 С под током азота добавили метансульфонилхлорид (0,67 мл, 14,5 ммоля). Реакционную смесь в течение 30 мин перемешали в бане со льдом и затем реакционную смесь экстрагировали с применением CH2Cl2 (200 мл), воды (100 мл),водного насыщенного раствора NH4Cl (100 мл) и рассола (50 мл), органический слой сушили(MgSO4), в вакууме удалили растворитель, при этом получили твердое вещество, которое растерли в порошок в THF (15 мл) и фильтровали до получения после сушки 1,58 г (71%) вышеназванного соединения. ЯМР МС (FD) m/z=310C14H18N2O3S: С, 54,18; Н, 5,85; N, 9,03. Найдено: С, 54,64; Н, 5,98; N, 8,97. Приготовление 11 1-(Трифенилметокси)-2-(2-(индол-3 ацетамид)-окси)-4-бутантриол 1,2-(Диметилацетонид)-4-бутантриол (9,5 г, 65,07 ммоля) при комнатной температуре поместили в 100 мл CH2Cl2. Добавили имидазол(8,85 г, 130,15 ммоля, 2,0 экв.) и затем третбутилдиметилсилилхлорид (16,99 г, 61,8 ммоля,0,95 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, гасили раствором NH4Cl, промыли рассолом, сушили над MgSO4 и выпарили до получения масла. Это масло перенесли в 80%-ный водный раствор уксусной кислоты и перемешали при комнатной температуре в течение 24 ч. Его гасили водой и разбавили CH2Cl2. Полученный органический слой промыли насыщенным растворомNаНСО 3 и водой и перед выпариванием до получения масла сушили над MgSO4, масло очистили колоночной хроматографией, при этом получили 14,2 г 1,2,4-(третбутилдифенилсилилокси)-бу-танола в виде прозрачного масла (выход 71%). 1,2,4-трет-бутилдифенилсилилокси)-бутантриол (28,0 г, 81,4 ммоля) при комнатной температуре перенесли в 400 мл CH2Cl2. Добавили триэтиламин (13,6 мл, 97,7 ммоля, 1,2 экв.) и затем тритилхлорид (25,0 г, 89,5 ммоля, 1,1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч, гасили раствором NH4Cl. Полученный органический слой промыли рассолом и сушили над MgSO4 перед выпариванием до масла, которое очисти 001392 16 ли колоночной хроматографией (гексан/EtOAc 7/1), при этом получили 40,9 г 1-(трифенилметокси)-2,4-(трет-бутилдифенилсилилокси)-бутантриола в виде прозрачного масла (выход 96%). В 100 мл THF перенесли NaH (5,0 г, 124,2 ммоля, 1,4 экв.). 1-(Трифенилметокси)-2,4(трет-бутилдифенилсилилокси)-бутантриол(52,0 г, 88,7 ммоля) поместили в 400 мл THF и добавили к реакционной смеси. Реакционную смесь в течение 1 ч нагревали при 45 С и затем по каплям добавили аллилбромид (13,8 мл,159,7 ммоля, 1,8 экв.). Реакционную смесь нагревали при 45 С в течение еще 12 ч. Ее гасили раствором NH4Cl. Полученный органический слой промыли рассолом и сушили над MgSO4 перед выпариванием до масла, которое очистили колоночной хроматографией (гексан/EtOAc 9/1), при этом получили 44,8 г 1(трифенилметокси)-2-(2-пентенокси)-4-(третбутилдифенилсилилокси)-бутантриола в виде прозрачного масла (выход 81%). 1-(Трифенилметокси)-2-(2-пентенокси)-4(трет-бутилдифенилсилилокси)-бутантриол (3,6 г, 5,76 ммоля) перенесли в 30 мл CH2Cl2/МеОН 1/1 и охладили до -50 С. В реакционную смесь в течение 30 мин барботировали озон, количество которого регулировали по изменении цвета суданского красного индикатора. При температуре -50 С добавили боргидрид натрия (0,43 г,11,52 ммоля, 2,0 экв.) и реакционную смесь в течение всей ночи медленно довели до комнатной температуры. Ее закалили раствором NH4Cl и полученный органический слой промыли рассолом и сушили над MgSO4 перед выпариванием до масла, которое очистили колоночной хроматографией (гексан/EtOAc 3/1), при этом получили 2,3 г 1-(трифенилметокси)-2-(2 гидроксиэтокси)-2-(2-третбутилдифенилсилилокси)-бутан-триола в виде прозрачного масла (выход 63%). 1-(Трифенилметокси)-2-(2-гидроксиэтокси)-4-(трет-бутилдифенилсилилокси)бутантриол (18,6 г, 30,0 ммолей) поместили в 200 мл CH2Cl2 и охладили до -5 С. Добавили триэтиламин (5,2 мл, 37,5 ммоля, 1,25 экв.) и после этого по каплям добавили метансульфонилхлорид (2,8 мл, 36,0 ммолей, 1,2 экв.) при поддержании температуры ниже 0 С. Реакционную смесь в течение 30 минут перемешивали при -5 С. Ее гасили раствором NH4Cl и полученный органический слой перед выпариванием промыли рассолом и сушили над MgSO4, при этом получили 19,7 г 1-(трифенилметокси)-2-(2 метансульфонилокси)этокси)-4-(трет-бутилдифенилсилилокси)-бутантриола в виде светложелтого масла (выход 96%). 60% NaH в минеральном масле (5,18 г, 129 ммолей, 1,5 экв.) перенесли в 400 мл DMF и охладили до 0 С. При поддержании температуры ниже 0 С медленно добавили раствор индол-3-ацетамида (22,6 г,129 ммолей, 1,5 экв.) в 325 мл DMF. Реакцион 17 ную смесь довели до комнатной температуры и перемешали в течение 2 ч. Ее повторно охладили до 0 С и при поддержании температуры ниже 0 С медленно добавили раствор 1(трифенилметокси)-2-(2-метансульфонилокси)этокси)-4-(трет-бутилдифенилсилилокси)бутантриола (61,3 г, 86,4 ммоля) в 500 мл DMF(в целом 20 объемом). Реакционную смесь перемешали при 0 С в течение 1 ч, затем оставили нагреваться до комнатной температуры в течение всей ночи. Ее закалили раствором NH4Cl,разбавили EtOAc и полученный органический слой несколько раз промыли водой для удаления DMF. Затем ее сушили путем промывки рассолом, сушки над MgSO4 и выпаривания,при этом получили 1-(трифенилметокси)-2-(2 индол-3-ацетамид)окси)-4-(трет-бутилдифенилсилилокси)-бутантриол в виде темнокоричневого масла, которое применяли без дополнительной очистки (общий выход 68,0 г). 1-(Трифенилметокси)-2-(2-индол-3-ацетамид)окси)-4-(трет-бутилдифенилсилил-окси)бутантриол (68,0 г, 129 ммолей) поместили в 100 мл 1 М раствора тетрабутиламмонийфторида в THF. Реакционную смесь перемешали при комнатной температуре в течение 6 ч. Ее гасили водой и разбавили EtOAc для улучшения разделения. Полученный органический слой промыли рассолом, сушили над MgSO4 и выпарили до получения коричневого масла, которое очистили колоночной хроматографией (гексан/ацетон 1/1 до 100% ацетона) до выхода 26,0 г названного соединения в виде пенистого, не совсем белого твердого вещества (55% выход за две стадии). Пример 1. 3,4-(3-Индолил)-1 Н-пиррол-2,5 дион. Суспензию индол-3-ацетамида (1,00 г, 5,74 ммоля) и метилиндолил-3-глиоксилата (1,28 г,6,30 ммоля) в THF (10 мл) при комнатной температуре под N2 обработали 1 молярным раствором трет-бутоксида калия в THF (17,2 мл,17,2 ммоля). Полученную темную реакционную смесь перемешивали в течение 3 ч при комнатной температуре и затем обработали концентрированной (37%) НСl (8 мл), обеспечив тем самым протекание экзотермической реакции. Реакционную смесь подвергли экстракции с применением EtOAc (125 мл), воды (2 х 100 мл),рассола (25 мл), органический слой сушили(MgSO4) и в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси гексана и EtOAc, используя градиент от 2:1 до 1:1 с получением 2,04 г (100%) арсириарубина А [1,28 г (68%) при применении глиоксилхлорида]. 3,4-(3-Индолил-1 Н-пиррол-2,5 дион может быть также перекристаллизован из ЕtOН, при этом получают стехиометрическое количество моносольвата этанола высокой чистоты ( 99%) с выходом 88%. ЯМР MS (FD)(10 мл) охладили на бане со льдом под N2 и затем обработали 1 молярным раствором третбутоксида калия в THF (15,9 мл, 15,9 ммоля). Полученную темную реакционную смесь в течение 5 мин перемешивали в бане со льдом и в течение 2,5 ч при комнатной температуре и затем обработали концентрированной (37%) НСl(8 мл), обеспечив при этом протекание экзотермической реакции. Реакционную смесь подвергали экстракции с применением EtOAc (150 мл),воды (100 мл), рассола (25 мл), и органический слой сушили (MgSO4), в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси гексана и ацетона и градиента от 2:1 до 1:1, получив при этом 1,66 г(1,00 г, 5,74 ммоля) и метил-(1-метилиндолил-3 глиоксилата (1,50 г, 6,91 ммоля) в THF (10 мл) охладили в бане со льдом под азотом и затем обработали 1 молярным раствором третбутоксида калия в ЕРА (17,2 мл, 17,2 ммоля). Полученную темную смесь перемешивали в течение 5 мин в бане со льдом и в течение 2,5 ч при комнатной температуре и затем обрабатывали концентрированной (37%) НСl (8 мл),обеспечив протекание экзотермической реакции. Реакционную смесь подвергли экстракции с применением EtOAc (150 мл), воды (100 мл),рассола (25 мл), органический слой сушили(MgSO4) и в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси гексана и ацетона и градиента от 2:1 до 1:1, получили 1,71 г (87%) названного соединения. ЯМР МС (FD) m/z=341 (M+, 100%). Анализ: вычислено для C21H15N3O2: С, 73,89; Н, 4,43; N,12,31. Найдено: С, 73,31; Н, 4,57; N, 12,27. Пример 3. 3,4-[(1-Метил)-3-индолил]-1 Нпиррол-2,5-дион. Суспензию 1-метилиндол-3-ацетамида (1,0 г, 5,31 ммоля) и метил(1-метилиндол-3-ил)глиоксилата (1,38 г, 6,35 ммоля) в THF (10 мл) обработали при комнатной температуре под N2 1 молярным раствором трет-бутоксида калия вTHF (15,9 мл, 15,9 ммоля). Полученную темную реакционную суспензию перемешивали в течение 2 ч при комнатной температуре и гасили 1 н НСl (25 мл). Продукт осадился и через 15 мин его выделили фильтрацией, получив 1,88 г 19 С 22 Н 17N3 О 2: С, 74,35; Н, 4,82; N, 11,82. Найдено: С, 74,25; Н, 5,03; N, 11,55. Пример 4. 3-[1-(2,2-Диметил-1,3 диоксаланил-4-этил) -3-индолил]-4-(3-индолил)1 Н-пиррол-2,5-дион. Суспензию 1-(2,2-диметил-1,3 диоксаланил-4-этил)-3-индол-3-ацетамида (1,00 г, 3,31 ммоля) и метилиндол-3-глиоксилата (0,81 г, 3,99 ммоля) в THF (10 мл) охладили в бане со льдом под N2 и затем обработали 1 молярным раствором трет-бутоксида калия в THF (14,9 мл,14,9 ммоля). Полученную темную реакционную смесь перемешали в течение 5 мин на бане со льдом и в течение 1 ч 15 мин при комнатной температуре. Реакционную смесь подвергли экстракции с применением EtOAc (125 мл), воды (2 х 100 мл), рассола (25 мл), и органический слой сушили (MgSO4), в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси гексана и EtOAc, используя градиент от 2:1 до 1:1, получив 1,41 г (93%) названного соединения. ЯМР МС (FD) m/z=455THF (10 мл) охладили в бане со льдом под N2 и затем обработали 1 молярным раствором третбутоксида калия в THF (6,30 мл, 6,30 ммоля). Полученную темную реакционную смесь перемешали в течение 5 мин в бане со льдом и в течение 2 ч при комнатной температуре. Реакционную смесь подвергли экстракции с применением EtOAc (125 мл), воды (100 мл), рассола (25 мл), органический слой сушили (MgSO4), и в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси гексана и ацетона при соотношении компонентов в смеси 1:1, получили 1,20 г (91%) названного соединения. ЯМР МС (FD) m/z=627 (M+,100%). Анализ: вычислено для C42H33N3O3: С,80,36; Н, 5,29; N, 6,69. Найдено: С, 79,35; Н,5,67; N, 6,29. Пример 6. 3-[1-(3-Гидроксипропил)-3 индолил]-4-(3-индолил)-1 Н-пиррол-2,5-дион. Метод 1: Суспензию 1-(1-гидроксипропил)-индол-3-ацетамида (1,00 г, 2,10 ммоля) и метилиндолил-3-глиоксилата (0,51 г, 2,51 ммоля) в THF (10 мл) охладили в бане со льдом под азотом и затем обработали 1 молярным раствором трет-бутоксида калия в THF (6,30 мл, 6,30 ммоля). Полученную темную реакционную смесь перемешали в течение 5 мин в бане со льдом и в течение 2 ч при комнатной температуре и затем обработали концентрированной(37%) НСl и после этого в течение 1 ч нагревали до образования флегмы для детритилирования спирта. Реакционную смесь подвергли экстракции с применением EtOAc (125 мл), воды (100 мл), рассола (25 мл), и органический слой сушили (MgSO4), в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси гексана и ацетона при соотношении компонентов в смеси 1:1, получали 0,66 гTHF (15 мл) охладили в бане со льдом под N2 и затем обработали 1 молярным раствором третбутоксида калия в THF (26,9 мл, 26,9 ммоля). Полученную темную реакционную смесь перемешивали в течение 5 мин в бане со льдом и в течение 3 ч при комнатной температуре и гасили концентрированной (37%) НСl (10 мл). Затем реакционную смесь подвергли экстракции с применением EtOAc (300 мл), воды (2 х 200 мл),рассола (50 мл), органический слой сушили(MgSO4) и в вакууме удалили растворитель, при этом получили твердое вещество, которое очистили флэш-хроматографией с применением смеси гексана и ацетона и градиента от 2:1 до 1:1, получили 2,55 г (100%) названного соединения. ЯМР МС (FD) m/z=385 (М+, 100%). Анализ: вычислено для С 23 Н 19N3 О 3: C, 71,67; Н,4,97; N, 10,90. Найдено: С, 71,08; Н, 5,17; N,10,32. Пример 7. 3-[1-(3-Диметиламинопропил)3-индолил]-4-(3-индолил)-1 Н-пиррол-2,5-дион. Метод 1: Суспензию 1-(1-диметиламинопропил)-индол-3-ацетамида (0,60 г, 2,31 ммоля) и метилиндолил-3-глиоксилата (0,94 г, 4,63 ммоля) и THF (10 мл) охладили в бане со льдом под азотом и затем обработали 1 молярным раствором трет-бутоксида калия в THF (9,3 мл, 9,3 ммоля). Полученную темную реакционную смесь перемешивали в течение 5 мин в бане со льдом и в течение 3 ч при комнатной температуре. После этого реакционную смесь подвергли экстракции с применением EtOAc (100 мл), воды (2 х 75 мл), рассола (25 мл), органический слой сушили (MgSO4), и в вакууме удалили растворитель, при этом получили 1,13 г пены. Для растворения пены добавили ацетон и продукт выкристаллизовали и выделили фильтрацией,после сушки получили 0,80 г (84%) названного соединения. Метод 2: Суспензию 3-[1-(3-метансульфонилпропил)-3-индолил]-4-(3-индолил)-1 Нпиррол-2,5-диона (70,39 г, 0,152 ммоля) в THF(1015 мл) обработали 40%-ным водным раствором диметиламина (423 мл, 3,37 молей), твердые частицы тотчас же растворились с образованием раствора, который перемешали при комнатной температуре в течение 16 ч. Реакционную смесь подвергли экстракции с примене 21(41,84 г, 0,109 моля) в CH2Cl2 (1200 мл) обработали пиридином (26,3 мл, 0,326 моля) и затем метансульфоновым ангидридом (22,69 г, 0,130 моля) и реакционную смесь перемешали под током N2 при комнатной температуре в течение 2,5 ч. Затем реакционную смесь подвергли эксопыта 1 2 3 4 5 6 7 8 9 10 22 тракции с применением водного раствора 0,1 нHCl (3260 мл), воды (1500 мл) и рассола (500 мл), органический слой сушили (MgSO4), и в вакууме удалили растворитель, получив при этом 49,96 (99%) названного твердого соединения. ЯМР МС (FD) m/z=464 (M+, 100%). Анализ: вычислено для C24H21N3O5S: С, 62,19; Н, 4,57; N,9,07, S, 6,92. Найдено: С, 61,52; Н, 4,72; N, 8,74,S, 6,88. Пример 9. Для определения границ применения этой реакции получили ряд замещенных индол-3 ацетамидов, которые подвергли взаимодействию с замещенным индолил-3-глиоксильным реагентом в присутствии 3 эквивалентов КОВut и 1,2 эквивалентов индолил-3-глиоксилатов вTHF. При взаимодействии незамещенного индол-3-ацетамида с незамещенным индолил-3 глиоксилхлоридом получили более низкий выход (68%) по сравнению с выходом, полученным при применении соответствующего сложного эфира метилглиоксилата (таблица II, опыты 1-2). Кроме получения более высоких выходов, сложный эфир был также более подходящим по сравнению с глиоксилхлоридом вследствие того, что соединение является более устойчивым при хранении и может быть анализировано посредством ВЭЖХ (высокоэффективный жидкостной хроматографией) с обращенной фазой. Выходы по хроматографии Продукт, непосредственно выделенный из реакционного сосуда после гашения водным раствором 1 н НСl. 3 Реакция протекала в присутствии 4,5 экв. основания. 4 Реакцию повторили с применением 4,0 экв. основания и 2,0 экв. (III). 2 23 1-(Трифенилметокси)-2-(2-(индол-3 ацетамид)-окси)-4-бутантриол (24,9 г, 45,3 ммоля) перенесли в 250 мл THF и добавили индол-3-метилглиоксилат (18,4 г, 90,7 ммоля,2,0 экв.). Суспензию охладили до 0 С. Медленно добавили 1 М раствор КОВut в THF (181 мл,181 ммоль, 4,0 экв.). Реакционная смесь светлокоричневого цвета быстро изменила свой цвет на красный, ее довели до комнатной температуры и перемешивали в течение всей ночи, гасили раствором NH4Cl и разбавили EtOAc. Полученный органический слой промыли водой,рассолом, сушили над MgSO4 и фильтровали через толстый слой силикагеля размером 1 дюйм (2,54 см) для удаления перед выпариванием исходной кислоты, получили 31,6 г 3-[1[2-[1-трифенилметокси)-2,4-бутантриол]этокси-3-индолил]-4-3-ндолил) -1 Н-пиррол-2,5 диона в виде твердого вещества красного цвета(выход 99%). 3-[1-[2-[1-Трифенилметокси)-2,4-бутантриол]-этокси-3-индолил]-4-(3-индолил)-1 Нпиррол-2,5-дион (10,0 г, 14,2 ммоля) поместили в 100 мл THF и охладили до 0 С. Добавили пиридин (3,45 мл, 42,8 ммоля, 3,0 экв.) и затем метансульфоновый ангидрид (5,10 г, 28,5 ммоля, 2,0 экв.). Реакционную смесь довели до комнатной температуры и перемешивали в течение 2,5 ч. Ее гасили раствором NH4Cl, добавили раствор NаНСО 3 до получения нейтрального рН, и затем полученный органический слой промыли раствором NH4Cl, сушили надMgSO4 и выпаривали при комнатной температуре (комнатная температура является важной,так как продукт неустойчивый), получили 3-[1[2-[1-трифенилметокси)-2,4-метансульфонилокси)-бутантриол]-этокси-3-индолил]-4-(3-индолил)-1 Н-пиррол-2,5-дион в виде твердого вещества красного цвета, который непосредственно перенесли на следующую стадию без дополнительной очистки (общий выход = 11,1 г). 3-[1-[2-[1-Трифенилметокси)-2,4-метансульфонил-окси)-бутантриол]-этокси-3 индолил]-4-(3-индолил)-1 Н-пиррол-2,5-дион(4,0 г, 5,12 ммоля) перенесли в 80 мл DMF и для нейтрализации образованной во время реакции кислоты добавили пиридин (414 мл, 5,12 ммоля, 1,0 экв.) и реакционную смесь в течение 3 ч нагрели до 50 С. Ее гасили растворомNH4Cl и разбавили EtOAc. Полученный органический слой для удаления DMF много раз промыли водой, затем рассолом, сушили надMgSO4 и выпарили до образования красного остатка, который выкристаллизовали из ацетона/EtOAc, при этом получили 3,11 г 3-[1[2-[1-трифенилметокси)-2,4-(бром)-бутантриол]-этокси-3-индолил]-4-(3-индолил)-1 Нпиррол-2,5-диона в виде ярко-оранжевого твердого вещества (выход 79%). Сs2 СО 3 (213 мг, 0,66 ммоля, 1,0 экв.) перенесли в 75 мл DMF и нагрели до 100 С. 3-[1 001392[2-[1-Трифенилметокси)-2,4-(бром)-бутантриол]-этокси-3-индолил]-4-(3-индолил)-1 Нпиррол-2,5-дион (500 мг, 0,66 ммоля) перенесли в 25 мл DNF, находящегося в 30 см 3 шприцевидном насосе. К раствору Сs2 СО 3 при 100 С в течение 1 ч медленно добавили раствор 3-[1[2-[1-трифенилметокси)-2,4-(бром)-бутантриол]-этокси-3-индолил]-4-(3-индолил)-1 Нпиррол-2,5-диона. После завершения добавления температуру поддерживали в течение 1 ч и затем реакционную смесь довели до комнатной температуры. Ее гасили раствором NH4C1 и разбавлением EtOAc. Полученный органический слой для удаления DMF несколько раз промыли водой, затем рассолом, сушили надMgSO4 и выпарили до образования остатка,который очистили колоночной хроматографией(100% гексаном и затем смесью гексана и ацетона при соотношении компонентов в смеси 1:1), при этом получили 328 мг 10,11,14,15 тетрагидро-13-[(трифенилметокси)метил]4,9:16,21-диметено-1 Н,13 Н-дибензо[Е.К.] пирроло[3,4-Н][1,4,13] оксадиазациклогексадецин 1,3(2 Н)-диона в виде твердого вещества пурпурного цвета (выход 73%). Пример 12. 10,11,14,15-Тетрагидро-13[диметиламино)метил]-4,9:16,21-диметено 1 Н,13 Н-дибензо[Е.К.]пирроло[3,4-Н][1,4,13] оксадиазациклогексадецин-1,3(2 Н)-дион. Для образования свободной гидроксигруппы у 10,11,14,15-тетрагидро-13-[(трифенилметокси)метил]-4,9:16,21-диметено 1 Н,13 Н-дибензо[Е.К]пирроло[3,4-Н][1,4,13] оксадиазациклогексадецин-1,3(2 Н)-диона удалили защитную группу и превратили в бромид. Полученный бромид подвергли замещению для образования диметиламина посредством добавления диметиламина в DMF или других методик, признанных в данной области. Полученные заявленной реакцией бисиндолилмалеимиды являются пригодными для ингибирования РКС у млекопитающих и для лечения состояний, связанных с аномальными уровнями РКС. Конкретная доза соединения,вводимого в соответствии с этим изобретением, будет, конечно, зависеть от конкретных обстоятельств каждого случая заболевания,включающих вводимое соединение, способ введения лекарственного средства, состояние подвергаемого лечению больного и подобных обстоятельств. Соединения можно вводить множеством способов, включающих пероральное введение, ректальное введение, чрескожное введение, подкожное введение, местное введение, внутримышечное или интраназальное введение. Для всех симптомов типичная суточная доза будет содержать от около 0,01 мг/кг до около 20 мг/кг активного соединения этого изобретения. Предпочтительные суточные дозы будут составлять от около 0,05 до около 10 мг/кг, в идеале от 0,1 до около 5 мг/кг массы тела. Однако при местном введении типичная 25 доза будет составлять от около 1 до около 500 мг соединения на см 2 пораженной болезнью ткани. Наносимое количество соединения находится в диапазоне от около 30 до около 300 мг/см 2, более предпочтительно от около 50 до около 200 мг/см 2 и наиболее предпочтительно от около 60 до около 100 мг/см 2. Пример 13. 7-Хлориндолил-3-ацетамид (0,10 г) и 0,137 г 7-хлориндолил-3-метилглиоксилата смешали под азотом в 3 мл THF. Добавили 2,4 мл (5 экв.) 1 М трет-бутоксида калия в THF, и темную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавили концентрированную НСl (1 мл) и реакционную смесь перемешивали в течение 15 мин. ВЭЖХ показала, что через 15,29 мин образовалось 32% продукта, а через 14,43 мин 60% недегидратированных диастереомеров (см. с. 138139 KUV). При достижении температуры флегмы образовалось 77% продукта и 13% диастереомеров. После нагревания реакционной смеси в течение 1 ч с обратным холодильником реакционная смесь полностью превратилась в продукт. Реакционную смесь охладили и разбавили 20 мл EtOAc и 20 мл воды. Высушенный органический слой выпарили до образования масла,которое смешали со смесью гексана/EtOAc, при этом получили 0,21 г 1,0 г (1) и 1,21 г (1,21 экв.) (2) объединили под током азота в 10 мл THF и при комнатной температуре добавили 29,2 мл (5,5 экв.) 1 молярного трет-бутоксида калия в THF. С помощью высокоэффективной жидкостной хроматографии установили, что образовалась смесь оранжевого цвета, затем ее цвет изменился и стал темно-синим и затем зеленым. В момент времени, равный 0, все еще присутствовало 38,4% (1) и 8% продукта. Через 1,5 ч реакционную смесь гасили концентрированной НСl и перемешали в течение 20 ч. Затем 22,3% продукта и 20,2% (1) подвергли экстракции EtOAc(100 мл плюс 25 мл). После промывки реакционной смеси 2 раза 100 мл воды и 25 мл рассола ее сушили(MgSO4) и выпарили, при этом получили 2,71 г неочищенного материала. Неочищенный продукт подвергли очистке колоночной хроматографией, при этом получили 0,38 г продукта ношении компонентов в смеси 4,5/4,5/1,RF=0,65. В предшествующем описании представлены принципы, предпочтительные варианты и порядок действий настоящего изобретения. Однако предложенное для защиты изобретение не следует истолковывать как изобретение,ограниченное раскрытыми здесь конкретными формами, потому что они приведены скорее с целью иллюстрации, чем ограничения. Специалистами в данной области без отклонения от сущности изобретения могут быть сделаны варианты и изменения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где R1 и R2 независимо являются необязательно замещенным 3-индолилом, включающий взаимодействие необязательно замещенного индол 3-ацетамида формулыR11 является СН 3 или Н; в присутствии основания, достаточно сильного для депротонирования амида и метилена в положении С-3 индолил-3-ацетамида. 2. Способ получения соединения формулы Iа где R1 и R2 независимо являются замещенным 3-индолилом, включающий взаимодействие необязательно замещенного индол-3-ацетамида формулыR4 является C1-C4 алкилом; в присутствии основания, достаточно сильного для депротонирования амида и метилена в положении С-3 индолил-3-ацетамида. 3. Способ по п.2, где необязательно замещенным индолил-3-ацетамидом является соединение формулы IIR6 независимо являются водородом, С 1-С 4 алкилом, фенилом, бензилом, или соединяясь с азотом, с которым они связаны, образуют насыщенное или ненасыщенное пяти- или шестичленное кольцо. 4. Способ по п.2, где необязательно замещенным индолил-3-ацетамидом является соединение формулы IIа где Х является необязательно замещенным С 1 С 4-алкиленом. 5. Способ по п.3, где необязательно замещенным индолилглиоксильным реагентом является соединение формулы IIIR7' является водородом, алкилом, галогеналкилом, арилалкилом, алкоксиалкилом, необязательно защищенным гидроксиалкилом,необязательно защищенным аминоалкилом,моноалкиламиноалкилом, диалкиламиноалкилом, или трилкиламиноалкилом или СОО(С 1 С 4-алкилом);(CH2)mNR5R6; и m равно 0, 1, 2 или 3. 6. Способ по п.2, где необязательно замещенный индолил-3-ацетамид и необязательно замещенный глиоксильный реагент вместе образуют соединение формулы IV где W представляет собой необязательно замещенную С 4-С 8-алкиленовую группу, необязательно имеющую внутреннюю эфирную (-O-),амино- (-NH-) или амидную (-СОNН-) связь. 7. Способ по п.6, где указанное соединение имеет формулуR10 является отщепляемой группой, гидрокси или защищенной гидроксигруппой; и индолил-3-гликоксильным реагентом является соединение формулы 9. Способ по п.2, где индолил-3 ацетамидом является соединение формулы и индолил-3-гликоксильным реагентом является соединение формулы 10. Способ по любому из пп.1-9, где основание выбирают из группы, состоящей из алкоксидов щелочного металла, гидрида натрия,диизопропиламида лития или н-бутиллития. 11. Способ по п.10, где R3 является OR4. 12. Способ по п.11, где основанием является гидрид натрия.
МПК / Метки
МПК: A61P 9/00, C07D 207/50
Метки: бисиндолилмалеимидов, синтез
Код ссылки
<a href="https://eas.patents.su/16-1392-sintez-bisindolilmaleimidov.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез бисиндолилмалеимидов</a>
Предыдущий патент: Антитромботические азациклоалкилалканоильные пептиды и псевдопептиды
Следующий патент: Способ получения солей гидроксиламмония.
Случайный патент: Ингибиторы ароматазы и моноклональные антитела против her2 как противоопухолевые агенты












