Сульфониламидные производные в качестве антагонистов брадикининовых рецепторов, их получение и фармацевтическая композиция, их содержащая
Номер патента: 18046
Опубликовано: 30.05.2013
Авторы: Беке Дьюла, Ваштаг Моника, Шмидт Эва, Кешеру Дьёрдь, Ваго Иштван, Фаркаш Шандор, Бозо Эва, Сентирмай Эва, Хорнок Каталин, Елеш Янош
Формула / Реферат
1. Сульфаниламидные производные антагонистов брадикининовых B1-рецепторов формулы (I)
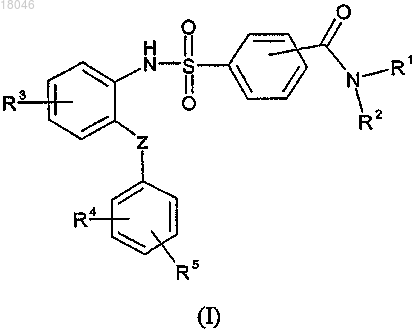
где R1 представляет атом водорода или C1-C4-алкильную группу;
R2 выбирается из (1) атома водорода при условии, что R1 и R2 могут не быть одновременно атомом водорода; (2) -(CH2)n-NRaRb; (3) -(CH2)m-X-Q или
R1 и R2 вместе с атомом азота, к которому они оба присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее от 0 до 1 гетероатома, в дополнение к атому азота, к которому R1 и R2 присоединены, выбранный из N; где указанное кольцо необязательно замещено -(CH2)q-Y-P, 4-(4,5-дигидро-1H-имидазол-2-ил)бензильной, 4-(1,4,5,6-тетрагидропиримидин-2-ил)бензильной или 4-илметилбензамидиновой группой;
R3, R4 и R5 представляют независимо друг от друга атом водорода, атом галогена, аминогруппу, замещенную одной или более C1-C4-алкильной группой, C1-C4-алкокси, трифторметильную или трифторметокси группу;
Z выбирается из (1) атома кислорода или (2) СО группы;
n представляет целое от 1 до 4;
m представляет 0 или число от 2 до 6;
q представляет число от 0 до 4;
Ra и Rb представляют собой (1) атом водорода; (2) линейную или разветвленную C1-C6-алкильную группу;
X представляет собой одинарную связь, -СО- или -CO-NH- или -NH-CO- группу;
Y представляет собой одинарную связь, -СО- или -CONRa группу;
Р представляет (1) -N(C1-C4-алкил)2 группу; (2) -NH-(CH2)n-Het группу; (3) насыщенное, или ароматическое 5-7-членное кольцо, содержащее 1-2 гетероатома, выбранных из О или N; где указанное кольцо необязательно замещено C1-C4-алкильной группой;
Q представляет (1) насыщенное 6-членное кольцо, содержащее 1-2 гетероатома, выбранных из N, указанное кольцо необязательно замещено 1-пиперидиниловой, 1-(C1-C4-алкил)-4-пиперидиниловой, 4-пиперидиниловой, 2-пиримидиниловой, 2-пиразиниловой, 2-пиридиловой, 4-метил-2-пиридиловой, 6-метил-2-пиридиловой или 4-пиридиловой группой; (2) фениловую группу, необязательно замещенную
-(CH2)n-Het, -(CH2)n-NH-C(=NH)-NH2, 4,5-дигидро-1H-имидазол-2-ил или [1,4']бипиперидинил-1'-ил группой; (3) C6 циклоалкильную группу, необязательно замещенную -(CH2)n-Het группой; (4) бензиловую группу, необязательно замещенную -(CH2)n-Het, -(CH2)n-NH-C(=NH)-NH2, 4,5-дигидро-1H-имидазол-2-ил группой; (5) -(CH2)n-Het группу;
Het представляет собой 6-членное гетероциклическое кольцо, содержащее 1 гетероатом N, необязательно замещенное C1-C4-алкильной группой;
и их оптические антиподы или рацематы, и/или соли, и/или гидраты, и/или сольваты.
2. Соединение по п.1, выбранное из группы, состоящей из
дигидрохлорида 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-4-илпиперазин-1-ил)этил]бензамида,
трифторацетата 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-{2-[4-(4,5-дигидро-1Н-имидазол-2-ил)фенил]этил}бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензамида,
4-[2-(3,4-дихлорфенокси)фенилсульфамоил]-N-{2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этил}бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензамида,
4-[2-(4-хлорфенокси)фенилсульфамоил]-N-{2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этил}бензамида,
4-[2-(4-бромфенокси)фенилсульфамоил]-N-{2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этил}бензамида,
N-(4-[1,4']бипиперидинил-1'-илфенил)-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензамида,
транс-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[4-(2-пирролидин-1-илэтил)циклогексил]бензамида,
дигидрохлорида 3-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-4-илпиперазин-1-ил)этил]бензамида,
трифторацетата 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-(2-пиперидин-4-илэтил)бензамида,
трифторацетата 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-2-илпиперазин-1-ил)этил]бензамида,
4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]-N-{2-[4-(4,5-дигидро-1Н-имидазол-2-ил)фенил]этил}бензамида,
гидрохлорида 4-[2-(4-бромфенокси)фенилсульфамоил]-N-(4-гуанидинометилбензил)бензамида,
4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(1'-метил[1,4]бипиперидинил-4-ил)этил]бензамида,
4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-4-илпиперазин-1-ил)пропил]бензамида,
(2-{4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламино}этил)амида пиперидин-4-карбоновой кислоты,
гидрохлорида 4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]-N-(3-пиперидин-4-илпропил)бензамида,
N-(4-[1,4']бипиперидинил-1'-илфенил)-4-(2-феноксифенилсульфамоил)бензамида,
ацетата 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(пиперидин-4-илкарбонил)этил]бензамида,
4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-{2-[4-(6-метилпиридин-2-ил)пиперазин-1-ил]этил}бензамида,
гидрохлорида 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-{2-[(пиперидин-4-илметил)карбамоил]этил}бензамида,
4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-{2-[4-(4-метилпиридин-2-ил)пиперазин-1-ил]этил}бензамида,
гидрохлорида 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(2-пиперидин-4-илэтилкарбонил)этил]бензамида,
N-(4-[1,4']бипиперидинил-1'-илфенил)-4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]бензамида,
трифторацетата N-(3-[1,4']бипиперидинил-1'-ил-3-оксопропил)-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензамида,
4-[2-(3,4-дихлорфенокси)фенилсульфамоил]-N-[4-(2-пирролидин-1-илэтил)циклогексил]бензамида,
4-[2-(3,4-дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-2-илпиперазин-1-ил)этил]бензамида,
4-[2-(3,4-дихлорфенокси)фенилсульфамоил]-N-[3-(4-пиридин-4-илпиперазин-1-ил)пропил]бензамида,
4-[2-(3,4-дихлорфенокси)фенилсульфамоил]-N-{2-[4-(6-метилпиридин-2-ил)пиперазин-1-ил]этил}бензамида,
4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-(3-пиперидин-1-илпропил)бензамида,
N-[2-(3,4-дихлорфенокси)фенил]-4-[4-(3-пиперидин-1-илпропил)пиперазин-1-карбонил]бензолсульфониламида,
4-[2-(4-бромфенокси)фенилсульфамоил]-N-[2-(4-пиридин-2-илметилпиперазин-1-ил)этил]бензамида,
гидрохлорида 4-[2-(4-бромфенокси)фенилсульфамоил]-N-(4-пиперидин-4-илбутил)бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]бензамида,
4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]-N-[4-(2-пирролидин-1-илэтил)циклогексил]бензамида,
4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]-N-[3-(4-пиридин-4-илпиперазин-1-ил)пропил]бензамида,
гидрохлорида 4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]-N-(4-пиперидин-4-илбутил)бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(4-бромфенокси)фенилсульфамоил]бензамида,
4-[2-(4-бромфенокси)фенилсульфамоил]-N-[3-(4-пиридин-4-илпиперазин-1-ил)пропил]бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(2-хлор-4-фторфенокси)фенилсульфамоил]бензамида,
4-[2-(2-хлор-4-фторфенокси)фенилсульфамоил]-N-[4-(2-пирролидин-1-илэтил)циклогексил]бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(4-трифторметилфенокси)фенилсульфамоил]бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(4-хлор-2-метоксифенокси)фенилсульфамоил]бензамида,
гидрохлорида 4-[2-(2-хлор-4-фторфенокси)фенилсульфамоил]-N-(4-пиперидин-4-илбутил)бензамида,
N-(4-[1,4']бипиперидинил-1'-илфенил)-4-[2-(4-трифторметилфенокси)фенилсульфамоил]бензамида,
гидрохлорида 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-(3-пиперидин-4-илпропил)бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(2-хлор-4-метоксифенокси)фенилсульфамоил]бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-(2-феноксифенилсульфамоил)бензамида,
N-(3-[1,4']бипиперидинил-1'-илпропил)-4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]бензамида,
4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]-N-[2-(2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)этил]бензамида,
гидрохлорида 4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]-N-(4-пиперидин-4-илметилбензил)бензамида,
гидрохлорида 4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]-N-(4-пиперидин-4-илбутил)бензамида,
N-(4-[1,4']бипиперидинил-1'-илфенил)-4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]бензамида,
гидрохлорида 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-(4-пиперидин-4-илбутил)бензамида или
N-(2-бензоилфенил)-4-[4-(3-пиперидин-1-илпропил)пиперазин-1-карбонил]бензолсульфониламида.
3. Способ получения соединений формулы (I) по п.1, который включает взаимодействие производного амина формулы (II)
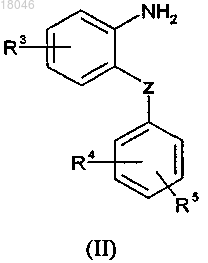
где значения R3, R4 и R5 соответствуют описанным выше для формулы (I),
с сульфонилхлоридом формулы (III)
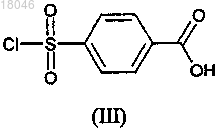
затем взаимодействие полученного таким образом производного фенилсульфамоил бензойной кислоты формулы (IV)
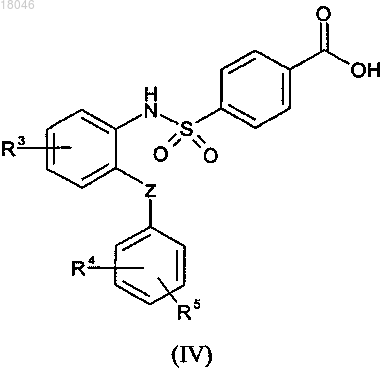
где значения R3, R4 и R5 соответствуют описанным выше,
с производным амина формулы (V)
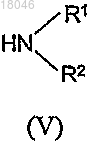
где значения R1 и R2 соответствуют описанным выше,
с получением производного фенилсульфамоил бензамида формулы (I) или его оптических антиподов или рацематов, и/или фармацевтически пригодных солей, и/или гидратов, и/или сольватов.
4. Способ получения соединений формулы (I) по п.3, который включает трансформацию соединения формулы (I) в другое соединение формулы (I) путем введения новых заместителей, и/или модифицирования или удаления старых, и/или солеобразования, и/или выделения соединения из солей.
5. Соединение формулы (V), выбранное из дигидрохлорида N-(4-аминометилбензил)гуанидина, 4-[4-(4,5-дигидро-1H-имидазол-2-ил)бензил]пиперидина и 4-пиперидин-4-илметилбензамидина.
6. Фармацевтическая композиция, обладающая антагонистической активностью в отношении брадикининовых рецепторов, содержащая терапевтически эффективное количество соединения формулы (I) по п.1, или его оптических антиподов, или рацематов либо его фармацевтически пригодных солей, или гидрата, или сольвата и один или более фармацевтически пригодный носитель.
Текст
Изобретение относится к новым сульфониламидным производным формулы (I) где R1-R5 и Z соответствуют, как указано в формуле изобретения, и их оптическим антиподам или рацематам, и/или солям, и/или гидратам, и/или сольватам, которые являются селективными антагонистами брадикинина B1, к способу получения таких соединений и к фармакологическим композициям, их содержащим. СУЛЬФОНИЛАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ БРАДИКИНИНОВЫХ РЕЦЕПТОРОВ, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ Область техники, к которой относится изобретение Настоящее изобретение относится к новым производным сульфониламидов формулы (I) и их оптическим антиподам или рацематам, и/или солям, и/или гидратам, и/или сольватам, которые являются пригодными для лечения или профилактики болевых и воспалительных процессов. Настоящее изобретение также относится к способам получения соединений формулы (I) и к фармакологическим композициям,содержащим такие соединения. Предшествующий уровень техники Кинины представляют собой эндогенные пептиды, вырабатывающиеся в плазме и периферических тканях в ответ на повреждение тканей или инфицирование вследствие каталитического расщепления кининогенов под действием каллекреиновых ферментов. Кинины играют важную роль в патофизиологических процессах, сопровождающихся болью и воспалением. Их биологические эффекты опосредуются двумя сопряженными с G-белком мембранными рецепторами, обозначаемыми B1 и В 2. B1- и В 2 рецепторы были клонированы [Biochem. Biophys. Res. Commun., 184 (1992), 260-268 и J. Biol. Chem., 269(1994), 21583-21586] и механизмы, регулирующие их экспрессию, самоподдержание и сигнальную функцию, находятся в стадии интенсивных изучений [Pharmacol. Rev., 57 (2005), 27-77]. Первая группа кининов, брадикинин (BK) и каллидин (LysBK), преимущественно действуют путем стимуляции нерегулируемо экспрессирующихся и быстро десенсибилизирующихся B2-рецепторов, которые широко распространены во многих тканях. С другой стороны, их активные карбоксипептидазные метаболиты, вторая группа кининов, desArg9BK (DABK) и LysdesArg9BK (LysDABK), активируют индуцируемые и не десенсибилизируемые B1-рецепторы, которые редко экспрессируются при непатологических условиях. Обычно B1-рецепторы быстро образуются после повреждений различного происхождения (травма тканей, инфекции и др.). Таким образом, представляется, что активация B1-рецепторов является частью генерализованного ответа, который включает местную коэкспрессию (в конечном счете, активацию) ферментов, рецепторов, физиологически активных веществ, цитокинов и хемокинов, которые,общеизвестно, играют ключевую роль в реакциях тканей немедленного и замедленного типа на различного вида повреждения. На экспериментальных (животных) моделях было продемонстрировано, что наблюдается переключение доминирования функционирования от В 2 к B1 в хронических воспалительных состояниях. ЕслиB2-рецептор вовлекается в острой фазе воспалительной и болевой реакции, то B1-рецептор включается в хронической фазе этой реакции. Включение кининовых рецепторов в воспалительной и болевой трансдукции подтверждается результатами исследований на мышах с недостаточным уровнем брадикининовых B1-рецепторов. Мыши с дефицитом B1-рецепторов отличались от мышей дикого типа по сенсорным функциям, проявляя повышенные анальгезирующие пороги к вредным химическим и тепловым стимулам и резкое снижение накопления полиморфно-ядерных лейкоцитов в очагах воспаления [PNAS, 97(2000), 8140-8145 и Neuropharmacology. 41 (2001), 1006-1012]. Кроме того, наиболее оригинальной находкой у мышей с дефицитом B1-рецепторов являлось прямое доказательство участия основных кининовых рецепторов в ноцицепции, предполагая, что гипоальгезия, наблюдаемая у мышей с нокаутированными B1-рецепторами, частично возникает вследствие сниженной центральной сенсибилизации в спинном мозге. Тем не менее, независимо от вышеуказанных изменений, B1-нокаутированные мыши явно являлись нормальными без каких-либо видимых патологических изменений. За исключением данных об основной экспрессии B1-рецепторов на периферии, в последнее время все больше данных демонстрируют, что B1-рецепторы нерегулируемо экспрессируются "центрально" в некоторых нейрональных элементах, включая спинной мозг и некоторые высшие структуры, так же. Функция данных рецепторов неясна, но они вовлечены в болевую трансмиссию и гиперальгезию. Следовательно, можно предположить, что антагонисты B1-рецепторов являются пригодными в снятии боли не только через периферические участки, но также, возможно, имеют более широкий спектр анальгезирующих эффектов, если они блокируют центральные B1-рецепторы, помимо всего прочего [NeuroReport, 11Letters. 294 (2000), 175-178]. Исходя из научных данных, брадикининовые рецепторы участвуют в опосредовании боли и гиперальгезии различными способами. Антагонисты B1-рецепторов могут иметь разнообразные механизмы действия. Они имеют (1) непрямые ("периферические") эффекты на ноцицепторы через ингибирование высвобождения других алгогенных медиаторов. N.B. B1-рецепторы, вырабатываемые при воспалительной индукции на клетки, прилегающие к чувствительным нейронам (макрофаги, фибробласты или эндотелиальные клетки), участвуют в высвобождении медиаторов (простогландинов, цитокинов и оксида азота), которые сенсибилизируют или активируют ноцицепторы; (2) прямые ("периферические") эффекты на ноцицепторы, экспрессируя B1-рецепторы (нерегулируемо) или при индукции; и (3) "центральные" эффекты на болевой процесс в поверхностных слоях заднего рога спинного мозга. Таким образом, пероральные активные непептидные антагонисты брадикининовых B1-рецепторов могут являться потенциальными терапевтическими агентами в лечении хронической воспалительной боли. Некоторые патенты и патентные заявки описывают антагонисты брадикининовых B1-рецепторов,которые имеют различные химические структуры. Такие документы представлены, например, в следующих международных патентных заявках: WO 200075107, WO 02076964, WO 04054584, WO 02099388,WO 05004810. Сущность изобретения Авторами изобретения был обнаружен класс производных бензамидов, которые имеют высокое сродство к брадикининовым B1-рецепторам и избирательность по отношению к брадикининовым B2 рецепторам. Избирательность является особенно важным свойством, поскольку намного меньше проявляются нежелательные побочные эффекты соединений. Настоящее изобретение относится к новым сульфониламидным производным формулы (I) где R1 представляет атом водорода или C1-C4-алкильную группу;R2 выбирается из (1) атома водорода при условии, что R1 и R2 могут не быть одновременно атомом водорода; (2) -(CH2)n-NRaRb; (3) -(CH2)m-X-Q илиR1 и R2 вместе с атомом азота, к которому они оба присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее 0-1 гетероатом, в дополнение к атому азота, к которому R1 и R2 присоединены, выбранный из N; где указанное кольцо необязательно замещено -(CH2)q-Y-P, 4-(4,5-дигидро-1 Нимидазол-2-ил)бензильной,4-(1,4,5,6-тетрагидропиримидин-2-ил)бензильной или 4-илметилбензамидиновой группой;R3, R4 и R5 представляют независимо друг от друга атом водорода, атом галогена, аминогруппу, замещенную одной или более C1-C4-алкильной группой, C1-C4-алкокси, трифторметильную или трифторметокси группу;Z выбирается из (1) атома кислорода или (2) СО группы;n представляет целое от 1 до 4;m представляет 0 или число от 2 до 6;q представляет число от 0 до 4;Ra и Rb представляют собой (1) атом водорода; (2) линейную или разветвленную C1-C6-алкильную группу;X представляет собой одинарную связь, -СО- или -CO-NH- или -NH-CO- группу;Y представляет собой одинарную связь, -СО- или -CONRa группу; Р представляет (1) -N(C1-C4-алкил)2 группу; (2) -NH-(CH2)n-Het группу; (3) насыщенное, или ароматическое 5-7-членное кольцо, содержащее 1-2 гетероатома, выбранного из О или N; где указанное кольцо необязательно замещено C1-C4-алкильной группой;Q представляет (1) насыщенное 6-членное кольцо, содержащее 1-2 гетероатома, выбранных N, где указанное кольцо необязательно замещено 1-пиперидиниловой, 1-(C1-C4-алкил)-4-пиперидиниловой,4-пиперидиниловой, 2-пиримидиниловой, 2-пиразиниловой, 2-пиридиловой, 4-метил-2-пиридиловой,6-метил-2-пиридиловой или 4-пиридиловой группой; (2) фениловую группу, необязательно замещеннуюHet представляет собой 6-членное гетероциклическое кольцо, содержащее 1 гетероатом N, необязательно замещенное C1-C4-алкильной группой,и их оптическим антиподам или рацематам, и/или солям, и/или гидратам, и/или сольватам. Изобретение также относится к фармацевтическим композициям, содержащим соединения формулы (I), или их оптические антиподы, или рацематы, или соли, или гидраты, или сольваты в качестве активного ингредиента. Кроме того, целями настоящего изобретения являются синтез соединений формулы (I) и химическое и фармацевтическое производство лекарственных средств, содержащих такие соединения. Подробное описание изобретения Настоящее изобретение относится к новым сульфониламидным производным антагонистов брадикининовых B1-рецепторов формулы (I) где R1 представляет атом водорода или C1-C4-алкильную группу;R2 выбирается из (1) атома водорода при условии, что R1 и R2 могут не быть одновременно атомом водорода; (2) -(CH2)n-NRaRb, (3) -(CH2)m-X-Q илиR1 и R2 вместе с атомом азота, к которому они оба присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее 0-1 гетероатома, в дополнение к атому азота, к которому R1 и R2 присоединены, выбранный из N; где указанное кольцо необязательно замещено -(СН 2)q-Y-P, 4-(4,5-дигидро-1 Нимидазол-2-ил)бензильной,4-(1,4,5,6-тетрагидропиримидин-2-ил)бензильной или 4-илметилбензамидиновой группой;R3, R4 и R5 представляют независимо друг от друга атом водорода, атом галогена, аминогруппу, замещенную одной или более C1-C4-алкильной группой, C1-C4-алкокси, трифторметильную или трифторметоксигруппу;Z выбирается из (1) атома кислорода или (2) СО-группы;n представляет целое от 1 до 4;m представляет 0 или число от 2 до 6;q представляет число от 0 до 4;Ra и Rb представляют собой (1) атом водорода; (2) линейную или разветвленную C1-C6-алкильную группу;X представляет собой одинарную связь, -СО- или -CO-NH- или -NH-CO- группу;Y представляет собой одинарную связь, -СО- или -CONRa группу; Р представляет (1) -N(C1-C4-алкил)2 группу; (2) -NH-(CH2)n-Het группу; (3) насыщенное или ароматическое 5-7-членное кольцо, содержащее 1-2 гетероатома, выбранных из О или N; где указанное кольцо необязательно замещено C1-C4-алкильной группой;Q представляет (1) насыщенное 6-членное кольцо, содержащее 1-2 гетероатома, выбранных из N,где указанное кольцо необязательно замещено 1-пиперидиниловой, 1-(C1-C4-алкил)-4-пиперидиниловой,4-пиперидиниловой, 2-пиримидиниловой, 2-пиразиниловой, 2-пиридиловой, 4-метил-2-пиридиловой,6-метил-2-пиридиловой или 4-пиридиловой группой; (2) фениловую группу, необязательно замещеннуюHet представляет собой 6-членное гетероциклическое кольцо, содержащее 1 гетероатом N, необязательно замещенное C1-C4-алкильной группой,и их оптическим антиподам или рацематам, и/или солям, и/или гидратам, и/или сольватам. Изобретение также относится к фармацевтическим композициям, содержащим соединения формулы (I), или их оптические антиподы, или рацематы, или соли, или гидраты, или сольваты в качестве активного ингредиента. Кроме того, целями настоящего изобретения являются синтез соединений формулы (I) и химическое и фармацевтическое производство лекарственных средств, содержащих такие соединения. Термин "галогеновый" заместитель обозначает атомы фтора, хлора, брома или йода. Термин"C1-C4-алкильная группа", использующийся в настоящем описании, обозначает метиловые, этиловые,нормальные и изопропиловые и различные бутиловые группы. Эти C1-C4-алкильные группы могут быть в составе C1-C4-алкоксигрупп и C1-C4-гидроксиалкильных групп. 4-7-членное гетероциклическое кольцо, в значении R1 и R2, может быть, например, пиперидиновым,пирролидиновым, пиперазиновым, гомопиперазиновым, морфолиновым, тиоморфолиновым и подобным.Het группа может быть, например, пиперидиновой, пирролидиновой, пиперазиновой, гомопиперазиновой, морфолиновой, тиоморфолиновой, пиридиновой, пиримидиновой, пиразиновой и подобной. Насыщенное, частично ненасыщенное или ароматическое 4-7-членное гетероциклическое кольцо в значении Р и Q может быть, например, пиперидиновым, пирролидиновым, пиперазиновым, гомопипера-3 018046 зиновым, морфолиновым, тиоморфолиновым, имидазольным, пиридиновым и т.п. Изобретение относится также к солям соединения формулы (I), образованным с кислотами или основаниями. Как органические, так и неорганические кислоты могут использоваться для образования солей, получаемых посредством добавления кислоты. Пригодными неорганическими кислотами могут быть, например, соляная, серная и фосфорная кислоты. Представителями моновалентных органических кислот могут являться, например, муравьиная, уксусная, трифторуксусная, пропионовая и различные масляные кислоты, валерьяновые и каприновые кислоты. Представителями бивалентных органических кислот могут являться, например, щавелевая, малоновая, малеиновая, фумаровая и янтарная кислоты. Также могут применяться и другие органические кислоты, такие как гидроксикислоты, например лимонная, винная кислоты, или ароматические карбоновые кислоты, например бензойная или салициловая кислота, а также алифатические и ароматические сульфоновые кислоты, например метансульфоновая и птолуолсульфоновая кислота. Особенно значимыми группами солей, получаемых посредством добавления кислоты, являются такие, в которых компонент кислоты сам по себе не обладает терапевтическим эффектом в применяемой дозе или он не оказывает неблагоприятного влияния на действие активного ингредиента. Такие соли, получаемые посредством добавления кислоты, являются фармацевтически пригодными солями присоединения кислот. Причиной, почему соли присоединения кислот, которые не принадлежат к фармацевтически пригодным солям присоединения кислот, принадлежат к настоящему изобретению, является то, что в данном случае они могут быть эффективными в очистке и выделении желаемого соединения. Среди солей, образованных основаниями, особенно значимыми являются соли, образованные щелочными металлами, например натрием, калием, щелочно-земельными металлами, например кальцием и магнием, а также аммонием или органическими аминами. Последние основания могут иметь дополнительные заместители, например гидрокси- или аминогруппы, которые могут оказывать влияние, например, на растворимость и обработку продукта. Соли, образованные основаниями, являются фармацевтически пригодными солями присоединения оснований. Согласно изобретению соединение формулы (I) может быть синтезировано за счет участия в реакции производного амина формулы (II) где значения R3, R4 и R5 соответствуют, как описано выше для формулы (I),вместе с сульфонилхлоридом формулы (III) затем полученное таким образом производное фенилсульфамоил бензойной кислоты формулы (IV) где значения R3, R4 и R5 соответствуют описанным выше,вступает в реакцию с производным амина формулы (V) где значения R1 и R2 соответствуют описанным выше,и полученное производное фенилсульфамоилбензамида формулы (I) в данном случае может быть трансформировано в другое соединение формулы (I) путем включения других заместителей и/или модифика-4 018046 ции или удаления старых, и/или солеобразования, и/или выделения соединения из соли. Реакция сульфонилирования предпочтительно осуществляется в подходящем растворителе предпочтительно в присутствии основания. Реакции выполняются с последующей тонкослойной хроматографией. Необходимое время реакции составляет 6-20 ч. Выделение продукта реакции из реакционной смеси может осуществляться следующими способами. а) Реакционную смесь концентрируют и продукт выделяют путем кристаллизации или экстракции. Если сырье не достаточно чистое, то может использоваться колоночная хроматография для его очистки. Колоночная хроматография выполняется либо на прямой фазе с использованием Kieselgel 60 в качестве адсорбента и различных систем растворителей, например н-гексан/этилацетат, хлороформ/метанол, дихлорметан/этилацетат или хлороформ/ацетон в качестве элюентов, либо на обращенной фазе с использованием заполнителей типаYMC) и ацетонитрил/вода/трифторуксусная кислота или ацетонитрил/вода/уксусная кислота в качестве элюента. б) Реакционную смесь вливают в ледяную воду и выделяют продукт путем фильтрации или экстракции. Сырье кристаллизуют или очищают при помощи колоночной хроматографии, как описано выше. Структуры продуктов определяют с помощью ИК, ЯМР или масс-спектрометрии. Образование амидной связи предпочтительно осуществляется путем получения активного производного карбоновой кислоты формулы (IV), которое вступает в реакцию с амином формулы (V), предпочтительно в присутствии основания. Превращение карбоновой кислоты в активное производное может осуществляться in situ во время образования амидной связи в подходящем растворителе (например, диметилформамиде, ацетонитриле,хлорированных углеводородах или углеводородах или их смесях). Активными производными могут являться хлорангидриды (например, полученные из карбоновой кислоты с тионилхлоридом), смешанные ангидриды (например, полученные из карбоновой кислоты с изобутилхлороформатом в присутствии основания, например триэтиламина), активные сложные эфиры (например, приготовленные из карбоновой кислоты вместе с гидроксибензотриазолом (HOBt) и дициклогексилкарбодиимидом (DCC) или О-бензотриазол-1-ил-N,N,N',N'-тетраметилуронийгексафторфосфатом (HBTU) в присутствии основания,например триэтиламина). Активные производные могут быть получены при температуре в пределе от 0 С до комнатной температуры. К полученному таким образом раствору или суспензии добавляют соответствующий амин формулы (V) или (IX) в виде основания или в виде соли, образованной с неорганической кислотой, в присутствии основания, например триэтиламина, необходимого для выделения амина. Реакции конденсации сопровождаются тонкослойной хроматографией. Необходимое время реакции составляет 6-20 ч. Обработку реакционной смеси проводят различными способами. Если реакционная смесь представляет собой суспензию, то осадок фильтруют, промывают водой и/или органическим растворителем с получением чистого продукта. Если реакционная смесь является раствором на завершающей стадии реакции образования амидной связи, то: а) реакционную смесь концентрируют и остаток кристаллизуют или экстрагируют с подходящим органическим растворителем и в данном случае очищают с помощью колоночной хроматографии. Колоночную хроматографию выполняют на прямой фазе с использованием в качестве адсорбента Kieselgel 60 и в качестве элюентов различных систем растворителей, например толуен/метанол, хлороформ/метанол или толуен/ацетон, или на обращенной фазе с использованием заполнителей типа YMC-Pack ODS-AQ(изготовленных YMC) и системы ацетонитрил/вода/трифторуксусная кислота или ацетонитрил/вода/уксусная кислота в качестве элюента; б) реакционную смесь непосредственно очищают при помощи колоночной хроматографии, как описано выше, с получением чистого продукта. Структуры продуктов определяют путем ИК, ЯМР и масс-спектрометрии. Полученные производные бензамидов формулы (I) - независимо от способа получения - в данном случае могут быть превращены в другое соединение формулы (I) путем введения дополнительных заместителей и/или модификации, и/или удаления существующих заместителей, и/или образования солей с кислотами, и/или выделения бензамидного производного формулы (I) из полученных солей присоединения кислоты путем обработки основанием, и/или свободное сульфониламидное производное формулы (I) может быть превращено в соль путем обработки основанием. Например, соединения формулы (I), содержащие свободную гидроксигруппу, могут быть превращены в ацилоксильные или сульфоксильные производные с помощью различных ацилирующих или сульфонилирующих агентов. Реакции могут осуществляться, например, в хлорированных углеводородах с использованием хлорангидрида или ангидрида кислоты в качестве ацилирующего агента в присутствии основания (например, триэтиламина или карбоната натрия). Сульфониламидные производные формулы(I), содержащие нитрогруппу, могут быть превращены в амины путем восстановления и амины дополнительно могут вступать в реакцию с получением амидов кислоты, как описано для ацилирования гидроксигрупп, или могут быть синтезированы карбаматные производные. Группы сложных эфиров могут быть гидролизованы и полученные свободные карбоновые кислоты могут преобразовываться в амиды при взаимодействии с подходящими производными аминами. Группа N-(трет-бутоксикарбонила) может отщепляться посредством органических или неорганических кислот (например, трифторуксусной кисло-5 018046 ты или хлорида водорода). Цианогруппы могут преобразовываться в амидные, N-гидроксиамидиновые или различные N-содержащие гетероциклические группы. Большинство аминов формулы (V) и сульфонилхлорид формулы (III) являются либо коммерчески доступными, либо могут быть получены различными известными способами. Синтезы некоторых новых аминов формулы (V) описаны в примерах. Следуя этим способам, также могут быть получены другие амины формулы (V). Соединения настоящего изобретения, а также их фармацевтически пригодные соли или гидраты или сольваты могут использоваться отдельно или соответственно в форме фармацевтических композиций. Указанные композиции (лекарственные средства) могут находиться в твердой, жидкой или полужидкой форме и могут быть добавлены фармацевтический адъювант и вспомогательные материалы, стабилизаторы, увлажнители или эмульгирующие агенты, вещества, влияющие на значение рН и осмотическое давление, отдушки или ароматизаторы, а также добавки, такие как разрыхлители или наполнители Доза, необходимая для оказания терапевтического действия, может варьироваться в широких пределах и будет соответствовать индивидуальным требованиям в каждом конкретном случае, в зависимости от стадии болезни, состояния и массы тела пациента, находящегося на излечении, а также от чувствительности пациента к активному ингредиенту, способа введения и числа обработок в день. Точная используемая доза активного ингредиента может быть без труда определена лечащим врачом на основании знаний уровня техники, а также - находящегося на излечении пациента Фармацевтические композиции, содержащие активный ингредиент настоящего изобретения, обычно содержат от 0,01 до 100 мг активного ингредиента в одной дозированной единице. Конечно, возможно, что количество активного ингредиента в некоторых композициях превышает верхние и нижние пределы, определенные выше. Твердыми формами фармацевтических композиций могут являться, например, таблетки, драже,капсулы, пилюли или лиофилизованные порошки в ампулах, пригодные для приготовления инъекций. Жидкими композициями являются инъецируемые и инфузируемые композиции, жидкие лекарственные средства, запаянные жидкости и капли. Полужидкими композициями могут быть мази, бальзамы, кремы,встряхиваемые микстуры и суппозитории. Для простого введения желательно, чтобы фармацевтические композиции включали дозированные единицы, содержащие количество активного ингредиента, которое следует ввести однократно или за несколько раз или половину, третью или четвертую часть от них. Такими дозированными единицами являются, например, таблетки, которые могут быть разделены с помощью канавок, отделяя половину или четверть таблетки для точного введения необходимого количества активного ингредиента. Таблетки могут быть покрыты растворимой в кислоте оболочкой для обеспечения высвобождения содержания активного ингредиента после прохождения через желудок. Такие таблетки являются покрытыми энтеросолюбильной оболочкой. Подобное действие может также достигаться инкапсулированием активного ингредиента. Фармацевтические композиции для перорального введения могут содержать, например, лактозу или крахмал в качестве наполнителей, карбоксиметилцеллюлозу натрия, метилцеллюлозу, поливинилпирролидин или крахмальную пасту в качестве связующих веществ или гранулирующих агентов. Картофельный крахмал или микрокристаллическую целлюлозу добавляют в качестве разрыхляющих агентов, а также могут использоваться ультраамилопектин или формальдегидный казеин. В качестве антиадгезивных и смазывающих средств могут использоваться тальк, коллоидная кремниевая кислота, стеарин, стеарат кальция или магния. Таблетки могут быть получены, например, путем влажного гранулирования с последующим прессованием. Смешанные активные ингредиенты и наполнители, а также в данном случае часть разрыхляющих агентов гранулируют в водном, спиртовом или водно-спиртовом растворе связующего вещества с использованием подходящего оборудования, затем гранулят высушивают. К сухому грануляту добавляют другие разрыхляющие, смазывающие и антиадгезионные агенты и смесь прессуют в таблетку. В данном случае, таблетки изготовляют с канавками, делящими таблетку напополам, для каждого введения. Таблетки могут быть изготовлены прессованием непосредственно из смеси активного ингредиента и нужных вспомогательных веществ. В данном случае таблетки могут быть покрыты с помощью добавок, широко известных в фармацевтической практике, например отдушек, красителей, таких как сахар,производных целлюлозы (метил- или этилцеллюлоза, карбоксиметилцеллюлоза натрия и т.д.), поливинилпирролидона, фосфата кальция, карбоната кальция, пищевых красителей, пищевых настоек, ароматизаторов, пигментов на основе оксида железа и т.д. В случае капсул смесь активного ингредиента и вспомогательных веществ помещают в капсулы. Жидкие пероральные композиции, например суспензии, сиропы, эликсиры, могут быть изготовлены с помощью воды, гликолей, масел, спиртов, красителей и отдушек. Для ректального введения композиция заключается в суппозитории или клизмы. Суппозитории,кроме активного ингредиента, могут содержать носитель, так называемые просуппозитории на основе свиного жира. Носителями могут быть растительные масла, такие как гидрированные растительные мас-6 018046Witepsol). Активный ингредиент гомогенно смешивают с расплавленными просуппозиториями на основе свиного жира и формируют суппозитории. Для парентерального введения композицию составляют в виде инъекционного раствора. Для получения инъекции раствор, состоящий из активных ингредиентов, растворяют в дистиллированной воде и/или в различных органических растворителях, таких как гликолевые эфиры, в данном случае в присутствии растворителей, например полиоксиэтиленсорбитан-монолаурат, -моноолеат или -моностеарат(Tween 20, Tween 60, Tween 80). Инъекционный раствор может также содержать различные вспомогательные вещества, такие как консерванты, например этилендиаминтетраацетат, а также агенты, поддерживающие значение рН, и буферы, и в данном случае местное анестезирующее вещество, например лидокаин. Инъекционный раствор, содержащий активный ингредиент изобретения, фильтруют до наполнения им ампул и стерилизуют после наполнения. Если активный ингредиент гигроскопичен, он может быть затем стабилизирован посредством лиофилизации. Применения. Соединения настоящего изобретения являются антагонистами брадикининовых рецепторов, а именно селективными антагонистами брадикининовых B1-рецепторов, вследствие чего являются пригодными для лечения или профилактики болевых или воспалительных процессов. Соединения могут быть эффективными для лечения боли, включая, например, хроническую боль, особенно боль воспалительного характера, гиперальгезию, костную и суставную боль (остеоартрит), боль из-за повторяющихся движений, мышечно-лицевую боль (мышечная травма, фибромиалгия), висцеральная боль (язвенный колит, панкреатит, цистит, увеит), периоперационную боль (общая хирургия, гинекологическая), послеоперационную боль (послеоперационный болевой синдром), посттравматическую боль (например, растяжения или переломы), невропатическую боль (постгерпетическая невралгия, повреждение нерва, фантомная боль в ампутированных конечностях, мононевропатия, полиневропатия), зубную боль и раковую боль. Кроме того, для лечения боли, связанной со стенокардией, менструацией, диабетической васкулопатией, посткапиллярной резистентностью или симптомами диабета, зависящего от инсулина (например,гипергликемия, диурез, протеинурия и повышенное выделение с мочой нитритов и каллекреина), диабетической гипералгезией. Более того, соединения могут использоваться для лечения болезни Квинке, атеросклероза, септического шока, например в качестве противогиповолемических и/или антигипотензивных агентов, и сепсиса. Они могут применяться как релаксанты гладкой мускулатуры для лечения спазма желудочно-кишечного тракта или матки. Кроме того, соединения настоящего изобретения могут дополнительно применяться в лечении воспалительных нарушений кожи, таких как псориаз и экзема, и повреждений кожи, включая ожог и солнечный ожог (УФ-эритема и боль). Соединения могут использоваться в лечении воспалительной боли различного происхождения (например, ревматоидный артрит, ревматическая болезнь, тендосиновит, заболевание печени, синдром раздраженного кишечника, болезнь Крона,нефрит, аллергический ринит, вазомоторный ринит, увеит, гингивит), аллергий. Такие соединения могут применяться терапевтически для лечения воспалительного заболевания дыхательных путей, например хронического обструктивного заболевания легких, синдрома расстройства дыхания у взрослых, бронхита, пневмонии, астмы. Они могут использоваться для контролирования, ограничения или изменения гиперреактивности дыхательных путей при астме, для лечения наследственной и приобретенной астмы,включая аллергическую астму (атопическую или неатопическую), профессиональную астму, астму, отягощенную вирусной или бактериальной инфекцией, другие неаллергические астмы, синдром "бронхита новорожденных", а также вызванный физической нагрузкой бронхостеноз. Они могут быть эффективными против пневмокониоза, включая алюминиевый пневмокониоз, антракоз, асбестовый пневмокониоз,вызванный вдыханием пыли пневмокониоз, птилоз, сидероз, силикоз, табачный пневмокониоз и пневмокониоз от вдыхания хлопковой пыли. Дополнительно, они могут являться эффективными для некоторых неврологических нарушений, например, против рассеянного склероза, болезни Альцгеймера, эпилепсии,отека мозга, головной боли, включая сильную приступообразную головную боль с периодическими рецидивами, мигрени, включая профилактику и применение в период приступа, а также закрытой травмы головы. Биологическое определение. Функциональный анализ. Оценка активности антагониста на B1- и B2-рецепторах in vitro путем измерения цитоплазматической концентрации ионов кальция флуориметрическим счетчиком в клетках, экспрессирующих рекомбинантные человеческие B1- или B2-рецепторы. Культура клеток. Клетки яичника китайского хомяка (СНО-клетки), стабильно экспрессирующие рекомбинантные человеческие B1-рецепторы (СНО-B1, Euroscreen) или В 2-рецепторы (СНО-В 2, Perkin-Elmer), культивировали в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% фетальную телячью сыворотку (FCS), 100 U/мл пенициллина, 0,1 мг/мл стрептомицина, 0,25 мкг/мл амфотерицина В, 1% минимальную эссенциальную среду Игла (MEM), раствор неэссенциальных аминокислот,-7 018046 600 мкг/мл G418, 1% пируват (для В 2-клеточной линии). Клетки хранили при 37 С во влажной камере в атмосфере, содержащей 5% СО 2 и 95% воздуха, и пересевали 1:4 три раза в неделю. Клетки высеивали в концентрации 1,5-2,5104 клеток/лунку на 96-луночные микропланшеты, измерения цитоплазматической концентрации ионов кальция ([Са 2+]) осуществляли через 1-2 дня после высеивания. Флуориметрическое измерение цитоплазматической концентрации кальция. Измерения [Са 2+] выполняли на СНО-B1 и СНО-В 2 клетках, стабильно экспрессирующих человеческие B1- и B2-рецепторы соответственно. Клетки выращивали в стандартных 96-луночных микропланшетах и перед измерением нагружали флуоресцентным Са 2+-чувствительным красителем, fluo-4/AM(2 мкм): после удаления культуральной среды к клеткам добавляли краситель (растворенный в аналитическом буфере: 145 мМ NaCl, 5 мМ KCl, 2 мМ MgCl2, 2 мМ CaCl2, 10 мМ HEPES, 20 мМ D-глюкозы,2 мМ пробенецида, 100 мкл/лунку) и клетки инкубировали при 37 С во влажной камере в атмосфере,содержащей 5% СО 2 и 95% воздуха, в течение 40-120 мин. Для прекращения окрашивания нагруженные клетки дважды промывали аналитическим буфером. После промывания, в зависимости от экспериментальной установки, в каждую лунку добавляли тестируемые соединения с различными концентрациями(разведенные во внеклеточном буфере из основного раствора DMSO, итоговая концентрация DMSO составляла 0,1%) или буфер. После инкубации при 37 С в течение 20-25 мин измеряли исходный уровень и вызванные агонистом изменения концентрации [Ca2+]i по столбцам с помощью ячеечного флуориметрического счетчика (Fluoroskan Ascent, Labsystems). Возбуждение и определение поглощения осуществляли со дна лунки. Используемые фильтры для Fluo-4: возбуждающий фильтр - 485 нм, поглощающий фильтр - 538 нм. Всю процедуру измерения проводили при 37 С и под контролем специального программного обеспечения. Ингибирующая способность тестовых соединений оценивалась посредством измерения снижения в повышении [Са 2+]i, вызванного агонистами, в присутствии различных концентраций соединений. Агонистами являлись LysDABK для СНО-B1 и брадикинин для СНО-В 2 клеток. Агонисты применялись при концентрации EC80, при этом уровни EC80 определяли из ежедневно установленных кривых дозовой зависимости. Данные о флуоресценции выражали как F/F (изменение флуоресценции по отношению к исходному значению). Все обработки на одной планшете измеряли в многочисленных лунках. Данные из всех лунок с одинаковыми обработками усредняли и для анализа использовали средние значения. Ингибирующую способность соединения в точке единичной концентрации выражали как ингибирование в процентах отклика на контрольный агонист. Сигмоидальные кривые концентрацияингибирование соответствовали данным (полученным по меньшей мере из трех независимых исследований) и IC50-значения определяли как концентрацию, которая вызывает половину от максимального ингибирования, вызванного соединением. Исследуемыми исходными соединениями, измеренными в функциональном тесте и тесте связывания, являются следующие: 1) 4-2-[(2,2-дифенилэтил)амино]-5-4-[4-[(4-метил-1-пиперазинил)карбонил]-1-пиперидинил]сульфонилбензоилморфолин (NVP-SAA164, Br. J. Pharmacol. 144 (2005), 889-899); Ki 8 нМ; IC50: 33 нМ; 2)(R)-N-[2,3-дигидро-2-оксо-5-(2-фенилэтил)-1-пропил-1H-1,4-бензодиазепин-3-ил]-N'-4-[4-(4 пиридинил)-1-пиперазинил]фенилмочевина (J. Med. Chem. 46 (2003), 1803-1806); Ki 0,59 нМ; IC50 1,9 нМ; 3) N-[4-(4'-бипиперидин)-1'-илфенил]-N'-[(3R)-2,3-дигидро-5-(4-метилфенил)-2-оксо-1-пропил-1 Н 1,4-бензодиазепин-3-ил]мочевина (J. Med. Chem. 46 (2003), 1803-1806); Ki 13,4 нМ; IC50 64,5 нМ. Величины Ki и IC50, измеренные авторами, для исходных соединений хорошо согласуются с величинами, приведенными в литературе. В табл. 1 перечислены наиболее эффективные соединения данного изобретения, измеренные в функциональном анализе. Анализы рецепторного связывания. 1. Связывание человеческих рекомбинантных B1-рецепторов брадикинина. Анализы связывания выполняли на человеческих рекомбинантных BR1 (брадикин) рецепторахES-091). 20 мкг протеина на пробирку инкубировали с [3,4-пролил-3,4-3H(N)]-[Des-Arg10]каллидином в качестве радиолиганда. Неспецифическое связывание определяли в присутствии 10 мкМ Lys-des-Arg9 брадикинина. Итоговый инкубационный объем составлял 250 мкл. Образцы инкубировали в течение 15 мин при 25 С, затем быстро фильтровали под вакуумом через фильтры GF/B, предварительно вымоченных в течение по меньшей мере 1 ч в 0,5% PEI Радиоактивность определяли с помощью жидкостной сцинтилляционной спектроскопии. В табл. 2 приведены наиболее эффективные соединения данного изобретения, измеренные в анализе связывания. 2. Связывание человеческих рекомбинантных В 2-рецепторов брадикинина. Анализы связывания выполняли на человеческих рекомбинантных брадикинин 2 рецепторах (экспрессирующихся в СНО-клетках) в соответствии с техническим паспортом биологических рецепторов(Cat. No. RBHB2M) с небольшими модификациями. 8,4 мкг протеина на пробирку инкубировали с[2,3-пролил-3,4-3 Н(N)]брадикинином в качестве радиолиганда. Неспецифическое связывание определяли в присутствии 5 мкМ брадикинина. Итоговый инкубационный объем составлял 200 мкл. Образцы инкубировали в течение 90 мин при 4 С, затем быстро фильтровали под вакуумом через фильтры GF/B, предварительно вымоченные в течение по меньшей мере 1 ч в 0,5% PEI. Радиоактивность определяли с помощью жидкостной сцинтилляционной спектроскопии. Соединения проявляли более высокое сродство и избирательность (50-кратно) для человеческогоB1-рецептора по сравнению с человеческим B2-рецептором в обоих функциональном анализе и анализе связывания. Синтез соединений и фармацевтических композиций по изобретению иллюстрируется следующими неограничивающими примерами. Справочный пример 1. 2-(4-Пиридин-4-илпиперазин-1-ил)этиламин. а) 2-[2-(4-Пиридин-4-илпиперазин-1-ил)этил]изоиндол-1,3-дион. Смесь из 1-пиридин-4-илпиперазина [Org. Lett. 4 (2002), 737-740] (1,0 г, 6,12 ммоль),N-(2-бромэтил)фталимида (1,71 г, 6,74 ммоль), карбоната калия (0,85 г, 6,12 ммоль), калия йодида (1,02 г,6,12 ммоль) и диметилформамида (10 мл) перемешивали при 70 С в течение 24 ч, затем концентрировали. Остаток растворяли в воде, экстрагировали дихлорметаном, органический слой высушивали над сульфатом натрия, фильтровали и концентрировали. Сырье очищали с помощью колоночной хроматографии, используя Kieselgel 60 (0,040-0,063 мм) (Merck) в качестве адсорбента, и системы хлороформ:метанол:аммония гидроксид = 10:1:0,1 в качестве элюента с получением 1,52 г (74%) названного соединения, в виде белого твердого вещества.b) 2-(4-Пиридин-4-илпиперазин-1-ил)этиламин. Перемешиваемую смесь из 2-[2-(4-пиридин-4-илпиперазин-1-ил)этил]изоиндол-1,3-диона (1,52 г,4,52 ммоль), этанола (47,5 мл), воды (2,55 мл) и гидразингидрата (98%, 0,438 мл, 9,04 ммоль) кипятили в течение 3 ч, затем охлаждали и разбавляли диэтиловым эфиром (100 мл). Осажденные кристаллы отфильтровывали, промывали диэтиловым эфиром и фильтрат концентрировали. Остаток растворяли N гидроксидом натрия (25 мл), экстрагировали дихлорметаном (425 мл). Объединенные органические слои промывали соленой водой (25 мл), высушивали над сульфатом натрия, фильтровали и концентрировали с получением 0,58 г (62%) названного соединения в виде бесцветного масла.a) 4-[2-(1,3-Диоксо-1,3-дигидроизоиндол-2-ил)этил]бензонитрил. В атмосфере аргона раствор из 4-(2-гидроксиэтил)бензонитрила [Helv. Chim. Acta 64 (1981), 16881703] (4,49 г, 30,5 ммоль), фталимида (4,94 г, 33,55 ммоль), трифенилфосфина (8,8 г, 33,55 ммоль) и диметилформамида (100 мл) перемешивали при 0 С в течение 20 мин, затем по каплям добавляли диэтилазодикарбоксилат (7,59 мл, 48,8 ммоль) при 0 С. Полученную таким образом реакционную смесь перемешивали при комнатной температуре всю ночь, затем вливали в ледяную воду (740 мл). Осажденный продукт отфильтровывали, промывали водой и высушивали. Сырье перекристаллизовывали из 2-пропанола с получением 7,83 г (93%) названного соединения в виде желтого твердого вещества.b) 2-2-[4-(4,5-Дигидро-1 Н-имидазол-2-ил)фенил]этилизоиндол-1,3-дион. Сухой хлороводородный газ барботировали через ледяной раствор 4-[2-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)этил]бензонитрила (7,83 г, 28,3 ммоль) в этаноле (400 мл) в течение 3 ч, затем полученную таким образом смесь хранили при 8 С всю ночь. Реакционную смесь концентрировали в вакууме, остаток растворяли в сухом этаноле (400 мл), добавляли этилендиамин (2,50 мл, 29,7 ммоль) и реакционную смесь перемешивали при комнатной температуре всю ночь. Смесь концентрировали в вакууме, остаток разделяли между дихлорметаном (400 мл) и концентрировали с гидроксидом аммония(400 мл), разделяли фазы и водную фазу экстрагировали дихлорметаном (2200 мл). Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Сырье перекристаллизовывали из 2-пропанола с получением 5,58 г (62%) названного соединения в виде белого твердого вещества. с) Дигидрохлорид 2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этиламина. Смесь из 2-2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этилизоиндол-1,3-диона (5,58 г,17,47 ммоль), этанола (140 мл) и гидразингидрата (98%, 6,57 мл, 135,4 ммоль) перемешивали при комнатной температуре в течение 2 ч, затем концентрировали в вакууме. Остаток разделяли между дихлорметаном (250 мл) и N гидроксидом натрия (250 мл), фазы разделяли и водную фазу экстрагировали дихлорметаном (6250 мл). Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Сырье растворяли в метаноле (15 мл), рН раствора доводили до 5 путем добавления метанолового раствора хлорида водорода, затем смесь перемешивали при комнатной температуре в течение 1 ч. После добавления диэтилового эфира (200 мл) суспензию перемешивали при 0 С в течение 2 ч. Осажденные кристаллы отфильтровывали, промывали диэтиловым эфиром и высушивали с получением 4,11 г (90%) названного соединения в виде белого твердого вещества. Справочный пример 3. Тригидрохлорид (3-[1,4']бипиперидинил-1'-ил)пропиламина.a) трет-Бутиловый эфир (3-[1,4']бипиперидинил-1'-илпропил)карбаминовой кислоты. Смесь 4-пиперидинопиперидина (Aldrich) (2,50 г, 11,88 ммоль), трет-бутилового эфира (3-бромпропил)карбаминовой кислоты [Eur. J. Med. Chem. Chim. Ther. 37 (2002), 573-584] (3,96 г, 16,63 ммоль),диметилформамида (130 мл) и карбоната калия (1,64 г, 11,88 ммоль) перемешивали при комнатной температуре всю ночь, затем концентрировали в вакууме. Остаток растворяли в воде (150 мл), экстрагировали дихлорметаном (3150 мл), объединенные органические слои промывали соленой водой (150 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Сырье очищали колоночной хроматографией, используя Kieselgel 60 (0,040-0,063 мм) (Merck) в качестве адсорбента, и систему хлороформ:метанол:аммония гидроксид = 10:1:0,1 в качестве элюента с получением 2,527 г (59%) названного соединения в виде масла.b) Тригидрохлорид (3-[1,4']бипиперидинил-1'-илпропиламина. Смесь трет-бутилового эфира (3-[1,4']бипиперидинил-1'-илпропил)карбаминовой кислоты (2,515 г,6,6 ммоль), сухого диоксана (40 мл) и 6,5 N хлорид водорода в диоксане (22 мл) перемешивали при комнатной температуре всю ночь, затем разбавляли диэтиловым эфиром и перемешивали при 0 С в течение 1 ч. Осажденные кристаллы отфильтровывали, промывали диэтиловым эфиром и высушивали с получением 2,503 г (92%) названного соединения в виде бежевого твердого вещества. Справочный пример 4. Дигидрохлорид транс-4-(2-пирролидин-1-илэтил)циклогексиламина. а) Транс-2-1-[4-(N-трет-бутоксикарбонил)амино]циклогексилэтанол. Раствор из метилового эфира транс-2-1-[4-(N-трет-бутоксикарбонил)амино]циклогексилуксусной кислоты [J. Med. Chem. 43 (2000) 1878-1885] (28,5 г, 105,2 ммоль) в сухом тетрагидрофуране (500 мл) охлаждали до -2 С, добавляли порционно литийалюминийгидрид (5,4 г, 142 ммоль) и смесь перемешивали при -2 С в течение 60 мин. Реакционную смесь охлаждали до -10 С и гасили в этилацетате (15 мл),затем к смеси медленно добавляли соленую воду (43 мл) при 0 С. Осажденные соли фильтровали и промывали этилацетатом. Фильтрат концентрировали в вакууме. Остаток перекристаллизовывали диизопропиловым эфиром (100 мл) с получением 23,7 г (93%) названного соединения в виде белого порошка.(15 г, 62 ммоль) и триэтиламина (10,5 мл, 75 ммоль) в сухом дихлорметане (150 мл) по каплям добавляли метансульфонилхлорид (5,7 мл, 73,4 ммоль) в дихлорметане (25 мл) при 0 С. После перемешивания в течение 30 мин при 0 С, раствор экстрагировали три раза водой. Органический раствор высушивали над сульфатом натрия и концентрировали в вакууме с выходом 13,0 г (65%) названного соединения.c) трет-Бутиловый эфир транс-[4-(2-пирролидин-1-илэтил)циклогексил]карбаминовой кислоты. Смесь транс-2-(4-трет-бутоксикарбониламиноциклогексил)этилового эфира метансульфоновой кислоты (3,2 г, 10 ммоль), карбоната калия (1,4 г, 10 ммоль) и пирролидина (1,25 мл, 15 ммоль) в ацетонитриле (40 мл) перемешивали при 60 С в течение 2 ч. Смесь охлаждали до комнатной температуры и вливали в воду (200 мл). Осажденные белые кристаллы отфильтровывали и промывали водой с выходом 1,9 г (64%) названного соединения.d) Транс-4-(2-пирролидин-1-илэтил)циклогексиламина дигидрохлорид. Названное соединение получали из трет-бутилового эфира транс-[4-(2-пирролидин-1 илэтил)циклогексил]карбаминовой кислоты по способу, описанному в справочном примере 3b. Справочный пример 5. Гидрохлорид (4-метилпиперазин-1-ил)пиперидин-4-илметанона. а) трет-Бутиловый эфир 4-(4-метилпиперазин-1-карбонил)пиперидин-1-карбоновой кислоты. Раствор из 1-(трет-бутоксикарбонил)-4-пиперидинкарбоновой кислоты (Aldrich) (21,88 г,95,4 ммоль), триэтиламина (13,3 мл, 95,4 ммоль) и HBTU [гексафторфосфат О-бензотриазол-1-илN,N,N',N'-тетраметилмочевины (Advanced Chem. Tech.)] (38,36 г, 101,0 ммоль) в сухом диметилформамиде (100 мл) перемешивали при комнатной температуре в течение 5 мин перед добавлениемN-метилпиперазина (10,6 мл, 95,5 ммоль). рН реакционной смеси доводили до 8 путем добавления триэтиламина, полученную таким образом смесь перемешивали при комнатной температуре всю ночь, затем концентрировали в вакууме. Остаток обрабатывали насыщенным раствором гидрогенкарбоната натрия(350 мл), экстрагировали этилацетатом (3250 мл). Объединенные органические слои промывали насыщенным раствором гидрокарбоната натрия, водой и соленой водой, высушивали над сульфатом натрия,фильтровали и концентрировали. Остаток очищали колоночной хроматографией, используя Kieselgel 60b) Гидрохлорид (4-метилпиперазин-1-ил)пиперидин-4-илметанона. Названное соединение получали из трет-бутилового эфира 4-(4-метилпиперазин-1 карбонил)пиперидин-1-карбоновой кислоты по способу, описанному в справочном примере 3b. Справочный пример 6. Тетрагидрохлорид 2-(4-пиридин-2-илпиперазин-1-ил)этиламина.a) Тригидрохлорид 2-(4-пиридин-2-илпиперазин-1-ил)этанола. Перемешиваемую смесь из 1-(2-пиридил)пиперазина (Aldrich) (4,6 мл, 30 ммоль), 2-бромэтанола(2,55 мл, 35 ммоль), карбоната калия (4,8 г, 35 ммоль) и 1-бутанола (60 мл) кипятили всю ночь, затем добавляли дополнительное количество 2-бромэтанола (2,55 мл, 35 ммоль) и смесь кипятили в течение 24 ч. После охлаждения до комнатной температуры осажденные соли отфильтровывали, промывали этилацетатом и фильтрат концентрировали. Остаток растворяли в этилацетате (150 мл) и экстрагировали водой (150 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток растворяли в диэтиловом эфире (100 мл), рН раствора доводили до 5 путем добавления раствора из хлорида водорода в этилацетате, затем смесь перемешивали при комнатной температуре в течение 1 ч. После добавления диэтилового эфира (150 мл) суспензию перемешивали при 0 С в течение 2 ч, осажденные кристаллы отфильтровывали, промывали диэтиловым эфиром и высушивали с получением 4,8 гb) 2-[2-(4-Пиридин-2-илпиперазин-1-ил)этил]изоиндол-1,3-дион. Названное соединение получали из 2-(4-пиридин-2-илпиперазин-1-ил)этанола (выделенного из соли тригидрохлорида с 10% раствором гидроксида натрия и экстрагированного дихлорметаном) по способу,описанному в справочном примере 2 а. с) Тетрагидрохлорид 2-(4-пиридин-2-илпиперазин-1-ил)этиламина. Названное соединение получали из 2-[2-(4-пиридин-2-илпиперазин-1-ил)этил]изоиндол-1,3-диона по способу, описанному в справочном примере 2 с. Справочный пример 7. Дигидрохлорид N-(4-аминометилбензил)гуанидина.a) трет-Бутиловый эфир (4-(N,N'-ди-трет-бутоксикарбонил-гуанидинометилбензилкарбаминовой кислоты. Смесь из трет-бутилового эфира (4-аминометилбензил)карбаминовой кислоты (Aldrich) (0,47 г,2 ммоль), 1-метил-ди-трет-бутокситиомочевины [J. Org. Chem. 52 (1987), 1700-1703] (0,6 г, 2 ммоль),HgCl2 (0,56 г, 2 ммоль) и диметилформамида (10 мл) перемешивали при комнатной температуре в течение 48 ч. Осажденные соли профильтровывали и фильтрат s концентрировали в вакууме. Остаток масла растворяли в хлороформе (70 мл), промывали водой (340 мл), высушивали над сульфатом натрия и концентрировали с выходом 0,65 г (68%) названного соединения.b) Дигидрохлорид N-(4-аминометилбензил)гуанидина. Названное соединение получали из трет-бутилового эфира (4-(N,N'-ди-трет-бутоксикарбонилгуанидинометилбензилкарбаминовой кислоты по способу, описанному в справочном примере 3b. Справочный пример 8. 4-[4-(4,5-Дигидро-1H-имидазол-2-ил)бензил]пиперидин.a) Диэтиловый эфир (4-цианобензил)фосфоновой кислоты. Смесь 4-цианобензилбромида (41,8 г, 0,213 моль) и триэтилфосфита (42 мл, 0,244 моль) перемешивали во флаконах, оснащенных ловушкой Дина-Старка, при 150 С в течение 6 ч, затем реакционную смесь подвергали фракционированию в вакууме с получением 52,52 г (97%) названного соединения.b) 4-(1-Бензилпиперидин-4-илиденметил)бензонитрил. В атмосфере аргона к перемешиваемой смеси из N-бензил-4-пиперидона (Aldrich) (26,0 г,0,137 моль) и диэтилового эфира (4-цианобензил)фосфоновой кислоты (36,6 г, 0,1445 моль) в диметилформамиде (260 мл) добавляли гидрид натрия (60%, 7,8 г, 0,195 моль) при 0 С. Реакционную смесь перемешивали при комнатной температуре всю ночь, затем добавляли по каплям этанол (10 мл), полученную таким образом смесь вливали в воду (300 мл) и экстрагировали диэтиловым эфиром (3300 мл). Органический слой высушивали над сульфатом натрия и концентрировали. Остаток очищали с помощью колоночной хроматографии, используя Kieselgel 60 (0,040-0,063 мм) (Merck) в качестве адсорбента, и систему н-гексан:этилацетат = 2:1 в качестве элюента с получением 34,65 г (87%) названного соединения в виде масла.(10 мл) и 6 М хлорида водорода в этаноле (300 мл) перемешивали при комнатной температуре в течение 48 ч. Раствор концентрировали в вакууме, оставшееся твердое вещество тщательно растворяли в этаноле(400 мл) и концентрировали в вакууме с получением 16,4 г (92,54%) названного соединения, которое использовалось в следующих этапах без дополнительной очистки.d) 1-Бензил-4-[4-(4,5-дигидро-1 Н-имидазол-2-ил)бензилиден]пиперидин. К раствору из этилового эфира 4-(1-бензилпиперидин-4-илиденметил)бензимидиновой кислоты(6,8 г, 18,3 ммоль) в этаноле (250 мл) добавляли этилендиамин (2,545 мл, 36,6 ммоль) и смесь перемешивали при комнатной температуре всю ночь. Осажденное твердое вещество отфильтровывали и фильтрат концентрировали в вакууме. Остаток тщательно растворяли в этаноле (100 мл) и концентрировали в вакууме. Сырье очищали с помощью флэш-хроматографии, используя систему хлороформ:метанол:аммония гидроксид = 9:2:0,1 в качестве элюента с получением 2,57 г (44,6%) названного соединения.e) 4-[4-(4,5-Дигидро-1H-имидазол-2-ил)бензил]пиперидин. К перемешиваемому раствору из 1-бензил-4-[4-(4,5-дигидро-1H-имидазол-2-ил)бензилиден]пиперидина (0,1 г, 0,3 ммоль) в этаноле (20 мл) добавляли формат аммония (0,19 г, 3 ммоль) и 10% Pd/C(20 мг), смесь кипятили в течение 8 ч. Катализатор отфильтровывали и фильтрат концентрировали в вакууме. Оставшийся сырьевой материал очищали с помощью колоночной хроматографии, используя основной оксид алюминия (150 меш, Aldrich) в качестве адсорбента и 10% метанол в хлороформе в качестве элюента с получением 68 мг (92%) названного соединения. Справочный пример 9. 4-Пиперидин-4-илметилбензамидин.a) 4-(1-Бензилпиперидин-4-илиденметил)бензамидин. Названное соединение получали из этилового эфира 4-(1-бензилпиперидин-4 илиденметил)бензимидиновой кислоты и метанолового аммония по способу, описанному в справочном примере 8d.b) 4-Пиперидин-4-илметилбензамидин. Названное соединение получали из 4-(1-бензилпиперидин-4-илиденметил)бензамидина по способу,описанному в справочном примере 8 е. Справочный пример 10. 2-(4-Пиперидин-4-илметилфенил)-1,4,5,6-тетрагидропиримидин. а) 2-[4-(1-Бензилпиперидин-4-илиденметил)фенил]-1,4,5,6-тетрагидропиримидин. Названное соединение получали из этилового эфира 4-(1-бензилпиперидин-4 илиденметил)бензимидиновой кислоты и 1,2-диаминопропана по способу, описанному в справочном примере 8d.b) 2-(4-Пиперидин-4-илметилфенил)-1,4,5,6-тетрагидропиримидин. Названное соединение получали из 2-[4-(1-бензилпиперидин-4-илиденметил)фенил]-1,4,5,6 тетрагидропиримидина по способу, описанному в справочном примере 8 е. Справочный пример 11. 2-(4-Пиридин-4-илпиперазин-1-ил)пропиламин.a) 2-[2-(4-Пиридин-4-илпиперазин-1-ил)пропил]изоиндол-1,3-дион. Названное соединение получали из 1-пиридин-4-илпиперазина [Org. Lett. 4 (2002), 737-740] иb) 2-(4-Пиридин-4-илпиперазин-1-ил)пропиламин. Названное соединение получали из 2-[2-(4-пиридин-4-илпиперазин-1-ил)пропил]изоиндол-1,3 диона по способу, описанному в справочном примере 1b. Справочный пример 12. трет-Бутиловый эфир 4-(4-аминобутил)пиперидин-1-карбоновой кислоты.a) трет-Бутиловый эфир 4-(3-метансульфонилоксипропил)пиперидин-1-карбоновой кислоты. К раствору трет-бутилового эфира 4-(3-гидроксипропил)пиперидин-1-карбоновой кислоты (2,12 г,8,7 ммоль) в дихлорметане (10 мл) добавляли триэтиламин (1,33 мл, 9,57 ммоль) и метансульфонилхлорид (0,74 мл, 9,57 ммоль) при 0 С и реакционную смесь перемешивали при этой температуре в течение 1 ч. После тушения реакции метанолом (1 мл) смесь промывали водой, насыщали раствором гидрогенкарбоната и воды, высушивали над сульфатом натрия, фильтровали и концентрировали с получением 2,73 г (97%) названного соединения.b) трет-Бутиловый эфир 4-(3-цианопропил)пиперидин-1-карбоновой кислоты. К раствору трет-бутилового эфира 4-(3-метансульфонилоксипропил)пиперидин-1-карбоновой кислоты (1,35 г, 4,2 ммоль) в диметилформамиде (30 мл) добавляли цианид калия (0,33 г, 5,1 ммоль) и реакционную смесь перемешивали при 80 С в течение 20 ч. После концентрирования в вакууме остаток обрабатывали водой и экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали водой и соленой водой, высушивали над сульфатом натрия, фильтровали и концентрировали с выходом 0,919 г (87%) названного соединения.c) трет-Бутиловый эфир 4-(4-аминобутил)пиперидин-1-карбоновой кислоты. К перемешиваемому раствору из трет-бутилового эфира 4-(3-цианопропил)пиперидин-1 карбоновой кислоты (0,896 г, 3,55 ммоль) и гидрата гидроксида лития (0,447 г, 10,65 ммоль) в смеси диоксана (56 мл) и воды (14 мл) добавляли 10% Pd/C (90 мг) и никель Ренея (0,42 г). Реакционную смесь гидрогенизировали при 50 С в течение 3 ч, затем катализаторы отфильтровывали и фильтрат концентрировали. Остаток очищали с помощью колоночной хроматографии, используя Kieselgel 60(0,33 г, 5,1 ммоль) и реакционную смесь перемешивали при 80 С в течение 20 ч. После концентрирования в вакууме остаток обрабатывали водой и экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали водой и соленой водой, высушивали над сульфатом натрия, фильтровали и концентрировали с выходом 1,08 г (96%) названного соединения. МС (ЭУ) 291,3 (M+Na+).b) трет-Бутиловый эфир 4-(3-аминопропил)пиперидин-1-карбоновой кислоты. К раствору трет-бутилового эфира 4-(3-азидопропил)пиперидин-1-карбоновой кислоты (1,738 г,6,48 ммоль) в сухом тетрагидрофуране (50 мл) добавляли воду (0,49 мл) и трифенилфосфин (3,4 г,12,96 ммоль). Реакционную смесь перемешивали при комнатной температуре всю ночь, затем концентрировали. Остаток очищали с помощью колоночной хроматографии, используя Kieselgel 60(0,015-0,040 мм) (Merck) в качестве адсорбента и систему метанол:гидроксид аммония = 10:1 в качестве элюента с выходом 1,498 г (95%) названного соединения. МС (ЭУ) 243,2 (МН+). Справочный пример 14. Три-трифторацетат 2-(1'-метил[1,4']бипиперидинил-4-ил)этиламин. а) трет-Бутиловый эфир [2-(1'-метил[1,4']бипиперидинил-4-ил)этил]карбаминовой кислоты. К раствору из триэтиламина (44 мг, 0,44 ммоль) в сухом этаноле (5 мл) добавляли трет-бутиловый эфир (2-пиперидин-4-илэтил)карбаминовой кислоты [Bioorg. Med. Chem. Lett.; 11 (2001), 2325-2330](300 мг, 0,44 ммоль), титан(IV)изопропроксид (125 мг, 0,44 ммоль) и N-метилпиперидон (50 мг, 0,44 ммоль). Реакционную смесь перемешивали при 25 С в течение 20 ч, затем добавляли борогидрид натрия(17 мг, 0,44 ммоль) и готовую смесь дополнительно перемешивали при 25 С в течение 24 ч. Затем реакцию гасили путем вливания смеси в 2 N водный аммиак (0,66 мл), полученный неорганический осадок отфильтровывали и промывали дихлорметаном и водный фильтрат экстрагировали дихлорметаном. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии, используя Kieselgel 60 (0,040-0,063 мм)[2-(1'-метил[1,4']бипиперидинил-4 ил)этил]карбаминовой кислоты (77 мг, 0,236 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (0,15 мл) и реакционную смесь перемешивали при комнатной температуре всю ночь, затем концентрировали в вакууме с получением 127 мг (95%) названного соединения. МС (ЭУ) 226,4 (МН+). Справочный пример 15. 2-(4-Пиридин-2-илметилпиперазин-1-ил)этиламин.a) (4-Пиридин-2-илметилпиперазин-1-ил)ацетонитрил. К перемешиваемому раствору 1-(2-пиридилметил)пиперазин (EMKA-Chemie) (309 мг, 1,69 ммоль) в этаноле (10 мл) добавляли хлор-ацетонитрил (306 мг, 4,06 ммоль) и натрия карбонат (718 мг,6,77 ммоль) и смесь кипятили в течение 4 ч. Осажденные неорганические соли затем отфильтровывали,промывали этанолом и фильтрат концентрировали в вакууме с получением 340 мг (93%) названного соединения в виде желтоватого масла. МС (ЭУ) 217,2 (МН+).b) 2-(4-Пиридин-2-илметилпиперазин-1-ил)этиламин. В атмосфере аргона к суспензии литийалюминийгидрида (125 мг, 3,37 ммоль) в сухом тетрагидрофуране (15 мл) добавляли раствор (4-пиридин-2-илметилпиперазин-1-ил)ацетонитрила (340 мг,1,57 ммоль) в тетрагидрофуране (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакцию затем гасили путем добавления 10% раствора гидроксида натрия (0,2 мл) и воды(0,75 мл) и смесь перемешивали при комнатной температуре всю ночь. Нерастворенный материал отфильтровывали, промывали тетрагидрофураном и фильтрат концентрировали в вакууме с получением 338 мг (98%) названного соединения в виде желтоватого твердого вещества. МС (ЭУ) 221,2 (МН+). Справочный пример 16. 2-(2,3,5,6-Тетрагидро-[1,2']бипиразинил-4-ил)этиламин. а) (2,3,5,6-Тетрагидро-[1,2']бипиразинил-4-ил)ацетонитрил. Названное соединение получали из 1-(2-пиразинилметил)пиперазина (EMKA-Chemie) по способу,описанному в справочном примере 17 а. МС (ЭУ) 204,2 (МН+).b) 2-[2,3,5,6-Тетрагидро-[1,2']бипиразинил-4-ил)этиламин. Названное соединение получали из (2,3,5,6-тетрагидро-[1,2']бипиразинил-4-ил)ацетонитрила по способу, описанному в справочном примере 17b. МС (ЭУ) 208,2 (МН+). Справочный пример 17. трет-Бутиловый эфир 4-(4-аминометилбензил)пиперидин-1-карбоновой кислоты.a) 4-Пиперидин-4-илметилбензонитрил. К перемешиваемому раствору 4-(1-бензилпиперидин-4-илиденметил)бензонитрила (справочный пример 8b) (17,4 г, 60 ммоль) в метаноле (100 мл) добавляли 10% Pd/C (1,7 г) и реакционную смесь гидрогенизировали в течение 3 дней, затем катализатор отфильтровывали и фильтрат концентрировали. Остаток очищали с помощью колоночной хроматографии, используя Kieselgel 60 (0,015-0,040 мм) (Merck) в качестве адсорбента, и систему хлороформ:метанол:аммония гидроксид = 4:1:0,1 в качестве элюента с получением 3,6 г (30%) названного соединения.(52 мл) добавляли ди-трет-бутилдикарбонат (5,44 г, 25 ммоль) и реакционную смесь перемешивали всю ночь при комнатной температуре. После концентрирования остаток разделяли между водой и хлороформом, органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме с получением 4,0 г (74%) названного соединения в виде желтоватого масла, которое отверждалось при хранении. МС (ЭУ) 323,1 (M+Na+).c) трет-Бутиловый эфир 4-(4-аминометилбензил)пиперидин-1-карбоновой кислоты. Названное соединение получали из трет-бутилового эфира 4-(4-цианобензил)пиперидин-1 карбоновой кислоты по способу, описанному в справочном примере 13 с. МС (ЭУ) 305,3 (МН+). Пример 1. Дигидрохлорид 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-2-[4-пиридин-4 илпиперазин-1-ил]этилбензамида. а) 2,4-Дихлор-1-(2-нитрофенокси)бензол. Смесь из 1-фтор-2-нитробензола (4,8 мл, 45,42 ммоль), карбоната калия (13,8 г, 0,1 моль) и 2,4-дихлорфенола (8,16 г, 50,06 ммоль) в сухом диметилформамиде (70 мл) перемешивали при 100 С в течение 2 ч. Твердые частицы отфильтровывали и фильтрат концентрировали в вакууме. Остаток разделяли между диэтиловым эфиром и 1 н. гидроксидом натрия, органический слой промывали 1 н. гидроксидом натрия, водой и соленой водой, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме с получением 11,69 г (91%) названного соединения в виде желтоватого масла, которое отвер- 15018046b) 2-(2,4-Дихлорфенокси)фениламин [Chem. Abstr. 84 (1976), 164313q]. К перемешиваемому раствору из 2,4-дихлор-1-(2-нитрофенокси)бензола (3,5 г, 12,32 ммоль) в этилацетате (60 мл) добавляли дигидрат хлорида олова (13,89 г, 61,6 ммоль) и смесь нагревали в течение 2 ч перед гашением насыщенным раствором sodium гидрогенкарбоната натрия (192 мл). Органическую фазу разделяли и водную фазу промывали несколько раз этилацетатом. Объединенные экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме с выходом 3,1 г (99%) названного соединения в виде желтоватого масла. МС (ЭУ) 255,2 (МН+).c) 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]бензойная кислота. В атмосфере аргона к охлажденному в ледяной воде раствору 2-(2,4-дихлорфенокси)фениламина(0,5 г, 1,97 ммоль) в сухом пиридине (5 мл) добавляли 4-хлорсульфонилбензойную кислоту (0,45 г,1,97 ммоль) порционно. Реакционную смесь перемешивали при комнатной температуре всю ночь. Смесь выпаривали под вакуумом, остаток обрабатывали 1 н. соляной кислотой (20 мл) и экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали 1 н. соляной кислотой, водой и соленой водой, высушивали над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографической колонки, используя Kieselgel 60 (0,015-0,040 мм) в качестве адсорбента (Merck) и смесь хлороформ:метанол:уксусная кислота = 294:6:1 в качестве элюента с выходом 0,6 г (70%) названного соединения в виде светло-розового твердого вещества, которое кристаллизовали из системы диэтиловый эфир-петролейный эфир. МС (ЭУ) 439,3 (МН+).d) Дигидрохлорид 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-2-[4-пиридин-4-илпиперазин-1 ил]этилбензамида. Раствор из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты (0,2 г, 0,45 ммоль), триэтиламина (0,07 мл, 0,5 ммоль) и HBTU [гексофторфосфат О-бензотриазол-1-ил-N,N,N',N'тетраметилурония (Advanced Chem. Tech.)] (0,19 г, 0,5 ммоль) в сухом диметилформамиде (5 мл) перемешивали при комнатной температуре в течение 5 мин перед добавлением 2-(4-пиридин-4-ил)пиперазин 1-ил)этиламина (справочный пример 1) (0,11 г, 0,5 ммоль). рН реакционной смеси доводили до 8 путем добавления триэтиламина, полученную таким образом смесь перемешивали при комнатной температуре всю ночь, затем концентрировали в вакууме. Остаток обрабатывали насыщенным раствором гидрогенкарбоната натрия (10 мл), экстрагировали этилацетатом (325 мл), объединенные органические слои промывали насыщенным раствором гидрогенкарбоната натрия, водой и соленой водой, высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной флэшхроматографией, используя Kieselgel 60 (0,015-0,040 мм) в качестве адсорбента (Merck) и системы хлороформ:метанол:гидроксид аммония = 95:5:1 в качестве элюента, затем превращали в форму соли дигидрохлорида с получением 0,078 г (25%) названного соединения в виде светло-желтоватого аморфного твердого вещества. МС (ЭУ) 627,5 (МН+). Пример 2. Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-2-[4-(4,5-дигидро-1Hимидазол-2-ил)фенил]этилбензамида. Раствор из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты (пример 1 с) (0,35 г,0,8 ммоль), триэтиламина (0,36 мл, 2,556 ммоль) и HBTU (0,34 г, 0,88 ммоль) в сухом диметилформамиде(8 мл) перемешивали при комнатной температуре в течение 5 мин перед добавлением дигидрохлорида 2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этиламина (справочный пример 2) (0,23 г, 0,88 ммоль). рН реакционной смеси доводили до 8 путем добавления триэтиламина, полученную таким образом смесь перемешивали при комнатной температуре всю ночь, затем концентрировали в вакууме. Остаток очищали обращенно-фазовой ФЭЖХ, используя заполнители типа YMC-Pack ODS-AQ (изготовленные YMC) и систему ацетонитрил/вода/трифторуксусная кислота в качестве элюента. После концентрирования нужных фракций остаток размельчали с эфиром, фильтровали и высушивали с получением 0,33 г (57%) названного соединения в виде белого аморфного твердого вещества. МС (ЭУ) 610,5 (МН+). Пример 3. N-(3-[1,4']Бипиперидинил-1'-илпропил)-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(0,2 г, 0,9 ммоль). Реакционную смесь перемешивали при комнатной температуре всю ночь, затем вливали в ледяную воду (50 мл). Осажденные кристаллы отфильтровывали, промывали водой и высушивали с получением 0,3 г (87%) названного соединения.b) 4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]-N-2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этилбензамид. Раствор 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты (0,11 г, 0,25 ммоль), триэтиламина (0,07 мл, 0,5 ммоль) и HBTU (0,11 г, 0,29 ммоль) в сухом диметилформамиде (5 мл) перемешивали при комнатной температуре в течение 5 мин перед добавлением дигидрохлорида 2-[4-(4,5 дигидро-1H-имидазол-2-ил)фенил]этиламина (справочный пример 2) (0,11 г, 0,5 ммоль). рН реакционной смеси доводили до 8 путем добавления триэтиламина, полученную таким образом смесь перемешивали при комнатной температуре всю ночь, затем концентрировали в вакууме. Остаток обрабатывали насыщенным раствором гидрогенкарбоната натрия (30 мл), осажденные кристаллы отфильтровывали, промывали водой и высушивали. Сырье очищали с помощью колоночной хроматографии, используя Kieselgel 60 (0,040-0,063 мм) (Merck) в качестве адсорбента и систему хлороформ:метанол:аммония гидроксид = 9:1:0,1 в качестве элюента. Продукт кристаллизовали с диэтиловым эфиром с получением 0,65 г (42%) названного соединения. Пример 5. N-(3-[1,4']Бипиперидинил-1'-илпропил)-4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензамида. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыa) 4-[2-(4-Хлорфенокси)фенилсульфамоил]бензойная кислота. Названное соединение получали из 2-(4-хлорфенокси)фениламина [Collect. Czech. Chem. Commun. 65 (2000) 862-880] по способу, описанному в примере 4 а.b) 4-[2-(4-Хлорфенокси)фенилсульфамоил]-N-2-[4-(4,5-дигидро-1 Н-имидазол-2-ил)фенил]этилбензамид. Названное соединение получали из 4-[2-(4-хлорфенокси)фенилсульфамоил]бензойной кислоты и дигидрохлорида 2-[4-(4,5-дигидро-1 Н-имидазол-2-ил)фенил]этиламина (справочный пример 2) по способу, описанному в примере 4b. Пример 7. 4-[2-(4-Бромфенокси)фенилсульфамоил]-N-2-[4-(4,5-дигидро-1H-имидазол-2 ил)фенил]этилбензамид.a) 4-[2-(4-Бромфенокси)фенилсульфамоил]бензойная кислота. Названное соединение получали из 2-(4-бромфенокси)фениламина [J. Chem. Soc. (1930), 1202, 1206] по способу, описанному в примере 4 а.b) 4-[2-(4-Бромфенокси)фенилсульфамоил]-N-2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этилбензамида. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислоты и дигидрохлорида 2-[4-(4,5-дигидро-1H-имидазол-2-ил)фенил]этиламина (справочный пример 2) по способу, описанному в примере 4b. Пример 8. N-(4-[1,4']Бипиперидинил-1'-илфенил)-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензамид. Раствор из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты (пример 1 с) (0,3 г,0,68 ммоль), HOBt [1-гидроксибензотриазол] (0,093 г, 0,68 ммоль) и EDC гидрохлорида(5 мл) перемешивали при 0 С в течение 10 мин перед добавлением 4-[1,4']бипиперидинил-1'илфениламина [J. Med. Chem. 46 (2003), 1803-1806] (0,178 г, 0,68 ммоль) и реакционную смесь перемешивали при комнатной температуре всю ночь. Смесь концентрировали в вакууме, остаток обрабатывали насыщенным раствором гидрогенкарбоната натрия (10 мл) и экстрагировали хлороформом (310 мл). Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток перекристаллизовывали хлороформом с получением 0,115 г (25%) названного соединения в виде желтого аморфного твердого вещества. МС (ЭУ) 680,6 (МН+). Пример 9. Транс-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[4-(2-пирролидин-1-илэтил)циклогексил]бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и дигидрохлорида транс-4-(2-пирролидин-1-илэтил)циклогексиламина (справочный пример 4) по способу, описанному в примере 4b. МС (ЭУ) 617,6 (МН+). Пример 10. Дигидрохлорид 3-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-4 илпиперазин-1-ил)этил]бензамида. а) 3-[2-(2,4-Дихлорфенокси)фенилсульфамоил]бензойная кислота. Названное соединение получали из 2-(2,4-дихлорфенокси)анилина (пример 1b) и 3-хлорсульфонилбензойной кислоты по способу, описанному в примере 1 с. МС (ЭУ) 439,3 (МН+).b) Дигидрохлорид 3-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-4-илпиперазин-1 ил)этил]бензамида. Названное соединение получали из 3-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты и 2-4-пиридин-4-ил)пиперазин-1-ил)этиламина (справочный пример 1) по способу, описанному в примере 1d. МС (ЭУ) 627,5 (МН+). Пример 11. Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-(2-пиперидин-4 илэтил)бензамида.a) трет-Бутиловый эфир 4-(2-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламиноэтил)пиперидин-1-карбоновой кислоты. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыb) Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-(2-пиперидин-4-илэтил)бензамида. К ледяному раствору трет-бутилового эфира 4-(2-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламиноэтил)пиперидин-1-карбоновой кислоты (0,26 г, 0,4 ммоль) в дихлорметане (2 мл) добавляли трифторуксусную кислоту (0,4 мл) и реакционную смесь перемешивали при комнатной температуре всю ночь, затем концентрировали. Остаток размельчали с диэтиловым эфиром,фильтровали и высушивали с получением 0,22 г (83%) названного соединения в виде белого аморфного твердого вещества. МС (ЭУ) 549,4 (МН+). Пример 12. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-(2-диметиламиноэтил)бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и N,N-диметилэтилендиамина (Aldrich) по способу, описанному в примере 1d. МС (ЭУ) 509,4 (МН+). Пример 13. Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[4-(4,5-дигидро-1Hимидазол-2-ил)бензил]-N-метилбензамида. а) 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-(4-цианобензил)-N-метилбензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыb) Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[4-(4,5-дигидро-1 Н-имидазол-2 ил)бензил]-N-метилбензамида. Сухой хлороводородный газ барботировали через ледяной раствор 4-[2-(2,4 дихлорфенокси)фенилсульфамоил]-N-(4-цианобензил)-N-метилбензамида (0,51 г, 0,9 ммоль) в сухом этанол (50 мл) в течение 1 ч, затем полученную таким образом смесь хранили при 8 С всю ночь. Реакционную смесь концентрировали в вакууме, остаток растворяли в сухом этанол (15 мл), добавляли этилендиамин (67 мкл, 0,99 ммоль) и реакционную смесь перемешивали при комнатной температуре всю ночь. Смесь концентрировали в вакууме, остаток подвергали обращенно-фазовой ВЭЖХ, используя заполнители типа YMC-Pack ODS-AQ (изготовленные YMC) и систему ацетонитрил/вода/трифторуксусная кислота в качестве элюента. После концентрирования нужных фракций остаток измельчали с эфиром,фильтровали и высушивали с получением 0,347 г (53%) названного соединения в виде белого твердого вещества. МС (ЭУ) 610,5 (МН+). Пример 14. Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-пиперидин-4 илметилбензамида. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыb) Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-пиперидин-4-илметилбензамида. Названное соединение получали из трет-бутилового эфира 4-(4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоиламинометил)пиперидин-1-карбоновой кислоты по способу,описанному в примере 11b. МС (ЭУ) 535,5 (МН+). Пример 15. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-[2-(4,5-дигидро-1H-имидазол-2 ил)этил]бензамид.a) 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-(пропионитрил-3-ил)бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыb) 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-[2-(4,5-дигидро-1 Н-имидазол-2-ил)этил]бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-(пропионитрил 3-ил)бензамида по способу, описанному в примере 13b. Пример 16. Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-пиперидин-4 илбензамида.a) трет-Бутиловый эфир 4-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопиперидин 1-карбоновой кислоты. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыb) Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-пиперидин-4-илбензамида. Названное соединение получали из трет-бутилового эфира 4-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоиламинопиперидин-1-карбоновой кислоты по способу, описанному в примере 11b. Пример 17. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-метилбензамида. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и метиламина (1,61 М раствор в ксилене) по способу, описанному в примере 1d. МС (ЭУ) 452,53 (МН+). Пример 18. N-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(4-метилпиперазин-1-карбонил)пиперидин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и гидрохлорида (4-метилпиперазин-1-ил)пиперидин-4-илметанона (справочный пример 5) по способу, описанному в примере 1d. МС (ЭУ) 632,55 (МН+). Пример 19. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-(2-диметиламиноэтил)-N-метилбензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и N,N,N'-триметилэтилендиамина (Aldrich) по способу, описанному в примере 1d. МС (ЭУ) 523,3 (МН+). Пример 20. Трифторацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-2 илпиперазин-1-ил)этил]бензамида. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и 2-(4-пиридин-2-илпиперазин-1-ил)этиламина (справочный пример 6) по способу, описанному в примере 2. Пример 21. 4-([1,4']Бипиперидинил-1'-карбонил)-N-[2-(2,4-дихлорфенокси)фенил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыa) 4-Бром-2-хлор-1-(2-нитрофенокси)бензол. Названное соединение получали из 4-бром-2-хлорфенола по способу, описанному в примере 1 а. МС (ЭУ) 329,3 (МН+).b) 2-(4-Бром-2-хлорфенокси)фениламин. Названное соединение получали из 4-бром-2-хлор-1-(2-нитрофенокси)бензола по способу, описанному в примере 1b. МС (ЭУ) 300,2 (МН+).c) 4-[2-(4-Бром-2-хлорфенокси)фенилсульфамоил]бензойная кислота. Названное соединение получали из 2-(4-бром-2-хлорфенокси)фениламина по способу, описанному в примере 1 с. МС (ЭУ) 483,4 (МН+).d) 4-[2-(4-Бром-2-хлорфенокси)фенилсульфамоил]-N-2-[4-(4,5-дигидро-1 Н-имидазол-2 ил)фенил]этилбензамид. Названное соединение получали из 4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]бензойной кислоты и дигидрохлорида 2-[4-(4,5-дигидро-1 Н-имидазол-2-ил)фенил]этиламина (справочный пример 2) по способу, описанному в примере 2. МС (ЭУ) 655 (МН+). Пример 23. Гидрохлорид 4-[2-(4-бромфенокси)фенилсульфамоил]-N-(4-гуанидинометилбензил)бензамида. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислоты(пример 7 а) и дигидрохлорида N-(4-аминометилбензил)гуанидина (справочный пример 7) по способу,описанному в примере 2. Пример 24. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-[2-(1'-метил[1,4']бипиперидинил-4 ил)этил]бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и три-трифторацетата 2-(1'-метил[1,4']бипиперидинил-4-ил)этиламина (справочный пример 14) по способу, описанному в примере 1d. МС (ЭУ) 646,3 (МН+). Пример 25. N-[2-(4-Бромфенокси)фенил]-4-4-[4-(4,5-дигидро-1H-имидазол-2-ил)бензил]пиперидин-1-карбонилбензолсульфониламид. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислоты(пример 7 а) и 4-[4-(4,5-дигидро-1H-имидазол-2-ил)бензил]пиперидина (справочный пример 8) по способу, описанному в примере 2. Пример 26. 4-(1-4-[2-(4-Хлорфенокси)фенилсульфамоил]бензоилпиперидин-4-илметил)бензамидин. Названное соединение получали из 4-[2-(4-хлорфенокси)фенилсульфамоил]бензойной кислоты(пример 6 а) и 4-пиперидин-4-илметилбензамидина (справочный пример 9) по способу, описанному в примере 2. Пример 27. N-[2-(4-Хлорфенокси)фенил-4]-4-[4-(1,4,5,6-тетрагидропиримидин-2-ил)бензил]пиперидин-1-карбонилбензолсульфониламид. Названное соединение получали из 4-[2-(4-хлорфенокси)фенилсульфамоил]бензойной кислоты(пример 6 а) и 2-(4-пиперидин-4-илметилфенил)-1,4,5,6-тетрагидропиримидина (справочный пример 10) по способу, описанному в примере 2. Пример 28. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-4-илпиперазин-1 ил)пропил]бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыa) трет-Бутиловый эфир (2-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламиноэтил)карбаминовой кислоты. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыb) Гидрохлорид N-(2-аминоэтил)-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензамида. К перемешиваемому раствору трет-бутилового эфира (2-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламиноэтил)карбаминовой кислоты (0,41 г, 0,71 ммоль) в дихлорметане (5 мл) добавляли 9 М хлорид водорода в этаноле (0,4 мл) и реакционную смесь оставляли стоять при комнатной температуре в течение 2 ч. Затем смесь разбавляли диэтиловым эфиром (20 мл), осажденный продукт фильтровали, промывали диэтиловым эфиром и высушивали с получением 0,28 г (77%) названного соединения в виде белого твердого вещества. МС (ЭУ) 481,2 (МН+).c) трет-Бутиловый эфир 4-(2-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламиноэтилкарбамоил)пиперидин-1-карбоновой кислоты. Названное соединение получали из N-(2-аминоэтил)-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензамида и моно-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (Aldrich) по способу,описанному в примере 1d.d) Гидрохлорид (2-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламиноэтил)амида пиперидин-4-карбоновой кислоты. Названное соединение получали из трет-бутилового эфира 4-(2-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоиламиноэтил)карбамоилпиперидин-1-карбоновой кислоты по способу, описанному в примере 29b. МС (ЭУ) 592,51 (МН+). Пример 30. Гидрохлорид 4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]-N-(3-пиперидин-4 илпропил)бензамида. К перемешиваемому раствору 4-[2-(4-бром-2-хлорфенокси)фенилсульфамоил]бензойной кислоты(24 мг, 0,1 ммоль), HBTU (46 мг, 0,12 ммоль) и триэтиламин (60 мкл, 0,4 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч, затем очищали с помощью колоночной хроматографии, используя Kieselgel 60 (0,015-0,040 мм) в качестве адсорбента (Merck) и градиентного элюирования, начиная с 100% А элюента и переходя к 100% В элюенту через 20 мин (элюентА: н-гексан; элюент В: этилацетат). Очищенное соединение растворяли в этилацетате (0,5 мл), добавляли 2,55 М хлорид водорода в этилацетате (2,50 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. Осажденный продукт фильтровали, промывали диэтиловым эфиром и высушивали в вакууме с получением 35 мг(64%) названного соединения. МС (ЭУ) 608,1 (МН+). Пример 31. N-(4-[1,4']Бипиперидинил-1'-илфенил)-4-(2-феноксифенилсульфамоил)бензамид. а) 4-(2-Феноксифенилсульфамоил)бензойная кислота. Названное соединение получали из 2-феноксифениламина (Aldrich) по способу, описанному в примере 4 а. МС (ЭУ) 370,2 (МН+).(46 мг, 0,12 ммоль) и триэтиламин (30 мкл, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч, затем очищали с помощью колоночной хроматографии, используя Kieselgel 60(0,015-0,040 мм) в качестве адсорбента (Merck) и градиентное элюирование, начиная с 100% А элюента и переходя к смеси 70% А и 30% В элюента через 15 мин (элюент А: хлороформ; элюент В: метанол, содержащий 5% гидроксида аммония) с получением 24,8 мг (48%) названного соединения. МС (ЭУ) 611,3 (МН+). Пример 32. Смешанная соль ацетат/гидрохлорид (пиперидин-4-илметил)амида 1-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4-карбоновой кислоты. а) Этиловый эфир 1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4-карбоновой кислоты. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыb) 1-4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4-карбоновая кислота. К перемешиваемому раствору этилового эфира 1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4-карбоновой кислоты (0,24 г, 0,42 ммоль) в смеси из тетрагидрофурана (2,55 мл), воды (1,25 мл) и метанола (1,25 мл) добавляли моногидрат гидроксида лития (0,044 г,1,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь концентрировали, остаток растворяли в воде, подкисляли 1 М соляной кислотой, осажденный осадок профильтровывали, промывали водой и высушивали с получением 0,18 г (79%) названного соединения. МС (ЭУ) 550,2 (МН+).c) трет-Бутиловый эфир 4-[(1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4 карбонил)амино]метилпиперидин-1-карбоновой кислоты. Названное соединение получали из 1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4-карбоновой кислоты и 4-(аминометил)-Вос-пиперидина (Fluka) по способу, описанному в примере 2. МС (ЭУ) 746,2 (МН+).(пиперидин-4-илметил)амида 1-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4-карбоновой кислоты. Названное соединение получали из трет-бутилового эфира 4-[(1-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоилпиперидин-4-карбонил)амино]метилпиперидин-1 карбоновой кислоты по способу, описанному в примере 29b. Сырье очищали обращенно-фазовой ВЭЖХ,- 21018046 используя заполнители типа YMC-Pack ODS-AQ (изготовленные YMC) и систему ацетонитрил/вода/уксусная кислота в качестве элюента с получением названного соединения. МС (ЭУ) 646,2 (МН+). Пример 33. Ацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(пиперидин-4 илкарбамоил)этил]бензамида.a) Этиловый эфир 3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропионовой кислоты. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и гидрохлорида этилового эфира -аланина (Aldrich) по способу, описанному в примере 1d. МС (ЭУ) 538,2 (МН+).b) 3-4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]бензоиламинопропионовая кислота. Названное соединение получали из этилового эфира 3-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоиламинопропионовой кислоты по способу, описанному в примере 32b. МС (ЭУ) 510,1 (МН+).c) трет-Бутиловый эфир 4-(3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропиониламино)пиперидинкарбоновой кислоты. Названное соединение получали из 3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропионовой кислоты и трет-бутилового эфира 4-аминопиперидин-1-карбоновой кислоты (Fluka) по способу, описанному в примере 1d. МС (ЭУ) 692,52 (МН+).d) Ацетат 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(пиперидин-4-илкарбамоил)этил]бензамида. Названное соединение получали из трет-бутилового эфира 4-(3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропиониламино)пиперидин-1-карбоновой кислоты по способу, описанному в примере 29b. Сырье очищали обращенно-фазовой ВЭЖХ, используя заполнители типа YMCPack ODS-AQ (изготовленные YMC) и систему ацетонитрил/вода/уксусная кислота в качестве элюента с получением названного соединения. МС (ЭУ) 592,52 (МН+). Пример 34. Гидрохлорид(S)-1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпирролидин-2-карбоновой кислоты. а) Бензиловый эфир (S)-1-4-[2-(2,4-Дихлорфенокси)фенилсулъфамоил]бензоилпирролидин-2 карбоновой кислоты. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и гидрохлорида бензилового эфира L-пролина (Aldrich) по способу, описанному в примере 1d. МС (ЭУ) 626,3 (МН+).b) (S)-1-4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]бензоилпирролидин-2-карбоновой кислоты. Названное соединение получали из бензилового эфираc) трет-Бутиловый эфир 4-[S)-1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпирролидин-2-карбонил)амино]метилпиперидин-1-карбоновой кислоты. Названное соединение получали из (S)-1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпирролидин-2-карбоновой кислоты и трет-бутилового эфира 4-аминометилпиперидин-1-карбоновой кислоты (Fluka) по способу, описанному в примере 1d. МС (ЭУ) 754,2 (M+Na+).d) Гидрохлорид (пиперидин-4-илметил)амида (S)-1-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоилпирролидин-2-карбоновой кислоты. Названное соединение получали из трет-бутилового эфира 4-[S)-1-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоилпирролидин-2-карбонил)амино]метилпиперидин-1 карбоновой кислоты по способу, описанному в примере 29b. МС (ЭУ) 632,51 (МН+). Пример 35. 4-[2-(4-Бромфенокси)фенилсульфамоил]-N-2-[4-(6-метилпиридин-2-ил)пиперазин-1 ил]этилбензамид. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислоты Пример 36. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-2-[4-(6-метилпиридин-2-ил)пиперазин 1-ил]этилбензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и 2-[4-(6-метилпиридин-2-ил)пиперазин-1-ил]этиламина [Arzneim. Forsch.; 24 (1974), 19641970] по способу, описанному в примере 8. МС (ЭУ) 641,2 (МН+). Пример 37. Смешанная соль ацетата/гидрохлорида 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N2-[(пиперидин-4-илметил)карбамоил]этилбензамида. а) трет-Бутиловый эфир 4-[(3-4-[2-[2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропиониламино)метил]пиперидин-1-карбоновой кислоты. Названное соединение получали из 3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропионовой кислоты (пример 33b) и 4-(аминометил)-Вос-пиперидина (Fluka) по способу, описанному в примере 1d. МС (ЭУ) 706,2 (МН+).b) Смешанная соль ацетата/гидрохлорида 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-2[(пиперидин-4-илметил)карбамоил]этилбензамида. Названное соединение получали из трет-бутилового эфира 4-[(3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропиониламино)метил]пиперидин-1-карбоновой кислоты по способу, описанному в примере 29b. Сырье очищали обращенно-фазовой ВЭЖХ, используя заполнители типаN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(3-пиперидин-1-илпропил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(3-пирролидин-1-илпропил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(3-диметиламинопропил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и диметил(3-пиперазин-1-илпропил)амина (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 592,52 (МН+). Пример 41. N-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(1-метилпиперидин-3-илметил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-пирролидин-1-илэтил)пиперидин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-пиридин-2-илэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(3-морфолин-4-илпропил)-[1,4]диазепан-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-диметиламиноэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и диметил(2-пиперазин-1-илэтил)амина (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 578,2 (МН+). Пример 46. N-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-оксо-2-пиперидин-1-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-(4-пиридин-2-илметилпиперазин-1 карбонил)бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-(4-пиридин-3-илметилпиперазин-1 карбонил)бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-диэтиламиноэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-пиридин-4-илэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-(4-пиридин-4-илметилпиперазин-1 карбонил)бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и 1-пиридин-4-илметилпиперазина (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 598,2 (МН+). Пример 52. 2-(4-4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]бензоилпиперазин-1-ил)-N-метил-Nфенилацетамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и N-метил-N-фенил-2-пиперазин-1-илацетамида (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 654,2 (МН+). Пример 53. 2-(4-4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]бензоилпиперазин-1-ил)-N-пиридин 3-илацетамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и 2-пиперазин-1-ил-N-пиридин-2-илацетамида (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 641,2 (МН+). Пример 54. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-2-[4-(4-метилпиридин-2-ил)пиперазин 1-ил]этилбензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты- 24018046 МС (ЭУ) 641,2 (МН+). Пример 55. N-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-оксо-2-пирролидин-1-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и 2-пиперазин-1-илпирролидин-1-илэтанона (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 618,2 (МН+). Пример 56. Гидрохлорид 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(2-пиперидин-4 илэтилкарбонил)этил]бензамида. а) трет-Бутиловый эфир 4-[2-(3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропиониламино)этил]пиперидин-1-карбоновой кислоты. Названное соединение получали из 3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропионовой кислоты (пример 33b) и трет-бутилового эфира 4-(2-аминоэтил)пиперидин 1-карбоновой кислоты [Bioorg. Med. Chem. Lett.; 13 (2003), 2167-2172,5] по способу, описанному в примере 1d. МС (ЭУ) 742,51 (MH-Na+).b) Гидрохлорид 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]-N-[2-(2-пиперидин-4 илэтилкарбамоил)этил]бензамида. Названное соединение получали из трет-бутилового эфира 4-[2-(3-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензоиламинопропиониламино)этил]пиперидин-1-карбоновой кислоты по способу, описанному в примере 29b. МС (ЭУ) 620,1 (МН+). Пример 57. Трифторацетат 4-[2-(4-Бромфенокси)фенилсульфамоил]-N-(3-пиперидин-4 илпропил)бензамида.a) трет-Бутиловый эфир 4-(3-4-[2-(4-бромфенокси)фенилсульфамоил]бензоиламинопропил)пиперидин-1-карбоновой кислоты. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислотыb) Трифторацетат 4-[2-(4-бромфенокси)фенилсульфамоил]-N-(3-пиперидин-4-илпропил)бензамида. Названное соединение получали из трет-бутилового эфира 4-(3-4-[2-(4-бромфенокси)фенилсульфамоил]бензоиламинопропил)пиперидин-1-карбоновой кислоты по способу, описанному в примере 11b. МС (ЭУ) 573,2 (МН+). Пример 58. N-(4-[1,4']Бипиперидинил-1'-илфенил)-4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]бензамид. а) 4-[2-(4-Бромфенокси)-5-фторфенилсульфамоил]бензойной кислоты. В атмосфере аргона к ледяному раствору 2-(4-бромфенокси)-5-фторфениламина [Yakugaku Zasshi; 87 (1967), 591, 594; ChemAbstr.; 61 (1967), 73282] (0,43 г, 1,52 ммоль) в сухом пиридине (10 мл) добавляли по частям 4-хлорсульфонилбензойную кислоту (0,34 г, 1,52 ммоль). Реакционную смесь перемешивали при комнатной температуре всю ночь. Смесь концентрировали в вакууме, остаток обрабатывали 1 н. соляной кислотой (15 мл) и экстрагировали этилацетатом (320 мл). Объединенные органические слои промывали 1 н. соляной кислотой, водой и соленой водой, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток измельчали с диэтиловым эфиром, фильтровали, промывали диэтиловым эфиром и высушивали с получением 0,31 г (43%) названного соединения в виде светлорозового твердого вещества. МС (ЭУ) 467,9 (МН+).b) N-(4-[1,4']Бипиперидинил-1'-илфенил)-4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]бензамид. Названное соединение получали из 4-[2-(4-бромфенокси)-5-фторфенилсульфамоил]бензойной кислоты и 4-[1,4']бипиперидинил-1'-илфениламина [J. Med. Chem. 46 (2003), 1803-1806] по способу, описанному в примере 31b. МС (ЭУ) 707,7 (MH+). Пример 59.N-[2-(3,4-Дихлорфенокси)фенил]-4-(4-пиридин-3-илметилпиперазин-1 карбонил)бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты Пример 60. N-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-пиридин-4-илэтил)пиперазин-1-карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-пирролидин-1-илэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-(3-[1,4']бипиперидинил-1'-ил-3-оксопропил)-4-[2-(2,4 дихлорфенокси)фенилсульфамоил]бензамида. Названное соединение получали из 3-4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензоиламинопропионовой кислоты (пример 33b) по способу, описанному в примере 8. Сырье очищали обращеннофазовой ВЭЖХ, используя заполнители типа YMC-Pack ODS-AQ (изготовленные YMC) и систему ацетонитрил/вода/трифторуксусная кислота в качестве элюента с получением названного соединения. Пример 63. N-(4-[1,4']Бипиперидинил-1'-илфенил)-4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 4-[1,4']бипиперидинил-1'-илфениламина [J. Med. Chem. 46 (2003), 1803-1806] по способу,описанному в примере 31b. МС (ЭУ) 680,2 (МН+). Пример 64. Транс-4-[2-(3,4-дихлорфенокси)фенилсульфамоил]-N-[4-(2-пирролидин-1 илэтил)циклогексил]бензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и дигидрохлорида транс-4-(2-пирролидин-1-илэтил)циклогексиламина (справочный пример 4) по способу, описанному в примере 31b. МС (ЭУ) 617,2 (МН+). Пример 65. 4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиридин-2-илпиперазин-1 ил)этил]бензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и тетрагидрохлорида 2-(4-пиридин-2-илпиперазин-1-ил)этиламина (справочный пример 6) по способу, описанному в примере 31b. МС (ЭУ) 627,2 (МН+). Пример 66. 4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]-N-[3-(4-пиридин-4-илпиперазин-1 ил)пропил]бензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 2-(4-пиридин-4-илпиперазин-1-ил)пропиламина (справочный пример 11) по способу, описанному в примере 31b. МС (ЭУ) 641,2 (МН+). Пример 67. 2-(4-4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]бензоилпиперазин-1-ил)-N-пиридин 2-илацетамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 2-пиперазин-1-ил-N-пиридин-2-илацетамида (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 641,2 (МН+). Пример 68. 2-(4-4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]бензоилпиперазин-1-ил)-N-пиридин 3-илацетамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-(4-пиридин-4-илметилпиперазин-1 карбонил)бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты Пример 70. 4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]-N-2-[4-(6-метилпиридин-2-ил)пиперазин 1-ил]этилбензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 2-[4-(6-метилпиридин-2-ил)пиперазин-1-ил]этиламина [Arzneim. Forsch.; 24 (1974), 19641970] по способу, описанному в примере 31b. МС (ЭУ) 641,2 (МН+). Пример 71. 4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]-N-2-[4-(4-метилпиридин-2-ил)пиперазин 1-ил]этилбензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 2-[4-(4-метилпиридин-2-ил)пиперазин-1-ил]этиламина [Arzneim. Forsch.; 24 (1974), 19641970] по способу, описанному в примере 31b. МС (ЭУ) 641,2 (МН+). Пример 72. 4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]-N-[2-(4-пиримидин-2-илпиперазин-1 ил)этил]бензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(3-морфолин-4-илпропил)-[1,4]диазепан-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(3-морфолин-4-илпропил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-диметиламиноэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и диметил(2-пиперазин-1-илэтил)амин (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 578,2 (МН+). Пример 76. 4-[2-(2,4-Дихлорфенокси)фенилсульфамоил]-N-(3-пиперидин-1-илпропил)бензамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-пирролидин-1-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(3-морфолин-4-илпропил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-пиперидин-1-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-морфолин-4-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и 4-(2-пиперазин-1-илэтил)морфолина (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 620,2 (МН+). Пример 81. N-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(3-пирролидин-1-илпропил)-[1,4]диазепан-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(2,4-Дихлорфенокси)фенил]-4-[4-(2-морфолин-4-ил-2-оксоэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(2,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 1 с) и 1-морфолин-4-ил-2-пиперазин-1-илэтанона (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 634,1 (МН+). Пример 83. 4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]-N-(3-пиперидин-1-илпропил)бензамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-пиридин-2-илэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсулъфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-(4-пиридин-2-илметилпиперазин-1 карбонил)бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-диэтиламиноэтил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(3-пиперидин-1-илпропил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(3-пирролидин-1-илпропил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(3-диметиламинопропил)пиперазин-1 карбонил]бензолсульфониламид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и диметил(3-пиперазин-1-илпропил)амина (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 593,1 (МН+). Пример 90. N-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(1-метилпиперидин-3-илметил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-пирролидин-1-илэтил)пиперидин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-пиперидин-1-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 1-(2-пиперидин-1-илэтил)пиперазина (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 618,0 (МН+). Пример 93. N-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-оксо-2-пирролидин-1-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-морфолин-4-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 4-(2-пиперазин-1-илэтил)морфолина (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 620,0 (МН+). Пример 95. N-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-оксо-2-пиперидин-1-илэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 2-пиперазин-1-ил-1-пиперидин-1-илэтанона (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 632,50 (МН+). Пример 96. 2-(4-4-[2-(3,4-Дихлорфенокси)фенилсульфамоил]бензоилпиперазин-1-ил)-N-метил-Nфенилацетамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислотыN-[2-(3,4-Дихлорфенокси)фенил]-4-[4-(2-морфолин-4-ил-2-оксоэтил)пиперазин-1 карбонил]бензолсульфонамид. Названное соединение получали из 4-[2-(3,4-дихлорфенокси)фенилсульфамоил]бензойной кислоты(пример 4 а) и 1-морфолин-4-ил-2-пиперазин-1-илэтанона (EMKA-Chemie) по способу, описанному в примере 31b. МС (ЭУ) 634,0 (МН+). Пример 98. 4-[2-(4-Бромфенокси)фенилсульфамоил]-N-2-[4-(4-метилпиридин-2-ил)пиперазин-1 ил]этилбензамид. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислоты(пример 7 а) и 2-[4-(4-метилпиридин-2-ил)пиперазин-1-ил]этиламина [Arzneim. Forsch.; 24 (1974), 19641970] по способу, описанному в примере 31b. МС (ЭУ) 651,2 (МН+). Пример 99. 4-[2-(4-Бромфенокси)фенилсульфамоил]-N-[2-(4-пиридин-2-илметилпиперазин-1 ил)этил]бензамид. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислоты(пример 7 а) и 2-(4-пиридин-2-илметилпиперазин-1-ил)этиламина (справочный пример 15) по способу,описанному в примере 31b. МС (ЭУ) 651,2 (МН+). Пример 100. 4-[2-(4-Бромфенокси)фенилсульфамоил]-N-[2-(4-пиримидин-2-илпиперазин-1 ил)этил]бензамид. Названное соединение получали из 4-[2-(4-бромфенокси)фенилсульфамоил]бензойной кислоты
МПК / Метки
МПК: A61K 31/18, C07D 213/38, C07D 211/56, C07D 213/74, C07D 211/62, A61P 29/00, C07D 239/04, C07D 211/26, C07C 311/21, C07D 211/76, C07D 233/54, C07D 213/75, C07D 239/42, C07D 207/26, C07D 211/34
Метки: содержащая, антагонистов, сульфониламидные, качестве, производные, рецепторов, композиция, получение, брадикининовых, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/30-18046-sulfonilamidnye-proizvodnye-v-kachestve-antagonistov-bradikininovyh-receptorov-ih-poluchenie-i-farmacevticheskaya-kompoziciya-ih-soderzhashhaya.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфониламидные производные в качестве антагонистов брадикининовых рецепторов, их получение и фармацевтическая композиция, их содержащая</a>
Предыдущий патент: Способ получения кристаллической силикоалюминофосфатной-34 (sapo-34) мембраны, обладающей высокой селективностью и производительностью при разделении co2/ch4
Следующий патент: Способ сульфинилирования производной пиразола
Случайный патент: Замещенные соединения тетрациклина (варианты), фармацевтическая композиция и способ лечения чувствительного к тетрациклину состояния субъекта












