Производные хинолин-4-карбоксамида, их получение и их применение в качестве антагонистов рецептора нейрокинина-3 (-к-3) и нейрокинина-2 (-к-2)
Номер патента: 1771
Опубликовано: 27.08.2001
Авторы: Груни Марио, Равелиа Лука Франческо, Гьярдина Джузеппе Арнальдо Мариа, Фарина Карло
Формула / Реферат
1. Соединение формулы

или его соль, или его сольват,
где Аr представляет фенил;
R представляет С1-С6алкил, С1-С6aлкилкарбонил, С1-С6алкоксикарбонил ;
R1 представляет собой водород, С1-С6алкил;
R2 представляет собой водород, С1-С6aлкил, гидрокси, галоген, циано, амино, моно- или ди-С1-С6алкиламино, С1-С6алкилсульфониламино, моно- или ди-С1-С6aлканоиламино, где любая алкильная группа необязательно замещена аминогруппой или моно- или ди-С1-С6алкиламиногруппой, или R2 является группой -Х-(СН2)n-Y, где Х является связью или -О-, и n представляет собой целое число от 1 до 5, при условии, что, когда Х является -О-, тогда n представляет собой только целое число от 2 до 5 и Y представляет собой группу NY1Y2, где Y1 и Y2 независимо выбирают из водорода, С1-С6алкила, С1-С6алкенила, фенила или фенил-С1-С6aлкила или Y является гидрокси, галогеном или N-связанной одиночной или конденсированной гетероциклической группой, причем любое единичное или конденсированное кольцо является насыщенным или ненасыщенным и состоит из 5 или 6 кольцевых атомов, причем указанные кольцевые атомы необязательно включают 1 или 2 дополнительных гетероатомов, выбранных из О или N, и где один или два кольцевых атома необязательно замещены одной или двумя оксогруппами или одной или двумя группами, выбранными из гидрокси, С1-С6алкоксикарбонила, С1-С6алкила, фенила или нафтила или ароматической гетероциклической группы, содержащей 5 или 6 кольцевых атомов, включающих один или два атома азота, или заместители на соседних кольцевых атомах образуют ароматическое карбоциклическое кольцо, причем указанные фенил, нафтил или ароматическая гетероциклическая группа необязательно замещены одной или двумя группами, выбранными из С1-С6алкила, С1-С6алкокси, гидрокси, галогена или галогенС1-С6алкила;
R3 представляет фенил; и
R4 представляет водород или С1-С6алкил.
2. Соединение по п.1, где R представляет собой этил.
3. Соединение по любому из пп.1, 2, где R2 представляет собой группу -Х-(СН2)n-Y.
4. Соединение по любому из пп.1-3, где группа -Х-(СН2)n-Y представляет группу формулы (а)

где Т представляет собой С1-С6алкильную, С1-С6алкоксикарбонильную, необязательно замещенную фенильную или фенил-С1-С6алкильную или ароматическую гетероциклическую группу, содержащую 5 или 6 кольцевых атомов, включающих один или два атома азота, и/или Х является -О- и n равно 2 или 3 или Х является связью и n равно 1, 2 или 3.
5. Соединение по п.4, где Т представляет собой метильную группу.
6. Соединение по п.4, где Т представляет собой фенильную группу, замещенную одной или более С1-С6алкоксильными группами.
7. Соединение по п.4, где Т представляет собой пиримидинильную группу.
8. Соединение по п.1, где -X-(CH2)n-Y представляет собой группу формулы (b)

где Х является -О- или связью, n равно 1, 2 или 3, каждый из T1 и Т2 независимо представляет собой гидрокси, С1-С6алкоксикарбонил, C1-С6алкил, фенильную или фенил-С1-С6алкильную или ароматическую гетероциклическую группу, имеющую одиночное или конденсированное кольцо, содержащее 5 или 6 кольцевых атомов, включающих один или два атома азота, или T1 и Т2 вместе с атомами углерода, к которым они присоединены, образуют ароматическое карбоциклическое кольцо, причем упомянутые фенил, фенил-C1-С6алкил или ароматические гетероциклические группы необязательно замещены одной или двумя группами, выбранными из С1-С6алкила, C1-С6алкокси, гидрокси, галогена или галоген-С1-С6алкила; или одна из T1 и Т2 является оксигруппой, а другую выбирают из соответствующих вышеуказанных групп.
9. Соединение по п.8, где T1 и Т2 вместе с атомами углерода, к которым они присоединены, образуют ароматическое карбоциклическое кольцо.
10. Соединение по п.8, где n представляет собой целое число, равное 1 и 2.
11. Соединение по п.1, где Аr является фенилом, R является этилом, R1 является водородом, R2 является группой -X-(CH2)n-Y, где Х является -О-, n равно 1, 2 или 3 и Y представляет группу формулы (а), которая определена в п.4, или группу формулы (b), которая определена выше в п.8.
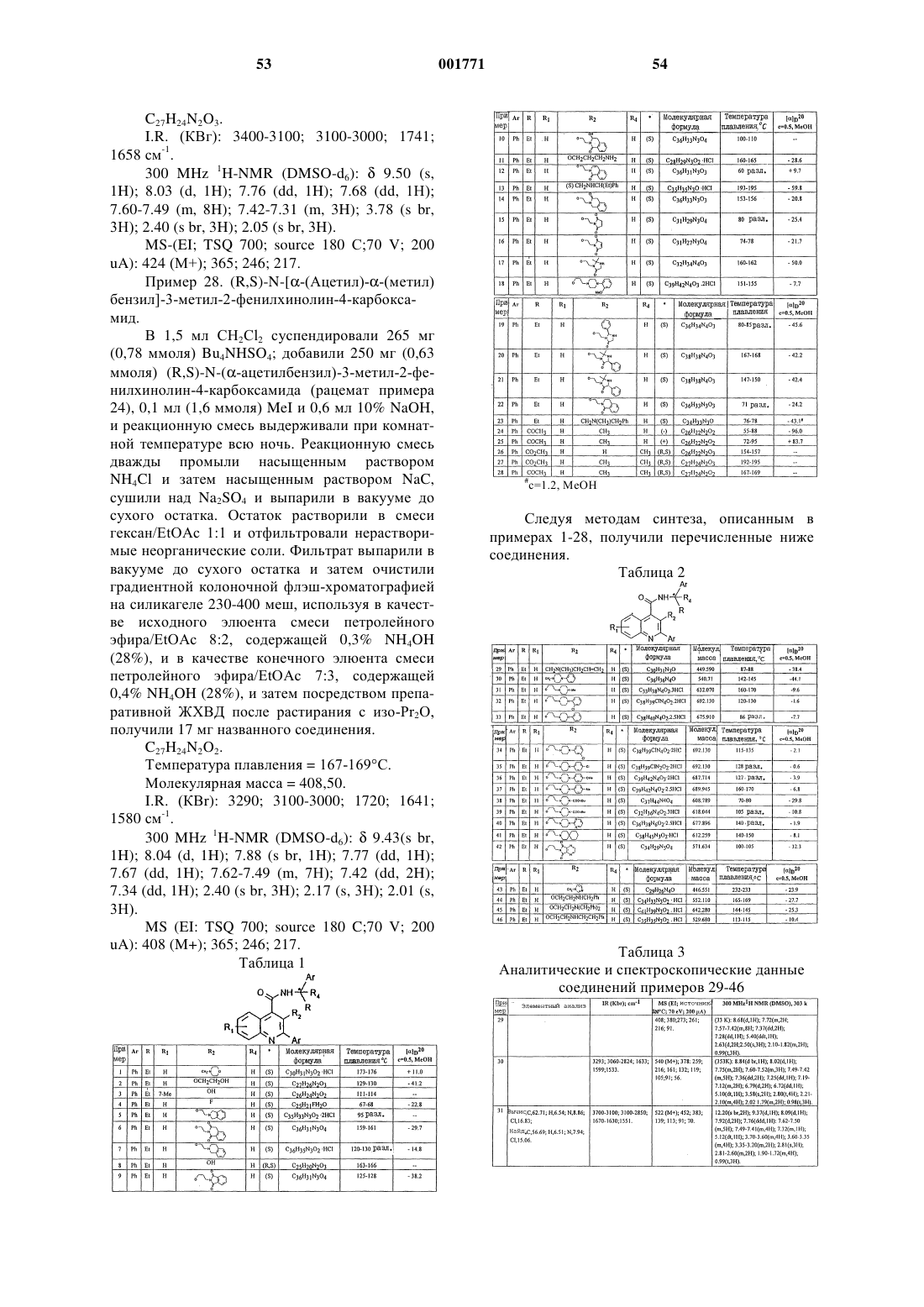
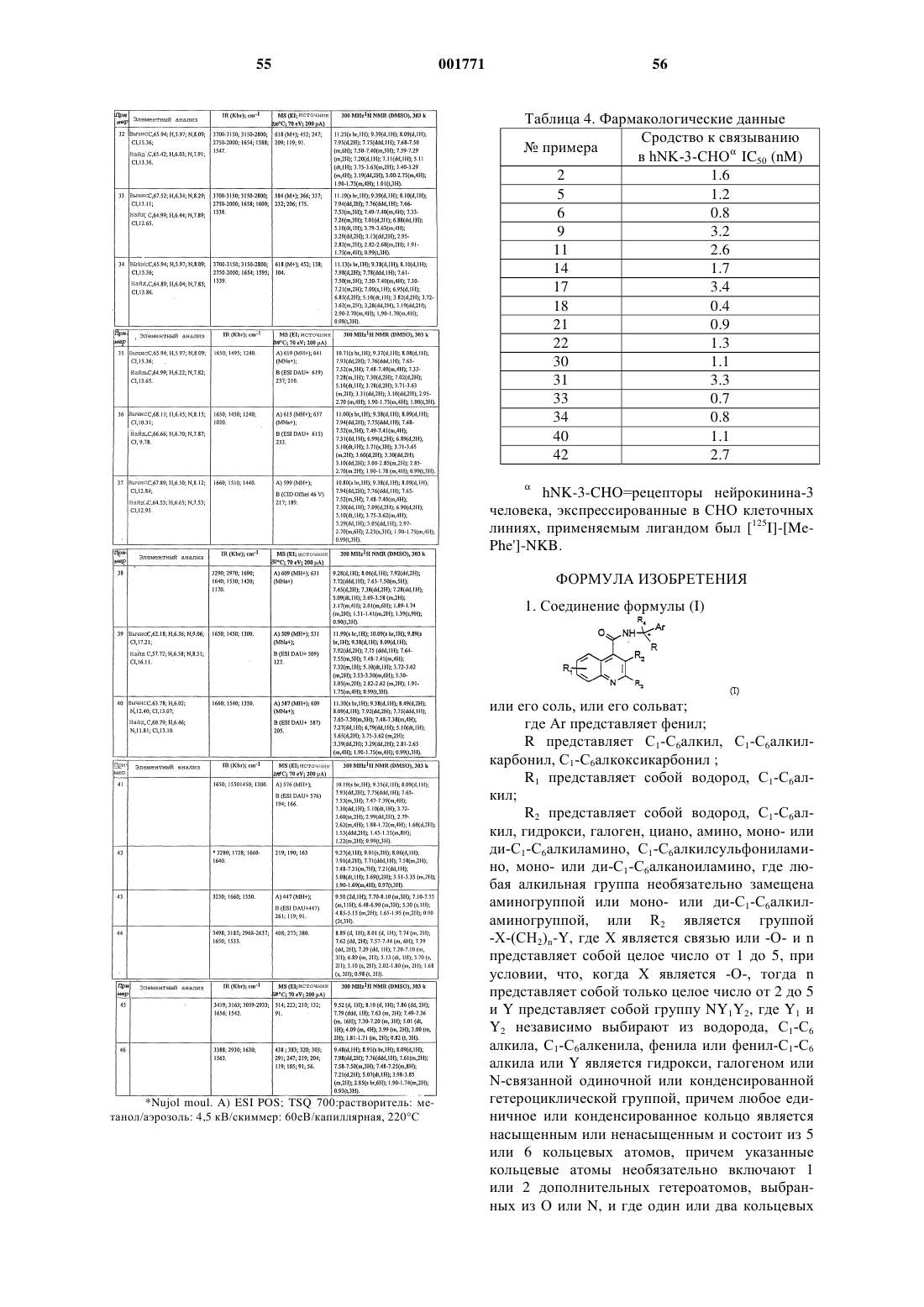
12. Соединение по п.1, выбранное из соединений со следующими значениями радикалов Ar, R, R1, R2 и R4
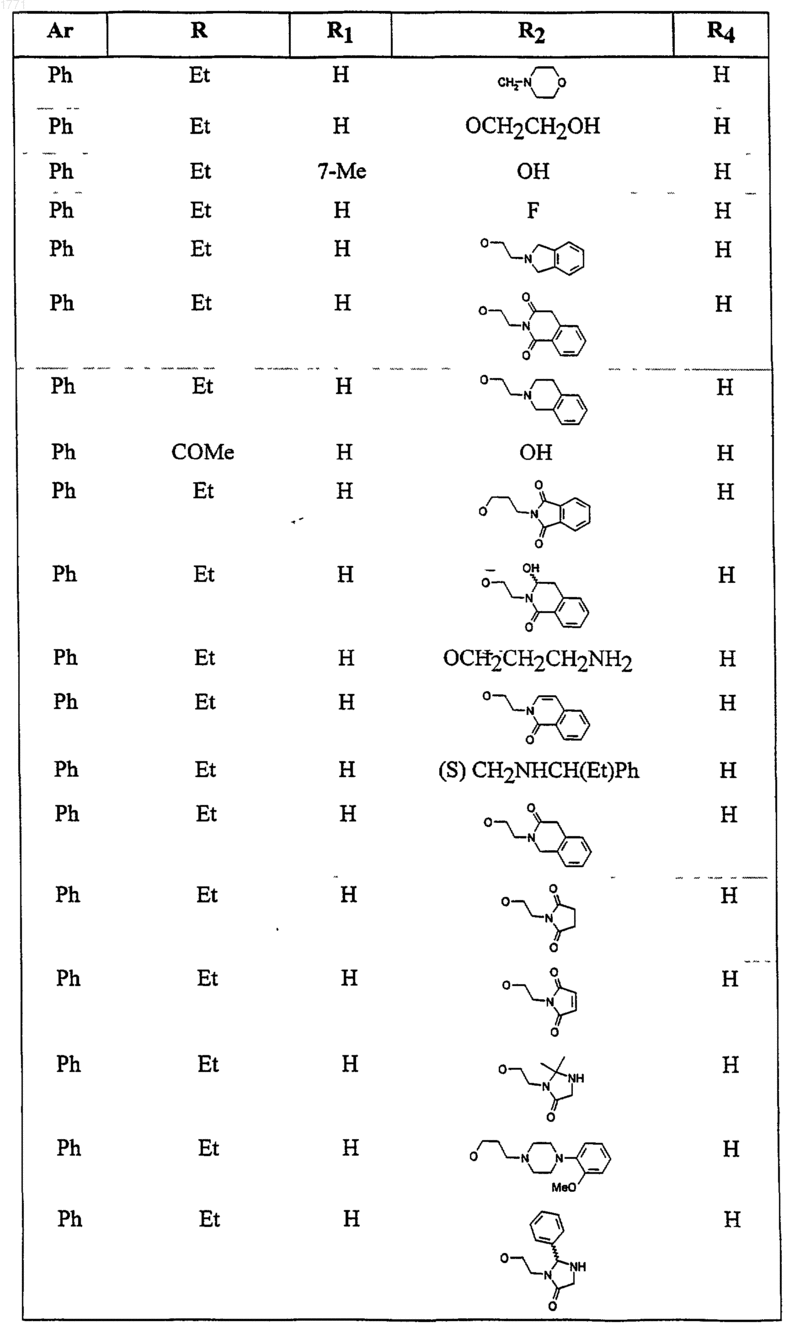
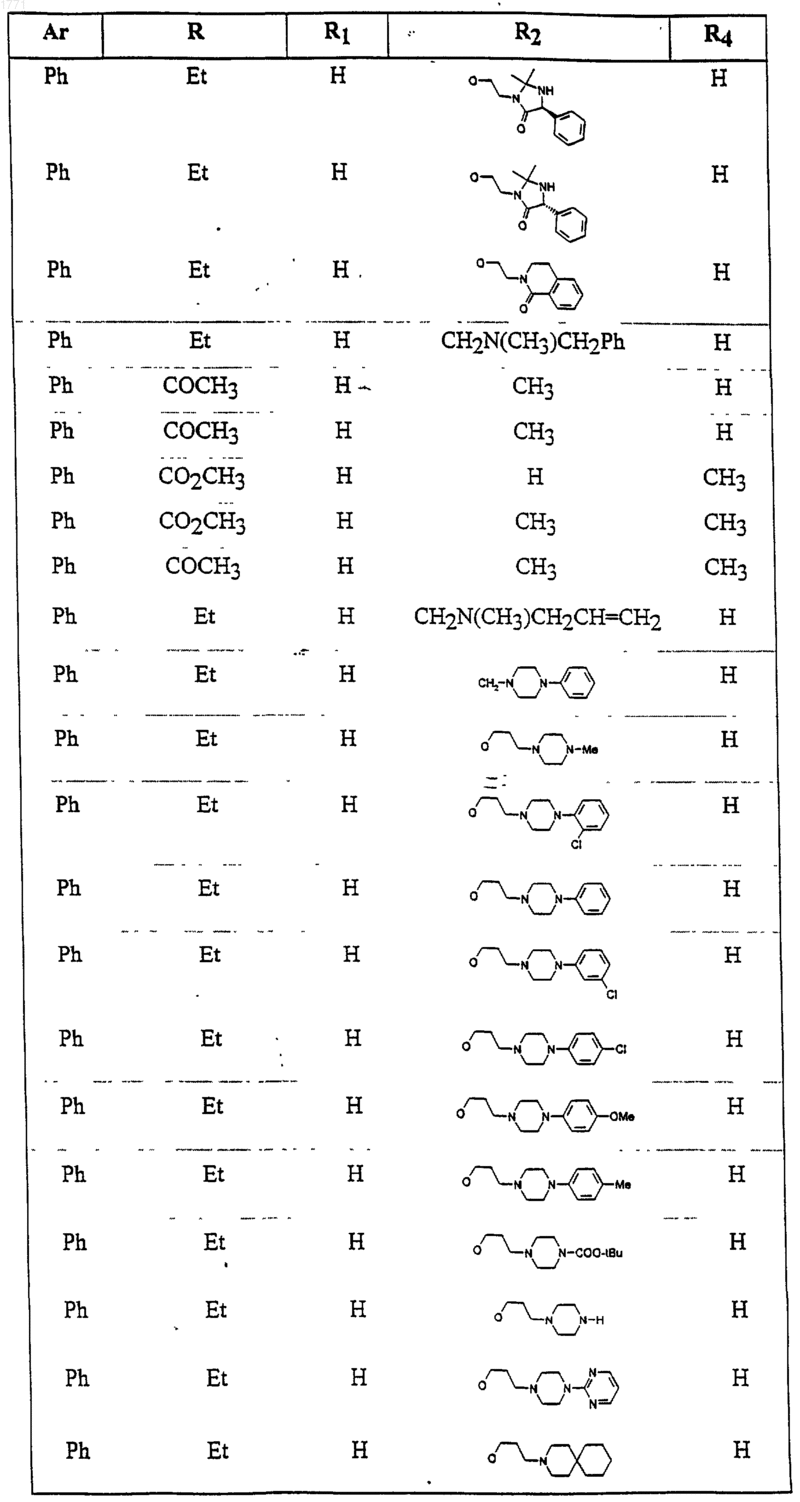
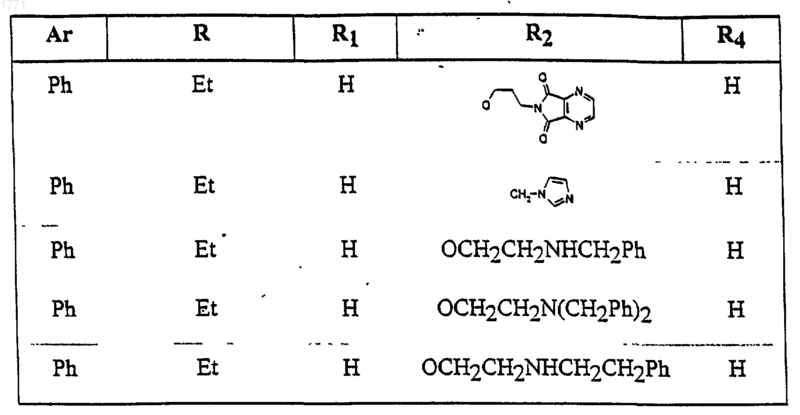
13. Соединение по п.1, выбранное из соединений со следующими значениями радикалов Ar, R, R1, R2 и R4
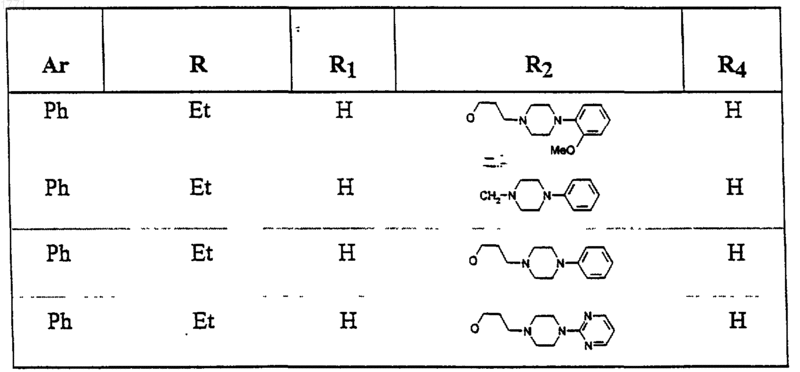
14. Способ получения соединения формулы (I), или его соли, и/или его сольвата, включающий взаимодействие соединения формулы
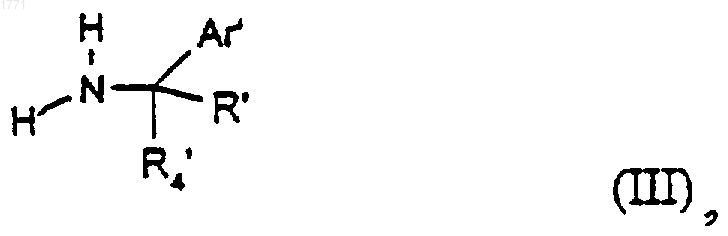
где R', R'4 и Ar представляют собой R, R4 и Ar, которые определены в формуле (I), или группу или атом, способный соответственно превращаться в R, R4 и Ar, с соединением формулы (II) или его активным производным
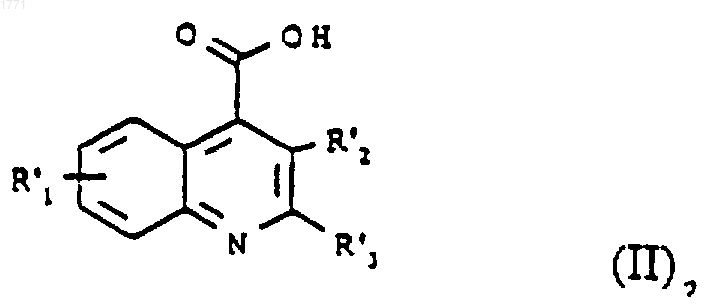
где R'1, R'2 и R'3 представляют собой соответственно R1, R2 и R3, которые определены в формуле (I), или группу, способную превращаться в R1, R2 и R3 с образованием соединения формулы
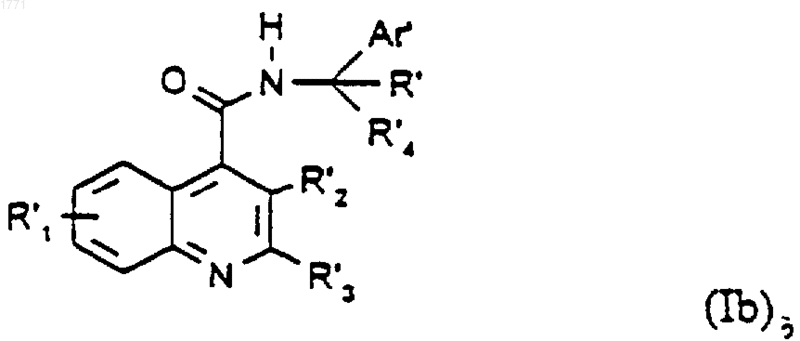
где Аr', R', R'1, R'2, R'3 и R'4 являются такими, как они определены выше, и необязательное проведение после него одной или нескольких следующих необязательных стадий:
(i) превращение одной любой из Аr', R', R'1, R'2, R'3 и R'4 соответственно в Аr, R, R1, R2, R3 и R4, как необходимо, с получением соединения формулы (I);
(ii) превращение соединения формулы (I) в другое соединение формулы (I); и
(iii) получение соли соединения формулы (I) и/или его сольвата.
15. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль или фармацевтически приемлемый сольват и фармацевтически приемлемый нoситель.
16. Применение соединения формулы (I) или его фармацевтически приемлемой соли или его фармацевтически приемлемого сольвата в качестве активного терапевтического средства.
Текст
1 Настоящее изобретение относится к новым соединениям, в частности к новым производным хинолина, к способам получения таких соединений, к лекарственным препаратам, содержащим такие соединения, и к применению таких соединений в медицине. Пептид млекопитающих Нейрокинин В(NKB) принадлежит к семейству Тахикининовых (ТК) пептидов, которое также включает Вещество Р (SP) и Нейрокинин A (NKA). Фармакологические и молекулярно-биологические данные показали существование трех подтипов ТК рецептора (NK1, NK2 и NК 3), и NKB предпочтительно связывается с NK-3 рецептором,хотя также распознает два других рецептора с меньшим сродством (Maggi et al, 1993, J. Auton.Pharmacol.,13, 23-93). Селективные пептидные антагонисты NK3 рецептора известны (Drapeau, 1990 Regul.Pept., 31, 125-135), и исходя из полученных данных, касающихся пептидных агонистов NK-3 рецептора, предполагают, что NKB, посредством активации NK-3 рецептора, играет основную роль при модуляции нервного ввода в дыхательных путях, коже, спинном мозге и нигростриарных проводящих путях нервной системы.(Myers and Undem, 1993, J. Physiol., 470, 665679; Counture et. аl., 1993, Regul. Peptides, 46,426-429; Mccarson and Krause, 1994, J. Neurosci.,14(2), 712-720; Arenas et al. 1991, J.Neurosci., 11,2332-8). Однако пептидоподобная природа известных антагонистов делает их, по всей вероятности, слишком неустойчивыми с точки зрения метаболизма, для того чтобы они могли служить в качестве лечебных средств на практике. В настоящем изобретении открыт новый класс непептидных антагонистов NK-3, которые являются гораздо более устойчивыми с точки зрения метаболизма, чем известные пептидные антагонисты NK-3, и которые обладают потенциальной терапевтической полезностью. Эти соединения также обладают антагонистической активностью в отношении NK-2 и поэтому полагают, что они найдут возможное применение для предотвращения и лечения множества клинических состояний, которые характеризуются гиперстимуляцией тахикининовых рецепторов,в частности NK-3 и NK-2. Эти состояния включают респираторные заболевания, такие как хроническая легочная недостаточность (COPD), астма, повышенная реактивность дыхательных путей, кашель: воспалительные заболевания, такие как воспаление пищеварительного тракта, псориаз, фиброз, остеоартроз, ревматоидный артроз и боли при воспалениях; нейрогенные воспаления или периферическую нейропатию, аллергии, например экзему и риниты; офтальмологические заболевания, например воспаление глаза, конъюнктивиты, весенние конъюнктивиты и подобные; кожные болезни, зуд, например волдыри и вос 001771 2 палительную гиперемию, контактный дерматит,атопический дерматит, крапивницу и другие экзематоидные дерматиты; побочные иммунологические реакции, например отторжение трансплантированных тканей, и расстройства,относящиеся к иммунологической активации или подавлению, например системную красную волчанку; желудочно-кишечные заболевания(GI) и заболевания желудочно-кишечного тракта, например заболевания, связанные с регуляцией внутренних органов, например неспецифический язвенный колит, болезнь Крона и недержание мочи; почечные расстройства и нарушения функции мочевого пузыря (далее отнесенные здесь к первичным (основным) заболеваниям). Некоторые из этих соединений также проявляют активность в отношении центральной нервной системы и поэтому полагают, что они найдут применение для лечения заболеваний центральной нервной системы, например тревоги, депрессии, психоза и шизофрении; нейродегенеративных нарушений, например, слабоумия,связанного со СПИДом, старческого слабоумия альцгеймеровского типа, болезни Альцгеймера,синдрома Дауна, болезни Хантингтона, болезни Паркинсона, двигательных расстройств и судорожного синдрома (например, эпилепсии); демиелинизирующих заболеваний, например, рассеянного склероза и бокового амиотрофического склероза и других нейродегенеративных нарушений, например, невропатии, вызванной диабетом, невропатии, вызванной СПИДом,невропатии, вызванной химиотерапией, и невралгии; заболеваний, связанных с привыканием,например, алкоголизма; соматических расстройств, связанных со стрессом; симпатической дистрофии, например, плечевого синдрома; дистимии; заболеваний пищевого происхождения; фиброза и коллагеноза, например,склеродермии и эозинофильного фасциолеза; нарушений кровотока,вызванных вазодилатацией и вазоспастических заболеваний,например ангины, мигрени, заболевания Реунауда и боли и/или периодическим восприятием боли, которые свойственны или связаны с любым из вышеприведенных состояний или связаны с любым из вышеперечисленных состояний, в особенности при распространении боли при мигрени (далее обозначены как вторичные заболевания). Полагают, что соединения формулы (I) являются пригодными в качестве диагностических средств для оценки степени влияния активности рецептора нейрокинина-3 (обычной, избыточной или недостаточной) на симптомы больного. В соответствии с настоящим изобретением предложено соединение или его сольват или его соль формулы (I)R2 представляет собой водород, C1-6-алкил,гидрокси, галоген, циано, амино, моно- или диС 1-6-алкиламино,C1-6-алкилсульфониламино,моно- или ди-С 1-6-алканоиламино, где любая алкильная группа необязательно замещена аминогруппой или моно-или диалкиламиногруппой,или R2 является группой -X-(CH2)n-Y, где Х является связью или -О-, и n представляет собой целое число в диапазоне от 1 до 5, при условии,что, когда Х является -О-, тогда n представляет собой только целое число от 2 до 5 и Y представляет собой группу NY1Y2, где Y1 и Y2 независимо выбирают из водорода, C1-6-алкила, C1-6 алкенила, фенила или фенил-C1-6-алкила или Y является гидрокси, галогеном или N-связанной одиночной или конденсированной гетероциклической группой, причем любое единичное или конденсированное кольцо является насыщенным или ненасыщенным и состоит из 5 или 6 кольцевых атомов, причем указанные кольцевые атомы необязательно включают 1 или 2 дополнительных гетероатома, выбранных из О или N, и, где один или два кольцевых атома необязательно замещены одной или двумя оксогруппами, выбранными из гидрокси, C1-С 6 алкоксикарбонила, C1-С 6-алкила, фенила или нафтила или ароматической гетероциклической группы, содержащей 5 или 6 кольцевых атомов,включающих один или два атома азота, или заместители на соседних кольцевых атомах образуют ароматическое карбоциклическое кольцо,причем указанные фенил, нафтил или ароматическая гетероциклическая группа необязательно замещены одной или двумя группами, выбранными из C1-С 6-алкила, C1-С 6-алкокси, гидрокси,галогена или галоген C1-С 6-алкила;R4 представляет собой водород или C1-6 алкил. Когда R представляет собой C1-6 алкилкарбонил, примером может служить ацетил. Когда R представляет собой C1-6 алкоксикарбонил, примером может служить метоксикарбонил.R1 представляет собой водород или C1-6 алкил, например, метил. 4 Когда R2 представляет собой моно- или диС 1-6-алканоиламино, то алканоильной группой предпочтительно является N-гексаноильная группа, подходящим образом замещенная аминогруппой по концевому атому углерода. Когда Y представляет собой вышеупомянутую N-связанную одиночную или конденсированную гетероциклическую группу, имеющую ОН или оксозаместитель на одном или двух кольцевых атомах, упомянутые атомы предпочтительно расположены смежно со связанным атомом N. Подходящей 6-членной насыщенной гетероциклической группой, содержащей Nсвязанное одиночное кольцо, включающей дополнительный гетероатом, является морфолиногруппа или пиперизинильная группа, например,необязательно замещенная 4-фенилпиперазинильная группа. Подходящие гетероциклические группы,содержащие N-связанное конденсированное кольцо, включают 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо,конденсированное с бензольным кольцом. Подходящей гетероциклической группой,содержащей N-связанное конденсированное кольцо, включающей 6-членное насыщенное гетероциклическое кольцо, конденсированное с бензольным кольцом, является 2-(1,2,3,4 тетрагидро)изохинолинильная группа. Подходящей гетероциклической группой,содержащей N-связанное конденсированное кольцо, включающей 5-членное насыщенное гетероциклическое кольцо, конденсированное с бензольным кольцом, является 2-изоиндолинильная группа. Подходящей гетероциклической группой,содержащей N-связанное конденсированное кольцо, включающей 6-членное гетероциклическое кольцо, конденсированное с бензольным кольцом, и имеющей оксозаместитель у одного насыщенного кольцевого атома, является 1,4 дигидро-3(2 Н)-изохинолинон-2-ильная группа или 3,4-дигидро-1(2 Н)-изохинолинон-2-ильная группа. Подходящей гетероциклической группой,содержащей N-связанное конденсированное кольцо, включающей 6-членное гетероциклическое кольцо, конденсированное с бензольным кольцом, и имеющей оксозаместитель у двух насыщенных кольцевых атомов углерода, является группа гомофталимидо. Когда R2 представляет собой -(CH2)n-Y,примеры Y включают аминогруппу или моноили ди-С 1-6-алкиламиногруппу. Еще одним примером Y в группе -(CH2)n-Y является морфолиногруппа или 4-фенилпиперазиновая группа илиN-метил-N-бензиламиногруппа. Предпочтительным значением группы -X(CH2)n-Y является группа формулы (а) где Т представляет собой C1-6-алкильную, C1-6 алкоксикарбонильную, необязательно замещенную фенильную или фенил-С 1-С 6-алкильную или ароматическую гетероциклическую группу,содержащую 5 или 6 кольцевых атомов, включающих один или два атома азота и/или Х является О, или n равно 2 или 3, или Х является связью и n равно 1, 2 или 3.X представляет собой О, Х представляет собой связь. Когда Т представляет собой C1-6-алкильную группу, тогда Т предпочтительно является метильной группой. Когда Т представляет собой необязательно замещенную фенильную группу, она является предпочтительно фенильной группой, замещенной одной или несколькими алкоксильными группами, особенно метоксильными группами в количестве до 3, главным образом замещенной по положению 2 относительно места присоединения в пиперазинильной группе. Когда Т представляет собой ароматическую гетероциклическую группу, подходящей группой является 6-членная ароматическая гетероциклическая группа, имеющая два атома азота, например, пиримидиновая группа и предпочтительно 2-пиримидиновая группа. Еще одним предпочтительным значением для группы -X-(CH2)n-Y является группа формулы (b) где X является О или связью, n равно 1, 2 или 3,каждый из T1 и Т 2 независимо представляют собой гидрокси, C1-6-алкоксикарбонил, C1-6 алкил, фенил или фенил-С 1-С 6-алкил или ароматическую гетероциклическую группу, содержащую 5 или 6 кольцевых атомов, включающих один или два атома азота, или T1 и T2 вместе с атомами углерода, к которым они присоединены, образуют ароматическое карбоциклическое кольцо; причем упомянутые фенил, фенил C1C6-алкил или ароматические гетероциклические группы необязательно замещены одной или двумя группами, выбранными из C1-6-алкила,C1-6-алкокси, гидрокси, галогена или галогенаC1-C6-алкила; или одна из T1 и Т 2 является оксогруппой, а другую выбирают из вышеупомянутых групп. Предпочтительно T1 и Т 2 вместе с атомами углерода, к которым они присоединены, образуют карбоциклическое кольцо, в частности циклогексильное кольцо. Когда R2 представляет собой группу 6 Примеры группы -(CH2)n-Y включают аминометил и метиламинометил, еще одним примером является морфолинометил. Когда R2 представляет собой группу-O-(CH2)n-Y, примеры Y включают ОН, 2 изоиндолинил, гомофталимидо, -2-(1,2,3,4 тетрагидро)изохинолинил, 1,4-дигидро-3(2 Н)изохинолинон-2-ил и, в особенности 3,4 дигидро-1(2 Н)-изохинолинон-2-ил. Дополнительными примерами Y в группе -O-(CH2)n-Y являются: фталимидо, 3-гидрокси-3,4-дигидро 1(2 Н)-изохинолинон-2-ил; 1-(2 Н)-изохинолинон-2-ил (предпочтительная группа); сукцинимидо; малеимидо,2,2-диметил-4-оксо-3 имидазолидинил; 4-(2-метоксифенил)пиперазин-1-ил (предпочтительная группа), 4-(3 хлорфенил)пиперазин-1-ил (предпочтительная группа); 4-фенилпиперазин-1-ил (предпочтительная группа), 4-(2-пиримидинил)пиперазин 1-ил (предпочтительная группа); 2-фенил-4 оксо-3-имидазолидинил и 2,2-диметил-5-фенил 4-оксо-3-имидазолидинил. Когда R2 представляет собой группу -O(CH2)n-Y, n является целым числом, равным 2 или 3.R2 предпочтительно представляет собой группу -Х-(СН 2)n-Y. В одном из вариантов Х является связью. Х представляет собой О. Когда R4 являетсяC1-6-алкилом, примером является метил. Предпочтительными соединениями формулы (I) являются такие соединения, в которых Аr является фенилом, R является этилом,R1 является водородом, R2 является группой -X(CH2)n-Y, где Х предпочтительно является О или связью, n равно 1, 2 или 3 и Y является группой формулы (а) или (b), которые определены выше, в частности, следует назвать соединения примеров 18, 30, 33 и 40. Соединения формулы (I) могут иметь, по меньшей мере, один асимметрический центр,например атом углерода, помеченный звездочкой в соединении формулы (I), и поэтому могут существовать более, чем в одной стереоизомерной форме. Изобретение включает также все эти стереоизомерные формы и их смеси, включая рацематы. В частности, изобретение включает соединения, где атом углерода, помеченный звездочкой в соединении формулы (I), имеет стереохимию, показанную в формуле (Iа) где Аr, R, R1, R2, R3 и R4 являются такими, как они определены в формуле (I). Соединения формулы (I) или их соли или сольваты находятся предпочтительно в фармацевтически приемлемой или, по существу, в чистой форме. Выражение "фармацевтически приемлемая форма" означает, между прочим, 7 форму, имеющую фармацевтически приемлемый уровень чистоты, за исключением обычных фармацевтических добавок, например разбавителей и носителей, и не включающую вещества,считающиеся токсичными при обычных уровнях дозы. По существу чистая форма будет обычно содержать, по меньшей мере, 50% (за исключением обычных фармацевтических добавок),предпочтительно 75%, более предпочтительно 90% и еще более предпочтительно 95% соединения формулы (I) или его соли или сольвата. Одной из предпочтительных фармацевтически приемлемых форм является кристаллическая форма, включая такую форму в фармацевтической композиции. В случае солей и сольватов дополнительные ионные части и части растворителя также должны быть нетоксичными. Подходящими солями являются фармацевтически приемлемые соли. Подходящие фармацевтически приемлемые соли включают кислотно-аддитивные соли с обычными фармацевтическими кислотами,например с малеиновой, хлористоводородной,бромистоводородной, фосфорной, уксусной,фумаровой, салициловой, лимонной, молочной,миндальной, винной, янтарной, бензойной, аскорбиновой и метансульфоновой. Подходящие фармацевтически приемлемые соли включают соли кислотных частей соединений формулы (I), если они присутствуют,например соли с карбоксигруппами или с фенильными гидроксигруппами. Подходящие соли кислотных групп включают соли металлов, например алюминия, соли щелочных металлов, например лития, натрия или калия, соли щелочно-земельных металлов,например, кальция или магния и соли аммония или замещенного аммония, например, соли с низшими алкиламинами, например, триэтиламином, с гидроксиалкиламинами, например, 2 гидроксиэтиламином, бис-(2-гидроксиэтил)амином или три-(2-гидроксиэтил)амином, с циклоалкиламинами, например, бициклогексиламином или с прокаином, дибензилпиперидином,N-бензилфенетиламином, дегидроабиетиламином, N,N'-бисдегидроабиетиламином, глюкамином, N-метилглюкамином или с основаниями пиридинового типа, например, пиридином, коллидином, хинином или хинолином. Подходящими сольватами являются фармацевтически приемлемые сольваты. Подходящие фармацевтически приемлемые сольваты включают гидраты. Термин "алкил" (если не указано иначе),когда он применяется в отдельности или когда он составляет часть других групп, (например,алкилоксильных), включает алкильные группы с прямой или разветвленной цепью, содержащие от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода, примеры включают метильную, этильную, н-пропильную, изопро 001771 8 пильную, н-бутильную, изобутильную или третбутильную группу. Термин "карбоциклический" относится к циклоалкильным и арильным кольцам. Термин "циклоалкил" включает группы,имеющие от 3 до 12, предпочтительно от 4 до 6 кольцевых атомов углерода. Термин "арил" включает фенил и нафтил,предпочтительно фенил, который, если не указано иначе, необязательно включает до пяти,предпочтительно до трех заместителей, выбранных из галогена, алкильных, фенильных, алкоксильных, галогеналкильных, гидроксиалкильных, гидроксильных, амино-, нитро-, циано-,карбоксильных, алкоксикарбонильных, алкоксикарбонилалкильных, алкилкарбонилокси или алкилкарбонильных групп. Термин "ароматическая гетероциклическая группа" включает группы, содержащие ароматические гетероциклические кольца, содержащие 5 или 6 кольцевых атомов, и содержащие до четырех гетероатомов в одном или каждом кольце, выбранных из S, О и N. Если не указано иначе, подходящие заместители для любой гетероциклической группы включают до четырех заместителей, выбранных из группы, состоящей из алкила, алкокси, арила и галогена, или два заместителя у смежных атомов углерода вместе с атомами углерода, к которым они присоединены, могут образовывать арильную группу, предпочтительно бензольное кольцо, и где атомы углерода арильной группы,представленной двумя заместителями, могут быть сами замещенными или незамещенными. Применяемый здесь термин "галоген" относится к фтору, хлору, брому и йоду, предпочтительно к фтору или хлору. Применяемый здесь термин "ацил" включает остатки кислот, в частности остаток карбоновой кислоты, например, алкил- или арилкарбонильную группу. Изобретение также относится к способу получения соединения формулы (I) или его соли и/или его сольвата, который включает взаимодействие соединения формулы (III): где R', R4' и Аr' соответствуют R, R4 и Аr, определенным в формуле (I), или группу или атом,способные соответственно превращаться в R, R4 и Аr, соответственно, с соединением формулы(II) или его активным производным где R1', R2' и R3' соответствуют R1, R2 и R3, которые определены в формуле (I), или группы, способные превращаться в R1, R2 и R3 с образованием соединения формулы (Ib) где Аr', R', R1', R2', R3' и R4' являются такими, как они определены выше, и необязательное проведение после этого одной или нескольких из следующих необязательных стадий:(i) превращение любого из Аr', R', R1', R2',R3' и R4' соответственно в Аr, R, R1, R2, R3, илиR4, как необходимо, с получением соединения формулы (I);(ii) превращение соединения формулы (I) в другое соединение формулы (I); и(iii) получение соли соединения формулы(I) и/или его сольвата. Подходящие группы, способные превращаться в другие группы, включают защищенные формы упомянутых групп. Каждый из Аr', R', R1' или R3' предпочтительно представляет собой Аr, R, R1 или R3, соответственно, или их защищенную форму.R2' предпочтительно представляет собой иную группу, чем защищенная форма, которая посредством общепринятых методов может быть превращена в R2.R4' предпочтительно представляет собой водород, для того, чтобы соединения формулы(I), где требуемое значение R4 алкил можно было удобно получить из соответствующего соединения, в котором R4 является водородом. Предпочтительно, чтобы соединение формулы (II) присутствовало в виде активного производного. Подходящее активное производное соединения формулы (II) представляет собой неустойчивую активированную форму соединения формулы (II) или производное, где карбоксильная группа соединения формулы (II) замещена другой группой или атомом, например карбоксигалогенидом, предпочтительно хлоридом, или азидом или ангидридом карбоновой кислоты. Другие подходящие активные производные включают смешанный ангидрид, образованный карбоксильной группой соединения формулы (II) и алкилхлорформиатом; активированный сложный эфир, например цианометиловый эфир, тиофениловый эфир, п-нитрофениловый эфир, п-нитротиофениловый эфир, 2,4,6 трихлорфениловый эфир, пентахлорфениловый эфир, пентафторфениловый эфир, N-гидроксифталимидоэфир,N-гидроксипиперидиновый эфир, N-гидроксисукцинимидный эфир, Nгидроксибензотриазоловый эфир; альтернативно, карбоксильная группа соединения формулы(II) может быть активирована с применением карбодиимида или N,N'-карбонилдиимидазола. Реакцию между соединением формулы (II) или его активным производным и соединением формулы (III) проводят в условиях, соответствующих для конкретных выбранных соедине 001771 10 ний. Обычно, когда соединение формулы (II) присутствует в виде активного производного,реакцию проводят, используя такой же растворитель и такие же условия, которые применяют для получения активного производного, активное производное предпочтительно получают insitu перед образованием соединения формулы(Ib) и затем получают соединение формулы (I) или его соль и/или сольват. Например, реакцию между активным производным соединения формулы (II) и соединением формулы (III) можно проводить следующим образом:(а) путем получения сначала хлорангидрида кислоты и затем взаимодействия упомянутого хлорида с соединением формулы (III) в присутствии неорганического или органического основания в подходящем апротонном растворителе, например диметилформамиде (DMF), при температуре в диапазоне от -70 до 50 С (предпочтительно в диапазоне от -10 до 20 С); или (в) обработкой соединения формулы (II) соединением формулы (III) в присутствии подходящего конденсирующего агента, например N,N'карбонилдиимидазола (CDI) или карбодиимида,например, дициклогексилкарбодиимида (DCC) или N-диметиламинопропил-N'-этилкарбодиимида, предпочтительно в присутствии Nгидроксибензотриазола (НОВТ), чтобы повысить выход и избежать процессов рацемизации(MeCN:THF) от 1:9 до 7:3 при температуре в диапазоне от -70 до 50 С (предпочтительно в диапазоне от -10 до 25 С). Предпочтительно реакцию осуществляют в соответствии с нижеприведенной схемой 1. Схема 1 где Аr', R', R1', R2', R3' и R4' являются такими, как они определены выше. Следует иметь в виду,что соединение формулы (Ib) может быть превращено в соединение формулы (I), или одно соединение формулы (I) может быть превращено в другое соединение формулы (I) посредством взаимопревращения соответствующих заместителей. Таким образом определенные соединения формулы (I) и (Ib) являются пригодными промежуточными соединениями для образования других соединений настоящего изобретения. Поэтому в соответствии с еще одним аспектом изобретение включает способ получения соединения формулы (I) или его соли и/или его сольвата, который включает превращение соединения вышеприведенной формулы (Ib), где, 11 по меньшей мере, один из Аr', R', R1', R2', R3' илиR4' не является соответственно Аr, R, R1, R2, R3 или R4, соответственно с получением соединения формулы (I); и затем, если это необходимо,проведения одной или нескольких из следующих стадий:(i) превращение соединения формулы (I) в другое соединение формулы (I); и(ii) получение соли соединения формулыAr', R', R1' и R3' представляют собой соответственно Ar, R, R1 или R3, или они являются их защищенными формами, R2' представляет собой группу или атом, которые могут быть превращены в переменную R2 посредством одной или нескольких стадий, и R4' является водородом,который затем, если это необходимо, превращают в C1-6-алкильную группу.R2' предпочтительно представляет собой ОН, СН 3 или аминогруппу.R2' может также представлять группу-X-(CH2)n-Y', где Х и n являются такими, как они определены в формуле (I), и Y' представляет собой группу Y, которая способна превращаться в другую группу Y, например, Y' представляет собой NН 2. Превращение любой группы Ar', R', R1' илиR3' в Ar, R, R1 или R3, которые, как определено выше, обычно являются защищенными формами Ar, R, R1 или R3, можно проводить, используя соответствующие известные условия, например, соответствующий метод удаления защитной группы. Превращение любой группы R2' в R2(включая превращение любой группы Y' в другую группу Y в вышеприведенной группе-X-(CH2)n-Y') можно проводить, используя известные реагенты и условия: когда R2' представляет собой, например,ОН, соединения формулы (Ib) можно превратить в соединения формулы (I) таким образом,как это представлено на схемах 2 а и 2 в. где Ar', R', R1', R2' и R3' являются такими, как они определены выше, L является уходящей группой или атомом, таким как атом галогена,например бромом, каждый L2 и L3 независимо представляет собой уходящую группу или атом,предпочтительно одинаковые уходящие группу или атом, такой как атом галогена, например бром, q является целым числом, равным 1 или 2,r равно 0 или 1, х представляет собой целое число от 2 до 5, y представляет собой целое число в диапазоне от 1 до 4, Y1a и Y2a вместе с атомом азота, к которому они присоединены, представляют собой гетероциклическую группу, содержащую N-связанное одиночное или конденсированное кольцо, при этом одиночное или конденсированное кольцо является насыщенным или ненасыщенным и включает 5 или 6 атомов,причем кольцевые атомы необязательно включают 1 или 2 дополнительных гетероатома, выбранных из О или N, и где один или два кольцевых атома необязательно замещены одной или двумя оксогруппами или одной или двумя гидрокси, C1-6-алкоксикарбонилом, C1-6-алкилом,арилом или ароматическими гетероциклическими группами, содержащими одиночное или конденсированное кольцо, при этом арил или ароматические гетероциклические группы необязательно замещены одной или двумя C1-6 алкильными, алкоксильными, гидроксильными галогенами или галогеналкильными группами. На представленной схеме 2 а примеромHNY1a Y2a является 1,2,3,4-тетрагидроизохинолин. Реакции на cхемах 2 а и 2 в показывают, что когда R2' является ОН, соединение формулы (Ib) может быть превращено в соединение, где R2 является -O-(CH2)n -Y', где n является таким, как он определен в формуле (I), и Y' является Y, 13 который определен в формуле (I), или представляет собой группу, способную в него превращаться посредством взаимодействия с соединением формулы (IV):(IV),где n и Y' являются такими, как они определены и проиллюстрированы выше, и L1 является уходящей группой или атомом, таким как атом галогена, например бромом и хлором. Конкретные применяемые реакционные условия зависят от таких факторов, как специфический характер требуемого превращения и от природы соединения формулы (IV), но при этом обычно применяют соответствующие известные условия. Например, как показано на схеме 2, когда R2' является ОН, его можно превратить в 2-аминоалкокси взаимодействием с 2 бром-алкилфталимидом и карбонатом калияO(CH2)nNH2, где n является таким, как он определен выше) можно превратить в циклический третичный амин взаимодействием с о-дибромалкилбензолом в DMF при 80 С, используя TEA для улавливания образующегося бромистого водорода. Первичный аминоалкоксихинолин можно также превратить в гомофталимидоалкоксихинолин кипячением с обратным холодильником с гомофталевым ангидридом в толуоле и азеотропной отгонкой образующейся воды, используя аппарат Дина-Старка или молекулярные сита 4 . Карбонил в положении 3 гомофталимидогруппы может быть восстановлен до гидрокси с помощью боргидрида натрия(NaBH4) в метаноле при комнатной температуре; затем гидроксильную группу можно удалить реакций с мезилхлоридом (MsCl) и TEA, и образовавшуюся двойную связь можно восстановить водородом, используя палладиевый катализатор на углероде (5% Pd на С) в смеси уксусной кислоты и трифторуксусной кислоты (AcOH/TFA). Гидроксильная группа в положении 3 хинолинового кольца может быть также алкилирована бромалкиловым сложным эфиром, например этилбромацетатом и К 2 СО 3 в THF при комнатной температуре; образованная сложноэфирная группа может быть восстановлена до спирта с помощью боргидрида селективного металла, например, NaBH4 в кипящем третВuОН/МеОН (Bull. Chem. Soc. Japan, 1984, 57,1948 или Synth. Commun., 1982, 12, 463). Затем гидроксильная группа может быть окислена до соответствующего альдегида в стандартных условиях Сверна с помощью оксалилхлорида/DMSO при -60 С в СН 2 Сl2. (Tetrahedron, 1978,34, 1651). Восстановительное аминирование образованного таким образом альдегида циклическим вторичным амином, например 1,2,3,4 тетрагидроизохинолином и NаСNВН 3 в метано 001771 14 ле при комнатной температуре (J. Am. Chem.Soc. 1971, 93, 2897) дает соответствующее 1,2,3,4-тетрагидроизохинолинилалкоксипроизводное. На cхеме 2 в показано, что соединения формулы (Ib), где R2' является ОН, могут взаимодействовать с соединением формулы (IV), гдеY представляет собой гетероциклическую группу, содержащую N-связанное одиночное или конденсированное кольцо, которая определена в отношении Y формулы (I), с получением соответствующего соединения формулы (I), где Y представляет собой упомянутую гетероциклическую группу, содержащую N-связанное одиночное или конденсированное кольцо. На cхеме 2 в гетероциклическая группа HNY1aY2a представляет собой, например, N-связанный пиперазин. Реакцию проводят в известных условиях алкилирования в апротонном растворителе, например, тетрагидрофуране, предпочтительно в присутствии основания, например, карбоната калия, обычно при повышенной температуре,предпочтительно при температуре кипения растворителя. Когда R2' является СН 3, соединения (Ib) можно превратить в другие соединения формулы (I), как показано на cхеме 3. Схема 3 где Аr', R', R1', R2' и R3' являются такими, как они определены выше, и где Y1a и Y2a являются такими, как они определены для схем 2 а или 2 в. В частности, когда R2' является СН 3, его можно превратить в производное моноалкилили диалкиламинометилхинолина взаимодействием промежуточного бромметилового производного (полученного, используя N-бромсукцинимид в дихлорэтане в присутствии каталитического количества бензоилпероксида) с соответствующими аминами с получением, например,3-морфолинометилового производного. Когда R2' является NH2, соединения (Ib) можно превратить в другие соединения формулы (I), используя соответствующие известные методы. В частности, когда R2' является NH2, его можно превратить в моноалкил или диалкиламиноациламиногруппу взаимодействием с хлорацилхлоридом и последующим замещением атома хлора или с фталимидом калия в DMF при кипячении с обратным холодильником, с последующим гидролизом, гидразингидратом в спиртовой среде или с соответствующим моноили диалкиламином в метаноле, применяемом в качестве растворителя, при температуре от 20 до 100 С. В соответствии с еще одним особым аспектом предложен способ получения соединений формулы (I), где Аr является фенилом, R 15 является C1-6-алкилом, R4 является водородом или C1-6-алкилом и R2 представляет собой группу -(СН 2)n-NHY3, где Y3 представляет собой группу -CR(Ar)(R4), где Аr и R являются такими, как они были определены ранее, и n является таким, как он определен в формуле (I), который включает:(II), где R1' и R3' являются такими, как они определены выше, и R2' является -(СН 2)n-1-СН 3; и последующее(в) взаимодействие галогенированного продукта с соединением формулы (V): где Аr', R' и R4' являются такими, как они определены ранее или представляют собой их защищенные формы. Соединение формулы (II) предпочтительно находится в активированной форме, которая описана выше, в частности в виде сложного трет-бутилового эфира. Реакцию галогенирования проводят с использованием известных галогенирующих агентов, например, с использованием для бромирования N-бромсукцинамида, обычно в инертном растворителе, например, в треххлористом углероде, при любой температуре, обеспечивающей подходящую скорость образования требуемого продукта, предпочтительно при повышенной температуре, например, при температуре кипения растворителя. Реакцию между упомянутым галогенированным продуктом и соединением формулы (V) предпочтительно проводят в протонном растворителе, обычно в спиртовом растворителе, например, в этаноле, при температуре в диапазоне от 0 до 50 С. Превращение R4', когда он представляет собой водород, в C1-6-алкильную группу, осуществляют с применением соответствующего известного метода, например, метода, показанного на схеме 4. Схема 4 где Аr', R', R1', R2', R3' и R4' являются такими, как они определены выше. Подходящие превращения одного соединения формулы (I) в другое соединение формулы (I) включают превращения, где одну группу из R, R1, R2, R3 или R4 превращают соответственно в другую группу R, R1, R2, R3 или R4, причем превращения обычно осуществляют через соответствующие группы Ar', R', R1', R2', R3' иR4', используя известные методы, например,такие, которые представлены на приведенных здесь реакционных схемах. 16 Примеры превращений одного соединения формулы (I) в другое соединение формулы (I) включают такие, где R2 превращают в другие значения R2. Таким образом, когда R2 является группой -О-(СН 2)n-NH2; где n является таким,как он определен в формуле (I), подходящие превращения в другие значения R2 показаны на схеме 5 Схема 5 где Ar', R', R1', R2' и R3' являются такими, как они определены в формулах (II) и (III). Реакцию соединения формулы (I), где R2 является группой -O-(CH2)n-NH2 (первичный амин), с защищенным FMOC глицинилхлоридом или с его соответствующим замещенным производным с получением соединения, имеющего N-связанную 4-оксоимидазолидинильную группу, или ее замещенного производного проводят в инертном растворителе, например, метилендихлориде при любой температуре, обеспечивающей подходящую скорость образования требуемого продукта, обычно при температуре от пониженной до комнатной, например, от 0 С до комнатной температуры, при этом сначала получают аминоацетиламиноэтоксильное производное или его соответствующее замещенное производное. Замыкание кольца этого промежуточного соединения осуществляют обработкой соответствующим альдегидом или кетоном, выбор которого зависит от природы требуемого кольца. Поэтому, когда требуемым кольцом является 2,2-диметилзамещенное кольцо, тогда применяют ацетон, обычно в растворителе нбутаноле при кипячении в колбе с обратным холодильником или, когда требуемым кольцом является 2-фенилзaмещенное кольцо, тогда применяют бензальдегид в метаноле при кипячении с обратным холодильником. Альтернативно, когда промежуточный первичный амин взаимодействует с ангидридом янтарной кислоты в ароматическом углеводородном растворителе, например толуоле, обычно при повышенной температуре, например при температуре кипячения растворителя, полученное промежуточное 3-карбоксипропаноильное соединение можно циклизовать с получением сукцинамидогруппы нагреванием с тетрагидронафталином. Соединение, где Y представляет собой 1,4 дигидро-3(2 Н)-изохинолинон-2-ильную группу 17 или его производное, получают из промежуточного первичного амина взаимодействием с соответствующим изохроманоном в спиртовом растворителе, например, в этаноле, предпочтительно в абсолютном этаноле, при повышенной температуре, например, при температуре кипения растворителя, получая промежуточное 2-(2 гидроксиметил)фенилацетильное производное,которое циклизуют сначала путем активации,например, путем хлорирования гидроксиметильной группы тионилхлоридом, с последующей обработкой основанием для достижения циклизации, таким как гидрид натрия в тетрагидрoфуране, циклизацию предпочтительно проводят в присутствии каталитического количества 1,3-диметил-2-имидазолидинона. Как упоминалось ранее, соединения формулы (I) могут существовать более, чем в одной стереоизомерной форме, и способом изобретения можно получить рацематы, а также энантиомерно чистые формы. Соответственно чистый энантиомер соединения формулы (I) получают взаимодействием соединения вышеопределенной формулы (II) с подходящим энантиомерно чистым первичным амином формулы где R', R4' и Аr' являются такими, как они определены выше, с получением соединения формулы (I'а) или (I'с) где Аr', R', R1', R2', R3' и R4' являются такими, как они определены выше. Соединения формулы (I'а) или (I'с) можно затем превратить в соединения формулы (Iа) или (Iс) с помощью упомянутых ранее методов превращения где Аr, R, R1, R2, R3 и R4 являются такими, как они определены выше. В вышеупомянутых соединениях формул(Iа), (Iс), (I'а), (I'с), (III'a) и (III'c) R4 предпочтительно представляет собой водород. Альтернативный способ разделения оптических изомеров, например таких соединений формулы (I), где R4 не является водородом, состоит в применении известных методов фракционного разделения, в частности, методов фракционной кристаллизации. Таким образом, чистый энантиомер соединения формулы (I) получают фракционной кристаллизаций диастереомерной соли, образованной реакцией рацемического соединения формулы (I) с оптически активным сильным кислотным разделяющим агентом, например камфосульфокислотой, в соответствующем спиртовом растворителе, например в этаноле или в метаноле или в кетонном растворителе, например, в ацетоне. Процесс образования соли следует проводить при температуре между 20 С и 80 С, предпочтительно при 50 С. В том случае, когда в молекуле присутствуют другие основные функциональные группы,например первичный, вторичный или третичный амин, становится доступным широкий диапазон оптически активных кислотных разделяющих агентов, включая винную кислоту,О,О'-ди-п-толуолвинную кислоту и миндальную кислоту. Соединения формулы (I), где R2 является СН 3, ОН или NH2 и защищенные формы таких соединений являются или известными соединениями или их получают в соответствии с методами, применяемыми для получения известных соединений, так например, 3-метил-2-фенил-4 хинолинкарбоновую кислоту (R2 является СН 3,CAS=[43071-45-0]) получают в соответствии с методами, описанными в: Synthesis (1993), page 993; 3-гидрокси-2-фенил-4-хинолинкарбоновую кислоту (R2 является ОН, САS=[485-89-2]) получают в соответствии с методами, описанными в патенте США 2776290 (1957); и 3-амино-2 фенил-хинолинкарбоновую кислоту (R2 является(1972), 4, 525-6). Соединения формулы (III) и (V) представляют собой коммерчески доступные соединения(в особенности, где R' является алкилом) или их можно получить из известных соединений известными методами, например соединения формулы (III), в которой R' является алкоксикарбонилом и R4' является водородом и Аr' яв 19 ляется таким, как он определен для соединений формулы (I) можно получить способами, описанными в Liebigs Ann. Der Chemie,523.199,1936. Соединения формулы (IV) являются известными соединениями или их можно получить, используя методы, аналогичные тем, которые применяют для получения известных соединений, например такие, которые раскрыты в патентах США 4386091 (Mead Johnson) и 4487773 (Mead Johnson). Следует иметь в виду, что в любой из вышеприведенных реакций любая реакционноспособная группа в молекуле субстрата может быть защищена в соответствии с общепринятыми химическими методами, применяемыми в практике. Подходящими защитными группами в любой из вышеприведенных реакций являются такие, которые обычно применяют в данной области. Так например, подходящие защитные группы для гидроксила включают бензильные или триалкилсилильные группы. Способы образования и удаления таких защитных групп представляют собой известные способы, подходящие для подлежащей защите молекулы. Так например, бензилоксигруппа может быть получена обработкой соответствующего соединения бензил-галогенидом, например, бензилбромидом, и затем, если это необходимо, бензильная группа может быть подходяще удалена каталитическим гидрированием или с использованием мягкого реагента, расщепляющего эфир, например, триметилсилилиодида или трибромида бора. Как указывалось выше, соединения формулы (I) обладают полезными фармацевтическими свойствами, соответственно настоящее изобретение также включает применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в качестве активного терапевтического средства. Кроме того, настоящее изобретение включает фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль или сольват и фармацевтически приемлемый носитель. Настоящее изобретение также включает применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата для производства лекарственного средства для лечения первичных и вторичных заболеваний. Такое лекарственное средство и препарат этого изобретения могут быть получены смешиванием соединения изобретения с соответствующим носителем. Оно может содержать разбавитель, связующее, наполнитель, разрыхляющий агент корригент, краситель, смазывающее вещество или консервант. Подходящими наполнителями могут быть такие, например, которые используют для полу 001771 20 чения композиций на основе известных агентов для лечения различных состояний. Фармацевтическая композиция изобретения предпочтительно находится в единичной дозированной форме и в форме, приспособленной для применения в области медицины и ветеринарии. Так, например, такие препараты могут находиться в упакованной форме с приложенной написанной или напечатанной инструкцией по его использованию в качестве агента для лечения различных состояний. Подходящий диапазон доз соединений изобретения зависит от применяемого соединения и от состояния больного. Доза, кроме всего,также будет зависеть от всасываемости лекарственного вещества, частоты и способа введения лекарственного средства. Соединение или композицию изобретения готовят для введения любым способом, предпочтительно в единичной дозированной форме или в такой форме, которая может быть введена больным себе в виде однократной дозы. Предпочтительно композиция является подходящей для перорального, ректального, местного, парентерального, внутривенного или внутримышечного введения. Препараты могут быть предназначены для медленного выделения активного ингредиента. Композиции могут быть, например, в форме таблеток, капсул, саше, ампул, порошков,гранул, лепешек, восстанавливаемых порошков или в виде жидких препаратов, например, растворов или суспензий, или суппозиториев. Композиции, подходящие, например, для перорального приема, могут содержать обычные наполнители, например, связующие вещества, такие как сироп, камедь, желатин, сорбит,трагакант или поливинилпирролидон; наполнители, например, лактозу, сахар, маисовый крахмал, фосфат кальция, сорбит или глицин; таблетирующие смазывающие вещества, например,стеарат магния; разрыхляющие вещества, например, крахмал, поливинилпирролидон, натрий-крахмал гликолят или микрокристаллическую целлюлозу; или фармацевтически приемлемые схватывающие вещества, например, лаурилсульфат натрия. Твердые композиции можно получить обычными методами смешивания, наполнения,таблетирования или подобными методами. Для распределения активного вещества в таких препаратах, в которых применяют большие количества наполнителей, операции смешивания можно использовать повторно. Когда препарат находится в форме таблетки, порошка или лепешки, может быть использован любой носитель,подходящий для получения твердых лекарственных препаратов, примерами таких носителей являются стеарат магния, крахмал, глюкоза,лактоза, сахароза, рисовая мука и мел. Таблетки могут быть покрыты в соответствии с методами, хорошо известными в области 21 обычной фармацевтической практики, в частности, они могут быть покрыты энтеросолюбильным покрытием. Препараты могут быть также в форме принимаемой внутрь капсулы, например в форме содержащей соединение желатиновой капсулы, по желанию с носителем или с другими наполнителями. Композиции, подходящие для перорального приема в виде жидкостей, могут быть, например, в форме эмульсий, сиропов или эликсиров или могут представлять собой сухой продукт, смешиваемый с водой или другим подходящим наполнителем перед приемом. Такие жидкие препараты могут содержать обычные добавки, например, суспендирующие агенты,такие как сорбит, сироп, метилцеллюлоза, желатин,гидроксиэтилцеллюлоза,карбоксилметилцеллюлоза; гель стеарата алюминия, гидрированные съедобные жиры; эмульгаторы,например лецитин, сорбитанмоноолеат или камедь; водные или неводные растворители, которые включают съедобные масла, например миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры, например,сложные эфиры глицерина, или пропиленгликоль, или этиловый спирт, глицерин, воду или обычный физиологический раствор; консерванты, например, метил- или пропил-п-гидроксибензоат или сорбиновую кислоту; и, по желанию, обычные корригенты или красители. Соединения этого изобретения могут быть также введены неперорально. Препараты могут быть приготовлены в соответствии с обычной фармацевтической практикой в виде суппозиториев, подходящих, например, для ректального введения. Их можно также получить в инъецируемой форме в водном или неводном растворе,суспензии или эмульсии в фармацевтически приемлемой жидкости, например в стерильном пирогене, не содержащем воды, или в парентерально приемлемом масле или в смеси жидкостей. Жидкость может содержать противомикробные средства, антиоксиданты или другие консерванты, буферы или растворенные вещества, предназначенные для того, чтобы сделать раствор изотоничным с кровью; загустители,суспендирующие агенты или другие фармацевтически приемлемые добавки. Такие формы будут присутствовать в виде единичной дозированной формы, например в виде ампул или устройства для инъекций или в виде многократно дозируемых лекарственных форм, например в виде сосуда, из которого отбирают соответствующую дозу, или в виде твердой формы или концентрата, который может быть использован для получения инъецируемого препарата. Соединения этого изобретения могут быть также введены посредством ингаляции, например назально или перорально. Такое введение можно осуществить с помощью аэрозоля, содержащего соединение изобретения и подходя 001771 22 щий носитель, необязательно суспендированный, например, в углеводородном пропелленте. Предпочтительные аэрозоли содержат микронные частицы соединения в комбинации с поверхностно-активным веществом, растворителем или диспергатором для предотвращения осаждения суспендированных частиц. Размер частиц соединения предпочтительно составляет от 2 до 10 мкм. Еще один способ введения соединений изобретения включает чрескожную доставку лекарственного средства с применением препаративной формы в виде пластыря, прикладываемого к коже. Предпочтительная препаративная форма включает соединение изобретения,диспергированное в адгезиве, чувствительном к давлению, которое прилипает к коже, посредством чего обеспечивается диффузия соединения из адгезива через кожу больного для доставки вещества. Для постоянной скорости абсорбции через кожу можно использовать адгезивы, чувствительные к давлению, являющиеся известными в данной области, например натуральный каучук или силикон. Как упоминалось выше, эффективная доза соединения зависит от конкретного применяемого соединения, состояния больного и от частоты и способа введения. Единичная доза обычно включает от 20 до 1000 мг и предпочтительно от 30 до 500 мг, в особенности 50, 100, 150,200, 250, 300, 350, 400, 450 или 500 мг. Композиция может быть введена однократно или несколько раз в день, например 2,3 или 4 раза в день, и общая суточная доза для взрослого человека весом 70 кг будет обычно составлять от 100 до 3000 мг. Альтернативно единичная доза содержит от 2 до 20 мг активного ингредиента и может быть введена, по желанию, многократно для получения предписанной суточной дозы. При применении соединений изобретения, вводимых в соответствии с этим изобретением,неприемлемые токсикологические эффекты не наблюдались. Настоящее изобретение также включает способ лечения и/или профилактики первичных и вторичных заболеваний млекопитающих, в особенности человека, который включает введение млекопитающему, нуждающемуся в таком лечении и/или профилактике, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата. Активность соединений настоящего изобретения в качестве NК 3 лигандов определяли по их способности ингибировать связывание радиомеченных NК 3 лигандов, [125I] [Me-Phe7]NKB или [3H]-Сенктид, NК 3 рецепторов морской свинки и человека (Renzetti et al, 1991,Neuropeptide, 18, 104-114; Buel et al, 1992, FEBS,299(1), 90-95; Chung et al, 1994, Biochem. Biophys. Res. Commun., 198(3), 967-972). 23 Проведенные анализы связывания дали возможность определения концентрации индивидуального соединения, необходимой для снижения на 50% специфического связывания[125I] [Me-Phe7]-NKB и [-3H] Сенктида с NК 3 рецептором в условиях равновесия [IC50]. В анализах связывания для каждого испытуемого соединения определяли среднее значение IC50 из 2-5 отдельных экспериментов, проводимых с двойными или тройными параллельными определениями. Наиболее сильнодействующие соединения настоящего изобретения имеют значения IC50 в диапазоне 0,1-1000 нМ. Антагонистическую активность в отношении NК 3 соединений настоящего изобретения определяли по их способности ингибировать сокращение подвздошной кишки морской свинки, вызванное сенктидом (Maggi et al., 1990, Br. J. Pharmacol., 101,996-1000), круговой мышцы радужной оболочки глаза кролика (Hall et al., 1991, Eur. J. Pharmacol., 199, 9-14) и высвобождение Са, медиируемое NК 3 рецепторами человека. (Mochizukiet al., 1994, J. Biol. Chem., 269, 9651-9658). В функциональных анализах на морской свинке и кролике in vitro определяли для каждого испытуемого соединения среднее значение Кв из 3-8 отдельных экспериментов, где Кв является концентрацией индивидуального соединения,необходимой для получения двойного сдвига вправо кривой сенктида концентрация-ответная реакция. Функциональный анализ рецептора человека дает возможность определения концентрации индивидуального соединения, необходимой для снижения на 50% (значения IC50) высвобождения Са, вызванного NKB агонистом. В этом анализе соединения настоящего изобретения ведут себя как антагонисты. Терапевтический потенциал соединений настоящего изобретения при лечении состояний может быть оценен с применением моделей язвенных заболеваний. Как указывалось выше, соединения формулы (I) рассматривают так же, как соединения,пригодные в качестве диагностического средства. Соответственно, изобретение включает применение соединения формулы (I) в качестве диагностического средства для оценки степени вовлечения активности рецептора нейрокинина 3 (нормальной, повышенной или недостаточной) в симптомы больного. Такое применение включает применение соединения формулы (I) в качестве антагониста указанной активности,включая, например, но не ограничиваясь, оборот инозитолфосфата, вызванный тахикининовым агонистом, или электрофизиологическую активацию образца клетки, полученного от больного. Сравнение такой активности в присутствии или отсутствии соединения формулы(I) даст возможность обнаружить степень включения NK3 рецептора в обеспечение действия агониста на эту ткань. 24 Последующие примеры получения иллюстрируют получение промежуточных соединений, в то время как примеры иллюстрируют получение соединений настоящего изобретения. Соединения примеров представлены в нижеприведенных таблицах 1-3. Пример получения 1. Гидрохлорид 3 морфолинометил-2-фенилхинолин-4-карбоновой кислоты. 5,60 г (21,27 ммоля) 3-метил-2-фенилхинолин-4-карбоновой кислоты (САS [43071-450]) растворили в 100 мл CH2Cl2; добавили 7,60 г(42,50 ммоля) N-бромсукцинимида и 0,52 г (2,00 ммоля) дибензопипероксида и суспензию кипятили в течение 24 ч с обратным холодильником. После охлаждения реакционную смесь выпарили в вакууме до сухого остатка, растворили в 100 мл THF и добавили к 50 мл (573,92 ммоля) морфолина. Затем ее перемешивали при комнатной температуре всю ночь, выпарили в вакууме до сухого остатка и очистили колоночной флэш-хроматографией на силикагеле 230-240 меш с применением в качестве исходного элюента смеси CH2Cl2/MeOH 95:5, содержащей 0,5% NH4OH (28%), в качестве конечного элюента смеси CH2Cl2/MeOH 80:20, содержащей 2%NH4OH (28%). Полученный продукт растворили в ацетоне и подкислили HCl/Et2O; фильтрацией с водоструйным насосом отделяли образованный таким образом осадок; получили 0,85 г названного соединения в виде белого твердого вещества.C21H20N2O3HCl Температура плавления = 173-175 С. Молекулярная масса = 384,87. ИК спектр (Nujol): 3700-3100; 2750-200; 1710, 1630 см-1. Пример получения 2. (S)-N-(-Этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамид. 2,49 г (9,4 ммоля) 3-гидрокси-2-фенилхинолин-4-карбоновой кислоты (САS [485-89-2]) суспендировали в 150 мл смеси THF/СН 3 СN при соотношении компонентов в смеси 7:3; добавили 1,40 г (10,3 ммоля) 1-гидроксибензотриазолаCH2Cl2, и реакционную смесь перемешали в течение 30 мин при комнатной температуре. Добавили по каплям 2,13 г (10,3 ммоля) дициклогексилкарбодиимида (DCC), растворенного в 20 мл CH2Cl2. Реакционную смесь выдержали при комнатной температуре в течение всей ночи, реакцию остановили добавлением 20 мл Н 2 О, выпарили в вакууме до сухого остатка и растворили в EtOAc. Отфильтровали осажденную дициклогексилмочевину, и органический слой промыли Н 2 О, 20% лимонной кислотой,насыщенным раствором NаНСО 3, насыщенным раствором NaCl. Органический слой отделили,сушили над Na2SO4 и выпарили в вакууме до 25 сухого остатка, остаток очистили колоночной хроматографией на силикагеле 60-240 меш с применением в качестве исходного элюента смеси гексан/EtOAc при соотношении компонентов в смеси 9:1 и качестве конечного элюента смеси гексан/EtOAc при соотношении компонентов в смеси 7:3. Сырой продукт перекристаллизовали из изо-РrОН, при этом получили 1,75 г названного соединения в виде белого твердого вещества.(14,5 ммоля) К 2 СО 3, 0,87 мл (7,8 ммоля) этилбромацетата и каталитическое количество KJ, и смесь выдержали при комнатной температуре в течение 2 ч 30 мин. После того, как отфильтровали неорганические соли, раствор выпарили в вакууме до сухого остатка, растворили в EtOAc и промыли водой; органический слой отделили, сушили надNa2SO4 и выпарили в вакууме до сухого остатка,получив 3,3 г желтого масла. Это масло очистили колоночной флэш-хроматографией на силикагеле 230-400 меш при элюировании смесью гексана/EtOAc при соотношении компонентов в смеси 7:3, содержащей 0,5% NH4OH (28%). Полученное сырое твердое вещество растерли с изо-Рr2O/изо-РrОН, фильтровали, промыли и сушили, получив 2,1 г названного соединения в виде белого твердого вещества.uA): 468 (М+.); 439; 334; 306; 278. Пример получения 4. (S)-N-(-Этилбензил)-2-фенил-3-(2-фталимидоэтокси) хинолин-4 карбоксамид. В 20 мл THF растворили 1,90 г (5,0 ммолей) (S)-N-(-этилбензил)-3-гидрoкси-2-фенилхинолин-4-карбоксамида (продукт примера получения 2). В 15 мл THF растворили 3,80 г (14,9 ммоля) N-(2-бромэтил)фталимида, добавили 2,0 г (14,5 ммоля) К 2 СО 3 и 0,25 г KJ, суспензию перемешали при комнатной температуре в течение 2,5 ч и затем в течение 2 ч кипятили с обратным холодильником. Добавили дополнительно 1,90 г (7,4 ммоля) N-(2-бромэтил) фталимида и каталитическое количество KJ, и реакционную смесь в течение 3,5 ч кипятили с обратным холодильником; добавили еще 0,50 г(2,0 ммоля) N-(2-бромэтил)фталимида и каталитическое количество KJ, и реакционную смесь в течение 5 ч кипятили с обратным холодильником. Отфильтровали неорганические соли, и реакционную смесь выпарили в вакууме до сухого остатка, растворили в СН 2 Сl2 и промыли водой; органический слой отделили, сушили надNa2SO4 и выпарили в вакууме до сухого остатка. Остаток очистили колоночной флэш-хроматографией на силикагеле 230-240 меш, сначала элюировали смесью гексан/этилацетат 8:2, содержащей 0,5% NH4OH (28%) и затем смесью гексан/этилацетат 3:2, содержащей 0,5% NH4OH(28%). Полученное сырое твердое веществоuA): 555 (М+.), 526, 421, 174. Пример получения 5. (S)-N-(-Этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4 карбоксамид. В 150 мл 96 % EtOH растворили 2,2 г (3,9 ммоля) (S)-N-(-этилбензил)-2-фенил-3-(2-фталимидоэтокси)хинолин-4-карбоксамида (соединение примера получения 4); раствор нагрели до кипения, добавили 0,38 мл (7,8 ммоля) гидра 27 зингидрата, и реакционную смесь кипятили с обратным холодильником в течение 4 ч. Через каждые 12 ч при кипячении с обратным холодильником дополнительно добавляли 0,4 мл (8,2 ммоля), 0,2 мл (4,1 ммоля), 0,2 мл(4,1 ммоля), 0,4 мл (8,2 ммоля), 0,4 мл (8,2 ммоля) гидразингидрата. Затем реакционную смесь выпарили в вакууме до сухого остатка и добавили 20 мл H2O; ее охладили в бане со льдом и добавили 10 мл концентрированной НСl. Реакционную смесь в течение 1 ч кипятили с обратным холодильником и затем после охлаждения отфильтровали фталиевый гидразид. Полученный водный фильтрат промыли EtOAc, подщелочили 2N NaOH и экстрагировали EtOAc. Органический слой промыли насыщенным раствором NaCl, сушили над Nа 2SO4 и выпарили в вакууме до сухого остатка. Остаток очистили колоночной флэш-хроматографией на силикагеле 230-240 меш, при элюировании смесью EtOAc/FAB газ Хе; 8 кВ; источник 50); 426 (МН+) Пример получения 6. (S)-N-(-Этилбензил)-3-формилметокси-2-фенилхинолин-4 карбоксамид. В атмосфере азота в 5 мл сухого СН 2 Сl2 растворили 0,64 мл (7,4 ммоля) оксалилхлорида. Раствор охладили при -55 С и по каплям добавили 0,53 мл (7,4 ммоля) DMSO, растворенного в 15 мл сухого CH2Cl2, поддерживая температуру -55 С. Раствор перемешивали в течение 7 мин, затем при сохранении температуры между -55 и -50 С по каплям добавили 2,1 г (4,9 ммоля) (S)-N-(-этилбензил)-3-(2 гидроксиэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера 2), растворенного в 50 мл сухого СН 2 Сl2. Через 30 мин по каплям добавили 4,6 мл (33,0 ммоля) TEA и температуру подняли до комнатной. Добавили 10 мл Н 2 О,органический слой отделили и промыли Н 2 О, 20NаНСО 3, насыщенным раствором NaCl, сушили над Na2SO4, фильтровали и выпарили в вакууме до сухого остатка. Остаток очистили градиентной колоночной флэш-хроматографией на силикагеле 230400 меш с применением в качестве исходного 28 элюента смеси гексан/EtOAc при соотношении компонентов в смеси 70:30, содержащей 0,5 %EtOAc, содержащего 0,5 % NH4OH (28%). Сырой продукт растерли с изо-Рr2O, при этом получили 0,53 г названного соединения, которое использовали без дальнейшей очистки. С 27 Н 24N2 О 3. Молекулярная масса = 424,50. Пример 1. (S)-N-(-Этилбензил)-3-морфолинометил-2-фенилхинолин-4-карбоксамид. В атмосфере азота в 25 мл смесиTHF/СН 3 СN 8:2 растворили 0,8 г (2,1 ммоля) гидрохлорида 3-морфолинометил-2-фенилхинолин-4-карбоновой кислоты (соединение примера получения 1); после охлаждения при -10 С добавили 0,31 г (2,3 ммоля) 1-гидроксибензотриазола (НОВТ), 0,29 мл (2,9 ммоля) TEA и 0,34 г (2,5 ммоля) (S)этилбензиламина. Реакционную смесь перемешали при температуре между -10 и -5 С в течение 5 мин, затем добавили 0,47 г (2,3 ммоля) дициклогексилкарбодиимида (DCC). Температуру подняли до комнатной, и реакционную смесь выдержали при перемешивании в течение 6 ч и затем всю ночь; после этого ее выпарили в вакууме до сухого остатка, растворили в CH2Cl2 и промыли насыщенным раствором NаНСО 3. Органический слой выпарили в вакууме до сухого остатка, растворили в 1NHCl, промыли изо-Рr2O, подщелочили насыщенным раствором NаНСО 3 и экстрагировалиCH2Cl2. Растворитель выпарили в вакууме до сухого остатка, и остаток подвергли хроматографии на силикагеле 60-240 меш при элюировании сначала смесью гексан/EtOAc 7:3, содержащей 1% NH4OH (28 %), и затем смесью гексан/EtOAc 3:2, содержащей 1% NH4OH(28%). Сырой продукт растворили в ацетоне, и раствор подкислили HCl/Et2 О фильтрованием с водоструйным насосом. Выделяли твердое вещество, и растерли с нагретым толуолом, при этом получили 0,43 г названного соединения в виде бледно-желтого твердого вещества. С 30 Н 31N3 О 2 НСl Температура плавления = 173-176 С. Молекулярная масса = 502,06. 29 В атмосфере азота в 50 мл трет-ВuОН растворили 0,65 г (1,4 ммоля) (S)-N-(-этилбензил)-3-(этоксикарбонилметокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 3), добавили 55 мл (1,4 ммоля) NaBH4, и смесь нагрели до кипения. Добавили по каплям 7 мл МеОН, реакционную смесь в течение 3-х ч кипятили с обратным холодильником и затем реакцию остановили 5 мл насыщенного раствора NH4Cl, выпарили в вакууме до сухого остатка, растворили в СН 2 Сl2 и промыли насыщенным раствором NaCl. Экстрагированный органический слой сушили над Na2SO4 и выпарили в вакууме до сухого остатка, получив 0,75 г сырого продукта, который очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси гексан/EtOAc 80:20, содержащей 0,5 % NH4OH (28%), и в качестве конечного элюента смеси гексан/EtOAc 50:50, содержащей 0,5% NH4OH (28%). Полученный очищенный продукт растерли с изо-РrОН, получив 0,28 г названного соединения в виде белого твердого вещества. С 27 Н 26N2 О 3. Температура плавления = 129-130 С. Молекулярная масса = 426,52.MS (EI; TSO 700; источник 180 С; 70 V; 200 uA); 426 (М+); 397; 292; 264. Пример 3. (S)-N-(-Этилбензил)-3-гидрокси-7-метил-2-фенилхинолин-4-карбоксамид. В атмосфере азота в 35 мл сухого THF и 20 мл CH3CN растворили 0,5 г (1,8 ммоля) 3 гидрокси-7-метил-2-фенилхинолин-4-карбоновой кислоты. Добавили 0,25 г (1,8 ммоля) (S)-этилбензиламина и 0,45 г (3,4 ммоля) НОВТ; раствор охладили до 0 С и по каплям добавили 0,41 г (2,0 ммоля) DCC, растворенного в 12 мл сухого СН 2 Сl2. Смесь перемешали в течение 1 ч при 0 С, в течение 2-х ч при комнатной температуре и в течение 2 ч при 40 С; после охлаждения осажденную дициклогексилмочевину отфильтровали, и фильтрат выпарили в вакууме до сухого остатка. Остаток растворили в CH2Cl2 и промыли 20% лимонной кислотой, насыщенным раствором NаНСО 3 и насыщенным раствором NaCl; органический слой сушили надNa2SO4, фильтровали и выпарили в вакууме до сухого остатка. 30 Сырой продукт очистили колоночной флэш-хроматографией на силикагеле 230-400 меш при элюировании CH2Cl2, содержащим 0,5% NP4OH (28%); затем продукт дополнительно очистили препаративной высокоэффективной жидкостной хроматографией, получили 30 мг названного соединения в виде белого твердого вещества.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA); 396 (М+); 367; 278; 261; 233. Пример 4. (S)-N-(-Этилбензил)-3-фтор-2 фенилхинолин-4-карбоксамид. В атмосфере азота в 10 мл сухого CH2Cl2 растворили 0,54 г (4,0 ммоля) (S)этилбензиламина и 0,7 мл (5,0 ммолей) TEA; по каплям добавили 1,14 г (4,0 ммоля) 3-фтор-2 фенилхинолин-4-карбонилхлорида (полученного из соответствующей карбоновой кислоты реакцией с оксалилхлоридом в СН 2 Сl2 при комнатной температуре), растворенного в 20 мл смеси сухого CH2Cl2/DMF 1:1, и реакционную смесь выдержали при комнатной температуре в течение всей ночи. Реакционную смесь выпарили в вакууме до сухого остатка,и остаток растворили в EtOAc и промыли Н 2 О, 5% лимонной кислотой, насыщенным раствором NаНСО 3 и насыщенным раствором NaCl. Органический слой сушили надNa2SO4, фильтровали и выпарили в вакууме до сухого остатка. Оставшееся масло очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента гексана, и в качестве конечного элюента смеси гексана/EtOAc 9:1,получили 0,5 г названного соединения.TEA и каталитическое количество KJ, и смесь нагрели в течение 3-х ч до 80 С. Реакционную смесь выпарили в вакууме до сухого остатка,растворили в 10% НСl и промыли гексаном. Зачем ее подщелочили 20% NaOH и экстрагировали CH2Cl2; органический слой промыли насыщенным раствором NaCl, сушили над Na2SO4,фильтровали и выпарили в вакууме до сухого остатка. Остаток очистили колоночной флэшхроматографией на силикагеле 230-400 меш при элюировании смесью гексан/EtOAc 7:3, содержащей 0,5 % NH4OH (28%); продукт дополнительно очистили препаративной высокоэффективной жидкостной хроматографией, растворили в EtOAc, и раствор подкислили HCl/Et2O, при этом получили 100 мг названного соединения в виде серого твердого вещества. С 35 Н 33N3O22 НСl. Температура плавления = 95 С (разл). Молекулярная масса = 600,59.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA); 527 (М+); 525; 383; 249. Пример 6. (S)-N-(-Этилбензил)-3-(2-гомофталимидоэтокси)-2-фенилхинолин-4-карбоксамид. В 20 мл толуола растворили 0,95 г (2,2 ммоля) соединения описания 5 и 0,47 г (2,9 ммоля) гомофталевого ангидрида; добавили растертые в порошок молекулярные сита, и раствор кипятили с обратным холодильником при перемешивании магнитной мешалкой и отогнали образующуюся воду с применением аппаратуры Дина-Старка. Реакционную смесь в течение 13 ч кипятили с обратным холодильником, затем после охлаждения отфильтровали молекулярные сита, и смесь выпарили в вакууме до сухого остатка. Остаток растворили в СН 2 Сl2 и промыли Н 2 О,20% лимонной кислотой, насыщенным раствором NаНСО 3 и насыщенным раствором NaCl,органический слой сушили над Na2SO4, фильтровали и выпарили в вакууме до сухого остатка. Сырой продукт очистили колоночной флэшхроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси гексан/EtOAc 70:30, содержащей 0,5%NH4OH (28%), и в качестве конечного элюента смеси гексан/EtOAc 50:50, содержащего 0,5%NH4OH (28%). Сырой продукт растерли в порошок с нагретой смесью изо-Рr2 О-изо-РrОН, получили 0,55 г названного соединения в виде белого твердого вещества. С 36 Н 31N3O4. Температура плавления = 159-161 С. Молекулярная масса = 569,67.MS (EI; TSQ 700; источник 180 С; 10 V; 200 uA); 569 (М+); 382; 187. Пример 7. (S)-N-(-Этилбензил)-2-фенил[2-(1,2,3,4-тетрагидро-2-изохинолинил)этокси] хинолин-4-карбоксамидгидрохлорид. В атмосфере азота в 10 мл СН 3 СN растворили 0,5 г (1,2 ммоля) (S)-N-(-этилбензил)-3 формилметокси-2-фенилхинолин-4-карбоксамида (соединение описания 6) и 0,3 мл (2,4 ммоля) 1,2,3,4-тетрагидроизохинолина. Добавили растертые в порошок молекулярные сита,и раствор выдержали при комнатной температуре и перемешивании в течение 30 мин; затем в течение 30 мин добавили 0,2 г (3,2 ммоля) NаСNВН 3. Реакционную смесь поддерживали при комнатной температуре в течение ночи, затем реакцию останавливали 15% NaOH, выдерживали при перемешивании в течение 20 мин и выпарили в вакууме до сухого остатка. Остаток растворили в 10% НСl, промыли Et2O, подкислили 15% NaOH и экстрагировали Et2O. Органический слой промыли Н 2 О, сушили надNa2SO4, фильтровали и выпарили в вакууме до сухого остатка. Остаток очистили колоночной флэш-хроматографией на силикагеле 230-400 меш при элюировании смесью гексан/EtOAc 7:3, содержащей 0,5% NH4OH (28%), при этом получили 140 мг продукта, который растворили в МеОН и подкислили HCl/Et2O. В вакууме выпарили растворитель до сухого остатка , и остаток растерли с нагретой смесью изо-Рr2 О-изоРrОН, получили 120 мг названного соединения.(3,9 ммоля) 1-амино-1-фенил-2-пропанола, (диастереомерная смесь) (Visconti, M., 1961,Helvetica Chimica Acta, 71, 631) 0,95 г (7,1 ммоля) НОВТ, 0,51 мл (4,6 ммоля) Nметилморфолина и 0,84 г (4,1 ммоля) DCC в 50 мл смеси THF и СН 3 СN 2:1. Обработку реакционной смеси осуществляли тем же способом,который представлен в примере получения 2. Оставшееся масло очистили колоночной флэшхроматографией на силикагеле 230-400 меш при элюировании смесью EtOAc/MeOH 98:2, содержащей 0,5 % NH4OH (28%), полученный сырой продукт растерли изо-РrОН, получили 690 мг названного соединения. С 25 Н 22N2O3. Молекулярная масса = 398,46(S)-N-(Этилбензил)-3-[2-(2'-гидроксиметилфенилацетил)аминоэтокси]-2-фенилхинолин-4-карбоксамид. В 25 мл абсолютного EtOH растворили 0,7 г (4,7 ммоля) изохроманона; добавили 2,0 г (4,7 ммоля) (S)-N-(-этилбензил)-3-(2-аминоэтокси)2-фенилхинолин-4-карбоксамида (соединение описания 5), и реакционную смесь в течение 12 ч кипятили с обратным холодильником. Добавили еще 0,3 г (2,0 ммоля) изохроманона, и реакционную смесь в течение 5 ч кипятили с обратным холодильником, затем добавили еще 0,5 г (3,4 ммоля) изохроманона, и реакционную смесь в течение 5 ч кипятили с обратным холодильником в течение еще 10-ти ч. После охлаждения реакционную смесь выпарили в вакууме до сухого остатка, и остаток очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси гексана/EtOAc 50:50, содержащей 0,5 % NH4OH (28%), и в качестве конечного элюента смеси гексан/EtOAc 20:80, содержащей 0,5 % NH4 ОH (28%). Полученный таким образом сырой продукт растерлиMS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 555; 438; 411; 382; 247; 218; 192; 174; 119. Пример получения 9. (S)-N-(-Этилбензил)-3-[2-(3-карбоксипропаноил)аминоэтокси]2-фенилхинолин-4-карбоксамид. В 20 мл толуола растворили 2,0 г (4.7 ммоля) (S)-N-(-этилбензил)-3-(2-аминоэтокси)-2 фенилхинолин-4-карбоксамида(соединение примера получения 5) и 0,6 г (6,2 ммоля) ангидрида янтарной кислоты; добавили растертые в порошок молекулярные сита, и реакционную смесь в течение 4-х ч кипятили с обратным холодильником в аппаратуре Дина-Старка. Реакционную смесь выпарили в вакууме до сухого остатка, растворили в 100 мл СН 2 Сl2 и промыли насыщенным раствором NaCl, 20% лимонной кислотой и насыщенным раствором NaCl. Органический слой сушили над Na2SO4 и выпарили в вакууме до сухого остатка, получив при этом 2,3 г сырого продукта, который очистили колоночной флэш-хроматографией на силикагеле 230240 меш, при элюировании сначала смесью СН 2 Сl2/МеОН 9:1 и затем смесью CH2Cl2/MeOH 8:2. Полученный сырой продукт растерли с изоРr2O/изо-РrОН, фильтровали, промыли и сушили, получив 1,4 г названного соединения. С 31 Н 31N3O5. Температура плавления = 118-122 С. Молекулярная масса = 525,60.(S,Z)-N-(Этилбензил)-3-[2-(3-карбоксипропеноил)аминоэтокси]-2-фенилхинолин-4-карбоксамид. В 50 мл толуола растворили 2,0 г (4,7 ммоля) (S)-N-(-этилбензил)-3-(2-аминоэтокси)-2 фенилхинолин-4-карбоксамида(соединение примера получения 5) и 0,61 г (6,2 ммоля) малеинового ангидрида. Добавили молекулярные сита,и реакционную смесь в течение 5 ч кипятили с обратным холодильником. После охлаждения реакционную смесь выпарили в вакууме до сухого остатка, растворили в СН 2 Сl2 и промыли насыщенным раствором NaCl, 20% лимонной кислотой и насыщенным раствором NaCl. Органический слой сушили над Na2SO4, и выпарили в вакууме до сухого остатка. Сырой продукт очистили колоночной флэш-хроматографией на силикагеле 230-240 меш, при элюировании смесью изо-Рr2 О/EtOAc 70:30, содержащей 0,5% 85% муравьиной кислоты, и затем растерли с изо-Рr2 О, получив 2,0 г названного соединения. С 31 Н 29N3O5. Температура плавления = 158-162 С. Молекулярная масса = 523,59.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 425; 407. Пример получения 11. (S)-N-(-Этилбензил)-3-(2-аминоацетиламиноэтокси)-2-фенилхинолин-4-карбоксамид. В 60 мл CH2Cl2 в атмосфере азота растворили 3,0 г (7,1 ммоля) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 5), добавили 1,2 мл (8,5 ммоля) TEA, раствор охладили до 0 С и по каплям добавили 2,7 г (8,5 ммоля)(9-флуоренилметоксикарбонил)глицинилхлорида (FMOC-глицинилхлорида), растворенного в 60 мл CH2Cl2. Реакционную смесь перемешали при комнатной температуре в течение 3-х ч и затем промыли насыщенным растворомNaCl, сушили над Na2SO4, и выпарили в вакууме до сухого остатка. Сырой продукт очистили градиентной колоночной флэш-хроматографией на силикагеле 230-240 меш с применением в качестве исходного элюента смеси гексана/EtOAc 1:1, ив качестве конечного элюента сме 001771 36 си EtOAc/MeOH 9:1. Продукт (5,0 г) растворили в 100 мл 10% раствора диэтиламина в DMF и перемешали при комнатной температуре в течение 30 мин. Затем реакционную смесь выпарили в вакууме до сухого остатка и очистили градиентной колоночной флэш-хроматографией на силикагеле 230-240 меш с применением в качестве исходного элюента смеси EtOAc/MeOH 9:1,и в качестве конечного элюента смеси(S)-N-(Этилбензил)-3-[2-(S)аминофенилацетиламиноэтокси]-2-фенилхинолин-4-карбоксамид. Проводили реакцию для получения FMOCзащищенного названного соединения, как описано в примере получения 11, используя в качестве исходных соединений 2,8 г (6,7 ммоля) (S)N-(-этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 5), 1,1 мл (8,0 ммолей) TEA и 3,1 г(8,0 ммолей) (S)-FMOC-фенилглицинилхлорида. Реакционную смесь перемешали при комнатной температуре в течение 20 ч и обработали, как описано в примере получения 11, при этом получили 4,5 г получения ЕМОС-защищенного названного соединения, удалили защитную группу, перемешивая при комнатной температуре в течение 30 мин с 90 мл 10% раствора диэтиламина в DMF. Затем реакционную смесь выпарили в вакууме до сухого остатка и очистили градиентной колоночной флэшхроматографией на силикагеле 230-240 меш с применением в качестве исходного элюентаEtOAc и в качестве конечного элюента смеси(S)-N-(Этилбензил)-3-[2-(R)аминофенилацетиламиноэтокси 1-2-фенилхинолин-4-карбоксамид. Реакцию проводили так же, как описано в примере получения 12, используя (R)-FMOCфенилглицинилхлорид вместо (S)-. Использовали такие же количества реагентов. Получили 0,8 г названного соединения.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 541; 453; 382; 292; 291; 247; 219; 106. Пример получения 14. 2-Этоксикарбонилметил-1,2,3,4-тетрагидроизохинолин. В 60 мл сухого THF в атмосфере азота растворили 6,0 г (45,0 ммолей) 1,2,3,4-тетрагидроизохинолина. Добавили 17,34 К 2 СО 3 и 5,0 мл(45,2 ммоля) этилбромацетата, и реакционную смесь перемешивали при комнатной температуре в течение ночи. Отфильтровали неорганические соли,и в вакууме выпарили растворитель до сухого остатка. Остаток растворили в CH2Cl2 и промыли насыщенным раствором NaCl, 5% лимонной кислотой, насыщенным растворомNaHCO3 и насыщенным раствором NaCl; сушили над Na2SO4, и выпарили в вакууме до сухого остатка, получив 6,6 г названного соединения,которое использовали без дополнительной очистки.C13H17NO2. Молекулярная масса = 219.28. ИК (KBr): 3100-3000; 1752 см-1. Пример получения 15. 2-(2-гидроксиэтил)1,2,3,4-гетрагидроизохинолин. В 100 мл сухого THF в атмосфере азота суспендировали 1,9 г (50,0 ммолей) LiAlH4; реакционную смесь охладили до 0 С и по каплям добавили 5,0 г (22,8 ммоля) 2-этоксикарбо 001771(соединение примера получения 14), растворенного в 100 мл сухого THF. Реакционную смесь выдержали при комнатной температуре в течение 2-х ч, охладили на бане со льдом и реакцию останавливали 2,5 мл Н 2 О, 7,5 мл 75% NaOH, 2,5 мл H2O, перемешали в течение 30 мин и фильтровали. Фильтрат выпарили в вакууме до сухого остатка, растворили в CH2Cl2 и промыли насыщенным раствором NaCl. Органический слой сушили над Na2SO4, и выпарили в вакууме до сухого остатка, получив при этом 3,9 г названного соединения, которое использовали без дополнительной очистки.(53,6 ммоля) дигидрата динатриевой соли этилендиаминтетрауксусной кислоты и 17,1 г (53,6 ммоля) ацетата ртути (II). Добавили 65 мл 2NNaOH,и реакционную смесь в течение 4-х ч кипятили с обратным холодильником. После охлаждения реакционную смесь экстрагировали СН 2 Сl2, промыли 5% НСl, насыщенным раствором NаНСО 3 и насыщенным раствором NaCl,сушили над Na2SO4 и досуха выпарили в вакууме, при этом получили 2,6 г названного соединения, которое использовали без дополнительной очистки.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 911(М+); 173; 160. Пример получения 17. 2-(2-Хлорэтил)-3,4 дигидро-1-(2 Н)-изохинолинон. В 150 мл СНСl3 растворили 2,5 г (13,1 ммоля) 2-(2-гидроксиэтил)-3,4-дигидро-1-(2H)изохинолинона (соединение примера получения 16). Добавили по каплям 1,24 мл (17,0 ммолей)SOCl2, растворенного в 30 мл СНСl3, и реакционную смесь в течение 2-х ч нагрели до 55 С и затем выпарили в вакууме до сухого остатка. Остаток растворили в EtOAc, подщелочили насыщенным раствором К 2 СО 3, экстрагировали и дважды промыли насыщенным раствором NaCl. Органический слой сушили над Na2SO4 и выпарили в вакууме до сухого остатка, получив при этом 2,7 г названного соединения, которое использовали без дополнительной очистки.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 209(М+);174; 160. Пример получения 18. 3-(N-Бензил-Nметиламино)метил-2-фенилхинолин-4-карбоновая кислота. В 500 мл дихлорэтана растворили 10,0 г(37,98 ммоля) 3-метил-2-фенил-4-хинолинкарбоновой кислоты (CAS=[43071-45-0]). Добавили 13,7 г (76,12 ммоля) N-бромсукцинимида и 1,0 г (3,85 ммоля) дибензоилпероксида,и раствор в течение 8 ч кипятили с обратным холодильником. Реакционную смесь выпарили в вакууме до сухого остатка,и остаток растворили в 250 мл THF; добавили 20 мл (155,50 ммолей) Nбензил-N-метиламина, раствор перемешали при комнатной температуре в течение 24-х ч. Осажденное вещество отфильтровали, и фильтрат выпарили в вакууме до сухого остатка. Остаток растворили в 300 мл 10% К 2 СО 3 и выпарили в вакууме до сухого остатка. Темное масло растворили в 200 мл ацетона, остаток отфильтровали, и фильтрат выпарили в вакууме до сухого остатка. Добавили 100 мл воды, и раствор, подкисленный 6N НСl, выпарили в вакууме до сухого остатка. Остаток растворили в 28%NH4OH, и раствор выпарили в вакууме до сухого остатка. Сырой продукт очистили колоночной флэш-хроматографией на силикагеле 230240 меш при элюировании смесью EtOAc/MeOH 85:15, содержащей 1,5% 28% NH4OH, получили 8,0 г названного соединения в виде белого твердого вещества.(12,2 ммоля) TEA. Обработку реакционной смеси проводили способом, который описан в примере получения 6. Остаток очистили колоночной флэшхроматографией на силикагеле 230-400 меш при элюировании сначала смесью петролейного эфира/EtOAc 80:20, содержащей 0,5% NH4 ОН(28%), и затем смесью петролейного эфира/EtOAc 70:30, содержащей 0,5% NH4OH (28%),получили сырой продукт, который растерли с изо-Рr2 О, с получением 96 г названного соединения в виде белого твердого вещества.THF, 4,21 г (30,5 ммоля) К 2 СО 3 и 0,53 г Кl, и суспензию нагрели с обратным холодильником в течение 20 ч. Отфильтровали неорганические соли, и реакционную смесь выпарили в вакууме до сухого остатка, растворили в СН 2 Сl2 и промыли водой; органический слой отделили, сушили надNa2SO4 и выпарили в вакууме до сухого остатка. 2,0 г остатка очистили колоночной флэшхроматографией на силикагеле 230-400 при элюировании сначала смесью гексан/EtOAc 8:2,содержащей 0,5% NH4OH (28%), а затем смесью гексан/EtOAc 3:2, содержащего 0,5% NH4OH(28%) . Полученное таким образом сырое твердое вещество растерли с изо-Рr2 О, фильтровали,промыли и сушили, при этом получили 1,1 г названного соединения. С 36 Н 31N3O4. Температура плавления = 125-128 С. Молекулярная масса = 569,60.MS (ЕI; TSQ 700; источник 180 С; 70 V; 200 uA): 569(М+); 188; 160. Пример 10. (S)-N-(-этилбензил)-3-2-[3(R,S)-гидрокси-3,4-дигидро-1(2H)-изохинолинон-2-ил]-этокси-2-фенилхинолин-4-карбоксамид (диастереомерная смесь). В атмосфере азота в 25 мл МеОН растворили 2,5 г (4,4 ммоля) (S)-N-(-этилбензил)-3(2-гомофталимидоэтокси)-2-фенилхинолин-4 карбоксамида (соединение примера 6); раствор охладили до 0 С и добавили 0,25 г (6,6 ммоля)NaBH4. Температуру подняли до комнатной, 41 через 30 мин добавили еще 0,25 г (6,6 ммоля)NaBH4, и реакционную смесь перемешали в течение 1 ч 15 мин. Дополнительно добавили 0,5 г(13,2 ммоля) NaBH4, и реакционную смесь выдержали при комнатной температуре в течение ночи. Добавили 2 мл 30% NaOH, при пониженном давлении выпарили органический растворитель, и водный раствор экстрагировалиCH2Cl2, промыли насыщенным раствором NaCl; сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Сырой продукт очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш, используя в качестве исходного элюента смесь петролейного эфира/EtOAc 7:3, содержащей 0,5% NH4OH(28%), и в качестве конечного элюента смесь петролейного эфира/EtOAc 3:7, содержащего 0,5% NH4OH (28%). Полученное таким образом серое твердое вещество растерли с изо-Рr2O, фильтровали,промыли и сушили, при этом получили 1,2 г названного соединения.(соединение примера 9), и к кипящему раствору добавили 0,71 мл (13,65 ммоля) гидразингидрата. Реакционную смесь в течение 24 ч кипятили с обратным холодильником, затем добавили еще 0,71 мл (13,65 ммоля) гидразингидрата и раствор в течение 4 ч кипятили с обратным холодильником. После охлаждения реакционную смесь выпарили в вакууме до сухого остатка,добавили 50 мл Н 2O, и раствор подкислили 37% НСl до рН = 1. Смесь в течение 1 ч кипятили с обратным холодильником, отфильтровали нерастворимое вещество и добавили 30% NaOH до рН = 10. Раствор экстрагировали EtOAc, промыли насыщенным раствором NaCl; сушили надNa2SO4 и выпарили в вакууме до сухого остатка. Сырой продукт очистили градиентной колоночной флэш-хроматографией на силикагеле 230 001771 42 400 меш с применением в качестве исходного элюента смеси EtOAc/MeOH 95:5, содержащей 0,5% NН 2 ОН (28%), и в качестве конечного элюента смеси/МеОН 85:15, содержащего 0,5%NH2OH (28%). Полученное таким образом серое твердое вещество растерли в порошок с нагретой смесью изо-Рr2 О/ЕtOАс, фильтровали, промыли и сушили, получили 1,4 г названного соединения в виде свободного основания. 0,9 г этого свободного основания растворили в EtOAc/ацетоне,получили 0,8 г названного соединения.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 439 (M+); 394; 383; 304; 277; 262; 248; 219; 119. Пример 12. (S)-N-(-этилбензил)-3-[2-(1(2H)-изохинолинон-2-ил)этокси)]-2-фенилхинолин-4-карбоксамид. В 20 мл сухого СН 2 Сl2 растворили 0,8 г(1,4 ммоля) (S)-N-(-ацетилбензил)-3-2-[3(R,S)-гидрокси-3,4-дигидро-1(2H)изохинолинон-2-ил]-этокси-2-фенилхинолин 4-карбоксамида (соединение примера 10). Раствор охладили до -10 С, добавили 0,21 мл (1,5 ммоля) TEA и по каплям добавили раствор 12 мл (1,5 ммоля) метансульфонилхлорида в 2,5 млCH2Cl2. Температуру подняли до 25 С, и реакционную смесь перемешали в течение всей ночи. Добавили 5 мл насыщенного раствораNаНСО 3, органический слой экстрагировали,промыли насыщенным раствором NaCl; сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Сырой продукт очистили колоночной флэш-хроматографией на силикагеле 230-400 меш при элюировании смесью гексан/EtOAc 7:3, содержащей 0,5% NH4OH (28%). Полученное таким образом сырое вещество растерли с нагретой смесью изо-Рr2 О, фильтровали, промыли и сушили с получением 0,4 г названного соединения. С 36 Н 31N3 О 3. Температура плавления = 60 С (разл.). Молекулярная масса = 553,67. Элементный анализ: Вычислено: С, 78,09; Н, 5,64; N, 7,59; Найдено: С, 76,86; Н, 6,05; N, 7,00.MS (EI; TSQ 700, источник 180 С; 70 V; 200 uA): 553 (М+); 249; 172. Пример 13. (S)-N-(-этилбензил)-3-[(S)-этилбензил]аминометил-2-фенилхинолин-4-карбоксамидгидрохлорид. В 100 мл ССl4 растворили 5,0 г (15.50 ммоля) трет-бутил-3-метил-2-фенилхинолин-4-карбоксилата (полученного реакцией 3-метил-2 фенилхинолин-4-карбонилхлорида с третВuОН), 3,0 г (17,0 ммолей) N-бромсукцинимида и каталитическое количество дибензоилпероксида и суспензию в течение 3-х ч кипятили с обратным холодильником. Добавили 1,5 г (8,43 ммоля) Nбромсукцинимида,и суспензию кипятили с обратным холодильником в течение 2-х ч; затем выпарили в вакууме до сухого остатка, получив при этом 11,1 г сырого продукта. 1,0 г этого остатка растворили в 30 мл абсолютного EtOH; добавили 1,0 г (7,40 ммолей) (S)-(-)-этилбензиламина, и раствор перемешали при комнатной температуре в течение 1 ч. Реакционную смесь выпарили в вакууме до сухого остатка. Сырой продукт очистили градиентной колоночной флэш-хроматографией на силикагеле 70-230 меш при элюировании смесью СН 2 Сl2/ МеОН (от 0 до 2%), при этом получили 0,6 г названного соединения в виде свободного основания. Его растворили в Et2O, и раствор подкислили HCl/Et2O, получили соответствующий гидрохлорид, который перекристаллизовали из(S)-N-(-этилбензил)-3-[2-(2'-гидроксиметилфенилацетил)аминоэтокси]-2-фенилхинолин-4 карбоксамида (соединение примера получения 8); добавили HCl/Et2O до рН = 4 и затем по каплям добавили раствор 0,2 мл (2,7 ммоля) SOCl2 в 6 мл СНСl3. Реакционную смесь в течение 5 ч нагрели до 50 С, дополнительно добавили 0,1 мл (1,4 ммоля) СОСl2, и реакционную смесь в течение 1 ч кипятили с обратным холодильником. Смесь выпарили в вакууме до сухого остатка, растворили в EtOAc, промыли насыщенным раствором К 2 СО 3, насыщенным растворомNaCl; сушили над Nа 2SO4 и выпарили в вакууме до сухого остатка, получив 1,3 г (S)-N-(ацетилбензил)-3-[2-(2'-хромметилфенилацетил) аминоэтокси]-2-фенилхинолин-4-карбоксамида в виде белого твердого вещества. Этот продукт растворили в 25 мл сухого THF и по каплям добавили к суспензии 100 мг (4,2 ммоля) NaH в 10 мл сухого THF и 1 мл 1,3-диметил-2-имидазолидинона. Реакционную смесь перемешали при комнатной температуре в течение 4-х ч, и затем реакцию останавливали Н 2 О, выпарили в вакууме до сухого остатка, растворили в EtOAc и промыли насыщенным раствором NaCl. Органический слой сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Сырой продукт очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш при элюировании смесью гексан/EtOAc 1:1, получили 113 мг названного соединения. С 36 Н 33N3 О 3. Температура плавления = 153-156 С. Молекулярная масса = 555, 68 []D20 =MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 382; 264; 247; 219; 172; 119; 91. Пример 15. (S)-N-(-Этилбензил)-3-(2 сукцинимидоэтокси)-2-фенилхинолин-4 карбоксамид. 0,8 г (S)-N-(-этилбензил)-3-[2-(3-карбоксипропаноил)аминоэтокси]-2-фенилхинолин-4 карбоксамида (соединение примера получения 9) и 4 мл тетрагидронафталина в течение 2,5 ч нагрели до 140 С и затем в течение 2-х ч до 200 С. После охлаждения добавили 80 млEtOAc, и раствор промыли насыщенным раствором NaCl, насыщенным раствором NаНСО 3,20% лимонной кислотой, насыщенным раствором NaCl, сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Остаток очистили колоночной флэш-хроматографией на силикагеле 45 230-400 меш при элюировании смесью гексан/EtOAc с 1:1, получили 148 мг названного соединения.MS (ЕI; TSQ 700; источник 180 С; 70 V; 200 uA): 507 (M+); 478; 374; 221; 126. Пример 16. (S)-N-(-этилбензил)-3-(малеимидоэтокси)-2-фенилхинолин-4-карбоксамид. В 3 мл ацетона растворили 0,3 г (5,73 ммоля) (S,Z)-N-(-этилбензил)-3-[2-(3-карбоксипропеноил)аминоэтокси]-2-фенилхинолин-4 карбоксамида (соединение примера получения 10). Добавили 1,6 мл (11,5 ммоля) TEA, и реакционную смесь нагрели до кипения. К кипящему раствору, который кипятили с обратным холодильником в течение 22 ч, по каплям добавили 0,82 мл (8,6 ммоля) уксусного ангидрида. После охлаждения реакционную смесь влили в лед, перемешали в течение 30 мин и затем экстрагировали EtOAc. Органический слой промыли насыщенным раствором NaCl, 20% лимонной кислотой, насыщенным раствором NаНСО 3 и насыщенным раствором NaCl, сушили надNа 2SO4 и выпарили в вакууме до сухого остатка. Остаток очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси гексан/EtOAc 80:20, и в качестве конечного элюента EtOAc, после растирания с изо-Рr2O получили 100 мг названного соединения. С 31 Н 27N3O4. Температура плавления = 74-78 С. Молекулярная масса = 505,57.(соединение примера получения 11); добавили 3,5 мл ацетона, и реакционную смесь в течение 30 ч кипятили с обратным холодильником. В вакууме выпарили растворитель до сухого остатка, и сырой продукт очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси EtOAc/MeOH 9:1, и в качестве конечного элюента смеси EtOAc/MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 522 (М+); 383; 360; 248; 141. Пример 18. (S)-N-(-этилбензил)-3-3-[4(2-метоксифенил)-пиперазин-1-ил]пропокси-2 фенилхинолин-4-карбоксамиддигидрохлорид. В 20 мл THF суспендировали 1,0 г (2,6 ммоля) (S)-N-(-этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида (соединение примера получения 2), 1,0 г (3,7 ммоля) 1-(2 метоксифенил)-4-(3-хлорпропил)пиперазина и 1,6 г (11,7 ммоля) К 2 СО 3, и реакционную смесь в течение 17 ч кипятили с обратным холодильником. Дополнительно добавили 1,1 г (4,1 ммоля) 1-(2-метоксифенил)-4-(3-хлорпропил)пиперазина и каталитическое количество KI, и реакционную смесь в течение 4-х часов кипятили с обратным холодильником. Отфильтровали неорганические соли, фильтрат выпарили в вакууме до сухого остатка и очистили колоночной флэш-хроматографией на силикагеле 230-400 меш при элюировании смесью CH2Cl2/MeOH 98:2, содержащей 0,5% NH2OH (28%), получили 0,6 г свободного основания, которое растворили в МеОН и подкислили до рН = 1,0 HCl/Et2O. В вакууме удалили растворитель, и продукт растерли в порошок с нагретым EtOAc, получив при этом 0,6 г названного соединения. С 39 Н 42N4O3 НСl Температура плавления = 151-155 С. Молекулярная масса = 687,71.MS (ЕI; TSQ 700; источник 180 С; 70 V; 200 uA): 614(М+); 599; 452; 382; 317; 288; 247; 205; 190; 136. Пример 19. (S)-N-(-этилбензил)-3-2-[3(R,S)-фенил-4-оксо-3-имидазолидинил]этокси 2-фенилхинолин-4-карбоксамид (диастереомерная смесь). В 8 мл МеОН растворили 0,8 г (1,7 ммоля)(соединение примера получения 11); добавили 0,25 мл (2,5 ммоля) бензальдегида, и реакционную смесь в течение 10 ч кипятили с обратным холодильником. В вакууме выпарили растворитель до сухого остатка, и остаток очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси гексана/EtOAc 1:1, и в качестве конечного элюента смесиMS (ЕI; TSQ 700; источник 180 С; 70 V; 200 uA): 570 (М+); 467; 435; 408; 383; 334; 305; 264; 247; 219; 189; 118; 91. Пример 20. (S)-N-(-этилбензил)-3-2-[2,2 диметил-5-(S)-фенил-4-оксо-3-имидозолидинил] этокси-2-фенилхинолин-4-карбоксамид. В 10 мл н-ВuОН растворили 0,5 г (0,9 ммоля) (S)-N-(-этилбензил)-3-[2-(S)аминофенилацетиламиноэтокси]-2-фенилхинолин-4 карбоксамида (соединение примера получения 12); добавили 3,5 мл ацетона, и реакционную смесь в течение 17 ч кипятили с обратным холодильником. В вакууме выпарили растворитель до сухого остатка, и остаток растерли с изо-Рr2 О, получили 440 мг названного соединения.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 598 (М+); 583; 463; 452; 436; 146. Пример 21. (S)-N-(-этилбензил)-3-2-[2,2 диметил-5-(R)-фенил-4-оксо-3-имидазолидинил] этокси-2-фенилхинолин-4-карбоксамид. В 10 мл н-ВuОН растворили 0,5 г (0,9 ммоля) (S)-N-(-этилбензил)-3-[2-(R)аминофенилацетиламиноэтокси]-2-фенилхинолин-4 карбоксамида (соединение примера получения 13); добавили 3,5 мл ацетона, и реакционную смесь в течение 17 ч кипятили с обратным холодильником. В вакууме выпарили растворитель до сухого остатка, и остаток очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси гексан/EtOAc 1:1,и в качестве конечного элюента EtOAc, получили 0,41 г названного соединения.MS (EI; TSQ 700; источник 180 С; 70 V; 200 uA): 598 (М+); 583; 463; 452; 436; 146. Пример 22. (S)-N-(-Этилбензил)-3-[2-(3,4 дигидро-1(2 Н)-изохинолинон-2-ил)этокси]-2 фенилхинолин-4-карбоксамид. В 12 мл сухого THF в атмосфере азота растворили 1,0 г (2,61 ммоля) (S)-N-(-этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида (соединение примера получения 2). Добавили 1,1 г К 2 СО 3 и 130 мг KJ и затем по каплям добавили 1,1 г (5,2 ммоля) 2-(2-хлорэтил)-3,4 дигидро-1-(2 Н)-изохинолинонаTHF. Реакционную смесь в течение 4-х ч кипятили с обратным холодильником, фильтровали и выпарили в вакууме до сухого остатка. Остаток растворили в CH2Cl2 и промыли насыщенным раствором NaCl; органический слой сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Сырой продукт очистили колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси гексан/EtOAc, 1:1, и в качестве ко 49 нечного элюента EtOAc, получили 1,2 г названного соединение.-этилбензиламина и 5,7 г (41,8 ммоля) НОВТ. Добавили 11,9 г (57,90 ммоля) DCC, растворенного в 20 мл CH2Cl2, и раствор перемешивали при комнатной температуре в течение ночи. Добавили 50 мл 20% лимонной кислоты и раствор перемешивали при комнатной температуре в течение 2 ч. Отфильтровали осажденную дициклогексилмочевину и подщелоченную твердым К 2 СО 3 суспензию разбавили 50 мл H2O и 50 мл CH2Cl2. Отделили органическую фазу, и водную фазу экстрагировали CH2Cl2; органическую фазу сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Сырой продукт подвергли колоночной флэш-хроматографии на силикагеле 230-400 меш при элюировании смесью гексан/EtOAc 8:2, при этом получили сырое вещество, которое обработали Et2O, осажденное названное соединение отфильтровали, растерли с пентаном и опять фильтровали, при этом получили 1,6 г чистого названного соединения в виде белого порошка. 50 камфосульфоната (Benjamin, В.М., Collins, C.I. 1961, J. Amer. Chem. Soc., 83, 3662). Добавили 270 мг РtO2, и реакционную смесь гидрировали в аппарате Парра в течение 10 мин при давлении 10 psi (фунтов/дюйм 2) (0,7031 кг/см 2). Отфильтровали катализатор, и в вакууме выпарили растворитель до сухого остатка, при этом получили 4,0 г соответствующего 1-амино-1-фенил 2-пропанол-D-10-камфосульфоната. 1,5 г (3,9 ммоля) этого соединения растворили в смеси СН 2 Сl2/СН 3 СN 1:1; добавили 1,36 мл (9,7 ммоля) ТFА, и реакционную смесь охладили до-15 С. При поддержании температуры ниже-10 С по каплям добавили 1,32 г (4,7 ммоля) 3 метил-2-фенилхинолин-4-карбоксамида (полученного из соответствующей карбоновой кислоты (CAS [43071-45-0]) реакцией с оксалилхлоридом в СН 2 Сl2 при комнатной температуре),растворенного в 50 мл смеси CH2Cl2/DMF 1:4. Реакционную смесь перемешали в течение 2 ч при 0 С и затем выдержали при комнатной температуре в течение ночи. Отфильтровали неорганические соли, фильтрат выпарили в вакууме до сухого остатка, растворили в CH2Cl2 и промыли насыщенным раствором NaНCО 3, 20% лимонной кислотой, насыщенным растворомNаНСО 3, насыщенным раствором NaCl. Органический слой сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Сырой продукт очистили градиентной колоночной флэшхроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси CH2Cl2/MeOH 99:1, содержащей 0,5%NH4OH (28%), и в качестве конечного элюента смеси CH2Cl2/MeOH 99:2, содержащей 0,5%NH4OH (28%), при этом получили 0,86 г N-[(1-гидроксиэтил)бензил]-3-метил-2-фенилхинолин-4-карбоксамида. В 6 мл сухого СН 2 Сl2 в атмосфере азота растворили 0,24 мл (2,8 ммоля) оксалилхлорида. Раствор охладили до -55 С и при поддержании температуры ниже -50 С по каплям добавили 0,40 мл (5,6 ммоля) DMSO, растворенного в 1,1 мл сухого CH2Cl2. Реакционную смесь перемешали в течение 9 мин при -55 С и затем при поддержании температуры между -50 и -55 С добавили 0,69 г (1,7 ммоля) N-[-(1-гидроксиэтил)бензил]-3-метил-2-фенилхинолин-4 карбоксамида, растворенного в 20 мл сухого СН 2 Сl2. Через 30 мин выдерживания при -55 С,при температуре, не превышающей - 40 С, добавили 1,7 мл (12,2 ммоля) TEA, затем реакционную смесь довели до комнатной температуры и перемешали в течение еще 15 мин. Реакцию останавливали 5 мл Н 2 О и экстрагировали CH2Cl2; органический слой промыли Н 2 О, 20% лимонной кислотой, насыщенным раствором NаНСО 3 и рассолом, органический слой отделили, сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Оставшееся масло очистили градиентной колоночной флэш 51 хроматографией на силикагеле 230-400 меш,используя в качестве исходного элюента смеси петролейного эфира/EtOAc 8:2, содержащей 0,3% NH4OH (28%), и в качестве конечного элюента смеси петролейного эфира/EtOAc 6:4,содержащей 0,5% NH4OH (28%), при этом получили 0,44 г названного соединения в виде аморфного твердого вещества.Chem. Soc., 83, 3662), полученного, как описано в примере 24, превратили в 1,7 г соответствующего 1-амино-1-фенил-2-пропанолгидрохлорида. 1,6 г (8,5 ммолей) этого соединения ацилировали 2,9 г (10,2 ммоля) 3-метил-2 фенилхинолин-4-карбонилхлорида в присутствии 3 мл (21,2 ммоля) TFA, при этом получили 1,9N-[-(1-гидроксиэтил)бензил]-3-метил-2 фенилхинолин-4-карбонилхлорида. 1,9 г (4,8 ммолей) этого соединения окислили в условияхSwern (Сверна), описанных в примере 24 (0,7 мл оксалилхлорида, 1,16 мл DMSO, 3,5 мл TEA),при этом получили 1,4 г названного соединения в виде аморфного твердого вещества. С 26 Н 22N2O2. Температура плавления = 72-95 С. Молекулярная масса = 394,48.(R,S)-N-[-(Метоксикарбонил)(метил)бензил]-2-фенилхинолин-4 карбоксамид. Получили, как описано в примере получения 2, из 1,0 г (4,0 ммоля) 2-фенилхинолин-4 карбоновой кислоты, 0,9 г (4,2 ммоля) метил-метилфенилглицинатгидрохлорида [полученного из соответствующей кислоты (Steinger, R.E., 001771(5,0 ммолей) N-метилморфолина и 0,92 г (4,4 ммоля) DCC в 50 мл смеси THF и СН 3 СN 2:1. Обработку реакционной смеси проводили способом, который описан в примере получения 2. Остаток очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси петролейного эфира/EtOAc 9:1, содержащей 0,3% NH4OH (28%), и в качестве конечного элюента смеси петролейного эфира/uA): 410 (М+); 351; 232; 204. Пример 27. (R,S)-N-[-(Метоксикарбонил)(метил)бензил]-3-метил-2-фенилхинолин-4-карбоксамид. 5,9 г (27,4 ммоля) метилметилфенилглицинатгидрохлорида (смотри ссылку на литературу примера 26) посредством реакции с МеОН и SOCl2 растворили в 100 мл сухого Et2O; добавили 9,6 мл (68,9 ммоля) TEA, и раствор охладили до 0 С. При поддержании температуры ниже 5 С по каплям добавили 8,6 г (30,4 ммоля) 3-метил-2-фенилхинолин-4-карбоксамида (полученного из соответствующей карбоновой кислоты (САS [43071-45-0]) реакцией с оксалилхлоридом в CH2Cl2 при комнатной температуре), растворенного в 180 мл смесиCH2Cl2/DMF 1:1. Затем реакционную смесь поддерживали при комнатной температуре в течение ночи. В вакууме выпарили растворитель до сухого остатка, остаток растворили в CH2Cl2 и промыли насыщенным раствором NаНСО 3, 20% лимонной кислотой, насыщенным растворомNаНСО 3, насыщенным раствором NaCl. Органический слой сушили над Na2SO4, выпарили в вакууме до сухого остатка и очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш с применением в качестве исходного элюента смеси петролейного эфира/EtOAc 8:2, содержащей 0,3% NH4OH(28%), и в качестве конечного элюента смеси петролейного эфира/EtOAc 7:3, содержащей 0,3% NH4OH (28%), после растирания с изоРr2O, получили 23 мг названного соединения. Температура плавления = 192-195 С. Молекулярная масса = 424,50.(0,78 ммоля) Bu4NHSO4; добавили 250 мг (0,63 ммоля) (R,S)-N-(-ацетилбензил)-3-метил-2-фенилхинолин-4-карбоксамида (рацемат примера 24), 0,1 мл (1,6 ммоля) MeI и 0,6 мл 10% NaOH,и реакционную смесь выдерживали при комнатной температуре всю ночь. Реакционную смесь дважды промыли насыщенным растворомNH4Cl и затем насыщенным раствором NaC,сушили над Na2SO4 и выпарили в вакууме до сухого остатка. Остаток растворили в смеси гексан/EtOAc 1:1 и отфильтровали нерастворимые неорганические соли. Фильтрат выпарили в вакууме до сухого остатка и затем очистили градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш, используя в качестве исходного элюента смеси петролейного эфира/EtOAc 8:2, содержащей 0,3% NH4OH(28%), и в качестве конечного элюента смеси петролейного эфира/EtOAc 7:3, содержащей 0,4% NH4OH (28%), и затем посредством препаративной ЖХВД после растирания с изо-Рr2 О,получили 17 мг названного соединения. Следуя методам синтеза, описанным в примерах 1-28, получили перечисленные ниже соединения. Таблица 2 Таблица 3 Аналитические и спектроскопические данные соединений примеров 29-46 56 Таблица 4. Фармакологические данные Сродство к связываниюпримера в hNK-3-CHO IC50 (nM) 2 1.6 5 1.2 6 0.8 9 3.2 11 2.6 14 1.7 17 3.4 18 0.4 21 0.9 22 1.3 30 1.1 31 3.3 33 0.7 34 0.8 40 1.1 42 2.7hNK-3-CHO=рецепторы нейрокинина-3 человека, экспрессированные в СНО клеточных линиях, применяемым лигандом был [125I]-[MePhe']-NKB. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)R2 представляет собой водород, С 1-С 6aлкил, гидрокси, галоген, циано, амино, моно- или ди-С 1-С 6 алкиламино, С 1-С 6 алкилсульфониламино, моно- или ди-С 1-С 6aлканоиламино, где любая алкильная группа необязательно замещена аминогруппой или моно- или ди-С 1-С 6 алкиламиногруппой, или R2 является группой-Х-(СН 2)n-Y, где Х является связью или -О- и n представляет собой целое число от 1 до 5, при условии, что, когда Х является -О-, тогда n представляет собой только целое число от 2 до 5 и Y представляет собой группу NY1Y2, где Y1 иY2 независимо выбирают из водорода, С 1-С 6 алкила, С 1-С 6 алкенила, фенила или фенил-С 1-С 6N-связанной одиночной или конденсированной гетероциклической группой, причем любое единичное или конденсированное кольцо является насыщенным или ненасыщенным и состоит из 5 или 6 кольцевых атомов, причем указанные кольцевые атомы необязательно включают 1 или 2 дополнительных гетероатомов, выбранных из О или N, и где один или два кольцевых 57 атома необязательно замещены одной или двумя оксогруппами или одной или двумя группами, выбранными из гидрокси, С 1-С 6 алкоксикарбонила, С 1-С 6 алкила, фенила или нафтила или ароматической гетероциклической группы,содержащей 5 или 6 кольцевых атомов, включающих один или два атома азота, или заместители на соседних кольцевых атомах образуют ароматическое карбоциклическое кольцо, причем указанные фенил, нафтил или ароматическая гетероциклическая группа необязательно замещены одной или двумя группами, выбранными из С 1-С 6 алкила, С 1-С 6 алкокси, гидрокси,галогена или галогенС 1-С 6 алкила;R4 представляет водород или С 1-С 6 алкил. 2. Соединение по п.1, где R представляет собой этил. 3. Соединение по любому из пп.1, 2, где R2 представляет собой группу -Х-(СН 2)n-Y. 4. Соединение по любому из пп.1-3, где группа -Х-(СН 2)n-Y представляет группу формулы (а) где Т представляет собой С 1-С 6 алкильную, С 1 С 6 алкоксикарбонильную, необязательно замещенную фенильную или фенил-С 1-С 6 алкильную или ароматическую гетероциклическую группу,содержащую 5 или 6 кольцевых атомов, включающих один или два атома азота, и/или Х является -О- и n равно 2 или 3 или Х является связью и n равно 1, 2 или 3. 5. Соединение по п.4, где Т представляет собой метильную группу. 6. Соединение по п.4, где Т представляет собой фенильную группу, замещенную одной или более С 1-С 6 алкоксильными группами. 7. Соединение по п.4, где Т представляет собой пиримидинильную группу. 8. Соединение по п.1, где -X-(CH2)n-Y представляет собой группу формулы (b) где Х является -О- или связью, n равно 1, 2 или 3, каждый из T1 и Т 2 независимо представляет собой гидрокси, С 1-С 6 алкоксикарбонил, C1-С 6 алкил, фенильную или фенил-С 1-С 6 алкильную или ароматическую гетероциклическую группу,имеющую одиночное или конденсированное кольцо, содержащее 5 или 6 кольцевых атомов,включающих один или два атома азота, или T1 и Т 2 вместе с атомами углерода, к которым они присоединены, образуют ароматическое карбоциклическое кольцо, причем упомянутые фенил, фенил-C1-С 6 алкил или ароматические гетероциклические группы необязательно замещены одной или двумя группами, выбранными из С 1 С 6 алкила, C1-С 6 алкокси, гидрокси, галогена или 58 галоген-С 1-С 6 алкила; или одна из T1 и Т 2 является оксигруппой, а другую выбирают из соответствующих вышеуказанных групп. 9. Соединение по п.8, где T1 и Т 2 вместе с атомами углерода, к которым они присоединены, образуют ароматическое карбоциклическое кольцо. 10. Соединение по п.8, где n представляет собой целое число, равное 1 и 2. 11. Соединение по п.1, где Аr является фенилом, R является этилом, R1 является водородом, R2 является группой -X-(CH2)n-Y, где Х является -О-, n равно 1, 2 или 3 и Y представляет группу формулы (а), которая определена в п.4, или группу формулы (b), которая определена выше в п.8. 12. Соединение по п.1, выбранное из соединений со следующими значениями радикалов Ar, R, R1, R2 и R4 60 чающий взаимодействие соединения формулы где R', R'4 и Ar представляют собой R, R4 и Ar,которые определены в формуле (I), или группу или атом, способный соответственно превращаться в R, R4 и Ar, с соединением формулы (II) или его активным производным где R'1, R'2 и R'3 представляют собой соответственно R1, R2 и R3, которые определены в формуле (I), или группу, способную превращаться в 13. Соединение по п.1, выбранное из соединений со следующими значениями радикалов Ar, R, R1, R2 и R4 где Аr', R', R'1, R'2, R'3 и R'4 являются такими, как они определены выше, и необязательное проведение после него одной или нескольких следующих необязательных стадий:(i) превращение одной любой из Аr', R', R'1,R'2, R'3 и R'4 соответственно в Аr, R, R1, R2, R3 иR4, как необходимо, с получением соединения формулы (I);(ii) превращение соединения формулы (I) в другое соединение формулы (I); и(iii) получение соли соединения формулы(I) и/или его сольвата. 15. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль или фармацевтически приемлемый сольват и фармацевтически приемлемый нoситель. 16. Применение соединения формулы (I) или его фармацевтически приемлемой соли или его фармацевтически приемлемого сольвата в качестве активного терапевтического средства. 14. Способ получения соединения формулы (I), или его соли, и/или его сольвата, вклю Евразийская патентная организация, ЕАПВ Россия, ГСП-9 101999, Москва, М. Черкасский пер., 2/6
МПК / Метки
МПК: C07D 215/52, A61P 1/00, A61K 31/47
Метки: к-3, применение, антагонистов, к-2, нейрокинина-3, рецептора, получение, хинолин-4-карбоксамида, нейрокинина-2, производные, качестве
Код ссылки
<a href="https://eas.patents.su/30-1771-proizvodnye-hinolin-4-karboksamida-ih-poluchenie-i-ih-primenenie-v-kachestve-antagonistov-receptora-nejjrokinina-3-k-3-i-nejjrokinina-2-k-2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолин-4-карбоксамида, их получение и их применение в качестве антагонистов рецептора нейрокинина-3 (-к-3) и нейрокинина-2 (-к-2)</a>
Предыдущий патент: Производные бензимидазола и их применение для лечения вирусных инфекций
Следующий патент: Немолочное замороженное кондитерское изделие
Случайный патент: Пластинчатый элемент для соединения паркетных щитов