Производные индола, полезные в качестве антагонистов рецептора эндотелина.
Номер патента: 1471
Опубликовано: 23.04.2001
Авторы: Джеймс Ким, Дэк Кевин Нил, Дикинсон Роджер Питер, Росон Дейвид Джеймс
Формула / Реферат
1. Соединение формулы I
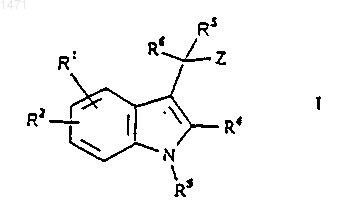
где R1 и R2 являются возможными заместителями и независимо представляют собой C1-6алкил, С3-6циклоалкил, С2-6алкенил [возможно замещенные СО2Н, СO2(С1-6алкилом) или СО2(С3-6циклоалкилом)], С2-6алкинил, галоген, С1-3перфторалкил, С3перфторциклоалкил, (CH2)mAr1, (СН2)mНеt1, (CH2)mCONR7R8, (CH2)mCO2R8, O(CH2)qCO2R8, (CH2)mCOR8, (CH2)mOR8, O(CH2)pOR8, (CH2)mNR7R8, CO2(CH2)qNR7R8, (CH2)mCN, S(O)nR8, SO2NR7R8, CONH(CH2)mAr1 или CONH(CH2)mHet1;
R3 представляет собой Н, С1-6алкил, С3-6циклоалкил, (CH2)pNR9R10, SO2R10, SO2NR9R10, (CH2)mCOR10, С2-6алкенил, С2-6алкинил, (СН2)mСОNR9R10, (CH2)mCO2R10, (CH2)pCN, (CH2)pR10 или (СH2)pOR10;
R4 и R9 независимо представляют собой Н, C1-6алкил или С3-6циклоалкил;
R7 представляет собой Н, C1-6алкил, С3-6циклоалкил или C1-6алкокси;
R5 представляет собой Н или ОН;
R6 представляет собой фенил, возможно конденсированный с насыщенным или ненасыщенным 5- или 6-членным гетероциклическим кольцом, содержащим 1 или 2 гетероатома, выбранных из N, S или О, причем эта группа в целом возможно замещена одной или более чем одной группой, выбранной из С1-6алкила, С3-6циклоалкила, C1-6алкокси и галогена, и где любые члены гетероциклического кольца, которые являются S, могут быть замещены одним или двумя атомами кислорода;
R8 и R10 независимо представляют собой Н, C1-6алкил, С3-6циклоалкил, Ar2, Het2 или замещенный Аr2 или Неt2С1-6алкил или С3-6циклоалкил;
Z представляет собой СО2Н, СОNН(тетразол-5-ил), СОNНSО2О(С1-4алкил), СОNНSO2O(С3-4циклоалкил), СО2Ar3, СO2(С1-6алкил), СO2(С3-6циклоалкил), тетразол-5-ил, CONHSO2Ar3, CONHSO2(CH2)qAr3, СОNНSО2(С1-6алкил) или СОNНSO2(С3-6циклоалкил);
m представляет собой 0, 1, 2 или 3;
n представляет собой 0, 1 или 2;
р представляет собой 2, 3 или 4;
q представляет собой 1, 2 или 3;
Аr1-3 независимо представляют собой фенил, нафтил или ароматический гетероцикл, имеющий 5 или 6 членов в кольце, до четырех из которых выбраны из N, S и О, причем ароматический гетероцикл является возможно конденсированным с бензольным кольцом, а фенильная группа является возможно конденсированной с ароматическим гетероциклом, таким как определено непосредственно выше, причем эта группа в целом возможно замещена одной или более чем одной группой, подпадающей под вышеуказанное определение R1; и
Het1 и Het2 независимо представляют собой неароматический гетероцикл, имеющий 5 или 6 членов в кольце, до четырех из которых выбраны из N, S и О, причем группа возможно замещена одной или более чем одной группой, подпадающей под вышеуказанное определение R1, и дополнительно возможно замещена =O или =S;
при условии, что
(1) когда R1 представляет собой метокси или отсутствует, R2 отсутствует, R3 представляет собой Н, R4 представляет собой Н, метил или этил и R6 представляет собой незамещенный фенил, тогда Z не представляет собой CO2H, CO2(C1-6алкил) или СО2(С3-6циклоалкил);
(2) когда R1 и R2 отсутствуют, R3 представляет собой CO(п-ClC6H4), R4 представляет собой Н и R6 представляет собой незамещенный фенил, тогда Z не представляет собой СО2(С1-6алкил) или СО2(С3-6циклоалкил); и
(3) когда R1 представляет собой метокси, R2 отсутствует, R3 представляет собой СО(п-СlС6Н4), R4 представляет собой метил и R6 представляет собой незамещенный фенил, тогда Z не представляет собой СO2Н;
или его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль.
2. Соединение по п.1, в котором R1 представляет собой галоген, (CH2)mCONR7R8, (CH2)mCO2R8, (CH2)mCOR8, (CH2)mOR8 или (CH2)mCN.
3. Соединение по п.1 или 2, в котором R2 отсутствует.
4. Соединение по любому из пп.1-3, в котором R3 представляет собой Н, C1-6алкил, С3-6циклоалкил или (CH2)pOR10.
5. Соединение по любому из пп.1-4, в котором R4 представляет собой Н.
6. Соединение по любому из пп.1-5, в котором R5 представляет собой Н.
7. Соединение по любому из пп.1-6, в котором R6 представляет собой фенил, конденсированный с насыщенным 5-членным гетероциклическим кольцом.
8. Соединение по любому из пп.1-7, в котором Z представляет собой СО2Н или CONHSO2Ar3.
9. Соединение формулы I по п.1, но без условий (1) и (2), или его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, для применения в качестве фармацевтического средства.
10. Фармацевтический препарат, содержащий соединение формулы I по п.1, но без условий (1) и (2), или его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, и фармацевтически приемлемый адъювант, разбавитель или носитель.
11. Применение соединения формулы I по п.1, но без условий (1)-(3), или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, в производстве лекарственного средства для лечения рестеноза, почечной недостаточности, легочной гипертензии, доброкачественной гипертрофии простаты, застойной сердечной недостаточности, удара, стенокардии, атеросклероза, церебральной и сердечной ишемии или индуцированного циклоспорином токсического повреждения почек.
12. Способ лечения рестеноза, почечной недостаточности, легочной гипертензии, доброкачественной гипертрофии простаты, застойной сердечной недостаточности, удара, стенокардии, атеросклероза, церебральной и сердечной ишемии или индуцированного циклоспорином токсического повреждения почек, при котором пациенту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения формулы I по п.1, но без условий (1)-(3), или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль.
13. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором, когда R5 представляет собой Н, соединение формулы IIА
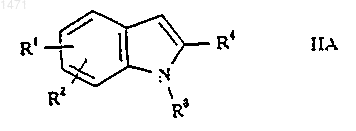
где R1-4 такие, как определено в п.1, подвергают взаимодействию с соединением формулы III

где R6 и Z такие, как определено в п.1, в присутствии кислоты Льюиса или трифторуксусной кислоты и три(С1-6алкил)силана, и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
14. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором, когда R5 представляет собой ОН, соединение формулы IIА, как оно определено выше, подвергают взаимодействию с соединением формулы III, как оно определено выше, в присутствии кислоты Льюиса, и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
15. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором, когда R3 представляет собой Н и R5 представляет собой Н, соединение формулы IIВ
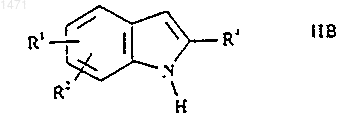
где R1, R2 и R4 такие, как определено в п.1, обрабатывают реагентом Гриньяра, после чего подвергают взаимодействию с соединением формулы III, как оно определено выше, после чего обрабатывают кислотой Льюиса или трифторуксусной кислотой и три(С1-6алкил)силаном и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
16. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором, когда R3 представляет собой Н и R5 представляет собой Н, соединение формулы IIВ, как оно определено выше, обрабатывают реагентом Гриньяра, после чего подвергают взаимодействию с соединением формулы IV
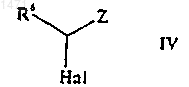
где R6 и Z такие, как определено в п.1, а Наl представляет собой галоген, и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемелемую соль, или наоборот.
17. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарcтво или фармацевтически приемлемую соль, при котором, когда R5 представляет собой Н, соединение формулы IIА, как оно определено выше, подвергают взаимодействию с соединением формулы IV, как оно определено выше, в присутствии затрудненного ненуклеофильного основания и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
18. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором соединение формулы I, в котором R1 представляет собой Вr, подвергают взаимодействию с газом СО в присутствии палладиевого катализатора и восстанавливающего агента с получением соответствующего соединения формулы I, в котором R1 представляет собой СНО, и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
19. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором соединение формулы I, в котором R1 представляет собой Вr, подвергают взаимодействию с газом СО в присутствии палладиевого катализатора и C1-6алканола с получением соответствующего соединения формулы I, в котором R1 представляет собой СО2(С1-6алкил), и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
20. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором соединение формулы I, в котором Z представляет собой СО2Н, сочетают с соединением формулы VI
Н2NSО2Аr3, VI
где Аr3 такой, как определено в п.1, с получением соответствующего соединения формулы I, в котором Z представляет собой СОNНSО2Аr3, и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
21. Способ получения соединения формулы I по п.1 или его фармацевтически приемлемого производного, представляющего собой пролекарство или фармацевтически приемлемую соль, при котором, соединение формулы I, в котором R1 представляет собой Вr, подвергают взаимодействию с алкиллитиевым реагентом и гасят диметилформамидом или диоксидом углерода с получением соответствующего соединения, в котором R1 представляет собой СНО или СO2Н, соответственно, и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное, представляющее собой пролекарство или фармацевтически приемлемую соль, или наоборот.
Текст
1 Настоящее изобретение относится к производным индола, полезным при лечении ряда заболеваний, включая рестеноз, почечную недостаточность и легочную гипертензию, а также к фармацевтическим препаратам, содержащим такие соединения. В международной заявке WO 94/14434 описаны производные индола, которые показаны в качестве антагонистов рецепторов эндотелина. В заявке на европейский патент 617001 описан целый ряд производных феноксифенилуксусной кислоты, которые также показаны в качестве антагонистов рецепторов эндотелина. Известен [Bergman et al.Tetrahedron. Vol. 31. 17,1975, pp. 2063-2073] ряд индол-3 уксусных кислот. Сходные соединения описаныBeilstein. Registry Number 431619)]. Эти соединения не показаны ни в одном виде терапии, и приведенное ниже условие (1) относится к ним. Известно [Julian et al. J. Chem. Soc. Chemical Communications, 1, 1973] производное Nп-хлорбензоилиндола в качестве побочного продукта реакции фотоприсоединения. Это соединение не показано ни в одном виде терапии, и приведенное ниже условие (2) относится к нему. Известно [Yamamoto et al., Japanese Patent 70 041381 (см. также Chemical Abstracts. Vol 75, 3, 1971, abstract 20189v)] производноеN-п-хлорбензоилиндола, которое показано в качестве противовоспалительного средства. Приведенное ниже условие (3) относится к нему. В соответствии с настоящим изобретением предложено соединение формулы IR1 и R2 являются возможными заместителями и независимо представляют собой C1-6 алкил, С 3-6 циклоалкил, С 2-6 алкенил [возможно замещенные СO2 Н, СО 2(С 1-6 алкилом) или СО 2(С 3-6 циклоалкилом)], С 2-6 алкинил, галоген,C1-3 перфторалкил,С 3 перфторциклоалкил,(CH2)mHet1,(CH2)mCONR7R8,(CH2)mAr1,8 8R4 и R9 независимо представляют собой Н,С 1-6 алкил или С 3-6 циклоалкил;R6 представляет собой фенил, возможно конденсированный с насыщенным или ненасыщенным 5- или 6-членным гетероциклическим кольцом, содержащим 1 или 2 гетероатома, выбранных из N, S или О, причем эта группа в целом возможно замещена одной или более чем одной группой, выбранной из С 1-6 алкила, С 3-6 циклоалкила, C1-6 алкокси или галогена, и где любые члены гетероциклического кольца, которые являются S, могут быть замещены одним или двумя атомами кислорода;R8 и R10 независимо представляют собой Н, C1-6 алкил, С 3-6 циклоапкил, Аr2, Het2 или замещенный Аr2 или Неt2 С 1-6 алкил или С 3-6 циклоалкил;q представляет собой 1, 2 или 3; Аr1-3 независимо представляют собой фенил, нафтил или ароматический гетероцикл,имеющий 5 или 6 членов в кольце, до четырех из которых выбраны из N, S и О, причем ароматический гетероцикл является возможно конденсированным с бензольным кольцом, а фенильная группа является возможно конденсированной с ароматическим гетероциклом, таким как определено непосредствено выше, причем эта группа в целом возможно замещена одной или более чем одной группой, подпадающей под вышеуказанное определение R1; иHet1 и Het2 независимо представляют собой неароматический гетероцикл, имеющий 5 или 6 членов в кольце, до четырех из которых выбраны из N, S и О, причем группа замещена одной или более чем одной группой, подпадающей под вышеуказанное определение R1, и дополнительно возможно замещена =O или =S; при условии, что(1) когда R1 представляет собой метокси или отсутствует, R2 отсутствует, R3 представляет собой Н, R4 представляет собой Н, метил или этил и R6 представляет собой незамещенный фенил, тогда Z не представляет собой СО 2 Н,СO2(С 1-6 алкил) или СO2(С 3-6 циклоалкил); 3 фенил, тогда Z не представляет собой СO2(С 1-6 алкил) или СО 2(С 3-6 циклоалкил); иR отсутствуют, R3 представляет собой СО(пСlС 6 Н 4), R4 представляет собой метил и R6 представляет собой незамещенный фенил, тогда Z не представляет собой СO2 Н; или его фармацевтически приемлемое производное. Фармацевтически приемлемые производные включают в себя те соединения, в которых функциональные группы, подробно перечисленные выше, дериватизированы с получением пролекарств, которые могут быть превращены в родительское соединение in vivo. Такие пролекарства известны [Drugs of Today, Vol. 19, 499538 (1938) и Annual Reports in Medicinal Chemistry, Vol. 10, Ch. 31, p. 306-326]. Кроме того,фармацевтически приемлемые производные включают в себя фармацевтически приемлемые соли, такие как соли щелочных металлов (например соли натрия) любых кислотных групп,которые могут быть представлены. Термин "галоген" включает в себя фтор,хлор, бром и йод. Алкильные группы, которые R1-4, R6-10 и Z представляют собой или содержат, могут быть прямоцепочечными или разветвленными. R1-4,R6-10 и Z также могут представлять собой или содержать циклоалкильные группы. Кроме фенила и нафтила конкретные группы, которые Аr1-3 могут представлять собой или содержать, включают в себя индолил, пиридинил, тиенил, оксазолил, тиазолил, изотиазолил, пиразолил, триазолил, тетразолил,оксадиазолил,тиадиазолил,имидазолил,тиазолинидил,изоксазолил,оксадиазолил,тиадиазолил, пирролил и пиримидинил. Конкретные группы, которые Het1 или Het2 могут представлять собой или содержать, включают в себя оксазолидинил, триазолетион, триазолон, оксадиазолон, оксадиазолетион, имидазолидинил, морфолинил, пиперидинил и пиперазинил. Предпочтительные группы соединений,которые могут быть упомянуты, включают в себя те из них, в которых:(а) R1 представляет собой галоген,(CH2)mCONR7R8, (CH2)mCO2R8, (CH2)mCOR8,(CH2)mOR8 или (CH2)mCN. В этих группах предпочтительно R7 и R8 представляют собой Н, C1-6 алкил или С 3-6 циклоалкил. Предпочтительно m равно 0 или 1. Таким образом, конкретными группами, которые могут быть упомянуты, являются CONH2, CO2H, CH2OH, F или СН 3 СО. R1 предпочтительно присоединен в положении 6 индольного кольца.(б) R2 отсутствует (то есть его место в индольном кольце занято Н). 4 а р равно 2. Таким образом, конкретными группами, которые могут быть упомянуты, являются метил и (СН 2)2 ОСН 3.(ж) Z представляет собой СО 2 Н или CONHSО 2Ar3. Предпочтительно Аr3 является фенилом, замещенным одной или более чем одной группой, выбранной из C1-6 алкила, С 3-6 циклоалкила, C1-6 алкоксила и С 1-6 алкила или С 3-6 циклоалкила, замещенного карбоксилом. Таким образом, конкретными группами, которые могут быть упомянуты, являются: Далее, предложен способ получения соединений по изобретению, при котором:(а) когда R5 представляет собой Н, соединения формулы IIА, где R1-4 такие как определено выше, подвергают взаимодействию с соединением формулы III, где R6 и Z, такие, как определено выше, в присутствии кислоты Льюиса или трифторуксусной кислоты, и три(С 1-6 алкил)силана;(б) когда R5 представляет собой ОН, соединение формулы IIА, как оно определено выше, подвергают взаимодействию с соединением формулы III, как оно определено выше, в присутствии кислоты Льюиса;(в) когда R3 представляет собой Н и R5 представляет собой Н, соединение формулы IIВ, где R1, R2 и R4 такие, как определено выше, обрабатывают реагентом Гриньяра, после чего подвергают взаимодействию с соединением формулы III, как оно определено выше, после чего обрабатывают кислотой Льюиса или трифторуксусной кислотой и три(С 1-6 алкил)силаном;(г) когда R3 представляет собой Н и R5 представляет собой Н, соединение формулы IIВ,как оно определено выше, обрабатывают реагентом Гриньяра, после чего подвергают взаимодействию с соединением формулы IV, где R6 и Z такие, как определено выше, a Hal представляет собой галоген;(д) когда R3 представляет собой Н, соединение формулы IIА, как оно определено выше,подвергают взаимодействию с соединением формулы IV, как оно определено выше, в присутствии затрудненного ненуклеофильного основания;(е) соединение формулы I, в котором R1 представляет собой Вr, подвергают взаимодействию с газом СО в присутствии палладиевого катализатора и восстанавливающего агента с получением соответствующего соединения формулы I, в котором R1 представляет собой СНО;(ж) соединение формулы I, в котором R1 представляет собой Вr, подвергают взаимодействию с газом СО в присутствии палладиевого катализатора и С 1-6 алканола с получением соответствующего соединения формулы I, в которомR1 представляет собой СО 2(С 1-6 алкил);(з) соединение формулы I, в котором Z представляет собой СО 2 Н, сочетают с соединением формулы VI,H2NSO2Ar3VI 2 где Аr является таким, как определено выше, с получением соответствующего соединения формулы I, в котором Z представляет собой(и) соединение формулы I, в котором R1 представляет собой Вr, подвергают взаимодействию с алкиллитиевым реагентом и гасят диметилформамидом или диоксидом углерода с получением соответствующего соединения, в котором R1 представляет собой СНО или СО 2 Н,соответственно; и, при желании или необходимости, превращают полученное соединение формулы I в его фармацевтически приемлемое производное или наоборот. В способе (а) подходящие кислоты Льюиса включают в себя трифторида бора диэтилэфират. Взаимодействие предпочтительно осуществляют в растворителе, не оказывающем неблагоприятного действия на реакцию, например в дихлорметане, при температуре ниже комнатной, например от -40 до -78 С. Предпочтительным три(С 1-6 алкил)силаном является триэтилсилан. Промежуточные соединения, в которых R5 представляет собой ОН, могут быть выделены этим способом. В способе (б) подходящие кислоты Льюиса включают в себя трифторида бора диэтилэфират. Взаимодействие предпочтительно осуществляют в растворителе, не оказывающем неблагоприятного действия на реакцию, например в дихлорметане, при температуре ниже комнатной, например от -40 до -78 С. После этого взаимодействия следует основная обработка. В способе (в) подходящие реагенты Гриньяра включают в себя метилмагниййодид. Взаимодействие предпочтительно осуществляют в растворителе, не оказывающем неблагоприятного действия на реакцию, например в 6 толуоле, ниже комнатной температуры, например при -70 С. Подходящие кислоты Льюиса включают в себя трифторида бора диэтилэфират. Обработку кислотами можно осуществлять в растворителе, не оказывающем неблагоприятного действия на реакцию, например в дихлорметане, при температуре от 0 С до комнатной температуры. Предпочтительным три(С 1-6 алкил) силаном является триэтилсилан. В способе (г) подходящие реагенты Гриньяра включают в себя метилмагниййодид. Взаимодействие предпочтительно осуществляют в растворителе, не оказывающем неблагоприятного действия на реакцию, например в толуоле,при комнатной температуре. Реакциюнную смесь можно обрабатывать слабой кислотой,такой как водный хлорид аммония. Hal предпочтительно представляет собой Вr. В способе (д) подходящие затрудненные ненуклеофильные основания включают в себя 2,6-диметилпиридин. Взаимодействие предпочтительно осуществляют в растворителе, не оказывающем неблагоприятного действия на реакцию, например в диметилформамиде, при повышенной температуре, например 80 С. В способе (е) подходящие палладиевые катализаторы включают в себя дихлорбис(трифенилфосфин)-палладий (II). Подходящие восстанавливающие агенты включают в себя формиат натрия. Взаимодействие предпочтительно осуществляют в растворителе, не оказывающем неблагоприятного действия на реакцию, например в диметилформамиде, при повышенной температуре, например 110 С. В способе (ж) подходящие палладиевые катализаторы включают в себя дихлорбис(трифенилфосфин)-палладий (II). Подходящие восстанавливающие агенты включают в себя формиат натрия. Взаимодействие предпочтительно осуществляют в растворителе, не оказывающем неблагоприятного действия на реакцию, например в диметилформамиде, при повышенной температуре, например при температуре дефлегмации реакционной смеси. В способе (з) реакция может быть облегчена использованием общепринятых агентов сочетания,напримерN,Nкарбонилдиимидазола. При использовании этого агента кислоту сначала подвергают взаимодействию с агентом (например в дихлорметане при температуре дефлегмации растворителя), а затем продукт этого взаимодействия подвергают взаимодействию с амином (предпочтительно в присутствии сильного затрудненного аминного основания,такого как 1,8 диазабицикло[5,4,0]ундец-7-ен, в растворителе,таком как дихлорметан, при температуре дефлегмации растворителя). Альтернативным агентом является 1-(3-диметиламинопропил)-3-этилкарбодиимид, который подвергают взаимодействию при комнатной температуре. 7 В способе (и) подходящие алкиллитиевые реагенты включают в себя н-бутиллитий. Взаимодействие осуществляют добавлением алкиллитиевого реагента к соединению формулы I в растворителе, таком как тетрагидрофуран, при температуре ниже комнатной (например от -40 до -78 С) и перемешиванием в течение примерно 2 ч. Затем добавляют диметилформамид или твердую двуокись углерода, и реакционной смеси дают возможность нагреться до комнатной температуры. Соединения формул IIА, IIВ, III, IV и VI либо известны, либо могут быть получены общепринятыми способами, хорошо известными специалистам из уровня техники. Например,соединения формул IIА и IIВ могут быть синтезированы по Фишеру, Райсерту и Маделюнгу. Кроме того, в WO 94/14434 описан ряд способов получения производных 2-карбоксииндола, которые можно легко подвергнуть декарбоксилированию (используя медь и хинолин) с получением соединений формул IIА или IIВ, в которыхR4 является Н, или восстановлению с получением соединений формул IIА или IIВ, в которыхR4 является алкилом. Другие способы получения индолов описаны Moyer et al. [J. Org. Chem,1986, 51, 5106-5110], Wender et al. [Tetrahedron,1983, 39 22, 3767-3776], Uhie. [J. Am. Chem.Trans 1, 1972, 1121], Bowman et al. [J. Chem Soc,Perkin Trans, 1, 1972, 1926], и Clark et al. [Heterocycles, 1984, 22, 195]. Соединения формулы III, в которых R6 является группой, богатой электронами (например, 1,3-бенздиоксол), a Z является СО 2 СН 2 СН 3,могут быть получены реакцией ацилирования по Фриделю-Крафтсу между соединением R6H и соединением формулы ClCOCO2CH2CH3. Взаимодействие предпочтительно проводят в присутствии кислоты Льюиса (например, AlCl3) в растворителе, который не оказывает неблагоприятного эффекта на реакцию, например в дихлорметане, ниже комнатной температуры (например, 0 С). Соединения формулы III, в которых R6 не является группой, богатой электронами (например, группы, замещенные галогеном или ОН), aZ является СО 2 СН 3, могут быть получены взаимодействием соединения формулы R6Li с соединением формулы СН 3 ОСОСО 2 СН 3. Взаимодействие можно осуществлять в растворителе,который не оказывает неблагоприятного эффекта на реакцию, например, в тетрагидрофуране,ниже комнатной температуры (например от-40 С до -78 С). Соединения формулы R6Li могут быть получены взаимодействием соединения формулыR6Br и бутиллития. Взаимодействие можно осуществлять в растворителе, который не оказывает неблагоприятного эффекта на реакцию, 001471 8 например в тетрагидрофуране, ниже комнатной температуры (например -78 С). Соединения формулы IV могут быть получены галогенированием соответствующего спирта агентом, таким как бромоводородная кислота. Когда Z представляет собой СО 2(С 1-6 алкил), соединения формулы R6CH(OH)Z могут быть получены взаимодействием альдегида формулы R6CHO с бромоформом в основных условиях и обработкой неочищенной промежуточной карбоновой кислоты С 1-6 алканолом. Соединения формулы I могут быть превращены в другие соединения формулы I при помощи известных технологий. Вышеуказанные способы (е)-(и) являются превращениями, представляющими особый интерес. Соединения формул I, III или IV, в которых Z представляет собой эфир карбоновой кислоты, могут быть превращены традиционными способами в соответствующие соединения, в которых Z представляет собой другие группы. Соединения формул I, IIА или IIВ, в которых R3 представляет собой Н, могут быть превращены в соответствующие соединения, в которых R3 не является Н, общепринятыми способами. В общем, группы R3, отличные от Н, могут быть присоединены путем обработки соединения формулы I, IIА или IIВ, в которых R3 представляет собой Н, гидридом натрия и затем соответствующим соединением формулы R3Br или R3I в диметилформамиде при 0 С. Предпочтительно соединения формул I, IIА или IIВ, в которых R3 представляет собой электронакцепторные группы (такие как SO2R10,SO2NR9R10, CONR9R10 и COR10), получают путем взаимодействия соединения формулы I, IIА или IIВ, в которых R3 представляет собой Н, с соответствующим соединением формулы R3Cl. Соединения по изобретению могут быть выделены и очищены общепринятыми способами. Для специалистов будет очевидно, что чувствительные функциональные группы могут нуждаться в защите и снятии защиты в процессе синтеза соединения по изобретению. Этого можно достичь с помощью традиционных методик, например как описано в "Protective GroupsWuts, John Wiley and Sons Inc., 1991. Например,может быть желательным защитить азот индола в соединении формулы IIА и использовать способ (а) с последующим снятием защиты с получением соединения формулы I, в котором R3 представляет собой Н. Способы (а)-(з) охватывают такие стадии защиты и снятия защиты. Синтез триазолетиона, оксадиазолона и оксадиазолетиона описан в J. Med. Chem., 1993,36, 1090-1099. Синтез оксатиадиазола описан вBioorganic and Medical Chemistry Letters, 1994, 4,1, 41-44. Соединения по изобретению могут обладать одним или более чем одним хиральным 9 центром и поэтому существовать в нескольких стереоизомерных формах. Все стереоизомеры и их смеси включены в объем настоящего изобретения. Рацемические соединения могут быть выделены либо препаративной HPLC (высокоэффективная жидкостная хроматография,ВЭЖХ) на колонке с хиральной стационарной фазой, либо разделены с получением индивидуальных энантиомеров способами, известными из уровня техники. Кроме того, хиральные промежуточные соединения могут быть выделены и использованы для получения хиральных соединений формулы I. Благодаря своей фармакологической активности соединения по изобретению полезны у животных, включая людей. Более конкретно они полезны при лечении рестеноза, почечной недостаточности,легочной гипертензии,доброкачественной гипертрофии простаты,застойной сердечной недостаточности, удара,стенокардии, атеросклероза, церебральной и сердечной ишемии и индуцированного циклоспорином токсического повреждения почек. Лечение рестеноза,почечной недостаточности и легочной гипертензии представляет особый интерес. Соединения по изобретению можно вводить сами по себе или в виде составной части комбинированной терапии. Таким образом, в соответствии со следующим аспектом изобретения предложено соединение формулы I, как оно определено выше,но без условий (1) и (2), или его фармацевтически приемлемое производное, для применения в качестве фармацевтического средства. Далее, предложен фармацевтический препарат, содержащий соединение формулы I, как оно определено выше, но без условий (1) и (2),или его фармацевтически приемлемое производное, и фармацевтически приемлемый адъювант, разбавитель или носитель. Согласно изобретению предложено также применение соединения формулы I, как оно определено выше, но без условий (1)-(3), или его фармацевтически приемлемого производного, в производстве лекарственного средства для лечения рестеноза, почечной недостаточности,легочной гипертензии, доброкачественной гипертрофии простаты, застойной сердечной недостаточности, удара, стенокардии, атеросклероза, церебральной и сердечной ишемии и индуцированного циклоспорином токсического повреждения почек. Согласно изобретению предложен также способ лечения этих заболеваний, при котором пациенту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения формулы I, как оно определено выше, но без условий (1)-(3), или его фармацевтически приемлемого производного. Не ограничиваясь теорией предполагают,что соединения по данному изобретению представляют собой антагонисты рецепторов эндо 001471 10 телина. Эндотелин (ЕТ) представляет собой мощный вазоконстриктор, синтезируемый и высвобождаемый эндотелиальными клетками. Имеются три различные изоформы ЕТ: ЕТ-1,ЕТ-2 и ЕТ-3, причем все три представляют собой пептиды, состоящие из 21 аминокислоты. Применяемый здесь термин "эндотелин" обозначает любую из трех изоформ. Фармакологически определены два подтипа рецепторов эндотелина, ЕТА и ЕТВ [см., например, Н. Arai etal, Nature, 348, 730, 1990], а в последнее время сообщалось и о других подтипах. Стимуляция ЕТА-рецепторов способствует вазоконстрикции,а стимуляция ЕТВ-рецепторов вызывает либо вазодилатацию, либо вазоконстрикцию. Эффекты эндотелина часто являются долгосрочными, причем, поскольку эндотелины широко распространены в тканях млекопитающих. Как в сосудистой, так и в несосудистой ткани отмечены разнообразные биологические реакции. Главные эффекты эндотелина отмечены в сердечно-сосудистой системе, особенно в коронарном, почечном, церебральном и мезентериальном кровообращении. Увеличенный уровень циркулирующих эндотелинов наблюдали у больных, перенесших чрескожную транслюминальную коронарную ангиопластику (PТCA) [A. Tahara et al. Metab.Clin. Exp. 40, 1235, 1991], и обнаружили, что ЕТ-1 индуцирует образование неоинтимы после баллонной ангиопластики у крыс [S. Douglas etal. J. Cardiovasc. Pharm., 22 (Suppl. 8), 371, 1993]. Те же исследователи обнаружили, что антагонист эндотелина SB-209670 вызывает снижение образования неоинтимы на 50% по сравнению с контрольными животными [S. Douglas et al.Circ. Res, 75, 1994]. Таким образом, антагонисты рецепторов эндотелина могут быть полезными в предотвращении рестеноза после РТСА. Эндотелин-1 вырабатывается в предстательной железе человека, в тканях которой были идентифицированы эндотелиновые рецепторы. Поскольку эндотелин представляет собой агент с контрактильным и пролиферативным действием, антагонисты рецепторов эндотелина могут быть полезными при лечении доброкачественной гипертрофии предстательной железы. Эндотелин и его рецепторы широко распространены в центральной нервной системе и церебральной сосудистой сети [R.K. Nikolov etal, Drugs of Today, 28(5), 303, 1992], причем полагают, что ЕТ играет роль в развитии церебрального вазоспазма, инфарктов мозга и смерти нейронов. Повышенный уровень эндотелина также наблюдали у пациентов с хронической почечной недостаточностью[F. Stockenhuber et al, Clin. Sci. (Lond.), 82, 255,1992],ишемической болезнью сердца [M. Yasuda,Am. Heart. J., 119, 801, 1990],стабильной или нестабильной стенокардией [J.T. Stewart, Br. Heart J., 66, 7, 1991], 11 легочной гипертензией [D.J. Stewart et al,Ann. Internal Medicine, 114, 464, 1991],застойной сердечной недостаточностьюJ. Med., 325, 997, 1991]. В каждом из этих случаев заболевание,связанное с физиологически повышенным уровнем эндотелина, возможно излечимо с помощью антагониста рецепторов эндотелина, и,следовательно, соединения по данному изобретению. Предпочтительны соединения, являющиеся селективными антагонистами скорее ЕТАрецепторов, а не ЕТв-рецепторов. Биологическая активность соединений по данному изобретению продемонстрирована с помощью Тестов А-С, описанных ниже. А. Анализ на связывание. Конкуренцию между исследуемыми соединениями и 125I-ЕТ-1 за связывание с рецепторами эндотелина человека определяли следующим образом. Связывание с ЕТА-рецепторами. 25 мкл 30 пМ раствора [125I]Туr13-ЕТ-1(удельная активность 2,200 Кюри/мМ) смешивают с образцами исследуемого соединения по 25 мкл (итоговая концентрация в диапазоне 0,1 нМ-50,000 нМ). Добавляют 200 мкл раствора,содержащего клонированный ЕТА-рецептор человека (0,75 пмоль белка рецептора на мл), 50 мМ Tris, 0,5 мМ СаСl2, 0,1% человеческого сывороточного альбумина, 0,1% бацитрацина и 0,05% Tween 20 и имеющего рН 7,4. Раствор перемешивают в течение 2 ч при температуре 37 С. После инкубации несвязанный лиганд отделяют от лиганда, связанного с рецептором,посредством фильтрации с помощью харвестера клеток Brandell и с последующим троекратным промыванием буфером. Определяют радиоактивность фильтровальной бумаги и определяютIС 50 (концентрацию исследуемого вещества, при которой 50% меченного радиоактивным изотопом соединения не связано) для исследуемого диапазона концентраций. Связывание с ЕТв-рецепторами. 25 мкл 30 пМ раствора [125I]Туr13-ЕТ-1(удельная активность 2,200 Кюри/мМ) смешивают с образцами исследуемого соединения по 25 мкл (итоговая концентрация в диапазоне 0,1 нМ-50,000 нМ). Добавляют 200 мкл раствора,содержащего клонированный ЕТв-рецептор человека (0,75 пмоль белка рецептора на мл), 50 мМ Tris, 0,5 мМ СаСl2, 0,1% человеческого сывороточного альбумина, 0,1% бацитрацина и 12 0,05% Tween 20 и имеющего рН 7,4. Раствор перемешивают в течение 2 ч при температуре 37 С. После инкубации несвязанный лиганд отделяют от лиганда, связанного с рецептором,посредством фильтрации с помощью харвестера клеток Brandell с последующим троекратным промыванием буфером. Определяют радиоактивность фильтровальной бумаги и определяютIC50 (концентрацию исследуемого вещества, при которой 50% меченного радиоактивным изотопом соединения не связано) для исследуемого диапазона концентраций. Б. Действие на гладкую мускулатуру сосудов in vitro. Аорта крыс. Аорту крысы очищают от соединительной ткани и жира и нарезают спиральными полосками шириной приблизительно 4 мм. Эндотелий удаляют посредством осторожного протирания внутренней поверхности сосуда фильтровальной бумагой, смоченной раствором Кребса,имеющим следующий состав (мМ): NaCl - 130,KCl - 5,6, NaHCO3- 25, глюкоза - 11,1, NaH2PO4- 0,6, CaCl2 - 2,16, MgCl2 - 0,5, и газированным смесью 95% О 2/5% СО 2. Полоски помещают в изолированные органные резервуары с раствором Кребса под натяжением в покое 1 г. Растворы в органном резервуаре держат при 37 С и постоянно аэрируют смесью 95% О 2/5% СО 2. Натяжение измеряют силовыми изометрическими трансдьюсерами Maywood Industries и отображают на записывающих устройствахGould TA4000. После достижения равновесия в органном резервуаре в течение 1 ч ткани сокращают посредством добавления KCl до конечной концентрации 60 мМ. KCl удаляют посредством замены раствора Кребса с двумя последующими промываниями раствором Кребса. Для определения мощности антагониста ЕТА-рецепторов в два образца ткани кумулятивно вводят ЕТ-1 (0,1 нМ-1 мкМ); в другие образцы ткани ЕТ-1 (0,1 нМ-1 мкМ) вводят дважды, начиная через 30 мин после введения исследуемого соединения в среду органного резервуара. В каждом эксперименте используют достаточное количество образцов ткани, чтобы построить кривые дозаответ для ЕТ-1 в отсутствие и в присутствии по меньшей мере 3 различных концентраций антагониста. Данные выражают в виде среднего значенияпогрешность измерения. Константы диссоциации (kd) конкурентных антагонистов рассчитывают по способу Arunlakshana и Schild. Легочная артерия кроликов. Изолированную легочную артерию кролика очищают от соединительной ткани и жира и нарезают кольцами шириной приблизительно 4 мм. Эндотелий удаляют посредством введения волоконного инструмента, смоченного раствором Кребса, имеющим следующий состав (мМ): 13 помещают в изолированные органные резервуары с раствором Кребса под натяжением в покое 1 г. Растворы в резервуаре держат при 37 С и постоянно аэрируют смесью 95% О 2/5% СО 2. Натяжение измеряют силовыми изометрическими трансдьюсерами Maywood Industries и отображают на записывающих устройствахGould TA4000. После достижения равновесия в органном резервуаре в течение 1 ч образцы ткани сокращают посредством добавления KCl до конечной концентрации 60 мМ. KCl удаляют посредством замены раствора Кребса с двумя последующими промываниями раствором Кребса. Для определения мощности антагониста ЕТв-рецепторов в два образца ткани кумулятивно вводят BQ-3020(0,1 нМ-1 мкМ); в другие образцы ткани BQ3020 (0,1 нМ-1 мкМ) вводят дважды, начиная через 30 мин после введения исследуемого соединения в среду органного резервуара. В каждом эксперименте используют достаточное количество образцов ткани, чтобы построить кривые доза-ответ для BQ-3020 в отсутствие и в присутствии по меньшей мере 3 различных концентраций антагониста. Данные выражают в виде среднего значенияпогрешность измерения. Константы диссоциации (kd) конкурентных антагонистов рассчитывают по способу Arunlakshana и Schild. В. Блокада вызванного эндотелином повышения артериального давления in vivo. У анестезированных крыс в условиях ганглионарной блокады и искусственной вентиляции легких в левую общую сонную артерию и правую яремную вену вставляют канюли для измерения артериального давления и введения препаратов, соответственно. Крысам вводят антагонист ЕТB-рецепторов BQ-788 (0,25 мг/кг внутривенно). Начиная через 10 мин после введения BQ-788 определяют гипертензивную реакцию на введение ЕТ-1 (1 мкг/кг внутривенно). После возвращения артериального давления к исходному вводят исследуемое соединение (0,120 мг/кг внутривенно) и через 10 мин после этого повторяют введение ЕТ-1. Исследуемые соединения вводят в возрастающей концентрации,а затем, через 10 мин, повторно вводят ЕТ-1.IC50 определяют в расчете на ингибирование прессорной реакции, индуцированной ЕТ-1, при кумулятивном введении исследуемого соединения. Продолжительность блокады определяют у анестезированных крыс в условиях ганглионарной блокады и искусственной вентиляции легких, которым в левую общую сонную артерию и правую яремную вену вставляют канюли для измерения артериального давления и введения препаратов, соответственно. Крысам вводят антагонист ЕТв-рецепторов BQ-788 (0,25 мг/кг внутривенно). Начиная через 10 мин после введения BQ788, определяют гипертензивную реакцию на 14 введение ЕТ-1 (1 мкг/кг в/в). После возвращения артериального давления к исходному вводят исследуемое соединение (10 мг/кг внутривенно). Дальнейшее введение ЕТ-1 производят через 5, 20 и 60 мин после введения исследуемого соединения. Отдельным животным, подготовленным так же, введение ЕТ-1 производят через 2 или 4 ч после введения исследуемого соединения. У этих животных введение BQ-788 производят за 10 мин до введения ЕТ-1. Для оценки более поздних моментов времени крысам вводят исследуемое соединение (10 мг/кг) в вену хвоста или перорально, после чего их анестезируют и подготавливают к измерению артериального давления как описано выше. Этим крысам ЕТ-1 (1 мкг/кг внутривенно) вводили через 6 или 8 ч после введения исследуемого соединения. Для применения у человека соединения по данному изобретению можно вводить сами по себе, но, как правило, их будут вводить в смеси с фармацевтическим носителем, выбранным с учетом предполагаемого способа введения и стандартной фармацевтической практики. Например, их можно вводить перорально в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах или овулях, сами по себе, либо в смеси с эксципиентами, или в форме эликсиров, растворов или суспензий, содержащих соединение или его соль в жидком носителе, например растительном масле, глицерине или воде с ароматизирующим или красящим агентом. Их также можно инъецировать парентерально, например внутривенно,внутримышечно или подкожно. Для парентерального введения их лучше всего применять в форме стерильных водных растворов, которые могут содержать и другие вещества, например глюкозу или соли в количестве, достаточном,чтобы сделать раствор изотоничным крови. Что касается парентерального введения, соединение или его соль можно также вводить в виде раствора или суспензии в подходящем масле, например полиэтиленгликоле, лецитине или кунжутном масле. Соединения по данному изобретению также можно вводить посредством ингаляции раствора, суспензии или эмульсии, которые можно применять в форме сухого порошка или в форме аэрозоля с использованием традиционного пропеллента, такого как дихлордифторметан. Суточные дозировки соединений по данному изобретению для перорального или парентерального введения людям должны составлять от 0,01 до 30 мг/кг (в однократной дозе или в разделенных дозах) и предпочтительно должны находиться в диапазоне от 0,01 до 5 мг/кг. Так,таблетки должны содержать от 1 мг до 0,4 г соединения для введения по одной или по две или более за раз, как потребуется. Вышеуказанные дозировки представляют собой, конечно же,только пример среднего случая, и могут иметь 15 место случаи, когда будут оправданы более высокие или низкие дозы. Подобные случаи также находятся в пределах объема данного изобретения. Альтернативно, соединения по изобретению можно вводить в форме суппозиториев или пессариев, или их можно наносить местно в форме лосьона, раствора, крема, масла или присыпки или в форме лекарственного пластыря,накладки или мембраны. Например они могут быть включены в состав крема, содержащего водную эмульсию полиэтиленгликолей или жидкого парафина. Соединения по изобретению также можно вводить интраназально. Изобретение иллюстрируется следующими примерами, в которых использованы следующие сокращения: ХИАД (APCI) ДМФ (DMF) ДМСО (DMSO) химическая ионизация при атмосферном давлении диметилформамид диметилсульфоксид этил час изопропил масс-спектрометрия низкого разрешения минута метил ядерный магнитный резонанс трифторуксусная кислота тонкослойная хроматография Гидрид натрия (480 мг 60% дисперсии в минеральном масле) добавляют к перемешиваемому раствору 6-броминдола (1,9 г, 9,2 ммоль) в диметилформамиде (20 мл) при 0 С в атмосфере азота. Через 1 ч добавляют бромэтан (1,1 мл,14,7 мл) и удаляют охлаждающую баню. Через 12 ч диметилформамид удаляют в вакууме. Остаток очищают непосредственно колоночной флэш-хроматографией (используя смесь 95% гексана, 5% этилацетата в качестве элюента) с получением 2,1 г соединения, указанного в подзаголовке, в виде желтого масла. 1 Н ЯМР (300 МГц, CDCl3): =1.45 (t, 3 Н),4.10 (q, 2H), 6.45 (d, 1H), 7.10 (d, 1H), 7.20 (d,1H), 7.45 (d, 1H), 7.55 (s, 1H). МСНР (Терморазбрызгивание): 224 (МН+). б) 6-Метоксикарбонил-1-этилиндол 16 раствор переносят в помощью канюли в перемешиваемый раствор метилхлорформиата (1,29 мл, 16,74 ммоль) в диэтиловом эфире (8 мл) при-78 С в атмосфере азота. Через 1 ч охлаждающую баню удаляют и смеси позволяют нагреться до комнатной температуры. Еще через 1 ч смесь вливают в рассол и экстрагируют этилацетатом. Органические слои сушат (MgSO4) и концентрируют в вакууме с получением желтого масла. Колоночная флэш-хроматография Смесь этилоксалилхлорида (50 мл, 0,45 ммоль) и 1,3-бензодиоксола (50 г, 0,41 ммоль) в дихлорметане (40 мл) по каплям добавляют к перемешиваемой суспензии трихлорида алюминия (71 г, 0,53 ммоль) в дихлорметане (500 мл) при 0 С в атмосфере азота. Через 2 ч смесь вливают в ледяную воду, и органический слой промывают дополнительными объемами воды (3 х 500 мл), насыщенным раствором бикарбоната натрия (500 мл) и рассолом (500 мл). Органический слой сушат (сульфат магния) и концентрируют до получения оранжевого масла. Колоночная флэш-хроматография (смесь 90% гексана, 10% этилацетата) дает 30 г соединения, указанного в подзаголовке, в виде бледно-желтого масла. 1 Н ЯМР (300 МГц, CDCl3): =1.40 (t, 3 Н),4.40 (q, 2H), 6.10 (s, 2H), 6.85 (d, 1H), 7.50(s, 1H),7.60 (d, 1H). МСНР(соединение из стадии (б), 2,1 г, 10,3 ммоль) и этилового эфира бензо(1,3)диоксол-5-ил-оксоуксусной кислоты (соединение, указанное в подзаголовке стадии (в), 2,4 г, 10,9 ммоль) в дихлорметане (10 мл) по каплям добавляют к раствору триэтилсилана (6,4 мл, 51,5 ммоль) и трифторида бора диэтилэфирата (3,28 мл, 20,6 ммоль) в дихлорметане (15 мл) при -78 С в атмосфере азота. Через 1 ч темно-окрашенную 17 смесь нагревают до -40 С. Через 10 ч смесь нагревают до комнатной температуры и вливают в раствор гидроксида натрия (200 мл 1 М раствора). Колбу промывают дихлорметаном (150 мл),и 2 фазы энергично встряхивают. Органический слой отделяют и промывают рассолом, затем сушат (MgSO4) и концентрируют в вакууме. Колоночная флэш-хроматография (элюирование смесью 90% гексана, 10% этилацетата) дает 4,2 г соединения, указанного в подзаголовке, в виде чистого масла. 1 Н ЯМР (300 МГц, CDCl3): =1.45 (t, 3 Н),4.00 (s, 3 Н), 4.25 (q, 2H), 5.15 (s, 2H), 5.90 (s,2H), 6.70 (d, 1H), 6.80 (d, 1H), 6.85 (s, 1H), 7.30 Раствор гидроксида натрия (5 мл 2 М раствора) добавляют к перемешиваемому раствору этил 2-[3-(1-этил-6-метоксикарбонил)индолил]2-(3,4-метилендиоксифенил)ацетата (соединение, указанное в заголовке примера 1, 3,76 г, 9,2 ммоль) в смеси 2:1 тетрагидрофурана и метанола (30 мл) при комнатной температуре. Смесь нагревают с обратным холодильником в течение 6 ч с последующей тонкослойной хроматографией, затем снова охлаждают и в вакууме удаляют органические растворители. Остаток вливают в раствор гидроксида натрия (200 мл 0,5 М раствора) и экстрагируют дихлорметаном для извлечения любого непрореагировавшего исходного материала. Затем водный слой подкисляют 2 М соляной кислотой до рН 1 и экстрагируют дихлорметаном (2 х 300 мл). Органические фракции объединяют, сушат и концентрируют в вакууме с получением неочищенного продукта в виде масла. Колоночная флэшхроматография (элюирование смесью 94% дихлорметана, 5% метанола, 1% аммиака) дает соединение, указанное в заголовке, в виде чистого масла. 1 Н ЯМР (300 МГц, CDCl3): =1.45 (t, 3 Н),3.95 (s, 3 Н), 4.20 (q, 2H), 5.20 (s, 1H), 5.95 (s,2H), 6.80 (d, 1H), 6.85 (d, 1H), 6.90 (s, 1H), 7.35(соединение, указанное в заголовке примера 2,1,8 г, 4,7 ммоль) в дихлорметане (60 мл) при комнатной температуре в атмосфере азота. Раствор нагревают с обратным холодильником в течение 12 ч. Смесь охлаждают и добавляют 1,8-диазабицикло[5.4.0]ундец-7-ен (0,92 мл, 6,14 ммоль) и 4-изопропилбензолсульфонамид (1,03 г, 5,17 ммоль). Смесь кипятят с обратным холодильником еще 12 ч. После охлаждения смесь вливают в раствор хлорида аммония (200 мл) и экстрагируют дихлорметаном. Органические фракции сушат (MgSO4) и концентрируют с получением желтого масла. Колоночная флэшхроматография с использованием сначала дихлорметана, а затем 3% метанола в дихлорметане дает 1,95 г соединения, указанного в заголовке, в виде бледно-желтого масла. 1 Н ЯМР (300 МГц, CDCl3): =1.30 (d, 6H),1.45 (t, 3 Н), 3.00 (m, 1H), 3.95 (s, 3 Н), 4.20 (q,2 Н), 5.00 (s, 1 Н), 5.90 (s, 2 Н), 6.60 (s, 1 Н), 6.70(50 мл), и раствор нагревают с обратным холодильником в течение 8 ч. После охлаждения метанол удаляют в вакууме, и полученный раствор распределяют между 1 М соляной кислотой(100 мл) и дихлорметаном (3 х 100 мл). Органические фракции сушат (MgSO4) и концентрируют с получением желтого твердого вещества. Колоночная флэш-хроматография (с использованием смеси 95% дихлорметан/5% метанол в качестве элюента) дает соединение, указанное в заголовке, в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3): =1.25 (d, 6H),1.40 (t, 3 Н), 3.00 (m, 1H), 4.15 (q, 2H), 5.00 (s, 19 1-(3-Диметиламинопропил)-3-этилкарбодиимда гидрохлорид (56 мг, 0,294 ммоль) добавляют к перемешиваемому раствору N-(4-изопропилбензолсульфонил)-2-[3-(1-этил-6-карбокси)индолил]-2-(3,4-метилендиоксифенил)ацетамида (соединение, указанное в заголовке примера 4, 124 мг, 0,23 ммоль), гидроксибензотриазола (37 мг, 0,27 ммоль), триэтиламина (63 мкл,0,45 ммоль) и метиленамингидрохлорида (23 мг,0,34 ммоль) в дихлорметане (7 мл) при комнатной температуре в атмосфере азота. Через 12 ч реакционную смесь вливают в водный раствор гидрокарбоната натрия и экстрагируют дихлорметаном (3 х 100 мл). Объединенные органические фракции сушат (MgSO4) и концентрируют с получением желтого твердого вещества. Колоночная флэш-хроматография (с использованием этилацетата в качестве элюента) дает соединение, указанное в заголовке, в виде желтого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3): =1.25 (d, 6H),1.40 (t, 3 Н), 3.00 (m, 1H), 3.05 (d, 3 Н), 4.05 (q,2H), 5.00 (s, 1H), 5.90 (s, 2H), 6.30 (d, 1H), 6.65(d, 1H), 6.70 (s, 1H), 6.90 (d, 1H), 6.95 (s, 1H),7.10 (d, 1 Н), 7.25 (s, 1 Н), 7.30 (d, 2H), 7.85 (d,2H), 7.90 (s, 1H), 9,40 (brs, 1H). МСНР (Терморазбрызгивание): 562 (МН+). Примеры 6-10 получают способом примера 5, используя продукт примера 4 и подходящий замещенный амин как исходные материалы. Их физические данные показаны в таблице 1. Оксалилхлорид (0,065 мл, 0,74 ммоль) добавляют к перемешиваемому раствору N-(4-изопропилбензолсульфонил)-2-[3-(1-этил-6-карбокси)индолил]-2-(3,4-метилендиоксифенил)ацетамида (соединение примера 4, 340 мг, 0,62 ммоль) в сухом тетрагидрофуране (10 мл) при комнатной температуре в атмосфере азота. Добавляют диметилформамид (3 капли) и продолжают перемешивание при комнатной температуре в течение 2 ч. Растворитель удаляют в вакууме (дважды отгоняя азеотроп с толуолом), и остаток заново растворяют в тетрагидрофуране(5 мл). Этот раствор добавляют к перемешиваемому раствору трет-бутилкарбазата (163 мг,1,24 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре в атмосфере азота. Через 18 ч растворитель удаляют в вакууме, а остаток растворяют в дихлорметане (3 мл). Раствор пропускают через тонкий слой диоксида кремния,промывая 20 мл смеси 95/5 дихлорметан/метанол. Растворитель снова удаляют в вакууме, а остаток заново растворяют в тетрагидрофуране (8 мл). Добавляют концентрирован 21 ную соляную кислоту (1,9 мл) и воду (0,6 мл), и смесь нагревают на паровой бане в течение 1 ч. После охлаждения смесь вливают в воду (100 мл), доводят рН до 6, и продукт экстрагируют дихлорметаном (2 х 100 мл). Органические слои сушат (MgSO4) и концентрируют. Желтый остаток заново растворяют в тетрагидрофуране (8 мл) и добавляют N,N-карбонилдиимидазолил(121 мг, 0,74 ммоль) и триэтиламин (0,095 мл,0,68 ммоль). Через 18 ч этот раствор вливают в водный хлорид аммония (100 мл) и экстрагируют дихлорметаном (2 х 100 мл). Органические слои сушат (MgSO4) и концентрируют в вакууме с получением желтого масла. Колоночная флэш-хроматография (элюирование смесью 97% дихлорметана, 3% метанола) дает соединение, указанное в заголовке, в виде желтой пены. 1 Н ЯМР (300 МГц, CDCl3): =1.25 (d, 6H),1.45 (t, 3H), 3.00 (m, 1H), 4.10 (q, 2H), 5.00 (s,1H), 5.90 (s, 2H), 6.65 (s, 1H), 6.70 (d, 1H), 7.00N-(4-изо-пропилбензолсульфонил)-2-[3-(1-этил 6-карбокси)индолил]-2-(3,4-метилендиоксифенил)ацетамида (соединение, указанное в заголовке примера 4, 300 мг, 0,55 ммоль) в сухом тетрагидрофуране (8 мл) в атмосфере азота. Раствор нагревают с обратным холодильником в течение 12 ч, затем охлаждают до комнатной температуры. Аммиак (газ) барботируют через этот раствор в течение 10 мин, и колбу прочно закрывают и перемешивание продолжают еще 48 ч, во время чего образуется желтый осадок. Растворитель удаляют в вакууме, остаток растворяют в дихлорметане (50 мл) и органический слой промывают водным хлоридом аммония, а затем рассолом, после чего сушат (сульфат магния) и концентрируют в вакууме. Желтый остаток растирают с 5% метанола и 95% дихлорметана с получением продукта в виде бледножелтого твердого вещества. 1 Н ЯМР (400 МГц, CD3OD): =1.25 (d, 6H),1.40 (t, 3H), 3.00 (sep. 1H), 4.20 (q, 2 Н), 5.05 (s,1H), 5.90 (s, 1H), 6.65 (s, 1H), 6.70 (s, 2H), 7.00 (s,1H), 7.20 (d, 1 Н), 7.40 (d, 2H), 7.45 (d, 1H), 7.80 Гидрид натрия (4,10 г 60% дисперсии в парафине) добавляют к перемешиваемому раствору 6-броминдола (10 г, 51,3 ммоль) в тетрагидрофуране (100 мл) при 0 С в атмосфере азота. Через 1 ч добавляют йодметан (6,38 мл, 102,6 ммоль) и охлаждающую баню удаляют. Через 12 ч по каплям добавляют метанол до прекращения выделения газа, а затем растворитель удаляют в вакууме. Густой остаток разбавляют дихлорметаном и промывают сначала водой,затем рассолом. Органический слой сушат(сульфат магния) и концентрируют в вакууме с получением темно-желтого масла. Фильтрация через слой диоксида кремния с использованием смеси 90% гексана/10% этилацетата в качестве элюента дает соединение, указанное в подзаголовке, в виде желтого масла (10,5 г). 1 Н ЯМР (300 МГц, CD3Cl3): =3.75 (d, 3H),6.40 (d, 1H), 7.00 (d, 1H), 7.20 (d, 1 Н), 7.50 (d,1H), 7.45 (s, 1H). МСНРN-(4-Изо-пропилбензолсульфонил)-2-[3-[1 метил-6-карбокси)индолил]-2-(3,4-метилендиоксифенил)ацетамид получают способами примеров 1(б), 1(г), 2 и 3, но начиная с соединения,указанного в подзаголовке стадии (а) вместо 6 бром-1-этилиндола. Затем к перемешиваемому раствору этого продукта (2 г, 3,65 ммоль) в метаноле (50 мл) добавляют водный КОН (7,3 мл 1 М раствора), и этот раствор нагревают с обратным холодильником в течение 8 ч. После охлаждения метанол удаляют в вакууме, и полученный раствор распределяют между 1 М соляной кислотой (100 мл) и дихлорметаном (3 х 100 мл). Органические фракции сушат (MgSO4) и концентрируют с получением желтого твердого вещество. Колоночная флэш-хроматография(с использованием смеси 95% дихлорметана/5% метанола в качестве элюента) дает соединение,указанное в заголовке, в виде белого твердого вещества (1,44 г). 1 Н ЯМР (400 МГц, CDCl3): =1.25 (d, 6H),3.00 (hept. 1H), 3.80 (s, 3 Н), 5.05 (s, 1 Н), 5.95 (s,2H), 6.65 (d, 2H), 6.70 (s, 1H), 7.00 (s, 1H), 7.20(МNН 4+). Примеры 14-18 получают, применяя способ примера 13(б), но с использованием соответствующего ароматического сульфонамида вместо 4-изопропилбензолсульфонамида в способе примера 3. Примеры 25-26 получают способом примера 5 из соединения примера 17 и подходящего амина. Пример 27. 2-(Диметиламино)этиловый эфир 3-[1-(1,3-бензодиоксол-5-ил)-2-[(2-метокси-4-метилфенил)сульфонамидо]-2-оксоэтил]1-метил-1 Н-6-индолкарбоновой кислоты. Смотри подготовительный пример 11 для получения ароматического сульфонамида Примеры 21-24 получают способом примера 12 из соединений примеров 14, 15, 16 и 20,соответственно. 1-(3-Диметиламинопропил)-3-этилкарбодиимида гидрохлорид (128 мг, 0,67 ммоль) добавляют к перемешиваемому раствору 3-1-(1,3 бензодиоксол-5-ил)-2-[(2-метокси-4-метилфенил)сульфонамидо]-2-оксоэтил-1-метил-1 Н-6 индол-карбоновой кислоты (продукт примера 17, 300 мг, 0,56 ммоль), N,N-диметиламинопиридина (75 мг, 0,61 ммоль) и диметиламино 25 этанола (0,17 мл, 1,67 ммоль) в смеси СН 2 Сl2 (9 мл) и ДМФ (0,5 мл) при комнатной температуре в атмосфере азота. Через 12 ч образуется тонкий белый осадок. Продукт удаляют фильтрацией и промывают холодным метанолом. 1 Н ЯМР (400 МГц, d6-ДМСО): =2.40 (s,9H), 2.70 (t, 2H), 3.60 (s, 3 Н), 3.75 (s, 3 Н), 4.30 (t,2H), 5.05 (s, 1H), 5.90 (s, 2H), 6.65 (d, 1H), 6.70 К раствору 3-нитро-4-метилбензойной кислоты (17,3 г 96 ммоль) в дихлорметане (250 мл) и трет-бутаноле (35,8 г 470 ммоль) при 0 С в атмосфере азота добавляют 4-диметиламинопиридин (6 г 50 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (25,8 г 140 ммоль), и раствору позволяют дойти до комнатной температуры примерно за 1 ч, затем перемешивают в течение ночи. Раствор вливают в смесь 1:1 этилацетат:вода (800 мл каждого), и органический слой промывают водным бикарбонатом и насыщенным водным хлоридом натрия, затем сушат (MgSO4) и выпаривают с получением продукта в виде прозрачного масла К раствору эфира из стадии (а) (23 г, 97 ммоль) в диметилформамиде (100 мл) добавляют диметилформамиддиметилацеталь (50 мл) и пирролидин (20 капель). Раствор перемешивают под азотом при 80 С в течение ночи с получением темно-красного раствора, который выпаривают до сухости с получением темнокрасного масла, которое кристаллизуется при стоянии и которое применяют без дальнейшей очистки. Неочищенный диметиленамин (предположим 97 ммоль) растворяют в толуоле (850 мл) и гидрируют в течение ночи при давлении 345 кПа (50 фунт/кв.дюйм) в присутствии 10% палладия-на-угле (5 г). Катализатор удаляют фильтрацией, а растворители выпаривают. Остаток флэш-хроматографируют на двуокиси кремния, используя дихлорметан в качестве 26 элюента, с получением продукта в виде кристаллического твердого вещества (12,6 г). 1 Н ЯМР (400 МГц, CDCl3): 1.65 (s, 9H),6.60 (s, 1H), 7.40 (t, 1H), 7.65 (d, 1H), 7.80 (d,1H), 8.15 (s, 1H), 8.50 (s, 1H). К раствору индола из стадии (б) (12,5 г, 57 ммоль) в тетрагидрофуране (150 мл) при 0 С в атмосфере азота добавляют гидрид натрия в виде 60% суспензии в масле (2,28 г, 57 ммоль). После прекращения выделения газа добавляют метилйодид (3,6 мл, 57 ммоль), и раствору позволяют дойти до комнатной температуры. Смесь перемешивают 1 ч, вливают в этилацетат(500 мл) и промывают водой и насыщенным рассолом, затем сушат (MgSO4) и выпаривают с получением масла, которое загрязнено гидридным маслом, но достаточно чистое для дальнейшего использования (14,1 г). 1 Н ЯМР (300 МГц, CDCl3): 1.65 (s, 9H),3.85 (s, 3H), 6.50 (d, 1H), 7.20 (s, 1H), 7.60 (d,1H), 7.75 (d, 1H), 8.05 (s, 1H). МСНР К раствору трифторида бора диэтилэфирата (14 мл, 132 ммоль) и триэтилсилана (40 мл,240 ммоль) в дихлорметане (60 мл) при -78 С в атмосфере азота по каплям добавляют раствор индола из стадии (в) (14 г, 60 ммоль) и бензодиоксолэтилпирувата (14 г, 66 ммоль) в дихлорметане (80 мл). Этот раствор перемешивают при-78 С в течение 30 мин, затем гасят водной соляной кислотой, органический слой отделяют,сушат (MgSO4) и выпаривают. Гидроксипромежуточное выделяют в виде тускло-желтого твердого вещества (19,38 г) флэш-хроматографией с использованием в качестве элюента 30% этилацетата в гексане. Этот промежуточный продукт (15 г) растворяют в дихлорметане(50 мл) и триэтилсилане (15 г) при 0 С в атмосфере азота, и по каплям добавляют трифторуксусную кислоту (50 мл) в течение 10 мин. Через 1 ч при комнатной температуре реакционную смесь гасят водой, органический слой отделяют,сушат (MgSO4) и выпаривают. Флэш-хроматография на диоксиде кремния с использованием этилацетат в качестве элюента дает эфир кислоты в виде бледной пены (9,53 г). К раствору кислоты (9,43 г 25 ммоль) в тетрагидрофуране (125 мл) добавляют карбонилдиимидазол (4,0 г 25 ммоль), и раствор кипятят с обратным холодильником в течение 4 ч. Раствор охлаждают до 0 С и насыщают газообразным аммиаком, затем перемешивают в течение ночи. Реакционную смесь концентрируют в вакууме и распределяют между этилацетатом и водой. Органический слой дважды промывают водой и рассолом, затем сушат (MgSO4) и выпаривают. Продукт выделяют флэш-хроматографией, используя в качестве элюента 2% метанола в дихлорметане, с получением эфира амида в виде бледной пены (5,6 г). 1 Н ЯМР (300 МГц, d6-ДМСО): 1.20 (t, 3H),3.80 (s, 3H), 4.15 (q, 2 Н), 5.20 (s, 1H), 5.95 (s,2H), 6.80-8.00 (m, 9H). МСНР К раствору эфира амида из стадии (д) (5,6 г, 14,7 ммоль) в тетрагидрофуране (60 мл) и метаноле (30 мл) по каплям добавляют водный раствор гидроксида натрия (10 мл 5 М раствора,50 ммоль), и смесь нагревают с обратным холодильником в течение 9 ч. Растворители удаляют в вакууме, остаток растворяют в водном гидроксиде натрия и промывают дихлорметаном. Водный слой подкисляют водной соляной кислотой и продукт выделяют фильтрацией. Растирание с этилацетатом дает продукт в виде белого твердого вещества (5,1 г). 1 Н ЯМР (300 МГц, d6-ДМСО): 3.80 (s, 3H),5.15 (s, 1H), 6.00 (d, 2H), 6.80-8.00 (m, 9H). МСНР 1-(3-Диметиламинопропил)-3-этилкарбодиимида гидрохлорид (65 мг, 0,34 ммоль) добавляют к перемешиваемому раствору 2-(1,3 бензодиоксол-5-ил)-2-(6-карбамоил-1-метил-1 Н 3-индолил)уксусной кислоты (из стадии (е), 100 мг, 0,28 ммоль), диметиламинопиридина (45 мг,0,37 ммоль) и п-толуолсульфонамида (53 мг,0,31 ммоль) в дихлорметане (5 мл) и диметилформамиде (1 мл) при комнатной температуре в атмосфере азота. Через 14 ч растворитель удаляют в вакууме и продукт экстрагируют из 1 н. соляной кислоты (50 мл) этилацетатом (2 х 50 мл). Органические слои сушат и концентрируют с получением желтовато-коричневой пены. Колоночная флэш-хролматография (элюирование смесью 95% дихлорметана/5% метанола) дает продукт (95 мг) в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CD3OD): =2.40 (s, 3H),3.75 (s, 3H), 5.05 (s, 1H), 5.90 (s, 2 Н), 6.60 (m,3H), 6.90 (s, 1H), 7.20 (d, 1H), 7.30 (d, 2H), 7.40(d, 1H), 7.80 (d, 2 Н), 7.95 (s, 1 Н). МСНР (ХИАД): 506 (МН+). Примеры 29-45 получают взаимодействием соединения примера 28(е) с подходящим ароматическим сульфонамидом, применяя способ примера 28(ж). См. подготовительный пример 8 для получения сульфонамидаСм. подготовительный пример 3 для получения сульфонамида Этиловый эфир (Е)-3-(4-[2-(6-карбамоил-1 метил-1 Н-3-индолил)-2-(1,3-бензодиоксол-5 ил)ацетил]сульфамоилфенил)-2-пропеновой кислоты (соединение примера 41, 0,24 г, 0,40 ммоль) растворяют в этаноле (5 мл) и добавляют 5% палладий-на-угле (24 мг). Смесь помещают в автоклав и поддерживают давление водорода 345 кПа (50 фунт/кв.дюйм) в течение 48 ч. Реакционную смесь фильтруют через Arbocel и концентрируют в вакууме. Колоночная флэш-хроматография (элюирование смесью 5% метанола/90% дихлорметана) дает продукт (70 мг). 1 Н ЯМР (400 МГц, C3OD): =1.20 (t, 3H),2.60 (t, 2H), 3.00 (t, 2H), 3.75 (s, 3 Н), 4.05 (q, 2H),5.05 (s, 1H), 5.85 (s, 2H), 6.60 (s, 1H), 6.70 (s, 2H),6.90 (s, 1H), 7.20 (d, 1H), 7.30 (d, 2H), 7.40 (d,1H), 7.80 (d, 2H), 7.90 (s, 1H). МСНР (ХИАД): 591.9 (МН+). Пример 47. 2-(4-[2-(1,3-Бензодиоксол-5 ил)-2-(6-карбамоил-1-метил-1 Н-3-индолил)ацетил]сульфамоилфенил)уксусная кислота 1 М раствор гидроксида натрия (0,57 мл) добавляют к перемешиваемому раствору этилового эфира 2-(4-[2-(1,3-бензодиоксол-5-ил)-2-(6 карбамоил-1-метил-1 Н-3-индолил)ацетил]сульфамоилфенил)уксусной кислоты (продукт примера 37, 110 мг, 0.19 ммоль) в водном диоксане(8 мл диоксана:2 мл Н 2 О) при комнатной темпе 31 ратуре. Через 1 ч растворитель удаляют в вакууме. Реакционную смесь разбавляют этилацетатом, вливают в 0,5 М соляную кислоту (50 мл) и экстрагируют этилацетатом (2 х 50 мл). Органические слои сушат (сульфат магния) и концентрируют в вакууме с получением желтой пены. Колоночная флэш-хроматография (элюирование смесью 5% метанола/90% дихлорметана) дает продукт в виде белого твердого вещества (90 мг). 1 Н ЯМР (400 МГц, CDCl3): =3.40 (s, 2H),3.90 (s, 3 Н), 5.20 (s, 1H), 6.00 (s, 2H), 6.80 (m,3 Н), 7.00 (s, 1H), 7.30 (d, 1H), 7.60 (d, 2H), 7.65(s, 1H), 8.00 (s, 1H), 8.10 (d, 2H). МСНР (ХИАД): 549.9 (МН+). Примеры 48-50 осуществляют, применяя способ примера 47, начиная с соединений примеров 45, 43 и 46, соответственно. Цианид меди (12,8 г, 143 ммоль) добавляют к перемешиваемому раствору 6-бром-1 метилиндола (10 г, 47 ммоль) в N-метилпирролидиноне (60 мл) в атмосфере азота. Реакционную смесь нагревают при 150 С в течение 48 ч. Реакционную смесь охлаждают и распределяют между этилацетатом (200 мл) и водным аммиаком (200 мл 0,88 М раствора). Органический слой промывают рассолом (3 х 200 мл), сушат(MgSO4) и концентрируют. Колоночная флэшхроматография (элюирование смесью 70% гексана/30% этилацетата) дает продукт в виде кристаллического белого твердого вещества (5,3 г). Соединение, указанное в заголовке, получают с использованием способов примеров 1(г),2 и 3, но начиная с соединения из стадии (а) вместо 6-метоксикарбонил-1-этилиндола. 1 Н ЯМР (400 МГц, CDCl3): =1.30 (d, 6H),3.00 (m, 1H), 3.80 (s, 3 Н), 5.00 (s, 1H), 6.00 (s,2 Н), 6.60 (s, 1 Н), 6.65 (d, 1 Н), 6.70 (d, 1H), 7.00 Триметилсилилазид (0,23 мл, 1,74 ммоль) и дибутилоловооксид (52 мг, 0,2 ммоль) добавляют к раствору 3-1-(1,3-бензодиоксол-5-ил)-2[(4-изопропилфенил)сульфонамидо]-2 оксоэтил-6-циано-1-метил-1 Н-индола (продукт примера 51, 300 мг, 0,58 ммоль) в толуоле (10 мл), и раствор нагревают с обратным холодильником в атмосфере азота в течение 14 ч. Анализ показывает, что реакция протекает не до конца. Добавляют дополнительные аликвоты триметилсилилазида (0,23 мл, 1,74 ммоль) и дибутилоловооксид (52 мг, 0,2 ммоль) и продолжают нагревание с обратным холодильником еще 24 ч. Реакционную смесь охлаждают и концентрируют. Неочищенный продукт очищают колоночной флэш-хроматографией (градиентное элюирование от 95% дихлорметана/5%метанола до 90% дихлорметана/10%метанола) с получением бледно-розового твердого вещества (100 мг). 1 Н ЯМР (300 МГц, d6-ДMCO): =1.20 (d,6H), 3.00 (m, 1H), 3.80 (s, 3 Н), 5.10 (s, 1 Н), 5.95 Боргидрид натрия (213 мг, 5,6 ммоль) медленно добавляют к энергично перемешиваемому раствору 3-1-(1,3-бензодиоксол-5-ил)-2-[(4 изопропилфенил)сульфонамидо]-2-оксоэтил-6 циано-1-метил-1 Н-индола (продукт примера 51,290 мг, 0,56 ммоль) и CoCl26H2O (200 мг, 0,84 ммоль) в метаноле (12 мл) при комнатной температуре в атмосфере азота. Через 2 ч, по окончании реакции, по каплям добавляют 2 н. соляную кислоту (4 мл). Перемешивание продолжают до растворения черного осадка. Метанол удаляют в вакууме и продукт экстрагируют из воды дихлорметаном (50 мл) и этилацетатом (50 мл). Органические слои объединяют, сушат(MgSO4) и концентрируют. Неочищенный продукт очищают колоночной флэш-хроматографией (элюирование смесью 90% дихлорметана/10%метанола/2% уксусной кислоты) с получением коричневой смолы. Остаток растворяют в метаноле (10 мл) и перемешивают с древесным углем в течение 30 мин. Фильтрация и концентрирование дают продукт в виде желтого масла. 1 Н ЯМР (300 МГц, CD3OD): =1.20 (d, 6H),2.95 (m, 1H), 3.65 (s, 3 Н), 4.20 (s, 2 Н), 5.00 (s,1H), 5.80 (d, 2H), 6.60 (d, 1H), 6.70 (d, 1H), 6.75 Диэтилдитиофосфат (1,3 мл, 7,7 ммоль) добавляют к 3-1-(1,3-бензодиоксол-5-ил)-2-[(4 изопропилфенил)сульфонамидо]-2-оксоэтил-6 циано-1-метил-1 Н-индолу (продукт примера 51,800 мг, 1,5 ммоль) в смеси этанола (10 мл) и воды (5 капель). Реакционную смесь нагревают с обратным холодильником при перемешивании в течение 14 ч. После охлаждения растворитель удаляют в вакууме, а остаток очищают колоночной флэш-хроматографией (элюирование смесью 98% дихлорметана/2%метанола) с получением коричневого масла. Этот остаток рас 001471 34 творяют в этилендиамине, и реакционную смесь нагревают с обратным холодильником в течение 3 ч. После охлаждения этилендиамин удаляют в вакууме. Добавляют соляную кислоту (10 мл) и полученный осадок фильтруют и промывают дихлорметаном и метанолом. Колоночная флэш-хроматография (элюирование смесью 80% дихлорметана/20%метанола/5% NН 3) дает продукт в виде белого твердого вещества. 1 Н ЯМР (300 МГц, d6-ДMCO): =1.20 (d,6H), 2.80 (m, 1H), 3.80 (s, 3 Н), 3.95 (s, 4 Н), 4.80 Соединение, указанное в заголовке, получают из соединения примера 13(а), применяя способы примеров 1(г), 2 и 3, с использованием 4-метилбензолсульфонамида вместо 4-изопропилбензолсульфонамида на последней стадии. 1 Н ЯМР (300 МГц, CDCl3): =2.40 (s, 3H),3.70 (s, 3H), 4.90 (s, 1H), 5.90 (s, 2H), 6.60 (s, 1H),6.65 (d, 1H), 6.70 (d, 1H), 6.75 (s, 1H), 6.90 (d,1H), 7.05 (d, 1H), 7.20 (d, 2H), 7.40 (s, 1H), 7.80 Соединение, указанное в заголовке, получают из соединения примера 13(а) с использованием способов примеров 1(г), 2 и 3. 1 Н ЯМР (300 МГц, d6-ДMCO): =1.20 (d,6H), 3.00 (m, 1H), 3.60 (s, 3 Н), 5.00 (s, 1 Н), 5.90 Ацетат палладия (9,5 мг, 0,042 ммоль) добавляют к перемешиваемому раствору 3-1-(1,3 бензодиоксол-5-ил)-2-[(4-изопропилфенил)сульфонамидо]-2-оксоэтил-6-бром-1-метил-1 Ниндола (продукт примера 56, 200 мг, 0.35 ммоль), этилакрилата (0,048 мл, 0,44 ммоль),триэтиламина (0,146 мл, 1 ммоль) и три-отолилфосфина (32 мг, 0,1 ммоль) в ацетонитриле (10 мл) при комнатной температуре в атмосфере азота. Раствор нагревают с обратным холодильником в течение 2 ч. После охлаждения смесь вливают в рассол (50 мл) и экстрагируют этилацетатом (2 х 50 мл). Органические слои промывают водой (50 мл), сушат (MgSO4) и концентрируют с получением серой пены. Очистка колоночной флэш-хроматографией (элюирование смесью 95% дихлорметана/5% метанола) дает продукт в виде бледно-желтой пены. 1 Н ЯМР (400 МГц, CDCl3): =1.30 (d, 6H),1.35 (t, 3 Н), 3.00 (m, 1H), 3.75 (s, 3 Н), 4.30 (q,2H), 5.00 (s, 1H), 5.95 (s, 2H), 6.40 (d, 1H), 6.70(Е)-3-(3-1-(1,3 бензодиоксол-5-ил)-2-[(4-изопропилфенил)сульфонамидо]-2-оксоэтил-1-метил-1 Н-6-индолил)2-пропеновой кислоты (продукт примера 57, 120 мг, 0,2 ммоль) растворяют в смеси 1:1 тетрагидрофурана и метанола (5 мл). Добавляют раствор гидроксида натрия (0,6 мл 1 н. раствора NaOH),и смесь нагревают с обратным холодильником при перемешивании. Через 3 ч растворитель удаляют в вакууме, и продукт экстрагируют из 1 н. соляной кислоты (50 мл) этилацетатом (2 х 50 мл). Органические слои сушат (MgSO4) и концентрируют. Очистка колоночной флэшхроматографией (градиентное элюирование от 100% дихлорметана до 90% дихлорметана/10% метанола/1% уксусной кислоты) дает продукт в виде бледно-зеленой пены (90 мг). 1 Н ЯМР (300 МГц, CDCl3): =1.30 (d, 6 Н),3.00 (m, 1 Н), 3.80 (s, 3 Н), 5.00 (s, 1H), 5.95 (s,2 Н), 6.40 (d, 1 Н), 6.65 (m, 3 Н), 6.90 (s, 1 Н), 7.20 10% Палладий-на-угле (10 мг) добавляют к перемешиваемому раствору (Е)-3-[3-1-(1,3 бензодиоксол-5-ил)-2-[(4-изопропилфенил)сульфонамидо]-2-оксоэтил-1-метил-1 Н-6-индолил]2-пропеновой кислоты (соединение примера 58,80 мг, 0,14 ммоль) и формиата аммония (64 мг,0,5 ммоль) в смеси 1:1 тетрагидрофурана и этанола (10 мл всего). Смесь перемешивают при температуре дефлегмации в течение 48 ч, охлаждают, фильтруют через Arbocel и концентрируют. Серую пену очищают колоночной флэш-хроматографией (элюирование смесью 98% дихлорметана/2% метанола) с получением продукта в виде белой пены. 1 Н ЯМР (300 МГц, CDCl3): =1.25 (d, 6H),2.70 (t, 2H), 3.00 (m, 3 Н), 3.60 (s, 3 Н), 4.95 (s,1 Н), 5.90 (s, 2 Н), 6.60 (m, 4 Н), 6.80 (d, 1 Н), 7.00 Диметилформамиддиметилацеталь (10 мл) добавляют к 3-1-(1,3-бензодиоксол-5-ил)-2-[(4 изопропилфенил)сульфонамидо]-2-оксоэтил-1 метил-1 Н-6-индолкарбоксамиду (продукт примера 28, 108 мг, 0,36 ммоль) и суспензию нагревают с обратным холодильником в течение 48 ч. Растворитель удаляют в вакууме, и остаток повторно растворяют в ледяной уксусной кислоте(8 мл). Добавляют гидразин гидрат (12 мг, 4,68 ммоль), и раствор нагревают с обратным холодильником в течение 24 ч. После охлаждения неочищенный продукт экстрагируют из рассола(50 мл) этилацетатом (2 х 50 мл). Органические слои сушат (MgSO4) и концентрируют. Колоночная флэш-хроматография (элюирование смесью 96% дихлорметана/4% метанола) дает целе 37 вой продукт в виде бледно-желтого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3): =2.40 (s, 3H),2.55 (s, 3H), 5.00 (s, 1H), 5.80 (s, 2H), 5.90 (brs,1H), 6.60 (s, 3H), 6.80 (s, 1H), 7.00 (d, 1H), 7.20 К раствору 6-метоксикарбонил-1 метилиндола (полученного способом примера 1(б), но с использованием 6-бром-1-метилиндола вместо 6-бром-1-этилиндола (5 г), в тетрагидрофуране (30 мл) при -70 С в атмосфере азота по каплям при перемешивании добавляют диизобутилалюминий гидрид (66 мл 1 М раствора в тетрагидрофуране). Раствор перемешивают при -70 С в течение 15 мин, затем нагревают до комнатной температуры в течение часов. Смесь разбавляют водой (100 мл) и распределяют между этилацетатом и водным гидроксидом натрия. Водный слой повторно экстрагируют этилацетатом, объединенные органические экстракты сушат (MgSO4) и выпаривают с получением неочищенного продукта, который очищают колоночной флэш-хроматографией (с использованием в качестве элюента смеси 80% этилацетата/20% гексана) с получением соединения, указанного в подзаголовке, в виде чистого масла, которое затвердевает при стоянии (4,1 г). 1 Н ЯМР (400 МГц, CDCl3): =1.60 (s, 1H),3.80 (s, 3 Н), 4.80 (d, 2 Н), 6.45 (s, 1H), 7.00 (s,1 Н), 7.05 (d, 1 Н), 7.35 (s, 1 Н), 7.60 (d, 1H). МСНР(31,4 г) и тетрабутиламмония бромид (4,5 г) растворяют в смеси 1,4-диоксана (120 мл) и воды (120 мл). К этой интенсивно перемешиваемой охлажденной на льду смеси добавляют пиперонал (21 г, 140 ммоль) и через 10 мин по каплям добавляют бромоформ (12,2 мл 140 ммоль) примерно в течение 30 мин. Перемешивание продолжают в течение 20 ч при температуре окружающей среды. Добавляют воду (500 мл), и смесь нагревают до растворения осадка. После промывки диэтиловым эфиром водный раствор подкисляют концентрированной соля 001471 38 ной кислотой. Неочищенное промежуточное соединение карбоновой кислоты выделяют экстракцией диэтиловым эфиром и выпариванием в вакууме. Остаток растворяют в метаноле (500 мл) и подкисляют 20 каплями концентрированной серной кислоты. Раствор нагревают с обратным холодильником в течение 2 ч, затем охлаждают и выпаривают в вакууме. Остаток растворяют в диэтиловом эфире и промывают водой. Органическую фракцию сушат (сульфат магния) и концентрируют в вакууме. Колоночная флэш-хроматография с использованием в качестве элюента дихлорметана, а затем перекристаллизация из диизопропилового эфира дает 13,2 г соединения, указанного в подзаголовке (т.пл. 93-95 С). 1 Н ЯМР (400 МГц, CDCl3): =3.35 (d, 1H обменный), 3.77 (s, 3H), 5.07 (d, 1H), 5.95 (s,2H), 6.80 (d, 1H), 6.90 (s, 1H), 6.92 (d, 1H). МСНР Бромоводородную кислоту (20 мл 62% масс./об. раствора в воде) добавляют к метиловому эфиру 2-(1,3-бензодиоксол-5-ил)-2-гидроксиуксусной кислоты (из стадии (б), 11 г, 52 ммоль) в толуоле (200 мл). После перемешивания в течение 3 ч водный слой удаляют, а органический слой выпаривают в вакууме. Остаток подвергают флэш-хроматографии, элюируя дихлорметаном, а затем кристаллизуют с диизопропиловым эфиром и гексаном. 1 Н ЯМР (300 МГц, CDCl3): =3.76 (s, 3H),5.26 (s, 1H), 5.95 (s, 2H), 6.70 (d, 1H), 6.92 (d,1H), 7.09 (s, 1H). Т. пл.: 39-41 С. 2,6-Диметилпиридин (0,12 мл) добавляют к перемешиваемому раствору метилового эфира 2-(1,3-бензодиоксол-5-ил)-2-бромуксусной кислоты (из стадии (в), 273 мг. 1 ммоль) и 6(гидроксиметил)-1-метилиндола (из стадии (а),161 мг, 1 ммоль) в безводном диметилформамиде (2 мл) при температуре окружающей среды в атмосфере азота. Этот раствор нагревают при 80 С в течение 3 ч. Реакционную смесь охлаждают, распределяют между диэтиловым эфиром и водой, отделяют, и органический слой сушат(сульфат магния) и выпаривают в вакууме. Остаток подвергают флэш-хроматографии (ис 39 пользуя диэтиловый эфир в качестве элюента) с получением соединения, указанного в подзаголовке, в виде бесцветной пены (273 мг). 1 Н ЯМР (300 МГц, CDCl3): =1.64 (t, 1H обменный), 3.72 (s, 3 Н), 3.76 (s, 3 Н), 4.79 (d,2H), 5.16 (s, 1H), 5.90 (s, 2H), 6.73 (d, 1H), 6.85 Хлортриизопропилсилан (0,19 мл, 0,88 ммоль) добавляют к раствору метилового эфира 2-(1,3-бензодиоксол-5-ил)-2-[6-(гидроксиметил)-1-метил-1 Н-3-индолил]уксусной кислоты(100 мг, 1,47 ммоль) в безводном диметилформамиде (3 мл). Через 3 ч смесь распределяют между диэтиловым эфиром и водой, органический слой отделяют и промывают водой. Органический слой сушат (сульфат магния), и растворитель удаляют в вакууме. Остаток подвергают флэш-хроматографии (используя смесь 50% дихлорметана/50% гексана в качестве элюента) с получением соединения, указанного в подзаголовке (305 мг), в виде масла. 1 Н ЯМР (300 МГц, CDCl3): =1.00-1.20 (m,21 Н), 3.74 (s, 3 Н), 3.75 (s, 3H), 4.95 (s, 2H), 5.15 Соединение, указанное в подзаголовке,получают способом примера 2 из соединения стадии (д). 1 Н ЯМР (300 МГц, CDCl3): =1.03-1.22 (m,21 Н), 3.72 (s, 3 Н), 4.96 (s, 2H), 5.18 (s, 1H), 5.91 1-(3-Диметиламинопропил)-3-этилкарбодиимида гидрохлорид (113 мг, 0,59 ммоль) добавляют к перемешиваемому раствору 2-(1,3 бензодиоксол-5-ил)-2-[6-(триизопропилсилилоксиметил)-1-метил-1 Н-3-индолил]уксусной кислоты (из стадии (е), 250 мг, 0,49 ммоль), N,Nдиметиламинопиридина (78 мг, 0,64 ммоль) и сульфонамида из подготовительного примера 1(107 мг, 0,54 ммоль) в дихлорметане (6 мл) при комнатной температуре в атмосфере азота. Через 12 ч реакционную смесь вливают в 1 н. соляную кислоту (50 мл) и экстрагируют дихлорметаном (2 х 50 мл). Органические фракции сушат Тетраэтиламмонийфторид (312 мг, 2,18 ммоль) добавляют к перемешиваемому раствору соединения из стадии (ж) (380 мг, 0,55 ммоль) в ацетонитриле (6 мл) при комнатной температуре в атмосфере азота. Через 12 ч смесь вливают в 1 М соляную кислоту (50 мл) и экстрагируют этилацетатом (2 х 50 мл). Органические фракции объединяют, сушат (MgSO4) и концентрируют в вакууме с получением желтой пены. Колоночная флэш-хроматография (элюирование смесью 98% дихлорметана/2% метанола) дает продукт в виде белого твердого вещества (242 мг). 1 Н ЯМР (400 МГц, CDCl3): =1.15 (t, 2H),2.30 (s, 3H), 2.60 (q, 2H), 3.60 (s, 3 Н), 4.75 (s,2 Н), 5.25 (s, 1H), 5.80 (s, 2H), 6.60 (m, 3 Н), 6.80 41 Примеры 62-64 получают способами примера 61, но с использованием подходящего сульфонамида на предпоследней стадии. Смотри подготовительный пример 2 для получения сульфонамида(а) 3-1-(1,3-Бензодиоксол-5-ил)-2-[(2-метокси-4-метилфенил)сульфонамидо]-2-оксоэтил-6-(метоксикарбонил)-1-метил-1 Н-индол. Соединение, указанное в подзаголовке,получают с использованием способов примеров 1(б), 1(г), 2 и 3, но начиная с 6-бром-1 метилиндола вместо 6-бром-1-этилиндола и проводя реакцию с сульфонамидом из подготовительного примера 11 в способе примера 3. Литийалюминийгидрид (15 мг, 0,2 ммоль) медленно добавляют к перемешиваемому раствору метилового эфира 3-1-(1,3 бензодиоксол-5-ил)-2-[(2-метокси-4 метилфенил)сульфонамидо]-2-оксоэтил-1-метил-1 Н-6-индол-карбоновой кислоты (из стадии (а), 220 мг, 0,4 ммоль) в тетрагидрофуране при 0 С в атмосфере азота. Через 2 ч добавляют дополнительно 1 эквивалент (30 мг) литийалюминийгидрида, и смесь нагревают до комнатной температуры. Через 1 ч осторожно добавляют этилацетат (10 мл), и продукт экстрагируют из 1 н. соляной кислоты этилацетатом (2 х 50 мл). Объединенные органические слои сушат (MgSO4) и концентрируют в вакууме. Очистка колоночной хроматографией (элюирование смесью 95% дихлорметана/5% метанола) дает продукт в виде белого твердого вещества (130 мг). 1 Н ЯМР (400 МГц, CD3OD): =2.45 (s, 3H),3.55 (s, 3H), 3.75 (s, 3H), 4.75 (s, 2H), 5.15 (s, 1 Н),5.95 (d, 2H), 6.70 (s, 1H), 6.75 (m, 3H), 6.85 (s,1H), 6.95 (d, 1H), 7.00 (d, 1 Н), 7.25 (d, 1 Н), 7.35(МН+). Анализ: найдено: С 61.00, Н 5.12, N 5.19. С 27 Н 26N2 О 7S0,5 Н 2 О требует: С 61.00; Н 5.12; N 5.27. Т.пл.=184-186 С. Соединение, указанное в заголовке, разделяют на его индивидуальные энантиомеры с применением колонки Chiralpak AD (25 х 2 см) с пропускной способностью 10 мл/мин, используя смесь 70:30 гексан:изопропиловый спирт с добавлением 0,6% трифторуксусной кислоты и 0,4% диэтиламина. Продукты детектируют при 220 нм, и они имеют времена удерживания 32 мин и 39 мин. Энантиомерную чистоту определяют хроматографированием 100 мкл элюента из вышеуказанного разделения с использованием колонки Chiralpak AD (25 х 0,46 см) с пропускной способностью 1 мл/мин и использованием в качестве элюента смеси 70:30 гексан: изопропиловый спирт с добавлением 0,3% трифторуксусной кислоты и 0,2% диэтиламина. Продукты детектируют при 220 нм, и они имеют времена удерживания 15,5 мин и 18 мин. Примеры 66 и 67 получают способом примера 65, но с использованием сульфонамидов подготовительных примеров 10 и 9, соответственно. 44 ганический слой сушат (сульфат магния) и выпаривают в вакууме. Остаток подвергают флэшхроматографии (с использованием смеси 50% дихлорметана и 50% гексана в качестве элюента) с получением соединения, указанного в подзаголовке, в виде бесцветного масла (1,98 г). 1 Н ЯМР (300 МГц, CDCl3): =3.72 (s, 3 Н),3.74 (s, 3 Н), 5.09 (s, 1H), 5.92 (s, 2H), 6.75 (d,1H), 6.85 (d, 1H), 6.88 (s, 1H), 7.10 (s, 1H), 7.15 Гидрид натрия (440 мг 60% дисперсии в парафине) добавляют к перемешиваемому раствору 5-броминдола (1,96 г, 10 ммоль) в диметилформамиде (20 мл) при температуре окружающей среды в атмосфере азота. Через 30 мин добавляют метил п-толуолсульфонат (2,05 г 11 ммоль). Через 20 ч смесь распределяют между диэтиловым эфиром и водой. Органический слой отделяют и дважды промывают водой. Органический слой сушат (сульфат магния), и растворитель удаляют в вакууме. Остаток очищают колоночной хроматографией (используя смесь 50% гексана, 50% дихлорметана в качестве элюента) с получением 2,07 г продукта в виде воскообразного твердого вещества. 1 Н ЯМР (300 МГц, CDCl3): =3.75 (s, 3H),6.42 (d, 1H), 7.05 (d, 1H), 7.17 (d, 1H), 7.28 (d,1H), 7.75 (s, 1H). МСНР (Терморазбрызгивание): 212 (МН+). 2,6-Диметилпиридин (0,75 мл) добавляют к перемешиваемому раствору метилового эфира 2-(1,3-бензодиоксол-5-ил)-2-бромуксусной кислоты (из примера 61 (в), 1,75 г, 6,43 ммоль) и 5-бром-1-метилиндола (из стадии (а), 1,35 г) в безводном диметилформамиде (10 мл) при температуре окружающей среды в атмосфере азота. Раствор нагревают до 80 С в течение 8 ч. Реакционную смесь распределяют между диэтиловым эфиром и водой, разделяют, и ор Водный гидроксид натрия (14,7 мл 1 М раствора) добавляют к раствору метиловому эфиру 2-(1,3-бензодиоксол-5-ил)-2-(5-бром-1 метил-1 Н-3-индолил)уксусной кислоты из стадии (б) (1,97 г, 4,9 ммоль) в смеси 3:1 метанола и 1,4-диоксана при температуре окружающей среды. Смесь нагревают с обратным холодильником в течение 1 ч перед повторным охлаждением и удалением органических растворителей в вакууме. Остаток повторно растворяют в воде и подкисляют несколькими каплями концентрированной соляной кислоты. Полученный осадок экстрагируют диэтиловым эфиром, сушат(сульфат магния), и растворитель удаляют в вакууме. Остаток кристаллизуют из диизопропилового эфира с получением соединения, указанного в подзаголовке (1,59 г). 1 Н ЯМР (300 МГц, CDCl3): =3.74 (s, 3 Н),5.09 (s, 1H), 5.92 (s, 2H), 6.75 (d, 1H), 6.85 (d,1H), 6.88 (s, 1H), 7.10 (s, 1H), 7.15 (d, 1H), 7.28C18H14BrNO4 требует: С 55.69; Н 3.64; N 3.60. Т.пл.=191-193 С. Примеры 69-78 получают способом примера 68, начиная с подходящего замещенного индола. 46 вергают флэш-хроматографии с использованием 1% метанола в дихлорметане в качестве элюента и кристаллизуют из смеси дихлорметана и диэтилового эфира с получением соединения,указанного в подзаголовке (535 мг). 1 Н ЯМР (400 МГц, d6-ДМСО): =2.30 (s,3 Н), 3.55 (s, 3 Н), 3.64 (s, 3 Н), 5.10 (s, 1 Н), 5.90(MNH4+). Анализ: найдено: С 53.79; H 4.29; N 4.62. С 26 Н 23 ВrN2O6S0,5 Н 2 О требует: С 53.80; Н 4.17; N 4.83. Т.пл.=145-150 С. Примеры 80-88 получают способом примера 79 с использованием карбоновых кислот примеров 69-76 и 78, соответственно.(продукт примера 68, 480 мг, 1,24 ммоль) в безводном дихлорметане (10 мл) при температуре окружающей среды. К раствору добавляют 2 метокси-4-метил-1-бензолсульфонамид (из Подготовительного примера 11, 300 мг, 1,48 ммоль),после чего добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (355 мг, 1,85 ммоль) и продолжают перемешивание в течение 20 ч. Раствор дважды промывают 2 н. соляной кислотой, сушат (сульфат магния), и растворители удаляют в вакууме. Остаток под 47 Литийалюминийгидрид (6 мг, 0,16 ммоль) добавляют к перемешиваемому раствору этилового эфира 2-(4-[2-(1,3-бензодиоксол-5-ил)-2-(6 хлор-1-метил-1 Н-3-индолил)ацетил]-сульфамоилфенил)уксусной кислоты (продукт примера 89, 80 мг, 0,14 ммоль) в тетрагидрофуране (6 мл) при 0 С в атмосфере азота. Через 40 мин медленно добавляют этилацетат (1 мл), и реакционную смесь вливают в соляную кислоту (50 мл). Продукт экстрагируют этилацетатом (2 х 50 мл), сушат (MgSO4) и концентрируют. Перекристаллизация (метанол/эфир) дает продукт в виде белого кристаллического твердого вещества (50 мг). 1 Н ЯМР (400 МГц, d6-ДМСО): =2.80 (t,2H), 3.60 (t, 2H), 3.65 (s, 3 Н), 4.60 (brs, 1 Н),5.00(s, 1H), 5.95 (s, 2H), 6.65 (d, 1H), 6.70 (s, 1H),6.80 (d, 1H), 6.90 (s, 1 Н), 6.95 (d, 1H), 7.10 (d,1H), 7.40 (d, 2H), 7.45 (s, 1H), 7.75 (d, 2H). Соединение, указанное в заголовке, получают способом примера 79 из соединения примера 73 и подходящего сульфонамида. 1 Н ЯМР (400 МГц, CDCl3): =1.15 (t, 3 Н),3.60 (s, 3 Н), 3.80 (s, 2H), 4.00 (q, 2H), 5.00 (s,1H), 5.85 (s, 2H), 6.60 (m, 2H), 6.75 (d, 1H), 6.85 Соединение, указанное в заголовке, получают способом примера 90 из соединения примера 64 (б). 1 Н ЯМР (400 МГц, CDCl3): =3.50 (s, 3 Н),3.60 (t, 1H), 3.80 (m, 2H), 3.90 (t, 1H), 3.95 (m,2H), 4.55 (d, 2H), 4.95 (s, 1H), 5.70 (s, 2H), 6.50(12,6 г) в виде воскообразного твердого вещества (4,5 г). 1 Н ЯМР (300 МГц, CDCl3): =3.40 (d, 1H обменный), 3.76 (s, 3 Н), 3.90 (s, 3 Н), 5.06 (d,1H), 5.97 (s, 2H), 6.59 (s, 1H), 6.61 (s, 1H). МСНР Метилмагнийбромид (3,6 мл 3 М раствора в диэтиловом эфире) добавляют по каплям к перемешиваемому раствору 6-бром-индола(2,13 г, 10,9 ммоль) в толуоле (20 мл) в атмосфере азота. Через 20 мин реакционную смесь переносят через канюлю в течение примерно 10 мин в перемешиваемый раствор метилового эфира 2-бром-2-(7-метокси-1,3-бензодиоксол-5 ил)уксусной кислоты (из стадии (б), 2,2 г, 7,26 ммоль) в толуоле (20 мл) при температуре окружающей среды. Через следующие 2 ч смесь вливают в смесь диэтилового эфира и водного хлорида аммония. Органический слой отделяют и сушат Гидрид натрия (289 мг 60% дисперсии в парафине) добавляют порциями к перемешиваемому раствору метилового эфира 2-(6-бром 1 Н-3-индолил)-2-(7-метокси-1,3-бензодиоксол 5-ил)уксусной кислоты (из стадии (в), 2.7 г, 6,5 ммоль) в безводном диметилформамиде (20 мл) при 0 С в атмосфере азота. Через 30 мин добавляют метил п-толуолсульфонат (1,34 г, 7,2 ммоль). Еще через 1 ч смесь распределяют между диэтиловым эфиром и водой. Органический слой отделяют и дважды промывают водой. Органический слой сушат (сульфат магния), и растворитель выпаривают в вакууме. Остаток очищают колоночной флэш-хроматографией (используя смесь 30% гексана, 70% дихлорметана в качестве элюента) с получением 1,49 г соединения, указанного в подзаголовке. 1 Н ЯМР (300 МГц, CDCl3): =3.72 (s, 3 Н),3.75 (s, 3 Н), 3.85 (s, 3 Н), 5.08 (s, 1H), 5.92 (s, 2H),3.78 (s, 2H), 7.04 (s, 1H), 7.17 (d, 1H), 7.28 (s,1H), 7.43 (s, 1H). МСНР Соединение, указанное в заголовке, получают из продукта стадии (г) с использованием способов примеров 68 (в) и 79. 1 Н ЯМР (300 МГц, d6-ДMCO): =2.36 (s,3 Н), 3.60 (s, 3 Н), 3.69 (s, 3 Н), 3.72 (s, 3 Н), 5.12 (s,1H), 5.95 (s, 2H), 6.39 (s, 1H), 6.45 (s, 1H), 6.88 Тионилбромид (3,7 мл) добавляют к перемешиваемому раствору метилового эфира 2-(6 хлор-1,3-бензодиоксол-5-ил)-2-гидроксиуксусной кислоты из стадии (а) (7,8 г, 32 ммоль) в толуоле (50 мл) при температуре окружающей среды. Через 6 ч реакционную смесь выпаривают в вакууме, и остаток подвергают флэшхроматографии, используя дихлорметан в качестве элюента, с последующей кристаллизацией из диизопропилового эфира с получением соединения, указанного в подзаголовке (7,6 г). 1 Н ЯМР (300 МГц, CDCl3): =3.80 (s, 3 Н),5.87 (s, 1H), 6.00 (d, 2H), 6.80 (s, 1H), 7.26 (s,1H).(в) Метиловый эфир 2-(6-бром-1 Н-3 индолил)-2-(6-хлор-1,3-бензодиоксол-5-ил)уксусной кислоты. Соединение, указанное в подзаголовке,получают следуя процедуре примера 92 (в) с использованием метиловый эфир 2-бром-2-(6 хлор-1,3-бензодиоксол-5-ил)уксусной кислоты из стадии (б), т.пл. 172-174 С, из диэтилового эфира и гексана. 1 Н ЯМР (300 МГц, CDCl3): =3.72 (s, 3 Н),5.58 (s, 1H), 5.86 (d, 2H), 6.70 (s, 1H), 6.83 (s,1H), 7.10-7.30 (m, 3 Н), 7.50 (s, 1H), 8.10 (br, 1H). МСНР(г) Метиловый эфир 2-(6-бром-1-метил 1 Н-3-индолил)-2-(6-хлор-1,3-бензодиоксол-5 ил)уксусной кислоты. Соединение, указанное в подзаголовке,получают следуя процедуре примера 92 (г) с использованием метиловый эфир 2-(6-бром-1 Н 3-индолил)-2-(6-хлор-1,3-бензодиоксол-5-ил)уксусной кислоты из стадии (в), т.пл. 183-185 С,из диизопропилового эфира. 1 Н ЯМР (300 МГц, CDCl3): =3.75 (s, 3 Н),3.76 (s, 3 Н), 5.60 (s, 1 Н), 5.90 (d, 2H), 6.77 (s,1H), 6.87 (s, 1H), 7.06 (s, 1H), 7.17 (d, 1H), 7.30 Соединение, указанное в подзаголовке,получают из соединения стадии (г), следуя способам примеров 68 (в) и 79 и применяя сульфонамид на последней стадии. 1 Н ЯМР (300 МГц, CDCl3): =2.46 (s, 3 Н),3.71 (s, 3 Н), 5.36 (s, 1H), 5.90 (s, 2H), 6.48 (s, 1H),6.82 (s, 1H), 6.85 (s, 1H), 7.00 (d, 1H), 7.07 (d,1H), 7.28 (d, 2H), 7.45 (s, 1H), 7.83 (d, 2H), 8.25 Монооксид углерода барботируют через перемешиваемый раствор 3-1-(1,3-бензодиоксол-5-ил)-2-[(4-метилфенил)сульфонамидо]-2 оксоэтил-6-бром-1-метил-1 Н-индол (из примера 55, 400 мг, 0,79 ммоль), формиата натрия(107 мг, 1,57 ммоль) и дихлорбис (трифенилфосфин)палладия (II) (11 мг, 0,016 ммоль) в диметилформамиде (6 мл) при 110 С в течение 4 ч. Реакционную смесь охлаждают и экстрагируют из 1 н. соляной кислоты этилацетатом (2 х 50 мл). Органические слои сушат (MgSO4) и концентрируют. Колоночная флэшхроматография (элюирование смесью 95% дихлорметана/5% метанола) дает продукт (320 мг) в виде желтовато-коричневого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3): =2.40 (s, 3 Н),3.80 (s, 3 Н), 5.05 (s, 1H), 5.90 (s, 2H), 6.60 (m,3H), 7.05 (s, 1 Н), 7.2-7.6 (m, 4 Н), 7.80 (m, 3 Н),9.20 (brs, 1 Н), 10.00 (s, 1 Н). МСНР 53 температуре в атмосфере азота. Через 1 ч этанол удаляют в вакууме, и продукт экстрагируют из 0,5 н. соляной кислоты (50 мл) дихлорметаном(2 х 50 мл). Органические слои сушат (MgSO4) и концентрируют. Колоночная флэш-хроматография (элюирование смесью 95% дихлорметан/5% метанол) дает продукт (230 мг) в виде белой пены. 1 Н ЯМР (400 МГц, d6-ДМСО): =2.35 (s,3H), 3.60 (s, 3H), 4.50 (s, 2H), 4.95 (brs, 1 Н), 5.05 н-Бутиллитий (0,8 мл 2,5 М раствора в гексане) добавляют к перемешиваемому раствору 6-бром-3-1-(7-метокси-1,3-бензодиоксол-5-ил)2-[(2-метокси-4-метилфенил)сульфонамидо]-2 оксоэтил-1-метил-1 Н-индола (из примера 92,400 мг, 0,67 ммоль) в безводном тетрагидрофуране при -75 С в атмосфере азота. Через 30 мин к оранжевому раствору добавляют диметилформамид (0,15 мл) и еще через 30 мин смеси дают возможность нагреться до 0 С, после чего гасят избытком 1 н. соляной кислоты. Добавляют этилацетат, и органический слой отделяют и промывают водой. Органический слой сушат(сульфат магния), и растворители удаляют в вакууме. Остаток подвергают флэшхроматографии с использованием 1% метанола в дихлорметане в качестве элюента, и продукт кристаллизуют из смеси дихлорметана и диэтилового эфира с получением соединения, указанного в заголовке (187 мг). 1 Н ЯМР (300 МГц, d6-ДMCO): =2.33 (s,3 Н), 3.61 (s, 3 Н), 3.72 (s, 3 Н), 3.80 (s, 3 Н), 5.20 (s,1H), 5.94 (s, 2H), 6.42 (s, 1H), 6.50 (s, 1H), 6.87 Используя 6-бром-3-1-(6-хлор-1,3-бензодиоксол-5-ил)-2-[(4-метилфенил)-сульфонамидо]-2-оксоэтил-1-метил-1 Н-индол (из примера 93), получают соединение, указанное в заголовке, способом, подобным способу примера 96. 1 Н ЯМР (400 МГц, CDCl3): =2.44 (s, 3 Н),3.82 (s, 3 Н), 5.41 (s, 1H), 5.90 (d, 2H), 6.48 (s,1H), 6.83 (s, 1H), 7.16 (s, 1H), 7.20-7.33 (m, 3 Н),7.50 (d, 1H), 7.82 (s, 1 Н), 7.85 (d, 2H), 8.40 (brs,1H обменный), 10.02 (s, 1H). МСНР (ХИАД): 524.9 (МН+). Пример 98. 6-(Гидроксиметил)-3-1-(7 метокси-1,3-бензодиоксол-5-ил)-2-[(2-метокси 4-метилфенил)сульфонамидо]-2-оксоэтил-1 метил-1 Н-индол Боргидрид натрия (9 мг) добавляют к суспензии 6-формил-3-1-(7-метокси-1,3-бензодиоксол-5-ил)-2-[(2-метокси-4-сульфонамидо]-2 оксоэтил-1-метил-1 Н-индола (из примера 96,130 мг, 0,24 ммоль) в смеси этанола (3 мл) и 1,4 диоксана (3 мл) при температуре окружающей среды. Перемешивание продолжают в течение 1,5 ч, а затем по каплям добавляют воду до получения раствора. После осторожного подкисления несколькими каплями концентрированной соляной кислоты растворители выпаривают в вакууме. Остаток распределяют между этилацетатом и водой, и органический слой отделяют и повторно промывают водой. Органический слой сушат (сульфат магния), и растворители удаляют в вакууме. Остаток кристаллизуют из смеси метанола и диэтилового эфира с получением соединения,указанного в заголовке (105 мг). 1 Н ЯМР (300 МГц, d6-ДМСО): =2.35 (s,3 Н), 3.60 (s, 3 Н), 3.68 (s, 3 Н), 3.74 (s, 3 Н), 4.56 К раствору 3-1-(1,3-бензодиоксол-5-ил)-2[(2-метокси-4-метилфенил)-сульфонамидо]-2 оксоэтил-5-бром-1-метил-1 Н-индол (из примера 79, 300 мг, 0,53 ммоль) в 1,4-диоксане (1,5 мл) в атмосфере азота добавляют гидроксиметилтрибутилстаннан (253 мг, 0,79 ммоль), затем тетракис(трифенилфосфин)палладий(0) (30 мг). Смесь нагревают с обратным холодильником в течение 8 ч, а затем охлаждают. Добавляют раствор гидроксида натрия (1 М) и смесь кипятят до растворения продукта. Прозрачный раствор декантируют от нерастворимого смолянистого остатка и промывают диэтиловым эфиром. После подкисления концентрированной соляной кислотой водную смесь экстрагируют этилацетатом. Органический экстракт сушат (сульфат магния), и растворители выпаривают в вакууме. Остаток подвергают флэш-хроматографии, используя 2% метанол в дихлорметане в качестве элюента, с получением соединения, указанного в заголовке (35 мг). 1 Н ЯМР (300 МГц, d6-ДMCO): =2.35 (s,3H), 3.58 (s, 3H), 3.68 (s, 3H), 4.47 (d, 2 Н), 4.95 (t,1H обменный), 5.20 (s, 1H), 5.92 (d, 2H), 6.657.00 (m, 6H), 7.08 (d, 1H), 7.22 (s, 1H), 7.30 (d,1H), 7.65 (d, 1H), 12.40 (s, 1H обменный). МСНР(0,1 мл) в ацетонитриле (5 мл) нагревают с обратным холодильником в течение 18 ч в атмосфере азота. После охлаждения растворитель выпаривают в вакууме, и остаток перемешивают с 2 н. соляной кислотой (примерно 6 мл) в течение 45 мин. Смесь дважды экстрагируют этилацетатом, затем промывают водой и рассолом. Органический слой сушат (сульфат магния), и растворители выпаривают в вакууме. Остаток подвергают флэш-хроматографии,применяя градиентное элюирование от смеси 90% гексана и 10% этилацетата до смеси 40% гексана и 60% этилацетата, с получением соединения, указанного в заголовке (80 мг). 1 Н ЯМР (400 МГц, CDCl3): =2.38 (s, 3 Н),2.60 (s, 3 Н), 3.42 (s, 3 Н), 3.70 (s, 3 Н), 5.00 (s, 1H),5.89 (s, 2H), 6.55 (s, 1H), 6.60-6.70 (m, 3 Н), 6.83 К раствору 3-1-(1,3-бензодиоксол-5-ил)-2[(2-метокси-4-метилфенил)-сульфонамидо]-2 оксоэтил-6-бром-1-метил-1 Н-индола (из примера 85, 300 мг, 0,53 ммоль) в 1,4-диоксане (1,5 мл) в атмосфере азота добавляют метоксиметилтрибутилстаннан (220 мг, 0,66 ммоль), затем тетракис(трифенилфосфин)палладий(0) (35 мг). Смесь нагревают с обратным холодильником в течение 16 ч, а затем охлаждают. Добавляют дополнительную порцию тетракис(трифенилфосфин)палладия(0) (30 мг) и продолжают нагревание с обратным холодильником еще 8 ч. Растворитель удаляют в вакууме, а остаток подвергают флэш-хроматографии, применяя градиентное элюирование от смеси 1% метанола и 99% дихлорметана до смеси 5% метанола и 95% дихлорметана, с получением соединения,указанного в заголовке (33 мг). 6-Бром-1-метилиндол обрабатывают согласно способу примера 65(а), но используя (4 метилфенил)сульфонамид вместо сульфонамида подготовительного примера 11, с получением метилового эфира, который затем обрабатывают способом примера 4 с получением соответствующей кислоты, которую затем конвертируют в соединение, указанное в заголовке, способом примера 5, используя (CH3O)CH3NH. 1 Н ЯМР (400 МГц, CDCl3): =2.47 (s, 3 Н),3.42 (s, 3 Н), 3.59 (s, 3 Н), 3.75 (s, 3 Н), 4.98 (s, 1H),5.93 (s, 2H), 6.65-6.77 (m, 3 Н), 6.89 (s, 1H), 7.02 Метилмагнийбромид (0,23 мл 3 М раствора в диэтиловом эфире) по каплям добавляют к перемешиваемому раствору N6-метокси-N6,1 диметил-3-1-(1,3-бензодиоксол-5-ил)-2-[(4 метилфенил)сульфонамидо]-2-оксоэтил-1 Ниндол-карбоксамида (из примера 103, 174 мг,0,32 ммоль) в безводном тетрагидрофуране (5 мл) при -70 С в атмосфере азота. Смесь перемешивают при -70 С еще 2 ч, после чего нагревают до комнатной температуры. К смеси медленно добавляют водную соляную кислоту (5 мл 1 М раствора), а затем экстрагируют этилацетатом (100 мл). Органическую фазу отделяют и промывают рассолом, сушат (сульфат магния),и растворитель удаляют в вакууме. Остаток подвергают флэш-хроматографии, применяя градиентное элюирование от смеси 90% гексана и 10% этилацетата до 100% этилацетата, с получением соединения, указанного в заголовке (18 мг).-70 С добавляют раствор N6-метокси-N6,1 диметил-3-1-(1,3-бензодиоксол-5-ил)-2-[(4 метилфенил)сульфонамидо]-2-оксоэтил-1 Ниндолкарбоксамида (соединение примера 103,200 мг, 0,36 ммоль) в безводном тетрагидрофуране (2 мл). Смесь перемешивают при -70 С еще 4 ч перед нагреванием до 0 С, а затем гасят добавлением воды (5 мл). Смесь подкисляют уксусной кислотой и экстрагируют этилацетатом (100 мл). Органическую фазу отделяют,промывают рассолом, сушат (сульфат магния) и удаляют растворитель в вакууме. Остаток подвергают флэш-хроматографии, применяя градиентное элюирование от смеси 90% гексана и 10% этилацетата до 100% этилацетата, с получением соединения, указанного в заголовке (42 мг). 1 Н ЯМР (400 МГц, CDCl3): =2.42 (s, 3H),3.73 (s, 3H), 4.98 (s, 1H), 5.91 (s, 2H), 6.60-6.70 Литийдиизопропиламид моно(тетрагидрофуран) (0,53 мл 1,5 М раствора в циклогексане) добавляют к перемешиваемому раствору 2 метилпиридина (0,08 мл, 0,8 ммоль) в безводном тетрагидрофуране (3 мл) при -70 С в атмосфере азота. Через 20 мин к смеси при -70 С добавляют раствор N6-метокси-N6,1-диметил-31-(1,3-бензодиоксол-5-ил)-2-[(4-метилфенил)сульфонамидо]-2-оксоэтил-1 Н-6-индолкарбоксамида (соединение примера 103, 200 мг, 59 0,36 ммоль) в безводном тетрагидрофуране (2 мл). Смесь перемешивают при -70 С еще 2 ч,после чего нагревают до 0 С, а затем гасят добавлением воды (5 мл). Смесь подкисляют уксусной кислотой и экстрагируют этилацетатом(100 мл). Органическую фазу отделяют, промывают рассолом, сушат (сульфат магния) и удаляют растворитель в вакууме. Остаток подвергают флэш-хроматографии, применяя градиентное элюирование от смеси 90% гексана и 10% этилацетата до 100% этилацетата, с получением соединения, указанного в заголовке (95 мг). 1 Н ЯМР (400 МГц, d6-ДМСО): Сложный из-за кето и енольных форм (2-пиридил) ацетильной группы соединения. 1 Н ЯМР (400 МГц, TFA-d): =2.43 (s, 3 Н),3.79 (s, 3 Н), 5.21 (s, 1H), 5.90 (s, 2H), 6.62 (s, 1H),6.66 (d, 1H), 6.75 (d, 1H), 7.02 (s, 1H), 7.30-7.40 Соединение, указанное в заголовке, получают из 6-бром-1-этилиндола, применяя способы примеров 1(а) (но используя аллилбромид вместо этилбромида), 1(б), 1(г), 2, 3 (но используя (4-метилфенил)сульфонамид), 4 и 12. 1 Н ЯМР (300 МГц, CD3OD): =2.40 (s, 3H),4.65 (d, 2H), 4.95 (d, 1H), 5.00 (s, 1 Н), 5.10 (d,1H), 5.80 (d, 2H), 5.95 (m, 1H), 6.70 (m, 3 Н), 6.95 60 при комнатной температуре. Через 4 ч добавляют раствор тиосульфата натрия (10 мл) и продолжают перемешивание в течение 1 ч. Черный осадок удаляют фильтрацией через целит, и растворитель удаляют в вакууме. Неочищенный диол повторно растворяют в этилацетате (50 мл) и промывают 1 М соляной кислотой (50 мл), затем рассолом (50 мл). Органический слой сушат(MgSO4) и концентрируют с получением коричневого твердого вещества. К перемешиваемой суспензии коричневого твердого вещества в этилацетате (10 мл) добавляют метапериодат натрия (1,0 г, 4,7 ммоль), растворенный в воде(1 мл). Через 2 ч смесь фильтруют, разбавляют этилацетатом (50 мл) и промывают насыщенным раствором хлорида натрия. Органический слой сушат (сульфат магния) и концентрируют в вакууме. На этой стадии проводят частичную очистку колоночной флэш-хроматографией(элюирование смесью 90% дихлорметана/10% метанола) с получением альдегидного промежуточного соединения в виде желто-коричневого твердого вещества. Без дальнейшей очистки это твердое вещество растворяют в метаноле (15 мл) при комнатной температуре в атмосфере азота. В течение примерно 10 мин порциями добавляют боргидрид натрия (36 мг), и перемешивание продолжают в течение 4 ч. Метанол удаляют в вакууме, а остаток растворяют в этилацетате (50 мл). Раствор этилацетата промывают насыщенным водным NH4Cl (50 мл), сушат (MgSO4) и концентрируют с получением желтой пены. Колоночная флэш-хроматография (элюирование смесью 90% дихлорметана/10% метанола) дает продукт в виде желто-коричневого твердого вещества (126 мг). 1 Н ЯМР (300 МГц, d6-ДMCO): =2.40 (s,3 Н), 3.60 (m, 2 Н), 4.10 (m, 2 Н), 5.10 (s, 1 Н), 5.90 Соединение, указанное в заголовке, получают из соединения примера 28(б), применяя способы примеров 28(в) (но используя СН 3 ОСН 2 СН 2 Вr вместо метилйодида), 28(г),28(д), 28(е) и 28(ж) (но используя сульфонамид подготовительного примера 11 вместо птолуолсульфонамида). 1 Н ЯМР (300 МГц, d6-ДМСО): =2.35 (s,3H), 3.20 (s, 3H), 3.60 (m, 2H), 3.65 (s, 3 Н), 4.20
МПК / Метки
МПК: A61P 9/10, C07D 209/18, A61K 31/405
Метки: индола, полезные, производные, рецептора, качестве, антагонистов, эндотелина
Код ссылки
<a href="https://eas.patents.su/30-1471-proizvodnye-indola-poleznye-v-kachestve-antagonistov-receptora-endotelina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индола, полезные в качестве антагонистов рецептора эндотелина.</a>
Предыдущий патент: Синергетическая гербицидная композиция и способ борьбы с сорняками
Следующий патент: Кристаллическая форма 4-[5-метил-3-фенилизоксазол-4-ил]бензолсульфонамида
Случайный патент: Производные аминобензамидов в качестве ингибиторов гликогенсинтаза-киназы 3β












