Производные триазолпиразинов, применимые в качестве противораковых агентов
Номер патента: 16204
Опубликовано: 30.03.2012
Авторы: Чэн Хэнмяо, Пэйриш Мейсон Алан, Джонсон Мари Кэтрин, Хоффман Джэки Элизабет, Шэнь Хун, Намбу Митчелл Дэвид, Цзя Лэй, Цуй Цзинжун Джин, Чан-Дьюб Мишель Бить, Кания Роберт Стивен, Ле Фыонг Тхи Куи
Формула / Реферат
1. Соединение формулы (I)
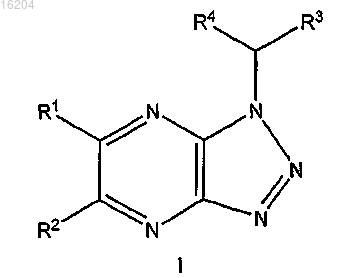
в которой R1 выбирают из водорода, Br, -O(CH2)nCH3, -(CH2)nOR10, -C(O)R10, -C(O)OR10, -C(O)NR10R11,
-NR10R11, -CN, C1-C6-алкила, C3-C8-циклоалкила, 3-8-членного гетероалицикла, 3-8-членного гетероалицикла-(3-8-членного гетероалицикла), 8-10-членного гетеробицикла, 5-7-членного гетероарила, C6-C10-арила и C2-C6-алкенила, где C1-C6-алкил, C3-C8-циклоалкил, 3-8-членный гетероалицикл, 8-10-членный гетеробицикл, 5-7-членный гетероарил, C6-C10-арил, C2-C6-алкенил и C2-C6-алкинил необязательно замещены одной или более группами, выбранными из группы, состоящей из Cl, F, -(CH2)nCH(OR10)CH3,
-(CH2)nOR10, -(CH2)nC(CH3)2OR10, -C(O)R10, -C(O)OR10, -(CR10R11)nC(O)OR10, -C(O)NR10R11,
-(CR10R11)nC(O)NR10R11, -(CH2)nNR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H,
-(CH2)nNR10C(O)NR10R11, -NR10C(O)R11, -NR10C(O)OR11, -CN, -NO2, оксо, C1-C6-алкила, C3-C8-циклоалкила,
-(CH2)n-(3-8-членного гетероалицикла), -(CH2)n-(5-7-членного гетероарила);
R2 представляет собой H;
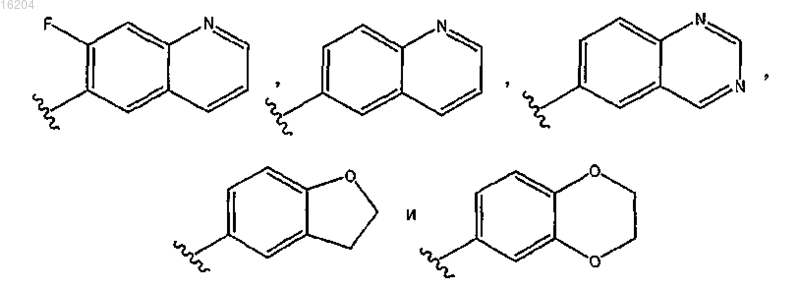
R3 выбран из
R10 и R11 независимо выбирают из H, -(CH2)nC(CH3)2OR12, -CHR12(CH2)nOR13, -C(O)OR12, -(CH2)nCHR12OR13, -C(CH3)2(CH2)nOR12, -CH2CF2H, -(CH2)nC(CH3)2NR12R13, -(CH2)nNR12R13, -(CH2)nCHOR12(CH2)nOR13,
-(CH2)nS(O)2R12, -(CH2)nC(O)NR12R13, -(CH2)n-(8-10-членного гетеробицикла), -(CH2)n-(3-8-членного гетероалицикла), C1-C6-алкила, C3-C8-циклоалкила, C6-C10-арила и 3-8-членного гетероалицикла, где указанный 8-10-членный гетеробицикл необязательно замещен одной или более группами, выбранными из группы, состоящей из -(CH2)nOR12, C1-C6-алкила, C3-C8-циклоалкила и C6-C10-арила; или когда R10 и R11 связаны с одним и тем же атомом, R10 и R11 необязательно объединяются с образованием 3-8-членного гетероалициклического кольца;
R12 и R13 независимо выбирают из H, C1-C6-алкила и -C(O)CH3;
R4 выбирают из группы, состоящей из водорода и C1-C6-алкила;
причем 3-8-членное гетероалициклическое кольцо выбирают из группы, состоящей из азиридинила, оксетанила, тиапанила, тетрагидрофуранила, тетрагидротиофенила, пирролидинила, тетрагидропиранила, тетрагидротиопиранила, пиперидинила, 1,4-диоксанила, 1,4-оксатианила, морфолинила, 1,4-дитианила, пиперазинила, 1,4-азатианила, азепанила, 1,4-оксаазепанила, 1,4-дитиепанила, 1,4-тиеазапанила, 1,4-диазепанила, 3,4-дигидро-2H-пиранила, 5,6-дигидро-2H-пиранила, 2H-пиранила, 1,2,3,4-тетрагидропиридинила, 1,2,5,6-тетрагидропиридинила, 1,2-дигидропиридила и имидазолидинила;
причем 8-10-членное гетеробициклическое кольцо выбирают из группы, состоящей из бензофуранила, бензотиофенила, индола, бензимидазолила, бензотриазолила, пирро[2,3-b]пиридинила, пирроло[2,3-c]пиридинила, пирроло[3,2-b]пиридинила, пирроло[3,2-c]пиридинила, имидазо[4,5-b]пиридинила, имидазо[4,5-c]пиридинила, пиразоло[4,3-d]пиридинила, пиразоло[4,3-c]пиридинила, пиразоло[3,4-c]пиридинила, пиразоло[3,4-c]пиридинила, пиразоло[3,4-b]пиридинила, изоиндолила, хинолинила, изохинолинила, хиназолинила, хинаксолинила, индазолила, пуринила, индолинила, имидазо[1,2-a]пиридинила пиразоло[1,5-a]пиридинила, пирроло[1,2-b]пиридазинила, имидазо[1,2-c]пиримидинила, 3H-индолила, индолила, изоиндолинила, 2,3-дигидробензофуранила, 1,3-дигидробензофуранила, 1H-изоиндолила, 1,2,3,4-тетрагидрохиноксалинила, 1,2-дигидрохиноксалинила, 1,2-дигидрохиназолинила, 3,4-дигидрохиназолинила, 3,4-дигидро-2H-хроменила, 2H-хроменила, 4H-хроменила, 3,3a-дигидропиразоло[1,5-a]пиримидинила, 5,6,7,8-тетрагидро-[1,2,4]триазоло[4,3-a]пиразинила, октагидропирроло[1,2-a]пиразина, 4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридинила и 4,5,6,7-тетрагидро-1H-пиразоло[3,4-c]пиридина;
причем 5-7-членный гетероарил выбирают из группы, состоящей из пирролила, фуранила, тиофенила, пиразолила, имидазолила, изоксазолила, оксазолила, изотиазолила, 1,2,3-триазолила, 1,3,4-триазолила, 1-окса-2,3-диазолила, 1-окса-2,4-диазолила, 1-окса-2,5-диазолила, 1-окса-3,4-диазолила, 1-тиа-2,3-диазолила, 1-тиа-2,4-диазолила, 1-тиа-2,5-диазолила, 1-тиа-3,4-диазолила, тетразолила, пиридинила, пиридазинила и пиримидинила;
причем арил выбирают из фенила или нафталинила;
каждый n независимо равен 0, 1 или 2;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором R4 представляет собой H.
3. Соединение по п.1, в котором R4 представляет собой C1-C6-алкил.
4. Соединение по п.1, в котором R4 представляет собой метил.
5. Соединение по п.1, в котором указанное соединение выбирают из
6-((6-(1-метил-1H-пиразол-4-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина,
N-(пиперидин-4-ил)-4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол-[4,5-b]пиразин-5-ил)бензамида,
N-(2-аминоэтил)-4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)бензамида,
N-(2-диметиламино)этил-4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)бензамида,
6-((6-(4-метил-1H-имидазол-1-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина,
N-метил-4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)бензамида,
6-((6-(3-метоксифенил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина,
6-((6-(4-метоксифенил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина,
6-((6-(1H-пиразол-4-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина,
(R)-1-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пирролидин-3-амина,
(4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)фенил)метанола,
(4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)фенил)метанамина,
6-[6-(1-этоксивинил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина,
2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола,
6-[6-(2-метил-5-трифторметил-2H-пиразол-3-ил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина,
6-[6-(2H-пиразол-3-ил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина
или его фармацевтически приемлемой соли.
6. Соединение по п.1, где соединение представляет собой 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанол.
7. Фармацевтическая композиция, содержащая соединение формулы (I), определенное в любом из пп.1-5, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
8. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения c-Met-зависимого нарушения у млекопитающего, где c-Met-зависимое нарушение представляет собой рак, выбранный из рака груди, рака легкого, рака кишечника, рака предстательной железы, рака поджелудочной железы, глиомы, рака печени, рака желудка, рака головы, рака шеи, меланомы, рака почки, лейкоза, миеломы и саркомы.
Текст
Настоящее изобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям, а которых R1, R2, R3 и R4 определены в настоящем описании. Кроме того,изобретение относится к фармацевтическим композициям, содержащим соединения формулы (I),и к способам лечения гиперпролиферативных нарушений у млекопитающего путем введения соединений формулы (I) Чэнь Хэнмяо, Цуй Цзинжун Джин,Хоффман Джэки Элизабет, Цзя Лэй,Джонсон Мари Кэтрин, Кания Роберт Стивен, Ле Фыонг Тхи Куи, Намбу Митчелл Дэвид, Пэйриш Мейсон Алан, Шэнь Хун, Чан-Дьюб Мишель Бить (US) Медведев В.Н. (RU) 016204 В заявке на данное изобретение заявлен приоритет относительно предварительной заявки США 60/799966, поданной 11 мая 2006 г., и предварительной заявки США 60/893231, поданной 6 марта 2007 г., содержание которых включено в настоящее описание посредством ссылки во всей полноте. Введение Данное изобретение относится к новым производным триазолпиразинов, которые применимы для лечения гиперпролиферативных заболеваний, таких как рак, у млекопитающих. Кроме того, данное изобретение относится к использованию подобных соединений для лечения гиперпролиферативных заболеваний у млекопитающих, в особенности у людей, и к фармацевтическим композициям, содержащим подобные соединения. Уровень техники Было показано, что во многих видах рака рецептор (c-Met, или HGFR) фактора роста гепатоцитов(HGF) рецептор тирозинкиназы (RTK) принимает участие в онкогенезе, причем развитие опухоли с повышенной клеточной подвижностью и инвазией, а также метастазами (см. например, Ma, P.C.,Maulik, G., Christensen, J.Salgia, R. (2003b). Cancer Metastasis Rev, 22, 309-25; Maulik, G.,Shrikhande, A., Kijima, T., Ma, P.C., Morrison, P.T.Salgia, R. (2002b). Cytokine Growth Factor Rev, 13,41-59). c-Met (HGFR) может быть активизирован за счет сверхэкспрессии, или мутации в различных видах рака, включая мелкоклеточный рак легких (SCLC) (Ma, P.C., Kijima, Т., Maulik, G., Fox, E.A.,Sattler, M., Griffin, J.D., Johnson, B.E.Salgia, R. (2003a). Cancer Res, 63, 6272-6281).c-Met представляет собой рецептор тирозинкиназы, кодируемый протоонкогеном Met и преобразующий биологические эффекты фактора роста гепатоцитов (HGF), который также называют рассеивающим фактором (SF). Jiang et al., Crit. Rev. Oncol. Hematol. 29: 209-248 (1999). c-Met и HGF экспрессируются в множестве тканей, хотя обычно их экспрессия ограничивается клетками эпителиальной и мезенхимальной природы соответственно. c-Met и HGF необходимы для нормального развития млекопитающего и было показано, что они важны для миграции клеток, пролиферации и выживания клеток,морфогенной дифференцировки и формирования 3-мерных тубулярных структур (например, почечных тубулярных клеток, образование желез и т.д.). Помимо их влияния на эпителиальные клетки, сообщалось о том, что HGF/SF является ангиогенным фактором, и передача сигналов c-Met в эндотелиальных клетках способна вызвать многие клеточные реакции, которые необходимы для ангиогенеза (пролиферация,подвижность, инвазия). Было показано, что рецептор c-Met экспрессируется в ряде типов рака человека. Кроме того, было показано, что c-Met и его лиганд, HGF, совместно экспрессируются при повышенных концентрациях во множестве типов рака человека (в частности, в саркомах). Однако, поскольку данный рецептор и лиганд обычно экспрессируются клетками различных типов, передача сигнала c-Met в наибольшем числе случаев регулируется взаимодействиями опухоль-строма (опухоль-хозяин). Более того, амплификация, мутация и перегруппировка гена c-Met наблюдались в подклассе рака человека. Семейства с генеративными мутациями, которые активируют c-Met киназу, склонны к множественным опухолям почек, а также к опухолям в других тканях. В многочисленных исследованиях была проведена корреляция экспрессииc-Met и/или HGF/SF с состоянием развития заболевания различными типами рака (включая рак легких,толстой кишки, груди, предстательной железы, печени, поджелудочной железы, мозга, почек, яичников,желудка, кожи и костей). Кроме того, было показано, что сверхэкспрессия c-Met, или HGF, коррелирует с неудовлетворительным прогнозом и исходом заболевания в ряде основных типов рака человека, включая рак легких, печени, желудка и груди. Кроме того, c-Met принимает непосредственное участие в типах рака, для которых отсутствует успешный режим лечения, таких как рак поджелудочной железы, глиома и печеночно-клеточная карцинома. Была найдена группа новых соединений, которые проявляют c-Met модулирующую способность и оказывают благотворное влияние в отношении нарушений, связанных с аномальной активностью c-Met. С медицинской точки зрения c-Met представляет собой заманчивую цель, поскольку 1) c-Met принимал участие в росте и метастазах большинства типов рака, 2) по-видимому, рост на вторичном сайте является скорость-определяющей стадией метастаз и 3) к моменту диагноза R представляет собой вероятность того, что болезнь уже распространилась. Данные наблюдения означают, что ингибиторы c-Met киназы могли бы являться эффективным лечением для первичных опухолей, управляемых c-Met, но, что более важно, могли бы предотвратить разрастание рассеянных метастаз в метастазы, которые угрожают жизни. Следовательно, полезность ингибитора c-Met распространяется на превентивные и адъювантные терапевтические назначения. Кроме того, можно лечить некоторые типы рака (например, папиллярную почечно-клеточную карциному, некоторые типы рака желудка и легких), которые, как предполагают, управляются мутацией c-Met/генной альтерацией и зависят от c-Met в отношении роста и выживания. Ожидается, что данные типы рака чувствительны к лечению. Более того, различные типы рака человека являются первичным указанием цели для антагонистов c-Met. Данные типы рака включают основные типы рака, такие как рак груди, легких, кишечника, предстательной железы, а также рак поджелудочной железы, глиому, рак печени, рак желудка,рак головы и шеи, меланому, рак почек, лейкозы, миелому и саркомы. c-Met принимал непосредственное участие в таких типах рака, как рак поджелудочной железы, глиома и гепатоклеточная карцинома.-1 016204 Соответственно, ингибиторы c-Met (HGFR) и способы использования подобных ингибиторов для лечения аномального роста клеток, такого как рак, представляют собой значительную неудовлетворенную медицинскую потребность в лечении указанных и, возможно, других типов рака. Сущность изобретения В первом варианте осуществления настоящее изобретение относится к соединению формулы (I) в которой R1 и R2 независимо выбирают из водорода, Br, Cl, F, -O(CH2)nCH3, -NR10C(O)OR12,-(CR R13)nNR10R11, -O(CH2)nOR10, -(CH2)nOR10, -C(O)R10, -C(O)OR10, -C(O)NR10R11, -NR10R11, -S(O)2R10,-S(O)R10, -S(O)2NR10R11, -CF3, -CF2H, -NR10C(O)NR10R11, -NR10C(O)R11, -NR10S(O)2R11, -N(CH2)n(C3-C8 циклоалкила), -CN, -NO2, C1-C6-алкила, C3-C8-циклоалкила, 3-8-членного гетероалицикла, 3-8-членного гетероалицикла-(3-8-членного гетероалицикла), 8-10-членного гетеробицикла, 5-7-членного гетероарила,C6-C10-арила, C2-C6-алкенила и C2-C6-алкинила, где C1-C6-алкил, C3-C8-циклоалкил, 3-8-членный гетероалицикл, 8-10-членный гетеробицикл, 5-7-членный гетероарил, C6-C10-арил, C2-C6-алкенил и C2-C6 алкинил необязательно замещены одной или более группами, выбранными из группы, состоящей из Br,Cl, F, -(CH2)nCH(OR10)CH3, -(CH2)nOR10, -(CH2)nC(CH3)2OR10, -C(O)R10, -C(O)OR10, -(CR10R11)nC(O)OR10, C(O)NR10R11, -(CR10R11)nC(O)NR10R11, -(CH2)nNR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H,-(CH2)nNR10C(O)NR10R11, -(CH2)nNR10C(O)OR11, -NR10C(O)OR11, -NR10C(O)R11, -NR10S(O)2R11, -CN, -NO2,оксо, C1-C6-алкила, C3-C8-циклоалкила, -(CH2)n-(3-8-членного гетероалицикла), -(CH2)n-(5-7-членного гетероарила), -(CH2)n(C6-C10-арила), C2-C6-алкенила и C2-C5-алкинила;R3 представляет собой группу формулы 12 в которой R5, R6, R7, R8 и R9 независимо выбирают из водорода, Br, Cl, F, -(CH2)nOR10, -C(O)R10,-C(O)OR10, -C(O)NR10R11, -NR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H, -NR10C(O)NR10R11,-NR10C(O)R11, -NR10SO2R11, -CN, -NO2, C1-C6-алкила, C3-C8-циклоалкила, 3-8-членного гетероалицикла,8-10-членного гетеробицикла, 5-7-членного гетероарила, C6-C10-арила, C2-C6-алкенила и C2-C6-алкинила,где C1-C6-алкил, C3-C8-циклоалкил, 3-8-членный гетероалицикл, 8-10-членный гетеробицикл, 5-7 членный гетероарил, C6-C10-арил, C2-C6-алкенил и C2-C6-алкинил необязательно замещены одной или более группами, выбранными из группы, состоящей из Br, Cl, F, -(CH2)nOR10, -C(O)R10, -C(O)OR10,-C(O)NR10R11, -NR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H, -NR10C(O)NR10R11, -NR10C(O)R11,-NR10S(O)2R11, -CN, -NO2, оксо, C1-C6-алкила, C3-C8-циклоалкила, C3-C8-гетероалицикла, 5-7-членного гетероарила, C6-C10-арила, C2-C6-алкенила и C2-C6-алкинила; при условии, что один из R7 и R8 или R8 и R9, объединяются с образованием цикла, выбранного из насыщенного C4-C8-циклоалкила, ненасыщенного C5-C8-циклоалкила, 3-8-членного гетероалицикла, 5-7 членного гетероарила и C6-C10-арила, где указанный цикл необязательно замещен одной или более группами, выбранными из группы, состоящей из Br, Cl, F, -(CH2)nOR10, -C(O)R10, -C(O)OR10, -C(O)NR10R11,-NR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H, -NR10C(O)NR10R11, -NR10C(O)R11,-NR10S(O)2R11, -CN, -NO2, оксо, C1-C6-алкила, C3-C8-циклоалкила, C3-C8-гетероалицикла, 5-7-членного гетероарила, C6-C10-арила, C2-C6-алкенила и C2-C6-алкинила;R10 и R11 независимо выбирают из H, -(CH2)nOR12, -(CH2)nC(CH3)2OR12, -CHR12(CH2)nOR13,-C(O)OR12, -(CH2)nCHR12OR13, -C(CH3)2(CH2)nOR12, -CH2CF2H, -(CH2)nC(CH3)2NR12R13, -(CH2)nNR12R13,-(CH2)nCHOR12(CH2)nOR13,-(CH2)n(NR12R13)C(O)NR12R13,-(CH2)nS(O)2R12,-(CH2)nC(O)NR12R13,12 12-NR (CH2)n-(5-7-членного гетероарила), -NR (CH2)n-(3-8-членного гетероцикла), -(CH2)n-(8-10-членного гетеробицикла), -(CH2)n-(3-8-членного гетероалицикла), C1-C6-алкила, C3-C8-циклоалкила, C6-C10-арила,C2-C6-алкенила и C2-C6-алкинила, где указанный 5-7-членный гетероарил, 3-8-членный гетероцикл и 8-10-членный гетеробицикл необязательно замещены одной или более группами, выбранными из группы, состоящей из -(CH2)nOR12, C1-C6-алкила, C3-C8-циклоалкила, C6-C10-арила, C2-C6-алкенила, 3-8 членного гетероалицикла и C2-C6-алкинила; или когда R10 и R11 связаны с одним и тем же атомом, R10 иR12 и R13 независимо выбирают из H, C1-C6-алкила, -C(O)CH3, C3-C8-циклоалкила, C6-C10-арила,C2-C6-алкенила, 5-7-членного гетероарила и C2-C6-алкинила, где указанный 5-7-членный гетероарил необязательно замещен одной или более группами, выбранными из группы, состоящей из C1-C6-алкила,C3-C8-циклоалкила, C6-C10-арила, C2-C6-алкенила и C2-C6-алкинила; или когда R12 и R13 связаны с одним и тем же атомом, R12 и R13 необязательно объединяются с образованием 3-8-членного гетероалициклического кольца;R4 выбирают из группы, состоящей из водорода, F, C1-C6-алкила и арила; и каждый n независимо равен 0, 1, 2, 3 или 4; или его фармацевтически приемлемой соли. В настоящем изобретении каждый из следующих вариантов осуществления рассмотрен отдельно или в связи с любым другим раскрытым в описании вариантом осуществления, за исключением случая,когда может возникнуть непоследовательность в описании настоящего изобретения. На основании настоящего описания специалист в данной области легко поймет, что может являться подобной непоследовательностью. В другом варианте осуществления R1 и R2 независимо выбирают из водорода, Br, -OR10,-O(CH2)nCH3, -OCH2(CH2)nOR10, -C(O)NR10R11, -NR10R11, C1-C6-алкила, 3-8-членного гетероалицикла,3-8-членного гетероалицикла-(3-8-членного гетероалицикла), 8-10-членного гетеробицикла, 5-7-членного гетероарила, C6-C10-арила и C2-C6-алкенила, где C1-C6-алкил, 3-8-членный гетероалицикл, 3-8-членный гетероалицикл-(3-8-членный гетероалицикл), 8-10-членный гетеробицикл, 5-7-членный гетероарил,C6-C10-арил и C2-C6-алкенил необязательно замещены одной или более группами, выбранными из группы, состоящей из Br, Cl, F, -(CH2)nCH(OR10)CH3, -(CH2)nOR10, -(CH2)nC(CH3)2OR10, -(CH2)n-(3-8-членного гетероалицикла), -C(O)R10, -C(O)OR10, -(CR10R11)nC(O)OR10, -C(O)NR10R11, -(CR10R11)nC(O)NR10R11,-(CH2)nNR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H, -(CH2)nNR10C(O)NR10R11,(CH2)nNR10C(O)OR11, -NR10C(O)R11, NR10C(O)OR11, -NR10S(O)2R11, -CN, -NO2, оксо, C1-C6-алкила,C3-C8-циклоалкила, -(CH2)n-(3-8-членного гетероалицикла), -(CH2)n-(5-7-членного гетероарила),-(CH2)n(C6-C10-арила), C2-C6-алкенила и C2-C6-алкинила. В другом варианте осуществления R1 и R2 независимо выбирают из -OR10, -O(CH2)nCH3,10-NR C(O)OR12, -(CR12R13)nNR10R11, -OCH2(CH2)nOR10, -C(O)NR10R11, -NR10R11, C1-C6-алкила,3-8-членного гетероалицикла,3-8-членного гетероалицикла-(3-8-членного гетероалицикла),8-10-членного гетеробицикла, 5-7-членного гетероарила, C6-C10-арила и C2-C6-алкенила, где C1-C6-алкил,3-8-членный гетероалицикл, 3-8-членный гетероалицикл-(3-8-членный гетероалицикл), 8-10-членный гетеробицикл, 5-7-членный гетероарил, C6-C10-арил и C2-C6-алкенил необязательно замещены одной или более группами, выбранными из группы, состоящей из Br, Cl, F, -(CH2)nCH(OR10)CH3, -(CH2)nOR10,-(CH2)nC(CH3)2OR10, -(CH2)n-(3-8-членного гетероалицикла), -C(O)R10, -C(O)OR10, -(CR10R11)nC(O)OR10,-C(O)NR10R11, -(CR10R11)nC(O)NR10R11, -(CH2)nNR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H,-(CH2)nNR10C(O)NR10R11, -(CH2)nNR10C(O)OR11, -NR10C(O)R11, -NR10C(O)OR11, -NR10S(O)2R11, -CN, -NO2,оксо, C1-C6-алкила, C3-C8-циклоалкила, -(CH2)n-(3-8-членного гетероалицикла), -(CH2)n-(5-7-членного гетероарила), -(CH2)n(C6-C10-арила), C2-C6-алкенила и C2-C6-алкинила. В следующем варианте осуществления R1 выбирают из Br, -OR10, -O(CH2)nCH3, -NR10C(O)OR12,12 13-(CR R )nNR10R11, -OCH2(CH2)nOR10, -C(O)NR10R11, -NR10R11, C1-C6-алкила, 3-8-членного гетероалицикла, 3-8-членного гетероалицикла-(3-8-членного гетероалицикла), 8-10-членного гетеробицикла,5-7-членного гетероарила, C6-C10-арила и C2-C6-алкенила, где C1-C6-алкил, 3-8-членный гетероалицикл,3-8-членный гетероалицикл-(3-8-членный гетероалицикл),8-10-членный гетеробицикл,5-7-членный гетероарил, C6-C10-арил и C2-C6-алкенил необязательно замещены одной или более группами, выбранными из группы, состоящей из Br, Cl, F, -(CH2)nCH(OR10)CH3, -(CH2)nOR10,-(CH2)nC(CH3)2OR10, -(CH2)n-(3-8-членного гетероалицикла), -C(O)R10, -C(O)OR10, -(CR10R11)nC(O)OR10,-C(O)NR10R11, -(CR10R11)nC(O)NR10R11, -(CH2)nNR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H,-(CH2)nNR10C(O)NR10R11, -(CH2)nNR10C(O)OR11, -NR10C(O)R11, NR10C(O)OR11, -NR10S(O)2R11, -CN, -NO2,оксо, C1-C6-алкила, C3-C8-циклоалкила, -(CH2)n-(3-8-членного гетероалицикла), -(CH2)n-(5-7-членного гетероарила), -(CH2)n(C6-C10-арила), C2-C6-алкенила и C2-C6-алкинила. В следующем варианте осуществления R1 представляет собой 5-7-членный гетероарил, необязательно замещенный одной или более группами, выбранными из группы, состоящей из Br, Cl, F,-(CH2)nCH(OR10)CH3, -(CH2)nOR10, -(CH2)nC(CH3)2OR10, -(CH2)n-(3-8-членного гетероалицикла), -C(O)R10,-C(O)OR10, -C(R10R11)nC(O)OR10, -C(O)NR10R11, -(CR10R11)nC(O)NR10R11, -(CH2)nNR10R11, -S(O)2R10,-S(O)R10, -S(O)2NR10R11, -CF3, -CF2H, -(CH2)nNR10C(O)NR10R11, -(CH2)nNR10C(O)OR11, -NR10C(O)R11,NR10C(O)OR11, -NR10S(O)2R11, -CN, -NO2, оксо, C1-C6-алкила, C3-C8-циклоалкила, -(CH2)n-(3-8-членного гетероалицикла), -(CH2)n-(5-7-членного гетероарила), -(CH2)n(C6-C10-арила), C2-C6-алкенила и-3 016204 В другом варианте осуществления R7 и R8 объединяются с образованием цикла, выбранного из насыщенного C4-C8-циклоалкила, ненасыщенного C5-C8-циклоалкила, 3-8-членного гетероалицикла, 5-7 членного гетероарила и C6-C10-арила, где указанный цикл необязательно замещен одной или более группами, выбранными из группы, состоящей из Br, Cl, F, -(CH2)nOR10, -C(O)R10, -C(O)OR10, -C(O)NR10R11,-NR10R11, -S(O)2R10, -S(O)R10, -S(O)2NR10R11, -CF3, -CF2H, -NR10C(O)NR10R11, -NR10C(O)R11,-NR10S(O)2R11, -CN, -NO2, оксо, C1-C6-алкила, C3-C8-циклоалкила, C3-C8-гетероалицикла, 5-7-членного гетероарила, C6-C10-арила, C2-C6-алкенила и C2-C6-алкинила. В следующем варианте осуществления R9 является H. В следующем варианте осуществления по меньшей мере один из R1 и R2 не является водородом. В другом варианте осуществления R2 является H. В другом варианте осуществления R4 является H. В другом варианте осуществления R4 представляет собой C1-C6-алкил. В другом варианте осуществления R4 представляет собой метил. В другом варианте осуществления R5 и R6 являются H. В другом варианте осуществления R3 выбирают из В другом варианте осуществления R3 выбирают из В другом варианте осуществления R3 представляет собой В другом варианте осуществления R3 представляет собой В другом варианте осуществления R3 представляет собой В следующем варианте осуществления настоящее изобретение относится к соединению, выбранному из 6-6-(1-метил-1H-пиразол-4-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина;(4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)фенил)метанамина; 6-[6-(1-этоксивинил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина; 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола; 6-[6-(2-метил-5-трифторметил-2H-пиразол-3-ил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина; 6-[6-(2H-пиразол-3-ил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина или его фармацевтически приемлемой соли.-4 016204 В следующем варианте осуществления настоящее изобретение относится к соединению, выбранному из[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]уксусной кислоты; 6-[S)-1-(6-бром)-[1,2,3]триазол[4,5-b]пиразин-1-ил)этил]хинолина; 6-[R)-1-(6-бром)-[1,2,3]триазол[4,5-b]пиразин-1-ил)этил]хинолина; 6-1-[6-(1-метил-1H-пиразол-4-ил)-[1,2,3]триазол[4,5-b]пиразин-1-ил]этилхинолина; 6-(S)-1-[6-(1-метил-1H-пиразол-4-ил)-[1,2,3]триазол[4,5-b]пиразин-1-ил]этилхинолина; 6-(R)-1-[6-(1-метил-1H-пиразол-4-ил)-[1,2,3]триазол[4,5-b]пиразин-1-ил]этилхинолина; 2-4-[3-(1-хинолин-6-илэтил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил]пиразол-1-илэтанола; 2-4-[3-S)-1-хинолин-6-илэтил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил]пиразол-1-илэтанола; 2-4-[3-R)-1-хинолин-6-илэтил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил]пиразол-1-илэтанола; 2-[4-(3-хиназолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола; 6-[6-(1-метил-1H-пиразол-4-ил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хиназолина. В следующем варианте осуществления настоящее изобретение относится к соединению, выбранному из любых 10 соединений, приведенных в качестве примера в табл. 3-5. В следующем варианте осуществления настоящее изобретение относится к любому соединению,приведенному в качестве примера в табл. 3-5. В следующем варианте осуществления в настоящем изобретении предоставлена кристаллическая форма свободного основания 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-3-ил)пиразол 1-ил]этанола. В конкретном варианте осуществления кристаллическая форма свободного основания 2-[4(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола является безводной. В другом варианте осуществления кристаллическая форма свободного основания 2-[4-(3-хинолин-6 илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола является гидратом. В следующем аспекте кристаллическая форма представляет собой полиморфную форму 1 свободного основания 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола. В следующем аспекте кристаллическая форма 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержится пик при угле дифракции (2) 5,80,1. В следующем аспекте кристаллическая форма 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 5,80,1 и 15,50,1. В следующем аспекте кристаллическая форма 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 5,80,1, 15,50,1 и 16,20,1. В следующем аспекте кристаллическая форма 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 5,80,1, 13,60,1, 15,50,1 и 16,20,1. В следующем аспекте кристаллическая форма 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 5,80,1, 11,60,1, 13,60,1, 15,50,1 и 16,20,1. В следующем аспекте кристаллическая форма 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 5,80,1, 11,60,1, 13,60,1, 15,5,1, 16,20,1 и 23,40,1. В следующем аспекте кристаллическая форма 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 5,80,1, 11,60,1, 13,60,1, 15,50,1, 16,20,1, 23,40,1 и 27,60,1. В следующем варианте осуществления в настоящем изобретении предоставлена кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1 ил]этанола. В конкретном варианте осуществления кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6 илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола является безводной. В другом варианте осуществления кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6 илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола является гидратом. В следующем аспекте кристаллическая форма представляет собой полиморфную форму 1 мезилатной соли 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола. В следующем аспекте кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержится пик при угле дифракции (2) 18,30,1. В следующем аспекте кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 18,30,1 и 19,30,1.-5 016204 В следующем аспекте кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 12,30,1, 18,30,1 и 19,30,1. В следующем аспекте кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 12,30,1, 14,80,1, 18,30,1 и 19,30,1. В следующем аспекте кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 12,30,1, 14,80,1, 18,30,1, 19,30,1 и 23,10,1. В следующем аспекте кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 12,30,1, 14,80,1, 18,30,1, 19,30,1, 23,10,1 и 24,90,1. В следующем аспекте кристаллическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола имеет порошкообразную рентгенограмму, в которой содержатся пики при углах дифракции (2) 12,30,1, 14,80,1, 17,70,1, 18,30,1, 19,30,1, 23,10,1 и 24,90,1. В следующем аспекте изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент. В следующем аспекте изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения c-Met-зависимого нарушения у млекопитающего. В следующем аспекте изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака у млекопитающего. В следующем аспекте изобретение относится к данному применению, при котором рак выбирают из рака груди, рака легкого, рака кишечника, рака предстательной железы, рака поджелудочной железы,глиомы, рака печени, рака желудка, рака головы, рака шеи, меланомы, рака почек, лейкоза, миеломы и саркомы. В следующем аспекте изобретение относится к способу лечения млекопитающего, страдающегоc-Met-зависимым нарушением, который включает введение данному млекопитающему терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В следующем аспекте изобретение относится к способу лечения млекопитающего, страдающего раком, который включает введение данному млекопитающему терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В следующем аспекте изобретение относится к способу лечения рака, при котором рак выбирают из рака груди, рака легкого, рака кишечника, рака предстательной железы, рака поджелудочной железы,глиомы, рака печени, рака желудка, рака головы, рака шеи, меланомы, рака почек, лейкоза, миеломы и саркомы. В следующем аспекте данное млекопитающее является человеком. В следующем аспекте данное млекопитающее является собакой. Определения"Фармацевтически приемлемая соль" относится к солям, которые сохраняют биологическую эффективность и свойства исходного соединения. Подобные соли включают соль присоединения кислоты,которую получают реакцией исходного соединения в форме свободного основания с неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, йодистоводородная кислота, азотная кислота, фосфорная кислота, серная кислота, хлорная кислота и т.д., или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, (D)- или (L)-яблочная кислота, малеиновая кислота, метансульфокислота, этансульфокислота, п-толуолсульфокислота, салициловая кислота, винная кислота, бензолсульфокислота (безилат), бензойная кислота, камфорсульфокислота,лимонная кислота, фумаровая кислота, глюконовая кислота, глутаминовая кислота, изетионовая кислота,молочная кислота, яблочная кислота, миндальная кислота, слизевая кислота, памовая кислота, пантотеновая кислота, янтарная кислота или малоновая кислота и т.д., предпочтительно с хлористо-водородной кислотой или (L)-яблочной кислотой; или соли, полученные в том случае, когда кислый протон, имеющийся в исходном соединении, либо замещают ионом металла, например ионом щелочного металла, ионом щелочно-земельного металла или ионом алюминия, либо координируют с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.д."Фармацевтически приемлемый эксципиент", или "эксципиент", относится к инертному веществу,добавляемому к фармацевтической композиции для дополнительного облегчения введения соединения. Примеры эксципиентов, без ограничения, включают карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла, полиэтиленгликоли, разбавители, гранулирующие агенты, смазывающие вещества, связующие вещества, разрыхляющие агенты и т.д."Фармацевтическая композиция" относится к смеси одного или более описанных соединений или их физиологически приемлемых солей с другими химическими компонентами, такими как физиологически приемлемые носители и эксципиенты. Назначение фармацевтической композиции состоит в облегчении введения соединения в организм. Использованный в настоящем описании "физиологически приемлемый носитель" относится к носителю или разбавителю, который не вызывает существенного раздражения в организме и не сводит на нет биологическую активность и свойства вводимого соединения. Термин "способ" относится к порядку действий, средствам, методам и методикам выполнения поставленной задачи, включая, но не ограничиваясь такими образами действий, средствами, методами и методиками, которые либо известны, либо легко выводятся из известных образов действий, средств, методов и методик профессионалами в области химии, фармации, биологии, биохимии и медицины. Использованный в настоящем описании термин "модулирование" или "модулирующий" относится к изменению каталитической активности c-Met. В частности, модулирование относится к активации каталитической активности c-Met, предпочтительно к активации, или ингибированию каталитической активности c-Met, в зависимости от концентрации соединения или соли, действию которых подвергаютc-Met, или более предпочтительно к ингибированию каталитической активности c-Met. Использованный в настоящем описании термин "контактирование" относится к введению во взаимодействие соединения данного изобретения и c-Met таким образом, чтобы соединение могло влиять на каталитическую активность c-Met либо непосредственным, т.е. за счет взаимодействия с самим c-Met,либо косвенным образом, т.е. за счет взаимодействия с другой молекулой, от которой зависит каталитическая активность c-Met. Подобное "контактирование" можно осуществить in vitro, т.е. в пробирке, чашке Петри или т.п. В пробирке контактирование может включать только соединение и c-Met или оно может включать целые клетки. Кроме того, клетки можно содержать или выращивать в чашках для клеточных культур и приводить в конктакт с соединением в этом окружении. В данном контексте способность конкретного соединения воздействовать на c-Met-связанное нарушение, т.е. IC50 данного соединения,определенное далее, можно определить перед тем, как пытаться использовать соединения in vivo на более сложных живых организмах. В случае клеток вне организма для приведения c-Met в контакт с соединениями существует множество методов, и они хорошо известны специалистам в данной области, включая, но не ограничиваясь, непосредственную клеточную микроинъекцию и многочисленные методы трансмембранного переноса."In vitro" относится к методам, осуществляемым в искусственном окружении, например, без ограничения, таким как в пробирке или культурной среде. Опытный специалист поймет, например, что выделенный c-Met можно привести в контакт с модулятором в окружении in vitro. Альтернативным образом можно привести в контакт выделенную клетку с модулятором в окружении in vitro. Использованное в настоящем описании "in vivo" относится к методам, осуществляемым в живом организме, без ограничения, таком как мышь, крыса, кролик, копытное животное, корова, лошадь, свинья, собака, кошка, примат или человек. Использованное в настоящем описании "c-Met-связанное нарушение" относится к состоянию, которое характеризуется несоответствующей, т.е. недостаточной, активностью или, чаще, повышенной активностью каталитической активности c-Met. Кроме того, "c-Met-связанное нарушение" относится к состоянию, при котором возможна мутация в гене, образующем c-Met, при которой, в свою очередь, образуется c-Met, обладающий повышенной или пониженной каталитической активностью c-Met. Несоответствующая каталитическая активность может возникнуть в результате либо (1) экспрессииc-Met в клетках, которые обычно не экспрессируют c-Met; (2) повышенной экспрессии c-Met, приводящей к нежелательной пролиферации, дифференцировке и/или росту клеток; либо (3) пониженной экспрессии c-Met, приводящей к нежелательным снижениям пролиферации, дифференцировке и/или росту клеток. Сверхактивность c-Met относится либо к амплификации гена, кодирующего производство c-Met,либо к получению уровня активности c-Met, который способен коррелировать с нарушением пролиферации, дифференцировке и/или росту клеток (т.е. по мере повышения уровня c-Met возрастает тяжесть одного или более симптомов клеточного нарушения). Разумеется, недостаточная активность является противоположностью, при которой тяжесть одного или более симптомов клеточного нарушения возрастает по мере снижения уровня активности c-Met.-7 016204 Использованные в настоящем описании термины "лечить", "лечение" и "способ лечения" относятся к способу облегчения или сведения на нет c-Met-зависимого клеточного нарушения и/или сопровождающих его симптомов. Что касается собственно рака, данные термины просто означают, что средняя продолжительность жизни индивидуума, пораженного раком, будет увеличена или что один или более симптомов этого заболевания будут уменьшены. Термин "организм" относится к любому живому организму, состоящему по меньшей мере из одной клетки. Живой организм может быть, например, простым, как одна эукариотическая клетка, или сложным, как млекопитающее. В предпочтительном аспекте данный организм представляет собой млекопитающее. В особенно предпочтительном аспекте данный организм представляет собой человека. Использованный в настоящем описании термин "терапевтически эффективное количество" относится к такому количеству вводимого соединения, которое до некоторой степени облегчит один или более симптомов нарушения, подвергаемого лечению. В отношении лечения рака терапевтически эффективное количество относится к такому количеству соединения, которое обладает эффектом (1) уменьшения размера опухоли, (2) ингибирования (т.е. до некоторой степени, уменьшения, предпочтительно остановки) метастаз опухоли, (3) ингибирования, до некоторой степени (т.е. до некоторой степени, замедления, предпочтительно прекращения) роста опухоли и/или (4) облегчения, до некоторой степени (или предпочтительно снятия) одного или более симптомов, связанных с раком. Под "мониторингом" имеется в виду наблюдение или детектирование эффекта контактирования соединения с клеткой, экспрессирующей c-Met. Наблюдаемый или детектируемый эффект может представлять собой изменение фенотипа клетки, каталитической активности c-Met или изменение во взаимодействии c-Met с естественным связывающим партнером. Методы наблюдения или детектирования подобных эффектов хорошо известны в данной области. Например, за каталитической активностью c-Met можно наблюдать при помощи определения скорости или степени фосфорилирования целевой молекулы."Фенотип клетки" относится к внешнему виду клетки или ткани либо биологической функции данной клетки или ткани. Примерами фенотипа клетки, без ограничения, являются размер клетки, рост клетки, клеточная пролиферация, выживание клетки, апоптоз и поглощение и использование питательных веществ. Подобные фенотипические характеристики поддаются определению при помощи методов,которые хорошо известны в данной области."Естественный связывающий партнер" относится к полипептиду, который связывается с c-Met в клетке. Естественные связывающие партнеры могут играть роль в процессе c-Met-опосредуемой передачи сигнала. Изменение во взаимодействии естественного связывающего партнера с c-Met может проявиться в виде повышенной или пониженной концентрации комплекса c-Met/естественный связывающий партнер и, как результат, в виде наблюдаемого изменения способности c-Met быть посредником при передаче сигнала. Как использовано в настоящем описании, термин"вводить", или "введение", относится к доставке соединения или соли согласно настоящему изобретению в организм в целях предупреждения или лечения c-Met-зависимого нарушения. Термины "аномальный клеточный рост" и "гиперпролиферативное нарушение" используются в настоящем описании по очереди. Как использовано в настоящем описании, "аномальный клеточный рост" относится к клеточному росту, который не зависит от обычных механизмов регулирования (например, потери контактного торможения), включая аномальный рост нормальных клеток и рост аномальных клеток. Это включает, но не ограничивается, аномальный рост (1) опухолевых клеток (опухолей), как доброкачественных, так и злокачественных, экспрессирующих активированный онкоген Ras; (2) опухолевых клеток, как доброкачественных, так и злокачественных, в которых белок Ras активирован в результате онкогенной мутации в другом гене; (3) доброкачественных и злокачественных клеток других пролиферативных заболеваний, в которых имеет место аберрантная активация Ras. Примерами подобных доброкачественных пролиферативных заболеваний являются псориаз, доброкачественная гипертрофия предстательной железы, вирус папилломы человека (HPV) и рестеноз. Кроме того, "аномальный клеточный рост" относится и включает аномальный рост клеток, как доброкачественных, так и злокачественных, который является результатом активности фермента фарнезил-протеинтрансферазы."Алкил" относится к насыщенному алифатическому углеводороду, включающему линейную цепь или разветвленную цепь. Предпочтительно алкильная группа содержит от 1 до 20 атомов углерода (всякий раз, когда в настоящем описании установлен численный интервал, например "1-20", это означает,что группа, в данном случае алкильная группа, может содержать 1 атом углерода, 2 атома углерода, 3 атома углерода и т.д., вплоть до 20 атомов углерода включительно). Более предпочтительно она представляет собой алкил среднего размера, содержащий от 1 до 10 атомов углерода. Наиболее предпочтительно она представляет собой низший алкил, содержащий от 1 до 6 атомов углерода. Алкильная группа может быть замещенной или незамещенной. В случае замещения каждая замещающая группа предпочтительно является одной или более группами, выбранными по отдельности из галогена,-гидрокси, -COR', -COOR', -OCOR', -CONRR', -RNCOR', -NRR', -CN, -NO2, -CF3, -SR', -SOR', -SO2R',-SO2OR', -SO2NRR', тиокарбонила, -RNSO2R', перфторалкила, O-карбамила, N-карбамила,-8 016204O-тиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила, низшего алкинила, циклоалкила, гетероалицикла, гетероарила и арила. R и R' могут независимо представлять собой H,алкил или арил, где алкил или арил могут быть дополнительно замещены галогеном, (CH2)nN(R)2,(CH2)nCO2R, (CH2)nOR, (CH2)nOC(O)R, алкоксикарбонилом, арилоксикарбонилом, аминокарбонилом,гетероалициклическим кольцом, арилом, алкокси, -OCF3, арилокси, C(O)NH2 или гетероарилом. R может представлять собой H, алкил или арил; n равен 0-3."Алкенил" относится к алифатическому углеводороду, содержащему по меньшей мере одну двойную углерод-углеродную связь, включая линейные, разветвленные или циклические группы, содержащие по меньшей мере одну двойную углерод-углеродную связь. Предпочтительно алкенильная группа содержит от 2 до 20 атомов углерода (всякий раз, когда в настоящем описании установлен численный интервал, например "2-20", это означает, что группа, в данном случае алкенильная группа, может содержать 2 атома углерода, 3 атома углерода и т.д., вплоть до 20 атомов углерода включительно). Более предпочтительно она представляет собой алкенил среднего размера, содержащий от 2 до 10 атомов углерода. Наиболее предпочтительно она представляет собой низший алкенил, содержащий от 2 до 6 атомов углерода. Примеры алкенильных групп, без ограничения, включают 1-пропенил, 1- и 2-бутенил и т.д. Алкенильная группа может быть замещенной или незамещенной. В случае замещения каждая замещающая группа предпочтительно является одной или более группами, выбранными по отдельности из галогена, -гидрокси, -COR', -COOR', -OCOR', -CONRR', -RNCOR', -NRR', -CN, -NO2, -CF3, -SR', -SOR',-SO2R', -SO2OR', -SO2NRR', тиокарбонила, -RNSO2R', перфторалкила, O-карбамила, N-карбамила,O-тиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила, низшего алкинила, циклоалкила, гетероалицикла, гетероарила и арила. При этом R и R' определены в настоящем описании."Алкинил" относится к алифатическому углеводороду, содержащему по меньшей мере одну тройную углерод-углеродную связь, включая линейные, разветвленные или циклические группы, содержащие по меньшей мере одну тройную углерод-углеродную связь. Предпочтительно алкинильная группа содержит от 2 до 20 атомов углерода (всякий раз, когда в настоящем описании установлен численный интервал, например "2-20", это означает, что группа, в данном случае алкинильная группа, может содержать 2 атома углерода, 3 атома углерода и т.д., вплоть до 20 атомов углерода включительно). Более предпочтительно она представляет собой алкинил среднего размера, содержащий от 2 до 10 атомов углерода. Наиболее предпочтительно она представляет собой низший алкинил, содержащий от 2 до 6 атомов углерода. Примеры алкинильных групп, без ограничения, включают 1-пропинил, 1- и 2-бутинил и т.д. Алкинильная группа может быть замещенной или незамещенной. В случае замещения каждая замещающая группа предпочтительно является одной или более группами, выбранными по отдельности из галогена, -гидрокси, -COR', -COOR', -OCOR', -CONRR', -RNCOR', -NRR', -CN, -NO2, -CF3, -SR',-SOR', -SO2R', -SO2OR', -SO2NRR', тиокарбонила, -RNSO2R', перфторалкила, O-карбамила, N-карбамила,O-тиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила, низшего алкинила, циклоалкила, гетероалицикла, гетероарила и арила. При этом R и R' определены в настоящем описании."Циклоалкильная" или "алициклическая" группа относится к состоящей только из атомов углерода моноциклической или конденсированной циклической (т.е. циклам, которые делят между собой два смежных атома углерода) группе, в которой один или более циклов не имеют полностью сопряженной пи-электронной системы. Предпочтительно данная циклоалкильная группа содержит 3-8 атомов углерода в цикле(ах). Примерами циклоалкильных групп, без ограничения, являются циклопропан, циклобутан,циклопентан, циклопентен, циклогексан, адамантан, циклогексадиен, циклогептан и циклогептатриен. Данная алкинильная группа может быть замещенной или незамещенной. В случае замещения каждая замещающая группа предпочтительно является одной или более группами, выбранными по отдельности из галогена, -гидрокси, -COR', -COOR', -OCOR', -CONRR', -RNCOR', -NRR', -CN, -NO2, -CF3, -SR', -SOR',-SO2R', -SO2OR', -SO2NRR', тиокарбонила, -RNSO2R', перфторалкила, O-карбамила, N-карбамила, Oтиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила, низшего алкинила,циклоалкила, гетероалицикла, гетероарила и арила. При этом R и R' определены в настоящем описании."Арильная" группа относится к состоящим только из атомов углерода моноциклическим или конденсированным полициклическим (т.е. циклам, которые делят между собой два смежных атомы углерода) группам, содержащим полностью сопряженную пи-электронную систему. Предпочтительно данная арильная группа содержит от 6 до 12 атомов углерода в цикле(ах). Примерами арильных групп, без ограничения, являются фенил, нафталинил и антраценил. Данная арильная группа может быть замещенной или незамещенной. В случае замещения каждая замещающая группа предпочтительно является одной или более группами, выбранными из галогена, гидрокси, алкокси, арилокси, -COR', -COOR', -OCOR',-CONRR', -RNCOR', -NRR', -CN, -NO2, -CF3, -SR', -SOR', -SO2R', -SO2OR', -SO2NRR', тиокарбонила,-RNSO2R', перфторалкила, O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила, низшего алкинила, циклоалкила, гетероалицикла, гетероарила и арила. При этом R и R' определены в настоящем описании.-9 016204 Как использовано в настоящем описании, "гетероарильная" группа относится к моноциклической группе, содержащей в цикле один или более атомов, выбранных из группы, включающей азот, кислород и серу, при условии, что в настоящем изобретении не рассматриваются гетероарильные группы, содержащие крайне нестабильные гетероатомные структуры, такие как O-O, O-O-O и т.п. Специалист в данной области узнает нестабильные структуры, которые не рассматриваются в данном изобретении. Помимо этого, гетероарильная группа содержит полностью сопряженную пи-электронную систему. Предпочтительно гетероарильная группа содержит от 5 до 7 атомов цикла. Примеры типичных моноциклических гетероарильных групп включают, но не ограничиваются: В случае замещения каждая замещающая группа предпочтительно является одной или более группами, выбранными из галогена, гидрокси, -COR', -COOR', -OCOR', -CONRR', -RNCOR', -NRR', -CN,-NO2, -CF3, -SR', -SOR', -SO2R', -SO2OR', -SO2NRR', тиокарбонила, -RNSO2R', перфторалкила,O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила, низшего алкинила, циклоалкила, гетероалицикла, гетероарила и арила. При этом R и R' определены в настоящем описании."Гетероалициклическое кольцо", или "гетероалицикл", или "гетероциклическая" группа, или "гетероцикл" относится к моноциклической группе, содержащей в цикле один или более атомов, выбранных из группы, включающей азот, кислород и серу. Данные циклы могут быть насыщенными и, кроме того,содержать одну или более двойных связей (т.е. быть частично ненасыщенными). Однако данные циклы могут не содержать полностью сопряженную пи-электронную систему. Предпочтительно гетероалициклическое кольцо содержит от 3 до 8 атомов цикла. Примеры подходящих насыщенных гетероалициклических групп включают, но не ограничиваются:- 10016204 Примеры подходящих ненасыщенных гетероалициклических групп включают, но не ограничиваются: Приведенные выше группы, полученные из перечисленных выше соединений, могут бытьC-связанными или N-связанными, где это возможно. Например, группа, полученная из пиррола, может представлять собой пиррол-1-ил (N-связанная) или пиррол-3-ил (C-связанная). Гетероалициклическое кольцо может быть замещенным или незамещенным. Гетероалициклическое кольцо может содержать одну или более оксогрупп. В случае замещения замещающая группа(ы) предпочтительно является одной или более группами, выбранными из галогена, гидрокси, -COR', -COOR', -OCOR', -CONRR', -RNCOR',-NRR', -CN, -NO2, -CZ3, -SR', -SOR', -SO2R', -SO2OR', -SO2NRR', тиокарбонила, -RNSO2R', перфторалкила,O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила, низшего алкинила, циклоалкила, гетероалицикла, гетероарила и арила. При этом R и R' определены в настоящем описании."3-8-членная гетероалициклическая-(3-8-членная гетероалициклическая)" группа относится к группе, включающей в себя две 3-8-членные гетероалициклические группы, ковалентно связанные друг с другом через один атом цикла от каждой. 3-8-членные гетероалициклические кольца могут представлять собой любое гетероалициклическое кольцо, определенное выше. Кроме того, гетероалициклические кольца могут быть замещенными или незамещенными, как определено выше.(т.е. циклам, которые делят между собой два смежных атома), содержащей в цикле(ах) один или более атомов, выбранных из группы, включающей азот, кислород и серу и, кроме того, содержащей полностью сопряженную пи-электронную систему (т.е. ароматическую гетеробициклическую), или одну или более двойных связей, которые не создают полностью сопряженную пи-электронную систему, при условии,что в настоящем изобретении не рассматриваются гетеробициклические группы, содержащие крайне нестабильные гетероатомные структуры, такие как O-O, O-O-O и т.п. Специалист в данной области узнает нестабильные структуры, которые не рассматриваются в данном изобретении. Предпочтительно гетеробициклическая группа содержит 8-10 атомов цикла. Гетеробициклическое кольцо может быть замещенным или незамещенным. Гетеробициклическое кольцо может содержать одну или более оксогрупп. Примеры подходящих ароматических гетеробициклических групп с конденсированными кольцами включают, но не ограничиваются:- 11016204 Примеры подходящих гетеробициклических групп с конденсированными кольцами включают, но не ограничиваются: В случае замещения замещающая группа(ы) предпочтительно является одной или более группами,выбранными из галогена, гидрокси, -COR', -COOR', -OCOR', -CONRR', -RNCOR', -NRR', -CN, -NO2, -CZ3,-SR', -SOR', -SO2R', -SO2OR', -SO2NRR', тиокарбонила, -RNSO2R', перфторалкила, O-карбамила,N-карбамила, O-тиокарбамила, N-тиокарбамила, силила, аммония, низшего алкила, низшего алкенила,низшего алкинила, циклоалкила, гетероалицикла, гетероарила и арила. При этом R и R' определены в настоящем описании. При использовании в настоящем описании R группы в заместителях, содержащих две или более R групп при различных атомах, такие как (CH2)n(NR12R13)C(O)NR12R13 или -NR10C(O)NR10R11, могут быть одинаковыми или различными. Конкретно, в приведенном в качестве примера заместителе-NR10C(O)NR10R11 две группы R10 могут быть одинаковыми или различными по отношению друг к другу,аналогичным образом, две группы R10 могут быть одинаковыми или различными по отношению к группеR11. Например, в -(CH2)n(NR12R13)C(O)NR12R13 две группы R12 могут быть одинаковыми или различными по отношению друг к другу и две группы R13 могут быть одинаковыми или различными по отношению друг к другу. Аналогичным образом, две группы R12 могут быть одинаковыми или различными по отношению к двум группам R13. Кроме того, в случае, когда один атом замещен более чем одной группой,группы при данном атоме могут быть одинаковыми или различными. Так, в -NR10C(O)NR10R11 R10 и R11 при одном и том же атоме азота могут быть одинаковыми или отличаться друг от друга."Алкокси" группа относится как к -O-алкильной, так и -O-циклоалкильной группам, определенным в настоящем описании."Арилокси" группа относится как к -O-арильной, так и -O-гетероарильным группам, определенным в настоящем описании."Гетероарилоксильная" группа относится к гетероарильной группе, в которой гетероарил определен в настоящем описании."Гетероалициклокси" группа относится к гетероалицикл-O группе, в которой гетероалицикл определен в настоящем описании."Перфторалкильная" группа относится к алкильной группе, в которой все атомы водорода были замещены атомами фтора. Соединения, имеющие ту же молекулярную формулу, но отличающиеся природой, или последовательностью связывания своих атомов, или расположением своих атомов в пространстве, называют "изомерами". Изомеры, отличающиеся расположением своих атомов в пространстве, называют "стереоизомерами". Стереоизомеры, не являющиеся зеркальными изображениями друг друга, называют "диастереомерами", а стереоизомеры, которые являются не совмещающимися при наложении зеркальными изображениями друг друга, называют "энантиомерами". Если соединение имеет асимметрический центр,например он связан с четырьмя различными группами, возможно существование пары энантиомеров. Энантиомер можно охарактеризовать абсолютной конфигурацией асимметрического центра и описать согласно правилам установления R- и S-последовательности Канна и Прелога или способом, которым молекула вращает плоскость поляризованного света, и обозначить как правовращающий или левовращающий (т.е. как (+) или (-)-изомеры соответственно). Хиральное соединение может существовать либо в виде индивидуального энантиомера, либо в виде их смеси. Смесь, содержащая равные доли энантиомеров, называют "рацемической смесью". Химические формулы, на которые ссылаются в настоящем описании, могут выражать явления таутомерии и структурной изомерии. Данное изобретение включает любую таутомерную или структурную изомерную форму и их смеси, которые обладают способностью модулировать активность c-Met, и не ограничивается какой-либо одной таутомерной или структурной изомерной формой. Соединения данного изобретения могут содержать один или более асимметрических центров, следовательно, подобные соединения можно получить в виде индивидуальных (R)- или (S)-стереоизомеров или их смесей. Если не указано иначе, подразумевается, что описание или название конкретного соединения в описании и формуле изобретения включает как индивидуальные стереоизомеры, так и их смеси,рацемические или иные. Методы определения стереохимического строения и разделения стереоизомеров хорошо известны в данной области (см. обсуждение в главе 4 "Advanced Organic Chemistry", 4th edition J.March, John Wiley and Sons, New York, 1992). Таким образом, данное изобретение включает любую стереоизомерную форму, соответствующие им энантиомеры (d- и l- или (+)- и (-)-изомеры) и их диастереомеры и их смеси, которые обладают способностью модулировать активность c-Met, и не ограничивается какой-либо одной стереоизомерной формой. В соединениях формулы (I) может проявляться явление таутомерии и структурной изомерии. Например, описанные здесь соединения могут принимать E- или Z-конфигурацию относительно двойной связи или они могут представлять собой смесь E и Z. Данное изобретение включает любую таутомерную или структурную изомерную форму и их смеси, которые обладают способностью модулировать активность c-Met, и не ограничивается какой-либо одной таутомерной или структурной изомерной формой.- 13016204 Предполагается, что соединения формулы (I) будут усваиваться ферментами в теле организма, такого как человек, с образованием метаболита, который способен модулировать активность c-Met. Подобные метаболиты входят в рамки настоящего изобретения. Те из соединений формулы (I), которые имеют кислую природу, способны образовывать соли оснований с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных или щелочно-земельных металлов и, в частности, соли натрия и калия. Соединения настоящего изобретения имеют асимметрические центры и, следовательно, существуют в виде различных энантиомерных и диастереомерных форм. Данное изобретение относится к использованию всех оптических изомеров и стереоизомеров соединений настоящего изобретения и их смесей и ко всем композициям и способам лечения, в которых они могут использоваться или содержаться. Соединения формулы (I) могут также существовать в виде таутомеров. Данное изобретение относится к использованию всех подобных таутомеров и их смесей. Кроме того, данное изобретение включает фармацевтические композиции, содержащие соединения формулы (I), и способы лечения пролиферативных нарушений или аномального клеточного роста путем введения пролекарств на основе соединений формулы (I). Соединения формулы (I), содержащие свободную амино, амидо, гидрокси или карбоксильную группы, можно перевести в пролекарства. Пролекарства включают соединения, в которых остаток аминокислоты или полипептидная цепь из остатков двух или более аминокислот (например, двух, трех или четырех) ковалентно связаны амидной или сложноэфирной связью со свободной амино, амидо, гидрокси или карбоксильной группой соединений формулы (I). Остатки аминокислоты включают, но не ограничиваются, 20 природных аминокислот, которые обычно обозначают символами из трех букв, и включают также 4-гидроксипролин, гидроксилизин, демозин,изодемозин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитрулин гомоцистеин, гомосерин, орнитин и метионинсульфон. Включены также дополнительные типы пролекарств. Например, свободные карбоксильные группы можно перевести в амиды или алкиловые сложные эфиры. Из свободных гидроксигрупп можно получить производные при помощи гемисукцинатов, сложных эфиров фосфатов, диметиламиноацетатов и фосфорилоксиметилоксикарбонилов, как отмечено в AdvancedDrug Delivery Reviews, 1996, 19, 115, но не ограничиваясь ими. Включены также карбаматные пролекарства на основе гидрокси- и аминогрупп, как и карбонатные пролекарства, сульфонатные сложные эфиры и сульфатные эфиры на основе гидроксигрупп. Включено также получение производных из гидроксигрупп, таких как (ацилокси)метиловые и (ацилокси)этиловые простые эфиры, в которых ацильная группа может представлять собой алкиловый сложный эфир, необязательно замещенный группами, которые включают, но не ограничиваются, группы простого эфира, амина и карбоновой кислоты или в которых ацильная группа является сложным эфиром аминокислоты, описанной выше. Пролекарства этого типа описаны в J. Med. Chem. 1996, 39, 10. Свободные амины можно также перевести в амиды, сульфонамиды или фосфонамиды. Все данные группы пролекарств могут содержать группы, включающие в себя, но не ограниченные, группы простого эфира, амина и карбоновой кислоты. Подробное описание изобретения Представленные в настоящем описании соединения приведены в качестве примеров и не должны истолковываться как ограничивающие рамки изобретения. Общий синтетический подход к соединениям настоящего изобретения представлен на схеме 1. Специалист в данной области поймет, что данную общую схему можно видоизменить и, тем не менее,получить по ней соединения настоящего изобретения. Группы Ra, Rb, Rc, Rd и Re, приведенные на схеме 1, включают в себя, но не ограничиваются, группы заместителей, описанных здесь в связи с настоящим изобретением. Дополнительные типичные способы получения соединений изобретения приведены в общих чертах далее в неограничивающих примерах. Схема 1 В первом аспекте целью данного изобретения является фармацевтическая композиция, содержащая одно или более соединений формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.- 14016204 Была получена необычная физическая форма свободного основания 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола. Табличные данные порошковой рентгенограммы (PXRD) полиморфной формы свободного основания 1 представлены в табл. 1. См. приведенный ниже способ 42. Таблица 1 Табличные данные PXRD формы 1 свободного основания 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола Была получена необычная физическая форма мезилатной соли 2-[4-(3-хинолин-6-илметил-3H[1,2,3]триазол[4,5-b]пиразин-3-ил)пиразол-1-ил]этанола. Табличные данные порошковой рентгенограммы (PXRD) полиморфной формы мезилатной соли 1 представлены в табл. 2. См. приведенный ниже способ 42. Таблица 2 Табличные данные PXRD формы 1 мезилатной соли 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]этанола Кроме того, аспектом настоящего изобретения является случай, когда описанное здесь соединение или его соль может быть соединено с другими химиотерапевтическими агентами для лечения описанных выше заболеваний и нарушений. Например, соединение или его соль согласно данному изобретению можно соединить с алкилирующими агентами, такими как фторурацил (5-FU) самим по себе, или в дополнительном сочетании с лейковорином; или другими алкилирующими агентами, такими как, без ограничения, прочие аналоги пиридина, такие как UFT, капецитабин, гемцитабин и цитарабин, алкилсульфонатами, например бусульфаном (используемым при лечении хронического гранулоцитарного лейкоза),импосульфаном и пипосульфаном; азиридинами, например бензодепой, карбоквоном, метуредепой и уредепой; этилениминами и метилмеламинами, например ал-трет-амином, триэтиленметамином, триэтиленфосфорамидом, триэтилентиофосфорамидом и триметилолмеламином; и азотистыми ипритами, например хлоамбуцилом (используемым при лечении хронического лимфоцитарного лейкоза, первичной макроглобулинемии и неходжкинской лимфомы), циклофосфамидом (используемым при лечении болезни Ходжкина, множественной миеломы, нейробластомы, рака груди, рака яичника, рака легких, опухоли Вильма и рабдомиосаркомы), эстрамустином, ифосфамидом, новембрихином, преднимустином и урацилипритом (используемыми при лечении первичного тромбоцитоза, неходжкинской лимфомы, болезни Ходжкина и рака яичника); и триазинами, например дакарбазином (используемым при лечении саркомы мягких тканей). Аналогичным образом, можно ожидать, что соединение или соль согласно данному изобретению будут иметь положительный эффект в сочетании с другими антиметаболическими химиотерапевтическими агентами, такими, без ограничения, как аналоги фолиевой кислоты, например метотрексат (используемый при лечении острого лимфоцитарного лейкоза, хориокарциномы, грибовидной гранулемы,рака груди, рака головы и шеи и остеобластосаркомы) и птероптерин; и аналогами пурина, такими как меркаптопурин и тиогуанидин, которые находят применение при лечении острого гранулоцитарного,острого лимфоцитарного и хронического гранулоцитарного лейкоза.- 15016204 Кроме того, можно ожидать, что соединение или соль согласно данному изобретению окажутся эффективными в сочетании с химиотерапевтическими агентами на основе природных продуктов, такими,без ограничения, как алкалоиды барвинка, например винбластин (используемый при лечении рака груди и яичка), винкристин и виндезин, эпиподофилотоксины, например этопозид и тенипозид, оба из которых применимы для лечения рака яичка и саркомы Капоши, антибиотическими химиотерапевтическими агентами, например даунорубицином, доксорубицином, эпирубицином, митомицином (используемыми при лечении рака желудка, шейки матки, толстой кишки, рака груди, мочевого пузыря и поджелудочной железы), дактиномицином, темозоломидом, пликамицином, блеомицином (используемыми при лечении рака кожи, пищевода и мочеполового тракта), и ферментными химиотерапевтическими агентами, такими как L-аспарагиназа. В дополнение к указанному выше, можно ожидать, что соединение или соль согласно данному изобретению будут иметь положительный эффект в сочетании с координационными комплексами платины(цисплатином и т.д.), замещенными мочевинами, такими как гидроксимочевина, производными метилгидразина, например, прокарбазином, адренокортикальными супрессивными средствами, например, митотаном, аминоглутетимидом, и гормонами и антагонистами гормонов, такими как адренокортикостероиды (например, преднизон), прогестины (например, гидроксипрогестеронкапроат); эстрогенами (например, диэтилстилбестерол); антиэстрогенами, такими как тамоксифен; андрогенами, например пропионатом тестостерона, и ингибиторами ароматазы (такими как анастрозол). Наконец, можно ожидать, что комбинация соединения данного изобретения будет особенно эффективна в сочетании с митоксантроном, или паклитакселем для лечения солидных опухолевых раков, или лейкозов, таких, без ограничения, как острый миелогенный (не лимфоцитарный) лейкоз. Указанный выше способ можно осуществить в сочетании с химиотерапевтическим агентом, выбранным из группы, включающей митотические ингибиторы, алкилирующие агенты, антиметаболиты,ингибиторы клеточных циклов, ферменты, ингибиторы топоизомеразы, модификаторы биологического ответа, антигормоны, антиангиогенные агенты, такие как ингибиторы MMP-2, MMP-9 и COX-2, и антиандрогены. Примеры пригодных ингибиторов COX-II включают Vioxx, CELEBREX (алекоксиб),вальдекоксиб, паракоксиб, рофекоксиб и COX 189. Примеры пригодных ингибиторов матричной металлопротеиназы описаны вWO 96/33172 (опубликованном 24 октября 1996 г.), WO 96/27583 (опубликованном 7 марта 1996 г.),европейской патентной заявке 97304971.1 (поданной 8 июля 1997 г.), европейской патентной заявке 99308617.2 (поданной 29 октября 1999 г.), WO 98/07697 (опубликованном 26 февраля 1998 г.),WO 98/03516 (опубликованном 29 января 1998 г.), WO 98/34918 (опубликованном 13 августа 1998 г.),WO 98/34915 (опубликованном 13 августа 1998 г.), WO 98/33768 (опубликованном 6 августа 1998 г.),WO 98/30566 (опубликованном 16 июля 1998 г.), европейской патентной заявке 606046 (опубликованной 13 июля 1994 г.), европейской патентной заявке 931788 (опубликованной 28 июля 1999 г.),WO 90/05719 (опубликованном 31 мая 1990 г.), WO 99/52910 (опубликованном 21 октября 1999 г.),WO 99/52889 (опубликованном 21 октября 1999 г.), WO 99/29667 (опубликованном 17 июня 1999 г.),PCT международной заявкеPCT/IB98/01113 (поданной 21 июля 1998 г.), европейской патентной заявке 99302232.1 (опубликованной 25 марта 1999 г.), патентной заявке Великобритании 9912961.1(поданной 3 июня 1999 г.), предварительной заявке США 60/148464 (поданной 12 августа 1999 г.),патенте США 5863949 (выданном 26 января 1999) г., патенте США 5861510 (выданном 19 января 1999 г.) и европейской патентной заявке 780386 (опубликованной 25 июня 1997 г.), все из которых включены в настоящее описание посредством ссылки во всей своей полноте. Предпочтительными ингибиторами MMP-2 и MMP-9 являются ингибиторы, которые обладают незначительной или отсутствием активности относительно ингибирования MMP-1. Более предпочтительно ингибиторами, которые селективно ингибируют MMP-2 и/или MMP-9 относительно другой матричной металлопротеиназы(протеиназ) (т.е. MMP-1, MMP-3, MMP-4, MMP-5, MMP-6, MMP-7, MMP-8, MMP-10,MMP-11, MMP-12 и MMP-13). Некоторыми конкретными примерами ингибиторов MMP, применимых в настоящем изобретении, являются AG-3340, RO 32-3555, RS 13-0830 и соединения, перечисленные в следующем списке: 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид(2R,3R)-1-[4-(4-фтор-2-метилбензилокси)бензолсульфонил]-3-гидрокси-3-метилпиперидин-2-карбоновой кислоты; 3-(4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовая кислота; 3-4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4 ил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-хлорфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид 3-эндо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты и гидроксиамид (R)-3-[4-(4-фторфенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты и фармацевтически приемлемые соли и сольваты указанных соединений. В настоящем изобретении можно также использовать другие антиангиогенезисные агенты, включая другие ингибиторы COX-II и другие ингибиторы MMP. Кроме того, соединения формулы (I) можно использовать вместе с ингибиторами передачи сигнала,такими как агенты, способные ингибировать ответы EGFR (рецепторов эпидермального фактора роста),такие как антитела EGFR, антитела EGF и молекулы, являющиеся ингибиторами EGFR; ингибиторамиVEGF (фактора роста сосудистого эндотелия) и ингибиторами рецептора erbB2, такими как органические молекулы, или антитела, связывающиеся с рецептором erbB2, например HERCEPTIN (Genentech, Inc.of South San Francisco, Calif., USA). Ингибиторы EGFR описаны, например, в WO 95/19970 (опубликованном 27 июля 1995),WO 98/14451 (опубликованном 9 апреля 1998 г.), WO 98/02434 (опубликованном 22 января 1998 г.) и патенте США 5747498 (выданном 5 мая 1998 г.), и такие вещества можно использовать в описанном здесь настоящем изобретении. Агенты, ингибирующие EGFR, включают в себя, но не ограничиваются, моноклональные антителаEGF (Seragen Inc. of Hopkinton, Mass). В настоящем изобретении можно использовать данные и другие агенты, ингибирующие EGFR. Ингибиторы VEGF также можно соединить с соединениями формулы (I). Ингибиторы VEGF описаны, например, в WO 99/24440 (опубликованном 20 мая 1999 г.),PCT международной заявке PCT/IB99/00797 (поданной 3 мая 1999 г.), в WO 95/21613 (опубликованном 17 августа 1995 г.), WO 99/61422 (опубликованном 2 декабря 1999 г.), патенте США 5834504 (выданном 10 ноября 1998 г.), WO 01/60814, WO 98/50356 (опубликованном 12 ноября 1998 г.), патенте США 5883113 (выданном 16 марта 1999 г.), патенте США 5886020 (выданном 23 марта 1999 г.), патенте США 5792783 (выданном 11 августа 1998 г.), WO 99/10349 (опубликованном 4 марта 1999 г.),WO 97/32856 (опубликованном 12 сентября 1997 г.), WO 97/22596 (опубликованном 26 июня 1997 г.),WO 98/54093 (опубликованном 3 декабря 1998 г.), WO 98/02438 (опубликованном 22 января 1998 г.),WO 99/16755 (опубликованном 8 апреля 1999 г.) и WO 98/02437 (опубликованном 22 января 1998 г.), все из которых включены в настоящее описание посредством ссылки во всей своей полноте. Другими примерами некоторых конкретных ингибиторов VEGF, применимых в настоящем изобретении, являются IM862 (Cytran Inc. Of Kirkland, Wash., USA), анти-VEGF моноклональное антителоGenentech, Inc. of South San Francisco, Calif.; и ангиозим, синтетический рибозим от Ribozyme (Boulder,Colo.) и Chiron (Emeryville, Calif.). В описанном здесь настоящем изобретении можно использовать данные и другие ингибиторы VEGF. Кроме того, с соединением формулы (I) можно соединить ингибиторы рецептора erbB2, такие какWoodlands, Tex., USA) и 2B-1 (Chiron), например, те из них, которые описаны в WO 98/02434 (опубликованном 22 января 1998 г.), WO 99/35146 (опубликованном 15 июля 1999 г.), WO 99/35132 (опубликованном 15 июля 1999 г.), WO 98/02437 (опубликованном 22 января 1998 г.), WO 97/13760 (опубликованном 17 апреля 1997 г.), WO 95/19970 (опубликованном 27 июля 1995 г.), патенте США 5587458 (выданном 24 декабря 1996 г.) и патенте США 5877305 (выданном 2 марта 1999 г.), все из которых включены в настоящее описание посредством ссылки во всей своей полноте. Кроме того, ингибиторы рецептора erbB2, применимые в настоящем изобретении, описаны в предварительной заявке США 60/117341, поданной 27 января 1999 г, и в предварительной заявке США 60/117346, поданной 27 января 1999 г., обе из которых включены в настоящее описание посредством ссылки во всей своей полноте.- 17016204 В соответствии с настоящим изобретением с соединениями формулы (I) можно использовать соединения и вещества ингибиторы рецептора erbB2, описанные в вышеупомянутых заявках PCT, патентах США и предварительных заявках США, а также другие соединения и вещества, которые ингибируют рецептор erbB2. Соединения формулы (I) можно также использовать с другими агентами, применимыми для лечения рака, включая, но не ограничиваясь, агенты, способные усиливать противоопухолевые иммунные ответы, такие как антитела CTLA4 (цитотоксический лимфоцитарный антиген 4), и другие агенты, способные блокировать CTLA4, и антипролиферативные агенты, такие как ингибиторы фамезилпротеинтрансферазы, например ингибиторы фамезилпротеинтрансферазы, описанные в ссылках, которые цитированы в разделе "Уровень техники" патента США 6258824 B1. Конкретные антителаCTLA4, которые можно использовать в настоящем изобретении, включают антитела, описанные в предварительной заявке США 60/113647 (поданной 23 декабря 1998 г.), которая включена здесь ссылкой во всей своей полноте, однако в настоящем изобретении можно использовать другие антитела CTLA4. Кроме того, настоящий способ можно осуществлять в сочетании с лучевой терапией, при которой количество соединения формулы (I) в сочетании с лучевой терапией эффективно для лечения указанных выше заболеваний. В случае введения в сочетании с соединениями предпочтительных вариантов осуществления настоящего изобретения уровень применяемой лучевой терапии можно снизить до недостаточно эффективной дозы. Методы введения лучевой терапии известны в данной области, и данные методы можно использовать в описанной здесь комбинационной терапии. Введение соединения изобретения в данной комбинационной терапии можно определить в соответствии с описанным здесь. Цель следующего аспекта данного изобретения заключается в использовании соединения формулы(I) для получения лекарственного средства, которое применимо для лечения заболевания, опосредуемого аномальной активностью Met киназы. Указания Для осуществления на практике настоящего изобретения не требуется точного знания механизма,по которому соединения изобретения, в частности соединения, генерируемые in vivo из соединений изобретения, ингибируют c-Met. Однако, не будучи таким образом связанными с каким-либо конкретным механизмом или теорией, предполагают, что данные соединения взаимодействуют с аминокислотами в каталитической области c-Met. Таким образом, описанные здесь соединения могут найти применение вin vitro анализах на c-Met, а также проявлять терапевтические эффекты in vivo путем взаимодействия сc-Met. В следующем аспекте данное изобретение относится к способу лечения или предупреждения c-Metсвязанного нарушения за счет введения в организм терапевтически эффективного количества соединения данного изобретения или его соли. Кроме того, аспектом данного изобретения является то, что фармацевтическую композицию, содержащую соединение данного изобретения или его соль, вводят в организм в целях лечения или предупреждения c-Met-связанного нарушения. Следовательно, целью данного изобретения являются соединения, которые модулируют передачу сигнала PK за счет воздействия на ферментную активность c-Met, препятствуя, таким образом, сигналу,переданному c-Met. Более конкретно, целью настоящего изобретения являются соединения, которые модулируют пути передачи сигнала, опосредуемого c-Met, в качестве терапевтического подхода к лечению многих описанных здесь типов рака. Следующий аспект данного изобретения составляет способ идентификации соединения, модулирующего каталитическую активность c-Met. Данный способ включает контактирование клеток, экспрессирующих c-Met, с соединением данного изобретения (или его солью), и наблюдение за данными клетками на предмет какого-либо эффекта, оказываемого на них соединением. Альтернативным образом,данный способ может включать контакт самого белка c-Met (т.е. не в клетке) с химическим соединением предпочтительных вариантов осуществления настоящего изобретения, и наблюдение за данным белком на предмет какого-либо эффекта, оказываемого на него соединением. Этот эффект можно наблюдать либо невооруженным глазом, либо при использовании аппаратуры. Этот эффект может представлять собой, например, изменение или отсутствие изменения фенотипа клетки. Наблюдаемое изменение или отсутствие изменения фенотипа клетки, например, может представлять собой, без ограничения, изменение или отсутствие изменения каталитической активности c-Met в клетках или изменение или отсутствие изменения во взаимодействии c-Met с естественным партнером по связыванию. Фармацевтические композиции и применение Соединение настоящего изобретения или его физиологически приемлемую соль можно вводить как таковую пациенту-человеку или можно вводить в составе фармацевтической композиции, в которой указанные выше вещества смешивают с подходящими носителями или эксципиентом(ами). Методики изготовления препаратов и введения лекарственных средств можно найти в "Remington's Pharmacological- 18016204 Способы введения Подходящие способы введения могут включать, без ограничения, пероральное, внутриротовое, ректальное, трансмукозное, или введение в кишечник, или внутримышечное, накожное, парентеральное,подкожное, чрескожное, внутримозговое, интратекальное, непосредственное внутрижелудочковое, внутривенное, введение в стекловидное тело, внутрибрюшинное, интраназальное, внутримышечное, интрадуральное, введение через дыхательные пути, назальную ингаляцию или внутриглазные инъекции. Предпочтительными способами введения являются пероральный и парентеральный. Альтернативным образом, можно вводить соединение локальным, а не системным образом, например путем инъекции соединения непосредственно в солидную опухоль, часто в виде депо или препарата с продолжительным высвобождением. Кроме того, можно вводить лекарственное средство в виде целевой системы доставки лекарственного средства, например в виде липосомы, покрытой опухоль-специфическим антителом. Данные липосомы будут селективно нацеливаться и поглощаться опухолью. Композиция/препарат Фармацевтические композиции согласно настоящему изобретению можно изготовить способами,которые хорошо известны в данной области, например путем обычного смешивания, растворения, гранулирования, дражирования, растирания в порошок, эмульгирования, инкапсулирования, захвата, методами лиофилизации или распылительной сушки. Фармацевтические композиции для использования в способах настоящего изобретения можно получить любыми фармацевтическими способами, но все способы включают стадию приведения активного ингредиента в контакт с носителем, который составляет один или более необходимых ингредиентов. В частности, фармацевтические композиции для использования в соответствии с настоящим изобретением можно составить стандартным способом при использовании одного или более фармацевтически приемлемых носителей, включая эксципиенты и вспомогательные вещества, которые облегчают переработку активных соединений в препараты, пригодные для фармацевтического использования. Подходящий препарат зависит от выбранного способа введения. Дозированные формы включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы,пластыри, сиропы, эликсиры, гели, порошки, густые водные суспензии, таблетки для рассасывания, мази,кремы, пасты, пластыри, лосьоны, диски, суппозитории, назальные или оральные спреи, аэрозоли и т.д. Для инъекции из соединений изобретения можно получить препараты в виде водных растворов,предпочтительно в физиологически совместимых буферах, при этом подобные буферы содержат или не содержат поверхностно-активное вещество или сорастворитель в малой концентрации или физиологический солевой буфер. Для трансмукозного введения в препарате используют проникающие жидкости,подходящие для барьера, через который необходимо проникнуть. Как правило, такие проникающие жидкости известны в данной области. Для перорального введения из соединений можно получить препарат, соединяя активные соединения с фармацевтически приемлемыми носителями, которые хорошо известны в данной области. Подобные носители позволяют получать из соединений данного изобретения препараты в виде таблеток, пилюль, таблеток для рассасывания, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.д.,для перорального приема пациентом. Фармацевтические препараты для перорального использования можно получить при использовании твердого эксципиента, необязательного дробления полученной смеси и переработки смеси гранул, после добавления других подходящих вспомогательных веществ, при желании, с получением таблеток или ядер драже. Применимыми эксципиентами являются, в частности,наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит, препараты целлюлозы,например, такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал и картофельный крахмал, и другие вещества, такие как желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). При желании, можно добавить разрыхлители, такие как сшитый поливинилпирролидон, агар или альгиновая кислота. Кроме того, можно использовать соль, такую как альгинат натрия. Ядра драже предоставлены с соответствующими покрытиями. Для этой цели можно использовать концентрированные растворы сахара, которые необязательно могут содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопол, полиэтиленгликоль и/или диоксид титана, растворы для лакового покрытия и подходящие органические растворители или смеси растворителей. Для идентификации или для характеризации различных сочетаний доз активного соединения в таблетки или покрытия для драже можно добавить красители или пигменты. Фармацевтические композиции, которые можно использовать перорально, включают твердые капсулы, изготовленные из желатина, а также мягкие запаянные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Твердые капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующим веществом, таким как крахмал, и/или смазывающим веществом, таким как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин, жидкие полиэтиленгликоли, кремофор, капмул, моно-, ди- или- 19016204 триглицерилы со средней или длинной цепью. Кроме того, в данные препараты можно добавить стабилизаторы. Для введения путем ингаляции соединения для использования согласно настоящему изобретению обычно доставляют в виде распыляемого аэрозоля с использованием находящейся под давлением упаковки или распылителя и подходящего газа-вытеснителя, например, без ограничения, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана или диоксида углерода. В случае находящегося под давлением аэрозоля разовую дозу можно контролировать, установив клапан для подачи дозированного количества. Для использования в ингаляторе или инсуффляторе можно изготовить препараты в виде капсул и картриджей, например, из желатина, содержащие порошкообразную смесь соединения, и подходящего порошкообразного основания, такого как лактоза или крахмал. Кроме того, из соединений можно приготовить препараты для парентерального введения, например путем инъекции болюса, или непрерывного вливания. Препараты для инъекций могут быть представлены в виде разовой дозированной формы, например в виде ампул или многодозовых контейнеров с добавленным консервантом. Данные композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, или могут содержать такие вещества для приготовления лекарственной формы, как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические композиции для парентерального введения включают водные растворы водорастворимой формы активного соединения, такой, без ограничения, как соль. Кроме того, можно приготовить суспензии активных соединений в липофильном носителе. Подходящие липофильные носители включают жирные масла, такие как кунжутное масло, синтетические эфиры жирных кислот, такие как этилолеат и триглицериды, или такие вещества, как липосомы. Водные суспензии для инъекций могут содержать вещества,повышающие вязкость данной суспензии,такие как натрийкарбоксиметилцеллюлоза, сорбит или декстран. Необязательно, данная суспензия может также содержать подходящие стабилизаторы и/или агенты, повышающие растворимость соединений для возможности получения высококонцентрированных растворов. Альтернативным образом, активный ингредиент может иметь порошкообразную форму для соединения перед применением с подходящим носителем, например стерильной, не содержащей пирогенных веществ водой. Кроме того, соединения можно ввести в состав ректальных композиций, таких как суппозитории или удерживающие клизмы, при использовании, например, обычных основ для суппозиториев, таких как масло какао, или других глицеридов. Помимо описанных ранее препаратов, соединения можно также включить в состав препаратов депо. Подобные препараты длительного действия могут вводиться путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Из соединения данного изобретения можно получить препарат для такого способа введения с использованием подходящих полимерных или гидрофобных веществ (например, в виде эмульсии в фармакологически приемлемом масле), ионообменных смол или труднорастворимого производного, такого, без ограничения, как труднорастворимая соль. Неограничивающим примером фармацевтического носителя для гидрофобных соединений изобретения является система сорастворителей, включающая бензиловый спирт, неполярное поверхностноактивное вещество, смешивающийся с водой органический полимер и водную фазу, такую как система сорастворителей VPD. VPD представляет собой раствор 3% мас./об. бензилового спирта, 8% мас./об. неполярного поверхностно-активного вещества Polysorbate 80 и 65% мас./об. полиэтиленгликоля 300, доведенный до объема абсолютным этанолом. Система сорастворителей VPD (VPD:D5W) состоит из VPD,разбавленного 1:1 5%-ной декстрозой в водном растворе. Данная система сорастворителей хорошо растворяет гидрофобные соединения и сама дает низкую токсичность при систематическом введении. Естественно, доли такой системы сорастворителей могут существенно варьироваться, не нарушая характеристик ее растворимости и токсичности. Кроме того, может изменяться природа компонентов сорастворителей: например, вместо Polysorbate 80 можно использовать другие неполярные поверхностно-активные вещества с низкой токсичностью, можно изменять объем фракции полиэтиленгликоля, полиэтиленгликоль можно заменить другими биосовместимыми полимерами, например поливинилпирролидоном, и декстрозу можно заменить другими сахарами или полисахаридами. Альтернативным образом, можно использовать другие системы доставки гидрофобных фармацевтических соединений. Липосомы и эмульсии являются широко известными примерами средств доставки или носителей для гидрофобных лекарственных средств. Помимо этого, можно также использовать некоторые органические растворители, хотя часто ценой большей токсичности. Кроме того, соединения можно доставлять при использовании системы замедленного высвобождения, такой как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих терапевтический агент. Были созданы различные вещества замедленного высвобождения, и они хорошо известны специалистам в данной области. В зависимости от своей химической природы капсулы замедленного высвобождения могут высвобождать соединения в течение от нескольких недель до 100 дней. В зависимости от своей химической природы и биологической устойчивости терапевтического реагента можно использовать дополнительные стратегии для стабилизации белка.- 20016204 Описанные здесь фармацевтические композиции могут также содержать подходящие носители или экципиенты, состоящие из твердой или гелеобразной фазы. Примеры подобных носителей или эксципиентов включают, но не ограничиваются, карбонат кальция, фосфат кальция, различные сахара, крахмалы,производные целлюлозы, желатины и полимеры, такие как полиэтиленгликоли. Многие из PK модулирующих соединений данного изобретения могут быть предоставлены в виде физиологически приемлемых солей, в которых заявленное соединение может образовывать отрицательно или положительно заряженную частицу. Примеры солей, в которых соединение образует положительно заряженную частицу, включают, без ограничения, четвертичные аммониевые соли (определенные в настоящем описании в другом месте), такие как гидрохлорид, сульфат, карбонат, лактат, тартрат, малеат,сукцинат, малат, ацетат и метилсульфонат (CH3SO3), в которых атом азота четвертичной аммониевой группы представляет собой атом азота выбранного соединения данного изобретения, которое прореагировало с соответствующей кислотой. Соли, в которых заявленное соединение образует отрицательно заряженную частицу, включают, без ограничения, соли натрия, калия, кальция и магния, полученные реакцией группы карбоновой кислоты в данном соединении с соответствующим основанием (например,гидроксидом натрия (NaOH), гидроксидом калия (KOH), гидроксидом кальция (Ca(OH)2) и т.д.). Дозировки Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в количестве, достаточном для достижения намеченной цели, т.е. модулирования активности PK, или лечения, или предупреждения PKзависимого нарушения. Более конкретно, терапевтически эффективное количество означает количество соединения, эффективное для предупреждения, облегчения или улучшения симптомов заболевания или увеличения продолжительности жизни подвергаемого лечению субъекта. Определение терапевтически эффективного количества находится вполне в пределах компетенции специалистов в данной области, особенно в свете предоставленного здесь подробного описания. Для любого соединения, использованного в способах данного изобретения, терапевтически эффективное количество или дозу можно сначала оценить на основании анализов на клеточных культурах. Затем из данной дозы можно составить препарат для использования на животных моделях для того, чтобы достигнуть интервала циркулирующей концентрации, который включает IC50, определенную на клеточной культуре (т.е. концентрация тестируемого соединения, при которой достигается половина максимального ингибирования активности c-Met). После этого данную информацию можно использовать для более точного определения подходящих дозировок для людей. Токсичность и терапевтическую эффективность описанных здесь соединений можно определить при помощи стандартных фармацевтических методов на клеточных культурах или подопытных животных, например, определяя IC50 и LD50 (обе из которых обсуждаются в настоящем описании в другом месте) для рассматриваемого соединения. Данные, полученные на основании этих анализов на клеточных культурах и исследований на животных, можно использовать при составлении интервала дозировок для использования на людях. Эта доза может изменяться в зависимости от используемой дозированной формы и применяемого способа введения. Для точного состава способ введения и дозировку может выбрать отдельный врач, исходя из состояния пациента (см., например, Fingl, et al., 1975, в "The PharmacologicalBasis of Therapeutics", Ch. 1 p. 1). Объем и интервал дозировки можно регулировать индивидуально, чтобы обеспечить концентрации активных частиц в плазме крови, которых достаточно для поддержания модулирующих киназу эффектов. Данные концентрации в плазме крови называют минимальными эффективными концентрациями(MEC). MEC будет изменяться для каждого соединения, но ее можно оценить из in vitro данных, например концентрацию, необходимую для достижения 50-90%-ного ингибирования киназы, можно установить при помощи описанных здесь анализов. Дозы, необходимые для достижения MEC, будут зависеть от индивидуальных характеристик и способа введения. Для определения плазменных концентраций можно использовать ВЭЖХ анализы или биоанализы. Интервалы дозировок можно также определить при помощи значения MEC. Соединения следует вводить при использовании режима, при котором концентрации в плазме крови будут поддерживаться на уровне, превышающем MEC на 10-90% от данного времени, предпочтительно в интервале 30-90% и наиболее предпочтительно в интервале 50-90%. В настоящее время терапевтически эффективные количества соединений формулы (I) могут изменяться приблизительно от 10 до 1000 мг/м 2 в сутки, еще более предпочтительно от 25 до 500 мг/м 2. В случаях локального введения или селективного поглощения эффективная локальная концентрация лекарственного средства может не иметь отношения к плазменной концентрации, и для определения правильного объема дозы и интервала можно использовать другие методы, известные в данной области. Количество вводимой композиции, конечно, будет зависеть от подвергаемого лечению субъекта,тяжести заболевания, способа введения, мнения врача, прописывающего лекарство, и т.д.- 21016204 Упаковки При желании, композиции могут быть представлены в виде упаковки или дозирующего устройства,такого как одобренный FDA комплект, который может включать одну или более разовых дозированных форм, содержащих активный ингредиент. Упаковка, например, может включать металлическую или полимерную пленку, такую как блистерная упаковка. Упаковка или дозирующее устройство может сопровождаться инструкциями для введения. Кроме того, упаковка или дозирующее устройство может сопровождаться уведомлением, связанным с контейнером, в форме, предписанной государственным управлением, регламентирующим производство, использование или продажу лекарственных препаратов, при этом данное уведомление является отражением принятия данным управлением формы композиций или введения человеку или животным. Подобное уведомление, например, может представлять собой маркировку, принятую Управлением по контролю за продуктами и лекарствами США, для лекарств, отпускаемых по рецепту, или самого разрешенного продукта. Можно также приготовить композиции, содержащие соединение изобретения в составе препарата в совместимом носителе, помещенного в соответствующий контейнер, содержащий инструкцию для лечения указанного состояния. Подходящие состояния,указанные в инструкции, могут включать лечение опухоли, ингибирование ангиогенеза, лечение фиброза, диабета и т.д. Примеры Соединения настоящего изобретения можно получить согласно общим способам 1-39, описанным далее. Специалистам в данной области будет понятно, что следующие общие способы не являются ограничивающими данное изобретение. Можно изменять конкретные растворители, условия и реагенты и количества без нежелательных эффектов. Конкретные варианты осуществления настоящего изобретения суммированы в приведенных далее табл. 1 и 2. Примеры 174 и 175, а также примеры 176 и 177 представляют собой индивидуальные энантиомеры. Однако точное стереохимическое строение определено не было. Рентгеновская дифракция на порошке (PXRD). Данные PXRD получали согласно следующему протоколу. Образец (2 мг) помещали на предметное стекло микроскопа. Затем образец помещали в Discover D8 (Bruker AXS Instruments), снабженный детектором GADDS. В данной системе использовался медный источник рентгеновских лучей, установленный при 40 кВ и 40 мА для получения CU1 излучения при 1,5406 ангстрем. Данные получали в интервале от 4 до 40 2 при использовании двухрамочного отбора данных при 60,1 с/рамка. Дифракционные конусы обычно определяли с ошибкой 0,1 (2). Сокращения В настоящем изобретении приняты следующие обозначения и сокращения:DCM - дихлорометан (известный также как хлористый метилен); ДМФА - N,N-диметилформамид; ВЭЖХ - высокоэффективная жидкостная хроматография (известная также как жидкостная хроматография высокого давления);- 22016204 3-(метилсульфонилокси)азетидин-1-карбоксилат (0,047 г, 0,18 ммоль), смесь перемешивали в течение 24 ч, очищали препаративной ВЭЖХ, после лиофильной сушки получали твердое вещество, данное твердое вещество растворяли в DCM (2 мл), добавляли 4 н. HCl (2 мл) при комнатной температуре, перемешивали 6 ч, удаляли растворитель, остаток очищали препаративной ВЭЖХ, получая твердый 6-6-(1(азетидин-3-ил)-1H-пиразол-4-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин (25 мг) с выходом 34%. Способ 2. 6-6-(1H-Пиразол-4-ил)-[1,2,4]триазол[4,3-b][1,2,4]триазин-3-ил)метил)хинолин (0,05 г, 0,15 ммоль) и трет-бутил 4-(бромметил)пиперидин-1-карбоксилат (0,052 г, 0,18 ммоль) в ДМФА (2 мл) перемешивали, прибавляли Cs2CO3 (0,101 г, 0,3 ммоль), смесь перемешивали при комнатной температуре в течение 24 ч, по данным ЖХМС реакция завершалась, удаляли растворитель, остаток очищали препаративной ВЭЖХ, после лиофильной сушки получали твердое вещество, данное твердое вещество растворяли вDCM (2 мл), добавляли 4 н. HCl (1 мл) при комнатной температуре, перемешивали 6 ч, удаляли растворитель, остаток очищали препаративной ВЭЖХ, получая твердый 6-6-(1-(пиперидин-4-илметил)-1Hпиразол-4-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин (45 мг) с выходом 56,2%. Способ 3. 6-Бром-N2-(хинолин-6-илметил)пиразин-2,3-диамин. Смесь хинолин-6-илметанамина (13 г, 82 ммоль), 3,5-дибромпиразин-2-амина (21 г, 82 ммоль) и диизопропилэтиламина (16 мл, 89 ммоль) нагревали при 130C в течение 5 ч. Реакционную смесь разбавляли смесью хлористый метилен:этанол (9:1) и фильтровали полученную суспензию. Осадок последовательно промывали водой и эфиром и сушили на воздухе, получая 6-бром-N2-(хинолин-6 илметил)пиразин-2,3-диамин (13 г, 49%). Способ 4.(97 мл) при 6C прибавляли по каплям NaNO2 (4,0 г, 58 ммоль) в H2O (12 мл) в течение 15 мин. Спустя 1,5 ч прибавляли по каплям смесь 1:1 концентрированной серной кислоты и воды (6 мл). Через 1,5 ч прибавляли по каплям NaNO2 (0,5 г, 7 ммоль) в H2O (2 мл) и смесь 1:1 концентрированной серной кислоты и воды (5 мл). Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь повторно охлаждали на бане со льдом и в течение 1,5 ч прибавляли смесь 1:1 концентрированной серной кислоты и воды (30 мл) и NaNO2 (1,5 г, 22 ммоль) в H2O (5 мл). Прибавляли по каплям водный 3,75 М NaOH (210 мл) и фильтровали полученную суспензию. Осадок последовательно промывали водой и эфиром, затем суспендировали в смеси хлористый метилен:этанол (1:1) и фильтровали. Фильтрат последовательно промывали 1 М водным Na2CO3 и насыщенным раствором соли, сушили надNa2SO4, фильтровали и концентрировали на роторном испарителе, получая 6-6-бром-1H[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин (9,6 г, 58%).N-(2-(Диметиламино)этил)-N-метил-4-(3-хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5 ил)бензамид. К смеси 4-(3-хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)бензойной кислоты (75 мг,0,20 ммоль), N1,N1,N2-триметилэтан-1,2-диамина (22 мг, 0,22 ммоль) и триэтиламина (0,060 мл,0,43 ммоль) в ДМФА (2,0 мл) прибавляли HATU (82 мг, 0,22 ммоль). После перемешивания в течение 18 ч реакционную смесь распределяли между хлористым метиленом:этанолом (9:1) и водой. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе,получая 108 мг сырого вещества. Данное вещество очищали препаративной ВЭЖХ, получая 6-6-(2-Фторфенил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин. Смесь DME (3,0 мл) и 1 М водного Na2CO3 (0,88 мл) дегазировали барботированием аргона в течение 10 мин. Смесь переносили при помощи шприца в сосуд, содержащий 6-6-бром-1H[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин (100 мг, 0,29 ммоль), 2-фторфенилбороновую кислоту(45 мг, 0,32 ммоль) и Pd(dppf)2Cl2CH2Cl2 (6,2 мг, 0,01 ммоль). Сосуд закрывали и нагревали до 80C в течение 3,5 ч. Сырую реакционную смесь разбавляли хлористым метиленом, затем промывали водой. Хлористый метилен сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе. Остаток очищали колоночной хроматографией с использованием градиентного элюирования этилацетатом и хлористым метиленом,получая 6-6-(2-фторфенил)-1H-[1,2,3]триазол[4,5-b]пиразин-1 ил)метил)хинолин (77 мг, 74%). Способ 7. 6-6-(1H-Пиразол-4-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин. Смесь DME (3,0 мл) и 1 М водного CsF (0,88 мл) дегазировали барботированием аргона в течение 10 мин. Смесь переносили при помощи шприца в сосуд, содержащий 6-6-бром-1H-[1,2,3]триазол[4,5b]пиразин-1-ил)метил)хинолин (100 мг, 0,29 ммоль), трет-бутил 4-(4,4,5,5-тетраметил-1,2,3 диоксаборолан-2-ил)-1H-пиразол-1-карбоксилат (95 мг, 0,32 ммоль) и Pd(dppf)2Cl2CH2Cl2 (6,1 мг,0,01 ммоль). Сосуд закрывали и нагревали до 80C в течение 16 ч. К сырой реакционной смеси добавляли воду (5 мл) и фильтровали полученную суспензию. Осадок промывали содой и сушили на воздухе. Остаток очищали колоночной хроматографией с использованием градиентного элюирования метанолом и хлористым метиленом,получая 6-6-(1H-пиразол-4-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1 ил)метил)хинолин (60 мг, 62%).N-(Пиперидин-4-ил)-4-(3-хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)бензамид. К раствору трет-бутил 4-(4-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5 ил)бензамидо)пиперидин-1-карбоксилата (72 мг, 0,13 ммоль) в DCM (1,0 мл) прибавляли трифторуксусную кислоту (0,33 мл, 4,2 ммоль). Через 96 ч реакционную смесь концентрировали на роторном испарителе. Остаток очищали препаративной ВЭЖХ, получая N-(пиперидин-4-ил)-(4-(3-хинолин-6-илметил)3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)бензамид (7 мг, выход 25%). Способ 9. 6-6-(4-Метил-1H-имидазол-1-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин. Смесь 6-6-бром-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина (50 мг, 0,15 ммоль),4-метил-1H-имидазола (36 мг, 0,44 ммоль) и CsF (25 мг, 0,16 ммоль) в ацетонитриле (1,45 мл) нагревали в микроволновой печи при 160C в течение 20 мин. Реакционную смесь разбавляли водой (5 мл) и фильтровали полученную суспензию. Осадок промывали водой, а затем очищали колоночной хроматографией с использованием градиентного элюирования метанолом и хлористым метиленом, получая 6-6-(4 метил-1H-имидазол-1-ил)-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолин (28 мг, выход 56%). Способ 10. Стадия 1. Смесь 6-6-бром-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина (200 мг, 0,5862 ммоль),карбоната калия (243 мг, 1,76 ммоль) и (R)-трет-бутилпирролидин-3-илкарбамата (218 мг, 1,17 ммоль) в 2-пропаноле (6 мл) нагревали в микроволновой печи при 80C в течение 20 мин. Смесь оставляли остывать и выделяли твердое вещество фильтрованием, затем очищали флэш-хроматографией при элюировании смесью хлороформ/этилацетат (25-75%), получая желаемый продукт A (239 мг, 91%). Стадия 2. К раствору трет-бутил(1R)-3-(3-(хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5 ил)циклопентилкарбамата, А (100 мг, 0,224 ммоль) в хлористом метилене (2,2 мл) прибавляли хлористоводородную кислоту (4N в диоксане 560 мкл, 2,24 ммоль). После перемешивания при комнатной температуре в течение 6 ч реакционную смесь разбавляли хлористым метиленом и гасили насыщенным раствором гидрокарбоната натрия (5 мл). Органический слой отделяли и концентрировали, получая желаемый продукт В (65 мг, 84%). Способ 11.(1,5 мл) нагревали в микроволновой печи при 60C в течение 10 мин. Смесь фильтровали, а фильтрат концентрировали. Остаток очищали флэш-хроматографией при элюировании смесью хлороформ/7 н. аммиак в метаноле (0,1-3,5%), с последующей второй колонкой при элюировании смесью хлороформ/метанол (1-7%), получая желаемый продукт (21 мг, 36%). Раствор 6-6-бром-1H-[1,2,3]триазол[4,5-b]пиразин-1-ил)метил)хинолина (50 мг, 0,15 ммоль), гидрохлорида (4-аминометилфенил)бороновой кислоты (30 мг, 0,16 ммоль), 1 М карбоната натрия (601 мкл) в диметоксиметане (1,5 мл) дегазировали, чередуя вакуум и азот (3), затем добавляли Pd(PPh3)Cl2 и нагревали смесь до 80C в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры, прибавляли воду и перемешивали. Твердое вещество отфильтровывали, затем растворяли в хлористом метилене (20 мл), содержащем 5 капель ТФУ. Раствор концентрировали, а остаток очищали флэшхроматографией, при элюировании смесью хлороформ/7 н. аммиак в метаноле (0,5-7%), получая желаемый продукт (26 мг, 48%). Способ 13. В сосуд для микроволновой печи помещали 3,5-дибромпиразин-2-иламин (2,0 г, 7,9 ммоль), сольC-(2,3-дигидробензофуран-5-ил)метиламин, HCl (2,36 г, 12,7 ммоль), триэтиламин (2,22 мл, 15,8 ммоль) и н-BuOH (6 мл). Реакционную суспензию облучали при 170C в течение 3 ч, н-BuOH удаляли в вакууме. К сырой смеси добавляли EtOAc (20 мл) и промывали водой (20 мл). Водный слой снова экстрагировали(320 мл). Органический слой сушили над Na2SO4, концентрировали и очищали хроматографией на силикагеле со смесьюAcOH:H2O (8 мл:8 мл) прибавляли раствор NaNO2 (2,12 г, 31,2 ммоль) в воде (5 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, а затем нагревали при 65C в течение 16 ч. Растворители удаляли, а затем добавляли EtOAc (20 мл) и воду (20 мл). Водный слой экстрагировали EtOAc (320 мл). Объединенные экстракты сушили над Na2SO4, концентрировали и очищали хроматографией на силикагеле со смесью К раствору трет-бутилового эфира (R)-пирролидин-3-илкарбаминовой кислоты (37 мг, 0,165 ммоль) в безводном ДМФА (2 мл) прибавляли NaH (60% в масле, 7 мг, 0,18 ммоль). Раствор перемешивали при 23C в течение 15 мин. Прибавляли 6-бром-1-(2,3-дигидробензофуран-5-илметил)-1H-[1,2,3]триазол[4,5b]пиразин (50 мг, 0,15 ммоль) и облучали реакционную смесь микроволновым облучением при 100C в течение 30 мин. Добавляли воду (10 мл) и экстрагировали водный слой EtOAc (310 мл). Объединенные экстракты сушили над Na2SO4 и концентрировали, получая трет-бутиловый эфир (R)-1-[3-(2,3 дигидробензофуран-5-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил]пирролидин-3-илкарбаминовой кислоты (67 мг, выход 99%)(10 мл) прибавляли по каплям 4 М HCl/диоксан (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Органический слой декантировали, а сырой остаток очищали препаративной ВЭЖХ с обращенной фазой при элюировании смесью ацетонитрил-вода, содержащей 0,1% уксусной кислоты, получая 61 мг (R)-1-[3-(2,3-дигидробензофуран-5-илметил)-3H-[1,2,3]триазол[4,5b]пиразин-5-ил]пирролидин-3-иламина в виде ацетатной соли (выход 99%). Способ 17. К раствору 6-бром-1-(2,3-дигидробензофуран-5-илметил)-1H-[1,2,3]триазол[4,5-b]пиразина (50 мг,0,15 ммоль), 1-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1H-пиразола (34 мг, 0,165 ммоль) и карбоната натрия (48 мг, 0,45 ммоль) в смеси DME/вода (4 мл/1 мл), дегазированному при помощи N2,добавляли Pd(PPh3)2Cl2 (5 мг, 0,008 ммоль). Реакционный раствор снова дегазировали N2 и перемешивали в течение 16 ч при 80C. Реакционную смесь фильтровали через целит, концентрировали и очищали препаративной ВЭЖХ с обращенной фазой при элюировании смесью ацетонитрил-вода, содержащей 0,1% уксусной кислоты, получая 1-(2,3-дигидробензофуран-5-илметил)-6-(1-метил-1H-пиразол-4-ил)-1H[1,2,3]триазол[4,5-b]пиразин (12 мг, выход 24%). Способ 18. К суспензии 6-[6-(1H-пиразол-4-ил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина (50 мг,0,15 ммоль) и Cs2CO3 (50 мг, 0,15 ммоль) в ДМФА (2 мл) прибавляли 2,2-диметилоксиран. Реакционную смесь перемешивали при 80C в течение 16 ч. После этого реакционную смесь очищали препаративной ВЭЖХ с обращенной фазой при элюировании смесью ацетонитрил-вода, содержащей 0,1% уксусной кислоты, получая 2-метил-1-[4-(3-хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин-1-ил]пропан-2-ол Раствор 6-(6-бром-1H-[1,2,3]триазол[4,5-b]пиразин-1-илметил)хинолина (200 мг, 0,586 ммоль) в смеси MeOH (10 мл):AcOH (1 мл):EtOAc (1 мл) дегазировали азотом 3 раза. К данному раствору прибавляли Pd/C (20 мг). Через шприц прибавляли камеру, содержащую водород, и оставляли перемешиваться при комнатной температуре в течение 18 ч. Реакция не доходила до конца, и добавляли еще Pd/C (20 мг) и перемешивали в течение 18 ч при комнатной температуре. Реакция останавливалась, когда по данным ЖХМС соотношение составляло 1:1 (продукт:исходное вещество). Реакционную смесь фильтровали через целит и промывали EtOAc (50 мл). Профильтрованный раствор концентрировали и очищали колоночной хроматографией Biotage на силикагеле со смесью EtOAc:гексаны, получая 30 мг продукта 6-[1,2,3]триазол[4,5-b]пиразин-1-илметилхинолин (выход 20%).(47 мл) (дегазированного азотом 3 раза) прибавляли Pd(PPh3)2Cl2 (205 мг, 0,293 ммоль), CuI (167 мг,0,879 ммоль) и бутил-(1-этоксивинил)олово (5,9 мл, 17,59 ммоль). Реакционную смесь кипятили 4 ч до тех пор, пока данные ЖХМС не указывали на полное образование продукта. Реакционную смесь фильтровали через слой целита и промывали эфиром (100 мл). Данный раствор промывали водой (150 мл),сушили над Na2SO4 и концентрировали. Сырой продукт очищали колоночной хроматографией на силикагеле со смесью EtOAc:гексаны, получая 1,05 г продукта 6-[6-(1-этоксивинил)-[1,2,3]триазол[4,5b]пиразин-1-илметил]хинолин (выход 55%). Способ 21. К раствору 6-[6-(1-этоксивинил)-[1,2,3]триазол[4,5-b]пиразин-1-илметил]хинолина (1,0 г,3,00 ммоль) в ACN (50 мл) прибавляли по каплям 2N HCl. Реакционную смесь кипятили с обратным холодильником 1 ч, а затем нейтрализовывали NaHCO3. Раствор экстрагировали EtOAc (3100 мл), получая продукт 1-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)этанон (950 мг, выход 99%). Способ 22. К раствору 1-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)этанона (100 мг,0,33 ммоль) в ТГФ прибавляли MeMgBr (0,260 мл, 0,362 ммоль, 1,4 М в смеси толуол/ТГФ) при 0C. Реакционную смесь оставляли перемешиваться в течение 16 ч при комнатной температуре. Данные ЖХМС указывали на соотношение 1:1 (кетон:спирт), так что добавляли еще эквивалент MeMgBr и перемешивали реакционную смесь еще в течение 16 ч. Сырую реакционную смесь концентрировали и очищали C-18 препаративной ВЭЖХ с обращенной фазой при элюировании смесью ACN-H2O, содержащей 0,1% уксусной кислоты, получая 2-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пропан-2-ола (4 мг, выход 4%). Способ 23. К раствору 1-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)этанона (150 мг,0,493 ммоль) в MeOH (5 мл) прибавляли ацетат аммония (76 мг, 0,987 ммоль). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Прибавляли цианоборгидрид натрия (62 мг,0,987 ммоль) и нагревали реакционную смесь при 70C в течение 16 ч. Данные ЖХМС указывали на 1:1 соотношение спирта и амина. Реакционную смесь концентрировали и очищали C-18 препаративной ВЭЖХ с обращенной фазой при элюировании смесью ACN-H2O, содержащей 0,1% уксусной кислоты,получая 1-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)этанол (70 мг) и 1-(3-хинолин-6 илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)этиламин (20 мг). Суспензию метилового эфира 2-метил-2-[4-(3-хинолин-6-илметил)-3H-[1,2,3]триазол[4,5-b]пиразин 5-ил)пиразол-1-ил]пропионовой кислоты (50 мг, 0,116 ммоль) в гидроксиде аммония (2 мл) облучали при 100C в микроволновой печи в течение 30 мин, получая первичный амид и карбоновую кислоту (соотношение 1:1). Реакционную смесь концентрировали и очищали ВЭЖХ Dioxnex, получая 2-[4-(3 хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]изобутирамид (20 мг) и 2-метил 2-[4-(3-хинолин-6-илметил-3H-[1,2,3]триазол[4,5-b]пиразин-5-ил)пиразол-1-ил]пропионовую кислоту Рацемический 1-[1-(2,3-дигидробензо[1,4]диоксин-6-ил)этил]-6-(1-метил-1H-пиразол-4-ил)-1H[1,2,3]триазол[4,5-b]пиразин очищали на хиральной колонке (колонка Chiralpak Ia 4,6250 мм 5u) при элюировании 50% В сухом боксе в пробирку для микроволновой печи Personal Chemistry на 2,0 мл помещали следующее: одну трехгранную мешалку, раствор соответствующего гетерогалогенида в NMP (320 мкл,80 мкмоль, 1,0 экв., 0,25 М), соответствующий амин в NMP (640 мкл, 160 мкмоль, 2,0 экв., 0,25 М) и раствор TEA в NMP (240 мкл, 120 мкмоль, 1,5 экв., 0,5 М). Данную пробирку для микроволновой печи закрывали септумом и за пределами сухого бокса реакционные смеси нагревали в микроволновом синтезаторе Personal Chemistry в течение 15 мин при 80C в случае вторичных аминов и 45 мин при 80C в случае первичных аминов. Реакционные смеси переносили в пробирки 1075 мм. Пробирки для микроволновой печи промывали ДМФА (0,5 мл) и объединяли смыв ДМФА с первоначально перенесенным веществом. Растворители удаляли, а остатки повторно растворяли в ДМСО. Способ 27. Синтез N-2-[1-(хинолин-6-илметил)-1H-[1,2,3]триазол[4,5-b]пиразин-6-ил]глицинамида(3,0 мл) нагревали в микроволновой печи при 100C в течение 10 мин, затем при 120C в течение 10 мин. Реакционную смесь разбавляли хлористым метиленом и фильтровали. Осадок очищали флэшхроматографией с использованием системы очистки Horizon на колонке 12 М при элюировании смесью хлороформ/7 н. аммиак в метаноле (0,1-10%), получая указанное в заголовке соединение (20 мг, 20%).
МПК / Метки
МПК: A61K 31/5025, A61P 35/00, C07D 487/04
Метки: агентов, триазолпиразинов, применимые, качестве, противораковых, производные
Код ссылки
<a href="https://eas.patents.su/30-16204-proizvodnye-triazolpirazinov-primenimye-v-kachestve-protivorakovyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазолпиразинов, применимые в качестве противораковых агентов</a>
Предыдущий патент: Производные амина
Следующий патент: Дисперсия полимерной добавки для нефти, способ ее получения и применение
Случайный патент: Средство для регулирования йодного обмена или профилактики йоддефицитных состояний












