Производные амина
Номер патента: 16203
Опубликовано: 30.03.2012
Авторы: Джеймс Ким, Прайс Дэвид Энтони, Джоунз Лин Ховард
Формула / Реферат
1. Соединение общей формулы (1)
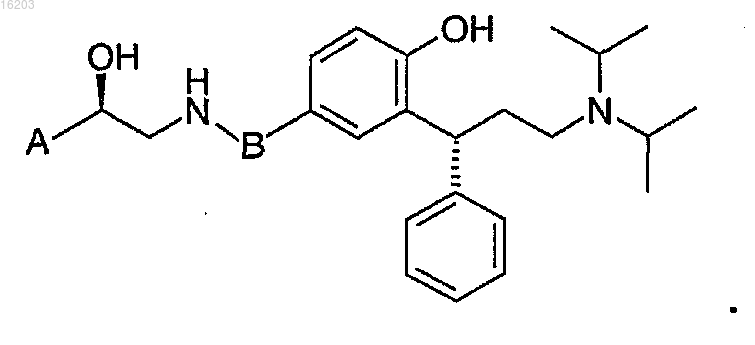
в которой А выбирают из

где * представляет собой точку присоединения А к углероду, замещенному гидрокси;
В выбирают из:
1) **-(СН2)2-(CH2)m-X1-(СН2)n-***, где X1 представляет собой О или S, m равно целому числу от 0 до 9, n равно целому числу от 0 до 9, n+m равно от 4 до 9 включительно;
2) С6-С12-алкилена, необязательно замещенного одним или двумя С1-С4-алкилами;
3) группы формулы
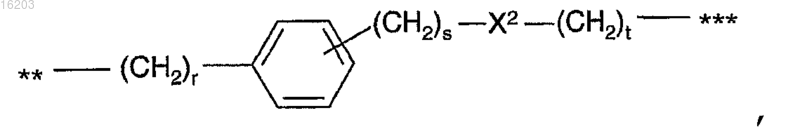
в которой X2 представляет собой О или S, r равно целому числу от 2 до 7, s равно целому числу от 0 до 6, t равно целому числу от 0 до 6, s+t равно от 1 до 6 включительно, r+s+t равно от 3 до 8 включительно; и
4) группы формулы
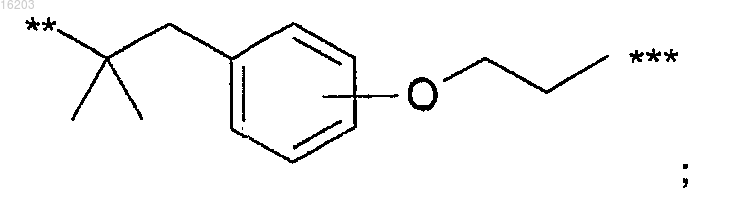
где ** представляет собой точку присоединения В к смежной NH-группе, *** представляет собой точку присоединения В к смежной фенильной группе;
и его четвертичные аммониевые соли или, если целесообразно, его фармацевтически приемлемые соли и/или изомеры, таутомеры, сольваты или меченные изотопами варианты.
2. Соединение по п.1, в котором В представляет собой С6-С12-алкилен.
3. Соединение по п.2, в котором В выбирают из (CH2)8, (СН2)9 или (СН2)10.
4. Соединение по п.1, в котором В представляет собой (CH2)2-(CH2)m-X1-(CH2)n.
5. Соединение по п.4, в котором X1 представляет собой О.
6. Соединение по п.5, в котором В выбирают из (СН2)6-O-(СН2)3, (СН2)6-O-(СН2)4 и (СН2)7-O-.
7. Соединение по п.1, в котором В представляет собой группу формулы
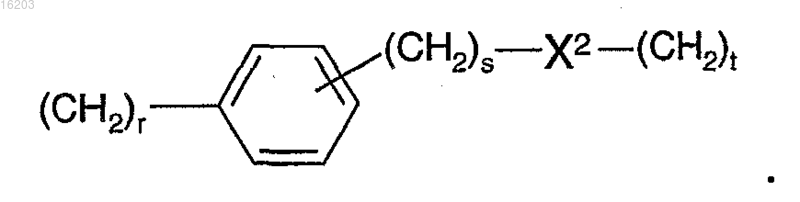
8. Соединение по п.7, в котором X2 представляет собой О.
9. Соединение по п.8, в котором В выбирают из
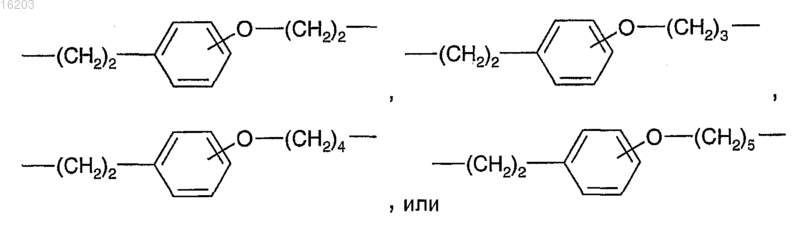
10. Соединение по п.9, в котором В выбирают из
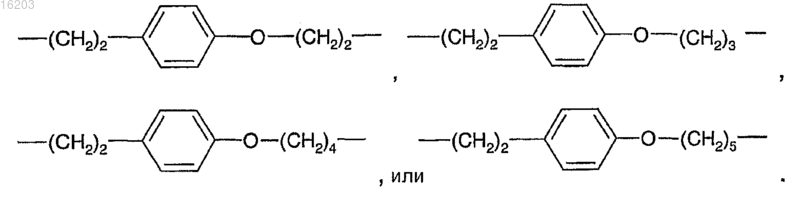
11. Соединение по п.1, в котором В имеет формулу
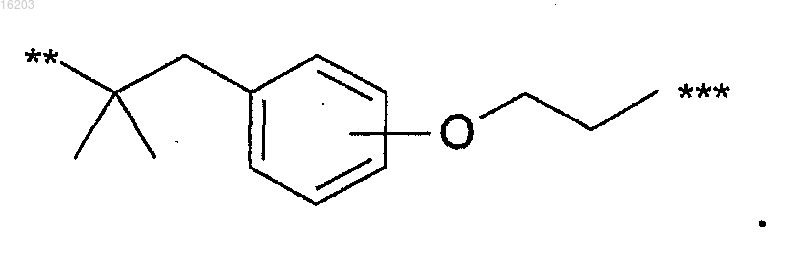
12. Соединение по п.11, в котором В имеет формулу
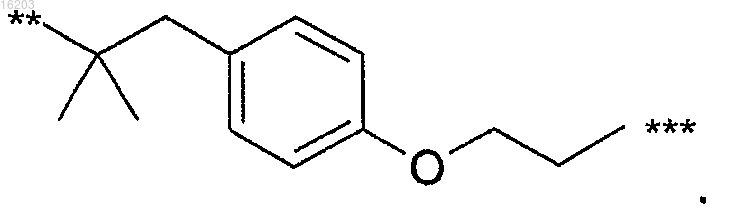
13. Соединение по любому из пп.1-12, в котором А имеет формулу
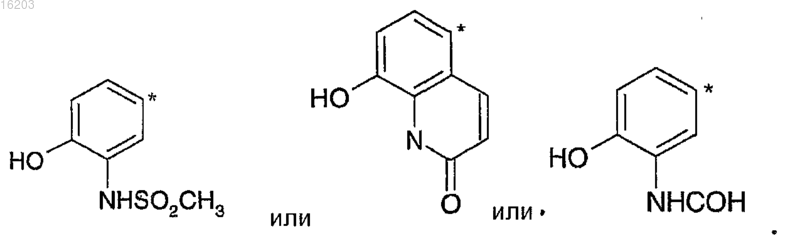
14. Соединение по п.1, выбранное из группы, состоящей из
N-(5-{(1R)-2-[(10-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}децил)амино]-1-гидроксиэтил}-2-гидроксифенил)метансульфонамида;
N-{5-[(1R)-2-({2-[4-(3-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}пропокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}метансульфонамида;
N-{5-[(1R)-2-({2-[4-(4-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}бутокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}метансульфонамида;
N-(5-{(1R)-2-[(7-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенокси}гептил)амино]-1-гидроксиэтил}-2-гидроксифенил)метансульфонамида;
N-{5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}метансульфонамида;
N-{5-[(1R)-2-{[6-(4-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}бутокси)гексил]амино}-1-гидроксиэтил]-2-гидроксифенил}метансульфонамида;
N-{5-[(1R)-2-({2-[4-(4-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}бутокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}формамида;
5-[(1R)-2-({2-[4-(4-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}бутокси)фенил]этил}амино)-1-гидроксиэтил]-8-гидроксихинолин-2(1Н)-она;
5-[(1R)-1-{гидрокси}-2-({2-[4-(4-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}бутокси)фенил]этил}амино)этил]бензол-1,3-диола;
N-{5-[(1R)-2-({2-[3-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}метансульфонамида;
2-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-(2-{3-[2-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)этил]фенокси}этил)фенола;
5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]бензол-1,3-диола;
N-{5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}формамида;
5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]-8-гидроксихинолин-2(1Н)-она;
2-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-(2-{4-[2-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)этил]фенокси}этил)фенола;
N-(5-{(1R)-2-[(8-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}октил)амино]-1-гидроксиэтил}-2-гидроксифенил)метансульфонамида;
N-(5-{(1R)-2-[(2-{4-[(5-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}пентил)окси]фенил}этил)амино]-1-гидроксиэтил}-2-гидроксифенил)метансульфонамида;
2-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-(4-{4-[2-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)этил]фенокси}бутил)фенола;
N-{5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}метансульфонамида сукцината;
5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]-11-диметилэтил}амино)-1-гидроксиэтил]-8-гидроксихинолин-2(1Н)-она;
и его четвертичные аммониевые соли или, если целесообразно, его фармацевтически приемлемые соли и/или изомеры, таутомеры, сольваты или меченные изотопами варианты.
15. Четвертичная аммониевая соль соединения по п.1, причем упомянутая четвертичная аммониевая соль имеет формулу
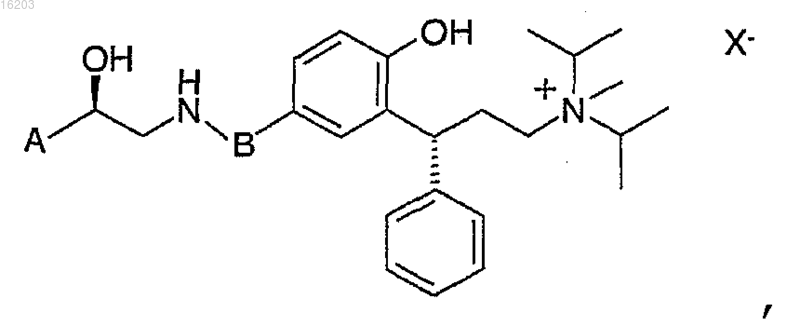
в которой X представляет собой ацетат, фумарат, мезилат, бромид, хлорид, сульфат, D- и L-тартрат или ксинафоат.
16. Четвертичная аммониевая соль соединения по п.1, причем упомянутая четвертичная аммониевая соль имеет формулу
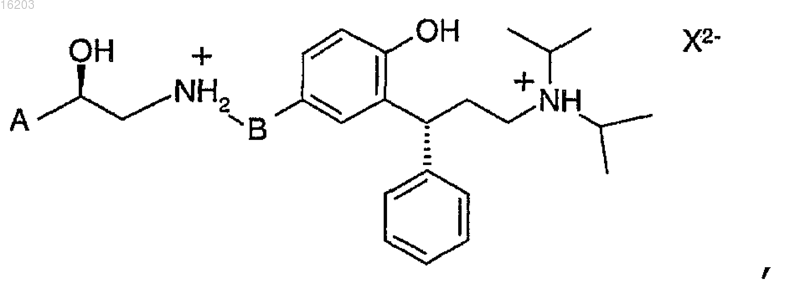
в которой X представляет собой сукцинат.
17. Соединение по п.1, которое представляет собой N-{5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}метансульфонамид и его четвертичные аммониевые соли или, если целесообразно, его фармацевтически приемлемые соли и/или изомеры, таутомеры, сольваты или меченные изотопами варианты.
18. Соединение по п.17, которое представляет собой N-{5-[(1R)-2-({2-[4-(2-{3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенил}этокси)фенил]этил}амино)-1-гидроксиэтил]-2-гидроксифенил}метансульфонамида сукцинат и его четвертичные аммониевые соли или, если целесообразно, его фармацевтически приемлемые соли и/или изомеры, таутомеры, сольваты или меченные изотопами варианты.
19. Фармацевтическая композиция, содержащая, по меньшей мере, эффективное количество соединения формулы (1), описанного в любом из пп.1-18, или его фармацевтически приемлемую соль или производную форму.
20. Фармацевтическая композиция по п.19, дополнительно содержащая один или несколько фармацевтически приемлемых наполнителей и/или добавок.
21. Применение соединения формулы (1) по любому из пп.1-18 или его фармацевтически приемлемой соли, производной формы или композиции в качестве лекарственного средства.
22. Применение соединения формулы (1) по любому из пп.1-18 или его фармацевтически приемлемой соли, производной формы или композиции для лечения заболеваний, нарушений или состояний, в которые вовлечены β2- и М3-рецепторы.
23. Применение соединения формулы (1) по любому из пп.1-18 или его фармацевтически приемлемой соли, производной формы или композиции для лечения заболеваний, нарушений или состояний, выбранных из группы, состоящей из
астмы любого типа, этиологии и патогенеза, включая атопическую астму, неатопическую астму, аллергическую астму, атопическую бронхиальную IgE-опосредованную астму, бронхиальную астму, эссенциальную астму, истинную астму, наследственную астму, обусловленную патофизиологическими нарушениями, приобретенную астму, обусловленную факторами окружающей среды, эссенциальную астму неизвестной или скрытой причины, неатопическую астму, астму, ускоренную бронхитом, эмфизематозную астму, астму, индуцированную физической нагрузкой, аллерген-индуцированную астму, астму, индуцированную холодным воздухом, профессиональную астму, инфекционную астму, обусловленную бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергическую астму, предастму, синдром стерторозного дыхания у детей и бронхиолита;
хронического или острого бронхостеноза, хронического бронхита, обструкции малых дыхательных путей и эмфиземы;
обструктивных или воспалительных заболеваний дыхательных путей любого типа, этиологии и патогенеза, включая хроническую эозинофильную пневмонию, хроническую обструктивную болезнь легких (ХОБЛ), ХОБЛ, которая включает хронический бронхит, эмфизему легких или одышку, ассоциированную или неассоциированную с ХОБЛ, ХОБЛ, которая характеризуется необратимой, прогрессирующей обструкцией дыхательных путей, респираторный дистресс-синдром взрослых (ARDS), обострения гиперактивности дыхательных путей вследствие другой терапии и заболевание дыхательных путей, ассоциированного с легочной гипертензией;
бронхита любого типа, патологии или патогенеза, включая острый бронхит, острый ларинготрахеальный бронхит, арахидный бронхит, катаральный бронхит, крупозный бронхит, сухой бронхит, инфекционный астматический бронхит, продуктивный бронхит, стафилококковый или стрептококковый бронхит и везикулярный бронхит;
острого поражения легкого;
бронхоэктаза любого типа, патологии или патогенеза, включая цилиндрический бронхоэктаз, мешотчатый бронхоэктаз, веретенообразный бронхоэктаз, капиллярный бронхоэктаз, кистозный бронхоэктаз, сухой бронхоэктаз и фолликулярный бронхоэктаз.
24. Применение соединения формулы (1) по любому одному из пп.1-18 или его фармацевтически приемлемой соли, производной формы или композиции для производства лекарственного средства, обладающего как β2-агонистической, так и М3-антагонистической активностью.
25. Применение соединения формулы (1) по любому одному из пп.1-18 или его фармацевтически приемлемой соли, производной формы или композиции для производства лекарственного средства для лечения заболеваний, нарушений или состояний, выбранных из группы, описанной в п.23.
26. Способ лечения млекопитающего, включая человека, включающий лечение упомянутого млекопитающего эффективным количеством соединения формулы (1), описанного в любом из пп.1-18, или его фармацевтически приемлемой соли, производной формы или композиции.
27. Способ по п.26, где заболевание, нарушение или состояние выбирают из группы, описанной в п.23.
28. Сочетание соединения по любому из пп.1-18 с другим терапевтическим средством(вами), выбранным из:
a) ингибиторов 5-липоксигеназы (5-L0) или антагонистов белка-активатора 5-липоксигеназы (FLAP);
b) антагонистов лейкотриенов (LTRAs), включая антагонисты LTB4, LTC4, LTD4 и LTE4;
c) антагонистов гистаминовых рецепторов, включая антагонисты H1 и Н3;
d) сосудосуживающих симпатомиметиков для уменьшения застойных явлений, являющихся агонистами α1- и α2-адренорецепторов;
e) ингибиторов PDE, включая ингибиторы PDE3, PDE4 и PDE5;
f) теофиллина;
g) кромгликата натрия;
h) ингибиторов СОХ как неселективных, так и селективных ингибиторов СОХ-1 или СОХ-2 (NSAIDs);
i) антагонистов простагландиновых рецепторов и ингибиторов простагландинсинтазы;
j) пероральных и ингалируемых глюкокортикостероидов;
k) диссоциированных агонистов кортикоидного рецептора (DAGR);
l) моноклональных антител против эндогенных воспалительных объектов;
m) средств против фактора некроза опухоли (анти-TNF-α);
n) ингибиторов молекул адгезии, включая антагонисты VLA-4;
о) антагонистов кинин-B1- и B2-рецепторов;
р) иммуносупрессивных средств, включая ингибиторы IgE пути и циклоспорин;
q) ингибиторов матриксных металлопротеаз (MMPs);
r) антагонистов тахикининовых NK1-, NK2- и NK3-рецепторов;
s) ингибиторов протеаз, включая ингибиторы эластазы;
t) агонистов аденозинового А2а-рецептора и антагонистов аденозинового А2b-рецептора;
u) ингибиторов урокиназы;
v) соединений, воздействующих на дофаминовые рецепторы, таких как агонисты D2-рецептора;
w) модуляторов NFkβ пути, включая ингибиторы IKK;
х) модуляторов цитокиновых сигнальных путей, включая р38 МАР-киназа, PI3-киназа, JAK-киназа, syk-киназа, EGFR или MK-2;
у) средств, которые можно классифицировать как муколитические и противокашлевые средства;
z) средств, которые усиливают ответ на ингалируемые кортикостероиды;
аа) антибиотиков и противовирусных средств, эффективных в отношении микроорганизмов, которые населяют дыхательные пути;
bb) ингибиторов HDAC;
cc) антагонистов CXCR2;
dd) антагонистов интегринов;
ее) хемокинов;
ff) блокаторов натриевого канала эпителия (ENaC) или ингибиторов натриевого канала эпителия (ENaC);
gg) агонистов P2Y2 и других агонистов нуклеотидного рецептора;
hh) ингибиторов тромбоксана;
ii) ниацина и
jj) факторов адгезии, включая VLAM, ICAM и ELAM.
29. Соединение формул

где значение В определено в п.1;
Ra представляет собой водород или подходящую гидроксизащитную группу;
Rb и Rc представляют собой любые заместители, подходящие для того, чтобы связи между атомом N и Rb и между атомом N и Rc могли легко расщепляться с получением соответствующего амина;
В2 выбирают из
СН2-(СН2)m-X1-(CH2)n1, где X1 представляет собой О или S, m равно целому числу от 0 до 9, n1 равно целому числу от 1 до 7, n1+m равно от 2 до 7 включительно;
С3-С9-алкилена, необязательно замещенного одним или двумя С1-С4-алкилами; или
группы формулы
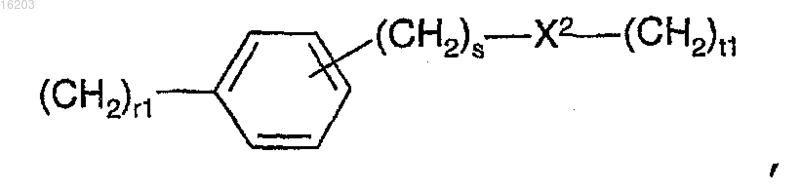
в которой X2 представляет собой О или S, r1 равно целому числу от 1 до 6, s равно целому числу от 0 до 6, t1 равно целому числу от 1 до 4, s+t1 равно от 1 до 4 включительно, r1+s+t1 равно от 2 до 5 включительно.
Текст
Настоящее изобретение относится к соединениям общей формулы (1) и к способам получения таких производных, промежуточным соединениям, используемым для получения таких производных, содержащим такие производные композициям и к применениям таких производных. Соединения по настоящему изобретению применимы при лечении многочисленных заболеваний, нарушений и состояний, в частности воспалительных,аллергических и респираторных заболеваний, нарушений и состояний. 016203 Настоящее изобретение относится к соединениям общей формулы (1) в которой значения А и В указаны ниже, и к способам получения и промежуточным соединениям для получения таких производных, к содержащим такие производные композициям и к их применениям. 2-адренергические агонисты и холинергические мускариновые антагонисты являются общепринятыми терапевтическими средствами для лечения обструктивных легочных заболеваний, таких как ХОБЛ и астма. Используемые в настоящее время ингалируемые 2-агонисты включают средства короткого действия, такие как сальбутамол (4 раза в сутки) и тербуталин (3 раза в сутки), и средства длительного действия, такие как сальметерол и формотерол (2 раза в сутки), и вызывают расширение бронхов посредством стимуляции адренергических рецепторов гладкой мускулатуры дыхательных путей. Используемые в клинической практике мускариновые антагонисты включают кратковременно действующие ипратропия бромид (4 раза в сутки), окситропия бромид (4 раза в сутки) и продолжительно действующий тиотропий(1 раз в сутки). Мускариновые антагонисты вызывают расширение бронхов путем подавления холинергического тонуса дыхательных путей, преимущественно путем противодействия воздействию ацетилхолина на мускариновые рецепторы гладкой мускулатуры дыхательных путей. В целом ряде опубликованных исследований было показано, что сочетанное введение ингалируемых 2-агонистов и ингалируемых мускариновых антагонистов (короткого или длительного действия) пациентам с обструктивным легочным заболеванием приводит к более выраженным улучшениям в деятельности легких, симптомах и качестве жизни по сравнению с пациентами, получающими средство только одного класса. До настоящего времени исследования ограничивались изучением сочетаний отдельно взятых фармацевтических средств, притом что было бы желательным сочетание фармакологического действия обеих групп внутри одной молекулы, поскольку это может обеспечить отдельно взятые средства с большей бронхолитической эффективностью со сходным терапевтическим индексом или сходной эффективностью с лучшим терапевтическим индексом. Кроме того, сочетание фармакологического действия обеих групп внутри одной молекулы предоставило бы потенциал для сочетанного применения с противовоспалительными средствами, обеспечивая тем самым тройную терапию с использованием одного ингалятора. Настоящее изобретение относится к соединениям общей формулы (1) гдепредставляет собой точку присоединения А к углероду, замещенному гидрокси; В выбирают из: 1) -(СН 2)2-(CH2)m-X1-(СН 2)n-, где X1 представляет собой О или S, m равно целому числу от 0 до 9, n равно целому числу от 0 до 9, n+m равно от 4 до 9 включительно; 2) С 6-С 12-алкилена, необязательно замещенного одним или двумя С 1-С 4-алкилами; 3) группы формулы в которой X2 представляет собой О или S, r равно целому числу от 2 до 7, s равно целому числу от 0 до 6,t равно целому числу от 0 до 6, s+t равно от 1 до 6 включительно, r+s+t равно от 3 до 8 включительно; и гдепредставляет собой точку присоединения В к смежной NH-группе,представляет собой точку присоединения В к смежной фенильной группе; и их четвертичным аммониевым солям или, если целесообразно, к их фармацевтически приемлемым солям и/или изомерам, таутомерам, сольватам или меченным изотопами вариантам. Соединения формулы (1) являются агонистами 2-адренергического рецептора и антагонистами мускаринового рецептора, которые особенно применимы для лечения заболеваний и/или состояний с вовлечением упомянутых рецепторов и обладают высокой эффективностью, в частности, при введении ингаляционным путем. Соединения формулы (1) могут быть получены с использованием традиционных методик, таких как следующие иллюстративные способы, в которых значения А и В определены выше для соединений формулы (1), если иное не указано особо. Производное амина формулы (1) может быть получено путем осуществления взаимодействия амина формулы (2) в которой Ra представляет собой водород или подходящую гидроксизащитную группу, предпочтительно бензил,с бромидом формулы (3) в которой значение А определено выше для соединений формулы (1). Предпочтительно гидроксигруппы А защищены подходящими гидроксизащитными группами. Предпочтительная гидроксизащитная группа представляет собой бензил. В типичной методике осуществляют взаимодействие амина формулы (2) с бромидом формулы (3) необязательно в присутствии растворителя или смеси растворителей (например, диметилсульфоксида,толуола, N,N-диметилформамида, пропионитрила, ацетонитрила), необязательно в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия, гидрокарбоната натрия) при температуре от 80 до 120 С в течение 12-48 ч. Затем защитные группы могут быть удалены с использованием стандартной методологии для расщепления защитных групп для кислорода, таких как представленные в учебнике Т.W. Greene, Protective Groups in Organic Synthesis,A. Wiley-Interscience Publication, 1981. Бромиды формулы (3) могут быть получены в соответствии со способами по WO 2005/080324,US 2005/222128, WO 2004/032921, US 2005/215590, WO 2005/092861.-2 016203 Амин формулы (2) может быть получен из соответствующего защищенного амина формулы (4) в которой Rb и Rc представляют собой любые заместители, подходящие для того, чтобы связи между атомом N и Rb и между атомом N и Rc могли легко расщепляться с получением свободного амина формулы (2) с использованием стандартной методологии для расщепления защитных групп для азота, такой как представленная в учебнике Т.W. Greene, Protective Groups in Organic Synthesis, A. Wiley-IntersciencePublication, 1981. Например, Rb и Rc могут быть выбраны из аллила, бензила, трет-бутилкарбамата, или при связывании вместе могут образовывать фталимид. Предпочтительно Rb и Rc, оба, представляют собой трет-бутилкарбамат или Rb представляет собой Н и Rc представляет собой трет-бутилкарбамат. Амин формулы (4), в которой Ra представляет собой бензил и В выбирают из (СН 2)2-(СН 2)m-X1(СН 2)n, где n равно 0, значения m и X1 определены, как для соединений формулы (1) или группы формулы в которой t равно 0 и значения r, s и X2 определены, как для соединений формулы (1); может быть получен путем осуществления взаимодействия соединения формулы (5) В типичной методике спиртовое соединение формулы (6) сначала преобразуют в галогенид (например, бромид, хлорид, йодид) или сульфонат (например, мезилат) с использованием стандартных методик(например, трифенилфосфин/йод; трифенилфосфин/четырехбромистый углерод; тионилхлорид; метасульфонилхлорид/триэтиламин) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, дихлорметана, толуола, N,N-диметилформамида, пропионитрила, ацетонитрила). Затем осуществляют взаимодействие этого продукта с соединением формулы (5) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, толуола, N,N-диметилформамида, ацетонитрила, тетрагидрофурана), необязательно в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия, гидрокарбоната натрия) при температуре от 60 до 120 С в течение 4-48 ч. В качестве альтернативы может быть применена схема по Мицунобу (например, диэтилазодикарбоксилат/трифенилфосфин) в присутствии растворителя или смеси растворителей (например, толуола,ацетонитрила, тетрагидрофурана) при температуре от 25 до 60 С в течение 2-4 ч.-3 016203 Соединение формулы (5), в которой X3 представляет собой О, может быть получено из альдегида формулы (7) В типичной методике альдегид (7) обрабатывают окислителем (например, перекисью водорода; мета-хлорпербензойной кислотой) в присутствии растворителя или смеси растворителей (например, метанола, воды, ацетонитрила) в присутствии кислоты (например, серной кислоты) при температуре от 25 до 60 С в течение 6-24 ч. Альдегид формулы (7) может быть получен в соответствии со способом по WO 2005/012227. Соединение формулы (5), в которой X3 представляет собой S, может быть получено из галогенида формулы (13) В типичной методике осуществляют взаимодействие упомянутого галогенида (13) с триизопропилсилантиолом в присутствии подходящего палладиевого катализатора (например, ацетат палладия/триортотолилфосфин формулы Pd(OAc)2/P(o-Tol)32) в присутствии растворителя или смеси растворителей(например, толуола, ацетонитрила, гексана) в присутствии основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната натрия). Предпочтительно взаимодействие осуществляют при температуре от 70 до 110 С в течение 4-16 ч. С полученного в виде продукта силилтиоэфира снимают защитные группы с использованием способов, представленных в учебнике Т.W. Greene, Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981. Арилбромид формулы (13) может быть получен в соответствии со способом по WO 1994/11337. Спиртовое соединение формулы (6) может быть получено из коммерчески доступных аминов с использованием способов, представленных в учебнике Т.W. Greene, Protective Groups in Organic Synthesis,A. Wiley-Interscience Publication, 1981. Амин формулы (4), в которой В выбирают из(СН 2)2-(СН 2)m-Х 1-(СН 2)n, где X1 представляет собой О или S, m равно целому числу от 0 до 9, n равно целому числу от 3 до 9, n+m равно от 4 до 9; С 6-С 12-алкилена, необязательно замещенного одним или двумя С 1-С 4-алкилами; группы формулы в которой X2 представляет собой О или S, r равно целому числу от 2 до 7, s равно целому числу от 0 до 6,t равно целому числу от 3 до 6, s+t равно от 3 до 6 и r+s+t равно от 5 до 8,может быть получен из амина формулы (8) в которой В 2 представляет собой СН 2-(CH2)m-Х 1-(СН 2)n1, где X1 представляет собой О или S, m равно целому числу от 0 до 9, n1 равно целому числу от 1 до 7 и n1+m равно от 2 до 7; С 3-С 9 алкилен, необязательно замещенный одним или двумя С 1-С 4-алкилами; группу формулы в которой X2 представляет собой О или S, r1 равно целому числу от 1 до 6, s равно целому числу от 0 до 6 и t1 равно целому числу от 1 до 4 и s+t1 равно от 1 до 4 и r1+s+t1 равно от 2 до 5. В типичной методике амин формулы (8) подвергают гидрированию с использованием металлического катализатора (например, палладированного угля; оксида платины) в присутствии растворителя(например, метанола, этанола, этилацетата, тетрагидрофурана) и источника водорода (например, формиата аммония; муравьиной кислоты, водорода) при температуре от 20 до 90 С в течение 1-6 ч. Амин формулы (8) может быть получен путем осуществления взаимодействия описанного ранее альдегида формулы (7) с солью фосфония формулы (9) В типичной методике соль фосфония (9) обрабатывают подходящим основанием (например, гидридом натрия, триэтиламином, н-бутиллитием, гексаметилдисилазидом), а затем осуществляют взаимодействие с альдегидом (8) в присутствии растворителя или смеси растворителей (например, толуола, тетрагидрофурана, ацетонитрила). Предпочтительно взаимодействие осуществляют при температуре от 50 до 110 С в течение 4-24 ч. Соль фосфония (9) может быть получена путем осуществления взаимодействия трифенилфосфина с бромидом формулы (10) В типичной методике осуществляют взаимодействие бромида формулы (10) с трифенилфосфином необязательно в присутствии растворителя или смеси растворителей (например, толуола, тетрагидрофурана, ацетонитрила). Предпочтительно взаимодействие осуществляют при температуре от 50 до 110 С в течение 1-5 суток. Бромид формулы (10) может быть получен путем осуществления взаимодействия подходящего амина или эквивалента амина с дибромидом формулы (11) В типичной методике осуществляют взаимодействие дибромида формулы (11) с подходящим амином или эквивалентом амина (например, фталимидом, ди-трет-бутилиминодикарбаматом) в присутствии растворителя или смеси растворителей (например, толуола, тетрагидрофурана, ацетонитрила) и с подходящим основанием (например, гидридом натрия, триэтиламином, н-бутиллитием). Предпочтительно взаимодействие осуществляют при температуре от 25 до 110 С в течение 4-24 ч. Дибромид (11) может быть либо коммерчески доступным, либо может быть получен из двухатомного спирта формулы (12) с использованием стандартных способов (например, трифенилфосфин/четырехбромистый углерод) в присутствии растворителя или смеси растворителей (например, дихлорметана, толуола, N,Nдиметилформамида, пропионитрила, ацетонитрила). Соединения формулы (12) являются коммерчески доступными или могут быть легко получены специалистом в данной области техники с использованием коммерчески доступных материалов и стандартных способов. В качестве альтернативы амин формулы (4), в которой В выбирают из(СН 2)2-(СН 2)m-X1-(СН 2)n, где X1 представляет собой О или S, m равно целому числу от 0 до 9, n равно целому числу от 3 до 9, n+m равно от 4 до 9; С 6-С 12-алкилена, необязательно замещенного одним или двумя С 1-С 4-алкилами; или группы формулы в которой X2 представляет собой О или S, r равно целому числу от 2 до 7, s равно целому числу от 0 до 6,-5 016203t равно целому числу от 3 до 6, s+t равно от 3 до 6 включительно и r+s+t равно от 5 до 8 включительно,может быть получен путем осуществления взаимодействия бромида формулы (13) в которой значение В 2 определено выше. В типичной методике осуществляют взаимодействие арилгалогенида формулы (13) с алкеном формулы (14) в присутствии подходящего палладиевого катализатора (например, ацетат палладия/триортотолилфосфин формулы Pd(OAc)2/P(o-Tol)32) в присутствии растворителя или смеси растворителей(например, толуола, ацетонитрила, гексана) в присутствии основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия). Предпочтительно взаимодействие осуществляют при температуре от 70 до 110 С в течение 4-16 ч. Арилбромид формулы (13) может быть получен в соответствии со способом по WO 1994/11337. Амин формулы (14) может быть получен из коммерчески доступных галогенидов формулы (15) в которой X представляет собой Cl, Br или I. В типичной методике осуществляют взаимодействие галогенида (15) с подходящим амином или эквивалентом амина (например, фталимидом, ди-третбутилиминодикарбаматом) в присутствии растворителя или смеси растворителей (например, толуола,тетрагидрофурана, ацетонитрила) и с подходящим основанием (например, гидридом натрия, триэтиламином, н-бутиллитием). Предпочтительно взаимодействие осуществляют при температуре от 25 до 110 С в течение 4-24 ч. В качестве альтернативы, если амин (14) имеет формулу (16) в которой X2 представляет собой О или S, t2 равно целому числу от 1 до 4,то он может быть получен путем осуществления взаимодействия соединения формулы (17) с коммерчески доступными галогенидами формулы (18) в которой X представляет собой Cl, Br или I. В типичной методике соединение формулы (17) обрабатывают галогенидом (18) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, толуола, N,N-диметилформамида,ацетонитрила, тетрагидрофурана), необязательно в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия, гидрида натрия) при температуре от 0 до 80 С в течение 1-48 ч. Соединения формулы (17), в которой X2 представляет собой О, могут быть получены из коммерчески доступного 3-(2-аминоэтил)фенола или 4-(2-аминоэтил)фенола с использованием способов, представленных в учебнике Т.W. Greene, Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981.-6 016203 Соединения формулы (17), в которой X2 представляет собой S, могут быть получены из галогенида формулы (17 а) в которой X представляет собой Cl, Br или I. В типичной методике осуществляют взаимодействие упомянутого галогенида (17 а) с триизопропилсилантиолом в присутствии подходящего палладиевого катализатора (например, ацетат палладия/три-ортотолилфосфин формулы Pd (ОАс)2/P(o-Tol)32) в присутствии растворителя или смеси растворителей (например, толуола, ацетонитрила, гексана) в присутствии основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната натрия). Предпочтительно взаимодействие осуществляют при температуре от 70 до 110 С в течение 4-16 ч. Затем с полученного силилтиоэфира снимают защитные группы с использованием способов, представленных в учебнике Т.W. Greene, Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981. Галогениды формулы (17 а) могут быть получены из коммерчески доступных галогенидов формулы то он может быть получен путем осуществления взаимодействия соединения формулы (17) с соединением формулы (20) В типичной методике соединение формулы (20) сначала преобразуют до галогенида (например,бромида, хлорида, йодида) или сульфоната (например, мезилата) с использованием стандартных методик(например, трифенилфосфин/йод; трифенилфосфин/четырехбромистый углерод; тионилхлорид; метансульфонилхлорид/триэтиламин) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, дихлорметана, толуола, N,N-диметилформамида, пропионитрила, ацетонитрила). Затем осуществляют взаимодействие этого продукта с соединением формулы (17) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, толуола, N,N-диметилформамида, ацетонитрила, тетрагидрофурана), необязательно в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия) при температуре от 60 до 120 С в течение 4-48 ч. В качестве альтернативы может быть применена схема по Мицунобу (например, диэтилазодикарбоксилат/трифенилфосфин) в присутствии растворителя или смеси растворителей (например, толуола,ацетонитрила, тетрагидрофурана) при температуре от 25 до 60 С в течение 2-4 ч.-7 016203 Соединение формулы (20) может быть получено из алкена формулы (21) путем осуществления взаимодействия с борирующим агентом (например, бораном, 9 борбицикло[3.3.1]нонаном) в присутствии подходящего растворителя (например, тетрагидрофурана) при температуре от 60 до 100 С в течение 4-24 ч с последующим окислением перекисью водорода в подходящем растворителе или смеси растворителей (например, воде, метаноле, тетрагидрофуране) с подходящим основанием (например, с гидроксидом натрия). Алкен формулы (21) может быть получен путем осуществления взаимодействия арилбромида (13) с подходящим виниловым соединением (например, винилтрибутилстаннан; винилтетрафторборат калия; комплекс 2,4,6-тривинилциклобороксана и пиридина). В типичной методике осуществляют взаимодействие арилгалогенида (13) и винилового соединения в присутствии подходящего палладиевого катализатора (например, ацетат палладия/три-ортотолилфосфин формулы Pd(OAc)2/P(o-Tol)32) в присутствии растворителя или смеси растворителей (например, толуола, ацетонитрила, гексана), в присутствии основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия). Предпочтительно взаимодействие осуществляют при температуре от 70 до 110 С в течение 4-16 ч. В качестве альтернативы соединение формулы (20) может быть получено из сложного эфира формулы (37) путем осуществления взаимодействия с восстановителем (например, с литийалюминийгидридом, боргидридом лития) в присутствии подходящего растворителя (например, тетрагидрофурана) при температуре от 0 до 100 С в течение 4-24 ч. Сложный эфир формулы (37) может быть получен из описанного выше в этом документе арилбромида формулы (13) путем осуществления взаимодействия с трет-бутилацетат-анионом с использованием палладиевого катализатора. В типичной методике осуществляют взаимодействие арилгалогенида (13) и аниона сложного эфира в присутствии подходящего палладиевого катализатора (например, дибензилиденацетат палладия или ацетат палладия/три-ортотолилфосфин формулы Pd(OAc)2/P(o-Tol)32) в присутствии растворителя или смеси растворителей (например, толуола, ацетонитрила, гексана), в присутствии основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия, гексаметилдисилазида лития). Предпочтительно взаимодействие осуществляют при температуре от 0 до 110 С в течение 4-16 ч. В качестве альтернативы амин формулы (2) может быть получен из соответствующего нитрила формулы (22) в которой значение В 2 определено выше. В типичной методике нитрил формулы (22) гидрируют с использованием катализатора или сочетания катализаторов (например, палладированного угля; оксида платины, Raney-Nickel) в присутствии растворителя (например, метанола, этанола, этилацетата, тетрагидрофурана) и источника водорода (например,формиата аммония, муравьиной кислоты, водорода) при температуре от 20 до 90 С в течение 1-6 ч. Нитрил формулы (22) может быть получен путем осуществления взаимодействия арилбромида (13) с алкеном формулы (23)-8 016203 В типичной методике осуществляют взаимодействие арилгалогенида формулы (13) с алкеном формулы (14) в присутствии подходящего палладиевого катализатора (например, ацетат палладия/триортотолилфосфин формулы Pd(OAc)2/P(o-Tol)32), в присутствии растворителя или смеси растворителей(например, толуола, ацетонитрила, гексана), в присутствии основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия). Предпочтительно взаимодействие осуществляют при температуре от 70 до 110 С в течение 4-16 ч. Алкен формулы (23) может быть коммерчески доступным. В качестве альтернативы, если алкен (23) имеет следующую формулу (24): в которой X3 представляет собой О или S, В 4 представляет собой СН 2-(СН 2)m, где m равно целому числу от 0 до 9, В 5 представляет собой (CH2)n1, где n1 равно целому числу от 1 до 7, n1+m равно от 2 до 7 включительно, или В 4 представляет собой группу формулы в которой r1 равно целому числу от 1 до 6, s равно целому числу от 0 до 6, В 5 представляет собой группу(CH2)t1, где t1 равно целому числу от 1 до 4 и s+t1 равно от 1 до 4 включительно, r1+s+t1 равно от 2 до 5 включительно; то упомянутое соединение формулы (24) может быть получено путем осуществления взаимодействия соединения формулы (25) В типичной методике одно из соединений (25) или (26) сначала преобразуют до галогенида (например, до бромида, хлорида, йодида) или сульфоната (например, до мезилата) с использованием стандартных методик (например, трифенилфосфин/йод; трифенилфосфин/четырехбромистый углерод; тионилхлорид; метансульфонилхлорид/триэтиламин) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, дихлорметана, толуола, N,N-диметилформамида, пропионитрила, ацетонитрила). Затем осуществляют взаимодействие этого продукта с другим соединением (26) или (25) в присутствии растворителя или смеси растворителей (например, воды, диметилсульфоксида, толуола,N,N-диметилформамида, ацетонитрила, тетрагидрофурана, дихлорметана) в присутствии подходящего основания (например, гидроксида натрия, трет-бутоксида калия, гидрида натрия), необязательно в присутствии катализатора межфазного переноса (например, бромида тетраэтиламмония) при температуре от 25 до 120 С в течение 4-48 ч. Соединения формул (25) и (26) являются коммерчески доступными или могут быть легко получены с использованием хорошо известных методик. В качестве альтернативы амин формулы (2) может быть получен из соответствующего нитрила формулы (32) в которой значение В 2 определено выше. В типичной методике нитрил формулы (32) гидрируют с использованием катализатора или сочетания катализаторов (например, палладированного угля; оксида платины, Raney-Nickel) в присутствии растворителя (например, метанола, этанола, этилацетата, тетрагидрофурана) и источника водорода (например,формиата аммония, муравьиной кислоты, водорода) при температуре от 20 до 90 С в течение 1-6 ч. Нитрил формулы (32) может быть получен путем осуществления взаимодействия арилбромида (13) с алкином формулы (33) В типичной методике осуществляют взаимодействие арилгалогенида формулы (13) с алкином фор-9 016203 мулы (33) в присутствии подходящего палладиевого катализатора (например, тетракис(трифенилфосфин)палладий или ацетат палладия/три-ортотолилфосфин формулы Pd(ОАс)2/P(o-Tol)32) в присутствии растворителя или смеси растворителей (например, толуола, ацетонитрила, гексана), в присутствии основания (например, триэтиламина, пиперидина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия). Предпочтительно взаимодействие осуществляют при температуре от 70 до 110 С в течение 4-16 ч. Алкин формулы (33) может быть коммерчески доступным. В качестве альтернативы, если алкин (33) имеет следующую формулу (34): в которой X3 представляет собой О или S, В 4 представляет собой СН 2-(СН 2)m, где m равно целому числу от 0 до 9, В 5 представляет собой (CH2)n1, где n1 равно целому числу от 1 до 7, n1+m равно от 2 до 7 включительно, или В 4 представляет собой группу формулы в которой r1 равно целому числу от 1 до 6, s равно целому числу от 0 до 6, В 5 представляет собой группу(CH2)t1, где t1 равно целому числу от 1 до 4, s+t1 равно от 1 до 4 включительно, r1+s+t1 равно от 2 до 5 включительно; то упомянутое соединение формулы (34) может быть получено путем осуществления взаимодействия соединения формулы (25) с соединением формулы (36) В типичной методике одно из соединений (35) или (36) сначала преобразуют до галогенида (например, до бромида, хлорида, йодида) или сульфоната (например, до мезилата) с использованием стандартных методик (например, трифенилфосфин/йод; трифенилфосфин/четырехбромистый углерод; тионилхлорид; метансульфонилхлорид/триэтиламин) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, дихлорметана, толуола, N,N-диметилформамида, пропионитрила, ацетонитрила). Затем осуществляют взаимодействие этого продукта с другим соединением (36) или (35) в присутствии растворителя или смеси растворителей (например, воды, диметилсульфоксида, толуола,N,N-диметилформамида, ацетонитрила, тетрагидрофурана, дихлорметана) в присутствии подходящего основания (например, гидроксида натрия, трет-бутоксида калия, гидрида натрия), необязательно в присутствии катализатора межфазного переноса (например, бромида тетраэтиламмония) при температуре от 25 до 120 С в течение 4-48 ч. Соединения формул (35) и (36) являются коммерчески доступными или могут быть легко получены с использованием хорошо известных методик. Соединения формулы (1), в которой В выбирают из (СН 2)2-(СН 2)m-X1-(СН 2)n, где n равно 1, или группы формулы в которой t равно 1,может быть получено путем осуществления взаимодействия амина формулы (27) в которой X3 и значения В 1 и Ra определены выше,с бромидом формулы (3). В типичной методике осуществляют взаимодействие амина формулы (27) с бромидом формулы (3) необязательно в присутствии растворителя или смеси растворителей (например, диметилсульфоксида,толуола, N,N-диметилформамида, пропионитрила, ацетонитрила), необязательно в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната- 10016203 натрия) при температуре от 80 до 120 С в течение 12-48 ч. Затем защитные группы могут быть удалены с использованием стандартной методики расщепления защитных групп для кислорода, такой как представленная в учебнике Т.W. Greene, Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981. Амин формулы (27) может быть получен из соответствующего защищенного амина формулы (28) в которой значения Rb и Rc определены выше. Амин (28) может быть получен путем осуществления взаимодействия спирта (29) В типичной методике спирт формулы (29) сначала преобразуют до галогенида (например, до бромида, хлорида, йодида) или сульфоната (например, до мезилата) с использованием стандартных методик(например, трифенилфосфин/йод; трифенилфосфин/четырехбромистый углерод; тионилхлорид; метансульфонилхлорид/триэтиламин) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, дихлорметана, толуола, N,N-диметилформамида, пропионитрила, ацетонитрила). Затем осуществляют взаимодействие этого продукта с соединением формулы (30) в присутствии растворителя или смеси растворителей (например, воды, диметилсульфоксида, толуола, N,N-диметилформамида, ацетонитрила, тетрагидрофурана, дихлорметана) в присутствии подходящего основания (например, гидроксида натрия, трет-бутоксида калия, гидрида натрия), необязательно в присутствии катализатора межфазного переноса (например, бромида тетраэтиламмония) при температуре от 25 до 120 С в течение 4-48 ч. Спирт формулы (29) может быть получен из альдегида формулы (7). В типичной методике альдегид(7) обрабатывают восстановителем (например, боргидридом натрия; алюминийгидридом лития) в присутствии растворителя (например, тетрагидрофурана, метанола, толуола) при температуре от 0 до 40 С в течение 1-24 ч. Соединение формулы (30) может быть получено из коммерчески доступного спирта формулы (31) с использованием способов, представленных в учебнике Т.W. Greene, Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981. Наконец, если амин (4) имеет следующую формулу (38): то он может быть получен путем осуществления взаимодействия соединения формулы (39) Упомянутые выше соединения формулы (39) могут быть получены в соответствии со способами,описанными в WO 97/34905. В типичной методике соединение формулы (20) сначала преобразуют до галогенида (например, до бромида, хлорида, йодида) или сульфоната (например, до мезилата) с использованием стандартных методик (например, трифенилфосфин/йод; трифенилфосфин/четырехбромистый углерод; тионилхлорид; метансульфонилхлорид/триэтиламин) в присутствии растворителя или смеси растворителей (например,диметилсульфоксида, дихлорметана, толуола, N,N-диметилформамида, пропионитрила, ацетонитрила). Затем осуществляют взаимодействие этого продукта с соединением формулы (39) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, толуола, N,N-диметилформамида,ацетонитрила, тетрагидрофурана), необязательно в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия) при температуре от 60 до 120 С в течение 4-48 ч. В качестве альтернативы может быть применена схема по Мицунобу (например, диэтилазодикарбоксилат/трифенилфосфин) в присутствии растворителя или смеси растворителей (например, толуола,ацетонитрила, тетрагидрофурана) при температуре от 25 до 60 С в течение 2-4 ч. Четвертичные аммониевые соли соединений формулы (1) включают соединения формулы в которой R1 выбирают из Н, С 1-С 4-алкила, бензила или фенэтила, Х- представляет собой подходящий противоион, такой как ацетат, мезилат, ксинафоат, тартрат, хлорид, бромид, йодид, сульфат, фосфонат(ы), нитрат, цитрат, метансульфонат, карбоксилат с 1-6 атомами углерода, дикарбоксилат с 2-6 атомами углерода, малеат, фумарат и бензоат. Для остальных приемлемых четвертичных аммониевых солей см. Int. J. Pharm., 33, 201-217 (1986). Предпочтительно X представляет собой ацетат, фумарат, мезилат,бромид, хлорид, сульфат, D и L тартрат или ксинафоат. Упомянутые четвертичные аммониевые соли могут быть получены путем осуществления взаимодействия соединения формулы (4) с алкилирующим агентом R1-X, где R1 представляет собой С 1-С 4 алкил, бензил или фенэтил и X представляет собой подходящую уходящую группу (предпочтительно R1-X представляет собой метилйодид) в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, толуола, N,N-диметилформамида,пропионитрила, ацетонитрила, дихлорметана), необязательно в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия) при температуре от 60 до 120 С в течение 4-48 ч. Затем с полученной четвертичной аммониевой соли соединения формулы (4) снимают защитные группы и осуществляют взаимодействие с раскрытым выше бромидом формулы (3) для получения упомянутой четвертичной аммониевой соли соединения формулы (1). Для некоторых стадий изложенного выше в этом документе способа получения соединений формулы (1) могут оказаться необходимыми защита потенциальных реакционноспособных функциональных групп, участие которых в реакции нежелательно, и последующее отщепление упомянутых защитных групп. В этом случае может быть использован любой совместимый защитный радикал. В частности, могут быть использованы такие способы введения и снятия защитных групп, как описанные T.W. Greene(Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981) или P.J. Kocienski (Protecting groups, Georg Thieme Verlag, 1994). Все упомянутые выше взаимодействия и реакции получения новых исходных материалов, используемых в представленных выше способах, являются традиционными, и соответствующие реагенты и условия проведения реакций для их осуществления или получения, а также методики выделения желаемых продуктов, хорошо известны специалистам в данной области техники со ссылкой на представленные в литературе прецеденты и примеры и приведенные там способы получения. Кроме того, соединения формулы (1), а также промежуточные соединения для их получения, могут быть очищены в соответствии с различными хорошо известными способами, такими как, например, кристаллизация или хроматография. Предпочтительные определения В представлены ниже в этом документе. В соответствии с одним примером осуществления (СН 2)8, (СН 2)9 и (СН 2)10 являются предпочтительными, если В представляет собой С 6-С 12-алкилен, необязательно замещенный одним или двумя С 1-С 4- 12016203 алкилами. В соответствии с другим примером осуществления -(СН 2)6-O-(СН 2)3, -(СН 2)6-O-(СН 2)4 и -(СН 2)7-Oявляются предпочтительными, если В имеет формулу -(СН 2)2-(СН 2)m-Х 1-(СН 2)n-. В соответствии с другим примером осуществления, если В имеет формулу то предпочтительными являются следующие: Предпочтительно кислород находится в мета- или пара-положении. Более предпочтительно кислород находится в пара-положении. В соответствии с другим примером осуществления, если В имеет формулу то предпочтительным является кислород в пара-положении. Четвертичные аммониевые соли соединений формулы (1) также являются предпочтительными. Предпочтительные четвертичные аммониевые соли представляют собой где X представляет собой ацетат, фумарат, мезилат, бромид, хлорид, сульфат, D и L тартрат или ксинафоат. В соответствии с другим примером осуществления настоящего изобретения предпочтительными также являются четвертичные аммониевые соли формулы в которой X представляет собой сукцинат. Предпочтительно А представляет собой группу формулы Более предпочтительно А представляет собой группу формулы Особенно предпочтительные соединения по настоящему изобретению представляют собойN-5-[(1R)-2-(2-[4-(2-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4 гидроксифенилэтокси)фенил]этиламино)-1-гидроксиэтил]-2 гидроксифенилметансульфонамидасукцинат и 5-[(1R)-2-(2-[4-(2-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4 гидроксифенилэтокси)фенил]-11-диметилэтиламино)-1-гидроксиэтил]-8-гидроксихинолин-2(1 Н)-он,или, если целесообразно, их фармацевтически приемлемые соли и/или изомеры, таутомеры, сольваты или меченные изотопами варианты. Наиболее предпочтительные соединения по настоящему изобретению представляют собойN-5-[(1R)-2-(2-[4-(2-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4 гидроксифенилэтокси)фенил]этиламино)-1-гидроксиэтил]-2-гидроксифенилметансульфонамида сукцинат и 5-[(1R)-2-(2-[4-(2-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4 гидроксифенилэтокси)фенил]-11-диметилэтиламино)-1-гидроксиэтил]-8-гидроксихинолин-2(1 Н)-он,или, если целесообразно, их фармацевтически приемлемые соли и/или изомеры, таутомеры, сольваты или меченные изотопами варианты. Фармацевтически приемлемые соли соединений формулы (1) и их четвертичная аммониевая соль включают их соли добавления кислоты и основания. Подходящие соли добавления кислоты образуются кислотами, которые образуют нетоксичные соли. Примеры включают ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат,гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат,лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 1,5-нафталиндифсульфонат, 2- 14016203 напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат,сахарат, стеарат, сукцинат, тартрат, тозилат и трифторацетат. Подходящие соли добавления основания образуются основаниями, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Также могут быть образованы гемисоли кислот и оснований, например гемисульфатная и гемикальциевая соль. Для обзора подходящих солей см. "Handbook of Pharmaceutical Salts: Properties, Selection, and Use"by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемые соли соединений формулы (1) и их четвертичная аммониевая соль могут быть получены одним или несколькими из трех способов:(i) путем осуществления взаимодействия соединения формулы (1) с желаемой кислотой или основанием;(ii) путем удаления лабильной при действии кислоты или основания защитной группы из подходящего предшественника соединения формулы (1) или путем раскрытия кольца подходящего циклического предшественника, например лактона или лактама, с использованием желаемой кислоты или основания; или(iii) путем преобразования одной соли соединения формулы (1) в другую путем осуществления взаимодействия с подходящей кислотой или основанием или посредством использования подходящей ионообменной колонки. Все три взаимодействия обычно проводят в растворе. Полученную соль можно осадить и собрать путем фильтрации или можно извлечь путем выпаривания растворителя. Степень ионизации полученной соли может варьировать от полностью ионизированного до почти неионизированного состояния. Соединения по настоящему изобретению могут существовать как в несольватированной, так и в сольватированной формах. Термин "сольват" используется в этом документе для описания молекулярного комплекса, содержащего соединение по настоящему изобретению и стехиометрическое количество молекул одного или нескольких фармацевтически приемлемых растворителей, например этанола. Термин "гидрат" используется, если упомянутым растворителем является вода. В объем настоящего изобретения включены такие комплексы, как клатраты, комплексы включения лекарственное средство-носитель, в которых, в отличие от упомянутых выше сольватов, лекарственное средство и носитель содержатся в стехиометрических или нестехиометрических количествах. Также включены комплексы лекарственного средства, содержащие два или более органических и/или неорганических компонентов, которые могут быть в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированы, частично ионизированы или неионизированы. Для обзора таких комплексов см. J. Pharm. Sci., 64 (8), 1269-1288 by Haleblian (August 1975). Здесь и далее в этом документе все ссылки на соединения формулы (1) включают ссылки на их соли, сольваты или комплексы и на сольваты и комплексы их солей. Соединения по настоящему изобретению включают определенные здесь и ранее в этом документе соединения формулы (1), включая все их полиморфы и кристаллические формы, их пролекарства и изомеры (включая оптические, геометрические изомеры и таутомерные изомеры), определенные здесь и далее в этом документе, и меченные изотопами соединения формулы (1). Как указано, так называемые "пролекарства" соединений формулы (1) также включены в объем настоящего изобретения. Таким образом, некоторые производные соединений формулы (1), которые как таковые могут обладать низкой фармакологической активностью или не обладать ею, могут при введении внутрь организма или при нанесении на его поверхность преобразовываться в соединения формулы(1) с желаемой активностью, например, в результате гидролитического расщепления. Такие производные называют "пролекарствами". Дополнительная информация по использованию пролекарств может быть найдена в Pro-drugs as Novel Delivery Systems, vol. 14, ACS Symposium Series (T. Higuchi and W. Stella) и"Bioreversible Carriers in Drug Design", Pergamon Press, 1987 (ed. E.В. Roche, American Pharmaceutical Association). Пролекарства по настоящему изобретению могут быть получены, например, путем замены соответствующих функциональных групп, содержащихся в соединении формулы (1), определенными фрагментами, известными специалистам в данной области техники как "профрагменты", как описано, например,в "Design of Prodrugs" by H. Bundgaard (Elsevier, 1985). Некоторые примеры пролекарств по настоящему изобретению включают:(i) когда соединение формулы (1) содержит метильную группу, его гидроксиметильное производное (-СН 3-СН 2 ОН);(ii) когда соединение формулы (1) содержит алкоксигруппу, его гидроксипроизводное(iii) когда соединение формулы (1) содержит третичную аминогруппу, его производное в виде вто- 15016203 ричного амина (-NR1R2-NHR1 или -NHR2);(iv) когда соединение формулы (1) содержит вторичную аминогруппу, его производное в виде первичного амина (-NHR1-NH2);(v) когда соединение формулы (1) содержит фенильный фрагмент, его фенольное производное(vi) когда соединение формулы (1) содержит амидную группу, его производное в виде карбоновой кислоты (-CONH2 СООН). Дополнительные примеры замещающих групп в соответствии с последующими примерами и примеры других типов пролекарств могут быть найдены в упомянутых выше ссылках. Более того, определенные соединения формулы (1) могут сами по себе действовать как пролекарства других соединений формулы (1). В объем настоящего изобретения также включены метаболиты соединений формулы (1), то есть соединения, образующиеся in vivo при введении лекарственного средства. Некоторые примеры метаболитов по настоящему изобретению включают:(i) когда соединение формулы (1) содержит вторичную аминогруппу, его производное в виде первичного амина (-NHR1-NH2),(ii) когда соединение формулы (1) содержит фенильный фрагмент, его фенольное производное(-Ph-PhOH). В объем настоящего изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (1), включая соединения, демонстрирующие более одного типа изомерии, и смеси одного или нескольких из них. Также включены соли добавления кислоты или основания, в которых противоион является оптически активным, например D-лактат или L-лизин, или рацемическим, например D,L-тартрат или D,L-аргинин. Цис/транс-изомеры могут быть разделены традиционными методами, хорошо известными специалистам в данной области техники, например, по методу хроматографии и фракционной кристаллизации. Традиционные методики для получения/выделения отдельных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, высокоэффективной жидкостной хроматографии(ВЭЖХ). В качестве альтернативы может быть осуществлено взаимодействие рацемата (или рацемического предшественника) с подходящим оптически активным соединением, например со спиртом, или, в том случае, если соединение формулы (1) содержит кислотный или основный фрагмент, с кислотой или основанием, такими как винная кислота или 1-фенилэтиламин. Полученная диастереоизомерная смесь может быть разделена по методу хроматографии и/или фракционной кристаллизации, а один или оба из диастереоизомеров преобразованы в соответствующий чистый энантиомер(ы) хорошо известным специалисту путем. Хиральные соединения по настоящему изобретению (и их хиральные предшественники) могут быть получены в энантиомерно-обогащенной форме с использованием хроматографии, обычно ЖХВД, на асимметрической смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, и содержащей от 0 до 50 об.% изопропанола, обычно от 2 до 20 и от 0 до 5 об.% алкиламина, обычно 0,1% диэтиламина. Концентрирование элюата приводит к получению обогащенной смеси. Стереоизомерные конгломераты могут быть разделены традиционными методами, известными специалистам в данной области техники (см., например, "Stereochemistry of Organic Compounds" by E.L. Eliel(Wiley, New York, 1994. Настоящее изобретение включает все фармацевтически приемлемые меченные изотопами соединения формулы (1), в которой один или несколько атомов заменены атомами, имеющими тот же атомный номер, но атомная масса или массовое число отличается от атомной массы или массового числа, преобладающего в природе. Примеры изотопов, подходящих для введения в соединения по настоящему изобретению, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такой как 36Cl, фтора, такой как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такой как 32 Р, и серы, такой как 35S. Определенные меченные изотопами соединения формулы (1), например соединения, содержащие радиоактивный изотоп, применимы при исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, особенно применимы для этих целей по причине легкости их введения и простых способов детектирования. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может дать определенные терапевтические преимущества, вытекающие из большей метаболической стабильности, например увеличение времени полувыведения in vivo или снижение требуемой дозировки, и, следовательно, может быть предпочтительно в некоторых случаях. Замещение позитронно-активными изотопами, такими как 11 С, 18F, 15O и 13N, может быть примени- 16016203 мо при проведении позитронной эмиссионной томографии (ПЭТ) для изучения степени связывания субстрата рецепторами. Меченные изотопами соединения формулы (1), как правило, могут быть получены с использованием традиционных методик, известных специалистам в данной области техники, или методик, сходных с описанными в сопроводительных примерах и примерах получения, с использованием меченных соответствующим изотопом реагентов вместо ранее использованных немеченых реагентов. Фармацевтически приемлемые сольваты по настоящему изобретению включают сольваты, в которых растворитель для кристаллизации может быть помечен изотопом, например D2O, d6-ацетон, d6 ДМСО. Соединения формулы (1), их фармацевтически приемлемые соли и/или производные представляют собой ценные фармацевтически активные соединения, которые подходят для терапии и профилактики многочисленных нарушений, с достижением эффекта за счет агонизма 2-рецептора и антагонизма мускаринового рецептора, в частности, аллергических и неаллергических заболеваний дыхательных путей. Соединения по настоящему изобретению, предназначенные для использования в фармацевтике, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде твердых масс, порошков или пленок такими способами, как осаждение, кристаллизация, лиофилизация, сушка распылением или упариванием. Для этой цели может быть использована сушка с использованием микроволновых и радиочастот. Они могут быть введены по отдельности или в сочетании с одним или несколькими другими соединениями по настоящему изобретению, или в сочетании с одним или несколькими другими лекарственными средствами (или в виде любого их сочетания). Как правило, их вводят в виде композиции вместе с одним или несколькими фармацевтически приемлемыми наполнителями. Термин "наполнитель" используется в этом документе для описания любого ингредиента, отличного от соединения(й) по настоящему изобретению. Выбор наполнителя в значительной степени зависит от таких факторов, как конкретный способ введения, влияние наполнителя на растворимость и стабильность и природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их приготовления очевидны для специалистов в данной области техники. Такие композиции и способы их приготовления могут быть найдены, например, в Remington's Pharmaceutical Sciences,19th Edition (Mack Publishing Company, 1995). Соединения по настоящему изобретению могут быть введены перорально. Пероральное введение может включать проглатывание, с тем, чтобы соединение попало в желудочно-кишечный тракт, или может быть применено буккальное или сублингвальное введение, при котором соединение попадает в кровоток непосредственно из ротовой полости. Композиции, подходящие для перорального введения, включают твердые композиции, такие как таблетки, капсулы, содержащие твердые частицы, жидкости или порошки, пастилки (включая наполненные жидким содержимым), жевательные резинки, мульти- или наночастицы, гели, твердый раствор, липосомы, пленки, овулы, спреи и жидкие композиции. Жидкие композиции включают суспензии, растворы, сиропы и эликсиры. Такие композиции могут быть применены в качестве наполнителей мягких или твердых капсул и обычно содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или несколько эмульгаторов и/или суспендирующих агентов. Жидкие композиции могут быть также получены путем восстановления твердого вещества, например, из саше. Соединения по настоящему изобретению могут быть также использованы в быстрорастворимых,быстро распадающихся лекарственных формах, таких как описанные в Expert Opinion in Therapeutic Patents, 11 (6), 981-986, by Liang and Chen (2001). В таблетированных лекарственных формах, в зависимости от дозы, лекарственное средство может составлять от 1 до 80 мас.% лекарственной формы, более часто от 5 до 60 мас.% лекарственной формы. В дополнение к лекарственному средству таблетки, как правило, содержат разрыхлитель. Примеры разрыхлителей включают натрия крахмала гликолят, натрия карбоксиметилцеллюлозу, кальция карбоксиметилцеллюлозу, натрия кроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, (низший алкил)замещенную гидроксипропилцеллюлозу, крахмал, прежелатинизированный крахмал и альгинат натрия. Как правило, разрыхлитель составляет от 1 до 25 мас.%,предпочтительно от 5 до 20 мас.% лекарственной формы. Связующие вещества, как правило, используют для наделения таблетируемой композиции вяжущими свойствами. Подходящие связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дикальция ортофосфат дигидрат. Таблетки могут также необязательно содержать поверхностно-активные вещества, такие как лау- 17016203 рилсульфат натрия и полисорбат 80, и скользящие вещества, такие как диоксид кремния и тальк. При наличии поверхностно-активные вещества могут составлять от 0,2 до 5 мас.% таблетки, а скользящие вещества могут составлять от 0,2 до 1 мас.% таблетки. Таблетки также, как правило, содержат смазки, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия, и смеси стеарата магния с лаурилсульфатом натрия. Смазки, как правило,составляют от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы, консерванты и корригенты. В характерном примере таблеток содержится приблизительно 80% лекарственного средства, приблизительно от 10 приблизительно до 90 мас.% связующего вещества, приблизительно от 0 приблизительно до 85 мас.% разбавителя, приблизительно от 2 приблизительно до 10 мас.% разрыхлителя и приблизительно от 0,25 приблизительно до 10 мас.% смазки. Таблетируемые смеси могут быть спрессованы непосредственно или при помощи вальцов с получением таблеток. В качестве альтернативы перед таблетированием таблетируемые смеси или части смесей могут быть подвергнуты влажной грануляции, сухой грануляции или грануляции в расплаве, расплавлению отвердевшей массы или формованию. Конечная композиция может содержать один или несколько слоев, и на него может быть нанесено или не нанесено покрытие; она может быть даже инкапсулирована. Состав таблеток обсуждается в Pharmaceutical Dosage Forms: Tablets, vol. 1, by H. Lieberman and L.Lachman (Marcel Dekker, New York, 1980). Пригодные для перорального употребления пленки для использования в медицине и ветеринарии обычно представляют собой гибкие водорастворимые или водопроницаемые лекарственные формы в виде тонких пленок, которые могут быстро растворяться или являются мукоадгезивными и обычно содержат соединение формулы (1), образующий пленку полимер, связующее вещество, растворитель, смачивающее средство, пластификатор, стабилизатор или эмульгатор, регулирующий вязкость агент и растворитель. Некоторые компоненты композиции могут выполнять более одной функции. Соединение формулы (1) может быть растворимо или нерастворимо в воде. Растворимое в воде соединение обычно содержит от 1 до 80 мас.%, более часто от 20 до 50 мас.% растворимых веществ. Менее растворимые соединения могут составлять большую долю композиции, обычно до 88 мас.% растворимых веществ. В качестве альтернативы соединение формулы (1) может находиться в форме гранул из множества частиц. Образующий пленку полимер может быть выбран из натуральных полисахаридов, белков или синтетических гидроколлоидов и обычно содержится в диапазоне от 0,01 до 99 мас.%, более часто в диапазоне от 30 до 80 мас.%. Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы и усилители вкуса, консерванты, стимулирующие слюноотделение агенты, охлаждающие средства, сорастворители(включая масла), мягчительные средства, агенты-наполнители, пеногасители, поверхностно-активные вещества и корригенты. Пленки в соответствии с настоящим изобретением обычно получают путем сушки упариванием тонких водных пленок, нанесенных на снимающуюся подложку или бумагу. Это может быть осуществлено в сушильной печи или сушильном туннеле, обычно комбинированных с устройством для нанесения покрытия, или путем лиофилизирования или вакуумирования. Твердые композиции для перорального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции для замедленного, непрерывного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Подходящие композиции для модифицированного высвобождения для целей настоящего изобретения описаны в патенте США 6106864. Подробности других технологий высвобождения, таких как высокоактивные дисперсии и осмотически активные и снабженные покрытием частицы, могут быть найдены в Pharmaceutical Technology On-line, 25(2), 1-14, by Verma et al. (2001). Использование жевательной резинки для достижения регулируемого высвобождения описано в WO 00/35298. Соединения по настоящему изобретению могут быть также введены непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенный, внутриартериальный, интраперитонеальный, внутриоболочечный, внутрижелудочковый, интрауретральный, внутригрудинный, внутричерепной, внутримышечный и подкожный. Подходящие устройства для перитонеального введения включают игольные (включая микроигольные) инжекторы, безыгольные инжекторы и инфузионные устройства. Парентеральные композиции обычно представляют собой водные растворы, которые могут содержать наполнители, такие как соли, углеводы и забуферивающие вещества (предпочтительно до рН от 3 до 9), но для некоторых применений они могут быть специально приготовлены в виде стерильного неводного раствора или в виде сухой формы, которую следует использовать в сочетании с подходящим растворителем, таким как стерильная апирогенная вода.- 18016203 Приготовление парентеральных композиций в стерильных условиях, например путем лиофилизации, может быть легко осуществлено с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Растворимость соединений формулы (1), используемых для приготовления парентеральных растворов, может быть повышена путем использования соответствующих методик приготовления композиций,таких как введение улучшающих растворимость агентов. Композиции для парентерального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции для замедленного, непрерывного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Поэтому соединения по настоящему изобретению могут быть включены в композицию в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение. Примеры таких композиций включают покрытые лекарственным средством стенты и микросферы из поли(D,Lмолочной-когликолевой) кислоты (PGLA). Соединения по настоящему изобретению могут быть также введены местно на кожу или слизистую облачку, то есть дермально или трансдермально. Типичные композиции для этой цели включают гели,гидрогели, лосьоны, растворы, кремы, мази, присыпки, перевязочные материалы, пены, пленки, накожные пластыри, облатки, имплантаты, губки, волокна, бандажи и микроэмульсии. Также могут быть использованы липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. В композицию могут быть включены вещества, усиливающие проникновение (см., например, J. Pharm. Sci., 88 (10), 955-958 by Finnin and Morgan (October 1999. Другие способы местного введения включают введение путем электропорации, ионофореза, фонофореза, сонофореза и микроигольной или безыгольной (например, Powderject, Bioject и т.д.) инъекции. Композиции для местного введения могут быть изготовлены для немедленого и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции для замедленного, непрерывного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Соединения по настоящему изобретению могут быть также введены интраназально или путем ингаляции, обычно в форме сухого порошка (или по отдельности, в виде смеси, например в виде сухой смеси с лактозой, или в виде многокомпонентной частицы, например, в смеси с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка или в виде аэрозольного спрея из находящегося под давлением контейнера, нагнетателя, спрея, распылителя (предпочтительно распылителя, использующего электрогидродинамический принцип для получения высокодисперсного аэрозоля) или небулайзера, с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназльного применения порошок может содержать биоадгезивное вещество, например хитозан или циклодекстрин. Находящийся под давлением контейнер, нагнетатель, спрей, распылитель или небулайзер содержат раствор или суспензию соединения(й) по настоящему изобретения, содержащие, например, этанол, водный раствор этанола или подходящее альтернативное средство для диспергирования, солюбилизации или замедляющего высвобождение активного ингредиента, пропеллент(ы) в качестве растворителя и необязательно поверхностно-активное вещество, такое как сорбитана триолеат, олеиновая кислота или олигомолочная кислота. Перед использованием в композиции в виде сухого порошка или в виде суспензии лекарственное средство микронизируют до размера, подходящего для доставки путем ингаляции (обычно менее 5 мкм). Это может быть достигнуто посредством любого подходящего способа измельчения, такого как размалывание на спиральной струйной мельнице, размалывание на струйной мельнице в псевдоожиженном слое, обработка надкритической текучей средой с получением наночастиц, гомогенизация под действием высокого давления или сушка распылением. Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для использования в ингаляторе или инсуффляторе могут быть изготовлены так, что содержат порошковую смесь соединения по настоящему изобретению, подходящую порошковую основу, такую как лактоза иликрахмал, и модификатор эксплуатационных характеристик, такой как L-лейцин,маннит или стеарат магния. Лактоза может быть безводной или находиться в форме моногидрата, последнее предпочтительно. Другие подходящие наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящая композиция в виде раствора для использования в работающем по электрогидродинамическому принципу распылителе с получением высокодисперсного аэрозоля может содержать от 1 мкг до 20 мг соединения по настоящему изобретению на одно срабатывание, а объем при срабатывании может варьировать от 1 до 100 мкл. Типичная композиция может содержать соединение формулы (1), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут- 19016203 быть использованы вместо пропиленгликоля, включают глицерин или полиэтиленгликоль. К композициям по настоящему изобретению, предназначенным для введения посредством ингаляции/интраназального введения, могут быть добавлены подходящие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия. Композиции для введения посредством ингаляции/интраназального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения с использованием, например, PGLA. Композиции для модифицированного высвобождения включают композиции для замедленного, непрерывного, пульсирующего, контролируемого, направленного и программируемого высвобождения. В случае ингаляторов сухого порошка или аэрозолей доза определяется посредством клапана, который обеспечивает доставку отмеренного количества. Устройства по настоящему изобретению обычно настроены на введение отмеренной дозы или "пшика", содержащей от 0,001 до 10 мг соединения формулы (1). Суммарная суточная доза обычно составляет от 0,001 до 40 мг, которые могут быть введены в виде разовой дозы или, в более типичном случае, в разделенных дозах на протяжении суток. Соединения формулы (1) особенно подходят для введения посредством ингаляции. Соединения по настоящему изобретению могут быть введены ректально или вагинально, например,в форме суппозитория, пессария или клизмы. Какао-масло представляет собой традиционную основу для суппозиториев, но, если целесообразно, могут быть использованы различные альтернативы. Композиции для ректального/вагинального введения могут быть приготовлены для немедленого и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции для замедленного, непрерывного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Соединения по настоящему изобретению могут быть также введены непосредственно в глаз или ухо, обычно в форме капель или тонкодисперсной суспензии или раствора в изотоническом, со скорректированным значением рН, стерильном солевом растворе. Другие композиции, подходящие для глазного или ушного введения, включают мази, биоразлагаемые (например, адсорбирующие гелевые губки, коллаген) и бионеразлагаемые (например, силикон) имплантаты, облатки, линзы и корпускулярные или везикулярные системы, такие как ниосомы или липосомы. В композицию может быть включен полимер,такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая камедь, вместе с консервантом, таким как хлорид бензалкония. Такие композиции могут быть также введены посредством ионофореза. Композиции для глазного/ушного введения могут быть приготовлены для немедленого и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции для замедленного, непрерывного, пульсирующего, контролируемого, направленного и программируемого высвобождения. Соединения по настоящему изобретению могут быть объединены с растворимыми макромолекулярными образованиями, такими как циклодекстрин и его подходящие производные или содержащие полиэтиленгликоль полимеры, с целью улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или стабильности для использования в любом из упомянутых выше способов введения. Обнаружено, что комплексы лекарственное средство - циклодекстрин, как правило, применимы для большинства лекарственных форм и путей введения. Могут быть использованы как комплексы включения, так и комплексы, не являющиеся комплексами включения. В качестве альтернативы прямому комплексообразованию с лекарственным средством циклодекстрин может быть использован в качестве вспомогательной добавки, т.е. в качестве носителя, разбавителя или солюбилизатора. Наиболее часто используемыми для этих целей являются -, - и -циклодекстрины, примеры которых могут быть найдены в международных заявках на выдачу патента WO 91/11172, WO 94/02518 и WO 98/55148. Поскольку может оказаться желательным введение сочетания активных соединений, например, с целью лечения конкретного заболевания или состояния, то объем настоящего изобретения охватывает возможность того, что две или несколько фармацевтических композиций, по крайней мере одна из которых содержит соединение по настоящему изобретению, могут быть подходящим образом объединены в форме набора, подходящего для совместного введения композиций. Таким образом, набор по настоящему изобретению содержит две или несколько отдельных фармацевтических композиций, по крайней мере одна из которых содержит соединение формулы (1) по настоящему изобретению, и средства для раздельного сохранения упомянутых композиций, такие как контейнер, разделенный на части флакон или разделенный на части фольтированный пакет. Примером такого набора является обычная блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобного. Набор по настоящему изобретению особенно применим для введения различных лекарственных форм, например парентеральных, для введения отдельных композиций с различными интервалами между принятием доз, или для титрования отдельных композиций друг относительно друга. Для соблюдения схемы лечения набор обычно содержит инструкции для введения и может быть укомплектован так назы- 20016203 ваемой "памяткой". Для введения пациентам-людям суммарная суточная доза соединений по настоящему изобретению обычно составляет от 0,001 до 5000 мг, естественно, в зависимости от способа введения. Например,внутривенная суточная доза может составлять лишь от 0,001 до 40 мг. Суммарная суточная доза может быть введена однократно или может быть разделена на дозы, и по усмотрению врача может выходить за рамки обычного диапазона доз, представленного в этом документе. Указанные дозировки рассчитаны на основании средних показателей человека, имеющего массу приблизительно от 65 до 70 кг. Врач легко способен определить дозы для субъектов, чей вес выходит за указанные рамки, как, например, у детей и лиц старшего возраста. Во избежание недоразумений представленные в этом документы ссылки на "лечение" включают ссылки на куративное, паллиативное и профилактическое лечение. В соответствии с другим примером осуществления настоящего изобретения соединения формулы(1) или их фармацевтически приемлемые соли, производные формы или композиции также могут быть использованы в сочетании с одним или несколькими дополнительными терапевтическими средствами для совместного введения пациенту с целью получения некоторого конкретно желаемого терапевтического конечного результата, такого как лечение патофизиологически релевантных болезненных процессов, включая без ограничения (i) бронхостеноз, (ii) воспаление, (iii) аллергию, (iv) разрушение тканей, (v) признаки и симптомы болезни, такие как одышка, кашель. Второе и последующие дополнительные терапевтические средства также могут представлять собой соединение формулы (1) или его фармацевтически приемлемую соль, производные формы или композиции, или один или несколько агонистов 2 адренорецепторов, антагонистов мускариновых рецепторов, или соединений, действующих в качестве агонистов 2-адренорецепторов и в качестве антагонистов мускариновых рецепторов, известных в данной области техники. В более типичном случае второе и последующие терапевтические средства выбирают из другого класса терапевтических средств. Предполагается, что используемые в этом документе термины "совместное введение", "совместно вводимый" или "в сочетании с", относящиеся к соединениям формулы (1) и одному или нескольким другим терапевтическим средствам, означают следующее, относятся к следующему и включают следующее: одновременное введение такого сочетания соединения(й) формулы (1) и терапевтического(их) средства(в) нуждающемуся в лечении пациенту, при котором такие компоненты представлены совместно в единой лекарственной форме, которая высвобождает упомянутые компоненты, по существу, в одно и то же время в организме упомянутого пациента,по существу, одновременное введение такого сочетания соединения(й) формулы (1) и терапевтического средства(в) нуждающемуся в лечении пациенту, при котором такие компоненты представлены отдельно друг от друга в отдельных лекарственных формах, которые принимаются упомянутым пациентом, по существу, в одно и то же время, вследствие чего упомянутые компоненты высвобождаются, по существу, в одно и то же время в организме упомянутого пациента,последовательное введение такого сочетания соединения(й) формулы (1) и терапевтического средства(в) нуждающемуся в лечении пациенту, при котором такие компоненты представлены отдельно друг от друга в отдельных лекарственных формах, которые принимаются упомянутым пациентом последовательно со значительным временным интервалом между каждым введением, вследствие чего упомянутые компоненты высвобождаются, по существу, в различное время в организме упомянутого пациента; и последовательное введение такого сочетания соединения(й) формулы (1) и терапевтического средства(в) нуждающемуся в лечении пациенту, при котором такие компоненты представлены совместно в единой лекарственной форме, которая высвобождает в организме упомянутого пациента упомянутые компоненты контролируемым образом, так что они вводятся одновременно, последовательно и/или с перекрыванием в одно и то же и/или в различные моменты времени, при этом каждая часть может быть введена либо одним и тем же, либо другим способом. Подходящие примеры других терапевтических средств, которые могут быть использованы в сочетании с соединением(ями) формулы (1) или с их фармацевтически приемлемыми солями, производными формами или комбинациями включают без ограничения: ингибиторы 5-липоксигеназы (5-LO) или антагонисты белка-активатора 5-липоксигеназы (FLAP); антагонисты лейкотриенов (LTRAs), включая антагонисты LTB4, LTC4, LTD4 и LTE4; антагонисты гистаминовых рецепторов, включая антагонисты H1 и Н 3; сосудосуживающие симпатомиметики для уменьшения застойных явлений, являющиеся агонистами 1- и 2-адренорецепторов; ингибиторы PDE, например ингибиторы PDE3, PDE4 и PDE5; теофиллин; кромгликат натрия; ингибиторы СОХ как неселективные, так и селективные ингибиторы СОХ-1 или СОХ-2 (NSAIDs); антагонисты простагландиновых рецепторов и ингибиторы простагландинсинтазы; пероральные и ингалируемые глюкокортикостероиды;- 21016203 диссоциированные агонисты кортикоидного рецептора (DAGR); моноклональные антитела против эндогенных воспалительных объектов; средства против фактора некроза опухоли (анти-TNF-); ингибиторы молекул адгезии, включая антагонисты VLA-4; антагонисты кинин-B1- и В 2-рецепторов; иммуносупрессивные средства, включая ингибиторы IgE пути и циклоспорин; ингибиторы матриксных металлопротеаз (MMPs); антагонисты тахикининовых NK1, NK2- и NK3-рецепторов; ингибиторы протеаз, такие как ингибиторы эластазы; агонисты аденозинового А 2 а-рецептора и антагонисты аденозинового А 2b-рецептора; ингибиторы урокиназы; соединения, воздействующие на дофаминовые рецепторы, такие как агонисты D2-рецептора; модуляторы NF пути, такие как ингибиторы IKK; модуляторы цитокиновых сигнальных путей, такие как р 38 МАР-киназа, PI3-киназа, JAK-киназа,syk-киназа, EGFR или MK-2; средства, которые можно классифицировать как муколитические и противокашлевые средства; средства, которые усиливают ответ на ингалируемые кортикостероиды; антибиотики и противовирусные средства, эффективные в отношении микроорганизмов, которые населяют дыхательные пути; ингибиторы HDAC; антагонисты CXCR2; антагонисты интегринов; хемокины; блокаторы натриевого канала эпителия (ENaC) или ингибиторы натриевого канала эпителия(ENaC); агонисты P2Y2 и другие агонисты нуклеотидного рецептора; ингибиторы тромбоксана; ниацин и факторы адгезии, включая VLAM, ICAM и ELAM. В соответствии с настоящим изобретением предпочтительными являются сочетания соединений формулы (1) с Н 3-антагонистами; ингибиторами PDE4; пероральными и ингалируемыми глюкокортикостероидами; диссоциированными агонистами кортикоидного рецептора (DAGR); агонистами аденозинового А 2 а-рецептора; модуляторами цитокиновых путей передачи сигнала, такими как р 38 МАР-киназа, PI3-киназа, JAKкиназа, syk-киназа, EGFR или MK-2, или антагонистами лейкотриенов (LTRAs), включая антагонисты LTB4, LTC4, LTD4 и LTE4. В соответствии с настоящим изобретением также предпочтительными являются сочетания соединений формулы (1) глюкокортикостероидами, включая преднизон, преднизолон, флунизолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флутиказона пропионат, циклесонид, мометазона фуроат и мометазона фуроат моногидрат, и, в особенности, ингалируемые глюкокортикостероиды со сниженными системными побочными эффектами. Следует понимать, что все приведенные в этом документе ссылки на лечение включают куративное, паллиативное и профилактическое лечение. Соединения формулы (1) обладают способностью взаимодействовать с 2-рецепторами и холинергическими мускариновыми рецепторами и обладают тем самым широким спектром терапевтических применений, описанных далее, вследствие существенной роли, которую играют 2-рецепторы и мускариновые рецепторы в физиологии всех млекопитающих. Поэтому дополнительный аспект настоящего изобретения относится к соединениям формулы (1) или их фармацевтически приемлемым солям, производным формам или композициям для использования при лечении заболеваний, нарушений и состояний, в которые вовлечены 2-рецепторы и/или мускариновые рецепторы. Более конкретно настоящее изобретение также относится к соединениям формулы (1) или их фармацевтически приемлемым солям, производным формам или композициям для использования при лечении заболеваний, нарушений и состояний, выбранных из группы, состоящей из астмы любого типа, этиологии и патогенеза, в частности астмы, которую выбирают из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопической бронхиальной- 22016203 факторами окружающей среды, эссенциальной астмы неизвестной или скрытой причины, неатопической астмы, астмы, ускоренной бронхитом, эмфизематозной астмы, астмы, индуцированной физической нагрузкой, аллерген-индуцированной астмы, астмы, индуцированной холодным воздухом, профессиональной астмы, инфекционной астмы, обусловленной бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергической астмы, предастмы, синдрома стерторозного дыхания у детей и бронхиолита; хронического или острого бронхостеноза, хронического бронхита, обструкции малых дыхательных путей и эмфиземы; обструктивных или воспалительных заболеваний дыхательных путей любого типа, этиологии и патогенеза, в частности обструктивного или воспалительного заболевания дыхательных путей, которое выбирают из группы, состоящей из хронической эозинофильной пневмонии, хронической обструктивной болезни легких (ХОБЛ), ХОБЛ, которая включает хронический бронхит, эмфизему легких или одышку,ассоциированную или неассоциированную с ХОБЛ, ХОБЛ, которая характеризуется необратимой, прогрессирующей обструкцией дыхательных путей, респираторного дистресс-синдрома взрослых (ARDS),обострения гиперактивности дыхательных путей вследствие другой терапии и заболевания дыхательных путей, ассоциированного с легочной гипертензией; бронхита любого типа, патологии или патогенеза, в частности бронхита, который выбирают из группы, состоящей из острого бронхита, острого ларинготрахеального бронхита, арахидного бронхита,катарального бронхита, крупозного бронхита, сухого бронхита, инфекционного астматического бронхита, продуктивного бронхита, стафилококкового или стрептококкового бронхита и везикулярного бронхита; острого поражения легкого; бронхоэктаза любого типа, патологии или патогенеза, в частности бронхоэктаза, который выбирают из группы, состоящей из цилиндрического бронхоэктаза, мешотчатого бронхоэктаза, веретенообразного бронхоэктаза, капиллярного бронхоэктаза, кистозного бронхоэктаза, сухого бронхоэктаза и фолликулярного бронхоэктаза. Еще один аспект настоящего изобретения также относится к использованию соединений формулы(1) или их фармацевтически приемлемых солей, производных форм или композиций для изготовления лекарства, обладающего 2-агонистической активностью и М 3-антагонистической активностью. В частности, настоящее изобретение относится к использованию соединений формулы (1) или их фармацевтически приемлемых солей, производных форм или композиций для изготовления лекарственного средства для лечения заболеваний и/или состояний с вовлечением 2- и М 3-рецепторов, в частности заболеваний и/или состояний, перечисленных выше. Как следствие, настоящее изобретение относится к особенно интересному способу лечения млекопитающего, включая человека, эффективным количеством соединения формулы (1) или его фармацевтически приемлемой соли, производной формы или композиции. Более точно, настоящее изобретение относится к особенно интересному способу лечения 2-опосредованных заболеваний и/или состояний с вовлечением 2- и М 3-рецепторов у млекопитающего, включая человека, в частности заболеваний и/или состояний, перечисленных выше, включающему введение упомянутому млекопитающему эффективного количества соединения формулы (1) его фармацевтически приемлемых солей и/или производных форм. Следующие примеры иллюстрируют получение соединений формулы (1). Пример получения 1. ди-трет-Бутил(9-бромнонил)имидокарбонат К перемешанному раствору ди-трет-бутилиминодикарбамат (6,50 г, 30,0 ммоль) в N,Nдиметилформамиде (5 мл) при 0 С в атмосфере азота одной порцией добавляли гидрид натрия (1,31 г 60% дисперсия в масле, 30,0 ммоль). Реакционную смесь перемешивали в течение 5 мин при 0 С, а затем перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь охлаждали до 0 С и по каплям добавляли 1,9-дибромнонан (8,60 г, 30,0 ммоль), реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 суток. Осторожно добавляли диэтиловый эфир (50 мл) и воду (20 мл), органическую фазу разделяли, водный слой промывали диэтиловым эфиром (50 мл),объединенные органические фазы сушили (сульфат магния) и удаляли растворитель в вакууме с получением чистого масла. Масло очищали по методу колоночной хроматографии на силикагеле, элюируя диэтиловым эфиром/гексаном (10/90 по объему), с получением указанного в заголовке соединения в виде бесцветного масла, 5,80 г. 1 Н-ЯМР (400 МГц, CD3OD):= 1,30 (10 Н, м), 1,50 (20 Н, м), 1,83 (2 Н, м), 3,42 (2 Н, т), 3,58 (2 Н, т) м.д. ди-трет-Бутил(9-бромнонил)имидокарбонат (пример получения 1, 1,80 г, 4,26 ммоль) и трифенилфосфин (2,00 г, 7,63 ммоль) растворяли в ацетонитриле (40 мл) и нагревали с обратным холодильником в течение 48 ч. Реакционную смесь охлаждали до комнатной температуры и выпаривали растворитель в вакууме до 8 мл. Реакционную смесь нагревали с обратным холодильником в течение 12 ч и охлаждали до комнатной температуры. Растворитель удаляли в вакууме с получением промежуточной фосфониевой соли в виде смолы. Смолу (1,70 г, 2,48 ммоль) растворяли в тетрагидрофуране (15 мл) и охлаждали до-78 С в атмосфере азота. По каплям добавляли н-бутиллитий (0,90 мл 2,5 М раствора в гексанах,2,25 ммоль) с получением оранжевого раствора, который затем нагревали до 0 С и перемешивали в течение 45 мин. Реакционную смесь охлаждали до -78 С, по каплям добавляли раствор 4-(бензилокси)-3[(1R)-3-(диизопропиламино)-1-фенилпропил]бензальдегидаWO 2005/012227, 320 мг, 0,75 ммоль) в тетрагидрофуране (5 мл) и перемешивали реакционную смесь при -78 С в течение 10 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 12 ч, а затем выливали на этилацетат (30 мл) и воду (20 мл). Органическую фазу разделяли, сушили (сульфат магния), удаляли растворитель в вакууме, остаток очищали по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (90/10/1,0 по объему), с получением указанного в заголовке соединения в виде белой смолы, 140 мг. ЖХ-МС: m/z 755,7 [М+Н]+. Пример получения 3. 10-4-(Бензилокси)-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]фенилдец-9-ен-1-амин К перемешанному раствору ди-трет-бутил[10-4-(бензилокси)-3-[(1R)-3-(диизопропиламино)-1 фенилпропил]фенилдец-9-ен-1-ил]имидодикарбоната (пример получения 2, 450 мг, 0,59 ммоль) в дихлорметане (5 мл) при комнатной температуре в атмосфере азота одной порцией добавляли соляную кислоту (10,0 мл 2 М раствора в диэтиловом эфире). Реакционную смесь перемешивали в течение 2 ч, удаляли растворитель в вакууме, остаток растворяли в этилацетате (30 мл) и насыщенном водном гидрокарбонате натрия (20 мл). Органическую фазу разделяли, промывали водой (10 мл), сушили (сульфат магния) и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (90/10/1,0 по объему), с получением указанного в заголовке соединения в виде прозрачного твердого вещества, 180 мг. ЖХ-МС: m/z 556 [М+Н]+. Пример получения 4.(20 мл) и воду (10 мл), органическую фазу разделяли, промывали водой (10 мл), сушили (сульфат магния) и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (80/20/2,0 по объему), с получением указанного в заголовке соединения в виде прозрачного твердого вещества, 90 мг. ЖХ-МС: m/z 989 [М+Н]+. Пример получения 5. трет-Бутил 2-[4-(аллилокси)фенил]этилкарбамат К суспензии карбоната калия (4,40 г, 31,8 ммоль) и трет-бутил[2-(4-гидроксифенил)этил]карбамата(полученного в соответствии с Journal of Organic Chemistry 1999, 64, 1074, 5,00 г, 21,1 ммоль) в ацетонитриле (50 мл) при комнатной температуре одной порцией добавляли аллилбромид (2,10 мл, 24,8 ммоль). Реакционную смесь перемешивали в течение 12 ч и удаляли растворитель в вакууме. Добавляли диэтиловый эфир (50 мл) и воду (20 мл), органическую фазу разделяли, промывали водой (20 мл), сушили(сульфат магния) и удаляли растворитель в вакууме с получением чистого масла. Масло очищали по методу колоночной хроматографии на силикагеле, элюируя этилацетатом/пентаном (25/75 по объему), с получением указанного в заголовке соединения в виде белого твердого вещества, 3,80 г. 1 Н-ЯМР (400 МГц, CDCl3):= 1,42 (9 Н, с), 2,78 (2 Н, м), 3,37 (2 Н, м), 4,58 (3 Н, м), 5,28 (1 Н, дд), 5,40(10 мл) в атмосфере азота в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и выливали на этилацетат (30 мл) и воду (20 мл). Органическую фазу разделяли, промывали насыщенным водным гидрокарбонатом натрия (20 мл), водой (20 мл), солевым раствором (20 мл), сушили (сульфат магния) и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (90/10/1,0 по объему), с получением указанного в заголовке соединения в виде прозрачного твердого вещества, 475 мг. ЖХ-МС: m/z 677 [М+Н]+. Пример получения 7. трет-Бутил 2-[4-(3-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенилпропокси)фенил]этилкарбамат трет-Бутил[2-(4-[(2 Е)-3-4-(бензилокси)-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]фенилпроп-2-ен-1-ил]оксифенил)этил]карбамат (пример получения 6, 475 мг, 0,70 ммоль) растворяли в этаноле (20 мл) и добавляли 10% палладированный уголь (50 мг). Реакционную смесь нагревали до 40 С при давлении 50 фунт/дюйм 2 (3,45105 Па) водорода в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали через Arbocel, фильтрат собирали и удаляли растворитель в вакууме с получением указанного в заголовке соединения в виде прозрачного твердого вещества, 400 мг. ЖХ-МС: m/z 589 [М+Н]+. трет-Бутил 2-[4-(3-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенилпропокси)фенил]этилкарбамат (пример получения 7, 400 мг, 0,68 ммоль) растворяли в дихлорметане (15 мл) и к перемешанному раствору при 0 С добавляли соляную кислоту (10 мл 2 М раствора в диэтиловом эфире). Через 3 ч удаляли растворитель в вакууме, добавляли этилацетат (20 мл) и насыщенный водный гидрокарбонат натрия (10 мл), разделяли органическую фазу. Водную фазу промывали дихлорметаном/метанолом (90:10, по объему, 220 мл), органические фазы объединяли, сушили (сульфат магния) и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле,элюируя дихлорметаном/метанолом/880 аммиаком (80/20/2,0 по объему), с получением указанного в заголовке соединения в виде прозрачного твердого вещества, 135 мг. ЖХ-МС: m/z 489 [М+Н]+. Пример получения 9.(20 мл) и воду (10 мл), разделяли органическую фазу. Водную фазу промывали этилацетатом (20 мл),объединенные органические фазы промывали солевым раствором (10 мл), сушили (сульфат магния) и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (80/20/2,0 по объему), с получением указанного в заголовке соединения в виде прозрачного твердого вещества, 101 мг. ЖХ-МС: m/z 923 [М+Н]+. Пример получения 10.N-2-(Бензилокси)-5-[(1R)-1-[трет-бутил(диметил)силил]окси-2-(2-[4-(3-3-[(1R)-3(диизопропиламино)-1-фенилпропил]-4-гидроксифенилпропокси)фенил]этиламино)этил]фенилметансульфонамид (пример получения 9, 100 мг, 0,11 ммоль) растворяли в этаноле (10 мл) и добавляли формиат аммония (68 мг, 1,07 ммоль) и 10% гидроксид палладия на угле (20 мг). Перемешанную реакционную смесь нагревали при 90 С в течение 2 ч, охлаждали до комнатной температуры и фильтровали через Arbocel, собирали фильтрат и удаляли растворитель в вакууме с получением указанного в заголовке соединения в виде желтого прозрачного твердого вещества, 98 мг. ЖХ-МС: m/z 833 [М+Н]+.Chemistry 1999, 64, 1074, 1 г, 4,2 ммоль) растворяли в диметилформамиде (8 мл) и добавляли карбонат калия (698 мг, 5,1 ммоль), а затем 4-бромбут-1-ен (0,51 мл, 5,1 ммоль), нагревали смесь до 60 С. Через 5 ч охлаждения до комнатной температуры добавляли дополнительную порцию карбоната калия (698 мг,5,1 ммоль) и 4-бромбут-1-ена (0,51 мл, 5,1 ммоль) и повторно нагревали смесь до 60 С. Через 18 ч охлаждения до комнатной температуры добавляли дополнительную порцию карбоната калия (698 мг,5,1 ммоль) и 4-бромбут-1-ена (0,51 мл, 5,1 ммоль) и снова нагревали смесь до 60 С. Через 5 ч охлаждения до комнатной температуры добавляли дополнительную порцию карбоната калия (350 мг, 2,5 ммоль) и 4-бромбут-1-ена (0,25 мл, 2,5 ммоль) и снова нагревали смесь до 60 С. Смесь оставляли перемешиваться в течение ночи, затем охлаждали до комнатной температуры, добавляли воду, экстрагировали этилацетатом, сушили (сульфат магния) и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле, элюируя пентаном/этилацетатом (80/20 по объему). Повторяли представленное выше взаимодействие с получением 1,1 г промежуточного соединения, которое растворяли в ацетонитриле (10 мл), добавляли (3R)-3-[2-(бензилокси)-5-бромфенил]-N,N-диизопропил-3 фенилпропан-1-амин (полученный в соответствии с WO 9411337, 1,2 г, 2,5 ммоль), трис-(2 метилфенил)фосфин (760 мг, 2,5 ммоль) и диизопропилэтиламин (0,87 мл, 4,99 ммоль) и дегазировали смесь струей газообразного аргона. Добавляли диацетат палладия (280 мг, 1,25 ммоль) и нагревали смесь до 90 С. Через 5 ч смесь охлаждали до комнатной температуры и оставляли перемешиваться в течение ночи. Смесь фильтровали через Arbocel и удаляли растворитель в вакууме. Добавляли воду, экстрагировали этилацетатом, органический слой разделяли и сушили (сульфат магния), удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (98/2/0,296/4/0,4 по объему), с получением указанного в заголовке соединения в виде бесцветной смолы, 1,45 г. ЖХ-МС: m/z 691 [М+Н]+. Пример получения 12. трет-Бутил 2-[4-(4-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенилбутокси)фенил]этилкарбамат трет-Бутил[2-(4-[(3 Е)-4-4-(бензилокси)-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]фенилбут-3-ен-1-ил]оксифенил)этил]карбамат (пример получения 11, 725 мг, 1,05 ммоль) растворяли в этаноле (10 мл), добавляли гидроксид палладия (20 мас.% на угле, 181 мг, 0,25 ммоль), затем формиат аммония (529 мг, 8,39 ммоль), нагревали до 80 С в течение 5 мин, а затем перемешивали при 75 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали смесь через Arbocel и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле,элюируя дихлорметаном/метанолом/880 аммиаком (97/3/0,394/6/0,6 по объему), с получением указанного в заголовке соединения в виде белой пены, 460 мг. ЖХ-МС: m/z 603 [М+Н]+. трет-Бутил 2-[4-(4-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]-4-гидроксифенилбутокси)фенил]этилкарбамат (пример получения 12, 450 мг, 0,75 ммоль) растворяли в дихлорметане (10 мл),добавляли хлороводород (2 М в диэтиловом эфире, 6 мл, 12 ммоль), а затем этанол (1 мл). Через 3 суток растворители удаляли в вакууме с получением указанного в заголовке соединения в виде желтой пены,420 мг. ЖХ-МС: m/z 503 [М (свободное основание)+Н]+. Пример получения 14. К ацетонитрилу (15 мл) добавляли бис-(гидрохлорид) 4-4-[4-(2-аминоэтил)фенокси]бутил-2[(1R)-3-(диизопропиламино)-1-фенилпропил]фенола (пример получения 13, 420 мг, 0,73 ммоль), N-2(бензилокси)-5-[(1R)-2-бром-1-[трет-бутил(диметил)силил]оксиэтил]фенилметансульфонамид (полученный в соответствии с WO 2005/080324, 375 мг, 0,73 ммоль), гидрокарбонат натрия (245 мг,2,92 ммоль) и йодид калия (121 мг, 0,73 ммоль), нагревали до 90 С в течение 30 мин и оставляли при комнатной температуре в течение 48 ч, добавляли воду и экстрагировали этилацетатом, сушили (сульфат магния) и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (97/3/0,392/8/0,8 по объему), с получением указанного в заголовке соединения в виде белой пены, 207 мг. ЖХ-МС: m/z 937 [М+Н]+. Пример получения 15.N-2-(Бензилокси)-5-[(1R)-1-[трет-бутил(диметил)силил]окси-2-(2-[4-(4-3-[(1R)-3(диизопропиламино)-1-фенилпропил]-4-гидроксифенилбутокси)фенил]этиламино)этил]фенилметансульфонамид (пример получения 14, 200 мг, 0,2 ммоль) и гидроксид палладия (20 мас.% на угле, 50 мг, 0,07 ммоль) растворяли в этаноле (5 мл), затем добавляли формиат аммония (74 мг,1,2 ммоль), нагревали до 80 С в течение 5 мин, а затем перемешивали при 75 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, смесь фильтровали через Arbocel и удаляли растворитель в вакууме с получением указанного в заголовке соединения в виде белой пены, 190 мг. ЖХ-МС: m/z 847 [М+Н]+.(2 М, 6 мл), затем пероксид водорода (30 мас.% в воде, 2 мл) и оставляли реакционную смесь перемешиваться в течение ночи. Смесь распределяли между водой и диэтиловым эфиром, органический слой разделяли, промывали насыщенным раствором сульфита натрия, сушили (сульфат магния), фильтровали и удаляли растворитель в вакууме. Остаток очищали по методу колоночной хроматографии на силикагеле,элюируя дихлорметаном/метанолом/880 аммиаком (24/1/0,123/2/0,2 по объему), с получением указанного в заголовке соединения в виде светло-коричневой пены, 560 мг. ЖХ-МС: m/z 418 [М+Н]+. Пример получения 17. ди-трет-Бутил(7-4-(бензилокси)-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]феноксигептил)имидокарбонат 4-(Бензилокси)-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]фенол (пример получения 16, 150 мг,0,36 ммоль) растворяли в диметилформамиде (2 мл), добавляли карбонат цезия (140 мг, 0,43 ммоль) и перемешивали при комнатной температуре в течение 30 мин. Добавляли трет-бутил(7 бромгептил)карбамат (полученный в соответствии с J. Med. Chem., 1994, 137, p. 2537-2551; 170 мг,0,43 ммоль), растворенный в диметилформамиде (1 мл) и нагревали до 70 С. Через 2,5 ч добавляли карбонат цезия (70 мг, 0,22 ммоль) и еще через 10 мин добавляли трет-бутил(7-бромгептил)карбамат (70 мг,0,18 ммоль). Через 1 ч добавляли карбонат цезия (20 мг, 0,06 ммоль) и трет-бутил(7 бромгептил)карбамат (35 мг, 0,09 ммоль), спустя 1 ч при 70 С охлаждали смесь до комнатной температуры, перемешивали ее в течение 3 суток, после чего добавляли воду и солевой раствор, экстрагировали смесь этилацетатом, сушили (сульфат магния), фильтровали, удаляли растворители в вакууме и очищали остаток по методу колоночной хроматографии на силикагеле, элюируя дихлорметаном/метанолом/880 аммиаком (98/2/0,295/5/0,5 по объему), с получением указанного в заголовке соединения в виде бесцветной смолы, 220 мг. ЖХ-МС: m/z 731 [М+Н]+. Пример получения 18. бис-(Гидрохлорид) 7-4-(бензилокси)-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]феноксигептан-1-амина ди-трет-Бутил(7-4-(бензилокси)-3-[(1R)-3-(диизопропиламино)-1-фенилпропил]феноксигептил)имидокарбонат (пример получения 17, 220 мг, 0,30 ммоль) растворяли в дихлорметане (6 мл), затем добавляли хлороводород (2 М раствор в диэтиловом эфире, 6 мл, 12 ммоль), через 30 мин добавляли этанол
МПК / Метки
МПК: C07C 311/08, C07C 217/48, A61P 37/08, C07C 271/16, C07D 215/26, A61P 29/00, C07C 255/13, A61K 31/18, C07C 233/43, C07D 215/60, A61P 11/08
Метки: производные, амина
Код ссылки
<a href="https://eas.patents.su/30-16203-proizvodnye-amina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные амина</a>
Предыдущий патент: Окрашенные изделия, полученные ротационным формованием
Следующий патент: Производные триазолпиразинов, применимые в качестве противораковых агентов
Случайный патент: Многостадийный способ получения газонаполненных микрокапсул












