Замещенные бициклические производные в качестве противораковых агентов
Номер патента: 6107
Опубликовано: 25.08.2005
Авторы: Лью Женгью, Бхаттачарья Сеймит Кумар, Кат Джон Чарльз, Моррис Джоуэл, Том Норма Жаклин, Кокс Эрик Дейвид
Формула / Реферат
1. Соединение формулы 1

или его фармацевтически приемлемая соль, или сольват,
где X представляет собой N;
A представляет собой конденсированное 6-членное углеродное кольцо, содержащее в сумме 3 двойные связи, включая связь в пиримидиновом кольце, с которым оно конденсировано, и где указанная группировка A возможно замещена группами R5 в количестве от 1 до 3;
каждый R1 и R2 независимо представляет собой H или C1-C6алкил;
R3 представляет собой -(CR1R2)m-R8, где m равно 0 или 1;
или R1 и R3, взятые вместе, образуют группу формулы
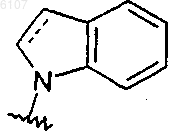
причем указанная группа возможно замещена группами R5 в количестве от 1 до 3;
R4 представляет собой -(CR1R2)m-Cу C-(CR1R2)tR9, -(CR1R2)m-Cу C-(CR1R2)t-R9, -C=NOR12 или -X1-R12, где m равно целому числу от 0 до 3, t равно целому числу от 0 до 5 и X1 представляет собой двухвалентную группу, производную от азетидина, оксетана или C3-C4карбоциклической группы;
либо R4 представляет собой -(CR1R2)m-Cу C-(CR1R2)kR13 или -(CR1R2)m-C=C-(CR1R2)k-R13, где k равно целому числу от 1 до 3, а m равно целому числу от 0 до 3;
либо R4 представляет собой -(CR1R2)tR9, где t равно целому числу от 0 до 5, а местом соединения с R9 является атом углерода группы R9;
каждый R5 независимо выбран из галогено, гидрокси, -NR1R2, C1-C6алкила, трифторметила, C1-C6алкокси, трифторметокси, -C(O)R6, -CO2R6, -NR6C(O)R1, -C(O)NR6R7, -SO2NR6R7, -NR6C(O)NR7R1 и -NR6C(O)OR7;
каждый R6 и R7 независимо выбран из H, C1-C6алкила, -(CR1R2)t(C6-C10арил) и -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5, при этом 1 или 2 кольцевых атома углерода гетероциклической группы возможно замещены оксо(=O) группировкой, а алкильные, арильные и гетероциклические группировки вышеупомянутых групп R6 и R7 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, -NR1R2, трифторметила, трифторметокси, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, гидрокси и C1-C6алкокси;
R8 независимо выбран из -(CR1R2)t(C6-C10арил) и -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5, при этом 1 или 2 кольцевых атома углерода гетероциклической группы возможно замещены оксо(=O) группировкой, а каждая из вышеупомянутых групп R8 возможно замещена группами R10 в количестве от 1 до 5;
R9 представляет собой неароматическое моноциклическое кольцо, конденсированное или мостиковое бициклическое кольцо или спироциклическое кольцо, причем указанное кольцо содержит от 3 до 12 атомов углерода, в числе которых от 0 до 3 атомов углерода возможно заменены гетерогруппировкой, независимо выбранной из N, O, S(O)j, где j равно целому числу от 0 до 2, и -NR12-, при условии что два атома O, две группировки S(O)j, атом O и группировка S(O)j, атом N и атом S или атом N и атом O не связаны непосредственно друг с другом в пределах указанного кольца, и при этом атомы углерода указанного кольца возможно замещены группами R11 в количестве от 1 до 2;
каждый R10 независимо выбран из галогено, циано, нитро, трифторметокси, трифторметила, азидо, гидрокси, C1-C6алкокси, C1-C10алкила, C2-C6алкенила, C2-C6алкинила, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR6C(O)R7, -NR6C(O)NR1R7, -NR6C(O)OR7, -C(O)NR6R7, -NR6R7, -NR6OR7, -SO2NR6R7, -S(O)j(C1-C6алкил), где j равно целому числу от 0 до 2, -(CR1R2)t(C6-C10арил), -(CR1R2)t(4-10-членный гетероцикл), -(CR1 R2)qC(O)(CR1 R2)t(C6-C10арил), -(CR1 R2)qC(O)(CR1 R2)t(4-10-членный гетероцикл), -(CR1 R2)tO(CR1 R2)q(C6-C10арил), -(CR1R2)tO(CR1R2)q(4-10-членный гетероцикл), -(CR1R2)qS(O)j(CR1R2)t(C6-C10арил) и -(CR1R2)qS(O)j(CR1R2)t(4-10-членный гетероцикл), где j равно 0, 1 или 2, q и t, каждый независимо, равен целому числу от 0 до 5, при этом 1 или 2 кольцевых атома углерода гетероциклических группировок вышеупомянутых групп R10 возможно замещены оксо(=O) группировкой, а алкильные, алкенильные, алкинильные, арильные и гетероциклические группировки вышеупомянутых групп R10 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, трифторметила, трифторметокси, азидо, -OR6, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -NR6OR7, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, -(CR1R2)t(C6-C10арил) и -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5;
каждый R11 независимо выбран из -R12, -OR1, -NR1R2, -NR6C(O)R7, -NR6C(O)NR7R1, -NR6C(O)OR7 и -NR6SO2NR7R1, либо R11 заменяет два атома водорода на углероде с образованием оксо (C=O) группы;
R12 представляет собой R6, -C(O)R6 или -SO2R6, -C(O)NR6R7, -SO2NR6R7 или -CO2R6;
R13 представляет собой -NR1R12 или -OR12;
и где любой из вышеупомянутых заместителей, содержащих CH3 (метильную), CH2 (метиленовую) или CH (метиновую) группу, которая не связана с галогено, группой SO или SO2 или с атомом N, O или S, возможно несет на указанной группе заместитель, выбранный из гидрокси, галогено, C1-C4алкила, C1-C4алкоксш ш -NR1R2.
2. Соединение по п.1, где R4 представляет собой -(CR1R2)m-Cу C-(CR1R2)tR9, где m равно целому числу от 0 до 3, а t равно целому числу от 0 до 5.
3. Соединение по п.1, где R4 представляет собой -(CR1R2)m-C=C-(CR1R2)t-R9 и m равно целому числу от 0 до 3, а t равно целому числу от 0 до 5.
4. Соединение по п.1, где R4 представляет собой -(CR1R2)m-Cу C-(CR1R2)kR13 или -(CR1R2)m-C=C-(CR1R2)kR13, где m равно целому числу от 0 до 3, а k равно целому числу от 1 до 3.
5. Соединение по п.1, где R4 представляет собой -C=NOR12 или -X1-R12, где X1 представляет собой двухвалентную группу, производную от азетидина, оксетана или C3-C4карбоциклической группы; либо R4 представляет собой -(CR1R2)tR9, где местом соединения с R9 является атом углерода R9.
6. Соединение по п.2, где R8 выбран из -(CR1R2)t(фенил), -(CR1R2)t(пиридил), -(CR1R2)t(пиримидинил), -(CR1R2)t(индолил), -(CR1R2)t(индазолил) и -(CR1R2)t(бензимидазолил), где t равно целому числу от 0 до 5, и каждая из вышеупомянутых групп R8 возможно замещена группами R10 в количестве от 1 до 5.
7. Соединение по п.3, где R8 выбран из -(CR1R2)t(фенил), -(CR1R2)t(пиридил), -(CR1R2)t(пиримидинил)-(CR1R2)t(индолил), -(CR1R2)t(индазолил) и -(CR1R2)t(бензимидазолил), где t равно целому числу от 0 до 5, и каждая из вышеупомянутых групп R8 возможно замещена группами R10 в количестве от 1 до 5.
8. Соединение по п.4, где R8 выбран из -(CR1R2)t(фенил), -(CR1R2)t(пиридил), -(CR1R2)t(пиримидинил), -(CR1R2)t(индолил), -(CR1R2)t(индазолил) и -(CR1R2)t(бензимидазолил), где t равно целому числу от 0 до 5, и каждая из вышеупомянутых групп R8 возможно замещена группами R10 в количестве от 1 до 5.
9. Соединение по п.3, где R8 выбран из -(CR1R2)t(фенил), -(CR1R2)t(пиридил), -(CR1R2)t(пиримидинил), -(CR1R2)t(индолил), -(CR1R2)t(индазолил) и -(CR1R2)t(бензимидазолил), где t равно целому числу от 0 до 5, и каждая из вышеупомянутых групп R8 возможно замещена группами R10 в количестве от 1 до 5.
10. Соединение по п.6, где переменная m в группе R4 равна 0, t в группе R8 равно целому числу между 0 и 2 и R9 представляет собой 4-10-членную гетероциклическую группу, имеющую от 1 до 3 гетерогруппировок, как указано в п.1, и где указанный R9 возможно замещен группами R11 в количестве от 1 до 2.
11. Соединение по п.8, где R4 представляет собой -(CR1R2)m-Cу C-(CR1R2)kR13, где m равно 0, а k равно целому числу от 1 до 2.
12. Соединение по п.9, где R4 представляет собой -(CR1R2)tR9, где местом соединения с R9 является атом углерода R9; t равно целому числу от 0 до 2 и R9 представляет собой 4-10-членную гетероциклическую группу, имеющую от 1 до 3 гетерогруппировок, как указано в п.1, и где указанный R9 возможно замещен группами R11 в количестве от 1 до 2.
13. Соединение по п.1, выбранное из группы, состоящей из
3-[4-(1-бензолсульфонил-1H-индол-5-иламино)хиназолин-6-ил]аллилового эфира уксусной кислоты;
(1-бензолсульфонил-1H-индол-5-ил)-{6-[3-(4-метилпиперазин-1-ил)проп-1-инил]хиназолин-4-ил}амина;
(1-бензолсульфонил-1H-индол-5-ил)-[6-(3-пирролидин-1-ил-проп-1-инил)хиназолин-4-ил]амина;
4-[4-(1-бензолсульфонил-1H-индол-5-иламино)хиназолин-6-илэтинил]пиперидин-4-ола;
(1-бензолсульфонил-1H-индол-5-ил)-(6-пиперидин-4-илэтинилхиназолин-4-ил)амина;
[6-(4-аминотетрагидропиран-4-илэтинил)хиназолин-4-ил]-(1-бензолсульфонил-1H-индол-5-ил)амина;
1-метил-4-{4-[3-метил-4-(пиридин-2-илметокси)фениламино]хиназолин-6-илэтинил}пиперидин-4-ола;
1-[4-(1-бензолсульфонил-1H-индол-5-иламино)хиназолин-6-ил]-4-метилпент-1-ин-3-ола;
4-{4-[4-(1-фенилэтокси)фениламино]хиназолин-6-илэтинил}тетрагидропиран-4-ола;
1-[4-(1-бензолсульфонил-1H-индол-5-иламино)хиназолин-6-ил]-4,4-диметилпент-1-ин-3-ола;
4,4-диметил-1-{4-[4-(1-фенилэтокси)фениламино]хиназолин-6-ил}пент-1-ин-3-ола;
3-{4-[1-(пропан-2-сульфонил)-1H-индол-5-иламино]хиназолин-6-илэтинил}пиперидин-3-ола;
1-метил-3-[4-(4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
3-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]-1-пирролидин-2-ил-проп-2-ин-1-ола;
5-[4-(1-бензил-1H-индазол-5-иламино)хиназолин-6-илэтинил]-4,4-диметилоксазолидин-2-она;
4-амино-1-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]пент-1-ин-3-ола;
4-амино-1-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]-4-метилпент-1-ин-3-ола;
3-{2-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]этил}пиперидин-3-ола
и фармацевтически приемлемых солей и сольватов вышеуказанных соединений.
14. Соединение по п.1, выбранное из группы, состоящей из
(+)-(3-метил-4-феноксифенил)-(6-пиперидин-3(R)-илэтинилхиназолин-4-ил)амина;
(-)-(3-метил-4-феноксифенил)-(6-пиперидин-3(S)-илэтинилхиназолин-4-ил)амина;
метиламида 3-(S)-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-1-карбоновой кислоты;
метиламида 3-(S)-[4-(3-метокси-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-1-карбоновой кислоты;
(3-метил-4-феноксифенил)-(6-пирролидин-3-илэтинилхиназолин-4-ил)амина;
3-[4-(5-метил-6-феноксипиридин-3-иламино)хиназолин-6-илэтинил]пиперидин-3-ола;
(-)-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
(+)-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
4-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]тетрагидропиран-4-ола;
{6-[1-(2-метоксиэтил)пиперидин-3-илэтинил]хиназолин-4-ил}-(3-метил-4-феноксифенил)амина;
[4-(2-фторфенокси)-3-метилфенил]-(6-пиперидин-3-илэтинилхиназолин-4-ил)амина;
[4-(3-фторфенокси)-3-метилфенил]-(6-пиперидин-3-илэтинилхиназолин-4-ил)амина;
(6-азетидин-3-илэтинилхиназолин-4-ил)-(3-метил-4-феноксифенил)амина;
3-{4-[4-(2-фторфенокси)-3-метилфениламино]хиназолин-6-илэтинил}пиперидин-3-ола;
3-{4-[4-(3-фторфенокси)-3-метилфениламино]хиназолин-6-илэтинил}пиперидин-3-ола;
4-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-4-ола;
(3-хлор-4-феноксифенил)-(6-пиперидин-3-илэтинилхиназолин-4-ил)амина;
3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]-8-азабицикло[3.2.1]октан-3-ола;
(3-хлор-4-феноксифенил)-(6-пиперидин-4-илэтинил-хиназолин-4-ил)амина;
3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пирролидин-3-ола;
3-[4-(3-метил-4-феноксифениламино)хиназолин-7-илэтинил]пиперидин-3-ола
и фармацевтически приемлемых солей и сольватов вышеуказанных соединений.
15. Соединение по п.1, выбранное из группы, состоящей из
N-{3-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]проп-2-инил}ацетамида;
N-{3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил}ацетамида;
(3-{3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил}-3-азабицикло[3.1.0]гекс-6-ил)метанола;
метиламида 4-{3-[4-(3-метокси-4-феноксифениламино)хиназолин-6-ил]проп-2-инил}пиперазин-1-карбоновой кислоты;
{6-[3-(1,1-диоксо-1-тиоморфолин-4-ил)проп-1-инил]хиназолин-4-ил}-(3-метил-4-феноксифенил)амина;
1-{3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил}пиперидин-4-ола;
N-{1-метил-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил}ацетамида;
N-{3-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]-1-метилпроп-2-инил}ацетамида;
N-{1,1-диметил-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил}ацетамида;
4-[4-(1-бензолсульфонил-1H-индол-5-иламино)хиназолин-6-илэтинил]-1-метилпиперидин-4-ола;
3-[4-(1-бензолсульфонил-1H-индол-5-иламино)хиназолин-6-илэтинил]пиперидин-3-ола;
3-[4-(3-бром-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
3-[4-(4-бензолсульфонил-3-метилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
3-[4-(4-циклогексилокси-3-метилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
2-метил-4-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]бут-3-ин-2-ола;
2-амино-4-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]бут-3-ин-1-ола;
3-[4-(3-метил-4-фенилсульфанилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола
и фармацевтически приемлемых солей и сольватов вышеуказанных соединений.
16. Соединение по п.1, выбранное из группы, состоящей из
3-[4-(3-хлор-4-фторфениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
3-[4-(3-этинилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола;
(3-метил-4-феноксифенил)-[6-(1-метилпиперидин-3-илэтинил)хиназолин-4-ил]амина;
(3-метил-4-феноксифенил)-[6-(2-пиперидин-3-ил-этил)хиназолин-4-ил]амина;
3-{2-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]этил}пиперидин-3-ола;
3-[4-(4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола
и фармацевтически приемлемых солей и сольватов вышеуказанных соединений.
17. Способ лечения аномального роста клеток у млекопитающего, при котором указанному млекопитающему вводят соединение по п.1 в количестве, которое эффективно в лечении аномального роста клеток.
18. Способ по п.17, где аномальный рост клеток представляет собой рак.
19. Способ по п.18, где указанный рак выбран из рака легкого, рака кости, рака поджелудочной железы, рака кожи, рака головы или шеи, кожной или внутриглазной меланомы, рака матки, рака яичника, рака прямой кишки, рака анальной области, рака желудка, рака толстой кишки, рака молочной железы, рака матки, карциномы фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, рака эндокринной системы, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, саркомы мягких тканей, рака уретры, рака полового члена, рака простаты, хронической или острой лейкемии, лимфоцитарных лимфом, рака мочевого пузыря, рака почки или мочеточника, почечноклеточного рака, карциномы почечной лоханки, новообразований центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухолей позвоночника, глиомы ствола мозга, аденомы гипофиза или комбинации одного или более чем одного из вышеупомянутых раков.
20. Фармацевтическая композиция для лечения аномального роста клеток у млекопитающего, содержащая соединение по п.1 в количестве, которое эффективно в лечении аномального роста клеток, и фармацевтически приемлемый носитель.
21. Способ получения соединения по п.1, при котором соединение формулы 11 или 2 подвергают взаимодействию с соединением формулы 3

где A, X, R1, R4 и R3 такие, как определено выше,
Z представляет собой уходящую группу.
Текст
006107 Данное изобретение относится к новым бициклическим производным, которые полезны при лечении аномального роста клеток, такого как рак, у млекопитающих. Данное изобретение также относится к способу применения таких соединений в лечении аномального роста клеток у млекопитающих, особенно людей, и к фармацевтическим композициям, содержащим такие соединения. Известно, что клетка может стать раковой путем трансформации части ее ДНК в онкоген (то есть ген, который при активации приводит к образованию злокачественных опухолевых клеток). Многие онкогены кодируют белки, которые представляют собой аберрантные тирозинкиназы, способные вызывать трансформацию клеток. Альтернативно, сверхэкспрессия нормальной протоонкогенной тирозинкиназы может также приводить к пролиферативным расстройствам, иногда злокачественного фенотипа. Рецепторные тирозинкиназы представляют собой ферменты, которые проходят через клеточную мембрану и имеют внеклеточный связывающий домен для факторов роста, таких как эпидермальный фактор роста, трансмембранный домен, и внутриклеточный участок, который функционирует как киназа,для фосфорилирования специфических тирозиновых остатков в белках и, следовательно, для влияния на клеточную пролиферацию. Другие рецепторные тирозинкиназы включают c-erbB-2, c-met, tie-2, PDGFr,FGFr и VEGFR. Известно, что такие киназы часто аберрантно экспрессируются при распространенных раках человека, таких как рак молочной железы, рак желудочно-кишечного тракта, такой как рак ободочной кишки, прямой кишки или рак желудка, лейкемия и рак яичника, бронхов или поджелудочной железы. Было установлено также, что рецептор эпидермального фактора роста (EGFR), который обладает тирозинкиназной активностью, мутируется и/или сверхэкспрессируется при многих человеческих раках, таких как опухоли головного мозга, легкого, плоскоклеточные опухоли, опухоли мочевого пузыря,желудка, молочной железы, головы и шеи, пищевода, гинекологические опухоли и опухоли щитовидной железы. Соответственно, было установлено, что ингибиторы рецепторных тирозинкиназ полезны в качестве селективных ингибиторов роста раковых клеток млекопитающих. Например, эрбстатин, ингибитор тирозинкиназы, селективно ослабляет рост трансплантированной человеческой опухоли молочной железы у бестимусной голой мыши, которая экспрессирует рецепторную тирозинкиназу эпидермального фактора роста (EGFR), но не влияет на рост другой карциномы, которая не экспрессирует рецептор EGF. Таким образом, соединения по настоящему изобретению, которые являются селективными ингибиторами определенных рецепторных тирозинкиназ, полезны в лечении аномального роста клеток, в частности рака, у млекопитающих. В дополнение к рецепторным тирозинкиназам, соединения по настоящему изобретению могут также проявлять ингибирующую активность в отношении многих других нерецепторных тирозинкиназ (например Ick, src, abl) или серин/треонинкиназ (например циклинзависимых киназ). Было показано также, что многие другие соединения, такие как производные стирола, обладают ингибирующими свойствами в отношении тирозинкиназ. Совсем недавно в пяти публикациях Европейских патентов, а именно: ЕР 0566226 А 1 (опубликован 20 октября 1993), ЕР 0602851 А 1 (опубликован 22 июня 1994), ЕР 0635507 А 1 (опубликован 25 января 1995), ЕР 0635498 А 1 (опубликован 25 января 1995) и ЕР 0520722 А 1 (опубликован 30 декабря 1992), раскрыты некоторые бициклические производные, в частности хиназолиновые производные, проявляющие противораковые свойства в результате их ингибирующих свойств в отношении тирозинкиназы. Международная патентная заявка WO 92/20642 (опубликована 26 ноября 1992) также относится к ряду бис-моно и бициклических арильных и гетероарильных соединений, являющихся ингибиторами тирозинкиназы, которые полезны в ингибировании аномальной клеточной пролиферации. Международные патентные заявки WO 96/16960 (опубликована 6 июня 1996),WO 96/09294 (опубликована 6 марта 1996), WO 97/30034 (опубликована 21 августа 1997), WO 98/02434(опубликована 22 января 1998), WO 98/02437 (опубликована 22 января 1998) и WO 98/02438 (опубликована 22 января 1998) и ЕР 837063 также относятся к замещенным бициклическим гетероароматическим производным, которые являются ингибиторами тирозинкиназы, которые полезны для той же цели. WO 96/28430 относится к тризамещенным фенильным производным. Сущность изобретения Настоящее изобретение относится к соединению формулы 1 или его фармацевтически приемлемой соли или сольвату, гдеX представляет собой N; А представляет собой конденсированное 6-членное углеродное кольцо, содержащее в сумме 3 двойные связи, включая связь в пиримидиновом кольце, с которым оно конденсировано, и где указанная группировка А возможно замещена группами R5 в количестве от 1 до 3; каждый R1 и R2 независимо представляет собой Н или С 1-С 6 алкил; причем указанная группа возможно замещена группами R5 в количестве от 1 до 3;R , где m равно целому числу от 0 до 3, t равно целому числу от 0 до 5, и X1 представляет собой двухвалентную группу, производную от азетидина, оксетана или С 3-С 4 карбоциклической группы; либо R4 представляет собой -(CR1R2)m-CC-(CR1R2)kR13 или -(CR1R2)m-C=C-(CR1R2)k-R13, где k равно целому числу от 1 до 3, a m равно целому числу от 0 до 3; либо R4 представляет собой -(CR1R2)tR9, где t равно целому числу от 0 до 5, а местом соединения сR9 является атом углерода группы R9; каждый R5 независимо выбран из галогено, гидрокси, -NR1R2, C1-С 6 алкила, трифторметила, С 1-С 6 алкокси, трифторметокси, -C(O)R6, -CO2R6, -NR6C(O)R1, -C(O)NR6R7, -SO2NR6R7, -NR6C(O)NR7R1 и-NR6C(O)OR7; каждый R6 и R7 независимо выбран из Н, C1-С 6 алкила, -(CR1R2)t(C6-С 10 арил) и -(CR1R2)t(4-10 членный гетероцикл), где t равно целому числу от 0 до 5, при этом 1 или 2 кольцевых атома углерода гетероциклической группы возможно замещены оксо(=O) группировкой, а алкильные, арильные и гетероциклические группировки вышеупомянутых групп R6 и R7 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, -NR1R2, трифторметила, трифторметокси, С 1-С 6 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила, гидрокси и C1-С 6 алкокси;R8 независимо выбран из -(CR1R2)t(C6-C10apил) и -(CR1R2)t(4-10-члeнный гетероцикл), где t равно целому числу от 0 до 5, при этом 1 или 2 кольцевых атома углерода гетероциклической группы возможно замещены оксо(=O) группировкой, а каждая из вышеупомянутых групп R8 возможно замещена группами R10 в количестве от 1 до 5;R9 представляет собой неароматическое моноциклическое кольцо, конденсированное или мостиковое бициклическое кольцо или спироциклическое кольцо, причем указанное кольцо содержит от 3 до 12 атомов углерода, в числе которых от 0 до 3 атомов углерода возможно заменены гетерогруппировкой,независимо выбранной из N, О, S(O)j, где j равно целому числу от 0 до 2, и -NR12-, при условии что два атома О, две группировки S(O)j, атом О и группировка S(O)j, атом N и атом S или атом N и атом О не связаны непосредственно друг с другом в пределах указанного кольца, и при этом атомы углерода указанного кольца возможно замещены группами R11 в количестве от 1 до 2; каждый R10 независимо выбран из галогено, циано, нитро, трифторметокси, трифторметила, азидо,гидрокси, C1-С 6 алкокси, С 1-С 10 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила, -C(O)R6, -C(O)OR6, -OC(O)R6,-NR6C(O)R7, -NR6C(O)NR1R7, -NR6C(O)OR7, -C(O)NR6R7, -NR6R7, -NR6OR7, -SO2NR6R7, -S(О)j(С 1 С 6 алкил), где j равно целому числу от 0 до 2, -(CR1R2)t(C6-C10aрил), -(CR1R2)t(4-10-членный гетероцикл),-(CR1R2)qC(O)(CR1R2)t(C6-C10apил), -(CR1R2)qC(O)(CR1R2)t(4-10-членный гетероцикл), -(CR1R2)tO(CR1R2)q-(CR1R2)qS(O)j(CR1R2)t(4-10-членный гетероцикл), где j равно 0, 1 или 2, q и t каждый независимо равен целому числу от 0 до 5, при этом 1 или 2 кольцевых атома углерода гетероциклических группировок вышеупомянутых групп R10 возможно замещены оксо(=O) группировкой, а алкильные, алкенильные,алкинильные, арильные и гетероциклические группировки вышеупомянутых групп R10 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, трифторметила, трифторметокси, азидо, -OR6, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR6C(O)R7, -C(O)NR6R7,-NR6R7, -NR6OR7, С 1-С 6 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила, -(CR1R2)t(C6-C10apил) и -(CR1R2)t(4-10 члeнный гетероцикл), где t равно целому числу от 0 до 5; каждый R11 независимо выбран из -R12, -OR1, -NR1R2, -NR6C(O)R7, -NR6C(O)NR7R1, -NR6C(O)OR7 и 6-NR SO2NR7R1, либо R11 заменяет два атома водорода на углероде с образованием оксо (С=O) группы;R13 представляет собой -NR1R12 или -OR12; и где любой из вышеупомянутых заместителей, содержащих СН 3 (метильную), СН 2 (метиленовую) или СН (метиновую) группу, которая не связана с галогено, группой SO или SO2 или с атомом N, О илиS, возможно несет на указанной группе заместитель, выбранный из гидрокси, галогено, С 1-С 4 алкила,С 1-С 4 алкокси и -NR1R2. Конкретные воплощения соединений формулы 1 включают соединения, где R4 представляет собой 1 2-(CR R )m-CC-(CR1R2)tR9, где m равно целому числу от 0 до 3, a t равно целому числу от 0 до 5. Другие конкретные воплощения соединений формулы 1 включают соединения, где R4 представляет собой -(CR1R2)m-C=C-(CR1R2)t-R9, и m равно целому числу от 0 до 3, a t равно целому числу от 0 до 5. Другие конкретные воплощения соединений формулы 1 включают соединения, где R4 представляет собой -(CR1R2)m-CC-(CR1R2)kR13 или -(CR1R2)m-C=C-(CR1R2)k-R13, где m равно целому числу от 0 до 3, аk равно целому числу от 1 до 3. Другие конкретные воплощения соединений формулы 1 включают соединения, где R4 представляет собой -C=NOR12 или -X1-R12, где X1 представляет собой двухвалентную группу, производную от азетидина, оксетана или С 3-С 4 карбоциклической группы; либо R4 представляет собой -(CR1R2)tR9, где местом связывания с R9 является атом углерода R9. Другие конкретные воплощения соединений формулы 1 включают соединения, где R4 принимает любое из вышеуказанных конкретных значений, a R8 выбран из -(CR1R2)t(фенил), -(CR1R2)t(пиридил),-(CR1R2)t(пиpимидинил), -(CR1R2)t(индoлил), -(CR1R2)t(индaзoлил) и -(CR1R2)t(бeнзимидaзoлил), где t равно целому числу от 0 до 5, и каждая из вышеупомянутых групп R8 возможно замещена группами R10 в количестве от 1 до 5. Предпочтительными соединениями являются соединения формулы 1, в которых R8 является таким,как указано выше, a R4 представляет собой -(CR1R2)m-CC-(CR1R2)tR9, где переменная m в группе R4 равна 0, t в группе R8 равно целому числу между 0 и 2, и R9 представляет собой 4-10-членную гетероциклическую группу, имеющую от 1 до 3 гетерогруппировок, как указано в формуле 1 выше, и где указанныйR9 возможно замещен группами R11 в количестве от 1 до 2. Другую предпочтительную группу образуют соединения формулы 1, в которых R8 является таким,как указано выше, a R4 представляет собой -(CR1R2)m-CC-(CR1R2)kR13, где m равно 0, а k равно целому числу от 1 до 2. Еще одну предпочтительную группу образуют соединения формулы 1, в которых R8 является таким, как указано выше, a R4 представляет собой -(CR1R2)tR9, где местом соединения с R9 является атом углерода R9; t равно целому числу от 0 до 2, и R9 представляет собой 4-10-членную гетероциклическую группу, имеющую от 1 до 3 гетерогруппировок, как указано в формуле 1 выше, и где указанный R9 возможно замещен группами R11 в количестве от 1 до 2. Наиболее предпочтительные соединения по изобретению включают соединения, которые выбраны из группы, состоящей из 3-[4-(1-бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-ил]аллилового эфира уксусной кислоты;[6-(4-аминотетрагидропиран-4-илэтинил)хиназолин-4-ил]-(1-бензолсульфонил-1 Н-индол-5-ил) амина; 1-метил-4-4-[3-метил-4-(пиридин-2-илметокси)фениламино]хиназолин-6-илэтинилпиперидин-4 ола; 1-[4-(1-бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-ил]-4-метилпент-1-ин-3-ола; 4-4-[4-(1-фенилэтокси)-фениламино]хиназолин-6-илэтинилтетрагидропиран-4-ола; 1-[4-(1-бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-ил]-4,4-диметилпент-1-ин-3-ола; 4,4-диметил-1-4-[4-(1-фенилэтокси)фениламино]хиназолин-6-илпент-1-ин-3-ола; 3-4-[1-(пропан-2-сульфонил)-1 Н-индол-5-иламино]хиназолин-6-илэтинилпиперидин-3-ола; 1-метил-3-[4-(4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола; 3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола; 3-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]-1-пирролидин-2-илпроп-2-ин-1-ола; 5-[4-(1-бензил-1 Н-индазол-5-иламино)хиназолин-6-илэтинил]-4,4-диметилоксазолидин-2-она; 4-амино-1-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]пент-1-ин-3-ола; 4-амино-1-[4-(3-хлор-4-феноксифениламино)хиназолин-6-ил]-4-метилпент-1-ин-3-ола; 3-2-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]этилпиперидин-3-ола; и фармацевтически приемлемых солей и сольватов вышеуказанных соединений. В соответствии с настоящим изобретением наиболее предпочтительные соединения включают соединения, выбранные из группы, состоящей из(3-хлор-4-феноксифенил)-(6-пиперидин-4-илэтинилхиназолин-4-ил)амина; 3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пирролидин-3-ола; 3-[4-(3-метил-4-феноксифениламино)хиназолин-7-илэтинил]пиперидин-3-ола; и фармацевтически приемлемых солей и сольватов вышеуказанных соединений. Другие наиболее предпочтительные соединения включают соединения, выбранные из группы, состоящей изN-1,1-диметил-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]-проп-2-инилацетамида; 4-[4-(1-бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-илэтинил]-1-метилпиперидин-4-ола; 3-[4-(1-бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-илэтинил]пиперидин-3-ола; 3-[4-(3-бром-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола; 3-[4-(4-бензолсульфонил-3-метилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола; 3-[4-(4-циклогексилокси-3-метилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола; 2-метил-4-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]бут-3-ин-2-ола; 2-амино-4-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]бут-3-ин-1-ола; 3-[4-(3-метил-4-фенилсульфанилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола; и фармацевтически приемлемых солей и сольватов вышеуказанных соединений. Другие наиболее предпочтительные соединения по настоящему изобретению включают соединения, выбранные из группы, состоящей из 3-[4-(3-хлор-4-фторфениламино)хиназолин-6-илэтинил]пиперидин-3-ола; 3-[4-(3-этинилфениламино)хиназолин-6-илэтинил]пиперидин-3-ола;(3-метил-4-феноксифенил)-[6-(2-пиперидин-3-илэтил)хиназолин-4-ил]амина; 3-2-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]этилпиперидин-3-ола; 3-[4-(4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола; и фармацевтически приемлемых солей и сольватов вышеуказанных соединений. Данное изобретение также относится к способу лечения аномального роста клеток у млекопитающего, включая человека, при котором указанному млекопитающему вводят соединение формулы 1, как оно определено выше, или его фармацевтически приемлемую соль или сольват в количестве, которое эффективно в лечении аномального роста клеток. В одном воплощении данного способа аномальный рост клеток представляет собой рак, включая,но не ограничиваясь ими, рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожную или внутриглазную меланому, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак молочной железы, рак матки, карциному фаллопиевых труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягких тканей, рак уретры, рак полового члена, рак простаты, хроническую или острую лейкемию, лимфоцитарные лимфомы, рак мочевого пузыря, рак почки или мочеточника, почечноклеточный рак, карциному почечной лоханки, новообразования центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухоли позвоночника, глиому ствола мозга, аденому гипофиза или комбинацию одного или более чем одного из вышеупомянутых раков. Данное изобретение также относится к фармацевтической композиции для лечения аномального-4 006107 роста клеток у млекопитающего, включая человека, содержащей соединение формулы 1, как оно определено выше, или его фармацевтически приемлемую соль или сольват в количестве, которое эффективно в лечении аномального роста клеток, и фармацевтически приемлемый носитель. Данное изобретение также относится к способу получения соединения формулы 1 и его фармацевтически приемлемых солей и сольватов, где А, X, R1, R4 и R3 такие, как определено выше,при котором соединение формулы 11 или 2 подвергают взаимодействию с соединением формулы 3 где Z представляет собой уходящую группу, а А, X, R1, R4 и R3 такие, как определено выше. Используемый здесь термин аномальный рост клеток относится, если не указано иное, к росту клеток, который не зависит от нормальных регуляторных механизмов (например потеря контактного ингибирования). Этот термин охватывает аномальный рост: (1) опухолевых клеток (опухолей), которые пролиферируют в результате экспрессии мутированной тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых имеет место активация аберрантной тирозинкиназы; (3) любых опухолей, которые пролиферируют благодаря рецепторным тирозинкиназам; (5) любых опухолей, которые пролиферируют благодаря активации аберрантной серин/треонинкиназы; и (6) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых имеет место активация аберрантной серин/треонинкиназы. Используемый здесь термин лечение ("treating") означает, если не указано иное, реверсию, облегчение, торможение прогрессирования или предупреждение расстройства или состояния, к которому такой термин применяется, или одного или более чем одного симптома такого расстройства или состояния. Используемый здесь термин лечение ("treatment") относится, если не указано иное, к акту лечения как оно определено непосредственно выше. Указанный аномальный рост клеток может представлять собой доброкачественное пролиферативное заболевание, включая, но не ограничиваясь ими, псориаз, доброкачественную гипертрофию простаты или рестеноз. При осуществлении способа лечения аномального роста клеток у млекопитающего по изобретению соединение формулы 1 или его фармацевтически приемлемую соль или сольват можно вводить в комбинации с противоопухолевым агентом, выбранным из группы, состоящей из митотических ингибиторов,алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антител, цитотоксических агентов, антигормонов и антиандрогенов. Используемый здесь термин галогено означает, если не указано иное, фторо, хлоро, бромо или иодо. Предпочтительными галогеногруппами являются фторо, хлоро и бромо. Используемый здесь термин алкил охватывает, если не указано иное, насыщенные моновалентные углеводородные радикалы, имеющие прямые, разветвленные или циклические группировки (включая конденсированные и мостиковые бициклические и спироциклические группировки) или комбинацию вышеуказанных группировок. Чтобы иметь циклические группировки, алкильная группа должна содержать по меньшей мере три атома углерода. Используемый здесь термин алкенил охватывает, если не указано иное, алкильные группировки,имеющие по меньшей мере одну двойную углерод-углеродную связь, где алкил является таким, как определено выше, включая Е и Z изомеры указанной алкенильной группировки. Используемый здесь термин алкинил охватывает, если не указано иное, алкильные группировки,имеющие по меньшей мере одну тройную углерод-углеродную связь, где алкил является таким, как определено выше. Используемый здесь термин алкокси охватывает, если не указано иное, О-алкильные группы, где алкил является таким, как определено выше. Используемый здесь термин арил относится, если не указано иное, к органическому радикалу,производному от ароматического углеводорода при удалении одного водорода, такому как фенил или нафтил. Используемый здесь термин 4-10-членный гетероцикл охватывает, если не указано иное, арома-5 006107 тические и неароматические гетероциклические группы, содержащие от одного до четырех гетероатомов, каждый из которых выбран из О, S и N, причем каждая гетероциклическая группа имеет от 4 до 10 атомов в своей кольцевой системе, и при условии, что данное кольцо указанной группы не содержит два соседних атома О или S. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в своей кольцевой системе, а ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в своей кольцевой системе. Гетероциклические группы включают бензоконденсированные кольцевые системы. Примером 4-членной гетероциклической группы является азетидинил (производный от азетидина). Примером 5-членной гетероциклической группы является тиазолил,и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил,индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил,дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3 азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеупомянутые группы как производные от групп, перечисленных выше, могут быть С-присоединяемыми или N-присоединеняемыми, если такое возможно. Например, группа, производная от пиррола, может представлять собой пиррол-1-ил (N-присоединяемый) или пиррол-3-ил (С-присоединяемый). Также, группа, производная от имидазола, может представлять собой имидазол-1-ил (N-присоединяемый) или имидазол-3-ил (Сприсоединяемый). Примером гетероциклической группы, где 2 кольцевых атома углерода замещены оксо (=O) группировками, является 1,1-диоксотиоморфолинил. Используемое здесь выражение фармацевтически приемлемая(ые) соль(и) охватывает, если не указано иное, соли кислотных или основных групп, которые могут присутствовать в соединениях формулы 1. Соединения формулы 1, которые являются основными по своей природе, способны к образованию широкого разнообразия солей с различными неорганическими и органическими кислотами. Кислоты, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения кислот таких основных соединений формулы 1, представляют собой кислоты, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармакологически приемлемые анионы, такие как ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальцийэдэтат, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдэтат, эдислиат, эстолат,эзилат, этилсукцинат, фумарат, глуцептат, глюконат, глутамат, гликоллиларсанилат, гексилресорцинат,гидрабамин, гидробромид, гидрохлорид, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат,манделат, мезилат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат,пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, надацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодод и валерат. Поскольку одно соединение по настоящему изобретению может включать в себя более чем одну кислотную или основную группировку, соединения по настоящему изобретению могут включать в себя моно-, ди- или трисоли в одном соединении. Те соединения по настоящему изобретению, которые являются кислотными по своей природе, способны к образованию солей с основаниями с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов или щелочноземельных металлов и в частности кальциевые, магниевые, натриевые и калиевые соли соединений по настоящему изобретению. В соединениях формулы 1, где использованы такие термины, как (CR1R2)q или (CR1R2)t, R1 и R2 могут варьировать с каждым повтором q или t выше 1. Например, если q или t равно 2, термины (CR1R2)q или (CR1R2)t могут соответствовать -СН 2 СН 2- или -СН(СН 3)С(СН 2 СН 3)(СН 2 СН 2 СН 3)-, или любому числу подобных группировок, подпадающих под объем определений R1 и R2. Далее, как отмечено выше, любые заместители, содержащие СН 3 (метильную), СН 2 (метиленовую) или СН (метиновую) группу, которая не связана с галогено, SO или SO2 группой, либо с атомом N, О или S, возможно несут на указанной группе заместитель, выбранный из гидрокси, С 1-С 4 алкокси и -NR1R2. В вышеуказанных соединениях формулы 1, где R4 представляет собой -(CR1R2)t-CR1R11R12, группа 12R предпочтительно присоединена по атому углерода, если это моноциклическое кольцо, и она может быть присоединена либо по атому углерода, либо по атому азота, если это бициклическое кольцо. Некоторые соединения формулы 1 могут иметь асимметрические центры и, следовательно, существовать в различных энантиомерных формах. Все оптические изомеры и стереоизомеры соединений формулы 1 и их смеси следует считать входящими в объем данного изобретения. В отношении соединений формулы 1 данное изобретение охватывает применение рацемата, одной или более чем одной энантио-6 006107 мерной формы, одной или более чем одной диастереомерной формы, или их смесей. Соединения формулы 1 могут также существовать в виде таутомеров. Данное изобретение относится к применению всех таких таутомеров и их смесей. Настоящее изобретение также охватывает меченные изотопами соединения, которые идентичны соединениям, перечисленным в формуле 1, за исключением того, что один или более чем один атом заменен атомом, имеющим атомную массу или массовое число, отличные от естественных атомной массы или массового числа. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 18O, 17O,31P, 32P, 35S, 18F и 36Cl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем настоящего изобретения. Некоторые меченные изотопами соединения по настоящему изобретению, например соединения, в которые включены радиоактивные изотопы, такие как 3 Н и 14 С, полезны в анализах на распределение лекарственного средства и/или субстрата в тканях. Тритированные, то есть 3 Н, и углерод-14, то есть 14 С, изотопы особенно предпочтительны из-за легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2 Н, может дать некоторые терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например увеличение периода полувыведения in vivo или снижение требований к дозировке и,следовательно, могут быть предпочтительны в некоторых случаях. Меченные изотопами соединения формулы 1 по настоящему изобретению и их пролекарства в общем случае могут быть получены по методикам, описанным ниже на схемах и/или в примерах и получениях, путем замещения немеченого реагента легко доступным меченым реагентом. Схема 1-7 006107 Подробное изложение сущности изобретения Общие методы синтеза, на которые можно сослаться, для получения соединений по настоящему изобретению приведены в патенте США 5747498 (выдан 5 мая 1998), в заявке на патент США серийный номер 08/953078 (подана 17 октября 1997), в WO 98/02434 (опубликована 22 января 1998), в WO 98/02438 (опубликована 22 января 1998), в WO 96/40142 (опубликована 19 декабря 1996), в WO 96/09294(опубликована 6 марта 1996), WO 97/03069 (опубликована 30 января 1997), в WO 95/19774 (опубликована 27 июля 1995) и в WO 97/13771 (опубликована 17 апреля 1997). Вышеупомянутые патенты и патентные заявки во всей своей полноте включены в данный документ посредством ссылки. Некоторые исходные материалы могут быть получены способами, известными специалистам в данной области, и некоторые модификации синтеза могут быть произведены методами, известными специалистам в данной области. Стандартная процедура получения 6-иодхиназолинона приведена в Stevenson, T.M., Kazmierczak,F., Leonard, N.J., J.Org.Chem. 1986, 51, 5, p. 616. Катализируемые палладием бороновокислотные взаимодействия описаны в Miyaura, N., Yanagi, Т., Suzuki, A.Syn.Comm. 1981, 11, 7, p. 513. Катализируемые палладием взаимодействия по Хеку описаны в Heck et. al. Organic Reactions, 1982, 27, 345 или Cabri et. al.in Acc. Chem. Res. 1995, 28, 2. Примеры катализированных палладием взаимодействия терминальных алкинов с арилгалогенидами см.: Castro et. al. J. Org. Chem. 1963, 28, 3136 или Sonogashira et. al. Synthesis,1977, 777. Относительно образования алкил- и циклоалкилцинковых реагентов специалисты в данной области могут обратиться к Rieke, R.D., Hanson, M.V., Brown, J.D., Niu, Q.J., J. Org. Chem., 1996, 61, 8, p. 2726. Химические превращения с азетидинилцинком могут быть осуществлены способами, описанными в Billotte, S. Synlett, 1998, 379. Синтез терминального алкина может быть осуществлен с использованием соответствующим образом замещенных/защищенных альдегидов, как описано в: Colvin, E. W. J. et. al.Chem. Soc, 119, 4, 1997, 698; или Marshall, J. A. et. al. J. Org. Chem., 62, 13, 1997, 4313. Альтернативно, терминальные алкины могут быть получены по двухстадийной методике: сначала литиевый анион триметилсилилацетилена присоединяют к соответственно замещенному/защищенному кетону или альдегиду, как описано в Nakatani, K. et. al. Tetrahedron, 49, 9, 1993, 1901, а затем снимают защиту с помощью основания с выделением промежуточного терминального алкина, как описано вMalakria, M., Tetrahedron, 33, 1977, 2813; или White, J. D. et. al. Tet. Lett., 31, 1, 1990, 59. Получение ариламинов, таких как феноксианилины, бензилоксианилины, фенилсульфонилиндолы, бензилиндолы или бензилиндазолы, может быть осуществлено путем восстановления соответствующих промежуточных нитросоединений. Восстановление ароматических нитрогрупп может быть осуществлено способами,приведенными в Brown, R. K., Nelson, N. A. J. Org. Chem. 1954, p. 5149; Yuste, R., Saldana, M, Walls, F.,Tet. Lett. 1982, 23, 2, p. 147, или в WO 96/09294. Нитрозамещенные N1-фенилсульфонилиндолы/индазолы могут быть получены способами, описанными в Sundberg, R. J., Bloom, J. D., J. Org. Chem. 1980, 45,17, p. 3382; Ottoni, O. et. al. Tetrahedron, 1998, 54, 13915; или Boger, Dale L. et. al.; J. Org. Chem. 55, 4,1990, 1379. Нитрозамещенные N1-бензилиндолы/индазолы могут быть получены способами, описанными в Makosza, M.; Owczarczyk, Z., J. Org. Chem., 54, 21, 1989, 5094; Adebayo, Adelaide T. O. M. et. al., J.Chem. Soc. Perkin Trans. 1, 1989, 1415; или WO 98/02434. Бензилокси-нитробензольные промежуточные соединения могут быть получены способами, описанными в WO 98/02434. Альтернативно, арилметоксиили арилокси-нитробензольные производные могут быть получены из галогено-нитробензольных предшественников путем нуклеофильного замещения галогенида с использованием соответствующего спирта, как описано в Dinsmore, С. J. et. al., Bioorg. Med. Chem. Lett., 7, 10, 1997, 1345; Loupy, A. et. al., Synth.Commun., 20, 18, 1990, 2855; или Brunelle, D. J., Tet. Lett., 25, 32, 1984, 3383. Исходные вещества, синтез которых специально не описан выше, либо имеются в продаже, либо могут быть получены с использованием способов, хорошо известных специалистам в данной области. В каждой из реакций, обсуждаемых или проиллюстрированных на схемах выше, давление не является критическим, если не указано иное. Давление от примерно 0,5 атмосфер до примерно 5 атмосфер обычно приемлемо, а давление окружающей среды, то есть примерно 1 атмосфера, предпочтительно с точки зрения удобства. Когда соединение формулы HNR1R3 возможно замещено индольной или индолиновой группировкой, такие соединения могут быть получены в соответствии с одним или более чем одним способом, известным специалистам в данной области. Такие способы описаны в публикации международной патентной заявки WO 95/23141 и в W. С. Sumpter and F. M. Miller, "Heterocyclic Compounds with Indole and Carbazole Systems" in volume 8 of "The Chemistry of Heterocyclic Compounds", Interscience Publishers Inc., NewYork (1954). Возможные заместители могут быть включены до взаимодействия, проиллюстрированного на схеме 1 или после него, когда как подходит. Перед взаимодействием первичные и вторичные аминогруппировки (иные чем указанный амин формулы HNR1R3) предпочтительно защищают защитной группой для азота, известной специалистам в данной области. Такие защитные группы и их использование описаны в T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", Second Edition, JohnWileySons, New York, 1991. Ссылаясь на схему 1, приведенную выше, соединение формулы 1 может быть получено взаимодей-8 006107 ствием соединения формулы 2, где X, А и R4 такие, как определено выше, a Z представляет собой уходящую группу, такую как замещенное феноксипроизводное (такие заместители могут включать галогено,циано, нитро и/или C1-С 6 алкильные группы) или хлоропроизводное, с амином формулы 3, где R1 и R3 такие, как определено выше, в безводном растворителе, в частности в растворителе, выбранном из ДМФ(N,N-диметилформамид), ДМЭ (диметиловый эфир этиленгликоля), ДХЭ (дихлорэтан), трет-бутанола и фенола или смеси вышеупомянутых растворителей, при температуре в пределах от примерно 50 до 150 С в течение периода времени в пределах от 1 до 48 ч. Соединение формулы 3 может быть получено способами, известными специалистам в данной области, такими как восстановление нитрилов, восстановление иминов или енаминов, восстановление оксимов, первичных или вторичных амидов, восстановление нитрогруппы или восстановительное аминирование либо R1NH2 и R3CH(O), либо R3NH2 иR1CH(O). Соединение формулы 2, ссылаясь на схему 2, может быть получено путем обработки соединения формулы 4, где Z1 является активирующей группой, такой как бромо, иодо, -N2 или -OTF (который представляет собой -OSO2CF3), или предшественником активирующей группы, таким как NO2, NH2 или ОН, с партнером связывания, таким как терминальный алкин, терминальный алкен, винилгалогенид, винилстаннан, винилборан, алкилборан или алкил- или алкенилцинковый реагент. Альтернативно, соединения формулы 1 могут быть получены в соответствии с синтезом, приведенным на схеме 2. На схеме 2 соединение формулы 8, где X представляет собой NH, может быть получено из соединения формулы 9, где А и Z1 такие, как определено выше, a Z3 представляет собой NH2, С 1-С 6 алкокси или ОН, по одной или более чем одной методике, описанной в WO 95/19774, а соединение формулы 8, где X представляет собой СН, может быть получено из соединения формулы 10, где А и Z1 такие, как определено выше, по методике, описанной в WO 95/19774. Соединение формулы 8 может быть превращено в соединение формулы 7 путем обработки исходного соединения хлорирующим агентом,таким как РОСl3 или СlC(О)С(О)Сl/ДМФ, в галогенированном растворителе при температуре в пределах от примерно 60 до 150 С в течение периода времени в пределах от примерно 2 до 24 ч. Соединение формулы 7 может быть превращено в соединение формулы 6, где Z представляет собой замещенное феноксипроизводное, путем обработки исходного соединения соответствующим фенолятом металла, таким как фенолят натрия, в растворителе, таком как ДМФ или фенол, при температуре в пределах от примерно 0 до 100 С в течение периода времени в пределах от примерно 2 до 24 ч. Соединение формулы 6 может быть подвергнуто взаимодействию с партнером взаимодействия, таким как терминальный алкин, терминальный алкен, винилгалогенид, винилстаннан, винилборан, алкилборан или алкил- или алкенилцинковый реагент, с получением соединения формулы 2. Соединение формулы 2 может затем быть превращено в соединение формулы 1 путем взаимодействия с амином формулы 3. Альтернативно, соединение формулы 1 может быть получено путем взаимодействия терминального алкина, терминального алкена,винилгалогенида, винилстаннана, винилборана, алкилборана или алкил или алкенилцинкового реагента с соединением формулы 7 с получением промежуточного соединения формулы 11. Промежуточное соединение формулы 11 затем может быть связано с амином формулы 3 с получением соединения формулы 1. Еще один альтернативный способ синтеза производных формулы 1 включает в себя связывание хлорхиназолина 7 с амином 3 с последующим взаимодействием промежуточного соединения 5 с терминальным алкином, терминальным алкеном, винилгалогенидом, винилстаннаном, винилбораном, алкилбораном или алкил или алкенилцинковым реагентом. Соединения по настоящему изобретению могут иметь асимметрические атомы углерода. Диастереомерные смеси могут быть разделены на их индивидуальные диастереомеры на основе их физикохимических различий способами, известными специалистам в данной области, например хроматографией или фракционной кристаллизацией. Энантиомеры могут быть разделены путем превращения энантиомерных смесей в диастереомерную смесь при взаимодействии с соответствующим оптически активным соединением (например спиртом), разделения диастереомеров и превращения (например гидролизом) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Все такие изомеры,включая диастереомерные смеси и чистые энантиомеры, рассматриваются как часть изобретения. Соединения формулы 1, которые являются основными по своей природе, способны к образованию широкого разнообразия различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто желательно первоначально выделить соединение формулы 1 из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнее обратно в соединение-свободное основание путем обработки щелочным реагентом, а затем превратить свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений по настоящему изобретению легко получить путем обработки основного соединения по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко образуется желаемая твердая соль. Желаемая соль кислоты может быть также осаждена из раствора свободного основания в органическом растворителе путем добавления к этому раствору соответствующей минеральной или органической кислоты. Соединения формулы 1, которые являются кислыми по своей природе, способны к образованию со-9 006107 лей с основаниями с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочно-земельных металлов, и, в частности, соли натрия и калия. Все эти соли получают по стандартным методикам. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых солей с основаниями по настоящему изобретению, представляют собой соли, которые образуют нетоксичные соли с основаниями кислотных соединений формулы 1. Такие нетоксичные соли с основаниями включают в себя соли, получаемые при взаимодействии с такими фармакологически приемлемыми катионами, как натрий, калий, кальций и магний и т.д. Эти соли легко могут быть получены путем обработки соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, а затем упаривания полученного раствора до сухости, предпочтительно при пониженном давлении. Альтернативно,они могут быть получены также путем смешивания вместе раствора кислотного соединения в низшем спирте и алкилата желаемого щелочного металла, а затем упаривания полученного раствора до сухости таким же образом, как указано выше. В любом случае предпочтительно используют стехиометрические количества реагентов, чтобы гарантировать протекание реакции до конца и максимальные выходы целевого конечного продукта. Поскольку одно соединение по настоящему изобретению может включать в себя более чем одну кислотную или основную группировку, соединения по настоящему изобретению включать в себя моно, ди или три-соли в одном соединении. Соединения по настоящему изобретению являются сильнодействующими ингибиторами онкогенных и протоонкогенных белковых тирозинкиназ семейства erbB, таких как рецептор эпидермального фактора роста (EGRF), erbB2, HER3 или HER4, и, таким образом, все они пригодны для терапевтического применения в качестве антипролиферативных агентов (например противораковых) у млекопитающих,особенно у людей. В частности, соединения по настоящему изобретению полезны для предупреждения и лечения различных гиперпролиферативных расстройств у человека, таких как злокачественные и доброкачественные опухоли печени, почки, мочевого пузыря, молочной железы, желудка, яичника, толстой кишки, простаты, поджелудочной железы, легкого, вульвы, щитовидной железы, злокачественные гепатомы, саркомы, глиобластомы, опухоли головы и шеи и другие гиперпластические состояния, такие как доброкачественная гиперплазия кожи (например псориаз) и доброкачественная гиперплазия простаты(ДГП). Кроме того, ожидается, что соединение по настоящему изобретению может обладать активностью против ряда лейкемий и лимфоидных злокачественностей. Соединения по настоящему изобретению могут быть также полезны в лечении дополнительных расстройств, в которые вовлечены аберрантная экспрессия, взаимодействия лиганд/рецептор или активация или сигнальные события, связанные с различными белковыми тирозинкиназами. Такие расстройства могут включать расстройства нейрональной, глиальной, астроцитарной, гипоталамической и другой гландулярной, макрофагиальной, эпителиальной, стромальной и бластокоэлической природы, в которые вовлечены аберрантное функционирование, экспрессия, активация или передача сигнала тирозинкиназerbB. Кроме того, соединения по настоящему изобретению могут иметь терапевтическое применение при воспалительных, ангиогенных и иммунологических расстройствах, в которые вовлечены как идентифицированные, так и еще не идентифицированные тирозинкиназы, которые ингибируются соединениями по настоящему изобретению.In vitro активность соединений формулы 1 может быть определена по следующей методике. Анализ киназы с-еrbВ 2 аналогичен анализу, описанному ранее в Schrang et. al. Anal. Biochem. 211,1993, p. 233-239. 96-Луночные планшеты Nunc MaxiSorp покрывают путем инкубации в течение ночи при 37 С с 100 мл на лунку 0,25 мг/мл Poly (Glu, Туr) 4:1 (PGT) (Sigma Chemical Co., St. Louis, МО) в ФСБ (фосфатно-солевой буфер). Избыток PGT удаляют путем аспирации, и планшет промывают три раза промывочным буфером (0,1% Tween 20 в ФСБ). Киназную реакцию проводят в 50 мл 50 мМ HEPES (рН 7,5), содержащего 125 мМ хлорида натрия,10 мМ хлорида магния, 0,1 мМ ортованадата натрия, 1 мМ АТФ, 0,48 мг/мл (24 нг/лунку) внутриклеточного домена с-erbВ 2. Внутриклеточный домен тирозинкиназы еrbВ 2 (аминокислоты 674-1255) экспрессируется как GST белок слияния в бакуловирусе, и его очищают путем связывания с шариками, покрытыми глутатионом, и элюирования с них. Добавляют тестируемое соединение в ДМСО (диметилсульфоксид) с получением конечной концентрации в ДМСО примерно 2,5%. Фосфорилирование инициируют путем добавления АТФ (аденозин трифосфат) и продолжают в течение 6 мин при комнатной температуре при постоянном встряхивании. Киназную реакцию останавливают путем аспирации реакционной смеси с последующим промыванием промывочным буфером (см. выше). Фосфорилированный PGT измеряют к 25 мин инкубации с 50 мл на лунку коньюгированного с пероксидазой хрена PY54 (Oncogene Science Inc. Uniondale, NY) антифосфотирозинового антитела, разбавленного до 0,2 мг/мл в блокирующем буфере (3% БСА (бычий сывороточный альбумин) и 0,05% Tween 20 в ФСБ). Антитело удаляют аспирацией, и планшет промывают 4 раза промывочным буфером. Колориметрический сигнал проявляют добавлением субстрата для пероксидазы ТМВ Microwell Peroxidase Substrate (Kirkegaard and Perry,Gaithersburg, MD), 50 мл на лунку, и останавливают добавлением 0,09 М серной кислоты, 50 мл на лунку. Фосфотирозин оценивают путем измерения поглощения при 450 нм. Сигнал для контролей составляет обычно 0,6-1,2 единиц поглощения, причем в лунках без PGT субстрата по существу отсутствует фон, и- 10006107 сигнал пропорционален времени инкубации в течение 10 мин. Ингибиторы идентифицировали путем преобразования сигнала, относящегося к лункам без ингибитора, и определяли значения ИК 50, соответствующие концентрации соединения, требуемой для 50% ингибирования. Активность соединений формулы 1 in vivo может быть определена по количеству ингибирования роста опухоли тестируемым соединением относительно контроля. Ингибирующие рост опухоли эффекты различных соединений измеряли в соответствии со способом Corbett Т.Н., et. al., "Tumor Induction Relationships in Development of Transplantable Cancers of the Colon in Mice for Chemotherapy Assays, with aNote on Carcinogen Structure", Cancer Res., 35, 2434-2439 (1975) и Corbett Т. Н., et. al., "A Mouse Colontumor Model for Experimental Therapy", Cancer Chemother. Rep. (Part 2), 5, 169-186 (1975), с небольшими модификациями. Опухоли индуцируют в левом боку путем подкожной (п.к.) инъекции 1-5 миллионов культивированных опухолевых клеток (мышиные клетки FRE-ErbB2 или человеческие клетки карциномы яичника SK-OV3), находящихся в фазе логарифмического роста, суспендированных в 0,1 мл средыRPMI 1640. После того, как прошло достаточно времени, чтобы опухоли стали пальпируемыми (100-150 мм 3 по размеру/5-6 мм в диаметре), тестируемых животных (самки бестимусных мышей) обрабатывают тестируемым соединением (приготовленным в концентрации 10-15 мг/мл в 5 Gelucire) внутрибрюшинным (в.б) или пероральным (п.о.) введением один раз или два раза в сутки в течение 7-10 последующих дней. Для того чтобы определить противоопухолевый эффект, опухоль измеряют в миллиметрах с помощью циркуля Вернера перекрестно по двум диаметрам и размер опухоли (мм 3) вычисляют, используя формулу: размер опухоли (мм 3) = (длина х [ширина]2)/2,согласно методу Geran, R.I., et. al. "Protocols for Screening Chemical Agents and Natural Products(1972). Результаты выражают в виде процента ингибирования по формуле: ингибирование (%) = (TuWcontrol- TuWtest)/TuWcontrol 100%. Наружная кромка имплантации опухоли обеспечивает воспроизводимые эффекты доза/ответ для разнообразия химиотерапевтических агентов, и данный способ измерения (диаметр опухоли) является надежным способом оценки скорости опухолевого роста. Введение соединений по настоящему изобретению (далее активное(ые) соединение(я, можно осуществлять любым способом, который обеспечивает доставку этих соединений к месту их действия. Эти способы включают пероральные пути введения, интрадуоденальные пути введения, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или инфузию),местное и ректальное введение. Количество вводимого активного соединения будет зависеть от субъекта, которого лечат, тяжести расстройства или состояния, скорости введения, распределения соединения и мнения лечащего врача. Однако эффективная дозировка находится в пределах от примерно 0,001 до примерно 100 мг на кг массы тела в сутки, предпочтительно от примерно 1 до примерно 35 мг/кг/сутки, в однократной или разделенной дозах. Для человека весом 70 кг это количество составляет от примерно 0,05 до примерно 7 г/сутки,предпочтительно от примерно 0,2 до примерно 2,5 г/сутки. В некоторых случаях уровни дозировки ниже нижней границы вышеупомянутых пределов могут быть более чем адекватными, а в других случаях еще более высокие дозы можно использовать без какого-либо вредного побочного эффекта при условии, что такие более высокие дозы сначала разделены на несколько небольших доз для введения в течение дня. Активное соединение можно применять в качестве единственного средства лечения, или терапия может включать одно или более чем одно другое противоопухолевое средство, например средства, выбранные из, например, митотических ингибиторов, например винбластина; алкилирующих агентов, например цис-платина, карбоплатина и циклофосфамида; антиметаболитов, например 5-фторурацила, цитозинарабинозида и гидроксимочевины, или, например, одного из предпочтительных антиметаболитов,описанных в Европейский патентной заявке 239362, такого как N-(5-[N-(3,4-дигидро-2-метил-4 оксохиназолин-6-илметил)-N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторов факторов роста; ингибиторов клеточного цикла; интеркалирующих антибиотиков, например адриамицина и блеомицина; ферментов, например интерферона; и антигормонов, например антиэстрогенов, таких как Nolvadex (тамоксифен) или, например, антиандрогенов, таких как Casodex (4'-циано-3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'-(трифторметил)пропионанилид). Такое совместное лечение можно осуществлять путем одновременного, последовательного или раздельного дозирования индивидуальных компонентов лечения. Фармацевтическая композиция может быть например в форме, подходящей для перорального введения, в виде таблетки, капсулы, пилюли, порошка, препаратов пролонгированного высвобождения, раствора, суспензии, для парентеральной инъекции в виде стерильного раствора, суспензии или эмульсии,для местного введения в виде мази или крема, или для ректального введения в виде суппозитория. Фармацевтическая композиция может быть в стандартных лекарственных формах, подходящих для однократного введения точных дозировок. Фармацевтическая композиция включает в себя традиционный фармацевтический носитель или эксципиент и соединение по изобретению в качестве активного ингредиента. В дополнение, она может включать в себя другие медицинские или фармацевтические агенты,- 11006107 носители, адьюванты и так далее. Примерные формы для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например водные пропиленгликолевые или декстрозные растворы. Такие лекарственные формы могут быть подходящим образом забуферены, если требуется. Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции могут, если требуется, содержать дополнительные ингредиенты, такие как корригенты, связующие вещества, эксципиенты и тому подобное. Так, для перорального введения в таблетках, содержащих различные эксципиенты, такие как лимонная кислота, могут быть использованы различные разрыхлители, такие как крахмал, альгиновая кислота и некоторые комплексные силикаты, и связующие агенты, такие как сахароза, желатин и аравийская камедь. Дополнительно, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк,часто используют в целях таблетирования. Твердые композиции подобного типа могут также быть использованы в мягких и твердых заполненных желатиновых капсулах. Предпочтительные материалы для них включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение в них может быть объединено с различными подсластителями или корригентами, подкрашивающими веществами или красителями и, если требуется, с эмульгирующими агентами или суспендирующими агентами, вместе с такими разбавителями как вода, этанол, пропиленгликоль, глицерин или их комбинации. Способы получения различных фармацевтических композиций с конкретным количеством активного соединения известны, или будут очевидны специалистам в данной области. Например, смотриRemington's Pharmaceutical Sciences, Mack Publishing Company, Easter, Pa., 15th Edition (1975). Примеры и получения, приведенные ниже, дополнительно иллюстрируют и служат примерами соединений по настоящему изобретению и способов получения таких соединений. Должно быть понятно,что объем настоящего изобретения в любом случае не ограничен рамками следующих ниже примеров и подготовительных примеров. В следующих ниже примерах молекулы с одним хиральным центром, если не указано иное, находятся в виде рацемической смеси. Молекулы с двумя или более чем двумя хиральными центрами, если не указано иное, находятся в виде рацемической смеси диастереомеров. Единственные энантиомеры/диастереомеры могут быть получены способами, известными специалистам в данной области. Когда в получениях и примерах, приведенных ниже, ссылаются на ВЭЖХ (высокоэффективная жидкостная хроматография), используемые общие условия, если не указано иное, следующие. Используемая колонка представляет собой колонку ZORBAX RXC18 (производства компании HewlettPackard) длиной 150 мм и внутренним диаметром 4,6 мм. Образцы прогоняют на системе HewlettPackard-1100. Используют метод градиентного растворителя, прогоняя от 100-процентного буфера ацетат аммония/уксусная кислота (0,2 М) до 100-процентного ацетонитрила за период времени 10 мин. Данную систему затем подвергают циклу промывки 100-процентным ацетонитрилом в течение 1,5 мин, а затем 100-процентным буферным раствором в течение 3 мин. Скорость потока в течение этого периода постоянная, 3 мл/мин. В следующих примерах и плучениях Et означает этил, Ас значает ацетил, Me означает метил, и Вu означает бутил. Получение 3-метил-4-фноксинитробензола. Гидрид натрия (95% сухой порошок) (83,62 г, 3,31 моль, 1,3 экв.) загружали в атмосфере азота в чистую и сухую 12-литровую четырехгорлую колбу, снабженную конденсатором, капельной воронкой,механической мешалкой и двумя впускными-выпускными барботерами для азота (Предостережение: гидрид натрия является пирофорным веществом, избегайте контакта с водой или влагой). Реакционную колбу охлаждали до 0 С (ледяная баня), затем осторожно добавляли безводный ДМФ (1280 мл), используя капельную воронку. Реакционную смесь перемешивали в течение 30 мин при 0 С, затем в течение 2 ч добавляли раствор фенола (263,5 г, 2,8 моль, 1,1 экв.) в безводном ДМФ (1280 мл), используя капельную воронку (Предостережение: экзотермический процесс с бурным выделением водорода). После окончания добавления реакционную смесь перемешивали в течение 40 мин при 0 С (реакционная смесь превращалась в белую суспензию), затем по каплям в течение 1 ч добавляли раствор 3-метил-4-фторнитробензола(390,0 г, 2,51 моль, 1,0 экв.) в безводном ДМФ (диметилформамид) (1280 мл). Реакционную смесь медленно нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 1522 ч (вязкий темно-коричневый раствор) до тех пор, пока весь исходный материал не превратился в феноксинитротолуол (ТСХ, 2% этилацетат в гексанах). Снова реакционную смесь охлаждали до 0 С (ледяная баня), затем осторожно гасили холодной водой (5000 мл) в течение 2 ч (Предостережение: экзотермический процесс с выделением водорода; первые 100 мл воды добавляли в течение 90 мин). Реакционную смесь перемешивали в течение 1 ч, затем переносили в две 50-литровые бутыли в оплетке, каждая из которых содержала 40 л воды. Содержимое перемешивали и оставляли стоять при комнатной температуре на 24 ч до получения феноксинитротолуола в виде желтого твердого вещества. Это желтое твердое вещество фильтровали, промывали избытком воды и сушили на воздухе с получением 3-метил-4 феноксинитробензола (552 г, 96% выход). По 1 Н и 13 С ЯМР спектрам было установлено, что неочищен- 12006107 ный 3-метил-4-феноксинитробензол является чистым, и его использовали как таковой в следующей реакции; т.пл. 51-52 С; ПФ-ИК (инфракрасная спектроскопия с преобразованием Фурье) (см-1): 1582, 1509,1480, 1339, 1242, 1204, 1091 и 796; 1 Н ЯМР (300 МГц, CDCl3)2.41 (s, 3 Н), 6.78 (d, 1H, J = 8,7 Гц), 7.027.08 (m, 2H), 7.19-7.29 (m, 1H), 7.38-7.46 (m, 2H), 7.99 (dd, 1H, J = 9,15 Гц, 2,7 Гц); 13 С ЯМР (75,45 МГц,CDCl3) 16.22, 115.93, 119.11, 123.17, 124.9, 126.79, 129.53, 130.28, 142.66, 155.44 и 161.4. Получение гидрохлорида 3-метил-4-феноксианилина. К перемешиваемому раствору 3-метил-4-феноксинитробензола (2) (548 г, 2,39 моль,1,0 экв.) в метаноле (5 л) добавляли 10% Pd/C (100 г, влажность 50%, 46,98 моль, 0,02 экв.). Затем реакционную смесь перемешивали в атмосфере водорода (60-80 фунт/кв.дюйм (420-560 кПа в течение 15-16 ч при комнатной температуре в 2-х галлонном гидрогенизаторе Парра. Протекание процесса контролировали ТСХ(50% этилацетат в гексанах, sm Rf = 0,69, pr Rf = 0,47, УФ видимый). Затем реакционную смесь фильтровали через целит, и твердое вещество промывали избытком метанола. Фильтрат концентрировали при пониженном давлении с получением 3-метил-4-феноксианилина в виде бледно-коричневой вязкой жидкости (451,0 г, 95%). По 1 Н и 13 С ЯМР спектрам установлено, что 3-метил-4-феноксианилин является чистым, и как таковой его использовали в следующей реакции. В охлажденный (0 С) и перемешиваемый раствор 3-метил-4-феноксианилина (451,0 г, 2,26 моль,1,0 экв.) в безводном эфире (12 л) барботировали сухой газ HCl в течение 40-90 мин до тех пор, пока весь исходный материал не превратился в гидрохлоридную соль анилина. Не совсем белое твердое вещество фильтровали, промывали эфиром и сушили в вакуумном сушильном шкафу в течение 6 ч при 60 С с получением гидрохлорида 3-метил-4-феноксианилина (511,8 г, 96%); т.пл. 173-174 С; ПФ-ИК (см-1): 3058,3019, 2840, 2573, 1485, 1253, 1223 и 691; 1 Н ЯМР (300 МГц, CDCl3)2.22 (s, 3 Н), 6.81-6.9 (m, 3 Н), 7.047.11 (m, 1H), 7.25-7.37 (т, 3 Н), 7.43 (d, 1H, J = 2,4 Гц), 10.45 (s, 3 Н); 13 С ЯМР (75,45 МГц, CDCl3) 16.03,118.01, 119.9, 122.12, 123.35, 124.78, 126.13, 129.93, 131.89, 155.5 и 156.96; APCl (химическая ионизация при атмосферном давлении) (отрицательный FAB) 200,3 (100%); Анализ: Вычислено для C13H14ClNO: С,66,24; Н, 5,99; N, 5,94. Найдено: С, 60,05; Н, 6,01; N,5,98. Примерами других аминов, полученных вышеописанными способами, являются: 3-хлор-4-феноксифениламин,3-метокси-4-феноксифениламин,4-фенокси-3-трифторметилфениламин,3-фтор-4-феноксифениламин,5-амино-2-феноксибензонитрил,4-(2-метоксифенокси)-3-метилфениламин,4-(3-метоксифенокси)-3-метилфениламин,4-(4-метоксифенокси)-3-метилфениламин,4-(2-фторфенокси)-3-метилфениламин,4-(3-фторфенокси)-3-метилфениламин,4-(4-фторфенокси)-3-метилфениламин,4-(2-метилфенокси)-3-метилфениламин,4-(3-метилфенокси)-3-метилфениламин,4-(4-метилфенокси)-3-метилфениламин,4-(2,6-дифторфенокси)-3-метилфениламин,3,5-дихлор-4-феноксифениламин,3-метил-4-фенилсульфанилфениламин,4-фенилсульфанилфениламин,4-циклогексилокси-3-метилфениламин,4-циклопентилокси-3-метилфениламин,4-циклобутилокси-3-метилфениламин,2-фтор-4-феноксиамин,4-фтор-2-феноксиамин,3-бром-4-феноксифениламин,4-(2-хлорфенокси)-3-метилфениламин,4-(2-метоксифенокси)-3-метилфениламин,4-(2-этилфенокси)-3-метилфениламин,4-(2-трифторметилфенокси)-3-метилфениламин,1-(5-амино-2-феноксифенил)этанон,(+/-)-4-Бензолсульфинил-3-метилфениламин, (+/-)-4-бензолсульфинилфениламин, 4-бензолсульфонил-3-метилфениламин, 4-бензолсульфонилфениламин были получены из 3-метил-4-фенилсульфанилфениламина и 4-фенилсульфанилфениламина методами окисления, известными специалистам в данной области. 3-Этил-4-феноксифениламин. К раствору 1-(5-амино-2-феноксифенил)этанона (0,5 г, 2,20 ммоль) в ТГФ (тетрагидрофуран) (15- 13006107 мл) добавляли боргидрид натрия (0,4 г, 10,5 ммоль) и АlСl3 (безводный) (0,803 г, 6,02 ммоль) в атмосфере азота. Полученную реакционную смесь нагревали с обратным холодильником в течение 4 ч. Эту смесь затем охлаждали и добавляли ледяную воду. Полученную смесь экстрагировали ЕtOАс и сушили надNa2SO4. Удаление растворителя дало коричневатый остаток, который хроматографировали с использованием смеси гексан/ЕtOАс в соотношении 4:1 с получением (15 мг, 10%) продукта 3-этил-4-феноксифениламина. 3-Гидрокси-4-феноксифениламин. 3-Метокси-4-феноксинитробензол (2 г, 8,15 ммоль) обрабатывали 48% НВr (20 мл) и НОАс (20 мл). Реакционную смесь нагревали до 110 С в течение 24 ч, а затем выливали на лед и экстрагировали ЕtOАс. Органический слой промывали солевым раствором и сушили над Na2SO4. Удаление растворителя дало коричневатый остаток 5-нитро-2-феноксифенола, который переносили на следующую стадию без дальнейшей очистки (почти количественный выход). 1 Н ЯМР (CDCl3):7.91 (d, 1H, 2,7 Гц), 7.72 (dd, 1H,J1=8,8 Гц, J2 = 2,4 Гц), 7.43 (t, 2 Н, J = 7,9 Гц), 7.28 (d, 1H, 7,9 Гц), 7.10 (d, 1H, J = 8,3 Гц), 6.78 (d, 2H, J = 8,9 Гц). Этокси-4-феноксифениламин. К раствору 5-нитро-2-феноксифенола (500 мг, 2,16 ммоль) в ацетоне (20 мл) добавляли бромэтан(0,353 г, 3,26 ммоль) и карбонат калия (0,447 г, 3,26 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч, а затем реакционную смесь нагревали до 50 С в течение 4 ч. Добавляли воду, и водный слой экстрагировали ЕtOАс (3x30 мл), органический слой промывали солевым раствором и сушили над Na2SO4. Удаление растворителя дало (0,3 г, 53%) 3-этокси-4-феноксинитробензола. Данный продукт подвергали гидрогенизации над 10% Pd-C в метаноле с получением (0,1 г, 38%) 3-этокси-4-фенокси-фениламина; m/z, 230,0. 1 Н ЯМР (CDCl3): 7.91 (d, 1H, 2,7 Гц), 7.72 (dd, 1H,J18,8 Гц, J2 = 2,4 Гц), 7.43 (приблизит, t, 2H, J = 7,9 Гц), 7.28 (d, 1H, 7,9 Гц), 7.10 (d, 1H, J = 8,3 Гц), 6.78(d, 2 Н, J = 8,9 Гц), 4.17 (dd, 2H, J1=13,9 Гц, J2 = 7,1 Гц), 1.42 (t, 3 Н, J = 7,1 Гц). По вышеприведенному протоколу алкилирования также был получен 3-изопропокси-4-феноксифениламин. 3-Фенил-1 Н-индазол-6-иламин. К раствору 2-хлор-5-нитробензофенона (1,0 г) в ТГФ (15 мл) добавляли безводный гидразин (120 мг). Полученную реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2-4 ч. Растворитель удаляли в вакууме, и остаток растворяли в ЕtOАс, промывали водой и солевым раствором и сушили над Na2SO4. Удаление растворителя дало (0,8 г, 88%) продукт 6-нитро-3-фенил-1 Ниндазол (5). 6-Нитро-3-фенил-1 Н-индазол гидрогенизировали над H2/Pd с получением 0,5 г 3-фенил-1 Ниндазол-6-иламина (71,5%); m/z, 210,0.1 Н ЯМР (CD3OD): 7.86 (d, 2H, J = 7,9 Гц), 7.47 (t, J = 8,1 Гц), 7.35(t, 3 Н, J = 8,7 Гц), 7.01 (d, 1H, J = 8,7 Гц). Общая методика присоединения 1-литий-2-триметилсилилацетилена к карбонилу Холодный (-78 С), перемешиваемый раствор (триметилсилил)ацетилена (1,2 экв.) в безводном ТГФ обрабатывали H-BuLi (1,2 экв.) в атмосфере азота (в случае тpeт-бутилоксикарбонил (ВОС)-защищенных аминоальдегидов, содержащих свободный NH количество (триметилсилил)ацетилена и H-BuLi удваивается). Бесцветный раствор перемешивали в течение 30-40 мин споследующим добавлением карбонильных соединений (1,0 экв.) в безводном ТГФ. Реакционную смесь нагревали до комнатной температуры,перемешивали в течение 2-4 ч и гасили водой. После удаления ТГФ остаток распределяли между эфиром или ЕtOАс и водой. Отделенный органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали с получением неочищенного триметилсилил (ТМС)-защищенного пропаргилового спирта. Затем смесь неочищенного пропаргилового спирта (1,0 экв.) и K2 СО 3 (2,0 экв.) в метаноле перемешивали при комнатной температуре в течение 0,5-1 ч. Твердые вещества отфильтровывали и промывали эфиром. Фильтрат концентрировали, растворяли в эфире, промывали водой и солевым раствором и сушили над сульфатом натрия. Удаление растворителя дало неочищенный терминальный ацетиленовый продукт, который очищали перегонкой или хроматографией (этилацетат/гексаны). Общие выходы для этой методики находятся в пределах 62-97%. Примерами терминальных алкинов, полученных вышеописанным способом, являются следующие: тpeт-бутиловый эфир 3-этинил-3-гидроксипиперидин-1-карбоновой кислоты,тpeт-бутиловый эфир 4-этинил-4-гидроксипиперидин-1-карбоновой кислоты,тpeт-бутиловый эфир 3-этинил-3-гидроксипирролидин-1-карбоновой кислоты,тpeт-бутиловый эфир эндо 3-этинил-3-гидрокси-8-азабицикло[3.2.1]октан-8-карбоновой кислоты,трет-бутиловый эфир экзо 3-этинил-3-гидрокси-8-азабицикло[3.2.1]октан-8-карбоновой кислоты,трет-бутиловый эфир 2-(1-гидрокси-проп-2-инил)пирролидин-1-карбоновой кислоты,1-циклобутил-проп-2-ин-1-ол,пент-1-ин-3-ол,4-амино-пент-1-ин-3-ол,1-(3-азабицикло[3.1.0]гекс-6-ил)проп-2-ин-1-ол,4-этинилтетрагидропиран-4-ол,- 14006107 трет-бутиловый эфир (4-этинилтетрагидропиран-4-ил)карбаминовой кислоты,трет-бутиловый эфир 2-(1-гидрокси-проп-2-инил)пиперидин-1-карбоновой кислоты,трет-бутиловый эфир 3-(1-гидрокси-проп-2-инил)пиперидин-1-карбоновой кислоты,4-этинил-1-метил-пиперидин-4-ол,трет-бутиловый эфир (2-гидрокси-бут-3-инил)метилкарбаминовой кислоты,трет-бутиловый эфир (2-этинил-2-гидроксициклогексил)карбаминовой кислоты,R- и S-3-этинил-1-азабицикло[2.2.2.]октан-3-ол. Общая методика гомологизации альдегидов до терминальных алкинов К холодному (-78 С), перемешиваемому раствору ЛДА (диизопропиламид лития) (1,3 экв.) в безводном ТГФ по каплям добавляли раствор (триметилсилил)диазометана в гексане (1,3 экв.) в атмосфере азота (в случае ВОС-защищенных амино альдегидов, содержащих свободный NH, количество (триметилсилил)диазометана и ЛДА удваивается). Через 1 ч вводили альдегид (1,0 экв.) в безводном ТГФ, и охлаждающую баню убирают. Реакционную смесь перемешивали при комнатной температуре в течение 1-2 ч, гасили водой, концентрировали и распределяли между эфиром и водой. Отделенный органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали с получением неочищенного продукта, который очищали путем перегонки или хроматографии (этилацетат/гексаны). Общие выходы для этой методики находятся в пределах 37-72%. Примерами терминальных алкинов, полученных этим способом, являются следующие: тpeт-бутиловый эфир 4-этинилпиперидин-1-карбоновой кислоты,тpeт-бутиловый эфир 3(S)-этинилпиперидин-1-карбоновой кислоты,тpeт-бутиловый эфир 3(R)-этинилпиперидин-1-карбоновой кислоты,тpeт-бутиловый эфир 2-этинилпиперидин-1-карбоновой кислоты,тpeт-бутиловый эфир 3-этинилпирролидин-1-карбоновой кислоты,тpeт-бутиловый эфир 3-этинилазетидин-1-карбоновой кислоты,тpeт-бутиловый эфир (4-этинилтетрагидропиран-4-ил)карбаминовой кислоты,тpeт-бутиловый эфир [1-(трет-бутилдиметилсиланилоксиметил)проп-2-инил]карбаминовой кислоты. тpeт-Бутиловый эфир 4-проп-2-инилпиперазин-1-карбоновой кислоты. К раствору N-трет-бутоксикарбонилпиперазина (5,0 г, 26,8 ммоль) в ацетоне (40 мл) добавляли карбонат калия (3,70 г, 26,8 ммоль). К вышеуказанной реакционной смеси по каплям добавляли пропаргилбромид (2,39 мл, 26,8 ммоль) в ацетоне (10 мл). Полученную реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Добавляли воду, водный слой экстрагировали эфиром, и объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировалив вакууме с получением трет-бутилового эфира 4-проп-2-инил-пиперазин-1 карбоновой кислоты, который в виде неочищенного материала переносили на стадию реакции Pd связывания с соответствующим анилинхиназолином. Примерами терминальных алкинов, полученных этим способом, являются следующие: 1-проп-2-инилпирролидин,тpeт-бутиловый эфир 3-метил-4-проп-2-инилпиперазин-1-карбоновой кислоты,тpeт-бутиловый эфир 3,5-диметил-4-проп-2-инилпиперазин-1-карбоновой кислоты,1-метил-4-проп-2-инилпиперазин,4-проп-2-инилморфолин,(3-проп-2-инил-3-азабицикло[3.1.0]гекс-6-ил)метанол,1-проп-2-инилпиперидин-4-ол,1-проп-2-инилпиперидин-3-ол,1-проп-2-инилпирролидин-3-ол,(1-проп-2-инилпиперидин-4-ил)метанол,(1-проп-2-инилпиперидин-3-ил)метанол,(1-проп-2-инилпиперидин-2-ил)метанол,(1-проп-2-инилпирролидин-2-ил)метанол,2-(1-проп-2-инилпиперидин-4-ил)этанол,2-(4-проп-2-инилпиперазин-1-ил)этанол,4,4-диметокси-1-проп-2-инилпиперидин,1-проп-2-инилпиперидин-4-иламин,2-(метил-проп-2-иниламино)-этанол,метиламид 4-проп-2-инилпиперазин-1-карбоновой кислоты,1-(4-проп-2-инилпиперазин-1-ил)-этанон,4-проп-2-инилпиперазин-1-карбоксамид,1-метансульфонил-4-проп-2-инилпиперазин. 2-Хлор-N-проп-2-инилацетамид. Пропаргиламин (250 мг; 0,34 мл; 4,6 ммоль) растворяли в дихлорметане (10 мл) и охлаждали до 0 С. К этому раствору добавляли по каплям хлорацетилхлорид (256 мг; 0,18 мл; 2,3 ммоль), и этот рас- 15006107 твор перемешивали в течение 30 мин и оставляли нагреваться до комнатной температуры. Раствор промывали 2 Н 2 О, сушили над Na2SO4, и растворитель удаляли. 2-Xлop-N-проп-2-инилацетамид (385 мг)Na2CO3 (21,0 г, 0,2 моль) в смеси вода/TГФ (150 мл/150 мл) кипятили с обратным холодильником в течение 1 ч. После удаления ТГФ остаток распределяли между эфиром (200 мл) и водой (150 мл). Отделенный органический слой промывали солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали с получением 17,97 г (95%) 2-(трет-бутоксикарбониламино)-2-метил-1-пропанола в виде воскообразного белого твердого вещества: 1 Н ЯМР (CDCl3)1.23 (s, 6H), 1.41 (s, 9H), 3.56 (s, 2H). 2-(трет-Бутоксикарбониламино)-2-метилпропиональдегид. К раствору 2-(трет-бутоксикарбониламино)-2-метил-1-пропанола (5,7 г, 30,0 ммоль) в триэтиламине(42 мл) добавляли смесь комплекса триоксид серы-пиридин (14,3 г, 90,0 ммоль) в безводном ДМСО (50 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 1 ч в атмосфере азота и концентрировали. Остаток растворяли в ЕtOАс (200 мл), промывали водой (100 мл) и солевым раствором(100 мл), сушили над сульфатом натрия и концентрировали с получением неочищенного 2-(третбутоксикарбониламино)-2-метил пропиональдегида в виде желтого масла. Очистка путем перегонки дала 4,90 г (87%) воскообразного белого твердого вещества: 1 Н ЯМР (CDCl3)1.30 (s, 6H), 1.41 (s, 9H), 4.97(br, 1H), 9.40 (s, 1H). 4,4-Диметил-5-триметилсилилэтинил-2-оксазолидинон. Холодный (-78 С), перемешиваемый раствор (триметилсилил)ацетилена (4,42 г, 45,0 ммоль) в безводном ТГФ (20 мл) обрабатывали н-BuLi (18 мл, 45,0 ммоль) в атмосфере азота. Бесцветный раствор перемешивали в течение 30 мин с последующим добавлением 2-(трет-бутоксикарбониламино)-2-метил пропиональдегида (2,80 г, 15 ммоль) в безводном ТГФ (20 мл). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 2 ч и гасили водой. После удаления ТГФ остаток распределяли между эфиром (150 мл) и водой (100 мл). Отделенный органический слой промывали солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали с получением неочищенного 4,4 диметил-5-триметилсилилэтинил-2-оксазолидинона (100%) в виде желтого масла, которое переносили на следующую стадию. 4,4-Диметил-5-этинил-2-оксазолидинон. Смесь 4,4-диметил-5-триметилсилилэтинил-2-оксазолидинона (15,0 ммоль) и K2 СО 3 (4,1 г, 30,0 ммоль) в метаноле (30,0 мл) перемешивали при комнатной температуре в течение 30 мин. Твердое вещество отфильтровывали и промывали эфиром. Фильтрат концентрировали, растворяли в эфире (100 мл),промывали водой (50 мл) и солевым раствором (50 мл) и сушили над сульфатом натрия. Удаление растворителя дало 1,10 г (53%) 4,4-диметил-5-этинил-2-оксазолидинона в виде желтого масла: 1 Н ЯМР(CDCl3)1.37 (s, 3 Н), 1.39 (s, 3 Н), 2.68 (s, 1 Н), 4.82 (s, 1 Н), 6.00 (br s, 1 Н). Получение амида 4-этинил-4-гидрокситетрагидропиран-2-карбоновой кислоты. Этиловый эфир 4-оксо-3,4-дигидро-2 Н-пиран-2-карбоновой килоты: ZnCl (0,63 г, 4,6 ммоль) растворяли в безводном ТГФ (15 мл) и добавляли к раствору 1-метокси-3-(триметилсилилокси)-1,3 бутадиена (7,94 г, 46,0 ммоль) и этилглиоксалата (7,05 г, 69,0 ммоль) в толуоле (30 мл) при комнатной температуре. После перемешивания в течение 30 мин добавляли воду (30 мл) и ТФУ (трифторуксусную кислоту) (2 мл), и эту смесь энергично перемешивали в течение 20 мин. После концентрирования остаток распределяли между EtOAc (200 мл) и водой (100 мл). Отделенный органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали с получением 8,0 г (100%) коричневого масла, которое переносили на следующую стадию без дополнительной очистки. 1 Н ЯМР (CDCl3)1.30 (t, 3 Н), 2.85 (d, 2 Н), 4.26 (q, 2 Н), 5.00 (t, 1 Н), 5.48 (d, 1H), 7.39 (d, 1H). Этиловый эфир 4-оксотетрагидропиран-2-карбоновой килоты. Смесь этилового эфира 4-оксо-3,4 дигидро-2 Н-пиран-2-карбоновой килоты (8,0 г, 46,0 ммоль) и Pd/C (10%, 0,20 г) в ЕtOАс (70 мл) встряхивали в склянке Парра с водородом при 50 фунт/кв.дюйм ( 350 кПа) в течение ночи и фильтровали через- 16006107 слой целита. Фильтрат концентрировали, и остаток перегоняли с получением 2,62 г (33%) желтоватого масла: 1 Н ЯМР (CDCl3)1.29 (t, 3 Н), 2.40 (d, 1H), 2.58-2.75 (m, 3 Н), 3.79 (tt, 1H), 4.23 (q, 2H), 4.28 (m,1H), 4.40 (m, 1H). Этиловый эфир 4-гидрокси-4-триметилсиланилэтинилтетрагидропиран-2-карбоновой кислоты. Холодный (-78 С), перемешиваемый раствор (триметилсилил)ацетилена (1,80 г, 18,24 ммоль) в безводном ТГФ (30 мл) обрабатывали н-BuLi (7,3 мл в гексане, 18,24 ммоль) в атмосфере азота. Бесцветный раствор перемешивали в течение 30 мин, а затем добавляли этиловый эфир 4-оксотетрагидропиран-2 карбоновой кислоты (2,62 г, 15,2 ммоль) в безводном ТГФ (30 мл). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 2 ч и гасили водой (30 мл). После удаления ТГФ продукт экстрагировали ЕtOАс (2 х 60 мл). Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали с получением 2,50 г (61%) желтого масла: 1 Н ЯМР (CDCl3)0.17 (s, 9 Н), 1.30 (t, 3 Н), 1.76-1.90 (m, 3 Н), 2.25 (m, 1 Н), 3.66 (tt, 1H), 4.11-4.21 (m, 2 Н),4.24 (q, 2H). Амид 4-этинил-4-гидрокситетрагидропиран-2-карбоновой кислоты. Этиловый эфир 4-гидрокси-4-триметилсиланилэтинилтетрагидропиран-2-карбоновой кислоты (2,50 г, 9,25 ммоль) растворяли в МеОН (20 мл) в реакционной пробирке под давлением, и газ NH3 пропускали через раствор в течение 10 мин при перемешивании. Пробирку плотно закрывали, и реакционную смесь перемешивали в течение 3 дней. После удаления растворителя получили 1,53 г (97%) желтого масла: 1 Н ЯМР (CD3OD)1.48 (t, 1 Н), 1.70 (td, 1H), 1.85 (d, 1H), 2.30 (d, 1H), 3.04 (s, 1H), 3.29 (s, 1H), 3.71 (t, 1H),3.98 (d, 1H), 4.06 (dt, 1H). Получение 2-(трет-бутилдиметилсиланилоксиметил)-4-этинилтетрагидропиран-4-ола. 2-Гидроксиметилтетрагидропиран-4-ол. К охлажденной (0 С), перемешиваемой суспензии LiAlH4 (3,42 г, 90,0 ммоль) в безводном ТГФ (50 мл) по каплям добавляли раствор этилового эфира 4-оксотетрагидропиран-2-карбоновой кислоты (5,17 г,30,0 ммоль). После перемешивания в течение 1 ч реакционную смесь гасили медленным добавлением последовательно воды (3,4 мл), 15% NaOH (3,4 мл) и воды (10,0 мл). Неорганическую соль отфильтровали и экстрагировали повторно ЕtOАс, поскольку продукт абсорбировался на твердом веществе. Удаление растворителя дало 2,42 г (61%) желтого масла. Неочищенную смесь переносили на следующую стадию без очистки. 2-(трет-Бутил-диметилсиланилоксиметил)тетрагидропиран-4-ол. К раствору 2-гидроксиметилтетрагидропиран-4-ола (2,42 г, 18,3 ммоль), ДМАП (4 диметиламинопиридин) (90 мг, 0,74 ммоль) и Et3N (2,04 г, 20,1 ммоль) в безводном CH2Cl2 (50 мл) добавляли тpeт-бутилдиметилсилилхлорид (2,76 г, 18,3 ммоль) при комнатной температуре. После перемешивания в течение ночи реакционный раствор гасили солевым раствором (30 мл), и отделенный водный слой экстрагировали CH2Cl2 (40 мл). Объединенный органический экстракт сушили над сульфатом натрия и концентрировали. Очистка на силикагелевой колонке с использованием 30% ЕtOАс в гексане дала 2,27 г (50%) бесцветного масла: 1 Н ЯМР (CDCl3)0.04 (s, 6H), 0.88 (s, 9H), 1.21 (m, 1H), 1.43 (m,1H), 1.82 (dt, 1H), 2.00 (dt, 1H), 3.35 (m, 1H), 3.51 (q, 1H), 3.66 (q, 1H), 3.79 (m, 1H), 4.01 (m, 1 Н). 2-(трет-Бутилдиметилсиланилоксиметил)тетрагидропиран-4-он. Раствор 2-(трет-бутилдиметилсиланилоксиметил)тетрагидропиран-4-ола (2,27 г, 9,21 ммоль) в безводном ДМСО/Et3N (15/13 мл) обрабатывали порциями комплекса триоксид серы-пиридин (7,33 г, 46,1 ммоль) при комнатной температуре. После перемешивания в течение 1 ч реакционную смесь концентрировали, и остаток распределяли между ЕtOАс (100 мл) и водой (50 мл). Отделенный органический слой промывали солевым раствором (70 мл), сушили над сульфатом натрия и концентрировали. Очистка на силикагелевой колонке с использованием 10-20% ЕtOАс в гексане дала 1,48 г (66%) бесцветного масла: 1 Н ЯМР (CDCl3)0.05 (s, 6H), 0.88 (s, 9H), 2.32 (dt, 1H), 2.41 (m, 2H), 2.58 (m, 1H), 3.62 (m, 2H), 3.70 (d,2H), 4.31 (m, 1H). 2-(трет-Бутилдиметилсиланилоксиметил)-4-триметилсиланилэтинилтетрагидропиран-4-ол. Холодный (-78 С), перемешиваемый раствор (триметилсилил)ацетилена (1,01 г, 10,3 ммоль) в безводном ТГФ (25 мл) обрабатывали н-BuLi (4,12 мл в гексане, 10,3 ммоль) в атмосфере азота. Бесцветный раствор перемешивали в течение 30 мин, а затем добавляли 2-(трет-бутилдиметилсиланилоксиметил) тетрагидропиран-4-она (1,48 г, 6,06 ммоль) в безводном ТГФ (25 мл). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 2 ч и гасили водой (30 мл). После удаления ТГФ продукт экстрагировали ЕtOАс (2 х 50 мл). Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали с получением 1,75 г (84%) желтого масла: 1 Н ЯМР (CDCl3)0.05 (s, 6H), 0.16 (s, 9H), 0.89 (s, 9H), 1.43 (m, 1H), 1.78 (td, 1H), 1.83 (d, 1 Н), 1.94 (d, 1 Н),3.52-3.70 (m, 4 Н), 4.00 (m, 1 Н). 2-(трет-Бутилдиметилсиланилоксиметил)-4-этинилтетрагидропиран-4-ол. Смесь 2-(трет-бутилдиметилсиланилоксиметил)-4-триметилсиланилэтинилтетрагидропиран-4-ола(1,75 г, 5,1 ммоль) и K2 СО 3 (1,4 г, 10,2 ммоль) перемешивали при комнатной температуре в течение 30 мин. После концентрирования остаток распределяли между ЕtOАс (50 мл) и водой (30 мл), и отделенный водный слой экстрагировали ЕtOАС. Объединенный органический экстракт сушили над сульфатом натрия и концентрировали с получением 1,33 г (96%) светло-желтого масла: 1 Н ЯМР (CDCl3)0.05 (s, 6H),0.88 (s, 9H), 1.50 (m, 1 Н), 1.78 (m, 1 Н), 1.84 (d, 1 Н), 2.01 (m, 1 Н), 2.55 (s, 1 Н), 3.55-3.70 (m, 4 Н), 4.00 (m,1 Н). 6-Иод-4-хиназолинон. Раствор 2-амино-5-иодбензойной кислоты (26,3 г, 100 ммоль) и ацетата формамидина (13,5 г, 130 ммоль) в этаноле (400 мл) кипятили с обратным холодильником в течение 20 ч. После охлаждения до 0 С твердый продукт собирали фильтрацией. Дополнительное высушивание в вакууме дало 6-иод-4 хиназолинон (22,0 г, 81%) в виде серого кристаллического твердого вещества. 1 Н ЯМР (400 МГц; ДMCOd6) : 12.38 (br. s, 1H), 8.35 (d, 1H), 8.05-8.10 (m, 2H), 7.43 (dd, 1H). МСНР (Масс-спектрометрия низкого разрешения): 272,9 (МН+). 6-Иод-4-хлорхиназолин (12). К перемешиваемому раствору ДМФ (6,3 мл) в ДХЭ (20 мл), охлажденному до 0 С, по каплям добавляли раствор оксалилхлорида (60 мл 2 М раствора в ДХЭ). После того, как добавление было завершено, охлаждающую баню убирали и 6-иод-3 Н-хиназолинон (10 г, 36,8 ммоль) добавляли в виде твердого вещества. Полученную смесь нагревали до температуры дефлегмации в атмосфере азота в течение 3 ч. После охлаждения до комнатной температуры реакционную смесь осторожно гасили Н 2 О. ДобавлялиCH2Cl2 и бислой переносили в делительную воронку. Водный слой экстрагировали CH2Cl2 (2 х 50 мл), и объединенные органические слои сушили (Na2SO4). Растворитель удаляли в вакуме с получением желтого твердого вещества, которое растирали с диэтиловым эфиром для удаления любых оставшихся примесей. ЯМР показал, что полученное желтое твердое вещество, полученное в результате фильтрации, является чистым. 1 Н ЯМР (CDCl3; 400 МГц): : 9.05 (s, 1H), 8.65 (d, 1H), 8.21 (dd, 1H), 7.78 (d, 1H). 6-Иод-4-феноксихиназолин (13). Суспензию NaH (отмытого от минерального масла) в ДМФ (40 мл) охлаждали до 0 С и по каплям добавляли раствор фенола (5,65 г, 60 ммоль) в ДМФ (20 мл). После того, как добавление было завершено, небольшими порциями добавляли 6-иод-4-хлорхиназолин (14,6 г, 50,3 ммоль) в виде твердого вещества. Охлаждающую баню убирали, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Эту смесь затем гасили водой (200 мл), разбавляли ЕtOАс (300 мл) и переносили в делительную воронку. Органический слой промывали разбавленным водным NaOH, водой и солевым раствором и сушили над Na2SO4. Фильтрование твердых веществ и удаление растворителя дало хиназолин 13 (17,2 г,98%) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц; CDCl3): : 8.74 (d, 1H),:8,14 (s, 1H), 8.12 (dd,1H), 7.71 (d, 1H), 7.49 (dd, 2H), 7.32 (t, 1H),7.22(m, 2H). Способ А. (1-Бензолсульфонил-1 Н-индол-5-ил)-[6-(3-имидазол-1-ил-проп-1-инил)-хиназолин-4-ил] амин (15).(1-Бензолсульфонил-1 Н-индол-5-ил)-(6-иодхиназолин-4-ил)амин (14). 6-Йод-4-хлорхиназолин (2,38 г, 8,20 ммоль) и 5-амино-1-бензолсульфонилиндол (2,46 г, 9,00 ммоль) объединяли в ДХЭ (20 мл) и трет-бутаноле (20 мл). Полученную смесь нагревали с обратным холодильником в атмосфере азота в течение 18 ч до образования прозрачной желтой суспензии. После охлаждения твердые вещества фильтровали и промывали CH2Cl2 и помещали под высокий вакуум для удаления всего избытка растворителя. Хиназолин 14 (3,23 г, 75%) получили в виде желтого твердого вещества. 1 Н ЯМР (ДMCO-d6; 400 МГц): : 9.24 (s, 1H, NH), 8.84 (s, 1H), 8.33 (dd, 1 Н, 8,9 Гц, 1,7 Гц), 8.01 (m, 4 Н), 7.90(1-Бензолсульфонил-1 Н-индол-5-ил)-[6-(3-имидазол-1-илпроп-1-инил)хиназолин-4-ил]амин (15). Хиназолин 14 (150 мг, 0,28 ммоль), 1-N-2-пропинилимидазол (200 мг, 1,89 ммоль), Pd(OAc)2 (4 мг,0,016 ммоль) и PPh3 (9 мг, 0,033 ммоль) смешивали в NEt3 (1,25 мл) и ДМФ (0,5 мл). Эту смесь нагревали при 80 С в атмосфере азота в течение 16 ч. После охлаждения черную суспензию концентрировали при пониженном давлении, и остаток растворяли в МеОН. Добавляли силикагель (1 г), и метанол удаляли в вакууме. Полученный силикагель помещали на силикагелевую (40 г) колонку, которую затем элюировали 200 мл смеси СН 2 Сl2:МеОН в соотношении 50:1, 300 мл СН 2 Сl2 25:1 с получением алкина 15 (72 мг,51%) в виде желтой пены. 1 Н ЯМР (CDCl3; 400 МГц): : 8.95 (br, 1H, NH), 8.63 (s, 1H), 8.62 (s, 1H), 8.24(6-Йодхиназолин-4-ил)-(3-метил-4-феноксифенил)амин. 4-Хлор-6-иодхиназолин (5,0 г, 17,2 ммоль) и 3-метил-4-феноксианилин (17,2 ммоль) смешивали вместе в смеси дихлорэтана и тpeт-бутанола в соотношении 1:1 (50 мл). Реакционную смесь нагревали при 90 С в течение 4 ч, при этом наблюдалось образование желтого осадка. Реакционную смесь охлаждали, и осадок собирали с получением (6-иодхиназолин-4-ил)-(3-метил-4-феноксифенил)амина (8,0 г,94%); m/z, 454. 1 Н ЯМР (CD3OD): : 9.12 (s, 1H), 8.83 (s, 1 Н), 8.39 (d, 1H, J = 8,8 Гц), 7.63 (d, 1H, J = 8,8(3-Метил-4-феноксифенил)-[6-(3-пиперазин-1-илпроп-1-инил)хиназолин-4-ил]амин. трет-Бутиловый эфир 4-проп-2-инилпиперазин-1-карбоновой кислоты (2,37 г, неочищенный) и (6 иодхиназолин-4-ил)-(3-метил-4-феноксифенил)амин (800 мг, 1,76 ммоль), Pd(OAc)2 (23,7 мг, 0,105 ммоль), PPh3 (55,3 мг, 0,21 ммоль) в Et3N (8 мл) и ДМФ (3 мл) смешивали вместе. Полученную реакционную смесь нагревали при 80 С в течение ночи. После охлаждения к реакционной смеси добавляли метиленхлорид, и темную смесь промывали солевым раствором и сушили над сульфатом натрия. Растворитель удаляли, а остаток хроматографировали на силикагеле (1:1 гексан + этилацетат) с получением продукта 2. 2 растворяли в метиленхлориде, и через этот раствор барботировали газ HCl в течение 5 мин. Осадок собирали с получением (400 мг, 46,7%) продукта (3-метил-4-феноксифенил)-[6-(3-пиперазин-1 ил-проп-1-инил)хиназолин-4-ил]амина.m/z, 450, 1 Н ЯМР (ДМСО),(млн-1), 9.52 (s, 1H), 8.84 (s, 1H), 8.20 (dd, 1H, J1=8,7 Гц, J2 = 1,3 Гц),7.99 (d, 1H, J = 2,5 Гц), 7.60 (dd, J1=8,7 Гц, J2 = 2,7 Гц), 7.36 (видимый t, 2H, J = 8,5 Гц), 7.11 (t, 1H, J = 7,5 Гц), 6.92 (d, 1H, J = 8,8 Гц), 6.91 (d, 1H, J = 7,9 Гц), 3.55 (br, 4H), 3.44 (br, 4H), 3.30 (s, 2H), 2.19 (s, 3 Н). Способ Б. (6-Циклобутилхиназолин-4-ил)-(4-феноксифенил)амин (17). 6-Циклобутил-4-феноксихиназолин (16). К перемешиваемому раствору нафталина (3,85 г, 30 ммоль) в сухом ТГФ (20 мл) при комнатной температуре небольшими порциями добавляли тонко нарезанный металлический литий (0,21 г, 30 ммоль). Смесь становилась темно-зеленой, и перемешивание продолжали в течение 2 ч. Затем посредством шприца по каплям добавляли раствор ZnCl2 (33 мл 0,5 М раствора в ТГФ, 16,5 ммоль), придающего черный цвет. Через 3 ч перемешивание прекращали и давали возможность осесть мелкому порошку Zn. Супернатант ( 40 мл) удаляли с помощью сухой пипетки и заменяли свежим ТГФ (10 мл). Затем добавляли циклобутилбромид (2,0 г, 14,8 ммоль), и полученную темную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. Перемешивание снова останавливали, и надосадочный цинкорганический реагент использовали непосредственно в следующей реакции. К раствору 6-иод-4-феноксихиназолина (1,75 г, 5,03 ммоль), Pd2(dba)3 [трис(дибензилиденацетамид) дипалладий(0)] (90 мг, 0,1 ммоль) и трифурилфосфина (185 мг, 0,8 ммоль) в ТГФ (10 мл) добавляли циклобутилцинк, полученный как указано выше. Полученную смесь перемешивали в течение 6 ч, затем разбавляли ТГФ (30 мл) и гасили насыщенным раствором NH4Cl (40 мл). Два слоя разделяли, и органический слой промывали водой и солевым раствором, затем сушили (Na2SO4). Удаление твердых веществ и удаление растворителя в вакууме дали коричневое масло. Очистка хроматографией на силикагеле, элюируя смесью ЕtOАс:гексаны в соотношении 1:1 дала 6-циклобутил-4-феноксихиназолин (0,78 г, 56%) в виде желтого масла. 1 Н ЯМР (400 МГц; CDCl3): : 8.71 (s, 1H), 8.14 (s, 1 Н), 7.92 (d, 1 Н), 7.78 (dd, 1H), 7.50(0,45 г). Эту смесь нагревали при 100 С в общем в течение 17 ч. Избыток фенола удаляли путем перегонки при пониженном давлении до получения остатка, который растирали с CH2Cl2 с получением целевого хиназолина 17 (20 мг, 30%) в виде желтого твердого вещества. 1 Н ЯМР (ДМСО-d6, 400 МГц): : 9.76 (s,1 Н), 8.47 (s, 1 Н), 8.31 (s, 1 Н), 7.77 (d, 2 Н), 7.69 (m, 2H), 7.36 (t, 2 Н), 7.11 (t, 1 Н), 7.03 (d, 2 Н), 6.98 (d, 2 Н),3.69 (m, 1 Н), 2.35 (m, 2 Н), 2.23 (m, 2 Н), 2.01 (m, 1 Н), 1.86 (m, 1 Н). Способ В. Этиловый эфир цис- и транс-3-[4-(1-бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6 ил]циклобутанкарбоновой кислоты (19 а/19 б). Этиловый эфир цис- и транс-3-(4-феноксихиназолин-6-ил)циклобутанкарбоновой кислоты (18 а/б): К раствору нафталина (1,92 г, 15 ммоль) в сухом ТГФ в атмосфере N2 небольшими порциями добавляли тонко нарезанный металлический Li (104 мг, 15 ммоль), что дало в результате зеленую смесь, которую перемешивали в течение 2 ч. Затем посредством шприца по каплям добавляли хлорид цинка (16 мл 0,5 М раствора в ТГФ, 8 ммоль) и данную смесь перемешивали при комнатной температуре в течение 3 ч. Перемешивание прекращали и супернатант удаляли и заменяли раствором этилового эфира 3 йодциклобутан-1-карбоновой кислоты (790 мг, 3 ммоль). Полученную суспензию перемешивали в течение 20 часов, затем перемешивание прекращали и оставшемуся металлическому Zn давали возможность осесть. Оставшийся раствор переносили в сухую колбу, содержащую хиназолин 13 (520 мг, 1,5 ммоль),Pd2(dba)3 (27 мг, 0,03 ммоль) и три-2-фурилфосфин (56 мг, 0,24 ммоль). Эту смесь перемешивали при комнатной температуре в течение 16 ч. Смесь концентрировали, и остаток растворяли в ЕtOАс (30 мл) и промывали насыщенным водным NH4Cl, солевым раствором и Н 2 О и сушили (Na2SO4). Растворитель удаляли в вакууме, и полученный остаток очищали хроматографией на силикагеле с получением циклобутиловых эфиров 18 а и 18 б в виде смеси цис и транс изомеров (300 мг, 57%). МСНР: 349,2 (МН+). ВЭЖХ: 7,31 мин (28%); 7,44 мин (72%). Этиловый эфир цис- и транс-3-[4-(1-бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-ил]циклобутанкарбоновой кислоты (19 а,б):- 19006107 Эфиры 18 а и 18 б (300 мг, 0,86 ммоль) объединяли с 5-амино-1-фенилсульфонилиндолом (270 мг,1,0 ммоль) и фенолом (1,0 г). Эту смесь нагревали до 100 С в течение 48 ч. Избыток фенола удаляли путем перегонки, а остаток растворяли в CH2Cl2, переносили в делительную воронку и промывали Н 2 О и солевым раствором. Органический слой сушили (Na2SO4) и растворитель удаляли с получением темного остатка, который очищали с помощью препаративной ТСХ, элюируя ЕtOАс, с получением эфиров 19 а и 19 б (0,20 г, 44%) в виде воскообразного твердого вещества. МСНР: 527,2 (МН+). ВЭЖХ: 7,54 мин (16%); 7,64 мин (84%). Способ Г. цис- и транс-3-[4-(1-Бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-ил]циклобутил) метанол (20 а,б). К холодному (-78 С), перемешанному раствору этиловых эфиров 19 а/19 б (70 мг, 0,13 ммоль) в безводном толуоле (5 мл) по каплям с помощью шприца добавляли 0,78 мл DIBAL-H (гидрид диизобутилалюминия) (1 М в толуоле). Реакционную смесь нагревали до 0 С, перемешивали в течение 3 часов, затем гасили путем разбавления водным NH4Cl. Смесь переносили в делительную воронку и экстрагировали этилацетатом. Органический слой сушили (Na2SO4), твердые вещества удаляли и оставшийся фильтрат концентрировали с получением масла, которое очищали с помощью препаративной ТСХ (элюирование этилацетатом) с получением 7 мг (11%) спиртов 20 а/20 б в виде желтого твердого вещества; МС т/г (МН+) 485,2; ВЭЖХ: 5,97 мин. Способ Д. цис- и транс-3-[4-(1-Бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-ил]циклобутил)пирролидин-1-ил-метанон (21 а,б). Этиловые эфиры 19 а/19 б (60 мг, 0,11 ммоль) растворяли в метаноле (5 мл) и кипятили с обратным холодильником в течение 1 ч до превращения этилового эфира в метиловый эфир. После удаления метанола остаток растворяли в пирролидине (5 мл) и нагревали с обратным холодильником в течение 20 ч. Удаление пирролидина дало маслянистый коричневый продукт, который очищали препаративной ТСХ(элюирование этилацетатом) с получением 22 мг (36%) амидов 21 а/21 б в виде воскообразного желтого твердого вещества: МС т/г (МН+) 552,2; ВЭЖХ: 6,447 мин. Способ Е. 4-[4-(1-Бензил-1 Н-индол-5-иламино)хиназолин-6-илэтинил]-1-метилпиперидин-4-ол (23). 1-Метил-4-(4-феноксихиназолин-6-илэтинил)пиперидин-4-ол (22). В 100-миллилитровую круглодонную колбу в атмосфере азота добавляли хиназолин 13 (1,32 г, 3,80 ммоль), 4-этинил-1-метилпиперидин-4-ол (1,06 г, 7,6 ммоль), Pd(OAc)2 (51 мг, 0,23 ммоль), PPh3 (120 мг,0,46 ммоль) и триэтиламин (18 мл). Колбу оснащали обратным холодильником, и смесь нагревали до 100 С в течение 16 ч. Темный раствор затем охлаждали, и триэтиламин удаляли при пониженном давлении. Полученный остаток разбавляли ЕtOАс (75 мл) и Н 2 О (25 мл) и переносили в делительную воронку. Органический слой промывали последовательно Н 2 О (2 х 25 мл), и объединенные водные промывочные жидкости снова экстрагировали ЕtOАс (25 мл). Объединенные органические слои сушили (MgSO4) и растворитель удаляли при пониженном давлении. Полученную черную пену очищали на силикагеле (50 г), элюируя 250 мл смеси СН 2 Сl2:МеОН в соотношении 30:1, затем 400 мл смеси CH2Cl2:MeOH:NEt3 в соотношении 30:1:1, с получением целевого продукта в виде желтой пены (930 мг, 68%). 1 Н ЯМР (CDCl3,400 МГц): : 8.71 (s, 1H), 8.36 (d, 1H, J = 1,9 Гц), 7.89 (d, 1H, J = 8,7 Гц), 7.80 (dd, 1H, J = 8,7 Гц, 1,9 Гц),7.45 (t, 2 Н, J = 8,3 Гц), 7.31 (m, 1 Н), 7.21 (m, 2 Н), 2.72 (br, 2H), 2.47 (br, 2H), 2.31 (s, 3 Н), 2.09 (m, 2 Н), 2.00(m, 2 Н). 4-[4-(1-Бензил-1 Н-индол-5-иламино)хиназолин-6-илэтинил 1-1-метилпиперидин-4-ол (23). В 1-миллилитровом сосуде Витона хиназолин 22 (80 мг, 0,22 ммоль) объединяли с 5-амино-1 бензилиндолом (54 мг, 0,24 ммоль), гидрохлоридом пиридиния (5 мг, 0,04 ммоль) и фенолом (104 мг,1,11 ммоль). Сосуд закрывали и нагревали при 100 С в течение 16 ч. После охлаждения содержимое сосуда Витона растворяли в минимальном количестве ЕtOАс и помещали на силикагелевую (5 г) колонку. Элюирование колонки смесью гексаны:EtOAc/NEt3 в соотношении 1:1:0,1 привело к удалению примесей с высоким Rf. Целевой продукт 23 (Rf 0,05, смесь СН 2 Сl2:МеОН в соотношении 10:1) элюировали смесью СН 2 Сl2:МеОН в соотношении 10:1 с получением желтого твердого вещества (65 мг, 60%). 1 Н ЯМР(br, 2H), 1.82 (br, 2H). МСНР: 488,2 (МН+); 126,1. Способ Ж. 3-[4-(1-Бензолсульфонил-1 Н-индол-5-иламино)хиназолин-6-ил]аллиловый эфир уксусной кислоты (27). Метиловый эфир 3-(4-феноксихиназолин-6-ил)-акриловой кислоты (24): В сосуд, предназначенный для работы под давлением, загружали хиназолин 13 (3,5 г, 10,0 ммоль), метилакрилат (6,0 г, 70,0 ммоль),Pd(OAc)2 (140 мг, 0,62 ммоль), PPh3 (320 мг, 1,22 ммоль), ДМФ (4 мл) и NEt3 (15 мл). Сосуд продували азотом, герметизировали и нагревали при 110 С при перемешивании в течение 3 ч. Смесь охлаждали,разбавляли ЕtOАс и переносили в делительную воронку, затем промывали Н 2 О и солевым раствором и сушили (MgSO4). После фильтрования фильтрат концентрировали при пониженном давлении с получением желтого твердого вещества, которое перекристаллизовывали (ЕtOАс) с получением эфира 24 в виде бледно-желтого твердого вещества (2,2 г, 72%). 1 Н ЯМР (CDCl3, 400 МГц):8.76 (s, 1H), 8.47 (s, 1 Н),8.08 (d, 1H), 8.06 (d, 1H), 7.87 (dd, J = 16 Гц, 1 Гц), 7.48 (t, 2H), 7.35 (t, 1H), 7.25 (m, 2H), 6.60 (d, J = 16 Гц,1 Гц), 3.83 (s, 3 Н). 3-(4-Феноксихиназолин-6-ил)проп-2-ен-1-ол (25). К раствору эфира 24 (1,35 г, 4,41 ммоль) в толуоле (60 мл) в атмосфере N2 при -78 С по каплям добавляли DIBAL-H (8,8 мл 1 М раствора в толуоле, 8,8 ммоль). Реакционную смесь затем нагревали до 0 С и перемешивали в течение 30 мин, затем гасили 30 мл насыщенным раствором сегнетовой соли, и эту смесь перемешивали в течение ночи. Бислой переносили в делительную воронку, и органический слой промывали Н 2 О и солевым раствором и сушили (MgSO4). После фильтрования органический слой концентрировали при пониженном давлении с получением желтого масла, которое очищали хроматографией на силикагеле, элюируя смесью гексаны:ЕtOАс в соотношении 1:1, затем ЕtOАс. Аллиловый спирт 25 (900 мг, 73%) выделяли в виде бледно-желтого масла. 1 Н ЯМР (CDCl3; 400 МГц) 8.72 (s, 1 Н),8.27 (s, 1 Н), 7.66 (m, 2 Н), 7.62 (m, 1 Н), 7.47 (m, 3 Н), 7.34 (m, 1 Н), 7.24 (m, 2 Н), 6.82 (dd, 1 Н), 6.56 (m, 1 Н),4.41 (dd, 1H). 3-(4-Феноксихиназолин-6-ил)аллиловый эфир уксусной кислоты (26): К спирту 25 (900 мг, 3,23 ммоль) и пиридину (0,8 мл, 10 ммоль) в сухом CH2Cl2 (15 мл) при 0 С добавляли ацетилхлорид (0,3 мл,4,2 ммоль). Полученную смесь перемешивали в течение 2 ч, разбавляли CH2Cl2 (10 мл) и 5% HCl (10 мл). Эту смесь переносили в делительную воронку, и органический слой промывали Н 2 О и солевым раствором. Органический слой сушили (Na2SO4), твердые вещества фильтровали, и растворитель удаляли в вакууме с получением целевого ацетата 26 в виде желтого воскообразного твердого вещества (1,04 г,100%). 1 Н ЯМР (CDCl3, 400 МГц): : 8.72 (s, 1H), 8.30 (d, 1 Н, J = 1,7 Гц), 7.98 (m, 2 Н), 7.49 (m, 2 Н), 7.30(m, 1 Н), 7.25 (m, 2 Н), 6.84 (d, 1 Н, J = 16,0 Гц), 6.46 (m, 1H),4.79 (dd, 2H, J = 6,2 Гц, 1,2 Гц), 2.11 (s, 3 Н). 3-[4-(1-Бензолсульфонил-1 Н-индол-5-иламино)-хиназолин-6-ил]-аллиловый эфир уксусной кислоты (27): Смесь эфира 26 (630 мг, 1,97 ммоль) и 5-амино-1-фенилсульфонилиндола в феноле (3,0 г) нагревали при 100 С в течение 20 ч. Избыток фенола удаляли путем перегонки, и полученное коричневое масло очищали хроматографией на силикагеле, элюируя смесью этилацетат:гексаны в соотношении 1:1, затем этилацетатом. Хиназолин 27 (430 мг, 43%) получили в виде не совсем белого воскообразного твердого вещества. 1 Н ЯМР (CDCl3; 400 МГц): : 8.61 (s, 1H), 7.92 (m, 3H), 7.82 (m, 4 Н), 7.51 (m, 2 Н), 7.43 (m,3 Н), 6.74 (d, 1H), 6.62 (d, 1H), 6.45 (dt, 1H), 4.74 (dd, 2H), 2.09 (s, 3 Н). Способ Ж'. Метиловый эфир 3-[4-(1-бензил-1 Н-индазол-5-иламино)хиназолин-6-ил]акриловой кислоты (28) и 3-[4-(4-феноксифениламино)хиназолин-6-ил]проп-2-ен-1-ол (29). Для превращения 4-феноксихиназолиновых промежуточных соединений 24 и 25 в их соответствующие 4-ариламинохиназолиновые производные 28 и 29 соответственно использовали методику, идентичную методике, которую использовали для превращения промежуточного соединения 26 в 27. Способ З. 6-[3-(6-Амино-3-азабицикло[3.1.0]гекс-3-ил)пропенил]хиназолин-4-ил-(1-бензолсульфонил-1 Н-индол-5-ил)амин (30). Смесь ацетата палладия (6 мг, 0,027 ммоль) и P(C6H4-мета-SO3Na)3 (30 мг, 0,053 ммоль) в воде (0,3 мл) перемешивали при комнатной температуре в течение 1 ч, после чего добавляли аллилацетат 16 (150 мг, 0,30 ммоль) и (1 а,5 а,6 а)-6-трет-бутилоксикарбониламино-3-азабицикло[3.1.0]гексан (полученный как изложено в Brighty, et. al. Synlett 1996, pp. 1097-1099) (71 мг, 0,36 ммоль) в CH3CN (3 мл). Полученную реакционную смесь перемешивали при 50 С в течение 1,5 ч, растворяли в этилацетате (10 мл) и промывали водным NH4Cl и водой. Отделенный органический слой сушили над Na2SO4 и концентрировали с получением коричневого масла. Очистка препаративной ТСХ (элюирование этилацетатом) дала 31 мг желтого твердого вещества. Полученный ВОС-защищенный продукт растворяли в метаноле (5 мл) и с него снимали защиту, пропуская газ HCl через раствор при перемешивании. После концентрирования и высушивания под высоким вакуумом был получен амин 30 в виде его гидрохлоридной соли (18 мг, 11%): МС m/z (МН+) 537,2; ВЭЖХ 4,423 мин. Способ И. Гидрохлорид 4-[4-(4-феноксифениламино)хиназолин-6-илэтинил]тетрагидропиран-4-ола(32). 4-(4-Хлорхиназолин-6-илэтинил)тетрагидропиран-4-ол (31). Смесь 4-этинил-4-гидрокситетрагидропирана (70 мг, 0,55 ммоль), 4-хлор-6-иодхиназолина (145 мг, 0,50 ммоль), хлорида бис(трифенилфосфин) палладия(II) (24 мг, 7 мол. %), иодида меди(I) (6,6 мг, 7 мол.%) и диизопропиламина (56 мг, 0,55 ммоль) в безводном ТГФ (5 мл) продували N2 и перемешивали в течение 2 ч в атмосфере N2. После разбавления этилацетатом (30 мл) эту смесь промывали водным NH4Cl, H2O и солевым раствором, сушили надNa2SO4 и концентрировали с получением продукта в виде желтого твердого вещества. Кристаллизация из смеси этилацетат/гексан дала 0,13 г (90%) рыжевато-коричневого твердого вещества. 1 Н ЯМР (CD3OD)- 21006107 в реакционном сосуде в течение 1 ч. Реакционную смесь охлаждали, разбавляли CH2Cl2, и продукт собирали путем фильтрования с получением 52 мг (73%) 32 в виде желтого твердого вещества: 1 Н ЯМР(t, J = 7,6 Гц, 2 Н), 7.69 (d, J = 6,8 Гц, 2 Н), 7.81 (d, J = 7,2 Гц, 1 Н), 8.07 (d, J = 7,2 Гц, 1 Н), 8.75 (s, 2H); ВЭЖХ: 6,36 мин. Способ К. (3-Метокси-4-феноксифенил)-(6-пиперидин-4-илэтинилхиназолин-4-ил)амин. трет-Бутиловый эфир 4-(4-хлорхиназолин-6-илэтинил)пиперидин-1-карбоновой кислоты. Смесь трет-бутилового эфира 4-этинилпиперидин-1-карбоновой кислоты (1,12 г, 5,35 ммоль), 4-хлор-6 иодхиназолина (1,35 г, 4,65 ммоль), дихлорбис(трифенилфосфин)палладия(II) (0,16 г, 0,23 ммоль), иодида меди(I) (0,044 г, 0,23 ммоль) и диизопропиламина (0,47 г, 4,65 ммоль) в безводном ТГФ (20 мл) перемешивали при комнатной температуре в атмосфере азота в течение 2 ч. После концентрирования остаток растворяли в CH2Cl2 (100 мл), промывали водным NH4Cl и солевым раствором, сушили над сульфатом натрия и концентрировали с получением сырого продукта в виде коричневого масла. Очистка на силикагелевой колонке с использованием 20% ЕtOАс в гексане дала 1,63 г (94%) вязкого желтого масла: 1 Н ЯМР (CDCl3) : 1.45 (s, 9H), 1.67-1.75 (m, 2H), 1.87-1.92 (m, 2H), 2.84 (m, 1H), 3.20-3.26 (m, 2H), 3.78 (br d,2H), 7.88 (dd, 1H), 7.97 (d, 1H), 8.26 (d, 1H), 9.00 (s, 1 Н).(131 мг, 0,304 ммоль) и гидрохлорида 3-метокси-4-феноксианилина (77 мг, 0,306 ммоль) в смеси третВuОН/СlCН 2 СН 2 Сl (1,0/1,0 мл) нагревали в плотно закрытом реакционном сосуде при 90 С в течение 30 мин. После охлаждения желтую смесь разбавляли МеОН и газ HCl пропускали через эту смесь в течение 10 мин. После перемешивания в течение 2 ч добавляли ЕtOАс для дополнительного осаждения твердого вещества, которое собирали путем фильтрования с вакуум-отсосом, промывали ЕtOАс, а затем сушили с получением 105 мг (66%) желтого твердого вещества: 1 Н ЯМР (CD3OD)1.93-2.02 (m, 2H), 2.18-2.24 (m,2H), 3.12-3.21 (m, 2H), 3.41-3.47 (m, 2H), 3.81 (s, 3 Н), 6.87 (d, 2H), 7.02 (t, 1H), 7.06 (d, 1H), 7.27 (t, 2H),7.33 (dd, 1H), 7.56 (d, 1H), 7.80 (d, 1 Н), 8.06 (d, 1 Н), 8.79 (s, 1 Н), 8.83 (s, 1 Н); МС м/z (МН+) 451,3. Способ Л. (3-Метил-4-феноксифенил)-[6-(1-пропилпиперидин-3-илэтинил)хиназолин-4-ил]амин.(3-Метил-4-феноксифенил)-(6-пиперидин-3-илэтинилхиназолин-4-ил)амин (114 мг, 0,2 ммоль) и пропиональдегид (116 мг, 2,0 ммоль) растворяли в МеОН/Н 2 О (5/0,5 мл) и рН доводили до 5 АсОН. Реакционную смесь перемешивали при комнатной температуре в течение ночи с последующим добавлением NaBH3CN (13 мг, 0,2 ммоль) в течение периода 1 ч. После перемешивания в течение еще одного часа реакционную смесь концентрировали, и остаток распределяли между CH2Cl2 (30 мл) и насыщеннымNa2CO3 (20 мл). Отделенный органический слой сушили над сульфатом натрия и концентрировали. Очистка препаративной ТСХ с использованием 10% МеОН в ЕtOАс дала продукт-свободное основание, который превращали в гидрохлоридную соль в виде желтого твердого вещества с выходом 42 мг (38%): 1 Н ЯМР (CD3OD) : 1.03 (t, 3 Н), 1.78-1.87 (m, 4H), 2.01-2.08 (m, 2H), 2.28 (s, 3 Н), 2.96 (t, 1H), 3.07-3.19 (m,3H), 3.31 (br, 1H), 3.59 (d, 1H), 3.80 (d, 1H), 6.94 (m, 3 Н), 7.09 (t, 1H), 7.34 (t, 2H), 7.53 (d, 1H), 7.63 (s, 1H),7.80 (d, 1H), 8.05 (dd, 1 Н), 8.73 (s, 1 Н), 8.75 (s, 1 Н); МС м/z (МН+) 477,1. Способ Л'. 6-[1-(2-Аминоэтил)пиперидин-3-илэтинил]хиназолин-4-ил-(3-метил-4-феноксифенил) амин. 6-[1-(2-Аминоэтил)пиперидин-3-илэтинил]хиназолин-4-ил)-(3-метил-4-феноксифенил)амин.(5/0,5 мл), и рН доводили до 5 АсОН. Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего добавляли NaBH3CN (13 мг, 0,2 ммоль) в течение периода 1 ч. После перемешивания в течение еще одного часа реакционную смесь концентрировали, и остаток распределяли междуCH2Cl2 (30 мл) и насыщенным Na2CO3 (20 мл). Отделенный органический слой сушили над сульфатом натрия и концентрировали. Очистка на силикагелевой колонке с использованием 5% МеОН в ЕtOАс дала свободное основание, которое растворяли в МеОН. Газ HCl пропускали через этот раствор в течение 5 мин, и продукт, с которого снята защита, осаждали в виде гидрохлоридной соли. Эту смесь разбавляли ЕtOАс, и твердое вещество собирали путем фильтрования с вакуум-отсосом, промывали ЕtOАс, а затем сушили с получением 83 мг (71%) желтого твердого вещества: 1 Н ЯМР (CD3OD) : 1.71-1.82 (br, 2H), 2.02.12 (br, 2H), 2.27 (s, 3H), 3.00 (t, 1H), 3.03-3.19 (br, 2H), 3.40 (br, 1H), 3.50 (s, 2H), 3.62 (br d, 1H), 3.70 (m,1H), 3.89 (br d, 1H), 6.93 (m, 3 Н), 7.08 (t, 1H), 7.33 (t, 2H), 7.52 (d, 1H), 7.64 (s, 1H), 7.79 (d, 1H), 8.05 (d,1H), 8.75 (s, 1 Н), 8.77 (s, 1 Н); МС m/z (MH+) 476,1. Способ М. 3-2-[4-(3-Метил-4-феноксифениламино)хиназолин-6-ил]этилпиперидин-3-ол. 3-2-[4-(3-Метил-4-феноксифениламино)хиназолин-6-ил]этилпиперидин-3-ол. Смесь дигидрохлорида 3-[4-(3-метил-4-феноксифениламино)хиназолин-6-илэтинил]пиперидин-3-ола (100 мг, 0,19 ммоль) иPd/C (10%, 6 мг) встряхивали в склянке Парра с водородом при 50 фунт/кв.дюйм (350 кПа) в течение ночи и фильтровали через слой целита. Фильтрат концентрировали до небольшого объема и по каплям- 22006107 добавляли в ЕtOАс при перемешивании. Твердое вещество собирали путем фильтрования с вакуумотсосом, промывали ЕtOАс, а затем сушили с получением 89 мг (89%) желтого твердого вещества: 1 Н ЯМР (CD3OD)1.69 (dt, 1H), 1.81 (br d, 1H), 1.95 (t, 3 Н), 2.15 (m, 1H), 2.28 (t, 3 Н), 2.93 (t, 1H), 3.02 (m,3 Н), 3.18 (d, 1H), 3.31 (br, 1 Н), 6.94 (m, 3 Н), 7.08 (t, 1H), 7.34 (t, 2H), 7.55 (d, 1H), 7.66 (d, 1H), 7.78 (d, 1H),8.02 (d, 1H), 8.58 (s, 1H), 8.73 (s, 1H); МС m/z (MH+) 455,2. Способ Н. N-3-[4-(3-Метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил-2-морфолин-4 илацетам. 2-Хлор-N-[3-(4-хлорхиназолин-6-ил)проп-2-инил]ацетамид. 2-Хлор-N-пpoп-2-инилацетамид (385 мг, 2,93 ммоль) и 4-хлор-6-иодхиназолин (850 мг; 1 экв.) растворяли в сухом ТГФ и диизопропиламине(296 мг; 0,41 мл; 1 экв.). К этой смеси добавляли 0,04 эквивалента иодида меди (22 мг) и Pd(PPh3)2Cl2 (82 мг). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи(20 ч). Растворитель затем удаляли в вакууме, и остаток растворяли в СН 2 Сl2. Этот раствор переносили в делительную воронку и промывали 1 х насыщенный NH4Cl, солевой раствор, сушили над Na2SO4, и растворитель удаляли в вакууме. Продукт очищали хроматографией на силикагеле, элюируя смесью гексан/ЕtOАс в соотношении 1:1 и собирая фракции с Rf = 0,25. Это привело к получению 2-хлор-N-[3-(4 хлорхиназолин-6-ил)проп-2-инил]ацетамида в виде не совсем белого твердого вещества (454 мг; 53%): 1 Н ЯМР (400 МГц; CDCl3)4.12 (2 Н, s), 4.40 (2 Н, d, J = 5,2 Гц), 7.91-7.93 (1 Н, dd, J = 2; 6,8 Гц), 8.00 (1 Н,d, J = 8,4 Гц), 8.34 (1 Н, d, J = 1,6 Гц), 9.03 (1 Н, s), MCHP (М+) 294,0; 296,0; 298,1. 2-Хлор-N-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инилацетамид. Раствор 2 хлор-N-[3-(4-хлорхиназолин-6-ил)проп-2-инил]ацетамида (50 мг; 0,17 ммоль) и 3-метил-4-феноксианилина (36 мг; 0,9 экв.) в 1,2-дихлорэтане (1 мл) и трет-бутаноле (1 мл) нагревали при 87 С в течение 30 мин. Эту смесь затем охлаждали до комнатной температуры и разбавляли этилацетатом для дополнительного облегчения осаждения. Раствор затем фильтровали с получением продукта взаимодействия в виде желтого порошка (73 мг; 90%). 2.28 (3 Н, s), 4.10 (2 Н, s), 4.30 (2 Н, s), 6.93 (3 Н, d), 7.09 (1 Н, t), 7.34N-3-[4-(3-Метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил-2-морфолин-4-илацетамид. К раствору 2-хлор-N-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]-проп-2-инилацетамида (63 мг, 0,12 ммоль) в толуоле (10 мл) добавляли 3 эквивалента морфолина (31 мг), и эту смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры, соли морфолина отфильтровывали, а растворитель удаляли из фильтрата. Остаток повторно растворяли в CH2Cl2 с небольшим количеством метанола, и газ HCl барботировали через раствор в течение 2-3 минут. Раствор затем концентрировали до 2-3 мл, разбавляли этилацетатом и фильтровали с получением N-3-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]проп-2-инил-2-морфолин-4-илацетамида в виде желтого/коричневого твердого вещества (65 мг; 94%): 1 Н ЯМР (400 МГц; CD3OD)2.27 (3 Н, s),3.21 (2 Н, m), 3.56 (2 Н, m), 3.87 (2 Н, m), 4.04 (2 Н, m), 4.09 (2 Н, s), 4.36 (2 Н, s), 6.93 (3 Н, d, J = 8,4), 7.09(1 Н, t, J = 7,4 Гц), 7.34 (2 Н, t, J = 8 Гц), 7.54 (1 Н, dd), 7.65 (1 Н, s), 7.82 (1 Н, d, J = 8,8 Гц), 8.06 (1 Н, d, J = 8,4 Гц), 8.76 (1 Н, s), 8.80 (1 Н, s). MCHP (M+): 508,0; (M-): 506,0. Способ О. (3-Метил-4-феноксифенил)-(6-пиперидин-4-илэтинилпиридо[3,4-d]пиримидин-4-ил) амин. 4,6-Дихлорпиридо[3,4-d]пиримидин: ДМФ (0,1 мл) добавили к 6-хлор-3 Н-пиридо[3,4-d]пиримидин 4-ону (1,82 г, 10 ммоль), после чего добавляля по каплям тионилхлорид (10 мл). На колбе устанавливали конденсатор и осушающую трубку, и содержимое нагревали до температуры дефлегмации в течение 20 минут. При этом твердые вещества растворялись. Нагревание продолжали в течение еще 1 ч, а затем охлаждали. Для промывки стенок колбы добавляли толуол, и растворители выпаривали в вакууме. Азеотропную перегонку с толуолом повторяли дважды, и полученный таким образом неочищенный продукт переносили на следующую стадию.(6-Хлорпиридо[3,4-d]пиримидин-4-ил)-(3-метил-4-феноксифенил)амин. 4,6-Дихлорпиридо[3,4-d]пиримидин, полученный на предыдущей стадии, растворяли в диоксане (50 мл), добавляли гидрохлорид 3-метил-4-феноксианилина (2,8 г, 12 ммоль) и содержимое нагревали до наружной температуры бани 80 С в течение 3 ч, при этом происходило выпадение желтого осадка. Добавляли дополнительное количество диоксана (20 мл) и содержимое нагревали при 75 С в течение 12 ч. Раствор затем фильтровали, и желтое твердое вещество помещали под вакуум до получения целевого гидрохлорида (6-хлорпиридо[3,4-d]пиримидин-4-ил)-(3-метил-4-феноксифенил)амина (3,6 г, -100%). 1 Н ЯМР (CD3OD; 400 МГц)9.05 (s, 1H), 8.87 (s, 1 Н), 8.64 (s, 1 Н), 7.69 (d, J = 2,5 Гц, 1 Н), 7.58 (dd, J = 8,7;2,5 Гц, 1 Н), 7.35 (dd, J = 8,7; 7,5 Гц, 2 Н), 7.10 (t, J = 7,2 Гц, 1 Н), 6.94 (d, J = 8,7 Гц, 3 Н), 2.29 (s, 3 Н). МС m/z (MH+): 363,2.(3-Метил-4-феноксифенил)-(6-пиперидин-4-илэтинилпиридо[3,4-d]пиримидин-4-ил)амин. В высушенную в пламени колбу грушевидной формы загружали гидрохлорид (6-хлорпиридо[3,4d]пиримидин-4-ил)-(3-метил-4-феноксифенил)амина (200 мг, 0,5 ммоль), трет-бутиловый эфир 4-этинил- 23006107 пиперидин-1-карбоновой кислоты (314 мг, 1,5 ммоль), Pd(PhCN)2Cl2 (19 мг, 0,05 ммоль), 1,4-бис(дифенилфосфин)бутан (32 мг, 0,075 ммоль) и CuI (4,8 мг, 0,025 ммоль). Добавляли диоксан (5 мл), и к этой перемешанной суспензии в атмосфере аргона (Аr) добавляли диизопропиламин (0,32 мл, 2,28 ммоль),при этом большая часть твердого вещества растворялась. Колбу (оснащенную конденсатором) затем помещали в предварительно нагретую масляную баню и нагревали при температуре бани 104 С в течение 14 ч, при этом ЖХ/МС (жидкостная хроматография/масс-спектрометирия) показала исчезновение исходного материала. Реакционную смесь затем фильтровали через набивку из силикагеля, концентрировали и хроматографировали, используя градиентное элюирование смесью 20-80% ЕtOАс-гексаны, с получением целевого продукта взаимодействия в виде твердого вещества (165 мг, 62%). Это твердое вещество растворяли в СН 2 Сl2 (и небольшом количестве МеОН для облегчения растворения), HCl (газ) барботировали через раствор, после чего добавляли эфир, при этом осаждалось твердое вещество, которое фильтровали и помещали под вакуум до получения целевого (3-метил-4-феноксифенил)-(6-пиперидин-4-илэтинилпиридо[3,4-d]пиримидин-4-ил)-амина в виде дигидрохлоридной соли. 1 Н ЯМР (CDCl3; 400 МГц)9.12(s, 1H), 8.85 (s, 1H), 8.68 (s, 1 Н), 7.70 (d, J = 2,5 Гц, 1 Н), 7.58 (dd, J = 8,7; 2,5 Гц, 1 Н), 7.34 (dd, J = 8,3; 7,5 Гц, 2 Н), 7.10 (видимый t, J = 7,2 Гц, 1 Н), 6.94 (d, J = 8,7 Гц, 3 Н), 3.42 (m, 2H), 3.19 (m, 3 Н), 2.29 (s, 3 Н),2.22 (m, 2 Н), 2.0 (m, 2 Н). МС m/z (MH+): 436,3. Способ П. 4-Амино-4-метил-1-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]-пент-1-ин-3-ол. 5-(4-Хлорхиназолин-6-илэтинил)-4,4-диметилоксазолидин-2-он. Смесь 4,4-диметил-5-этинил-2-оксазолидинона (1,10 г, 7,90 ммоль), 4-хлор-6-иодхиназолина (1,63 г,5,60 ммоль), дихлорбис(трифенилфосфин)палладия (II) (200 мг, 0,28 ммоль), иодида меди (53 мг, 0,28 ммоль) и диизопропиламина (0,57 г, 5,60 ммоль) в безводном ТГФ (30 мл) перемешивали при комнатной температуре в атмосфере азота в течение 4 ч. После концентрирования остаток растворяли в CH2Cl2 (80 мл), промывали водным NH4Cl и солевым раствором, сушили над сульфатом натрия и концентрировали с получением неочищенного продукта в виде коричневого масла. Очистка на колонке с силикагелем с использованием 50-70% ЕtOАс в гексане дала 1,22 г (72%) желтого твердого вещества: 1 Н ЯМР (CDCl3)1.49 (s, 3 Н), 1.53 (s, 3 Н), 5.14 (s, 1 Н), 5.57 (br s, 1H), 7.95 (dd, 1H), 8.04 (d, 1H, J = 8,8 Гц), 8.38 (d, 1H, J = 2,0 Гц), 9.05 (s, 1H). 4-Амино-4-метил-1-[4-(3-метил-4-феноксифениламино)хиназолин-6-ил]-пент-1-ин-3-ол. Раствор 5-(4-хлорхиназолин-6-илэтинил)-4,4-диметилоксазолидин-2-она (151 мг, 0,5 ммоль) и гидрохлорида 3-метил-4-феноксианилина (130 мг, 0,55 ммоль) в смеси трет-BuOH/ClCH2CH2Cl (1:1, 2,0 мл) нагревали в плотно закрытом реакционном сосуде при 90 С в течение 30 мин. После охлаждения желтую смесь разбавляли ЕtOАс для дополнительного осаждения твердого вещества, которое собирали путем фильтрования с вакуум-отсосом, промывали ЕtOАс, а затем сушили с получением 215 мг (86%) желтого твердого вещества. Этот материал (215 мг, 0,43 ммоль) сразу объединяли с KОН (0,51 г, 9,0 ммоль) в МеОН/Н 2 О (9/3 мл) и кипятили с обратным холодильником в течение 20 ч. После охлаждения реакционную смесь нейтрализовали 0,60 г (10,0 ммоль) АсОН и концентрировали. Остаток суспендировали вCH2Cl2 и очищали на колонке с силикагелем, используя 20% МеОН в CH2Cl2. Очищенное свободное основание превращали в HCl соль с получением 46 мг (22%) желтого твердого вещества: 1 Н ЯМР (CD3OD)1.49 (s, 3 Н), 1.52 (s, 3 Н), 2.28 (s, 3 Н), 4.64 (s, 1H), 6.93 (m, 3 Н), 7.09 (t, 1H), 7.34 (m, 2H), 7.55 (dd, 1H),7.65 (d, 1H), 7.83 (d, 1H), 8.13 (dd, 1 Н), 8.77 (s, 1H), 8.87 (s, 1H); МС m/z (MH+) 439,2. Приведенные ниже соединения были получены с использованием способов, описанных выше. В таблице, приведенной ниже, термин мин означает "минуты". Номера примеров в следующей ниже таблице не соответствуют номерам соединений, на которые ссылаются в предыдущем экспериментальном разделе.
МПК / Метки
МПК: C07D 239/94, A61P 35/00, A61K 31/517
Метки: противораковых, производные, замещенные, качестве, бициклические, агентов
Код ссылки
<a href="https://eas.patents.su/30-6107-zameshhennye-biciklicheskie-proizvodnye-v-kachestve-protivorakovyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные бициклические производные в качестве противораковых агентов</a>
Предыдущий патент: Способ стабильной непрерывной выработки этанола
Следующий патент: Способы стимуляции и ингибирования роста в-клеток, продуцирования иммуноглобулинов и коррекции нарушений, связанных с baff-лигандом, у животного
Случайный патент: Способ приготовления мяса говядины












