Производные тиенопиримидина и тиенопиридина, полезные в качестве противораковых агентов
Формула / Реферат
1. Соединение формулы 1 или 2
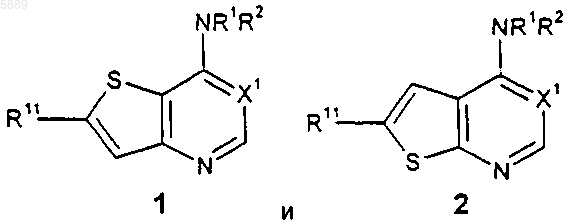
или его фармацевтически приемлемая соль или гидрат,
где X1 представляет собой CH;
R1 представляет собой H, C1-C6алкил или -C(O)(C1-C6алкил);
R2 представляет собой C6-C10арил или 5-13-членный гетероцикл, причем указанные группы R2 возможно замещены заместителями R5 в количестве от 1 до 5;
каждый R5 независимо выбран из галогено, циано, нитро, трифторметокси, трифторметила, азидо, -C(O)R8, -C(O)OR8, -OC(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -OR9, -SO2NR6R7, C1-C6алкила, -(CH2)jO-(CH2)qNR6R7, -(CH2)tO(CH2)qOR9, -(CH2)tOR9, -S(O)j(C1-C6алкил), -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -C(O)(CH2)t(C6-C10арил), -(CH2)tO(CH2)j(C6-C10арил), -(CH2)tO(CH2)q(5-10-членный гетероцикл), -C(O)(CH2)t(5-10-членный гетероцикл), -(CH2)jNR7(CH2)qNR6R7, -(CH2)jNR7CH2C(O)NR6R7, -(CH2)jNR7(CH2)qNR9C(O)R8, -(CH2)jNR7(CH2)tO(CH2)qOR9, -(CH2)jNR7(CH2)qS(O)j(C1-C6алкил), -(CH2)jNR7(CH2)tR6, -SO2(CH2)t(C6-C10арил) и -SO2(CH2)t(5-10-членный гетероцикл), где j равно целому числу в пределах от 0 до 2, t равно целому числу в пределах от 0 до 6, q равно целому числу в пределах от 2 до 6, группировки -(CH2)q- и -(CH2)t- вышеупомянутых групп R5 возможно заключают в себе двойную или тройную углерод-углеродную связь, если t равно целому числу между 2 и 6, и алкильные, арильные и гетероциклические группировки вышеупомянутых групп R5 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -OC(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -(CH2)tNR6R7, C1-C6алкила, -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, а q равно целому числу в пределах от 2 до 6;
каждый R6 и R7 независимо выбран из H, C1-C6алкила, -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, а q равно целому числу в пределах от 2 до 6, и алкильные, арильные и гетероциклические группировки вышеупомянутых групп R6 и R7 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -CO(O)R8, -OC(O)OR8, -NR9C(O)R10, -C(O)NR9R10, -NR9R10, C1-C6алкила, -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, а q равно целому числу в пределах от 2 до 6, при условии, что если R6 и R7 оба присоединены к одному и тому же атому азота, то R6 и R7 оба не связаны с этим атомом азота непосредственно через кислород;
каждый R8 независимо выбран из H, C1-C10алкила, -(CH2)t(C6-C10арил) и -(CH2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6;
каждый R9 и R10 независимо выбран из H и C1-C6алкила и
R11 представляет собой H, C1-C6алкил, -C(O)NR6R9, -C(O)(C6-C10арил), -(CH2)t(C6-C10арил) или -(CH2(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6, причем указанные группы R11, иные чем H, возможно замещены группами R5 в количестве от 1 до 5.
2. Соединение по п.1, где указанное соединение представляет собой соединение формулы 1, в которой R11 представляет собой -(CH2)t(C6-C10арил) или -(CH2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6, причем указанные группы R11 возможно замещены группами R5 в количестве от 1 до 5.
3. Соединение по п.2, где R11 представляет собой фенил или пиридил, причем указанные фенил и пиридил возможно замещены группами R5 в количестве от 1 до 5.
4. Соединение по п.1, где указанное соединение представляет собой соединение формулы 1, в которой R2 представляет собой фенил, возможно замещенный заместителями R5 в количестве от 1 до 5.
5. Соединение по п.1, где указанное соединение представляет собой соединение формулы 1, в которой R2 представляет собой группу формулы
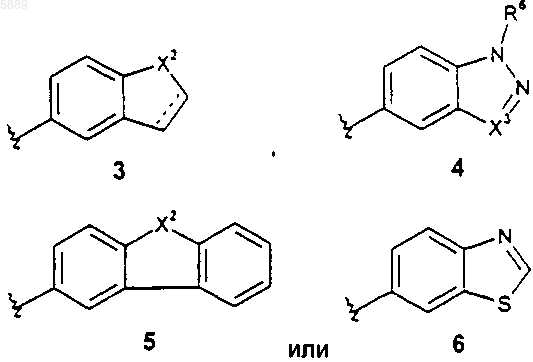
где X2 представляет собой -S- или -N(R6)-, X3 представляет собой N или CH, пунктирная линия в формуле 3 означает возможную двойную связь, и вышеуказанные группы R2 формул 3 и 5 возможно замещены заместителями R5 в количестве от 1 до 5, а группы R2 формул 4 и 6 возможно замещены заместителями R5 в количестве от 1 до 3.
6. Соединение по п.5, где R2 представляет собой группу вышеуказанной формулы 3, причем указанная группа возможно замещена заместителями R5 в количестве от 1 до 5.
7. Соединение по п.1, выбранное из группы, состоящей из
(2-бромтиено[3,2-b]пиридин-7-ил)-(1H-индол-5-ил)амина,
[2-(4-фторфенил)тиено[3,2-b]пиридин-7-ил]-(1H-индол-5-ил)амина,
(1H-индол-5-ил)-(2-тиофен-2-ил-тиено[3,2-b]пиридин-7-ил)амина,
4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензальдегида,
(1H-индол-5-ил)-[2-(4-метилсульфанилфенил)тиено[3,2-b]пиридин-7-ил]амина,
(1H-индол-5-ил)тиено[3,2-b]пиридин-7-ил-амина,
2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]фенокси}этанола,
[2-(4-диметиламинофенил)тиено[3,2-b]пиридин-7-ил]-(1H-индол-5-ил)амина,
метилового эфира 4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензойной кислоты,
(1H-индол-5-ил)-(2-тиофен-3-ил-тиено[3,2-b]пиридин-7-ил)амина,
(1H-индол-5-ил)-(2-{4-[(2-метоксиэтиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)амина,
фуран-2-ил-(4-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пиперазин-1-ил)метанона,
4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]фенола,
2-(2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}этокси)этанола,
2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}этанола,
N-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}-N',N'-диметилгексан-1,6-диамина,
2-({4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}метиламино)этанола,
(1H-индол-5-ил)-(2-{4-[(2-пиперазин-1-ил-этиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)амина,
(2-{4-[(3-имидазол-1-ил-пропиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)-(1H-индол-5-ил)амина,
(2-(2-гидроксиэтил)-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}амино)этанола,
[2-(4-диметиламинометилфенил)тиено[3,2-b]пиридин-7-ил]-(1H-индол-5-ил)амина,
N-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}-N',N'-диметилэтан-1,2-диамина,
(1-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пирролидин-2-ил)метанола,
2-(4-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пиперазин-1-ил)этанола,
(1H-индол-5-ил)-{2-[4-(2-морфолин-4-илэтокси)фенил]тиено[3,2-b]пиридин-7-ил}амина,
амида 1-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пиперидин-4-карбоновой кислоты,
{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]фенил}метанола,
2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}бутан-1-ола,
N-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}-N'-метилэтан-1,2-диамина,
(1H-индол-5-ил)-[2-(4-морфолин-4-илметилфенил)тиено[3,2-b]пиридин-7-ил]амина,
3-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-1-ола,
1-(3-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропил)пирролидин-2-она,
(1H-индол-5-ил)-{2-[4-(2-метоксиэтокси)фенил]тиено[3,2-b]пиридин-7-ил}амина,
2-(2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}этиламино)этанола,
3-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}-2,2-диметилпропан-1-ола,
3-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-1,2-диола,
[2-(4-{[2-(1H-имидазол-4-ил)этиламино]метил}фенил)тиено[3,2-b]пиридин-7-ил]-(1H-индол-5-ил)амина,
N-(2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}этил)ацетамида,
2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}ацетамида,
2-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-1,3-диола,
N-(4-метоксифенил)-N'-[2-(3-нитрофенил)тиено[3,2-b]пиридин-7-ил]бензол-1,4-диамина,
(7-метокси-1H-индол-5-ил)-(2-фенилтиено[3,2-b]пиридин-7-ил)амина,
(1H-индол-5-ил)-[2-(4-метиламинометилфенил)тиено[3,2-b]пиридин-7-ил]амина,
N-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}этан-1,2-диамина,
метилового эфира {4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}уксусной кислоты,
N-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}-N',N'-диметилпропан-1,3-диамина,
(1H-индол-5-ил)-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-ил)амина,
(1H-индол-5-ил)-(2-{4-[(2-морфолин-4-ил-этиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)амина,
(1H-индол-5-ил)-{2-[4-(пирролидин-3-иламинометил)фенил]тиено[3,2-b]пиридин-7-ил}амина,
1-(4-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пиперазин-1-ил)этанона,
амида 1-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пирролидин-2-карбоновой кислоты,
N-(4-метоксифенил)-N'-[2-(6-метоксипиридин-3-ил)тиено[3,2-b]пиридин-7-ил]бензол-1,4-диамина,
(1H-индол-5-ил)-(2-пиридин-3-ил-тиено[3,2-b]пиридин-7-ил)амина,
4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]-бут-3-ин-1-ола,
N-(4-метоксифенил)-N'-(2-тиофен-2-ил-тиено[3,2-b]пиридин-7-ил)бензол-1,4-диамина,
N-(2-гидроксиэтил)-4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензамида,
N-(3-имидазол-1-ил-пропил)-4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензамида,
3-[4-(4-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}бутил)пиперазин-1-ил]пропан-1-ола,
(1H-индол-5-ил)-[2-(4-{[4-(4-метилпиперазин-1-ил)бутиламино]метил}фенил)тиено[3,2-b]пиридин-7-ил]амина,
2-[4-(4-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}бутил)пиперазин-1-ил]этанола,
1-имидазол-1-ил-3-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-2-ола,
5-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пентан-1-ола,
2-[2-(4-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пиперазин-1-ил)этокси]этанола,
(1H-индол-5-ил)-(2-{4-[(2-метилсульфанилэтиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)амина,
2-[(2-гидроксиэтил)-(3-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропил)амино]этанола,
N-(2-аминоэтил)-N'-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}этан-1,2-диамина,
2-(3-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропиламино)этанола,
N-{4-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}гексан-1,6-диамина,
(2-метил-1H-индол-5-ил)-[2-(4-морфолин-4-илметилфенил)тиено[3,2-b]пиридин-7-ил]амина,
2-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}этанола,
(1H-индол-5-ил)-[2-(6-метоксипиридин-3-ил)тиено[3,2-b]пиридин-7-ил]амина,
{5-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]пиридин-2-ил}метанола,
N,N-диметил-N'-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пропан-1,3-диамина,
2-[(2-гидроксиэтил)-(3-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропил)амино]этанола,
2-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-1,3-диола,
3-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-1,2-диола,
1-(3-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропил)пирролидин-2-она,
N-(2-аминоэтил)-N'-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}этан-1,2-диамина,
2-(2-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}этиламино)этанола,
3-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-1-ола,
амида 1-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пиперидин-4-карбоновой кислоты,
2-(2-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}этокси)этанола,
2-(метил-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}амино)этанола,
N-метил-N'-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}этан-1,2-диамина,
(1H-индол-5-ил)-[2-(3-нитрофенил)тиено[3,2-b]пиридин-7-ил]амина,
N-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}этан-1,2-диамина,
(2-метил-1H-индол-5-ил)-(2-{4-[(2-пиперазин-1-ил-этиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)амина,
N,N-диметил-N'-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}этан-1,2-диамина,
2-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}бутан-1-ола,
(2-метил-1H-индол-5-ил)-(2-{4-[(2-морфолин-4-ил-этиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)амина,
(2-метил-1H-индол-5-ил)-{2-[4-(пирролидин-3-иламинометил)фенил]тиено[3,2-b]пиридин-7-ил}амина,
{6-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]пиридин-3-ил}метанола,
{6-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]пиридин-3-ил}метанола,
3-[4-(4-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}бутил)пиперазин-1-ил]пропан-1-ола,
2-[4-(4-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}бутил)пиперазин-1-ил]-этанола,
(2-{4-[(3-имидазол-1-ил-пропиламино)метил]фенил}тиеню[3,2-b]пиридин-7-ил)-(2-метил-1H-индол-5-ил)амина,
1-имидазол-1-ил-3-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}пропан-2-ола,
2-[(2-гидроксиэтил)-(4-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензиламино}бутил)амино]этанола,
N,N-диэтил-N'-{4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензил}пропан-1,3-диамина,
[2-(3-аминофенил)тиено[3,2-b]пиридин-7-ил]-(1H-индол-5-ил)амина,
(2-метил-1H-индол-5-ил)-(2-{4-[(3-морфолин-4-ил-пропиламино)метил]фенил}тиено[3,2-b]пиридин-7-ил)амина,
[2-(4-диметиламинометилфенил)тиено[3,2-b]пиридин-7-ил]-(2-метил-1H-индол-5-ил)амина,
1-[5-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-иламино)-2,3-дигидроиндол-1-ил]этанона,
(2,3-дигидро-1H-индол-5-ил)-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-ил)амина,
(1H-бензотриазол-5-ил)-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-ил)амина,
5-(2-фенилтиено[3,2-b]пиридин-7-иламино)-1H-индол-3-карбальдегида,
(1H-индазол-5-ил)-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-ил)амина,
(2-метил-1H-индол-5-ил)-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-ил)амина,
(1H-бензимидазол-5-ил)-(2-фенилтиено[3,2-b]пиридин-7-ил)амина,
диметиламида 5-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-иламино)-1H-индол-2-карбоновой кислоты,
{5-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]пиридин-2-ил}метанола,
N-(3-имидазол-1-ил-пропил)-6-[7-(1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]никотинамида,
N-(3-гидроксипропил)-6-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]никотинамида,
[2-(5-аминопиридин-2-ил)тиено[3,2-b]пиридин-7-ил]-(2-метил-1H-индол-5-ил)амина,
N-[2-(2-гидроксиэтокси)этил]-6-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]никотинамида,
[2-(3-метил-3H-имидазол-4-ил)тиено[3,2-b]пиридин-7-ил]-(2-метил-1H-индол-5-ил)амина,
2-{1-метил-5-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]-1H-имидазол-2-ил}пропан-2-ола,
[2-(1-метил-1H-имидазол-2-ил)тиено[3,2-b]пиридин-7-ил]-(2-метил-1H-индол-5-ил)амина,
(2-метил-1H-индол-5-ил)-(2-тиазол-2-ил-тиено[3,2-b]пиридин-7-ил)амина,
2-{2-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]тиазол-5-ил}пропан-2-ола,
4-[7-(2-метил-1H-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]бензальдегида и
их фармацевтически приемлемых солей и гидратов.
8. Соединение формулы 25 или 26
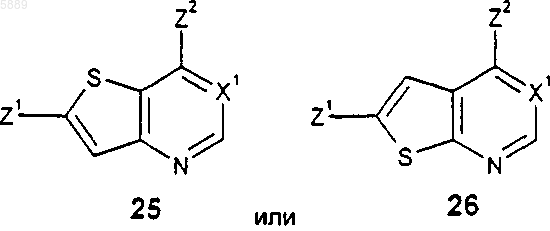
или его фармацевтически приемлемая соль или гидрат, где X1 представляет собой CH; Z1 представляет собой галогено и Z2 представляет собой -NR1R2; либо Z1 представляет собой R11, а Z2 представляет собой галогено; либо Z1 и Z2, каждый независимо, представляет собой галогено;
R1 представляет собой H, C1-C6алкил или -C(O)(C1-C6алкил);
R2 представляет собой C6-C10арил или 5-13-членный гетероцикл, причем указанные группы R2 возможно замещены заместителями R5 в количестве от 1 до 5;
каждый R5 независимо выбран из галогено, циано, нитро, трифторметокси, трифторметила, азидо, -C(O)R8, -C(O)OR8, -OC(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -OR9, -SO2NR6R7, C1-C6алкила, -(CH2)jO(CH2)qNR6R7, -(CH2)tO(CH2)qOR9, -(CH2)tOR9, -S(O)j(C1-C6алкил), -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -C(O)(CH2)t(C6-C10арил), -(CH2)tO(CH2)j(C6-C10арил), -(CH2)tO(CH2)q(5-10-членный гетероцикл), -C(O)(CH2)t(5-10-членный гетероцикл), -(CH2)jNR7(CH2)qNR6R7, -(CH2)jNR7CH2C(O)NR6R7, -(CH2)jNR7(CH2)qNR9C(O)R8, -(CH2)jNR7(CH2)tO(CH2)qOR9, -(CH2)jNR7(CH2)qS(O)j(C1-C6алкил), -(CH2)jNR7(CH2)tR6, -SO2(CH2)t(C6-C10арил) и -SO2(CH2)t(5-10-членный гетероцикл), где j равно целому числу в пределах от 0 до 2, t равно целому числу в пределах от 0 до 6, q равно целому числу в пределах от 2 до 6, группировки -(CH2)q- и -(CH2)t- вышеупомянутых групп R5 возможно заключают в себе двойную или тройную углерод-углеродную связь, если t равно целому числу между 2 и 6, а алкильные, арильные и гетероциклические группировки вышеупомянутых групп R5 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -OC(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -(CH2)tNR6R7, C1-C6алкила, -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, а q равно целому числу в пределах от 2 до 6;
каждый R6 и R7 независимо выбран из H, C1-C6алкила, -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, а q равно целому числу в пределах от 2 до 6, и алкильные, арильные и гетероциклические группировки вышеупомянутых групп R6 и R7 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -CO(O)R8, -OC(O)OR8, -NR9C(O)R10, -C(O)NR9R10, -NR9R10, C1-C6алкила, -(CH2)t(C6-C10арил), -(CH2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, а q равно целому числу в пределах от 2 до 6, при условии, что если R6 и R7 оба присоединены к одному и тому же атому азота, то R6 и R7 оба не связаны с этим атомом азота непосредственно через кислород;
каждый R8 независимо выбран из H, C1-C10алкила, -(CH2)t(C6-C10арил) и -(CH2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6;
каждый R9 и R10 независимо выбран из H и C1-C6алкила; и R11 представляет собой H, C1-C6алкил, -C(O)NR6R9, -C(O)(C6-C10ариы), -(CH2)t(C6-C10арил) или -(CH2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6, причем указанные группы R11, иные чем H, возможно замещены трет-бутилдиметилсиланилом и группами R5 в количестве от 1 до 3.
9. Фармацевтическая композиция для лечения гиперпролиферативного расстройства у млекопитающего, которая содержит (а) терапевтически эффективное количество соединения по пп.1-8, или его фармацевтически приемлемой соли, или гидрата и (б) фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п.9, где указанное гиперпролиферативное расстройство представляет собой рак.
11. Фармацевтическая композиция по п.10, где указанный рак является раком мозга, лёгкого, почки, ренальным раком, раком яичника, плоскоклеточным раком, раком мочевого пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, пищевода, гинекологическим раком, раком простаты, толстой кишки или щитовидной железы.
12. Фармацевтическая композиция по п.9, где указанное гиперпролиферативное расстройство является нераковым.
13. Фармацевтическая композиция по п.12, где указанное расстройство представляет собой доброкачественную гиперплазию кожи или простаты.
14. Фармацевтическая композиция для лечения гиперпролиферативного расстройства у млекопитающего, которая содержит (а) терапевтически эффективное количество соединения по пп.1-8, или его фармацевтически приемлемой соли, или гидрата в комбинации с (б) противоопухолевым агентом, выбранным из группы, состоящей из митотических ингибиторов, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ферментов, ингибиторов топоизомеразы, модификаторов биологической реакции, антигормонов и антиандрогенов, и фармацевтически приемлемый носитель.
15. Фармацевтическая композиция для лечения панкреатита или заболевания почек у млекопитающего, которая содержит (а) терапевтически эффективное количество соединения по пп.1-8, или его фармацевтически приемлемой соли, или гидрата и (б) фармацевтически приемлемый носитель.
16. Фармацевтическая композиция против имплантации бластоцита у млекопитающего, которая содержит (а) терапевтически эффективное количество соединения по пп.1-8, или его фармацевтически приемлемой соли, или гидрата и (б) фармацевтически приемлемый носитель.
17. Фармацевтическая композиция для лечения заболевания, связанного с васкулогенезом или ангиогенезом, у млекопитающего, которая содержит (а) терапевтически эффективное количество соединения по пп.1-8, или его фармацевтически приемлемой соли, или гидрата и (б) фармацевтически приемлемый носитель.
18. Фармацевтическая композиция по п.17, где указанное заболевание выбрано из группы, состоящей из опухоли ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, заболеваний кожи, таких как псориаз, экзема и склеродерма, диабетов, диабетической ретинопатии, ретролетальной фиброплазии, возрастной дегенерации желтого пятна, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичника, молочной железы, легкого, поджелудочной железы, простаты, толстой кишки и эпидермоидного рака.
19. Применение соединения по п.1 для лечения гиперпролиферативного расстройства у млекопитающего.
20. Применение по п.19, где указанное гиперпролиферативное расстройство является раком.
21. Применение по п.20, где указанный рак является раком мозга, лёгкого, плоскоклеточным раком, ренальным раком, раком почки, яичника, мочевого пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, пищевода, простаты, колоректальным раком, гинекологическим раком или раком щитовидной железы.
22. Применение по п.20, где указанное гиперпролиферативное расстройство является нераковым.
23. Применение по п.22, где указанное расстройство представляет собой доброкачественную гиперплазию кожи или простаты.
24. Применение соединения по п.1 в комбинации с противоопухолевым агентом, выбранным из группы, состоящей из митотических ингибиторов, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологической реакции, антигормонов и антиандрогенов, для лечения гиперпролиферативного расстройства у млекопитающего.
25. Применение соединения по п.1 для лечения панкреатита или заболевания почек у млекопитающего.
26. Применение соединения по п.1 для предупреждения имплантации бластоцита у млекопитающего.
27. Применение соединения по п.1 для лечения заболевания, связанного с васкулогенезом или ангиогенезом, у млекопитающего.
28. Применение соединения по п.27, где указанное заболевание выбрано из группы, состоящей из опухоли ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, заболеваний кожи, таких как псориаз, экзема и склеродерма, диабетов, диабетической ретинопатии, ретролетальной фиброплазии, возрастной дегенерации желтого пятна, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичника, молочной железы, легкого, поджелудочной железы, простаты, толстой кишки и эпидермоидного рака.
Текст
005889 Предпосылки изобретения Настоящее изобретение относится к новым бициклическим производным пиримидина и пиридина,которые полезны при лечении гиперпролиферативных заболеваний, таких как рак, у млекопитающих. Это изобретение относится также к способу использования таких соединений при лечении гиперпролиферативных заболеваний у млекопитающих, особенно у людей, и к фармацевтическим композициям,содержащим такие соединения. Соединения, которые полезны при лечении гиперпролиферативных заболеваний, описаны также в следующих совместно рассматриваемых патентных заявках: Международная заявкаPCT/IB97/00675(подана 11 июня 1997), предварительная патентная заявка США 60/041846 (подана 9 апреля 1997),предварительная патентная заявка США 60/031862 (подана 27 ноября 1996), предварительная патентная заявка США 60/028881 (подана 17 октября 1996), Международная заявкаPCT/IB97/00584 (подана 22 мая 1997), заявка США 08/653 786 (подана 28 мая 1996), публикация Международной заявкиWO 96/40142 (опубликована 19 декабря 1996), публикация Международной заявкиWO 97/13771(опубликована 17 апреля 1997) и публикация Международной заявкиWO 95/23141 (опубликована 31 августа 1995). Каждая из вышеупомянутых Международных заявок и заявок США во всей своей полноте включена в данное описание ссылкой. Известно, что клетка может стать злокачественной из-за трансформации части ее ДНК в онкоген(т.е. в ген, активация которого приводит к образованию клеток злокачественной опухоли). Многие онкогены кодируют белки, которые являются аберрантными тирозинкиназами, способными вызывать трансформацию клеток. Альтернативно, сверхэкспрессия нормальной протоонкогенной тирозинкиназы, также может приводить к пролиферативным расстройствам, которые иногда приводят к злокачественному фенотипу. Рецепторные тирозинкиназы являются большими ферментами, которые прошивают клеточную мембрану и обладают внеклеточным доменом связывания факторов роста, таких как эпидермальный фактор роста, трансмембранным доменом и внутриклеточным участком, который, функционируя как киназа, фосфорилирует специфический тирозиновый остаток в белках и, следовательно, влияет на пролиферацию клеток. Вышеупомянутые тирозинкиназы можно классифицировать как киназы рецепторов факторов роста (например EGFR (рецептор эпидермального фактора роста), PDGFR (рецептор тромбоцитарного фактора роста), FGFR (рецептор фактора роста фибробластов и erbВ 2), либо как нерецепторные киназы (например c-src и bcr-abi). Известно, что такие киназы часто аберрантно экспрессируются при распространенных видах рака человека, таких как рак молочной железы, желудочно-кишечный рак,такой как рак ободочной кишки, рак прямой кишки или рак желудка, лейкемия, а также рак яичника,бронхов или поджелудочной железы. Аберрантная активность erbВ 2 вовлечена в рак молочной железы,рак яичника, немелкоклеточный рак лгкого, рак поджелудочной железы, рак желудка и рак толстой кишки. Было также показано, что рецептор эпидермального фактора роста (EGFR) мутирует или сверхэкспрессируется при многих видах рака человека, таких как рак мозга, рак лгкого, плоскоклеточный рак, рак мочевого пузыря, рак желудка, рак молочной железы, рак в области головы и шеи, рак пищевода, гинекологический рак и рак щитовидной железы. Поэтому считается, что ингибиторы рецепторных тирозинкиназ, такие как соединения по настоящему изобретению, полезны в качестве селективных ингибиторов роста раковых клеток у млекопитающих. Было также показано, что ингибиторы EGFR могут быть полезны при лечении панкреатита и заболевания почек (такого как пролиферативный гломерулонефрит и ренальное заболевание, вызванное диабетом), и могут уменьшать успешную имплантацию бластоцита и, таким образом, могут быть полезны в качестве контрацептива [публикация международной заявкиWO 95/19970 (опубликована 27 июля 1995)]. Известно, что полипептидые факторы роста, такие как сосудистый эндотелиальный фактор роста(VEGF), имеющие значительную аффинность к рецептору человека, содержащему домен-вставку киназы(KDR) или к рецептору, содержащему киназу печени мышиного эмбриона 1 (FLK-1), связаны с пролиферацией эндотелиальных клеток и более конкретно с васкулогенезом и ангиогенезом [публикация Международной заявкиWO 95/21613 (опубликована 17 августа 1995)]. Агенты, такие как соединения по настоящему изобретению, которые способны связываться с рецептором KDR/FLK-1 или модулировать его, можно использовать для лечения расстройств, связанных с васкулогенезом или ангиогенезом, таких как диабеты, диабетическая ретинопатия, гемангиома, глиома, меланома, саркома Капоши и рак яичника,молочной железы, лгкого, поджелудочной железы, простаты, толстой кишки и эпидермоидный рак. Сущность изобретения Настоящее изобретение относится к соединениям формул 1 и 2-1 005889 и их фармацевтически приемлемым солям и гидратам, гдеR2 представляет собой С 6-С 10 арил или 5-13-членный гетероцикл, причем указанные группы R2 возможно замещены заместителями R5 в количестве от 1 до 5; каждый R3 независимо выбран из Н, -C(O)OR9 и C1-С 6 алкил, причем указанный алкил возможно замещн группами R5 в количестве от 1 до 3;R4 представляет собой R3, -OR9 или -NR9R10; каждый R5 независимо выбран из галогено, циано, нитро, трифторметокси, трифторметила, азидо,-C(O)R8, -C(O)OR8, -C(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -OR9, -SO2NR6R7, С 1 С 6 алкила, -(CH2)jO(CH2)qNR6R7, -(CH2)tO(CH2)qOR9, -(CH2)tOR9, -S(О)j(С 1-С 6 алкил), -(СН 2)t(С 6-С 10 арил),-(СН 2)t(5-10-членный гетероцикл), -С(О)(СН 2)t(С 6-С 10 арил), -(CH2)tO(CH2)j(C6-C10 арил), -(СН 2)tО(СН 2)q(510-членный гетероцикл), -C(О)(СН 2)t(5-10-членный гетероцикл), -(CH2)jNR7(CH2)qNR6R7, -(CH2)jNR7CH2C(O)NR6R7, -(CH2)jNR7(CH2)qNR9C(O)R8, -(CH2)jNR7(CH2)tO(CH2)qOR9, -(CH2)jNR7(CH2)qS(O)j(C1C6 алкил), -(CH2)jNR7(CH2)tR6, -SО 2(СН 2)t(С 6-С 10 арил) и -SО 2(СН 2)t(5-10-членный гетероцикл), где j равно целому числу в пределах от 0 до 2, t равно целому числу в пределах от 0 до 6, q равно целому числу в пределах от 2 до 6, группировки -(CH2)q- и -(СН 2)t- вышеупомянутых групп R5 возможно заключают в себе двойную или тройную углерод-углеродную связь, если t равно целому числу между 2 и 6, а алкильные, арильные и гетероциклические группировки вышеупомянутых групп R5 возможно замещены заместителями в количестве от 1 до 3, которые независимо выбраны из галогено, циано, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -OC(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -(CH2)tNR6R7, C1C6 алкила, -(СН 2)t(С 6-С 10 арил), -(СН 2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, a q равно целому числу в пределах от 2 до 6; каждый R6 и R7 независимо выбран из Н, C1-C6 алкила, -(СН 2)t(С 6-С 10 арил), -(СН 2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, a q равно целому числу в пределах от 2 до 6, и алкильные, арильные и гетероциклические группировки вышеупомянутых групп R6 и R7 возможно замещены заместителями в количестве от 1 до 3, которые независимо выбраны из галогено, циано, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -CO(O)R8, -OC(O)OR8,-NR9C(O)R10, -C(O)NR9R10, -NR9R10, C1-C6 алкила, -(СН 2)t(С 6-С 10 арил), -(СН 2)t(5-10-членный гетероцикл),-(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, a q равно целому числу в пределах от 2 до 6, при условии, что если R6 и R7 оба присоединены к одному и тому же атому азота, тоR6 и R7 оба не связаны с этим атомом азота непосредственно через кислород; каждый R8 независимо выбран из Н, C1-C10 алкила, -(СН 2)t(C1-C10 арил) и -(СН 2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6; каждый R9 и R10 независимо выбран из Н и C1-C6 алкила;-(СН 2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6, где указанные группыR11, иные чем Н, возможно замещены группами R5 в количестве от 1 до 5, иR12 представляет собой Н, C1-C6 алкил, -С(О)(С 1-С 6 алкокси), -S(О)j(С 1-С 6 алкил), -SO2(CH2)t(C6C10 арил), -(СН 2)t(С 6-С 10 арил), -(СН 2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 или -(CH2)tOR9, где j равно целому числу в пределах от 0 до 2, t равно целому числу в пределах от 0 до 6, a q равно целому числу в пределах от 2 до 6. Предпочтительные соединения включают в себя соединения формулы 1, где R11 представляет собой-(СН 2)t(С 6-С 10 арил) или -(СН 2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6,причем указанные группы R11 возможно замещены группами R5 в количестве от 1 до 5. Конкретные предпочтительные группы R11 включают в себя фенил или пиридил, причем указанные фенил и пиридил возможно замещены группами R5 в количестве от 1 до 5. Другие предпочтительные соединения включают в себя соединения формулы 1, где X1 представляет собой СН. Другие предпочтительные соединения включают в себя соединения формулы 1, где R2 представляет собой фенил, возможно замещенный заместителями R5 в количестве от 1 до 5, либо R2 представляет собой группу формулы где X2 представляет собой -S- или -N(R6)-, X3 представляет собой N или СН, пунктирная линия в формуле 3 означает возможную двойную связь, и вышеупомянутые группы R2 формул 3 и 5 возможно замещены заместителями R5 в количестве от 1 до 5, а группы R2 формул 4 и 6 возможно замещены заместителями R5 в количестве от 1 до 3. Особо предпочтительные соединения включают в себя соединения, в которых R2 представляет собой группу формулы 3, приведнную выше, где указанная группа возможно замещена заместителями R5 в количестве от 1 до 5. Конкретные воплощения настоящего изобретения включают в себя следующие соединения:[6-(4-фторфенил)-тиено[3,2-d]пиримидин-4-ил]-(1 Н-индол-5-ил)-амин; и фармацевтически приемлемые соли и гидраты вышеупомянутых соединений. Настоящее изобретение относится также к промежуточным соединениям формул 25 и 26 и их фармацевтически приемлемым солям, гдеZ1 и Z2 каждый независимо представляет собой галогено;R2 представляет собой С 6-С 10 арил или 5-13-членный гетероцикл, причем указанные группы R2 возможно замещены заместителями R5 в количестве от 1 до 5; каждый R3 независимо выбран из Н, -C(O)OR9 и C1-C6 алкила, причем указанный алкил возможно замещн группами R5 в количестве от 1 до 3;R4 представляет собой R3, -OR9 или -NR9R10; каждый R5 независимо выбран из галогено, циано, нитро, трифторметокси, трифторметила, азидо,-C(O)R8, -C(O)OR8, -OC(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -OR9, -SO2NR6R7, C1C6 алкила, -(CH2)jO-(CH2)qNR6R7, -(CH2)tO(CH2)qOR9, -(CH2)tOR9, -S(О)j(C1-C6 алкил), -(СН 2)t(С 6-С 10 арил),-(СН 2)t(5-10-членный гетероцикл), -С(О)(СН 2)t(С 6-С 10 арил), -(CH2)tO(CH2)j(C6-C10 арил), -(CH2)tO(CH2)q(510-членный гетероцикл), -C(O)(CH2)t(5-10-членный гетероцикл), -(CH2)jNR7(CH2)qNR6R7, -(CH2)jNR7CH2C(O)NR6R7, -(CH2)jNR7(CH2)qNR9C(O)R8, -(CH2)jNR7(CH2)tO(CH2)qOR9, -(CH2)jNR7(CH2)qS(O)j(C1-C6aлкил), -(CH2)jNR7(CH2)tR6, -SO2(CH2)t(C6-C10 арил) и -SO2(CH2)t(5-10-членный гетероцикл), где j равно целому числу в пределах от 0 до 2, t равно целому числу в пределах от 0 до 6, q равно целому числу в пределах от 2 до 6, группировки -(CH2)q- и -(CH2)t- вышеупомянутых групп R5 возможно заключают в себе двойную или тройную углерод-углеродную связь, если t равно целому числу между 2 и 6, а алкильные,арильные и гетероциклические группировки вышеупомянутых групп R5 возможно замещены заместителями в количестве от 1 до 3, которые независимо выбраны из галогено, циано, нитро, трифторметила, азидо,-C(O)R8, -C(O)OR8, -OC(O)R8, -OC(O)OR8, -NR6C(O)R7, -C(O)NR6R7, -(CH 2) tNR6R7, C1-C6 алкила,-(СН 2) t(С 6-С 10 арил), -(CH 2) t(5-10-членный гетероцикл), -(CH 2) tO(CH 2) qOR9 и группы -(CH 2) tOR9,где t равно целому числу в пределах от 0 до 6, a q равно целому числу в пределах от 2 до 6; каждый R6 и R7 независимо выбран из Н, C1-C6 алкила, -(СН 2)t(C6-С 10 арил), -(СН 2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, a q равно целому числу в пределах от 2 до 6, и алкильные, арильные и гетероциклические группировки вышеупомянутых групп R6 и R7 возможно замещены заместителями в количестве от 1 до 3, которые независимо выбраны из галогено, циано, нитро, трифторметила, азидо, -C(O)R8, -C(O)OR8, -CO(O)R8, -OC(O)OR8,-NR9C(O)R10, -C(O)NR9R10, -NR9R10, C1-C6 алкила, -(CH2)t(C6-С 10 арил), -(СН 2)t(5-10-членный гетероцикл),-(CH2)tO(CH2)qOR9 и -(CH2)tOR9, где t равно целому числу в пределах от 0 до 6, a q равно целому числу в пределах от 2 до 6, при условии, что если R6 и R7 оба присоединены к одному и тому же атому азота, тоR6 и R7 оба не связаны с этим атомом азота непосредственно через кислород; каждый R8 независимо выбран из Н, C1-C10 алкила, -(СН 2)t(С 6-С 10 арил) и -(СН 2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6; каждый R9 и R10 независимо выбран из Н и C1-C6 алкила;-(СН 2)t(5-10-членный гетероцикл), где t равно целому числу в пределах от 0 до 6, причем указанные группы R11, иные чем Н, возможно замещены трет-бутилдиметилсиланилом и группами R5 в количестве от 1 до 3; иR12 представляет собой Н, C1-C6 алкил, -С(О)(C1-C6 алкокси), -S(О)j(C1-C6 алкил), -SО 2(СН 2)t(С 6 С 10 арил), -(СН 2)t(С 6-С 10 арил), -(СН 2)t(5-10-членный гетероцикл), -(CH2)tO(CH2)qOR9 или -(CH2)tOR9, где j равно целому числу в пределах от 0 до 2, t равно целому числу в пределах от 0 до 6, и q равно целому числу в пределах от 2 до 6. Вышеупомянутые промежуточные соединения формул 25 и 26 могут быть использованы для получения вышеприведнных соединений формул 1 и 2. Настоящее изобретение относится также к фармацевтической композиции для лечения гиперпролиферативного расстройства у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата, и фармацевтически приемлемый носитель. В одном воплощении указанная фармацевтическая композиция предназначена для лечения рака, такого как рак мозга, лгкого, плоскоклеточный рак, рак мочевого пузыря,желудка, поджелудочной железы, молочной железы, рак головы, шеи, ренальный рак, рак почки, яичника, простаты, колоректальный рак, рак пищевода, гинекологический рак или рак щитовидной железы. В другом воплощении указанная фармацевтическая композиция предназначена для лечения неракового гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (т.е. псориаз) или простаты (например доброкачественная гипертрофия простаты (ДГП. Настоящее изобретение относится также к фармацевтической композиции для лечения панкреатита или заболевания почек (включая пролиферативный гломерулонефрит и ренальное заболевание, вызванное диабетом) у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата, и фармацевтически приемлемый носитель.- 10005889 Настоящее изобретение относится также к фармацевтической композиции для предупреждения имплантации бластоцита у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к фармацевтической композиции для лечения заболевания,связанного с васкулогенезом или ангиогенезом, у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата, и фармацевтически приемлемый носитель. В одном воплощении указанная фармацевтическая композиция предназначена для лечения заболевания, выбранного из группы, состоящей из опухоли ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза,заболеваний кожи, таких как псориаз, экзема и склеродерма, диабетов, диабетической ретинопатии, ретролетальной фиброплазии, возрастной дегенерации желтого пятна, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичника, молочной железы, легкого, поджелудочной железы, простаты, толстой кишки и эпидермоидного рака. Настоящее изобретение относится также к способу лечения гиперпрофилеративного расстройства у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата. В одном воплощении указанный способ относится к лечению рака, такого как рак мозга, плоскоклеточный рак,рак мочевого пузыря, желудка, поджелудочной железы, молочной железы, рак головы, шеи, рак пищевода, простаты, колоректальный рак, рак лгкого, ренальный рак, рак почки, яичника, гинекологический рак или рак щитовидной железы. В другом воплощении указанный способ относится к лечению неракового гиперпролиферативного расстройства, такого как доброкачественная гиперплазия кожи (т.е. псориаз) или простаты (например доброкачественная гипертрофия простаты (ДГП. Настоящее изобретение относится также к способу лечения гиперпрофилеративного расстройства у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата, в комбинации с противоопухолевым агентом, который выбран из группы, состоящей из митотических ингибиторов, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологической реакции, антигормонов и антиандрогенов. Настоящее изобретение относится также к способу лечения панкреатита или заболевания почек у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата. Настоящее изобретение относится также к способу предупреждения имплантации бластоцита у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата. Настоящее изобретение относится также к способу лечения заболеваний, связанных с васкулогенезом или ангиогенезом у млекопитающего, при котором указанному млекопитающему вводят эффективное количество соединения формулы 1 или 2, либо его фармацевтически приемлемой соли или гидрата. В одном воплощении указанный способ предназначен для лечения заболевания, выбранного из группы,состоящей из опухоли ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, заболеваний кожи, таких как псориаз, экзема и склеродерма, диабетов, диабетической ретинопатии, ретролетальной фиброплазии, возрастной дегенерации желтого пятна, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичника, молочной железы, легкого, поджелудочной железы, простаты, толстой кишки и эпидермоидного рака. Пациенты, которых можно лечить соединениями формул 1 и 2 и фармацевтически приемлемыми солями и гидратами указанных соединений способами по настоящему изобретению, включают в себя например пациентов, которым был поставлен диагноз псориаз, ДГП, рак лгкого, рак кости, рак поджелудочной железы, рак кожи, рак в области головы и шеи, кожная или внутриглазная меланома, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, гинекологические опухоли (например саркома матки, карцинома фаллопиевых труб,карцинома эндометрия, карцинома шейки матки, карцинома влагалища или карцинома вульвы), болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы (например рак щитовидной железы, паращитовидной железы или надпочечников), саркома мягких тканей, рак уретры, рак пениса,рак простаты, хроническая или острая лейкемия, солидные опухоли подросткового периода, лимфоцитарная лимфома, рак мочевого пузыря, рак почки или мочеточника (например гипернефрома, карцинома почечной лоханки) или неоплазмы центральной нервной системы (например первичная лимфома ЦНС,опухоли позвоночника, глиомы ствола мозга или гипофизарные аденомы). Используемый здесь термин "галогено" означает, если иное особо не оговорено, фторо, хлоро, бромо или йодо. Предпочтительными галогеногруппами являются фторо, хлоро и бромо. Используемый здесь термин "алкил" включает в себя, если иное особо не оговорено, насыщенные одновалентные углеводородные радикалы, которые имеют линейные, циклические или разветвлнные- 11005889 группировки. Указанная "алкильная" группа может заключать в себе двойную или тройную углеродуглеродную связь, при этом указанная алкильная группа содержит по меньшей мере два атома углерода. Разумеется, для циклических группировок в указанной алкильной группе требуется по меньшей мере три атома углерода. Используемый здесь термин "алкокси" включает в себя, если иное особо не оговорено, Оалкильные группы, при этом "алкил" является таким, как определено выше. Используемый здесь термин "арил" включает в себя, если иное особо не оговорено, органический радикал, образующийся из ароматического углеводорода при удалении одного водорода, такой как фенил или нафтил. Используемый здесь термин "5-10-членный гетероцикл" или "5-13-членный гетероцикл" включает в себя, если иное особо не оговорено, ароматические и неароматические гетероциклические группы, которые содержат от одного до четырх гетероатомов, каждый из которых выбран из О, S и N, при этом каждая гетероциклическая группа имеет в своей кольцевой системе 5-10 или 5-13 атомов. Эти гетероциклические группы включают в себя бензоконденсированные кольцевые системы и кольцевые системы, замещнные одной или двумя оксогруппами (=O), такие как пирролидин-2-он. Примером 5-членной гетероциклической группы является тиазолил, примером 10-членной гетероциклической группы является хинолинил, а примером 13-членной гетероциклической группы является карбазольная группа. Примерами неароматических гетероциклических групп являются пирролидинил, пиперидино, морфолино, тиоморфолино и пиперазинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил тетразолил, фурил, тиенил,изоксазолил и тиазолил. Гетероциклические группы, имеющие конденсированное бензольное кольцо,включают в себя бензимидазолил, бензофуранил и бензо[1,3]диоксолил. Используемое здесь выражение "фармацевтически приемлемая соль (соли)" включает в себя, если не указано иначе, соли кислотных и основных групп, которые могут присутствовать в соединениях формул 1 и 2. Соединения формул 1 и 2, которые имеют основную природу, способны образовывать разнообразные соли с различными неорганическими и органическими кислотами. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения кислот таких основных соединений формул 1 и 2, являются кислоты, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармацевтически приемлемые анионы, такие как гидрохлорид,гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый сульфат, изоникотинат, ацетат,лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат,гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [то есть 1,1'-метилен-бис-(2-гидрокси-3 нафтоат)]. Те соединения формул 1 и 2, которые имеют кислотную природу, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примерами таких солей являются соли щелочных или щелочно-земельных металлов, в частности соли натрия и калия. Некоторые соединения формул 1 и 2 могут иметь асимметрические центры и, таким образом, существовать в разных энантиомерных формах. Настоящее изобретение относится к использованию всех оптических изомеров и стереоизомеров соединений формул 1 и 2 и их смесей. Соединения формул 1 и 2 могут также существовать в виде таутомеров. Настоящее изобретение относится к использованию всех таких таутомеров и их смесей. Подробное описание изобретения Получение соединений по настоящему изобретению проиллюстрировано на следующих схемах 1-3. Соединения по настоящему изобретению легко получают в соответствии со способами синтеза, которые известны специалистам в данной области техники. Схема 1 иллюстрирует общую процедуру синтеза для получения соединений по настоящему изобретению. Несмотря на то, что схема 1 иллюстрирует- 14005889 получение конкретно соединений формулы 1, она в равной степени применима в получениях соединений формулы 2. Соединение формулы 7 (где X1 является таким, как определено выше) может быть получено по одной или более методикам, описанным в опубликованных международных заявкахWO 95/19774 (опубликована 27 июля 1995), WO 95/19970 (опубликована 27 июля 1995) и WO 97/13771(опубликована 17 апреля 1997). Кроме того, 4-хлортиено[3,2-d]пиримидин имеется в продаже, например,от фирмы Maybridge Chemical Co. Ltd. Предпочтительный способ получения 4-хлортиено[3,2-d]пиридина описан ниже со ссылкой на стадии 1-3 схемы 2. На стадии 1 схемы 1 соединение формулы 7 может быть превращено в соответствующее бромпроизводное формулы 8 путем обработки исходного соединения литийдиизопропиламином или н-бутиллитием, а затем дибром-1,1,2,2-тетрафторэтаном или бромом в неполярном растворителе, таком как тетрагидрофуран (ТГФ), при температуре около -78 С в течение периода времени примерно от 15 мин до получаса с последующим постепенным нагреванием смеси до комнатной температуры (20-25 С). На стадии 2 схемы 1 соединение формулы 8 может быть подвергнуто реакции сочетания с соединением формулы HNR1R2, где R1 и R2 такие, как определено выше, возможно в присутствии основания, такого как пиридин, триэтиламин или гидрид натрия, и возможно в присутствии в качестве катализатора пиридина гидрохлорида в инертной атмосфере, такой как сухой азот, в растворителе, таком как C1-C6 спирт, диметилформамид (ДМФ), 1,2-дихлорэтан (ДХЭ), N-метилпирролидин-2-он(NMП), хлороформ, ацетонитрил, ТГФ, диметилсульфоксид (ДМСО), 1,4-диоксан или пиридин, либо в смеси двух или более чем двух вышеупомянутых растворителей, предпочтительно в смеси третбутилового спирта и ДХЭ, при температуре от температуры окружающей среды до температуры образования флегмы, предпочтительно 80-125 С, в течение периода времени примерно от 2 до 72 ч с получением соединения формулы 9. Вышеупомянутую реакцию предпочтительно проводят в герметично закрытой пробирке. Если соединение формулы HNR1R2 представляет собой возможно замещнную индольную или индолиновую группировку, то такие соединения могут быть получены согласно одному или более чем одному способу, известному специалистам. Такие способы описаны в приведнной выше публикации Международной патентной заявкиWO 95/23141 и в W.C. Sumpter and P.M. Miller, "Heterocyclic Compounds with Indole and Carbazole Systems", v.8 The Chemistry of Heterocyclic Compounds", IntersciencePublishers Inc., New York (1954). Соответствующие возможные заместители могут быть введены до или после стадии сочетания, приведнной на схеме 1. Перед стадией сочетания первичные и вторичные аминогруппировки (иные чем указанный амин формулы HNR1R2) предпочтительно защитить с использованием защитной группы азота, известной специалистам. Такие защитные группы и их использование описаны в T.W. Greene and P.G.M. Wuts. "ProtectiveGroups in Organic Synthesis," Second Edition, John WileySons, New York, 1991. На стадии 3 схемы 1 соединение формулы 9 может быть превращено в соединение формулы 1 путем сочетания исходного соединения с соединением формулы R11-B(OH)2 (где R11 является таким, как определено выше) в присутствии 1,4-бис(дифенилфосфино)бутана и палладиевого катализатора, такого как бис(бензонитрил)-палладий (II)хлорид, основания, такого как карбонат натрия или калия, и растворителя, такого как толуол, этанол, ТГФ, ДМФ или диметоксиэтан (ДМЭ), предпочтительно смеси толуола, этанола и ТГФ, при температуре в диапазоне примерно 50-110 С в течение периода времени примерно от 1 до 24 ч. Данная стадия аналогична описанной в N. Miyaura, A. Suzuki, Chem. Rev. 1995, 95, 2457 процедуре реакции сочетания Сузуки. В качестве альтернативы, стадии 2 и 3 схемы 1 можно поменять местами. То есть, группа R11 может быть введена в соединение формулы 7 с последующим сочетанием полученного соединения с соединением формулы HNR1R2 как описано выше. По другой методике стадия 3 схемы 1 может быть осуществлена путем взаимодействия соединения формулы 9 с соединением формулы (триалкилстаннил)-R11 (где R11 является таким, как определено выше), таким как (трибутилстаннил)-R11, в присутствии иодида меди и транс-бензил(хлор)бис(трифенилфосфин)палладия(II) в ДМФ при температуре около 90 С в течение примерно 14 ч. Исходное соединение для этой методики, а именно(трибутилстаннил)-R11, может быть получено из R11-Br по меньшей мере тремя разными способами. Согласно первому способу R11-Br может быть обработан (трибутилстаннил)-хлоридом и н-бутиллитием в ТГФ или ДМФ с получением (трибутилстаннил)-R11. Согласно второму способу R11-Br может быть обработан Bu3Sn-SnBu3, где Вu представляет собой бутил, и металлическим натрием с получением (трибутилстаннил)-R11. И согласно третьему способу R11-Br может быть обработан Bu3Sn-SnBu3, где Вu представляет собой бутил, и Pd(РPh3), где Ph представляет собой фенил, в толуоле с получением (трибутилстаннил)-R11. До или после стадии 3 схемы 1 группа R11 может быть модифицирована введением одной или более чем одной R5-группы (где R5 является таким, как определено выше). Согласно одному предпочтительному способу, если R11 представляет собой фенильную группу, которая содержит альдегидную группу, этот альдегид может быть превращен в предпочтительную аминометильную группу. Согласно этому способу исходное соединение, которое включает в себя альдегид на группе R11, подвергают взаимодействию с амином формулы HNR6R7 (где R6 и R7 такие, как определено выше) в присутствии восстанавливающего агента, такого как цианборгидрид натрия или боргидрид натрия, в растворителе, содержащем уксусную кислоту и этанол или метанол, при температуре в диапазоне 0-100 С, предпочтительно при комнатной- 15005889 температуре. Этот способ обеспечивает превращение альдегида в группировку формулы R6R7NCH2-. Другие способы модификации соединений формулы 1 будут очевидны специалистам. Соединения формулы 2 получают аналогично. Схема 2 иллюстрирует процедуру получения соединений формулы 1, где X1 представляет собой СН. На стадии 1 схемы 2 соединение формулы 10 (метиловый эфир 3-аминотиофен-2-карбоновой кислоты) растворяют в гидроксиде натрия и нагревают с обратным холодильником в течение примерно 2 ч. Затем этот раствор охлаждают до 0 С и подкисляют концентрированной НСl до рН 5, при этом образуется осадок. Этот осадок отделяют и обрабатывают пропанолом и щавелевой кислотой, и раствор перемешивают при температуре около 38 С в течение приблизительно 45 мин с получением соединения формулы 11 (тиофен-3-иламин). На стадии 2 схемы 2, соединение формулы 11 растворяют в триэтилортоформиате и перемешивают при комнатной температуре до полного растворения. Затем при комнатной температуре порциями добавляют 2,2-диметил[1,3]диоксан-4,6-дион, при этом по завершении добавления образуется осадок. Затем эту смесь нагревают при 85 С в течение ночи. Полученный осадок, который представляет собой промежуточное соединение (2,2-диметил-5-(тиофен-3-иламинометилен)[1,3]диоксан 4,6-дион), затем отделяют и промывают. Это промежуточное соединение добавляют к даутерму А (нагретому до 260 С), и полученную смесь нагревают в течение 30 мин, а затем охлаждают до комнатной температуры с получением соединения формулы 12. На стадии 3 схемы 2 соединение формулы 12 добавляют к оксалилхлориду в смеси метиленхлорида и ДМФ и нагревают до температуры образования флегмы в течение приблизительно двух часов с получением соединения формулы 13. Соединение формулы 13 может быть превращено в соединение формулы 14, как описано выше относительно стадии 1 схемы 1. Соединение формулы 14 может быть превращено в соединение формулы 15, как описано выше в отношении стадии 2 схемы 1. Соединение формулы 15 может быть превращено в соединение формулы 16,как описано выше относительно стадии 3 схемы 1. Схема 3 иллюстрирует альтернативный способ сочетания группы R11, представленной соединением формулы 18, где каждая группировка X представляет собой СН или N, a R5 такой, как определено выше,с остатком соединения формулы 1 или 2, который показан как соединение формулы 17. Хотя соединение формулы 17 по структуре соответствует соединению формулы 1, процедура, описанная для схемы 3, позволяет получать соответствующие соединения формулы 2. На стадии 1 схемы 3 соединение формулы 17 подвергают реакции сочетания с соединением формулы 18 в ДМФ в присутствии иодида меди и трансбензил(хлор)бис-(трифенилфосфин)палладия(II) при температуре около 90 С в течение примерно 14 ч с получением соединения формулы 19. Затем соединение формулы 19 может быть подвергнуто реакции сочетания с соединением формулы HNR1R2, где R1 и R2 такие, как определено выше, как описано выше в отношении стадии 2 схемы 1 с получением соединения формулы 20. Соединения по настоящему изобретению могут иметь асимметрические атомы углерода. Такие диастереомерные смеси могут быть разделены на их индивидуальные диастереомеры на основе их физико-химических различий методами, известными специалистам, например, хроматографией или фракционной кристаллизацией. Энантиомеры могут быть разделены путм превращения энантиомерных смесей в диастереоизомерные смеси путем взаимодействия с соответствующим оптически активным соединением (например спиртом), разделением диастереомеров и превращением (например гидролизом) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Все такие изомеры, включая диастереомерные смеси и чистые энантиомеры, рассматриваются как часть настоящего изобретения. Соединения формул 1 и 2, которые имеют основную природу, способны образовывать множество солей с различными органическими и неорганическими кислотами. Хотя для введения животным такие соли должны быть фармацевтически приемлемыми, на практике часто желательно вначале выделить соединение формулы 1 или 2 из реакционной смеси в виде фармацевтически неприемлемой соли, а затем лишь превратить ее в свободное основание путем обработки щелочным реагентом, а затем превратить это свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений по настоящему изобретению легко получают путем обработки основного соединения, по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. Желаемую тврдую соль легко получают при осторожном выпаривании растворителя. Желаемую тврдую соль также можно осадить из раствора свободного основания в органическом растворителе путем добавления к этому раствору соответствующей минеральной или органической кислоты. Соединения формул 1 и 2, которые имеют кислотную природу, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных или щелочноземельных металлов, в частности соли натрия и калия. Все эти соли получают общепринятыми способами. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых основных солей по настоящему изобретению, представляют собой основания, которые образуют нетоксичные основные соли с кислотными соединениями формул 1 и 2. Такими нетоксичными основными солями являются соли, производные от таких фармакологически приемлемых катионов, как натрий, калий, кальций, магний и т.д. Эти соли легко могут быть получены- 16005889 путем обработки соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, с последующим выпариванием полученного раствора досуха,предпочтительно при пониженном давлении. Альтернативно, они также могут быть получены смешиванием вместе менее основных растворов кислотных соединений и алкоксидов желаемых щелочных металлов с последующим выпариванием полученного раствора досуха способом, аналогичным предыдущему. В том и другом случае используют предпочтительно стехиометрические количества реагентов,чтобы обеспечить полноту протекания реакции и максимальный выход желаемого конечного продукта. Соединения по настоящему изобретению являются сильными ингибиторами семейства erbB онкогенных и протоонкогенных тирозинкиназ белков, таких как рецептор эпидермального фактора роста(EGFR), erbB2, HER3 или HER4, и поэтому все они пригодны для терапевтического использования в качестве антипролиферативных агентов (например противораковых) у млекопитающих, в частности у людей. Соединения по настоящему изобретению являются также ингибиторами ангиогенеза и/или васкулогенеза. В частности, соединения по настоящему изобретению полезны в предотвращении и лечении различных гиперпролиферативных расстройств у человека, таких как доброкачественные и злокачественные опухоли печени, почки, мочевого пузыря, молочной железы, яичника, толстого кишечника, простаты, поджелудочной железы, лгкого, вульвы, щитовидной железы, печночные карциномы, саркомы,глиобластомы, опухоли в области головы и шеи, и другие гиперпластические состояния, такие как доброкачественная гиперплазия кожи (например псориаз) и доброкачественная гиперплазия простаты (например ДГП). В дополнение к этому предполагается также, что соединение по настоящему изобретению может обладать активностью против ряда лейкемий и лимфоидных злокачественностей. Соединения по настоящему изобретению могут быть полезны также при лечении дополнительных расстройств, в которые вовлечены аберрантная экспрессия, лиганд/рецепторные взаимодействия, или активация, или сигнальные события, связанные с различными белковыми тирозинкиназами. Такие расстройства могут включать в себя расстройства нейрональной, глиальной, астроцитальной, гипоталамусной, а также другой гландулярной, макрофаговой, эпителиальной, стромальной и бластоцитовой природы, в которые вовлечены аберрантная функция, экспрессия, активация или передача сигналов тирозинкиназ erbB. Кроме того, соединения по настоящему изобретению могут иметь терапевтическое применение при воспалительных ангиогенных и иммунологических расстройствах, в которые вовлечены как идентифицированные, так и ещ не идентифицированные тирозинкиназы, которые ингибируются соединениями по настоящему изобретению. Активность in vitro соединений формул 1 и 2 в ингибировании рецепторных тирозинкиназ (и, таким образом, последующей пролиферативной реакции, например рака) может быть определена по следующей методике. Активность соединений формул 1 и 2 in vitro может быть определена по величине ингибирования фосфорилирования киназой рецептора эпидермального роста экзогенного субстрата (например Lys3Gastrin или статистического сополимера polyGluTyr (4:1 [I. Posner et al., J. Biol. Chem. 267 (29), 2063847 (1992)] на тирозине тестируемым соединением относительно контроля. В соответствии с методикой,изложенной в G. N. Gill, W. Weber, Metods in Enzymology 146, 82-88 (1987), из клеток А 431 ( AmericanType Culture Collection, Роквилл, MD) получают очищенный методом аффинной хроматографии рецептор EGF человека (96 нг) и предварительно инкубируют его в пробирке для микроцентрифугирования сEGF (2 мкг/мл) в буфере для фосфорилирования + ванадат (PVB: 50 мМ HEPES, рН 7,4; 125 мМ NaCl; 24 мМ MgCl2; 100 мкМ ортованадата натрия), при общем объме 10 мкл, в течение 20-30 мин при комнатной температуре. Тестируемое соединение растворяют в диметилсульфоксиде (ДМСО), разводят PVB, и 10 мкл смешивают со смесью рецептор EGF/EGF и инкубируют в течение 10-30 мин при 30 С. Реакцию фосфорилирования инициируют добавлением 20 мкл смеси 33 Р-АТФ/субстрат (120 мкм Lys3-GastrinHepes рН 7,4, 40 мкМ АТФ; 2 мкКи -[33 Р]-АТФ) к смеси EGFr/EGF и инкубируют в течение 20 мин при комнатной температуре. Реакцию останавливают добавлением 10 мкл стоп-раствора (0,5 М EDTA, рН 8; 2 мМ АТФ) и 6 мкл 2 н. HCl. Пробирки центрифугируют при 14000 об./мин при 4 С в течение 10 мин. 35 мкл супернатанта из каждой пробирки капают из пипетки на кружок бумаги Whatman P81 размером 2,5 см, все это промывают четыре раза в 5% уксусной кислоте, 1 л на промывку, а затем сушат на воздухе. Это приводит к связыванию субстрата с бумагой и удалению свободного АТФ при промывке. Содержание включнного [33 Р] измеряют счетом жидкостных сцинтилляций. Из всех значений вычитают значение фона, представляющего собой включение в отсутствии субстрата (например Lys3-Gastrin) и вычисляют процент ингибирования относительно контролей в отсутствии тестируемых соединений. Такие анализы, проводимые в диапазоне доз тестируемых соединений, дают возможность определить аппроксимированное значение IC50 для ингибировании киназы EGFR in vitro. Активность соединений формул 1 и 2 in vivo может быть определена по величине ингибирования роста опухоли тестируемым соединением относительно контроля. Эффекты ингибирования роста опухоли различными соединениями измеряют в соответствии со способами Corbett Т. Н., et al. "Tumor Induction Relationships in Development of Transplantable Cancers of the Colon in Mice for Chemotherapy Assays,with a Note on Carcinogen Structure", Cancer Res. 35, 2434-2439 (1975) и Corbett, Т. Н., et al. "A Mouse Co- 17005889lon-tumor Model for Experimental Therapy", Cancer Chemother. Rep. (Part 2)". 5, 169-186 (1975), с незначительными изменениями. Образование опухолей в левом боку вызывают подкожной инъекцией 1 X 106 культивированных опухолевых клеток, находящихся в фазе логарифмического роста (клетки карциномы молочной железы человека MDA-MB-468 или клетки карциномы в области головы и шеи человека HN5),суспендированные в 0,10 мл RPMI 1640. По истечении достаточного промежутка времени, когда опухоли пальпируются (2-3 мм в диаметре), подопытных животных (бестимусные мыши) лечат активным соединением (приготовленным в виде препарата путм его растворения в ДМСО, обычно в концентрации от 50 до 100 мг/мл с последующим разведением физиологическим раствором в соотношении 1:9 либо,альтернативно, с последующим разведением 0,1% Pluronic P105 в 0,9% физиологическим растворе в соотношении 1:9) путем внутрибрюшинного (вб) или перорального (по) введения два раза в сутки (т.е. каждые 12 ч) в течение 5 последовательных дней. Для определения противоопухолевого эффекта опухоль измеряют в миллиметрах штангенциркулем Вернье, два диаметра крест-накрест, и размер опухоли рассчитывают по формуле: Вес опухоли = (длина х [ширина]2)/2 согласно методу, изложенному в Geran, R.I., et al., "Protocols for Screening Chemical Agents and NaturalProducts Against Animal Tumors and Other Biological Systems", Third edition, Cancer Chemother. Rep 3, 1104 (1972). Результаты выражают в виде процента ингибирования по формуле: Ингибирование (%) = (TuWконтроль-TuWтест-соединение)/TuWкoнтроль)100%. Имплантация опухоли в боку обеспечивает воспроизводимые эффекты доза/ответ для различных химиотерапевтических агентов, и этот метод измерения (диаметр опухоли) является достоверным методом оценки скорости роста опухоли. Другие методы оценки активности соединений по настоящему изобретению описаны в публикации Международной заявкиWO 95/21613 (опубликована 17 августа 1995), которая включена в данное описание ссылкой.In vitro активность соединений формул 1 и 2 в ингибировании рецептора KDR/VEGF может быть определена по следующей методике. Способность соединений по настоящему изобретению ингибировать активность тирозинкиназы может быть измерена с использованием рекомбинантного фермента в анализе, в котором измеряют способность соединений ингибировать фосфорилирование экзогенного субстрата полиGluTyr (PGT,Sigma, 4:1). Используя систему экспрессии бакуловируса, киназный домен рецептора KDR/VEGF человека (аминокислоты 805-1350) экспрессируется в клетки насекомого Sf9 в виде белка, образованного слиянием глутатиона и S-трансферазы (GST). Этот белок очищают от лизатов этих клеток, используя колонки с аффинным сорбентом глутатион-агароза. Ферментный анализ проводят на 96-луночных планшетах, покрытых субстратом PGT (0,625 мкг PGT на лунку). Тестируемые соединения разводят диметилсульфоксидом (ДМСО), а затем добавляют в PGT-планшеты так, чтобы конечная концентрация ДМСО в образце для анализа составляла 1,6% (об./об.). Рекомбинантный фермент разводят буфером для фосфорилирования (50 мМ Hepes, pH 7,3; 125 мМ NaCl; 24 мМ MgCl2). Реакцию инициируют добавлением АТФ до конечной концентрации 10 мкМ. Через 30 мин инкубирования при комнатной температуре с встряхиванием реакционную смесь удаляют, а планшеты промывают промывочным буфером(РВS(фосфтный буферный раствор)-содержащий 0,1% Tween-20). Количество фосфорилированного PGT измеряют путем инкубирования с ПХ-конъюгированным (ПХ - пероксидаза хрена) антителом PY-54(Transduction Labs), проявляемым ТМБ-пероксидазой (ТМБ - 3,3',5,5'-тетраметилбензидин), и протекание реакции количественно измеряют на планшет-ридере BioRad Microplate при 450 нм. Ингибирование ферментативной активности киназы тестируемым соединением определяют по снижению поглощения, и концентрацию соединения, которая требуется для ингибирования сигнала на 50%, представляют для тестируемого соединения как значение IC50. Для измерения способности соединений ингибировать активность KDR-тирозинкиназы непроцессированного белка, который присутствует в клеточной среде, можно использовать клетки эндотелия аорты свиньи (ЭАС), трансфецированные KDR человека (Waltenbergeretal., J. Biol. Chem. 269:26988, 1994). Клетки наносят на планшет и дают им возможность закрепиться на поверхности 96-лунок с одинаковой средой (среда Хама F12 (Ham's F12 с 10% ФБС (фетальная бычья сыворотка). Затем эти клетки промывают, к ним снова добавляют обедненную сывороткой среду, которая содержит 0,1% (об./об.) бычий сывороточный альбумин (БСА), и инкубируют в течение 24 ч. Непосредственно перед дозированием соединения к клеткам вновь добавляют обедненную сывороткой среду (без БСА). Растворнные в ДМСО тестируемые соединения разводят средой (конечная концентрация ДМСО 0,5% (об./об К концу 2 ч инкубирования в эту среду добавляют VEGF165 (конечная концентрация 50 нг/мл) и инкубируют 8 мин. Клетки промывают и лизируют в буфере HNTG (20 мМ Hepes, pH 7,5, 150 мМ NaCl, 0,2% Triton X-100,10% глицерин, 0,2 мМ ФМСФ (фенилметилсульфонилфторид), 1 мкг/мл пепстатин, 1 мкг/мл лейпептин,1 мкг/мл апротонин, 2 мМ пирофосфата натрия, 2 мМ ортованадата натрия). Степень фосфорилированияKDR измеряют при помощи твердофазного иммуноферментного анализа (ELISA). 96-луночные планшеты покрывают козлиным антикроликовым антителом из расчта 1 мкг на лунку. Несвязанное антитело смывают с планшета, и перед добавлением антитела anti-flk-1 C-20 (0,5 мкг на планшет, Santa Cruz) ос- 18005889 тальные сайты блокируют буфером Superblock (Pierce). Перед добавлением клеточного лизата все несвязанное антитело смывают с планшетов. После 2 ч инкубирования лизатов с антителом flk-1 связанный сKDR фосфотирозин количественно определяют проявлением с использованием ПХ-конъюгированным антителом PY-54 и ТМБ как описано выше. Способность соединений ингибировать VEGFстимулированную реакцию аутофосфорилирования на 50% относительно VEGF-стимулированных контролей для тестируемого соединения представляют как значение IC50. Способность соединений ингибировать митогенез эндотелиальных клеток человека измеряют по их способности ингбировать включение 3 Н-тимидина в клетки ЭПВЧ (эндотелиальные клетки пупочной вены человека, Clonetics). Этот анализ был описан в литературе (Waltenberger J. Et al. J. Biol. Chem. 269: 26988, 1994: Cao Y. et al. J. Biol. Chem. 271: 3154, 1996). Коротко, 104 клеток помещают в покрытые коллагеном 24-луночные планшеты и оставляют их прикрепляться. К клеткам добавляют обедненную сывороткой среду и через 24 ч обрабатывают соединением различной концентрации (приготовленным в виде препарата в ДМСО, конечная концентрация ДМСО в данном анализе составляет 0,2% об./об.) и 2-30 нг/мл VEGF165. В течение последних 3 ч из этих 24 ч обработки соединением клетки импульсно метят 3 Нтимидином (NEN, 1 мкКи на лунку). Затем среду удаляют, и клетки интенсивно промывают ледяным солевым уравновешивающим раствором Хэнка, а затем 2 раза ледяной трихлоруксусной кислотой (10% об./об.). Клетки лизируют добавлением 0,2 мл 0,1 н. NaOH, и лизаты переносят в сцинтилляционные виалы. Затем эти клетки промывают 0,2 мл 0,1 н. HCl, и эту промывочную жидкость переносят в эти виалы. Степень включения 3 Н-тимидина определяют подсчтом сцинтилляций. Способность соединениий ингибировать включение на 50% относительно контроля (обработка VEGF только носителем ДМСО) представляют для тестируемого соединения как значение IC50. Введение соединений по настоящему изобретению (именуемое далее "активное(ые) соединение(я)") может быть осуществлено любым способом, который обеспечивает доставку соединений к месту воздействия. Такие способы включают в себя пероральные способы, интрадуоденальные способы, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или инфузию), местное и ректальное введение. Количество вводимого активного соединения будет зависеть от субъекта, находящегося на лечении,серьзности расстройства или состояния, скорости введения и мнения лечащего врача. Однако эффективная дозировка находится в пределах от 0,001 до примерно 100 мг на килограмм веса тела в сутки,предпочтительно от примерно 1 до примерно 35 мг/кг/сутки, в однократной или разделнной дозах. Для человека весом 70 кг это составляет от примерно 0,05 до примерно 7 г/сутки, предпочтительно от примерно 0,2 до примерно 2,5 г/сутки. В некоторых случаях более адекватными могут быть уровни дозировки ниже нижнего предела вышеуказанного диапазона, а в других случаях можно применять без какихлибо отрицательных побочных эффектов ещ большие дозы при условии, что для введения на протяжении суток такие большие дозы сначала делят на несколько малых доз. Активное соединение можно применять в качестве единственного средства лечения или можно вовлекать одно или более чем одно противоопухолевое вещество, например вещество, которое выбрано из например митотических ингибиторов, например винбластина; алкилирующих агентов, например цисплатина, карбоплатина и циклофосфамида; антиметаболитов, например 5-фторурацила, цитозинарабинозида и гидроксимочевины, или например одного из предпочтительных антиметаболитов, раскрытых в Европейской патентной заявке 239362, такого как N-(5-N-3,4-дигидро-2-метил-4 оксохиназолин-6-илметил)-N-метиламино]-2-теноил-L-глутаминовая кислота; ингибиторов факторов роста; ингибиторов клеточного цикла; интеркалирующих антибиотиков, например адриамицина и блеомицина; ферментов, например интерферона; и антигормонов, например антиэстрогенов, таких как Nolvadex (тамоксифен), или например антиандрогенов, таких как Casodex (4'-циано-3-(4 фторфенилсульфанил)-2-гидрокси-2-метил-3'-(трифторметил)пропиоанилид). Такое совместное лечение может быть осуществлено путм одновременного, последовательного или раздельного дозирования индивидуальных компонентов этого лечения. Фармацевтическая композиция может быть например в форме, пригодной для перорального введения, такой как таблетки, капсулы, пилюли, порошки, препараты пролонгированного действия, растворы,суспензии; для парентеральной инъекции в форме стерильного раствора, суспензии или эмульсии; для местного применения в форме мази или крема; или в форме суппозитория для ректального введения. Фармацевтическая композиция может быть в стандартных лекарственных формах, пригодных для однократного введения точных доз. Фармацевтическая композиция будет содержать традиционный фармацевтический носитель или эксципиент и соединения по изобретению в качестве активного ингридиента. В дополнение к этому, она может содержать другие медицинские или фармацевтические агенты, носители, адъюванты и т.д. Примеры форм для парентерального введения включают в себя растворы или суспензии активных соединений в стерильных водных растворах, например в водных пропиленгликолевых или декстрозных растворах. При желании такие лекарственные формы могут быть соответственно забуферены. Подходящие фармацевтические носители включают в себя инертные разбавители или наполнители,водные и различные органические растворители. Фармацевтические композиции могут, при желании,- 19005889 содержать дополнительные ингридиенты, такие как корригенты, связывающие вещества, эксципиенты и тому подобное. Так, для перорального введения таблетки, содержащие различные эксципиенты, такие как лимонная кислота, могут содержать различные разрыхлители, такие как крахмал, альгиновая кислота и некоторые комплексные силикаты, и связывающие агенты, такие как сахароза, желатин и аравийская камедь. В дополнение к этому, в целях таблетирования часто полезны смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции аналогичного типа могут быть использованы также в мягких и твердых желатиновых капсулах. Предпочтительные вещества для них включают в себя лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение в них может быть объединено с различными подслащивающими агентами или корригентами, красящими веществами или красителями, и, при желании, с эмульгаторами или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин, или с их комбинациями. Способы приготовления различных фармацевтических композиций, содержащих конкретное количество активного соединения, известны или очевидны специалистам в данной области [напримерRemington's Pharmaceutical Sciences. Mack Publishing Company, Easter, Pa., 15th Edition (1975)]. Представленные ниже примеры и получения дополнительно поясняют и иллюстрируют соединения по настоящему изобретению и способы получения таких соединений. Должно быть понятно, что настоящее изобретение никоим образом не ограничено объемом нижеследующих примеров и получений. Пример 1. А. Метиловый эфир 3-формиламинотиофен-2-карбоновой кислоты К раствору метилового эфира 3-аминотиофен-2-карбоновой кислоты (25 г, 159 ммоль) в 125 мл муравьиной кислоты добавляли ацетат аммония (15,9 г, 207 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 3 ч, и спустя это время раствор охлаждали до комнатной температуры (2025 С). Образовавшееся тврдое вещество отфильтровывали, промывали водой и сушили под вакуумом с получением 24,5 г (86%) метилового эфира 3-формиламинотиофен-2-карбоновой кислоты. 1 Н ЯМР (400 МГц, ДМСО) d 10,2 (s, 1H), 8,35 (s, 3 Н), 7,92 (d, 1H), 7,91 (d, 1H), 3,76 (s, 3 Н). ЖХ-МС: 186 (МН+): ВЭЖХ ВУ: 2,81 мин.(ЖХ-МС - жидкостная хроматография - масс-спектрометрия ВЭЖХ - высокоэффективная жидкостная хроматография ВУ - время удерживания) Б. 3 Н-Тиено[3,2-d]пиримидин-4-он В круглодонной колбе емкостью 125 мл объединяли метиловый эфир 3-формиламинотиофен-2 карбоновой кислоты (5 г, 27,0 ммоль), формиат аммония (5,11 г, 81,0 ммоль) и формамид (6,40 мл, 162 ммоль) и нагревали при 140 С. Через 10 ч реакционную смесь охлаждали до комнатной температуры и фильтровали. Кристаллическое тврдое вещество промывали водой и сушили под вакуумом с получением 2,96 г (72%) 3 Н-тиено[3,2-d]пиримидин-4-она. 1 Н ЯМР (400 МГц, ДМСО) d 8,10 (m, 2H), 7,34(m, 1H). ЖХ-МС: 153 (МН+); ВЭЖХ ВУ: 1,21 мин. В. 4-Хлортиено[3,2-d]пиримидин Диметилформамид (6,6 мл, 85,4 ммоль) в 50 мл дихлорэтана охлаждали до 0 С и в течение нескольких минут медленно добавляли оксалилхлорид (62 мл, 124 ммоль, 2 М в дихлорметане) с образованием белого геля. Затем добавляли 3 Н-тиено[3,2-d]пиримидин-4-он (5,90 г, 38,8 ммоль) и реакционную смесь нагревали до температуры образования флегмы. Через 2,5 ч смесь охлаждали до комнатной температуры и вливали в воду. Продукт экстрагировали дихлорметаном (3 х 100 мл), сушили над сульфатом натрия и концентрировали под вакуумом с получением 5,01 г (76%) 4-хлортиено[3,2-d]пиримидина. 1 Н ЯМР (400 МГц, ДМСО) d 8,99 (s, 1H), 8,55 (d, 1H), 7,71 (d, 1H). ЖХ-МС: 171 (МН+); ВЭЖХ ВУ: 2,85 мин. Г. 6-Бром-4-хлортиено[3,2-d]пиримидин В круглодонной колбе емкостью 250 мл 65 мл тетрагидрофурана и диизопропиламин лития (18,5 мл, 37 ммоль, 2 М в тетрагидрофуране) охлаждали до -78 С. В 37 мл тетрагидрофурана растворяли 4 хлортиено[3,2-d]пиримидин (5,26 г, 31 ммоль) и в течение 5 мин медленно добавляли к реакционной смеси. Через 20 мин к раствору этого аниона медленно добавляли 1,2-дибром-1,1,2,2-тетрафторэтан (4,05 мл, 34 ммоль). Температуру поддерживали равной -78 С в течение 20 мин, затем в течение 2 ч смесь нагревали до комнатной температуры. Реакционную смесь вливали в воду, экстрагировали хлорформом (3 х 100 мл), сушили над сульфатом натрия и сушили под вакуумом с получением 7,70 г (99%) 6-бром-4 хлортиено[3,2-d]пиримидина. 1 Н ЯМР (400 МГц, ДМСО) d 8,97 (s, 1H), 8,01 (s, 1H). ЖХ-МС: 249,251(МН+); ВЭЖХ ВУ: 4,04 мин. Д. (6-Бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амин 6-Бром-4-хлортиено[3,2-d]пиримидин (7,73 г, 31 ммоль) растворяли в 50 мл дихлорэтана и 50 мл трет-бутилового спирта, и добавляли 5-аминоиндол (4,09 г, 31 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 14 ч, охлаждали до комнатной температуры и концентрировали под вакуумом с получением 13,02 г (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина. Этот сырой материал использовали без дальнейшей очистки (чистота 83%). Н ЯМР (400 МГц, ДМСО) d 11,1 (s, 1H), 9,62 (s, 1H), 8,38 (s, 1H), 7,63 (s, 1H), 7,49 (s, 1H), 7,35 (m,2H), 7,10 (d. 1H), 6,40 (s, 1H): ЖХ-МС: 345, 347 (МН+); ВЭЖХ ВУ: 3,77 мин. Пример 2. (1 Н-Индол-5-ил)-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амин Смесь 1,4-бис(дифенилфосфино)бутана (50 мг, 0,12 ммоль) и бис(бензонитрил)-палладия(II) хлорида (45 мг, 0,12 ммоль) суспендировали в 12 мл толуола, и через этот раствор в течение 30 с пропускали азот. Раствор перемешивали в течение 20 мин и добавляли (6-бромтиено[3,2-d]пиpимидин-4-ил)-(1Hиндoл-5-ил)-aмин (400 мг, 1,16 ммоль), фенилборную кислоту (283 мг, 2,32 ммоля), карбонат натрия(2,32 мл, 2,32 ммоля, 1 М водный раствор), 16 мл тетрагидрофурана и 6 мл этанола. Через этот раствор в течение 60 с пропускали азот и смесь нагревали до 85 С. Через 14 ч реакционную смесь охлаждали до комнатной температуры и, добавляя водный 1 н. раствор хлористо-водородной кислоты, доводили рН до 7. Затем этот материал концентрировали до сухого состояния и хроматографировали на силикагеле,элюируя смесью 1-5% метанол:дихлорметан с получением 194 мг (49%) (1 Н-индол-5-ил)-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амина. 1 Н ЯМР (400 МГц, ДMCO) d 11,1 (s, 1H), 9,73 (s, 1H), 8,49 (s, 1H), 7,79 (m, 4H), 7,46 (m, 4 Н), 7,25 (d,1H), 6,43 (s, 1H); ЖХ-МС: 343 (МН+); ВЭЖХ ВУ: 4,71 мин. Пример 3. [6-(4-хлорфенил)-тиено[3,2-d]пиримидин-4-ил]-(1 Н-индол-5-ил)-амин Указанное в заголовке соединение получали из п-хлорбензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H), 8,86 (s, 1H), 7,58 (m, 9H), 7,21 (d, 1H), 6,50 (s, 1H). Т.пл. 190-210 С: ЖХ-МС; 377 (МН+); ВЭЖХ ВУ: 5,32 мин. Пример 4. [6-4-Фторфенил)-тиено[3,2-d]пиримидин-4-ил]-(1 Н-индол-5-ил)-амин Указанное в заголовке соединение получали из п-фторбензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H), 8,82 (s, 1 Н), 7,79 (m, 4 Н), 7,41 (m, 5 Н), 7,21 (d, 1H), 6,50 (s,1H). Т.пл. 193-205 С: ЖХ-МС: 361 (МН+); ВЭЖХ ВУ: 4,88 мин. Пример 5. (1 Н-Индол-5-ил)-[6-(4-метоксифенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из п-метоксибензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H),11,2 (s, 1H), 8,81 (s, 1H), 7,55 (m, 6H), 7,20 (d, 1H), 7,05 (m,2 Н), 6,50 (s, 1H), 3,79 (s, 3 Н). Т.пл. 150-180 С; ЖХ-МС: 373 (МН+): ВЭЖХ ВУ: 4,45 мин. Пример 6. (1 Н-Индол-5-ил)-(6-п-толилтиено[3,2-d]пиримидин-4-ил)-амин Указанное в заголовке соединение получали из п-метилбензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,1 (s, 1H), 9,50 (s, 1H), 8,41 (s, 1H), 7,71 (d, 2H), 7,59 (s, 2H), 7,24 (m,5H), 6,38 (s, 1H), 2,28 (s, 3 Н). Т.пл. 200-220 С; ЖХ-МС: 357 (МН+); ВЭЖХ ВУ: 4,57 мин. Пример 7. 4-[4-(1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-илбензальдегид Указанное в заголовке соединение получали из п-формилбензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,2 (s, 1H), 9,95 (s, 1H), 8,85 (s, 1H), 7,90 (m, 6H), 7,75 (s, 1H), 7,46 (m,3 Н), 7,20 (d, 1H), 6,49 (s, 1H), 2,28 (s, 3 Н). ЖХ-МС: 371 (МН+); ВЭЖХ ВУ: 4,10 мин. Пример 8. (1 Н-Индол-5-ил)-(6-тиофен-3-илтиено[3,2-d]пиримидин-4-ил)-амин Указанное в заголовке соединение получали из тиофен-3-бороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H), 11,2 (s, 1H), 8,86 (s, 1H), 8,10 (s, 1H), 7,70 (m, 3 Н), 7,46 (m,3 Н), 7,21 (d, 1H), 6,49 (s, 1 Н). Т.пл. 178-189 С; ЖХ-МС: 349 (MH+); ВЭЖХ ВУ: 4,05 мин. Пример 9. (1 Н-Индол-5-ил)-[6-(4-метилсульфанилфенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из 4-(метилтио)бензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H), 11,2 (s, 1H), 8,82 (s, 1H), 7,76 (d, 2H), 7,61 (s, 2H), 7,51 (m,2 Н), 7,35 (d, 2H), 7,22 (d, 1H), 6,50 (s, 1H), 2,49 (s, 3 Н). Т.пл. 163-178 С; ЖХ-МС: 389 (МН+); ВЭЖХ ВУ: 4,73 мин. Пример 10. (1 Н-Индол-5-ил)-[6-(3-нитрофенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из 3-нитробензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. 1 Н ЯМР (400 МГц, ДМСО) d 11,3 (s, 2H), 8,83 (s, 1H), 8,47 (s, 1H), 8,31 (m, 1H), 8,05 (m, 2H), 7,77 (m, 2H), 7,47 (m, 2H),7,25 (m, 1 Н), 6,50 (s, 1H). Т.пл. 175-183 С; ЖХ-МС: 388 (МН+); ВЭЖХ ВУ: 4,80 мин. Пример 11. (1 Н-Индол-5-ил)-[6-(4-трифторметилфенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из 3-трифторметилбензолбороновой кислоты и (6 бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. Т.пл. 181-194 С: ЖХ-МС: 411 (МН+); ВЭЖХ ВУ: 4,88 мин.- 21005889 Пример 12. [6-(3-хлор-4-фторфенил)-тиено[3,2-d]пиримидин-4-ил]-(1 Н-индол-5-ил)-амин Указанное в заголовке соединение получали из 3-хлор-4-фторметилбензолбороновой кислоты и (6 бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. Т.пл. 175-183 С: ЖХ-МС: 395 (МН+); ВЭЖХ ВУ: 5,33 мин. Пример 13. [6-(4-Этилфенил)-тиено[3,2-d]пиримидин-4-ил]-(1 Н-индол-5-ил)-амин Указанное в заголовке соединение получали из 4-этилбензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. Т.пл. 171182 С: ЖХ-МС: 371 (МН+); ВЭЖХ ВУ: 5,13 мин. Пример 14. (1 Н-Индол-5-ил)-[6-(4-тиофен-2-илфенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из тиофен-2-бороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. Т.пл. 165-178 С: ЖХ-МС: 349(МН+): ВЭЖХ ВУ: 4,55 мин. Пример 15. (1 Н-Индол-5-ил)-[6-(3-метоксифенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из 3-метоксибензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. Т.пл. 160168 С; ЖХ-МС: 373 (МН+); ВЭЖХ ВУ: 4,75 мин. Пример 16. [6-(3,4-диметоксифенил)-тиено[3,2-d]пиримидин-4-ил-(1 Н-индол-5-ил)-амин Указанное в заголовке соединение получали из 3,4-диметоксибензолбороновой кислоты и (6-бромтиено[3,2-d]пиримидин-4-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 2. Т.пл. 171178 С; ЖХ-МС: 403 (МН+); ВЭЖХ ВУ: 4,11 мин. Пример 17. Метиловый эфир 3-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]бензиламино)-пропионовой кислоты Метиловый эфир 3-аминопропионовой кислоты (261 мг, 1,7 ммоль) растворяли в 3 мл метилового спирта и доводили рН до 6 концентрированной уксусной кислотой. К этому раствору добавляли 4-[4(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегид (100 мг, 0,28 ммоль), а затем цианборгидрид натрия (11 мг, 0,17 ммоль). Через 14 ч реакционную смесь вливали в воду и разбавляли хлорформом. Водный слой отделяли и доводили рН до 8,5 1 н. раствором гидроксида натрия. Требуемый продукт экстрагировали из водного слоя хлороформом (3 х 20 мл), объединнные органические экстракты сушили над сульфатом натрия, фильтровали и сушили под вакуумом с получением 85 мг (41%) метилового эфира 3-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-пропионовой кислоты. Этот продукт превращали в HCl соль путм перемешивания с 1 эквивалентом 1 н. HCl в эфире и полученное желтое тврдое вещество сушили под вакуумом. Т.пл. 105-118 С; ЖХ-МС: 458 (МН+); ВЭЖХ ВУ: 3,86 мин. Пример 18. N-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-N',N'-диметилэтан-1,2-диамин Указанное в заголовке соединение получали из N,N-диметилэтилендиамина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 170183 С: ЖХ-МС: 443 (МН+); ВЭЖХ ВУ: 3,02 мин. Пример 19. N-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-N'-метилэтан-1,2 диамин Указанное в заголовке соединение получали из N-метилэтилендиамина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl соль в примере 17. Т.пл. 93105 С; ЖХ-МС: 429 (МН+); ВЭЖХ ВУ: 3,46 мин. Пример 20. (1 Н-Индол-5-ил)-(6-4-[(2-метоксиэтиламино)-метил]-фенил-тиено[3,2-d]пиримидин]4-ил)-амин Указанное в заголовке соединение получали из 2-аминоэтанола и 4-[4-(1 Н-индол-5-иламино)тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 170-190 С; ЖХ-МС: 416 (МН+): ВЭЖХ ВУ: 2,91 мин. Пример 21. (1 Н-Индол-5-ил)-6-(4-пропиламинометилфенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из пропиламина и 4-[4-(1 Н-индол-5-иламино)тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 190-205 С; ЖХ-МС: 414 (МН+); ВЭЖХ ВУ: 4,15 мин. Пример 22. (1 Н-Индол-5-ил)-(6-4-[(3-метоксипропиламино)-метил]-фенил-тиено[3,2-d]пиримидин-4-иламин Указанное в заголовке соединение получали из 3-метоксипропиламина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 160175 С: ЖХ-МС: 444 (МН+); ВЭЖХ ВУ: 3,92 мин.- 22005889 Пример 23. (1 Н-Индол-5-ил)-(6-4-[(2-пиперазин-1-илэтиламино)-метил]-фенил-тиено[3,2-d]пиримидин-4-иламин Указанное в заголовке соединение получали из N-(2-аминоэтил)-пиперазина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 178191 С; ЖХ-МС: 484 (МН+); ВЭЖХ ВУ: 3,41 мин. Пример 24. (1 Н-Индол-5-ил)-(6-4-[(2-морфолин-4-илэтиламино)-метил]-фенил-тиено[3,2-d]пиримидин-4-ил)-амин Указанное в заголовке соединение получали из N-(2-аминоэтил)морфолина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 100111 С; ЖХ-МС: 485 (МН+); ВЭЖХ ВУ: 4,23 мин. Пример 25. (1 Н-Индол-5-ил)-[6-(4-метиламинометилфенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из метиламина и 4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. Т.пл. 140-147 С; ЖХ-МС: 386 (МН+); ВЭЖХ ВУ: 3,54 мин. Пример 26. (1 Н-Индол-5-ил)-6-[4-(4-метилпиперазин-1-илметил)-фенилтиено[3,2-d]пиримидин-4 ил)-амин Указанное в заголовке соединение получали из N-метилпиперазина и 4-[4-(1 Н-индол-5-иламино)тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт переводили в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. Т.пл. 143-150 С; ЖХМС: 455 (МН+); ВЭЖХ ВУ: 4,23 мин. Пример 27. 2-4-[4-(1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-пропан-1,3 диол Указанное в заголовке соединение получали из серина и 4-[4-(1 Н-индол-5-иламино)-тиено[3,2d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl соль в примере 17. 1 Н ЯМР (400 МГц, МеОН) d 8,37 (s, 1H), 7,67 (s, 1H), 7,59 (d, 2H), 7,49 (s, 1H), 7,41 (m, 5H), 7,30 (d, 1H), 7,19 (dd, 1 Н), 6,48 (d, 1 Н), 3,85s, 2 Н), 3,59 (m, 4 Н), 2,72 (m, 1 Н); ЖХ-МС: 446 (МН+); ВЭЖХ ВУ: 3,2 мин. Пример 28. 3-4-[4-(1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-пропан-1-ол Указанное в заголовке соединение получали из 3-аминопропанола и 4-[4-(1 Н-индол-5-иламино)тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. 1 Н ЯМР (400 МГц,ДМСО) d 11,1 (s, 1H), 9,54 (s, 1H), 8,44 (s, 1H), 7,75 (dd, 4H), 7,42 (m, 4H), 7,23 (m, 1H), 6,41 (s, 1H), 3,67(s, 2H), 3,43 (s, 2H), 3,30 (s, 2H), 1,54 (m, 2H): ЖХ-МС: 430 (МН+); ВЭЖХ ВУ: 3,34 мин. Пример 29. 2-2-Гидроксиэтил)-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-амино)-этанол Указанное в заголовке соединение получали из 2-(2-гидроксиэтиламино)-этанола и 4-[4-(1 Н-индол 5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. Т.пл. 110-127 С; ЖХ-МС: 460 (МН+); ВЭЖХ ВУ: 3,50 мин. Пример 30. 2-(2-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-этокси)этанол Указанное в заголовке соединение получали из 2-(2-аминоэтокси)-этанола и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. Т.пл. 111-119 С; ЖХ-МС: 460 (МН+): ВЭЖХ ВУ: 3,40 мин. Пример 31. 2-(2-4-[4-(1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-этиламино)-этанол Указанное в заголовке соединение получали из 2-(2-аминоэтиламино)-этанола и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. Т.пл. 7895 С; ЖХ-МС: 459 (МН+): ВЭЖХ ВУ: 3,74 мин. Пример 32. [6-(4-[2-(4 Н-имидазол-4-ил-этиламино]-метил-фенил)-тиено[3,2-d]пиримидин-4-ил](1 Н-индол-5-ил)-амин Указанное в заголовке соединение получали из гистамина и 4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. 1 Н ЯМР (400 МГц, ДМСО) d 11,1 (s, 1H), 9,61 (s, 1H), 8,47 (s, 1H), 7,83 (m, 3 Н), 7,66 (s, 1H), 7,57 (m,2H), 7,38 (m, 2H), 7,24 (m, 1H), 6,95 (s, 1H), 6,42 (s, 1H), 4,22 (s, 2H), 3,15 (m, 2H), 2,82 (m, 2H): ЖХ-МС: 466 (МН+): ВЭЖХ ВУ: 3,76 мин.- 23005889 Пример 33. (1 Н-индол-5-ил)-[6-(4-[(тиофен-2-илметил)-аминометил-фенил)-тиено[3,2-d]пиримидин-4-ил]-амин Указанное в заголовке соединение получали из С-тиофен-2-ил-метиламина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Продукт превращали в мезилатную соль аналогично превращению соединения в HCl-соль в примере 17. Т.пл. 111-121 С; ЖХ-МС: 468 (МН+); ВЭЖХ ВУ: 4,44 мин. Пример 34. [6-(4-[(Фуран-2-илметил)-амино]-метил-фенил)-тиено[3,2-d]пиримидин-4-ил]-(1 Ниндол-5-ил)-амин Указанное в заголовке соединение получали из С-фуран-2-ил-метиламина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 125134 С; ЖХ-МС: 452 (МН+); ВЭЖХ ВУ: 4,51 мин. Пример 35. 1-(3-4-[4-(1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-пропил)пирролидин-2-он Указанное в заголовке соединение получали из 1-(3-аминопропил)-пирролидин-2-он и 4-[4-(1 Ниндол-5-иламино)-тиено[3,2-d]пиридин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 139-146 С; ЖХ-МС: 497 (МН+); ВЭЖХ ВУ: 4,01 мин. Пример 36. N-4-[4-(1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-N',N'-диметилпропан-1,3-диамин Указанное в заголовке соединение получали из N,N-диметилпропилендиамина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 148160 С; ЖХ-МС: 457 (МН+); ВЭЖХ ВУ: 3,84 мин. Пример 37. (1 Н-Индол-5-ил)-[6-(4-морфолин-4-илметилфенил)-тиено[3,2-d]пиримидин-4-ил-амин Указанное в заголовке соединение получали из морфолина и 4-[4-(1 Н-индол-5-иламино)-тиено[3,2d]пиримидин-4-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 141-152 С; ЖХ-МС: 442(МН+); ВЭЖХ ВУ: 4,10 мин. Пример 38. Этиловый эфир (2-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]бензиламино-ацетиламино)-уксусной кислоты Указанное в заголовке соединение получали из этилового эфира (2-аминоацетиламино)-уксусной кислоты и 4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 98-115 С; ЖХ-МС: 515 (МН+); ВЭЖХ ВУ: 3,88 мин. Пример 39. 1-(4-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-пиперазин-1 ил)-этанон Указанное в заголовке соединение получали из 1-пиперазин-1-илэтанона и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 163180 С; ЖХ-МС: 483 (МН+); ВЭЖХ ВУ: 4,24 мин. Пример 40. [6-(4-Циклопропиламинометилфенил)-тиено[3,2-d]пиримидин-4-ил]-(1 Н-индол-5-ил)амин Указанное в заголовке соединение получали из циклопропиламина и 4-[4-(1 Н-индол-5-иламино)тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 176-180 С: ЖХ-МС: 412 (МН+); ВЭЖХ ВУ: 4,10 мин. Пример 41. 2-4-[4-(1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-пропан-1-ол Указанное в заголовке соединение получали из 2-аминопропан-1-ола и 4-[4-(1 Н-индол-5-иламино)тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 160-175 С; ЖХ-МС: 444 (МН+); ВЭЖХ ВУ: 3,90 мин. Пример 42. (1 Н-Индол-5-ил)-6-[4-(2-метоксиметилпирролидин-1-илметил)-фенилтиено[3,2-d]пиримидин-4-ил-амин Указанное в заголовке соединение получали из 2-метоксиметилпирролидина и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 161177 С; ЖХ-МС: 470 (МН+); ВЭЖХ ВУ: 4,55 мин. Пример 43. N-(2-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензиламино-этил)аиетамид Указанное в заголовке соединение получали из N-(2-аминоэтил)-ацетамида и 4-[4-(1 Н-индол-5 иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 142155 С; ЖХ-МС: 457 (МН+); ВЭЖХ ВУ: 3,35 мин. Пример 44. Амид 1-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-пиперидин 4-карбоновой кислоты Указанное в заголовке соединение получали из амида пиперидин-4-карбоновой кислоты и 4-[4-(1 Ниндол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. Т.пл. 198-205 С; ЖХ-МС: 483 (МН+); ВЭЖХ ВУ: 3,56 мин.- 24005889 Пример 45. N-4-[4-1 Н-Индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-N',N'-диметилгексан-1,6-диамин Указанное в заголовке соединение получали из амида N',N'-диметилгексан-1,6-диамина и 4-[4-(1 Ниндол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц, ДМСО) d; Т.пл. 134-148 С; ЖХ-МС: 499 (МН+); ВЭЖХ ВУ: 4,12 мин. Пример 46. Фуран-2-ил-(4-4-[4-(1 Н-индол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензил-пиперазин-1-ил)-метанон Указанное в заголовке соединение получали из фуран-2-илпиперазин-1-ил-метанона и 4-[4-(1 Ниндол-5-иламино)-тиено[3,2-d]пиримидин-6-ил]-бензальдегида по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц, ДМСО) d; Т.пл. 167-174 С; ЖХ-МС: 535 (МН+); ВЭЖХ ВУ: 5,24 мин. Пример 47 А. Тиофен-3-иламин Метиловый эфир 3-аминотиофен-2-карбоновой кислоты (25 г, 159 ммоль) растворяли в 160 мл 2 н гидроксида натрия и нагревали с обратным холодильником в течение 2 ч. Раствор охлаждали до 0 С и подкисляли до рН 5 концентрированной HCl, при этом образовывался осадок. Этот осадок промывали водой, а затем растворяли в ацетоне, сушили над сульфатом магния и концентрировали почти досуха при комнатной температуре. К остатку добавляли 50 мл пропанола и щавелевую кислоту (15,8 г, 175 ммоль),и раствор перемешивали при 38 С в течение 45 мин. Смесь охлаждали и к ней добавляли эфир. Образовавшийся осадок отфильтровывали, промывали эфиром и сушили с получением 16,7 г сырого вещества. Это тврдое вещество суспендировали в 300 мл воды и доводили рН до 9 насыщенным водным раствором гидроксида аммония. Этот раствор экстрагировали метиленхлоридом (4 х 100 мл), сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением 6,37 г (40%) тиофен-3 иламина. Б. 4 Н-Тиено[3,2-b]пиридин-7-он Диметил-[1,3]диоксан-4,6-дион (5,0 г, 34,6 ммоль) объединяли с триэтилортоформиатом (205 мл,138 ммоль) и перемешивали при 30 С в течение 1 ч. Затем при комнатной температуре небольшими порциями добавляли тиофен-3-иламин (2,81 г, 28,3 ммоль), при этом выпадал белый осадок. Эту смесь нагревали при 85 С в течение ночи. Реакционную смесь охлаждали до комнатной температуры, добавляли изопропиловый эфир, и суспензию перемешивали в течение одного часа. Осадок отфильтровывали, промывали изопропиловым эфиром и сушили под вакуумом. Промежуточное соединение растворяли в метиленхлориде, добавляли карбонат калия, и перемешивали суспензию в течение 30 мин. Тврдое вещество отфильтровывали,раствор концентрировали с получением 2,2-диметил-5-(тиофен-3 иламинометилен)-[1,3]диоксан-4,6-диона в виде свободного основания. В одногорлой круглодонной колбе даутерм А (15 мл) нагревали до 260 С и маленькими порциями добавляли 2,2-диметил-5-(тиофен-3 иламинометилен)-[1,3]диоксан-4,6-дион. Смесь нагревали в течение 30 мин, затем охлаждали до комнатной температуры, добавляли изопропиловый эфир и суспензию перемешивали в течение одного часа. Осадок отфильтровывали, промывали изопропиловым эфиром и сушили под вакуумом с получением 3,43 г (79%) 4 Н-тиено[3,2-b]пиридин-7-он. 1 Н ЯМР (400 МГц, ДМСО) d 7,93 (d, 1H), 7,79 (d, 1H), 7,21 (d,1H), 5,99 (d, 1H): ЖХ-МС: 152(МН+); ВЭЖХ ВУ: 1,21. В. 7-хлортиено[3,2-b]пиридин В круглодонной колбе 250 мл объединяли 100 мл метиленхлорида и диметилформамид (6,1 мл, 78,6 ммоль) и охлаждали до 0 С. По каплям в течение нескольких минут добавляли оксалилхлорид (57 мл,114 ммоль). Затем добавляли 4 Н-тиено[3,2-b]пиридин-7-он (5,4 г, 35,7 ммоль), и раствор нагревали до температуры образования флегмы. Через 2 ч колбу охлаждали до комнатной температуры, полученное тврдое вещество отфильтровывали и сушили под вакуумом с получением 6,29 г (100%) 7-хлортиено[3,2-b]пиридина в виде желтого тврдого вещества, 1 Н ЯМР (400 МГц, ДМСО) d 8,67 (d, 1H), 8,29(d, 1H), 7,66 (d, 1H), 7,61 (d, 1H); ЖХ-МС: 171 (МН+); ВЭЖХ ВУ: 4,19. Г. 2-Бром-7-хлортиено[3,2-b]пиридин Раствор из 90 мл тетрагидрофурана и диизопропиламина (4,6 мл, 32,9 ммоль) охлаждали до -78 С и по каплям добавляли н-бутиллитий (12,2 мл, 30,3 ммоль) в гексане. Раствор нагревали до 0 С в течение 10 мин, вновь охлаждали до -78 С, и добавляли 7-хлортиено[3,2-b]пиридин (4,29 г, 25,2 ммоль). Этот анион перемешивали в течение 10 мин и добавляли 1,2-дибром-1,1,2,2-тетрафторэтан (3,3 мл, 27,8 ммоль). Раствор перемешивали ещ 20 мин, затем оставляли нагреваться до комнатной температуры. Через 1 ч реакционную смесь вливали в воду и экстрагировали хлорформом (3 х 100 мл). Объединенные органические порции сушили над сульфатом магния, фильтровали и сушили с получением 4,65 г (74%) 2-бром-7-хлортиено[3,2-b]пиридина. 1 Н ЯМР (400 МГц, ДМСО) d 8,64 (d, 1H), 7,91 (s 1H), 7,65 (d, 1H): ЖХ-МС: 250 (МН+); ВЭЖХ ВУ: 5,49. Д. (1 Н-Индол-5-ил)-(2-фенилтиено[3,2-b]пиридин-7-ил)-амин В герметично закрывающейся пробирке 2-бром-7-хлортиено[3,2-b]пиридин (1,01 г, 4,08 ммоль) растворяли в 15 мл дихлорэтана и 15 мл трет-бутилового спирта. Затем добавляли 5-аминоиндол (540 мг,4,08 ммоль), пробирку герметично закрывали и содержимое нагревали при 85 С в течение 36 ч. Раствор охлаждали и фильтровали, тврдое вещество промывали метиленхлоридом и сушили под вакуумом с получением 1,96 г сырого продукта. Порцию этого материала (100 мг, 0,29 ммоль) подвергали реакции- 25005889 сочетания бензолбороновой кислотой по методике, аналогичной примеру 2, с получением 37,1 мг (38%)(МН+): ВЭЖХ ВУ: 4,81. Пример 48. 4-[7-(1 Н-индол-5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензальдегид Указанное в заголовке соединение получали из 4-формилбензолбороновой кислоты и (2-бромтиено[3,2-b]пиридин-7-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц, ДМСО) d 11,1 (s, 1H), 9,98 (s, 1H), 8,21 (d, 1H), 8,05 (s, 1H), 7,95 (s, 3H), 7,82 (d,1 Н), 7,60 (m, 3H), 7,00 (d, 1H), 6,58 (s, 1H), 6,40 (s, 1H); ЖХ-МС: 370 (МН+); ВЭЖХ ВУ: 4,83 мин. Пример 49. (1 Н-Индол-5-ил)-(2-тиофен-2-ил-тиено[3.2-b]пиридин-7-ил)-амин Указанное в заголовке соединение получали из тиофен-2-бороновой кислоты и (2-бромтиено[3,2b]пиридин-7-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц,ДМСО) d 11,1 (s, 2H), 8,27 (d, 1H), 7,73 (s, 1H), 7,48 (m, 5H), 7,19 (m, 1H), 7,03 (d, 1H), 6,50 (s, 1H); ЖХМС: 348 (МН+); ВЭЖХ ВУ: 5,11 мин. Пример 50. (1 Н-Индол-5-ил)-[2-(4-метоксифенил)-тиено[3,2-b]пиридин-7-ил]-амин Указанное в заголовке соединение получали из 4-метоксибензолбороновой кислоты и (2-бромтиено[3,2-b]пиридин-7-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц, ДМСО) d 11,3 (s, 1 Н), 10,6 (s, 1 Н), 8,21 (d, 1 Н), 7,65 (m, 5 Н), 7,00 (m, 5 Н), 6,43 (d, 1 Н), 3,80 (s, 3 Н); ЖХ-МС: 372 (МН+); ВЭЖХ ВУ: 5,45 мин. Пример 51. (1 Н-Индол-5-ил)-[2-(4-метилсульфанилфенил)-тиено[3,2-b]пиридин-7-ил]-амин Указанное в заголовке соединение получали из 4-(метилтио)бензолбороновой кислоты и (2-бромтиено[3,2-b]пиридин-7-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H), 10,6 (s, 1H), 8,30 (d, 1H), 7,53 (m, 9H), 7,05 (d, 1H), 6,43 (s, 1 Н), 2,48 (s, 3 Н); ЖХ-МС: 388 (МН+); ВЭЖХ ВУ: 6,07 мин. Пример 52. [2-4-Фторфенил)-тиено[3,2-b]пиридин-7-ил]-(1 Н-индол-5-ил)-амин Указанное в заголовке соединение получали из 4-фторбензолбороновой кислоты и (2-бромтиено[3,2-b]пиридин-7-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H), 10,7 (s, 1H), 8,28 (d, 1H), 7,50 (m, 9H), 7,05 (d, 1H), ), 6,49(s, 1H); ЖХ-МС: 360 (МН+); ВЭЖХ ВУ: 5,40 мин. Пример 53. 2-4-[7-(1 Н-Индол-5-иламино)-тиено[3,2-b]пиридин -2-ил]-фенокси-этанол Указанное в заголовке соединение получали из 4-[2-(трет-бутилдиметилсиланилокси)-этокси]бензолбороновой кислоты и (2-бромтиено[3,2-b]пиридин-7-ил)-(1 Н-индол-5-ил)-амина по методике, аналогичной примеру 17. 1 Н ЯМР (400 МГц, ДМСО) d 11,4 (s, 1H), 10,7 (s, 1H), 8,24 (d, 1H), 7,53 (m, 9H),7,08 (m, 1 Н), 6,49 (s, 1H), 4,02 (t, 2H), 3,70 (t, 2H); ЖХ-МС: 402 (МН+); ВЭЖХ ВУ: 3,95 мин. Пример 54. 2-(2-4-[7-(1 Н-Индол-5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензиламино-этокси)этанол Указанное в заголовке соединение получали из 2-(2-аминоэтокси)-этанола и 4-[7-(1 Н-индол-5 иламино)-тиено[3,2-b]пиридин-2-ил]-бензальдегида по методике, аналогичной примеру 17. ЖХ-МС: 459(МН+); ВЭЖХ ВУ: 3,48 мин. Пример 55. 2-4-[7-(1 Н-Индол-5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензиламино-этанол Указанное в заголовке соединение получали из 2-аминоэтанола и 4-[7-(1 Н-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]-бензальдегида по методике, аналогичной примеру 17. ЖХ-МС: 415 (МН+); ВЭЖХ ВУ: 3,40 мин. Пример 56. Амид 1-4-[7-(1 Н-индол-5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензил-пиперидин-4 карбоновой кислоты Указанное в заголовке соединение получали из амида пиперидин-4-карбоновой кислоты и 4-[7-(1 Ниндол-5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензальдегида по методике, аналогичной примеру 17. ЖХМС: 482 (МН+); ВЭЖХ ВУ: 3,56 мин. Пример 57. N-4-[7-(1 Н-Индол-5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензил-N',N'-диметилгексан-1,6-диамин Указанное в заголовке соединение получали из N,N-диметилгексан-1,6-диамина и 4-[7-(1 Н-индол 5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензальдегида по методике, аналогичной примеру 17. ЖХ-МС: 498 (МН+); ВЭЖХ ВУ: 3,93 мин. Пример 58. 2-(4-[7-(1 Н-Индол-5-иламино)-тиено[3,2-b]пиридин-2-ил]-бензил-метиламино)этанол Указанное в заголовке соединение получали из метиламиноэтанола и 4-[7-(1 Н-индол-5-иламино)тиено[3,2-b]пиридин-2-ил]-бензальдегида по методике, аналогичной примеру 17. ЖХ-МС: 429 (МН+): ВЭЖХ ВУ: 3,53 мин. Пример 59. (1 Н-Индол-5-ил)-(2-4-[(2-пиперазин-1-ил-этиламино)-метил]-фенил-тиено[3,2-b]пиридин-7-ил)-амин- 26005889 Указанное в заголовке соединение получали из 2-пиперазин-1-илэтиламина и 4-[7-(1 Н-индол-5 иламино)-тиено[3,2-b]пиридин-2-ил]-бензальдегида по методике, аналогичной примеру 17. ЖХ-МС: 483(МН+); ВЭЖХ ВУ: 3,41 мин. Пример 60. (1 Н-Индол-5-ил)-(2-пиридин-2-ил-тиено[3,2-b]пиридин-7-ил)-амин В герметично закрывающейся пробирке объединяли (2-бромтиено[3,2-b]пиридин-7-ил)-(1 Н-индол 5-ил)-амин (150 мг, 0,29 ммоль) и 2-(трибутилстаннил)пиридин (118 мг, 1,1 ммоль) в 3 мл диметилформамида вместе с иодидом меди (3 мг, 0,015 ммоль). Через этот раствор пропускали азот, добавляли транс-бензил(хлор)бис-(трифенилфосфин)палладий(II) (33 мг, 0,044 ммоль), пробирку герметично закрывали и нагревали до 90 С. Через 14 ч раствор охлаждали и концентрировали досуха. Хроматографией на 15 г силикагеля с использованием смеси СН 2 Сl2/МеОН (5-20%) получали 30,3 мг (28%) указанного в заголовке соединения. ЖХ-МС: 343 (МН+); ВЭЖХ ВУ: 3,94 мин. Пример 61. 2-Метокси-N-(4-фенил)-N'-(6-фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамин К 4-хлор-6-фенилтиено[3,2-d]пиримидину (150 мг, 0,608 ммоль) в трет-бутаноле (2,5 мл) и дихлорэтане (2,5 мл) добавляли 2-метокси-N-(4-фенил)-бензол-1,4-диамин (130 мг, 0,608 ммоль), и смесь нагревали на масляной бане при 80 С в течение ночи. Реакцию охлаждали до температуры окружающей среды и добавляли изопропиловый эфир. Продукт отфильтровывали с получением желтовато-коричневого тврдого вещества (200 мг, выход 78%). ОФ 18-ВЭЖХ ВУ: 6,261 мин; МС ИАД: 424,52 (М+1); Т.пл.: 201203 С. (ОФ 18-ВЭЖХ - обращенно-фазовая С 18 ВЭЖХ МС ИАД - масс-спектрометрия с ионизацией при атмосферном давлении). Пример 62. N-(4-Метоксифенил)-N'-(6-фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамин К 4-хлор-6-фенилтиено[3,2-d]пиримидину (150 мг, 0,608 ммоль) в трет-бутаноле (2,5 мл) и дихлорэтане (2,5 мл) добавляли N-4-метоксиофенил)-бензол-1,4-диамин (152 мг, 0,608 ммоль), и смесь нагревали на масляной бане при 80 С в течение ночи. Реакционную смесь охлаждали до температуры окружающей среды и добавляли изопропиловый эфир. Продукт отфильтровывали с получением желтоватокоричневого тврдого вещества (248 мг, выход 96%). ОФ 18-ВЭЖХ ВУ: 6,228 мин; МС ИАД: 424,52(М+1); Т.пл.:210-211 С. Пример 63. А. Получение N-м-толилбензол-1,4-диамина К смеси 4-нитрофторбензола (250 мг, 1,77 ммоль) и 3-метиланилина (190 мг, 1,77 ммоль) в 4 мл воды в герметично закрывающейся пробирке добавляли оксид магния (86 мг, 2,126 ммоль). Суспензию перемешивали при 200 С в течение 2 дней. Реакционную смесь охлаждали до температуры окружающей среды, суспензию разбавляли водой и для удаления нерастворимого материала фильтровали. Водный слой экстрагировали 3 раза этилацетатом (50 мл), объединенные органические слои промывали бороновой кислотой (5%, 50 мл) и водой, сушили над сульфатом магния и концентрировали под вакуумом с получением (4-нитрофенил)-м-толиламина (190 мг, выход 47%). ОФ 18-ВЭЖХ ВУ: 7,020 мин; МС ИАД: 229,20 (М+1). В склянке Парра к раствору (4-нитрофенил)-м-толиламина (180 мг, 0,788 ммоль) в толуоле (10 мл) добавляли 18 мг палладия на углероде (10%). Смесь гидрировали при давлении 35 фунтов на кв. дюйм(240 кПа), встряхивая в течение 12 ч, а затем фильтровали и концентрировали под вакуумом с получением N-(6-фенилтиено[3,2-d]пиримидин-4-ил)-N'-м-толилбензол-1,4-диамина с количественным выходом в виде жлтого тврдого вещества. МС ИАД: 199,20 (М+1). Б. N-(6-Фенилтиено[3,2-d]пиримидин-4-ил)-N'-м-толилбензол-1,4-диамин По методике, аналогичной описанной в примере 61, указанное в заголовке соединение получали изN-м-толил-бензол-1,4-диамина (230 мг, 1,16 ммоль) и 4-хлор-6-фенилтиено[3,2-d]пиримидина (250 мг,1,16 ммоль) с выходом 21%. ОФ 18-ВЭЖХ ВУ: 7,432 мин; МС ИАД: 409,1 (М+1); Т.пл. 170-171 С. Пример 64. А. Получение N'-п-толилбензол-1,4-диамина К смеси 4-нитрофторбензола (250 мг, 1,77 ммоль) и 4-аминотолуола (195 мл, 1,77 ммоль) в 4 мл воды в герметично закрытой пробирке добавляли оксид магния (86 мг, 2,126 ммоль). Суспензию перемешивали при 200 С в течение 2 дней. Реакционную смесь охлаждали до температуры окружающей среды,суспензию разбавляли водой и для удаления нерастворимого материала фильтровали. Водный слой экстрагировали 3 раза этилацетом (50 мл), объединенные органические слои промывали бороновой кислотой(5%, 50 мл) и водой, сушили над сульфатом магния и концентрировали под вакуумом с получением (4 нитрофенил)-п-толиламина (190 мг, выход 47%). МС ИАД: 229,20 (М+1). В склянке Парра к раствору (4-нитрофенил)-п-толиламина (180 мг, 0,788 ммоль) в толуоле (10 мл) добавляли 18 мг палладия на углероде (10%). Смесь гидрировали при давлении 35 фунтов на кв. дюйм(240 кПа), встряхивая в течение 12 ч, а затем фильтровали и концентрировали под вакуумом с получением N-(6-фенилтиено[3,2-d]пиримидин-4-ил)-N'-п-толилбензол-1,4-диамина с количественным выходом в виде жлтого тврдого вещества. МС ИАД: 199,20 (М+1).- 27005889 Б. N-(6-Фенилтиено[3,2-d]пиримидин-4-ил)-N'-п-толилбензол-1,4-диамин По методике, аналогичной описанной в примере 61, указанное в заголовке соединение получали изN-м-толилбензол-1,4-диамина (100 мг, 0,45 ммоль) и 4-хлор-6-фенилтиено[3,2-d]пиримидина (80 мг, 0,45 ммоль) с выходом 27%. ОФ 18-ВЭЖХ ВУ: 7,468 мин; МС ИАД: 409,1 (М+1); Т.пл. 221-222 С. Пример 65. А. Получение 2,3-диметокси-N-(4-фенил)-бензол-1,4-диамина По методике, описанной в примере 63, это промежуточное соединение получали с общим выходом 40% из 4-нитрофторбензола (376 мг, 3,54 ммоль) и 4-амино-1,2-диметоксибензола (542 мг, 3,54 ммоль) с последующим гидрированием в этаноле. ОФ 18-ВЭЖХ ВУ: 6,10 мин; МС ИАД: 245,10 (М+1). Б. N-(3,4-диметоксифенил)-N'-(6-фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамин По методике, аналогичной описанной в примере 61, указанное в заголовке соединение получали из добавляемого 2,3-диметокси-N-(4-фенил)-бензол-1,4-диамина (191 мг, 0,696 ммоль) и 4-хлор-6-фенилтиено[3,2-d]пиримидина (172 мг, 0,696 ммоль) с выходом 21%. ОФ 18-ВЭЖХ ВУ: 6,512 мин; МС ИАД: 454,55 (М+1); Т.пл. 160-161 С. Пример 66. А. Получение N-(3-метоксифенил)-бензол-1,4-диамина По методике, описанной в примере 63, это промежуточное соединение получали с общим выходом 53% из 4-нитрофторбензола (199 мг, 1,77 ммоль) и 3-метоксианилина (250 мг, 1,77 ммоль) с последующим гидрированием в этаноле. МС ИАД: 215,28 (М+1). Б. N-(3-метоксифенил)-N'-(6-фенилтиено[3.2-d]пиримидин-4-ил)-бензол-1,4-диамин По методике, аналогичной описанной в примере 61, указанное в заголовке соединение получали из(100 мг, 0,405 ммоль) с выходом 17%. ОФ 18-ВЭЖХ ВУ: 6,833 мин; МС ИАД: 425,53 (М+1); Т.пл. 189191 С. Пример 67. А. Получение N-(4-(N,N-диметил)-аминфенил)-бензол-1,4-диамина По методике, описанной в примере 63, указанное в заголовке промежуточное соединение получали из 4-нитрофторбензола (250 мг, 1,77 ммоль) и 4-(N,N-диметил)-аминанилина (228 мг, 1,77 ммоль) с последующим гидрированием в этаноле; общий выход 44%. ОФ 18-ВЭЖХ ВУ: 5,25 мин; МС ИАД: 215,28(М+1). Б. 4-(N,N-диметиламин)-N-(4-фенил)-N'-(6-фенилтиено[3.2-d]пиримидин-4-ил)-бензол-1,4-диамин По методике, аналогичной описанной в примере 61, указанное в заголовке соединение получали из добавляемого N-(4-(N,N-диметил)-аминфенил)-бензол-1,4-диамина (100 мг, 0,405 ммоль) и 4-хлор-6 фенилтиено[3,2-d]пиридина (93 мг, 0,405 ммоль) с выходом 31%. ОФ 18-ВЭЖХ ВУ: 7,056 мин; МС ИАД: 438,45 (М+1); Т.пл. 198-199 С. Пример 68. А. Получение 2-метил-5-аминоиндола К смеси 2-метил-5-нитроиндола (200 мг, 1,13 ммоль) и палладия на углероде (20 мг, 10%) в 10 мл этанола добавляли гидразин (100 мг, 3,4 ммоль) и нагревали при 80 С в течение 16 ч. Реакционную смесь фильтровали через целит и концентрировали под вакуумом с получением красно-коричневого тврдого вещества, которое использовали без дальнейшей очистки. ОФ 18-ВЭЖХ ВУ: 1,278 мин; МС ИАД: 147,1(М+1). Б. (2-метил-1 Н-индол-5-ил)-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амин В герметично закрывающейся пробирке растворяли 2-фенил-7-хлортиено[3,2-b]пиридин (150 мг,0,608 ммоль) в 15 мл дихлорэтана и 15 мл трет-бутилового спирта. Затем добавляли 2-метил-5 аминоиндол (89 мг, 0,608 ммоль), пробирку герметично закрывали и содержимое нагревали при 85 С в течение 36 ч. Раствор охлаждали и фильтровали, тврдое вещество промывали метиленхлоридом и сушили под вакуумом с получением 123 мг (выход 61%) указанного в заголовке соединения. ОФ 18-ВЭЖХ ВУ: 5,407 мин; МС ИАД: 357,1 (М+1). Т.пл. 218-220 С. Пример 69. А. Получение 1-бензолсульфонил-1 Н-индол-5-ил амина К смеси 5-нитроиндола (30 г, 185 ммоль) в сухом ТГФ (300 мл) добавляли трет-бутилат калия(24,26 г, 204 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем одной порцией добавляли бензолсульфонилхлорид (28,33 г, 222 ммоль), при этом цвет реакционной смеси изменялся от чисто чрного до оранжевого. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь распределяли между водой и этилацетом, и водный слой экстрагировали 3 раза этилацетатом. Органические экстракты объединяли, сушили над сульфатом магния и концентрировали под вакуумом. Сырой остаток перекристаллизовывали из гексана с получением 50 г (91%) промежуточного нитросоединения. ОФ 18-ВЗЖХ ВУ: 5,13 мин. Это промежуточное нитросоединение растворяли в 90 мл ТГФ и добавляли палладий на углероде(500 мг, 10%). Смесь гидрировали при комнатной температуре при давлении 1,2 атмосферы. Реакционную смесь фильтровали и концентрировали под вакуумом с получением указанного в заголовке соедине- 28005889 ния в виде жлтого остатка, который использовали без дополнительной очистки. ОФ 18-ВЭЖХ ВУ: 4,251 мин. Б. Получение [1-бензолсульфонил-1 Н-индол-5-ил]-(6-фенилтиено[3,2-d]пиримидин-4-иламина В герметично закрывающейся пробирке в 15 мл дихлорэтана и 15 мл трет-бутилового спирта растворяли 2-фенил-7-хлортиено[3,2-b]пиримидин (1000 мг, 4,05 ммоль). Затем добавляли 1-бензолсульфонил-1 Н-индол-5-иламин (1100 мг, 4,05 ммоль), пробирку герметично закрывали и содержимое нагревали при 85 С в течение 36 ч. Раствор охлаждали и фильтровали, тврдое вещество промывали метиленхлоридом и сушили под вакуумом с получением 1723 мг (выход 89%) указанного в заголовке соединения. ОФ 18-ВЭЖХ ВУ: 6,629 мин; МС ИАД: 483,45 (М+1). В. [1-(2-Морфолин-4-илэтил)-1 Н-индол-5-ил]-(6-фенилтиено[3,2-d]пиримидин-4-иламин К суспензии NaH (486 мг, 0,642 ммоль) в диоксане добавляли [1-бензолсульфонил-1 Н-индол-5-ил](6-фенилтиено[3,2-d]пиримидин-4-ил)-амин (246 мг, 1,00 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем добавляли гидроксиэтилморфолин (46 мг, 1,0 ммоль) и реакционную смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь распределяли между водой и этилацетатом и водный слой экстрагировали 3 раза этилацетатом. Органические экстракты объединяли, сушили над сульфатом магния и концентрировали под вакуумом. Сырой остаток хроматографировали на силикагеле с использованием смеси 1% метанола/метиленхлорид с получением 26 мг (16%) указанного в заголовке соединения. ОФ 18-ВЭЖХ ВУ: 5,586 мин: МС ИАД: 342,43(М+1) Т.пл. 225-226 С. Пример 70. [1-(3-Диэтиламинопропил)-1 Н-индол-5-ил]-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амин Указанное в заголовке соединение получали из [1-бензолсульфонил-1 Н-индол-5-ил]-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амина (246 мг, 1,00 ммоль) и диэтиламинопропанола (120 мг, 0,939 ммоль) по методике, аналогичной примеру 69. ОФ 18-ВЭЖХ ВУ: 4,55 мин; МС ИАД: 455,63 (М+1) Т.пл. 178180 С. Пример 73. А. Получение N-(6-фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамина В герметично закрытой пробирке в 15 мл дихлорэтана и 15 мл трет-бутилового спирта растворяли 2-фенил-7-хлортиено[3,2-b]пиримидин (500 мг, 2,026 ммоль). Затем добавляли 4-нитроанилин (279 мг,2,026 ммоль), пробирку герметично закрывали и содержимое нагревали при 85 С в течение 36 ч. Раствор охлаждали и фильтровали, тврдое вещество промывали метиленхлоридом и сушили под вакуумом с получением 400 мг (57% выход) указанного в заголовке соединения. ОФ 18-ВЭЖХ ВУ: 5,46 мин: МС ИАД: 357,38 (М+1) Т.пл. 210-211 С. К смеси (4-нитрофенил)-(6-фенилтиено[3,2-с 1]пиримидин-4-ил)-амина (400 мг, 1,48 ммоль) и палладия на углероде (40 мг, 10%) в 10 мл этанола добавляли гидразин (200 мг, 3,4 ммоль) и нагревали при 80 С в течение 16 ч. Реакционную смесь фильтровали через целит, концентрировали под вакуумом с получением красно-коричневого тврдого вещества, которое использовали без дальнейшей очистки. ОФ 18 ВЭЖХ ВУ: 4,815 мин; МС ИАД: 319,38 (М+1). Б. N-(2-Бензилоксиэтил)-N'-(6-Фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамин Указанное в заголовке соединение получали из бензилоксиацетальдегида (12 мг, 0,079 ммоль) и N(6-фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамина (150 мг, 0,471 ммоль) по методике, аналогичной примеру 17. ОФ 18-ВЭЖХ ВУ: 7,062 мин; МС ИАД: 452,58 (М+1). Т.пл. 201-203 С. Пример 74. 5-(6-Фенилтиено[3,2-d]пиримидин-4-иламино)-1 Н-индол-3-карбальдегид К раствору (1 Н-Индол-5-ил)-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амина (481 мг, 1,4 ммоля) в 3 мл метиленхлорида в 3-х горлой колбе через капельную воронку в токе азота при 0 С по каплям добавляли тетрахлорид титана (461 мл, 4,2 ммоль). Смесь перемешивали в течение 30 мин, а затем по каплям добавляли дихлорметоксиметан (380 мл, 4,2 ммоль). Реакционную смесь подогревали до комнатной температуры и концентрировали под вакуумом. Полученный остаток предварительно адсорбировали на силикагеле (10 гм) и очищали флэш-хроматографией с использованием смеси 5% метанол/метиленхлорид с получением указанного в заголовке соединения с выходом 92%. ОФ 18-ВЭЖХ ВУ: 4,80 мин. МС ИАД: 371,20 (М+1): Т.пл. 174-175 С. Пример 75. (3-Бром-1 Н-индол-5-ил)-(6-фенил-тиено[3,2-d]пиримидин-4-ил)-амин К раствору (1 Н-Индол-5-ил)-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амина (150 мг, 0,438 ммоль) в метиленхлориде добавляли N-бромсукцинимид (86 мг, 0,482 ммоль). Реакционную смесь перемешивали в течение 2 дней при комнатной температуре, а затем концентрировали под вакуумом. Оранжевый остаток хроматографировали препаративной ВЭЖХ с обращенной фазой, используя 200 нМ ацетатный буфер и градиент ацетонитрила, с получением чистого продукта (выход 17%). ОФ 18-ВЭЖХ ВУ: 6,377 мин; МС ИАД: 371,2 (М+1); Т.пл. 201-203 С. Пример 76. N-(1 Н-Индол-3-илметил)-N'-(6-фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамин Указанное в заголовке соединение получали из 1 Н-индол-3-карбальдегида (12 мг, 0,079 ммоль) и N(6-фенилтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамина (150 мг, 0,471 ммоль) по методике, аналогичной примеру 73. ОФ 18-ВЭЖХ ВУ: 6,932 мин: МС ИАД: 448,20 (М+1) Т.пл. 259-261 С.- 29005889 Пример 77. N-(6-Бромтиено[3,2-d]пиримидин-4-ил)-N'-(4-метоксифенил)-бензол-1,4-диамин. Указанное соединение получали из 2-бром-7-хлортиено[3,2-b]пиридина (1,8 г, 7,25 ммоль) и N-(4 метоксифенил)-бензол-1,4-диамина (1,7 мг, 0,767 ммоль) по методике, аналогичной примеру 1. ОФ 18 ВЭЖХ ВУ: 5,75 мин: МС ИАД: 426,26 (М+1). Пример 78. N-(4-Метоксифенил)-N'-[6-(2-нитрофенил)-тиено[3,2-d]пиримидин-4-ил]-бензол-1,4 диамин. Указанное в заголовке соединение получали из 2-нитробензолбороновой кислоты и N-(6-бромтиено[3,2-с 1]пиримидин-4-ил)-N'-(4-метоксифенил)-бензол-1,4-диамина по методике, аналогичной примеру 2. Т.пл. 228-237 С; ЖХ-МС: 383,56 (МН+); ВЭЖХ ВУ: 6,885 мин. Пример 79. N-(4-Метоксифенил)-N'-[6-(4-метоксифенил)-тиено[3,2-d]пиримидин-4-ил]-бензол-1,4 диамин Указанное в заголовке соединение получали из 2-метоксибензолбороновой кислоты и N-(6-бромтиено[3,2-d]пиримидин-4-ил)-N'-(4-метоксифенил)-бензол-1,4-диамина по методике, аналогичной примеру 2. Т.пл. 159-169 С; ЖХ-МС: 454,31 (МН+); ВЭЖХ ВУ: 7,003 мин. Пример 80. N-(4-Метоксифенил)-N'-[6-(6-метоксипиридин-3-ил)-тиено[3,2-d]пиримидин-4-ил]бензол-1,4-диамин Указанное в заголовке соединение получали из 2-метоксипиридил-5-бороновой кислоты и N-(6 бромтиено[3,2-d]пиримидин-4-ил)-N'-(4-метоксифенил)-бензол-1,4-диамина по методике, аналогичной примеру 2. Т.пл. 149-159 С: ЖХ-МС: 455,29 (МН+); ВЭЖХ ВУ: 6,747 мин. Пример 81. N-(4-Метоксифенил)-N'-(6-тиофен-2-илтиено[3,2-d]пиримидин-4-ил)-бензол-1,4-диамин Указанное в заголовке соединение получали из 2-тиофенбороновой кислоты и N-(6-бромтиено[3,2-d]пиримидин-4-ил)-N'-(4-метоксифенил)-бензол-1,4-диамина по методике, аналогичной примеру 2. Т.пл. 231-240 С; ЖХ-МС: 431 (МН+); ВЭЖХ ВУ: 6,740 мин. Пример 82. (3-Метил-1 Н-индол-5-ил)-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амин К суспензии 5-(6-фенилтиено[3,2-d]пиримидин-4-иламино)-1 Н-индол-3-карбальдегида (75 мг, 0,203 ммоль) в 5 мл метиленхлорида добавляли иодид цинка (97 г, 0,303) и цианборгидрид натрия (97 мг, 1,522 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 24 ч, охлаждали до температуры окружающей среды и вливали в ледяной насыщенный раствор хлорида аммония. Затем этот раствор нейтрализовали 6 н. HCl и экстрагировали этилацетатом (3 раза, 50 мл). Органические экстракты сушили над сульфатом магния и концентрировали под вакуумом. Остаток хроматографировали, используя систему Biotage Autoflash 40 и смесь 1% MeOH/CH2Cl2, с получением указанного в заголовке соединения (22 мг, выход 31%). ОФ 18-ВЭЖХ ВУ: 6,071 мин; МС ИАД: 357,10 (М+1); Т.пл. 221-223 С. Пример 83. N-(4-Метоксифенил)-N'-[2-(3-нитрофенил)-тиено[3,2-b]пиридин-7-ил]-бензол-1,4-диамин Указанное в заголовке соединение получали из 2-нитробензолбороновой кислоты и N-(6-бромтиено[3,2-d]пиридин-4-ил)-N'-(4-метоксифенил)-бензол-1,4-диамина по методике, аналогичной примеру 2. Т.пл. 175-184 С; ЖХ-МС: 455,29 (МН+); ВЭЖХ ВУ: 6,646 мин. Пример 84. (7-Метокси-1 Н-индол-5-ил)-(2-фенилтиено[3,2-b]пиридин-7-ил)-амин Указанное в заголовке соединение получали в соответствии с методикой, которая аналогична методикам, приведнным в предыдущих прмерах. Пример 85. N-(4-Метоксифенил)-N'-тиено[3,2-d]пиримидин-4-илбензол-1,4-диамин Указанное соединение получали из 7-хлортиено[3,2-b]пиридина (3,65 г, 14,64 ммоль) и N-(4 метоксифенил)-бензол-1,4-диамина (3,13 г, 14,64 ммоль) по методике, аналогичной примеру 1. ОФ 18 ВЭЖХ ВУ: 6,070 мин; Т.пл. 181-186 С; МС ИАД:428(М+1). Пример 86. (1 Н-Индол-5-ил)-[6-(6-метоксипиридин-3-ил)-тиено[3,2-d]пиримидин-4-иламин В герметично закрывающейся пробирке объединяли (2-бромтиено[3,2-b]пиримидин-7-ил)-(1 Ниндол-5-ил)-амин (150 мг, 0,29 ммоль) и 3-пиридилдиэтилборан (133 мг, 0,869 ммоль) в 3 мл диметилформамида вместе с иодидом меди (3 мг, 0,015 ммоль). Через этот раствор пропускали азот и добавляли транс-бензил(хлор)бис-трифенилфосфин)палладий (II) (33 мг, 0,044 ммоль), пробирку герметично закрывали и нагревали до 90 С. Через 14 ч раствор охлаждали и концентрировали досуха. При помощи хроматографии на 15 г силикагеля с использованием смеси СН 2 Сl2/МеОН (5-20%) получали 71 мг (44%) указанного в заголовке соединения. ЖХ-МС: 374(МН+); Т.пл. 243-249 С: ВЭЖХ ВУ: 5,396 мин. Пример 87. N-(4-Метоксифенил)-N'-[2-(6-метоксипиридин-3-ил)-тиено[3,2-b]пиридин-7-ил]-бензол 1,4-диамин Указанное в заголовке соединение получали из 2-метоксипиридил-5-бороновой кислоты и N-(6 бромтиено[3,2-d]пиридин-4-ил)-N'-(4-метоксифенил)-бензол-1,4-диамина по методике, аналогичной примеру 2. Т.пл. 175-184 С; ЖХ-МС: 455,29 (МН+); ВЭЖХ ВУ: 6,646 мин. Пример 88. (6-Хлор-1 Н-индол-5-ил)-(6-фенилтиено[3,2-d]пиримидин-4-ил)-амин. Указанное в заголовке соединение получали в соответствии с методикой, которая аналогична методикам, приведнным в предыдущих прмерах.
МПК / Метки
МПК: A61K 31/505, C07D 495/04
Метки: тиенопиримидина, агентов, противораковых, качестве, тиенопиридина, полезные, производные
Код ссылки
<a href="https://eas.patents.su/30-5889-proizvodnye-tienopirimidina-i-tienopiridina-poleznye-v-kachestve-protivorakovyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиенопиримидина и тиенопиридина, полезные в качестве противораковых агентов</a>
Предыдущий патент: Реагент для удаления асфальтеносмолопарафиновых отложений
Следующий патент: Способы лечения инфекций, вызываемых вирусом гепатита дельта, с использованием β-l-2′-дезоксинуклеозидов
Случайный патент: Соединительная головка для асептической подачи жидких, и/или полужидких , и/или порошкообразных веществ в протекающую среду












