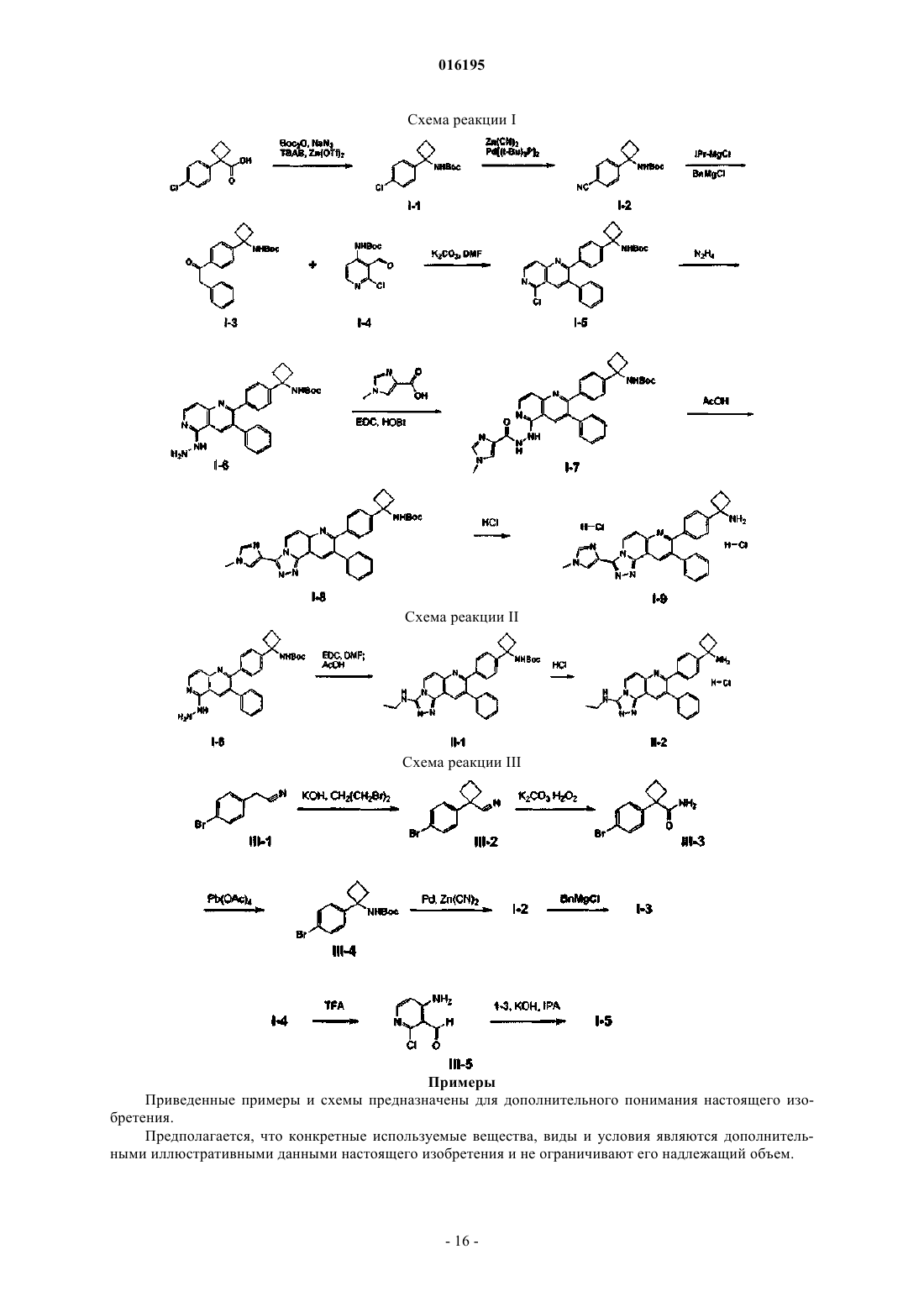
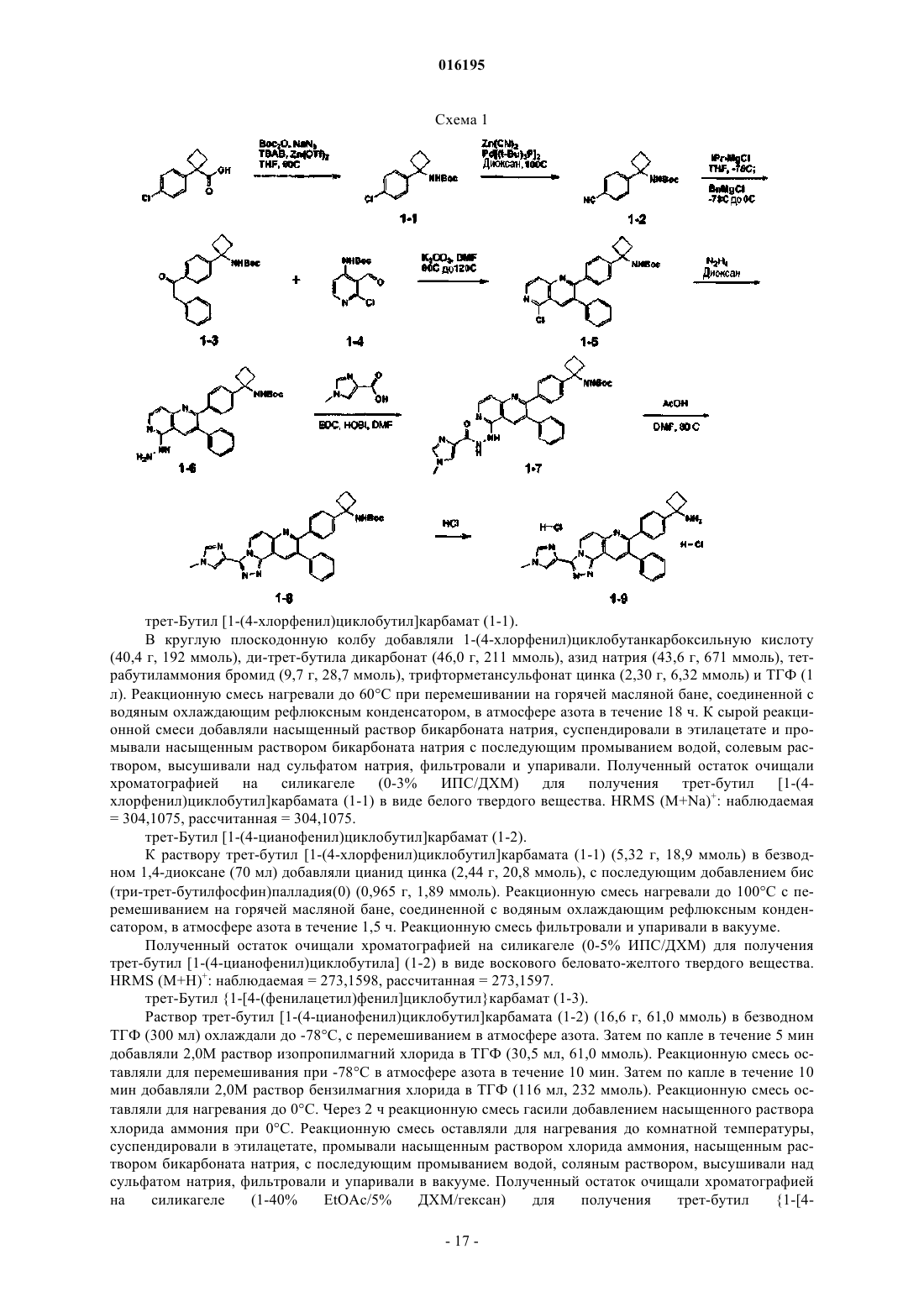
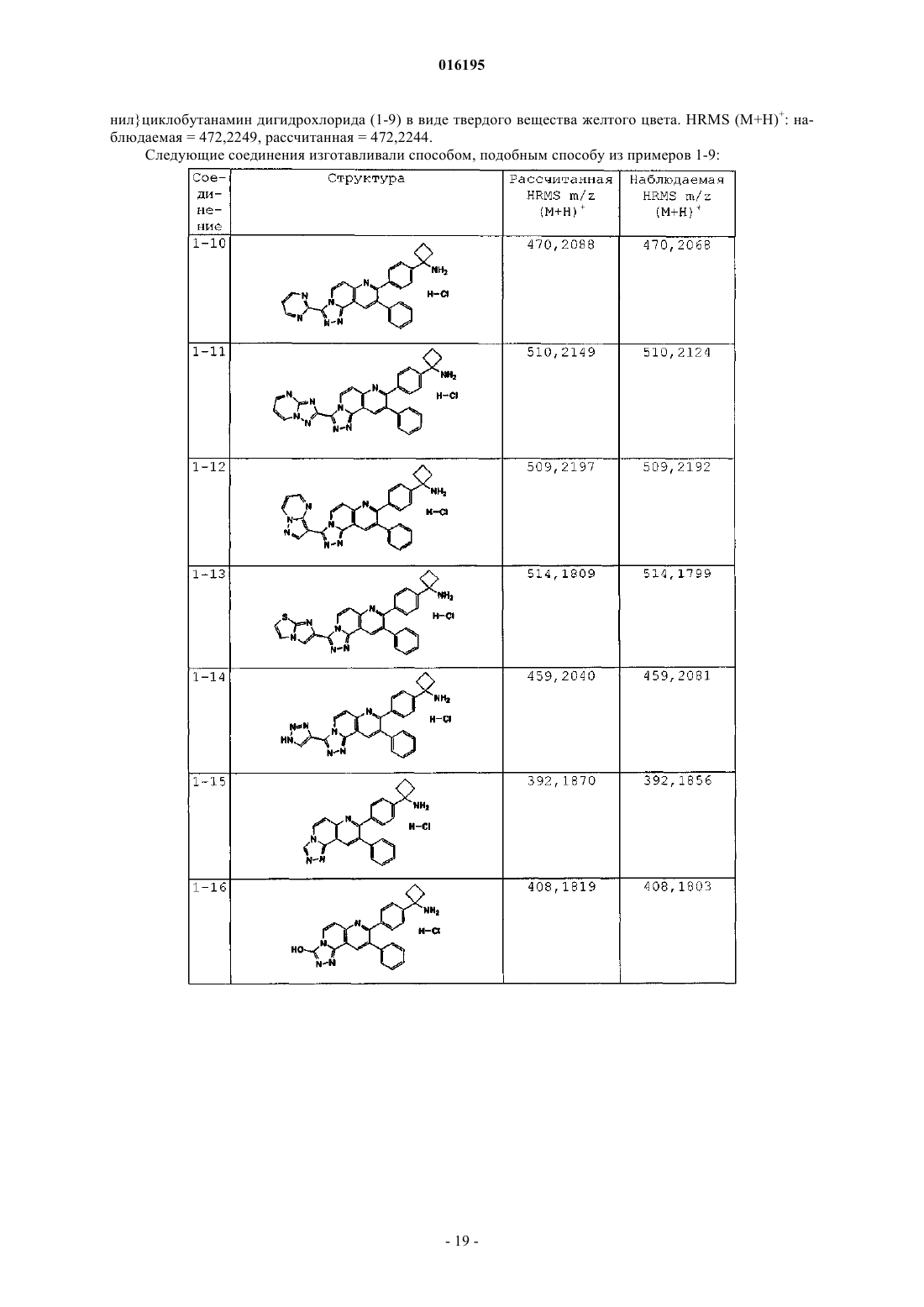
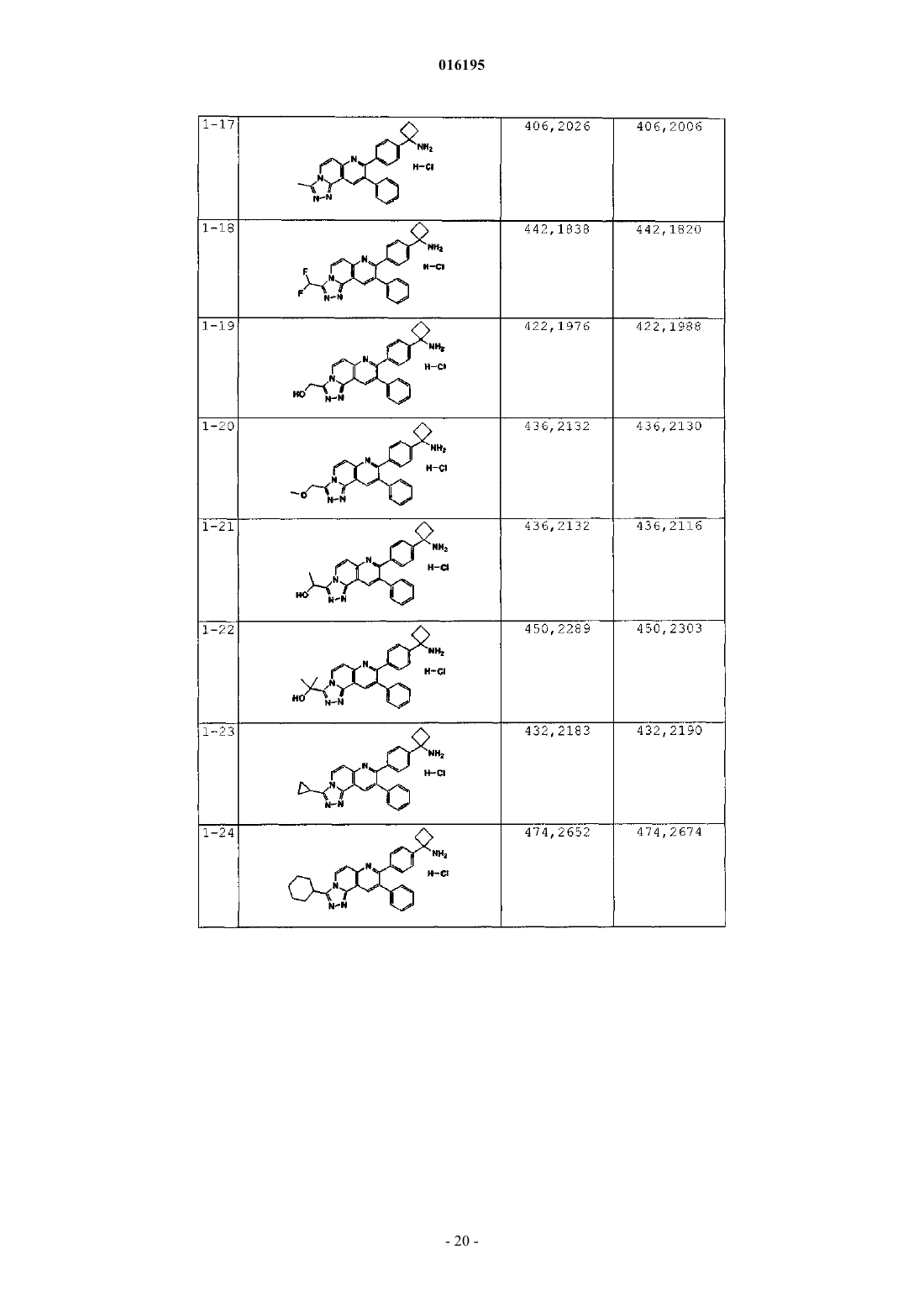
Ингибиторы действия akt
Номер патента: 16195
Опубликовано: 30.03.2012
Авторы: Келли Майкл Дж.III, Сандерсон Филип Э., Лейтон Марк Э.
Формула / Реферат
1. Соединение формулы C
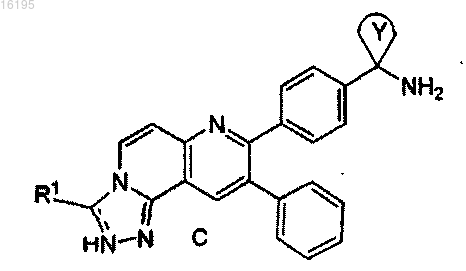
в котором пунктирная линия означает необязательную двойную связь;
кольцо Y представляет собой (C4-C7)циклоалкил; и
R1 выбирают из H, OH, оксо, (C1-C10)алкила, (C3-C8)циклоалкила, 3-10-членного моноциклического или бициклического ароматического или неароматического гетероциклила, содержащего от 1 до 4 гетероатомов, выбираемых из группы, состоящей из O, N и S, при этом указанные алкил, циклоалкил и ароматический или неароматический гетероциклил необязательно замещены одним или более заместителями, выбираемыми из R6; где
R6 представляет собой OH, ObC1-С10алкил (где b является 0 или 1), галоген;
или его фармацевтически приемлемая соль, таутомер или стереоизомер.
2. Соединение формулы E

в которой
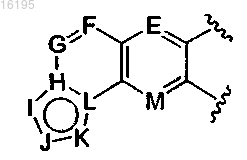
представляет собой
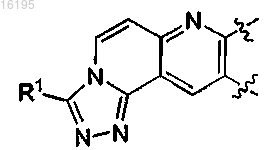
или
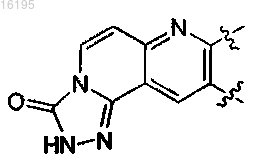
кольцо Y является циклобутилом;
R1 представляет собой H, пиримидил, метилимидазолил, OH, метил или циклопропил;
или его фармацевтически приемлемую соль.
3. Соединение, представляющее собой
1-{4-[3-(1-метил-1H-имидазол-4-ил)-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил]фенил}циклобутанамина дигидрохлорид;
или его фармацевтически приемлемую соль.
4. Соединение, представляющее собой
трет-бутил{1-[4-(9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутил}карбамат;
или его фармацевтически приемлемую соль.
5. Соединение, представляющее собой
1-[4-(9-фенил-3-пиримидин-2-ил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин;
или его фармацевтически приемлемую соль.
6. Соединение, представляющее собой
8-[4-(1-аминоциклобутил)фенил]-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3(2H)-он;
или его фармацевтически приемлемую соль.
7. Соединение, представляющее собой
1-[4-(3-метил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин;
или его фармацевтически приемлемую соль.
8. Соединение, представляющее собой
1-[4-(3-циклопропил-9-фенил[1,2,4]триазоло[3,4-f]-l,6-нафтиридин-8-ил)фенил]циклобутанамин;
или его фармацевтически приемлемую соль.
9. Фармацевтическая композиция, содержащая фармацевтический носитель и диспергированное в нем терапевтически эффективное количество соединения по п.1.
10. Применение соединения по п.1 для приготовления лекарственного средства, предназначенного для лечения и предупреждения рака у млекопитающего, нуждающегося в таком лечении.
Текст
Рассматриваемое изобретение относится к замещенным соединениям нафтиридина, которые ингибируют действие Akt. В частности, раскрыты соединения формулы C, селективно ингибирующие одну или две изоформы Akt. Настоящее изобретение также относится к композициям, содержащим указанные ингибирующие соединения, и к способам ингибирования действия Akt путем введения соединения больному, нуждающемуся в лечении рака.(71)(73) Заявитель и патентовладелец: МЕРК ШАРП ЭНД ДОМЭ КОРП. 016195 Уровень техники Настоящее изобретение относится к замещенным соединениям нафтиридина, которые являются ингибиторами действия одной или больше изоформ серин/треонин киназы, Akt (также называемой PKB; далее в настоящем изобретении называемой "Akt"). Настоящее изобретение также относится к фармацевтическим композициям, содержащим такие соединения, и к способам применения предложенных соединений при лечении рака. Апоптоз (запрограммированная смерть клетки) играет значительную роль в эмбриональном развитии и патогенезе различных заболеваний, таких как дегенеративные заболевания нервной системы, сердечно-сосудистые заболевания и рак. Результатом работы последних лет стала идентификация ряда прои антиапоптозных генных продуктов, вовлеченных в регуляцию или осуществление запрограммированной смерти клетки. Экспрессия антиапоптозных генов, таких как Bcl2 или Bcl-xL, ингибирует апоптозную смерть клетки, вызванную разными стимулами. С другой стороны, экспрессия проапоптозных генов, таких как Bax или Bad, приводит к запрограммированной смерти клетки (Adams et al. Science, 281: 1322-1326 (1998. Осуществление запрограммированной смерти клетки опосредуется каспаза-1 связанными протеиназами, включающими каспазу-3, каспазу-7, каспазу-8 и каспазу-9 и т.д. (Thornberryet al. Science, 281: 1312-1316 (1998. Обнаружено, что пути фосфатидилинозитол-3'-OH киназы (PI3K)/ Akt имеют большое значение для регуляции клеточной смерти/выживания клетки (Kulik et al. Mol. Cell. Biol. 17: 1595-1606 (1997); Frankeet al., Cell, 88: 435-437 (1997); Kauffmann-Zeh et al. Nature 385: 544-548 (1997) Hemmings Science, 275: 628-630 (1997); Dudek et al., Science, 275: 661-665 (1997. Факторы выживаемости, такие как фактор роста тромбоцитов (ФРТ), фактор роста нерва (ФРН) и инсулиноподобный фактор роста-1 (ИФР-1), способствуют выживаемости клетки в различных условиях путем индукции действия PI3K (Kulik et al. 1997,Hemmings 1997). Активация PI3K ведет к продукции фосфатидилинозитол(3,4,5)-трифосфата (PtdIns(3,4,5)-P3), который в свою очередь связывается с серин/треонин киназой Akt, содержащей плекстрингомологичный домен (ПГ), и способствует ее активации (Franke et al. Cell, 81: 727-736 (1995); HemmingsScience, 277: 534 (1997); Downward, Curr. Opin. Cell Biol. 10: 262-267 (1998), Alessi et al., EMBO J. 15: 6541-6551 (1996. Специфичные ингибиторы PI3K, или доминантные отрицательные мутанты Akt устраняют действие стимуляции выживаемости у этих факторов роста или цитокинов. Ранее было раскрыто,что ингибиторы PI3K (LY294002 или вортманин) блокируют активацию Akt посредством upstream-киназ. Дополнительно, введение конститутивно активных мутантов PI3K или Akt способствует выживанию клетки в условиях, при которых обычно происходит апоптозная смерть клетки (Kulik et al. 1997, Dudek etal. 1997). Были идентифицированы три члена субсемейства Akt, регулируемых вторичным мессенджером серин/треонин протеинкиназ, именуемых Akt1/PKB, Akt2/PKB и Akt3/PKB (далее в настоящем изобретении называемых " Akt1", " Akt2" и " Akt3"), соответственно. Указанные изоформы являются гомологичными, в частности, в областях, которые кодируют каталитические домены. Изоформы Akt активируются посредством процессов фосфорилирования, происходящих в ответ на сигналы PI3K. PI3K фосфорилируют мембранные инозитолфосфолипиды, образуя вторичные мессенджеры фосфатидил-инозитол 3,4,5-трисфосфата и фосфатидилинозитол 3,4-бисфосфата, которые связываются с ПГ-доменом Akt. Рассматриваемая модель активации Akt предполагает рекрутинг фермента посредством 3'фосфорилированных фосфоинозитидов к мембране, где происходит фосфорилирование регуляторных сайтов Akt upstream-киназами (B.A. Hemmings, Science 275: 628-630 (1997); B.A. Hemmings, Science 276: 534 (1997); J. Downward, Science 279: 673-674 (1998. Фосфорилирование Akt 1 происходит на двух регуляторных сайтах, а именно, на Thr308 в каталитическом домене петли активации и на Ser473 вблизи карбоксильного конца (D. R. Alessi et al. EMBO J. 15: 6541-6551 (1996) and R. Meier et al. J. Biol. Chem. 272: 30491-30497 (1997. Такие же регуляторные сайты фосфорилирования встречаются в Akt 2 и Akt 3. Проводилось клонирование upstream-киназы, фосфорилирующей Akt на сайте петли активации, которая была названа 3'-фосфоинозитидзависимой протеинкиназой 1 (PDK1). PDK1 фосфорилирует не только Akt, но также p70 рибосомальную S6 киназу, p90RSK,сывороточную и глюкокортикоид-регулируемую киназы (SGK) и протеинкиназу C. До настоящего времени не идентифицирована upstream-киназа, фосфорилирующая регуляторный сайт Akt вблизи карбоксильного конца, но последние сообщения указывают на роль интегрин-связанной киназы (ILK-1), серин/треонин протеинкиназы или аутофосфорилирования. Анализ уровней Akt в человеческих опухолях показал сверхэспрессию Akt2 в значительном количестве случаев рака яичника (J.Q. Cheng et al. Proc. Natl. Acad. Sci. U.S.A. 89: 9267-9271 (1992 и рака поджелудочной железы (J.Q. Cheng et al. Proc. Natl. Acad. Sci. U.S.A. 93: 3636-3641 (1996. Аналогично,была выявлена сверэкспрессия Akt3 в клеточных линиях раковых клеток при раке молочной железы и простаты (Nakatani et al. J. Biol. Chem. 274: 21528-21532 (1999). Опухолевый супрессор PTEN, представляющий собой белковую и липидную фосфатазу, которая специфично удаляет 3'фосфат из PtdIns (3,4,5)-P3, является отрицательным регулятором пути PI3K/AktU.S.A. 96: 6199-6204 (1999. Мутации в зародышевой линии PTEN отвечают за проявление синдромов-1 016195 рака у человека, таких как болезнь Коудена (Liaw et al. Nature Genetics 16: 64-67 (1997. Делецию PTEN выявляют в большинстве человеческих опухолей и опухолевых клеточных линиях, при этом функционально PTEN не показывает повышение уровня активированного Akt (Li et al. supra, Guldberg et al. CancerResearch 57: 3660-3663 (1997), Risinger et al. Cancer Research 57: 4736-4738 (1997. Эти наблюдения показывают, что путь PI3K/Akt играет важную роль в регуляции выживаемости или апоптоза клетки при онкогенезе. Можно достичь ингибирования активации и действия Akt путем ингибирования PI3K ингибиторами, такими как LY294002 и вортманнином. Вместе с тем, ингибирование PI3K способно влиять на все без исключения три изозима Akt, а также другие содержащие ПГ-домены сигнальные молекулы, которые зависят от PdtIns (3,4,5)-P3, такие как Tec-семейство тирозинкиназ. Кроме того, было раскрыто, что Akt можно активировать сигналами роста, которые не зависят от PI3K. Альтернативно, действие Akt можно ингибировать путем блокирования действия upstream-киназыPDK1. Не существует раскрытых специфичных ингибиторов PDK1. В этом случае ингибирование PDK1 также будет приводить к ингибированию множественных протеинкиназ, активность которых зависит отPDK1, таких как атипичные изоформы PKC, SGK и S6 киназы (Williams et al. Curr. Biol. 10: 439-448(2000). Соединения рассматриваемого изобретения обладают неожиданными выгодными свойствами по сравнению с соединениями циклопропилзамещенного нафтиридина, подробно описанными в патентеWO 2006/135627. Задача, на решение которой направлено настоящее изобретение, состоит в обеспечении новых соединений, которые представляют собой ингибиторы Akt. Другой задачей настоящего изобретения является разработка фармацевтических композиций, которые содержат новые соединения, представляющие собой ингибиторы Akt. Еще одной задачей настоящего изобретения является способ лечения рака, который содержит введение указанных ингибиторов действия Akt. Сущность изобретения Настоящее изобретение обеспечивает соединения замещенного нафтиридина, которые ингибируют действие Akt. В частности, раскрытые в настоящем изобретении соединения селективно ингибируют одну или две изоформы Akt. Настоящее изобретение также обеспечивает композиции, содержащие такие ингибирующие соединения и способы ингибирования действия Akt путем введения соединения больному, нуждающемуся в лечении рака. Подробное описание изобретения Соединения настоящего изобретения полезны для ингибирования действия серин/треонин киназыAkt. В варианте осуществления ингибиторы рассматриваемого изобретения представляют собой соединения формулы C в котором пунктирная линия означает необязательную двойную связь; кольцо Y представляет собой (C4-C7)циклоалкил иR1 выбирают из H, OH, оксо, (C1-C10)алкила, (C3-C8)циклоалкила, 3-10-членного моноциклического или бициклического ароматического или неароматического гетероциклила, содержащего от 1 до 4 гетероатомов, выбираемых из группы, состоящей из O, N и S, при этом указанные алкил, циклоалкил и ароматический или неароматический гетероциклил необязательно замещены одним или более заместителями, выбираемыми из R6; гдеR6 представляет собой OH, ObC1-С 10 алкил (где b является 0 или 1), галоген; или его фармацевтически приемлемую соль, таутомер или стереоизомер. В другом варианте осуществления настоящего изобетения ингибиторы действия Akt представлены соединением формулы ER1 представляет собой H, пиримидил, метилимидазолил, OH, метил или циклопропил; или его фармацевтически приемлемой солью. Соединением рассматриваемого изобретения является соединение, представляющее собой 1-4-[3-(1-метил-1H-имидазол-4-ил)-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил]фенилциклобутанамина дигидрохлорид; или его фармацевтически приемлемую соль. Соединением рассматриваемого изобретения является соединение, представляющее собой трет-бутил 1-[4-(9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамат; или его фармацевтически приемлемую соль. Соединением рассматриваемого изобретения является соединение, представляющее собой: 1-[4-(9-фенил-3-пиримидин-2-ил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин; или его фармацевтически приемлемую соль. Соединением рассматриваемого изобретения является соединение, представляющее собой 8-[4-(1-аминоциклобутил)фенил]-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3(2H)-он; или его фармацевтически приемлемую соль. Соединением рассматриваемого изобретения является соединение, представляющее собой 1-[4-(3-метил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин; или его фармацевтически приемлемую соль. Соединением рассматриваемого изобретения является соединение, представляющее собой 1-[4-(3-циклопропил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин; или его фармацевтически приемлемую соль. Ещ одним объектом настоящего изобретения является фармацевтическая композиция, содержащая фармацевтический носитель, и диспергированное в ней терапевтически эффективное количество соединения формулы C. Другим объектом настоящего избртения является применение соединения по п.1 для приготовления лекарственного средства, предназначенного для лечения и предупреждения рака у млекопитающего, нуждающегося в таком лечении. Соединения настоящего изобретения могут иметь асимметричные центры, хиральные оси и хиральные плоскости (как описано в E.L. Eliel and S.H. Wilen, Stereochemistry of Carbon Compounds, JohnWileySons, New York, 1994, c. 1119-1190 и встречаться в виде рацематов, рацемических смесей и в виде отдельных диастереомеров, со всеми возможными своими изомерами и смесями, включающими оптические изомеры, и все из перечисленных стереоизомеров входят в объем настоящего изобретения. Дополнительно, раскрытые в настоящем изобретении соединения могут существовать в форме таутомеров, и предполагается, что обе таутомерные формы входят в объем настоящего изобретения даже в том случае, если приведено изображение только одной таутомерной структуры. Тетразолы существуют в виде смеси 1H/2H таутомеров. Таутомерные формы тетразольных групп также входят в объем рассматриваемого изобретения. Также предполагается, что настоящее изобретение охватывает пролекарства раскрываемых в нем соединений. Пролекарство любого из указанных соединений можно изготавливать, используя общеизвестные фармакологические технологии. Если какая-либо из переменных (например, R2 и т.д.) встречается чаще одного раза в любом элементе, ее определение в каждом случае является независимым от других случаев. Вместе с тем, комбинации заместителей и переменных допустимы только в случае, если такие комбинации создают устойчивые соединения. Линии, изображенные внутри кольцевых систем заместителей, обозначают, что указанную связь можно присоединить к любому из замещаемых атомов кольца. Если кольцевая система является бициклической, предполагается, что указанная связь присоединяется к любому из подходящих атомов на любом кольце бициклической группы. Подразумевается, что в соединения рассматриваемого изобретения специалист в данной области техники может включать один или более атомов кремния (Si) вместо одного или более атомов углерода,для получения соединений, являющихся химически устойчивыми, которые можно легко синтезировать способами, известными в данной области техники из общедоступных исходных материалов. Углерод и кремний отличаются по их ковалентному радиусу, что приводит к различиям в длине химической связи и стерической структуры при сравнении аналогичных связей C-элемента и Si-элемента. Эти различия приводят к едва уловимым изменениям размера и формы кремнийсодержащих соединений по сравнению с углеродсодержащими соединениями. Специалисту в данной области техники известно, что различия в размере и форме могут приводить к едва уловимым или значительным изменениям эффективности, растворимости, упаковочных свойств, к отсутствию активности в мишени и так далее (Diass, J.O. et al. Organometallics (2006) 5: 1188-1198; Showell, G.A. et al. BioorganicMedicinal Chemistry Letters (2006) 16: 2555-2558). Подразумевается, что рядовой специалист в данной области техники может выбирать заместители и замещающие структуры в соединениях рассматриваемого изобретения, чтобы получать химически устойчивые соединения, которые можно легко синтезировать способами, известными в данной области техники, а также способами, сформулированными ниже, из общедоступных исходных материалов. Если заместитель сам по себе замещается более чем одной группой, подразумевается, что эти множественные группы могут располагаться на одном и том же атоме углерода или на другом атоме углерода при условии получения устойчивой структуры. Выражение "необязательно замещенный одним или более заместителями" должно считаться эквивалентным выражению "необязательно замещенный по меньшей мере одним заместителем", и в таких случаях количество заместителей в предпочтительном варианте осуществления будет составлять от нуля до четырех, и более предпочтительный вариант осуществления будет иметь от нуля до трех заместителей. Используемый в настоящем изобретении термин "алкил" включает и разветвленные и линейные насыщенные алифатические углеводородные группы, имеющие определенное количество атомов углерода. Например, определено, что C1-C10, указанный в "(C1-C10)алкил", включает группы, имеющие 1, 2, 3, 4, 5,6, 7, 8, 9 или 10 атомов углерода в линейной или разветвленной структуре. Например, "(C1-C10)алкил" конкретно включает метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил,гептил, октил, нонил, децил и т.д. Термин "циклоалкил" означает моноциклическую насыщенную алифатическую углеводородную группу, имеющую определенное количество атомов углерода. Например, "циклоалкил" включает циклопропил, метилциклопропил, 2,2-диметилциклобутил, 2-этилциклопентил, циклогексил и т.д."Алкокси" представляет или циклическую или нециклическую алкильную группу указанного числа атомов углерода, соединенных кислородным мостиком. Таким образом, "алкокси" поэтому охватывает приведенные выше определения алкила и циклоалкила.-4 016195 Если не указано какое-либо число атомов углерода, термин "алкенил" относится к неароматическому углеводородному радикалу, прямому, разветвленному или циклическому, содержащему от 2 до 10 атомов углерода и по меньшей мере одну углерод-углеродную двойную связь. Предпочтительно присутствует одна углерод-углеродная двойная связь, и могут присутствовать до четырех неароматических углерод-углеродных двойных связей. Таким образом, "(C2-C10)алкенил" означает алкенильный радикал,имеющий от 2 до 10 атомов углерода. Алкенильные группы включают этенил, пропенил, бутенил, 2 метилбутенил и циклогексенил. Прямая, разветвленная или циклическая часть алкенильной группы может содержать двойные связи и может быть замещена, если указана замещенная алкенильная группа. Термин "алкинил" относится к прямому, разветвленному или циклическому углеводородному радикалу, содержащему от 2 до 10 атомов углерода и по меньшей мере одну углерод-углеродную тройную связь. Могут присутствовать до трех углерод-углеродных тройных связей. Таким образом, "(C2C10)алкинил" означает алкинильный радикал, имеющий от 2 до 10 атомов углерода. Алкинильные группы включают этинил, пропинил, бутинил, 3-метилбутинил и т.д. Прямая, разветвленная или циклическая часть алкинильной группы может содержать тройные связи и может быть замещена, если указана замещенная алкинильная группа. В некоторых случаях могут быть указаны заместители с количеством атомов углерода в диапазоне,который включает нуль, такие как (C0-C6)алкиленарил. Если присутствующий арил является фенилом,это определение будет включать непосредственно фенил, а также -CH2Ph, -CH2CH2Ph, CH(CH3)CH2CH(CH3)Ph и так далее. Используемый в настоящем изобретении термин "арил" означает любое устойчивое моноциклическое или бициклическое углеродное кольцо, имеющее до 7 атомов в каждом кольце, в котором по меньшей мере одно кольцо является ароматическим. Примеры таких арильных элементов включают фенил,нафтил, тетрагидронафтил, инданил и бифенил. В случаях, если арильный заместитель является бициклическим и одно кольцо является неароматическим, подразумевается, что присоединение происходит посредством ароматического кольца. Используемый в настоящем изобретении термин "гетероарил" представляет собой моноциклическое или бициклическое кольцо, имеющее до 7 атомов в каждом кольце, в котором по меньшей мере одно кольцо является ароматическим и содержит от 1 до 4 гетероатомов, выбираемых из группы, состоящей из O, N и S. Гетероарильные группы в рамках приведенного определения включают, без ограничения, акридинил, карбазолил, циннолинил, хиноксалинил, пирразолил, индолил, бензотриазолил, фуранил, тиенил, бензотиенил, бензофуранил, хинолинил, изохинолинил, оксазолил, изоксазолил, индолил,пиразинил, пиридазинил, пиридинил, пиримидинил, пирролил, тетрагидрохинолин. Как и в приведенном ниже определении гетероциклила, подразумевается, что "гетероарил" включает производное N-оксида любого азотсодержащего гетероарила. Если гетероарильный заместитель является бициклическим и одно кольцо является неароматическим или не содержит гетероатомов, подразумевается, что присоединение происходит посредством ароматического кольца или посредством гетероатома, соответственно содержащего кольцо. Такие гетероарильные группы для Q-заместителя включают, без ограничения, 2 бензимидазолил, 2-хинолинил, 3-хинолинил, 4-хинолинил, 1-изохинолинил, 3-изохинолинил и 4 изохинолинил. Используемый в настоящем изобретении термин "гетероцикл" или "гетероциклил" подразумевает ароматический или неароматический гетероцикл с количеством членов от 3 до 10, содержащий от 1 до 4 гетероатомов, выбираемых из группы, состоящей из O, N и S, и включает бициклические группы. Таким образом, "гетероциклил" включает вышеупомянутые гетероарилы, а также их дигидро- и тетрагидроаналоги. Дополнительные примеры "гетероциклила" включают, без ограничения, следующее: бензоимидазолил, бензоимидазолонил, бензофуранил, бензофуразанил, бензопиразолил, бензотриазолил, бензотиофенил, бензоксазолил, карбазолил, карболинил, циннолинил, фуранил, имидазолил, индолинил, индолил,индолазинил, индазолил, изобензофуранил, изоиндолил, изохинолил, изотиазолил, изоксазолил, нафтпиридинил, оксадиазолил, оксазолил, оксазолин, изоксазолин, оксетанил, пиранил, пиразинил, пиразолил,пиридазинил, пиридопиридинил, пиридазинил, пиридил, пиримидил, пирролил, хиназолинил, хинолил,хиноксалинил, тетрагидропиранил, тетразолил, тетразолопиридил, тиадиазолил, тиазолил, тиенил, триазолил, азетидинил, 1,4-диоксанил, гексагидроазепинил, пиперазинил, пиперидинил, пиридин-2-онил,пирролидинил, морфолинил, тиоморфолинил, дигидробензоимидазолил, дигидробензофуранил, дигидробензотиофенил, дигидробензоксазолил, дигидрофуранил, дигидроимидазолил, дигидроиндолил, дигидроизооксазолил, дигидроизотиазолил, дигидрооксадиазолил, дигидрооксазолил, дигидропиразинил,дигидропиразолил, дигидропиридинил, дигидропиримидинил, дигидропирролил, дигидрохинолинил,дигидротетразолил, дигидротиадиазолил, дигидротиазолил, дигидротиенил, дигидротриазолил, дигидроазетидинил, метилендиоксибензоил, тетрагидрофуранил и тетрагидротиенил, и N-оксиды указанных соединений. Присоединение гетероциклического заместителя может происходить посредством атома углерода или гетероатома. Специалистам в данной области техники будет очевидно, что используемый в настоящем изобретении термин "галоген" включает хлор (Cl), фтор (F), бром (Br) и йод (I). В одном варианте осуществления R1 выбирают из оксо, NH2, OH, SH, Oa(C1-C6)алкила, при этом-5 016195 указанный алкил необязательно замещают R6a. В одном варианте осуществления Rb независимо выбирают из H и (C1-C6)алкила. В одном варианте осуществления формулы C R1 выбирают из оксо, (C=O)aOb(C1-C10)алкила,(C=O)aOb-арила, (C=O)aOb(C2-C10)алкенила, (C=O)aOb(C2-C10)алкинила, CO2H, галогена, OH, Ob(C1-C6) перфторалкила, (C=O)aNR7R8, CN, (C=O)aOb(C3-C8)циклоалкила, S(O)2NR7R8, SH, S(O)2-(C1-C10)алкила и(C=O)aOb-гетероциклила, при этом указанные алкил, арил, алкенил, алкинил, циклоалкил и гетероциклил необязательно замещают R6a. В другом варианте осуществления формулы C R1 выбирают из оксо, (C=O)aOb (C1-C10)алкила,CO2H, галогена, OH, CN, (C1-C6)алкокси, S(O)2NR7R8, SH, S(O)2-(C1-C10)алкила и O(C=O)(C1-C6)алкила иN(Rb)2, при этом указанный алкил необязательно замещают R6a. В другом варианте осуществления формулы C R1 выбирают из оксо, NH2, OH, SH, Oa(C1-C6)алкила,при этом указанный алкил необязательно замещают R6a. В другом варианте осуществления формулы C R2 выбирают из оксо, (C=O)aOb(C1-C10)алкила, CO2H,галогена, OH, CN, (C1-C6)алкокси, O(C=O)(C1-C6)алкила, (C2-C10)алкенила и N(Rb)2, при этом указанный алкил необязательно замещают Rb, OH, (C1-C6)алкокси, галогеном, CO2H, CN, O(C=O)(C1-C6)алкилом,оксо и N(Rb)2. В другом варианте осуществления формулы C R1 выбирают из H, гетероциклила, (C3-C6) циклоалкила, OH, (C1-C6)алкила, NH(C1-C6)алкила, NH-гетероциклила, NH-циклоалкила, при этом указанные гетероциклил, циклоалкил и алкил необязательно замещают следующим: галогеном, (C1-C6)алкилом, (C1C6)алкил-NH2, OH, O(C1-C6)алкилом и R2 выбирают из H и галогена. В другом варианте осуществления формулы C кольцо Y является циклобутилом; R1 выбирают из H,гетероциклила, (C3-C6)циклоалкила, OH, (C1-C6)алкила, NH(C1-C6)алкила, NH-гетероциклила, NHциклоалкила, при этом указанные гетероциклил, циклоалкил и алкил необязательно замещают галогеном, (C1-C6)алкилом, (C1-C6)алкил-NH2, OH, O(C1-C6)алкилом и R2 является H или F. В другом варианте осуществления формулы C кольцо Y является циклобутилом; R1 представляет собой H или (C1-C6)алкил; и R2 является H или F. В объем рассматриваемого изобретения включены свободные формы соединений формулы C или E,а также их фармацевтически приемлемые соли и стереоизомеры. Некоторые из выделенных конкретных соединений, приведенных здесь в качестве примера, являются протонированными солями соединений амина. Термин "свободная форма" относится к соединениям амина в несолевой форме. Входящие в настоящее изобретение фармацевтически приемлемые соли не только включают выделенные соли, приводимые в качестве примеров для конкретных соединений, описываемых в настоящем изобретении, но также и все типичные фармацевтически приемлемые соли свободной формы соединений формул C илиE. Можно выделять свободную форму описанных конкретных солевых соединений, используя способы,известные в данной области техники. Например, свободную форму можно восстанавливать обработкой соли подходящим разведенным водным раствором основания, таким как разведенный водный NaOH,калия карбонат, аммиак и натрия бикарбонат. Свободные формы некоторым образом могут отличаться от своих соответствующих солевых форм по ряду физических свойств, таких как растворимость в полярных растворителях, но с другой стороны, для задач настоящего изобретения кислотные и основные соли фармацевтически эквивалентны своим соответствующим свободным формам. Фармацевтически приемлемые соли рассматриваемых соединений можно синтезировать из соединений настоящего изобретения, которые содержат основную или кислую функциональную группу, путем общепринятых химических способов. Обычно соли основных соединений приготавливают или ионообменной хроматографией или путем реакции свободного основания со стехиометрическим количеством или с избытком желательной солеобразующей неорганической или органической кислоты в подходящем растворителе или в разных комбинациях растворителей. Аналогично, соли кислых соединений образуют посредством реакций с соответствующим неорганическим или органическим основанием. Таким образом, фармацевтически приемлемые соли соединений настоящего изобретения включают общепринятые нетоксичные соли соединений настоящего изобретения в виде солей, образованных реакцией щелочного рассматриваемого соединения с неорганической или органической кислотой. Например,общепринятые нетоксичные соли включают соли, полученные из неорганических кислот, таких как хлористоводородная, гидробромистая, серная, сульфамовая, фосфорная, азотная и т.п., а также соли, изготовленные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая,молочная, яблочная, виннокаменная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая, трифторуксусная (ТФУ) и т.п. Если соединение настоящего изобретения является кислотным, выражение подходящие "фармацевтически приемлемые соли" относится к солям, изготовленным из фармацевтически приемлемых нетоксичных оснований, включающих неорганические основания и органические основания. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, соли трехвалентного марганца, двухвалентного марганца,-6 016195 калия, натрия, цинка и т.п. В особенности предпочтительными являются соли аммония, кальция, магния,калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включающих замещенные амины природного происхождения, циклические амины и катионобменные смолы, таких как аргинин, бетаин кофеин, холин, N,N1-дибензилэтилендиамин, диэтиламин, 2-диэтиламинэтанол, 2 диметиламинэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин,полиаминовые смолы, прикаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п. Изготовление фармацевтически приемлемых солей, описанных выше, и других обычных фармацевтически приемлемых солей более подробно описано в публикации Berg et al., "Pharmaceutical Salts," J.Pharm. Sci., 1977, 66: 1-19. Также необходимо отметить, что соединения настоящего изобретения вероятнее всего представляют собой внутренние соли или цвиттер-ионы, поскольку при физиологических условиях присутствующая в соединении депротонированная кислотная функциональная группа, такая как карбоксильная группа, может быть анионной, и тогда такой электронный заряд может быть уравновешен внутренним образом с катионным зарядом протонированной или алкилированной щелочной группы, такой как атом четвертичного азота. Применение Соединения рассматриваемого изобретения представляют собой ингибиторы действия Akt и, таким образом, являются полезными при лечении рака, в частности раковых заболеваний, связанных с дисрегуляцией действия Akt и downstream клеточных мишеней Akt. Такие раковые заболевания включают, без ограничения, рак яичника, поджелудочной железы, молочной железы и рак простаты, а также подобные раковым заболевания (включающие глиобластому), при которых происходит мутация опухолевого супрессора PTEN (Cheng et al., Proc. Natl. Acad. Sci. (1992) 89: 9267-9271; Cheng et al., Proc. Natl. Acad. Sci.(1996) 93: 3636-3641; Bellacosa et al., Int. J. Cancer (1995) 64: 280-285; Nakatani et al., J. Biol. Chem. (1999) 274: 21528-21532; Graff, Expert. Opin. Ther. Targets (2002) 6(1): 103-113; и Yamada and Araki, J. Cell Science. (2001) 114: 2375-2382; Mischel and Cloughesy, Brain Pathol. (2003) 13(1): 52-61). Соединения, композиции и способы, обеспечиваемые в настоящем изобретении, считаются особенно полезными для лечения рака. Раковые заболевания, которые можно лечить с помощью соединений,композиций и способов настоящего изобретения, включают без ограничения следующие заболевания: опухоли сердца: саркома (ангиосаркома, фибросаркома, рабдомиосаркома, липосаркома), миксома,рабдомиома, фиброма, липома и тератома; заболевания легких: немелкоклеточный рак легкого, бронхогенная карцинома (плоскоклеточный рак, недифференцированный мелкоклеточный, недифференцированный крупноклеточный рак, аденокарцинома), альвеолярная (бронхиолярная) карцинома, бронхиальная аденома, саркома, лимфома, хондроматозная гамартома, мезотелиома; заболевания желудочно-кишечного тракта: рак пищевода (плоскоклеточная карцинома, аденокарцинома, лейомиосаркома, лимфома), рак желудка (карцинома, лимфома, лейомиосаркома), рак поджелудочной железы (протоковая аденокарцинома, инсулинома, глюкагонома, гастринома, карциноидные опухоли, випома), рак тонкой кишки (аденокарцинома, лимфома, карциноидные опухоли, саркома Капоши, лейомиома, гемангиома, липома, нейрофиброма, фиброма), рак толстой кишки (аденокарцинома,тубулярная аденома, ворсинчатая аденома, гамартома, лейомиома), рак толстой кишки колоректальный,ректальный рак; заболевания урогенитального тракта: рак почки (аденокарцинома, опухоль Вильмса [нефробластома], лимфома, лейкоз), рак мочевого пузыря и уретры (плоскоклеточная карцинома, переходноклеточная карцинома, аденокарцинома), рак простаты (аденокарцинома, саркома), рак яичка (семинома,тератома, эмбриональная карцинома, тератокарцинома, хориокарцинома, саркома, интерстициальноклеточная карцинома, фиброма, фиброаденома, аденоматоидные опухоли, липома); заболевания печени: гепатома (гепатоцеллюлярная карцинома), холангиокарцинома, гепатобластома, ангиосаркома, гепатоцеллюлярная аденома, гемангиома; заболевания костей: остеогенная саркома (остеосаркома), фибросаркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Эвинга, злокачественная лимфома (ретикулярно-клеточная саркома), множественная миелома, злокачественная гигантско-клеточная опухоль - хордома, остеохондрома (костно-хрящевые экзостозы), доброкачественная хондрома, хондробластома, хондромиксофиброма, остеоидная остеома и гигантско-клеточные опухоли; заболевания нервной системы: опухоли черепа (остеома, гемангиома, гранулема, ксантома, деформирующий остит), мягких мозговых оболочек (менингиома, менингиосаркома, глиоматоз), мозга (астроцитома, медуллобластома, глиома, эпендимома, герминома [пинеалома], мультиформная глиобластома,олигодендроглиома, шваннома, ретинобластома, врожденные опухоли), спинного мозга (нейрофиброма,менингиома, глиома, саркома); гинекологические заболевания: опухоли матки (эндометриальная карцинома), шейки матки (церви-7 016195 кальная карцинома, предопухолевая цервикальная дисплазия), яичников (яичниковая карцинома [серозная цистаденокарцинома, муцинозная цистаденокарцинома, неклассифицированная карцинома], опухоли гранулезных и текальных клеток, опухоли клеток Сертоли-Лейдига, дисгерминома, злокачественная тератома), вульвы (плоскоклеточная карцинома, интраэпителиальная карцинома, аденокарцинома, фибросаркома, меланома), влагалища (светлоклеточная карцинома, плоскоклеточная карцинома, ботриоидная саркома (эмбриональная рабдомиосаркома), фаллопиевых труб (карцинома); гематологические заболевания: кровь (миелоидный лейкоз [острый и хронический], острый лимфообластный лейкоз, хронический лимфоцитарный лейкоз, миелопролиферативные болезни, множественная миелома, миелодиспластический синдром), болезнь Ходжкина, нехожкинская лимфома [злокачественная лимфома]; заболевания кожи: злокачественная меланома, базальноклеточная карцинома, плоскоклеточная карцинома, саркома Капоши, диспластические невусы, липома, ангиома, дерматофиброма, келоиды, псориаз; и заболевания надпочечников: нейробластома. Таким образом, термин "злокачественная клетка", согласно настоящему изобретению, включает клетку, пораженную любым из вышеуказанных состояний. Раковые заболевания, которые можно лечить с помощью соединений, композиций и способов настоящего изобретения, включают, без ограничения, рак молочной железы, простаты, толстой кишки, колоректальный рак, рак легкого, немелкоклеточный рак легкого, рак мозга, яичка, желудка, поджелудочной железы, кожи, тонкой кишки, толстой кишки, горла, головы и шеи, ротовой полости, кости, печени,мочевого пузыря, почки, щитовидной железы и крови. Раковые заболевания, которые можно лечить с помощью соединений, композиций и способов настоящего изобретения, включают, без ограничения, рак молочной железы, простаты, толстой кишки,яичников, колоректальный рак, рак легкого и немелкоклеточный рак легкого. Раковые заболевания, которые можно лечить с помощью соединений, композиций и способов настоящего изобретения, включают, без ограничения, рак молочной железы, толстой кишки (колоректальный рак) и легкого (немелкоклеточный рак легкого). Раковые заболевания, которые можно лечить с помощью соединений, композиций и способов настоящего изобретения, включают, без ограничения, лимфому и лейкоз. Соединения рассматриваемого изобретения полезны для лечения рака молочной железы. Соединения рассматриваемого изобретения полезны для лечения рака простаты. Сигнальный путь Akt регулирует множество важнейших этапов ангиогенеза. Shiojima and Walsh,Circ. Res. (2002) 90: 1243-1250. Известно о полезности ингибиторов ангиогенеза для лечения рака по литературным данным, например, см. J. Rak et al. Cancer Research, 55: 4575-4580, 1995 and Dredge et al., Expert Opin. Biol. Ther. (2002) 2(8): 953-966. Доказана роль ангиогенеза при раке для некоторых видов раковых заболеваний и тканей: карциномы молочной железы (G. Gasparini and A.L. Harris, J. Clin. Oncol.,1995, 13: 765-782; M. Toi et al., Japan. J. Cancer Res., 1994, 85: 1045-1049); карциномы мочевого пузыря(A.J. Dickinson et al., Br. J. Urol., 1994, 74: 762-766); карциномы толстой кишки (L.M. Ellis et al., Surgery,1996, 120(5): 871-878); и опухолей полости рта (J.K. Williams et al., Am. J. Surg., 1994, 168: 373-380). Другие раковые заболевания включают запущенные опухоли, волосатоклеточный лейкоз, меланому, запущенные опухоли головы и шеи, метастатический рак почечных клеток, неходжкинскую лимфому, метастатический рак молочной железы, аденокарциному молочной железы, запущенную меланому, рак поджелудочной железы, желудка, глиобластому, рак легкого, яичников, немелкоклеточный рак легкого, рак простаты, мелкоклеточный рак легкого, карциному почечных клеток, разные солидные опухоли, множественную миелому, метастатический рак простаты, злокачественную глиому, рак почки, лимфому, рефрактерное метастазирование, рефрактерную множественную миелому, цервикальный рак, саркому Капоши, рекуррентную анапластическую глиому и метастатический рак толстой кишки (Dredge et al., Expert Opin. Biol. Ther. (2002) 2(8): 953-966). Таким образом, ингибиторы Akt, раскрытые в рассматриваемой заявке, также являются полезными при лечении раковых заболеваний, связанных с ангиогенезом. Опухоли, в которых происходит неоваскуляризация, проявляют повышенную склонность к метастазированию. Фактически, ангиогенез является существенным для роста опухоли и метастазирования.(S.P. Cunningham, et al., Can. Research, 61: 3206-3211 (2001. Таким образом, ингибиторы Akt, раскрытые в настоящей заявке, также полезны для профилактики или уменьшения метастазирования опухолевых клеток. Дополнительно в объем настоящего изобретения включен способ лечения или предупреждения заболевания, в которое вовлечен ангиогенез, указанный способ состоит в том, что млекопитающему, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения настоящего изобретения. Неоваскулярные патологии глаза представляют собой пример состояний, при которых поражение основной массы тканей может быть обусловлено аберрантной инфильтрации кровеносных сосудов в глаз (см. патент WO 00/30651, опубликованный 2 июня 2000 г.). Нежелательная инфильтрация может возникать по причине ишемической ретинопатии, например, вследствие диабетической ретинопатии, ретинопатии при преждевременных родах, окклюзии вен сетчатки глаза и т.д., или по причине деге-8 016195 неративных заболеваний, таких как хориоидальная неоваскуляризация, наблюдаемая при старческой макулярной дегенерации. Таким образом, ингибирование роста кровеносных сосудов с помощью введения соединений настоящего изобретения способно предотвращать инфильтрациию кровеносных сосудов и действовать в качестве предупреждения или лечения заболеваний, связанных с ангиогенезом, таких как глазные болезни, например, ретинальная васкуляризация, диабетическая ретинопатия, старческая макулярная дегенерация и подобных болезней. Дополнительно в объем настоящего изобретения включен способ лечения или предупреждения доброкачественных заболеваний, которые связаны с ангиогенезом и включают, без ограничения, глазные болезни (такие как ретинальная васкуляризация, диабетическая ретинопатия и старческая макулярная дегенерация), атеросклероз, артрит, псориаз, ожирение и болезнь Альцгеймера (Dredge et al., Expert Opin.Biol. Ther. (2002) 2(8): 953-966). В другом варианте осуществления способ лечения или профилактики болезни, связанной с ангиогенезом, включает глазные болезни (такие как ретинальная васкуляризация,диабетическая ретинопатия и старческая макулярная дегенерация), атеросклероз, артрит и псориаз. Дополнительно в объем настоящего изобретения включен способ лечения гиперпролиферативных нарушений, таких как рестеноз, воспаление, аутоиммунные заболевания и аллергия/астма. Дополнительно в объем рассматриваемого изобретения входит использование рассматриваемых соединений для покрытия стентов, то есть использование рассматриваемых соединений в стентах с покрытием для лечения и/или профилактики рестеноза (WO 03/032809). Дополнительно в объем рассматриваемого изобретения включено использование рассматриваемых соединений для лечения и/или предупреждения остеоартрита (WO 03/035048). Дополнительно в объем настоящего изобретения включен способ лечения гиперинсулинимии. Соединения настоящего изобретения также полезны для изготовления лекарственного средства для лечения описанных выше заболеваний, в частности рака. В одном варианте осуществления настоящего изобретения рассматриваемое соединение представляет собой селективный ингибитор, ингибирующая эффективность которого зависит от ПГ-домена. В указанном варианте осуществления соединение проявляет уменьшение ингибирующей активности invitro или уменьшение активности ингибирования не in vitro усеченных белков Akt, лишенных ПГдомена. В дополнительном варианте осуществления рассматриваемое соединение выбирают из группы, состоящей из селективного ингибитора Akt1, селективного ингибитора Akt2 и селективного ингибитораAkt1 и Akt2. В другом варианте осуществления рассматриваемое соединение выбирают из группы, состоящей из селективного ингибитора Akt1, селективного ингибитора Akt2, селективного ингибитора Akt3 и селективного ингибитора двух из трех изоформ Akt. В другом варианте осуществления рассматриваемое соединение представляет собой селективный ингибитор всех трех изоформ Akt, но не является ингибитором одной, двух или всех указанных изоформAkt, которые подверглись модификации с делецией ПГ-домена, делецией шарнирного участка или делецией и ПГ-домена и шарнирного участка. Дополнительно, целью настоящего изобретения является способ ингибирования действия Akt, который содержит введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества рассматриваемого соединения. Соединения настоящего изобретения можно вводить млекопитающим, включая людей, как единственными, так и в комбинации с фармацевтически приемлемыми носителями, наполнителями или разбавителями, в фармацевтической композиции согласно стандартной фармацевтической практике. Соединения можно вводить перорально или парентерально, включая внутривенный, внутримышечный, внутрибрюшинный, подкожный, ректальный и местный пути введения. Фармацевтические композиции, содержащие активный компонент, можно изготавливать в форме,подходящей для перорального применения, например, в виде таблеток, пилюль, пастилок, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов или эликсиров. Композиции, предназначенные для перорального применения, можно изготавливать согласно любому способу, известному в области производства фармацевтических композиций, и такие композиции могут содержать одно или более веществ, выбираемых из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов, для получения фармацевтически изящных и приятных на вкус рецептур. Таблетки содержат активный компонент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые подходят для изготовления таблеток. Эти наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например, микрокристаллическая целлюлоза, натрийкроскармелоза, кукурузный крахмал или альгиновая кислота; связующие агенты, например, крахмал, желатин, поливинилпирролидон или гуммиарабик, и смазывающие агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия, или их можно покрывать общеизвестными способами, чтобы замаскировать неприятный вкус лекарства или замедлить расщепление и усвоение лекарства в желудочно-кишечном тракте, и таким об-9 016195 разом, обеспечить продолжительное действие в течение более долгого периода. Например, можно использовать водорастворимый материал, маскирующий вкус, такой как гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза, или материал-замедлитель, такой как этилцеллюлоза, ацетатбутират целлюлозы. Рецептуры для перорального применения также могут иметь вид твердых желатиновых капсул, в которых активный компонент смешивают с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или быть в виде мягких желатиновых капсул, в которых активный компонент смешивают с водорастворимым носителем, таким как полиэтиленгликоль, или с масляной средой, например с арахисовым маслом, вазелиновым маслом или оливковым маслом. Водные суспензии содержат активное вещество в смеси с наполнителями, подходящими для изготовления водных суспензий. Такие наполнители представляют собой суспендирующие агенты, например, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую смолу и гуммиарабик; диспергирующие или увлажняющие агенты могут представлять собой фосфатиды природного происхождения, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например со стеаратом полиоксиэтилена, или продукты конденсации этиленоксида с длинноцепочечными многоатомными алифатическими спиртами,например, гептдекаэтилен-оксицетанолом, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гекситола, такими как полиоксиэтиленсорбитолмоноолеат, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гекситола, например с полиэтиленсорбитол-моноолеатом. Водные суспензии могут также содержать один или больше консервантов, например этил, или н-пропил-пгидроксибензоат, один или больше красителей, один или больше ароматизаторов, и один или больше подсластителей, таких как сахароза, сахарин или аспартам. Можно создавать рецептуру масляных суспензий путем суспендирования активного компонента в растительном масле, например, в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как вазелиновое масло. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый вазелин или цетиловый спирт. Можно добавлять подслащивающие агенты и ароматизаторы, такие как указанные выше, для получения приятной на вкус пероральной рецептуры. Такие композиции можно сохранять с добавлением антиоксиданта, такого как бутил-гидроксианузол или альфа-токоферол. Диспергируемые порошки и гранулы, подходящие для изготовления водной суспензии путем добавления воды, обеспечивают активный компонент в смеси с диспергирующим или увлажняющим агентом, суспендирующим агентом и одним или больше консервантов. Примеры подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов приведены выше. Также могут присутствовать дополнительные наполнители, например подсластители, ароматизаторы и красители. Такие композиции можно сохранять добавлением антиоксиданта, такого как аскорбиновая кислота. Фармацевтические композиции настоящего изобретения могут также быть в виде эмульсии маслов-воде. Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например вазелиновое масло, или их смеси. Подходящие эмульгирующие агенты могут представлять собой фосфатиды природного происхождения, например лецитин соевых бобов, и сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и ангидридов гекситола, например сорбитол-моноолеат, и продукты конденсации указанных неполных сложных эфиров с этиленоксидом например, полиоксиэтиленсорбитол-моноолеатом. Эмульсии могут также содержать подсластители, ароматизаторы, консерванты и антиоксиданты. Рецептуры сиропов и эликсиров можно создавать с подсластителями, например глицерином, пропиленгликолем, сорбитолом или сахарозой. Такие рецептуры также могут содержать смягчающий агент,консервант, ароматизаторы и красители и антиоксидант. Фармацевтические композиции могут представлять собой форму стерильных водных растворов для инъекций. Из возможных для использования подходящих носителей и растворителей можно применять воду, раствор Рингера и изотонический раствор хлорида натрия. Стерильная рецептура для инъекций также может представлять собой стерильную микроэмульсию масло-в-воде для инъекций, в которой активный компонент растворен в масляной фазе. Например, активный компонент можно сначала растворять в смеси соевого масла и лецитина. Затем масляный раствор вводят в смесь воды и глицерина и обрабатывают для получения микроэмульсии. Растворы для инъекций или микроэмульсии можно вводить в кровеносное русло больного путем местной болюсной инъекции. Альтернативно, может иметь преимущество такое введение раствора или микроэмульсии, при котором будет поддерживаться постоянная циркулирующая концентрация рассматриваемого соединения. Можно использовать устройство для непрерывной внутривенной доставки для поддержания такой постоянной концентрации. Примером такого устройства является внутривенная помпа модели 5400 Deltec CADD-PLUS. Фармацевтические композиции могут представлять собой форму стерильной инъекционной водной или маслянистой суспензии для внутримышечного и подкожного введения. Рецептуру такой суспензии- 10016195 можно создавать согласно общепринятой методики, используя указанные выше подходящие диспергирующие или увлажняющие агенты и суспендирующие агенты. Стерильная рецептура для инъекций может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном, подходящем для парентерального введения разбавителе или растворителе, например, в растворе 1,3 бутандиола. Дополнительно, в качестве суспендирующей или растворяющей среды общепринято используют стерильные жирные масла. С этой целью можно использовать любое мягкое жирное масло, включающее синтетические моно- или диглицериды. Дополнительно для изготовления инъекционных форм могут применяться жирные кислоты, такие как олеиновая кислота. Соединения формулы C или E можно также вводить в форме свечей для ректального введения лекарственного средства. Такие композиции можно изготавливать путем смешивания лекарственного средства с подходящим нераздражающим наполнителем, который является твердым при обычной температуре, но становится жидким при ректальной температуре, и поэтому будет таять в прямой кишке с высвобождением лекарственного средства. Такие вещества включают масло какао, обработанный глицерином желатин, гидрогенированные растительные масла, смеси полиэтиленгликолей разного молекулярного веса и сложных эфиров жирных кислот полиэтиленгликоля. Для местного применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие соединение формулы C или E. (Для целей настоящей заявки местное применение должно включать ополаскиватели для полости рта и полоскания). Соединения настоящего изобретения можно вводить в интраназальной форме посредством местного применения подходящих интраназальных носителей и устройств доставки, или путем чрескожного введения, используя известные рядовым специалистам в данной области техники трансдермальные формы кожных пластырей. Введение дозы в форме трансдермальной системы доставки будет, безусловно,непрерывным, в отличие от периодического введения по схеме дозирования. Соединения настоящего изобретения можно также вводить в виде суппозиториев, с использованием основы, такой как масло какао, обработанный глицерином желатин, гидрогенированные растительные масла, смеси полиэтиленгликолей разного молекулярного веса и сложных эфиров жирных кислот полиэтиленгликоля. При введении человеку композиций согласно настоящему изобретению ежедневная доза обычно должна определяться лечащим врачом, при этом доза обычно варьирует в соответствии с возрастом, весом и индивидуальной реакцией больного, а также в соответствии со степенью тяжести симптомов у больного. Можно выбирать схему введения с применением соединений рассматриваемого изобретения в соответствии с рядом факторов, включающих тип, вид, возраст, вес, пол и тип ракового заболевания, которое необходимо лечить; степень тяжести (т.е. стадии) рака, который лечат; путь введения; функцию почек и печени пациента; и конкретного применяемого соединения или его соли. Обычно квалифицированный врач или ветеринар могут легко определить и назначить эффективное количество лекарственного средства, необходимого для лечения, например, для предупреждения, замедления (полного или частичного) или прекращения развития болезни. Например, соединения рассматриваемого изобретения можно вводить в общей ежедневной дозе до 10000 мг. Соединения рассматриваемого изобретения можно вводить ежедневно однократно (QD), или разделять на многократные ежедневные дозы, например, вводя соединения два раза в день (BID) и три раза в день (TID). Соединения рассматриваемого изобретения можно вводить в общей ежедневной дозе до 10000 мг, например 2000, 3000, 4000, 6000, 8000 или 10000 мг, и указанные дозы можно вводить в однократной ежедневной дозе или можно разделять на многократные ежедневные дозы, как описано выше. Например, соединения рассматриваемого изобретения можно вводить в общей ежедневной дозе до 1000 мг. Соединения рассматриваемого изобретения можно вводить однократно ежедневно (QD), или разделять на многократные ежедневные дозы, например, два раза в день (BID), и три раза в день (TID). Соединения рассматриваемого изобретения можно вводить в общей ежедневной дозе до 1000 мг, например 200, 300, 400, 600, 800 или 1000 мг, и указанные дозы можно вводить в однократной ежедневной дозе, или их можно разделять на многократные ежедневные дозы, как описано выше. Дополнительно, введение может быть непрерывным, то есть, ежедневным, или периодическим. Термины "периодическое" или "периодичность", используемые в настоящем изобретении, означают начало и прекращение введения с регулярными или нерегулярными интервалами. Например, периодическое введение соединения рассматриваемого изобретения может представлять собой введение от одного до шести дней в неделю, или оно может означать введение циклами (например, ежедневное введение в течение от двух до восьми последовательных недель, затем перерыв без введения в течение одной недели), или периодическое введение может означать введение через день. В дополнение, соединения рассматриваемого изобретения можно вводить согласно любой из схем,описанных выше, последовательно в течение нескольких недель, с последующим перерывом. Например,соединения рассматриваемого изобретения можно вводить согласно любой из схем, описанных выше, от двух до восьми недель, с последующим перерывом в течение одной недели, или два раза в день в дозе 100-500 мг в течение от трех до пяти дней в неделю. В другом конкретном варианте осуществления со- 11016195 единения рассматриваемого изобретения можно вводить три раза в день в течение двух последовательных недель, с последующим перерывом на одну неделю. Также можно применять любую одну или больше конкретных дозировок и схем дозирования соединений рассматриваемого изобретения для любого одного или больше терапевтических агентов, которые применяются при комбинированной терапии (далее называемых "вторым терапевтическим агентом"). Кроме того, можно дополнительно менять конкретную дозу и схему дозирования этого второго терапевтического агента, и определять оптимальную дозу, схему дозирования и путь введения будут с учетом конкретного применяемого второго терапевтического агента. Безусловно, путь введения соединений рассматриваемого изобретения не зависит от пути введения второго терапевтического агента. В одном варианте осуществления путем введения соединения рассматриваемого изобретения является пероральное введение. В другом варианте осуществления введение соединения рассматриваемого изобретения осуществляют внутривенным вливанием. Таким образом, согласно указанным вариантам осуществления, соединения рассматриваемого изобретения вводят перорально или внутривенно, и второй терапевтический агент можно вводить перорально, парентерально,интраперитонеально, внутривенно, внутриартериально, чрескожно, сублингвально, внутримышечно,ректально, трансбуккально, интраназально, с помощью липосом, путем ингаляции, вагинально, интраокулярно, локализованной доставкой посредством катетера или стента, подкожно, в жировую ткань, интраартикулярно, интратекально или в фармацевтической форме с замедленным высвобождением дозы. В дополнение, соединения рассматриваемого изобретения и второе терапевтическое средство можно вводить одинаковым способом введения, т.е. оба применяемых вещества вводят, например, перорально или внутривенно. Вместе с тем, также в объем настоящего изобретения входит способ введения соединения рассматриваемого изобретения одним путем введения, например перорально, и второго терапевтического агента другим путем введения, например внутривенно, или любыми другими способами введения, описанными выше. Первая процедура лечения, а именно введение соединения рассматриваемого изобретения, может происходить перед второй процедурой лечения, т.е. перед введением второго терапевтического средства,после введения второго терапевтического средства одновременно с применением второго терапевтического средства или в их комбинированном применении. Например, для соединения рассматриваемого изобретения может быть установлен общий период лечения. Второе терапевтическое средство можно вводить до начала применения соединения рассматриваемого изобретения или после лечения соединением рассматриваемого изобретения. Дополнительно, противораковую терапию можно проводить во время периода введения соединения рассматриваемого изобретения, но нет необходимости ее проводить в течение всего периода применения соединения рассматриваемого изобретения. Рассматриваемые соединения также являются полезными в комбинации с терапевтическими, химиотерапевтическими и противораковыми средствами. В объем изобретения входят комбинации раскрытых в настоящем изобретении соединений с терапевтическими, химиотерапевтическими и противораковыми средствами. Примеры таких средств можно найти в издании Cancer Principles and Practice of Oncology, V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott WilliamsWilkins Publishers. Рядовой специалист в данной области техники сможет отличить, какие комбинации средств будут полезны, на основании конкретных характеристик лекарственных средств и онкологического диагноза. Такие агенты включают следующее: модуляторы рецепторов эстрогена, модуляторы рецепторов андрогена, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические агенты, антипролиферативные агенты, ингибиторы пренил-протеин трансферазы, ингибиторы HMG-CoA редуктазы и другие ингибиторы ангиогенеза, ингибиторы протеазы ВИЧ, ингибиторы обратной транскриптазы, ингибиторы клеточной пролиферации и сигнальных путей выживаемости, бисфосфонаты, ингибиторы ароматазы,препараты siPHK, ингибиторы -секретазы, агенты, влияющие на рецептор тирозинкиназ (PTK), и агенты, которые влияют на контрольные точки клеточного цикла. Рассматриваемые соединения особенно полезны при совместном применении с лучевой терапией. Соединение рассматриваемого изобретения может также быть полезным для лечения рака в комбинации со следующими терапевтическими агентами: абареликс (Plenaxis depot); алдеслейкин (Prokine); алдеслейкин (Proleukin); алемтузумаб (Campath); алитретиноин (Panretin); аллопуринол (Zyloprim); алтретамин (Hexalen); амифостин (Ethyol); анастрозол (Arimidex); триоксид мышьяка (Trisenox); аспарагиназа (Elspar); азацитидин (Vidaza); бевакузимаб (Avastin); бексаротен, капсулы(Paxene); паклитаксел (Taxol); паклитаксел протеинсвязанные частицы (Abraxane); парлифермин(Vumon); тестолактон (Teslac); тиогуанин, 6-TG (Thioguanine); тиотепа (Thioplex); топотекан (Hycamtin); торемифен (Fareston); тоситумомаб (Веххаr); тоситумомаб/I-131 тоситумомаб (Веххаr); трастузумаб (Herceptin); третиноин, ATRA (Vesanoid); нитроиприт урацил (Uracil Mustard Capsules); валрубицин (Valstar); винбластин (Velban); винкристин (Oncovin); винорелбин (Navelbine); золедронат (Zometa) и вориностат (Zolinza). Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с таксанами. Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с доцетакселом (Taxotere). Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с вориностатом (Zolinza). Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с ингибитором ауроракиназы, MK 0457. Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с ингибиторомmTor, AP 23573. Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с ингибиторомIGFlR, MK 0646. Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с сатраплатином. Соединения рассматриваемого изобретения полезны для лечения рака в комбинации с лапатинибом(Tykerb). Таким образом, область рассматриваемого изобретения охватывает использование соединений, указанных в формуле настоящего изобретения, в комбинации со вторым соединением, выбираемым из следующих соединений: модулятор рецепторов эстрогена, модулятор рецепторов андрогена, модулятор ретиноидных рецепторов, цитотоксический/цитостатический агент, антипролиферативный агент, ингибитор пренил-протеин трансферазы, ингибитор HMG-CoA редуктазы, ингибитор протеазы ВИЧ, ингибитор обратной транскриптазы, ингибитор ангиогенеза, агонисты PPAR-, агонисты PPAR-, ингибитор врожденной множественной лекарственной устойчивости, противорвотное средство, средство, полезное для лечения анемии, средство, полезное для лечения нейтропении, лекарственное средство, повышающее иммунитет, ингибитор клеточной пролиферации и сигнальных путей выживаемости, бисфосфонат, ингибитор ароматазы, препарат siPHK, ингибитор -секретазы агенты, влияющие на рецептор тирозинкиназ(PTK), агент, влияющий на контрольные точки клеточного цикла, и любой из вышеупомянутых терапевтических агентов.- 13016195 Термин "введение" и его варианты (например, "введение" соединения) в отношении соединения настоящего изобретения означает, что соединение или пролекарство соединения поступает в систему животного, нуждающегося в лечении. Если соединение настоящего изобретения или его пролекарство представлено в комбинации с одним или более другими активными агентами (например, цитотоксический агент и т.д.), общепринято считать, что термин "введение" и его варианты включают параллельное и последовательное применение соединения или его пролекарства и других агентов. Используемый в настоящем изобретении термин "соединение" охватывает продукт, содержащий указанные компоненты в указанном количестве, а также любой продукт, который прямым или опосредованным способом получают из комбинации указанных компонентов в указанном количестве. Используемый в настоящем изобретении термин "терапевтически эффективное количество" означает количество активного соединения или фармацевтического агента, которое вызывает искомую биологическую или медицинскую реакцию в ткани, системе, у животного или человека, ожидаемую исследователем, ветеринаром, врачом или другим клиническим специалистом. Термин "лечение рака" относится к введению млекопитающему, пораженному злокачественной патологией, и относится к действию, которое облегчает злокачественную патологию путем уничтожения злокачественных клеток, а также к действию, которое приводит к замедлению роста и/или метастазирования рака. В варианте осуществления ингибитор ангиогенеза, который применяют в качестве второго соединения, выбирают из ингибитора тирозинкиназы, ингибитора фактора роста эпидермиса, ингибитора фактора роста фибробластов, ингибитора фактора роста тромбоцитов, ингибитора MMP (матрицы металлопротеазы), блокатора интегрина, интерферона-, интерлейкина-12, полисульфата пентозана, ингибитора циклооксигеназы,карбоксиамидотриазола,комбретастатинаA-4,скваламина,6-Oхлорацетилкарбонил)фумагиллола, талидомида, ангиостатина, тропонина-1 или антитела к VEGF. В одном варианте осуществления модулятором рецептора эстрогена является тамоксифен или ралоксифен. Также в объем формулы изобретения входит способ лечения рака, который содержит введение терапевтически эффективного количества соединения рассматриваемого изобретения в комбинации с лучевой терапией и/или в комбинации со вторым соединением, выбираемым из следующих соединений: модулятор рецептора эстрогена, модулятор рецепторов андрогена, модулятор ретиноидных рецепторов,цитотоксический/цитостатический агент, антипролиферативный агент, ингибитор пренил-протеин трансферазы, ингибитор HMG-CoA редуктазы, ингибитор протеазы ВИЧ, ингибитор обратной транскриптазы, ингибитор ангиогенеза, агонисты PPAR-, агонисты PPAR-, ингибитор врожденной множественной лекарственной устойчивости, противорвотное средство, средство, полезное для лечения анемии,средство, полезное для лечения нейтропении, лекарственное средство для повышения иммунитета, ингибитор клеточной пролиферации и сигнальных путей выживаемости, бисфосфонат, ингибитор ароматазы,препарат siPHK, ингибитор -секретазы, агенты, влияющие на рецептор тирозинкиназ (PTK), агент,влияющий на контрольные точки клеточного цикла, и любой из вышеупомянутых терапевтических агентов. Рассматриваемое изобретение также включает фармацевтическую композицию, полезную для лечения или профилактики рака, которая содержит терапевтически эффективное количество соединения рассматриваемого изобретения и второго соединения, выбираемого из следующего: модулятор рецепторов эстрогена, модулятор рецепторов андрогена, модулятор ретиноидных рецепторов, цитотоксический/цитостатический агент, антипролиферативный агент, ингибитор пренил-протеин трансферазы, ингибитор HMG-CoA редуктазы, ингибитор протеазы ВИЧ, ингибитор обратной транскриптазы, ингибитор ангиогенеза, агонисты PPAR-, агонисты PPAR-, ингибитор клеточной пролиферации и сигнальных путей выживаемости, бисфосфонат, ингибитор ароматазы, препарат siPHK, ингибитор -секретазы агенты, влияющие на рецептор тирозинкиназ (PTK), агенты, влияющие на контрольные точки клеточного цикла, и любой из вышеупомянутых терапевтических агентов. Все указанные патенты, публикации и патентные заявки, находящиеся на рассмотрении, включены в настоящее изобретение ссылкой. В химическом описании и в приведенных далее примерах использованы следующие сокращения:DMAP (4-диметиламинопиридин); EDC (N-этил-N'-(3-диметиламинопропил)карбодиимид); Eq (эквиваленты); Et (этил); HOBt (ГОБТ - гидроксибензотриазол); IPA (ИПС - изопропанол); LC/MS (жидкостной хроматограф/масс-спектрометр); Me (метил); MeCN (ацетонитрил); NMP (НМЛ - Nметилпирролидинон); Pr (пропил); Pyr (пиридин); Sat (насыщенный), Tosic, TCK (п-толуолсульфоновая кислота) и Bn (бензил); t-Bu (трет-бутил); dba (ДБА - дибензилиденацетон); DIPEA (диизопропилэтиламин); IPAC (изопропилацетат); MTBE (трет-бутилметил эфир); OAc (ацетат); RT (КТ - комнатная температура); Wt - вес; и XRPD - (рентгеновская порошковая дифракция). Соединения настоящего изобретения можно изготавливать посредством осуществления реакций,приведенных в разделе Схемы реакций ниже, в дополнение к другим стандартным манипуляциям, известным в литературе или показанным в качестве примеров экспериментов. Примеры приведенных ниже схем реакций, таким образом, не ограничены перечисленными соединениями или какими-либо конкретными заместителями, используемыми в иллюстративных целях. Нумерация заместителей, употребляемая в схемах реакций, не имеет обязательной корреляции с нумерацией, приведенной в формуле изобретения, и часто, для ясности, там, где допускаются несколько заместителей согласно определениям формулы C или E, показанной выше, указан единственный заместитель, присоединенный к соединению. Краткий обзор схем реакций Ниже приведены схемы реакции. Схемы реакции I-III подробно характеризуют изготовление рассматриваемых соединений. Необходимые промежуточные продукты в некоторых случаях являются коммерчески доступными,или их можно изготовить согласно методике, описанной в литературе. Как показано в схеме реакции I, вначале реагирует производное циклоалкил(фенил)уксусной кислоты, в данном случае циклобутил, и трансформируется в условиях по Курциусу для получения карбамата I-1. Цианирование, в данном случае катализируемое палладием, дает нитрил I-2. Депротонирование продукта I-2 с последующей реакцией с нуклеофильным бензильным реактивом Гриньяра и гидролитическое выделение продукта реакции дает кетон I-3. Конденсация продукта I-3 с альдегидом I-4 при щелочных условиях дает хлорнафтиридин I-5. Замещение хлора гидразином дает гидразид I-6. Ацилирование дает ацилгидразид I-7, который циклизуется при кислых условиях, и дает триазолонафтиридин I-8. При снятии защитных групп с амина в данном случае с помощью HCl получают I-9. Плавленый триазол можно изготавливать путем ацилирования гидразида I-6 с активированным карбонильным эквивалентом, таким как карбонилдиимидазо, или с муравьиной кислотой в присутствии карбодиимида, без необходимости этапа циклизации. Альтернативно, хлорнафтиридин I-5 может реагировать с дериватизированным гидразином, таким как карбоксилат алкилгидразина, при условиях кислотного катализа, для получения аддукта гидразина,который подвергается циклизации в триазол при щелочных условиях. Соединения рассматриваемого изобретения, в котором R1 является аминоалкильной группой, можно изготавливать согласно способам, в общих чертах описанным в схеме реакции II. Гидразид I-6 реагирует с карбодиимидом для получения мочевины, которая подвергается циклизации in situ при кислых условиях для получения алкиламинотриазола II-1. Затем осуществляют снятие защитных групп продуктаII-2. Альтернативный синтез хлорнафтиридина I-5 показан в схеме реакции III. Производное (4 галогенфенил)ацетонитрила III-1, в данном случае бромзамещенное, вначале подвергается алкилированию при щелочных условиях для получения циклобутана III-2, который гидратируется перекисью водорода в присутствии основания, для получения амида III-3. Затем амид подвергается окислительной транформации в присутствии трет-бутанола для получения карбамата III-4. Цианирование, в данном случае катализируемое палладием, дает нитрил I-2. Реакция продукта I-2 с избытком нуклеофильного бензильного реактива Гриньяра и гидролитическое выделение продукта реакции дает кетон I-3. Снятие защитных групп альдегида I-4 кислотой, такой как ТФУ, дает аминопиридин III-5. Конденсация I-3 с альдегидом III-5 при щелочных условиях дает хлорнафтиридин I-5. Примеры Приведенные примеры и схемы предназначены для дополнительного понимания настоящего изобретения. Предполагается, что конкретные используемые вещества, виды и условия являются дополнительными иллюстративными данными настоящего изобретения и не ограничивают его надлежащий объем. трет-Бутил [1-(4-хлорфенил)циклобутил]карбамат (1-1). В круглую плоскодонную колбу добавляли 1-(4-хлорфенил)циклобутанкарбоксильную кислоту(40,4 г, 192 ммоль), ди-трет-бутила дикарбонат (46,0 г, 211 ммоль), азид натрия (43,6 г, 671 ммоль), тетрабутиламмония бромид (9,7 г, 28,7 ммоль), трифторметансульфонат цинка (2,30 г, 6,32 ммоль) и ТГФ (1 л). Реакционную смесь нагревали до 60C при перемешивании на горячей масляной бане, соединенной с водяным охлаждающим рефлюксным конденсатором, в атмосфере азота в течение 18 ч. К сырой реакционной смеси добавляли насыщенный раствор бикарбоната натрия, суспендировали в этилацетате и промывали насыщенным раствором бикарбоната натрия с последующим промыванием водой, солевым раствором, высушивали над сульфатом натрия, фильтровали и упаривали. Полученный остаток очищали хроматографией на силикагеле[1-(4 хлорфенил)циклобутил]карбамата (1-1) в виде белого твердого вещества. HRMS (M+Na)+: наблюдаемая= 304,1075, рассчитанная = 304,1075. трет-Бутил [1-(4-цианофенил)циклобутил]карбамат (1-2). К раствору трет-бутил [1-(4-хлорфенил)циклобутил]карбамата (1-1) (5,32 г, 18,9 ммоль) в безводном 1,4-диоксане (70 мл) добавляли цианид цинка (2,44 г, 20,8 ммоль), с последующим добавлением бис(три-трет-бутилфосфин)палладия(0) (0,965 г, 1,89 ммоль). Реакционную смесь нагревали до 100C с перемешиванием на горячей масляной бане, соединенной с водяным охлаждающим рефлюксным конденсатором, в атмосфере азота в течение 1,5 ч. Реакционную смесь фильтровали и упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле (0-5% ИПС/ДХМ) для получения трет-бутил [1-(4-цианофенил)циклобутила] (1-2) в виде воскового беловато-желтого твердого вещества.HRMS (M+H)+: наблюдаемая = 273,1598, рассчитанная = 273,1597. трет-Бутил 1-[4-(фенилацетил)фенил]циклобутилкарбамат (1-3). Раствор трет-бутил [1-(4-цианофенил)циклобутил]карбамата (1-2) (16,6 г, 61,0 ммоль) в безводном ТГФ (300 мл) охлаждали до -78C, с перемешиванием в атмосфере азота. Затем по капле в течение 5 мин добавляли 2,0 М раствор изопропилмагний хлорида в ТГФ (30,5 мл, 61,0 ммоль). Реакционную смесь оставляли для перемешивания при -78C в атмосфере азота в течение 10 мин. Затем по капле в течение 10 мин добавляли 2,0 М раствор бензилмагния хлорида в ТГФ (116 мл, 232 ммоль). Реакционную смесь оставляли для нагревания до 0C. Через 2 ч реакционную смесь гасили добавлением насыщенного раствора хлорида аммония при 0C. Реакционную смесь оставляли для нагревания до комнатной температуры,суспендировали в этилацетате, промывали насыщенным раствором хлорида аммония, насыщенным раствором бикарбоната натрия, с последующим промыванием водой, соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле(фенилацетил)фенил]циклобутилкарбамата (1-3) в виде воскового беловатого твердого вещества. HRMS(M+Na)+: наблюдаемая = 388,1892, рассчитанная = 388,1883. трет-Бутил 1-[4-(5-хлор-3-фенил-1,6-нафтиридин-2-ил)фенил]циклобутилкарбамат (1-5). В круглую плоскодонную колбу добавляли трет-бутил 1-[4-(фенилацетил)фенил]циклобутилкарбамат (1-3) (2,7 г, 6,1 ммоль), трет-бутил (2-хлор-3-формилпиридин-4 ил)карбамат (1-4) (1,6 г, 6,1 ммоль), карбонат калия (5,0 г, 6,0 ммоль) и ДМФ (20 мл). Реакционную смесь нагревали до 80C с перемешиванием на горячей масляной бане в атмосфере азота в течение 15 ч. Затем реакционную смесь нагревали до 120C в течение 1 ч. Реакционную смесь оставляли для охлаждения до комнатной температуры, добавляли воду, суспендировали в этилацетате, промывали насыщенным раствором бикарбоната натрия с последующим промыванием водой, соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле (5-50% EtOAc/5% ДХМ/гексан) для получения трет-бутил 1-[4-(5-хлор-3-фенил-1,6 нафтиридин-2-ил)фенил]циклобутилкарбамата (1-5) в виде беловатого твердого вещества. HRMS(M+H)+: наблюдаемая = 486,1954, рассчитанная = 486,1943. трет-Бутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин-2-ил)фенил]циклобутилкарбамат (1-6). В пробирку для микроволновой печи добавляли трет-бутил 1-[4-(5-хлор-3-фенил-1,6-нафтиридин 2-ил)фенил]циклобутилкарбамат (1-5) (4,05 г, 8,34 ммоль), безводный гидразин (5,24 мл, 167 ммоль) и 1,4-диоксан (15 мл). Затем реакционную смесь нагревали с помощью микроволнового излучения в течение 5 мин при 100C (высокий уровень поглощения). Реакционную смесь оставляли для охлаждения до комнатной температуры, суспендировали в этилацетате, промывали насыщенным раствором бикарбоната натрия с последующим промыванием водой, соляным раствором, высушивали над сульфатом натрия,фильтровали и упаривали в вакууме для получения трет-бутил 1-[4-(5-гидразино-3-фенил-1,6 нафтиридин-2-ил)фенил]циклобутилкарбамата (1-6) в виде твердого вещества оранжевого цвета/пены.MS (M+H)+: наблюдаемая = 482,3, рассчитанная = 482,59. трет-Бутил 1-[4-(5-2-[(1-метил-1H-имидазол-4-ил)карбонил]гидразино-3-фенил-1,6-нафтиридин 2-ил)фенил]циклобучилкарбамат (1-7). В круглую плоскодонную колбу добавляли трет-бутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин 2-ил)фенил]циклобутилкарбамат (1-6) (3,94 г, 8,18 ммоль), EDC (1,34 г, 10,6 ммоль), ГОБТ (1,44 г, 10,6 ммоль), 1-метил-1H-имидазол-4-карбоксильную кислоту (1,34 г, 10,6 ммоль) и ДМФ (40 мл). Реакционную смесь нагревали до 60C, с перемешиванием в атмосфере азота на горячей масляной бане. Через 45 мин реакционную смесь оставляли для охлаждения до комнатной температуры, суспендировали в этилацетате, промывали насыщенным раствором бикарбоната натрия, с последующим промыванием водой,соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме для получения трет-бутил 1-[4-(5-2-[(1-метил-1H-имидазол-4-ил)карбонил]гидразино-1,3-фенил-1,6 нафтиридин-2-ил)фенил]циклобутилкарбамата (1-7) в виде пены красного цвета. MS (M+H)+: наблюдаемая = 590,3, рассчитанная = 590,69. трет-Бутил (1-4-[3-(1-метил-1H-имидазол-4-ил)-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8 ил]фенилциклобутил)карбамат (1-8). В круглую плоскодонную колбу добавляли трет-бутил 1-[4-(5-2-[(1-метил-1H-имидазол-4 ил)карбонил]гидразино-3-фенил-1,6-нафтиридин-2-ил)фенил]циклобутилкарбамат (1-7) (2,73 г, 4,63 ммоль), уксусную кислоту (5,30 мл, 93 ммоль) и 1,4-диоксан (20 мл). Реакционную смесь нагревали до 80C с перемешиванием в открытом состоянии в атмосфере (накрытой) на горячей масляной бане. Через 3 ч реакционную смесь оставляли для охлаждения до комнатной температуры, суспендировали в этилацетате, промывали насыщенным раствором бикарбоната натрия, с последующим промыванием водой,соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле 1-15% ИПС/ДХМ. Соответствующие фракции объединяли и растворитель удаляли в вакууме. Полученный остаток повторно очищали обращенно-фазовой колоночной хроматографией (Sunfire C18) элюировали с градиентом 5-95% ацетонитрил/(0,1% ТФУ/вода). Соответствующие фракции оставляли в виде свободных оснований путем суспендирования в этилацетате, промывали насыщенным раствором бикарбоната натрия с последующим промыванием водой, соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме для получения трет-бутил (1-4-[3-(1-метил-1H-имидазол-4-ил)-9-фенил[1,2,4]триазоло[3,4-f]-l,6-нафтиридин-8-ил]фенилциклобутил)карбамата (1-8) в виде беловатого твердого вещества. MS (M+H)+: наблюдаемая = 572,3, рассчитанная = 572,7. 1-4-[3-(1-Метил-1H-имидазол-4-ил)-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил]фенилциклобутанамин дигидрохлорид (1-9). К раствору трет-бутил (1-4-[3-(1-метил-1H-имидазол-4-ил)-9-фенил[1,2,4]триазоло[3,4-f]-1,6 нафтиридин-8-ил]фенилциклобутил)карбамата (1-8) (2,52 г, 4,41 ммоль) в MeOH (5 мл) и ДХМ (15 мл) добавляли 4N раствор HCl в EtOAc (22 мл, 88 ммоль). Герметичную реакционную смесь оставляли для перемешивания при комнатной температуре. Через 4 ч реакционную смесь упаривали в вакууме для получения 1-4-[3-(1-метил-1H-имидазол-4-ил)-9-фенил[1,2,4]триазоло[3,4-f]-l,6-нафтиридин-8-ил]фе- 18016195 нилциклобутанамин дигидрохлорида (1-9) в виде твердого вещества желтого цвета. HRMS (M+H)+: наблюдаемая = 472,2249, рассчитанная = 472,2244. Следующие соединения изготавливали способом, подобным способу из примеров 1-9: 8-[4-(1-Аминоциклобутил)фенил]-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3-ол (1-16). В круглую плоскодонную колбу добавляли трет-бутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин 2-ил)фенил]циклобутилкарбамат (1-6) (2,77 г, 5,75 ммоль) и 1,1'-карбонил-бис(1H-имидазол) (4,10 г,4,40 ммоль) в 1,4 диоксане (30 мл). Затем герметично закрытую реакционную смесь нагревали при 95C в атмосфере азота. К сырой реакционной смеси добавляли насыщенный раствор бикарбоната натрия (100 мл) и этилацетата. Органический слой промывали насыщенным раствором бикарбоната натрия с последующим промыванием водой, соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали. Затем полученный остаток очищали хроматографией на силикагеле, элюировали ИПС/ДХМ с градиентом 0-10%. После этого объединяли соответствующие фракции и растворитель удаляли в вакууме для получения трет-бутил 1-[4-(3-гидрокси-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8 ил)фенил]циклобутилкарбамата (1-6a) в виде твердого вещества коричневого цвета. MS (M+H)+: наблюдаемая = 508,1, рассчитанная = 508,6. К раствору трет-бутил 1-[4-(3-гидрокси-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8 ил)фенил]циклобутилкарбамата (1-6a) (1,14 г, 2,25 ммоль) в MeOH (5 мл) и ДХМ (15 мл) добавляли 4N раствор HCl в EtOAc (22 мл, 8 8 ммоль) при комнатной температуре. Через 4 ч реакционную смесь упаривали в вакууме для получения 8-[4-(1-аминоциклобутил)фенил]-9-фенил[1,2,4]триазоло[3,4-f]-l,6 нафтиридин-3-ол гидрохлорида (1-16) в виде твердого вещества желтого цвета. HRMS (M+H)+: наблюдаемая = 408,1803, рассчитанная = 408,1819. Проведенный далее рентгеновский кристаллографический анализ желтого твердого вещества указывает, что твердое соединение 1-16 существует и имеет следующую химическую структуру:(1-6b). В круглую плоскодонную колбу добавляли EDC (569 мг, 2,97 ммоль), ГОБТ (401 мг, 10,6 ммоль),муравьиную кислоту (248 мг, 5,40 ммоль), ДХМ (20 мл) и НМП (2,5 мл). Затем реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 30 мин. После этого добавляли трет-бутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин-2-ил)фенил]циклобутилкарбамат (1-6) (1,30 г,2,70 ммоль). Затем реакционную смесь оставляли для перемешивания в течение ночи при комнатной температуре в атмосфере азота. Затем реакционную смесь суспендировали в этилацетате, промывали насыщенным раствором бикарбоната натрия, с промыванием водой, соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле EtOAc/ДХМ, 50-90%, затем 1-15% ИПС/ДХМ. Соответствующие фракции объединяли и растворитель удаляли в вакууме для получения трет-бутил 1-[4-(9-фенил[1,2,4]триазоло[3,4-f]-1,6 нафтиридин-8-ил)фенил]циклобутилкарбамата (1-6b) в виде твердого вещества коричневого цвета. MS(M+H)+: наблюдаемая = 492,2, рассчитанная = 492,6. 1-[4-(9-Фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин гидрохлорид (1-15). К раствору трет-бутила 1-[4-(9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамата (1-6b) (1,07 г, 2,177 ммоль) в MeOH (5 мл) и ДХМ (15 мл) добавляли 4N раствор HCl в EtOAc (5,44 мл, 21,77 ммоль). Герметично закрытую реакционную смесь оставляли для перемешивания при комнатной температуре. Через 4 ч реакционную смесь фильтровали для получения 1-[4-(9 фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамина гидрохлорида (1-15) в виде твердого вещества коричневого цвета. HRMS (M+H)+: наблюдаемая = 392,1872, рассчитанная = 392,1870. Схема 1C 1-(4-Бромфенил)циклобутанкарбонитрил (1-2c). Соединения ТБАБ (1,61 г, 0,5 ммоль), дибромпропан (22,2 г, 110 ммоль) и нитрил 1-1c (19,6 г, 100 ммоль) добавляли с перемешиванием к раствору KOH (31,17 г, 500 ммоль) в смеси с 15 мл воды и 200 мл толуола (поддерживали температуру от 72 до 79C). Реакционную смесь нагревали паром и перемешивали при 99-108C в течение 2,5 ч. Реакционную смесь охлаждали до 80C и добавляли 200 мл гептана. После охлаждения с перемешиванием смеси до КТ прозрачную верхнюю фазу раствора фильтровали,промывали водой (330 мл) и упаривали в вакууме для получения маслянистого продукта 1-2c. 1-(4-Бромфенил)циклобутанкарбоксамид (1-3c).H2O2 (30% 11,3 мл, 118 ммоль) добавляли в течение 3 ч к перемешиваемой смеси нитрила 1-2c(13,88 г, примерно 58,9 ммоль) и K2CO3 (1,62 г, 11,8 ммоль) в 59 мл диметилсульфоксида при температу- 22016195 ре от 40 до 87C с охлаждением на водяной бане. Получаемую смесь охлаждали до 27C и добавляли воду (100 мл) в течение 30 мин. Получали прозрачный продукт 1-3c. Дополнительное количество воды(100 мл) добавляли в течение 1 ч. Полученную суспензию выдерживали при КТ в течение 16 ч перед фильтрованием. Осадок ополаскивали 100 мл воды и затем 100 мл гептана. После высушивания в вакуумной печи при 50C получали продукт 1-3c в виде белого твердого вещества. трет-Бутил [1-(4 бромфенил)циклобутил]карбамат (1-4c) Pb(OAc)4 (25,7 г, 25,7 ммоль) добавляли к перемешиваемому раствору амида 1-3c (12,7 г, 50 ммоль) в 64 мл t-BuOH при температуре от 57 до 86C с охлаждением на водяной бане. Получаемую смесь перемешивали при 65-86C в течение 0,5 ч. Смесь охлаждали до 26C и добавляли 12,7 г Na2CO3, с последующим добавлением 65 мл MTBE. Через 10 мин смесь фильтровали. Осадок ополаскивали 10 л MTBE, объединенный фильтрат промывали 20 мл воды и затем промывали органический слой 3 раза по 10 мл 10% KHCO3 (внимание: пузырение), высушивали над Na2SO4 и упаривали в вакууме. Получаемое твердое вещество ополаскивали с помощью 8 мл ИПС и 8 мл гептана и высушивали в вакуумной печи при 40C для получения продукта 1-4c в виде серого твердого вещества. трет-Бутил [1-(4-цианофенил)циклобутил]карбамат (1-2). Перемешиваемую суспензию Pd2dba3 (101 мг; 1% моль) и dppf (122 мг; 2% моль) в ДМФ (25 мл) разбрызгивали с азотом в течение 5 мин и затем нагревали до 65C и выдерживали 30 мин. В этот временной отрезок добавляли арилбромид 1-4c (3,6 г, 11 ммоль), цинковый порошок (51 мг; 6% моль) и цианид цинка (777 мг; 0,60 экв.), с ополаскиванием ДМФ (5 мл). Раствор нагревали до 92-95C и выдерживали в течение 4 ч. Раствор охлаждали до КТ в течение ночи и фильтровали через подушку Solka Floc,ополаскивали осадок ДМФ (5 мл). Воду (30 мл) добавляли в течение 3,5 ч при 25-33C вместе с затравкой. После выдерживания в течение ночи при КТ полученный прозрачный раствор фильтровали, промывали водным метанолом и высушивали в течение ночи, чтобы получить продукт 1-2 в виде желтого твердого вещества. трет-Бутил 1-[4-фенилацетил)фенил]циклобутилкарбамат (1-3). Бензильный реактив Гриньяра (19 мл, 38,5 ммоль) добавляли к перемешиваемому, немного мутному раствору нитрила 1-2 (3 г, 11 ммоль) в ТГФ (25 мл) и охлаждали примерно до -20C с такой скоростью, чтобы температура реакции не повышалась выше -10C. Раствор выдерживали в течение 3-4 ч, поддерживая температуру реакции в диапазоне от -10 до -20C. Перемешанный раствор охлаждали до -30C и добавляли в раствор водной лимонной кислоты 15% вес. (60 мл), который предварительно охлаждали до 5-10C, и поддерживали температуру ниже 15C. Разделяли слои и водный слой промывали с MTBE. Органические слои объединяли, промывали половиной насыщенного соляного раствора (60 мл) и упаривали при пониженном давлении. Добавляли гептан и упаривали смесь до состояния суспензии, которую фильтровали, промывали гептаном (15 мл) и высушивали в атмосфере азота для получения 1-3. 4-Амино-2-хлорникотинальдегид (1-5c). Трифторуксусную кислоту (17,4 мл, 234 ммоль) осторожно добавляли к перемешанной смеси БОКальдегида 1-4 (20 г, 78,1 ммоль) и дихлорметана (60 мл), поддерживая температуру ниже 25C. Раствор нагревали до 35C, выдерживали в течение ночи (с энергичным рассыщением газом) и затем охлаждали до комнатной температуры. Добавляли 25 мл MTBE и полученный белый жидкий раствор выдерживали в течение одного часа, фильтровали и ополаскивали фильтровальный осадок MTBE (10 мл 2). Соль ТФУ 1-5c в виде твердого вещества высушивали в вакууме. трет-Бутил 1-[4-(5-хлор-3-фенил-1,6-нафтиридин-2-ил)фенил]циклобутилкарбамат (1-5). Раствор гидроксида калия 45 вес.% (18 мл; 5 экв.) добавляли по капле в течение свыше 20 мин к перемешиваемой смеси соли хлорпиридина ТФУ 1-5c (19,5 г), циклобутиламинокетона 1-3 (26 г) и изопропанола (200 мл), поддерживая температуру ниже 24C. Через 1 ч добавляли воду (100 мл) и еще через один час полученную суспензию фильтровали, промывали смесью 2:1 ИПС/воды (30 мл, потом 24 мл),затем водой (80 мл, потом 260 мл). Твердое вещество высушивали в токе азота с получением 1-5 в виде не совсем белого твердого вещества. трет-Бутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин-2-ил)фенил]циклобутилкарбамат (1-6). Безводный гидразин (25 мл, 797 ммоль) добавляли к перемешанному раствору хлорнафтиридина (15) (25,12 г, 51,7 ммоль) в 1,4-диоксане (200 мл) в атмосфере азота, и реакционную смесь нагревали до 95C. Через 30 мин раствор охлаждали до комнатной температуры, добавляли этилацетат (400 мл) и раствор промывали насыщенным раствором бикарбоната натрия с последующим промыванием водой и соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме для получения (1-6) в виде твердого вещества оранжевого цвета. трет-Бутил 1-[4-(9-фенил-3-пиримидин-2-ил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамат (1-6d). В круглую плоскодонную колбу добавляли трет-бутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин 2-ил)фенил]циклобутилкарбамат (1-6) (267 мг, 0,554 ммоль), EDC (138 мг, 0,721 ммоль), ГОБТ (97 мг,0,721 ммоль), пиримидин-2-карбоксильную кислоту (89 мг, 0,721 ммоль), DIPEA (0,367 мл, 2,218 ммоль) и ДМФ (3 мл). Реакционную смесь закрывали и нагревали с помощью микроволнового излучения при 100C в течение 5 мин. Смесь охлаждали, добавляли уксусную кислоту (0,476 мл, 8,32 ммоль) и затем реакционную смесь закрывали и нагревали микроволновым излучением при 80C в течение 5 мин. Реакционную смесь оставляли для охлаждения до комнатной температуры, суспендировали в этилацетате, промывали насыщенным раствором бикарбоната натрия с последующим промыванием водой,соляным раствором, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле 0-10% ИПС/ДХМ. Соответствующие фракции объединяли и растворитель удаляли в вакууме для получения трет-бутил 1-[4-(9-фенил-3-пиримидин-2-ил[1,2,4]триазоло [3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамата (1-6d) в виде твердого вещества оранжевого цвета. MS (M+H)+: наблюдаемая = 570,2, рассчитанная = 570,7. 1-[4-(9-Фенил-3-пиримидин-2-ил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутамин гидрохлорид (1-10). К раствору трет-бутил 1-[4-(9-фенил-3-пиримидин-2-ил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8 ил)фенил]циклобутилкарбамата (1-6d) (71 мг, 0,125 ммоль) в MeOH (2 мл) и ДХМ (3 мл) добавляли 4N раствор HCl в EtOAc (3 мл, 12 ммоль). Герметично запечатанную реакционную смесь оставляли для перемешивания при комнатной температуре. Через 4 ч реакционную смесь упаривали. Через 4 ч реакционную смесь упаривали в вакууме. Полученный остаток очищали обращенно-фазовой колоночной хроматографией (Sunfire C18), элюировали с градиентом 1-50% ацетонитрил/(0,1% ТФУ/вода). Соответствующие фракции упаривали в вакууме. Полученный остаток затем растворяли в ДХМ (5 мл) и MeOH (5 мл),после этого добавляли 4N раствор HCl в EtOAc (5 мл, 20 ммоль), затем упаривали в вакууме для получения 1-[4-(9-фенил)-3-пиримидин-2-ил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин гидрохлорида (1-10) в виде коричневого твердого вещества. HRMS (M+H)+: наблюдаемая = 470,2098,рассчитанная = 470,2088. Промежуточный продукт (1-5e). Перемешанную суспензию хлорнафтиридина 1-5 (1,8 г), метилгидразинкарбоксилата (0,318 г) и изопропанола (20 л) нагревали до 66C до состояния гомогенности. Добавляли 5-6 N HCl в ИПС (0,05 мл) и повышали температуру до 70C в течение 16 ч, затем охлаждали до КТ. После охлаждения до КТ 45 вес.% раствора гидроксида калия (0,52 мл) смешивали с водой (5,5 мл) и добавляли в течение 15 мин. Через 30 мин добавляли водную уксусную кислоту (0,7 мл в 6 мл воды) с последующим добавлением воды (2 мл). Полученную суспензию выдерживали при КТ в течение трех часов, фильтровали и промывали промывали смесью 1:1 ИПС/воды (22,4 мл). Продукт высушивали в токе азота, затем приводили в пастообразное состояние в метиленхлориде при 20C в течение 4 ч, фильтровали и высушивали в токе азота для получения продукта 1-5e в виде не совсем белого твердого вещества. 8-[4-(1-Аминоциклобутил)фенил]-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3(2H)он (1-16). Раствор водной концентрированной HCl (12,1 М, 1,64 мл) в этаноле (2,0 мл) добавляли по капле в течение 30 мин к перемешанной суспензии 1-5e (500 мг, 0,985 ммоль) в этаноле (1,7 мл) и воде (0,2 мл) при 50C. Через 3 ч после добавления кислоты в реакционную смесь вводили затравку и выдерживали в течение ночи при 50C, охлаждали до комнатной температуры и фильтровали. К этанолу (2 мл) добавляли ацетилхлорид (0,5 г, 7 ммоль) в течение 1 ч при 0C. Затем раствор охлаждали до комнатной температуры и выдерживали в течение 30 мин. Фильтровальный осадок промывали указанным раствором (1 мл 2), затем этилацетатом (4 мл 2), после чего высушивали в вакуумной печи при 75,0C с очисткой азотом (50 торр) до полного превращения из формы IV 1-16 в Форму II, что выявляли по XRPD. Способ, используемый в схеме 1A, дает кристаллическую соль бис-HCl 1-16 указанной формы I. Способы, описанные в схеме 1E, дают на выходе три новых полиморфа соли бис-HCl 1-16, обозначенные как формы II, III и IV. Было обнаружено, что высушивание как формы III, так и формы IV при сниженном давлении с очисткой азотом приводит к их полному превращению в форму II. Когда смеси форм I иII в подкисленном этаноле приводили в пастообразное состояние, в результате получали форму III в виде суспензии. Отделение формы III и ее высушивание, как описано выше, приводит к получению формы II. Моно-HCl вариант 1-16 также получали посредством растворения в воде. Через 6 ч водная суспензия становилась светло-желтой и подвергалась фильтрованию. Титрование хлоридом серебра указанного твердого вещества показывает присутствие одного эквивалента хлорида. Наконец, обработка соли бисHCl 1-16 водным KOH (2 экв.) дает в результате нейтральный продукт 1-16, что определяли титрованием хлоридом. Схема 1F трет-Бутил 1-[4-(3-метил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамат 1-6f). В круглую плоскодонную колбу добавляли EDC (4,63 г, 24,17 ммоль), ГОБТ (3,27 г, 24,17 ммоль),безводный ДХМ (50 мл) и уксусную кислоту (13,2 мл, 13,86 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 30 мин. После этого добавляли третбутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин-2-ил)фенил]циклобутилкарбамат (1-6) (10,58 г, 21,97 ммоль). Затем реакционную смесь оставляли для перемешивания в течение ночи (18 ч) при комнатной температуре в атмосфере азота, затем нагревали до 80C в течение 2 ч. После этого реакционную смесь суспендировали в этилацетате, медленно вливали в насыщенный раствор бикарбоната натрия, с последующим промыванием водой и соляным раствором, высушивали над сульфатом натрия, фильтровали и- 25016195 упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле 1-20% ИПС/ДХМ. Соответствующие фракции соединяли и растворитель удаляли в вакууме для получения трет-бутил 1[4-(3-метил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамата (1-6f) в виде коричневого твердого вещества. MS (M+H)+: наблюдаемая = 506,2, рассчитанная = 506,6. 1-[4-(3-Метил-9-фенил[1,2,4]триазоло[3,4-f]-l,6-нафтиридин-8-ил)фенил]циклобутанамин гидрохлорид (1-17). К раствору трет-бутил 1-[4-(3-метил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил] циклобутилкарбамата (1-6f) (9,23 г, 18,26 ммоль) в MeOH (20 мл) и ДХМ (100 мл) добавляли 4N раствор HCl в EtOAc (91 мл, 3 65 ммоль). Герметично запечатанную реакционную смесь оставляли для перемешивания при комнатной температуре. Через 18 ч реакционную смесь фильтровали для получения 1[4-(3-метил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин гидрохлорида (117) в виде беловатого твердого вещества. HRMS (M+H)+: наблюдаемая = 406,2047, рассчитанная = 406,2026. Схема 1G трет-Бутил 1-[4-(3-циклопропил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамат (1-6g). В круглую плоскодонную колбу добавляли EDC (535 мг, 2,79 ммоль), ГОБТ (37 7 мг, 2,79 ммоль),безводный ДХМ (17,5 мл), безводный НМП (2,5 мл) и циклопропанкарбоновую кислоту (248 мг, 5,40 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 30 мин. Затем добавляли трет-бутил 1-[4-(5-гидразино-3-фенил-1,6-нафтиридин-2 ил)фенил]циклобутилкарбамат (1-6) (1,221 г, 2,54 ммоль). После этого реакционную смесь оставляли для перемешивания в течение ночи (18 ч) при комнатной температуре в атмосфере азота. Добавляли уксусную кислоту (2,178 мл, 38,0 ммоль) и реакционную смесь нагревали на горячей масляной бане при 80C в течение 2 ч. Реакционную смесь оставляли для охлаждения до комнатной температуры и добавляли этилацетат, после чего смесь промывали насыщенным раствором бикарбоната натрия, воды и соляного раствора, высушивали над сульфатом натрия, фильтровали и упаривали в вакууме. Полученный остаток очищали хроматографией на силикагеле 90% EtOAc/ТДХМ (изократической). Соответствующие фракции объединяли и растворитель удаляли в вакууме для получения трет-бутил 1-[4-(3-циклопропил 9-фенил [1,2,4]триазоло [3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутилкарбамата (1-6g) в виде розового твердого вещества. HRMS (M+H)+: наблюдаемая = 532,2729, рассчитанная = 532,2707. 1-[4-(3-Циклопропил-9-фенил[1,2,4]триазоло[3,4-f]-l,6-нафтиридин-8-ил)фенилциклобутанамина гидрохлорид (1-23). К раствору трет-бутил 1-[4-(3-циклопропил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8 ил)фенил]циклобутилкарбамата (MJK-9)(899,4 мг, 18,26 ммоль) в MeOH (5 мл) и ДХМ (15 мл) добавляли 4N раствор HCl в EtOAc (4,23 мл, 16,92 ммоль). Герметично запечатанную реакционную смесь оставляли для перемешивания при комнатной температуре. Через 18 ч реакционную смесь фильтровали для получения 1-[4-(3-метил-9-фенил[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-ил)фенил]циклобутанамин гидрохлорида (1-23) в виде желтого твердого вещества. HRMS (M+H)+: наблюдаемая = 432,2186, рассчитанная = 432,2183. Пример 1. Клонирование изоформ Akt и PH-Akt1 человека. Вектор pS2neo (депонированный в Американской коллекции типовых культур ATCC 3 апреля 2001 г. под наименованием ATCC PTA-3253) был изготовлен следующим образом: вектор pRmHA3 (изготовленный согласно описанию в Nucl. Acid. Res. 16: 1043-1061 (1988 подвергали усечению с помощью BglII и выделяли фрагмент в 2734 пар оснований (п.о.). Вектор pUChsneo (изготовленный, как описано в журналеEMBO J. 4: 167-171 (1985 также подвергали усечению BglII и выделяли группу в 4029 п.о. Оба указанных выделенных фрагмента сшивали вместе для создания вектора, называемого pS2neo-1. Эта плазмида содержит полилинкер между промотором металлотионина и добавочным сайтом поли-A алкогольдегид- 26016195 рогеназы. Также указанная плазмида несет новый ген резистентности, переносимый промотором теплового шока. Вектор pS2neo-1 подвергали усечению с помощью Psp5II и BsiWI. Синтезировали два комплементарных олигонулеотида и затем подвергали гибридизации (CTGCGGCCGC (SEQ ID NO: 1) иGTACGCGGCCGCAG (SEQ ID NO: 2. Усеченный pS2neo-1 и гибридизованные олигонулеотиды сшивали вместе для создания второго вектора, pS2neo. При этой конверсии добавляли участок NotI для облегчения линеаризации перед трансфекцией в клетки S2. Ген человека Akt1 амплифицировали ПЦР (Clontech) из кДНК человеческой селезенки (Clontech) с использованием 5' праймера 5'CGCGAATTCAGATCTACCATGAGCGACGTGGCTATTGTG 3' (SEQ IDNO: 3) и праймера 3': 5'CGCTCTAGAGGATCCTCAGGCCGTGCTGCTGGC3' (SEQ ID NO: 4). 5' праймер включал сайты EcoRI и BglII. В целях клонирования целей 3' праймер включал сайт XbaI и BamHI. Получаемый продукт ПЦР субклонировали в pGEM3Z (Promega) как фрагмент EcoRI/XbaI. В целях экспрессии/очистки средний маркер T добавляли к 5' концу полноразмерного гена Akt1, используя ПЦР праймер 5'GTACGATGCTGAACGATATCTTCG 3' (SEQ ID NO: 5). Полученный продукт ПЦР охватывал сайт 5' KpnI и сайт 3' BamHI, которые использовали для клонирования фрагмента в рамке считывания с маркером биотина, содержащим вектор экспрессии клетки насекомого, pS2neo. Для экспрессии плекстрин-гомологичного домена (ПГ) выполняли делецию версии Akt1 (аа 4-129,которая включала делецию части шарнирной области Akt1), проводили ПЦР для мутегенеза делецией,используя в качестве матрицы полноразмерный ген Akt1 в векторе pS2neo. ПЦР проводили в 2 этапа, используя перекрывающиеся внутренние праймеры(5'GAATACATGCCGATGGAAAGCGACGGGGCTGAAGAGATGGAGGTG 3' (SEQ ID NO:6) и 5'CCCCTCCATCTCTTCAGCCCCGTCGCTTTCCATCGGCATGTATTC 3' (SEQ ID NO:7, охватывающих делецию и 5' и 3' фланкирующих праймеров, в которые входили сайт KpnI и средний маркер T на 5' конце. Конечный продукт ПЦР расщепляли с помощью KpnI и SmaI и лигировали в pS2neo полноразмерного Akt1 KpnI/усеченного SmaI вектора, эффективно замещая 5' конец клона делетированной версией. Человеческий ген Akt3 амплифицировали путем ПЦР из кДНК мозга взрослого человека (Clontech) с использование олигопраймера с аминоконцом 5' GAATTCAGATCTACCATGAGCGATGTTACCATTGTG 3' (SEQ ID NO:8) и олигопраймера с карбоксиконцом 5' TCTAGATCTTATTCTCGTCCACTTGCAGAG 3' (SEQ ID NO:9). Для клонирования указанные праймеры включали сайт 5' EcoRI/BglII и сайт 3' XbaI/BglII. Получаемый продукт ПЦР клонировали в сайты EcoRI и XbaI вектора pGEM4Z (Promega). Для экспрессии/очистки средний маркер T добавляли к 5' концу клона полноразмерного Akt3 с использованием ПЦР праймера 5'GGTACCATGGAATACATGCCGATGGAAAGCGATGTTACCATTGTGAAG 3' (SEQ ID NO: 10). Получаемый продукт ПЦР охватывал сайт 5' KpnI, что позволяло проводить в рамке клонирование с маркером биотина, содержащим вектор экспрессии клетки насекомого, pS2neo. Человеческий ген Akt2 амплифицировали путем ПЦР из кДНК тимуса человека (Clontech) с использование олигопраймера с аминоконцом: 'AAGCTTAGATCTACCATGAATGAGGTGTCTGTC 3' (SEQ(SEQ ID NO: 12). В целях клонирования указанные праймеры включали сайты 5' HindIII/BglII и сайт 3'EcoRI/BamHI. Получаемый продукт ПЦР клонировали в сайты HindIII/EcoRI вектора pGem3Z (Promega). Для экспрессии/очистки средний маркер T добавляли к 5' концу клона полноразмерного Akt2, с использованием ПЦР праймера 5' GGTACCATGGAATACATGCCGATGGAAAATGAGGTGTCTGTCATCAAAG 3' (SEQ ID NO: 13). Получаемый продукт ПЦР клонировали в вектор pS2neo, как описано выше. Пример 2. Экспрессия изоформ Akt и PH- Akt1 человека. Проводили очистку ДНК, содержащей клонированные Akt1, Akt2, Akt3 и ДРН- Akt1 гены в pS2neo векторе экспрессии, и использовали ее для трансфекции в клетки S2 Drosophila (ATCC) по фосфатнокальциевой методике. Отбирали пулы клеток, резистентных к антибиотикам (G418, 500 мкг/мл). Клетки выращивали до объема 1,0 л (примерно 7,0106/мл), добавляли биотин и CuSO4 в конечной концентрации 50 мкМ и 50 мМ, соответственно. Клетки выращивали в течение 72 ч при 27C и собирали центрифугированием. Клеточную пасту замораживали при -70C до использования. Пример 3. Очистка изоформ Akt и PH- Akt1 человека. Клеточную пасту из одного литра клеток S2, описанных в примере 2, подвергали лизированию ультразвуком с 50 мл 1% CHAPS в буфере А: (50 мМ Трис pH 7,4 с 1 мМ ЭДТА, 1 мМ ЭГТА, 0,2 мМAEBSF, 10 мкг/мл бензамидина, по 5 мкг/мл лейпептина, апротинина и пепстатина, 10% раствор глицерина и 1 мМ ДТТ). Растворимую фракцию очищали на протеин G-сефарозной колонке с быстрым потоком (Protein G Sepharose fast flow column Pharmacia), которую загружали 9 мг/мл анти-T-средним моноклональным антителом, и элюировали пептидом EYMPME (SEQ ID NO: 14) в объеме 75 мкМ в буфереA, содержащем 25% глицерина. Соединяли фракции, содержащие Akt/PKB, и чистоту белка оценивали электрофорезом в SDS-PAGE. Проводили количественный анализ очищенного белка с использованием стандартного Брэдфордского протокола. Очищенный белок подвергали быстрому замораживанию в жидком азоте и сохраняли при -70C.Akt и Akt с делециями плекстрин-гомологичного домена очищали из клеток S2, предусматривая активацию. Akt и Akt с делециями плекстрин-гомологичного домена подвергали активации (Alessi et al.Current Biology 7:261-269) в реакции, содержащей 10 нм PDK1 (Upstate Biotechnology, Inc.), липидные везикулы (10 мкМ фосфатидилинозитол-3,4,5-трифосфата - Metreya, Inc, 100 мкМ фосфатидилхолина и 100 мкМ фосфатидилсерина - Avanti Polar lipids, Inc.) и активирующий буфер (50 мМ Трис с уровнем pH 7,4, 1,0 мМ ДТТ, 0,1 мМ ЭГТА, 1,0 мкМ микроцистина-LR, 0,1 мМ АТФ, 10 мМ MgCl2, 333 мкг/мл БСА и 0, 1 мМ ЭДТА). Реакционную смесь инкубировали при 22C в течение 4 ч. Аликвотные количества подвергали быстрому замораживанию в жидком азоте. Пример 4. Анализы Akt-киназы Проводили анализ активированных Akt изоформ и конструкций с делецией плекстрингомологичного домена, используя биотинилированную пептидную матрицу киназы гликогенсинтетазы(GSK). Степень фосфорилирования пептида определяли по гомогенной флюоресценции с разрешением во времени (HTRF), с использованием нагруженного лантанидным хелатом моноклонального антитела(SA-APC), флуорофором, который будет связываться с группой биотина на пептиде. Если Lanceантитело и аллофикоцианин (APC) находятся в близости (т.е. соединены с одной и той же фосфопептидной молекулой), происходит неизлучающая передача энергии от Lance-антитела до АРС, сопровождающаяся эмиссией света от APC с длиной волны 665 нм. Материалы, необходимые для анализаG. 100 Коктейль ингибиторов протеазы (КИП): 1 мг/мл бензамидина, 05 мг/мл пепстатина, 0,5 мг/мл лейпептина, 0,5 мг/мл апротинина.K. Ферментный рабочий раствор: 1 тестовый буфер, 1 мМ ДТТ, 1 КИП, 5% глицерина, активированный Akt. Конечные концентрации фермента выбирают таким образом, чтобы анализ происходил с прямо пропорциональной реакцией.L. Пептидный рабочий раствор: 1 тестовый буфер, 1 мМ ДТТ, 1 КИП, 5% глицерина, 2 TM GSK3 биотинилированного пептида 3928. Постановку реакции начинали путем добавления рабочего раствора 16 TL АТФ/MgCl2 в соответствующие лунки 96-луночного микротитровального планшета. Добавляли ингибитор или носитель (1,0 Tl) с последующим добавлением 10 Tl пептидного рабочего раствора. Реакцию начинали путем добавления 13 Tl ферментного рабочего раствора и смешивания. Реакцию оставляли для осуществления в течение 50 мин и затем останавливали добавлением 60 Tl HTRF - блокирующего буфера. После остановки реакционную смесь инкубировали при комнатной температуре в течение по меньшей мере 30 мин и затем считывали на устройстве Discovery. Методика теста свечения стрептавидина в планшете (Streptavidin Flash Plate) Этап 1. 1 мкл раствора тестового соединения в 100% ДМСО добавляли к 20 мкл 2 матричного раствора (20 мкМ GSK3 пептида, 300 мкМ АТФ, 20 мМ MgCl2, 20 мкКи/мл [33P]АТФ, 1 тестового буфера, 5% глицерина, 1 мМ ДТТ, 1 КИП, 0,1% БСА и 100 мМ KCl). Начинали реакции фосфорилирования путем добавления 19 мкл 2 ферментного раствора (активированные Akt/PKB, 6,4 нМ, 1 тестового буфера, 5% глицерина, 1 мМ ДТТ, 1 КИП и 0,1% БСА). Затем реакционную смесь инкубировали при комнатной температуре в течение 45 мин. Этап 2. Реакцию останавливали путем добавления 170 мкл ЭДТА в объеме 125 мМ. После прекращения реакции 200 мкл реакционной смеси переносили в планшет Streptavidin Flashplate PLUS (NEN Life Sciences,в каталоге SMP103). Планшет инкубировали при комнатной температуре в течение 10 мин на планшетном шейкере. Содержимое каждой лунки аспирировали и лунки ополаскивали 2 раза 200 мкл- 28016195 Трис-буферного раствора (TBS) на лунку. Затем лунки промывали 3 раза в течение 5 мин TBS в объеме 200 мкл на лунку и во время этапов промывания планшеты инкубировали при комнатной температуре на планшетном шейкере. Планшеты покрывали воздухонепроницаемой лентой и производили подсчет с использованием счетчика Packard TopCount с соответствующими параметрами настройки для подсчета вспышек света[33P] в планшетах Flashplates. Методика теста стрептавидина на фильтровальной пластине (Streptavidin Filter Plate) Этап 1. Проводили ферментативные реакции, как описано на этапе 1 теста свечения стрептавидина в планшете. Этап 2. Реакцию останавливали путем добавления 20 мкл 7,5 М гуанидина гидрохлорида. После прекращения реакции 50 мкл реакционной смеси переносили на фильтровальную пластину со стрептавидином(SAM2 Biotin Capture Plate, Promega,в каталоге V7542) и реакционную смесь инкубировали на фильтре в течение 1-2 мин перед воздействием вакуумом. Затем промывали планшету, используя вакуумный коллектор следующим образом: 1) 4200 мкл/лунка 2 М NaCl; 2) 6200 мкл/лунка 2 М NaCl 1% H3PO4; 3) 2200 мкл/лунка ди H2O; и 4) 2100 мкл/лунка 95% этанола. После этого мембраны оставляли на воздухе до полного высушивания перед добавлением сцинтилляционной жидкости. Дно планшета заклеивали белой поддерживающей лентой и добавляли сцинтилляционную жидкость Microscint 20 (Packard Instruments,в каталоге 6013621) в объеме 30 мкл/лунка. Верх планшета закрывали воздухонепроницаемой лентой и производили подсчет с использованием счетчика PackardTopCount с соответствующими параметрами настройки для подсчета в планшетах [33P] со сцинтилляционной жидкостью. Методика теста фосфоцеллюлозы на фильтровальной пластине Этап 1. Проводили ферментативные реакции, как описано на этапе 1 теста свечения стрептавидина в планшете (см. выше) с использованием в качестве матрицы последовательности KKGGRARTSSFAEPG (SEQID NO: 16) вместо последовательности биотин-GGRARTSSFAEPG. Этап 2. Реакцию останавливали путем добавления 20 мкл 0,75% H3PO4. После прекращения реакции 50 мкл реакционной смеси переносили на фильтровальный планшет (UNIFILTER, Whatman P81 Strong CationExchanger, белые полистироловые 96-луночные планшеты, Polyfiltronics,в каталоге 7700-3312), и реакционную смесь инкубировали на фильтре в течение 1-2 мин перед воздействием вакуумом. Затем промывали планшет, используя вакуумный коллектор следующим образом: 1) 9200 мкл/лунка, 0,75% H3PO4; и 2) 2200 мкл/лунка ди H2O. Дно планшета заклеивали белой поддерживающей лентой и добавляли сцинтилляционную жидкость Microscint 20 в объеме 30 мкл/лунка. Верх планшета закрывали воздухонепроницаемой лентой и производили подсчет с использованием счетчика Packard TopCount с соответствующими параметрами настройки для подсчета в планшетах [33P] со сцинтилляционной жидкостью. Анализ PKA В каждом отдельном анализе PKA использовали следующие компоненты:B. 50 мкМ исходного раствора Kemptide (Sigma), разведенного в воде.C. 33P-АТФ, приготовленный путем разведения 1,0 мкл 33P-АТФ [10 мКи/мл] в 200 Tl 50 мкМ исходного раствора немеченного АТФ.D. 10 мкл исходного раствора 70 нМ каталитической субъединицы PKA (каталог UBI 14-114), разведенного в БСА в количестве 0,5 мг/мл.E. Рабочий раствор PKA/Kemptide: равные объемы 5 тестового буфера PKA, раствора Kemptide и каталитической субъединицы PKA. Постановку реакции осуществляли в 96-луночном тестовом планшете с глубокими лунками. Ингибитор или носитель (10 Tl) добавляли к 10 Tl раствора 33P-АТФ. Реакцию начинали путем добавления в каждую лунку 30 Tl рабочего раствора PKA/Kemptide. Реакционные компоненты смешивали и инкубировали при комнатной температуре в течение 20 мин. Реакции прекращали путем добавления 50 Tl 100 ммоль ЭДТА и 100 ммоль пирофосфата натрия и смешивали. Продукт ферментной реакции (фосфорилированный раствор Kemptide) собирали на p81 фосфоцеллюлозный 96-луночный фильтровальный планшет (Millipore). Для подготовки планшета каждую лунку в фильтровальном планшете р 81 заполняли фосфорной кислотой в объеме 75 мМ. Лунки освобождали через фильтр, воздействуя вакуумом на дно планшета. В каждую лунку добавляли фосфорную кислоту (75 мм, 170 мкл). Аликвоты в объеме 30 мкл из каждой остановленной PKA реакции добавляли в соответст- 29
МПК / Метки
МПК: C07D 413/04, A61K 31/4353, C07D 403/06, C07D 401/04, A61P 35/00, C07D 409/04, C07D 471/04, C07D 417/04, C07D 407/04, C07D 401/06, C07D 403/04
Метки: ингибиторы, действия
Код ссылки
<a href="https://eas.patents.su/30-16195-ingibitory-dejjstviya-akt.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы действия akt</a>
Предыдущий патент: Обожженный огнеупорный продукт
Следующий патент: Производные индолинона и способ их получения
Случайный патент: Оценка шума на одной частоте посредством замера шума на других частотах