Производные пиримидина
Номер патента: 15890
Опубликовано: 30.12.2011
Авторы: Ху Чэн-Кун, Чоу Мин-Чэнь, Хуан Ин-Хуэй, У Чиэнь-Хуан, Кинг Чи-Син Ричард, Тсэн Чэнь-Тсо, Ен Чи-Фэн, Чэнь Шу-Цзэн
Формула / Реферат
1. Соединение формулы (I)
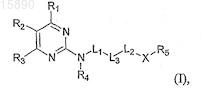
где
X представляет собой -N(Ra)-;
L1 представляет собой C1-С10алкилен или -С(О)-;
L2 отсутствует или представляет собой C1-С10алкилен;
L3 представляет собой С3-С20циклоалкил;
каждый из R1, R2и R3 независимо представляет собой Н, С1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил, гетероарил, галоген, CN, ORc, COORc, OC(O)Rc, C(O)Rc, C(O)NRcRd или NRcRd;
R4 представляет собой Н и
R5 представляет собой С3-С20циклоалкил, С3-С20гетероциклоалкил, арил, гетероарил или C1-С10алкил, замещенный С3-С20циклоалкилом, С3-С20гетероциклоалкилом или N(ReRf);
где каждый из Ra, Rb, Rc, Rd, Re и Rf независимо представляет собой Н, С1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил, гетероарил или -C(O)R, причем R представляет собой Н, C1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил или гетероарил;
или его соль.
2. Соединение по п.1, в котором L3 представляет собой циклогексилен.
3. Соединение по п.1, в котором R5 представляет собой C1-С10алкил, замещенный N(ReRf) или С3-С20гетероциклоалкил.
4. Соединение по п.3, в котором R5 представляет собой
![]()
5. Соединение по п.1, в котором R3 представляет собой С3-С20гетероциклоалкил, замещенный C1-C10алкилом, который необязательно замещенный PO(OR')2, OSO3R' или COOR', С3-С20циклоалкилом, С3-С20гетероциклоалкилом, арилом, группами OR', C(O)R', COOR', C(O)N(R'R"), SO2R' или C(S)N(R'R"), в которых каждый из R' и R" независимо представляет собой Н, C1-C10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил или гетероарил.
6. Соединение, представляющее собой одно из

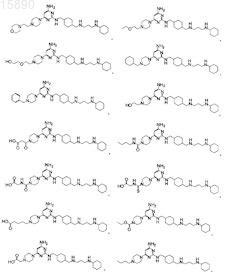
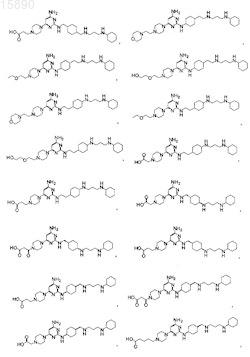
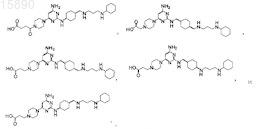
7. Соединение, представляющее собой одно из
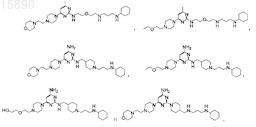
8. Соединение формулы (I)

где X представляет собой -N(Ra)-;
L1 представляет собой C1-C10алкилен или -С(O)-;
L2 отсутствует или представляет собой C1-C10алкилен;
L3 представляет собой,С3-С20циклоалкил или отсутствует;
R1 представляет собой Н, C1-C10алкил, С3-С20циклоалкил, арил, гетероарил, галоген, CN, ORc, COORc, OC(O)Rc, C(O)Rc, C(O)NRcRd или NRcRd;
каждый из R2 и R3независимо представляет собой Н, C1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил, гетероарил, галоген, CN, ORe, COORe, OC(O)Re, C(O)Re, C(O)NReRf или NReRf;
R4 представляет собой Н и
R5 представляет собой Н, С1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил или гетероарил или R4и R5 вместе представляют собой C1-C10алкилен или C1-С10гетероалкилен;
в которых каждый из Ra, Rb, Rc, Rd, Re и Rf независимо представляет собой Н, С1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил или гетероарил,
или его соль.
9. Соединение по п.8, в котором
X представляет собой -N(Ra)-;
каждый из L1 и L2независимо представляет собой C1-С10алкилен;
L3 отсутствует;
R1 представляет собой NRcRd;
каждый из R2 и R3независимо представляет собой Н, C1-С10алкил, галоген или С3-С20циклоалкил и
R5 представляет собой Н или С3-С20циклоалкил или R4 и R5вместе представляют собой С1-С10алкилен или С1-С10гетероалкилен.
10. Соединение по п.9, в котором R5 представляет собой
![]()
или R4и R5 вместе представляют собой -СН2СН2-.
11. Соединение по п.9, в котором один из Rc и Rd представляет собой С1-С10алкил, замещенный арилом или группой N(RR'), в которой каждый из R и R' независимо представляет собой Н, С1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил или гетероарил.
12. Соединение по п.11, в котором один из Rc и Rd представляет
![]()
13. Соединение по п.9, в котором R3 представляет собой группу
![]()
замещенную С1-С10алкилом, который, в свою очередь, замещен С3-С20гетероциклоалкилом или OR, причем R представляет собой Н, C1-С10алкил, С3-С20циклоалкил, С3-С20гетероциклоалкил, арил или гетероарил.
14. Соединение по п.9, в котором соединение представляет собой одно из
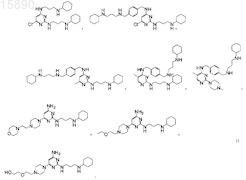
15. Применение соединения по любому из пп.1-14 или его соли для лечения воспалительного или иммунопатологического заболевания, болезни роста или дегенеративного заболевания или повреждения тканей у субъекта.
16. Применение по п.15, в котором воспалительное или иммунопатологическое заболевание представляет собой ретинопатию, астму, аллергический ринит, гиперчувствительное заболевание легких, аутоиммунную болезнь, отторжение трансплантата, инфекцию вируса иммунодефицита человека или рак.
17. Применение по п.15, где рак представляет собой рак мозга, молочной железы, предстательной железы, толстой кишки, почки, яичника, щитовидной железы, легких или кроветворных органов.
18. Применение по п.15, в котором гиперчувствительное заболевание легких представляет собой идиопатический легочный фиброз.
19. Применение по п.15, в котором аутоиммунная болезнь представляет собой ревматоидный артрит, системную эритематозную волчанку, анкидозирующий спондилит или системный склероз.
20. Применение по п.15, в котором болезнь роста или дегенеративное заболевание представляет собой спинальную мышечную атрофию, мышечную дистрофию Дюшенна, болезнь Паркинсона или болезнь Альцгеймера.
21. Применение по п.15, в котором повреждение тканей представляет собой повреждение головного мозга, сердца, печени, скелетных мышц, почек, поджелудочной железы, легких, кожи или желудочно-кишечного тракта.
22. Применение соединения по любому из пп.1-14 или его соли для увеличения миграции в кровь клеток, продуцируемых костным мозгом, у субъекта.
23. Применение по п.22, в котором клетки, продуцируемые костным мозгом, представляют собой клетки CD34+ или клетки CD133+.
24. Применение по п.22, в котором клетки, продуцируемые костным мозгом, являются стволовыми клетками или эндотелиальными клетками-предшественниками.
25. Применение по п.22, в котором субъекту одновременно вводят эффективное количество фактора роста G-CSF.
Текст
Дата публикации и выдачи патента Номер заявки Настоящее изобретение относится к способу лечения воспалительных или иммунопатологических заболеваний, болезней роста или дегенеративных заболеваний или повреждений тканей. Способ включает введение субъекту, который нуждается в лечении, эффективного количества одного или нескольких соединений формулы (I). Каждая изменяемая группа в представленной формуле определена в описании. 015890 Перекрестная ссылка на родственные заявки В соответствии с 35 USC119(e), настоящая заявка испрашивает приоритет по предварительной заявке США 60/690267, поданной 14 июня 2005 г., и предварительной заявке США 60/798596, поданной 8 мая 2006 г., содержание которых включено в настоящую заявку путем ссылки. Уровень техники Хемокины представляют собой семейство цитокинов, которые регулируют адгезию и трансэндотелиальную миграцию лейкоцитов при иммунной или воспалительной реакции (Mackay C.R., Nat. Immunol., (2001) 2:95; Olson et al., Am. J. Physiol. Regul. Integr. Comp. Physiol, (2002) 283:R7). Хемокины также регулируют направленную миграцию и хоминг Т-клеток и В-клеток и вносят вклад в развитие системы лимфоцитообразования и кроветворной системы. (Ajuebor et al., Biochem. Pharmacol., (2002) 63:1191). Идентифицировано приблизительно 50 хемокинов человека. Их можно разделить на 4 подсемейства, т.е. СХС, СХЗС, СС, и С хемокины, исходя из положений консервативных цистеиновых остатков на N-конце(Onuffer et al., Trends Pharmacol Sci., (2002) 23:459). Биологические функции хемокинов опосредованы их связыванием и активацией сопряженных с G-белком рецепторов (GPCR) на поверхности клеток. Возьмем, например, рецептор CXCR4, он может быть активирован стромальным фактором роста-1 или SDF1, членом семейства СХС хемокинов. Первоначально SDF-1 был клонирован из линий стромальных клеток костного мозга, и показано,что он действует в качестве фактора роста для В клеток-предшественников (Nishikawa et al., Eur. J. Immunol., (1988) 18:1767). SDF-1 также включает колонизацию кроветворных клеток-предшественников костного мозга при эмбриогенезе (Bleul et al., J. Exp. Med., (1996) 184:1101). Физиологическая функцияSDF-1 опосредована рецептором CXCR4. Мыши, у которых отсутствует SDF-1 или CXCR4 рецептор,показывают летальную аномалию при миелопоэзе костного мозга, лимфопоэзе В-клеток и при развитии мозжечка. (Nagasawa et al., Nature, (1996) 382:635; Ma et al., Proc. Natl. Acad. Sci. (1998) 95:9448; Zou etal., Nature (1998) 393:595; Lu et al., Proc. Natl. Acad. Sci. (2002) 99:7090). Рецептор CXCR4 широко экспрессируется в ряде тканей, особенно в иммунной и центральной нервной системах и описан в качестве главного ко-рецептора для HIV-1/2 на Т-лимфоцитах. Хотя первоначальный интерес к антагонизмуCXCR4 был сосредоточен на его потенциальном применении в лечении СПИД (Bleul et al., Nature (1996) 382:829), в настоящее время становится понятно, что рецептор CXCR4 и SDF-1 участвуют также в других патологических состояниях, таких как ревматоидный артрит, астма и метастазы опухолей. (Buckleyet al., J. Immunol., (2000) 165:3423). Обнаружено также, что рецептор CXCR4 и SDF-1 широко экспрессируются во многих тканях во время эмбрионального развития. Кроме того, показано на нескольких моделях повреждения тканей, что путь CXCR4/SDF-1 решающим образом участвует в регенерации тканей. Конкретно, обнаружено, что уровень SDF-1 повышен в месте повреждения и CXCR4-положительные клетки активно участвуют в процессе регенерации тканей. Сущность изобретения Настоящее изобретение базируется на обнаружении того, что некоторые производные пиримидина являются эффективными в лечении воспалительных и иммунопатологических заболеваний (например,ретинопатии), болезней роста или дегенеративных заболеваний или повреждений тканей посредством их связывания с хемокиновыми рецепторами (например, рецепторами CXCR3 или CXCR4). Кроме того,указанные соединения при использовании в комбинации с фактором роста G-CSF показали синергетические эффекты в стволовых клетках и мобилизацию эндотелиальных клеток-предшественников. Один объект настоящего изобретения относится к производным пиримидина формулы (I) и их соли:L2 отсутствует или представляет собой C1-С 10 алкилен;L3 представляет собой С 3-С 20 циклоалкил; каждый из R1, R2 и R3 независимо представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, С 3 С 20 гетероциклоалкил, арил, гетероарил, галоген, CN, ORc, COORc, OC(O)Rc, C(O)Rc, C(O)NRcRd илиR5 представляет собой С 3-С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил, гетероарил или C1 С 10 алкил, замещенный С 3-С 20 циклоалкилом, С 3-С 20 гетероциклоалкилом или N(ReRf); где каждый из Ra, Rb, Rc, Rd, Re и Rf независимо представляет собой Н, C1-С 10 алкил, С 3 С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил, гетероарил, или -C(O)R, причем R представляет собой Н,C1-С 10 алкил, С 3-С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил или гетероарил;-1 015890 или его соль. Согласно формуле (I), подкласс производных пиримидина, описанных выше, представляет собой производные (соединения), в которых X может представлять собой -N(Ra)-, L1 может представлять собойC1-С 10 алкилен или -С(О)-, и L2 может представлять собой C1-С 10 алкилен, и L3 может представлять собой С 3-С 20 циклоалкил. В упомянутых соединениях R5 может представлять собой С 3-С 20 циклоалкил (например), C3-С 20 гетероциклоалкил; Rb может представлять собой C1-С 10 алкил; и R1 может представ лять собой С 3-С 20 гетероциклоалкил (например,или). R3 может представлять собой Н, C1-С 10 алкил, ORc, NRcRd или С 3-С 20 гетероциклоалкил, замещенный C1-C10 алкилом, который необязательно замещенный PO(OR')2, OSO3R' или COOR', С 3-С 20 циклоалкилом, С 3-С 20 гетероциклоалкилом, арилом, группами OR', С(О)R', COOR', C(O)N(R'R"), SO2R' или C(S)N(R'R"), в которых каждый из R' и R" независимо представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил или гетероарил. Например, R3 может представлять собой Н, СН 3, OPh, группы необязательно замещенную C1-С 10 алкилом, С 3-С 20 циклоалкилом, С 3-С 20 гетероциклоалкилом, арилом, ОН, C(O)R', COOR', C(O)N(R'R"), SO2R', C(S)N(R'R"), OSO3R', PO(OR')2 или NH(R'), замещенными ОН или NHC(O)R". В качестве еще одного примера в некоторых производных пиримидина L3 может представлять собой С 3-С 20 циклоалкил (например, циклогексилен). В упомянутых соединениях R5 может и R3 может представпредставлять собой C1-С 10 алкил, замещенный N(ReRf) (например,лять собой С 3-С 20 гетероциклоалкил, замещенный C1-С 10 алкилом, С 3-С 20 циклоалкилом, С 3 С 20 гетероциклоалкилом, арилом, группами OR', C(O)R', COOR', C(O)N(R'R"), SO2R' или C(S)N(R'R"), в которых каждый из R' и R" независимо представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, С 3 С 20 гетероциклоалкил, арил или гетероарил. Термин алкил относится к насыщенной или ненасыщенной, линейной или разветвленной углеводородной группе, такой как -СН 3, -СН 2-СН=СН 2 или разветвленная -С 3 Н 7. Термин алкилен относится к двухвалентной насыщенной или ненасыщенной линейной или разветвленной углеводородной группе,такой как -СН 2- или -СН=СН-. Термин гетероалкилен относится к алкиленовой группе, содержащей по меньшей мере один гетероатом (например, N, О или S). Термин циклоалкил относится к насыщенной или ненасыщенной, неароматической, циклической углеводородной группе, такой как циклогексил или циклогексен-3-ил. Термин гетероциклоалкил относится к насыщенной или ненасыщенной, неароматической циклической группе, содержащей по меньшей мере один гетероатом в кольце (например, N, О или S), такой как 4-тетрагидропиранил или 4-пиранил. Термин арил относится к углеводородной группе, содержащей одно или несколько ароматических колец. Примеры арильных групп включают фенил(Ph), фенилен, нафтил, нафтилен, пиренил, антрил и фенантрил. Термин гетероарил относится к группе, содержащей одно или несколько ароматических колец, которые содержат по меньшей мере один гетероатом (например, N, О или S). Примеры гетероарильных групп включают фурил, фурилен, флуоренил, пирролил, тиенил, оксазолил, имидазолил, тиазолил, пиридил, пиримидинил, хиназолинил, хинолил,изохинолил и индолил. Упомянутые здесь алкил, алкилен, гетероалкилен, циклоалкил, гетероциклоалкил, арил и гетероарил включают как замещенные, так и незамещенные группы, если не указано иное. Возможные заместители на циклоалкиле, гетероциклоалкиле, ариле и гетероариле включают, но не ограничиваются перечисленными ниже, C1-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил, С 3-С 20 циклоалкил, С 3-С 20 циклоалкенил,С 3-С 20 гетероциклоалкил, С 3-С 20 гетероциклоалкенил, C1-С 10 алкокси, арил, арилокси, гетероарил, гетероарилокси, амино, С 1-С 10 алкиламино, C1-C20 диалкиламино, ариламино, диариламино, гидроксил, галоген,тио, C1-С 10 алкилтио, арилтио, C1-С 10 алкилсульфонил, арилсульфонил, ациламино, аминоацил, аминотио-2 015890 ацил, амидино, гуанидин, уреидо, циано, нитро, ацил, тиоацил, ацилокси, карбоксил и сложноэфирную группу. С другой стороны, возможные заместители на алкиле, алкилене или гетероалкилене включают все из перечисленных заместителей, за исключением C1-С 10 алкила, С 2-С 10 алкенила и С 2-С 10 алкинила. Циклоалкил, гетероциклоалкил, арил и гетероарил могут также быть конденсированы друг с другом. Еще один объект настоящего изобретения относится к производным пиримидина формулы (I),представленной выше, гдеL2 отсутствует или представляет собой C1-С 10 алкилен;R1 представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, арил, гетероарил, галоген, CN, ORc, COORc, ОС(О)Rc, C(O)Rc, C(O)NRcRd или NRcRd; каждый из R2 и R3 независимо представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, С 3 С 20 гетероциклоалкил, арил, гетероарил, галоген, CN, ORe, COORe, OC(O)Re, C(O)Re, C(O)NReRf илиR5 представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил или гетероарил; или R4 и R5 вместе представляют собой C1-С 10 алкилен или C1-С 10 гетероалкилен; в которых каждый из Ra, Rb, Rc, Rd, Re и Rf независимо представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил или гетероарил,или его соль. Согласно формуле (I) подкласс только что описанных производных пиримидина представляет собой соединения, в которых X представляет собой -N(Ra)-, каждый из L1 и L2 независимо представляет собой C1-С 10 алкилен, L3 отсутствует; R1 представляет собой NRcRd; каждый из R2 и R3 независимо представляет собой Н, C1-С 10 алкил, галоген или С 3-С 20 циклоалкил; и R4 представляет собой Н; R5 представляет собой Н или С 3-С 20 циклоалкил; или R4 и R5 вместе представляют собой C1-С 10 алкилен или C1 С 10 гетероалкилен. В указанных соединениях R5 может представлять собой, или R4 и R5 вместе могут представлять собой -СН 2 СН 2-; один из Rc и Rd может представлять собой C1-С 10 алкил, замещенный арилом или группой N(RR'), в которой каждый из R и R' независимо представляет собой Н, C1-С 10 алкил,С 3-С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил или гетероарил (например, один из Rc и Rd, который представляет собой, замещенный C1-С 10 алкилом, который, в свою очередь, замещен С 3 собой С 20 гетероциклоалкилом или OR, причем R представляет собой Н, C1-С 10 алкил, С 3-С 20 циклоалкил, С 3-С 20 гетероциклоалкил, арил или гетероарил. Еще один объект настоящего изобретения относится к способу лечения воспалительного заболевания или иммунопатологического заболевания, болезни роста или дегенеративного заболевания или повреждения тканей. Способ включает введение субъекту, нуждающемуся в лечении, эффективного количества одного или нескольких производных пиримидина формулы (I), показанной выше. Термин лечение относится к введению одного или нескольких производных пиримидина субъекту, который страдает вышеописанным заболеванием, симптомом такого заболевания или предрасположенностью к такому заболеванию, с целью получить терапевтический эффект, например, вылечить, облегчить, изменить, оказать действие, ослабить или предотвратить вышеописанное заболевание, его симптом или предрасположенность к нему. Воспалительное заболевание характеризуется местным или системным, острым или хроническим воспалением. Примеры воспалительных заболеваний включают ретинопатию, воспалительные дерматозы (например, дерматит, экзему, атопический дерматит, аллергический контактный дерматит, крапивницу, некротический васкулит, кожный васкулит, гиперчувствительный васкулит, эозинофильный миозит,полимиозит, дерматомиозит и эозинофильный фасциит), воспалительные заболевания кишок (например,болезнь Крона и язвенный колит), гиперчувствительные заболевания легких (например, гиперчувствительный пневмонит, эозинофильная пневмония, гиперчувствительность замедленного типа, интерстициальный легочный процесс или ILD, идиопатический легочный фиброз и ILD, связанный с ревматоидным артритом), астма и аллергический ринит. Иммунопатологическое заболевание характеризуется гипер- или гипореакцией иммунной системы. Примеры включают аутоиммунные болезни (например, ревматоидный артрит, псориатический артрит,системную эритематозную волчанку, злокачественную миастению, юношеский диабет, гломерулонефрит, аутоиммунный тиреоидит, анкилозирующий спондилит, системный склероз и рассеянный склероз),острые и хронические воспалительные заболевания (например, системную анафилаксию или гиперчув-3 015890 ствительные реакции, аллергию на лекарства, аллергию на укусы насекомых, отторжение трансплантата,включающее отторжение аллотрансплантата и реакцию трансплантат против хозяина), синдром Шегрена, инфекцию вируса иммунодефицита человека, рак, (например, рак мозга, молочной железы, предстательной железы, толстой кишки, почки, яичника, щитовидной железы, легких и рак кроветворных органов) и метастаз опухолей. Болезни роста представляют собой нарушения (расстройства), связанные с ростом и дифференцировкой, которые приводят к потере функции или приобретению функции. Дегенеративные заболевания обычно относятся к превращению ткани в низшую или менее функциональную форму. Примеры болезни роста или дегенеративного заболевания включают спинальную мышечную атрофию, мышечную дистрофию Дюшенна, болезнь Паркинсона или болезнь Альцгеймера. Повреждения тканей могут быть вызваны окислительным стрессом (например, ишемия-реперфузия при инсульте или инфаркте миокарда), активацией комплемента, отторжением трансплантата, химикатами (например, индуцированное алкоголем повреждение печени или повреждения слизистых тканей в результате лечения рака), вирусной инфекцией(например, спортивные травмы). Примеры повреждения тканей включают повреждение головного мозга,сердца, печени, скелетных мышц, почек, поджелудочной железы, легких, кожи или желудочнокишечного тракта. Субъекту, который нуждается в лечении вышеописанного заболевания, можно также одновременно с вышеописанным производным пиримидина вводить одно или несколько других терапевтических средств. Примеры таких терапевтических средств включают фактор роста G-CSF, стероидное или нестероидное противовоспалительное средство, ингибитор COX2, ингибитор лейкотриеновых рецепторов,модулятор простагландинов, модулятор TNF и иммунодепрессивное средство (например, циклоспорин А). Термин одновременно введенный относится к введению производного пиримидина и одного или нескольких других терапевтических средств в одно и то же время или в различные моменты времени во время периода лечения. Еще один объект настоящего изобретения относится к способу увеличения миграции в кровь клеток, продуцируемых костным мозгом. Способ включает введение субъекту, который в этом нуждается,эффективного количества одного или нескольких производных пиримидина формулы (I), показанных выше. Термин клетки, продуцируемые костным мозгом относится к клеткам, образующимся из костного мозга. Примеры клеток, продуцируемых костным мозгом, включают клетки CD34+ и клетки CD133+,но не ограничиваются ими. Продуцируемые костным мозгом клетки представляют собой стволовые клетки или эндотелиальные клетки-предшественники. Кроме того, настоящее изобретение включает в себя фармацевтическую композицию, которая содержит эффективное количество по меньшей мере одного из вышеупомянутых производных пиримидина и фармацевтически приемлемый носитель. Производные пиримидина, описанные выше, включают сами соединения, а также их соли, если применимы. Соль может быть образована, например, между анионом и положительно заряженной группой (например, амино) производного пиримидина. Подходящие анионы включают хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат, ацетат, малат, тозилат, тартрат,фумарат, глутамат, глюкуронат, лактат, глютарат и малеат. Соль также может быть образована аналогичным образом между катионом и отрицательно заряженной группой (например, карбоксилатной) производного пиримидина. Подходящие катионы включают ион натрия, ион калия, ион магния, ион кальция и катион аммония, такой как ион тетраметиламмония. Производные пиримидина включают также соли,содержащие четвертичный атом азота. Примеры фармацевтически приемлемых растворителей включают воду, этанол, изопропанол, этилацетат, уксусную кислоту и этаноламин. В объем притязаний настоящего изобретения включена также композиция, содержащая одно или несколько производных пиримидина, описанных выше для применения в лечении вышеописанного заболевания, и применение такой композиции для производства лекарственного препарата для только что упомянутого лечения. Подробности одного или нескольких вариантов осуществления изобретения изложены в приведенном ниже описании. Другие признаки, объекты и преимущества изобретения будут очевидны из описания и формулы изобретения. Подробное описание Ниже показаны типичные соединения по настоящему изобретению (соединения 1-268): Производные пиримидина, описанные выше, можно получать способами, хорошо известными в данной области техники. В примерах 1-268, приведенных ниже, дано подробное описание получения соединений 1-268 по настоящему изобретению. На схеме 1, показанной ниже, изображен типичный путь синтеза некоторых типичных соединений. В указанной схеме R1, R2, R3, R6 и R7 такие, как определено выше в разделе Сущность изобретения. Конкретно, производное пиримидина, содержащее галоген, реагирует с соединением, содержащим две защищенные аминогруппы и незащищенную первичную аминогруппу, и дает соединение формулы (2), с которого затем снимают защиту, удаляя аминозащитную группу, и получают соединение формулы (3). Типичные аминозащитные группы включают трет-бутоксикарбонил, бензилоксикарбонил, ацетил, фенилкарбонил и триалкилсилил. Схема I Соединения формулы (2) можно модифицировать различными способами, получая другие соединения по настоящему изобретению. Например, как показано ниже на схеме II, когда R3 представляет собой галоген, соединение формулы (2) реагирует с гетероциклическим соединением, содержащим в кольце атом азота, и дает соединение формулы (4), с которого затем снимают защиту, получая соединение формулы (5). В качестве еще одного примера, соединение формулы (2), где R3 также представляет собой галоген, реагирует со спиртом и дает соединение формулы (8), с которого затем снимают защиту, получая соединение формулы (9). Как показано ниже на схеме III, когда R2 представляет собой CN, соединение формулы (2) может быть сначала восстановлено с образованием соединения формулы (10), которое содержит альдегидную группу. Соединение формулы (10) может затем реагировать с первичным амином и давать соединение формулы (11), защита которого может быть снята с образованием соединения формулы (12). Схема III Соединения формулы (4), полученные выше, можно дополнительно модифицировать различными способами и получать другие соединения по настоящему изобретению. Например, как показано ниже на схеме IV, когда Y представляет собой NH, соединение формулы (4) реагирует с соединением, содержащим галогенидную группу, альдегидную группу или ацилхлоридную группу, и дает соединение формулы (6), с которого затем снимают защиту, получая соединение формулы (7). В качестве примера можно привести соединение формулы (4), когда Y представляет собой NH, которое реагирует с ,ненасыщенным сложным эфиром и последующий гидролиз дает соединение формулы (13), с которого затем снимают защиту, получая соединение формулы (14). В качестве еще одного примера, когда Y представляет собой NH, приведем соединение формулы (4), которое реагирует с винилфосфонатом и дает соединение формулы (15). Затем снимают защиту соединения формулы (15) и гидролизуют, получая соединение формулы (16). Производное пиримидина, синтезированное таким образом, можно очищать такими способами, как колоночная хроматография, жидкостная хроматография высокого давления или перекристаллизация. Другие производные пиримидина можно получать, используя другие подходящие исходные вещества, по вышеуказанным и другим способам синтеза, известным в данной области техники. Вышеописанные способы могут также включать дополнительные стадии для введения или удаления подходящих защитных групп (или перед стадиями, или после стадий, конкретно описанных здесь), чтобы в конечном счете сделать возможным синтез производных пиримидина. Кроме того, различные стадии синтеза можно осуществлять, изменяя их последовательность или порядок, чтобы получить требуемые соединения. Синтетические химические превращения и методология защитных групп (введение защиты и снятие защиты), применимые в синтезе подходящих производных пиримидина, известны в данной области техники и включают, например, превращения и методы, описанные в литературе: R. Larock, ComprehensiveSynthesis, 2nd Ed., John Wiley and Sons (1991); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994) and L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley и Sons (1995) и их последующие издания. Производные пиримидина, упоминаемые в настоящей заявке, могут содержать неароматическую двойную связь и один или несколько асимметричных центров. Поэтому они могут существовать в виде рацематов и рацемических смесей, отдельных энантиомеров, индивидуальных диастереомеров, диастереомерных смесей и цис- и транс-изомерных форм. Все такие изомерные формы рассматриваются. В объем притязаний настоящего изобретения также входит фармацевтическая композиция, содержащая эффективное количество по меньшей мере одного производного пиримидина, описанного выше, и фармацевтически приемлемый носитель. Кроме того, настоящее изобретение охватывает способ введения эффективного количества одного или нескольких производных пиримидина пациенту, страдающему заболеванием, описанным выше в разделе Сущность изобретения. Настоящее изобретение охватывает способ введения эффективного количества одного или нескольких производных пиримидина для увеличения миграции в кровь клеток, продуцируемых костным мозгом. Термин эффективное количество относится к такому количеству активного производного пиримидина, которое необходимо, чтобы получить лечебный эффект для субъекта, который получает лечение. Эффективные дозы будут варьироваться, что понимают специалисты в данной области техники, в зависимости от видов заболеваний, подвер- 23015890 гаемых лечению, пути введения, применения эксципиентов и возможности совместного применения с другим терапевтическим лечением. Чтобы осуществить на практике способ по настоящему изобретению, композицию, содержащую одно или несколько производных пиримидина, можно вводить парентерально, перорально, назально,ректально, местно или буккально. Термин парентеральный, используемый в настоящем документе,относится к подкожной, внутрикожной, внутривенной, внутримышечной, внутрисуставной, внутриартериальной, внутрисуставной, надчревной, интратекальной, вводимой внутрь пораженных тканей или интракраниальной инъекции, а также к любому подходящему способу инфузии. Стерильная композиция для инъекций может быть раствором или суспензией в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, таком как раствор в 1,3 бутандиоле. Приемлемыми средами и растворителями, которые можно использовать, являются маннит,вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно применяют нелетучие масла (например, синтетические моно и диглицериды). Жирная кислота, такая как олеиновая кислота и ее триглицеридные производные применимы для приготовления препаратов для инъекций, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных модификациях. Такие масляные растворы или суспензии могут также содержать разбавитель, представляющий собой спирт с длинной цепью, или диспергатор, карбоксиметилцеллюлозу или аналогичные диспергирующие агенты. Другие обычно применяемые поверхностно-активные вещества, такие как твины или спаны, или другие аналогичные эмульгирующие агенты или усилители, биодоступности, которые обычно используют в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм, можно также использовать для составления композиций. Композиция для перорального введения может быть в виде любой лекарственной формы, подходящей для перорального введения, включая капсулы, таблетки эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток обычно применяемые носители включают лактозу и кукурузный крахмал. Обычно прибавляют также вещества, способствующие скольжению, такие как стеарат магния. Для перорального применения в виде капсул применяемые разбавители включают лактозу и высушенный кукурузный крахмал. Когда водные суспензии или эмульсии вводят перорально, активный ингредиент может быть суспендирован или растворен в масляной фазе, объединенной с эмульгатором или суспендирующим агентом. Если необходимо, могут быть добавлены некоторые подслащивающие, придающие вкус и аромат вещества и красители. Назальный аэрозоль или композиция для ингаляции могут быть приготовлены методами, хорошо известными в технологии изготовления фармацевтических композиций. Например, такая композиция может быть получена в виде раствора в физиологическом растворе, в котором используют бензиловый спирт или другие подходящие консерванты, промоторы всасывания для усиления биодоступности, фторуглероды и/или другие солюбилизаторы или диспергаторы, известные в данной области техники. Композицию, содержащую одно или несколько активных производных пиримидина, можно также вводить в виде суппозиториев для ректального введения. Носитель в фармацевтической композиции должен быть приемлемым в том смысле, что он должен быть совместимым с активным ингредиентом композиции (и предпочтительно способным стабилизировать активный ингредиент) и не должен оказывать вредного действия на субъект, который получает лечение. Один или несколько солюбилизаторов можно использовать в качестве фармацевтических эксципиентов для доставки активного производного пиримидина. Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, натрийлаурилсульфат и DC желтый 10. Производные пиримидина, описанные выше, могут быть предварительно испытаны на их эффективность в лечении вышеуказанных заболеваний с помощью анализа in vitro (см. ниже примеры 269 и 270), а затем эффективность подтверждают экспериментами на животных и клиническими испытаниями. Другие способы будут также очевидны для специалистов средней квалификации в данной области техники. Конкретные примеры, приведенные ниже, должны рассматриваться просто как иллюстративные и не ограничивающие никаким образом остальную часть описания. Считается, что специалист в данной области может без дополнительного исследования, основываясь на описании, использовать настоящее изобретение в его наиболее полном объеме. Все публикации, цитируемые в настоящем документе, включены в него путем ссылки во всей полноте. Гексаметиленимин (0,673 г) медленно прибавляют к перемешиваемому раствору 2,4 дихлорпиримидина (1 г) в ТГФ (50 мл) при 0 С. Реакционную смесь перемешивают при 0 С в течение 2 ч и реакционной смеси дают возможность нагреться до комнатной температуры в течение ночи. Раствор затем концентрируют, получая остаток, который далее очищают хроматографией на силикагеле(EtOAc/гексан=1/5) , получая промежуточное соединение 1-I (1,234 г) с выходом 86%. Раствор промежуточного соединения 1-I (0,46 г) и трис-(2-аминоэтил) амина (1,6 г) в ДМСО (2 мл) нагревают при 120 С в течение 8 ч микроволновым излучением. Раствор распределяют между CH2Cl2 иH2O. Органический слой отделяют и затем концентрируют. Остаток очищают хроматографией на силикагеле (21% NH3(водн.)/МеОН=1/3), получая промежуточное соединение 1-II (0,454 г) с выходом 65%. Циклогексанон (488 мг) и NaBH(OAc)3 (1320 мг) прибавляют к перемешиваемому раствору промежуточного соединения 1-II (200 мг) в CH2Cl2 (50 мл) при комнатной температуре в течение короткого периода времени. Полученный раствор перемешивают при комнатной температуре в течение 8 ч и затем гасят насыщенным водным раствором NaHCO3. Водный слой отделяют и экстрагируют CH2Cl2. Объединенные органические слои затем промывают водой, сушат, фильтруют и концентрируют, получая неочищенный остаток, который очищают хроматографией на силикагеле (21% NH3 (водн.)/МеОН=1/10),получая соединение 1 (217 мг) с выходом 72%. ХИ-МС (М 1): 486,4. К соединению 1 (217 мг) прибавляют 1 М хлористо-водородную кислоту (6 мл) и CH2Cl2 (4 мл). Смесь перемешивают в течение 10 мин при комнатной температуре. Затем удаляют надосадочную жидкость и полученное твердое вещество сушат в вакууме, получая гидрохлоридную соль соединения 1 с выходом 95%. Пример 2. Получение соединения 2 Промежуточное соединение 2-I получают при получении соединения 1. Раствор промежуточного соединения 2-I (200 мг) и трис-(2-аминоэтил) амина (70 мг) в ДМСО (2 мл) нагревают при 120 С в течение 8 ч микроволновым излучением. Раствор распределяют междуCH2Cl2 и H2O. Органический слой отделяют и затем концентрируют. Остаток очищают хроматографией на силикагеле (21% NH3(водн.)/МеОН=1/5), получая промежуточное соединение 2-II (296 мг) с выходом 63%. Циклогексанон (234 мг) и NaBH(OAc)3 (506 мг) прибавляют к перемешиваемому раствору промежуточного соединения 2-II (296 мг) в CH2Cl2 (30 мл) при комнатной температуре в течение короткого периода времени. Полученный раствор перемешивают при комнатной температуре в течение 8 ч и затем гасят насыщенным водным раствором NaHCO3. Водный слой отделяют и экстрагируют CH2Cl2. Объединенные органические слои затем промывают водой, сушат, фильтруют и концентрируют, получая неочищенный остаток, который очищают хроматографией на силикагеле (21% NH3 (водн.)/МеОН=1/15),получая соединение 2 (266 мг) с выходом 77%. ХИ-МС (М 1): 579,4. К соединению 2 (266 мг) прибавляют 1 М хлористо-водородную кислоту (6 мл) и CH2Cl2 (4 мл). Смесь перемешивают в течение 10 мин при комнатной температуре. Затем удаляют надосадочную жидкость и полученное твердое вещество сушат в вакууме, получая соль - гидрохлорид соединения 2 (302 мг) с выходом 91%. Пример 3. Получение соединения 3 Соединение 3 получают способом, аналогичным способу, применяемому для получения соединения 1.- 25015890 ХИ-МС (М 1): 472,4. Пример 4. Получение соединения 4 Соединение 4 получают способом, аналогичным способу, применяемому для получения соединения 1. ХИ-МС (М 1): 514,4. Пример 5. Получение соединения 5 Раствор трис-(2-аминоэтил)амина (2,0 г) и Boc2O (1,0 г) в CH2Cl2 (280 мл) перемешивают при 25 С в течение 15 ч и затем концентрируют. Полученный остаток очищают хроматографией на силикагеле(EtOAc/MeOH=1/1), получая промежуточное соединение 5-I (2,04 г) с выходом 43%. 1-Бензил-4-пиперидон (2,177 г) и NaBH(OAc)3 (3,665 г) прибавляют к перемешиваемому раствору промежуточного соединения 5-I (2,0 г) в МеОН (30 мл) при комнатной температуре в течение короткого периода времени. Полученный раствор перемешивают при комнатной температуре в течение 8 ч и затем гасят насыщенным водным раствором NaHCO3. Водный слой отделяют и экстрагируют CH2Cl2. Объединенные органические слои затем промывают водой, сушат, фильтруют и концентрируют, получая неочищенный остаток, который очищают хроматографией на силикагеле (EtOAc/MeOH=9/1), получая промежуточное соединение 5-II (2,488 г) с выходом 83%. Раствор 20% ТФУ/CH2Cl2 (20 мл) прибавляют к промежуточному соединению 5-II (1,0 г) в CH2Cl2(10 мл). Реакционную смесь перемешивают в течение 5 ч при комнатной температуре и концентрируют,удаляя растворитель. Остаток очищают хроматографией на силикагеле (21% NH3 (водн.)/МеОН=1/4),получая промежуточное соединение 5-III (0,54 г) с выходом 88%. Циклогексанон (1,323 мг) и NaBH(OAc)3 (3,220 мг) прибавляют к перемешиваемому раствору промежуточного соединения 5-III (540 мг) в CH2Cl2 (30 мл) при комнатной температуре в течение короткого периода времени. Полученный раствор перемешивают при комнатной температуре в течение 8 ч и затем гасят насыщенным водным раствором NaHCO3. Водный слой отделяют и экстрагируют CH2Cl2, Объединенные органические слои затем промывают водой, сушат, фильтруют и концентрируют, получая неочищенный остаток, который очищают хроматографией на силикагеле (21% NH3 (водн.)/МеОН=1/10),получая промежуточное соединение 5-IV (0,58 г) с выходом 71%. Раствор промежуточного соединения 5-IV (580 мг), Boc2O (863 мг) и Et3N (485 мг) в CH2Cl2 (150 мл) перемешивают при 25 С в течение 15 ч и затем концентрируют. Полученный остаток очищают хроматографией на силикагеле (EtOAc/гексан=1/5), получая промежуточное соединение 5-V (8 65 мг) с выходом 92%. Смесь промежуточного соединения 5-V (8 65 мг) и Pd/C (90 мг) в МеОН (20 мл) перемешивают в атмосфере Н 2 (из резиновой камеры) при 25 С в течение 15 ч, затем фильтруют через колонку с целитом и концентрируют. Полученный остаток очищают хроматографией на силикагеле (EtOAc/MeOH=15/l),получая промежуточное соединение 5-VI (681 мг) с выходом 89%. Диизопропилэтиламин (0,1 мл) прибавляют к раствору 5-VII (30 мг, полученного при получении соединения 1) и промежуточного соединения 5-VI (100 мг) в 1-пентаноле (2 мл). Реакционную смесь перемешивают при 140 С в течение ночи. Затем растворитель удаляют в вакууме, полученный остаток очищают хроматографией на силикагеле (EtOAc/гексан=1/1), получая промежуточное соединение 5-VIIICH2Cl2 (1 мл) . Реакционную смесь перемешивают в течение 5 ч при комнатной температуре и концентрируют, удаляя растворитель в вакууме. К полученному остатку прибавляют 1 М хлористо-водородную кислоту (2 мл) и CH2Cl2 (1 мл). Смесь перемешивают в течение 10 мин при комнатной температуре. Затем удаляют надосадочную жидкость и полученное твердое вещество сушат в вакууме, получая соль гидрохлорид соединения 5 (81 мг) с выходом 85%.- 26015890 ХИ-МС (М 1): 569,5. Пример 6. Получение соединения 6 Соединение 6 получают аналогично получению соединению 1. ХИ-МС (М 1): 572,5. Пример 7. Получение соединения 7 Соединение 7 получают способом, аналогичным способу, применяемому для получения соединения 1. ХИ-МС (М 1): 458,4. Пример 8. Получение соединения 8 Раствор 4-цианобензилальдегида (5 г) и N-циклогексил-1,3-пропан-диамина (6 г) в СН 3 ОН (100 мл) нагревают до 60 С в течение 6 ч. После охлаждения до комнатной температуры к вышеупомянутому раствору медленно прибавляют NaBH4 (2,5 г). Смесь перемешивают еще 30 мин. Затем смесь концентрируют, гасят NH4Cl (водн.) и экстрагируют CH2Cl2. Органические слои объединяют, сушат безводнымMgSO4 и концентрируют, получая остаток. Остаток очищают хроматографией на силикагеле(EtOAc/Et3N=4/1), получая промежуточное соединение 8-I (7,2 г) с выходом 70%. Раствор промежуточного соединения 8-I (7,2 г) и Вос 2 О (17,3 г) в CH2Cl2 (280 мл) перемешивают при 25 С в течение 15 ч и затем концентрируют. Полученный остаток очищают хроматографией на силикагеле (EtOAc/гексан=1/1), получая промежуточное соединение 8-II в виде желтого масла (10,6 г, выход 85%). Раствор промежуточного соединения 8-II (4,7 г) и NiCl2 (64 мг) в СН 3 ОН (100 мл) перемешивают сначала при 25 С. После охлаждения до 0 С медленно прибавляют NaBH4 (1,83 г) и смесь перемешивают еще 15 ч. Раствор концентрируют, гасят NH4Cl (водн.) и экстрагируют CH2Cl2. Объединенный органический слой промывают водой, фильтруют, сушат безводным MgSO4 и концентрируют, получая остаток. Остаток очищают хроматографией на силикагеле (21% NH3 (водн.)/МеОН=1/19), получая промежуточное соединение 8-III (2,36 г) с выходом 50%. Диизопропилэтиламин (0,1 мл) прибавляют к раствору 2-хлор-6-метил-4-диметиламинопиримидина(110 мг) и промежуточного соединения 8-III (150 мг) в 1-пентаноле (2 мл). Реакционную смесь перемешивают в течение ночи при 150 С. Растворитель удаляют в вакууме, остаток очищают хроматографией на силикагеле (EtOAc/гексан=1/1), получая промежуточное соединение 8-IV (88 мг) с выходом 47%. Раствор 20% ТФУ/CH2Cl2 (2 мл) прибавляют к промежуточному соединению 8-IV (88 мг) в CH2Cl2(1 мл). Реакционную смесь перемешивают в течение 5 ч при комнатной температуре и концентрируют путем удаления растворителя. К полученному остатку прибавляют 1 М хлористо-водородную кислоту (2 мл) и CH2Cl2 (1 мл). Смесь перемешивают в течение 10 мин при комнатной температуре. Затем удаляют надосадочную жидкость и полученное твердое вещество сушат в вакууме, получая соль - гидрохлорид соединения 8 (60 мг) с выходом 80%. ХИ-МС (М 1): 411,3. Пример 9. Получение соединения 9 Раствор N-циклогексил-1,3-пропандиамина (2,6 г), Et3N (3,8 мл) и 2,4,6-трихлорпиримидина (1 г) в ТГФ (50 мл) перемешивают в течение ночи при 60 С и концентрируют удалением растворителя в вакууме. Остаток очищают хроматографией на силикагеле (21% NH3 (водн.)/МеОН=5/95), получая соединение 9 (1,7 г) с выходом 75%.- 27015890 ХИ-МС (М 1): 423,3. К соединению 9 (100 мг) прибавляют 1 М хлористо-водородную кислоту (3 мл) и CH2Cl2 (2 мл). Смесь перемешивают в течение 10 мин при комнатной температуре. Затем удаляют надосадочную жидкость и полученное твердое вещество сушат в вакууме, получая соль - гидрохлорид соединения 9 (130 мг) с выходом 97%. Пример 10. Получение соединения 10N-циклогексил-1,3-пропандиамин (0,808 г) медленно прибавляют к перемешиваемому раствору 2,4,6-трихлорпиримидина (1 г) в ТГФ (50 мл) при комнатной температуре. Реакционную смесь перемешивают при 0 С в течение 2 ч и реакционной смеси дают нагреться до комнатной температуры в течение ночи. Затем раствор концентрируют, получая остаток, который очищают хроматографией на силикагеле(EtOAc/гексан=1/2), получая промежуточное соединение 10-I (1,38 6 г), с выходом 60%. Раствор промежуточного соединения 10-I (500 мг) и Boc2O (770 мг) в CH2Cl2 (15 мл) перемешивают при 25 С в течение ночи. Затем раствор концентрируют и полученный остаток очищают хроматографией на силикагеле (EtOAc/гексан=1/9), получая промежуточное соединение 10-II (590 мг) с выходом 80%. Диизопропилэтиламин (0,25 мл) прибавляют к раствору промежуточного соединения 10-II (590 мг),промежуточного соединения 8-III, полученного в примере 8 (700 мг), и NaI (260 мг) в 1-пентаноле (20 мл). Реакционную смесь перемешивают в течение 24 ч при 120 С и затем концентрируют, удаляя растворитель в вакууме. Полученный остаток растворяют в CH2Cl2, промывают водой, сушат безводнымMgSO4 и концентрируют, получая остаток. Остаток очищают хроматографией на силикагеле(EtOAc/гексан=1/1), получая промежуточное соединение 10-III (865 мг) с выходом 70%. Раствор 20% ТФУ/CH2Cl2 (3 мл) прибавляют к раствору промежуточного соединения 10-III (150 мг) в CH2Cl2 (2 мл). Реакционную смесь перемешивают в течение 5 ч при комнатной температуре и концентрируют, удаляя растворитель. К остатку прибавляют 1 М хлористо-водородную кислоту (3 мл) и CH2Cl2(2 мл). Смесь перемешивают еще 10 мин при комнатной температуре. Затем удаляют надосадочную жидкость и полученное твердое вещество сушат в вакууме, получая соль - гидрохлорид соединения 10N-циклогексил-1,3-пропандиамин (0,808 г) медленно прибавляют к перемешиваемому раствору 2,4,6-трихлорпиримидина (1 г) в ТГФ (50 мл) при комнатной температуре. Реакционную смесь перемешивают при 0 С в течение 2 ч и реакционной смеси дают нагреться до комнатной температуры в течение ночи. Затем раствор концентрируют и получают остаток, который очищают хроматографией на силика- 28015890 геле (EtOAc/гексан = 1/4) , получая промежуточное соединение 11-I (0,349 г) с выходом 21%. Раствор промежуточного соединения 11-I (349 мг) и Вос 2 О (54 0 мг) в CH2Cl2 (15 мл) перемешивают при 25 С в течение ночи. Затем раствор концентрируют и полученный остаток очищают хроматографией на силикагеле (EtOAc/гексан = 1/10), получая промежуточное соединение 11-II (400 мг) с выходом 86% (ХИ-МС (М 1) : 403,4). Диизопропилэтиламин (0,17 мл) прибавляют к раствору промежуточного соединения 11-II (400 мг),промежуточного соединения 8-III (полученного в примере 8) (475 мг) и NaI (176 мг) в 1-пентаноле (20 мл). Реакционную смесь перемешивают в течение 24 ч при 120 С и затем концентрируют, удаляя растворитель в вакууме. Полученный остаток растворяют в CH2Cl2, промывают водой, сушат безводнымMgSO4 и концентрируют, получая остаток. Остаток очищают хроматографией на силикагеле(EtOAc/гексан = 1/1), получая промежуточное соединение 11-III (427 мг) с выходом 51%. Раствор 20% ТФУ/CH2Cl2 (4 мл) прибавляют к раствору промежуточного соединения 11-III (200 мг) в CH2Cl2 (2 мл). Реакционную смесь перемешивают в течение 5 ч при комнатной температуре и концентрируют, удаляя растворитель. К остатку прибавляют 1 М хлористо-водородную кислоту (5 мл) и CH2Cl2(2 мл). Смесь перемешивают в течение еще 10 мин при комнатной температуре. Затем удаляют надосадочную жидкость и полученное твердое вещество сушат в вакууме, получая соль - гидрохлорид соединения 11 (117 мг) с выходом 91%. ХИ-МС (М 1): 542,4. Пример 12. Получение соединения 12 Соединение 12 получают способом, аналогичным способу, применяемому для получения соединения 8. ХИ-МС (М 1): 422. Пример 13. Получение соединения 13 Соединение 13 получают способом, аналогичным способу, применяемому для получения соединения 10. ХИ-МС (М 1): 508,4. Пример 14. Получение соединения 14 Соединение 14 получают способом, аналогичным способу, применяемому для получения соединения 8. ХИ-МС (М 1): 387. Пример 15. Получение соединения 15 Соединение 15 получают способом, аналогичным способу, применяемому для получения соединения 8. ХИ-МС (М 1): 403. Пример 16. Получение соединения 16 Соединение 16 получают способом, аналогичным способу, применяемому для получения соединения 8. ХИ-МС (М 1): 354,3. Пример 17. Получение соединения 17 Соединение 17 получают способом, аналогичным способу, применяемому для получения соединения 11. ХИ-МС (М 1): 522,4. Пример 18. Получение соединения 18 Соединение 18 получают способом, аналогичным способу, применяемому для получения соединения 10. ХИ-МС (М 1) : 522,4. Пример 19. Получение соединения 19 Соединение 19 получают способом, аналогичным способу, применяемому для получения соединения 11. ХИ-МС (М 1): 522,4.
МПК / Метки
МПК: C07D 239/42, A61K 31/496, A61K 31/5377, A61P 29/00, A61K 31/505, C07D 413/06, C07D 403/04
Метки: производные, пиримидина
Код ссылки
<a href="https://eas.patents.su/30-15890-proizvodnye-pirimidina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидина</a>
Предыдущий патент: Схемные устройства для управления бытовым прибором
Следующий патент: Способ получения полимеров этилена с применением ряда последовательно расположенных реакторов
Случайный патент: Пестицидные композиции, содержащие азол, фениламид и азоксистробин












