Производные хиназолина в качестве mtki
Номер патента: 13995
Опубликовано: 30.08.2010
Авторы: Фрейн Эдди Жан Эдгар, Виллемс Марк, Тен Холтэ Петер, Папаникос Александра, Понселе Виржини Софи, Эмбрехтс Вернер Констант Йохан, Сторк Пьер Анри
Формула / Реферат
1. Соединение, имеющее формулу
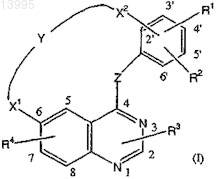
его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,
где Z означает NH;
Y означает -C3-9-алкил-, -С1-5-алкил-NR13-С1-5-алкил-, -С1-5-алкил-NR14-СО-С1-5-алкил-, -С1-2-алкил-NR23-СО-CR16R17-NH;
X1 означает О, -O-C1-2-алкил-;
X2 означает прямую связь, C1-2-алкил, NR12 или NR12-C1-2-алкил-;
R1 означает водород или галоген;
R2 означает водород, галоген или С2-6-алкинил-;
R3 означает водород;
R4 означает C1-4-алкилоксигруппу, необязательно замещенную гидроксигруппой, C1-4-алкилоксигруппой, С1-4-алкилокси-С1-4-алкилоксигруппой, NR37R38-карбонилоксигруппой, NR7R8, NR9R10-карбонилом или Het2-;
R7 означает водород, гидрокси-С1-4-алкил- или C1-4-алкил;
R8 означает С1-4-алкилоксикарбонил; моно- или ди(С1-4-алкил)аминокарбонил- или C1-4-алкилкарбонил, необязательно замещенный C1-4-алкилоксигруппой; или R8означает С1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, NR25R26, C1-4-алкилкарбонилоксигруппы, гидрокси-С1-4-алкилоксигруппы;
R9 означает водород;
R10 означает С1-4-алкил-, замещенный С1-4-алкилсульфонилом;
R12 означает водород, C1-4-алкил-;
R13 означает Ar6-сульфонил;
R14 и R15, каждый независимо, выбраны из водорода, Het15-C1-4-алкила;
R16 и R17, каждый независимо, означают водород, C1-4-алкил или C1-4-алкил, замещенный C3-6-циклоалкилом; или R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуют C3-6-циклоалкил;
R23 означает С1-4алкил, замещенный группой Het25, водород;
R37 и R38, каждый независимо, означают водород, C1-4-алкил;
Het2 означает 1,1-диоксотиоморфолинил, пиперазинил, необязательно замещенные моно- или ди(С1-4-алкил)аминокарбонилом;
Het15 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, при этом указанный Het15 необязательно замещен одним или, в тех случаях, когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, аминогруппы или C1-4-алкила;
Het25 означает гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила или пиперидинила;
Ar6 означает фенил, необязательно замещенный нитрогруппой.
2. Соединение по п.1, в котором
Z означает NH;
Y означает -С3-9-алкил-, -С1-5-алкил-NR13-С1-5-алкил-, -C1-5-алкил-NR14-СО-С1-5-алкил- или -C1-2-алкил-NR23-CO-CR16R17-NH-;
X1 означает О;
X2 означает прямую связь, -C1-2-алкил или NR12-С1-2-алкил-;
R2 означает водород, галоген или C2-6-алкинил;
R4 означает C1-4-алкилоксигруппу, необязательно замещенную гидроксигруппой, C1-4-алкилоксигруппой, С1-4-алкилокси-С1-4-алкилоксигруппой, NR7R8 или Het2;
R7 означает водород, гидрокси-С1-4-алкил- или C1-4-алкил;
R8 означает C1-4-алкилоксикарбонил или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, C1-4-алкилкарбонилоксигруппы или NR25R26, предпочтительно R8означает C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила или NR25R26;
R14 и R15, каждый, означает водород;
R16 и R17, каждый независимо, означают водород или C1-4-алкил, необязательно замещенный C3-6-циклоалкилом, или R16 и R17, вместе взятые с атомом углерода, с котором они связаны, образуют C3-6-циклоалкил;
R23 означает С1-4алкил, замещенный группой Het25;
Het2 означает 1,1-диоксотиоморфолинил или Het2означает пиперазинил, замещенный моно- или ди(C1-4-алкил)аминокарбонилом;
Het25 означает гетероцикл, выбранный из морфолинила или пиперазинила.
3. Соединение по п.1 или 2, в котором
Z означает NH;
Y означает -С3-9-алкил-, -С1-5-алкил-NR13-С1-5-алкил-, -C1-5-алкил-NR14-CO-C1-5-алкил-, -C1-2-алкил-NR23-CO-CR16R17-NH-;
X1 означает О;
X2 означает прямую связь, -C1-2-алкил- или NR12-C1-2-алкил-;
R4 означает C1-4-алкилоксигруппу, необязательно замещенную гидроксигруппой, C1-4-алкилоксигруппой, С1-4-алкилокси-С1-4-алкилоксигруппой, NR7R8 или Het2;
R7 означает водород или C1-4-алкил;
R8 означает C1-4-алкилоксикарбонил или C1-4-алкил-, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, C1-4-алкилкарбонилоксигруппы или NR25R26;
R14 и R15 означают водород;
R16 и R17, каждый независимо, означают водород или C1-4-алкил, необязательно замещенный C3-6-циклоалкилом, или R16 и R17, вместе взятые с атомом углерода, с котором они связаны, образуют C3-6-циклоалкил;
R23 означает водород;
Het2 означает 1,1-диоксотиоморфолинил или пиперазинил.
4. Соединение по любому из пп.1-3, в котором
Z означает NH;
Y означает -C3-9-алкил-, -C1-5-алкил-NR13-C1-5-алкил-, -C1-5-алкил-NR14-СО-С1-5-алкил- или -C1-2-алкил-NR23-CO-CR16R17-NH-;
X1 означает О;
X2 означает прямую связь, C1-2-алкил или NR12-С1-2-алкил;
R1 означает водород;
R2 означает галоген или ацетилен;
R4 означает C1-4-алкилоксигруппу, необязательно замещенную Het2, NR7R8, гидроксигруппой или С1-4-алкилокси-С1-4-алкилоксигруппой;
R7 означает водород или C1-4-алкил;
R8 означает C1-4-алкил, замещенный NR25R26 или C1-4-алкилсульфонилом;
R16 и R17 означают водород, C1-4-алкил или R16 и R17, вместе взятые с атомом углерода, с котором они связаны, образуют C3-6-циклоалкил;
R23 означает водород.
5. Соединение по любому из пп.1-3, в котором
Z означает NH;
Y означает -С3-9-алкил-, -C1-5-алкил-NR13-C1-5-алкил- или -C1-2-алкил-NR23-CO-CR16R17-NH-;
X1 означает О;
X2 означает прямую связь или NR12-С1-2-алкил-;
R1 означает водород;
R2 означает галоген;
R4 означает C1-4-алкилоксигруппу, необязательно замещенную С1-4-алкилокси-С1-4-алкилоксигруппой;
R16 и R17, вместе взятые с атомом углерода, с котором они связаны, образуют C3-6-циклоалкил;
R23 означает водород.
6. Соединение по любому из пп.1-5, в котором заместитель X2находится в положении 2', заместитель R1означает водород или галоген и находится в положении 4', заместитель R2 означает галоген и находится в положении 5' и заместитель R4 находится в положении 7 структуры формулы (I).
7. Ингибитор киназы формулы (I).
8. Применение соединения по любому из пп.1-6 в качестве лекарственного средства.
9. Применение соединения по любому из пп.1-6 в производстве лекарственного средства для лечения расстройств пролиферации клеток, таких как атеросклероз, рестеноз и рак.
10. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное для ингибирования киназы количество соединения по любому из пп.1-6.
Текст
Настоящее изобретение относится к соединениям формулы (I), их N-оксидным формам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где Z означает NH; Y означает-С 3-9-алкил-, -С 1-5-алкил-NR13-С 1-5-алкил-, -C1-5-алкил-NR14-СО-С 1-5-алкил-, -С 1-2-алкил-NR21-Н 2-СО-NH-C1-3 алкил- или -C1-2-алкил-NR23-CO-CR16R17-NH-; X1 означает О или -O-C1-2-алкил-; X2 означает прямую связь,C1-2-алкил, -CO-C1-2-алкил- или NR12-C1-2-алкил; R1 означает водород или галоген; R2 означает галоген,ацетилен или Het1; R3 означает водород или цианогруппу; R4 означает Ar4-С 1-4-алкилоксигруппу, C1-4 алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно,двумя или более заместителями, выбранными из Het2, NR7R8, гидроксигруппы и C1-4-алкилокси-C1-4 алкилоксигруппы; R7 означает водород или C1-4-алкил; R8 означает C1-4-алкил, замещенный NR25R26 или С 1-4-алкилсульфонилом; R12 означает водород или C1-4-алкил-; R13 означает Ar6-сульфонил или C1-6 алкилоксикарбонил, необязательно замещенный фенилом; R16 и R17 означают водород, С 1-4-алкил или R16 иR17, вместе взятые с атомом углерода, с котором они связаны, образуют С 3-6-циклоалкил; R23 означает С 1-4 алкил и R23 означает водород в том случае, когда R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуют С 3-6-циклоалкил; R25, R26, R27 и R28, каждый независимо, означают водород или C1-4 алкилкарбонил; Het1 означает 2-бора-1,3-диоксоланил; Het2 означает пиперидинил, пиперазинил,морфолинил, тиоморфолинил или 1,1-диоксотиоморфолинил, при этом указанный Het2 необязательно замещен C1-4-алкилоксикарбонилом или NR27R28-С 1-4-алкилом; Ar4 и Ar5 означают фенил; Ar6 означает фенил, необязательно замещенный нитрогруппой. Фрейн Эдди Жан Эдгар, Виллемс Марк,Тен Холтэ Петер, Папаникос Александра,Эмбрехтс Вернер Констант Йохан (BE),Сторк Пьер Анри, Понселе Виржини Софи 013995 Геном человека охватывает около 2000 белков, которые так или иначе используют аденозин-5'-трифосфат (АТФ), и около 500 из них кодируют протеинкиназы, т.е. тирозиновые и сериновые/треониновые протеинкиназы, которые имеют общий каталитический домен, консервативный по последовательности и структуре, но которые заметно отличаются по тому, как регулируется их катализ. Субстратное фосфорилирование указанными ферментами является преобладающим в природе молекулярным путем организации сигнальной трансдукции в клетках и регуляции биохимических процессов в общем. Поэтому не является неожиданным, что аномальное фосфорилирование клеточных белков является признаком заболевания и что существует возрастающий интерес к применению ингибиторов киназ в качестве лекарственных средств для терапевтического вмешательства во многие патологические состояния, такие как рак, диабет, воспаление и артрит. Целью настоящего изобретения являются такие ингибиторы киназ, которые представляют собой производные от хиназолина макроциклы, в дальнейшем также называемые направленными к нескольким мишеням ингибиторами киназ (MTKI), которые, как обнаружено, обладают антипролиферативной активностью, такой как противораковая активность, и которые соответственно применимы в способах лечения организма человека или животного, например в производстве лекарственных средств для применения при гиперпролиферативных расстройствах, таких как атеросклероз, рестеноз и рак. Изобретение также относится к способам производства указанных производных хиназолина, к содержащим их фармацевтическим композициям и к их применению в производстве лекарственных средств, применяемых для получения антипролиферативного действия. В частности, обнаружено, что соединения согласно настоящему изобретению ингибируют тирозинкиназные ферменты, также называемые тирозинкиназами. Тирозинкиназы представляют собой класс ферментов, которые катализируют перенос концевого фосфата аденозинтрифосфата на фенольную гидроксильную группу остатка тирозина, присутствующего в белке-мишени. Известно, что некоторые онкогены, вовлеченные в трансформацию клетки в злокачественную опухолевую клетку, кодируют тирозинкиназные ферменты, включая некоторые рецепторы факторов роста, таких как EGF, FGF, IGF-IR, IR,PDGF и VEGF. Указанное семейство рецепторных тирозинкиназ, и в частности EGF-семейство рецепторных тирозинкиназ, часто присутствует при распространенных раковых заболеваниях человека, таких как рак молочной железы, немелкоклеточный рак легкого, включая аденокарциномы и плоскоклеточный рак легкого, рак мочевого пузыря, рак пищевода, рак желудочно-кишечного тракта, такой как рак ободочной кишки, прямой кишки или желудка, рак простаты, лейкоз и рак яичника, бронхов или поджелудочной железы, которые являются примерами расстройств пролиферации клеток. Соответственно было понятно, что избирательное ингибирование тирозинкиназ будет иметь важное значение для лечения связанных с пролиферацией клеток расстройств. Подтверждение такой точки зрения получено при разработке Herceptin (трастузумаба) и Gleevec (мезилата иматиниба), первых примеров, основанных на мишенях лекарственных средств против раковых заболеваний. Herceptin (трастузумаб) направлен против мишени Her2/neu, рецепторной тирозинкиназы, количество которой, как обнаружено, увеличивается до 100 раз примерно у 30% пациентов с инвазивным раком молочной железы. В клинических испытаниях доказано, что Herceptin (трастузумаб) обладает противоопухолевой активностью против рака молочной железы (обзор L.K. Shawer et al., "Smart Drugs: Tyrosine kinase inhibitors incancer therapy", 2002, Cancer Cell. Vol. 1, 117), и соответственно представлено подтверждение принципа терапии, нацеленной на рецепторные тирозинкиназы. Второй пример, Gleevec (мезилат иматиниба),направлен против мишени тирозинкиназы abelson (BcR-Abl), конститутивно активной цитоплазматической тирозинкиназы, присутствующей фактически у всех пациентов с хроническим миелогенным лейкозом (CML) и от 15 до 30% взрослых пациентов с острым лимфобластным лейкозом. В клинических испытаниях Gleevec (мезилат иматиниба) проявил очень высокую эффективность с минимальными побочными эффектами, что привело к одобрению препарата через 3 месяца после представления. Быстрота прохождения указанным средством клинических испытаний и проверки на соответствие требованиям стала примером быстрой разработки лекарственного средства (Drucker B.J.and Lydon N., "Lessons learned from the development of an Abl tyrosine kinase inhibitor for chronic myelogenous leukaemia", 2000, J. Clin. Invest. 105, 3). Следующее подтверждение получено при обнаружении того, что ингибиторы EGF-рецепторных тирозинкиназ специфично ослабляют у бестимусных мышей nude рост трансплантированных карцином,таких как карцинома молочной железы человека или плоскоклеточная карцинома человека (обзорT.R. Burke Jr., Drugs of the Future, 1992, 17, 119). Как следствие, для лечения различных раковых заболеваний значительный интерес проявляли к разработке лекарственных средств, мишенью которых является рецептор EGFR. Например, клиническим испытаниям подвергаются несколько антител, которые связываются с внеклеточным доменом EGFR, включая Erbitux (также называемый С 225, цетуксимаб), который разработан Imclone Systems и находится в фазе III клинических испытаний для лечения некоторых раковых заболеваний. Также несколько многообещающих перорально активных лекарственных средств,которые являются эффективными и относительно специфичными ингибиторами тирозинкиназы EGFR, в настоящее время далеко продвинулись в клинических испытаниях. Показано, что соединение ZD1839AstraZeneca, которое в настоящее время называют IRESSA и которое одобрено для лечения немелкоклеточного рака легкого на поздних стадиях, и соединение OSI-774 OSI/Genentech/Roche, которое в настоящее время называют Tarceva (эрлотиниб), обладают заметной эффективностью против некоторых раковых заболеваний в клинических испытаниях на человеке (Morin M.J., "From oncogene to drug:development of small molecule tyrosine kinase inhibitors as anti-tumour and anti-angiogenic agents, 2000,Oncogene 19, 6574). Кроме указанного выше, показано, что EGF-рецепторные тирозинкиназы вовлечены в незлокачественные пролиферативные расстройства, такие как псориаз (Elder et al., Science, 1989, 243; 811). Поэтому предполагается, что ингибиторы рецепторных тирозинкиназ EGF-типа будут применимы для лечения незлокачественных заболеваний с избыточной пролиферацией клеток, таких как псориаз, доброкачественная гипертрофия простаты, атеросклероз и рестеноз. В международной патентной заявке WO 96/33980 и в J. Med., Chem., 2002, 45, 3865 описано, что некоторые 4-анилинзамещенные производные хиназолина могут быть применимы в качестве ингибиторов тирозинкиназы и в частности рецепторных тирозинкиназ EGF-типа. Неожиданно было обнаружено, что производные хиназолина формулы (I), которые отличаются по структуре, обладают активностью ингибиторов тирозинкиназ. Соответственно целью настоящего изобретения является получение новых ингибиторов тирозинкиназ, применимых для производства лекарственных средств для лечения расстройств, связанных с пролиферацией клеток. Настоящее изобретение относится к соединениям формулы (I) их N-оксидным формам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам,где Z означает NH;R3 означает C1-4-алкил, замещенный одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы или галогена;R4 означает С 1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, галогена, С 1-4-алкилоксигруппы,C1-4-алкилокси-C1-4-алкилоксигруппы, NR37R38-карбонилоксигруппы, Het5-карбонилоксигруппы, NR7R8,NR9R10-карбонила, Het3-карбонила, Het13-оксигруппы или Het2-;R8 означает С 3-6-циклоалкил; Het6-карбонил-; Het7-аминокарбонил-; Het8; Het9-оксикарбонил-; Het10 сульфонил-; C1-4-алкилоксикарбонил; моно- или ди(С 1-4-алкил)аминокарбонил-; моно- или ди(С 1-4-алкил) аминокарбонил, замещенный C1-4-алкилсульфонилом; или C1-4-алкилкарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы иR8 означает C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изR9 означает водород или C1-4-алкил-;R18 означает водород или C1-4-алкил, необязательно замещенный гидроксигруппой или фенилом;R19 означает водород или C1-4-алкил, предпочтительно водород или метил, еще более предпочтительно водород;R20 означает водород или C1-4-алкил, предпочтительно водород или метил;R22 означает водород или C1-4-алкил, необязательно замещенный гидроксигруппой илиHet ; R23 также может означать водород в том случае, когда R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуют C3-6-циклоалкил;R25 и R26, каждый независимо, означают водород, C1-4-алкил, C1-4-алкилсульфонил-,аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-, C1-4-алкилкарбонил-, С 1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изR27 и R28, каждый независимо, означают водород, C1-4-алкил, C1-4-алкилсульфонил-,аминокарбонил-, моно- или ди(С 1-4-алкил)аминокарбонил-, C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изC1-4-алкилсульфонила, гидроксигруппы и C1-4-алкилоксигруппы; или в случае таких соединений формулы (I), в которых Het2 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила,пирролидинила или тиоморфолинила, замещенного NR27R28-C1-4-алкилом, указанные R27 и R28, каждый независимо, означают C1-4-алкилсульфонил-, аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-,C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы и С 1-4-алкилоксигруппы;R23 и R30, каждый независимо, означают водород, аминосульфонил, аминокарбонил, моно- или ди(С 1-4-алкил)аминокарбонил-, моно- или ди(C1-4-алкил)аминосульфонил- или C1-4-алкил-, необязательно замещенный одним или несколькими заместителями, выбранными из NR31R32, С 1-4-алкилсульфонила,аминокарбонилоксигруппы, гидроксигруппы, C1-4-алкилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, или C1-4-алкилоксикарбонил, необязательно замещенный одним или несколькими заместителями,выбранными из гидроксигруппы,C1-4-алкилоксигруппы иC1-4-алкилсульфонила, или C1-4-алкилкарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;R31 и R32, каждый независимо, означают водород, C1-4-алкил, C1-4-алкилсульфонил-,аминокарбонил-, моно- или ди(С 1-4-алкил)аминокарбонил-, C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изR33 означает водород или C1-4-алкил;R34 означает C1-4-алкилсульфонил-, аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-,C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы и C1-4-алкилоксигруппы;R35 означает водород или C1-4-алкил;R36 означает C1-4-алкилсульфонил-, аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-,C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы и C1-4-алкилоксигруппы;C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила,гидроксигруппы и C1-4-алкилоксигруппы;C1-4-алкил-,замещенный одним или несколькими заместителями, выбранными из NR31R32, C1-4-алкилсульфонила,аминокарбонилоксигруппы, гидроксигруппы, C1-4-алкилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, или C1-4-алкилоксикарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы иC1-4-алкилсульфонила, или C1-4-алкилкарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;Het1 означает тиазолил или 2-бора-1,3-диоксоланил, при этом указанный Het1 необязательно замещен одним или, в тех случаях когда это возможно, двумя, тремя, четырьмя или большим количеством заместителей, выбранных из аминогруппы, C1-4-алкила, гидрокси-С 1-4-алкила, фенила, фенил-C1-4-алкила,C1-4-алкилокси-C1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы или аминокарбонила;Het2 означает гетероцикл, выбранный из тетрагидропиранила, тетрагидрофуранила, фуранила,1,1-диоксотиоморфолинила, пиперазининонила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, азетидинила или 2-азетидинонила, при этом указанный Het2 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, аминогруппы, NR29R30, аминокарбонила, моно- или ди(C1-4-алкил)аминокарбонила, C1-4-алкилсульфонила илиC1-4-алкила, необязательно замещенного одним или несколькими заместителями, выбранными изNR27R28, C1-4-алкилсульфонила, аминокарбонилоксигруппы, аминокарбонила и моно- или ди(C1-4 алкил)аминокарбонила, или С 1-4-алкилоксигруппы, необязательно замещенной C1-4-алкилоксигруппой, или С 1-4-алкилоксикарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, С 1-4-алкилоксигруппы и C1-4-алкилсульфонила; илиHet2 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила, пирролидинила, тиоморфолинила или 1,1-диоксотиоморфолинила, при этом указанный Het2 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными изC1-4-алкила, необязательно замещенного одним или несколькими заместителями, выбранными из NR27R28, С 1-4-алкилсульфонила, аминокарбонилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, илиC1-4-алкилоксикарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;Het3 означает гетероцикл, выбранный из тетрагидропиранила, тетрагидрофуранила, фуранила,1,1-диоксотиоморфолинила, пиперазининонила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, азетидинила или 2-азетидинонила, при этом указанный Het3 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, гидроксигруппой, аминогруппой,C1-4-алкилом,C3-6-циклоалкил-С 1-4-алкилом,аминосульфонилом,моноили ди(С 1-4 алкил)аминосульфонилом, амино-С 1-4-алкилом, моно- или ди(С 1-4-алкил)амино-С 1-4-алкилом, NR35R36,С 1-4-алкилсульфонил-С 1-4-алкилом илиHet3 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила, фуранила или пирролидинила, при этом указанный Het3 замещен одним или, в тех случаях когда это возможно,двумя или более заместителями, выбранными из NR35R36, C1-4-алкилсульфонил-С 1-4-алкила илиHet4 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила, фуранила,пиразолила, диоксоланила, тиазолила, оксазолила, имидазолила, изоксазолила, оксадиазолила,пиридинила или пирролидинила, при этом указанный Het4 замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из C1-4-алкилсульфонил-C1-4-алкила,C1-4-алкилоксигруппы, необязательно замещенной C1-4-алкилоксигруппой или гидроксигруппой;Het5 означает гетероцикл, выбранный из фуранила, пиперазинила, 1,1-диоксотиоморфолинила, пиперазининонила, пиперидинила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, морфолинила или пирролидинила, при этом указанный Het5 необязательно замещен гидроксигруппой, аминогруппой, моно- или ди(C1-4-алкил)аминогруппой, C1-4-алкилом;Het6 и Het7, каждый независимо, означают гетероцикл, выбранный из пиперазинила, пиперидинила или пирролидинила, при этом указанные гетероциклы необязательно замещены одним или несколькимиHet8 означает гетероцикл, выбранный из тетрагидропиранила, тетрагидрофуранила,1,1-диоксотиоморфолинила, пиперазининонила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, азетидинила или 2-азетидинонила, при этом указанный Het8 необязательно замещен аминосульфонилом, аминокарбонилом, моно- или ди(C1-4-алкил)аминокарбонилом, моно- или ди(C1-4-алкил)аминосульфонилом или C1-4-алкилом, необязательно замещенным одним или несколькими заместителями, выбранными из аминогруппы, моно- или ди(C1-4-алкил)аминогруппы, NR33R34, C1-4-алкилсульфонила,аминокарбонилоксигруппы, гидроксигруппы, C1-4-алкилоксигруппы, аминокарбонила и моно- или ди(С 1-4-алкил)аминокарбонила, илиC1-4-алкилоксикарбонилом, необязательно замещенным одним или несколькими заместителями,выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонилом, необязательно замещенным одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила; илиHet8 означает гетероцикл, выбранный из фуранила, пиперидинила или пиперазинила, при этом указанный Het8 замещен аминокарбонилом, моно- или ди(C1-4-алкил)аминокарбонилом, моноили ди(C1-4-алкил)аминосульфонилом, илиC1-4-алкилом, замещенным одним или несколькими заместителями, выбранными из NR33R34,C1-4-алкилсульфонила, аминокарбонилоксигруппы, гидроксигруппы, C1-4-алкилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, илиC1-4-алкилоксикарбонилом, необязательно замещенным одним или несколькими заместителями,выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонилом, необязательно замещенным одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;Het9 и Het10, каждый независимо, означают гетероцикл, выбранный из пиперазинила, пиперидинила или пирролидинила, при этом указанные гетероциклы необязательно замещены одним или несколькими заместителями, выбранными из гидроксигруппы, аминогруппы, гидрокси-C1-4-алкила, С 1-4-алкилокси-С 1-4 алкила и C1-4-алкила;Het12 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, при этом указанный Het12 необязательно замещен одним или, в тех случаях когда это возможно,двумя или более заместителями, выбранными из гидроксигруппы, аминогруппы или C1-4-алкила;Het14 и Het15, каждый независимо, означают гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, при этом указанные Het14 и Het15 необязательно замещены одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы,аминогруппы или C1-4-алкила;Het16 означает гетероцикл, выбранный из пиперидинила или пирролидинила;Het20 означает пирролидинил, 2-пирролидинонил, пиперидинил или гидроксипирролидинил, предпочтительно пирролидинил или гидроксипирролидинил;Het21 означает пирролидинил или гидроксипирролидинил;Het23 и Het25, каждый независимо, означает гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила или пиперидинила, при этом указанный Het23 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из C1-4-алкила,C3-6-циклоалкила, гидрокси-C1-4-алкила, C1-4-алкилокси-С 1-4-алкила или полигидрокси-C1-4-алкила;Het1 означает 2-бора-1,3-диоксоланил, необязательно замещенный одним или, в тех случаях когда это возможно, двумя, тремя, четырьмя или более заместителями, выбранными из аминогруппы,C1-4-алкила, гидрокси-C1-4-алкила, фенила, фенил-C1-4-алкила, C1-4-алкилокси-С 1-4-алкила, моно- илиR4 означает C1-4-алкилоксигруппу, замещенную по меньшей мере одним заместителем, выбранным из С 1-4-алкилокси-С 1-4-алкилоксигруппы, NR37R38-карбонилоксигруппы, Het5-карбонилоксигруппы,NR7R8, NR9R10-карбонила, Het3-карбонила, Het13-оксигруппы или Het2-; гдеC1-4-алкилсульфонилом; или C1-4-алкилкарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы и C1-4-алкилоксигруппы; илиR8 означает C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из гидрокси-C1-4-алкилсульфонила, NR25R26, аминокарбонилоксигруппы, C1-4-алкилкарбонилоксигруппы, аминокарбонила, С 1-4-алкилокси-С 1-4-алкилоксигруппы и Het11;Het2 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила, пирролидинила или тиоморфолинила, при этом указанный Het2 замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными изC1-4-алкила, замещенного одним или несколькими заместителями, выбранными из NR27R28,C1-4-алкилсульфонила, аминокарбонилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила; илиC1-4-алкилоксикарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила; или С 1-4-алкилкарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила; илиHet2 означает 1,1-диоксотиоморфолинил, необязательно замещенный С 1-4-алкилом, необязательно замещенным одним или несколькими заместителями, выбранными из NR27R28, C1-4-алкилсульфонила,аминокарбонилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила; илиC1-4-алкилоксикарбонилом, необязательно замещенным одним или несколькими заместителями,выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила; илиC1-4-алкилкарбонилом, необязательно замещенным одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила. В используемом в приведенных выше определениях и в следующем описании смысле галоген является общим названием фтора, хлора, брома и йода;C1-2-алкил означает метил или этил;C1-3-алкил означает насыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие от 1 до 3 атомов углерода, например, такие как метил, этил, пропил и т.п.;C1-4-алкил означает насыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие от 1 до 4 атомов углерода, например, такие как метил, этил, пропил, бутил, 1-метилэтил,2-метилпропил, 2,2-диметилэтил и т.п.;C1-5-алкил означает насыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие от 1 до 5 атомов углерода, например, такие как метил, этил, пропил, бутил, пентил,1-метилбутил, 2,2-диметилпропил, 2,2-диметилэтил и т.п.; подразумевают, что C1-6-алкил включает C1-5-алкил и его гомологи более высокого порядка, имеющие 6 атомов углерода, например, такие как гексил, 1,2-диметилбутил, 2-метилпентил и т.п.; подразумевают, что C1-7-алкил включает C1-6-алкил и его гомологи более высокого порядка, имеющие 7 атомов углерода, например, такие как 1,2,3-диметилбутил, 1,2-метилпентил и т.п.;C3-9-алкил означает насыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие от 3 до 9 атомов углерода, такие как пропил, бутил, пентил, гексил, гептил, октил, нонил и т.п.; С 2-4-алкенил означает углеводородные радикалы с прямой или разветвленной цепью, содержащие одну двойную связь и имеющие от 2 до 4 атомов углерода, например, такие как винил, 2-пропенил,3-бутенил, 2-бутенил и т.п.;C3-9-алкенил означает углеводородные радикалы с прямой или разветвленной цепью, содержащие одну двойную связь и имеющие от 3 до 9 атомов углерода, например, такие как 2-пропенил, 3-бутенил,2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил, 3-гексенил и т.п.;C2-6-алкинил означает углеводородные радикалы с прямой или разветвленной цепью, содержащие одну тройную связь и имеющие от 2 до 6 атомов углерода, например, такие как 2-пропинил, 3-бутинил,2-бутинил, 2-пентинил, 3-пентинил, 3-метил-2-бутинил, 3-гексинил и т.п.;C3-6-циклоалкил является общим названием циклопропила, циклобутила, циклопентила и циклогекC1-4-алкилоксигруппа означает углеводородные радикалы с прямой или разветвленной цепью, такие как метокси-, этокси-, пропилокси-, бутилокси-, 1-метилэтилокси-, 2-метилпропилоксигруппа и т.п.; подразумевают, что C1-6-алкилоксигруппа включает C1-4-алкилоксигруппу и гомологи более высокого порядка, такие как метокси-, этокси-, пропилокси-, бутилокси-, 1-метилэтилокси-,2-метилпропилоксигруппа и т.п.; полигидрокси-C1-4-алкил является общим названием C1-4-алкила, который определен выше, имеющего два, три или, в тех случаях когда это возможно, большее количество гидроксизаместителей, например, такого как трифторметил. В используемом в приведенных выше определениях и в нижеследующем описании смысле термин формил относится к радикалу формулы -СН(=O). Когда X1 означает двухвалентный радикал -O-N=CH-,указанный радикал связан атомом углерода с R3,R4-несущим циклическим фрагментом соединений формулы (I), и когда X2 означает двухвалентный радикал -O-N=CH-, указанный радикал связан атомом углерода с R1,R2-несущим фенильным компонентом соединений формулы (I). Подразумевается, что гетероциклы, которые упоминаются в приведенных выше определениях и далее в описании, включают все их возможные изомерные формы, например пирролил также включает 2 Н-пирролил; триазолил включает 1,2,4-триазолил и 1,3,4-триазолил; оксадиазолил включает 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил и 1,3,4-оксадиазолил; тиадиазолил включает 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил и 1,3,4-тиадиазолил; пиранил включает 2 Н-пиранил и 4 Н-пиранил. Кроме того, гетероциклы, которые упоминаются в приведенных выше определениях и далее в описании, в соответствующих случаях могут быть связаны с остальной частью молекулы формулы (I) через любой атом углерода или гетероатом в цикле. Таким образом, например, в том случае когда гетероцикл является имидазолилом, он может представлять собой 1-имидазолил, 2-имидазолил, 3-имидазолил,4-имидазолил и 5-имидазолил; в том случае когда гетероцикл является тиазолилом, он может представлять собой 2-тиазолил, 4-тиазолил и 5-тиазолил; в том случае когда гетероцикл является триазолилом, он может представлять собой 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 1,3,4-триазол-1-ил и 1,3,4-триазол-2-ил; в том случае когда гетероцикл является бензотиазолилом, он может представлять собой 2-бензотиазолил, 4-бензотиазолил, 5-бензотиазолил, 6-бензотиазолил и 7-бензотиазолил. Подразумевают, что фармацевтически приемлемые аддитивные соли, которые указаны выше,включают терапевтически активные нетоксичные формы кислотно-аддитивных солей, которые соединения формулы (I) способны образовывать. Последние могут быть легко получены обработкой формы основания подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты,такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота; серная; азотная; фосфорная и т.п. кислоты; или органические кислоты, например, такие как уксусная,пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (т.е. бутандионовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, паратолуолсульфоновая, цикламовая, салициловая, аминосалициловая,памовая и т.п. кислоты. Подразумевается, что фармацевтически приемлемые аддитивные соли, которые указаны выше,включают терапевтически активные нетоксичные формы основно-аддитивных солей, которые соединения формулы (I) способны образовывать. Примерами таких форм основно-аддитивных солей, например,являются соли натрия, калия, кальция, а также соли фармацевтически приемлемых аминов, например,таких как аммиак, алкиламины, бензатин, N-метил-D-глюкамин, гидрабамин, аминокислоты, например аргинин, лизин. Наоборот, указанные солевые формы могут быть превращены обработкой соответствующим основанием или кислотой в форму свободной кислоты или основания. Термин "аддитивная соль", который использован выше, также включает сольваты, которые соединения формулы (I), а также их соли способны образовывать. Такими сольватами являются, например,гидраты, алкоголяты и т.п. Термин "стереохимически изомерные формы", который использован выше, означает возможные различные изомерные, а также конформационные формы, которые соединения формулы (I) могут иметь. Если не оговорено или не указано иное, то химическое название соединений означает смесь всех возможных стереохимически и конформационно изомерных форм, при этом указанные смеси включают все диастереомеры, энантиомеры и/или конформеры основной молекулярной структуры. Подразумевается,что все стереохимически изомерные формы соединений формулы (I) как в чистой форме, так и в виде смеси друг с другом входят в объем настоящего изобретения. Некоторые соединения формулы (I) также могут существовать в таутомерных формах. Подразумевается, что, хотя такие формы явно не указаны в приведенной выше формуле, они включены в объем настоящего изобретения.-7 013995 Подразумевается, что формы N-оксидов соединений формулы (I) включают такие соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида. Первая группа соединений согласно настоящему изобретению состоит из таких соединений формулы (I), к которым применимы одно или несколько из следующих ограничений:R3 означает C1-4-алкил, замещенный одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы или галогена;R4 означает Ar4-С 1-4-алкилоксигруппу, C1-4-алкилоксигруппу, или R4 означает C1-4-алкилоксигруппу,замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, галогена, C1-4-алкилоксигруппы, С 1-4-алкилокси-С 1-4-алкилоксигруппы, NR37R38 карбонилоксигруппы,Het5-карбонилоксигруппы,NR7R8,NR9R10-карбонила,Het3-карбонила,13 2R7 означает водород или C1-4-алкил;Het -сульфонил-; моно- или ди(C1-4-алкил)аминокарбонил-; моно- или ди(С 1-4-алкил)аминокарбонил,замещенный С 1-4-алкилсульфонилом, или C1-4-алкилкарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из С 1-4-алкилсульфонила, гидроксигруппы и C1-4-алкилоксигруппы, илиR8 означает C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изR9 означает водород или C1-4-алкил-;R16 и R17, каждый независимо, означают водород, C1-4-алкил или C1-4-алкил, замещенный гидроксигруппой или фенилом; илиR18 означает водород или C1-4-алкил, необязательно замещенный гидроксигруппой или фенилом;R19 означает водород или C1-4-алкил, предпочтительно водород или метил, еще более предпочтительно водород;R20 означает водород или C1-4-алкил, предпочтительно водород или метил;R22 означает водород или C1-4-алкил, необязательно замещенный гидроксигруппой или С 1-4-алкилоксигруппой;R23 также может означать водород в том случае, когда R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуют C3-6-циклоалкил;R25 и R26, каждый независимо, означают водород, C1-4-алкил, C1-4-алкилсульфонил-,аминокарбонил-, моно- или ди(С 1-4-алкил)аминокарбонил-, C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изR27 и R28, каждый независимо, означают водород, C1-4-алкил, С 1-4-алкилсульфонил-,аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-, C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изR29 и R30, каждый независимо, означают водород, аминосульфонил, аминокарбонил, моно- или ди(С 1-4-алкил)аминокарбонил-, моно- или ди(С 1-4-алкил)аминосульфонил- или С 1-4-алкил-, необязательно замещенный одним или несколькими заместителями, выбранными из NR31R32, С 1-4-алкилсульфонила,аминокарбонилоксигруппы, гидроксигруппы, С 1-4-алкилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, или C1-4-алкилоксикарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы иC1-4-алкилсульфонила, или C1-4-алкилкарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;R31 и R32, каждый независимо, означают водород, C1-4-алкил, C1-4-алкилсульфонил-,аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-, C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными изR33 означает водород или C1-4-алкил;R34 означает C1-4-алкилсульфонил-, аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-,C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы и C1-4-алкилоксигруппы;R35 означает водород или C1-4-алкил;R36 означает C1-4-алкилсульфонил-, аминокарбонил-, моно- или ди(C1-4-алкил)аминокарбонил-,C1-4-алкилкарбонил-, C1-4-алкилоксикарбонил- или C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы и C1-4-алкилоксигруппы;C1-4-алкил, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила,гидроксигруппы и C1-4-алкилоксигруппы;R39 и R40, каждый независимо, означают аминосульфонил, аминокарбонил, моно- или ди(C1-4-алкил)аминокарбонил-, моно- или ди(C1-4-алкил)аминосульфонил- или C1-4-алкил-, замещенный одним или несколькими заместителями, выбранными из NR31R32, C1-4-алкилсульфонила, аминокарбонилоксигруппы, гидроксигруппы, C1-4-алкилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, или C1-4-алкилоксикарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонил, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;Het1 означает тиазолил или 2-бора-1,3-диоксоланил, при этом указанный Het1 необязательно замещен одним или, в тех случаях когда это возможно, двумя, тремя, четырьмя или большим количеством заместителей, выбранных из аминогруппы, C1-4-алкила, гидрокси-C1-4-алкила, фенила, фенил-C1-4-алкила,C1-4-алкилокси-C1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы или аминокарбонила;Het2 означает гетероцикл, выбранный из тетрагидропиранила, тетрагидрофуранила, фуранила,1,1-диоксотиоморфолинила, пиперазининонила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, азетидинила или 2-азетидинонила, при этом указанный Het2 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, аминогруппы, NR29R30, аминокарбонила, моно- или ди(C1-4-алкил)аминокарбонила, C1-4-алкилсульфонила илиC1-4-алкила, необязательно замещенного одним или несколькими заместителями, выбранными изC1-4-алкилоксикарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила; илиHet2 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, при этом указанные морфолинил, пиперазинил, пиперидинил или пирролидинил необязательно замещены одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными изC1-4-алкила, необязательно замещенного одним или несколькими заместителями, выбранными из NR27R28, C1-4-алкилсульфонила, аминокарбонилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, илиC1-4-алкилоксикарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонила, необязательно замещенного одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;Het3 означает гетероцикл, выбранный из тетрагидропиранила, тетрагидрофуранила, фуранила,1,1-диоксотиоморфолинила, пиперазининонила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, азетидинила или 2-азетидинонила, при этом указанный Het3 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, гидроксигруппой, аминогруппой, C1-4-алкилом, C3-6-циклоалкил-С 1-4-алкилом, аминосульфонилом, моно- или ди(С 1-4-алкил)аминосульфонилом, амино-C1-4-алкилом, моно- или ди(C1-4-алкил)амино-С 1-4-алкилом, NR35R36, С 1-4-алкилсульфонил-С 1-4-алкилом или C1-4-алкилоксигруппой, необязательно замещенной C1-4-алкилоксигруппой или гидроксигруппой; илиHet3 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, при этом указанный Het3 необязательно замещен одним или, в тех случаях когда это возможно,двумя или более заместителями, выбранными из NR35R36, С 1-4-алкилсульфонил-С 1-4-алкила илиHet4 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила, фуранила,пиразолила, диоксоланила, тиазолила, оксазолила, имидазолила, изоксазолила, оксадиазолила, пиридинила или пирролидинила, при этом указанный Het4 замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из C1-4-алкилсульфонил-C1-4-алкила,C1-4-алкилоксигруппы, необязательно замещенной C1-4-алкилоксигруппой или гидроксигруппой;Het5 означает гетероцикл, выбранный из фуранила, пиперазинила, 1,1-диоксотиоморфолинила, пиперазининонила, пиперидинила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, морфолинила или пирролидинила, при этом указанный Het5 необязательно замещен гидроксигруппой, аминогруппой, моно- или ди(C1-4-алкил)аминогруппой, C1-4-алкилом;Het6 и Het7, каждый независимо, означают гетероцикл, выбранный из пиперазинила, пиперидинила или пирролидинила, при этом указанные гетероциклы необязательно замещены одним или несколькими заместителями, выбранными из гидроксигруппы, аминогруппы, гидрокси-С 1-4-алкила,С 1-4-алкилокси-С 1-4-алкила и C1-4-алкила;Het8 означает гетероцикл, выбранный из тетрагидропиранила, тетрагидрофуранила,1,1-диоксотиоморфолинила, пиперазининонила, тетрагидро-1,1-диоксидо-2 Н-тиопиранила, пиперидинонила, азетидинила или 2-азетидинонила, при этом указанный Het8 необязательно замещен аминосульфонилом, аминокарбонилом, моно- или ди(C1-4-алкил)аминокарбонилом, моно- или ди(C1-4-алкил)аминосульфонилом или C1-4-алкилом, необязательно замещенным одним или несколькими заместителями, выбранными из аминогруппы, моно- или ди(C1-4-алкил)аминогруппы, NR33R34, C1-4-алкилсульфонила, аминокарбонилоксигруппы, гидроксигруппы, C1-4-алкилоксигруппы, аминокарбонила и моно- или ди(С 1-4-алкил)аминокарбонила, илиC1-4-алкилоксикарбонилом, необязательно замещенным одним или несколькими заместителями,выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонилом, необязательно замещенным одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила; илиHet8 означает гетероцикл, выбранный из фуранила, пиперидинила или пиперазинила, при этом указанный Het8 замещен аминокарбонилом, моно- или ди(C1-4-алкил)аминокарбонилом, моно- или ди(С 1-4-алкил)аминосульфонилом, илиC1-4-алкилом, замещенным одним или несколькими заместителями, выбранными из NR33R34,C1-4-алкилсульфонила, аминокарбонилоксигруппы, гидроксигруппы, C1-4-алкилоксигруппы, аминокарбонила и моно- или ди(C1-4-алкил)аминокарбонила, илиC1-4-алкилоксикарбонилом, необязательно замещенным одним или несколькими заместителями,выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила, илиC1-4-алкилкарбонилом, необязательно замещенным одним или несколькими заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы и C1-4-алкилсульфонила;Het9 и Het10, каждый независимо, означают гетероцикл, выбранный из пиперазинила, пиперидинила или пирролидинила, при этом указанные гетероциклы необязательно замещены одним или несколькими заместителями, выбранными из гидроксигруппы, аминогруппы, гидрокси-C1-4-алкила,С 1-4-алкилокси-С 1-4-алкила и C1-4-алкила;Het12 означает гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, при этом указанный Het12 необязательно замещен одним или, в тех случаях когда это возможно,двумя или более заместителями, выбранными из гидроксигруппы, аминогруппы или C1-4-алкила;Het16 означает гетероцикл, выбранный из пиперидинила или пирролидинила;Het20 означает пирролидинил, 2-пирролидинонил, пиперидинил или гидроксипирролидинил, предпочтительно пирролидинил или гидроксипирролидинил;Het21 означает пирролидинил или гидроксипирролидинил;Het23 означает гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила или пиперидинила, при этом указанный Het23 необязательно замещен одним или, в тех случаях когда это возможно,двумя или более заместителями, выбранными из C1-4-алкила, C3-6-циклоалкила, гидрокси-C1-4-алкила,C1-4-алкилокси-C1-4-алкила или полигидрокси-С 1-4-алкила;Het1 означает 2-бора-1,3-диоксоланил, необязательно замещенный одним или, в тех случаях когда это возможно, двумя, тремя, четырьмя или более заместителями, выбранными из аминогруппы,C1-4-алкила, гидрокси-C1-4-алкила, фенила, фенил-C1-4-алкила, С 1-4-алкилокси-С 1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы или аминокарбонила;R4 означает С 1-4-алкилоксигруппу, замещенную по меньшей мере одним заместителем, выбранным из С 1-4-алкилокси-С 1-4-алкилоксигруппы, NR37R38-карбонилоксигруппы, Het5-карбонилоксигруппы,NR7R8, NR9R10-карбонила, Het3-карбонила, Het13-оксигруппы или Het2-. Другая группа соединений согласно настоящему изобретению состоит из таких соединений формулы (I), к которым применимы одно или несколько их следующих ограничений:R4 означает Ar4-C1-4-алкилоксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы, C1-4-алкилокси-C1-4-алкилоксигруппы, NR7R8 или Het2; предпочтительно R4 означает Ar4-C1-4-алкилоксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными изR8 означает C1-4-алкилоксикарбонил или C1-4-алкил-, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, C1-4-алкилкарбонилоксигруппы или NR25R26; предпочти- 11013995 тельно R8 означает C1-4-алкил-, замещенный одним или несколькими заместителями, выбранными изR11 означает водород, C1-4-алкилоксикарбонил или C1-4-алкил; предпочтительно R11 означает водород или C1-4-алкил;R12 означает водород или C1-4-алкил;R14 и R15, каждый независимо, означают водород или C1-4-алкил; предпочтительно R14 и R15, каждый независимо, означают водород;R16 и R17, каждый независимо, означают водород или C1-4-алкил, необязательно замещенныйR21 означает водород или C1-4-алкилоксикарбонил; предпочтительно R21 означает водород или C1-4 алкилоксикарбонил;R23 также может означать водород в том случае, когда R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуют C3-6-циклоалкил;R25 и R26, каждый независимо, означают водород, C1-4-алкил, C1-4-алкилсульфонил, C1-4-алкилоксикарбонил или C1-4-алкилкарбонил; предпочтительно R25 и R26, каждый независимо, означают водород или C1-4-алкилкарбонил;R27 и R28, каждый независимо, означают водород, C1-4-алкил, C1-4-алкилсульфонил-,C1-4-алкилоксикарбонил- или C1-4-алкилкарбонил; предпочтительно R27 и R28, каждый независимо, означают водород или C1-4-алкилкарбонил;Het1 означает 2-бора-1,3-диоксоланил-, необязательно замещенный одним или, в тех случаях когда это возможно, двумя, тремя, четырьмя или большим количеством заместителей, выбранных из аминогруппы, C1-4-алкила, гидрокси-C1-4-алкила, фенила, фенил-C1-4-алкила, С 1-4-алкилокси-С 1-4-алкила, моноили ди(C1-4-алкил)аминогруппы или аминокарбонила;Het2 означает 1,1-диоксотиоморфолинил, необязательно замещенный C1-4-алкилоксикарбонилом или C1-4-алкил-NR27R28; или Het2 означает пиперидинил или пиперазинил, замещенныйHet25 означает гетероцикл, выбранный из морфолинила или пиперазинила, при этом указанный гетероцикл необязательно замещен C1-4-алкилом, гидрокси-С 1-4-алкилом, С 1-4-алкилокси-С 1-4-алкилом или полигидрокси-C1-4-алкилом; илиR4 означает C1-4-алкилоксигруппу, замещенную по меньшей мере одним заместителем, выбранным из С 1-4-алкилокси-C1-4-алкилоксигруппы, NR7R8 или Het2. Другая группа соединений согласно настоящему изобретению состоит из таких соединений формулы (I), к которым применимо одно или несколько из следующих ограничений:R1 означает водород или галоген;R4 означает Ar4-С 1-4-алкилоксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещен- 12013995 ную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4-алкилоксигруппы, С 1-4-алкилокси-С 1-4-алкилоксигруппы, NR7R8 или Het2; предпочтительно R4 означает Ar4-C1-4-алкилоксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными изR7 означает водород или C1-4-алкил;R8 означает C1-4-алкилоксикарбонил или C1-4-алкил-, замещенный одним или несколькими заместителями, выбранными из C1-4-алкилсульфонила, гидроксигруппы, C1-4-алкилкарбонилоксигруппы илиNR25R26; предпочтительно R8 означает C1-4-алкил, замещенный одним или несколькими заместителями,выбранными из C1-4-алкилсульфонила или NR25R26;R11 означает водород или C1-4-алкил;R12 означает водород или C1-4-алкил;R16 и R17, каждый независимо, означают водород или C1-4-алкил, необязательно замещенныйR21 означает водород или C1-4-алкилоксикарбонил;Het ; R23 также может означать водород в том случае, когда R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуют С 3-6-циклоалкил;R25 и R26, каждый независимо, означают водород или C1-4-алкилкарбонил;R27 и R28, каждый независимо, означают водород или C1-4-алкилкарбонил;Het2 означает 1,1-диоксотиоморфолинил, пиперидинил или пиперазинил, при этом указанный Het2 необязательно замещен C1-4-алкилоксикарбонилом или -C1-4-алкил-NR27R28;Het25 означает гетероцикл, выбранный из морфолинила или пиперазинила, при этом указанный гетероцикл необязательно замещен C1-4-алкилом, гидрокси-С 1-4-алкилом, С 1-4-алкилокси-С 1-4-алкилом или полигидрокси-C1-4-алкилом;R4 означает C1-4-алкилоксигруппу, замещенную по меньшей мере одним заместителем, выбранным из С 1-4-алкилокси-С 1-4-алкилоксигруппы, NR7R8 или Het2; предпочтительно C1-4-алкилоксигруппу, замещенную С 1-4-алкилокси-С 1-4-алкилоксигруппой или NR7R8. Представляющая интерес группа соединений состоит из таких соединений формулы (I), к которым применимо одно или несколько из следующих ограничений:X2 означает прямую связь, C1-2-алкил, -CO-C1-2-алкил- или NR12-С 1-2-алкил-; предпочтительно X2 означает прямую связь или NR12-C1-2-алкил-;R1 означает водород или галоген; предпочтительно R1 означает водород;R2 означает водород, C2-6-алкинил, цианогруппу или Het1; предпочтительно R2 означает галоген,ацетилен или Het1; более предпочтительно R2 означает галоген или Het1;R4 означает Ar4-С 1-4-алкилоксигруппу, С 1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из Het2,NR7R8, гидроксигруппы и С 1-4-алкилокси-С 1-4-алкилоксигруппы; предпочтительно R4 означаетR7 означает водород или С 1-4-алкил;R12 означает водород или C1-4-алкил-;R23 означает водород или C1-4-алкил; предпочтительно R23 означает C1-4-алкил, и R23 означает водород в том случае, когда R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуют С 3-6-циклоалкил;R25 и R26, каждый независимо, означают водород или C1-4-алкилкарбонил;R27 и R28, каждый независимо, означают водород или C1-4-алкилкарбонил;Het2 означает пиперидинил, пиперазинил, морфолинил, тиоморфолинил или 1,1-диоксотиоморфолинил, при этом указанный Het2 необязательно замещен C1-4-алкилоксикарбонилом илиAr6 означает фенил, необязательно замещенный нитрогруппой. Представляющая интерес группа соединений состоит из таких соединений формулы (I), к которым применимы одно или несколько из следующих ограничений:R1 означает водород, цианогруппу или галоген; предпочтительно R1 означает водород или галоген,более предпочтительно R1 означает водород, фтор или бром;R2 означает галоген, С 2-6-алкинил, цианогруппу или Het1; предпочтительно R2 означает галоген,ацетилен или Het1; более предпочтительно R2 означает галоген или Het1;R4 означает Ar4-C1-4-алкилоксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из Het2,NR7R8, гидроксигруппы и C1-4-алкилокси-C1-4-алкилоксигруппы; предпочтительно R4 означает Ar4-C1-4 алкилоксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из Het2, NR7R8 или гидроксигруппы;R12 означает водород или C1-4-алкил-;R23 означает C1-4-алкил, необязательно замещенный Het25; R23 также может означать водород в том случае, когда R16 и R17, вместе взятые с атомом углерода, с которым они связаны, образуютR25 и R26, каждый независимо, означают водород или C1-4-алкилкарбонил;R27 и R28, каждый независимо, означают водород или C1-4-алкилкарбонил;Het2 означает пиперидинил,пиперазинил,морфолинил,тиоморфолинил или 1,1-диоксотиоморфолинил, при этом указанный Het2 необязательно замещен C1-4-алкилоксикарбонилом или -NR27R28-C1-4-алкилом; предпочтительно Het2 означает 1,1-диоксотиоморфолинил, пиперидинил, замещенный C1-4-алкилоксикарбонилом, или пиперазинил, замещенный C1-4-алкилоксикарбонилом илиAr6 означает фенил, необязательно замещенный нитрогруппой. Следующая представляющая интерес группа соединений состоит из таких соединений формулы (I),к которым применимо одно или несколько из следующих ограничений:R1 означает водород или галоген;R3 означает водород или цианогруппу;R4 означает Ar4-С 1-4-алкилоксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из Het2,NR7R8, гидроксигруппы и С 1-4-алкилокси-С 1-4-алкилоксигруппы;R7 означает водород или C1-4-алкил;R12 означает водород или C1-4-алкил-;R25, R26, R27 и R28, каждый независимо, означают водород или C1-4-алкилкарбонил;Het2 означает пиперидинил, пиперазинил, морфолинил, тиоморфолинил или 1,1-диоксотиоморфолинил, при этом указанный Het2 необязательно замещен C1-4-алкилоксикарбонилом или NR27R28C1-4-алкилом;Ar6 означает фенил, необязательно замещенный нитрогруппой. Другими конкретными группами соединений являются такие соединения формулы (I), в которыхR7 означает водород или метил иR8 означает аминокарбонил-C1-4-алкил-, NR25R26, С 1-4-алкилсульфонил-C1-4-алкил-, C1-4-алкилкарбонилокси-C1-4-алкил или Het11C1-4-алкил-; в частности такие соединения формулы (I), в которых R7 означает водород или метил, иHet2 означает пиперидинил, 1,1-диоксотиоморфолинил или пиперазинил, и указанный Het2 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из NR39R40, аминокарбонила, моно- или ди-(C1-4-алкил)аминокарбонила или C1-4-алкилсульфонила; в частности такие соединения формулы (I), в которых Het2 означает пиперидинил или пиперазинил и указанный Het2 необязательно замещен одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из NR39R40, аминокарбонила, моно- или ди(C1-4-алкил)аминокарбонила илиC1-4-алкилсульфонила. В следующем варианте настоящего изобретения заместитель X2 находится в положении 2',заместитель R1 представляет собой водород или галоген и находится в положении 4',заместитель R2 представляет собой галоген и находится в положении 5',заместитель R3 находится в положении 2 и заместитель R4 находится в положении 7 структурной формулы (I). Альтернативно заместитель X2 находится в положении 3',заместитель R1 представляет собой водород или галоген и находится в положении 4',заместитель R2 представляет собой галоген и находится в положении 5',заместитель R3 находится в положении 2 и заместитель R4 находится в положении 7 структурной формулы (I). Соединения согласно настоящему изобретению могут быть получены любым из нескольких стан 21- 15013995 дартных способов синтеза, обычно используемых специалистами в области органической химии и описанных, например, в следующих публикациях: "Heterocyclic Compounds". Vol. 24 (part 4), p. 261-304,Fused pyrimidines, Wiley - Interscience; Chem. Pharm. Bull. Vol. 41 (2) 362-368 (1993); J. Chem. Soc., PerkinTrans. 1, 2001, 130-137. Как показано на примерах в экспериментальной части описания, конкретной группой соединений являются такие соединения формулы (I), в которых -X1- означает -О-, в дальнейшем называемые соединениями формулы (3). Указанные соединения обычно получают, исходя из известного 6-ацетокси-4 хлор-7-метоксихиназолина (II'), который может быть получен из коммерчески доступной вератровой кислоты и 4-гидрокси-3-метоксибензойной кислоты соответственно. Сочетание последнего с подходящими замещенными анилинами (III') в стандартных условиях, например, при перемешивании в 2-пропаноле при повышенной температуре в диапазоне 40-100 С в течение 3-12 ч дает промежуточные соединения (IV') (схема 1). Схема 1V = водород или защитная группа, например, такая группа как метилкарбонил, трет-бутил, метил,этил, бензил или триалкилсилил;X2, R1 и R2 имеют значения, которые определены для соединений формулы (I). Удаление защиты промежуточных соединений формулы (IV'), как описано в Protective Groups inOrganic Synthesis, Т.W. Greene and P.G.M. Wuts, 3rd edition, 1998, с последующей циклизацией в условиях реакции Митсунобу дают макроциклические соединения (1), которые используют в качестве исходных соединений в синтезе конечных соединений согласно настоящему изобретению (схема 2 - на которой V имеет значение, определенное выше). Схема 2 аV = водород или защитная группа, например, такая группа как метилкарбонил, трет-бутил, метил,этил, бензил или триалкилсилил;X2, R1 и R2 имеют значения, которые определены для соединений формулы (I). Коротко, указанные макроциклические соединения формулы (1) деметилируют, используя известные в данной области условия, например, такие как условия, показанные на схемах 3 и 4, с последующим алкилированием подходящим спиртом, например, как описано на схеме 5. Схема 3 Деметилирование хиназолина Перемешиваемую суспензию 1 (1 экв.), LiCl (7 экв.) и Na2S9H2O (7 экв.) в ДМФА нагревали в условиях микроволновой печи до 140 С до завершения реакции (30 мин). Реакционной смеси давали возможность остыть до температуры окружающей среды и затем вливали в ледяную воду. Смесь фильтровали и желтый осадок перерастворяли в ДХМ/МеОН (9:1) с некоторым количеством НСООН и очищали через фильтр из силикагеля (элюенты: DCM/MeOH 9,5/0,5). Чистые фракции собирали, упаривали и осуществляли совместное выпаривание с толуолом, получая очищенное соединение 2 К перемешиваемой суспензии 1 (1 экв.) и KI (10 экв.) в DMA добавляли HBr (48% в H2O), при этом барботируя N2 через реакционную смесь. Смесь быстро нагревали до 130 С и перемешивали при указанной температуре до завершения реакции (2 ч). Реакционной смеси давали возможность остыть до 70 С и выливали на лед/H2O/NH3. Смесь фильтровали и желтый осадок перерастворяли в ТГФ/МеОН (2:1),концентрировали и выпаривали совместно с толуолом. Кристаллизация из 2-пропанол давала очищенное соединение 2 (выход: 42-78%). Схема 5 Алкилирование хиназолина где R означает Ar4-С 1-4-алкил-, C1-4-алкил- или R означает C1-4-алкил, замещенный одним или, в тех случаях когда это возможно, двумя или более заместителями, выбранными из гидроксигруппы, галогена,C1-4-алкилоксигруппы, С 1-4-алкилокси-С 1-4-алкилоксигруппы, NR7R8 или Het2-. Ar4, Her2, R7 и R8 имеют значения, которые определены для соединений формулы (I) выше. К перемешиваемой суспензии 2 (1 экв.), спирта (8 экв.) и трифенилфосфина (2 экв.) в ТГФ по каплям добавляли DIAD (2 экв.) и смесь перемешивали при комнатной температуре в течение 60 мин. Реакционную смесь концентрировали при пониженном давлении и неочищенный продукт растирали в ацетонитриле, получая очищенное соединение 3. Для соединений формулы (3), в которых R1 или R2 означают ацетилен, обычно применяли следующую схему синтеза (схема 6). Коротко, галогенированную форму соединения формулы (3) ацетилируют,используя триметилсилилацетилен, с последующим удалением защиты ацетиленовой группы, получая соединения общей формулы (5). Схема 6 Включение остатка ацетилена где R имеет значение, которое определено на схеме 5. К перемешиваемому раствору 3 (1 экв.) в пирролидине добавляли хлорид бис-(трифенилфосфин)палладия(II) (20 мол.%), затем CuI (каталитическое количество). Реакционную смесь нагревали до 75 С и добавляли триметилсилилацетилен (2,5 экв.). Смесь перемешивали при указанной температуре, по существу, до завершения реакции и затем фильтровали через небольшую подушку целита и концентрировали досуха. Остаток перерастворяли в EtOAc и распределяли между EtOAc и водой. Объединенные органические слои концентрировали при пониженном давлении и остаток обрабатывали МР-ТМТ в ацетонитриле в течение ночи. Затем его фильтровали, смолу промывали ацетонитрилом, затем DCM и фильтрат концентрировали, получая соединение 4.- 17013995 Соединение 4 и водный раствор K2CO3 (насыщ.) в МеОН (1:1) перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении, остаток перерастворяли в DCM и промывали водой. Органическую фазу отделяли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали либо хроматографией на колонке, либо обращенно-фазовой ВЭЖХ,получая очищенное соединение 5. Конкретную группу соединений представляют соединения формулы (3), в которой R означает C1-4 алкил, замещенный NR7R8 или Het2, при этом указанный Het2 связан с остальной частью молекулы через атом азота. Указанные соединения общей формулы (7) обычно получают согласно схеме синтеза 7, исходя из промежуточных соединений общей формулы (2). Схема 7 где R7 и R8 имеют значения, которые определены для соединений формулы (I), илиR7 и R8, вместе взятые с атомом азота, с которым они связаны, образуют гетероцикл, при этом указанный гетероцикл имеет такие же значения, как и Het2, определенные для соединений формулы (I) выше. К перемешиваемой суспензии 2 (1 экв.), бромпропилового спирта (2 экв.) и трифенилфосфина(2 экв.) в ТГФ по каплям добавляли DIAD (2 экв.) и смесь перемешивали при комнатной температуре в течение 60 мин. Реакционную смесь концентрировали в вакууме и неочищенный продукт растирали в ацетонитриле, получая очищенное соединение 6. К перемешиваемой суспензии 6 (1 экв.) в ацетонитриле добавляли амин (20 экв.) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме и неочищенный продукт растирали в ацетонитриле, получая очищенное соединение 7. Альтернативно указанному выше и, в частности, в случае соединений формулы (7), в которых остаток C1-4-алкила дополнительно замещен гидроксигруппой, указанные соединения получают с использованием реакции нуклеофильного присоединения, исходя из аналога оксирана 3' (схема 8). Схема 8 где R7 и R8 имеют значения, которые определены для соединений формулы (I), илиR7 и R8, вместе взятые с атомом азота, с которым они связаны, образуют гетероцикл, при этом указанный гетероцикл имеет такие же значения, как и Het2, определенные для соединений формулы (I) выше. К перемешиваемой суспензии 3' (1 экв.) в 2-пропаноле добавляли амин (20 экв.) и смесь перемешивали при 70 С в течение 2 ч. Реакционную смесь охлаждали и продукт кристаллизовали из 2-пропанола,получая очищенное соединение 8. В том случае когда это необходимо или желательно, может быть осуществлена любая одна или несколько из следующих дополнительных стадий в любом порядке:(i) удаление любой остающейся защитной группы (групп);(ii) превращение соединения формулы (I) или его защищенной формы в новое соединение формулы(I) или его защищенную форму;(iii) превращение соединения формулы (I) или его защищенной формы в N-оксид, соль, четвертичный амин или сольват соединения формулы (I) или его защищенной формы;(iv) превращение N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в соединение формулы (I) или его защищенную форму;(v) превращение N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в другой N-оксид, фармацевтически приемлемую аддитивную соль, четвертичный амин или сольват соединения формулы (I) или его защищенной формы;(vi) в том случае, когда соединение формулы (I) получают в виде смеси (R)- и (S)-энантиомеров,разделение смеси с получением требуемого энантиомера.- 18013995 Соединения формулы (I), их N-оксиды, аддитивные соли, четвертичные амины и стереохимические изомерные формы могут быть превращены в другие соединения согласно изобретению с использованием способов, известных в данной области. Специалистам в данной области будет понятно, что в описанных выше способах может требоваться блокирование функциональных групп промежуточных соединений защитными группами. Функциональные группы, которые необходимо защищать, включают гидроксигруппу, аминогруппу и группу карбоновой кислоты. Подходящие защитные группы гидроксигруппы включают триалкилсилильные группы (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил),бензил и тетрагидропиранил. Подходящие защитные группы аминогруппы включают третбутилоксикарбонил или бензилоксикарбонил. Подходящие защитные группы карбоновой кислоты включают С(1-6)алкиловые или бензиловые эфиры. Защита и удаление защиты функциональных групп может иметь место перед стадией реакции или после нее. Кроме того, атомы N в соединениях формулы (I) могут быть метилированы известными в данной области способами с использованием СН 3-I в подходящем растворителе, например, таком как 2-пропанон, тетрагидрофуран или диметилформамид. Соединения формулы (I) также можно превращать друг в друга, следуя известным в данной области способам трансформации функциональных групп, некоторые примеры которых указаны далее. Соединения формулы (I) также можно превратить в соответствующие формы N-оксидов, следуя известным в данной области способам превращения трехвалентного азота в форму его N-оксида. Указанная реакция N-окисления обычно может быть осуществлена в результате взаимодействия исходного соединения формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия,пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, например, такие как бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота, например 3-хлорбензолкарбопероксикислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены с использованием известных в данной области способов. Диастереомеры могут быть разделены физическими способами, такими как фракционная кристаллизация и хроматографические способы, например распределение в противотоке, жидкостная хроматография и т.п. Некоторые соединения формулы (I) и некоторые промежуточные соединения согласно настоящему изобретению могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных продуктов могут быть получены с использованием известных в данной области способов. Например, диастереомеры могут быть разделены физическими способами, такими как фракционированная кристаллизация или хроматографические способы,например распределение в противотоке, жидкостная хроматография и т.п. способы. Энантиомеры могут быть получены из рацемических смесей сначала превращением указанных рацемических смесей с использованием подходящих разделяющих агентов, например, таких как хиральные кислоты, в смеси диастереомерных солей или соединений; затем физическим разделением указанных смесей диастереомерных солей или соединений, например, фракционированной кристаллизацией или хроматографическими способами, например жидкостной хроматографией, и т.п.способами, и, наконец, превращением указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм соответствующих промежуточных продуктов и исходных веществ при условии, что промежуточные реакции происходят стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных продуктов заключается в жидкостной хроматографии, в частности жидкостной хроматографии с использованием хиральной неподвижной фазы. Некоторые промежуточные продукты и исходные соединения, которые использованы в способах реакции, указанных выше, являются известными соединениями и могут быть коммерчески доступны или могут быть получены согласно известным в данной области способам. Как описано в экспериментальной части далее, ингибирующее рост действие и противоопухолевая активность соединений согласно настоящему изобретению показаны in vitro в ферментативных анализах на рецепторных тирозинкиназах, например, таких как EGFR, Abl, Fyn, FlT1, HcK или семейство киназSar, например, таких как Lyn, Yes и cSRC. В альтернативном анализе ингибирующее рост действие соединений тестировали на нескольких линиях клеток карцином, предпочтительно на линии клеток карци- 19013995 номы яичника SKOV3 и линии клеток плоскоклеточной карциномы А 431 с использованием известных в данной области анализов цитотоксичности, таких как MTT. Соответственно настоящее изобретение относится к соединениям формулы (I) и их фармацевтически приемлемым N-оксидам, аддитивным солям, четвертичным аминам и стереохимически изомерным формам для применения в терапии, более конкретно для применения для лечения или профилактики опосредованных пролиферацией клеток заболеваний. Соединения формулы (I) и их фармацевтически приемлемые N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы могут в дальнейшем называться соединениями согласно изобретению. Расстройствами, в случае которых соединения согласно изобретению особенно применимы, являются атеросклероз, рестеноз, рак и диабетические осложнения, например ретинопатия. Принимая во внимание применимость соединений согласно изобретению, предлагается способ лечения расстройства пролиферации клеток, такого как атеросклероз, рестеноз и рак, при этом способ включает введение животному, нуждающемуся в таком лечении, например млекопитающему, включая человека, страдающему от расстройства пролиферации клеток, терапевтически эффективного количества соединения согласно настоящему изобретению. Указанный способ включает системное или местное введение эффективного количества соединения согласно изобретению животным, включая человека. Специалисту в данной области будет понятно, что терапевтически эффективным количеством ингибиторовEGFR согласно настоящему изобретению является количество, достаточное для индукции ингибирующего рост действия, и что такое количество варьирует, наряду с прочим, в зависимости от размера, типа неоплазии, концентрации соединения в терапевтическом препарате и состояния пациента. В общем количество ингибитора EGFR, вводимого в качестве терапевтического средства для лечения расстройства пролиферации клеток, такого как атеросклероз, рестеноз и рак, в каждом конкретном случае будет определять лечащий врач. В общем подходящей дозой является доза, которая дает концентрацию ингибитора EGFR в месте лечения в диапазоне от 0,5 нМ до 200 мкМ и более обычно от 5 нМ до 10 мкМ. Чтобы получить такие концентрации при лечении пациенту, нуждающемуся в лечении, вероятно, будут вводить от 0,01 до 300 мг/кг массы тела, предпочтительно от 10 до 100 мг/кг массы тела. Как указано, приведенные выше количества могут варьировать в каждом конкретном случае. В указанных способах лечения соединения согласно изобретению предпочтительно составляют композицию перед приемом. Как описано в данном документе ниже, подходящие фармацевтические композиции получают известными способами с использованием хорошо известных и легкодоступных ингредиентов. Вследствие своей высокой степени избирательности в качестве ингибиторов EGFR соединения формулы (I), которые описаны выше, также применимы для маркирования или идентификации киназного домена в тирозинкиназных рецепторах. С этой целью соединения согласно настоящему изобретению можно метить, предпочтительно заменяя, частично или полностью, один или несколько атомов в молекуле их радиоактивными изотопами. Примерами представляющих интерес меченых соединений являются соединения, имеющие по меньшей мере один атом галогена, который представляет собой радиоактивный изотоп йода, брома или фтора; или соединения, имеющие по меньшей мере один 11 С-атом или атом трития. Одна конкретная группа состоит из соединений формулы (I), в которых R1 является радиоактивным атомом галогена. В принципе любое соединение формулы (I), содержащее атом галогена, подвергается радиоактивному мечению посредством замены атома галогена подходящим изотопом. Подходящими для этой цели радиоактивными изотопами галогенов являются радиоактивные йодиды, например 122I, 123I,125 131F. Введение радиоактивного атома галогена можно осуществить подходящей реакцией обмена или с использованием любого из способов, которые описаны выше для получения галогенпроизводных формулы (I). Другой представляющей интерес формой радиоактивного мечения является замена атома углерода 11 С-атомом или замена атома водорода атомом трития. Следовательно, указанные радиоактивно меченые соединения формулы (I) можно использовать в способе специфичного маркирования мест рецепторов в биологическом материале. Указанный способ включает в себя стадии (а) радиоактивного мечения соединения формулы (I); (b) введения полученного радиоактивно меченого соединения в биологический материал и затем (с) выявления излучения от радиоактивно меченого соединения. Альтернативно, соединения метят стабильными изотопами. При такой форме мечения широко распространенные в природе изотопы водорода, углерода и азота (1 Н, 12 С и 14N) заменяют стабильными изотопами таких элементов (2 Н [дейтерий], 13 С и 15N соответственно). Мечение стабильными изотопами используют для двух основных целей: включение стабильных изотопов в белки, углеводы и нуклеиновые кислоты облегчает определение их структуры на атомном уровне; в метаболических исследованиях используют увеличенную массу соединений, меченных стабильными изотопами.- 20013995 Подразумевают, что термин "биологический материал" включает любой вид материала, который имеет биологическое происхождение. Более конкретно указанный термин относится к образцам тканей,плазме или жидкостям организма, а также к животным, в частности теплокровным животным, или частям организма животных, таким как органы. При использовании в анализах in vivo радиоактивно меченые соединения вводят в подходящей композиции животному, и место нахождения указанных радиоактивно меченых соединений выявляют с использованием методик визуализации, например, таких как однофотонная эмиссионная компьютерная томография (SPECT) или позитронно-эмиссионная томография(PET) и т.п. Таким образом, можно выявить распределение рецепторов в конкретных местах в организме и можно визуализировать органы, содержащие указанные места рецепторов с использованием методик визуализации, указанных выше. Указанный способ визуализации органа посредством введения радиоактивно меченого соединения формулы (I) и выявления излучений от такого радиоактивного соединения также составляет часть настоящего изобретения. В еще одном аспекте настоящее изобретение относится к применению соединений согласно изобретению в производстве лекарственного средства для лечения любого из указанных выше расстройств пролиферации клеток или симптомов. Количество соединения согласно настоящему изобретению, также называемого в данном описании активным ингредиентом, которое необходимо для достижения терапевтического эффекта, конечно, будет варьировать в зависимости от конкретного соединения, пути введения, возраста и состояния реципиента и конкретного расстройства или заболевания, подвергаемого лечению. Подходящая суточная доза может составлять от 0,01 до 300 мг/кг массы тела, предпочтительно от 10 до 100 мг/кг массы тела. Способ лечения также может включать введение активного ингредиента по схеме от одного до четырех приемов в сутки. Хотя активный ингредиент можно вводить отдельно, предпочтительно его вводят в виде фармацевтической композиции. Соответственно настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей соединение согласно настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должны быть "приемлемыми" в смысле совместимости с другими ингредиентами композиции и не опасными для реципиентов. Фармацевтические композиции согласно настоящему изобретению могут быть получены любыми способами, хорошо известными в области фармации, например с использованием способов, таких как способы, описанные в Gennaro et al. Remington's Pharmaceutical Sciences (18th ed., Mack PublishingCompany, 1990, особенно см. часть 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения в форме основания или в форме аддитивной соли в качестве активного ингредиента объединяют в виде однородной смеси с фармацевтически приемлемым носителем, который может иметь широкое множество форм, в зависимости от формы препарата, требуемого для введения. Указанные фармацевтические композиции имеют единичную дозированную форму, предпочтительно подходящую для системного введения, такого как пероральное, подкожное или парентеральное введение; или местного введения, такого как введение путем ингаляции, в виде назального спрея, глазных капель или в виде крема, геля, шампуня или т.п. Например, для получения композиций в пероральной дозированной форме можно использовать обычные фармацевтические среды, например, такие как вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты,связывающие вещества, дезинтегрирующие агенты и т.п., в случае порошков, пилюль, капсул и таблеток. Вследствие простоты введения таблетки и капсулы представляют собой наиболее предпочтительную пероральную единичную дозированную форму, и в данном случае обычно используют твердые фармацевтические носители. В случае парентеральных композиций носитель обычно будет содержать стерильную воду, по меньшей мере большую часть, хотя могут быть включены и другие ингредиенты, например,для обеспечения растворимости. Например, могут быть получены инъекционные растворы, в которых носитель содержит раствор соли, раствор глюкозы или смесь раствора соли и глюкозы. Также могут быть получены инъекционные суспензии, и в этом случае можно использовать подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, подходящих для подкожного введения, носитель необязательно содержит средство, усиливающее проникновение, и/или подходящий увлажнитель, необязательно вместе с подходящими добавками любой природы в минорных долях, при этом добавки не оказывают какого-либо значимого вредного влияния на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными для получения требуемых композиций. Указанные композиции могут быть введены различными путями, например в виде трансдермального пластыря, в виде точечных препаратов или в виде мази. Особенно предпочтительно приготовление указанных выше фармацевтических композиций в единичной дозированной форме для простоты введения и единообразия доз. Единичная дозированная форма в используемом в описании и формуле изобретения смысле относится к физически дискретным единицам, подходящим в качестве единичных доз, при этом каждая единица содержит предварительно определяемое количество активного ингредиента, рассчитанное так, чтобы получить требуемый терапевтиче- 21013995 ский эффект, вместе с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с насечкой или покрытые оболочкой таблетки), капсулы, пилюли, пакетики с порошками, облатки, инъекционные растворы или суспензии, чайная ложка препарата, столовая ложка препарата и т.п., и группы, состоящие из множества отдельных указанных форм. Экспериментальная часть В приведенном ниже описании используются следующие термины: ТГФ - тетрагидрофуран,DIPE - диизопропиловый эфир,ДМФА - N,N-диметилформамид,NaBH(OAc)3 - триацетоксиборгидрид натрия,EtOAc - этилацетат,EDCI - моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина,НОВТ - 1-гидрокси-1 Н-бензотриазол,CDI - 1,1'-карбонил-бис-1 Н-имидазол,DIPEA - N-этил-N-(1-метилэтил)-2-пропанамин,NaBH4 - тетрагидроборат натрия (-1),DMA - диметилацетамид,DIAD - бис-(1-метилэтиловый)эфир диазендикарбоновой кислоты,HBTU - 1-[бис-(диметиламино)метилен]-1 Н-бензотриазолийгексафторфосфат(1-)3-оксид,HATU - гексафторфосфат(1-) 1-[бис-(диметиламино)метилен]-1 Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксида,НОАТ - 3-гидрокси-3H-1,2,3-триазоло[4,5-b]пиридин. А. Получение промежуточных соединений. Пример А 1. а) Получение промежуточного соединения (1) Смесь этилового эфира N-[(4-хлор-2-нитрофенил)ацетил]глицина (0,023 моль) в ТГФ (250 мл) гидрировали, используя Pt/C (2,0 г) в качестве катализатора, в присутствии 4%-ного раствора тиофена вDIPE (1 мл). После поглощения Н 2 (3 экв.) катализатор отфильтровывали и фильтрат упаривали. Полученный остаток суспендировали в DIPE, затем суспензию перемешивали при температуре кипения, охлаждали и требуемый продукт собирали фильтрованием, получая 6,2 г (100%) промежуточного соединения (1).b) Получение промежуточного соединения (2) Смесь ацетатного эфира 4-хлор-7-метокси-6-хиназолинола (0,00050 моль) и промежуточного соединения (1) (0,00050 моль) в 2-пропаноле (5 мл) перемешивали в течение 16 ч в сосуде высокого давления при 80 С (температура масляной бани), затем реакционную смесь фильтровали и остаток на фильтре сушили на воздухе, получая 0,165 г (67,7%) промежуточного соединения (2). с) Получение промежуточного соединения (3) Смесь промежуточного соединения (2) (0,0244 моль) в NH3/CH3OH (7N) (50 мл) и СН 3 ОН (100 мл) перемешивали в течение ночи при комнатной температуре и затем растворитель выпаривали (Genevac) при пониженном давлении и при комнатной температуре. Наконец, полученный остаток сушили (в вакууме) в течение ночи при 60 С, получая 8,2 г (75%) промежуточного соединения (3).d) Получение промежуточного соединения (4) Смесь промежуточного соединения (3) (0,0138 моль) и Cs2CO3 (0,0690 моль) в ДМФА (120 мл) перемешивали в течение 30 мин при комнатной температуре, затем добавляли 1,2-дибромэтан (0,117 моль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали при пониженном давлении и остаток упаривали совместно с толуолом. Полученный остаток перемешивали в DIPE и требуемый продукт отфильтровывали, получая 6,93 г (91%) промежуточного соединения (4). е) Получение промежуточного соединения (5) Смесь промежуточного соединения (4) (0,00181 моль) и 4-морфолинэтанамина (0,00907 моль) в этаноле (20 мл) нагревали в микроволновой печи в течение 90 мин при 100 С и затем реакционную смесь очищали обращенно-фазовой высокоэффективной жидкостной хроматографией. Собирали содержащие продукт фракции и растворитель выпаривали, получая 0,39 г (36%) промежуточного соединения (5).f) Получение промежуточного соединения (6) Смесь промежуточного соединения (5) (0,00065 моль) и гидроксида лития (0,0032 моль) в этаноле(20 мл) и H2O (2 мл) перемешивали в течение 2 ч при комнатной температуре и затем растворитель выпаривали при пониженном давлении, получая промежуточное соединение (6) (количественный выход). Пример А 2. а) Получение промежуточного соединения (7) Смесь 4-хлор-5-фтор-2-нитробензальдегида (0,0491 моль), гидрохлорида метилового эфира Nметил-L-аланина (0,0589 моль) и 2-пропанолята титана (4+) (0,0737 моль) в 1,2-дихлорэтане (100 мл) перемешивали при комнатной температуре в течение 30 мин. Добавляли NaBH(OAc)3 (0,0589 моль). Смесь перемешивали в течение ночи, затем разбавляли в CH2Cl2, гасили водным раствором (10%) K2CO3 и фильтровали. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха, получая 16,5 г (количественный выход) промежуточного соединения (7) (в S-конфигурации).b) Получение промежуточного соединения (8) Смесь промежуточного соединения (7) (0,0491 моль), Fe (0,246 моль) и NH4Cl (0,491 моль) в ТГФ/CH3OH/H2O (4/4/2; 500 мл) перемешивали и кипятили с обратным холодильником в течение ночи,затем охлаждали до комнатной температуры и фильтровали. Фильтрат разбавляли в CH2Cl2. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха, получая 13 г- 23013995 с) Получение промежуточного соединения (9) Смесь ацетатного эфира 4-хлор-7-метокси-6-хиназолинола (0,0162 моль) и промежуточного соединения (8) (0,0162 моль) в CH3CN (150 мл) перемешивали и кипятили с обратным холодильником в течение 4 ч, затем снова охлаждали до комнатной температуры, растворитель выпаривали в вакууме и остаток собирали в K2CO3 (водный) (10%) и CH2Cl2. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (6,4 г) очищали хроматографией на колонке с силикагелем (элюент: CH2Cl2/CH3OH от 100/0 до 99/1; 15-40 мкм). Требуемые фракции собирали и растворитель выпаривали, получая 3,09 г (37%) промежуточного соединения (9) (в S-конфигурации).d) Получение промежуточного соединения (10) Смесь промежуточного соединения (9) (0,0061 моль) в NH3/CH3OH (7N) (20 мл) и СН 3 ОН (100 мл) перемешивали при комнатной температуре в течение 40 ч, затем упаривали досуха. Остаток собирали в(т.пл.: 234 С; S-конфигурация). е) Получение промежуточного соединения (11)Cs2CO3 (0,0063 моль) добавляли к раствору промежуточного соединения (10) (0,0042 моль) в безводном ДМФА (20 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли раствор (3-бромпропил)-1,1-диметилэтилового эфира карбаминовой кислоты (0,0046 моль) в безводном ДМФА (5 мл). Смесь перемешивали при комнатной температуре в течение 3 ч, вливали в H2O и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха, получая 2,8 г (количественный выход) промежуточного соединения (11) (в S-конфигурации).f) Получение промежуточного соединения (12) Смесь промежуточного соединения (11) (0,0042 моль) в HCl (водный раствор) (6N) (20 мл) и диоксане (100 мл) перемешивали при 60 С в течение 3 ч, затем охлаждали до комнатной температуры и упаривали досуха. Остаток собирали в смеси этанол/диэтиловый эфир. Осадок отфильтровывали в потоке N2 и сушили в вакууме, получая 2,24 г (100%) промежуточного соединения (12) в виде соли хлористоводородной кислоты (3,02 HCl, 1,88 H2O; S-конфигурация; т.пл.: 175 С).g) Получение промежуточного соединения (13)EDCI (0,0037 моль), НОВТ (0,0037 моль) и триэтиламина (0,008 моль) в CH2Cl2/ТГФ (50/50; 1000 мл) в течение 3-часового периода времени при энергичном перемешивании при 50 С. После выпаривания растворителя остаток собирали в K2CO3 (водный раствор) (10%). Смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (1 г) кристаллизовали из смеси этанол/DIPE. Осадок отфильтровывали и сушили. Полученную фракцию снова кристаллизовали из CH3CN. Осадок отфильтровывали и сушили, получая 0,21 г (24%) промежуточного соединения (13) (т.пл.: 270 С; S-конфигурация).h) Получение промежуточного соединения (14) Смесь промежуточного соединения (13) (0,0001 моль), сульфида натрия (0,001 моль) и хлорида лития (0,0011 моль) в ДМФА (1 мл) перемешивали при комнатной температуре в течение 5 мин, затем нагревали в микроволновой печи при 90 С в течение 15 мин, вливали в насыщенный раствор NaHCO3 и 3 раза экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным раствором NaCl,сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (1,3 г) очищали хроматографией на колонке с силикагелем (элюент: CH2Cl2/CH3OH от 100/0 до 90/10; 15-40 мкм). Требуемые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из CH3CN. Осадок отфильтровывали и сушили, получая 0,406 г (84%) промежуточного соединения (14) (т.пл.: 196 С; S-конфигурация).i) Получение промежуточного соединения (15) 1-Бром-3-хлорпропан (0,0012 моль) добавляли к суспензии промежуточного соединения (14)(0,0008 моль) и K2CO3 (водный раствор) (0,0016 моль) в CH3CN/ДМФА (8 мл). Смесь перемешивали и кипятили с обратным холодильником в течение 18 ч, затем охлаждали до комнатной температуры, вливали в H2O и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (0,85 г) очищали хроматографией на колонке с силикагелем (элюент: CH2Cl2/CH3OH от 100/0 до 97/3; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали,получая 0,24 г (58%) промежуточного соединения (15) (в S-конфигурации). Пример A3. а) Получение промежуточного соединения (16) Смесь промежуточного соединения (15) (0,0005 моль), 1,1-диметилэтилового эфира 1 пиперазинкарбоновой кислоты (0,001 моль) и K2CO3 (водный раствор) (0,0005 моль) в CH3CN (3 мл) перемешивали и кипятили с обратным холодильником в течение ночи. Снова добавляли 1,1 диметилэтиловый эфир 1-пиперазинкарбоновой кислоты (0,001 моль) и K2CO3 (водный раствор) (0,0005 моль). Смесь перемешивали и кипятили с обратным холодильником в течение 18 ч, охлаждали до комнатной температуры, вливали в H2O и экстрагировали CH2Cl2. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (0,487 г) очищали хроматографией на колонке с кромасилом (элюент: CH2Cl2/CH3OH/NH4OH от 99/1/0,05 до 90/10/0,5; 5 мкм). Очищенные фракции собирали и растворитель выпаривали, получая 0,165 г (46%) промежуточного соединения (16)b) Получение промежуточного соединения (17)HCl/2-пропанол (0,3 мл) добавляли к смеси промежуточного соединения (16) (0,0001 моль) в СН 3 ОН (3 мл). Смесь перемешивали при комнатной температуре в течение ночи, затем дополнительно перемешивали при комнатной температуре еще в течение 18 ч и упаривали досуха. Полученную соль хлористо-водородной кислоты собирали в K2CO3 (водный) (10%). Смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха, получая 0,095 г (100%) промежуточного соединения (17) (в S-конфигурации). Пример А 4. а) Получение промежуточного соединения (18) Смесь 4-бром-2-нитробензолуксусной кислоты (0,077 моль) и НОВТ (0,077 моль) в CH2Cl2 (550 мл) перемешивали при комнатной температуре. Добавляли CDI (0,077 моль) и перемешивание продолжали в течение 10 мин. Затем добавляли DIPEA (0,077 моль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Сразу же добавляли гидрохлорид метилового эфира L-лейцина(0,077 моль) и смесь перемешивали в течение ночи при комнатной температуре. Добавляли дополнительное количество НОВТ (0,077 моль), CDI (0,077 моль) и DIPEA (0,077 моль) и реакционную смесь перемешивали при комнатной температуре в течение выходных дней. Смесь гасили H2O и слои разделяли. Органический слой промывали насыщенным K2CO3 (водный) (1) и HCl (1N) (1), затем сушили(MgSO4), фильтровали и растворитель выпаривали. Красный камедеобразный продукт растирали в 2-пропаноле. Не совсем белое твердое вещество отфильтровывали и сушили, получая 7,87 г промежуточного соединения (18) (в S-конфигурации).b) Получение промежуточного соединения (19) Смесь промежуточного соединения (18) (0,056 моль) в толуоле (219 мл) перемешивали (смесь (1. Смесь NH4Cl (0,283 моль) в H2O (151 мл) добавляли к смеси (1) и на следующей стадии добавляли Fe(0,283 моль). Реакционную смесь кипятили с обратным холодильником в течение ночи. Затем добавляли другую порцию NH4Cl (0,283 моль) и Fe (0,283 моль) и реакционную смесь кипятили с обратным холодильником в течение 1 ч. Смесь охлаждали до комнатной температуры и затем фильтровали через дикалит. Слои разделяли и водный слой промывали толуолом. Объединенные органические слои сушили(в S-конфигурации). с) Получение промежуточного соединения (20) Раствор промежуточного соединения (19) (0,055 моль) в 2-пропаноле (200 мл) нагревали до 70 С(раствор (1. Раствор ацетатного эфира 4-хлор-7-метокси-6-хиназолинола (0,066 моль) в 2-пропаноле(200 мл) также нагревали до 70 С и полученный раствор добавляли к раствору (1). Перемешивание при 70 С продолжали в течение 75 мин. Добавляли дополнительное количество ацетатного эфира 4-хлор-7 метокси-6-хиназолинола (0,027 моль) в 2-пропаноле (100 мл) и смесь подвергали взаимодействию еще в течение 2 ч. Растворитель выпаривали и остаток очищали хроматографией на колонке с силикагелем(элюент: CH2Cl2/CH3OH от 99,5/0,5 до 90/10). Содержащие продукт фракции собирали и растворитель выпаривали, получая 13,82 г промежуточного соединения (20) (в S-конфигурации).d) Получение промежуточного соединения (21) Смесь промежуточного соединения (20) (0,081 моль) в CH3OH (400 мл) перемешивали при комнатной температуре. Добавляли NH3/CH3OH (7N) (200 мл) и реакционную смесь перемешивали при комнатной температуре в течение 95 мин. Растворитель выпаривали и остаток растирали в 2-пропаноле. Бледножелтое твердое вещество отфильтровывали и сушили, получая 43 г (99,9%) промежуточного соединения(21) (в S-конфигурации). е) Получение промежуточного соединения (22) Смесь промежуточного соединения (21) (0,0113 моль) перемешивали в ДМФА (300 мл). ДобавлялиK2CO3 (водный) (0,056 моль) и реакционную смесь перемешивали при комнатной температуре в течение 35 мин. Затем добавляли 1,3-дибромпропан (0,113 моль) и реакционную смесь перемешивали в течение 40 ч при комнатной температуре. Реакционную смесь фильтровали и концентрировали при пониженном давлении до 20 мл. Концентрат вливали в H2O и осадок отфильтровывали и сушили, получая 7,16 гf) Получение промежуточного соединения (23) Смесь промежуточного соединения (22) (0,003832 моль) и 4-морфолинпропанамина (0,0383 моль) в этаноле (40 мл) нагревали до 100 С в течение 1 ч и затем очищали высокоэффективной жидкостной хроматографией. Органический растворитель выпаривали и водный слой концентрировали до 20 мл. Концентрат делали щелочным, используя водный раствор NaOH (1N) до рН 10 и экстрагировали EtOAc. Отделенный органический слой сушили (MgSO4), фильтровали и смесь концентрировали, получая 9,14 г промежуточного соединения (23) (в S-конфигурации).g) Получение промежуточного соединения (24) Смесь промежуточного соединения (23) (0,007909 моль) в СН 3 ОН (40 мл) и H2O (4 мл) перемешивали при комнатной температуре до растворения. Добавляли гидроксид лития (0,0395 моль) и реакционную смесь перемешивали в течение 85 мин. Реакционную смесь концентрировали и остаток сушили, получая 5,53 г (99,6%) промежуточного соединения (24) (в S-конфигурации).h) Получение промежуточного соединения (25)- 27013995 Смесь HATU (0,002052 моль) и НОАТ (0,00008551 моль) в DMA (50 мл) по каплям добавляли к смеси промежуточного соединения (24) (0,0007126 моль) и DIPEA (0,002138 моль) в DMA (50 мл). Реакционную смесь перемешивали в течение ночи. Добавляли H2O и смесь концентрировали до 10 мл. К смеси добавляли EtOAc до получения раствора. Добавляли H2O и два слоя разделяли. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Полученный остаток очищали высокоэффективной жидкостной хроматографией (NH4HCO3-буфер). Содержащие продукт фракции собирали, растворитель выпаривали и остаток сушили, получая промежуточное соединение (25) (S-конфигурация; количественный выход).i) Получение промежуточного соединения (26) Смесь промежуточного соединения (25) (0,0007314 моль) в пирролидине (10 мл) перемешивали,добавляли дихлор-бис-(трифенилфосфин)палладий (0,00003657 моль) и йодид меди (каталитическое количество) и реакционную смесь нагревали до 75 С. Добавляли этинилтриметилсилан (0,001828 моль) и нагревание продолжали в течение 30 мин. Затем добавляли дополнительную порцию дихлор-бис(трифенилфосфин)палладия (0,00003657 моль) и этинилтриметилсилана (0,001828 моль) и смесь подвергали взаимодействию в течение 270 мин. Реакционную смесь фильтровали через целит и промывали СН 3 ОН. Растворитель выпаривали и остаток перерастворяли в EtOAc и 2 раза промывали H2O. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Неочищенный остаток перерастворяли в CH3CN и добавляли МР-ТМТ-смолу (0,0003657 моль), чтобы очистить от остаточного Pd. Полученную смесь перемешивали в течение 36 ч при комнатной температуре и затем фильтровали. Смолу промывали СН 3 ОН и фильтрат упаривали, получая 0,48 г промежуточного соединения (26)(в S-конфигурации). Пример А 5. а) Получение промежуточного соединения (27) 4-Хлор-1-(хлорметил)-2-нитробензол (0,81 моль) и диэтиловый эфир пропандионовой кислоты(0,794 моль) суспендировали в гексане (300 мл). Добавляли K2CO3 (водный) (0,81 моль). Затем добавляли 18-краун-6 (0,008 моль). Полученную реакционную смесь перемешивали и кипятили с обратным холодильником в течение 30 ч в атмосфере N2. Реакционную смесь охлаждали до 20 С. Полученную смесь экстрагировали водой (750 мл). Слои разделяли. Водную фазу промывали толуолом. Объединенные органические слои сушили (Na2SO4), фильтровали и растворитель выпаривали, получая 255,8 г промежуточного соединения (27).b) Получение промежуточного соединения (28) Промежуточное соединение (27) (255,8 г, 0,466 моль) растворяли в уксусной кислоте (1000 мл). Добавляли 20%-ный водный раствор HCl (1000 мл) и полученную в результате реакционную смесь перемешивали и кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до 20 С и растворитель выпаривали. Остаток суспендировали в воде (500 мл) и обрабатывали 10%-ным водным раствором NaOH (500 мл). Полученную смесь перемешивали в течение 1 ч. Указанную смесь экстрагировали диэтиловым эфиром (3500 мл) и затем подкисляли концентрированной HCl, получая осадок из охлажденного водного слоя. Осадок отфильтровывали и сушили, получая 109 г промежуточного соединения (28) (т.пл.: 109-111 С). с) Получение промежуточного соединения (29)- 28013995 Смесь промежуточного соединения (28) (0,015 моль) и НОВТ (0,015 моль) в CH2Cl2 (10 мл) перемешивали в течение 30 мин при комнатной температуре. Добавляли CDI (0,015 моль) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Полученный в результате раствор добавляли к смеси гидрохлорида метилового эфира -аминоциклогексанпропионовой кислоты(0,01875 моль) и диизопропилметиламина/смолы (10,05 моль) в CH2Cl2 (70 мл) и реакционную смесь встряхивали в течение ночи при комнатной температуре. Добавляли избыток смолы для очистки (смола с группами бикарбоната(полистирилметил)триметиламмония и сульфоновой кислоты MP (70-90 меш) и смесь встряхивали в течение 18 ч. Смесь фильтровали. Фильтрат концентрировали при комнатной температуре, получая промежуточное соединение (29) (S-конфигурация; количественный выход).d) Получение промежуточного соединения (30) Смесь промежуточного соединения (29) (0,001 моль) в 2-пропаноле (20 мл) гидрировали, используя 5% Pt/C (каталитическое количество) в качестве катализатора, в присутствии оксида ванадия (q.s.) и 4%ного раствора тиофена в DIPE (q.s.). После поглощения Н 2 (3 экв.) катализатор отфильтровывали и фильтрат упаривали, получая промежуточное соединение (30) (S-конфигурация; количественный выход). е) Получение промежуточного соединения (31) Смесь ацетатного эфира 4-хлор-7-метокси-6-хиназолинола (0,001 моль) и промежуточного соединения (30) (1 экв.; 0,001 моль) в 2-пропаноле (25 мл) перемешивали в течение 6 ч при 80 С. Реакционную смесь охлаждали до комнатной температуры и использовали как таковую на следующей стадии реакции,получая промежуточное соединение (31) (S-конфигурация; количественный выход).f) Получение промежуточного соединения (32) Смесь промежуточного соединения (31) (0,0010 моль) в 2-пропаноле (25 мл) и NH3/CH3OH (5 мл) перемешивали в течение 18 ч при комнатной температуре. Растворитель выпаривали при пониженном давлении. Остаток очищали высокоэффективной жидкостной хроматографией. Содержащие продукт фракции собирали и растворитель выпаривали, получая промежуточное соединение (32)g) Получение промежуточного соединения (33) Смесь промежуточного соединения (32) (неочищенного) и Cs2CO3 (5 экв.) в ДМФА (5 мл) перемешивали в течение 30 мин при комнатной температуре. Добавляли (3-бромпропил)-1,1-диметилэтиловый эфир карбаминовой кислоты (1,1 экв.) и реакционную смесь перемешивали в течение 18 ч при комнатной
МПК / Метки
МПК: A61P 35/00, C07D 273/00, C07D 498/08, A61K 31/529, C07D 239/00
Метки: хиназолина, качестве, производные
Код ссылки
<a href="https://eas.patents.su/30-13995-proizvodnye-hinazolina-v-kachestve-mtki.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хиназолина в качестве mtki</a>
Предыдущий патент: Белково-витаминно-минеральная добавка для свиней и способ откорма свиней
Следующий патент: Способ алкоксиалкилирования ненасыщенного или замещённого ароматического субстрата
Случайный патент: Составная потребительская тара