Производные хиназолина, содержащие эти соединения лекарственные средства, их применение и способ их получения
Номер патента: 6317
Опубликовано: 27.10.2005
Авторы: Химмельсбах Франк, Юнг Биргит, Блех Штефан, Баум Эльке, Лангкопф Эльке, Золка Флавио
Формула / Реферат
1. Производные хиназолина общей формулы
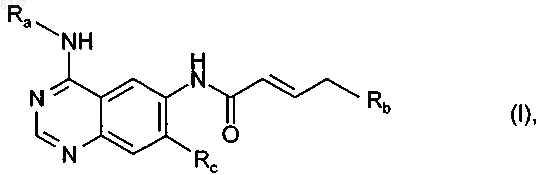
в которой Ra обозначает бензильную, 1-фенилэтильную или 3-хлор-4-фторфенильную группу,
Rb обозначает диметиламино-, N-метил-N-этиламино-, диэтиламино-, N-метил-N-изопропиламино-, N-метил-N-циклопропиламино-, N-метил-N-(2-метоксиэтил)амино-, N-этил-N-(2-метоксиэтил)амино-, бис(2-метоксиэтил)амино-, морфолино-, N-метил-N-(тетрагидрофуран-3-ил)амино-, N-метил-N-(тетрагидрофуран-2-илметил)амино-, N-метил-N-(тетрагидрофуран-3-илметил)амино-, N-метил-N-(тетрагидропиран-4-ил)амино- или N-метил-N-(тетрагидропиран-4-илметил)аминогруппу и
Rc обозначает циклопропилметокси-, циклобутилокси-, циклопентилокси-, тетрагидрофуран-3-илокси-, тетрагидрофуран-2-илметокси-, тетрагидрофуран-3-илметокси-, тетрагидропиран-4-илокси- или тетрагидропиран-4-илметоксигруппу,
за исключением следующих соединений:
(1) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(2) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(3) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(4) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(5) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(6) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(7) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(8) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(9) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(10) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(11) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(12) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(13) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(14) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[бис(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(15) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-этил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(16) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидропиран-4-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(17) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидрофуран-2-ил)метокси]хиназолина,
(18) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(S)-(тетрагидрофуран-3-ил)окси]хиназолина,
(19) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидропиран-4-ил)окси]хиназолина,
(20) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидрофуран-2-илметил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина и
(21) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
их таутомеры, их стереоизомеры и их соли.
2. Соединения общей формулы I по п.1, в которых Ra, Rb и Rc имеют указанные в п.1 значения, но за исключением следующих соединений:
(1) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(2) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(3) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(4) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(5) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(6) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(7) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(8) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(9) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(10) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(11) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(12) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(13) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(14) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[бис(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(15) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-этил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(16) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидропиран-4-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(17) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидрофуран-2-ил)метокси]хиназолина,
(18) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(S)-(тетрагидрофуран-3-ил)окси]хиназолина,
(19) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидропиран-4-ил)окси]хиназолина,
(20) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидрофуран-2-илметил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(21) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(22) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-(2-метоксиэтил)-N-метиламино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(23) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[бис(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(24) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(25) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(S)-N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(26) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(R)-N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(27) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидропиран-4-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(28) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(R)-N-метил-N-(тетрагидрофуран-2-илметил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(29) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(S)-N-метил-N-(тетрагидрофуран-2-илметил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(30) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-(тетрагидрофуран-3-илокси)хиназолина,
(31) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-(тетрагидропиран-4-илокси)хиназолина,
(32) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-(тетрагидрофуран-2-илметокси)хиназолина и
(33) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N-циклопропил-N-метиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
их таутомеры, их стереоизомеры и их соли.
3. Соединения общей формулы I по п.1, в которых Ra обозначает 1-фенилэтильную или 3-хлор-4-фторфенильную группу, Rb обозначает диметиламино-, N-метил-N-этиламино-, диэтиламино-, N-метил-N-изопропиламино-, N-метил-N-циклопропиламино-, N-метил-N-(2-метоксиэтил)амино-, N-этил-N-(2-метоксиэтил)амино-, бис(2-метоксиэтил)амино-, морфолино-, N-метил-N-(тетрагидрофуран-3-ил)амино-, N-метил-N-(тетрагидрофуран-2-илметил)амино-, N-метил-N-(тетрагидрофуран-3-илметил)амино-, N-метил-N-(тетрагидропиран-4-ил)амино- или N-метил-N-(тетрагидропиран-4-илметил)аминогруппу и Rc обозначает циклопропилметокси-, циклобутилокси-, циклопентилокси-, тетрагидрофуран-3-илокси-, тетрагидрофуран-2-илметокси-, тетрагидрофуран-3-илметокси-, тетрагидропиран-4-илокси- или тетрагидропиран-4-илметоксигруппу, за исключением следующих соединений:
(1) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(2) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(3) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(4) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(5) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(6) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(7) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(8) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(9) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(10) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(11) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолина,
(12) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолина,
(13) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(14) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[бис(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(15) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-этил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(16) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидропиран-4-ил)амино]-1-оксо-2-бутен-1-ил }амино)-7-циклопропилметоксихиназолина,
(17) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидрофуран-2-ил)метокси]хиназолина,
(18) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(S)-(тетрагидрофуран-3-ил)окси]хиназолина,
(19) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидропиран-4-ил)окси]хиназолина,
(20) 4-[(3-хлор-4-фторфенил)амино]-6-({4-N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(21) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-(2-метоксиэтил)-N-метиламино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(22) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[бис(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(23) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(24) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(S)-N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(25) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(R)-N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(26) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидропиран-4-ил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
(27) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-(тетрагидрофуран-3-илокси)хиназолина,
(28) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-(тетрагидропиран-4-илокси)хиназолина,
(29) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-(тетрагидрофуран-2-илметокси)хиназолина,
(30) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N-циклопропил-N-метиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолина,
(31) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N-метил-N-(тетрагидрофуран-2-илметил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолина,
(32) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(R)-N-метил-N-(тетрагидрофуран-2-илметил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина и
(33) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[(S)-N-метил-N-(тетрагидрофуран-2-илметил)амино]-1-оксо-2-бутен-1-ил}амино)-7-циклобутилоксихиназолина,
их таутомеры, их стереоизомеры и их соли.
4. Соединения общей формулы I по п.1 из группы, включающей
(а) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклобутилоксихиназолин,
(б) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолин,
(в) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(N,N-бис(2-метоксиэтил)амино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолин,
(г) 4-[(R)-(1-фенилэтил)амино]-6-({4-[N-(2-метоксиэтил)-N-этиламино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолин,
(д) 4-[(R)-(1-фенилэтил)амино]-6-({4-[N-(2-метоксиэтил)-N-метиламино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолин,
(е) 4-[(R)-(1-фенилэтил)амино]-6-({4-[N-(тетрагидропиран-4-ил)-N-метиламино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолин,
(ж) 4-[(R)-(1-фенилэтил)амино]-6-({4-[N-(тетрагидрофуран-3-ил)-N-метиламино]-1-оксо-2-бутен-1-ил}амино)-7-циклопропилметоксихиназолин ,
(з) 4-[(3-хлор-4-фторфенил)амино]-6-[(4-{N-[(тетрагидрофуран-3-ил)метил]-N-метиламино}-1-оксо-2-бутен-1-ил)амино]-7-циклопропилметоксихиназолин,
(и) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((R)-тетрагидрофуран-3-илокси)хиназолин,
(к) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолин,
(л) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-(тетрагидропиран-4-илокси)хиназолин,
(м) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидрофуран-2-ил)метокси]хиназолин,
(н) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидрофуран-3-ил)метокси]хиназолин,
(о) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диэтиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидрофуран-3-ил)метокси]хиназолин,
(п) 4-[(R)-(1-фенилэтил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопропилметоксихиназолин,
(р) 4-[(3-хлор-4-фторфенил)амино]-6-({4-[N,N-бис(2-метоксиэтил)амино]-1-оксо-2-бутен-1-ил}амино)-7-[(тетрагидрофуран-2-ил)метокси]хиназолин,
(с) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино}-7-[(тетрагидрофуран-2-ил)метокси]хиназолин,
(т) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N-циклопропил-N-метиламино)-1-оксо-2-бутен-1-ил]амино}-7-циклопентилоксихиназолин и
(у) 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-[(S)-(тетрагидрофуран-2-ил)метокси]хиназолин,
их таутомеры, их стереоизомеры и их соли.
5. Физиологически приемлемые сюыш соединений по любому из пп.1-4 с неорганическими или органическими кислотами или основаниями.
6. Лекарственное средство, содержащее соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5, необязательно в сочетании с одним или несколькими инертными носителями и/или разбавителями.
7. Применение соединения по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения доброкачественных или злокачественных опухолей, для профилактики и лечения заболеваний дыхательных путей и легких, а также для лечения заболеваний желудочно-кишечного тракта и желчных протоков и желчного пузыря.
8. Способ получения лекарственного средства по п.6, отличающийся тем, что соединение по любому из пп.1-5 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями.
9. Способ получения соединений общей формулы I по любому из пп.1-5, отличающийся тем, что соединение общей формулы

в которой Ra и Rc имеют указанные в пп.1-5 значения, подвергают взаимодействию с соединением общей формулы
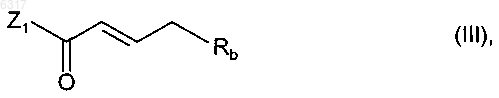
в которой Rb имеет указанные в пп.1-5 значения, а Z1 обозначает уходящую группу или гидроксигруппу, и затем при необходимости вновь отщепляют защитную группу, использовавшуюся при проведении указанных выше реакций, и полученное таким путем соединение общей формулы I при необходимости разделяют на его стереоизомеры и/или полученное таким путем соединение общей формулы I переводят в одну из его солей, прежде всего для фармацевтического применения в одну из его физиологически приемлемых солей.
10. Способ получения соединений общей формулы I по любому из пп.1-5, отличающийся тем, что соединение общей формулы
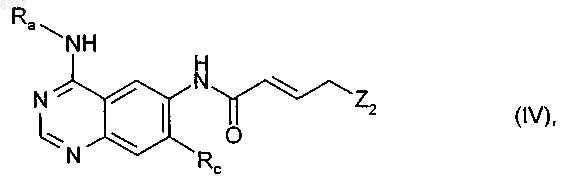
в которой Ra и Rc имеют указанные в пп.1-5 значения, а Z2 обозначает уходящую группу, подвергают взаимодействию с соединением общей формулы
H-Rb (V),
в которой Rb имеет указанные в пп.1-5 значения,
и затем при необходимости вновь отщепляют защитную группу, использовавшуюся при проведении указанных выше реакций, и/или полученное таким путем соединение общей формулы I при необходимости разделяют на его стереоизомеры и/или полученное таким путем соединение общей формулы I переводят в одну из его солей, прежде всего для фармацевтического применения в одну из его физиологически приемлемых солей.
Текст
006317 Настоящее изобретение относится к производным хиназолина общей формулы их таутомерам, их стереоизомерам и их солям, прежде всего их физиологически приемлемым солям с неорганическими или органическими кислотами, обладающим ценными фармакологическими свойствами, прежде всего ингибирующим действием на опосредуемую тирозинкиназами трансдукцию сигнала,а также относится к их применению для лечения определенных заболеваний, прежде всего опухолевых или онкологических заболеваний и заболеваний легких и дыхательных путей, и к способу их получения. В приведенной выше общей формуле I(21) 4-[(3-хлор-4-фторфенил)амино]-6-(4-[N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2 бутен-1-ил амино)-7-циклопропилметоксихиназолина. Предпочтительными соединениями приведенной выше общей формулы I являются таковые, в которых Ra, Rb и Rc имеют указанные выше значения, но за исключением следующих соединений:(33) 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N-циклопропил-N-метиламино)-1-оксо-2-бутен-1-ил] амино-7-циклопропилметоксихиназолина,их таутомеры, их стереоизомеры и их соли. Особенно предпочтительными соединениями общей формулы I являются таковые, в которых(33) 4-[(3-хлор-4-фторфенил)амино]-6-(4-[(S)-N-метил-N-(тетрагидрофуран-2-илметил)амино]-1 оксо-2-бутен-1-иламино)-7-циклобутилоксихиназолина,их таутомеры, их стереоизомеры и их соли. В качестве примера наиболее предпочтительных соединений общей формулы I можно назвать следующие конкретные соединения:(у) 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-[(S)(тетрагидрофуран-2-ил)метокси]хиназолин,их таутомеры, их стереоизомеры и их соли. Соединения общей формулы I можно получать, например, описанным ниже способом. а) В этом варианте соединение общей формулы в которой Ra и Rc имеют указанные выше значения, подвергают взаимодействию с соединением общей формулы в которой Rb имеет указанные выше значения, a Z1 обозначает уходящую группу, такую как атом галогена, например атом хлора или брома, или гидроксигруппу. Эту реакцию при необходимости проводят в растворителе или смеси растворителей, например в метиленхлориде, диметилформамиде, бензоле, толуоле, хлорбензоле, тетрагидрофуране, бензоле/тетрагидрофуране или диоксане, необязательно в присутствии неорганического или органического основания и необязательно в присутствии обезвоживающего средства, преимущественно при температуре от -50 до 150 С, предпочтительно при температуре от -20 до 80 С. Взаимодействие с соединением общей формулы III, в которой Z1 представляет собой уходящую группу, при необходимости проводят в растворителе или смеси растворителей, например в метиленхлориде, диметилформамиде, бензоле, толуоле, хлорбензоле, тетрагидрофуране, бензоле/тетрагидрофуране или диоксане, преимущественно в присутствии третичного органического основания, такого как триэтиламин, пиридин или 4-диметиламинопиридин, в присутствии N-этилдиизопропиламина (основания Хюнига), причем такие органические основания одновременно могут также служить растворителями, либо в присутствии неорганического основания, такого как карбонат натрия, карбонат калия или раствор едкого натра, преимущественно при температуре от -50 до 150 С, предпочтительно при температуре от -20 до 80 С. Взаимодействие с соединением общей формулы III, в которой Z1 представляет собой гидроксигруппу, предпочтительно проводят в присутствии обезвоживающего средства, например в присутствии изобутилового эфира хлормуравьиной кислоты, тионилхлорида, триметилхлорсилана, трихлорида фосфора,пентаоксида фосфора, гексаметилдисилазана, N,N'-дициклогексилкарбодиимида, N,N'-дициклогексилкарбодиимида/N-гидроксисукцинимида, 1-гидроксибензотриазола, N,N'-карбонилдиимидазола или трифенилфосфина/четыреххлористого углерода, преимущественно в растворителе, таком как метиленхлорид, тетрагидрофуран, диоксан, толуол, хлорбензол, диметилформамид, диметилсульфоксид, диэтиловый эфир этиленгликоля или сульфолан, и необязательно в присутствии ускорителя реакции, такого как 4-диметиламинопиридин, при температуре от -50 до 150 С, предпочтительно, однако, при температуре от -20 до 80 С. б) В этом варианте соединение общей формулы в которой Ra и Rc имеют указанные выше значения, a Z2 обозначает уходящую группу, такую как атом галогена, например атом хлора или брома, замещенную гидрокси- или сульфонилоксигруппу, метансульфонилокси- или n-толуолсульфонилоксигруппу, подвергают взаимодействию с соединением общей формулы(V),в которой Rb имеет указанные выше значения. Эту реакцию целесообразно проводить в растворителе, таком как изопропанол, бутанол, тетрагидрофуран, диоксан, толуол, хлорбензол, диметилформамид, диметилсульфоксид, метиленхлорид, монометиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля или сульфолан либо их смеси, необязательно в присутствии неорганического или третичного органического основания, например карбоната-5 006317 натрия или гидроксида калия, третичного органического основания, например триэтиламина или Nэтилдиизопропиламина (основания Хюнига), причем такие органические основания одновременно могут также служить растворителями, и необязательно в присутствии ускорителя реакции, такого как галогенид щелочного металла, при температуре от -20 до 150 С, предпочтительно, однако, при температуре от-10 до 100 С. Однако эту реакцию можно проводить и в отсутствие растворителя либо в избытке используемого соединения общей формулы V. В описанных выше реакциях присоединенную к хиназолину общей формулы II или IV вторичную аминогруппу можно защищать на время проведения реакции обычными защитными группами, которые вновь отщепляют по завершении реакции. В качестве примера подобных защитных групп можно назвать формильную, ацетильную, трифторацетильную, этоксикарбонильную, трет-бутоксикарбонильную, бензилоксикарбонильную, бензильную, метоксибензильную или 2,4-диметоксибензильную группу. Необходимое при определенных условиях последующее отщепление используемой защитной группы осуществляют, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде, уксусной кислоте/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты,такой как трифторуксусная кислота, соляная кислота или серная кислота, или в присутствии щелочи,такой как гидроксид натрия или гидроксид калия, либо апротонным путем, например в присутствии йодтриметилсилана, при температуре от 0 до 120 С, предпочтительно при температуре от 10 до 100 С. Однако отщепление бензильной, метоксибензильной или бензилоксикарбонильной группы осуществляют, например, путем гидрогенолиза, в частности с использованием водорода в присутствии катализатора, такого как палладий на угле, в растворителе, таком как метанол, этанол, этиловый эфир уксусной кислоты или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота, при температуре от 0 до 100 С, но предпочтительно при комнатной температуре от 20 до 60 С, и при давлении водорода от 1 до 7 бар, более предпочтительно от 3 до 5 бар. 2,4-Диметоксибензильную группу предпочтительно, однако, отщеплять в трифторуксусной кислоте в присутствии анизола. трет-Бутильную или трет-бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, или обработкой йодтриметилсиланом, необязательно с использованием растворителя, такого как метиленхлорид, диоксан, метанол или диэтиловый эфир. Трифторацетильную группу предпочтительно отщеплять обработкой кислотой, такой как соляная кислота, необязательно в присутствии растворителя, такого как уксусная кислота, при температуре от 50 до 120 С или обработкой едким натром, необязательно в присутствии растворителя, такого как тетрагидрофуран, при температуре от 0 до 50 С. Помимо этого полученные соединения общей формулы I можно, как уже упоминалось выше, разделять на их энантиомеры и/или диастереомеры. Так, например, смеси цис-/транс-изомеров можно разделять на отдельные цис- и транс-изомеры, а соединения по меньшей мере с одним оптически активным атомом углерода - на их энантиомеры. Так, например, полученные смеси цис-/транс-изомеров можно разделять хроматографией на отдельные цис- и транс-изомеры, полученные соединения общей формулы I, которые образуются в виде рацематов, можно разделять по известным методам (см. Allinger N.L. и Eliel E.L., "Topics in Stereochemistry", т. 6, изд-во Wiley Interscience, 1971) на их оптические антиподы, а соединения общей формулы I по меньшей мере с 2 асимметрическими атомами углерода можно разделять на основе различий их физикохимических свойств по известным методам, например хроматографией и/или фракционированной кристаллизацией, на их диастереомеры, которые при их образовании в рацемической форме в последующем можно разделять, как это описано выше, на энантиомеры. Разделение на энантиомеры предпочтительно осуществлять путем колоночного разделения на хиральных фазах либо путем перекристаллизации из оптически активного растворителя или взаимодействием с образующим с рацемическим соединением соли или производные, такие как сложные эфиры или амиды, оптически активным веществом, прежде всего с кислотами и их активированными производными или спиртами, и разделением полученной в результате смеси диастереомерных солей или производных,например, на основе различий в их растворимости, при этом из чистых диастереомерных солей или производных можно высвобождать свободные антиподы воздействием пригодных для этой цели средств. В качестве примера наиболее часто используемых в вышеуказанных целях оптически активных кислот можно назвать D- и L-формы винной либо дибензоилвинной кислоты, ди-о-толилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. Примером оптически активного спирта служит (+)- или (-)-ментол, а в качестве примера оптически активного ацильного фрагмента в амидах можно назвать (+)- или (-)ментилоксикарбонил. Помимо этого полученные соединения формулы I можно переводить в их соли, прежде всего в их пригодные для фармацевтического применения физиологически приемлемые соли, с неорганическими или органическими кислотами. В качестве примера пригодных для этой цели кислот можно назвать соляную кислоту, бромисто-водородную кислоту, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, лимонную кислоту, винную-6 006317 кислоту или малеиновую кислоту. Используемые в качестве исходных веществ соединения общих формул II-V отчасти известны из литературы либо их получают по известным из литературы методам. Так, например, исходное соединение общей формулы II получают взаимодействием соответствующим образом замещенного в положении 47-фтор-6-нитросоединения с соответствующим алкоголятом с последующим восстановлением полученного таким путем нитросоединения, или исходное соединение общей формулы III получают, например, взаимодействием приемлемого производного бромкротоновой кислоты с одним из известных из литературы аминов общей формулы V, или исходное соединение общей формулы IV получают ацилированием соединения общей формулы II пригодным для этой цели производным кротоновой кислоты. Предлагаемые в изобретении соединения общей формулы I и их физиологически совместимые соли обладают, как уже указывалось выше, ценными фармакологическими свойствами, прежде всего ингибирующим действием на опосредуемую рецептором эпидермального фактора роста (EGF-R) трансдукцию сигнала, которая может быть вызвана, например, ингибированием связывания лигандов, димеризации рецепторов или самой тирозинкиназы. Помимо этого существует также возможность блокировать передачу сигналов компонентами, расположенными на более глубоком уровне. Биологические свойства новых соединений исследовали по описанной ниже методике. Ингибирование человеческой EGF-рецепторной киназы определяли с помощью цитоплазматического домена тирозинкиназы (фрагмент от метионина в положении 664 до аланина в положении 1186 на основе последовательности, опубликованной в Nature 309 (1984), с. 418). С этой целью белок в виде слитого с GST (глутатион-S-трансфераза) белка экспрессировали в Sf9-клетках насекомых с использованием бакуловирусной системы экспрессии. Ферментативную активность определяли в присутствии или в отсутствии тестируемых соединений методом серийных разведений. В качестве субстрата использовали полимер pEY (4:1) фирмы SIGMA. В качестве меченого (индикаторного) субстрата добавляли биотинилированный полимер pEY (био-pEY). В каждых 100 мкл реакционного раствора содержалось 10 мкл ингибитора в 50%-ном ДМСО, 20 мкл раствора субстрата (200-миллимолярная HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) с рН 7,4, 50-миллимолярный ацетат магния, 2,5 мг/мл полимера pEY, 5 мкг/мл био-pEY) и 20 мкл ферментативного препарата. Ферментативную реакцию инициировали добавлением 50 мкл 100 микромолярного раствора АТФ в 10-миллимолярном хлориде магния. Параметры процесса разведения ферментативного препарата подбирали с таким расчетом, чтобы встраивание фосфата в био-pEY происходило в линейной зависимости от времени и расхода фермента. Ферментативный препарат разводили в 20-миллимолярной HEPES с рН 7,4, 1-миллимолярной ЭДТК, 130-миллимолярном растворе поваренной соли, 0,05%-ном тритоне Х-100, 1-миллимолярно дитиотреитоле (ДТТ) и 10%-ном глицерине. Опыты с ферментами проводили при комнатной температуре в течение 30 мин, прекращая реакцию добавлением 50 мкл стоп-раствора (250-миллимолярная ЭДТК в 20-миллимолярной HEPES с рН 7,4). Образец объемом 100 мкл переносили на покрытый стрептавидином титрационный микропланшет и инкубировали в течение 60 мин при комнатной температуре. После этого планшет промывали 200 мкл промывочного раствора (50-миллимолярный трис, 0,05%-ный твин 20). После добавления 100 мкл меченного пероксидазой хрена (HRPO) антитела к pPY (PY20H Anti-PTyr:HRP фирмы Transduction Laboratories, 250 нг/мл) инкубировали в течение 60 мин. После этого титрационный микропланшет трижды промывали промывочным раствором порциями по 200 мкл. Затем образцы смешивали с 100 мкл содержащего ТМБ (3,3',5,5'-тетраметилбензидин) и пероксидазу раствора (А:В = 1:1, фирма Kirkegaard PerryLaboratories). Через 10 мин реакцию прекращали. Оптическую плотность ОП 450HM измеряли с помощьюELISA-ридера. Все значения для построения соответствующих графиков определяли в трех повторностях. Данные согласуют путем итерационного исчисления с использованием программы анализа сигмоидальных кривых (программа Graph Pad Prism, версия 3.0) с переменным наклоном холма. Коэффициент корреляции у всех разрешенных данных, полученных итерацией, превышал 0,9, а верхние и нижние значения кривых проявляли расхождение с коэффициентом, равным по меньшей мере 5. На основе этих кривых определяли ту концентрацию действующего вещества, при которой активность EGFрецепторной киназы ингибируется на 50% (IС 50). При этом были получены следующие результаты: Из приведенных выше результатов следует, что предлагаемые в изобретении соединения общей формулы I ингибируют опосредуемую тирозинкиназами трансдукцию сигналов, как это проиллюстрировано на примере человеческого EGF-рецептора, и поэтому пригодны для лечения патофизиологических процессов, обусловленных гиперфункцией тирозинкиназ. В качестве примера подобных процессов можно назвать образование добро- и злокачественных опухолей, прежде всего опухолей эпителиального и нейроэпителиального происхождения, метастазирование, а также аномальную пролиферацию сосудистых эндотелиальных клеток (неоангиогенез). Предлагаемые в изобретении соединения пригодны также для профилактики и лечения заболеваний дыхательных путей и легких, связанных с избыточным или измененным слизеобразованием, обусловленным стимуляцией тирозинкиназ, например при воспалительных заболеваниях дыхательных путей,таких как хронический бронхит, хронический обструктивный бронхит, астма, бронхиэктазия, аллергический или неаллергический ринит или синусит, кистозном фиброзе, дефиците 1-антитрипсина или при кашле, эмфиземе легких, фиброзе легких и повышенной реактивности дыхательных путей. Соединения по изобретению пригодны далее для лечения заболеваний желудочно-кишечного тракта, а также желчных протоков и желчного пузыря, связанных с нарушением активности тирозинкиназ,как это имеет место, например, при хронических воспалительных изменениях, таких как холецистит,болезнь Крона, язвенный колит и язвы в желудочно-кишечном тракте, или как это имеет место при заболеваниях желудочно-кишечного тракта, связанных с гиперсекрецией, таких как болезнь Менетрие, аденома секреторных желез и синдром потери белка. Соединения общей формулы I и их физиологически совместимые соли могут применяться, кроме того, для лечения иных заболеваний, обусловленных аберрантной функцией тирозинкиназ, таких, например, как эпидермальная гиперпролиферация (псориаз), воспалительные процессы, заболевания иммунной системы, гиперпролиферация кроветворных клеток и т.д. Предлагаемые в изобретении соединения благодаря их биологическим свойствам могут применяться индивидуально или в сочетании с другими фармакологически активными соединениями, например для терапевтического лечения опухолей при монотерапии либо в сочетании с другими противоопухолевыми лечебными средствами, например в сочетании с ингибиторами топоизомеразы (например, этопозидом), с антимитотическими средствами (например, винбластином), со взаимодействующими с нуклеиновыми кислотами соединениями (например, цис-платином, циклофосфамидом, адриамицином), с антагонистами гормонов (например, тамоксифеном), с ингибиторами метаболических процессов (например, 5FU и т.д.), с цитокинами (например, интерферонами), с антителами и т.д. Для лечения заболеваний дыхательных путей эти соединения могут применяться индивидуально либо в сочетании с другими предназначенными для лечения дыхательных путей лекарственными средствами, такими, например, как обладающие отхаркивающим, бронхолитическим и/или подавляющим воспалительный процесс действием веществами. Для лечения заболеваний в области желудочно-кишечного тракта эти соединения также можно назначать индивидуально либо в сочетании с влияющими на перистальтику или секрецию веществами. В подобных сочетаниях действующие вещества можно вводить либо одновременно, либо последовательно. Предлагаемые в изобретении соединения индивидуально или в сочетании с другими действующими веществами можно вводить внутривенно, подкожно, внутримышечно, внутрибрюшинно, назально, путем ингаляции или чрескожно либо перорально, причем для ингаляции пригодны прежде всего аэрозольные препараты. При фармацевтическом применении предлагаемые в изобретении соединения вводят, как правило,теплокровным позвоночным животным, прежде всего человеку, в дозах от 0,01 до 100 мг/кг веса тела,предпочтительно от 0,1 до 15 мг/кг. Для приготовления лекарственных препаратов такие соединения перерабатывают совместно с одним или несколькими обычными инертными носителями и/или разбавителями, например с кукурузным крахмалом, лактозой, тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, стеа-8 006317 риловым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, такими как отвержденный жир, или их приемлемыми смесями в обычные галеновы формы, такие как таблетки, драже,капсулы, порошки, суспензии, растворы, спреи или суппозитории. Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Получение исходных соединений Пример I. 3-Метиламинотетрагидрофуран. К 50 мл тетрагидрофурана при охлаждении на ледяной бане порциями добавляют 3,43 г алюмогидрида лития. Далее по каплям добавляют раствор из 5,00 г 3-[(бензилоксикарбонил)амино]тетрагидрофурана в 20 мл тетрагидрофурана, поддерживая при этом температуру ниже 10 С. Через 10 мин охлаждающую баню удаляют и реакционную смесь в течение примерно 3 ч кипятят с обратным холодильником. Для переработки реакционную смесь при охлаждении на ледяной бане осторожно смешивают по каплям с 3,7 мл воды, 3,7 мл 15%-ного раствора едкого натра и вновь с 3 мл воды. После этого добавляют небольшое количество тетрагидрофурана и затем перемешивают в течение 15 мин. Выпавший в осадок гидроксид алюминия отделяют вакуум-фильтрацией и затем промывают тетрагидрофураном общим количеством 150 мл. Фильтрат концентрируют на роторном испарителе. В результате в виде остатка получают бесцветное масло, которое без дополнительной очистки используют в последующей реакции. Масс-спектр (ESI+): m/z = 102 [М+Н]+.Rf-значение: 0,20 (силикагель, метиленхлорид/метанол в соотношении 9:1). Пример II. 3-[(Бензилоксикарбонил)амино]тетрагидрофуран. 12,36 мл тетрагидрофуран-3-карбоновой кислоты и 27,84 мл дифенилфосфорилазида в 500 мл диоксана смешивают с 41,91 г бензилового спирта и 35,81 мл триэтиламина. Реакционную смесь нагревают до 100 С и выдерживают при этой температуре в течение примерно 7 ч. После охлаждения до комнатной температуры реакционную смесь концентрируют на роторном испарителе. Остаток растворяют в 500 мл метиленхлорида и дважды промывают 1 н. едким натром порциями по 100 мл. Органическую фазу сушат над сульфатом магния и концентрируют. Сырой продукт очищают хроматографией на силикагелевой колонке, используя циклогексан/этилацетат (в соотношении от 3:1 до 1:2) в качестве элюента. Выход: 15,60 г (55% от теории). Масс-спектр (ESI-): m/z = 220 [N-Н]-.Rf-значение: 0,78 (силикагель, метиленхлорид/метанол в соотношении 9:1). Пример III. 6-Амино-4-[(3-хлор-4-фторфенил)амино]-7-R)-тетрагидрофуран-3-илокси)хиназолин. Смесь из 12,80 г 4-[(3-хлор-4-фторфенил)амино]-6-нитро-7-R)-тетрагидрофуран-3-илокси) хиназолина, 200 мл этанола, 100 мл воды и 17,20 мл ледяной уксусной кислоты нагревают до температуры кипения с обратным холодильником. Далее порциями добавляют железный порошок общим количеством 7,00 г. Реакционную смесь в течение примерно 4 ч кипятят с обратным холодильником и затем оставляют на ночь для охлаждения до комнатной температуры. Для переработки реакционную смесь концентрируют на роторном испарителе. Остаток растворяют в метиленхлориде/метаноле (9:1), смешивают с 20 мл концентрированного раствора аммиака и фильтруют через слой силикагеля. Далее реакционную смесь обильно промывают метиленхлоридом/метанолом (9:1) и объединенные фильтраты концентрируют. Остаток размешивают с диэтиловым эфиром и отделяют вакуум-фильтрацией. Выход: 8,59 г (73% от теории). Масс-спектр (ESP-): m/z = 373, 375 [N-Н]-,Rf-значение: 0,27 (силикагель, этилацетат/метанол в соотношении 9:1). Аналогично примеру III получают следующие соединения:(4) 6-амино-4-[(3-хлор-4-фторфенил)амино]-7-[(тетрагидрофуран-3-ил)метокси]хиназолин: масс-спектр (ESI-): m/z = 387, 389 [N-Н]-,Rf-значение: 0,40 (силикагель, этилацетат/метанол в соотношении 9:1). Пример IV. 4-[(3-Хлор-4-фторфенил)амино]-6-нитро-7-(R-тетрагидрофуран-3-илокси)хиназолин. К раствору 10,80 г (R)-3-гидрокситетрагидрофурана в 100 мл N,N-диметилформамида при охлаждении на ледяной бане порциями добавляют 13,80 г трет-бутилата калия. Реакционную смесь перемешивают в течение примерно одного часа, после чего порциями добавляют 10,40 г 4-[(3-хлор-4 фторфенил)амино]-6-нитро-7-фторхиназолина. Затем охлаждающую баню удаляют, а реакционную смесь темно-красного цвета перемешивают в течение двух часов при комнатной температуре. Для переработки реакционную смесь сливают примерно в 500 мл воды и нейтрализуют 2 н. соляной кислотой. Выпавший осадок желтоватого цвета отделяют вакуум-фильтрацией и сушат в сушильном шкафу с цир-9 006317 куляцией воздуха при 70 С. Выход: 12,80 г. Температура плавления: 244 С. Масс-спектр (ESI-): m/z = 403, 405 [N-Н]-. Аналогично примеру IV получают следующие соединения:VI) растворяют в 200 мл метанола и гидрируют в присутствии 4,00 г палладия на активированном угле(10%-ный Pd) при комнатной температуре до тех пор, пока не прекратится поглощение водорода. Для переработки катализатор отфильтровывают и фильтрат концентрируют на роторном испарителе. В качестве остатка получают жидкотекучее желтоватое масло, которое без дополнительной очистки используют в последующей реакции. Выход: 8,60 г (73% от теории). Масс-спектр (ESI+): m/z = 116 [М+Н]+. Аналогично примеру V получают следующие соединения:(2) N-[(тетрагидропиран-4-ил)метил]-N-метиламин масс-спектр (ESI+): m/z = 130 [М+Н]+. Пример VI. (R)-N-[(тетрагидрофуран-2-ил)метил]-N-бензил-N-метиламин. К 17,00 г алюмогидрида лития в 150 мл тетрагидрофурана по каплям добавляют раствор 24,60 г Nбензил-N-метиламида (R)-тетрагидрофуран-2-карбоновой кислоты в 90 мл тетрагидрофурана. Реакционную смесь в течение двух часов кипятят с обратным холодильником. Для переработки реакционную смесь охлаждают на ледяной бане до 0 С, смешивают с 20 мл воды и 10 мл 15 н. едкого натра и затем перемешивают в течение 20 мин. После этого фильтруют через слой сульфата магния и затем промывают тетрагидрофураном общим количеством примерно 500 мл. Фильтрат концентрируют в вакууме, получая при этом в качестве остатка желтоватое масло, которое без дополнительной очистки используют в последующей реакции. Выход: 21,10 г (92% от теории). Масс-спектр (ESI+): m/z = 206 [М+Н]+. Аналогично примеру VI получают следующие соединения:(2) N-[(тетрагидропиран-4-ил)метил]-N-бензил-N-метиламин: масс-спектр (ESI+): m/z = 220 [М+Н]+. Пример VII. N-бензил-N-метиламид (R)-тетрагидрофуран-2-карбоновой кислоты. К раствору 20,00 мл (R)-тетрагидрофуран-2-карбоновой кислоты в 200 мл тетрагидрофурана добавляют 25,30 г N-бензил-N-метиламина. Затем при охлаждении на ледяной бане порциями добавляют тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония общим количеством 67,10 г и реакционную смесь после этого перемешивают при комнатной температуре в течение примерно 48 ч. Образовавшийся осадок отделяют вакуум-фильтрацией, фильтрат концентрируют, смешивают с водой и вновь фильтруют. Значение рН полученного фильтрата устанавливают на щелочное с помощью раствора гидрокарбоната натрия и экстрагируют этилацетатом. Объединенные этилацетатные экстракты промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. В результате в качестве остатка получают желтоватое масло, которое без дополнительной очистки используют в последующей реакции. Выход: 24,60 г (54% от теории).(2) N-бензил-N-метиламид тетрагидропиран-4-карбоновой кислоты (амидное сочетание с 1,1'карбонилдиимидазолом проводят в тетрагидрофуране): масс-спектр (ESI+): m/z = 256 [M+Na]+,Rf - значение: 0,45 (силикагель, этилацетат). Пример VIII. 6-амино-4-[(3-хлор-4-фторфенил)амино]-7-[(тетрагидропиран-4-ил)метокси]хиназолин. 22,80 г 4-[(3-хлор-4-фторфенил)амино]-6-нитро-7-[(тетрагидропиран-4-ил)метокси]хиназолина при комнатной температуре гидрируют в 300 мл тетрагидрофурана в присутствии 3,50 г диоксида платины до поглощения расчетного количества водорода. Затем катализатор отфильтровывают, а фильтрат досуха концентрируют на роторном испарителе. Остаток размешивают с диэтиловым эфиром, отделяют вакуумфильтрацией, затем промывают диэтиловым эфиром и сушат при комнатной температуре. Выход: 19,95 г (93% от теории). Масс-спектр (ESI+): m/z = 403, 405 [М+Н]+. Температура плавления: 221 С. Аналогично примеру VIII получают следующие соединения:(2) 6-амино-4-[(3-хлор-4-фторфенил)амино]-7-[(S)-(тетрагидрофуран-2-ил)метокси]хиназолин: масс-спектр (ESI+): m/z = 389, 391 [М+Н]+ ,Rf - значение: 0,33 (силикагель, этилацетат/метанол в соотношении 9:1). Получение конечных соединений Пример 1. 4-[(3-хлор-4-фторфенил)амино]-6-(4-[N-(2-метоксиэтил)-N-метиламино]-1-оксо-2-бутен-1-иламино)-7-циклопропилметоксихиназолин. К раствору 4,50 г бромкротоновой кислоты в 60 мл метиленхлорида по каплям добавляют 4,70 мл оксалилхлорида. Далее добавляют одну каплю N,N-диметилформамида. Через примерно 30 мин выделение газа завершается, и реакционную смесь концентрируют на роторном испарителе. Сырой хлорангидрид бромкротоновой кислоты растворяют в 30 мл метиленхлорида и при охлаждении на ледяной бане по каплям добавляют к раствору 7,00 г 4-[(3-хлор-4-фторфенил)амино]-6-амино-7-циклопропилметоксихиназолина и 10,20 мл основания Хюнига в 150 мл тетрагидрофурана. Реакционную смесь перемешивают в течение примерно 1,5 ч при охлаждении на ледяной бане, а затем еще в течение 2 ч при комнатной температуре. После этого добавляют 5,20 г N-(2-метоксиэтил)-N-метиламина и реакционную смесь перемешивают в течение ночи при комнатной температуре. Для переработки реакционную смесь разбавляют метиленхлоридом и тщательно промывают водой. Органическую фазу сушат над сульфатом магния и концентрируют. Сырой продукт очищают хроматографией на силикагелевой колонке, используя этилацетат, а затем этилацетат/метанол (19:1) в качестве элюента. Выход: 5,07 г (51% от теории). Масс-спектр (ESI-): m/z = 512, 514 [N-Н]-,Rf-значение: 0,25 (силикагель, этилацетат/метанол в соотношении 9:1). Аналогично примеру 1 получают следующие соединения:(39) 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N-изопропил-N-метиламино)-1-оксо-2-бутен-1-ил]амино-7-[(S)-(тетрагидрофуран-2-ил)метокси]хиназолин: масс-спектр (ESI+): m/z = 528, 530 [М+Н]+ ,Rf-значение: 0,31 (силикагель, метиленхлорид/метанол в соотношении 9:1). Аналогично приведенным выше примерам и иным известным из литературы методам можно также получить следующие соединения:(1) 4-бензиламино-6-[4-(N,N-диэтиламино)-1-оксо-2-бутен-1-ил]амино-7-циклопропилметоксихиназолин,(2) 4-[(3-хлор-4-фторфенил)амино]-6-[(4-N-[(тетрагидропиран-4-ил)метил]-N-метиламино-1-оксо 2-бутен-1-ил)амино]-7-циклопропилметоксихиназолин,(3) 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-[(тетрагидропиран-4-ил)метокси]хиназолин,(4) 4-[(R)-(1-фенилэтил)амино]-6-[(4-N-[(тетрагидрофуран-2-ил)метил]-N-метиламино-1-оксо-2 бутен-1-ил)амино]-7-циклопропилметоксихиназолин,(5) 4-[(R)-(1-фенилэтил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-[(тетрагидрофуран-2-ил)метокси]хиназолин,(6) 4-[(R)-(1-фенилэтил)амино]-6-(4-[N,N-бис(2-метоксиэтил)амино]-1-оксо-2-бутен-1-иламино)7-[(тетрагидрофуран-2-ил)метокси]хиназолин,(7) 4-[(R)-(l-фенилэтил)амино]-6-[4-(морфолин-4-ил)-1-оксо-2-бутен-1-ил]амино-7-[(тетрагидрофуран-2-ил)метокси]хиназолин. Пример 2. Драже с содержанием действующего вещества 75 мг Состав из расчета на 1 ядро драже: Действующее вещество 75,0 мг Фосфат кальция 93,0 мг Кукурузный крахмал 35,5 мг Поливинилпирролидон 10,0 мг Гидроксипропилметилцеллюлоза 15,0 мг Стеарат магния 1,5 мг 230,0 мг Получение. Действующее вещество смешивают с фосфатом кальция, кукурузным крахмалом, поливинилпирролидоном, гидроксипропилметилцеллюлозой и половиной от указанного количества стеарата магния. Из полученной смеси на таблетировочной машине получают прессованные продукты диаметром примерно 13 мм, которые протирают на соответствующей машине через сито с размером ячеек 1,5 мм и смешивают с остальным количеством стеарата магния. Из этого гранулята на таблетировочной машине прессуют таблетки заданной формы. Масса ядра: 230 мг. Пуансон: диаметр 9 мм, с вогнутой рабочей поверхностью. На полученные таким путем ядра драже наносят пленочное покрытие, состоящее в основном из гидроксипропилметилцеллюлозы. Готовые драже с покрытием полируют пчелиным воском. Масса драже: 245 мг. Пример 3. Таблетки с содержанием действующего вещества 100 мг Состав из расчета на 1 таблетку: Действующее вещество 100,0 мг Лактоза 80,0 мг Кукурузный крахмал 34,0 мг Поливинилпирролидон 4,0 мг Стеарат магния 2,0 мг 220,0 мг Получение. Действующее вещество смешивают с лактозой и крахмалом и равномерно увлажняют водным раствором поливинилпирролидона. После продавливания влажной массы через сито (размер ячеек 2,0 мм) и сушки в решетчатом сушильном шкафу при 50 С продукт вновь просеивают через сито (с размером ячеек 1,5 мм) и примешивают смазывающее вещество. Готовую к прессованию смесь перерабатывают в таблетки. Масса таблетки: 220 мг. Диаметр таблетки: 10 мм, двоякоплоская с двусторонней фасеткой и разделительной насечкой с од- 14006317 ной стороны. Пример 4 Таблетки с содержанием действующего вещества 150 мг Состав из расчета на 1 таблетку: Действующее вещество 150,0 мг Лактоза, порошковая 89,0 мг Кукурузный крахмал 40,0 мг Коллоидная кремниевая кислота 10,0 мг Поливинилпирролидон 10,0 мг Стеарат магния 1,0 мг 300,0 мг Получение. Смесь действующего вещества с лактозой, кукурузным крахмалом и кремниевой кислотой увлажняют 20%-ным водным раствором поливинилпирролидона и продавливают через сито с размером ячеек 1,5 мм. Высушенный при 45 С гранулят еще раз протирают через то же самое сито и смешивают с указанным количеством стеарата магния. Из этой смеси прессуют таблетки. Масс таблетки: 300 мг. Пуансон: диметр 10 мм, с плоской рабочей поверхностью. Пример 5. Твердожелатиновые капсулы с содержанием действующего вещества 150 мг. Состав из расчета на 1 капсулу: Действующее вещество 150,0 мг Кукурузный крахмал, высушенный примерно 180,0 мг Лактоза, порошковая примерно 87,0 мг Стеарат магния 3,0 мг примерно 420,0 мг Получение. Действующее вещество смешивают со вспомогательными веществами, просеивают через сито с размером ячеек 0,75 мм и смешивают до гомогенности в соответствующем аппарате. Полученную смесь расфасовывают в твердожелатиновые капсулы размера 1. Масса содержимого капсулы: примерно 320 мг. Оболочка капсулы: твердожелатиновая капсула размера 1. Пример 6. Суппозитории с содержанием действующего вещества 150 мг. Состав из расчета на 1 свечу: Действующее вещество 150,0 мг Полиэтиленгликоль 1500 550,0 мг Полиэтиленгликоль 6000 460,0 мг Полиоксиэтиленсорбитанмоностеарат 840,0 мг 2000,0 мг Получение. После расплавления массы для суппозиториев в ней гомогенно диспергируют действующее вещество и расплавленную массу разливают по предварительно охлажденным формам. Пример 7. Суспензия с содержанием действующего вещества 50 мг. Состав из расчета на 100 мл суспензии: Действующее вещество 1,00 гNa-соль карбоксиметилцеллюлозы 0,10 г Метиловый эфир n-гидроксибензойной кислоты 0,05 г Пропиловый эфир n-гидроксибензойной кислоты 0,01 г Тростниковый сахар 10,00 г Глицерин 5,00 г Раствор сорбита, 70%-ный 20,00 г Ароматизатор 0,30 г Вода дистиллированная До 100 мл Получение. Дистиллированную воду нагревают до 70 С. Далее в ней при перемешивании растворяют метиловый и пропиловый эфиры n-гидроксибензойной кислоты, а также глицерин и натриевую соль карбоксиметилцеллюлозы. Раствор охлаждают до комнатной температуры, при перемешивании добавляют действующее вещество и диспергируют до гомогенности. После добавления и растворения сахара, раствора сорбита и ароматизатора суспензию для удаления из нее воздуха вакуумируют при перемешивании. В 5 мл суспензии содержание действующего вещества составляет 50 мг.- 15006317 Пример 8. Ампулы с содержанием действующего вещества 10 мг. Состав: Действующее вещество 10,0 мг 0,01 н. соляная кислотаs.q. Дважды дистиллированная вода До 2,0 мл Получение. Действующее вещество растворяют в необходимом количестве 0,01 н. НС 1, раствор доводят до изотонического добавлением поваренной соли, стерилизуют фильтрацией и расфасовывают в 2 миллилитровые ампулы. Пример 9. Ампулы с содержанием действующего вещества 50 мг. Состав: Действующее вещество 50,0 мг 0,01 н. соляная кислотаs.q. Дважды дистиллированная вода До 10,0 мл Получение. Действующее вещество растворяют в необходимом количестве 0,01 н. НСl, раствор доводят до изотонического добавлением поваренной соли, стерилизуют фильтрацией и расфасовывают в 10 миллилитровые ампулы. Пример 10. Капсулы для порошковой ингаляции с содержанием действующего вещества 5 мг. Состав из расчета на 1 капсулу: Действующее вещество 5,0 мг Лактоза для ингаляции 15,0 мг 20,0 мг Получение. Действующее вещество смешивают с лактозой для ингаляции. Полученную смесь расфасовывают в капсулы (масса пустой капсулы около 50 мг) в машине для заполнения капсул. Масса капсулы: 70,0 мг. Размер капсулы: 3. Пример 11. Раствор для ингаляции, содержащий 2,5 мг действующего вещества, для ручного ингалятора. Состав из расчета на одну порцию, выдаваемую при однократном нажатии на головку ингалятора: Действующее вещество 2,500 мг Бензалконийхлорид 0,001 мг 1 н. соляная кислотаq.s. Этанол/вода (50:50) До 15,000 мг Получение. Действующее вещество и бензалконийхлорид растворяют в этаноле/воде (50:50). Значение рН раствора устанавливают на требуемое добавлением 1 н. соляной кислоты. Полученный раствор фильтруют и расфасовывают в сменные баллончики (патроны), предназначенные для ручного ингалятора. Масса содержимого баллончика: 4,5 г. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные хиназолина общей формулы(21) 4-[(3-хлор-4-фторфенил)амино]-6-(4-[N-метил-N-(тетрагидрофуран-3-ил)амино]-1-оксо-2-бутен-1-иламино)-7-циклопропилметоксихиназолина,их таутомеры, их стереоизомеры и их соли. 2. Соединения общей формулы I по п.1, в которых Ra, Rb и Rc имеют указанные в п.1 значения, но за исключением следующих соединений:(33) 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N-циклопропил-N-метиламино)-1-оксо-2-бутен-1-ил] амино-7-циклопропилметоксихиназолина,их таутомеры, их стереоизомеры и их соли. 3. Соединения общей формулы I по п.1, в которых Ra обозначает 1-фенилэтильную или 3-хлор-4 фторфенильную группу, Rb обозначает диметиламино-, N-метил-N-этиламино-, диэтиламино-, N-метилN-изопропиламино-, N-метил-N-циклопропиламино-, N-метил-N-(2-метоксиэтил)амино-, N-этил-N-(2 метоксиэтил)амино-, бис(2-метоксиэтил)амино-, морфолино-, N-метил-N-(тетрагидрофуран-3-ил)амино-,N-метил-N-(тетрагидрофуран-2-илметил)амино-, N-метил-N-(тетрагидрофуран-3-илметил)амино-, Nметил-N-(тетрагидропиран-4-ил)амино- или N-метил-N-(тетрагидропиран-4-илметил)аминогруппу и Rc обозначает циклопропилметокси-, циклобутилокси-, циклопентилокси-, тетрагидрофуран-3-илокси-, тетрагидрофуран-2-илметокси-, тетрагидрофуран-3-илметокси-, тетрагидропиран-4-илокси- или тетрагидропиран-4-илметоксигруппу, за исключением следующих соединений:(33) 4-[(3-хлор-4-фторфенил)амино]-6-(4-[(S)-N-метил-N-(тетрагидрофуран-2-илметил)амино]-1 оксо-2-бутен-1-иламино)-7-циклобутилоксихиназолина,их таутомеры, их стереоизомеры и их соли. 4. Соединения общей формулы I по п.1 из группы, включающей(у) 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-[(S)(тетрагидрофуран-2-ил)метокси]хиназолин,их таутомеры, их стереоизомеры и их соли. 5. Физиологически приемлемые соли соединений по любому из пп.1-4 с неорганическими или органическими кислотами или основаниями. 6. Лекарственное средство, содержащее соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5, необязательно в сочетании с одним или несколькими инертными носителями и/или разбавителями. 7. Применение соединения по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения доброкачественных или злокачественных опухолей, для профилактики и лечения заболеваний дыхательных путей и легких, а также для лечения заболеваний желудочно-кишечного тракта и желчных протоков и желчного пузыря. 8. Способ получения лекарственного средства по п.6, отличающийся тем, что соединение по любому из пп.1-5 нехимическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями. 9. Способ получения соединений общей формулы I по любому из пп.1-5, отличающийся тем, что соединение общей формулы в которой Rb имеет указанные в пп.1-5 значения, а Z1 обозначает уходящую группу или гидроксигруппу,и затем при необходимости вновь отщепляют защитную группу, использовавшуюся при проведении указанных выше реакций, и полученное таким путем соединение общей формулы I при необходимости разделяют на его стереоизомеры и/или полученное таким путем соединение общей формулы I переводят в одну из его солей, прежде всего для фармацевтического применения в одну из его физиологически приемлемых солей. 10. Способ получения соединений общей формулы I по любому из пп.1-5, отличающийся тем, что соединение общей формулыH-Rb (V),в которой Rb имеет указанные в пп.1-5 значения,и затем при необходимости вновь отщепляют защитную группу, использовавшуюся при проведении указанных выше реакций, и/или полученное таким путем соединение общей формулы I при необходимости разделяют на его стереоизомеры, и/или полученное таким путем соединение общей формулы I переводят в одну из его солей, прежде всего для фармацевтического применения в одну из его физиологически приемлемых солей.
МПК / Метки
МПК: A61K 31/505, C07D 239/94, A61P 35/00
Метки: получения, соединения, хиназолина, применение, средства, содержащие, эти, лекарственные, способ, производные
Код ссылки
<a href="https://eas.patents.su/22-6317-proizvodnye-hinazolina-soderzhashhie-eti-soedineniya-lekarstvennye-sredstva-ih-primenenie-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хиназолина, содержащие эти соединения лекарственные средства, их применение и способ их получения</a>
Предыдущий патент: Комбинация, включающая комбретастатин и противораковые средства
Следующий патент: Сильнодействующие иммуностимуляторы из микроводорослей
Случайный патент: Полипептиды и пути биосинтеза












