Ингибиторы протеазы вич
Номер патента: 13520
Опубликовано: 30.06.2010
Авторы: Самуэльссон Бертиль, Экегрен Йенню, Каннан Махалинган, Вальберг Ханс, Хальберг Андерс
Формула / Реферат
1. Соединение формулы I
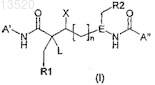
где R1является фенилом,
R2 является фенилом, необязательно замещенным пиридилом, галогеном, фенилом, пиримидинилом, бензотиофеном, бензодиоколилом, диалкилизоксазолилом, фенилалкенилом, фенилалкинилом, пиридилалкинилом;
X является Н, F, ОН, C1-C3Alk или С0-С3алкандиил-O-С1-С3алкилом;
L является ОН;
n равно 0, 1 или 2;
Е является N или СН;
А' является инданилом, замещенным гидрокси или группой формулы (II)
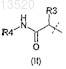
где R3является C1-C6Alk;
R4 является C1-C6Alk;
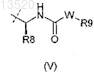
А" является группой формулы (V) или (VII)

где R8является C1-C6Alk;
R9 является C1-C6Alk, бензилом;
W является -NR13- или -O-;
R13 является бензилом;
и его фармацевтически приемлемые соли.
2. Соединение по п.1, имеющее стереохимию, показанную на конкретной структуре

3. Соединение по п.1, где необязательный заместитель R2 выбирают из фтора.
4. Соединение по п.1, где R2 является фенилом, замещенным пиридилом.
5. Соединение по любому из предшествующих пунктов, где X является Н или ОН.
6. Соединение по любому из предшествующих пунктов, где n равно 1.
7. Соединение по любому из предшествующих пунктов, где Е является N.
8. Соединение по любому из предшествующих пунктов, где А' является группой формулы (II).
9. Соединение по любому из предшествующих пунктов, где R4 является метилом.
10. Соединение по п.9, имеющее стереохимию, показанную на конкретной структуре
11. Соединение по любому из предшествующих пунктов, где А" имеет формулу (V).
12. Соединение по п.11, где R8 является изопропилом или трет-бутилом.
13. Соединение по п.11, где R9 является метилом.
14. Соединение по любому из пп.11-13, где W является -О-.
15. Соединение по любому из пп.11-13, имеющее стереохимию, показанную на конкретной структуре
16. Фармацевтическая композиция, содержащая соединение по любому из представленных выше пунктов и фармацевтически приемлемый носитель или разбавитель.
17. Фармацевтическая композиция по п.16, также включающая 1-3 дополнительных анти-ВИЧ агента.
18. Применение соединения по любому из пп.1-15 для производства лекарственного средства для профилактики или лечения инфекции ВИЧ.
19. Способ медицинского лечения или профилактики инфекции ВИЧ, включающий введение эффективного количества соединения по любому из пп.1-15 пациенту, зараженному или находящемуся под угрозой заражения инфекцией ВИЧ.
Текст
013520 Два отдельных ретровируса, вирусы иммунодефицита человека (ВИЧ) тип-1 (ВИЧ-1) или тип-2(ВИЧ-2) этиологически связаны с иммуносупрессивным заболеванием, синдромом приобретенного иммунодефицита (СПИД). Серопозитивные к ВИЧ лица сначала не имеют симптомов, но обычно затем у них развивается связанный со СПИДом комплекс (ССК) с последующим развитием СПИД. Пораженные лица демонстрируют тяжелую иммуносупрессию, которая вызывает у них предрасположенность к ослаблению сил и крайне пагубным приспосабливающимся инфекциям. Заболевание СПИДом является конечным результатом вирусов ВИЧ-1 или ВИЧ-2, проходящих свои собственные комплексные жизненные циклы. Жизненный цикл вириона зачинается с момента присоединения вириона к хозяйской человеческой Т-4 иммунной клетке лимфоцита путем связывания гликопротеина на поверхности защитной оболочки вириона с гликопротеином CD4 клетки лимфоцита. Сразу после присоединения вирион сбрасывает гликопротеиновую оболочку, проникает в мембрану клетки-хозяина и оголяет ее РНК. Фермент вириона, обратная транскрипатаза, направляет процесс транскрибирования РНК на однонитевые ДНК. РНК вируса разрушается и создается вторая цепь ДНК. Новая двунитевая ДНК интегрируется в гены клетки человека, и эти гены используются для репродукции вируса. На этом этапе полимераза РНК считывает генетический код интегрированной ДНК в РНК вируса. РНК вируса транслируется в сшитый полипротеин gaga-pol предшественника, полипротеин затем расщепляется ферментом протеазы ВИЧ с получением зрелых вирусных белков. Таким образом, протеаза ВИЧ ответственна за регулирование каскада расщеплений, который ведет к созреванию частиц вируса в вирусы, которые ответственны за полную инфективность. Обычная реакция иммунной системы человека, уничтожение проникающего вириона, истощена,так как вирус поражает и убивает Т клетки иммунной системы. Кроме того, обратная транскриптаза вируса, фермент, применяемый для получения новых частиц вириона, не является очень специфичной и вызывает ошибки транскрипции, которые дают непрерывно меняющиеся гликопротеины на поверхности защитной оболочки вируса. Потеря специфичности снижает эффективность иммунной системы, так как антитела, специфично вырабатываемые против одного гликопротеина, могут быть бесполезны против другого, следовательно, количество антител, доступных для уничтожения вируса, снижается. Вирус продолжает воспроизводиться, в то время как реакция иммунной системы продолжает слабеть. В итоге ВИЧ в значительной степени доминирует над иммунной системой тела, что позволяет возникать приспосабливающимся инфекциям что без введения противовирусных агентов, иммуномодуляторов или обоих может привести к смерти. Существует по крайней мере три критических момента в жизненном цикле вируса, которые идентифицированы как возможные цели для противовирусных лекарственных средств: (1) начальное присоединение вириона к Т-4 лимфоциту или макрофагу, (2) транскрипция вирусной РНК в вирусную ДНК(обратная транскриптаза, ОТ) и (3) обработка белка gag-pol протеазой ВИЧ. Геномы ретровирусов кодируют протеазу, которая ответственна за протеолитическую обработку одного или более предшественников полипротеина, таких как продукты pol или gag генов. Ретровирусная протеаза обычно обрабатывает предшественник gag в протеины ядра, а также обрабатывает предшественник pol в обратную транскриптазу и ретровирусную протеазу. Правильная обработка предшественников полипротеинов ретровирусной протеазой необходима для сборки инфекционных вирионов. Было показано, что in vitro мутагенез, который дает вирус с поврежденной протеазой, приводит к получению незрелых форм ядра, которые не имеют инфективности. Поэтому ингибирование ретровирусной протеазы является привлекательной целью для противовирусной терапии. Как доказано ингибиторами протеазы, имеющимися в настоящее время на рынке, и клиническими испытаниями, было изучено множество соединений в качестве потенциальных ингибиторов протеазы ВИЧ. Первым ингибитором так называемой ретровирусной аспартат протеазы, одобренным для борьбы с инфекцией, был саквинавир. Далее последовали другие ингибиторы, включающие индинавир (Merck),ритонавир (Abbott), ампренавир и его пролекарство фосфат ампренавира (Vertex/GSK), лопинавир (Abbott), нелфинавир (Aguoron/Pfizer), типранавир (Pharmacia/Boehringer) и атазанавир (Novartis/BMS). Каждое из этих соединений известного уровня техники несет ответственность в терапевтическом контексте за суб-оптимальные режимы лечения, побочные эффекты, такие как липодистрофия и плохая переносимость пациентами. В сочетании с репликативным неверием генетического механизма ВИЧ и очень высоким вирусным оборотом in vivo, суб-оптимальное действие и фармакокинетика ингибиторов протеазы ВИЧ известного уровня техники позволяет быстро создать мутанты, устойчивые к лекарственным средствам. Это, в свою очередь, ограничивает эффективную продолжительность лечения современными лекарственными средствами против ВИЧ, так как ВИЧ быстро становится устойчивым и/или у пациентов развивается физическое или физиологическое отвращение к самим лекарственным средствам или их побочным эффектам. Целью данного изобретения является новый тип соединения, которое имеет особенно высокую ингибирующую активность против репликации вируса в клетках, высокую противовирусную активность против множественных штаммов вируса, включая те, которые устойчивы к известным соединениям, таким как саквинавир, ритонавир и индинавир, и особенно преимущественные фармакологические свойст-1 013520 ва, например хорошую фармакокинетику, такую как высокая биодоступность, и хорошие уровни в крови и/или высокую селективность. В соответствии с данным изобретением представлено соединение формулы In равно 0, 1 или 2; Е является N или СН; А' является инданилом, замещенным гидрокси или группой формулы (II)R4 является C1-C6Alk; А" является группой формулы (V) или (VII)R13 является бензилом; и его фармацевтически приемлемые соли. Другой аспект данного изобретения относится к фармацевтической композиции, содержащей соединение, определенное выше, и фармацевтически приемлемый носитель или разбавитель. В еще одном аспекте данное изобретение относится к применению соединения, определенного выше, для производства лекарственного средства для профилактики или лечения инфекции ВИЧ. Еще один аспект данного изобретения относится к способу медицинского лечения или профилактики инфекции ВИЧ, включающему введение эффективного количества соединения, определенного выше, пациенту, зараженному или находящемуся под угрозой заражения инфекцией ВИЧ. Не претендуя на какую-либо теорию или определение экспериментальных способов связывания для определенных переменных, воображаемые понятия Р 1, Р 1', Р 2 и Р 2' в данном описании представлены только для удобства и имеют, по существу, их обычные значения, как показано у SchechterBerger,(1976) Biochem Biophys Res Comm 27 157-162, и означают те положения ингибитора, которые предположительно заполняют S1, S1', S2 и S2' подсайты соответственно ферменту, где S1 является соседним и S2 удален от места расщепления на одной стороне, и S1' является соседним и S2' удален от места расщепления на другой стороне. Независимо от способа связывания соединения, определенные формулой I, включены в объем данного изобретения. Возможно, что R1 и R2, соответственно, заполняют S1 и S1' подсайты, в то время как А' и А" взаимодействуют с S2 и S2', но также возможно противоположное размещение. Предпочтительно соединения в соответствии с данным изобретением имеют по крайней мере 75%,предпочтительно по крайней мере 90%, более предпочтительно избыток 95% энантиомерную чистоту относительно атома углерода, общего с гидроксильной группой и R1 метиленовой функциональной группой, изображенных на формуле I. Предпочтительно, чтобы соединения демонстрировали высокую степень энантиомерной чистоты стереоизомеров, как показано на конкретной структуре Группа X может иметь либо R, либо S стереохимию. Как определено выше, X является Н, ОН, C1-C3Alk или С 0-С 3 алкандиил-О-С 1-С 3 алкилом. Предпочтительные значения X включают ОН и С 0-С 3 алкандиил-О-С 1-С 3 алкил, особенно метокси (т.е. С 0) и гидроксиметил. Особенно предпочтительным значением X является Н или ОН. Как указано выше, L является ОН, F, NH2, -NHC1-C3Alk, -N(C1-C3Alk)2, где NHC1-C3Alk и -N(C1C3Alk)2 предпочтительно являются NHMe и NHMe2 соответственно. Особенно предпочтительным значением для L является фтор, более предпочтительным значением является ОН. Соединения в соответствии с данным изобретением могут иметь 2 атома в цепи между карбонилом,изображенным на формуле I, и функциональной группой Е (т.е. n равно 0). Другие варианты данного изобретения включают 3 или 4 атома в цепи между карбонилом и функциональной группой Е, т.е. n равно 1 или 2 соответственно. В предпочтительных вариантах данного изобретения соединения имеют 3 атома в цепи между карбонилом и функциональной группой Е, т.е. n равно 1. Предпочтительно соединения в соответствии с данным изобретением содержат гидразидную функциональную группу, то есть Е является N, и полагают, что такая конфигурация поворачивает R2 метиленовую боковую цепь под предпочтительным углом относительно S1' (или S1) ячейку протеазы ВИЧ, например, если А" соответствует формуле V. Однако оптимальный угол, конечно, будет зависеть от других взаимосвязей внутри основной молекулы, боковых цепей и окончаний соединения, и такие дополнительные варианты данного изобретения включают СН в функциональной группе Е. Как определено выше, R1 является R1', OR1' или -SR1', где R1' является C1-С 6 алкилом, но предпочтительно С 0-С 3 алкандиилкарбоциклилом или С 0-С 3 алкандиилгетероциклилом. Типовые примеры таких групп представлены ниже. Любая из этих групп необязательно замещена вплоть до 3 заместителями, независимо выбранными из R10, как определено выше. Предпочтительные необязательные заместители для R1' включают один или два заместителя, выбранные из галогена, оксо,циано, C1-C6Alk, С 0-С 3 алкандиилкарбоциклила, С 0-С 3 алкандиилгетероциклила, Y-NRaRb, Y-O-Rb; где Y является связью или C1-C3Alk, Ra является Н или C1-C3Alk и Rb является Н или C1-C3Alk. Особенно предпочтительные заместители включают фтор, C1-C3Alk, С 0-С 1 алкандиилкарбоциклил, С 0-С 1 алкандиилгетероциклил. Предпочтительно С 0-С 3 алкандиильный линкер такого С 0-С 3 алкандиилкарбоциклила или С 0 С 3 алкандиилгетероциклила в качестве R1' или его необязательного заместителя включают метилен или более предпочтительно связь, т.е. R1' или заместитель просто являются необязательно замещенным карбоциклилом или гетероциклилом, таким как необязательно замещенный фенил или необязательно замещенный пиридил, пиразинил, пиримидинил или пиридазинил. Предпочтительно R1 является R1' или OR1'. В одном варианте данного изобретения, R10 заместитель R1 является Y-O-Rb, где Y является связью и Rb является необязательно замещенным С 0-С 3 алкандииларилом или С 0-С 3 алкандиилгетероарилом. Необязательным заместителем предпочтительно является C1-C3Alk, такой как метил. Предпочтительные структуры R1 в соответствии с данным вариантом включают Следовательно, другие подходящие значения для R1 включают фенил, пирид-2-ил, пирид-3-ил, пирид-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиразин-2-ил, пиразин-3-илил или пиридазин-3-ил, пиридазин-4-ил или триазинил; или моно- или дигалозамещенный фенил, такой как моно- или дифторзамещенный фенил. Как определено выше, R2 является C1-C6Alk, но предпочтительно С 0-С 3 алкандиилкарбоциклилом или С 0-С 3 алкандиилгетероциклилом, любой из которых необязательно замещен вплоть до 3 заместителями, независимо выбранными из R10. Необязательный заместитель предпочтительно является одним или двумя членами, выбранными из галогена, оксо, циано, C1-C6Alk, С 0-С 3 алкандиилкарбоциклила, С 0 С 3 алкандиилгетероциклила, Y-NRaRb, Y-O-Rb; где Y является связью или C1-C3Alk, Ra является Н илиC1-C3Alk и Rb является Н или C1-C3Alk. Особенно предпочтительные заместители включают фтор, С 1C3Alk, метиленкарбоциклил или метиленгетероциклил, но особенно предпочтительным является заместитель, такой как необязательно замещенный карбоциклил или гетероциклил, например, в положении пара R2 циклической группы.-3 013520 Предпочтительно С 0-С 3 алкандиильный линкер такого C0-С 3 алкандиилкарбоциклила или С 0 С 3 алкандиилгетероциклила в качестве R2 или его необязательного заместителя включают метилен или более предпочтительно связь, т.е. R2 или заместитель просто являются необязательно замещенным карбоциклилом или гетероциклилом, таким как необязательно замещенный фенил или необязательно замещенный пиридил, пиразинил, пиримидинил или пиридазинил. Следовательно, другие подходящие значения для R2 включают фенил, пирид-2-ил, пирид-3-ил, пирид-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиразин-2-ил, пиразин-3-илил или пиридазин-3-ил, пиридазин-4-ил или триазинил; или фенил, замещенный, особенно в положении пара, арильным карбоциклическим кольцом, таким как фенил, или гетероциклическим кольцом, таким как гетероарильная группа, такая как определена ниже, например пирид-2-ил, пирид-3-ил или пирид-4-ил. Что касается конечного амида А', один из предпочтительных вариантов включает бициклическую кольцевую систему, содержащую первое 5- или 6-членное насыщенное кольцо, необязательно содержащее гетероатом кислорода и необязательно замещенное гидрокси или метилом, конденсированное со вторым 5- или 6-членным ненасыщенным кольцом, необязательно содержащим один или два гетероатома, выбранных из S, О или N, и необязательно замещенное моно- или дифтором. Предпочтительно, в этом варианте связь с амидом и остаток молекулы тянется от атома углерода 1 указанного насыщенного кольца. Соответственно, необязательный гидрокси заместитель в этом варианте находится на атоме углерода 2 указанного насыщенного кольца. Альтернативно представлен гетероатом кислорода обычно в положении 3 5-членного насыщенного кольца или в положении 4 6-членного насыщенного кольца. Второе кольцо в данном варианте А' предпочтительно является 5-членным и содержит гетероатом серы или гетероатом кислорода. Альтернативно, указанное второе кольцо является конденсированным пиридилом, как описано в WO 9845330 или необязательно замещенным фенилом, например конденсированным фенилом, где заместителем является моно- или дифтор. Характерные группы А' в данном варианте данного изобретения включают Альтернативный вариант соединения в соответствии с данным изобретением включает соединения,в которых А' является группой формулы (II), тем самым определяя соединение формулы Другой альтернативный вариант соединений в соответствии с данным изобретением включает соединения, в которых А' является группой формулы (II'), тем самым определяя соединение формулы Как указано выше, R3 является Н; или R3 является C1-C6Alk, С 0-С 3 алкандиилкарбоциклилом, С 0 С 3 алкандиилгетероциклилом, любой из которых необязательно замещен вплоть до трех заместителями,независимо выбранными из R11. Предпочтительные значения для R3 включают необязательно замещенный С 0-С 3 алкилгетероциклил и, особенно Н или необязательно замещенный C1-C6Alk. Более предпочтительные значения для R3 включают C1-C6Alk, такой как изопропил или трет-бутил, необязательно замещенный гидрокси или метокси или галогеном, таким как фтор. Предпочтительными значениями для R3 являются изопропил, трет-бутил, 2-фтор-1-метилэтил, 2 гидрокси-1-метилэтил, 2-метокси-1-метилэтил, 2-фтор-1,1-диметилэтил, 2-гидрокси-1,1-диметилэтил и 2 метокси-1,1-диметилэтил. Необязательные заместители R3 являются такими, как определены выше. Характерные значения включают оксо, циано или, особенно, галоген или Y-O-Ra, где Y является связью или C1-C3Alk и Ra является Н или C1-C3Alk. Как указано выше, R4 в формулах I, IIa и II' является C1-C6Alk, С 0-С 3 алкандиилкарбоциклилом, С 0 С 3 алкандиилгетероциклилом, любой из которых необязательно замещен вплоть до трех заместителями,независимо выбранными из R10. Предпочтительные значения для R4 включают необязательно замещенный C1-C6Alk, особенно метил или этил, или необязательно замещенный метил или этил. Предпочтительные необязательные заместители для R4 включают галоген, оксо, циано, азидо, нитро, C1-C6Alk, С 0-С 3 алкандиилкарбоциклил, С 0-С 3 алкандиилгетероциклил, Y-NRaRb или Y-O-Rb, гдеY является связью или C1-C3Alk;Rb является Н или C1-C6Alk, С 0-С 3 алкандиилкарбоциклилом или С 0-С 3 алкандиилгетероциклилом. Предпочтительные значения R4 включают фторэтил, дифторэтил, трифторэтил и метоксиэтил. Предпочтительные необязательные заместители для R4 включают галоген, оксо, C1-C6Alk, С 0 С 3 алкандиилкарбоциклил, С 0-С 3 алкандиилгетероциклил или Y-O-Rb, особенно галоген или Y-O-Rb. Группа формулы II может иметь S или R стереохимию в хиральном центре, к которому присоединен R3, или рацемат, но предпочтительно, чтобы стереохимия была такая, которая показана на частичной структуре где R3 является Н; или R3 является C1-C6Alk, С 0-С 3 алкандиилкарбоциклилом, С 0-С 3 алкандиилгетероциклилом, любой из которых необязательно замещен вплоть до трех заместителями, независимо выбранными из R11; R5 является C1-C6Alk, С 0-С 3 алкандиилкарбоциклилом, С 0-С 3 алкандиилгетероциклилом, любой из которых необязательно замещен вплоть до трех заместителями, независимо выбранными из R10; и Z является связью, -NH- или -O-; предпочтительные значения для R3 такие, которые определены выше для формулы II. Группа формулы III может иметь S или R стереохимию в хиральном центре, к которому присоединен R3, или рацемат, но предпочтительно, чтобы стереохимия была такая, которая показана на частичной структуре Предпочтительным значением для Z является О. Предпочтительные значения R5 включают необязательно замещенный C1-C6Alk, особенно метил или необязательно замещенный метил. Предпочтительным значением для А' является группа формулы IV, определяющая соединение формулы Характерные значения для соединений формулы IV включают моноциклические фураны, в которыхRx является Н, C1-С 3 алкилокси, C1-С 3 прямым или разветвленным алкилом, необязательно замещенным галогеном, гидрокси, C1-С 3 алкокси. Характерные значения из данного списка включают такие, где Rx является Н или где Rx является C1-C3Alk, замещенным галогеном на 1 атоме углерода цепи, гидрокси или C1-C2Alk. Предпочтительные значения включают такие, где Rx является гидроксиметилом, 1 гидроксиэтилом, 1-гидроксипропилом, фторметилом, 1-фторэтилом или 1-фторпропилом, и такие, где Rx является метоксиметилом, этоксиметилом, 1-метоксиэтилом, 1-этоксиэтилом, 1-метоксипропилом или 1 этоксипропилом. Особенно предпочтительными соединениями формулы IV являются те, в которых n равно 1 и/или L является ОН. Альтернативно, Rx является дополнительным фуранильным или пиранильным кольцом, конденсированным с изображенным фураном, необязательно замещенным галогеном или C1-C3Alk. Характерные примеры включают группы, в которых гетероциклический атом кислорода расположен следующим образом: Что касается другого конечного амида, А", такого как определен выше, его выбирают из групп формулы V, VI, VII или VIII. Характерные значения для групп формулы VI, особенно если A' является группой формулы II, IV или бициклической кольцевой системой, включают группы формул Предпочтительные соединения данного варианта включают соединения формул VIa и VIb Другие предпочтительные соединения данного варианта включают соединения формул VIc и VId Особенно предпочтительными соединениями формул VIa, VIb, VIc и VId являются те, в которых n равно 1, R1 является фенилом и/или L является ОН. Подходящие стандартные блоки для получения соединения в соответствии с данным вариантом изобретения описаны в WO 99/48885 и WO 94/05639. Предпочтительно А" является группой формулы V, тем самым определяет соединение формулы Как указано выше, R8 является Н; или R8 является C1-C6Alk, С 0-С 3 алкандиилкарбоциклилом, С 0 С 3 алкандиилгетероциклилом, любой из которых необязательно замещен вплоть до трех заместителями,независимо выбранными из R11. Предпочтительно R8 является Н или необязательно замещенным C1C6Alk или необязательно замещенным С 0-С 3 алкандиилкарбоциклилом. Предпочтительным значением для R8 является Н или необязательно замещенный C1-C6Alk, особенно изопропил или трет-бутил.R8 необязательно замещен 1-3 заместителями, независимо выбранными из R11. Характерные необязательные заместители включают оксо, циано, C1-C3Alk или, особенно, галоген или Y-O-Ra, где Y является связью или C1-C3Alk и Ra является Н или C1-C3Alk. Как указано выше, R9 является C1-C6Alk, С 0-С 3 алкандиилкарбоциклилом, С 0-С 3 алкандиилгетероциклилом, любой из которых необязательно замещен вплоть до трех заместителями, независимо выбранными из R10; и W является связью, -NH- или -О-. Предпочтительно R9 является необязательно замещенным C1-C6Alk или С 0-С 3 алкандиилкарбоциклилом, особенно необязательно замещенным метилом или незамещенным метилом. Характерные необязательные заместители R9 включают галоген, оксо, циано, азидо, нитро, C1C6Alk, С 0-С 3 алкандиилкарбоциклил, С 0-С 3 алкандиилгетероциклил, Y-NRaRb или Y-O-Rb, где Y является связью или C1-C3Alk, Ra является Н или C1-C3Alk и Rb является Н или C1-C6Alk, С 0 С 3 алкандиилкарбоциклилом или С 0-С 3 алкандиилгетероциклилом. Особенно предпочтительные необязательные заместители, например, если R9 является метилом,включают галоген, оксо, C1-C6Alk, C0-С 3 алкандиилкарбоциклил, С 0-С 3 алкандиилгетероциклил или Y-ORb. Если А" является группой формулы V, предпочтительно, чтобы W являлся -О-. Группа формулы V может иметь S или R стереохимию в хиральном центре, к которому присоединен R8, или рацемат, но предпочтительно, чтобы стереохимия была такая, которая показана на частичной структуре Один из вариантов, в котором А" имеет формулу V, включает соединения, в которых R9 является необязательно замещенным гетероциклилом, либо непосредственно связанным с W (т.е. С 0), либо связанным с W через C1-С 3 алкандиильную цепь, например метиленовую цепь (т.е. C1). Предпочтительные соединения в соответствии с данным вариантом включают соединения, имеющие структуру в соответствии с формулами Va и Vb Особенно предпочтительными соединениями формул Va и Vb являются соединения, в которых n равно 1, R1 является фенилом и/или L является ОН. Подходящие стандартные блоки для получения соединения в соответствии с данным вариантом изобретения описаны здесь и в WO 98/00410 и WO 96/39398. Другой вариант, в котором А" является группой формулы V, включает соединения, в которых W является связью и R9 является С 0-С 3 алкандиилкарбоциклилом или С 0-С 3 алкандиилгетероциклилом, где карбоциклил и гетероциклил необязательно замещены. Предпочтительные соединения в соответствии с данным вариантом включают соединения, имеющие структуру в соответствии с формулами Vc и Vd Особенно предпочтительные соединения формулы Vc и Vd включают соединения, в которых n равно 1, R1 является фенилом и/или L является ОН. Подходящие стандартные блоки для получения соединения в соответствии с данным вариантом изобретения описаны здесь и в US 5196438. Если А" имеет формулу VII, предпочтительно, чтобы R8 был таким, как описан выше, и R9 являлсяC1-C6Alk, таким как метил. Предпочтительно А" имеет формулу VIII, тем самым определяя соединения формулы VIIIa Как описано выше, R15 является карбоциклилом или гетероциклилом, любой из которых необязательно замещен вплоть до трех заместителями, независимо выбранными из C1-C3Alk, гидрокси, оксо,галогена, Q является О, NR8 или связью и r и q независимо равны 0 или 1. Характерные значения для R15 включают 5-6-членные, необязательно замещенные, ароматические кольца, содержащие от 0 до 2 гетероатомов, где гетероатомы независимо выбирают из N, О и S. Предпочтительно необязательные заместители R15 включают C1-C3Alk, такой как метил, этил, про-8 013520 пил или изопропил. Характерные соединения для данного варианта данного изобретения включают те, в которых Q является связью и r и q оба равны нулю. Предпочтительными соединениями данного варианта являются те, которые имеют структуру в соответствии с формулами VIIIb и VIIIc Особенно предпочтительными соединениями формул VIIIb и VIIIc являются те, в которых n равно 1, R1 является фенилом и/или L является ОН. Подходящие стандартные блоки для получения соединения в соответствии с данным вариантом изобретения описаны здесь и в US 5484926 и US 5952343. Другие предпочтительные соединения, в которых А" имеет структуру формулы VIII, включают те,в которых Q является О. Предпочтительные соединения в соответствии с данным вариантом включают те, которые имеют структуры в соответствии с формулами VIIId, VIIIe, VIIIf и VIIIg Особенно предпочтительными соединениями формул VIIId, VIIIe, VIIIf и VIIIg являются соединения, в которых n равно 1, R1 является фенилом и/или L является ОН. Подходящие стандартные блоки для получения соединения в соответствии с данным вариантом изобретения описаны здесь и в WO 98/00410 и WO 96/39398. Другие предпочтительные соединения, в которых А" имеет структуру формулы VIII, включают те,в которых Q является CR8. Предпочтительные соединения в соответствии с данным вариантом включают те, которые имеют структуры в соответствии с формулами VIIIh и VIIIi Особенно предпочтительными соединениями формул VIIIh и VIIIi являются соединения, в которыхn равно 1, R1 является фенилом и/или L является ОН. Подходящие стандартные блоки для получения соединения в соответствии с данным вариантом изобретения описаны здесь и в US 6372905 и WO 97/21685. Подходящие промежуточные соединения, применяемые для синтеза соединений формулы (I), в которых n равно 0, включают эпоксиды, имеющие общую структуру, показанную ниже где А' и R1 такие, как определены выше. Другие промежуточные соединения, особенно применяемые для синтеза соединений формулы (I), в которых n равно 1, включают эпоксиды и спирты, имеющие структуры, показанные ниже"С 0-С 3 алкандиил-О-С 1-С 3 алкил" в данном описании включает C1-С 3 алкоксигруппы, такие как метокси, этокси, н-пропокси, изопропокси, связанные непосредственно (т.е. С 0) или через промежуточную метиленовую, этандиильную, 1,3-пропандиильную или 1,3-пропандиильную цепи."C1-C6Alk" в данном описании включает прямые и разветвленные алифатические углеродные цепи,содержащие от 1 до 6 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил,трет-бутил, пентил, изопентил и гексил, и их любые простые изомеры. Группа Alk может иметь ненасыщенную связь. Кроме того, любой атом С в C1-C6Alk может быть необязательно замещен одним, двумя или, где позволяет валентность, тремя атомами галогена и/или гетероатомами S, О, NH. Если гетероатом расположен на конце цепи, то он соответствующим образом замещен одним или 2 атомами водорода,например ОН или NH2. Предпочтительно C1-C6Alk является небольшим, насыщенным или ненасыщенным или замещенным галогеном, таким как фтор. C1-C4Alk и C1-C5Alk имеют значения, соответствующие C1-C6Alk, при необходимости скорректированные на количество атомов углерода. Me означает метильную группу."C1-C3Alk" в данном описании означает метил, этил, пропил, изопропил, циклопропил, любой из которых может быть необязательно замещен, как описано в предыдущем параграфе, или если он содержит С 2 или С 3, может иметь ненасыщенную связь, такую как СН=СН 2."С 0-С 3 алкандиил" в данном описании включает двухвалентные прямые и разветвленные алифатические углеродные цепи, такие как метилен, этандиил, 1,3-пропандиил, 1,2-пропандиил."Гало" или галоген в данном описании означает F, Cl, Br, I, особенно хлор и предпочтительно фтор."С 0-С 3 алкандииларил" в данном описании включает фенил, нафтил или фенил, конденсированный с С 3-С 7 циклопропилом, такой как инданил, где арил связан непосредственно (т.е. С 0) или через промежуточную метиленовую, этандиилильную, 1,2-пропандиильную или 1,3-пропандиильную группы, такие как определены для С 0-С 3 алкандиила выше. Если не указано иначе, арил и/или его конденсированная циклоалкильная группа необязательно замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6Alk, С 1-С 6 алкокси, С 1-С 6 алкокси-C1-C6Alk, С 1-С 6 алканоила, амино, азидо, оксо,меркапто, нитро, С 0-С 3 алкандиилкарбоциклила, С 0-С 3 алкандиилгетероциклила."С 0-С 3 алкандиилкарбоциклил" в данном описании включает С 0-С 3 алкандииларил и С 0 С 3 алкандиилС 3-С 7 циклоалкил. Если не указано иначе, арильная или циклоалкильная группа необязательно замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6Alk,C1-С 6 алкокси, С 1-С 6 алкокси-С 1-C6Alk, C1-С 6 алканоила, амино, азидо, оксо, меркапто, нитро, С 0 С 3 алкандиилкарбоциклила и/или С 0-С 3 алкандиилгетероциклила."С 0-С 3 алкандиилгетероциклил" в данном описании включает моноциклическое, насыщенное или ненасыщенное, содержащее гетероатом кольцо, такое как пиперидинил, морфолинил, пиперазинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазинолил, изотиазинолил, тиазолил, оксадиазолил, 1,2,3 триазолил, 1,2,4-триазолил, тетразолил, фуранил, тиенил, пиридил, пиримидинил, пиридазинил, пиразинил, пиразолил или любую подобную группу, конденсированное с фенильным кольцом, таким как хинолинил, бензмидазолил, бензоксазолил, бензизоксазолил, бензотиазинолил, бензизотиазинолил, бензотиазолил, бензоксадиазолил, бензо-1,2,3-триазолил, бензо-1,2,4-триазолил, бензотетразолил, бензофуранил,бензотиенил, бензопиридил, бензопиримидинил, бензопиридазинил, бензопиразинил, бензопиразолил и т.д., где кольцо связано непосредственно, т.е. (С 0) или через промежуточную метильную, этильную, пропильную или изопропильную группу, как определено для С 0-С 3 алкандиила выше. Любые подобные ненасыщенные кольца, имеющие ароматический характер, могут быть обозначены в данном описании как гетероарил. Если не указано иначе, гетеро кольцо и/или его конденсированная фенильная группа необязательно замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1C6Alk, С 1-С 6 алкокси, С 1-С 6 алкокси-C1-C6Alk, С 1-С 6 алканоила, амино, азидо, оксо, меркапто, нитро, С 0- 10013520 С 3 карбоциклила и/или С 0-С 3 гетероциклила. "Гетероциклил" и "гетероарил" имеют соответствующие значения, например, где отсутствует С 0-С 3 алкандиильная группа. Обычно термины "необязательно замещенный С 0-С 3 алкандиилкарбоциклил" и "необязательно замещенный С 0-С 3 алкандиилгетероциклил" относятся предпочтительно к замещению карбоциклического или гетероциклического кольца. Обычно гетероциклильные и карбоциклильные группы представляют собой моноциклическое кольцо, имеющее 5 и, особенно, 6 атомов в кольце, или бициклическую кольцевую структуру, содержащую 6-членное кольцо, конденсированное с 4-, 5- или 6-членным кольцом. Обычно такие группы включают С 3-С 8 циклоалкил, фенил, бензил, тетрагидронафтил, инденил, инданил, гетероциклил, такой как азепанил, азоканил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, пиперазинил, индолинил, пиранил, тетрагидропиранил, тетрагидротиопиранил, тиопиранил,фуранил, тетрагидрофуранил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, имидазолил, пиридил, пиримидинил, пиразинил, пиридазинил, тетразолил, пиразолил, индолил, бензофуранил, бензотиенил, бензимидазолил, бензтиазолил, бензоксазолил, бензизоксазолил, хинолинил, тетрагидрохинолинил,изохинолинил, тетрагидроизохинолинил, хиназолинил, тетрагидрохиназолинил и хиноксалинил, любой из которых может быть необязательно замещен так, как определено в данном описании. Таким образом, насыщенный гетероцикл включает радикалы, такие как пирролинил, пирролидинил, пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил, пиранил, тиопиранил,пиперазинил, индолинил, азетидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрофуранил,гексагидропиримидинил, гексагидропиридазинил, 1,4,5,6-тетрагидропиримидиниламин, дигидрооксазолил, 1,2-тиазинанил-1,1-диоксид, 1,2,6-тиадиазинанил-1,1-диоксид, изотиазолидинил-1,1-диоксид и имидазолидинил-2,4-дион, где ненасыщенный гетероцикл включает радикалы с ароматическим характером,такие как фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, индолизинил, индолил, изоиндолил. В каждом случае гетероцикл может быть конденсирован с фенильным кольцом с получением бициклической кольцевой системы. Соединения в соответствии с данным изобретением могут образовывать соли, которые являются дополнительным аспектом данного изобретения. Подходящие фармацевтически приемлемые соли соединений формулы I включают соли органических кислот, особенно карбоновых кислот, включая, но не ограничиваясь ими, ацетат, трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат,изетионат, адипат, альгинат, аспартат, бензоат, бутират, диглюконат, циклопентанат, глюкогептанат,глицерофосфат, оксалат, гептаноат, гексаноат, фумарат, никотинат, пальмоат, пектинат, 3 фенилпропионат, пикрат, пивалат, пропионат, тартрат, лактобионат, пиволат, камфорат, индеканоат и сукцинат, органических сульфоновых кислот, такие как метансульфонат, этансульфонат, 2 гидроксиэтансульфонат, камфорсульфонат, 2-нафталинсульфонат, бензолсульфонат, п-хлорбензолсульфонат и п-толуолсульфонат; и соли неорганических кислот, такие как гидрохлорид, гидробромид,гидройодид, сульфат, бисульфат, гемисульфат, тиоцианат, персульфат, соли фосфорной и сульфоновой кислот. Соединения формулы I в некоторых случаях могут быть выделены в виде гидрата. Должно быть понятно, что данное изобретение охватывает пролекарства, сольваты, комплексы и другие формы, выделяющие соединение формулы I in vivo. Хотя возможно, что активный агент вводится отдельно, предпочтительно, чтобы он вводился как часть фармацевтической композиции. Такая композиция содержит определенный выше активный агент вместе с одним или более приемлемыми носителями/наполнителями и, необязательно, другими терапевтическими ингредиентами. Носитель(и) должны быть приемлемыми с точки зрения совместимости с другими ингредиентами композиции, и не должны быть опасными для реципиента. Композиции включают формы, подходящие для ректального, назального, местного (включая буккальное и подъязычное), вагинального или парентерального (включая подкожное, внутримышечное,внутривенное и чрезкожное) введения, но предпочтительно композиция представляет собой композицию для перорального введения. Композиции предпочтительно могут быть в виде стандартных лекарственных форм, например таблеток и капсул с замедленным выделением, и могут быть получены любыми способами, хорошо известными в области фармацевтики. Такие способы включают стадию соединения определенного выше активного агента с носителем. В общем, композиции получают однородным и тщательным смешиванием активного агента с жидкими носителями или тонкоизмельченными твердыми носителями, или обоими, и затем, при необходимости,приданием продукту формы. Данное изобретение включает способы получения фармацевтической композиции, включающие смешивание соединения формулы I или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем или наполнителем. Если получение фармацевтических композиций включает тщательное смешивание фармацевтических наполнителей и активного ингредиента в виде соли, то часто является предпочтительным применять наполнители, которые являются не основными по природе, т.е. либо кислыми, либо нейтральными. Композиции для перорального введения в соответствии с данным изобретением могут присутствовать в виде отдельных форм, таких как капсулы, облаток или таблеток, каждая из которых содержит пре- 11013520 допределенное количество активного агента; в виде порошка или гранул; в виде раствора или суспензии активного агента в водной жидкости или не водной жидкости; или в виде жидкой эмульсии масло в воде или жидкой эмульсии вода в масле и в виде болюсов и т.д. Что касается композиций для перорального введения (например, таблеток и капсул), термин подходящий носитель включает носители, такие как известные наполнители, например связующие агенты,например сироп, аравийскую камедь, желатин, сорбит, трагакант, поливинилпирролидон (повидон), метилцеллюлозу, этилцеллюлозу, карбоксиметилцеллюлозу натрия, гидроксипропилметилцеллюлозу, сахарозу и крахмал; наполнители и носители, например кукурузный крахмал, желатин, лактозу, сахарозу,микрокристаллическую целлюлозу, каолин, маннит, фосфат дикальция, хлорид натрия и альгиновую кислоту; и смазывающие агенты, такие как стеарат магния, стеарат натрия и стеараты других металлов,стеарат глицерина стеариновой кислоты, силиконовое масло, тальковые воски, масла и коллоидную двуокись кремния. Вкусовые агенты, такие как перечная мята, масло зимолюбки, вишневая вкусовая добавка или подобные также могут применяться. Может быть желательным добавлять краситель для того,чтобы лекарственная форма легко идентифицировалась. Таблетки также могут иметь оболочку, нанесенную способами, известными в данной области техники. Таблетка может быть получена прессованием или формованием, необязательно с одним или более дополнительными ингредиентами. Прессованные таблетки могут быть получены прессованием в подходящей машине активного агента в сыпучей форме, такой как порошок или гранулы, необязательно в смеси со связующим агентом, смазывающим агентом, инертным разбавителем, консервантом, поверхностноактивным или диспергирующим агентом. Формованные таблетки могут быть получены формованием в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки необязательно могут иметь оболочки или насечки и могут быть получены таким образом,чтобы обеспечивать замедленное или контролируемое выделение активного агента. Другие композиции, подходящие для перорального введения, включают лепешки, содержащие активный агент в ароматном основании, обычно сахарозе и аравийской камеди или трагаканте; пастилки,содержащие активный агент в инертном основании, таком как желатин и глицерин, или сахароза и аравийская камедь; и полоскания для рта, содержащие активный агент в подходящем жидком носителе. Подходящая доза зависит от показаний и пациента, и легко может быть определена с применением обычных метаболизма и фармакокинетики лекарственного средства (DMPK) у животных или клинических исследований и программного обеспечения для прогнозирования in silico. Для лечения ВИЧ соединения формулы I обычно вводят в количестве, достаточном для достижения уровня в плазме от около 100 до 5000 нМ, например от 300 до 2000 нМ. Это соответствует дозировке, в зависимости от биодоступности композиции, порядка 0,01-10 мг/кг/день, предпочтительно от 0,1 до 2 мг/кг/день. Обычный интервал дозирования для нормального взрослого человека составляет от около 0,05 до 5 г в сутки, предпочтительно от 0,1 до 2 г, например 500-750 мг, от одного до четырех раз в день. Как и для других фармацевтических средств, дозировки зависят от размера и обмена вещества у пациента, а также от тяжести инфекции и могут быть скорректированы в зависимости от сопутствующего лечения. В общем, подходят дозы от около 3 мг до приблизительно 1,6 г на человека в сутки, разделенные на 1-3 приема. Обычная дозировка для взрослого человека составляет 50-800, более предпочтительно 400600, дважды или более предпочтительно один раз в сутки. Как более подробно описано ниже, ингибиторы ВИЧ обычно вводят совместно, в стандартной лекарственной форме, с другими ингибиторами ВИЧ или агентами, модифицирующими метаболизм, и режим дозирования (QQ, BiD TiD, на голодный желудок/с пищей и т.д.) для таких совместно вводимых лекарственных средств, конечно, делает необходимым соответствующую корректировку режима дозирования для соединений формулы I. Как принято на практике прописывания антивирусной терапии, соединения формулы I обычно вводят совместно с другими терапиями ВИЧ для избежания образования устойчивых к лекарственным средствам мутантов. Однако определенные антифективы могут вызывать синергетическую реакцию, что позволяет вводить один или оба активных ингредиента в меньшей дозе, по сравнению с соответствующей монотерапией. Например, для лекарств, способных ускорять метаболизм посредством Сур 3 А 4, совместное дозирование с ингибитором протеазы ВИЧ ритонавиром позволяет снижать режим дозирования при введении. Соединение в соответствии с данным изобретением и каждый из представленных ниже противовирусных агентов обычно вводят совместно в молярных соотношениях, отражающих их соответствующие активность и биодоступность. Обычно такое соотношение составляет порядка от 25:1 до 1:25,относительно соединения формулы I, но могут быть меньше, например в случае применения антагонистов цитохрома, таких как ритонавир. Характерные противовирусные агенты ВИЧ включают NRTI, такие как аловудин (FLT), зудовудин(AZT, ZDV), ставудин (d4T, Zerit), залцитабин (ddC), диданозин (ddI, Videx), абакавир (ABC, Ziagen),ламивудин (3 ТС, Epivir), эмтрицитабин (FTC, Emtriva), рацевир (рацемический FTC), адефовир (ADV),энтакавир (BMS 200475), аловудин (FLT), тенофовир дизопроксил фумарат (TNF, Viread), амдоксавирJohnson), TMC-125 (R-16335; JohnsonJohnson), UC-781 (Biosyn Inc.), и YM215389 (Yamanoushi). Характерные ингибиторы протеазы ВИЧ включают РА-457 (Panacos), КРС-2 (Kucera Pharm.), 5(BMS), GS224338 (Gilead Sciences), KNI-272 (Nippon Mining Holdings), Nar-DG-35 (Narhex), P(PL)-100 (P1946; Procyon Biopharma), P-1946 (Procyon Biopharma), R-944 (Hoffmann-LaRoche), RO-0334649 (Hoffmann-LaRoche), TMC-114 (JohnsonJohnson), VX-385 (GW640385; GSK/Vertex), VX-478 (Vertex/GSK). Другие противовирусные агенты ВИЧ включают ингибиторы входа, включая ингибиторы сшивания, ингибиторы рецептора CD4, ингибиторы корецептора CCR5 и ингибиторы корецептора CXCR4, или их фармацевтически приемлемые соли или пролекарства. Примеры ингибиторов входа включают AMD070 (AMD11070; AnorMed), BlockAide/CR (ADVENTRX Pharm.), BMS 806 (BMS-378806; BMS), Enfurvirtide (T-20, R698, Fuzeon), KRH1636 (Kureha Pharmaceuticals), ONO-4128 (GW-873140, AK-602, E-913;Schering-Plough), T-1249 (R724; Roche/Trimeris), TAK-220 (Takeda Chem. Ind.), TNX-355 (Tanox) и UK427,857 (Pfizer). Примеры ингибиторов интегразы включают L-870810 (MerckCo.), c-2507 (MerckCo.) и S(RSC)-1838 (shionogi/GSK). Многие пациенты с ВИЧ также инфицированы другими инфекционными заболеваниями или подвержены суперинфекциям. Следовательно, другой аспект данного изобретения относится к комбинированным терапиям,включающим соединение в соответствии с данным изобретением, объединенное в одной лекарственной форме или в одной упаковке по крайней мере с одним другим противомикробным лекарственным средством. Соединение в соответствии с данным изобретением и, по крайней мере, одно другое противомикробное средство вводятся одновременно или последовательно, обычно в дозах, соответствующих дозам при монотерапии для соответствующих агентов. Обычные соинфекции или суперинфекции включают вирус гепатита В (ВГВ) или вирус гепатита С(ВГС). Следовательно, соединение в соответствии с данным изобретением преимущественно вводят совместно (либо в одной лекарственной форме, либо в одной упаковке, либо в виде отдельно прописанных лекарственных форм) по крайней мере с одним анти-ВГС и/или анти-ВГВ агентом. Следовательно, соединение в соответствии с данным изобретением преимущественно вводят совместно (либо в одной лекарственной форме, либо в одной упаковке, либо в виде отдельно прописанных лекарственных форм) по крайней мере с одним анти-ВГС и/или анти-ВГВ агентом. Примеры анти-ВГВ агентов включают ламивудин и 2'3'-дидеокси-3'-фторгуанозин (FLG) и его пролекарства, такие как 5'-О-лацитлвалиловое пролекарство MIV-210. Эти анти-ВГВ агенты особенно предпочтительны, так как они одновременно действуют против ВГВ и ВГС. Примеры анти-ВГС агентов для совместного введения с соединением формулы I включают иммунные модификаторы, такие как рибавирин или интерфероны, ингибиторы нуклеозида полимеразы ВГС или ингибиторы протеазы ВГС, многие из которых в настоящее время находятся в разработке. Полагают, что соединения в соответствии с данным изобретением препятствуют повышению уровней ЛПНП-холестерина или триглицеридов, часто возникающему в качестве побочного эффекта при применении ингибиторов протеазы ВИЧ известного уровня техники. Следовательно, соединения в соответствии с данным изобретением применяют для замены таких ингибиторов известного уровня техники в проводящихся режимах дозирования у пациентов. Обычно такие пациенты проходили или проходят противоретровирусную терапию одним или более обычными ингибиторами протеазы ВИЧ и имеют повышенные уровни ЛПНП-холестерина и/или триглицеридов в плазме. Такие другие ингибиторы протеазы ВИЧ могут даваться в виде монотерапии или как часть противоретровирусной терапии, которая также включает одно или более другие антиретровирусные лекарственные средства, такие как ингибиторы обратной транскриптазы или ингибиторы ненуклеозидной обратной транскриптазы. Такие пациенты, хотя у них может наблюдаться удовлетворительное подавление вирусов, имеют повышенный риск возникновения гиперлипидемии и преждевременного инфаркта миокарда. Термин повышенные уровни ЛПНП-холестерина и/или триглицеридов в плазме в данном описании основан на нормативах клинической практики Национальной Программы по холестериновому образованию (NCEP), направленной на профилактику и управление высокими уровнями холестерина у взрослых. В последних нормативах, изданных в 2001 г., уровни в плазме 130 мг/дл ЛПНП-холестерина и- 13013520 150 мг/дл триглицеридов считаются повышенными или высокими. Способ в соответствии с данным изобретением особенно полезен для тех пациентов, которые имеют уровни триглицеридов в плазме 200 мг/дл, и для тех пациентов, которые, при отсутствии факторов риска или преждевременного инфаркта миокарда, имеют уровни ЛПНП-холестерина 160 мг/дл. Определение повышенных уровней ЛПНП-холестерина и триглицеридов, конечно, может измениться в будущем, так как NCEP продолжает оценивать факторы риска сердечного приступа. Это значит,что термин повышенные уровни ЛПНП-холестерина и/или триглицеридов в данном описании будет согласоваться с текущими нормативами NCEP. В одном из аспектов данное изобретение включает прекращение приема провоцирующих (лекарственные средства, вызывающие повышенные уровни ЛПНП-холестерина и/или триглицеридов в плазме) ингибиторы протеазы ВИЧ из указанного выше режима и замену их таким количеством соединения формулы I, которое эффективно для ингибирования ВИЧ и снижения уровней ЛПНП-холестерина и/или триглицеридов в плазме. Применяемая доза соединения в соответствии с данным изобретением зависит от таких факторов,как масса тела, возраст и индивидуальное состояние лечимого пациента и способ введения. Полагают, что соединения в соответствии с некоторыми вариантами данного изобретения могут в некоторых композициях благоприятно взаимодействовать с монооксигеназой цитохрома Р 450 и могут улучшать фармакокинетику лекарственных средств, усвоенных этим ферментом, включая особенно другие ингибиторы протеазы ВИЧ, такие как саквинавир, индинавир, нелфинавир, арапренавир, типанавир и лопинавир. Таким образом, они могут действовать таким же образом, как и ритонавир, описанный в патенте США 6037157, на повышение уровней в крови вводимого совместно ингибитора протеазы ВИЧ. Подходящим образом и в противоположность ритонавиру полагают, что соединение в соответствии с данным изобретением может применяться в комбинированной терапии с другими ингибиторами протеазы ВИЧ в обычной терапевтической дозе, вместо субтерапевтической дозы, применяемой для ритонавира. Любой такой потенцирующий эффект на другие ингибиторы протеазы ВИЧ, которые усваиваются монооксигеназой цитохрома Р 450, позволяет применение соединений в соответствии с данным изобретением одновременно с другими ингибиторами протеазы ВИЧ, тем самым позволяя снижать применяемые дозы таких других ингибиторов протеазы ВИЧ при сохранении той же степени подавления вируса. Предположительно соединение в соответствии с данным изобретением может применяться в сочетании с другими ингибиторами протеазы ВИЧ для снижения уровней ЛПНП-холестерина и триглицеридов у пациентов со СПИД, проходящих лечение ингибитором протеазы при сохранении желаемого уровня подавления вируса. Подходящие дозы ингибитора протеазы ВИЧ, объединенного с соединениями в соответствии с данным изобретением, могут быть определены следующим способом, который применяют для сочетания атазанавир/саквинавир, описанным в WO 03020206. Атазанавир представляет собой умеренный ингибитор фермента цитохрома Р 450 3 А, сопоставимый с нелфинавиром и индинавиром с Ki 2,4 мкМ. Два последние соединения увеличивают воздействие саквинавира, дозированного при 1200 мг три раза в сутки(ТРС) на 392 и 364% соответственно при устойчивом состоянии. Были проведены исследования фармакологии при многократном дозировании для оценки того, может ли ожидаться похожее увеличение для сочетания атазанавира и саквинавира. Это исследование показало более чем 3-кратное увеличение воздействия благодаря сочетанию с атазанавиром при дозировании 1200 мг саквинавира один раз в сутки,что эквивалентно применяемому в настоящее время режиму дозирования саквинавира 1200 мг ТРС. Применяя постоянную дозу атазанавира изучали интервал дозирования саквинавира, который позволяет получить такое воздействие саквинавира (ППК (площадь под кривой) и CMIN (минимальная концентрация, которое описано в литературе. Таким же образом могут быть рассчитаны подходящие дозы других ингибиторов протеазы ВИЧ, применяемых в сочетании с соединением в соответствии с данным изобретением. Соединения в соответствии с данным изобретением обычно синтезируют, как показано ниже. Способ получения соединений в соответствии с данным изобретением, в которых Е является N и n равно 0 путем взаимодействия подходящего эпоксида с желаемым производным гидразида, показан на схеме 1. Подходящее производное малоновой кислоты (1 а), где R1 такой, как описан выше, может быть превращено в производное акриловой кислоты (1b) с применением реакции Манниха с последующим декарбоксилированием in situ. Различные производные малоновой кислоты доступны коммерчески или могут быть легко получены специалистом в данной области техники по методикам, описанным в литературе. Затем акриловая кислота может быть соединена с желаемым амином А'-NH2, где А' такой, как определен выше, с применением стандартных условий пептидного сочетания с использованием гидрохлорида 1-(3 диметиламинопропил)-3-этилкарбодиимида (EDAC), N-метилморфолина (NMM) и 1-гидроксибензотриазола (НОВТ), или любых других подходящих условий, которые известны специалисту в данной области техники, с получением производного акриламида (1 с). Эпоксидирование двойной связи любым подходящим способом, таким как применение перекиси, например, 3-хлорпербензойной кислоты(mCPBA) дает соответствующий эпоксид (1d). Последующее раскрытие полученного эпоксида подходящим гидразидом (1 е), необязательно в присутствии изопропилата титана(IV), как описано в JOC, 50,1985, стр. 1557, дает третичный спирт (1f). При желании, полученная гидроксигруппа затем может быть превращена во фторид или первичный или вторичный амин с получением соединений общей формулы I,в которых n равно 0, X является Н, Е является N и L является F, NHC1-С 3 алкилом или N(C1-С 3 алкилом)2,как показано на схеме 2 ниже. Схема 2 Взаимодействие спирта (1f) с подходящим фторирующим агентом, таким как DAST или Deoxofluor,или подобными, в растворителе, таком как дихлорметан, как описано, например, у Singh, R.P. and Shreve,J.M. in Synthesis, 17, 1999, p. 2561-2578, дает соответствующее соединение фтора (2 а). Альтернативно, гидроксигруппа спирта (1f) может быть перенесена в амин с применением любого подходящего способа, описанного в литературе. Например, может применяться методика Мицунобу, т.е. взаимодействие спирта (1f) с азодикарбоксилатом, таким как DIAD или подобные, в присутствии трифенилфосфина, с последующим замещением желаемым амином с получением соответствующего производного амино (2b). Альтернативный способ получения амина (2b) включает превращение гидроксигруппы в уходящую группу, такую как производное сульфоновой кислоты, такое как мезилат, трифлат,тозилат или подобные, обработкой подходящим сульфонилирующим агентом в растворителе, например пиридине или дихлорметане, необязательно в присутствии триэтиламина или подобного, с последующим замещением уходящей группы желаемым первичным или вторичным амином NH2C1-C3 алкилом илиNH(C1-С 3 алкилом)2. Альтернативно, уходящая группа может быть замещена азидом или гидроксигруппа может быть превращена в азид с применением азидного агента переноса, такого как дифенилфосфорилазид (DPPA) с последующим восстановлением введенного азида до амина с применением, например трифенилфосфина, необязательно в присутствии основания, такого как триэтиламин, с получением соединений, в которых L является NH2, в то время как восстановительное аминирование полученного амина желаемым альдегидом или кетоном дает вторичные или третичные амины.- 15013520 Описанные выше промежуточные соединения, например эпоксид 1d, в котором А' и R1 такие, как определены выше, являются новыми и составляют другой аспект данного изобретения. Различные амины, А'-NH2, применяемые на схеме 1, доступны коммерчески или, альтернативно,они могут быть получены по методикам, известным в литературе. Например, амины, в которых А' соответствует формуле (IV), могут быть получены, как описано у В. Samuelsson et al., в Bioorg.Med.Chem., 11,2003, p. 1107-1115. Альтернативно, они могут быть получены из соответствующих спиртов А'-ОН превращением гидроксигруппы в аминогруппу. Это превращение может быть достигнуто любым подходящим методом, известным специалисту в данной области техники, например превращением гидроксигруппы в уходящую группу, такую как галогенид, такой как бромид, хлорид или йодид, или в производное сульфоновой кислоты, такое как мезилат, трифлат или тозилат, с последующим нуклеофильным замещением путем взаимодействия с азидом, и, наконец, восстановлением азида до амина с применением любого подходящего способа восстановления, такого как каталитическое гидрирование. Подходящие спирты описаны, например, у А.K.Gosh et al. в J.Med.Chem., 1996, 39, 3278-3290. Другая альтернатива получения аминов, А'-NH2, где А' соответствует формуле (IV), описана на схеме 3. Схема 3 Добавление бромида и пропаргилоксигруппы к двойной связи ненасыщенного кольца (3 а) проводят, например, взаимодействием с N-бромсукцинимидом и пропаргиловым спиртом с последующим восстановительным замыканием кольца, активированным гидридом три-н-бутилолова в присутствии радикального инициатора, например 1,1'-азобис(изобутиронитрила) или подобного с получением бициклического олефина (3 с). Затем экзоциклическая двойная связь может быть окислительно расщеплена при помещении соединения олефина в подходящие условия окисления, такие как обработка тетроксидом осмия в сочетании с периодатом натрия, что дает кето производное (3d). Реакция полученной кетогруппы с Обензилгидроксиламином с последующим восстановлением восстанавливающим агентом, таким как алюмогидрид лития, дает соответствующий амин (3f) в виде рацемической смеси. Затем рацемическая смесь может быть отделена по методикам, известным в данной области техники. Например, диастереомерная смесь, которая может быть разделена хроматографическими методами, может быть получена сочетанием хирального вспомогательного соединения, такого как хиральная аминокислота, например Boc-Lфенилаланин, с применением стандартных методов пептидного сочетания. Разделение смеси и последующее отщепление вспомогательной аминокислоты дает чистые диастереомеры желаемого амина (3f). Пример получения производных амина А'-NH2, применяемых, среди прочего, на схеме 1, где А' соответствует формуле (II), показан на схеме 4 ниже. Схема 4 Сочетание подходящим образом N-защищенной, например Вос-защищенной, аминокислоты (4 а),имеющей желаемую побочную цепь R3 с производным амино (4b), где R3 и R4 такие, как определены выше, с применением стандартных условий пептидного сочетания, таких как применение реагентов, таких как EDAC, NMM и НОВТ, в инертном растворителе, таком как диметилформамид, дает амид (2 Вс). Удаление N-защитной группы кислой обработкой для защитной группы Boc, например, с применением трифторуксуной кислоты в дихлорметане, дает амин (4d). Аминокислоты (4 а), применяемые на указанной выше схеме, являются коммерчески доступными или могут быть получены по методикам, описанным в литературе. Способ получения аминокислот, имеющих разветвленную боковую цепь, показан на схеме 4 А. Обработка аминокислоты (4 Аа), проведенная, как описано у Rapoport et al. в J. Org. Chem., 55,(1990), p. 5017-5025, с одним или двумя последовательными добавлениями основания, такого как бис(триметилсилил)амид калия (KHMDS) и метилйодида, дает моно- или диметилированную аминокислоту(4Ab) соответственно. Восстановление сложного эфира боковой цепи с применением реагента, такого как DIBAL, с последующей перестановкой PhF1 группы и Boc группы, проведенной путем каталитического гидрирования в присутствии Boc2O и катализатора, такого как Pd/C, дает спирт (4 Ас). При желании гидроксигруппа полученного спирта может быть далее метилирована, например, обработкой подходящим метилирующим агентом, таким как метилйодид, и основанием, таким как NaH, что дает соединение метокси (4 Ае). Альтернативно, спирт может быть превращен в соответствующее фторсоединение(4Ad) обработкой фторирующим агентом, таким как DAST или подобные, или любым другим подходящим методом фторирования, описанным здесь или в других источниках. Амины A'-NH2, где А' соответствует формуле (III), могут быть получены, как показано на схеме 5. Схема 5 Реакция природной или не природной аминокислоты (5 а), имеющей подходящую боковую цепь R3,такую как определена выше, с желаемым ацилирующим агентом; хлорформиатом (i) для получения соединений, в которых W является О, хлорангидридом (ii) для получения соединений, в которых W является связью, или изоцианатом (iii) для получения соединений, в которых W является NH, дает кислоту (5b). Амин A'-NH2 (5d) может быть получен превращением кислоты (5b) в соответствующий первичный амид(5 с), например, обработкой раствором аммиака в присутствии изобутилхлорформиата и Nметилморфолина в растворителе, таком как диметоксиэтан, с последующей реакцией перегруппировки путем обработки [бис(трифторацетокси)йод]бензолом, необязательно в присутствии пиридина, как описано у, например, J-A. Fehreentz в J. Med. Chem., 2003, 46, 1191-1203. Производные гидразида (1 е), применяемые на схеме 1, могут быть получены взаимодействием кислоты А"СООН или ее производного, например хлорангидрида или ангидрида кислоты, с гидразиномR2CH2NHNH2 в стандартных условиях пептидного сочетания. На схеме 6 показан пример, в котором А" в кислоте, А"СООН, соответствует формуле (V), такой как определена выше. Схема 6 Реакция природной или неприродной аминокислоты (6 а), имеющей подходящую боковую цепь R8,- 17013520 такую как определена выше, с желаемым ацилирующим агентом, как описано на схеме 3, дает кислоту(6b). Производное гидразида (6d) затем может быть получено сочетанием производного гидразина (6 с),которое либо коммерчески доступно, либо описано в литературе, с применением стандартных условий пептидного сочетания, как описано выше. Соединения, в которых А" соответствует формуле (VII), могут быть получены описанным выше методом, но с применением подходящего сульфонилирующего агента, такого как алкилсульфонилхлорид,R9-S(=O)2Cl, в присутствии основания, такого как гидроксид натрия, вместо любого из описанных ацилирующих агентов i, ii или iii в реакции с аминокислотой 3 а. Гидразиды (1 е), в которых А" соответствует формуле (VI), могут быть получены взаимодействием подходящего электрофильного соединения карбонила, такого как хлорформиат или активированный карбонат, с производным гидразина R2CH2NHNH2, как показано на схеме 7. Схема 7 Спирт (7 а) может быть превращен в соответствующий активированный карбонат (7b) или хлорформиат взаимодействием гидроксигруппы с подходящим ацилирующим агентом, таким как карбонат, такой как карбонат дипиридила или хлорформиат паранитрофенила, необязательно в присутствии основания,такого как триэтиламин или имидазол, или в хлорформиат взаимодействием с фосгеном, необязательно в присутствии основания, такого как гидрокарбонат натрия. Полученное электрофильное соединение затем может быть подвергнуто взаимодействию с желаемым производным гидразина (7 с) с получением соответствующего гидразида (7d). Спирт (7 а) является либо коммерчески доступным, либо может быть получен, как описано у A.K. Ghosh et al. в J.Med.Chem., 1996, 39, 3278-3290. Методика, описанная на схеме 7, также может применяться к другим спиртам, например, необязательно замещенному карбоциклилметанолу, необязательно замещенному гетероциклилметанолу, необязательно замещенному карбоциклоспирту или необязательно замещенному гетероциклоспирту с получением гидразидов, в которых А" соответствует формуле (VIII), такой как определена выше. Способ получения соединений общей формулы I, в которых Е является N и n равно 1, изображен на схеме 8. Схема 8 Конденсация -бутиролактона (8 а) с подходящим альдегидом (8b) в присутствии основания, такого как трет-бутоксид калия, в инертном растворителе, таком как бензол, дихлорметан или подобные, дает олефиновое соединение (8 с). Затем может быть проведено эпоксидирование двойной связи, например, с применением mCPBA в присутствии каталитического количества радикального инициатора, такого какAIBN или подобные, что дает эпоксид (8d). Восстановительное размыкание эпоксида, например, каталитическим гидрированием в присутствии катализатора, такого как Pt(IV)O или подобные, с последующим размыканием кольца лактона с желаемым амином, А'-NH2, дает диол (8f). Окисление первичного спирта любым подходящим способом окисления, таким как, например, применением периодината ДессаМартина, дает альдегид (8g), который затем может быть подвергнут взаимодействию с подходящим производным гидразида (8h) в реакции восстановительного аминирования с применением восстановительного агента, такого как NaCNBH4, с получением гидразида (8i). N-Заместитель CH2-R2 затем может быть введен алкилированием -азота гидразида желаемым алкилирующим агентом (8j), где R2 такой, как оп- 18013520 ределен выше, и X является уходящей группой, такой как галогенид, такой как хлорид, бромид или йодид, или производное сульфоновой кислоты, такое как трифлат, мезилат или тозилат, с получением Nалкилированного соединения (8k). Указанный выше способ синтеза также может проводиться, начиная с-пропиолактона с получением соединений общей формулы I, в которых n равно 0. N-Алкилированный гидразид (8k) также может быть получен более прямо взаимодействием альдегида (8g) с уже Nалкилированным производным гидразина, таким как соединение 3d со схемы 3. Указанные выше промежуточные соединения, такие как эпоксид 8d и спирт 8 е, в которых R1 такой,как определен выше, являются новыми соединениями и составляют другой аспект данного изобретения. При желании, гидроксигруппа соединения (8k) может быть превращена во фторид или первичный или вторичный амин с получением соединений общей формулы I, в которых n равно 1, X является Н, Е является N и L является F, NHC1-С 3 алкилом или N(C1-С 3 алкилом)2, как показано на схеме 9 ниже. Схема 9and Shreve, J.M. in Synthesis, 17, 1999, p. 2561-2578, дает соответствующее соединение фтора (9 а). Альтернативно, гидроксигруппа соединения 8k может быть перенесена в амин с применением любого подходящего способа, описанного в литературе. Например, может применяться методика Мицунобу, т.е. взаимодействие спирта (8k) с азодикарбоксилатом, таким как DIAD или подобные, в присутствии трифенилфосфина, с последующим замещением желаемым амином с получением соответствующего производного амино (9b). Альтернативный способ получения амина (9b) включает превращение гидроксигруппы в уходящую группу, такую как производное сульфоновой кислоты, такое как мезилат, трифлат, тозилат или подобные, обработкой подходящим сульфонилирующим агентом в растворителе, например, пиридине или дихлорметане, необязательно в присутствии триэтиламина или подобного, с последующим замещением уходящей группы желаемым первичным или вторичным амином NH2C1C3 алкилом или NH(C1-С 3 алкилом)2. Альтернативно, уходящая группа может быть замещена азидом или гидроксигруппа может быть превращена в азид с применением азидного агента переноса, такого как дифенилфосфорилазид (DPPA) с последующим восстановлением введенного азида до амина с применением, например, трифенилфосфина, необязательно в присутствии основания, такого как триэтиламин, с получением соединений, в которых L является NH2, в то время как восстановительное аминирование полученного амина желаемым альдегидом или кетоном дает вторичные или третичные амины. Дигидроксилированные или дифторированные соединения, в которых n равно 1, Е является N и X =L = ОН или F, общей формулы I, могут быть получены, как изображено на схеме 10. Производное олефина (10 а) может быть получено из спирта (8f), полученного, как описано на схеме 8, превращением первичного спирта в уходящую группу, такую как мезилат или подобные, с последующей реакцией удаления, проведенной, например, путем обработки основанием, таким как трет-BuOK ИЛИ DBU в растворителе, таком как ДМСО, ДМФ или дихлорметан, необязательно в присутствии краунэфира. Полученное ненасыщенное соединение (10 а) затем может быть эпоксидировано обработкой подходящим окисляющим реагентом, таким как mCPBA или BuOOK или подобные, в растворителе, таком как дихлорметан, с получением эпоксида (10b). Размыкание эпоксида желаемым производным гидразида, как описано на схеме 1, дает диол (10d). Альтернативно, дигидроксилирование двойной связи в олефине (10 а) может быть проведено, например, обработкой окислительной системой, такой как OsO4 иNMMO или подобные, что дает триол (10 с). Превращение первичного спирта в уходящую группу, как описано выше, с последующей реакцией замещения желаемым производным гидразида, дает дигидроксигидразид (10d). При желании две гидроксигруппы могут быть превращены во фториды методом фторирования, известным в данной области техники, например, с применением фторирующего агента, такого как DAST, Deoxofluor или подобные, как описано у Rajendra et al. в Synthesis 17, 2002, p. 2561-2578, с получением дифторгидразида (10 е). Соединения общей формулы I, в которых n равно 1, Е является N, X является ОН и L является F,NH(C1-С 3 алкилом) или N(C1-С 3 алкилом)2, могут быть получены, как показано на схеме 11. Схема 11 Превращение первичного спирта 8f, полученного, как показано на схеме 8, в уходящую группу, такую как производное сульфоновой кислоты, такое как мезилат, трифлат, тозилат или подобные, обработкой подходящим сульфонилирующим агентом в растворителе, таком как, например, пиридин или дихлорметан, необязательно в присутствии триэтиламина или подобного, с последующей реакцией удаления, проведенной, например, путем обработки основанием, таким как трет-BuOK или DBU, в растворителе, таком как ДМСО, ДМФ или дихлорметан, необязательно в присутствии краун-эфира, или в любых- 20013520 других подходящих условиях удаления. Гидроксигруппа полученного ненасыщенного соединения (11b) затем может быть превращена во фторид, например, реакцией с подходящим фторирующим агентом,таким как DAST, или Deoxofluor, или подобными, в растворителе, таком как дихлорметан, как описано,например, у Singh, R.P. and Shreve, J.M. in Synthesis, 17, 1999, p. 2561-2578, что дает соответствующее фторсоединение (11 с). Альтернативно, гидроксигруппа соединения (11b) может быть перенесена в амин любым подходящим методом, описанным в литературе. Например, может применяться методика Мицунобу, т.е. взаимодействие спирта (11b) с азодикарбоксилатом, таким как DIAD или подобным, в присутствии трифенилфосфина, с последующим замещением желаемым амином с получением соответствующего производного амино (11 с). Альтернативный способ получения амина (11 с) включает превращение гидроксигруппы в уходящую группу, такую как производное сульфоновой кислоты, такое как мезилат,трифлат, тозилат или подобные, обработкой подходящим сульфонилирующим агентом в растворителе,например пиридине или дихлорметане, необязательно в присутствии триэтиламина или подобного, с последующим замещением уходящей группы желаемым первичным или вторичным амином NH2C1C3 алкилом или NH(C1-С 3 алкилом)2. Альтернативно, уходящая группа может быть замещена азидом или гидроксигруппа может быть превращена непосредственно в азид с применением азидного агента переноса, такого как дифенилфосфорилазид (DPPA) с последующим восстановлением введенного азида до амина с применением, например, трифенилфосфина, необязательно в присутствии основания, такого как триэтиламин, с получением соединений, в которых L является NH2, в то время как восстановительное аминирование полученного амина желаемым альдегидом или кетоном дает вторичные или третичные амины. Дальнейшая обработка соединения олефина (11 с), как описано для соединения 10 а на схеме 10, например, либо эпоксидирование двойной связи с последующим взаимодействием с желаемым производным гидразида, либо дигидроксилирование двойной связи с последующим мезилированием, замещением и, наконец, взаимодействием с желаемым производным гидразида, дает производное гидразида (11d). При желании, гидроксигруппа соединения 11d может быть превращена во фторид обработкой DAST или подобным, как описано выше, с получением соединений общей формулы I, в которых X является F. Способ получения соединений общей формулы I, в которых n равно 1, Е является N, X является F иL является ОН, F, NH(C1-С 3 алкилом) или N(C1-С 3 алкилом)2, показан на схеме 12. Схема 12 Размыкание эпоксида (10b) с применением фторирующего агента, такого как (HF)x/пиридин, как описано у Baklouti, A. et al. в Synthesis 1999, p. 85-89, или (изо-PrO)2TiF2-ET4NF-nHF, как описано у Hara,S. et al. в Tetrahedron 55, 1999, p. 4947-4954, или любым другим подходящим фторирующим агентом дает фторгидрин (12 а). Превращение первичной гидроксигруппы в уходящую группу, такую как производное сульфоновой кислоты, такое как мезалит, трифлат, тозилат или подобные, обработкой подходящим сульфонилирующим агентом в растворителе, таком как, например, пиридин или дихлорметан, необязательно в присутствии триэтиламина или подобного, с последующей реакцией с желаемым производным гидразида дает гидразид (12b). При желании гидроксигруппа гидразида (12b) может быть превращена во фторид обработкой DAST или подобным, с получением соединений общей формулы I, в которых L является F, или гидроксигруппа может быть превращена в амин, например, реакцией Мицунобу, обработкой желаемым амином в присутствии DIAD или подобного, или превращением гидроксигруппы в азид с последующим восстановлением азида до амина, с получением соединений общей формулы I, в которых L является NH2, или полученный амин может быть подвергнут реакции восстановительного аминирования с желаемым альдегидом или кетоном, как описано выше, с получением соединений общей формулы I, в которых L является замещенным амином. Соединения общей формулы I, в которых L является F, X является C1-С 3 алкилом, n равно 1 и Е является N, могут быть получены, как показано на схеме 13. Эпоксидирование соединения олефина (11 с), полученного, как показано на схеме 11, взаимодействием с подходящим окисляющим агентом, таким как mCPBA или трет-BuOOK или подобные, в растворителе, таком как дихлорметан, дает эпоксид (13 а). Алкилированное соединение (13b) может быть получено региоселективным размыканием эпоксида с применением, например, алюминиевого реагента, такого как (алкил)2AlOAlалкил или (алкил)3Al, в присутствии воды или в растворителе, таком как дихлорметан, как описано, например, у Maruoka, K. et al. в Tetrahedron Lett., 40, 1999, p. 5369-5372, или с применением алкилтитанового реагента, как описано у Tanaka, Т. et al. в Tetrahedron Lett., 45, 2004, p. 75-78. Превращение полученного первичного спирта в уходящую группу, такую как галогенид, такой как хлор,фтор или йод, или в производное сульфоновой кислоты, такое как мезалит, трифлат, тозилат или подобные, обработкой подходящим сульфонилирующим агентом в растворителе, таком как, например, пиридин или дихлорметан, необязательно в присутствии триэтиламина или подобного, с последующим взаимодействием с желаемым производным гидразида, необязательно в присутствии основания, такого какEt3N, трет-BuOK или подобные, дает гидразид (13d). Синтез гидразидов (8h) описан в литературе, см., например, J.Med.Chem. 1998, 41, р. 3387, общий пример которого показан на схеме 14. Схема 14 Коммерчески доступный трет-бутилкарбазат (14 а) может быть подвергнут сочетанию с кислотой(14b), где А" такой, как определен выше, реакцией пептидного сочетания с применением стандартной методики с получением соответствующего Вос-защищенного гидразида (14 с). Удаление группы Boc с применением стандартных условий, таких как обработка кислотой, например ТФК в дихлорметане, дает незащищенный гидразид (8h). Соединения общей формулы I, в которых Е является СН и n равно 0 или 1, могут быть получены,как описано на схеме 15. Схема 15- 22013520 Альдегид (15b) может быть получен обработкой желаемой аминокислоты или производного гомоаминокислоты (15 а) до N,O-диметилгидроксиламина в условиях пептидного сочетания, таких как присутствие EDAC, НОВТ, триэтиламина или подобного, с последующим восстановлением полученного амида Вейнреба восстанавливающим агентом, таким как LiAlH4. Сочетание полученного альдегида с фосфонатом (15 с) реакцией Хорнера-Эммонса, как описано, например, у A. Nadine et al. в Bioorg.Med.Chem.Lett.,2003, 13, 37-41, дает алкен (15 е). Затем двойная связь может быть эпоксидирована с применением, например, mCPBA, и полученный эпоксид (15f) размыкают восстановительным гидрированием в присутствии катализатора, такого как Pt(IV)O, как описано на схеме 8. Последующее сочетание оставшихся фрагментов, А и А', таких как определены для общей формулы I, с применением стандартных методов пептидного сочетания, например удаления группы Boc, сочетания кислоты А"СООН с последующим гидролизом сложной эфирной группы и сочетания амина A'-NH2, дает амид (15h). Соединения, в которых А" соответствует формуле (VI), получают взаимодействием N-незащищенного производного (15g) с активированным карбонатом или хлорформиатом желаемого производного, полученным, как описано на схеме 4, вместо кислоты А"-СООН. Гидроксигруппа соединения (15h) затем может быть превращена во фторид или первичный или вторичный амин с получением соединений общей формулы I, в которых X является Н, Е является CH, L является F, NHC1-С 3 алкилом или N(C1-С 3 алкилом)2, как показано на схеме 16 ниже. Схема 16and Shreve, J.M. in Synthesis, 17, 1999, p. 2561-2578, дает соответствующее соединение фтора (16 а). Альтернативно, гидроксигруппа соединения 15h может быть перенесена в амин с применением любого подходящего способа, описанного в литературе. Например, может применяться методика Мицунобу, т.е. взаимодействие спирта (15h) с азодикарбоксилатом, таким как DIAD или подобным, в присутствии трифенилфосфина, с последующим замещением желаемым амином с получением соответствующего производного амина (16b). Альтернативный способ получения амина (16b) включает превращение гидроксигруппы в уходящую группу, такую как производное сульфоновой кислоты, такое как мезилат, трифлат, тозилат или подобные, обработкой подходящим сульфонилирующим агентом в растворителе, например пиридине или дихлорметане, необязательно в присутствии триэтиламина или подобного, с последующим замещением уходящей группы желаемым первичным или вторичным амином NH2C1-С 3 алкилом или NH(C1 С 3 алкилом)2. Альтернативно, уходящая группа может быть замещена азидом, или гидроксигруппа может быть превращена в азид с применением азидного агента переноса, такого как дифенилфосфорилазид(DPPA), с последующим восстановлением введенного азида до амина с применением, например, трифенилфосфина, необязательно в присутствии основания, такого как триэтиламин, с получением соединений, в которых L является NH2, в то время как восстановительное аминирование полученного амина желаемым альдегидом или кетоном дает вторичные или третичные амины. Дигидроксилированные или дифторированные соединения, в которых Е является СН и X = L = ОН или F и n равно 0 или 1, общей формулы I, могут быть получены, как изображено на схеме 17. Гидролиз эпоксида (15f), полученного, как показано на схеме 15, может быть проведен с применением любой подходящей методики, известной в данной области техники, например, такой как помещение эпоксида в кислые условия, такие как обработка протоносодержащей кислотой, например разбавленной хлорной кислотой, серной кислотой или муравьиной кислотой, или кислотой Льюиса, такой какBiCl3, в растворителе, таком как тетрагидрофуран или подобные, что дает диол (17 а). Последующее сочетание кислоты А"-СООН и амина А'-NH2, как описано на схеме 15, дает дигидроксиамид (17b). При желании две гидроксигруппы могут затем быть превращены во фториды с применением фторирующего агента, такого как DAST, Deoxofluor или подобный, с получением дифторгидразида (17 с). Способ получения соединений общей формулы I, в которых Е является СН, X является ОН, L является F и n равно 0 или 1, показан на схеме 18. Схема 18 Размыкание эпоксида (15f) с применением фторирующего агента, такого как (HF)x/пиридин, как описано у Baklouti, A. et al. в Synthesis 1999, p. 85-89, или (изо-PrO)2TiF2-ET4NF-nHF, как описано у Hara,S. et al. в Tetrahedron 55, 1999, p. 4947-4954, или любым другим подходящим фторирующим агентом,дает фторгидрин (18 а). Последующее сочетание в любом подходящем порядке кислоты А"-СООН и амина А'-NH2, как описано на схеме 7, дает фторгидрин (18d). При желании, гидроксигруппа любого из соединений 18 а, 18b или 18 с может быть превращена во фторид обработкой DAST или подобным, как описано выше, с получением альтернативного способа получения соединений общей формулы I, в которыхX и L являются F. Соединения общей формулы I, в которых Е является CH, L является ОН, F, NH(C1-С 3 алкилом) илиN(C1-С 3 алкилом)2, X является C1-С 3 алкилом и n равно 0 или 1, показан на схеме 19. Схема 19- 24013520 Алкилирование эпоксида (15f), полученного, как показано на схеме 15, с применением медьорганического реагента, такого как диалкилкупрат лития, в растворителе, таком как диэтиловый эфир, или ТГФ,или подобный, дает алкилированное соединение (19 а). Сочетание кислоты А"-СООН и амина А'-NH2 в любом подходящем порядке, как описано на схеме 15, дает производное гидразида (19b). При желании,гидроксигруппа соединения 19b может быть превращена во фторид обработкой DAST или подобными, с получением соединений общей формулы I, в которых L является F, или гидроксигруппа может быть превращена в амин, например, реакцией Мицунобу, обработкой желаемым амином в присутствии DIAD или подобного, или превращением гидроксигруппы в азид с последующим восстановлением азида до амина,с получением соединений общей формулы I, в которых L является NH2, или полученный амин может быть подвергнут восстановительному аминированию с желаемым альдегидом или кетоном, как описано выше, с получением соединений общей формулы I, в которых L является замещенным амином. Альтернативный способ получения соединений, в которых Е является СН и n равно 1, показан на схеме 20. Схема 20 Производное брома (20b) может быть получено из подходящего алкилированного производного малоната (20 а) методом гидролиза-восстановления с последующим превращением полученного первичного спирта в бромид, как описано у Jew et al. в Heterocycles, 46, 1997, p. 65-70. Алкилированные производные малоната либо коммерчески доступны, либо получают алкилированием диэтилмалоната желаемым алкилирующим агентом по методикам, описанным в литературе, хорошо известным специалистам в данной области техники. Третичный спирт полученного производного брома (20b) необязательно может быть защищен, например, ацетатом, что достигается обработкой уксусным ангидридом в пиридине или подобным и последующим сочетанием с медь-цинковым реагентом (20d), полученным из природной или не природной аминокислоты, как описано у Dudu et al. в Tetrahedron 50, 1994, p. 2415-2432, с получением соединения (20 е). Оставшиеся фрагменты А" и А', такие как определены для общей формулы I, затем могут быть введены, как описано на схеме 15. Замещение группы R2 в любом из описанных выше соединений желаемой группой с применением любого подходящего способа, известного из литературы, может быть проведено на любой подходящей стадии синтеза. Способ, в котором гетероарильную группу добавляют к арильной группе, представлен на схеме 21. Схема 21 Арильная группа соединения (21 а) может быть замещена, например, арильной или гетероарильной группой, такой как пиридильная группа, взаимодействием производного три-н-бутилолова желаемого заместителя в реакции сочетания с применением палладиевого(0) реагента, такого как Pd(PPh3)2Cl2 или подобного, в присутствии CuO в растворителе, таком как диметилформамид, при повышенной температуре, вызванной, например, нагреванием микроволнами. Должно быть понятно, что методика, описанная на схеме 21, не ограничивается только пиридильными группами, но также применима к другим, необязательно замещенным, алкильным, арильным или гетероарильным группам. Также должно быть понятно, что другие методы, многие из которых широко описаны в литературе, могут применяться для замещения R2 группы. Общий способ получения соединений формулы I, в которых n равно 2 и Е является N, показан на схеме 22. Две гидроксигруппы желаемой 3-замещенной 2-гидроксипропионовой кислоты (22 а) могут быть защищены в виде циклического ацеталя взаимодействием кислоты с подходящим ацетализирующим агентом, таким как 2,2-диметоксипропан или 2-метоксипропен, в кислых условиях, получаемых, например, в присутствии каталитического количества тозилата пиридиния (PPTS), pTS, CSA или подобных,что дает циклический ацеталь (22b). Последующее добавление метилакрилата по Майклу к полученному ацеталю в присутствии основания, такого как LDA или подобные, дает -алкилированное соединение(22 с). Гидролиз ацеталя и замыкание кольца полученного промежуточного спирта путем обработки кислотой, такой как ТФК, при повышенной температуре, дает лактон (22d). Сочетание амина A'-NH2 с применением стандартных условий пептидного сочетания, таких как применение реагентов, таких какEDAC, HOBt и, необязательно, основания, такого как триэтиламин или подобных, и последующее восстановительное размыкание лактона с применением восстанавливающего агента, такого как LiBN4 или подобные, дает диол (22f). Производное гидразида (22g) затем может быть получено с применением любого метода, описанного выше. Например, может применяться последовательность окислительновосстановительного аминирования, описанная, кроме прочего, на схеме 8, т.е.первичную гидроксигруппу окисляют до альдегида с применением любого удобного окисляющего агента, такого как, например, периодинан Десса-Мартина, с последующей реакцией аминирования с желаемым производным гидразида в присутствии подходящего восстанавливающего агента, такого как Na(OAc)3BH или подобных. Альтернативно, гидразидная группа может быть введена реакцией замещения, как описано, кроме прочего, на схеме 10, т.е. первичный спирт переносят к уходящей группе, такой как мезилат или подобные, с последующим замещением уходящей группы желаемым производным гидразида. При желании гидрокси заместитель гидразида (22g) может быть превращен в аминовый или фторный заместитель с применением любой из описанных выше методик с получением соединений общей формулы (I), в которых L являетсяF, NH2, NHC1-С 6 алкилом или N(С 1-С 6 алкилом)2, X является Н, n равно 2 и Е является N. Как понятно специалисту в области органического синтеза, стадии синтеза при получении соединений формулы I могут осуществляться в другом порядке, где это применимо. Например, заместитель-СН 2-R2 атома азота гидразида в соединениях, где Е является N, может быть введен с применением замещенного производного гидразида, как показано на схеме 1, или, альтернативно, может применяться незамещенное или, необязательно, временно N-защищенное производное гидразида и заместитель N вводится после, как описано на схеме 8. Также должно быть понятно, что введение амино и кислых производных, например, на схемах 18 и 19, может быть осуществлено в обратном порядке, т.е. кислоту А"СООН сочетают до амина A'-NH2. Любые функциональные группы, присутствующие в любых из составляющих соединений, применяемых при получении соединений в соответствии с данным изобретением, подходящим образом замещены там, где это необходимо. Например, функциональные группы природных или не природных аминокислот обычно защищены, как это принято в пептидном синтезе. Специалист в данной области техники поймет, что выбор и применение подходящих защитных групп зависит от условий реакции. Подходящие защитные группы описаны в Greene, "Protective Groups in Organic Synthesis", John WileySons, NewYork (1981) и "The Peptides: Analysis, Synthesis, Biology", Vol. 3, Academic Press, New York (1981), описание которых включено сюда в качестве ссылок. Подробное описание Различные варианты соединений в соответствии с данным изобретением и ключевые промежуточные соединения для получения таких соединений далее описаны с целью иллюстрации в прилагаемых не ограничивающих химических и биологических примерах. Химия. Общая информация. Аналитическую ОФ-ЖХ-МС проводят на ВЭЖХ системе Gilson с квадрополярным масс- 26013520 спектрометром Finnigan AQA с применением колонки Chromolith Performance RP-18 е 4,6100 мм (MerckKGaA), с MeCN в 0,05% водной НСООН в качестве подвижной фазы, при скорости потока 4 мл/мин. Препаративную ОФ-ЖХ-МС проводят на ВЭЖХ системе Gilson с квадрополярным масс-спектрометромFinnigan AQA с применением колонки Zorbax SB-C8, 5 мкм 21,2150 мм (Agilent technologies), с MeCN в 0,05% водной НСООН в качестве подвижной фазы, при скорости потока 15 мл/мин. Вращение плоскости поляризации света получают на поляриметре Perkin-Elmer 241, конкретные вращения ([]D) указаны в/дм, и концентрация (с) дана в г/100 мл в определенном растворителе. 1 Н и 13 С ЯМР спектры записывают на инструменте Varian Mercury Plus при 300 и 75,45 МГц или 399,78 и 100,53 МГц соответственно. Химические сдвиги записаны как значения(ч./млн), косвенно относящиеся к TMS через остаточный сигнал растворителя. Флэш-хроматографию на колонке проводят на Merck силикагеле 60 (40-63 мкм) или Merck силикагеле 60 ОФ-18 (40-63 мкм). Аналитическую тонкослойную хроматографию проводят с применением алюминиевых пластин, предварительно покрытых силикагелем 60 F254, УФ-лучей и этанольного раствора фосфомолибденовой кислоты с последующим нагреванием визуализированных компонентов. Элементный анализ проводят в Analytische Laboratorien, Lindlar, Germany. Пример 1. 2-Бензил-N-[(1S,2R)-2-гидроксииндан-1-ил]акриламид (1). 2-Бензилакриловую кислоту (J. Organomet., Chem. 646, 212-222, 2002) (2,72 г, 16,8 ммоль) растворяют в EtOAc (50 мл) и добавляют EDAC (3,54 г, 18,5 ммоль), НОВТ (2,49 г, 18,4 ммоль) и NMM (2,21 мл, 20,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют (1S,2R)-1-амино-2-инданол (2,75 г, 18,4 ммоль) и перемешивание продолжают в течение ночи. Промывание насыщенной NaHCO3 (водн.) и насыщенным раствором соли с последующей сушкой(Na2SO4) и выпариванием органического растворителя дает неочищенный продукт, который подвергают хроматографии на колонке (двуокись кремния, EtOAc/пентан, 40:60-50:50) с получением соединения 2(3,34 г, 68%) в виде белого твердого вещества. Амид (2S)-2-бензилоксиран-N-[(1S,2R)-2-гидроксииндан-1-ил]-2-карбоновой кислоты S)-3) (2a) и амид (2R)-2-бензилоксиран-N-[(1S,2R)-2-гидроксииндан-1-ил]-2-карбоновой кислоты R)-3) (2b). Соединение 1 (1,57 г, 5,36 ммоль) растворяют в CH2Cl2 (30 мл) и добавляют mCPBA (77%, 2,40 г,10,7 ммоль). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 48 ч, охлаждают и промывают 10% Na2S2O3 (водн.), насыщенным NaHCO3 (водн.) и насыщенным раствором соли. Органическую фазу сушат (Na2SO4), фильтруют и выпаривают, затем неочищенный продукт очищают хроматографией на колонке (двуокись кремния, EtOAc/пентан, 40:60-100:0) с получением двух диастереомерных эпоксидов; 2 а (0,414 г) в виде бледно-желтого твердого вещества и 2b (0,460 г) в виде белого твердого вещества с общим выходом 53%. 2 а: Rf = 0,58 (EtOAc/пентан 50:50); []D19 -60,1 (с 1,00, CHCl3); 1- 27013520 1,14, 5,04, 9,23 Гц, 1 Н), 4,43 (ддд, J=1,33, 4,97, 5,04 Гц, 1 Н), 3,73 (д, J=14,5 Гц, 1 Н), 3,07 (м, 1 Н), 3,00 (д,J=5,09 Гц, 1 Н), 2,93 (д, J=5,09 Гц, 1 Н), 2,84 (м, 1 Н), 2,75 (д, J=14,5 Гц, 1 Н); 13 С ЯМР (CD3OD/CDCl3 1:1+2 капли D2O)171,3, 141,1, 140,6, 136,7, 130,5, 129,0, 128,5, 127,6,127,5, 125,6, 124,7, 73,3, 60,8, 57,4, 53,4, 40,5, 37,8; МС (m/z 310, М + Н+, 619); анал. (C19H19NO3) С, Н, N. Общая методика получения гидразидов Бензилгидразин 2HCl и Et3N в EtOAc (20 мл) перемешивают в течение 30 мин при комнатной температуре и затем добавляют к раствору N-функционализированной аминокислоты (ниже), EDAC, НОВТ и NMM в EtOAc (40 мл), после чего реакционную смесь перемешивают в течение ночи при комнатной температуре. Разбавление EtOAc, промывание насыщенным NaHCO3 (водн.), Н 2 О и насыщенным раствором соли с последующей сушкой (Na2SO4), фильтрацией и концентрацией органической фазы в вакууме дает неочищенный продукт, который очищают хроматографией на колонке (двуокись кремния,CHCl3/MeOH, 100:0-95:5). Пример 3. Бензиловый эфир [(1S)-1-(N'-бензилгидразинокарбонил)-2-метилпропил]карбаминовой кислоты (3). Применяют описанную выше общую методику получения гидразидов с применением Cbz-(L)валина (0,540 г, 2,15 ммоль), EDAC (0,450 г, 2,35 ммоль), НОВТ (0,320 г, 2,37 ммоль), NMM (0,260 мл,2,36 ммоль), бензилгидразина 2HCl (0,500 г, 2,56 ммоль) и Et3N (0,710 мл, 5,09 ммоль), что дает указанное в заголовке соединение (0,502 г, 66%) в виде белого твердого вещества.(4). Применяют описанную выше общую методику получения гидразидов с применением Cbz-(L)-третлейцина (2,00 г, 4,48 ммоль), EDAC (0,969 г, 5,05 ммоль), НОВТ (0,669 г, 4,95 ммоль), NMM (0,542 мл,4,93 ммоль), бензилгидразина 2HCl (0,962 г, 4,93 ммоль) и Et3N (1,38 мл, 9,85 ммоль), что дает указанное в заголовке соединение (1,11 г, 67%) в виде твердого вещества с низкой температурой плавления. Метиловый эфир [(1S)-1-(N'-бензилгидразинокарбонил)-2-метилпропил]карбаминовой кислоты (5). Применяют описанную выше общую методику получения гидразидов с применением N(метоксикарбонил)-(L)-валина (J. Med. Chem., 39, 3203-3216, 1996) (2,11 г, 12,0 ммоль), EDAC (2,41 г,12,6 ммоль), НОВТ (1,70 г, 12,6 ммоль), NMM (1,38 мл, 12,6 ммоль), бензилгидразина 2HCl (2,45 г, 12,6 ммоль) и Et3N (3,52 мл, 25,0 ммоль), что дает указанное в заголовке соединение (2,08 г, 65%) в виде светло-желтого твердого вещества.(6). Применяют описанную выше общую методику получения гидразидов с применением N(метоксикарбонил)-(L)-трет-лейцина (J. Med. Chem., 41, 3387-3401, 1998) (1,56 г, 8,24 ммоль), EDAC(1,61 г, 8,25 ммоль) и Et3N (2,53 мл, 18,0 ммоль), что дает указанное в заголовке соединение (1,21 г, 50%) в виде светло-желтого твердого вещества. Сульфонамид N-[(1S)-1-(N'-бензилгидразинокарбонил)-2,2-диметилпропил]метана (7). Раствор хлорида метансульфонила (0,593 мл, 7,62 ммоль) в 1 М NaOH (7,60 мл, 15,2 ммоль) и ТГФ(10 мл) по каплям добавляют к перемешиваемой смеси (L)-трет-лейцина (1,0 г, 7,6 ммоль), растворенного в ТГФ (7,6 мл) и Н 2 О (12 мл) при температуре 0 С. Реакционную смесь перемешивают при температуре 0 С в течение 3 ч, затем при комнатной температуре в течение ночи. Смесь подкисляют 4 М HCl и экстрагируют EtOAc. Органическую фазу отделяют, сушат (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением (2S)-2-метансульфониламино-3,3-диметилмасляной кислоты (0,486 г,30%), которую анализируют ЯМР и затем применяют без дальнейшей очистки. Затем применяют описанную выше общую методику получения гидразидов с применением неочищенной (2S)-2 метансульфониламино-3,3-диметилмасляной кислоты (0,476 г, 2,27 ммоль), EDAC (0,481 г, 2,51 ммоль),НОВТ (0,338 г, 2,50 ммоль), NMM (0,275 мл, 2,50 ммоль), бензилгидразина 2HCl (0,489 г, 2,51 ммоль) иEt3N (0,700 мл, 4,98 ммоль), что дает указанное в заголовке соединение (0,416 г, 58%) в виде белого твердого вещества.(L)-трет-лейцин (0,500 г, 3,81 ммоль) растворяют в диоксане (23 мл) и добавляют 2 М NaOH (6,3 мл,12,6 ммоль). После перемешивания в течение 10 мин по каплям добавляют фенилизоцианат (0,900 мл,7,29 ммоль) с получением прозрачного раствора. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и затем подкисляют добавлением концентрированной HCl и затем экстрагируютEtOAc. Органическую фазу сушат и выпаривают с получением (2S)-2-(3-бензилуреидо)-3,3 диметилмасляной кислоты (0,36 г, выход 36%), которую анализируют ЯМР и затем применяют без дальнейшей очистки. Затем применяют описанную выше общую методику получения гидразидов с применением неочищенной (2S)-2-(3-бензилуреидо)-3,3-диметилмасляной кислоты (0,646 г, 2,44 ммоль), EDAC(0,528 г, 2,71 ммоль) и Et3N (0,753 мл, 5,38 ммоль). Продукт фильтруют через короткую колонку с силикагелем (CHCl3/MeOH, 100:0-95:5) и затем применяют без дальнейшей очистки на следующей стадии.(1,11 мл, 10,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют 4-бромбензилгидразин (полученный как описано в Zh. Org. Khim., 28, 43-50, 1992) (2,31 г, 11,5 ммоль) в EtOAc (20 мл), и перемешивание продолжают в течение ночи. Реакционную смесь промывают насыщенным NaHCO3 (водн.), Н 2 О и насыщенным раствором соли и затем органическую фазу сушат (Na2SO4), фильтруют и выпаривают. Неочищенный продукт очищают хроматографией на колонке(двуокись кремния, CHCl3/MeOH, 100:0-96:4) с получением указанного в заголовке соединения (1,85 г,54%) в виде белого твердого вещества.Cbz-(L)-валин (1,04 г, 4,14 ммоль) растворяют в EtOAc (50 мл) и добавляют EDAC (0,870 г, 4,54 ммоль), НОВТ (0,610 г, 4,51 ммоль) и NMM (0,500 мл, 4,55 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют 4-бромбензилгидразин (1,00 г, 4,97 ммоль) в EtOAc (5 мл) и перемешивание продолжают в течение 2 ч. После выпаривания растворителя добавляют CHCl3 и раствор промывают насыщенным NaHCO3 (водн.) и насыщенным раствором соли с последующей сушкой (Na2SO4), фильтрацией и выпариванием органического растворителя. Неочищенный продукт очищают хроматографией на колонке (двуокись кремния, CHCl3/MeOH, 100:0-95:5) с получением указанного в заголовке соединения (1,42 г, 79%) в виде белого твердого вещества.[]D21 +6,2 (с 0,47, ДМФ); 1 Н ЯМР (ДМСО-d6 + 2 капли D2O)7,53-7,18 (м, 9 Н), 4,98 (с, 2 Н), 3,79 (с, 2 Н), 3,69 (д, J=7,65 Гц,1 Н), 1,80 (м, 1H), 0,75 (д, J=6, 92 Гц, 3 Н), 0,72 (д, J=6,92 Гц, 3 Н); 13 С ЯМР (ДМСО-d6 + 2 капли D2O)170,8, 156,6, 138,8, 137,7, 131,6, 131,4, 129,0, 128,5, 128,3,120,6, 66,1, 59,5, 54,2, 30,8, 19,7, 19,0; MC (m/z 434, M + Н+, 436, М + Н+); анал. (C20H24BrN3O3) С, Н, N. Общие методики синтеза ингибиторов Способ А. Эпоксид 2 а или 2b и гидразид растворяют в iPrOH (6 мл) и реакционную смесь перемешивают при температуре 80 С в течение указанного времени. Выпаривание растворителя дает неочищенный продукт, который очищают, как описано ниже. Способ В. Эпоксид 2 а или 2b и гидразид растворяют в сухом ТГФ (30 мл) и добавляют Ti(OiPr)4 в атмосфере N2. Перемешивают при комнатной температуре в течение 2,5 ч и затем при температуре 40 С в течение 30 мин с последующим добавлением насыщенного NaHCO3 (водн.) и Et2O, и полученную смесь перемешивают при комнатной температуре в течение 10 мин. Фильтрование и разделение двух фаз, сушка органической фазы (Na2SO4) и выпаривание дает неочищенный продукт, который очищают хроматографией на колонке (ОФ-двуокись кремния, MeCN/H2O, 50:50-90:10). Пример 11.
МПК / Метки
МПК: C07D 261/08, C07D 333/58, C07D 241/12, C07C 311/06, C07D 213/42, A61K 31/18, C07C 275/24, A61K 31/325, C07D 317/58, C07C 271/22, A61K 31/17
Метки: вич, протеазы, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-13520-ingibitory-proteazy-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы протеазы вич</a>
Предыдущий патент: Противобактериальный или педикулоцидный препарат, содержащий аллицин
Следующий патент: Производные тетрагидроиндазолона
Случайный патент: Щеточный модуль для щеточной шлифовальной машины