Ингибиторы протеазы вич
Номер патента: 2378
Опубликовано: 25.04.2002
Авторы: Рейх Зигфрид, Зханг Канйин Е., Варни Майкл Д., Кобаяси Такуо, Альбицати Ким Ф.
Формула / Реферат
1. Соединение формулы
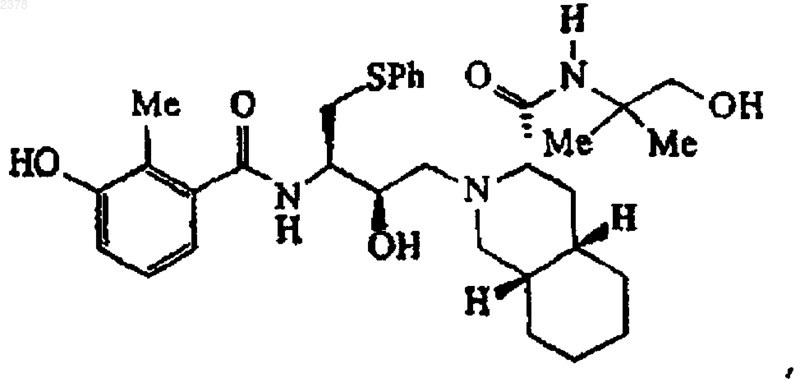
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, обладающее чистотой более 90%.
3. Соединение по п.1, обладающее чистотой, по крайней мере, 95%.
4. Соединение по п.1, обладающее чистотой, по крайней мере, 97%.
5. Соединение по п.1, обладающее чистотой, по крайней мере, 99%.
6. Фармацевтическая композиция для лечения ВИЧ инфекции, содержащая эффективное количество соединения или его соли или сольвата по п.1 и фармацевтически приемлемый носитель.
7. Фармацевтическая композиция по п.6, где соединение или его соль или сольват обладают чистотой более 90%.
8. Фармацевтическая композиция по п.6, где соединение или его соль или сольват обладают чистотой, по крайней мере, 95%.
9. Фармацевтическая композиция по п.6, где соединение или его соль или сольват обладают чистотой, по крайней мере, 97%.
10. Фармацевтическая композиция по п.6, где соединение или его соль или сольват обладают чистотой, по крайней мере, 99%.
Текст
1 Предпосылки и сущность изобретения Данное изобретение относится к новому ряду химических соединений, применяемых в качестве ингибиторов протеазы ВИЧ и к применению таких соединений в качестве противовирусных средств. Синдром приобретенного иммунодефицита (СПИД) является относительно недавно обнаруженным заболеванием или состоянием. СПИД вызывает последовательное разрушение иммунной системы также, как и прогрессирующее нарушение функций центральной и периферической нервной системы. Со времени описания первых случаев заболевания в начале 1980-х годов ВИЧ-инфекция широко распространилась и к настоящему времени достигла эпидемиологических значений в сравнительно ограниченных слоях населения. Интенсивные исследования привели к открытию возбудителя,Т-лимфотропного ретровируса человека III(HTLV-III), в настоящее время, как правило,обозначаемого как вирус иммунодефицита человека, или ВИЧ. ВИЧ является членом класса вирусов, известного как ретровирусы. Геном ретровируса состоит из РНК, которая транскрибируется в ДНК посредством обратной транскрипции. Затем данная ДНК ретровируса устойчиво интегрируется в хромосому клетки-хозяина, используя репликативные процессы клетки-хозяина,продуцируя новые ретровирусные частицы и осуществляя дальнейшее инфицирование других клеток. Представляется возможным, что ВИЧ имеет особенное сродство к человеческим лимфоцитам Т-4, играющим жизненно важную роль в иммунной системе. Поражение ВИЧ данных клеток белой крови истощает данную клеточную популяцию. В конечном итоге, иммунная система становится недейственной и неэффективной против различных оппотунистических заболеваний, таких как, среди прочих,пневмония, вызванная pneumocystic carini, саркома Капоши и злокачественные опухоли лимфотической системы. Несмотря на то, что точный механизм формирования и деятельности ВИЧ не изучен,идентификация вируса привела к определенному прогрессу в лечении заболевания. Например,было обнаружено, что лекарственное средство азидотимидин (АЗТ) эффективно в ингибировании обратной транскрипции ретровирусного генома ВИЧ, таким образом обеспечивая частичное лечение, хотя и не полное излечение больных СПИД. Продолжается поиск лекарственных препаратов, способных излечивать или,по крайней мере, обеспечивать более эффективное лечение смертельной до сих пор ВИЧинфекции. Репликация ретровируса определенно отображает посттрансляционный процессинг полипептидов. Данный процессинг осуществляется кодируемым вирусом ферментом протеазой 2 ВИЧ. Это приводит к образованию зрелых полипептидов, которые последовательно присоединяются в формирование и фукционирование инфицирующего вируса. Если данный молекулярный процессинг будет заингибирован, будет остановлена нормальная продукция ВИЧ. Таким образом, ингибиторы протеазы ВИЧ могут функционировать в качестве противовирусных анти-ВИЧ средств. Протеаза ВИЧ является одним из продуктов трансляции гена роl структурного белка ВИЧ. Данная ретровирусная протеаза специфически расщепляет другие структурные полипептиды в отдельных сайтах для высвобождения данных активированных структурных белков и ферментов, таким образом придавая вириону способность к репликации. Ингибирование протеазы ВИЧ сильнодействующими соединениями, как таковое, может предотвратить интеграцию провируса в инфицированных Тлимфоцитах в течение ранней фазы жизненного цикла ВИЧ-1 равно как и подавлять протеолитический процессинг вируса из поздней стадии. К тому же ингибиторы протеазы могут обладать преимуществом большей доступности для считывания, более продолжительного периода жизни в вирусе и меньшей токсичности, чем имеющиеся в настоящее время лекарственные средства, возможно в связи со своей специфичностью к протеазе ретровируса. В соответствии с данным изобретением,которое относится к новому классу соединений,способных ингибировать и/или блокировать активность протеазы ВИЧ, которые останавливают пролиферацию ВИЧ, фармацевтическим композициям, содержащим данные соединения,и применение указанных соединений в качестве ингибиторов протеазы ВИЧ. Настоящее изобретение относится к соединениям, определяемым приведенной ниже формулой 9, и фармацевтически приемлемым солям, пролекарствам и их сольватам, которые ингибируют протеазу, кодируемую вирусом иммунодефицита человека (ВИЧ) 1 типа (ВИЧ 1) или 2 типа (ВИЧ-2). Данные соединения применимы для лечения ВИЧ-инфекции и для лечения синдрома приобретенного иммунодефицита(СПИД). Соединения, их фармацевтически приемлемые соли и фармацевтические композиции по настоящему изобретению могут быть применены отдельно или в комбинации с другими противовирусными препаратами, иммуномодуляторами, антибиотиками или вакцинами. Соединения по настоящему изобретению также могут применяться в качестве пролекарств. Описаны способы лечения СПИД, способы лечения ВИЧ-инфекции и способы ингибирования протеазы ВИЧ. Соединения по настоящему изобретению описываются формулой 9 где R и R' выбирают независимо из Н, замещенной или незамещенной алкил-OR1 группы, циклоалкильной группы,замещеннойR1 представляет собой Н, замещенную или незамещенную алкильную группу или ацильную группу;R2 и R3 независимо выбирают из Н, замещенного или незамещенного алкила, циклоалкила, гетероцикла и арильных групп и ацильных и сульфонильных групп;R4 представляет собой Н, замещенный или незамещенный алкил, циклоалкил, гетероцикл или арильную группу и каждый из Х и Y отсутствует или представляет собой =O; или фармацевтически приемлемое пролекарство, соль или его сольват. Предпочтительно в соединениях формулы 9 R представляет собой Н. Более предпочтительно R представляет собой Н, а R' представляет собой циклоалкильную группу, выбранную из-С(СН 3)2 СН 2-O-ацила или из фармацевтически приемлемого пролекарства, соли или их сольватов. Предпочтительно, если, по крайней мере,один из R и R' является циклоалкильной группой, замещенной (C1-С 6)алкильной группой или(C1-С 6)алкил-ОН группой, циклоалкильную группу выбирают из Предпочтительно, если, по крайней мере,один из R и R' является гетероциклической группой, замещенной (C1-С 6)алкильной группой или (C1-С 6)алкил-ОН группой, гетероциклическую группу выбирают из где R3 является Н, замещенным или незамещенным алкилом, циклоалкилом, гетероциклической или арильной группой или ацильной или сульфонильной группой. Предпочтительным веществом формулы 9 является или его фармацевтически приемлемые соли или аналогичные пролекарства. Предпочтительные пролекарства могут быть получены посредством замещения водорода в одной из спиртовых групп ацильной группой и более предпочтительно на аминокислотную ацильную группу. Далее настоящее изобретение относится к фармацевтической композиции, включающей эффективное количество соединения формулы 9 или его фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым носителем, таким как разбавитель или наполнитель. Далее настоящее изобретение относится к способу лечения СПИД, включающему введение реципиенту или пациенту, такому как примат, эффективного количества соединения по настоящему изобретению. Далее настоящее изобретение относится к способу ингибирования репликации ВИЧ,включающему введение в ВИЧ-инфицированную клетку, клетку, восприимчивую к ВИЧинфекции, или реципиенту или пациенту, такому как примат, эффективного количества соединения по настоящему изобретению. Подробное описание изобретения Настоящее изобретение относится к новым соединениям формулы 9, как описано выше,которые применимы для лечения ВИЧинфекции и/или СПИД. Заявители включают в качестве ссылки патент США 5484926, заявки на выдачу патента США 08/708411 и 08/708607 и заявку на выдачу патента ЯпонииJP 95-248183 и JP 95248184, с условием, что определения предпочтений, терминов, обозначений, определений и т.п., применяемых в каждой заявке, подходят только для соответствующего описания из конкретной заявки. В частности, поскольку каждая из указанных выше заявок, включенных в качестве ссылки, составлялась отдельно, в приоритетных за 5 явках в некоторых случаях одинаковый термин,определение или переменная может применяться в различных значениях. Например, переменная "X" используется в каждой заявке, но в каждой заявке содержится соответственное определенное значение для заместителя или радикала,представленного данной переменной. Для специалистов в данной области будет очевидно, что термины, обозначения и переменные в каждой заявке, включенной в качестве ссылки, ограничены исключительно описанием из конкретной заявки, и могут быть заменены другими подходящими терминами, обозначениями и переменными и т.п., представляющими определенные заместители и радикалы. Безусловно, специалисту в данной области будет очевидно, что любой подходящий набор терминов, обозначений и переменных может быть в общем или более конкретно представлять описываемый в настоящем приложении объект, включая термины,обозначения, переменные и т.п., традиционно применяемые к включенным описаниям в указанных выше заявках и настоящего описания. Соединения формулы 9 могут быть пролекарствами, которые могут служить для улучшения фармацевтических свойств соединений, таких как фармакокинетические свойства, например, улучшения биологической доступности или растворимости. Изготовление пролекарств может быть осуществлено в соответствии со стандартными методиками, известными специалистам в данной области. Предпочтительное пролекарство может быть получено ацилированием или алкилированием исходного спирта,гдеR' представляет собой СН(СН 3)2 СН 2OН. Все указанные здесь температуры даны в градусах Цельсия (С). Все единицы измерения указаны здесь в весовых единицах, за исключением жидкостей, которые измеряли в единицах объема. Термин "алкил", используемый здесь, относится к неразветвленным или разветвленным группам, предпочтительно, содержащим от одного до восьми, более предпочтительно, содержащим от одного до шести, и, наиболее предпочтительно, содержащим от одного до четырех атомов углерода. Термин "C1-С 6 алкил" представляет собой неразветвленную или разветвленную алкильную цепь, содержащую от одного до шести атомов углерода. Показательные C1-С 6 алкильные группы включают в себя метил, этил,н-пропил, изопропил, бутил, изобутил, вторбутил, трет-бутил, пентил, неопентил, гексил,изогексил и т.п. Определение термина "C1-С 6 алкил" включает термин "C1-С 4 алкил". Термин "циклоалкил" представляет насыщенное или частично насыщенное моно- или поликарбоциклическое кольцо, содержащее предпочтительно 5-14 углеродных атомов. Показательные циклоалкилы включают моноциклические кольца, содержащие 3-7, предпочти 002378 6 тельно 3-6 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил,циклогептил и т.п. Показательным циклоалкилом является C5-С 7 циклоалкил, который представляет собой насыщенную углеводородную кольцевую структуру, содержащую от пяти до семи атомов углерода. Термин "алкоксил" представляет -O-алкил. Примером алкоксила является C1-С 6 алкоксил,который представляет собой неразветвленную или разветвленную алкильную цепь, содержащую от одного до шести атомов углерода, соединенных с атомом кислорода. ПоказательныеC1-С 6 алкоксильные группы включают метоксил,этоксил, пропоксил, изопропоксил, бутоксил,втор-бутоксил, трет-бутоксил, пентоксил, гексоксил и т.п. Определение C1-С 6 алкоксила включает в себя C1-С 4 алкоксил. Термин "арил", используемый здесь, относится к карбоциклическому или гетероциклическому, ароматическому, 5-14-членному или полициклическому кольцу. Показательные арилы включают фенил, нафтил, антрил, фенантрил,тиенил, пирролил, имидазолил, пиразолил, фурил, изотиазолил, фуразанил, изоксазолил, тиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил, бензо-[b]тиенил, нафто[2,3-b]тиантриенил, изобензофуранил, хроменил, ксантенил, феноксатиенил, индолизинил,изоиндонил, индолил, индазолил, пуринил, изохинолин, хинолин, фталазинил, нафтиридинил,хиноксиалинил, хинзолинил, бензотиазолил,бензимидазолил, тетрагидрохинолинил, циннолинил,птеридинил,карбазолил,бетакарболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил и феноксазинил. Термин "арилоксил" представляет -O-арил. Термин "гидролизуемая группа" представляет собой группу, которая при замещении гидроксильного водорода спирта образует сложный эфир, который может быть гидролизован in vivo обратно до соответствующего спирта. Показательные гидролизуемые группы, которые необязательно замещены, содержат ацильную функциональную группу, сульфонатную функциональную группу, фосфатную, функциональную группу. Например, подобные гидролизуемые группы содержат блокированный или неблокированный аминокислотный остаток, остаток гемисукцината и остаток никотината. Термин "галоген" представляет хлор, фтор,бром или йод. Термин "галоген-" представляет хлор-, фтор-, бром- или йод-. Термин "карбоцикл" представляет ароматическое или насыщенное или частично насыщенное 5-14-членное моноциклическое или полициклическое кольцо, такое как от 5-7-членное моноциклическое или от 7-10-членное бициклическое кольцо, где все члены кольца являются атомами углерода. 7 Термин "гетероцикл" представляет ароматическое или насыщенное или частично насыщенное 5-14-членное моноциклическое или полициклическое кольцо, такое как от 5-7-членное моноциклическое или от 7-10-членное бициклическое кольцо, содержащее от одного до трех гетероатомов, выбранных из атомов азота, кислорода и серы, и где любой из гетероатомов азота и серы может быть необязательно окислен и любой гетероатом азота может быть необязательно кватернизован. Гетероциклическое кольцо может быть присоединено к любому подходящему гетероатому или атому углерода. Примерами подобных гетероциклов являются декагидроизохинолинил,октагидротиено[3,2-с] пиридинил, пиперидинил, пиперазинил, азепинил, пирролил, пирролидинил, пиразолил, пиразолидинил, имидазолил, изобензофуранил, фуразинил, имидазолинил, имидазолидинил, пиридил, пиразинил, пиримидинил, пиридазинил,оксазолил, оксазолидинил, изоксазолил, тиантренил, триазинил, изоксазолидинил, морфолинил, тиазолил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, хинолинил, хроменил, ксантенил, изохинолинил,бензимидазолил, тиадиазолил, бензопиранил,бензотиазолил, бензоазолил, фурил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, бензо[b]тиенил, нафто[2,3-b]тиенил, тиаморфолинил, тиаморфолинилсульфоксид, тиаморфолинилсульфон, оксадиазолил, триазолил,тетрагидрохинолинил,тетрагидроизохинолинил, феноксатиенил, индолизинил, изоиндолил,индазолил, пуринил, изохинолил, хинолил, фталазинил, нафтиридинил, хиноксиалинил, хинзолинил, циннолинил, птеридинил, карбазолил,бета-карболинил, фенантридинил, акридинил,перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил и феноксазинил. Термин "тиоэфир" включает в себя S-арил,такой как фенилтио или нафтилтио; Sгетероцикл, где гетероцикл является насыщенным или частично насыщенным; S-(C5-С 7)циклоалкил; и S-алкил, такой как C1-С 6 алкилтио. В тиоэфире -арил, -гетероцикл, -циклоалкил и -алкил могут быть необязательно замещены. Примером тиоэфира является "C1 С 6 алкилтио", который представляет собой неразветвленную или разветвленную алкильную цепь, содержащую от одного до шести атомов углерода, соединенных с атомом серы. Показательные C1-С 6 алкилтиогруппы включают метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио, пентилтио, гексилтио и т.п. Термин "меркапто" представляет собой-NL1L2, где L1 и L2 независимо выбирают предпочтительно из карбоцикла, гетероцикла, алкила, сульфонила и водорода; или NС(O)L3, где L3 8 предпочтительно является алкилом, алкоксилом, водородом или -NL1L2. Арильная, алкильная и алкоксильная группы могут быть необязательно замещены. Примером амино является C1 С 4 алкиламино, который представляет собой неразвeтвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода, присоединенных к аминогруппе. Показательные C1-С 4 аминогруппы включают метиламино, этиламино, пропиламино, изопропиламино, бутиламино, втор-бутиламино и т.п. Другим примером амино является ди(C1 С 4)алкиламино, который представляет собой две неразветвленных или разветвленных алкильных цепи, причем каждая содержит от одного до четырех атомов углерода, присоединенных к общей аминогруппе. Показательные ди(C1 С 4)алкиламиногруппы включают диметиламино, этилметиламино, метилпропиламино, этилизопропиламино, бутилметиламино, втор-бутилэтиламино и т.п. Примером амино является C1 С 4 алкилсульфониламино, который имеет неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода, соединенных с радикалом сульфониламино. Показательные C1-С 4 алкилсульфониламиногруппы включают метилсульфониламино,этилсульфониламино, пропилсульфониламино,изопропилсульфониламино, бутилсульфониламино, втор-бутилсульфониламино, трет-бутилсульфониламино и т.п. Термин "ацил" представляет L6 С(O)L4, гдеL6 является простой связью, -О или -N, далее,где L4 предпочтительно является алкилом, амино, гидроксилом, алкоксилом или водородом. Алкильные или алкоксильные группы могут быть необязательно замещены. Показательным ацилом является C1-С 4 алкоксикарбонил, который является неразветвленной или разветвленной алкоксильной цепью, содержащей от одного до четырех атомов углерода, присоединенных к карбонильному радикалу. Показательные C1-С 4 алкококсикарбонильные группы включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил и т.п. Другим показательным ацилом является карбокси, где L6 является простой связью, и L4 является алкоксилом, водородом или гидроксилом. Еще одним показательным ацилом является N-(C1-С 4)алкилкарбамоил (L6 является простой связью, и L4 является амино), который является неразветвленной или разветвленной алкильной цепью, содержащей от одного до четырех атомов углерода, присоединенных к атому азота карбамоильного радикала. ПоказательныеN-(C1-С 4)алкилкарбамоильные группы включают N-метилкарбамоил, N-этилкарбамоил, Nпропилкарбамоил, N-изопропилкарбамоил, Nбутилкарбамоил и N-трет-бутилкарбамоил и т.п. Еще одним показательным ацилом являетсяN,N-ди(C1-С 4)алкилкарбамоил, который содержит две неразветвленные или разветвленные 9 алкильные цепи, причем каждая из них содержит от одного до четырех атомов углерода, присоединенных к атому азота карбамоильного радикала. Показательные N,N-ди(C1-С 6)алкилкарбамоильным группам относитсяN,Nдиметилкарбамоил, N,N-этилметилкарбамоил,N,N-метилпропилкарбамоил, N,N-этилизопропилкарбамоил, N,N-бутилметилкарбамоил, N,Nвтор-бутилэтилкарбамоил и т.п. Термин "сульфинил" представляет -SO-L5,где L5 предпочтительно является алкилом, амино, арилом, циклоалкилом или гетероциклом. Алкил, арил, циклоалкил и гетероцикл могут быть необязательно замещены. Термин "сульфонил" представляет -SO2L5,где L5 предпочтительно является алкилом, арилом, циклоалкилом, гетероциклом или амино. Арил, алкил, циклоалкил и гетероцикл могут быть необязательно заменены. Примером сульфонила является C1-С 4 алкилсульфонил, который представляет собой неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода, присоединенных к сульфонильному радикалу. Показательные C1-С 4 алкилсульфонильные группы входят в метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил и т.п. Как указано выше, большое количество групп необязательно замещено. На самом деле,если только это не было указано специально,все группы, обозначаемые терминами, определенными в данной заявке, могут быть замещены или не замещены. Для примера, когда применяют термин "алкил", следует понимать, что он охватывает как замещенный, так и незамещенный алкил, если только не исключен тот или иной конкретный алкил. Примеры заместителей алкила или арила включают меркапто, тиоэфир,нитро (NO2), амино, арилоксил, галоген, гидроксил, алкоксил и ацил, равно как и арил, циклоалкил и насыщенные и частично насыщенные гетероциклы. Примеры заместителей гетероцикла и циклоалкила включают указанные выше заместители для алкила и арила, равно как и арил и алкил. Показательные замещенные арилы включают фенильное или нафтильное кольцо, замещенное одним или более заместителей, предпочтительно от одного до трех заместителей,независимо выбираемых из галоген, гидрокси,морфолино(C1-С 4)алкоксикарбонила, пиридил(C1-С 4)алкоксикарбонила, галоген(C1-С 4)алкила,C1-С 4 алкила, C1-С 4 алкокси, карбокси, C1-С 4 алкоксикарбонила, карбамоила, N-(C1-С 4)алкилкарбамоила, амино, C1-С 4 алкиламино, ди(C1 С 4)алкиламино или группы формулы -(CH2)a-R7,где а равно 1, 2, 3 или 4, и R7 представляет собой гидрокси, C1-С 4 алкокси, карбокси, C1-С 4 алкоксикарбонил, амино, карбамоил, C1-С 4 алкиламино или ди(C1-C4)алкиламино. 10 Другим замещенным алкилом является галоген(C1-С 4)алкил, который представляет собой неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода с 1-3 атомами галогена, связанными с ней. Показательные галоген(C1-С 4)алкильные группы включают хлорметил, 2-бромэтил, 1 хлоризопропил,3-фторпропил,2,3 дибромбутил, 3-хлоризобутил, йод-трет-бутил,трифторметил и т.п. Другим замещенным алкилом является гидрокси(C1-С 4)алкил, который представляет собой неразветвленную или разветвленную алкильную цепь, имеющую от одного до четырех атомов углерода, с присоединенной к ней гидроксигруппой. Показательные гидрокси(C1 С 4)алкильные группы включают гидроксиметил,2-гидроксиэтил, 3-гидроксипропил, 2-гидроксиизопропил, 4-гидроксибутил и т.п. Еще одним замещенным алкилом являетсяC1-С 4 алкилтио(C1-С 4)алкил, который представляет собой неразветвленную или разветвленнуюC1-С 4 алкилтиогруппой. Показательные C1-С 4 алкилтио(C1-С 4)алкильные группы включают метилтиометил, этилтиометил, пропилтиопропил, втор-бутилтиометил и т.п. Еще другим показательным замещенным алкилом является гетероцикл(C1-С 4)алкил, который представляет собой неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода с присоединенным к ней гетероциклом. Показательные гетероцикл(C1-С 4)алкилы включают пирролилметил, хинолинилметил, 1-индолилэтил, 2 фурилэтил, 3-тиен-2-илпропил, 1-имидазолилпропил, 4-тиазолилпропил и т.п. Еще одним замещенным алкилом является арил(C1-С 4)алкил, который представляет собой неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода с присоединенной к ней арильной группой. Показательные арил-(C1-С 4)алкильные группы включают фенилметил, 2-фенилэтил, 3 нафтилпропил, 1-нафтилизопропил, 4-фенилбутил и т.п. Гетероцикл может, например, быть замещен 1, 2 или 3 заместителями, независимо выбранными из галоген, галоген(C1-С 4)алкила, C1 С 4 алкила, C1-С 4 алкокси, карбокси, C1-С 4 алкоксикарбонила, карбамоила, N-(C1-С 4)алкилкарбамоила, амино, C1-С 4 алкиламино, ди(C1 С 4)алкиламино или группы, имеющей структуру-(СН 2)a-R7, где а равно 1, 2, 3 или 4, и R7 представляет собой гидрокси, C1-С 4 алкокси, карбокси, C1-С 4 алкоксикарбонил, амино, карбамоил,C1-С 4 алкиламино или ди(C1-С 4)алкиламино. К примерам замещенных гетероциклов относятся 3-N-трет-бутилкарбоксамиддекагидроизохинолинил, 6-N-трет-бутилкарбоксамидоктагидротиено[3,2-с]пиридил, 3-метилимидазолил,3-метоксипиридил, 4-хлорхинолинил, 4-амино 11 тиазолил, 8-метилхинолинил, 6-хлорхиноксалинил,3-этилпропил,6-метоксибензимидазолил, 4-гидроксифурил, 4-метилизохинолинил, 6,8-дибромхинолинил, 2-метил-1,2,3,4 тетрагидроизохинолинил, N-метилхинолин-2 ил, 2-трет-бутоксикарбонил-1,2,3,4-изохинолин 7-ил и т.п. Показательные гетероциклические кольцевые системы, представленные А или В, включают(3) полициклические гетероциклические кольцевые группы, такие как декагидроизохинолинил, октагидротиено[3,2-с]пиридинил, бензо[b]тиенил, нафто[2,3-b]тиантренил, изобензофуранил, хроменил, ксантенил и их полностью или частично насыщенные аналоги. Циклоалкил может быть необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из галоген, галоген(C1-С 4)алкила,C1-С 4 алкила, C1-С 4 алкокси, карбокси, C1-С 4 алкоксикарбонила, карбамоила, N-(C1-С 4)алкилкарбамоила, амино, C1-С 4 алкиламино, ди(C1 С 4)алкиламино или группы, имеющей структуру-(СН 2)а-R7, где а равно 1, 2, 3 или 4, и R7 является гидрокси, C1-С 4 алкокси, карбокси, C1 С 4 алкоксикарбонил, амино, карбамоилом, C1-С 4 алкиламино или ди(C1-С 4)алкиламино. Показательные циклоалкильные группы включают 3 метилциклопентил, 4-этоксициклогексил, 5 карбоксициклогептил, 6-хлорциклогексил и т.п. Показательные гидролизуемые группы включают N-бензилглицил, N-Cbz-L-валил и Nметилникотинат. Соединения по настоящему изобретению имеют, по крайней мере, пять асимметричных центров, обозначенных ниже в формуле 9 звездочкой Как следствие наличия данных асимметричных центров, соединения по настоящему изобретению могут существовать в любой из возможных стереоизомерных форм и могут использоваться в виде смеси стереоизомеров, которая может быть оптически активной или рацемической, или могут быть использованы по отдельности в виде существенно чистых стереоизомеров, т.е., по крайней мере, чистых на 95%. Все асимметричные формы, отдельные стереоизомеры и их комбинации входят в объем притязаний по настоящему изобретению. 12 Отдельные стереоизомеры могут быть получены из соответствующих предшественников в соответствии с описанными выше методиками, посредством разделения рацемических смесей или разделения диастереомеров. Разделение может быть проведено в присутствии разделяющего агента, путем хроматографии или перекристаллизации, или определенной комбинации данных методик, известных специалисту в данной области. Более подробно относительно разделения можно найти в Jacques с сотр., Enantiomers, Racemates, and Resolutions, John WileySons 1981. Предпочтительно соединения по настоящему изобретению являются существенно чистыми, т.е. чистыми более чем на 50%. Более предпочтительно соединения являются чистыми, по крайней мере, на 75%. Еще более предпочтительно соединения являются чистыми более чем на 90%. Еще более предпочтительно соединения являются чистыми, по крайней мере, на 95%, более предпочтительно, по крайней мере, на 97% и наиболее предпочтительно, по крайней мере, на 99%. Как упоминалось выше, изобретение относится к фармацевтически приемлемым солям соединений формулы 9. Соединение по настоящему изобретению может содержать достаточно кислую, достаточно основную или обе функциональные группы и, соответственно, взаимодействовать с любым из ряда неорганических или органических оснований и неорганических и органических кислот, с образованием фармацевтически приемлемой соли. Используемый здесь термин "фармацевтически приемлемая соль" относится к солям соединений вышеуказанной формулы, которые, по существу, не токсичны по отношению к живым организмам. Показательные фармацевтически приемлемые соли включают соли, полученные взаимодействием соединений настоящего изобретения с минеральной или органической кислотой или неорганическим основанием. Реагенты обычно объединяют в общем растворителе, таком как диэтиловый эфир или бензол для солей добавления кислот, или воде, или спиртах для солей добавления оснований. Соли, как правило, выпадают в осадок в течение от приблизительно одного часа до приблизительно десяти суток и могут быть выделены фильтрованием или другими общепринятыми способами. Подобные соли известны как соли добавления кислот или оснований. Кислоты, которые могут применяться для образования солей добавления кислот, представляют собой неорганические кислоты, такие как хлористо-водородная кислота, бромистоводородная кислота, йодисто-водородная кислота, серная кислота, фосфорная кислота и т.п., и органические кислоты,такие как птолуолсульфоновая, метансульфоновая кислота,щавелевая кислота, п-бромфенилсульфоновая 13 кислота, карбоновая кислота, янтарная кислота,лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примерами фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат,деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат,малонат, сукцинат, суберат, себакат, фумарат,малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат,сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат,гидроксибутират, гликолат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. Предпочтительными фармацевтически приемлемыми солями добавления кислот являются соли, образованные с минеральными кислотами, такими как хлористо-водородная и бромисто-водородная кислота, и соли, образованные с органическими кислотами, такими как малеиновая кислота и метансульфоновая кислота. К солям добавления оснований относятся соли, образованные неорганическими и органическими основаниями, такими как гидроксиды аммония или гидроксиды щелочных или щелочно-земельных металлов, карбонаты, бикарбонаты и т.п. Таким образом, подобные основания, используемые для получения солей по данному изобретению, включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия, карбонат натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция,карбонат кальция и т.п. Соли калия и натрия являются особенно предпочтительными. Под "фармацевтически приемлемым пролекарством" подразумевают соединение, которое может быть преобразовано в физиологических условиях или посредством сольволиза в соединение формулы 9. Под "фармацевтически приемлемым сольватом" подразумевают сольват, который сохраняет биологическую эффективность и свойства биологически активных компонентов соединений формулы 9. Примеры фармацевтически приемлемых сольватов включают, не ограничиваясь, соединения формулы 9 в комбинации с водой, изопропанолом, этанолом, метанолом, ДМСО,этилацетатом, уксусной кислотой или этаноламином. Следует понимать, что конкретный противоион, образующий часть любой соли по настоящему изобретению, не имеет принципиального значения, пока соль в целом является фармацевтически приемлемой и пока противоион 14 не придаетсоли в целом нежелательных свойств. Предпочтительное соединение представляет собой соединение 21[3S-[2(2S,3S), 3 альфа, 4 а бета, 8 а бетаN-(1,1-диметил-2-гидроксиэтил)декагидро-2-[2 гидрокси-3-[(3-гидрокси-2-метилбензоил)амино]-4-(фенилтио)бутил]-3-изохинолинкарбоксамид. Способ получения соединения 21 приведен ниже. Соединение 21 также было получено как метаболит из плазмы пациентов, получающих метансульфонат [3S-(3R,4aR,8aR,2'S,3'S)]2-[2'-гидрокси-3'-фенилтиометил-4'-аза-5'-оксо 5'-(2-метил-3-гидроксифенил)пентил]декагидроизохинолин-3-N-трет-бутилкарбоксамида,описанную в патенте США 5484926. Соединения формулы 9 могут быть получены в соответствии со следующей схемой реакции I. Схема реакции I Схема I. Общий путь синтеза 9b и производных. Соединение 1 а, пергидроизохинолин, которое является коммерчески доступным из NSCTechnologies (Chicago, IL) или Procos SpA (Milan, Italy), подвергается длительному кислотному гидролизу на стадии 1 а с получением соединения 2 а. Множество неорганических кислот можно использовать либо в смеси воды/органического растворителя, либо только в воде при температуре более 50 С. Примером такой неорганической кислоты является 6 н. водная НСl. Заместители соединения 1 а включают соответствующие сложные эфиры 1b,сложные тиоэфиры 1 с или другие амиды 1d где каждый из Z, Z1 и Z2 может независимо являться алкилом, циклоалкилом, гетероциклом или арилом. 15 Азот амина соединения 2 а затем защищают с получением соединения 2b на стадии 1b. Защитная группа Rp определена как подходящим образом присоединяющаяся группа, позволяющая избежать нежелательного разложения активированных карбоксилатных производных соединения 2b на стадии 2. Такие защитные группы обыкновенно могут являться карбаматом, имеющим общую структуру формулы 11R" в формуле 11 может являться любым алкилом, циклоалкилом, арилом или гетероциклом, который может быть легко удален на стадии снятия защиты после стадии 2. Примеры R" включают, не ограничиваясь, метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил или высший разветвленный или неразветвленный алкил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, аллил, фенил, замещенный фенил, бензил,замещенный бензил, 9-флуоренилметил, 9 антрилметил и высшую полициклическую ароматическую кольцевую систему. Следующие материалы, как определено ниже, могут быть получены из Aldrich Chemical Co. (Sigma Aldrich 16 основания, такие как амины, подобные триэтиламину, диэтиламину, диэтилизопропиламину,1,8-диазабицикло[2,2,2]октану (DABCO) или связанные ди- или триалкиламины, равно как и амидные основания,подобные 1,8 диазабицикло[5,4,0]ундек-7-ену (DBU) и 1,8 диазабицикло[4,3,0]нон-5-ену (DBN). Следующие материалы, как определено ниже, могут быть получены из Aldrich Chemical Co. (Sigma Данные реакции обычно идут при температурах от ниже комнатной до приблизительно 100 С. Амидное взаимодействие на стадии 2 может быть проведено любым из способов в зависимости от того, как активирована карбоксильная группа. Группа J присоединяется на стадии 2 реакцией карбоновой кислоты для получения активированной производной 2 с. Стадия 2. Группа J может быть любой из существующего множества уходящих групп, таких как алкокси, гидрокси, галоген, псевдогалоген(включая азид, цианид, изоцианат и изотиоцианат), алкил или аренсульфонат, ароматический гетероцикл (связанный через гетероатом) и Nгидроксигетероцикл, включая гидроксисукцинимид или гидроксибензотриазолевый сложный эфир. Следующие определения относятся к вышеуказанным терминам Подобные защитные группы обычно присоединяют путем реакции ацилирования соответствующего сложного эфира галогенформиата 12 а или дикарбоната 12b в присутствии подходящего основания в типичных органических растворителях для этих типов реакций, таких как галогенированные растворители, эфиры и углеводороды. Подобные основания, как правило, являются неорганическими, такими как гидроксиды металлов,бикарбонаты и карбонаты или органические 17 Ацилгалогениды (2 с, J=галоген) могут быть получены, используя неорганические галогенирующие агенты, такие как тионилхлорид или бромид, трихлорид или трибромид фосфора, пентахлорид или бромид фосфора, или органическими агентами, такими как оксалилхлорид и трихлоризоциануровая кислота. Эфиры (2 с,J=OR") (R" определена выше) могут быть получены множеством способов, начинающихся с кислого хлорида 2 с, где J является Сl, комбинацией, требующей наличия спирта в присутствии органического или неорганического основания,предварительно добавленных для ацилирования соединения 12 а или соединения 12b. Альтернативно, эфир может быть получен этерификацией, опосредованной кислотой, в присутствии необходимого спирта. Сульфонаты(2 с,J=OSO2W1, где W1 является алкилом или арилом) обыкновенно получают реакцией карбоновой кислоты 2b с алкилом или арилсульфонилхлоридами в присутствии органического основания амина, такого как триэтиламин в неполярном растворителе при температуре ниже 0 С. Алкил и арилсульфонил определены следующим образом Псевдогалогенные производные 2 с (J= псевдогалоген) обыкновенно получают из кислых галогенидов 2 с (J=галоген) реакцией с неорганическим псевдогалогенидом в присутствии основания. Подобные основания включают, но не только, гидроксиды металлов, бикарбонаты и карбонаты или органические основания, такие как триэтиламин, диэтиламин, диэтилизопропиламин, 1,8-диазабицикло[2,2,2]октан (DABCO) или связанные ди- или триалкиламины, равно как и амидинные основания, подобные 1,8 диазабицикло[5,4,0]ундек-7-ену (DBU) и 1,8 диазабицикло[4,3,0]нон-5-ену (DBN). В частности, предпочтительным основанием является триэтиламин. Гетероароматические производные 2 с также получают из кислых галогенидов 2 с (J=галоген), используя специфическое гетероароматическое соединение в присутствии аминного основания в неполярном растворителе. N-гидроксигетероциклические производные 2 с могут быть получены из кислых галогенидов,как указано выше, и также могут быть образованы, используя алкилкарбодиимиды (алкилN=С=N-алкил, где алклильные группы могут быть одинаковы или различны) или арилкарбодиимиды (арил-N=С=N-арил, где арильные группы могут быть одинаковы или различны), и аминные основания в качестве конденсирующих агентов. 18 Первичный или вторичный амин (показано под стрелкой в этапе 2 схемы I), используемый в процессе взаимодействия, может соединить подходящие защитные группы, в зависимости от функциональных свойств, определяемых амином, в используемом способе взаимодействия. Тип взаимодействия 2 с с первичным или вторичным амином может быть проведен различными способами в зависимости от значенияJ. В случае, когда используется свободная кислота (2 с, J=ОН), взаимодействие может быть проведено с использованием способов, основанных на карбодиимидах, используя любой из обычных реагентов этого класса, включая дициклогексилкарбодиимид или связанные диалкилкарбодиимиды, EDC (соли 1-(3-диметиламинопропил)-3-этилкарбодиимида) или водорастворимые связанные реагенты вместе с органическим аминным основанием в полярном органическом растворителе, таком как диоксан,DME, NMP и ацетонитрил в присутствии Nгидроксигетероциклического соединения, такого как N-гидросукцинимид или 3-гидроксибензотриазол. Альтернативно, галогенформиатные эфиры, такие как 12d, могут быть использованы для временной активации кислоты для получения смешанных ангидридов общей формулы 2d. Подобные галогенформиатные эфиры являются типичными, как сказано выше, и включают в себя метил-, этил-, изопропил-, изобутил-, н-бутил, фенил- и связанные алкильные и арильные хлорформиаты, определенные ниже. Формула 2d возможно является промежуточной в стадии от формулы 2b до формулы 3. Формула 2d является промежуточной, но процесс, описанный здесь, приводит к формуле 3 без изоляции формулы 2d. Данные реакции обыкновенно протекают в ряде неполярных органических растворителей,подобных галогенуглеводородам и эфирам, таким как диэтиловый эфир, метиловый третбутилэфир, диизопропиловый эфир, диоксан и тетрaгидрофуран при температуре ниже 0 С в присутствии органического аминного основания, такого как триэтиламин, диэтиламин, диэтилизопропиламин, DABCO или связанные ди 19 или триалкиламины, равно как и амидинных оснований, подобных DBU и DBN. Если J в соединении 2 с является алкилом или аренсульфонатом (J=OSO2R или OSO2Ar),взаимодействие может протекать в ряде неполярных органических растворителей, подобных галогенуглеводородам и эфирам, таким как диэтиловый эфир, метил трет-бутиловый эфир,диизопропиловый эфир, диоксан и тетрагидрофуран при температурах ниже 0 С в присутствии органического аминного основания, такого как триэтиламин, диэтиламин, диэтилизопропиламин, DABCO или связанные ди- или триалкиламины, равно как и амидинных оснований,подобных DBU и DBN. Если J в соединении 2 с является галогеном или псевдогалогеном, взаимодействие может быть проведено в большинстве обычных органических растворителей, таких как ТГФ, диэтиловый эфир, диоксан, метил трет-бутиловый эфир или другие эфиры, ацетон, циклогексанон,метилизобутилкетон и другие кетоны; эфиры,такие как этиловый, метиловый и изопропилацетат; галогенированных растворителях, таких как галогенированные метаны и этаны, хлорбензoл и другие галогенированные бензолы; нитрилах, таких как ацетонитрил и пропионитрил; низших спиртах, таких как этанол, изопропанол, трет-бутанол и связанные спирты; и полярных органических растворителях, таких как диметилформамид, диметилсульфоксид, Nметил-2-пирролидон и связанных содержащих амиды растворителях. Обычно используют основание, которое может быть любым из ряда неорганических оснований, таких как гидроксиды металлов, бикарбонаты и карбонаты или органическим основанием, таким как амины, подобные триэтиламину, диэтиламину, диэтилизопропиламину, DABCO или связанному диили триалкиламину, равно как и амидинным основаниям, подобным DBU и DBN. Квалифицированный в данной области специалист сможет провести связывание амина на стадии 2 с другими возможными J группами. На стадии J удаление защитной группы может быт осуществлено, используя любой из стандартных способов для снятия защиты из определенного класса защитных групп. Простые карбаматы алкилов и замещенных алкилов могут быть удалены водными растворами основания при температурах до 100 С, используя любой из простых неорганических гидроксидов металлов, таких как гидроксид натрия, лития,калия или бария или гидроксиды других металлов в, по крайней мере, стехиометрических количествах. Карбаматные защитные группы, которые содержат бензильные группы, связанные с кислородом, могут быть удалены гидрогенолизом на палладиевом или платиновом катализаторе. Альтернативно, основной водный гидролиз может проводиться при температурах до примерно 100 С с использованием любого из 20 простых неорганических гидроксидов металлов,таких как гидроксид натрия, лития, калия или бария или гидроксиды других металлов, по крайней мере, в стехиометрических количествах. Различные безводные кислоты могут также быть использованы для снятия защиты с основанных на бензиле карбаматов, включая НСl,НВr и HI. Льюисовские кислоты бора и алюминия, такие как AlCl3, ВВr3, ВСl3 также эффективны в неполярных растворителях. Также могут быть использованы некоторые замещенные бензильные, арильные или алкильные группы, в которых заместительная схема выбрана для их способности быть удаленной при специфических условиях. Например, 2-триметилсилилэтилкарбонильная группа (Теос) является защитной группой, разработанной для получения преимущества специфичной реакционноспособности 2-триметилсилилэтильной группы в процессе снятия защиты. 2-триметилсилилэтилкарбонилхлорид может быть использован для защиты азота амина и впоследствии может быть удален при помощи источника ионов фтора,таких как HF или соли фторида тетраалкиламмония. На стадии 4 пергидроизохинолиновая часть формулы 4 присоединена к хлороспирту(соединение 5, схема I) через промежуточный эпоксид (13), образованный через индуцированную основанием близость хлороводородного функционального центра. Соединение 5 производится Kaneka Industries, Japan. Можно провести несколько процедур закрытия-открытия в течение процесса соединение 5 = соединение 13 = соединение 6. Эпоксид 13 может быть изолирован или он может реагировать с 4, добавленным также впоследствии, до формирования 13, или 4 может находиться с самого начала процесса. Эпоксид 13 может быть получен, используя неорганические основания, такие как гидроксиды металлов,карбонаты и бикарбонаты в растворителях, таких как спирты, подобные метанолу, этанолу или изопропиловому спирту, эфирах, таких как тетрагидрофуран и диоксан или смесях из двух. Также эпоксид может быть получен в 2-фазной системе растворителей, состоящей из воды и галогенуглеродного растворителя, такого как дихлорметан вместе с основанием. Фазотрансферный катализатор, такой как соль тетраалкиламмония, может быть использован для облегчения процесса. Разрыв связи эпоксида 13 с соединением 4 завершается в спиртовых растворителях или смесях спирта и другого сольвента, который может быть эфиром или полярным апротонным растворителем, таким как диметилформамид или диметилсульфоксид. Разрыв связи эпоксида 13 с соединением 4 до вы 21 хода соединения 6 оптимально происходит в течение 2-7 ч при 50-60 С. На стадии 5 карбобензилокси группа может быть удалена до выхода свободного амина 7. Это может быть осуществлено при использовании НВr в уксусной кислоте, используя косольвенты, такие как галогенуглеводороды. Также это может быть проведено, используя галогениды бора, такие как ВВr3 и ВСl3 или алкилзамещенные галогениды бора, такие как бордиметилбромид в галогенуглеводородных растворителях, подобных хлороформу и дихлорметану при температурах от 0 С до температуры окружающей среды. Альтернативным путем карбоксибензилокси группа может быть удалена гидролизом,используя водные/ спиртовые растворы гидроксидов металлов, подобных барию, натрию, литию или гидроксиду калия при температурах выше температуры окружающей среды в течение нескольких часов. Стадия 6 а представляет собой взаимодействие производных бензойной кислоты с формулой 8 до образования 9 а. В формуле 8 Q может быть уходящей группой. Q может быть любой из уходящих групп, описанных выше для группы J. Соединения формулы 8, где Q=ОН или Сl доступны коммерчески в EMS Dottikon,Lenzburg, Switzerland и Sugai Chemical Industries, Ltd. в Японии. Связывание может быть приведено несколькими путями в зависимости от значения Q. Если используется свободная кислота (Q=ОН), связывание может быть проведено с использованием основанных на карбодиимидах способах утилизации любого из обычных реагентов данного класса, включая дициклогексилкарбодиимид или связанные диалкилкарбодиимиды, EDC (соли 1-(3-диметиламинопропил)-3-этилкарбодиимида) или связанные водорастворимые реагенты вместе с органическим аминным основанием в полярных органических растворителях, таких как диоксан,DMF, NMP и ацетонитрил в присутствии Nгидрогетероцикла, включая N-гидроксисукциниимид или 3-гидробензотриазола. Если Q = а, галоген или псевдогалоген, связывание может быть проведено в большинстве обычных органических растворителей, таких как тетрагидрофуран, диэтиловый эфир, диоксан, метил третбутиловый эфир или другие эфиры; ацетоне,циклогексаноне, метилизобутилкетоне и других кетонах; эфирах, таких как этил, метил и изопропилацетат; галогенированных растворителях, таких как галогенированные метаны и этаны, хлорбензоле и других галогенированных бензолах; нитрилах, таких как ацетонитрил и пропионитрил; низших спиртах, таких как этанол, изопропанол, трет-бутанол и связанных спиртах, и полярных органических растворителях, таких как диметилформамид, диметилсульфоксид, N-метил-2-пирролидон и связанные амид-содержащие растворители. Обычно используют основание, которое может быть лю 002378 22 бым из ряда неорганических основания, таких как гидроксиды металлов, бикарбонаты и карбонаты или органическим основанием, таким как амины, подобные триэтиламину, диэтиламину, диэтилизопропиламину, DABCO или связанному ди- или триалкиламину, равно как и амидинным основаниям, подобным DBU иDBN. Удаление ацетата завершается на стадии 6b водным или спиртовым растворами неорганических оснований, таких как гидроксиды металлов, карбонаты и бикарбонаты при температурах от температуры окружающей среды до 100 С. Если функциональная группа карбоксамида связана с пергидроизохинолиновой кольцевой системой, то в данном случае она будет наиболее легко удаляема (в течение или после стадии 6b). Суть данной стадии строго зависит от вида защитной группы. Способ, предпочтительный для завершения всего процесса, изображенного на схеме I,дан на схеме II. Cbz-защищенные аминокислоты 15 связаны с амином 22 для получения амида 16. Группу Cbz удаляют гидрированием. Схема II Синтез амида 21 для получения амина 17. Он связывается с хлороспиртом через эпоксид, используя in situ процедуру для выхода аддукта 18. Общепринятое снятие защиты основанием и связыванием свободного первичного амина с кислым хлоридом 20 привело к получению амида 21. Подробно это процесс описан ниже в примерах 1 с А по F. Описание от А до F в схеме II взаимосвязано с нижеуказанными примерами 1 от А до F. Следующие примеры иллюстрируют аспекты изобретения. Данные примеры используются в описательных целях и не предназначены для ограничения поля деятельности изобретения. Аббревиатуры для терминов: точка плавления, спектр ядерного магнитного резонанса,массовый спектр электронного удара, массовый спектр полевой десорбции, массовый спектр бомбардировки быстрыми атомами, инфракрасный спектр, ультрафиолетовый спектр, элементарный анализ, жидкостная хроматография высокого давления и хроматография в тонком слое являются, соответственно, т.пл., ЯМР, EIMS,MS(FD), MS(FAB), ИК, Уф, эл.анализ, HPLC,TLC. Дополнительно абсорбционный максимум, 23 указанный для ИК спектра, выбирается на выбор, не указываются все максимумы. При описании спектров ЯМР используются следующие сокращения: синглет (с), дублет(шир.д), широкий триплет (шир.т), широкий мультиплет (шир.м). J указывает постоянную связывания в герцах (Гц). Кроме того, данные ЯМР относятся к свободному основанию исследуемого соединения. Спектр ЯМР был получен на приборе General Electric QE-300 300 МГц. Химическое смешение выражено в единицахна м.д. Массовый спектр был получен на спектрометре VG ZAB-3 в Scripps Research Institute, La Jolla, CA. Инфракрасный спектр был записан на спектрометреMidac Corporation. Уф-спектр был получен на приборе Varian Cary 3E. Хроматография в тонком слое проводилась на кремниевых пластинах, приобретенных в Е. Merck. Температуры плавления были измерены на приборе MettlerFP62 и не были исправлены. Пример 1. Процессы для синтеза амида формулы 21. А. Пергидроизохинолин (26,4 г, 111 ммоль) (коммерчески доступен из NSC Technologies (Chicago, IL) или Procos SpA (Milan,Italy суспендировали в воде (200 мл) и концентрированной водной НСl (200 мл). Данную смесь нагревали с обратным холодильником и перемешивали в течение 3 дней, в это время она перешла в раствор. Растворители удаляли при пониженном давлении для получения яркожелтого твердого вещества. Твердое вещество растворили в 2-пропаноле (200 мл) и профильтровали. Фильтрат выпарили при пониженном давлении до состояния масла. Добавили EtOAc(100 мл) и воду (100 мл) и довели рН раствора до 8 при дополнительном 2 н. водным КОН. По каплям добавили бензилхлорформиат (15,8 мл,111 ммоль) в течение 30 мин и поддерживали рН между 7 и 8 дополнительным 2 н. водным КОН. Смесь помешивали при комнатной температуре в течение 18 ч. Добавили EtOAc (200 мл) и промывали органический слой 1 н. водной НСl(100 мл) и рассолом (100 мл). Органический слой высушивали (MgSO4), отфильтровали и выпарили при пониженном давлении до состоя 002378 24 ния масла. Продукт очистили способом хроматографии на силикагеле, элюировали с 1:1 40-60 петролейного эфира/EtOAc и затем 100%EtOAc. Продукт, содержащий фракции, собирали и выпаривали при пониженном давлении до выхода соединения 15 (11,3 г, 32%) в виде бесцветного масла: 1 Н ЯМР (300 МГц, CDCl3)7,43-7,28 (м, 5 Н), 5,17 (шир.с, 2 Н), 4,76 (м,1 Н), 3,79 (м, 1 Н), 3,33 (м, 1 Н), 2,19 (м, 1 Н), 1,96(м, 1 Н), 1,88-1,15 (м, 10 Н). В. 1-Гидроксибензотриазол (4,2 г, 31,4 ммоль) и дихлорэтан (6,0 г, 21,4 ммоль) добавили в раствор кислоты 15 (8,3 г, 26,2 ммоль) в ДМФ (128 мл) при комнатной температуре. Смесь нагревали до 80 С в течение 10 мин. Добавили 1,1-диметил-2-триметилсилилоксиэтиламин (5,1 г, 31,4 ммоль), полученный из 1,1 диметил-2-гидроксиэтиламина (Aldrich ChemicalCo.) нагреванием смеси с обратным холодильником в течение нескольких часов с последующим выпариванием летучих компонентов, и нагревали раствор до 80 С в течение 17 ч. Желтый раствор влили в EtOAc (250 мл) и 2 н. водный НСl (250 мл). После перемешивания в течение 10 мин добавили EtOAc (750 мл) и смесь промывали Н 2O (3500 мл) и рассолом (1250 мл). Полученные водные соли высушили(Na2SO4) и очистили тонкослойной хроматографией (50/50 EtOAc/гексана) для получения соединения 16 в виде бесцветного масла (7,9 г,78%): 1 Н ЯМР (300 МГц, CD3OD)7,36 (м, 5 Н),5,20 (д, J=8,1 Гц, 1 Н), 5,10 (м, 1 Н), 4,53 (м, 1 Н),3,78 (дд, J=13,2, 4,4 Гц, 1 Н), 3,60 (м, 2 Н), 3,48 (д,J=10,7 Гц, 1 Н), 2,15-1,25 (м, 12 Н), 1,31 (с, 3 Н),1,29 (с, 3 Н). С. Смесь карбамата 16 (7,9 г, 20,4 ммоль) и 5% палладия на углероде (Pd/C) (1,6 г) гидрогенирировали при 50 фунт на кв. дюйм Н 2 в абсолютном EtOH (110 мл) при комнатной температуре в течение 18 ч. Смесь фильтровали через целит и упаривали под вакуумом для получения амина 17 в виде белого твердого кристаллического вещества: 1(ИП) (104 мл), механически перемешивая. По прошествии 1 ч 1 н. для нейтрализации добавили водную НСl в ИП (приготовленную добавлением 1 мл концентрированной водной НСl к 12 мл ИП) в количестве приблизительно (пр.) 1 мл(рН=7). Амин 17 (5,2 г, 20,4 ммоль) добавили в виде раствора в ИП (50 мл) и тонкую суспензию нагревали при температуре 60 С в течение 10 ч. 25 ИП удалили под вакуумом. Остаток разбавилиEtOAc (150 мл) и промыли водой (250 мл),насыщенным водным NаНСО 3 (150 мл) и рассолом (150 мл). Объединенные органические слои экстрагировали с EtOAc (125 мл). Объединенные органические слои высушивали(Nа 2SO4) и очищали тонкослойной хроматографией (75/25 EtOAc/гексана, затем EtOAc) до получения соединения 18 в виде белого твердого вещества (8,98 г, 76%): 1(6,75 г, 11,6 ммоль) в ИП (34 мл) при комнатной температуре. Смесь кипятили с обратным холодильником в течение 12 ч. После охлаждения до комнатной температуры смесь разбавили метил трет-бутиловым эфиром (МТБЭ) (600 мл) и промывали Н 2 О (2250 мл) и рассолом (1125 мл). Объединенные органические слои экстрагировали с МТБЭ (1150 мл). Объединенные органические слои высушивали (Na2SO4) и выпаривали в вакууме до получения смеси соединения 19 и бензилового спирта в виде маслянистого белого твердого вещества. 1F. Триэтиламин (3,2 г, 4,3 мл, 31,2 ммоль) добавляют в раствор смеси амина 19 (4,7 г, 10,4 ммоль теоретически из 18) и бензилового спирта в EtOH (23 мл) при комнатной температуре. Затем добавили раствор 3-ацетокси-2 метилбензоилхлорида (20) (полученного соответственно процессам, описанным в приложении к патенту США Serial08/708,411, опубликованному 5 сентября 1996 г., здесь специально внесенного в приложение) (2,4 г, 11,5 ммоль) в тетрагидрофуране (4 мл). По прошествии 2 ч добавили 50% водный NaOH (4,1 г, 2,8 мл, 52,2 ммоль) и смесь кипятили с обратным холодильником в течение 1 ч. После охлаждения до температуры окружающей среды, рН смеси нейтрализовали до 7 при помощи 2 н. водной НСl (26 мл). Данную смесь разбавили(1250 мл) и рассолом (1125 мл). Органический слой высушивали (Na2SO4) и очищали тонкослойной хроматографией (75/25 EtOAc/ гексана) до получения амида 21 в виде белой пены (1173-57 А, 1,39 г, 23%). 1H ЯМР показало присутствие 11 мас.%EtOAc, который было невозможно удалить под вакуумом.(м, 2 Н), 2,04 (м, 1H), 1,86-1,20 (м, 11 Н), 1,19 (с,3 Н), 1,18 (с, 3 Н). 13 С ЯМР (75,5 МГц, CD3OD)175,7, 172,5,155,9, 138,8, 136,7, 129,8, 128,9, 126,3, 126,0,122,4, 118,4, 115,9, 70,3, 69,9, 68,2, 59,3, 58,8,54,9, 53,0, 36,5, 34,2, 34,1, 31,1, 30,7, 26,4, 26,0,23,1, 23,0, 20,8, 12,1. Пример 2. Активность протеазы ВИЧ и анти-ВИЧ активность в клеточной культуре соединения 21. Для определения значения Ki в соединении 21 использовался способ анализа кинетики прочного связывания. Ki = 5,60,91 нМ. Способы Экспрессия протеазы ВИЧ-1. Ген протеазы ВИЧ-1 был выделен из вирусной вытяжки IIIB (Ratner, L. с сотр., Nature,316, 227-284 (1985. С целью усиления стабильности очищенной протеазы (Rose, J.R. с сотр., J. Biol. Chem., 268, 11939-11945 (1993,глутаминовый остаток в положении 7 (Q7) был заменен на серин (S) заменой 33 основных пар сегментов между сайтами NdeI и BstEII протеазной генной последовательности синтетическими олигонуклеотидами, кодируемыми мутацией (Q7S). Модифицированная генная последовательность была внедрена в плазмидный вектор pGZ (Menge, K.L. с сотр., Biochemistry,34:15934-15942 (1995 под контролем фага промотора Т 7. Полученная конструкция,pGZ/HP-19Q7S9, была введена в штамм Е. coliYeast extract, 0,5% NaCl с начальным рН 7,5),содержащей 200 мкг/л ампициллина в 100 л ферменторе (Biolafitte SА) при 37 С в течение 5 ч и затем индуцирована добавлением 1 мМ ИЗТГ(изопропилD-тиогалактопиранозид). Температура культуры в течение индукции повышалась до 42 С для увеличения накопления рекомбинантной протеазы ВИЧ-1 как нерастворимых включений. После 2 ч при 42 С клетки собирали перекрестной фильтрацией, используяPellicon 0,1 мкм VVPP000C5 кассеты 10 (Millipore), и клеточная паста была заморожена и оставлена при -70 С. Очищение рекомбинантной протеазы ВИЧ-1: Все стадии, если только это не указано специально, проводились при температуре 4 С. Концентрации белков измерялись с использованием белкового анализационного раствора BioRad с бычьим сывороточным альбумином (Bio 27Rad, Richmond, CA) как стандарта. Стадии хроматографии и чистота ВИЧ PR измерялась додецилсульфатнонатриевым полиакриламидным гелевым электрофорезом (SDS-PAGE). Окончательная чистота ВИЧ PR была 98%. Средний окончательный выход с каждых 100 л культуры был 120 мг. Клеточную пасту из 100 л культуры ресуспендировали в 300 мл лизирующего буфера (50 мМ Трис-Сl рН 8,0, 25 мМ NaCl, 20 мМ 2 меркаптоэтанола) и микрофлюидизировали вMicrofluids Corporation флюидизаторе при 22000 фунт на кв.дюйм. Неочищенный клеточный лизат осветляли центрифугированием при 14000 об/мин в течение 20 мин. В осадке после центрифугирования большинство составляли включения ВИЧ PR. Включения последовательно отмывались несколько раз в лизирующем буфере, содержащем дополнительно 0,1 Trition-X100 и 1 М мочевину и, после процесса отмыва,включения перевели в осадок центрифугированием при 5000 об/мин в течение 20 мин. Очищенные включения растворили в буфере, содержащем 50 мМ Трис-Cl, рН 8,0, 25 мМ NaCl,20 мМ 2-меркаптоэтанола и 8 М мочевины. Раствор осветляли центрифугированием при 14000 об/мин и при комнатной температуре залили в 300 мл быстропроточную колонку на Qсефарозе (Pharmacia, Piscataway, NJ), уравновешенную с таким же буфером. В таких услoвиях ВИЧ PR не связывается с колонкой и практически очищенный фермент находится в проточной фракции. Для ренатурации белка фракции из быстропроточной колонки на Q-сефарозе подвергали диализу против трех сменных буферов,содержащих 25 мМ NaH2PO4 pH 7,0, 25 мМNaCl, 10 мМ ДДТ и 10% глицерина. После перегонки небольшие количества преципитата удаляли центрифугированием и полученный ферментный препарат концентрировали и подвергали диализу против 0,5 NaCl, 50 мМ MES pH 5,6, 10 мМ ДДТ, замораживали в небольших аликвотах 2 мг/мл и оставляли при -70 С. Оценка кинетики прочного связывания и ее анализ. Протеолитическая активность очищенной протеазы ВИЧ-1 измерялась модифицированным хромогенным анализом, разработаннымHis-Lys-Ala-Arg-Val-Leu-Phe(paraNO2)Glu-Ala-Nle-Ser-NH2 (American Peptide Company) (Nle - норлейцин) использовался в качестве субстрата. Анализ проводился в 0,5 М NaCl,50 мМ MES pH 5,6, 5 мМ ДДТ, и 2% ДМСО при 37 С. Разрыв расщепленной связи между лейцином и паранитрофенилаланином (Phe paraNO2) был анализирован спектрофотометрическим мониторингом снижения абсорбции при 305 нм. Начальная скорость была определена по уровню снижения абсорбции в течение первых 100 с ферментативной реакции. В этих уловиях 28 и при использовании Q7S протеазу ВИЧ-1 константа Михаэслиса (КМ) для данного субстрата являлась 5917 мкм. До остановки ингибирования соединения 21 применили насыщение концентрации субстрата при 200 мкм. Между 13 и 20 концентрации ингибиторов были измерены, и скорость реакции была измерена для каждой концентрации, как описано выше. Найденное Ki (Ki найд.), указанное выше, было определено компьютерным нелинейным фиттингом на малых площадях по способу плотносвязанного выравнивания Моррисона (Morrison, J.F., Biochem.Biophis. Acta, 185, 269-286 (1963. Пример 3. Противовирусная активность соединения 21 против ВИЧ-1 в клеточной культуре. Клеточные и вирусные штаммы. Линии CEM-SS и МТ-2 Т-клеток человека и штаммы ВИЧ-1 RF и IIIB получают из AIDSAIDS, NIAID и NIH. Анализы клеточной защиты. Ингибиторные эффекты каждого агента на репликацию ВИЧ-1 измеряли способом снижения смертности МТТ (Alley, M.C. с сотр., CancerRes. 48: 589-601 (1988. Соединения растворили в ДМСО с концентрацией 40 мг/мл затем разбавили 1:200 медиум культурой (RPMI, дополненной 10% зародышевой бычьей сывороткой). Из каждого исходного разбавленного продукта было взято по 100 мкл и перенесено в 96 луночную плату, где были сделаны стандартные двойные разведения. В различных трубках клетки МТ-2 и клетки CEM-SS инфицировали ВИЧ 1 IIIB или ВИЧ-1 RF множественными заражениями (МЗ) по 0,01 и 0,03 соответственно. По прошествии 4-часового адсорбционного периода 100 мкл зараженных или незараженных клеток добавляли в лунки платы, содержащей лекарственное вещество до получения конечной концентрации 1104 клеток/лунку. Через 6(клетки CEM-SS) или 7 (клетки МТ-2) дней в тестовые платы добавили МТТ (5 мг/мл) и количественно получившегося формазана измеряли спектрофотометрически на 570 нм. Данные экспрессировались в процентном отношении к образовавшемуся в незараженных, свободных от лекарственного препарата, лунках, формазану. ED50 было рассчитано, когда количество формазана, образовавшегося в зараженных, обработанных лекарственным средством, клетках достигло 50% от образовавшегося в незараженных, не обработанных лекарственным препаратом, клетках. Терапевтический индекс (ТИ) посчитан делением цитотоксичности (ЦТ 50) на противовирусную эффективность (ED50). Таблица 1 Противовирусная активность и оценки цитотоксичности соединения 21 при острой инфекции клеток Таблица 2 Противовирусная активность и оценки цитотоксичности соединения 21 при острой инфекции клеток МТ-2 ВИЧ-1 IIIBED50, ED95,ЦТ 50,Терапевтический нм нм мкм индекс а 21 85,6 Как указано выше, соединения настоящего изобретения используются для ингибирования протеазы ВИЧ, которая является ферментом,имеющим отношение к продукции и сборке вирусных компонентов. Воплощением настоящего изобретения является способ лечения ВИЧинфекции, включающей в себя введение носителю или пациенту, такому как примат, эффективного количества соединения формулы 9 или его фармацевтически приемлемой соли. Другим воплощением настоящего изобретения является способ лечения СПИД, включающий в себя введение носителю или пациенту, такому как примат, эффективного количества соединения формулы 9 или его фармацевтически приемлемой соли. Дальнейшим воплощением настоящего изобретения является способ ингибирования протеазы ВИЧ, включающий в себя введение носителю или пациенту, такому как примат,зараженный ВИЧ, эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли. Термин "эффективное количество" означает количество соединения формулы 9 или его фармацевтически приемлемой соли, эффективное для ингибирования продукции и сборки вирусных компонентов, связанных с протеазой ВИЧ. Специфическая доза соединения, вводимого согласно настоящему изобретению, дает терапевтический или ингибиторный эффект,будет, безусловно, определяться различными обстоятельствами, определенными каждой ситуацией, включая, например, вводимым соединением, способом введения, состоянием, в котором находится носитель или пациент, или его индивидуальных особенностях. Примерная дневная доза (вводимая одновременно или разделенная) содержит уровень дозировки от примерно 0,01 мг/кг до примерно 50 мг/кг массы тела соединения настоящего изобретения. 30 Предпочтительные дневные дозы, как правило,от примерно 0,05 мг/кг до примерно 40 мг/кг и,более предпочтительно, от примерно 1,0 мг/кг до примерно 30 мг/кг. Соединения изобретения могут вводиться множеством способов, включая оральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный способы. Соединения настоящего изобретения предпочтительно формируются перед введением. Более того, другим воплощением настоящего изобретения является фармацевтическая композиция или формулировка, включающая в себя эффективное количество соединения формулы 9 или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя,такого как их дилюент или наполнитель. Активный ингредиент предпочтительно содержит от 0,1 до 99,9% веса состава. Под"фармацевтически приемлемый" понимают то,что носитель, такой как дилюент или наполнитель, является совместимым с остальными ингредиентами смеси и не является ядовитым для носителя или пациента. Фармацевтические смеси могут быть приготовлены из соединений изобретения посредством известных процедур, используя известные и широко доступные ингредиенты. В приготовлении композиций настоящего изобретения активный ингредиент, как правило, смешан с носителем или растворен в носителе, или заключен в носитель, который может быть в форме капсулы, саше, бумаге или другом подходящем контейнере. Когда носитель играет роль растворителя, он может быть твердым, полутвердым или жидким материалом, который действует как переносчик, наполнитель или медиум для активного ингредиента. Таким образом, смесь может быть в виде таблеток, пилюль, порошков,саше, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как в твердой, так и в жидкой среде), мазей (содержащих, например,до 10% массы активного соединения), мягких или твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций, стерильных порошков и т.п. Следующие примеры композиций являются только иллюстративными и не предназначены для ограничения области изобретения. Термин "активный ингредиент" представляет соединение формулы 9 или его фармацевтически приемлемую соль. Композиция 1. Твердые капсулы желатина готовят, используя следующие ингредиенты: Активный ингредиент Крахмал, сухой Стеарат магния Всего Композиция 2. Таблетку готовят, используя следующие ингредиенты: Активный ингредиент Целлюлоза монокристаллическая Диоксид кремния, одымленный Стеариновая кислота Всего Компоненты смешиваются и прессуются в виде таблеток каждая весом по 665 мг. Композиция 3. Аэрозольный раствор готовят из следующих компонентов: Активный ингредиент Метанол Пропеллант 22 (хлордифторметан) Всего Активные компоненты смешивают с этанолом и смесь добавляют в порцию поропелланта 22, охлаждают до -30 С и переводят в наполнительный аппарат. Затем необходимое количество вносят в контейнер из нержавеющей стали и разбавляют остатками пропелланта. Клапанный аппарат прикрепляют на контейнер позже. Композиция 4. Таблетки, каждая содержащая по 60 мг активного ингредиента, готовят следующим образом: Активный ингредиент Крахмал Монокристаллическая целлюлоза Поливинилпирролидон(в виде 10% раствора в воде) Карбоксиметил натрия крахмал Стеарат магния Тальк Всего Активный ингредиент, крахмал и целлюлозу пропускают через No. 45 mesh U.S. сито и тщательно перемешивают. Водный раствор,содержащий поливинилпирролидон, смешивают с полученным порошком и смесь пропускают через No. 45 mesh U.S. сито. Полученные таким образом гранулы сушат при 50 С и пропускают через No. 18 mesh U.S. сито. Карбоксиметил натрия крахмал, стеарат магния и тальк предварительно пропускают через No. 60 mesh U.S. сито и затем добавляют к гранулам, которые после смешивания прессуют в таблеточной машине для получения таблеток каждая весом по 150 мг. 32 Композиция 5. Капсулы, каждая содержащая по 80 мг активного ингредиента, изготавливают следующим образом: Активный ингредиент Крахмал Монокристаллическая целлюлоза Стеарат магния Всего Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через No. 45 mesh U.S. сито и помещают в твердые желатиновые капсулы в количестве по 200 мг. Композиция 6. Суппозитории, каждый содержащие по 225 мг активного ингредиента, готовят следующим образом: Активный ингредиент Насыщенные жирные кислые глицериды Всего Активный ингредиент пропускают черезNo. 60 mesh U.S. сито и суспендируют в насыщенных жирных глицеридах, предварительно расплавив их, используя минимально необходимое количество тепла. Смесь затем вливают в форму для изготовления суппозиториев емкостью 2 г и охлаждают. Композиция 7. Суспензии, содержащие каждая по 50 мг активного ингредиента, по 5 мг готовят следующим образом: Активный ингредиент Натриевая карбоксиметилцеллюлоза Сироп Раствор бензойной кислоты Подсластитель Краситель Чистая вода до общего объема Активный ингредиент пропускают черезNo. 45 mesh U.S. сито и смешивают с натриевой карбоксиметилцеллюлозой и сиропом до формирования равномерной пасты. Раствор бензойной кислоты, подсластитель и краситель растворяют в порции воды и добавляют, помешивая. Необходимую воду добавляют до получения требуемого объема. Композиция 8. Состав для внутривенного введения готовят следующим образом: Активный ингредиент Изотонический солевой раствор Раствор вышеуказанных ингредиентов, как правило, вводят пациенту со скоростью 1 мл/мин. Активный ингредиент Силикат кальция Кросповидон Стеарат магния Всего или его фармацевтически приемлемая соль или сольват. 2. Соединение по п.1, обладающее чистотой более 90%. 34 3. Соединение по п.1, обладающее чистотой, по крайней мере, 95%. 4. Соединение по п.1, обладающее чистотой, по крайней мере, 97%. 5. Соединение по п.1, обладающее чистотой, по крайней мере, 99%. 6. Фармацевтическая композиция для лечения ВИЧ инфекции, содержащая эффективное количество соединения или его соли или сольвата по п.1 и фармацевтически приемлемый носитель. 7. Фармацевтическая композиция по п.6,где соединение или его соль или сольват обладают чистотой более 90%. 8. Фармацевтическая композиция по п.6,где соединение или его соль или сольват обладают чистотой, по крайней мере, 95%. 9. Фармацевтическая композиция по п.6,где соединение или его соль или сольват обладают чистотой, по крайней мере, 97%. 10. Фармацевтическая композиция по п.6,где соединение или его соль или сольват обладают чистотой, по крайней мере, 99%.
МПК / Метки
МПК: A61P 37/00, C07D 217/26, A61K 31/472
Метки: вич, ингибиторы, протеазы
Код ссылки
<a href="https://eas.patents.su/18-2378-ingibitory-proteazy-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы протеазы вич</a>
Предыдущий патент: Погруженный трансформатор, самозащищенный устройством, включающим автоматический выключатель и плавкие предохранители
Следующий патент: Средство, обладающее антиишемической, гипотензивной и антигипоксической активностью
Случайный патент: Способ и устройство для регулирования разделения дисперсной системы при жидкостной экстракции












