Противобактериальный или педикулоцидный препарат, содержащий аллицин
Формула / Реферат
1. Противобактериальный или педикулоцидный препарат, содержащий аллицин или метаболит аллицина и фармацевтически приемлемый эксципиент и дополнительно содержащий по крайней мере одно другое противобактериальное или педикулоцидное средство.
2. Препарат по п.1, в котором другое средство выбрано из (i) пенициллинов, (ii) аминогликозидаз, (iii) тетрациклинов, (iv) макролидов, (v) цефалоспоринов и цефамицинов и (vi) фузидиновой кислоты, рифампицина, новобиоцина, ванкомицина, ципрофлоксацина, хлорамфеникола или метронидазола.
3. Препарат по п.1 или 2, в котором метаболит аллицина выбран из DADS (диаллилдисульфида), DATS (диаллилтрисульфида), эдзоена, аллитридия и винилдитиинов.
4. Препарат по любому из пп.1-3, в котором фармацевтически приемлемый эксципиент представляет собой твердую композицию, на которой связан аллицин.
5. Препарат по п.4, в котором твердая композиция содержит модифицированный крахмал, такой как мальтодекстрин, аравийская камедь, диоксид кремния и эмульгатор, такой как стеарат магния.
6. Препарат по любому из пп.1-3, в котором фармацевтически приемлемый эксципиент представляет собой крем или мыло.
7. Препарат по п.6, в котором эксципиент включает белый полутвердый парафин, эмульгатор, глицерин, воду, желтый полутвердый парафин и стабилизатор.
8. Препарат по п.7, в котором эмульгатор представляет собой стеарат, предпочтительно стеарат магния.
9. Препарат по п.8, в котором эксципиент включает оксисульфат, кокамид и кокобетаин.
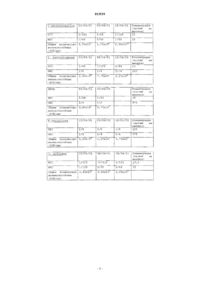
10. Препарат по любому из пп.4-9, в котором отношение аллицина к наполнителю является таким, которое обеспечивает концентрацию аллицина от 1 до 2000 ч./млн, предпочтительно от 50 до 1000 ч./млн, более предпочтительно от 250 до 500 ч./млн.
Текст
013519 Настоящее изобретение относится к аллицину. Считается, что аллицин, соединение серы, имеющее формулу представляет собой основное активное соединение, характеризующееся многочисленными терапевтическими свойствами, которые описаны для чеснока (Allium sativium). В естественном состоянии чеснок содержит не аллицин, а его предшественник-аллиин [(+)S-аллил-L-цистеинсульфоксид]. Аллиин превращается в аллицин в результате действия фермента аллиназы или аллиинлиазы, также компонента чеснока. Аллиин и аллиназу получают вместе, когда разрезают или дробят чесночные зубки. Следующее уравнение представляет схему синтеза. Однако аллиназа быстро и необратимо инактивируется продуктом ее реакции, аллицином, а также инактивируется в кислых условиях, таких как в желудке. Поэтому на практике выход аллицина из зубков чеснока оказывается значительно ниже теоретического максимума. Действительно, выход обычно составляет порядка 0,3-0,5%. В WO 97/39115 описан непрерывный способ синтеза аллицина, который включает приготовление колонки, содержащей аллиназу, иммобилизованную на твердом носителе, пропускание раствора аллиина через колонку и получение раствора аллицина в вытекающей жидкости. Кроме того, авторы настоящей заявки получали аллицин в высушенной распылением форме и приобретали в капсулах от фирмы Allicin International Limited of Half House, Military Road, Rye, East Sussex,TN31 7NY, United Kingdom, под товарным наименованием аллимакс (ALLIMAX). Настоящее изобретение основано на исследованиях новых терапевтических свойств аллицина. В наиболее общем аспекте настоящее изобретение относится к противобактериальному или педикулоцидному препарату, содержащему аллицин или метаболит аллицина и фармацевтически приемлемый эксципиент. Предпочтительно препарат содержит по меньшей мере одно другое противобактериальное или педикулоцидное средство. Более предпочтительно другое средство выбирают из (i) пенициллинов, включая ампициллин, пиперациллин, карбенициллин, амоксициллин, метициллин и пенициллин G; (ii) аминогликозидаз, включающих в себя гентамицин, тобрамицин, стрептомицин и амикацин; (iii) тетрациклинов; (iv) макролидов,включая эритромицин; (v) цефалоспоринов и цефамицинов, включающих в себя цефуроксим, цефамандол и моксалактам; и (vi) фузидиновой кислоты, рифампицина, новобиоцина, ванкомицина, ципрофлоксацина, хлорамфеникола и метронидазола. Соответственно, метаболит аллицина представляет собой по меньшей мере одно вещество из числаDADS (диаллилдисульфид), DATS (диаллилтрисульфид), эдзоена, аллитридия или винилдитиина. Предпочтительно для перорального введения или введения в виде суппозитория, вагинального суппозитория или назального препарата фармацевтически приемлемый эксципиент представляет собой твердую композицию, на которую присоединяют аллицин или его метаболит. Более предпочтительно,если требуется, твердая композиция содержит средство, увеличивающее объем, такое как лактоза, микрокристаллическая целлюлоза или дикальцийфосфат; загуститель, такой как смола или крахмал; дезинтегрирующий агент, такой как натрийгликолят крахмала или поперечно-сшитый повидон; способствующее высвобождению средство, такое как стеарат магния; эмульгатор; поверхностно-активное вещество и подсластители, ароматизаторы и красители. Наиболее предпочтительно аллицин связывают способом распылительной сушки, а твердая композиция содержит модифицированный крахмал, такой как мальтодекстрин, аравийская камедь, диоксид кремния и эмульгатор, такой как стеарат магния. Соответственно, для местного применения фармацевтически приемлемый эксципиент входит в состав крема или мыла. Альтернативно, эксципиент может представлять собой лосьон, мазь, зубную пасту,жидкость для полоскания рта или препарат для волос, такой как шампунь, гель для укладки волос или кондиционер. Если уместно, такие препараты могут включать в себя комбинации следующих веществ: поверхностно-активных веществ, ароматизаторов, красителей, стабилизаторов, антиоксидантов, эмульгаторов, загустителей, восков, глицеринов, жиров, веществ, способствующих суспендированию, дефлокулирующих веществ и антиоксидантов, все из которых могут быть, а могут и не быть гипоаллергенами. Предпочтительно эксципиент-крем содержит белый полутвердый парафин, эмульгатор, такой как стеарат, предпочтительно стеарат магния, глицерин, воду, желтый полутвердый парафин и стабилизатор,такой как цитрат калия. Наиболее предпочтительно эксципиент-крем представляет собой водный крем,предпочтительно водный крем ВР. Соответственно, наполнитель-мыло содержит эфир серной кислоты,кокамид и кокобетаин. Возможно, эксципиент, кроме того, может включать в себя ароматизаторы и красители.-1 013519 Предпочтительно для перорального, парентерального или местного применения соотношение аллицина к наполнителю является таким соотношением, которое обеспечивает концентрацию аллицина между 1 и 2000 ч./млн, предпочтительно между 50 и 1000 ч./млн, более предпочтительно между 250 и 500 ч./млн. На фиг. 1 представлены средние размеры зон к аллициновой жидкости относительно клинических изоляторов Staphylococcus aureus, проявивших резистентность, промежуточную резистентность и чувствительность к мупироцину; на фиг. 2 - средние размеры зон к аллициновому крему относительно клинических изоляторовStaphylococcus aureus, проявивших резистентность, промежуточную резистентность и чувствительность к мупироцину; на фиг. 3 - минимальные ингибиторные (MIC) и минимальные бактерицидные (МВС) концентрации для аллицина (мкг/мл) относительно клинических изоляторов Staphylococcus aureus; на фиг. 4 - зоны ингибирования, образованные аллицином в отношении MRSA103; на фиг. 5 отражена реакция степени 1 с Оксфордским штаммом и стрептомицином; на фиг. 6 - реакция степени 2 с Оксфордским штаммом и ванкомицином; на фиг. 7 - реакция степени 3 MRSA102. Приведенные выше и другие аспекты данного изобретения в дальнейшем описывают более подробно со ссылкой на следующие примеры только как показательный пример. 1. Противомикробные свойства одного аллицина. Определение минимальной ингибиторной концентрации (MIC) методом пробирочного разведения. Используя асептический способ, 1 мл питательной среды двойной концентрации разливали в каждую из 11 пробирок Кана (Khan). В первую пробирку, пробирка 1, (обозначенная контроль) добавляли 1 мл стерильной деионизованной воды. Во вторую пробирку, пробирка 2, добавляли 1 мл аллицина (2000 ч./млн в водном растворе), смешивали, используя механический смеситель, и 1 мл переносили из пробирки 2 в пробирку 3. Процесс повторяли последовательно до пробирки 11. Следовательно, получали серию двойных разведений между 1/2 и 1/1024. 4 мкл культуры, выращенной в течение ночи на питательной среде, использовали для инокулирования каждой пробирки. Содержимое пробирок смешивали и инкубировали при 37 С в течение 24 ч. Наблюдали за помутнением в пробирках и самую низкую концентрацию без помутнения регистрировали как MIC. Определение минимальной бактерицидной концентрации (МВС). Из каждой из пробирок MIC-серии, в которых не было обнаружено никакого помутнения, отбирали 100 мкл и рассеивали на поверхности чашки питательного агара, используя стерильный стеклянный шпатель. Чашки инкубировали при 37 С в течение 24 ч и следили за появлением бактериальных колоний. Самую низкую концентрацию, при которой не наблюдали никаких жизнеспособных бактерий, регистрировали как МВС. Определение MIC с использованием многоточечного инокулятора. Исходный раствор аллицина 1/4 об./об. готовили добавлением 5 мл аллицина (2000 ч./млн в водном растворе) к 15 мл стерильной воды. Отбирали 10 мл приготовленного раствора, добавляли к 10 мл расплавленного, охлажденного питательного агара двойной концентрации, смешивали и использовали для приготовления чашки с разведением 1/8 об./об. Оставшиеся 10 мл аллицина (1/4) разбавляли 10 мл стерильной воды, чтобы получить раствор с разведением 1/8 об./об. 10 мл 1/8-раствора использовали для приготовления 1 чашки с разведением 1/16 об./об. Серийное разведение продолжали до тех пор, пока не получали чашки с разведением аллицина 1/1024 об./об. Чашки оставляли для уравновешивания и высушивали при 44 С в течение 15 мин. Тестируемые микроорганизмы (табл. 1) культивировали на питательном бульоне при 37 С в течение 18 ч. 0,3 мкл неразведенных культур засевали на поверхность приготовленных высушенных чашек,используя многоточечный инокулятор. Чашки инкубировали при 37 С в течение 24 ч и наблюдали за ростом. Общее количество жизнеспособных организмов определяли по способу Милеса-Мисра (MilesMisra). Минимальные ингибиторные концентрации, установленные методом пробирочного разведения. Из тестируемых микроорганизмов Pseudomonas aeruginosa оказался наименее чувствительным к аллицину, a Candida albicans был наиболее чувствительным (табл. 3). Были рассчитаны величины MIC и МВС для аллицина и представлены в табл. 2. Полученный образец аллицина анализировали при концентрации 2000 ч. Минимальные ингибиторные концентрации, установленные с помощью многоточечного инокулятора.MIC определяли, используя многоточечный инокулятор (табл. 3). Величины MIC вычисляли, используя аллицин при концентрации 2000 ч./млн, и результаты хорошо согласовались с результатами, полученными способом пробирочного разведения. Противомикробную активность аллицина продемонстрировали в отношении одиннадцати микробных видов. Относительные чувствительности микроорганизмов отличались, Pseudomonas aeruginosa оказался наименее чувствительным, a Candida albicans был наиболее чувствительным. Стафилококки являются одним из наиболее важных видов бактерий, вызывающих заболевание у человека. Они являются нормальными обитателями верхних дыхательных путей, кожи, вагины и кишечника. Они являются представителями группы, называемой пиогенными кокками (гноеродными). Стафилококк легко передается от бессимптомных носителей (без признаков заболевания) или от субъектов с заболеванием через кожный контакт, аэрозоли или от неживых объектов. Стафилококк может вызывать патологический процесс почти в каждом органе и ткани организма.MIC и МВС, определенные методом пробирочного разведения Метициллин (или его родственные антибиотики) является одним из основных лекарственных средств, используемых для лечения инфекционных заболеваний, вызванных Staphylococcus aureus. Метициллинрезистентные Staphylococcus aureus (MRSA) являются основной нозокомиальной проблемой(инфекции, вызванные штаммами, приобретенными в больнице). Большинство из названных штаммов являются резистентными к большому разнообразию антибиотиков (включая некоторые из наиболее последних). Некоторые штаммы также являются резистентными к агентам, таким как мупироцин, используемый в настоящее время для борьбы с бессимптомным носительством и образованием колоний в больницах. В некоторых отделениях интенсивной терапии 10-20% пациентов может быть заражено MRSA. С помощью диффузионных тестов определяют чувствительность изолятов к противомикробным средствам, измеряя зоны ингибирования вокруг совокупного показателя противомикробного средства. Однако названные тесты являются наиболее общими тестами, используемыми для обследования на противомикробную резистентность. Зоны ингибирования не менее 6 мм, которые меньше зон известного контрольного штамма, указывают на бактериальную чувствительность к противомикробному средству. Размеры зон 12 мм или меньше обычно указывают на резистентность, также между указанными уровнями существует промежуточная резистентная группа. Используя приведенные выше критерии, в следующих примерах при сравнении размеров зон с размерами зон чувствительного к антибиотику контроля клинические изоляты классифицировали как (i) резистентные к мупироцину, (ii) промежуточно резистентные и (iii) чувствительные к мупироцину. Бактериальные штаммы. 30 клинических изолятов и один контрольный штамм Staph aureus (Оксфордский штамм, NCTC 6571) тестировали в фазе 1 испытаний. Все штаммы были предоставлены Королевскими госпиталями(Royal London и St Bartholomew's) в Лондоне и были идентифицированы как имеющие множественную резистентность к антибиотикам. Впоследствии семнадцать из названных штаммов плюс контроль были отобраны для фазы 2 испытаний. Фаза 1. Диффузионный анализ. Первоначально упомянутые испытания проводили, чтобы тестировать эффективность кремов. Однако результаты исследования кремов сравнивали с результатами тестирования чесночной и аллициновой жидкости, используя способы стандартных агаровых лунок. Резистентность к мупироцину подтверждали, используя диффузионный тест со стандартным бумажным диском (Unipath Ltd). Чашки с агаром Мюллера-Гинтона (Muller-Hinton) засевали (газонный слой) стандартизированной концентрацией Staph.aureus. Чашки оставляли для высушивания на воздухе. Круглые лунки стандартного размера вырезали в агаровой культуральной среде и заполняли одинаковым количеством (100 мкл) крема или раствора. Противобактериальную активность определяли при измерении зон ингибирования, образовавшихся вокруг каждой лунки.-8 013519 Чувствительность к мупироцину. Оксфордский Staph. aureus образовывал зону размером 35 мм. 5 штаммов идентифицировали как полностью чувствительные (размеры зон от 33 до 45 мм), 12 зон показали промежуточную чувствительность (размеры зон между 12 и 23 мм) и 13 штаммов оказались резистентными (никакой зоны ингибирования). Активность раствора аллицина. Показано, что водный раствор жидкости аллицина является высокоактивным в отношении всех штаммов Staph. aureus, тестированных вплоть до уровней 250 ч./млн, (фиг. 1). Активность аллицинового крема. Когда составляли обычный водный крем, обнаружили, что аллицин является высокоактивным в отношении всех штаммов при концентрациях 500 ч./млн. Указанные концентрации соответствуют подходящим уровням для применения как местного средства (фиг. 2). Фаза 2. Минимальные ингибиторные концентрации (MIC) и минимальные бактерицидные концентрации (МВС) для аллицина в отношении Staphylococcus aureus. Тестировали семнадцать клинических изолятов (выбранных из группы штаммов фазы 1) и один контрольный штамм (Оксфордский штамм, NCTC 6571) Staph. aureus. Каждый штамм культивировали в течение ночи при 37 С в бульоне Мюллера-Гинтона (Oxoid Ltd. СМ 405). Культуры разводили названным бульоном, чтобы получить концентрацию Log 7 КОЕ/мл, использовали десятикратную конечную концентрацию. 2 мл водного раствора аллицина (в концентрации 5000 ч./млн) добавляли к 8 мл бульона МюллераГинтона (бульон концентрировали, чтобы избежать эффекта разведения среды) и вдвое разводили, чтобы получить область концентраций между 1000 ч./млн (мкг/мл) и 1 ч./млн (мкг/мл) плюс 0 ч./млн (мкг/мл) в отрицательном контроле. 1 мл каждой смеси отбирали из каждой среды и добавляли 1 мл бактериального концентрата, достигая конечной концентрации приблизительно Log 6 КОЕ/мл. Названные бульонные культуры инкубировали в течение ночи при 37 С. На следующий день бульоны исследовали относительно роста (мутные культуры). Наиболее низкую концентрацию, не показавшую никакого роста (прозрачную), рассматривали как MIC. Культуру, содержащую MIC и все вышеприведенные концентрации, субкультивировали на чашках с питательным агаром (Oxoid Ltd, СМ 3), чтобы определить МВС. Отбирали 0,1 мл каждой культуры и культивировали. Культуру с наиболее высокой концентрацией, при которой наблюдали рост (мутность) при исследовании MIC, также субкультивировали как позитивный контроль. Чашки инкубировали в течение ночи при 37 С. Наиболее высокую концентрацию, при которой наблюдали рост (видимые бактериальные колонии), рассматривали как МВС. Для приготовления крема или раствора для клинического применения против Staphylococcus aureus важно установить оптимальные концентрации противомикробного средства, которое проявляет активность в отношении тестируемых штаммов. Результаты сопоставлены в табл. 4 ниже. Исследованный контрольный штамм (Оксфордский Staph. aureus) показал MIC 32 мкг/мл и МВС 256 мкг/мл. MICs для 17 тестированных клинических изолятов составляли или 16, или 32 мкг/мл, MBCs составляли или 128, или 256 мкг/мл. Большинство клинических изолятов имели MICs 16 мкг/мл и MBCs 128 мкг/мл, см. табл. 5. Таблица 5 88% клинических изолятов имели MICs 16 мкг/мл и 88% клинических изолятов имели MBCs 128 мкг/мл, см. фиг. 3. Из 17 тестированных штаммов 3 оказались чувствительными к мупироцину (как показано дисковым диффузионным тестом), 8 проявили промежуточную чувствительность и 6 оказались резистентными. Все 6 резистентных к мупироцину штаммов имели MICs 16 мкг/мл, 4 штамма имели На основании полученных результатов оказалось очевидным, что активность аллицина в концентрации 500 и 1000 ч./млн соответствовала активности 1 к 10 и 1 к 5 разведениям грубого экстракта чеснока; 88% штаммов показали минимальные ингибиторные концентрации для аллицина 16 мкг/мл и 100% штаммов ингибировались аллицином при концентрации 32 мкг/мл; 88% штаммов показали минимальные бактерицидные концентрации для аллицина 128 мкг/мл и 100% штаммов уничтожались аллицином при концентрации 256 мкг/мл. Аллицин оказался высокоэффективным в отношении как охарактеризованных, так и диких штаммов MRSA. Кроме определения минимальной ингибиторной концентрации (MIC) проводили тестирование аллицина в отношении ряда грамположительных и грамотрицательных бактериальных видов относительно селекции девяти бактериальных изолятов при более близких разведениях водных растворов аллицинаStaphylococcus aureus: Оксфордский контрольный штамм (ОХ) и 2 лаб. изолята MRSA (102103)Escherichia coli (палочки) Оксфордскую изочувствительную агаровую среду стерилизовали и охлаждали приблизительно до 45-50 С перед применением. Получали серийные разведения водного аллицина (аллимакс) в концентрации 5000 ч./млн в изочувствительном бульоне. 2 мл из каждого разведения аллицина добавляли в каждую стерильную чашку Петри (каждый тест проводили в двух копиях). 18 мл охлажденной среды добавляли к аллицину, смешивали и оставляли для охлаждения и затвердевания. Бактериальные образцы готовили как посевной материал 106 КОЕ/мл и 0,02 мл засевали на каждую чашку, используя многоточечный инокулятор. В каждую серию опытов включали отрицательные контроли. Проведенные исследования выявили ряд MICs среди выбранных образцов грамположительных и грамотрицательных видов бактерий, наиболее чувствительными видами были стафилококки, характеризующиеся MIC между 15 и 41 ч./млн. Наиболее резистентным грамотрицательным видом оказался Pseudomonas aeruginosa (MIC 378 ч./млн) и наиболее резистентным грамположительным видом оказалась палочка Serratia marcescens (MIC 170 ч./млн). Жидкие экстракты аллицина были высокоактивными в отношении клинических изолятов Staphylococcus aureus с множественной резистентностью к антибиотикам, включая те штаммы, которые были идентифицированы как резистентные к мупироцину. Крем-препараты показали подходящие уровни активности при концентрации 500 мкг/мл, что подтверждает применение аллицинового крема как местного средства против мупироцинрезистентных и мупироцинчувствительных штаммов Staphylococcus aureus с множественной резистентностью к антибиотикам. Следуя аналогичной методике, подобные испытания проводили также для сравнения эффективности аллицина с эффективностью стрептомицина в отношении шести штаммов MDRTB (множественная лекарственная резистентность туберкулеза). Результаты представлены в табл. 7. В присутствии противомикробного средства любой рост микобактерий туберкулеза оказывается очень важным. Из полученных результатов понятно, что, в то время как отмечали рост на всех скошенных агарах, на которых штаммы обрабатывали стрептомицином, не обнаруживали никакого роста ни на одном из скошенных агаров, обработанных аллицином (водный раствор при концентрации 500 ч./млн). Кроме того, затем проводили исследования инсектицидных свойств аллицина, в частности его педикулоцидной активности в отношении головных вшей (Pediculus humanus). Контроль заражения головными вшами по традиции осуществляли, используя обычные инсектициды с некоторым избытком. Однако в некоторых частях мира появились штаммы головных вшей, которые устойчивы к одному или более из названных инсектицидов. В испытании взрослых самцов и самок вшей использовали приблизительно в равном количестве. Вшей кормили в начале испытания и оставляли минимально на четыре часа для акклиматизации, время,в течение которого они могли выделить избыток воды, поглощенной с насасываемой ими порцией крови. В экспериментальные серии включали по двадцать вшей и помещали их на квадраты открытой сетчатой нейлоновой ткани (тюль) как на субстрат. Каждую серию размещали на маркированной 30-мм пластиковой чашке Петри. Аликвоту приблизительно 5-10 мл аллицина в концентрации 5000 ч./млн в водном растворе наливали на основание чистой 30-мм пластиковой чашки Петри. Ткань, несущую вшей, погружали в жидкость на 10 с, во время которых ткань вращали по крайней мере дважды, чтобы обеспечить удаление пузырьков воздуха. После удаления из жидкости ткань и насекомых слегка промокали, чтобы устранить избыток жидкости, и возвращали в маркированную чашку Петри. Процедуру повторяли на других подобных квадратах ткани в той серии. Тканевые квадраты, несущие вшей, инкубировали при нормальных условиях содержания (302,Cand 50%15% повышенная влажность) в течение ночи. В конце периода экспозиции, насекомых и ткань промывали, используя мягкий косметический шампунь (Boots Frequent Wash Shampoo), разведенный одна часть шампуня к четырнадцать частям воды, после чего их три раза промывали, используя 250 мл теплой водопроводной воды (34 С), которую наливали через или на тканевые квадраты. Затем тканевые квадраты промокали досуха, используя медицинскую ткань для вытирания, и инкубировали при нормальных условиях содержания в чистой пластиковой чашке Петри соответствующего размера в течение одного часа. Обеспечивали порцией крови. Вшей оставляли на четыре часа для восстановления, прежде чем еще раз обрабатывали, как описано выше. Результаты трех испытаний представлены в табл. 8 в сравнении с контрольными сериями, которые обрабатывали 60% изопропиловым спиртом через 24 ч и 48 ч. Таблица 8 Как можно видеть, аллицин показывает приемлемую эффективность в течение ночи при общей смертности 57,8% по сравнению со смертностью контроля 11%. Однако после порции насасываемой крови и второй обработки эффективность аллицина становится 98,4% против контроля 28,6%. 2. Синергическое действие аллицина в комбинации с другими противомикробными средствами. Для оценки активности аллицина в отношении контрольных штаммов и клинических изолятовStaphylococcus aureus и Escherichia coli обследовали большое разнообразие антибиотиков, используя способы диффузии в чашках, относительно резистентности к антибиотикам и чувствительности к антибио- 13013519 тикам бактерий. Использовали оксфордскую изочувствительную среду (ISA, СМ 471, Oxoid, Basingstoke, UK). Названная среда рекомендована для тестирования противомикробной чувствительности Британским обществом противомикробной химиотерапии (BSAC). Использовали способы, предписанные BSAC (BSAC,2001). Для каждой серии опытов проводили предварительные тесты, чтобы оптимизировать посевной материал, концентрацию аллицина и расстояние на чашке между тестируемыми агентами. Бактериальные штаммы: один чувствительный к антибиотику контроль (Staph. aureus, NCTC 6571),2 метициллинрезистентных Staph. aureus (MRSA) и E. coli, K12. Антибиотики: тестировали 22 антибиотика; см. табл. 9. Процедура. Для каждого теста (проводили в трех копиях). 1. Приготовить культуру, выращенную в течение ночи. 2. Приготовить посевной материал, чтобы получить плотный, но не сплошной рост на стандартизированных 25-мл чашках агара. Высушить поверхность чашки. 3. Применение 6-мм стерильного пробкового бура, чтобы вырезать лунки в чашке, добавить 150 мкл аллицина. 4. Добавить антибиотический диск. 5. Инокулировать в течение ночи при 37 С. 6. Оценить синергизм (слияние зон), антагонизм (снижение в зоне ингибирования) или отсутствие эффекта. Получить большое количество результатов, чтобы выбрать те комбинации, которые следует тестировать в фазе 2 испытаний. Результаты. Первую серию экспериментов проводили, чтобы определить, оказывает ли изменение концентрации аллицина какое-либо влияние на возможный синергизм. В табл. 10 показано взаимодействие 8 антибиотиков с аллицином при двух концентрациях (500 250 ч./млн). Размеры зон даны в миллиметрах.Staph. aureus: размеры зон для концентрации аллицина 250 ч./млн были между 5 и 9 мм и были меньше, чем размеры зон для 500 ч./млн аллицина. Е. coli: размеры зон для концентрации аллицина 250 ч./млн составляли между 1 и 12 мм и были меньше, чем размеры зон для 500 ч./млн аллицина. Вообще размеры зон были меньше, чем размеры, полученные с Staph. aureus. Концентрацию 500 ч./млн выбрали для дальнейших испытаний, чтобы область взаимодействия между аллицином и антибиотиком была больше. Также не выявили никаких неубедительных результатов при использовании концентрации 500 ч./млн, но которые получали при использовании концентрации 250 ч./млн (табл. 10 - результаты отмечены ). Результаты, представленные в табл. 9, демонстрируют комбинации антибиотиков, выбранные для дальнейших исследований. Выбрали двенадцать комбинаций, все из которых имели оценку степени реакции больше 5. Комбинации с оценками выше 5, которые не были выбраны, содержали антибиотики,относящиеся к уже исследованной группе (например, группе аминогликозидаз). Гентамицин и тобрамицин, оба, были выбраны вследствие их обычного употребления при лечении пациентов и их высоких оценок степени. В табл. 9 представлены результаты исследования сравнительной синергической активности 22 антибиотиков с аллицином в концентрации 500 ч./млн. Оценки степени реакции связывали с возможной степенью синергизма, который определяли, используя тесты диффузии в агаре. Таблица 9- 14013519 Хотя чувствительный к антибиотикам контрольный штамм (Оксфорд) показал наибольшее число высоких оценок степени реакции, штаммы MRSA также показали хороший потенциал и отмечен возможный синергизм тетрациклина с Е. coli. На фиг. 5-9 продемонстрировано, как различные синергические взаимодействия распределились по степени. Данные испытания четко продемонстрировали потенциал противомикробного синергического действия аллицина и большого разнообразия антибиотиков в отношении Staphylococcus aureus, включаяR = результат, A1 = размер зоны аллицина. Результаты - S = синергизм, N = нет синергизма,= неубедительные данные, А = возможный антагонизм. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Противобактериальный или педикулоцидный препарат, содержащий аллицин или метаболит аллицина и фармацевтически приемлемый эксципиент и дополнительно содержащий по крайней мере одно другое противобактериальное или педикулоцидное средство. 2. Препарат по п.1, в котором другое средство выбрано из (i) пенициллинов, (ii) аминогликозидаз,(iii) тетрациклинов, (iv) макролидов, (v) цефалоспоринов и цефамицинов и (vi) фузидиновой кислоты,рифампицина, новобиоцина, ванкомицина, ципрофлоксацина, хлорамфеникола или метронидазола. 3. Препарат по п.1 или 2, в котором метаболит аллицина выбран из DADS (диаллилдисульфида),DATS (диаллилтрисульфида), эдзоена, аллитридия и винилдитиинов. 4. Препарат по любому из пп.1-3, в котором фармацевтически приемлемый эксципиент представляет собой твердую композицию, на которой связан аллицин. 5. Препарат по п.4, в котором твердая композиция содержит модифицированный крахмал, такой как мальтодекстрин, аравийская камедь, диоксид кремния и эмульгатор, такой как стеарат магния. 6. Препарат по любому из пп.1-3, в котором фармацевтически приемлемый эксципиент представляет собой крем или мыло.- 15013519 7. Препарат по п.6, в котором эксципиент включает белый полутвердый парафин, эмульгатор, глицерин, воду, желтый полутвердый парафин и стабилизатор. 8. Препарат по п.7, в котором эмульгатор представляет собой стеарат, предпочтительно стеарат магния. 9. Препарат по п.8, в котором эксципиент включает оксисульфат, кокамид и кокобетаин. 10. Препарат по любому из пп.4-9, в котором отношение аллицина к наполнителю является таким, которое обеспечивает концентрацию аллицина от 1 до 2000 ч./млн, предпочтительно от 50 до 1000 ч./млн, более предпочтительно от 250 до 500 ч./млн.
МПК / Метки
МПК: A61P 31/04, A61P 33/00, A61K 31/095
Метки: аллицин, препарат, противобактериальный, содержащий, педикулоцидный
Код ссылки
<a href="https://eas.patents.su/19-13519-protivobakterialnyjj-ili-pedikulocidnyjj-preparat-soderzhashhijj-allicin.html" rel="bookmark" title="База патентов Евразийского Союза">Противобактериальный или педикулоцидный препарат, содержащий аллицин</a>
Предыдущий патент: Кристаллические полиморфные формы n-[8(2-гидроксибензоил)амино]каприлата натрия
Следующий патент: Ингибиторы протеазы вич
Случайный патент: Четвертичные аммониевые соединения для пенной флотации силикатов из железной руды