2, 6 – бисгетероарил – 4 – аминопиримидины в качестве антагонистов аденозиновых рецепторов
Номер патента: 10568
Опубликовано: 30.10.2008
Авторы: Прат Киньонес Мария, Гуал Ройг Сильвия, Креспо Креспо Мария Изабель, Кастро Паломино Лария Хулио Сезар, Сли Дебора Х.
Формула / Реферат
1. Соединение формулы (I)
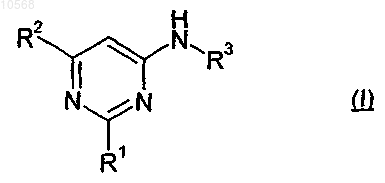
в которой R1 выбирают из группы, состоящей из фурила, тиенила, пиразолила, тиазолила, триазолила, пиридила, где каждый необязательно замещен 1 или 2 заместителями, выбранными из атомов галогена или метильной группы;
R2 выбирают из группы, состоящей из фурила, тиенила, пиразолила, тиазолила, триазолила, пиридила, бензотиазолила, где каждый необязательно замещен 1 или 2 заместителями, выбранными из трифторметила или метильной группы;
R3 представляет собой группу, выбранную из -COR4, -CONHR4, -COOR4 и -R6, где
R4 представляет собой группу, выбранную из
прямой или разветвленной C1-5алкильной группы, которая необязательно замещена одним или более атомом галогена или одной или более С3-6циклоалкильной, гидрокси, амино, моно- или ди(С1-5)алкиламиногруппой;
группы формулы
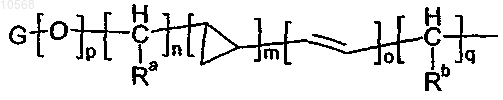
в которой m, o и p независимо равны 0 или 1;
n и q независимо выбирают из целых чисел от 0 до 6;
Ra и Rb независимо представляют собой атом водорода или метильную группу;
G представляет собой группу, выбранную из С3-6циклоалкильной, фенильной, пиридильной, имидазолильной, пиридазинильной, фурильной, тиенильной, бензотиазолильной, хинолинильной и нафталенильной группы, которая необязательно замещена одним или более атомом галогена либо одной или более дифторметокси, гидрокси или метоксигруппой;
R6 представляет собой группу, выбранную из
атомов водорода,
прямой или разветвленной C1-5алкильной группы, которая необязательно замещена одним или более атомом галогена либо одной или более С3-6циклоалкильной, гидрокси, амино, моно- или ди(C1-5)алкиламино группой,
группы формулы
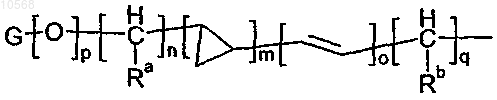
в которой m равен 0 или 1;
o и p равны 0;
n и q независимо выбирают из целых чисел от 0 до 6;
Ra и Rb независимо представляют собой атом водорода или метильную группу;
G представляет собой группу, выбранную из С3-6циклоалкильной, фенильной, пиридильной и имидазолильной группы, которая необязательно замещена одной или двумя метоксигруппами;
или его фармацевтически приемлемые соли;
при условии, что данное соединение не является одним из
2,6-дипиридин-4-илпиримидин-4-амина,
4-(3-метоксианилино)-2,6-ди(2-пиридинил)пиримидина,
4-(2,5-диметоксианилино)-2,6-ди(2-пиридинил)пиримидина,
4-(5-метокси-2-метиланилино)-2,6-ди(2-пиридинил)пиримидина,
4-(2-метокси-5-метиланилино)-2,6-ди(2-пиридинил)пиримидина,
4-(2-хлор-5-метоксианилино)-2,6-ди(2-пиридинил)пиримидина и
4-(2,5-диметиланилино)-2,6-ди(2-пиридинил)пиримидина.
2. Соединение по п.1, в котором R6 представляет собой группу, выбранную из
атомов водорода;
прямой или разветвленной C1-5алкильной группы, которая необязательно замещена одним или более атомом галогена либо одной или более С3-6циклоалкильной, гидрокси, амино, моно- или ди(С1-5)алкиламино группой;
группы формулы
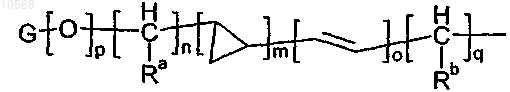
в которой m равен 0 или 1;
o и p равны 0;
n и q независимо выбирают из целых чисел от 0 до 6;
Ra и Rb независимо представляют собой атом водорода или метильную группу;
G представляет собой группу, выбранную из С3-6циклоалкильной, фенильной, пиридильной и имидазолильной группы, которая необязательно замещена одной или двумя метоксигруппами;
при условии, что, когда р, m и o одновременно равны нулю, G не представляет собой необязательно замещенную фенильную группу.
3. Соединение по п.1 или 2, в котором R1 выбирают из группы, состоящей из фурила, тиенила и пиразолила, которая необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из атомов галогена и метильной группы.
4. Соединение по п.3, в котором R1 представляет собой незамещенную фурильную группу.
5. Соединение по любому из предыдущих пунктов, в котором R2 выбирают из группы, состоящей из пиразолила, фурила, тиазолила, пиридила, тиенила и триазолила, которая необязательно замещена одним или двумя заместителями, выбранным из трифторметила и метильной группы.
6. Соединение по любому из предыдущих пунктов, в котором R4 представляет собой группу, выбранную из
прямой или разветвленной C1-5алкильной группы, которая необязательно замещена одним или более атомом галогена;
группы, выбранной из С3-6циклоалкил-С1-5алкильной, фенилалкильной, гетероарилалкильной, феноксиалкильной и гетероарилоксиалкильной группы, которая необязательно замещена одним или более атомом галогена, одной или более метоксигруппой или дифторметокси.
7. Соединение по любому из предыдущих пунктов, в котором R6 представляет собой группу, выбранную из
атома водорода;
прямой или разветвленной C1-5алкильной группы, которая необязательно замещена одним или более атомом галогена;
группы, выбранной из С3-6циклоалкил-С1-5алкильной, фенилалкильной, гетероарилалкильной, феноксиалкильной и гетероарилоксиалкильной группы, которая необязательно замещена одним или более атомом галогена, одной или более метоксигруппой.
8. Соединение по любому из предыдущих пунктов, в котором R3 представляет собой атом водорода или группу, выбранную из группы формулы -COR4; где R4 представляет собой группу формулы
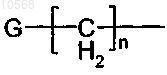
в которой n представляет собой целое число, выбранное из 0 или 1;
G представляет собой группу, выбранную из фенила или группы, выбранной из фенила, пиридила, имидазолила, пиридазила, фурила, тиенила, бензотиазолила, хинолинила и нафталенила, которая необязательно замещена одним или более атомом галогена, одной или более метоксигруппой или дифторметокси.
9. Соединение по любому из предыдущих пунктов, в котором R1 представляет собой 2-фурильную группу и R2 представляет собой пиразолильную группу, которая необязательно замещена одной или двумя метильными или трифторметильными группами.
10. Соединение по п.9, в котором R3 представляет собой атом водорода или группу, выбранную из группы формулы -COR4; где R4 представляет собой группу формулы
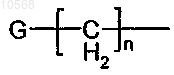
в которой n представляет собой целое число, выбранное из 0 или 1;
G представляет собой группу, выбранную из фенила или группы, выбранной из фенила, пиридила, имидазолила, пиридазила, фурила, тиенила, бензотиазолила, хинолинила и нафталенила, которая необязательно замещена одним или более атомом галогена, одной или более метоксигруппой или дифторметокси.
11. Соединение по п.1, которое представляет собой одно из следующих соединений:
2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-метилпропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2,2-диметилпропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]циклопропанкарбоксамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]циклобутанкарбоксамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]цилогексанкарбоксамид;
3-циклопентил-N-[2-(2-фурил-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-(4-метоксифенил)ацетамид;
2-(3,4-диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3-фенилпропанамид;
(2S)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-фенилциклопропанкарбоксамид;
3,3,3-трифтор-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
3-(3,4-диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-метил-3-фенилпропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3-феноксипропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3-пиридин-3-илпропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-пиридин-3-илацетамид;
(2Е)-3-(3,4-диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]акриламид;
6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-амин;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]ацетамид;
N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-(2-фурил)пиримидин-4-ил]пропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-2-метилпропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-2,2-диметилпропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]циклопропанкарбоксамид;
3-циклопентил-N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]пропанамид;
N-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-2-(4-метоксифенил)ацетамид;
2-(3,4-диметоксифенил)-N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]ацетамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-3-фенилпропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-3,3,3-трифторпропанамид;
3-(3,4-диметоксифенил)-N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]пропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-3-феноксипропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-2-пиридин-3-илацетамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-3-пиридин-3-илпропанамид;
2-(2-фурил)-6-(4-метил-1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(2-фурил)-6-(4-метил-1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
2-(2-фурил)-6-(3-метил-1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(2-фурил)-6-(3-метил-1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
2-(2-фурил)-6-[3-(трифторметил)-1H-пиразол-1-ил]пиримидин-4-амин;
N-{2-(2-фурил)-6-[3-(трифторметил)-1H-пиразол-1-ил]пиримидин-4-ил}пропанамид;
2-(2-фурил)-6-[5-метил-3-(трифторметил)-1H-пиразол-1-ил]пиримидин-4-амин;
N-{2-(2-фурил)-6-[5-метил-3-(трифторметил)-1H-пиразол-1-ил]пиримидин-4-ил}пропанамид;
2-(2-фурил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-амин;
N-[2-(2-фурил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]ацетамид;
N-[2-(2-фурил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]пропанамид;
3,3,3-трифтор-N-[2-(2-фурил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]пропанамид;
2-(5-бром-2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(5-бром-2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
2-(5-хлор-2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(5-хлор-2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
2-(5-метил-2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(5-метил-2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
N-[2-(2-фурил)-6-пиридин-3-илпиримидин-4-ил]пропанамид;
2-(2-фурил)-6-пиридин-3-илпиримидин-4-амин;
6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-амин;
N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]ацетамид;
N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]пропанамид;
3-циклопентил-N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]пропанамид;
3-фенил-N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]пропанамид;
3,3,3-трифтор-N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]пропанамид;
3-(3,4-диметоксифенил)-N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]пропанамид;
3-фенокси-N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]пропанамид;
N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]-2-пиридин-3-илацетамид;
N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]-3-пиридин-3-илпропанамид;
(2Е)-3-(3,4-диметоксифенил)-N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]акриламид;
6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-амин;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]ацетамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]пропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]-3,3,3-трифторпропанамид;
2-(2-тиенил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-амин;
N-[2-(2-тиенил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]ацетамид;
N-[2-(2-тиенил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]пропанамид;
3,3,3-трифтор-N-[2-(2-тиенил)-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]пропанамид;
N-[2-(3-метил-2-тиенил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
6-(2-фурил)-2-(1H-пиразол-1-ил)пиримидин-4-амин;
N-[6-(2-фурил)-2-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
N-[6-(2-фурил)-2-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
3,3,3-трифтор-N-[6-(2-фурил)-2-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
2-(3,5-диметил-1H-пиразол-1-ил)-6-(2-фурил)пиримидин-4-амин;
N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-(2-фурил)пиримидин-4-ил]пропанамид;
N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-(2-фурил)пиримидин-4-ил]-2-(4-метоксифенил)ацетамид;
6-(2-фурил)-2-(1H-1,2,4-триазол-1-ил)пиримидин-4-амин;
N-[6-(2-фурил)-2-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]пропанамид;
2-(1H-пиразол-1-ил)-6-пиридин-2-илпиримидин-4-амин;
N-[2-(1H-пиразол-1-ил)-6-пиридин-2-илпиримидин-4-ил]пропанамид;
2-(3,5-диметил-1H-пиразол-1-ил)-6-пиридин-2-илпиримидин-4-амин;
N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-пиридин-2-илпиримидин-4-ил]пропанамид;
N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-пиридин-2-илпиримидин-4-ил]-2-(4-метоксифенил)ацетамид;
2-(1H-пиразол-1-ил)-6-пиридин-3-илпиримидин-4-амин;
N-[2-(1H-пиразол-1-ил)-6-пиридин-3-илпиримидин-4-ил]пропанамид;
2-(3,5-диметил-1H-пиразол-1-ил)-6-пиридин-3-илпиримидин-4-амин;
N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-пиридин-3-илпиримидин-4-ил]пропанамид;
N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-пиридин-3-илпиримидин-4-ил]-2-(4-метоксифенил)ацетамид;
2-(1H-пиразол-1-ил)-6-пиридин-4-илпиримидин-4-амин;
N-[2-(1H-пиразол-1-ил)-6-пиридин-4-илпиримидин-4-амин;
6-(2-фурил)-2-пиридин-2-илпиримидин-4-амин;
N-[6-(2-фурил)-2-пиридин-2-илпиримидин-4-ил]пропанамид;
2-(3-метилпиридин-2-ил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(3-метилпиридин-2-ил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
6-(1H-пиразол-1-ил)-2-пиридин-3-илпиримидин-4-амин;
N-[6-(1H-пиразол-1-ил)-2-пиридин-3-илпиримидин-4-ил]ацетамид;
N-[6-(1H-пиразол-1-ил)-2-пиридин-3-илпиримидин-4-ил]пропанамид;
6-(3,5-диметил-1H-пиразол-1-ил)-2-пиридин-3-илпиримидин-4-амин;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-пиридин-3-илпиримидин-4-ил]ацетамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-пиридин-3-илпиримидин-4-ил]пропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-пиридин-3-илпиримидин-4-ил]-3,3,3-трифторпропанамид;
2-пиридин-3-ил-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-амин;
3,3,3-трифтор-N-[2-пиридин-3-ил-6-(1H-1,2,4-триазол-1-ил)пиримидин-4-ил]пропанамид;
6-(2-фурил)-2-пиридин-3-илпиримидин-4-иламин;
N-[6-(2-фурил)-2-пиридин-3-илпиримидин-4-ил]пропанамид;
N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-пиридин-4-илпиримидин-4-ил]пропанамид;
6-(3,5-диметил-1H-пиразол-1-ил)-2-пиридин-4-илпиримидин-4-амин;
6-(2-фурил)-2-пиридин-4-илпиримидин-4-иламин;
N-[6-(2-фурил)-2-пиридин-4-илпиримидин-4-ил]пропанамид;
6-(2-фурил)-2-(1,3-тиазол-2-ил)пиримидин-4-амин;
N-[6-(2-фурил)-2-(1,3-тиазол-2-ил)пиримидин-4-ил]пропанамид;
2-(4-фторфенил)-N-[6-(2-фурил)-2-(1,3-тиазол-2-ил)пиримидин-4-ил]ацетамид;
N-(циклопропилметил)-2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
(2R)-2-{[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]амино}пропан-1-ол;
3-{[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]амино}пропан-1-ол;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]этан-1,2-диамин;
2-(2-фурил)-N-[2-(4-метоксифенил)этил]-6-(1H-пиразол-1-ил)пиримидин-4-амин;
N-[2-(3,4-диметоксифенил)этил]-2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
2-(2-фурил)-6-(1H-пиразол-1-ил)-N-[2-(пиридин-2-ил)этил]пиримидин-4-амин;
2-(2-фурил)-6-(1H-пиразол-1-ил)-N-[2-(пиридин-3-ил)этил]пиримидин-4-амин;
2-(2-фурил)-N-(3-фенилпропил)-6-(1H-пиразол-1-ил)пиримидин-4-амин;
2-(2-фурил)-N-[3-(1H-имидазол-1-ил)пропил]-6-(1H-пиразол-1-ил)пиримидин-4-амин;
N-(циклопропилметил)-6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-амин;
(2R)-2-{[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]амино}пропан-1-ол;
3-{[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]амино}пропан-1-ол;
N-(2-аминоэтил)-N-[6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]амин;
N-[2-(4-метоксифенил)этил]-6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-амин;
N-[2-(3,4-диметоксифенил)этил]-6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-амин;
6-(1H-пиразол-1-ил)-N-(2-пиридин-3-илэтил)-2-(2-тиенил)пиримидин-4-амин;
6-(1H-пиразол-1-ил)-N-(2-пиридин-2-илэтил)-2-(2-тиенил)пиримидин-4-амин;
N-(3-фенилпропил)-6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-амин;
N-[3-(1H-имидазол-1-ил)пропил]-6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-амин;
этил 6-(1H-пиразол-1-ил)-2-(2-тиенил)пиримидин-4-ил]карбамат;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-N'-[(1S*,2R*)-2-фенилциклопропил]мочевина (*относительная трансконфигурация);
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-N'-пропилмочевина;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-N'-изопропилмочевина;
N-циклопентил-N'-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]мочевина;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-N'-(4-метоксифенил)мочевина;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-N'-(2-фенилэтил)мочевина;
N-бензил-N'-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]мочевина;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3-метилбутанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3,3-диметилбутанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]циклопентанкарбоксамид;
2-хлор-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-фенилацетамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-фенилацетамид;
2-(4-фторфенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-(3-метоксифенил)ацетамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-(2-метоксифенил)ацетамид;
2-(3,4-дихлорфенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
2-(1,3-дибензодиоксол-5-ил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
2-(3,4-дигидроксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
2-(2,5-диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
2-(4-хлор-3-метилфенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
2-(3,5-диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
2-[3-(бензилокси)-4-метоксифенил]-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
2-[4-(циклобутилокси)-3-метоксифенил]-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-(4-дифторметокси-3-метоксифенил)ацетамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-(3,4,5-триметоксифенил)ацетамид;
2-(3,4-диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]бензамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3,4-диметоксибензамид;
2,6-дифтор-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]бензамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-фурамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]тиофен-2-карбоксамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]никотинамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]изоникотинамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-1-нафтамид;
N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]хинолин-2-карбоксамид;
(2Е)-3-(3,4-диметоксифенил)-N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]акриламид;
2-(2-фурил)-6-(2H-1,2,3-триазол-2-ил)пиримидин-4-амин;
2-(2-фурил)-6-(1H-1,2,3-триазол-1-ил)пиримидин-4-амин;
N-[2-(2-фурил)-6-(2H-1,2,3-триазол-2-ил)пиримидин-4-ил]пропанамид;
2-(3,4-диметоксифенил)-N-[2-(2-фурил)-6-(2H-1,2,3-триазол-2-ил)пиримидин-4-ил]ацетамид;
N-[2-(2-фурил)-6-(1H-1,2,3-триазол-1-ил)пиримидин-4-ил]пропанамид;
2-(2-фурил)-6-(1,3-тиазол-2-ил)пиримидин-4-амин;
N-[2-(2-фурил)-6-(1,3-тиазол-2-ил)пиримидин-4-ил]пропанамид;
3-(3,4-диметоксифенил)-N-[2-(2-фурил)-6-(1,3-тиазол-2-ил)пиримидин-4-ил]пропанамид;
2,6-ди-2-фурилпиримидин-4-амин;
N-(2,6-ди-2-фурилпиримидин-4-ил)-2-(3,4-диметоксифенил)ацетамид;
6-(1,3-бензотиазол-2-ил)-2-(2-фурил)пиримидин-4-амин;
2-(5-метил-2-фурил)-6-(1,3-тиазол-2-ил)пиримидин-4-амин;
6-(1,3-тиазол-2-ил)-2-(2-тиенил)пиримидин-4-амин;
2-(3,4-диметоксифенил)-N-[6-(2-фурил)-2-(1,3-тиазол-2-ил)пиримидин-4-ил]ацетамид;
6-(1H-пиразол-1-ил)-2-(1,3-тиазол-2-ил)пиримидин-4-амин;
2-(3,4-диметоксифенил)-N-[6-(1H-пиразол-1-ил)-2-(1,3-тиазол-2-ил)пиримидин-4-ил]ацетамид;
2-(2-фурил)-N-метил-6-(1,3-тиазол-2-ил)пиримидин-4-амин;
N-(циклопропилметил)-2-(2-фурил)-6-(1,3-тиазол-2-ил)пиримидин-4-амин;
N-[2-(3,4-диметоксифенил)этил]-2-(2-фурил)-6-(1,3-тиазол-2-ил)пиримидин-4-амин;
N-(циклопропилметил)-6-(2-фурил)-2-(1,3-тиазол-2-ил)пиримидин-4-амин;
N-[2-(3,4-диметоксифенил)этил]-6-(2-фурил)-2-(1,3-тиазол-2-ил)пиримидин-4-амин;
6-(2-фурил)-N-(2-пиридин-3-илэтил)-2-(1,3-тиазол-2-ил)пиримидин-4-амин;
6-(2-фурил)-N-[(1S*,2R*)-2-фенилциклопропил]-2-(1,3-тиазол-2-ил)пиримидин-4-амин (*относительная трансконфигурация);
этил[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]карбамат;
циклопентилметил[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]карбамат;
бензил[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]карбамат;
3,4-диметоксибензил[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]карбамат;
пиридин-3-илметил[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]карбамат;
4-метоксифенил[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]карбамат и
3,4-диметоксифенил[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]карбамат.
12. Фармацевтическая композиция, содержащая соединение по любому из пп.1-11, смешанное с фармацевтически приемлемым разбавителем или носителем.
13. Применение соединения по любому из пп.1-11 для получения лекарственного средства для лечения патологического состояния или заболевания, поддающегося улучшению путем антагонизма аденозиновых рецепторов.
14. Применение соединения по п.13, где патологическое состояние или заболевание представляет собой ишемию, суправентрикулярную аритмию, острую почечную недостаточность, нарушение реперфузии миокарда, аллергические реакции, включая в себя, но не ограничиваясь, риниты, крапивницу, артриты склеродермы, другие аутоиммунные болезни, воспалительные заболевания внутренних органов, астму, сахарный диабет, ожирение, болезнь Паркинсона, болезнь Хантингтона, дистонии, такие как синдром "усталых ног", дискинезии, такие как дискинезии, вызванные продолжительным использованием нейролептических или допаминергических препаратов, или расстройства сна.
15. Применение соединения по любому из пп.1-11 фыя получения лекарственного средства для лечения патологического состояния или заболевания, поддающегося улучшению путем антагонизма аденозинового рецептора A2A.
16. Применение по п.15, где патологическое состояние или заболевание представляет собой ишемию, суправентрикулярную аритмию, болезнь Паркинсона, болезнь Хантингтона, дистонии, такие как синдром "усталых ног", дискинезии, такие как дискинезии, вызванные продолжительным использованием нейролептических или допаминергических препаратов, или расстройства сна.
17. Объединенный продукт, содержащий соединение по любому из пп.1-11, и другое соединение, выбранное из (a) L-DOPA, (b) допаминовых антагонистов, (с) ингибиторов допаминдекарбоксилазы, (d) ингибиторов катехол-O-метилтрансферазы и (е) ингибиторов моноаминоксидазы, для одновременного, раздельного или последовательного применения.
18. Соединение по п.1, в котором R3 представляет собой -COR4.
19. Соединение по п.18, в котором R2 представляет собой пиразол, замещенный пиразол, тиазол или замещенный тиазол и R1 представляет собой фуран или замещенный фуран.
20. Соединение по п.19, в котором R2 представляет собой пиразол, замещенный пиразол, тиазол или замещенный тиазол и R1 представляет собой фуран или замещенный фуран.
21. Соединение по п.20, в котором R2 представляет собой пиразол или тиазол и R1 представляет собой фуран или метилфуран.
22. Соединение по п.21, в котором R4 представляет собой моноалкиламиналкил или диалкиламиналкил.
23. Соединение по п.22, в котором соединение выбирают из группы
N-(2-фуранил-6-пиразол-1-илпиримидин-4-ил)-2-метиламиноацетамид;
2-диметиламино-N-(2-фуран-2-ил-6-пиразол-1-илпиримидин-4-ил)ацетамид;
2-метиламино-N-[2-(5-метилфуран-2-ил)-6-тиазол-2-илпиримидин-4-ил]ацетамид;
2-диэтиламино-N-[2-(5-метилфуран-2-ил)-6-тиазол-2-илпиримидин-4-ил]ацетамид.
24. Соединение по п.23, в котором соединение представляет собой N-[2-(5-метилфуран-2-ил)-6-тиазол-2-илпиримидин-4-ил]-2-пиридин-3-илпропионамид или N-[2-(5-метилфуран-2-ил)-6-тиазол-2-илпиримидин-4-ил]-3-пиридин-3-илпропионамид.
Текст
010568 Уровень техники изобретения Область, к которой относится изобретение Настоящее изобретение относится к новым антагонистам аденозиновых рецепторов, в частности к антагонисту аденозинового рецептора подтипа A2A, применению упомянутых соединений для лечения заболеваний и расстройств, которые могут улучшаться путем антагонизма аденозиновых рецепторов,особенно для лечения расстройств центральной нервной системы, которые, как известно, улучшаются при использовании антагонистов аденозиновых рецепторов A2A, более конкретно двигательных расстройств, таких как болезнь Паркинсона, синдром "усталых ног" и дискинезия, и к фармацевтическим композициям, содержащим упомянутые соединения. Описание предшествующего уровня техники Воздействие аденозина передается по меньшей мере через четыре особых клеточных мембранных рецептора, далее называемых и классифицируемых как рецепторы A1, A2A, A2B и A3, принадлежащие семейству рецепторов, связанных с G белком. Рецепторы A1 и A3 понижающе регулируют клеточные уровни cAMP путем их связывания с G белками, которые ингибируют аденилатциклазу. Напротив, рецепторы A2A и A2B связываются G белками, которые активируют аденилатциклазу и увеличивают внутриклеточные уровни cAMP. Через указанные рецепторы аденозин регулирует широкий диапазон физиологических функций. Таким образом, в сердечно-сосудистой системе активация рецептора A1 защищает сердечную ткань от воздействий ишемии и гипоксии. Подобный защитный эффект также создается за счет антагонизма рецептора A2A, который усиливает вызываемые рецептором A1 антиадренергические реакции и может также быть полезным при лечении острой ишемии миокарда и суправентрикулярной аритмии(Norton G.R. et al. Am. J. Physiol. 1999; 276 (2 Pt. 2): H341-9; Auchampach J.A., Bolli R. Am. J. Physiol. 1999; 276 (3 Pt. 2): H1113-6). Кроме того, аденозиновый рецептор подтипа A2B (Feoktistov, I. et al.,Pharmacol. Rev. 1997, 49, 381-402) вовлечен в регулирование сосудистого тонуса и регулирование роста сосудистых гладких мышц. В почке аденозин влияет на двухфазное действие, включая вазодилатацию при высоких концентрациях и вазоконстрикцию при низких концентрациях. Таким образом, аденозин играет роль в патогенезе некоторых форм острой почечной недостаточности, которая может облегчаться антагонистами рецептораA1 (Costello-Boerrigter L.C., et al. Med Clin North Am. 2003 Mar.; 87(2):475-91; Gottlieb S.S., Drugs. 2001; 61(10): 1387-93). Аденозин также участвует в физиопатологии иммунной системы. Он может вызывать дегрануляцию активированных тучных клеток человека через рецепторы A2B и/или A3. Таким образом, антагонисты A2B и/или A3 предотвращают дегрануляцию тучных клеток и поэтому применимы для лечения, предотвращения или подавления болезненных состояний, вызываемых активацией рецептора A2B и/или A3 и дегрануляцией тучных клеток. Указанные болезненные состояния включают, но не ограничиваются ими,астму, нарушение реперфузии миокарда, аллергические реакции, включая, но не ограничиваясь ими, риниты, крапивницу, артриты склеродермы, другие аутоиммунные болезни и воспалительные заболевания внутренних органов. Кроме того, в дыхательной системе аденозин вызывает бронхоконстрикцию, корректирует воспаление дыхательных путей и помогает хемотаксису нейтрофилов. Поэтому аденозиновый антагонист был бы особенно полезен при лечении астмы. В желудочно-кишечной и метаболической системе аденозиновый рецептор подтипа A2B (Feoktistov,I. et al., Pharmacol. Rev. 1997, 49, 381-402), по-видимому, вовлечен в регулирование продуцирования печеночной глюкозы, корректирование кишечного тонуса так же, как и кишечной секреции. Поэтому антагонисты A2B также могут быть полезны при лечении сахарного диабета и ожирения. В центральной нервной системе аденозин представляет собой сильный эндогенный нейромодулятор, который регулирует пресинаптическое высвобождение многих нейротрансмиттеров и, таким образом, принимает участие в моторной функции, сне, беспокойстве, боли и психомоторной активности. Все подтипы аденозиновых рецепторов присутствуют в мозге, причем подтипы A1 и A2A по-разному распределены. Первый находится преимущественно в гиппокампе и коре головного мозга, тогда как последний находится главным образом в стриатуме. Аденозиновые рецепторы A2A корректируют выделение GABA в стриатуме, который необязательно регулирует активность нейронов средней колючести. Поэтому антагонисты рецепторов A2A могут быть подходящим лечением нейродегенеративных двигательных расстройств, таких как болезни Паркинсона и Хантингтона (Tuite P., et al., J. Expert Opin Investig Drugs. 2003; 12: 1335-52; Popoli P. et al. J. Neurosci. 2002; 22: 1967-75), дистоний, таких как синдром "усталых ног" (Нарре S., et al. Neuropsychobiology, 2003; 48: 82-6), и дискинезий, таких как дискинезии, вызываемые продолжительным применением нейролептических и допаминергических лекарственных средств(Jenner P. J. Neurol. 2000; 247 Suppl. 2: 1143-50). При лечении болезни Паркинсона антагонист A2A может быть полезен не только для монотерапии,но также при введении в комбинации с L-DOPA и/или одним или более из следующих лекарств: допаминовых агонистов, ингибиторов допаминдекарбоксилазы, ингибиторов катехол-O-метилтрансферазы и ингибиторов моноаминоксидазы.-1 010568 Кроме того, антагонисты A2A могут обладать терапевтическим потенциалом как нейропротектанты(Stone T.W. et al. Drug. Dev. Res. 2001; 52: 323-330) и при лечении расстройств сна (Dunwidie T.V. et al.Ann. Rev. Neurosci. 2001; 24: 31-55). Было обнаружено, что определенные производные 4-аминопиримидина представляют собой новые сильные антагонисты аденозинового рецептора A2A и поэтому могут быть использованы для лечения или предотвращения заболеваний, поддающихся облегчению за счет антагонизма аденозинового рецептора. Дополнительными задачами настоящего изобретения являются обеспечение способа получения упомянутых соединений; фармацевтические композиции, содержащие эффективное количество упомянутых соединений; применение указанных соединений для производства лекарственного средства для лечения патологических состояний или заболеваний, поддающихся улучшению за счет антагонизма аденозинового рецептора, особенно антагонизма аденозинового рецептора A2A; способы лечения патологических состояний или заболеваний, поддающихся облегчению за счет антагонизма аденозинового рецептора, особенно антагонизма аденозинового рецептора A2A, включающие введение соединений изобретения пациенту, нуждающемуся в лечении, и комбинации упомянутых соединений с одним или более из следующих лекарственных соединений: L-DOPA, допаминовых антагонистов, ингибиторов допаминдекарбоксилазы, ингибиторов катехол-O-метилтрансферазы и ингибиторов моноаминоксидазы. Сущность изобретения Таким образом, настоящее изобретение относится к производным 4-аминопиримидина формулы в которой R1 и R2 независимо представляют собой моноциклическую или полициклическую гетероарильную группу, необязательно замещенную одним или более заместителем, выбранным из группы, состоящей из атомов галогена, прямого или разветвленного, необязательно замещенного низшего алкила,циклоалкила, гидрокси, прямого или разветвленного, необязательно замещенного низшего алкокси, -SH,прямого или разветвленного, необязательно замещенного низшего алкилтио, циано, -NR'R", -CO2R', гдеR' и R", каждый независимо, представляет собой атом водорода или прямую или разветвленную, необязательно замещенную группу низшего алкила или R' и R" вместе с атомом азота, к которому они присоединены, образуют циклическую группу;R3 представляет собой группу, выбранную из -COR4, -CON(R4)R5, -COOR4 и R6,где R4 представляет собой группу, выбранную из атомов водорода; прямой или разветвленной низшей алкильной группы, которая необязательно замещена одним или более атомом галогена или одной или более циклоалкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой; группы формулыn и q независимо выбирают из целых чисел от 0 до 6;Ra и Rb независимо представляют собой атом водорода или низшую алкильную группу;G представляет собой группу, выбранную из циклоалкильной, арильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена или одной или более низшей алкильной, циклоалкильной, низшей галогеналкильной, гидрокси, низшей алкокси, низшей алкилтио,амино, моно- или диалкиламино, гидроксиалкильной, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой;R5 представляет собой атом водорода или низшую алкильную, циклоалкильную или бензильную группу илиR4 и R5 вместе с атомом азота, к которому они присоединены, образуют насыщенное или ненасыщенное кольцо, которое необязательно замещено одной или более низшей алкильной, циклоалкильной или бензильной группой;R6 представляет собой группу, выбранную из атомов водорода; прямой или разветвленной низшей алкильной группы, которая необязательно замещена одним или более атомом галогена или одной или более циклоалкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой;n и q независимо выбирают из целых чисел от 0 до 6;Ra и Rb независимо представляют собой атом водорода или низшую алкильную группу;G представляет собой группу, выбранную из циклоалкильной, арильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена или одной или более низшей алкильной, циклоалкильной, низшей галогеналкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, гидроксиалкильной, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой; или их фармацевтически приемлемым солям при условии, что данное соединение не является одним из 2,6-дипиридин-4-илпиримидин-4-амина,4-(3-метоксианилино)-2,6-ди(2-пиридинил)пиримидина,4-(2,5-диметоксианилино)-2,6-ди(2-пиридинил)пиримидина,4-(5-метокси-2-метиланилино)-2,6-ди(2-пиридинил)пиримидина,4-(2-метокси-5-метиланилино)-2,6-ди(2-пиридинил)пиримидина,4-(2-хлор-5-метоксианилино)-2,6-ди(2-пиридинил)пиримидина,4-(2,5-диметиланилино)-2,6-ди(2-пиридинил)пиримидина. Как отмечается выше, настоящее изобретение, в общем, относится к производным 4-аминопиридина формулы в которой R1 и R2 независимо представляют собой моноциклическую или полициклическую гетероарильную группу, необязательно замещенную одним или более заместителем, выбранным из группы, состоящей из атомов галогена, прямого или разветвленного, необязательно замещенного низшего алкила,циклоалкила, гидрокси, прямого или разветвленного, необязательно замещенного низшего алкокси, -SH,прямого или разветвленного, необязательно замещенного низшего алкилтио, циано, -NR'R", -CO2R', гдеR' и R", каждый независимо, представляет собой атом водорода или прямую или разветвленную, необязательно замещенную группу низшего алкила или R' и R" вместе с атомом азота, к которому они присоединены, образуют циклическую группу;R3 представляет собой группу, выбранную из -COR4, -CON(R4)R5, -COOR4 и R6,где R4 представляет собой группу, выбранную из атомов водорода; прямой или разветвленной низшей алкильной группы, которая необязательно замещена одним или более атомом галогена или одной или более циклоалкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой; группы формулыn и q независимо выбирают из целых чисел от 0 до 6;Ra и Rb независимо представляют собой атом водорода или низшую алкильную группу;G представляет собой группу, выбранную из циклоалкильной, арильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена или одной или более низшей алкильной, циклоалкильной, низшей галогеналкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, гидроксиалкильной, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой;R5 представляет собой атом водорода или низшую алкильную, циклоалкильную или бензильную группу илиR4 и R5 вместе с атомом азота, к которому они присоединены, образуют насыщенное или ненасыщенное кольцо, которое необязательно замещено одной или более алкильной, циклоалкильной или бензильной группой;R6 представляет собой группу, выбранную из атомов водорода;-3 010568 прямой или разветвленной низшей алкильной группы, которая необязательно замещена одним или более атомом галогена или одной или более циклоалкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой; группы формулыn и q независимо выбирают из целых чисел от 0 до 6;Ra и Rb независимо представляют собой атом водорода или низшую алкильную группу;G представляет собой группу, выбранную из циклоалкильной, арильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена или одной или более низшей алкильной, циклоалкильной, низшей галогеналкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, гидроксиалкильной, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой; или их фармацевтически приемлемым солям при условии, что данное соединение не является одним из 2,6-дипиридин-4-илпиримидин-4-амина,4-(3-метоксианилино)-2,6-ди(2-пиридинил)пиримидина,4-(2,5-диметоксианилино)-2,6-ди(2-пиридинил)пиримидина,4-(5-метокси-2-метиланилино)-2,6-ди(2-пиридинил)пиримидина,4-(2-метокси-5-метиланилино)-2,6-ди(2-пиридинил)пиримидина,4-(2-хлор-5-метоксианилино)-2,6-ди(2-пиридинил)пиримидина и 4-(2,5-диметиланилино)-2,6-ди(2-пиридинил)пиримидина. Другие аспекты настоящего изобретения представляют собой:a) фармацевтические композиции, содержащие эффективное количество упомянутых соединений;b) применение указанных соединений для производства лекарственного средства для лечения заболеваний, поддающихся улучшению за счет антагонизма аденозинового рецептора, в частности за счет антагонизма аденозинового рецептора A2A;c) способы лечения заболеваний, поддающихся облегчению за счет антагонизма аденозинового рецептора, в частности за счет антагонизма аденозинового рецептора A2A, включающие введение соединений изобретения пациенту, нуждающемуся в лечении, и комбинации упомянутых соединений с одним или более из следующих лекарственных соединений: L-DOPA, допаминовых антагонистов, ингибиторов допаминдекарбоксилазы, ингибиторов катехол-O-метилтрансферазы и ингибиторов моноаминоксидазы. Используемый здесь термин "низший алкил" охватывает необязательно замещенные, линейные или разветвленные радикалы, имеющие от 1 до 8, предпочтительно от 1 до 6 и более предпочтительно от 1 до 4 атомов углерода. Предпочтительные заместители в упомянутых алкильных группах выбирают из атомов галогена, гидроксигрупп и аминогрупп. Примеры включают в себя радикалы метил, этил, н-пропил, изопропил, н-бутил, втор-бутил и трет-бутил, н-пентил, 1-метилбутил, 2-метилбутил, изопентил, 1-этилпропил, 1,1-диметилпропил,1,2-диметилпропил, н-гексил, 1-этилбутил, 2-этилбутил, 1,1-диметилбутил, 1,2-диметилбутил,1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 2-метилпентил, 3-метилпентил и изогексил. Используемый здесь термин "низший алкокси" охватывает необязательно замещенные, линейные или разветвленные оксисодержащие радикалы, имеющие, каждый, алкильные части от 1 до 8, предпочтительно от 1 до 6 и более предпочтительно от 1 до 4 атомов углерода. Предпочтительные заместители в упомянутых алкоксигруппах выбирают из атомов галогена, гидроксигрупп и аминогрупп. Предпочтительные алкоксирадикалы включают в себя метокси, этокси, н-пропокси, изопропокси,н-бутокси, втор-бутокси, трет-бутокси, трифторметокси, дифторметокси, гидроксиметокси,2-гидроксиэтокси или 2-гидроксипропокси. Используемый здесь термин "низший алкилтио" охватывает радикалы, содержащие необязательно замещенные, линейные или разветвленные алкильные радикалы от 1 до 8, предпочтительно от 1 до 6 и более предпочтительно от 1 до 4 атомов углерода. Предпочтительные заместители в упомянутых алкилтиогруппах выбирают из атомов галогена, гидроксигрупп и аминогрупп. Предпочтительные необязательно замещенные алкилтиорадикалы включают в себя метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, втор-бутилтио, трет-бутилтио, трифторметилтио, дифторметилтио, гидроксиметилтио, 2-гидроксиэтилтио или 2-гидроксипропилтио. Используемый здесь термин "циклические группы" охватывает, если не оговорено иное, карбоциклические и гетероциклические радикалы. Циклические радикалы могут содержать одно или более колец. Карбоциклические радикалы могут быть ароматическими или алициклическими, например циклоалкильные радикалы.-4 010568 Гетероциклические радикалы также включают в себя гетероарильные радикалы. Используемый здесь термин "ароматические группы" охватывает обычно (5-14)-членную ароматическую кольцевую систему, такую как 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, S и N. Когда гетероатомы отсутствуют, радикал называют арильным, и когда присутствует по меньшей мере один гетероатом, его называют гетероарильным радикалом. Ароматический радикал может быть моноциклическим или полициклическим, таким как фенил или нафтил. Когда ароматический радикал или фрагмент несет 2 или более заместителей, указанные заместители могут быть одинаковыми или различными. Используемый здесь термин "арильный радикал" включает в себя обычно C5-C14 моноциклический или полициклический арильный радикал, такой как фенил или нафтил, антранил или фенантрил. Фенил является предпочтительным. Когда арильный радикал несет 2 или более заместителей, указанные заместители могут быть одинаковыми или различными. Используемый здесь термин "гетероарильный радикал" включает в себя обычно (5-14)-членную кольцевую систему, содержащую по меньшей мере одно гетероароматическое кольцо и по меньшей мере один гетероатом, выбранный из O, S и N. Гетероарильный радикал может представлять собой одно, или два, или более конденсированных колец, в которых по меньшей мере одно кольцо содержит гетероатом. Примеры включают в себя радикалы пиридил, пиразинил, пиримидинил, пиридазинил, фурил, оксадиазолил, оксазолил, имидазолил, тиазолил, тиадиазолил, тиенил, пирролил, бензотиазолил, индолил,индазолил, пуринил, хинолил, изохинолил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, хинолизинил, циннолинил, триазолил, индолизинил, индолинил, изоиндолинил, изоиндолил, имидизолидинил, птеридинил и пиразолил. Радикалы пиридил, тиенил, фурил, пиразолил, пиридазинил, пиримидинил, тиазолил и хинолил являются предпочтительными. Еще более предпочтительными являются радикалы пиридил, тиенил, фурил, пиразолил, пиридазинил, пиримидинил и хинолил. Когда гетероарильный радикал несет 2 или более заместителей, указанные заместители могут быть одинаковыми или различными. Используемый здесь термин "циклоалкил" охватывает насыщенные, необязательно замещенные карбоциклические радикалы, и, если не оговорено иное, циклоалкильный радикал обычно имеет от 3 до 7 атомов углерода. Предпочтительные заместители в упомянутых циклоалкильных группах выбирают из атомов галогена, гидроксигрупп, алкильных групп и аминогрупп. Примеры включают в себя циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Предпочтительны циклопропил, циклопентил или циклогексил. Когда циклоалкильный радикал несет 2 или более заместителей, указанные заместители могут быть одинаковыми или различными. Как используется здесь, некоторые из атомов, радикалов, фрагментов, цепей или циклов, присутствующих в общих структурах изобретения, являются "необязательно замещенными". Это означает, что указанные атомы, радикалы, фрагменты, цепи или циклы могут быть либо незамещенными, либо замещенными в любом положении одним или более, например 1, 2, 3 или 4, заместителями, в соответствии с чем атомы водорода, связанные с незамещенными атомами, радикалами, фрагментами, цепями или циклами, замещаются химически приемлемыми атомами, радикалами, фрагментами, цепями или циклами. Когда присутствуют два или более заместителей, каждый заместитель может быть тем же или другим. Используемый здесь термин "атом галогена" охватывает атомы хлора, фтора, брома или йода,обычно атом фтора, хлора или брома, наиболее предпочтительно хлора или фтора. Термин "гало", когда используется в качестве приставки, имеет такое же значение. Используемый здесь термин "фармацевтически приемлемая соль" охватывает соли фармацевтически приемлемой кислоты или основания. Фармацевтически приемлемые кислоты включают в себя неорганические кислоты, например соляную, серную, фосфорную, дифосфорную, бромисто-водородную,йодисто-водородную и азотную кислоты, и органические кислоты, например лимонную, фумаровую,малеиновую, яблочную, миндальную, аскорбиновую, щавелевую, янтарную, винную, бензойную, уксусную, метансульфоновую, этансульфоновую, бензолсульфоновую или п-толуолсульфоновую кислоты. Фармацевтически приемлемые основания включают в себя гидроксиды щелочных металлов (например,натрия или калия) и щелочно-земельных металлов (например, кальция или магния) и органические основания, например алкиламины, арилалкиламины и гетероциклические амины. Другие предпочтительные соли по изобретению представляют собой четвертичные аммониевые соединения, в которых эквивалент аниона (X-) связан с положительным зарядом атома N. X- может быть анионом различных минеральных кислот, таким как, например, хлорид, бромид, йодид, сульфат, нитрат,фосфат, или анионом органической кислоты, таким как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, трифторацетат, метансульфонат и п-толуолсульфонат.X- предпочтительно представляет собой анион, выбранный из хлорида, бромида, йодида, сульфата, нитрата, ацетата, малеата, оксалата, сукцината или трифторацетата. Более предпочтительно X- представляет собой хлорид, бромид, трифторацетат или метансульфонат. Используемый здесь N-оксид образован из третичных основных аминов или иминов, присутствующих в молекуле, с использованием подходящего окислительного агента.-5 010568 Согласно одному варианту осуществления настоящего изобретения в соединении формулы (I) R6 представляет собой группу, выбранную из атомов водорода; прямой или разветвленной низшей алкильной группы, которая необязательно замещена одним или более атомом галогена или одной или более циклоалкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, алкоксиалкильной, гидроксикарбонильной, алкоксикарбонильной и нитрильной группой; группы формулыn и q независимо выбирают из целых чисел от 0 до 6;Ra и Rb независимо представляют собой атом водорода или низшую алкильную группу;G представляет собой группу, выбранную из циклоалкильной, арильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена или одной или более низшей алкильной, циклоалкильной, низшей галогеналкильной, гидрокси, низшей алкокси, низшей алкилтио, амино, моно- или диалкиламино, гидроксиалкильной, алкоксиалкильной, гидроксикарбонильной, алкоксикарбомильной и нитрильной группой при условии, что, когда p, m и o одновременно равны нулю, G не является необязательно замещенной арильной группой, и при условии, что данное соединение не является одним из 2,6-дипиридин-4-илпиримидин-4-амина,4-(3-метоксианилино)-2,6-ди(2-пиридинил)пиримидина,4-(2,5-диметоксианилино)-2,6-ди(2-пиридинил)пиримидина,4-(5-метокси-2-метиланилино)-2,6-ди(2-пиридинил)пиримидина,4-(2-метокси-5-метиланилино)-2,6-ди(2-пиридинил)пиримидина,4-(2-хлор-5-метоксианилино)-2,6-ди(2-пиридинил)пиримидина и 4-(2,5-диметиланилино)-2,6-ди(2-пиридинил)пиримидина. Согласно одному варианту осуществления настоящего изобретения в соединениях формулы (I) R1 представляет собой моноциклическую гетероарильную группу, выбранную из группы, состоящей из фурильной, тиенильной, тиазолильной, оксазолильной, пиразинильной, пиразолильной, пиридазинильной,имидазолильной, триазолильной, пиримидинильной и пиридильной группы, которая необязательно замещена одним или более заместителем, выбранным из группы, состоящей из атомов галогена, линейного или разветвленного, необязательно замещенного низшего алкокси и линейного или разветвленного, необязательно замещенного низшего алкила, более предпочтительно, выбранными из группы, состоящей из атомов галогена и линейного или разветвленного, необязательно замещенного низшего алкила. Согласно предпочтительному варианту осуществления настоящего изобретения в соединениях формулы (I) R1 представляет собой моноциклическую гетероарильную группу, выбранную из группы,состоящей из фурильной, тиенильной, пиразолильной, триазолильной, тиазолильной и пиридильной группы, которая необязательно замещена одним или более заместителем, выбранным из группы, состоящей из атомов галогена и линейного или разветвленного, необязательно замещенного низшего алкила. Согласно дополнительному предпочтительному варианту осуществления настоящего изобретения в соединениях формулы (I) R1 представляет собой моноциклическую гетероарильную группу, выбранную из группы, состоящей из фурильной, тиенильной и пиразолильной группы, которая необязательно замещена одним или более заместителем, выбранным из группы, состоящей из атомов галогена и линейного или разветвленного, необязательно замещенного низшего алкила. В еще более предпочтительном варианте осуществления настоящего изобретения в соединениях формулы (I) R1 представляет собой незамещенную фурильную группу. Согласно другому варианту осуществления настоящего изобретения в соединениях формулы (I) R2 представляет собой моноциклическую гетероарильную группу, выбранную из группы, состоящей из пиразолильной, фурильной, тиазолильной, оксазолильной, пиридильной, пиримидинильной, пиразинильной, пиридазинильной, тиенильной, имидазолильной и триазолильной группы, которая необязательно замещена одним или более заместителем, выбранным из группы, состоящей из атомов галогена и линейного или разветвленного, необязательно замещенного низшего алкила. Согласно другому предпочтительному варианту осуществления настоящего изобретения в соединениях формулы (I) R2 представляет собой моноциклическую гетероарильную группу, выбранную из группы, состоящей из пиразолильной, фурильной, тиазолильной, пиридильной, тиенильной и триазолильной группы, которая необязательно замещена одним или более заместителем, выбранным из группы, состоящей из атомов галогена, линейного или разветвленного, необязательно замещенного низшего алкокси и линейного или разветвленного, необязательно замещенного низшего алкила, более предпочтительно,выбранным из группы, состоящей из атомов галогена и линейного или разветвленного, необязательно замещенного низшего алкила.-6 010568 Согласно еще одному варианту осуществления настоящего изобретения в соединениях формулы (I)R4 и R6 независимо представляют собой группу, выбранную из атомов водорода; прямой или разветвленной низшей алкильной группы, которая необязательно замещена одним или более атомом галогена; группы формулыn и q независимо выбирают из целых чисел от 0 до 6;Ra и Rb независимо представляют собой атом водорода или низшую алкильную группу;G представляет собой группу, выбранную из циклоалкильной, арильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена или одной или более низшей алкоксигруппой;R5 представляет собой атом водорода. Согласно еще одному варианту осуществления настоящего изобретения в соединениях формулы (I)R4 и R6 независимо представляют собой группу, выбранную из атомов водорода; прямой или разветвленной низшей алкильной группы, которая необязательно замещена одним или более атомом галогена; группы, выбранной из циклоалкильной, фенилалкильной, гетероарилалкильной, феноксиалкильной и гетероарилоксиалкильной группы, которая необязательно замещена одним или более атомом галогена,одной или более низшей алкоксигруппой или одной или более низшей алкильной группой;R5 представляет собой атом водорода. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения в соединениях формулы (I) R3 представляет собой атом водорода или группу, выбранную из групп формулы-COR4; где R4 представляет собой группу формулы в которой n представляет собой целое число, выбранное из 0 или 1;G представляет собой группу, выбранную из фенильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена, одной или более низшей алкоксигруппой или одной или более низшей алкильной группой. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения в соединениях формулы (I) R1 представляет собой 2-фурильную группу и R2 представляет собой пиразолильную группу, которая необязательно замещена одной или более низшей алкильной группой. В дополнительном варианте осуществления настоящего изобретения R1 представляет собой 2-фурильную группу, R2 представляет собой пиразолильную группу, которая необязательно замещена одной или более низшей алкильной группой, и R3 представляет собой атом водорода или группу, выбранную из групп формулы -COR4; где R4 представляет собой группу формулы в которой n представляет собой целое число, выбранное из 0 или 1;G представляет собой группу, выбранную из фенильной или гетероарильной группы, которая необязательно замещена одним или более атомом галогена или одной или более низшей алкоксигруппой. Отдельные индивидуальные соединения изобретения включают в себя: 2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин (соединение 1);N-(2,6-ди-2-фурилпиримидин-4-ил)-2-(3,4-диметоксифенил)ацетамид; 2-(3,4-диметоксифенил)-N-[6-(2-фурил)-2-(1,3-тиазол-2-ил)пиримидин-4-ил]ацетамид. Дополнительные соединения настоящего изобретения включают в себя следующие:N-[6-(3,5-диметилпиразол-1-ил)-2-тиазол-2-илпиримидин-4-ил]-2-пиридин-3-илпропионамид (соединение 299) и 2-пиридин-3-ил-N-(6-пиридин-2-ил-2-тиазол-2-илпиримидин-4-ил)пропионамид (соединение 300). Соединения настоящего изобретения можно получить при помощи одного из способов, описанных ниже. Соединения формулы (I) и, в частности, соединения формулы (VIIIa) или (IXa), где R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, и R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом азота, могут быть получены, как показано на схеме 1. Схема 1 Карбоксиамидины формулы (II), где R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с карбоксиамидиновой группой через атом углерода, могут быть получены взаимодействием нитрила формулы (XXXI) с триметилалюминием и хлоридом аммония в растворителе, таком как бензол, толуол или ксилол, при температуре от 80 до 120C. Они также могут быть получены взаимодействием нитрила формулы (XXXI) с метоксидом натрия в метаноле при комнатной температуре, с последующим взаимодействием с хлоридом аммония при той же температуре. Карбоксиамидины формулы (II) могут взаимодействовать с диэтилмалонатом в растворителе, таком как метанол, этанол, изопропиловый спирт, бутиловый спирт или тетрагидрофуран, в присутствии основания, такого как метоксид натрия, этоксид натрия или трет-бутоксид калия, и при температуре от комнатной температуры до температуры кипения растворителя с получением пиримидин-4,6-диолов формулы (III). Полученные пиримидин-4,6-диолы формулы (III) могут взаимодействовать с хлорирующим агентом, таким как оксихлорид фосфора, пентахлорид фосфора или их смесь, в растворителе, таком как оксихлорид фосфора, бензол или толуол, при температуре от комнатной температуры до температуры кипения растворителя с получением 4,6-дихлорпиримидиновых соединений формулы (IV). Необязательно,присутствие основания, такого как диметиламиноанилин, триэтиламин или диизопропилэтиламин, может быть необходимым на данной стадии реакции. Взаимодействие 4,6-дихлорпиримидиновых соединений формулы (IV) с гидроксидом аммония в растворителе, таком как метанол, этанол, изопропиловый спирт или тетрагидрофуран, при температуре от 80 до 140C дает 6-хлорпиримидин-4-амины формулы (V). Полученные 6-хлорпиримидин-4-амины формулы (V) взаимодействуют с соединением формулыR2-H, где R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом азота, с получением соединений формулы (VIIIa), которые представляют собой частный случай соединений формулы (I) по изобретению. Реакцию проводят в растворителе, таком как диметилформамид, диметилацетамид или диметилсульфоксид, в присутствии основания, такого как гидрид натрия, карбонат калия или карбонат цезия, при температуре от 60 до 140 С. Соединения формулы (VIIIa) можно ацилировать с помощью хлорангидрида кислоты и основания,такого как пиридин, триэтиламин или диизопропилэтиламин, в растворителе, таком как тетрагидрофу- 15010568 ран, метиленхлорид, хлороформ или пиридин, при температуре от комнатной температуры до температуры кипения растворителя с получением соединения формулы (IXa), которое представляет собой частный случай соединений формулы (I) по изобретению. Соединения формулы (IXa) можно также получить взаимодействием амина (VIIIa) с ангидридом при температуре от 80 до 160 С. 4,6-Дихлорпиримидиновые соединения формулы (IV) можно также превратить в 4-хлорпиримидины формулы (Ха) взаимодействием с соединением формулы R2-H, где R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом азота. Реакцию проводят в растворителе, таком как диметилформамид, диметилацетамид или диметилсульфоксид, в присутствии основания, такого как гидрид натрия, карбонат калия или карбонат цезия, при температуре от 60 до 140 С. Полученные 4-хлорпиримидины формулы (Ха) можно превратить в соединения формулы (VIIIa) по изобретению взаимодействием с гидроксидом аммония в растворителе, таком как метанол, этанол, изопропиловый спирт или тетрагидрофуран, при температуре от 80 до 140 С. Альтернативно, соединения формулы (VIIIa) по изобретению также могут быть получены из соединений формулы (IXa) взаимодействием с минеральной кислотой, такой как соляная или серная кислота, в растворителе, таком как вода, метанол, этанол или изопропиловый спирт, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (IXa) по изобретению могут быть получены взаимодействием соединений формулы (XII) с соединениями формулы R2-H, где R2 такой, как определено выше. Реакцию проводят в растворителе, таком как диметилформамид, диметилацетамид или диметилсульфоксид, в присутствии основания, такого как гидрид натрия, карбонат калия или карбонат цезия, при температуре от 60 до 140 С. Соединения формулы (XII) могут быть получены из соединений 6-аминопиридин-4-ола формулы(VI) взаимодействием с карбоновой кислотой формулы R4COOH, где R4 такой, как определено выше, в присутствии хлорирующего агента, такого как оксихлорид фосфора, пентахлорид фосфора или тионилхлорид, при температуре от 60 до 120 С. Соединения 6-аминопиридин-4-ола формулы (VI), в свою очередь, получают взаимодействием карбоксиамидинов формулы (II) с этилцианоацетатом. Реакцию проводят в растворителе, таком как метанол, этанол, изопропиловый спирт, бутиловый спирт или тетрагидрофуран, в присутствии основания,такого как метоксид натрия, этоксид натрия или трет-бутоксид калия, и при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (I) и, в частности, соединения формулы (VIIIb) или (IXb), где R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом азота, и R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, могут быть получены,как показано на схеме 2. Схема 2 Аминонитрилы формулы (XIV) могут быть получены взаимодействием нитрилов формулы (XIII),где R2 такой, как определено выше, и ацетонитрила в присутствии основания, предпочтительно такого,как диизопропиламид лития или трет-бутоксид калия, в растворителе, таком как бензол, толуол или ксилол, при температуре от комнатной температуры до температуры кипения растворителя. Полученные аминонитрилы (XIV) взаимодействуют с тиомочевиной в растворителе, таком как метанол, этанол, изопропиловый спирт, бутиловый спирт или тетрагидрофуран, в присутствии основания,такого как метоксид натрия, этоксид натрия или трет-бутоксид калия, при температуре от 60 до 140 С с получением 4-аминопиримидин-2-тиолов формулы (XV).- 16010568 4-Аминопиримидин-2-тиолы формулы (XV) могут взаимодействовать в растворителе, таком как вода, метанол, этанол, диметилформамид или диметилсульфоксид, с метилиодидом или диметилсульфатом в присутствии основания, такого как гидроксид натрия, карбонат натрия, карбонат калия или гидрид натрия, и при температуре от комнатной температуры до 80 С с получением 2-(метилтио)пиримидин-4 аминов формулы (XVI). 2-(Метилтио)пиримидин-4-амины формулы (XVI) могут быть либо подвергнуты взаимодействию с окислительным агентом, предпочтительно м-хлорпербензойной кислотой, оксоном или монопероксифталатом магния, в растворителе, таком как метанол, этанол, ацетон, метиленхлорид или хлороформ, и при температуре от 0 до 70 С с получением 2-(метилсульфонил)пиримидин-4-аминов формулы (XVII),либо, альтернативно, они могут быть ацилированы хлорангидридом кислоты и основанием, таким как пиридин, триэтиламин или диизопропилэтиламин, в растворителе, таком как тетрагидрофуран, метиленхлорид, хлороформ или пиридин, при температуре от комнатной температуры до температуры кипения растворителя с получением 2-(метилтио)пиримидин-4-амидов формулы (XXI). 2-(Метилсульфонил)пиримидин-4-амины формулы (XVII) можно превратить в соединения (VIIIb) по настоящему изобретению взаимодействием с соединениями формулы R1-H, где R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом азота. Реакцию проводят в растворителе, таком как диметилформамид, диметилацетамид или диметилсульфоксид, в присутствии основания, предпочтительно гидрида натрия, карбоната калия или карбоната цезия, и при температуре от 60 до 160 С. Обычно 2-(метилсульфонил)пиримидин-4-амиды формулы (XXII) можно превратить в соединения (IXb) по настоящему изобретению, следуя той же методике. 2-(Метилтио)пиримидин-4-амиды формулы (XXI) могут взаимодействовать с окислительным агентом, предпочтительно м-хлорпербензойной кислотой, оксоном или монопероксифталатом магния, в растворителе, таком как метанол, этанол, ацетон, метиленхлорид или хлороформ, и при температуре от 0 до 70 С с получением 2-(метилсульфонил)пиримидин-4-амидов формулы (XXII). Наконец, соединения (VIIIb) по изобретению можно превратить в соединения (IXb) также по изобретению взаимодействием с хлорангидридом кислоты и основанием, таким как пиридин, триэтиламин или диизопропилэтиламин, в растворителе, таком как тетрагидрофуран, метиленхлорид, хлороформ или пиридин, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (IXb) могут быть также получены взаимодействием амина (VIIIb) с ангидридом при температуре от 80 до 160 С. Обратная операция, по которой соединения формулы (IXb) превращаются в соединения формулы(VIIIb), также возможна и может быть осуществлена взаимодействием с минеральной кислотой, такой как соляная или серная кислота, в растворителе, таком как вода, метанол, этанол или изопропиловый спирт, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (I) и, в частности, соединения формулы (VIIIc) или (IXc), где R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, и R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, могут быть получены,как показано на схеме 3. Схема 3 Взаимодействие между метилкетонами формулы (XXIII), где R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, и диэтилкарбонатом может быть проведено в присутствии основания, предпочтительно гидрида натрия, в растворителе, таком как бензол, толуол, этиловый эфир, тетрагидрофуран или диоксан,и при температуре от 40 до 120 С с получением замещенных этил-3-оксопропаноатов формулы (XXIV). Соединения пиримидин-4-ола формулы (XXV) могут быть получены из замещенных этил-3-оксопропаноатов формулы (XXIV) взаимодействием с карбоксиамидинами формулы (II) в растворителе, таком как метанол, этанол, изопропиловый спирт, бутиловый спирт или тетрагидрофуран, в присутствии основания, такого как метоксид натрия, этоксид натрия или трет-бутоксид калия, и при температуре от комнатной температуры до температуры кипения растворителя.- 17010568 Соединения пиримидин-4-ола формулы (XXV) могут взаимодействовать с хлорирующим агентом,таким как оксихлорид фосфора, пентахлорид фосфора или их смесь, в растворителе, таком как оксихлорид фосфора, бензол или толуол, при температуре от комнатной температуры до температуры кипения растворителя с получением 4-хлорпиримидинов формулы (Xb). Необязательно, присутствие основания,такого как диметиламиноанилин, триэтиламин или диизопропилэтиламин, может быть необходимым на данной стадии реакции. Соединения формулы (VIIIc) по настоящему изобретению могут быть получены из 4-хлорпиримидинов формулы (Xb) взаимодействием с гидроксидом аммония в растворителе, таком как метанол, этанол, изопропиловый спирт или тетрагидрофуран, при температуре от 80 до 140 С. Наконец, соединения формулы (IXc) по настоящему изобретению могут быть получены из соединений формулы (VIIIc) ацилированием хлорангидридом кислоты и основанием, таким как пиридин, триэтиламин или диизопропилэтиламин, в растворителе, таком как тетрагидрофуран, метиленхлорид, хлороформ или пиридин, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (IXc) могут также быть получены взаимодействием амина (VIIIc) с ангидридом при температуре от 80 до 160 С. Соединения формулы (VIIIc) также могут быть получены из соединений формулы (IXc) взаимодействием с минеральной кислотой, такой как соляная или серная кислота, в растворителе, таком как вода,метанол, этанол или изопропиловый спирт, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (VIIIc) и (IXc), где R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, и R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, также могут быть получены, как показано на схеме 4. Схема 4 Реакцию Судзуки между 4-аминопиримидинами формулы (IV), (V) или (XII) и бороновой кислотой формулы (XXIX), где R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, предпочтительно проводят в органическом растворителе, таком как метанол, этанол, ацетонитрил, диоксан, тетрагидрофуран, диметоксиэтан, бензол или толуол, необязательно в присутствии воды, при температуре от 60 до 120 С с основанием, таким как карбонат натрия или калия, и палладиевым(0) катализатором, таким как тетракис-(трифенилфосфин)палладий(0). Реакцию Стилле между 4-аминопиримидинами формулы (IV), (V) или (XII) и оловоорганическим производным формулы (XXX), где R2 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, предпочтительно проводят в органическом растворителе, таком как метанол, этанол, ацетонитрил, диоксан, тетрагидрофуран, диметоксиэтан, бензол или толуол, необязательно в присутствии воды, при температуре от 60 до 120 С с основанием, таким как карбонат натрия или калия, и катализатором, таким как тетракис(трифенилфосфин)палладий(0) или хлорид бис(трифенилфосфин)палладия (II). 4-Хлорпиримидиновые соединения формулы (Xb) можно превратить в соединения формулы (VIIIc) взаимодействием с гидроксидом аммония в растворителе, таком как метанол, этанол, изопропиловый спирт или тетрагидрофуран, при температуре от 80 до 140 С.- 18010568 Наконец, соединения формулы (IXc) по настоящему изобретению могут быть получены из соединений формулы (VIIIc) ацилированием хлорангидридом кислоты и основанием, таким как пиридин, триэтиламин или диизопропилэтиламин, в растворителе, таком как тетрагидрофуран, метиленхлорид, хлороформ или пиридин, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (IXc) также могут быть получены взаимодействием амина (VIIIc) с ангидридом при температуре от 80 до 160 С. Соединения формулы (VIIIc) также могут быть получены из соединений формулы (IXc) взаимодействием с минеральной кислотой, такой как соляная или серная кислота, в растворителе, таком как вода,метанол, этанол или изопропиловый спирт, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (VIIId) и (IXd), где R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, и R2 представляет собой замещенную гетероциклическую группу, могут быть получены, как показано на схеме 5. Схема 5 Замещенные 4-хлор-2-(2-гетероарил)пиримидины формулы (Xd) могут быть получены взаимодействием соответствующих незамещенных 4-хлор-2-(2-гетероарил)пиримидинов формулы (Xc). Когда гетероарильная группа представляет собой фурильную группу, реакцию, предпочтительно, проводят вN-хлорсукцинимиде (X=хлор) или N-бромсукцинимиде (Х=бром) с растворителем, таким как диметилформамид или диметилсульфоксид, при температуре от 40 до 100 С. Альтернативно, галогенирующий агент может быть выбран из группы, состоящей из Cl2, Br2, SOCl2 и SOBr2. 4-Хлорпиримидиновые соединения формулы (Xd) можно превратить в соединения формулы (VIIId) взаимодействием с гидроксидом аммония в растворителе, таком как метанол, этанол, изопропиловый спирт или тетрагидрофуран, при температуре от 80 до 140 С. Наконец, соединения формулы (IXd) по настоящему изобретению могут быть получены из соединений формулы (VIIId) ацилированием хлорангидридом кислоты и основанием, таким как пиридин, триэтиламин или диизопропилэтиламин, в растворителе, таком как тетрагидрофуран, метиленхлорид, хлороформ или пиридин, при температуре от комнатной температуры до температуры кипения растворителя. Соединения формулы (IXd) также могут быть получены взаимодействием амина (VIIId) с ангидридом при температуре от 80 до 160 С. Соединения формулы (VIIId) также могут быть получены из соединений формулы (IXd) взаимодействием с минеральной кислотой, такой как соляная или серная кислота, в растворителе, таком как вода,метанол, этанол или изопропиловый спирт, при температуре от комнатной температуры до температуры кипения растворителя. Карбаматы формулы (XXVI) и мочевины формулы (XX) можно синтезировать так, как показано на схеме 6. Схема 6 Карбаматы формулы (XXVI) получают взаимодействием соединения формулы (VIII) с соединением формулы Z-COOR4, где Z представляет собой уходящую группу, такую как атом галогена, предпочтительно хлора, или группу, выбранную из этокси, метокси, п-нитрофенокси и имидазолила. Реакцию проводят в растворителе, таком как тетрагидрофуран, хлороформ, метиленхлорид или диметилформамид, в присутствии основания, предпочтительно триэтиламина, диизопропилэтиламина, карбоната калия или гидроксида натрия, при температуре от -70 до 100 С. Соединения формулы (VIII) можно также превратить в мочевины формулы (XX), где R5 представ- 19010568 ляет собой атом водорода, взаимодействием с изоцианатом формулы R4-N=C=O в растворителе, таком как бензол, толуол или ксилол, при температуре от комнатной температуры до 140 С. Синтез аминов формулы (XXVII) можно проводить, следуя схеме 7. Схема 7 Когда R1 представляет собой моноциклическую или полициклическую гетероарильную группу, соединенную с пиримидиновым кольцом через атом углерода, соединения формулы (XXVII) могут быть получены из соединений формулы (Xa и Xb) взаимодействием с амином формулы R4NH2. Реакцию проводят в растворителе, таком как метанол, этанол, изопропанол, бутанол, пентанол, тетрагидрофуран или диметилформамид, в присутствии основания, такого как избыток реагирующего амина R4NH2 или карбонат калия, карбонат натрия, триэтиламин или диизопропилэтиламин, и при температуре от комнатной температуры до температуры кипения растворителя. Если определенные группы R1-R5 чувствительны к химической реакции в условиях вышеописанных способов или не совместимы с упомянутыми способами, можно использовать обычные защитные группы в соответствии со стандартной практикой, например см. T.W. Greene and P.G.M. Wuts in "ProtectiveGroups in Organic Chemistry", 3rd Edition, John WileySons (1999). Возможно, что снятие защиты будет последней стадией синтезов соединений формулы (I). Соединения формулы (XIII), (XXIII), (XXIX), (XXX) и (XXXI) представляют собой известные соединения или могут быть получены по аналогии с известными способами. В частности, соединения формулы (XXIX) и (XXX) могут быть получены способами, описанными вEi-chi Negishi, John WileySons, 2002. Фармакологическая активность Оценка связывания конкурентного радиолиганда аденозинового рецептора подтипа 2A Человеческие мембраны из рекомбинантных рецепторов A2a приобретали от Receptor Biology, Inc.(USA). Конкурентные анализы проводили инкубацией мембран из рецепторов hA2a, трансфицированных в клетки HEK293, [3H]ZM241385 в качестве радиолиганда, буфер (50 мМ Tris-HCl (pH 7,4), 10 мМ MgCl2,1 мМ ЭДТА, 2 ед./мл аденозиндеаминазы) и немеченый лиганд в полном объеме 0,2 мл в течение 90 мин при 25 С. NECA использовали для определения неспецифического связывания. Фильтрование черезSchleicherSchuell GF/52 фильтры (предварительно пропитанный 0,5% полиэтиленимин) в харвестере клеток Brandel. Несвязанный радиолиганд удаляли с помощью 83 мл ледяного 50 мМ Tris-HCl (pH 7,4),0,9% NaCl. Что касается сродства связывания рецептора A2A, антагонисты рецептора A2A данного изобретения могут иметь IC50 менее чем 10 мкМ. В одном варианте осуществления данного изобретения антагонисты рецептора A2A имеют IC50 менее чем 1 мкМ. В другом варианте осуществления IC50 составляет менее чем 0,25 мкМ (т.е. 250 нМ). Производные пиримидин-4-амина данного изобретения полезны для лечения или предотвращения заболеваний, про которые известно, что они поддаются улучшению при лечении антагонистом аденозинового рецептора, в частности заболеваний, про которые известно, что они поддаются улучшению при лечении антагонистом аденозинового рецептора A2A. Такие заболевания представляют собой, например,ишемию, суправентрикулярную аритмию, острую почечную недостаточность, нарушение реперфузии миокарда, аллергические реакции, включая, но не ограничиваясь ими, риниты, крапивницу, артриты склеродермы, другие аутоиммунные болезни, воспалительные заболевания внутренних органов, астму,сахарный диабет, ожирение, болезнь Паркинсона, болезнь Хантингтона, дистонии, такие как синдром"усталых ног", дискинезии, такие как дискинезии, вызванные продолжительным использованием нейролептических или допаминергических лекарственных средств, или расстройства сна. Соответственно, производные пиримидин-4-амина данного изобретения и их фармацевтически приемлемые соли и фармацевтические композиции, содержащие такое соединение и/или его соль, можно использовать в способе лечения заболеваний организма человека, который включает введение пациенту,требующему такого лечения, эффективного количества производного пиримидин-4-амина данного изобретения или его фармацевтически приемлемой соли. Настоящее изобретение также обеспечивает фармацевтические композиции, которые содержат в качестве активного ингредиента по меньшей мере одно производное пиримидин-4-амина формулы (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым наполнителем,таким как носитель или разбавитель. Активный ингредиент может содержать от 0,001 до 99 мас.%, пред- 20010568 почтительно от 0,01 до 90 мас.%, композиции в зависимости от природы состава и того, должно ли быть дополнительное разбавление перед применением. Композиции, предпочтительно, делают в форме, подходящей для перорального, местного, назального, ректального, подкожного или инъекционного введения. Фармацевтически приемлемые наполнители, которые смешивают с активным соединением или солями таких соединений с образованием композиций данного изобретения, хорошо известны per se, и фактические использованные наполнители зависят inter alia от назначенного способа введения композиций. Композиции данного изобретения предпочтительно адаптированы для инъекционного или per os введения. В данном случае композиции для перорального введения могут иметь форму таблеток, ретард таблеток, подъязычных таблеток, капсул, ингаляционных аэрозолей, ингаляционных растворов, сухого порошка для ингаляции или жидких препаратов, таких как микстуры, эликсиры, сиропы или суспензии,причем все они содержат соединение изобретения; такие препараты можно изготавливать способами,хорошо известными в технике. Разбавители, которые можно использовать в приготовлении данных композиций, включают в себя такие жидкие и твердые разбавители, которые совместимы с активным ингредиентом, вместе с окрашивающими или ароматизирующими агентами, если требуется. Таблетки или капсулы могут удобно содержать от 2 до 500 мг активного ингредиента или эквивалентного количества его соли. Жидкая композиция, адаптированная для перорального применения, может быть в виде растворов или суспензий. Растворы могут быть водными растворами растворимой соли или другого производного активного соединения в сочетании, например, с сахарозой с образованием сиропа. Суспензии могут содержать нерастворимое активное соединение изобретения или его фармацевтически приемлемую соль в сочетании с водой вместе с суспендирующим или ароматизирующим агентом. Композиции для парентеральной инъекции можно приготовить из растворимых солей, которые могут быть или не быть лиофилизованными и которые могут быть растворенными в свободной от пирогена водной среде или другой соответствующей жидкости для парентеральной инъекции. Эффективные дозы обычно находятся в диапазоне от 2 до 2000 мг активного ингредиента в день. Дневную дозу можно вводить за одно или более применений, предпочтительно от 1 до 4 применений в день. Настоящее изобретение будет дополнительно проиллюстрировано следующими примерами. Указанные примеры даны только для иллюстрации и не могут быть истолкованы как ограничение. Синтезы соединений данного изобретения и промежуточных соединений для использования здесь иллюстрируются следующими примерами (1-205), включая получение промежуточных соединений 1-83,которые не ограничивают область изобретения каким-либо образом. Общее. Реагенты, исходные вещества и растворители заказывали у коммерческих поставщиков и использовали в полученном виде. Концентрация относится к упариванию в вакууме с использованием роторного испарителя Bchi. Продукты реакции очищали, когда было необходимо, с помощью флэшхроматографии на силикагеле (40-63 мкм) указанной системой растворителей. Спектроскопические данные регистрировали на спектрометре Varian Gemini 200, спектрометре Varian Gemini 300, спектрометреVarian Inova 200 и спектрометре Brucker DPX-250. Температуры плавления регистрировали на прибореBchi 535. ВЭЖХ-МС выполняли на приборе Gilson, оборудованном поршневым насосом Gilson 321,вакуумным дегазатором Gilson 864, жидкостным манипулятором Gilson 215, инжекционным модулемWATERS), и смесями вода/формиат аммония (0,1%, pH 3) и ацетонитрил/формиат аммония (0,1%, pH 3) в качестве подвижной фазы. Промежуточное соединение 1. 2-Фуранкарбоксамидин (HCl). К раствору метоксида натрия (55,5 ммоль) в метаноле (50 мл) добавляли 2-фуронитрил (5,0 г,53,2 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч. К полученному раствору медленно добавляли хлорид аммония (3,14 г, 58,7 ммоль) и смесь перемешивали при комнатной температуре в течение 68 ч. Полученную суспензию фильтровали и растворитель удаляли при пониженном давлении. Полученное твердое вещество промывали этиловым эфиром (325 мл), получая 7,5 г (96%) 2-фуранкарбоксамидина (HCl).(200 МГц, ДМСО-d6): 6,88-6,86 (м, 1H); 7,89 (д, J=3,8 Гц, 1H); 9,22 (с, 3H). Промежуточное соединение 2. 2-(2-Фурил)пиримидин-4,6-диол. К раствору этоксида натрия (0,191 моль) в этаноле (90 мл) медленно добавляли промежуточное соединение 1 (5,6 г, 38,2 ммоль). Смесь перемешивали при комнатной температуре в течение 30 мин и затем добавляли диэтилмалонат (4,87 г, 30,4 ммоль). Суспензию кипятили с обратным холодильником в течение 32 ч. Растворитель удаляли при пониженном давлении, остаток суспендировали в воде (100 мл)- 21010568 и подкисляли 5 н. соляной кислотой до pH 6. Полученное твердое вещество отфильтровывали и промывали водой (50 мл), этанолом/этиловым эфиром (4:1, 25 мл), этиловым эфиром (225 мл). 2-(2-Фурил)пиримидин-4,6-диол получали (4,1 г, 78%) в виде бледно-желтого твердого вещества.(300 МГц, ДМСО-d6): 5,00 (с, 1H); 6,60-6,70 (м, 1H); 7,40 (д, J=3,4 Гц, 1H); 7,80 (с, 1H). Промежуточное соединение 3. 4,6-Дихлор-2-(2-фурил)пиримидин. Суспензию промежуточного соединения 2 (3,0 г, 16,8 ммоль) и N,N-диизопропилэтиламина (3,85 г,29,8 ммоль) в оксихлориде фосфора (17 мл) кипятили с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении и медленно добавляли метиленхлорид (50 мл) и лед. Органический слой промывали водой (225 мл), насыщенным раствором бикарбоната натрия (225 мл), насыщенным раствором соли и сушили (Na2SO4). Растворитель удаляли при пониженном давлении, получая 4,6-дихлор-2-(2-фурил)пиримидин (3,15 г, 87%) в виде серого твердого вещества.(300 МГц, CDCl3): 6,63-6,61 (м, 1H); 7,22 (с, 1H); 7,46 (д, J=3,4 Гц, 1H); 7,68 (с, 1H). Промежуточное соединение 4. 6-Хлор-2-(2-фурил)пиримидин-4-амин. Суспензию промежуточного соединения 3 (2,0 г, 9,3 ммоль) в метаноле (14 мл) и 30% гидроксиде аммония (27 мл) нагревали в реакторе под давлением в течение 20 ч. Растворитель частично удаляли при пониженном давлении. Полученное твердое вещество отфильтровывали, промывали водой (25 мл), этиловым эфиром (25 мл) и сушили. 6-Хлор-2-(2-фурил)пиримидин-4-амин получали (1,48 г, 76%) в виде не совсем белого твердого вещества.(400 МГц, CDCl3): 5,21 (уш.с, 2H); 6,31 (с, 1H); 6,54 (м, 1H); 7,28 (д, J1=3,7 Гц, 1H); 7,58 (с, 1H). Пример 1. 2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-амин К раствору промежуточного соединения 4 (1,0 г, 5,1 ммоль) в безводном ДМФА (20 мл) добавляли пиразол (0,7 г, 10,2 ммоль) и карбонат цезия (3,34 г, 10,2 ммоль). Смесь нагревали при 85 С в течение 21 ч. Раствор выливали в воду (50 мл) и экстрагировали этилацетатом (225 мл). Органический слой промывали водой (225 мл) и насыщенным раствором соли (25 мл), сушили (Na2SO4) и растворитель удаляли при пониженном давлении. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, элюируя смесью метиленхлорид/метанол (3%), с получением 2-(2-фурил)-6-(1H-пиразол 1-ил)пиримидин-4-амин (0,64 г, 55%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 5,12 (уш.с, 2H); 6,48-6,46 (м, 1H); 6,57-6,55 (м, 1H); 6,90 (с, 1H); 7,31 (д,J=3,6 Гц, 1H); 7,61 (с, 1H); 7,75 (д, J=1,2 Гц, 1H); 8,63 (д, J=3,0 Гц, 1H). Пример 2. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамид(7 мл) добавляли пиридин (0,21 г, 2,64 ммоль) и ацетилхлорид (0,21 г, 2,64 ммоль). Смесь перемешивали при комнатной температуре в течение 5 ч и добавляли еще пиридин (52, мг, 0,66 ммоль) и ацетилхлорид(52 мг, 0,66 ммоль). Реакцию дополнительно оставляли на 1,5 ч при комнатной температуре. Раствор разбавляли метиленхлоридом (20 мл), промывали 10% гидроксидом натрия (210 мл), насыщенным раствором соли (10 мл) и сушили (Na2SO4). Растворитель удаляли при пониженном давлении. Очистка колоночной хроматографией на силикагеле с элюированием смесью этилацетат/н-гексан (1:3) приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамида (0,33 г, 92%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,25 (с, 3H); 6,51-6,49 (м, 1H); 6,61-6,58 (м, 1H); 7,36-7,34 (м, 1H); 7,62 (с, 1H); 7,81 (с, 1H); 8,21 (уш.с, 1H); 8,54 (с, 1H); 8,65-8,63 (м, 1H). Пример 3. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид Получали из соединения, указанного в заголовке примера 1 (0,34 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/н-гексан(1:1) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4- 22010568 ил]пропанамида (0,35 г, 83%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,28 (т, J=7,3 Гц, 3H); 2,48 (кв, J=7,3 Гц, 2H); 6,50-6,48 (м, 1H); 6,60-6,58 (м,1H); 7,34 (д, J=3,6 Гц, 1H); 7,62 (с, 1H); 7,79 (с, 1H); 8,13 (уш.с, 1H); 8,58 (с, 1H); 8,62 (д, J=2,4 Гц, 1H). Пример 4. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-метилпропанамид Получали из соединения, указанного в заголовке примера 1 (0,10 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2%) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]-2-метилпропанамида (90 мг, 72%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,28 (д, J=7,0 Гц, 6H); 2,58 (h, J=7,0 Гц, 1H); 6,49 (дд, J1=2,7 Гц, J2=1,5 Гц, 1H); 6,60 (дд, J1=3,3 Гц, J2=1,5 Гц, 1H); 7,36 (дд, J1=3,6 Гц, J2=0,9 Гц, 1H); 7,65-7,63 (м, 1H); 7,80-7,78 (м, 1H); 8,08 (уш.с, 1H); 8,64-8,61 (м, 2H). Пример 5. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2,2-диметилпропанамид Получали из соединения, указанного в заголовке примера 1 (0,30 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/н-гексан(от 10:90 до 15:85) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]-2,2-диметилпропанамида (25 мг, 6%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,35 (с, 9H); 6,49-6,47 (м, 1H); 6,59 (дд, J1=3,4 Гц, J2=1,8 Гц, 1H); 7,36-7,35 (м,1H); 7,64-7,63 (м, 1H); 7,78-7,77 (м, 1H); 8,19 (уш.с, 1H); 8,62 (д, J=2,7 Гц, 1H); 8,66 (с, 1H). Пример 6. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]циклопропанкарбоксамид Получали из соединения, указанного в заголовке примера 1 (0,20 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2%) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]циклопропанкарбоксамида (0,10 г, 39%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 0,98-0,91 (м, 2H); 1,20-1,13 (м, 2H); 1,59-1,51 (м, 1H); 6,49 (дд, J1=2,7 Гц,J2=1,5 Гц, 1H); 6,59 (дд, J1=3,6 Гц, J2=1,8 Гц, 1H); 7,35 (д, J=3,6 Гц, 1H); 7,64-7,63 (м, 1H); 7,77 (д,J=1,5 Гц, 1H); 8,42 (уш.с, 1H); 8,56 (с, 1H); 8,62 (д, J=2,7 Гц, 1H). Пример 7. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]циклобутанкарбоксамид Получали из соединения, указанного в заголовке примера 1 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (0,5%) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]циклобутанкарбоксамида (0,14 г, 67%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,50-1,93 (м, 6H); 3,22 (кв, J=8,5 Гц, 1H); 6,49 (дд, J1=2,7 Гц, J2=1,8 Гц, 1H); 6,59 (дд, J1=3,3 Гц, J2=1,8 Гц, 1H); 7,35 (д, J=3,3 Гц, 1H); 7,63 (м, 1H); 7,79 (м, 1H); 7,97 (уш.с, 1H); 8,62 Получали из соединения, указанного в заголовке примера 1 (0,15 г), по методике, описанной в при- 23010568 мере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (0,5%) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]циклогексанкарбоксамида (0,20 г, 91%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,00-1,26 (м, 10 Н); 2,35-2,23 (м, 1H); 6,49 (дд, J1=2,7 Гц, J2=1,5 Гц, 1H); 6,59 Получали из соединения, указанного в заголовке примера 1 (0,20 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/н-гексан(от 1:9 до 2:8) в качестве элюента приводила к получению 3-циклопентил-N-[2-(2-фурил)-6-(1H-пиразол 1-ил)пиримидин-4-ил]пропанамида (0,29 г, 94%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,18-1,07 (м, 2H); 1,86-1,51 (м, 9H); 2,43 (т, J=7,4 Гц, 2H); 6,49 (дд, J1=2,1 Гц,J2=1,5 Гц, 1H); 6,59 (дд, J1=3,3 Гц, J2=1,5 Гц, 1H); 7,34 (дд, J1=3,3 Гц, J2=0,6 Гц, 1H); 7,63-7,62 (м, 1H); 7,80-7,79 (м, 1H); 8,16 (уш.с, 1H); 8,58 (с, 1H); 8,63 (дд, J1=2,7 Гц, J2=0,6 Гц, 1H). Пример 10. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-(4-метоксифенил)ацетамид Получали из соединения, указанного в заголовке примера 1 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/н-гексан(1:4) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2(4-метоксифенил)ацетамида (63 мг, 27%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 3,73 (с, 2H); 3,82 (с, 3H); 6,50-6,48 (м, 1H); 6,58-6,56 (м, 1H); 6,91 (с, 1H); 6,94 Получали из соединения, указанного в заголовке примера 1 (80 мг), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (0,5%) в качестве элюента приводила к получению 2-(3,4-диметоксифенил)-N-[2-(2-фурил)6-(1H-пиразол-1-ил)пиримидин-4-ил]ацетамида (87 мг, 61%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 3,73 (с, 2H); 3,90 (с, 6H); 6,51-6,48 (м, 1H); 6,59-6,56 (м, 1H); 6,84 (с, 1H); 6,88 Получали из соединения, указанного в заголовке примера 1 (0,20 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/н-гексан(1:4) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3 фенилпропанамида (0,27 г, 85%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,74 (т, J=7,8 Гц, 2H); 3,08 (т, J=7,8 Гц, 2H); 6,51-6,49 (м, 1H); 6,60-6,57 (м, 1H); 7,35-7,22 (м, 6H); 7,62 (с, 1H); 7,81 (с, 1H); 8,11 (уш.с, 1H); 8,58 (с, 1H); 8,64(м, 1H). Пример 13. Получали из соединения, указанного в заголовке примера 1 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (0,5%) в качестве элюента приводила к получению (2S)-N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]-2-фенилциклопропанкарбоксамида (0,23 г, 95%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,49-1,40 (м, 1H); 1,86-1,75 (м, 2H); 2,71-2,63 (м, 1H); 6,50-6,49 (м, 1H); 6,57 (дд,J1=3,3 Гц, J2=1,8 Гц, 1H); 7,14-7,11 (м, 2H); 7,34-7,19 (м, 4H); 7,61 (м, 1H); 7,79 (м, 1H); 8,59-8,58 (м, 2H); 8,63 (д, J=2,7 Гц, 1H). Пример 14. 3,3,3-Трифтор-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамид К раствору 3,3,3-трифторпропионовой кислоты (0,21 г, 1,65 ммоль) в метиленхлориде (4 мл) добавляли оксалилхлорид (0,21 г, 1,65 ммоль) и каталитическое количество ДМФА. Смесь перемешивали при комнатной температуре в течение 1 ч. Полученный раствор охлаждали до 0 С и при данной температуре добавляли к раствору соединения, указанного в заголовке примера 1 (125 мг, 0,55 ммоль), и пиридина(123 г, 1,65 ммоль) в метиленхлориде (4 мл). Смесь перемешивали при комнатной температуре в течение 22 ч и разбавляли метиленхлоридом (8 мл). Органический слой промывали водой (28 мл) и насыщенным раствором соли (8 мл), сушили (Na2SO4) и растворитель удаляли при пониженном давлении. Очистка колоночной хроматографией на силикагеле с элюированием смесью этилацетат/н-гексан (1:4) приводила к получению 3,3,3-трифтор-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамида(0,16 г, 87%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 3,33 (кв, J=10,0 Гц, 2H); 6,52-6,50 (м, 1H); 6,61-6,59 (м, 1H); 7,36 (д, J=3,6 Гц,1H); 7,64-7,63 (м, 1H); 7,82-7,81 (м, 1H); 8,40 (уш.с, 1H); 8,54 (с, 1H); 8,65-8,63 (м, 1H). Пример 15. 3-(3,4-Диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4 ил]пропанамид Получали из соединения, указанного в заголовке примера 1 (0,20 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/нгексан (от 3:7 до 2:3) в качестве элюента приводила к получению 3-(3,4-диметоксифенил)-N-[2-(2 фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]пропанамида (0,27 г, 72%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,71 (т, J=7,6 Гц, 2H); 3,02 (т, J=7,6 Гц, 2H); 3,85 (с, 3H); 3,86 (с, 3H); 6,50 (дд,J1=2,7 Гц, J2=1,5 Гц, 1H); 6,59 (дд, J1=3,3 Гц, J2=1,8 Гц, 1H); 6,80-6,76 (м, 3H); 7,34 (дд, J1=3,3 Гц,J2=0,9 Гц, 1H); 7,62 (дд, J1=1,8 Гц, J2=0,9 Гц, 1H); 7,81 (дд, J1=1,1 Гц, J2=0,6 Гц, 1H); 8,07 (уш.с, 1H); 8,58 (с, 1H); 8,64 (дд, J1=2,7 Гц, J2=0,6 Гц, 1H). Пример 16. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-2-метил-3-фенилпропанамид Получали из соединения, указанного в заголовке примера 1 (0,15 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (1%) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]-2-метил-3-фенилпропанамида (0,14 г, 51%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,29 (д, J=6,4 Гц, 3H); 2,79-2,62 (м, 2H); 3,16-3,08 (м, 1H); 6,51-6,49 (м, 1H); Получали из соединения, указанного в заголовке примера 1 (0,20 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/нгексан (30:70) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]-3-феноксипропанамида (0,23 г, 70%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,91 (т, 2H); 4,37 (т, 2H); 6,50-6,49 (м, 1H); 6,61-6,58 (м, 1H); 7,01-6,94 (м, 3H); 7,35-7,27 (м, 3H); 7,64 (м, 1H); 7,80 (м, 1H); 8,58 (с, 1H); 8,64 (д, J=2,4 Гц, 1H). Пример 18. N-[2-(2-Фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]-3-пиридин-3-илпропанамид Получали из соединения, указанного в заголовке примера 1 (0,20 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2%) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]-3-пиридин-3-илпропанамида (0,19 г, 60%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,76 (т, J=7,3 Гц, 2H); 3,09 (т, J=7,3 Гц, 2H); 6,51-6,50 (м, 1H); 6,60-6,58 (м, 1H); 7,28-7,21 (м, 1H); 7,34 (д, J=3,6 Гц, 1H); 7,63-7,57 (м, 2H); 7,81 (с, 1H); 8,13 (с, 1H); 8,54-8,47 (м, 2H); 8,56 Получали из соединения, указанного в заголовке примера 1 (0,20 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2%) в качестве элюента приводила к получению N-[2-(2-фурил)-6-(1H-пиразол-1 ил)пиримидин-4-ил]-2-пиридин-3-илацетамида (0,70 г, 23%) в виде не совсем белого твердого вещества.(250 МГц, ДМСО-d6): 3,89 (с, 2H); 6,65 (дд, J1=2,6 Гц, J2=1,3 Гц, 1H); 6,75 (дд, J1=3,5 Гц,J2=1,7 Гц, 1H); 7,37 (дд, J1=7,9 Гц, J2=4,8 Гц, 1H); 7,49 (дд, J1=3,5 Гц, J2=0,9 Гц, 1H); 7,77 (дт, J1=7,9 Гц,J2=1,7 Гц, 1H); 7,91 (м, 1H); 7,97 (м, 1H); 8,40 (с, 1H); 8,48 (дд, J1=4,8 Гц, J2=1,7 Гц, 1H); 8,55 (д,J1=1,7 Гц, 1H); 8,77 (д, J1=2,6 Гц, 1H); 11,50 (с, 1H). Пример 20. Раствор 3,4-диметоксифенилакриловой кислоты (0,55 г, 2,64 ммоль) в тионилхлориде (4 мл) перемешивали при 55 С в течение 1 ч. Растворитель удаляли при пониженном давлении. Полученное масло растворяли в метиленхлориде (2 мл), раствор охлаждали до 0 С и добавляли к раствору соединения, указанного в заголовке примера 1 (0,20 мг, 0,88 ммоль), и пиридина (0,20 мг, 2,64 ммоль) в метиленхлориде(6 мл). Смесь перемешивали при комнатной температуре в течение 44 ч и разбавляли метиленхлоридом(8 мл). Органический слой промывали водой (28 мл) и насыщенным раствором соли (8 мл), сушили(Na2SO4) и растворитель удаляли при пониженном давлении. Очистка колоночной хроматографией на силикагеле с элюированием смесью метиленхлорид/этанол (0,5%) приводила к получению(2 Е)-3-(3,4-диметоксифенил)-N-[2-(2-фурил)-6-(1H-пиразол-1-ил)пиримидин-4-ил]акриламида (0,70 г,19%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 3,93 (с, 3H); 3,94 (с, 3H); 6,40 (д, J=15,5 Гц, 1H); 6,52-6,50 (м, 1H); 6,61-6,59 (м,- 26010568 1H); 6,90 (д, J=8,2 Гц, 1H); 7,06 (д, J=1,8 Гц, 1H); 7,16 (дд, Л=8,2 Гц, J2=1,8 Гц, 1H); 7,36 (дд, J1=3,3 Гц,J2=0,6 Гц, 1H); 7,64-7,63 (м, 1H); 7,76 (д, J=15,5 Гц, 1H); 7,82 (м, 1H); 8,33 (уш.с, 1H); 8,66-8,65 (м, 1H); 8,69 (с, 1H). Пример 21. 6-(3,5-Диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-амин К раствору промежуточного соединения 4 (2,0 г, 10,2 ммоль) в безводном ДМСО (50 мл) добавляли 3,5-диметилпиразол (1,97 г, 20,5 ммоль) и карбонат цезия (6,70 г, 20,6 ммоль). Смесь нагревали при 150 С в течение 9 ч. Раствор выливали в воду (150 мл) и экстрагировали этилацетатом (3100 мл). Органический слой промывали водой (3100 мл), насыщенным раствором соли (100 мл), сушили (Na2SO4) и растворитель удаляли при пониженном давлении. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетат/н-гексан (от 3:7 до 1:1), с получением 6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-амина (1,86 г, 71%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,29 (с, 3H); 2,78 (с, 3H); 5,10 (уш.с, 2H); 6,00 (с, 1H); 6,55-6,52 (м, 1H); 6,84 (с,1H); 7,19 (д, J=2,4 Гц, 1H); 7,58 (с, 1H). Пример 22. N-[6-(3,5-Диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]ацетамид Получали из соединения, указанного в заголовке примера 21 (0,30 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/нгексан (1:1) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]ацетамида (0,25 г, 72%) в виде не совсем белого твердого вещества.(250 МГц, CDC13): 2,23 (с, 3H); 2,29 (с, 3H); 2,77 (с, 3H); 6,02 (с, 1H); 6,58-6,55 (м, 1H); 7,24 (д,J=3,3 Гц, 1H); 7,61-7,60 (м, 1H); 8,17 (уш.с, 1H); 8,48 (с, 1H). Пример 23. N-[2-(3,5-Диметил-1H-пиразол-1-ил)-6-(2-фурил)пиримидин-4-ил]пропанамид Получали из соединения, указанного в заголовке примера 21 (0,30 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/нгексан (1:4) в качестве элюента приводила к получению N-[2-(3,5-диметил-1H-пиразол-1-ил)-6-(2 фурил)пиримидин-4-ил]пропанамида (0,26 г, 71%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,27 (т, J=7,6 Гц, 3H); 2,29 (с, 3H); 2,46 (кв, J=7,6 Гц, 2H); 2,78 (с, 3H); 6,03 (с,1H); 6,59-6,57 (м, 1H); 7,25 (д, J=2,7 Гц, 1H); 7,62-7,61 (м, 1H); 8,12 (уш.с, 1H); 8,55(с, 1H). Пример 24. N-[6-(3,5-Диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-2-метилпропанамид Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (1%) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]-2-метилпропанамида (0,11 г, 60%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,28 (д, J=7,0 Гц, 6H); 2,27 (с, 3H); 2,56 (h, J=7,0 Гц, 1H); 2,77 (с, 3H); 6,02 (с,1H); 6,58-6,56 (м, 1H); 7,26 (с, 1H); 7,62-7,61 (м, 1H); 8,03 (уш.с, 1H); 8,58 (с,1H).N-[6-(3,5-Диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-2,2-диметил Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/нгексан (15:85) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]-2,2-диметилпропанамида (95 мг, 48%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,34 (с, 9H); 2,27 (с, 3H); 2,77 (с, 3H); 6,02 (с, 1H); 6,57 (дд, J1=3,3 Гц, J2=1,8 Гц,1H); 7,25 (д, J=0,9 Гц, 1H); 7,62 (дд, J1=1,8 Гц, J2=0,9 Гц, 1H); 8,14 (уш.с, 1H); 8,62 (с, 1H). Пример 26. Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (1%) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]циклопропанкарбоксамида (70 мг, 37%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 0,97-0,89 (м, 2H); 1,21-1,13 (м, 2H); 1,59-1,49 (м, 1H); 2,26 (с, 3H); 2,77 (с, 3H); 6,01 (с, 1H); 6,57 (дд, J1=3,3 Гц, J2=1,8 Гц, 1H); 7,24 (дд, J1=3,3 Гц, J2=0,9 Гц, 1H); 7,61 (дд, J1=1,8 Гц,J2=0,9 Гц, 1H); 8,39 (уш.с, 1H); 8,52 (с, 1H). Пример 27. 3-Циклопентил-N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4 ил]пропанамид Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/н-гексан (от 90% до чистого метиленхлорида) в качестве элюента приводила к получению 3-циклопентил-N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]пропанамида (0,22 г,99%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 1,16-1,07 (м, 2H); 1,83-1,51 (м, 9H); 2,28 (с, 3H); 2,42 (т, J=7,3 Гц, 2H); 2,77 (с,3H); 6,02 (с, 1H); 6,57 (дд, J1=3,3 Гц, J2=1,8 Гц, 1H); 7,24 (д, J=3,6 Гц, 1H); 7,61 (с, 1H); 8,16 (уш.с, 1H); 8,54 (с, 1H). Пример 28. N-[6-(3,5-Диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-2-(4-метоксифенил)ацетамид Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2%) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]-2-(4-метоксифенил)ацетамида (0,11 г, 4 6%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,28 (с, 3H); 2,76 (с, 3H); 3,71 (с, 2H); 3,82 (с, 3H); 6,01 (с, 1H); 6,55 (дд,J1=3,3 Гц, J2=1,8 Гц, 1H); 6,89 (с, 1H); 6,93 (с, 1H); 7,26-7,20 (м, 3H); 7,59-7,58 (м, 1H); 8,04 (с, 1H); 8,54 Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2%) в качестве элюента приводила к получению 2-(3,4-диметоксифенил)-N-[6-(3,5 диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]ацетамида (0,12 г, 47%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,28 (с, 3H); 2,77 (с, 3H); 3,71 (с, 2H); 3,89 (с, 3H); 3,90 (с, 3H); 6,02 (с, 1H); 6,55 Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 2. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/н-гексан (от 90% до чистого метиленхлорида) в качестве элюента приводила к получению N-[6-(3,5 диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-3-фенилпропанамида (0,23 г, 99%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,29 (с, 3H); 2,72 (т, J=7,6 Гц, 2H); 2,77 (с, 3H); 3,07 (т, J=7,6 Гц, 2H); 6,02 (с,1H); 6,57-6,55 (м, 1H); 7,34-7,18 (м, 6H); 7,60 (м, 1H); 8,15 (уш.с, 1H); 8,54 (с, 1H). Пример 31. Получали из соединения, указанного в заголовке примера 21 (0,30 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/нгексан (1:4) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]-3,3,3-трифторпропанамида (0,21 г, 49%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,29 (с, 3H); 2,78 (с, 3H); 3,30 (с, J=10,0 Гц, 2H); 6,04-6,02 (м, 1H); 6,59-6,57 (м,1H); 7,28-7,24 (м, 1H); 7,62-7,61 (м, 1H); 8,30 (уш.с, 1H); 8,50 (с, 1H). Пример 32. 3-(3,4-Диметоксифенил)-N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4 ил]пропанамид Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (1%) в качестве элюента приводила к получению 3-(3,4-диметоксифенил)-N-[6-(3,5 диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]пропанамида (0,18 г, 67%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,70 (т, J=7,6 Гц, 2H); 2,77 (с, 6H); 3,02 (т, J=7,6 Гц, 2H); 3,85 (с, 3H); 3,87 (с,3H); 6,03 (с, 1H); 6,58-6,55 (м, 1H); 6,82-6,75 (м, 3H); 7,23 (дд, J1=3,3 Гц, J2=0,9 Гц, 1H); 7,60 (дд,J1=1,8 Гц, J2=0,9 Гц, 1H); 8,09 (уш.с, 1H); 8,54 (с, 1H).N-[6-(3,5-Диметил-1H-пиразол-1-ил)-2-(2-фурил)пиримидин-4-ил]-3-фенокси Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (1%) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]-3-феноксипропанамида (0,21 г, 88%) в виде не совсем белого твердого вещества.(250 МГц, CDC13): 2,28 (с, 3H); 2,78 (с, 3H); 2,89 (т, J-6,1 Гц, 2H); 4,36 (т, J=6,1 Гц, 2H); 6,02 (с,1H); 6,58-6,56 (м, 1H); 7,00-6,93 (м, 3H); 7,33-7,24 (м, 3H); 7,62 (м, 1H); 8,47 (уш.с, 1H); 8,54(с, 1H). Пример 34. Получали из соединения, указанного в заголовке примера 21 (0,15 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2,5%) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2(2-фурил)пиримидин-4-ил]-2-пиридин-3-илацетамида (55 мг, 25%) в виде не совсем белого твердого вещества.(250 МГц, ДМСО-d6): 2,19 (с, 3H); 2,74 (с, 3H); 3,87 (с, 2H); 6,20 (с, 1H); 6,73 (дд, J1=3,4 Гц,J2=1,7 Гц, 1H); 7,30 (д, J=3,4 Гц, 1H); 7,37 (дд, J1=7,7 Гц, J2=4,7 Гц, 1H); 7,79-7,74 (м, 1H); 7,96 (с, 1H); 8,35 (с, 1H); 8,50-8,46 (м, 1H); 11,41 (с, 1H). Пример 35. Получали из соединения, указанного в заголовке примера 21 (0,20 г), по методике, описанной в примере 14. Очистка колоночной хроматографией на силикагеле с использованием смеси метиленхлорид/метанол (2%) в качестве элюента приводила к получению N-[6-(3,5-диметил-1H-пиразол-1-ил)-2-(2 фурил)пиримидин-4-ил]-3-пиридин-3-илпропанамида (97 мг, 31%) в виде не совсем белого твердого вещества.(250 МГц, ДМСО-d6): 2,23 (с, 3H); 2,74 (с, 3H); 2,97-2,81 (м, 4H); 6,22 (с, 1H); 6,73-6,71 (м, 1H); 7,34-7,27 (м, 2H); 7,71-7,66 (м, 1H); 7,95 (м, 1H); 8,37 (с, 1H); 8,42-8,39 (м, 1H); 8,49 (м, 1H); 11,13 (с, 1H). Пример 36. 2-(2-Фурил)-6-(4-метил-1H-пиразол-1-ил)пиримидин-4-амин Получали из промежуточного соединения 4 (0,50 г) по методике, описанной в примере 21. Очистка колоночной хроматографией на силикагеле с использованием смеси этилацетат/н-гексан (1:1) в качестве элюента приводила к получению 2-(2-фурил)-6-(4-метил-1H-пиразол-1-ил)пиримидин-4-амина (0,29 г,47%) в виде не совсем белого твердого вещества.(250 МГц, CDCl3): 2,16 (с, 3H); 5,10 (уш.с, 2H); 6,57-6,55 (м, 1H); 6,83 (с, 1H); 7,29 (дд, J1=3,3 Гц,J2=0,6 Гц, 1H); 7,56 (с, 1H); 7,61 (м, 1H); 8,39 (с, 1H).
МПК / Метки
МПК: C07D 401/14, C07D 409/14, C07D 417/14, A61P 37/00, A61P 9/00, C07D 405/14, A61P 11/06, A61K 31/506
Метки: аминопиримидины, рецепторов, качестве, антагонистов, аденозиновых, бисгетероарил
Код ссылки
<a href="https://eas.patents.su/30-10568-2-6-bisgeteroaril-4-aminopirimidiny-v-kachestve-antagonistov-adenozinovyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">2, 6 – бисгетероарил – 4 – аминопиримидины в качестве антагонистов аденозиновых рецепторов</a>
Предыдущий патент: Изделие из волокнистого материала, придающее ощущение свежести при контакте с кожей
Следующий патент: Способ получения хирально чистой кристаллической модификации натеглинида
Случайный патент: Транспортер, прежде всего багажный транспортер


































