Полициклоалкилпурины в качестве антагонистов аденозиновых рецепторов
Номер патента: 5211
Опубликовано: 30.12.2004
Авторы: Лин Ко-Чунг, Кесман Уилльям Ф., Петтер Расселл К., Кумаравел Гнанасамбандам, Чан Хэ Си, Энсингер Кэрол Л., Даулинг Джеймс Е.
Формула / Реферат
1. Соединение, имеющее формулу
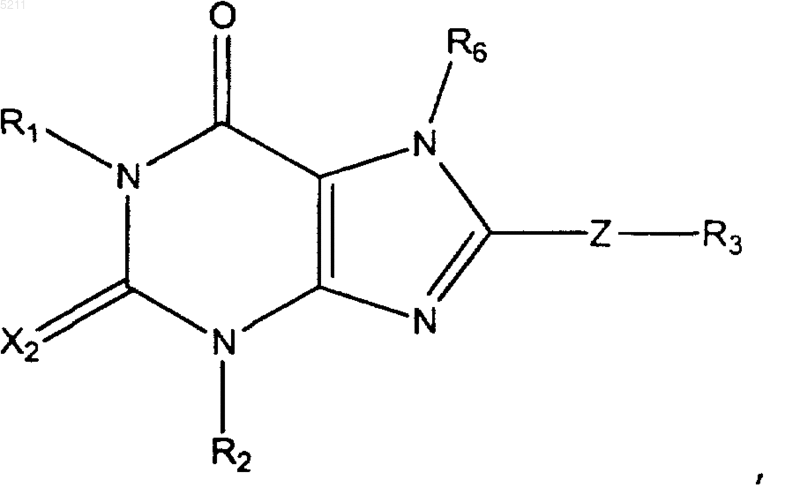
где R1 и R2 независимо выбраны из группы, состоящей из
a) водорода;
b) C1-C6алкила, незамещенного или замещенного C1-C6алкокси или галогеном; и
c) замещенного арила или замещенного арил-C1-C6алкила;
R3 выбран из группы, состоящей из
(a) бициклической, трициклической или пентациклической группы, выбранной из группы, состоящей из

где бициклическая или трициклическая группа является незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
(a) C1-C6алкила и C3-C6алкенила, где каждая алкильная или алкенильная группа является незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, состоящей из (амино) (R5)-C1-C6ацилгидразинилкарбонила, (амино)(R5)-C1-C6ацилоксикарбокси, (гидрокси)(карбокси-C1-C6алкокси)-C1-C6алкилкарбамоила, C1-C6ацилокси, альдегидо, C3-C6алкенилсульфониламино, C1-C6алкоксикарбонила, C1-C6алкиламино, C1-C6алкилфосфоно, C1-C6алкилсульфониламино, карбамоила, -R5, R5-C1-C6алкокси, циано, циано-C1-C6алкилкарбамоила, C3-C8циклоалкиламино, ди-C1-C6алкиламино, ди-C1-C6алкиламино-C1-C6алкиламино, ди-C1-C6алкилфосфоно, гетероциклила, гетероциклил-C1-C6алкиламино, гетероциклилкарбамоила, гидрокси, гидрокси-C1-C6алкилсульфониламино, оксимино, фосфоно, замещенного арил-C1-C6алкиламино, замещенного арилкарбокси-C1-C6алкоксикарбонила, замещенного гетероарилсульфониламино, замещенного гетероциклила и тиокарбамоила; и
(b) (C1-C6алкоксикарбонил)-C1-C6алкилкарбамоила, (C1-C6алкоксикарбонил)арил-C1-C6алкилкарбамоила, альдегидо, C3-C6алкенокси, C3-C6алкенилсульфониламино, C1-C6алкокси, C1-C6алкоксикарбонила, C1-C6алкоксикарбониламино, (C1-C6алкоксикарбонил)гидрокси-C1-C6алкилкарбамоила, C1-C6алкилсульфониламино, C1-C6алкилсульфонилокси, амино, амино-C1-C6алкилкарбамоила, арил-C1-C6алкоксикарбониламино, арилокси, R5-арилсульфониламино, R5-арилсульфонилокси, карбамоила, карбонила, -R5, R5-C1-C6алкокси, R5-C1-C6алкиламино, (R5-C1-C6алкил)-C1-C6алкиламино, R5-C1-C6алкилкарбамоила, R5-C1-C6алкилсульфонила, R5-C1-C6алкилсульфониламино, R5-C1-C6алкилтио, R5-арил-C1-C6алкилкарбамоила, R5-гетероциклилкарбонила, циано, C3-C8циклоалкиламино, ди-C1-C6алкиламино-C1-C6алкилкарбамоила, галогена, гетероциклила, гетероциклил-C1-C6алкиламино, гидрокси, фосфата, замещенного арил-C1-C6алкиламино, замещенного гетероциклила, замещенного гетероциклил-C1-C6алкиламино, замещенного гетероциклилсульфониламино, сульфокси-C1-C6ациламино и тиокарбамоила; и
(b) трициклической группы
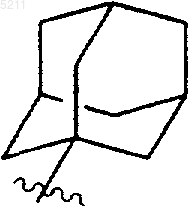
где трициклическая группа является замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
(a) C1-C6алкила, замещенного одним или несколькими заместителями, выбранными из группы, состоящей из -R5 и гидрокси; и
(b) амино-C1-C6алкиларил-C1-C6алкилкарбамоила, амино-C1-C6алкилкарбамоила, амино-C1-C6алкилгетероциклил-C1-C6алкилкарбамоила, амино-C3-C8циклоалкил-C1-C6алкил-C3-C8циклоалкилкарбамоила, амино-C3-C8циклоалкилкарбамоила, карбамоила, -R5, гетероциклила,
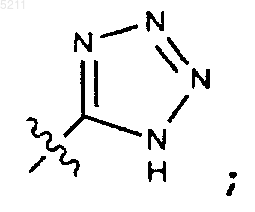
R5 выбран из группы, состоящей из -COOH, -CH2COOH, -OCH(CF3)2, -CH3, -NH2-OPO3H2, -SO3H, и группы
X2 независимо выбран из группы, состоящей из O и S;
Z выбран из группы, состоящей из простой связи и -(CH2)1-3-; и
R6 выбран из группы, состоящей из водорода и арил-C1-C6алкила.
2. Соединение по п.1, которое находится в форме, выбранной из группы, состоящей из ахирального соединения, рацемата, оптически активного соединения, чистого диастереомера, смеси диастереомеров и фармакологически приемлемой аддитивной соли.
3. Соединение по п.1, в котором R1 и R2 каждый представляет C1-C6алкильную группу.
4. Соединение по п.1, в котором R1 и R2 каждый представляет н-пропил.
5. Соединение по п.1, в котором R1 представляет н-пропил и R3 представляет арил-C1-C6алкил.
6. Соединение по п.4, в котором Z представляет простую связь.
7. Соединение по п.6, в котором R3 представляет

и в котором R3 является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, R5- и R5-C3-C6алкенила.
8. Соединение по п.7, которое представляет собой
5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[3.2.1]октан-1-карбоновую кислоту;
8-(4-гидроксибицикло[3.2.1]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион;
5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[3.2.1]октан-2-карбоновую кислоту.
9. Соединение по п.6, в котором R3 представляет
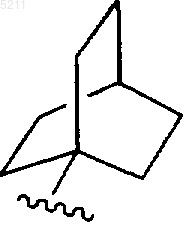
и где R3 является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, R5-C1-C6алкила, -R5, R5-C3-C6алкенила, C1-C6алкоксикарбонила, C1-C6алкоксикарбонил-C1-C6алкила, C1-C6алкоксикарбонил-C3-C6алкенила, гидрокси-C1-C6алкила, альдегидо, C1-C6алкокси-C1-C6алкила, R5-C1-C6алкокси, фосфата и R5-C1-C6алкилкарбамоила.
10. Соединение по п.9, которое представляет собой
8-(4-гидроксибицикло[2.2.2]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион;
4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]октан-1-карбоновую кислоту;
4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]октан-1-карбальдегид;
метиловый эфир 4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]октан-1-карбоновой кислоты;
метиловый эфир 3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]акриловой кислоты;
метиловый эфир 3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]пропионовой кислоты;
3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]акриловую кислоту;
3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]пропионовую кислоту;
4-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]масляную кислоту;
моно-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]эфир фосфорной кислоты;
{[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]октан-1-карбонил]метиламино}уксусную кислоту;
{[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]октан-1-карбонил]амино}уксусную кислоту;
3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-илокси]пропионовую кислоту;
метиловый эфир 3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-илокси]пропионовой кислоты;
трет-бутиловый эфир 3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-илокси]пропионовой кислоты;
3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]-2-метилпропионовую кислоту.
11. Соединение по п.6, где R3 представляет
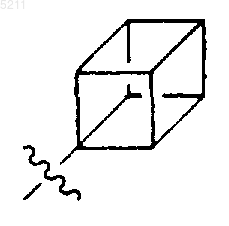
и где R3 является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, состоящей из R5-C1-C6алкила, -R5, R5-C3-C6алкенила, C1-C6алкоксикарбонила, C1-C6алкоксикарбонил-C3-C6алкенила, гидрокси-C1-C6алкила, альдегидо и гидрокси.
12. Соединение по п.11, которое представляет собой
6-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)кубан-3-карбоновую кислоту;
8-(6-гидроксиметилкубан-3-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион;
3-[6-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)кубан-3-ил]акриловую кислоту.
13. Соединение по п.6, где R3 представляет
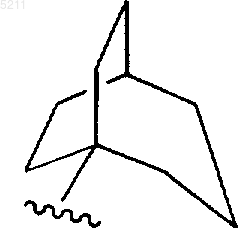
и где R3 является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, состоящей из R5-C1-C6алкила, -R5, R5-C3-C6алкенила, R5-C1-C6алкокси, C1-C6алкоксикарбонила, C1-C6алкоксикарбонил-C3-C6алкенила, гидрокси-C1-C6алкила, альдегидо и гидрокси.
14. Соединение по п.13, которое представляет собой
[5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[3.2.2]нон-1-илокси]уксусную кислоту;
8-(5-гидроксибицикло[3.2.2]нон-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион;
5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[3.2.2]нонан-1-карбоновую кислоту.
15. Соединение по п.6, где R3 представляет
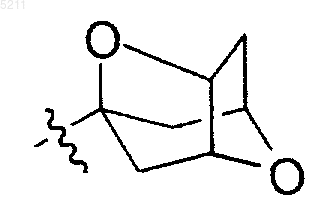
и где R3 является незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, R5-C1-C6алкокси, R5-C1-C6алкенила, C1-C6алкоксикарбонила и карбонила.
16. Соединение по п.15, которое представляет собой
8-(4-гидрокси-7-метил-2,6-диоксабицикло[3.3.1]нон-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион и
[1-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)-7-метил-2,6-диоксабицикло[3.3.1]нон-4-илокси]уксусную кислоту.
17. Лекарственная композиция, содержащая соединение по п.1 вместе с подходящим наполнителем.
18. Способ лечения субъекта, страдающего от состояния, характеризуемого повышенной концентрацией аденозина и/или повышенной чувствительностью к аденозину, включающий введение субъекту эффективного для антагонистического действия в отношении аденозина количества соединения по п.1.
19. Способ по п.18, где состояние выбрано из группы, состоящей из расстройств сердечной деятельности и кровообращения, дегенеративных расстройств центральной нервной системы, респираторных заболеваний, заболеваний, для которых показано лечение мочегонными средствами, болезнь Паркинсона, депрессии, травматического повреждения головного мозга, послешокового неврологического дефицита, угнетения дыхания, травмы головного мозга новорожденного, дислексии, гиперактивности, кистозного фиброза, цирротического асцита, апноэ новорожденного, почечной недостаточности, диабета, астмы и отечных состояний.
20. Способ по п.18, где указанное состояние представляет собой застойную сердечную недостаточность или почечную дисфункцию.
21. Способ получения 8-замещенных ксантинов, включающий стадии
a) получения ксантина, незамещенного в 8 положении;
b) защиты положения N7 ксантина, незамещенного в 8 положении;
c) депротонирования положения C8 сильным основанием с получением аниона;
d) захвата аниона карбонильным соединением, альдегидом или кетоном;
e) снятие защиты у защищенного положения N7 с получением 8-замещенного ксантина.
Текст
1 Предпосылки создания изобретения Настоящее изобретение относится к антагонистам аденозиновых рецепторов и к способам их получения и применения для лечения заболеваний. Аденозин является внутриклеточным и внеклеточным мессенджером, вырабатываемым всеми клетками в организме. Он вырабатывается также внеклеточно путем ферментативного превращения. Аденозин связывается с семью трансмембранными, связанными с G-белком рецепторами и активирует их, вызывая разнообразные ответные физиологические реакции. Сам аденозин, вещества, имитирующие действие аденозина (агонисты), и вещества, являющиеся его антагонистами, имеют важное клиническое применение. Аденозиновые рецепторы делятся на четыре известных подтипа (т.е. A1, А 2 а, А 2b и А 3). Указанные подтипы обладают необычным и иногда противоположным действием. Активация аденозинового A1-рецептора,например, вызывает повышение почечного сосудистого сопротивления, а активация аденозинового А 2 а-рецептора вызывает снижение почечного сосудистого сопротивления. В большинстве систем органов периоды метаболического стресса приводят к значительному росту концентрации аденозина в тканях. Например, сердце продуцирует и высвобождает аденозин для опосредования адаптивных ответных реакций на стресс, таких как уменьшение частоты сердечных сокращений и расширения коронарных сосудов сердца. Аналогичным образом, в ответ на гипоксию, метаболический стресс и многие нефротоксические вещества концентрация аденозина в почках повышается. Почки также вырабатывают аденозин конститутивно. Почки регулируют количество конститутивно продуцированного аденозина, чтобы регулировать клубочковую фильтрацию и электролитную реабсорбцию. Что касается клубочковой фильтрации, то активация A1-рецепторов приводит к сужению приносящих артериол, тогда как активация А 2 а-рецепторов ведет к расширению выносящих артериол. Активация А 2 арецепторов может также оказывать сосудорасширяющее действие на приносящую артериолу. В общем, эффект активации указанных клубочковых аденозиновых рецепторов заключается в снижении уровня клубочковой фильтрации. Кроме того, аденозиновые A1-рецепторы локализованы в областях проксимальных и дистальных канальцев. Активация этих рецепторов стимулирует реабсорбцию натрия из просвета канальцев. Следовательно, блокирование действия аденозина на эти рецепторы даст повышение уровня клубочковой фильтрации и увеличение экскреции натрия. Краткое изложение сущности изобретения Настоящее изобретение основано на том,что, как было обнаружено, соединения формулыI неожиданно оказались очень мощными и из 005211 2 бирательными ингибиторами определенных подтипов аденозиновых рецепторов. Антагонисты аденозина могут быть полезны для профилактики и/или лечения многочисленных заболеваний, включающих расстройства сердечной деятельности и кровообращения, дегенеративные расстройства центральной нервной системы, респираторные заболевания и многие заболевания, для которых показано лечение мочегонными средствами. В одном из вариантов осуществления настоящее изобретение относится к соединению формулы Ib) алкил, алкенил с не менее чем 3 углеродными атомами или алкинил с не менее чем 3 углеродными атомами (например, когда алкил,алкенил или алкинил может быть незамещенным или замещенным одним или несколькими заместителями, выбранными из гидрокси, алкокси, амино, алкиламино, диалкиламино, гетероциклила, ациламино, алкилсульфониламино и гетероциклилкарбониламино); или с) арил или замещенный арил;(а) бициклической, трициклической или пентациклической группы, выбранной из где бициклическая или трициклическая группа может быть незамещенной или замещенной одним или несколькими заместителями, выбранными из(а) алкила, алкенила и алкинила, где каждая алкильная, алкенильная или алкинильная группа может быть незамещенной или замещенной одним или несколькими заместителями,выбранными из группы, состоящей из (амино)(R5)ацилгидразинилкарбонила, (амино)(R5) ацилоксикарбокси,(гидрокси)(карбоалкокси) алкилкарбамоила, ацилокси, альдегидо, алкенилсульфониламино, алкокси, алкоксикарбонила, алкиламиноалкиламино, алкилфосфоно, алкилсульфониламино, карбамоила, R5, R5 алкокси, R5-алкиламино, циано, цианоалкил 3 карбамоила, циклоалкиламино, диалкиламино,диалкиламиноалкиламино,диалкилфосфоно,галогеналкилсульфониламино, гетероциклилалкиламино, гетероциклилкарбамоила, гидрокси,гидроксиалкилсульфониламино,оксимино,фосфоно, замещенного аралкиламино, замещенного арилкарбоксиалкоксикарбонила, замещенного гетероарилсульфониламино, замещенного гетероциклила, тиокарбамоила и трифторметила; или где трициклическая группа является замещенной одним или несколькими заместителями,выбранными из группы, состоящей из(а) алкила, алкенила и алкинила, где каждая алкильная, алкенильная или алкинильная группа является незамещенной или замещенной одним или несколькими заместителями, выбранными из группы, состоящей из (амино)R4 может представлять водород, С 1-С 4 алкил, С 1-4 алкил-СО 2 Н или фенил, где группы С 1-С 4 алкильная, С 1-4 алкил-СО 2 Н и фенильная могут быть незамещенными или замещенными одним, двумя, тремя или более заместителями,такими как галоген, -ОН, -ОМе, -NH2, -NO2 и бензил или бензил, замещенный одним, двумя,тремя или более заместителями, такими как галоген, -ОН, -ОМе, -NH2 и -NO2;R4PO3H2,-NHCOCF3,-NHCONHSO2R4,-NHPO3H2,-NHSO2R4,-NHSO2NHCOR4,-OPO3H2, -OSO3H, -PO(OH)R4, -PO3H2, -SO3H,-SO2NHR4, -SО 3NНСОR4, -SO3NHCONHCO2R4 или любую из следующих групп:X1 и Х 2 выбраны из кислорода (О) и серыZ может представлять простую связь, -O-,-(CH2)1-3-, -O(CH2)1-2-, -CH2OCH2-, -(CH2)1-2O-,-СН=СНСH2-, -СН=СН- или -СН 2 СН=СН-; иR6 может представлять водород, алкил,ацил, алкилсульфонил, аралкил, замещенный аралкил, замещенный алкил или гетероциклил. Предпочтительно R6 представляет водород. Однако когда R6 представляет метил или другой неводородный заместитель, соединения могут проявлять высокую избирательность к ингибированию аденозиновых А 2 а-рецепторов. 5 В некоторых вариантах R1 и R2 могут представлять одинаковые или разные алкильные группы (например, один или оба могут представлять н-пропил).R3 может представлять аралкил, замещенный -ОН, -Оме или галогеном, метил или 3 гидроксипропил, a Z может представлять простую связь. В некоторых вариантах R3 может представлять и может быть незамещенным или замещенным одним или несколькими (т.е. 1, 2, 3 или более) заместителями, такими как гидрокси, R5- илиR5-алкенил. Таким образом, соединение может представлять собой, например, 5-(2,6-диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[3.2.1]октан-1-карбоновую кислоту, 8(4-гидроксибицикло[3.2.1]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион или 5-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[3.2.1]октан-2-карбоновую кислоту. В других вариантах R3 может представлять и может быть незамещенным или замещенным одним или несколькими заместителями, такими как гидрокси, R5 алкил, -R5, R5 алкенил, алкоксикарбонил, алкоксикарбонилалкил, алкоксикарбонилалкенил, гидроксиалкил, альдегидо, алкоксиалкил, R5 алкокси, фосфат, R5 алкилкарбамоил и R5 алкил(алкил)карбамоил. Таким образом, соединение может представлять собой,например,8-(4-гидроксибицикло[2.2.2]окт-1 ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион, 4(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро 1 Н-пурин-8-ил)бицикло[2.2.2]октан-1-карбоновую кислоту,4-(2,6-диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло и может быть незамещенным или замещенным одним или несколькими заместителями, такими как R5 алкил, -R5, R5 алкенил, алкоксикарбонил,алкоксикарбонилалкенил, гидроксиалкил, альдегидо и гидрокси. Таким образом, соединение может представлять собой, например, 6-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)кубан-3-карбоновую кислоту, 8-(6 гидроксиметилкубан-3-ил)-1,3-дипропил-3,7 дигидропурин-2,6-дион или 3-[6-(2,6-диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8 ил)кубан-3-ил]акриловую кислоту. В еще одном варианте R3 может представлять и может быть незамещенным или замещенным одним или несколькими заместителями, такими как R5 алкил, -R5, R5 алкенил, R5 алкокси, алкоксикарбонил, алкоксикарбонилалкенил, гидроксиалкил, альдегидо и гидрокси. Таким образом,соединение может представлять собой, например, [5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.2]нон-1-илокси]уксусную кислоту, 8-(5-гидроксибицикло 7 И в еще одном варианте R3 может представлять и может быть незамещенным или замещенным одним или несколькими заместителями, такими как гидрокси, R5 алкокси, R5 алкенил, алкоксикарбонил и карбонил. Таким образом, соединение может представлять собой, например, 8-(4 гидрокси-7-метил-2,6-диоксабицикло[3.3.1]нон 1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион или [1-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-7-метил-2,6-диоксабицикло[3.3.1]нон-4-илокси]уксусную кислоту. Соединение может быть, например, в форме ахирального соединения, рацемата, оптически активного соединения, чистого диастереомера, смеси диастереомеров или фармакологически приемлемой аддитивной соли. Соединения по настоящему изобретению могут быть также модифицированы путем присоединения подходящих функциональных групп для улучшения избирательных биологических свойств. Такие модификации известны в данной области и включают модификации, которые увеличивают биологическую проницаемость в заданную биологическую систему (например,кровь, лимфатическую систему, центральную нервную систему), повышают пероральную доступность, повышают растворимость, обеспечивая тем самым возможность введения путем инъекции, облегчают метаболизм и/или изменяют скорость выведения. Примеры указанных модификаций включают, но не ограничиваются ими, эстерификацию полиэтиленгликолями,получение производных пивалатами или заместителями - жирными кислотами, превращение в карбаматы, гидроксилирование ароматических колец и гетероатомное замещение в ароматических кольцах. В соответствии с настоящим изобретением предлагается также лекарственная композиция,включающая любое из описанных выше соединений, одно или в сочетании, вместе с подходящим наполнителем. Предлагается также способ лечения субъекта, страдающего от состояния, характеризуемого повышенной концентрацией аденозина и/или повышенной чувствительностью к аденозину и/или повышенным числом аденозиновых рецепторов или их повышенной способностью к связыванию. Способ включает стадию введения субъекту эффективного количества любого из вышеописанных соединений в качестве антагониста аденозиновых рецепторов. Указанное состояние может представлять собой, например,расстройство сердечной деятельности и кровообращения, дегенеративное расстройство центральной нервной системы, респираторное заболевание, заболевание, для которого показано 8 лечение мочегонными средствами, гипертензию, болезнь Паркинсона, депрессию, травматическое повреждение головного мозга, послешоковый неврологический дефицит, подавление дыхания, травму головного мозга новорожднного, дислексию, гиперактивность, кистозный фиброз, цирротический асцит, апноэ новорожднного, почечную недостаточность, диабет,астму, отчное состояние, застойную сердечную недостаточность или почечную дисфункцию(например, дисфункцию, связанную с применением мочегонных средств при застойной сердечной недостаточности, или почечное отравление вследствие лечения химиотерапевтическими средствами). В соответствии с настоящим изобретением предлагается также способ получения 8 замещенных ксантинов. Способ включает стадии получения N7,С 8-дигидроксантина (например, соединения 10 на фиг. 1), защиты положения N7 ксантина (например, с использованием ТНР или ВОМ эфира), депротонирования положения С 8 сильным основанием (таким как диизопропиламид лития или н-бутиллитий) с получением аниона, захвата аниона карбоксильным соединением, карбонильным соединением, альдегидом или кетоном и снятие защиты в защищенном положении N7 с получением 8 замещенного ксантина. При использовании в данном описании группа алкил означает насыщенную алифатическую углеводородную группу. Алкильная группа может быть неразветвленной или разветвленной и может иметь, например, от 1 до 6 углеродных атомов в цепи. Примеры неразветвленных алкильных групп включают, но не ограничиваются ими, этил и бутил. Примеры разветвленных групп включают, но не ограничиваются ими, изопропил и трет-бутил. Алкенил означает алифатическую углеводородную группу, которая имеет по крайней мере одну двойную связь. Алкенильная группа может быть неразветвленной или разветвленной и может иметь, например, от 3 до 6 углеродных атомов в цепи и 1 или 2 двойные связи. Примеры алкенильной группы включают, но не ограничиваются ими, аллил и изопренил. Алкинил означает алифатическую углеводородную группу, которая имеет по крайней мере одну тройную связь. Алкинильная группа может быть неразветвленной или разветвленной и может иметь, например, от 3 до 6 углеродных атомов в цепи и 1-2 тройные связи. Примеры алкинильной группы включают, но не ограничиваются ими, пропаргил и бутинил. Арил означает фенильную или нафтильную группу или ее производные. Замещенная арильная группа означает арильную группу,которая замещена одним или несколькими заместителями, такими как алкил, алкокси, амино,нитро, карбокси, карбоалкокси, циано, алкиламино, диалкиламино, галоген, гидрокси, гидро 9 ксиалкил, меркаптил, алкилмеркаптил, тригалогеналкил, карбоксиалкил, сульфокси или карбамоил. Аралкил означает алкильную группу,замещенную арильной группой. Примером аралкильной группы является бензил. Циклоалкил означает алифатическое кольцо, например, из 3-8 углеродных атомов. Примеры циклоалкильных групп включают циклопропил и циклогексил. Ацил означает неразветвленную или разветвленную алкил-С(=O)группу или формильную группу. Примеры ацильных групп включают алканоильные группы (например,имеющие от 1 до 6 углеродных атомов в алкильной группе). Примерами ацильных групп являются ацетил и пивалоил. Ацильные группы могут быть замещенными или незамещенными. Карбамоил означает группу, имеющую формулу H2N-C(=O)-. Алкилкарбамоил и диалкилкарбамоил относятся к карбамоильным группам, в которых азот имеет одну или две алкильные группы, присоединенные вместо атомов водорода соответственно. Аналогичным образом, арилкарбамоил и арилалкилкарбамоил включают арильную группу вместо одного из атомов водорода и (в последнем случае) алкильную группу вместо второго атома водорода. Карбоксил означает группу -СООН. Алкокси означает алкил-О-группу, в которой алкил такой, как описанный выше. Алкоксиалкил означает алкильную группу, как описана выше, с атомом водорода,замещенным алкоксигруппой, как описана выше. Галоген означает фтор, хлор, бром или иод. Гетероциклил означает 5-10-членную кольцевую структуру, в которой один или несколько атомов в кольце представляют собой элемент, отличный от углерода, например N, О,S. Гетероциклическая группа может быть ароматической или неароматической, т.е. может быть насыщенной или частично или полностью ненасыщенной. Примеры гетероциклических групп включают пиридил, имидазолил, фуранил, тиенил, тиазолил, тетрагидрофуранил, тетрагидропиранил, морфолинил, тиоморфолинил,индолил, индолинил, изоиндолинил, пиперидинил, пиримидинил, пиперазинил, изоксазолил,изоксазолидинил, тетразолил и бензимидазолил. Замещенный гетероциклил означает гетероциклическую группу, в которой один или несколько атомов водорода замещены заместителями, такими как алкокси, алкиламино, диалкиламино, карбалкокси, карбамоил, циано, галоген, тригалогенметил, гидрокси, карбонил, тиокарбонил, гидроксиалкил или нитро. Гидроксиалкил означает алкильную группу, замещенную гидроксигруппой. 10 Сульфамоил означает группу формулы-S(O)2NH2. Алкилсульфамоил и диалкилсульфамоил относятся к сульфамоильным группам, в которых азот имеет одну или две алкильные группы, присоединенные вместо атомов водорода соответственно. Аналогичным образом,арилсульфамоил и арилалкилсульфамоил содержат арильную группу вместо одного из атомов водорода и (в последнем случае) алкильную группу вместо второго атома водорода. Антагонист означает молекулу, которая связывается с рецептором, не активируя его. Антагонист конкурирует с эндогенным лигандом за указанный сайт связывания и, таким образом, снижает способность эдогенного лиганда стимулировать рецептор. В контексте настоящего изобретения селективный антагонист означает антагонист,который связывается с определенным подтипом аденозинового рецептора с более высоким сродством к связыванию, чем к другим подтипам. Антагонисты по настоящему изобретению могут, например, иметь высокое сродство к связыванию A1-рецепторов или А 2 а-рецепторов и являются селективными, когда имеют (а) наномолярное сродство к связыванию одного из указанных двух подтипов и (b) по крайней мере в 10 раз, более предпочтительно в 50 раз и наиболее предпочтительно по крайней мере в 100 раз большее сродство к связыванию одного подтипа, чем других. Настоящее изобретение дает много преимуществ. Предлагаемые соединения легко получают из легкодоступных исходных материалов в относительно малое число стадий. Соединения имеют ряд групп, способных к образованию различных производных, что обеспечивает возможность систематической оптимизации. В качестве специфических антагонистов соединения имеют большую медицинскую полезность. Поскольку соединения являются очень мощными и специфическими антагонистами, их можно(1) применять в низких дозах для сведения к минимуму вероятности побочных эффектов и(2) включать в различные лекарственные формы, включающие, но не ограниченные ими, пилюли, таблетки, капсулы, аэрозоли, суппозитории, жидкие препаративные формы для приема внутрь или для инъекции, пищевые добавки или препараты местного применения. Кроме медицинского применения, соединение-антагонист можно применять для лечения домашнего скота и домашних животных. Если не указано иное, все технические и научные термины, используемые в данном описании, имеют то же значение, которое обычно знакомо специалисту в области, к которой относится настоящее изобретение. Хотя при практическом осуществлении настоящего изобретения или при испытаниях соединений по настоящему изобретению можно использовать способы и 11 материалы, аналогичные или равноценные тем,что описаны в данном описании, подходящими способами и материалами являются те, которые описаны ниже. Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в данном описании, полностью включены сюда в качестве ссылок. Кроме того, материалы, способы и примеры является иллюстративными, а не ограничивающими. Другие признаки и преимущества настоящего изобретения очевидны из следующего подробного описания и из формулы изобретения. Краткое описание чертежей Фиг. 1 - серия иллюстративных примеров соединений по настоящему изобретению; фиг. 2 - схематическое изображение синтеза соединений по настоящему изобретению; фиг. 3 - схематическое изображение альтернативного пути синтеза соединений по настоящему изобретению; фиг. 4 - схематическое изображение превращения соединения (VII) в соответствующий олефин (XII) через спирт (X); фиг. 5 - схематическое изображение еще одного пути синтеза соединений по настоящему изобретению; фиг. 6 - схематическое изображение синтеза соединения (XXI), которое является исходным материалом, используемым в реакции, показанной на фиг. 3; фиг. 7 - схематическое изображение альтернативного пути синтеза соединения (XXI); фиг. 8 - схематическое изображение синтеза различных соединений по настоящему изобретению. Описание предпочтительных вариантов изобретения В общем, в соответствии с настоящим изобретением предлагаются очень мощные и селективные антагонисты аденозиновогоA1 рецептора. Описаны также селективные антагонисты аденозинового А 2 а-рецептора. Синтез соединений-антагонистов аденозина Соединения по настоящему изобретению могут быть получены многими известными способами. Здесь описаны два основных способа. Как показано на двух схемах, представленных ниже, в каждом из указанных способов используют один и тот же исходный материал 1,3 дизамещенный-5,6-диаминоурацил (соединение(VI. 1,3-Дизамещенные-5,6-диаминоурацилы могут быть получены обработкой соответствующей симметрично или несимметрично замещенной мочевины цианоуксусной кислотой с последующими нитрозированием и восстановлением (см., например, J. Org. Chem. 16, 1879,1951; Can. J. Chem. 46, 3413, 1968, включено в данное описание в качестве ссылки). Несимметрично замещенные ксантины могут быть получены по методу Мюллера (Mueller) (J. Med.Chem. 36, 3341, 1993, включено в данное описание в качестве ссылки). Согласно этому методу 6-аминоурацил специфично моноалкилируют,по N3 урацила в условиях по Ворбрюггену(Vorbruggen). В соответствии с другим вариантом, незамещенное положение N1 или N3 может быть функционализировано (например, алкилированием) на последней стадии синтеза. В первом общем способе 1,3 дизамещенный-5,6-диаминоурацил (соединение(VI может быть сначала подвергнут реакции замыкания кольца с получением промежуточного производного ксантина, незамещенного в положении 8. Указанное промежуточное соединение, в свою очередь, может быть связано с предшественником части Z-R3 соединения с получением требуемых 8-замещенных ксантинов. Как показано на представленной ниже схеме 1,исходный 1,3-дизамещенный-5,6 диаминоурацил (т.е. соединение (VI сначала подвергают взаимодействию с HC(OEt)3 для проведения реакции замыкания кольца с получением промежуточного производного ксантина, незамещенного в положении 8 (т.е. соединения (А. Указанное промежуточное соединение после защиты аминозащитной группой (например, ТНР или ВОМ в положении N7) подвергают реакции связывания, взаимодействию с предшественником части Z-R3 (например, альдегидом или кетоном) в присутствии сильного основания (например, н-бутиллития (nBuLi) или диизопропиламида лития (LDA с получением спирта (т.е. соединения (С. Гидроксильная группа спирта может быть затем подвергнута реакции превращения спирта в амин, меркаптан,простой эфир, лактон (например, соединение(Е или другое функционализированное соединение способами, известными специалистам в данной области. После этого может быть удалена защитная группа в положении N7 с получением продукта со снятой защитой (т.е. соединения F, который затем может быть функционализирован с получением соединений по настоящему изобретению. См., например, примеры 16, 51 и 52. Согласно второму общему способу, соединения по настоящему изобретению могут быть получены осуществлением взаимодействия исходного 1,3-дизамещенного-5,6-диаминоурацила с предшественником части Z-R3 (например, альдегиды, карбоновые кислоты или хлорангидриды карбоновых кислот) с получением промежуточного 6-амидзамещенного производного урацила, которое, в свою очередь, может быть подвергнуто реакции замыкания кольца с получением требуемого соединения ксантина. Как показано на представленной ниже схеме 2,исходный 1,3-дизамещенный-5,6-диаминоурацил (т.е. соединение (VI сначала связывают с ди(карбоксил/сложный эфир)замещенным предшественником части Z-R3, HOOC-Z-R3COORa (т.е. соединением (G), где Ra представляет Н, C1-5 алкил или бензил, причем фенильное кольцо является необязательно замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, гидроксила или C1-3 алкокси) с получением 6-амидзамещенного промежуточного производного урацила (т.е. соединения (Н путем проведения реакций,хорошо известных специалисту в данной области техники (например, с использованием реагентов для связывания, таких как бензотриазол 1-илокситрис(диметиламино)фосфония гексафторфосфат(HATU. Примеры соединений (G) включают монометиловый эфир бицикло[3.2.1]октан-1,5 дикарбоновой кислоты и моноэтиловый эфир бицикло[2.2.2]октан-1,4-дикарбоновой кислоты. См., например, примеры 8 и 13. С промежуточным производным урацила проводят затем реакцию замыкания кольца в основных условиях(например, с использованием КОН и изопропилового спирта) с получением ксантина (т.е. соединения (J, который затем может быть функ 005211 14 ционализирован с получением различных соединений по настоящему изобретению. Необходимые альдегиды, кетоны, карбоновые кислоты и хлорангидриды карбоновых кислот коммерчески доступны (например, Aldrich Chemical Co., Inc., Milwaukee, Wise.) или могут быть легко получены из коммерчески доступных материалов хорошо известными методами синтеза. Такие методы синтеза включают, но не ограничиваются ими, окисление, восстановление, гидролиз, алкилирование и реакции гомологизации по Виттигу (Wittig). В качестве ссылок, касающихся получения бициклоалкановых карбоновых кислот по настоящему изобретению (например, соединения (III), которое является примером соединения (G, см.,например, Aust. J. Chem. 38, 1705, 1985; Aust. J.Chem. Soc. 102, 6862, 1980; J. Org. Chem. 46,4795, 1981; and J. Org. Chem. 60, 6873, 1995. В одном случае, когда соединение (G) представляет собой бицикло[2.2.2]октан-1,4 дикарбоновую кислоту или соответствующие ее эфиры (где Z представляет простую связь и R3 представляет бицикло[2.2.2]октил), существует ряд способов их получения. Как показано на фиг. 2, исходный материал (т.е. соединение (I представляет собой 1-СОORа-4-СОORb-циклогексан, где каждый из Ra и Rb независимо представляет Н, C1-5 алкил или бензил, причем фенильное кольцо является необязательно замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, гидроксила илиC1-3 алкокси. Предпочтительно Ra и Rb одинаковы и представляют метил или этил. На фиг. 2 показаны три разных пути синтеза для превращения соединения (I) в соединение (III) (пример соединения (G. Путь (1) (т.е. стадии (А) и (В включает превращение соединения (I) в его соответствующее хлорэтилсодержащее соединение (II), которое, в свою очередь, подвергают реакции замыкания кольца с получением соответствующей 1,4-бицикло[2.2.2]октановой кислоты или ее эфира (III). См. примеры 79 и 80. Путь (2) также включает соединение (II), которое превращают в соединение (III) через другое промежуточное соединение (XXV), иодэтилсодержащее производное соединения (I). См. примеры 101 и 102. Путь (3) (т.е. стадия (ТТ включает в себя превращение соединения (I) в 1,4-бицикло[2.2.2]октановую кислоту или ее 15 эфир (III) без выделения промежуточных соединений, т.е. соединения (II). См. пример 110. Для получения соединения (II) исходное соединение (I) обрабатывают примерно 1-1,5 экв. сильного основания. Сильные основания, которые могут быть использованы в данной реакции, включают диизопропиламид лития (LDA) и изопропилциклогексиламид лития, из которых предпочтительным основанием является LDA. Типичные растворители для этой реакции включают тетрагидрофуран (ТГФ, THF), диметоксиэтан, диоксан и трет-бутилметиловый эфир, из которых предпочтительным растворителем является ТГФ. Данную реакцию нужно проводить в температурном диапазоне от примерно -100 до примерно -60 С. Далее реакционную смесь обрабатывают примерно 1-1,5 экв. бромхлорэтана в присутствии по крайней мере 4 экв. реагента, такого как 1,1,3,3-тетраметилмочевина (TMU), 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидинон(DMPU), 15-краун-5 и 12-краун-4, из которых предпочтительной является TMU. Данная реакция может быть проведена в растворителях, таких как ТГФ, диметоксиэтан, диоксан или третбутилметиловый эфир (из них предпочтительным растворителем является ТГФ), и при температуре в пределах от примерно -80 до примерно 0 С. Реакция замыкания кольца может быть осуществлена сначала обработкой соединения (II) примерно 4 экв. гексилметилфосфорамида (НМРА) с последующей обработкой сильным основанием, таким как н-бутиллитий и диизопропиламин (DIEA). Возвращаясь к пути (2), нужно отметить,что хлорэтилсодержащее промежуточное соединение (II) может быть обработано иодидом с получением требуемого иодэтилсодержащего промежуточного соединения (XXV). Примеры иодида, который может быть использован в данной реакции, включают иодид натрия, иодид калия, иодид лития или иодид тетрабутиламмония, из которых предпочтительным являетсяNaI. Затем проводят реакцию замыкания кольца в присутствии подходящего сильного основания, такого как LDA или изопропилциклогексиламид лития (LDA является предпочтительным основанием) и реагентов, таких как TMU илиDMPU. Типичные растворители для использования в данной реакции включают ТГФ, диметоксиэтан, диоксан или трет-бутилметиловый эфир (предпочтительным является ТГФ). Данную реакцию нужно проводить при температуре в пределах от примерно -80 до примерно 25 С. Что касается пути (3), где исходное соединение (I) превращают непосредственно в соединение (III), то соединение (I) сначала обрабатывают примерно 1-1,5 экв. сильного основания,такого как LDA или изопропилциклогексиламид лития (LDA является предпочтительным основанием), в подходящем растворителе, таком как 16 ТГФ, диметоксиэтан, диоксан или третбутилметиловый эфир (из них предпочтительным растворителем является ТГФ). Температура реакции должна находиться в пределах от примерно -100 до примерно -60 С. Полученную реакционную смесь затем обрабатывают менее чем 1 экв. бромхлорэтана в присутствии по крайней мере 4 экв. НМРА при температуре в пределах от примерно -80 до примерно 25 С. Далее реакционную смесь вводят в контакт с примерно 1-1,5 экв. сильного основания, такого как LDA или изопропилциклогексиламид лития(LDA является предпочтительным основанием),и по крайней мере 4 экв. НМРА в подходящем растворителе, таком как ТГФ, диметоксиэтан,диоксан или трет-бутилметиловый эфир (предпочтительным растворителем является ТГФ). Данную реакцию нужно проводить при температуре в пределах от примерно -100 до примерно -60 С. Следует отметить, что путь (3) не требует выделения промежуточных соединений. Существует много способов дополнительной функционализации соединения (J), которое содержит карбоновую кислоту или ее сложный эфир, присоединенные к группе R3. Например,соединение (J) может быть превращено в соответствующее производное акриловой кислоты. Согласно одному из способов сначала гидролизуют сложноэфирную группу соединения (J)(при условии, что Ra представляет не Н) с получением соответствующей карбоновой кислоты,восстанавливают карбоновую кислоту до соответствующего спирта, окисляют спирт до соответствующего альдегида и затем осуществляют реакцию Уодсворта-Хорнера-Эммонса (Wadsworth-Horner-Emmons) или Виттига (Wittig) с получением соответствующего производного акриловой кислоты. См., например, примеры 5,6, 15, 16 и 17. Соединение (J) может быть также превращено непосредственно в соответствующий спирт (см., например, пример 4). В соответствии с другим вариантом соединение (J) превращают непосредственно в его соответствующий альдегид. Согласно еще одному варианту соединение (J), содержащее сложноэфирную группу, превращают в соответствующую карбоновую кислоту и затем непосредственно в альдегид. Альтернативно, можно также функционализировать предшественник части Z-R3 перед связыванием с 1,3-дизамещенным-8 незамещенным ксантином по схеме 1 или 1,3 дизамещенным-5,6-диаминоурацилом по схеме 2. Кроме того, соединения по настоящему изобретению могут быть получены на твердом носителе (например, смоле Ванга (Wang. См. пример 36. На фиг. 3 показан альтернативный способ получения соединения (XIV) из соединения(IV). В способе, показанном на фиг. 3, используют химию процесса, аналогичную той, что показана на фиг. 2, но сначала получают боковую цепь - пропионовую кислоту у бицик 17 ло[2.2.2]октильной части и затем присоединяют к 1,3-дизамещенной урацильной части с последующей циклизацией, получая в результате требуемое соединение (XIV). Что касается соединения (XX), то R3 и R4 должны быть химически различными по их реакционной способности(например, метил и бензил). На фиг. 4 показан альтернативный способ превращения соединения (VII) в соответствующий спирт (X) и последующего превращения спирта (X) в соответствующий олефин (XII). На стадиях (F')-(H) осуществляют замыкание кольца и затем омыление сложного эфира (VIII) до кислоты (IX) с последующим восстановлением до спирта (X), см. примеры 84, 85 и 86. В соответствии с другим вариантом соединение (VII) можно подвергнуть восстановлению (стадия(Y), см. пример 103) и реакциям циклизации с получением соединения (X) (стадия (Z), см.,например, пример 84 а). Еще один альтернативный способ включает омыление и циклизацию соединения (VII) с получением соединения (IX)(стадии (Y') и (Z'. Данные реакции хорошо известны специалистам в данной области. См.,например, примеры 85 а и 84 а. Стадии (I)-(DD) показывают альтернативные процессы превращения спирта (X) в соответствующий олефин(XII). В частности, стадии (J), (АА) и (СС) (см. примеры 89, 104 и 105) являются альтернативными путями превращения монокарбонового альдегида соединения (XI) в часть, содержащую акриловую кислоту/сложный эфир, известными специалистам в данной области способами. Как показано на фиг. 5, соединения (XXIX) и (XXX) уже были описаны в литературе (Grob,С.A., Rich, R. Helv. Chim. Acta. 1979, 62, 2802;Trans. I, 1979, 2180) (т.е. стадии (ЕЕ) and (FF. Соединение (XXX) может быть превращено в соединение (XXXI) хорошо известными методами. Например, соединение (XXX) может быть непосредственно восстановлено по Вольфу-Кижнеру (Wolff-Kishner) или по Клемменсону (Clemmenson). В соответствии с альтернативным вариантом функциональная кетогруппа соединения (XXX) может быть сначала превращена в дитиокетальное производное, такое как,например, 1,3-дитиан, 1,3-дитиолан или 1,3 диалкилтиокеталь. Указанное производное, в свою очередь, может быть десульфуризовано никелем Ренея. Такого рода манипуляции с функциональными группами обычны и известны рядовому специалисту в данной области. Следующие две стадии, т.е. стадии (GG) и (НН),являются примерами связывания 1,3 дизамещенного-5,6-диаминоурацила с карбоновой кислотой с последующим замыканием кольца, опосредуемым основанием. На стадии(II) третичный гидроксил превращают в его соответствующий бромид, иодид или трифторметансульфонат воздействием PBr3, TMSBr, TMSI,KI and H3PO4 или трифторметансульфонового 18 ангидрида в присутствии ненуклеофильного основания. Затем получают соединение (XXXV) обработкой соединения (XXXIV) катализатором, производным от соли палладия (Pd(OAc)2,PdCl2, Pd(O2CCF3) и т.д.) и фосфинового лиганда (РРh3, Р(о-толил)3 и т.д.), с последующей обработкой олефином (таким как метилакрилат,метилпропиолат и т.д.). Гидрирование соединения (XXXV) с последующим превращением сложного эфира в соответствующую кислоту дает соединение (XIV). В соответствии с другим вариантом сложный эфир может быть сначала превращен в кислоту, после чего осуществляют гидрирование также с получением соединения(XIV). На фиг. 6 показан процесс получения кислоты (соединение (XXI, являющейся исходным материалом в процессе, показанном на фиг. 3. На стадии (LL) обработка соединения (XXXI) трифторметансульфоновым ангидридом в присутствии основания, такого как пиридин, дает соединение XXXVI (Rg представляет OTf). Следующая стадия, т.е. стадия (ММ) заключается в обработке соединения (XXXVI)(Rg представляетOTf) катализатором, производным от соли палладия (Pd(OAc)2, PdCl2, Pd(O2CCF3)2 и т.д.) и фосфинового лиганда (РРh3, Р(о-толил)3 и т.д.),с последующей обработкой олефином (метилакрилат, метилпропиолат и т.д.), в результате чего получают соединение (XXXVII) (где М представляет -СС- или -СН=СН-). На стадии (NN) соединение (XXXVII) подвергают гидрированию с палладием на углероде в атмосфере водорода с получением соединения (XXI). Как показано на фиг. 7, соединение (X) может быть превращено в соединение (XL), содержащее уходящую группу (LG), такую как,например, галоген (Сl, Вr или I), мезилат, нозилат, тозилат и трифторметансульфонат. Затем уходящая группа (LG) может быть замещена сложным малоновым эфиром, таким как диметилмалонат, в присутствии основания, такого как, например, метоксид. Уходящая группа (LG) может быть также замещена кислотой Мелдрума (Meldrum) в присутствии основания, такого как метоксид. Превращение сложных эфиров,или циклического ангидрида в случае использования кислоты Мелдрума, в соответствующие кислоты с последующим декарбоксилированием дает соединение (XXXV). На фиг. 8 дополнительно показаны способы синтеза, которые могут быть использованы для получения различных соединений по настоящему изобретению. На стадии 1 обработка соединения 7-1 (Z представляет Вr, I или OTf иR представляет Н, тетрагидропиран-2-ил или 1 пирролидинилметил) катализатором, производным от соли палладия (Pd(OAc)2, PdCl2,Pd(O2CCF3)2 и т.д.) и фосфинового лиганда(РРh3, Р(о-толил)3 и т.д.), с последующей обработкой соединением 7-2 (X представляет Li,ZnCl, MgBr, SnBu3, В(ОН)2 и R' представляет СО 2 Н, СО 2 Ме, CO2Et, CССO2 Ме, CCCO2Et,CH=CHCO2Me, CH=CHCO2Et, CH2CH2CO2Me,CH2CH2CO2Et) дает соединение 7-3 (R представляет Н, тетрагидропиран-2-ил или 1 пирролидинилметил и R' представляет СО 2 Н,СО 2 Ме,CO2Et,CCCO2Me,CCCO2Et,CH=CHCO2Me, CH=CHCO2Et, CH2CH2CO2Me,CH2CH2CO2Et). Когда R представляет тетрагидропиран-2-ил или 1-пирролидинилметил, обработка кислотой (TFA, PPTS, HCl и т.д.) дает соединение 7-3, где R представляет Н. На стадии 2 обработка соединения 7-2 (Z представляет Вr, I или OTf и R' представляет СО 2H, СО 2 Ме,CO2Et, CCCO2Me, CCCO2Et, CH=CHCO2Me,CH=CHCO2Et, CH2CH2CO2Me, CH2CH2CO2Et) катализатором, производным от соли палладия(Pd(OAc)2, PdCl2, Pd(O2CCF3)2 и т.д.) и фосфинового лиганда (PPh3, Р(о-толил)3 и т.д.), с последующей обработкой соединением 7-1 (X представляет Li, ZnCl, MgBr, SnBu3, B(OH)2 и R представляет тетрагидропиран-2-ил или 1 пирролидинилметил) дает соединение 7-3 (R представляет тетрагидропиран-2-ил или 1 пирролидинилметил и R' представляет СО 2 Н,СО 2 Ме,CO2Et,СССО 2 Ме,CCCO2Et,CH=CHCO2Me, CH=CHCO2Et, CH2CH2CO2Me,CH2CH2CO2Et). Когда R представляет тетрагидропиран-2-ил или 1-пирролидинилметил, обработка кислотой (TFA, PPTS, HCl и т.д.) дает соединение 7-3, где R представляет Н. На стадии 3 проводят НАТU-опосредуемую реакцию связывания диаминоурацильной части с бицикло[2.2.2]октановой кислотой (которая уже была описана выше). На стадии 4 обработка соединения 7-4 (X представляет Сl, Br, I) катализатором, производным от соли палладия (Pd(OAc)2,PdCl2, Pd(O2CCF3)2 и т.д.) и фосфинового лиганда (PPh3, Р(о-толил)3 и т.д.), с последующей обработкой олефином (метилакрилат, метилпропиолат, аллиловый спирт и т.д.) дает соединение 7-5 (R' представляет CССO2 Ме, CCCO2Et,СН=СНСО 2 Ме, CH=CHCO2Et, CH2CH2CHO и т.д.). На стадии 5 проводят промотируемую основанием циклизацию урацила 7-5 до ксантина типа 7-3 (которая уже была описана выше). Аналогичным образом, уже была описана выше проведенная на стадии 6 промотируемая основанием циклизация урацила 7-4 до ксантина типа 7-6. На стадии 7 обработка соединения 7-6(X представляет Cl, Br, I, OTf) катализатором,производным от соли палладия (Pd(OAc)2,PdCl2, Pd(O2CCF3)2 и т.д.) и фосфинового лиганда (PPh3, P(o-толил)3 и т.д.), с последующей обработкой олефином (метилакрилат, метилпропиолат, аллиловый спирт и т.д.) дает соединение 7-3 (R представляет Н, R' представляет СССО 2 Ме,CCCO2Et,CH=CHCO2Me,CH=CHCO2Et, CH2CH2CHO и т.д.). На стадии 8 проводят окисление концевой альдегидной группы в соединении 7-3 (R представляет Н, R' представляет СН 2 СН 2 СНО) стандартными сред 005211NaIO4 и т.д.). Определения Все температуры показаны в градусах Цельсия (С).HPLC (ВЭЖХ) означает высокоэффективную жидкостную хроматографию. НМРА означает гексилметилфосфорамид.TMU означает 1,1,3,3-тетраметилмочевину. Солевой раствор означает насыщенный водный раствор хлорида натрия. Хроматография (колоночная и флэшхроматография) означает очистку/разделение соединений, выражаемые определенными терминами (носитель, элюент). Понятно, что подходящие фракции собирают и концентрируют с получением требуемого соединения(ий).FTIR означает инфракрасную спектроскопию с Фурье-преобразованием.ATR означает ослабленную полную отражательную способность.NMR (ЯМР) означает спектроскопию ядерного (протонного) магнитного резонанса,химические сдвиги даются в ч./млн d) от поля,получаемого от тетраметилсилана.pci означает давление в фунтах на квадратный дюйм.[a]D25 означает угол вращения плоскополяризованного света (удельное оптическое вращение) при 25 с D-линией натрия (589 А).MS (MC) означает масс-спектрометрию,выраженную как m/е, m/z или отношение масса/заряд. [М+Н]+ означает положительный ион источника плюс атом водорода. EI означает электронный удар. CI означает химическую ионизацию. FAB означает бомбардировку быстрыми атомами. Выражение фармацевтически приемлемый относится к тем свойствам и/или веществам, которые приемлемы для пациента с фармакологической/токсикологической точки зрения и для фармацевтического химического производства с физико-химической точки зрения в отношении композиции, препаративной формы,стабильности, приемлемости для пациента и биодоступности. Фармацевтически приемлемые анионные соли включают соли следующих кислот: метансульфоновой, хлористо-водородной, бромистоводородной, серной, фосфорной, азотной, бензойной, лимонной, винной, фумаровой, малеиновой, СН 3-(СН 2)n-СООН, где n равно 0-4,НООС-(СН 2)n-СООН, где n - такой, как определенный выше. При использовании пары растворителей отношения используемых растворителей выражена как объем/объем (об./об.). При использовании растворимости твердого вещества в растворителе отношение твердого вещества к растворителю выражено как масса/объем (мас./об.).Ra представляет Н, C1-5 алкил, бензил, где фенильное кольцо является необязательно замещенным от одного до трех атомами галогена,гидроксилами или C1-3 алкокси.Rb представляет Н, C1-5 алкил, бензил, где фенильное кольцо является необязательно замещенным от одного до трех атомами галогена,гидроксилами или C1-3 алкокси. Когда Ra и Rb оба находятся в одной и той же молекуле, они могут быть одинаковыми или разными.Rc представляет Н, C1-5 алкил, бензил, где фенильное кольцо является необязательно замещенным от одного до трех атомами галогена,гидроксилами или C1-3 алкокси. Когда Ra и Rc оба находятся в одной и той же молекуле, они могут быть одинаковыми или разными.Rd представляет Н, C1-5 алкил, бензил, где фенильное кольцо является необязательно за 005211 22 мещенным от одного до трех атомами галогена,гидроксилами или C1-3 алкокси. Когда Rc и Rd находятся в одной и той же молекуле, такой как соединение (XX), они должны быть разными. Когда Ra и Rd оба находятся в одной и той же молекуле, они должны быть разными.Re представляет -Н, C1-5 алкил, бензил, где фенильное кольцо является необязательно замещенным от одного до трех атомами галогена,гидроксилами или C1-3 алкокси. Когда R1 и R5 оба находятся в одной и той же молекуле, они должны быть разными.Rg представляет галоген или трифлат. М представляет -СН 2-СН 2- или -СН=СН-.LG означает уходящую группу и представляет собой -O-SO2-фенил-NO2, -O-SO2-CH3,-О-SО 2-фенил-СН 3 или -O-SO2-CF3. Применение антагонистов аденозина Активация аденозиновых рецепторов вызывает много физиологических ответных реакций, включающих снижение почечного кровотока, снижение уровня клубочковой фильтрации и повышение реабсорбции натрия в почке. Активация аденозиновых рецепторов снижает частоту сердечных сокращений, скорость проводимости и сократимость. Указанные и другие эффекты активации аденозиновых рецепторов в других органах обычно являются регуляторными процессами. Однако указанные эффекты становятся патологическими при многих болезненных состояниях. Поэтому антагонисты аденозина имеют широкое применение как для профилактики, так и для лечения заболеваний. Заболевания, которые могут быть предупреждены и/или вылечены с помощью антагонистов аденозиновых рецепторов, включают любые состояния, (а) отмечаемые наличием анормального уровня аденозина и/или (b) требующие для лечения ингибирования или стимуляции продукции и/или высвобождения аденозина. Такие состояния включают, но не ограничиваются ими, застойную сердечную недостаточность,восстановление сердечной деятельности и дыхания, геморрагический шок и другие расстройства сердечной деятельности и кровообращения; дегенеративные расстройства центральной нервной системы; респираторные заболевания(например, бронхиальную астму, аллергические легочные заболевания) и многие заболевания,для которых показано лечение мочегонными средствами (например, острую и хроническую почечную недостаточность, почечную недостаточность, гипертензию). Дегенеративные заболевания, такие как болезнь Паркинсона, депрессия, травматическое повреждение головного мозга, послешоковый неврологический дефицит, травма головного 23 мозга новорожднного, дислексия, гиперактивность и кистозный фиброз связаны с активностью аденозиновых рецепторов. Другие состояния, в которых лечение антагонистами аденозиновых рецепторов может иметь терапевтическую пользу, включают цирротический асцит,апноэ новорожднного, почечную недостаточность, связанную с традиционным лечением мочегонными средствами, диабет и астму. Кроме того, обнаружено, что введение высокоселективных и мощных антагонистов, например, аденозиновых A1-рецепторов может вызывать диуретическую ответную реакцию при введении в отдельности и может усиливать диуретическую ответную реакцию на традиционные диуретики. К тому же введение антагонистов аденозиновых рецепторов с традиционными диуретиками уменьшает снижение уровня клубочковой фильтрации, вызываемое традиционными мочегонными средствами. Заявленные способы применимы, например, при отчных состояниях, таких как застойная сердечная недостаточность и асцит. Введение соединений-антагонистов аденозина Соединения могут быть введены животному (например, млекопитающему, такому как человек, нечеловекообразный примат, лошадь,собака, корова, свинья, овца, коза, кошка, мышь,крыса, морская свинка, кролик, хомяк, песчанка,хорк, ящерица, рептилия или птица). Соединения могут быть введены любым из подходящих для введения фармацевтических соединений способов, включающих, но не ограничиваемых ими, пилюли, таблетки, капсулы, аэрозоли, суппозитории, жидкие составы для приема внутрь или инъекции или для применения в виде глазных или ушных капель, пищевые добавки и препараты для местного применения. Соединения могут быть введены перорально, интраназально, трансдермально, интрадермально, вагинально, интраокулярно, трансбуккально, ректально, трансмукозально или путем ингаляции,имплантации (т.е. хирургически) или внутривенного введения. Соединения, необязательно, могут быть введены в сочетании с фармацевтической композицией, немодифицирующей аденозин (например, в сочетании с немодифицирующим аденозин диуретиком, как описано, например, в одновременно рассматриваемой заявке PCT/US 99/08879, поданной 23 апреля 1999 г., включена полностью в данное описание в качестве ссылки). Далее настоящее изобретение описано в следующих ниже примерах, которые не ограничивают объем изобретения, описанного в прилагаемой формуле изобретения. Примеры Пример 1. 8-(3-Оксо-2-оксабицикло[2.2.2] окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион. 24 1,3-Дипропил-7-(тетрагидропиран-2-ил)3,7-дигидропурин-2,6-дион (3,0 г, 9,37 ммоль) растворяли в 100 мл безводного ТГФ и охлаждали до -78 С. Добавляли nBuLi (2,5 М в гексанах, 4,70 мл), а затем этиловый эфир 4 оксоциклогексанкарбоновой кислоты (9,37 ммоль, 1,5 мл) и полученную реакционную смесь медленно нагревали до комнатной температуры и перемешивали при комнатной температуре в течение ночи. На следующий день реакцию останавливали насыщенным водным раствором NH4Cl. Реакционную смесь разбавляли водой и экстрагировали EtOAc. Органический слой сушили и концентрировали при пониженном давлении. Очистка хроматографией (2:1 гексаны/EtAOc) дала 1,30 г требуемого производного спирта. Полученный продукт (290 мг, 0,592 ммоль) растворяли в 3 мл ТГФ и добавляли водный раствор LiOH (2 М, 0,60 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Затем ее останавливали 10% водным раствором лимонной кислоты и экстрагировали EtOAc. Органический слой сушили(Na2SO4) и концентрировали. Полученную кислоту растворяли в уксусном ангидриде (3 мл) и кипятили с обратным холодильником в течение 1 ч. Затем ее охлаждали до комнатной температуры и концентрировали. Полученный остаток растворяли вEtOAc и промывали насыщенным водным раствором NаНСО 3, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали. Очистка хроматографией (2:1 EtAOc/гексаны) дала указанное в заголовке соединение. МС (ES+) 361. Пример 2. 8-(2-Оксабицикло[2.2.2]окт-1 ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. Этиловый эфир 4-[2,6-диоксо-1,3-дипропил-7-(тетрагидропиран-2-ил)-2,3,6,7-тетрагидро-1 Н-пурин-8-ил]-4-гидроксициклогексанкарбоновой кислоты (пример 1) (270 мг, 0,551 ммоль) растворяли в 4 мл безводного ТГФ и добавляли LiBH4 (2,0 М раствор в ТГФ, 0,55 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. На следующий день реакцию останавливали 10% водным раствором лимонной кислоты и экстрагировалиEtOAc. Органический слой концентрировали при пониженном давлении и полученный неочищенный продукт очищали хроматографией(1:1 гексаны/EtAOc). Чистый диол (90 мг, 0,21 ммоль) растворяли в СН 2 Сl2 (5 мл) и добавляли Et3N (1,2 экв.). Затем добавляли MsCl (1,1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем останавливали насыщенным водным раствором NH4Cl и экстрагировали СН 2 Сl2. Органический слой сушили(Na2SO4) и концентрировали. Полученный остаток растворяли в ТГФ (2 мл) и 1 н. НСl (1 мл). Реакционную смесь пере 25 мешивали при комнатной температуре в течение 12 ч, разбавляли Н 2O и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении. Очистка ВЭЖХ с использованием водного раствораCH3CN дала указанное в заголовке соединение. МС (ES+) 347. Пример 3. 1-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт-4-илметиловый эфир уксусной кислоты. Этиловый эфир 4-оксоциклогексанкарбоновой кислоты превращали в соответствующее кетальное производное в соответствии с установленной методикой (Green, ProtectiveGroups in Organic Synthesis, Third Edition). Указанное кетальное производное (1,0 г, 4,67 ммоль) растворяли в безводном ТГФ (15 мл). В отдельной колбе растворяли 2,2,6,6-тетраметилпиперидин (1,2 мл, 1,5 экв.) в ТГФ (30 мл) и полученный раствор охлаждали до -78 С, после чего добавляли nBuLi (2,80 мл, 2,5 М раствор в гексанах, 1,5 экв.). Через 15 мин добавляли раствор кеталя и реакционную смесь перемешивали при -78 С в течение 1 ч. Добавляли метилхлорформиат (0,72 мл, 2 экв.) и реакционную смесь нагревали до комнатной температуры. Реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении. Очистка хроматографией (2:1 гексаны/EtAOc) дала промежуточный диэфир. Полученный диэфир (8,0 г, 29,4 ммоль) растворяли в сухом Et2O (500 мл) и охлаждали до 0 С. Добавляли LiАlН 4 (2,2 г, 2 экв.) небольшими порциями в течение 15 мин. Реакционную смесь перемешивали при 0 С в течение 15 мин и затем нагревали до комнатной температуры и перемешивали 1 ч. Затем ее охлаждали до 0 С и осторожно гасили 5% водным раствором NaOH(3,3 г, 2,2 экв.). Реакционную смесь перемешивали при комнатной температуре 18 ч. Затем ее разбавляли EtOAc и промывали 10% водным раствором лимонной кислоты. Органический слой сушили (Na2SO4) и концентрировали с получением производного дитозилата. Полученный материал растворяли в ТГФ(60 мл) и 1 н. НСl (30 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc. Органический слой сушили(Na2SO4) и концентрировали при пониженном давлении. Очистка хроматографией (1:1 гексаны/EtAOc) дала 2,0 г дитозилатного производного 4,4-бисгидроксиметилциклогексанона. 26 1,3-Дипропил-7-(тетрагидропиран-2-ил)3,7-дигидропурин-2,6-дион (5,30 г, 16,5 ммоль) растворяли в безводном ТГФ (250 мл) и охлаждали до -78 С. Добавляли nBuLi (2,5 М в гексанах, 6,60 мл, 1 экв.), а затем дитозилатное производное 4,4-бисгидроксиметилциклогексанона(7,7 г, 1 экв.) и полученную реакционную смесь медленно нагревали до комнатной температуры и перемешивали при комнатной температуре в течение ночи. На следующий день реакцию останавливали насыщенным водным растворомNH4Cl. Реакционную смесь разбавляли водой и экстрагировали EtOAc. Органический слой сушили и концентрировали при пониженном давлении. Очистка хроматографией(9,0 г) растворяли в сухом ТГФ (200 мл) и к полученному раствору добавляли порошкообразный NaOH (9,0 г). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 24 ч. Затем ее охлаждали до комнатной температуры и разбавляли Н 2 О и экстрагировали EtOAc. Органический слой сушили(Na2SO4) и концентрировали при пониженном давлении. Очистка хроматографией (2:1 гексаны/EtAOc) дала 5,6 г монотозилатного производного. Полученное монотозилатное производное(40 г, 6,5 ммоль) растворяли в ДМСО (70 мл). Добавляли NaOAc (9 г) и реакционную смесь перемешивали при 70-80 С в течение 2 дней. Реакционную смесь охлаждали до комнатной температуры и разбавляли Н 2 О и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали. Очистка хроматографией(2:1 гексаны/EtAOc) дала 800 мг указанного в заголовке соединения. МС (ES+) 419. Пример 4. 8-(4-Гидроксиметил-2-оксабицикло[2.2.2]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 1-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт 4-илметиловый эфир уксусной кислоты, получали так, как описано в примере 3. Полученный ацетат (120 мг, 0,287 ммоль) растворяли в МеОН (5 мл). Добавляли К 2 СО 3 (200 мг, 5 экв.) в виде раствора в 5 мл Н 2O. Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли Н 2O и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении. Полученный остаток очищали препаративной ВЭЖХ с использованием водного раствора CH3CN, получая указанное в заголовке соединение. МС (ES+) 377. Пример 5. 1-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]октан-4-карбоновая кислота. 27 1-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт 4-илметиловый эфир уксусной кислоты, получали так, как описано в примере 3. Полученный ацетат (400 мг) растворяли в 3 мл СН 2 Сl2 и 3 мл дигидропирана. Добавляли PPTS (10 мг) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь разбавляли СН 2 Сl2 и промывали NаНСО 3, 10% водным раствором лимонной кислоты и насыщенным солевым раствором. Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении. Полученный остаток растворяли в 10 мл МеОН и добавляли К 2 СО 3 (450 мг) в виде раствора в 10 мл Н 2 О. Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Затем ее разбавляли Н 2O и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали с получением 8-(4-гидроксиметил-2-оксабицикло[2.2.2]окт 1-ил)-1,3-дипропил-7-(тетрагидропиран-2-ил)3,7-дигидропурин-2,6-диона. Полученный продукт (320 мг, 0,7 ммоль) растворяли в 8 мл ДМФ. Добавляли PDC (1,0 г,4 экв.) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь разбавляли 3 мл 10% водного раствора лимонной кислоты и 20 мл Н 2 О и быстро экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток растворяли в 10 мл Н 2 О и 20 мл СН 3 СN вместе с 1 мл TFA. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали. Полученный остаток очищали препаративной ВЭЖХ с использованием водного раствора CH3CN, получая указанное в заголовке соединение. МС (ES+) 391. Пример 6. 3-[1-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт-4-ил]акриловая кислота. 8-(4-Гидроксиметил-2-оксабицикло[2.2.2] окт-1-ил)-1,3-дипропил-7-(тетрагидропиран-2 ил)-3,7-дигидропурин-2,6-дион синтезировали по методике примера 4. Полученное производное спирта (140 мг, 0,3 ммоль) растворяли в 5 мл СН 2 Сl2 вместе с реактивом Десса-Мартина(Dess-Martin) (Lancaster, 155 мг, 1,2 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли водным раствором (1 М) сульфита натрия и экстрагировали CH2Cl2. Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении с получением промежуточного альдегида. Полученный продукт сразу же растворяли в 4 мл безводного ТГФ. В отдельной колбе растворяли триметилфосфоноацетат (60 мкл, 1,2 экв.) в 3 мл безводного ТГФ, охлаждали до 0 С и добавляли KHDMS (0,5 М в PhMe, 730 мкл). Полученную смесь перемешивали при 0 С в 28 течение 10 мин и затем добавляли к раствору альдегида. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем гасили насыщенным водным растворомNH4Cl и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали. Полученный остаток растворяли в 4 мл ТГФ и 4 мл Н 2O, содержащей LiOH (4 экв.), и перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь разбавляли водным раствором лимонной кислоты и экстрагировали EtOAc. Органический слой сушили(Na2SO4) и концентрировали. Очистка препаративной ВЭЖХ с использованием водного раствора CH3CN дала указанное в заголовке соединение. МС (ES+) 417. Пример 7. 3-[1-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт-4-ил]пропионовая кислота. 3-[1-(2,6-Диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт-4-ил]акриловую кислоту растворяли в 50 мл МеОН. Добавляли 10% Pd на С (10 мг) и реакционную смесь гидрировали при комнатной температуре при давлении Н 2 55 фунт/кв.дюйм(3,9 кг/см 2) в течение 30 мин. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения. МС (ES+) 419. Пример 8. 5-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]октан-1-карбоновая кислота. К раствору монометилового эфира бицикло[3.2.1]октан-1,5-дикарбоновой кислоты (Delia(17,82 ммоль, 3,1 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем ее концентрировали при отсасывании для удаления ДМФ. Остаток растворяли вEtOAc и промывали 1 н. НСl, 5% NаНСО 3 и насыщенным солевым раствором и сушили(M+Na, 100%), 421,4 (М+Н, 10%). Раствор монометилового эфира 5-(6 амино-2,4-диоксо-1,3-дипропил-1,2,3,4-тетрагидропиримидин-5-илкарбамоил)бицикло[3.2.1] октан-1-карбоновой кислоты (0,238 ммоль, 0,10 г) в 20% NaOH (2,0 мл) и МеОН (10,0 мл) перемешивали и кипятили с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали для удаления МеОН. Водный раствор 29 подкисляли (рН 2-3) концентрированной НСl и затем экстрагировали EtOAc. Объединенные этилацетатные экстракты промывали Н 2 О и насыщенным солевым раствором и сушили(MgSO4). Фильтрование и выпаривание с последующей обращннофазовой ВЭЖХ дали продукт (0,039 г, 42%) в виде твердого вещества.(25 мл). По окончании добавления выдерживалиLDA при -78 С в течение 45 мин. К полученному раствору медленно добавляли при -78 С раствор 1,3-дипропил-7-(тетрагидропиран-2-ил)3,7-дигидропурин-2,6-диона (пример 52) (2,78 ммоль, 0,89 г) в ТГФ (35 мл). После перемешивания в течение еще 1 ч при -78 С добавляли раствор 8-оксабицикло[3.2.1]окт-6-ен-3-она(Mann. J. et al., J. Chem. Soc. Parkin Trans I 1992,787) (2,78 ммоль, 0,345 г) в ТГФ (5 мл). Реакционную смесь перемешивали в течение ночи при нагревании до комнатной температуры. Затем реакцию останавливали добавлением насыщенного NH4Cl и смесь экстрагировали EtOAc. Объединенные органические экстракты промывали насыщенным NH4Cl, Н 2 О и насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание и затем колоночная флэш-хроматография с элюированием градиентом смеси EtOAc/CH2Cl2 дали продукт связывания (0,55 г, 45%). МС (ESP+, 60V): 445,07(полученного так, как описано выше) (0,225 ммоль, 0,10 г) в изоРrОН (2 мл) и Н 2 О (1 мл) добавляли ММРР (80%, 0,45 ммоль, 0,223 г) одной порцией. Через 5 дней выдерживания при комнатной температуре реакционную смесь гасили добавлением насыщенного водного раствора Nа 2S2 О 3 и концентрировали для удаления изоРrОН. Водный остаток распределяли междуEtOAc и насыщенным NаНСО 3. Органические экстракты промывали H2 О и насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание дали продукт (0,093 г, 90%) в виде пенообразного вещества. 13 С ЯМР (75 МГц, CDCl3): 11,50, 11,63,21,55, 21,61, 21,72, 23,00, 25,01, 32,17, 37,96,40,42, 43,52, 45,19, 54,46, 54,62, 70,46, 70,79,71,51, 71,64, 86,09, 107,18, 147,34, 151,21,155,19, 157,82. К раствору 8-(4-гидрокси-2,6-диоксатрицикло[3.3.1.03,7]нон-1-ил)-1,3-дипропил-7(тетрагидропиран-2-ил)-3,7-дигидропурин-2,6 диона (0,065 ммоль, 0,030 г) в смеси (1:1) ТГФ/МеОН (6 мл) добавляли 1 н. НСl (3 капли). 30 Реакционную смесь перемешивали при комнатной температуре в течение 4 ч и затем концентрировали досуха. Остаток очищали обращннофазовой ВЭЖХ с получением продукта(м, 6 Н), 1,48-1,56 (м, 2 Н), 1,60-1,70 (м, 2 Н), 1,92,09 (м, 2 Н), 2,2-2,25 (м, 1 Н), 3,78-3,82 (м, 2 Н),3,89-3,91 (м, 2 Н), 3,99 (с, 1 Н), 4,21 (ш.с, 1 Н),4,51 (ш.с, 1 Н), 4,80 (м, 1 Н). Пример 10. 8-(5-Гидроксиметилбицикло[3.2.1]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. К раствору метилового эфира 5-(6-амино 2,4-диоксо-1,3-дипропил-1,2,3,4-тетрагидропиримидин-5-илкарбамоил)бицикло[3.2.1] октан-1-карбоновой кислоты (полученного так,как описано в примере 8) (0,714 ммоль, 0,30 г) добавляли LiBH4 (2M в ТГФ, 0,54 мл). После перемешивания в течение ночи при комнатной температуре с последующим кипячением с обратным холодильником в течение 90 мин, реакционную смесь останавливали при комнатной температуре добавлением 1 н. НСl, разбавляли Н 2 О и экстрагировали EtOAc. Объединенные органические экстракты промывали насыщенным NаНСО 3, водой и насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание дали продукт (0,20 г, 71%) в виде масла. МС (ES+) 415,15 (M+Na, 100%), 393,5NaOH (2 мл) и МеОН (10,0 мл) перемешивали и кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали для удаления МеОН. Водный раствор подкисляли (рН 2-3) концентрированной НСl и затем экстрагировали EtOAc. Объединенные EtOAc экстракты промывали насыщенным NаНСО 3, Н 2 О и насыщенным солевым раствором и сушили 31 ммоль, 0,0027 г) одной порцией. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем добавляли третбутилбромацетат (0,068 ммоль, 10 мкл). Через 3 дня реакционную смесь гасили насыщенным водным раствором NH4Cl и экстрагировалиEtOAc (3 раза). Объединенные органические слои промывали насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание дали продукт (0,059 г) с примесью третбутилбромацетата. МС (ES+) 575,15 (М+Н). Раствор трет-бутилового эфира 1-[2,6 диоксо-1,3-дипропил-7-(тетрагидропиран-2-ил)2,3,6,7-тетрагидро-1 Н-пурин-8-ил]-2,6-диоксатрицикло[3.3.1.03,7]нон-4-илоксиуксусной кислоты (0,10 ммоль, 0,059 г) в СН 2 Сl2 (1 мл) обрабатывали TFA (1 мл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали досуха и остаток очищали обращннофазовой ВЭЖХ с получением продукта (0,0036, 8%). МС (ES+) 435,13(1,29 ммоль, 0,126 г) в ДМФ (12 мл) добавляли изoPr2NEt (3,86 ммоль, 0,67 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем ее концентрировали при отсасывании для удаления ДМФ. Остаток растворяли в EtOAc, промывали 1 н. НСl, насыщенным NaHCO3 и насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание дали продукт (0,791 г) с примесью ДМФ. МС (ES+) 432,13 (М+Н). К раствору метоксиметиламида 5-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[3.2.1]октан-1-карбоновой кислоты (0,232 ммоль, 0,100 г) в ТГФ (3 мл) при-78 С добавляли раствор LiАlН 4 (1M в ТГФ, 0,52 мл). По окончании добавления реакционную смесь перемешивали при -78 С 30 мин и при 0 С 30 мин. Реакционную смесь осторожно гасили последовательным добавлением Н 2 О (20 мкл), 20% NaOH (20 мкл) и Н 2 О (40 мкл). Суспензию интенсивно перемешивали в течение ночи, затем фильтровали через целит, обильно промывая колбу и осадок ТГФ. Выпаривание и затем флэш-хроматография с элюированием смесью 5% ТГФ/СН 2 Сl2 дали продукт (0,048 г,56%) в виде масла. МС (ES+): 373,17 (М+Н). К раствору триметилфосфоноацетата(0,310 ммоль, 0,056 г) в ТГФ (4 мл) при 0 С добавляли раствор KHMDS (0,5 М в PhMe, 0,6 мл). После перемешивания в течение 45 мин, медленно добавляли раствор 5-(2,6-диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)(0,129 ммоль, 0,048 г) в ТГФ (2 мл). После перемешивания при комнатной температуре в течение ночи реакционную смесь гасили насыщенным водным раствором NH4Cl и экстрагировалиEtOAc. Объединенные органические слои промывали насыщенным NaHCO3, насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание дали продукт (0,119 г) с примесью избыточного триметилфосфоноацетата. МС (ES+) 429,16 (М+Н). Раствор метилового эфира 3-[5-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[3.2.1]окт-1-ил]акриловой кислоты (0,129 ммоль, 0,055 г) в ТГФ (4 мл) обрабатывали при комнатной температуре 1 н.LiOH (1,1 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли Н 2 О, подкисляли концентрированной НСl (рН 2-3) и экстрагировалиEtOAc. Объединенные органические слои промывали насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание с последующей обращеннофазовой ВЭЖХ дали продукт (0,010 г, 19%). МС (ES+) 397,24 (М+НОН, 100%); МС (ES-) 413,01 (М-Н, 100%). Пример 13. 4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бициклоNEt3 и 30 мл безводного ацетонитрила добавляли 3,76 г (9,89 ммоль) HATU. Реакционный раствор перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали в вакууме и объединяли с 40 мл EtOAc и 40 мл 10% лимонной кислоты. Водный слой отделяли и промывали дважды 40-мл порциямиEtOAc. Объединенные органические фракции промывали 20-мл порциями насыщенногоNаНСО 3 и насыщенным солевым раствором и концентрировали в вакууме. Полученное твердое вещество объединяли в 200-мл круглодонной колбе, снабженной холодильником, со смесью 35 мл изоРrОН и 35 мл 1 н. КОН (35 ммоль) и нагревали с обратным холодильником. После нагревания в течение 1 ч, реакционный раствор концентрировали в вакууме, растворяли в 40 мл воды и промывали дважды 30-мл порциями СН 2 Сl2. Водный слой подкисляли концентрированной НСl и полученный осадок собирали фильтрованием с отсасыванием с получением 3,00 г (выход 87%) не совсем белого твердого вещества. (МН+=389,25). Аналогичным образом получали следующие соединения.[2.2.2]окт-1-ил]карбаминовой кислоты метиловый эфир, (МН+=418,15). Пример 13 е. 8-(4-Бромбицикло[2.2.2]окт-1 ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион,(MNa+=425,22). Пример 13f. 8-(1-Азабицикло[2.2.2]окт-4 ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион,(МН+=346,31). Осуществляли N-3 алкилирование предшественников монопропилурацилов по методикам,описанным в литературе (Muller, С.Е.; Geis, U.;Hipp, J.; Schobert, U.; Frobenius, W.; Pawlowski,M.; Suzuki, F.; Sandoval-Ramirez, J.J. Med. Chem. 1997, 40, 4396-4405.) используя ВОС защищенный 5,6-диамино-1-пропилурацил с последующим удалением ВОС 4 н. НСl в диоксане. Затем для получения производных ксантина использовали описанную выше методику связыванияциклизации. Пример 13g. 3-(2-Метоксиэтил)-8-(4 пентилбицикло[2.2.2]окт-1-ил)-1-пропил-3,7 дигидропурин-2,6-дион. (МН+=431,64). Пример 13h. 4-[3-(2-Метоксиэтил)-2,6 диоксо-1-пропил-2,3,6,7-тетрагидро-1 Н-пурин 8-ил]бицикло[2.2.2]октан-1-карбоновая кислотаChem. 1989, 32, 1873-1879). Пример 14. Метиловый эфир 4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]октан-1-карбоновой кислоты. 4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]октан-1 карбоновую кислоту (пример 13) (1,50 г, 3,86 ммоль) смешивали с 60 мл МеОН и 10 каплями концентрированной H2SO4. Реакционный раствор кипятили с обратным холодильником, пока не израсходовался исходный материал. Затем добавляли насыщенный NаНСО 3 до получения нейтрального рН и реакционную смесь концентрировали в вакууме. Остаток растворяли вEtOAc и промывали насыщенным NaHCO3, насыщенным солевым раствором и сушили надNa2SO4. Этилацетатный раствор концентрировали в вакууме с получением 1,51 г (выход 97%) белого твердого вещества. (МН+=403,13). Пример 15. 8-(4-Гидроксиметилбицикло(1,40 г, 3,48 ммоль) смешивали с LiBH4 (0,379 г,17,4 ммоль), МеОН (0,141 мл, 3,48 ммоль) и 100 мл ТГФ и полученную смесь кипятили с обратным холодильником в течение 18 ч. После охлаждения до комнатной температуры добавляли 50 мл 1 М НСl и смесь концентрировали в вакууме. Остаток растворяли в EtOAc и промывали 1 М НСl, насыщенным NaHCO3, насыщенным солевым раствором и сушили над Na2SO4. Этилацетатный раствор концентрировали в вакууме с получением 1,15 г (выход 88%) белого твердого вещества. (МН+=375,50). Пример 16. 4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-бицикло 35 периодинана Десса-Мартина (Dess-Martin). Реакционную смесь перемешивали при комнатной температуре до завершения окисления. Реакционный раствор фильтровали через слой основного оксида алюминия, промывали насыщенным NаНСО 3, насыщенным солевым раствором и сушили над Na2SO4. Дихлорметановый раствор концентрировали в вакууме с получением 0,057 г (выход 62%) не совсем белого твердого вещества. (МН+=373,30). Пример 17. 3-[4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-теарагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]акриловая кислота. Триметилфосфоноацетат (0,161 г, 0,886 ммоль) растворяли в 12 мл толуола и охлаждали до 0-5 С. В течение 5 мин добавляли по каплям при перемешивании KHMDS (0,5 М в толуоле)(3,54 мл). Еще через 30 мин выдержки при 0-5 С добавляли 0,300 г (0,805 ммоль) 4-(2,6-диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[2.2.2]октан-1-карбальдегида из примера 16 и реакционной смеси давали нагреться до комнатной температуры и перемешивали ее 16 ч. Реакционную смесь концентрировали в вакууме. Неочищеный материал растворяли в 25 мл МеОН и 10 мл воды, добавляли 0,150 г LiOH и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме и вновь растворяли в 15 мл воды. Водный слой трижды экстрагировали 20-мл порциями EtOAc, подкисляли концентрированной НСl и собирали осадок путем вакуумфильтрования с получением 0,190 г (выход 57%) (транс)-акриловой кислоты. (МН+=415,08). Пример 18. 3-[4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил]пропионовая кислота. 3-[4-(2,6-Диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1 ил]акриловую кислоту (пример 17) растворяли в 5 мл МеОН и смешивали с 0,005 г 10% Pd/C. Реакционный сосуд продували три раза N2 и затем соединяли с баллоном с газообразным Н 2. Через 2 ч реакционную смесь фильтровали и концентрировали с получением 0,037 г (выход 74%) белого твердого вещества. (МН+=417,30). Аналогичным образом получали следующее соединение. Пример 18 а. 3-[4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бициклоNEt3 и 2 мл безводного ацетонитрила добавляли 36 0,103 г (0,270 ммоль) HATU. Реакционный раствор перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали в вакууме и смешивали с 10 мл EtOAc и 10 мл 10% лимонной кислоты. Водный слой отделяли и промывали дважды 10-мл порциямиEtOAc. Объединенные органические фракции промывали 10-мл порциями насыщенногоNаНСО 3 и насыщенного солевого раствора и концентрировали в вакууме. Полученное твердое вещество растворяли в смеси 5 мл МеОН и 5 мл 1 н. NaOH и перемешивали 16 ч. Реакционный раствор концентрировали в вакууме, растворяли в 10 мл воды и промывали два раза 10 мл порциями СН 3 Сl2. Водный слой подкисляли концентрированной НСl и полученный осадок собирали вакуум-фильтрованием с получением 0,094 г (выход 77%) не совсем белого твердого вещества. (МН+=460,18). Аналогичным образом были получены следующие соединения. Пример 19 а. 4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло(пример 13d) (8,3 г, 20 ммоль) кипятили с об 37 ратным холодильником в 40 мл концентрированной НСl в течение 3 ч. Реакционную смесь концентрировали в вакууме до твердого остатка,который растирали в ацетонитриле с получением 5,8 г (77%) белого твердого вещества(R)-метиллактата и 0,075 мл изоамилнитрита. Смесь нагревали до 60 С в течение 2 ч и охлаждали до комнатной температуры. Реакционную смесь концентрировали в вакууме и остаток перемешивали с 8 мл 50% МеОН раствора и 0,050 г LiOH в течение ночи. Реакционную смесь концентрировали в вакууме, растворяли в 8 мл воды, доводили рН раствора до 10 и смесь экстрагировали два раза 6-мл порциями CH2Cl2. Водный слой подкисляли концентрированной НСl и полученный осадок собирали вакуумфильтрованием с получением 0,024 г (выход 20%) требуемого продукта. (МН+=433,08). Аналогичным образом были получены следующие соединения. Пример 21 а. 2-(S)-[4-(2,6-Диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[2.2.2]окт-1-илокси]пропионовая кислота, (МН+=433,10). Пример 21b. 8-(4-ИзопропоксибициклоCH2Cl2 (2 мл) добавляли 27 мкл пиридина и реакционную смесь охлаждали до 0 С. Добавляли к ней 40 мкл трифликангидрида (0,24 ммоль) вCH2Cl2 (1 мл). Реакционную смесь выдерживали при 10 С в течение ночи. Затем ее разбавляли СН 2 Сl2 (5 мл) и промывали холодной 1 н. НСl,насыщенным NaHCO3 и насыщенным солевым раствором. Сушили над сульфатом натрия и концентрировали в вакууме с получением желтого масла. Неочищенный трифлат растворяли в 1,4 диоксане (3 мл) и добавляли 100 мг фенола (1,08 ммоль) с последующим нагреванием при 80 С в течение ночи. Реакционную смесь выпаривали и остаток растворяли в этилацетате (10 мл), промывали 1 н. КОН (5 мл), насыщенным NaHCO3(5 мл), 1 н. НСl (5 мл) и насыщенным солевым раствором. Органический слой сушили надNa2SO4 и концентрировали в вакууме до бесцветного масла, которое очищали колоночной хроматографией (SiO2, 1:1 гексаны/EtOAc) с получением 11 мг указанного в заголовке соединения в виде белого твердого вещества 39 омыления сложного метилового эфира были получены следующие соединения. Пример 22 а. [4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона (пример 13 а) (0,14 ммоль) в СН 2 Сl2 (5 мл) добавляли 20 мкл Et3N и реакционную смесь охлаждали на бане со льдом. Добавляли к ней 20 мкл метансульфонилхлорида(0,26 ммоль) и реакционную смесь выдерживали при 10 С в течение ночи. Реакционную смесь концентрировали в вакууме и остаток растворяли в EtOAc и промывали 2 раза разбавленной НСl (5 мл). Органический слой сушили надNa2SO4 и концентрировали. Остаток растирали в ацетонитриле с получением 36 мг (59%) чистого белого твердого вещества (МН+=439,4). Пример 24. 4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ильный эфир толуол-4-сульфоновой кислоты. К раствору 100 мг 8-(4-гидроксибицикло[2.2.2]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона (пример 13 а) (0,28 ммоль) в СН 2 Сl2 (10 мл) добавляли 40 мкл Et3N и реакционную смесь охлаждали на бане со льдом. Добавляли к ней 100 мг п-толуолсульфонилхлорида (0,52 ммоль) и реакционную смесь выдерживали при 10 С в течение ночи. Реакционную смесь концентрировали в вакууме и остаток растворяли в EtOAc и промывали 2 раза разбавленной НСl (10 мл). Органический слой сушили над Na2SO4 и концентрировали. Остаток растирали в ацетонитриле с получением 78 мг (54%) чистого белого твердого вещества[2.2.2]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона (пример 20) (0,28 ммоль) в 2 мл пиридина, охлаждаемого на водяной бане со льдом, добавляли 22 мкл метансульфонилхлорида (0,28 ммоль), при этом через 24 ч при 10 С реакция завершилась на 30%. Для полного завершения реакции добавляли еще две аликвоты(22 мкл и 50 мкл) метансульфонилхлорида. Реакционную смесь концентрировали в вакууме с получением желтого масла, которое растворяли в EtOAc (10 мл) и промывали дважды насыщенным NaHCO3 (5 мл), один раз 0,5 н. НСl и один раз насыщенным солевым раствором. Органический слой сушили над Na2SO4 и концентрировали до масла. Остаток кристаллизовали из ацетонитрила с получением 27 мг (22%) в виде белого твердого вещества (МН+=438,08). Аналогичным образом были получены следующие соединения. Пример 25 а. 3-[4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-илметил]сульфамоилтиофен-2 карбоновой кислоты метиловый эфир,(МН+=578,3). Пример 25g. 3-[4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-диона (пример 20) (0,28 ммоль) и 37 мг тиофен-2-карбоксальдегида (0,33 ммоль) в СН 2 Сl2 (5 мл) добавляли 5 капель ледяной уксусной кислоты и 100 мг триацетоксиборогидрида натрия (0,47 ммоль). Полное превращение происходило за 24 ч при комнатной температуре. Реакционную смесь останавливали 2 мл этанола и 2 мл 2 н. НСl и затем концентрировали в вакууме с получением бесцветного масла, которое очищали от безводного ацетонитрила с получением 50,8 мг (40%) требуемого соединения в виде белого твердого вещества (МН+=456,29). 41 Аналогичным образом были получены следующие соединения. Пример 26 а. [4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-иламино]метилфуран-2-сульфоновая кислота, (МН+=520,26). Пример 26l. 8-(4-Циклопентиламинобицикло[2.2.2]окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион, (МН+=428,38). Пример 26m. 8-(4-Циклопентиламинометилбицикло[2.2.2]окт-1-ил)-1,3-дипропил-3,7 дигидропурин-2,6-дион, (МН+=442,56). Пример 26n. 8-4-[(1-Метилбутиламино) метил]бицикло[2.2.2]окт-1-ил-1,3-дипропил 3,7-дигидропурин-2,6-дион, (МН+=444,60). Пример 27. 4-[3-(4-Гидроксифенил)-2,6 диоксо-1-пропил-2,3,6,7-тетрагидро-1 Н-пурин 8-ил]бицикло[2.2.2]октан-1-карбоновая кислота. К раствору 10 мг 4-[3-(4-метоксифенил)2,6-диоксо-1-пропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил]бицикло[2.2.2]октан-1-карбоновой кислоты (пример 13l) (0,022 ммоль) в СН 2 Сl2 (2 мл), охлаждаемому на бане со смесью сухой лед/ацетон, добавляли 1 мл 1 М раствора три 005211 42 бромида бора (1 ммоль) в СН 2 Сl2. Реакционной смеси давали нагреться до комнатной температуры и выдерживали в течение 2 ч. По истечении указанного времени реакционную смесь охлаждали на сухом льду и останавливали МеОН. Неочищенный продукт выделяли после концентрирования в вакууме и перекристаллизовывали из ацетонитрила с получением 10 мг белого твердого вещества (МН+=439,09). Аналогичным образом были получены следующие соединения. Пример 27 а. 4-3-[2-(4-Гидроксифенил) этил]-2,6-диоксо-1-пропил-2,3,6,7-тетрагидро 1 Н-пурин-8-илбицикло[2.2.2]октан-1-карбоновая кислота, (МН+=467,4). Пример 27b. 4-[3-(2-Гидроксиэтил)-2,6 диоксо-1-пропил-2,3,6,7-тетрагидро-1 Н-пурин 8-ил]бицикло[2.2.2]октан-1-карбоновая кислота,(МН+=391,12). Пример 27 с. 4-[3-(4-Гидроксифенил)-2,6 диоксо-1-пропил-2,3,6,7-тетрагидро-1 Н-пурин 8-ил]бицикло[2.2.2]октан-1-карбоновая кислота,(МН+=439,09). Пример 27d. 3-(4-3-[2-(4-Гидроксифенил) этил]-2,6-диоксо-1-пропил-2,3,6,7-тетрагидро 1 Н-пурин-8-илбицикло[2.2.2]окт-1-ил)пропионовая кислота, (МН+=495,12). Пример 27 е. 8-(4-Гидроксибицикло[2.2.2]окт-1-ил)-3-[2-(4-гидроксифенил)этил]-1 пропил-3,7-дигидропурин-2,6-дион, (МН+ = 439,14). Пример 28. 4-3-[2-(4-Гидрокси-3-иодофенил)этил]-2,6-диоксо-1-пропил-2,3,6,7-тетрагидро-1 Н-пурин-8-илбицикло[2.2.2]октан-1-карбоновая кислота. К раствору 50 мг 4-3-[2-(4-гидроксифенил)этил]-2,6-диоксо-1-пропил-2,3,6,7-тетрагидро-1 Н-пурин-8-илбицикло-[2.2.2]октан-1-карбоновой кислоты (пример 27 а) (0,107 ммоль) в воде (10 мл), содержащей 1 экв. 1 н. NaOH (110 мкл), добавляли при комнатной температуре раствор 30 мг иода (0,107 ммоль) в этаноле (1 мл). Реакционную смесь концентрировали в вакууме и неочищенный продукт очищали препаративной хроматографией с получением 12 мг(20%) требуемого продукта (МН+=592,89). Аналогичным образом были получены следующие соединения. Пример 28 а. 4-3-[2-(4-Гидрокси-3,5 дииодофенил)этил]-2,6-диоксо-1-пропил-2,3,6,7 тетрагидро-1 Н-пурин-8-илбицикло[2.2.2]октан 1-карбоновая кислота, (МН+=718,50). Пример 28b. 3-(4-3-[2-(4-Гидрокси-3 иодофенил)этил]-2,6-диоксо-1-пропил-2,3,6,7 тетрагидро-1 Н-пурин-8-илбицикло[2.2.2]окт-1 ил)пропионовая кислота, (МН+=621,08). Пример 29. Амид 4-(2,6-диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[2.2.2]октан-1-карбоновой кислоты. К раствору 200 мг 4-(2,6-диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[2.2.2]октан-1-карбоновой кислоты(пример 13) (0,515 ммоль) в 5 мл ДМФ добавляли 235 мг HATU (0,618 ммоль) и 0,4 мл N,Nдиизопропилэтиламина. Полученную смесь оставляли перемешиваться при комнатной температуре в течение 30 мин. Добавляли 2,1 мл 0,5 М раствора NH3 в диоксане (1,03 ммоль) по каплям за 5 мин. Оставляли перемешиваться на ночь,добавляли 0,5 экв. 0,5 М раствора NH3 в диоксане (0,5 мл). Добавляли EtOAc и 1 н. NaOH до рН 9 и промывали 10% лимонной кислотой, насыщенным NаНСО 3 и насыщенным солевым раствором. Сушили над Na2SO4 и концентрировали в вакууме с получением 80,9 мг (40%) чистого продукта (МН+=388,34). Пример 30. 8-(4-Аминометилбицикло(пример 29) (0,129 ммоль) в ТГФ (10 мл) добавляли по каплям при комнатной температуре 0,28 мл 1 М комплекса боран-ТГФ (0,284 ммоль) и по окончании добавления смесь медленно доводили до кипения с обратным холодильником. Кипятили с обратным холодильником в течение 3,5 ч, после чего охлаждали и гасили 10 мл метанола и доводили до кипения. Концентрировали в вакууме и остаток растворяли в 1 н. НСl и промывали дважды CH2Cl2. Доводили до рН 8 и промывали два раза EtOAc, сушили над[3.2.1]октан-1-карбоновая кислота. Пользуясь методикой, описанной в ссылках Kraus, W., et al. Liebigs Ann.Chem. 1981, 10,1826, and Kraus, W., et al. Tetrahedron Lett. 1978,445; Filippini, M.-H. et al. J. Org. Chem. 1995, 60,6872, этиловый эфир 4-оксобицикло[3.2.1] октан-1-карбоновой кислоты (6,17 ммоль, 1,21 г) превращали в этиловый эфир 4-метоксиметиленбицикло[3.2.1]октан-1-карбоновой кислоты. Флэш-хроматография с элюированием смесью 10% диэтиловый эфир/гексаны дала чистый продукт (0,96 г, 69%) в виде жидкости 44 ция) Rf (указанное в заголовке соединение) = 0,29. К охлаждаемому льдом раствору этилового эфира 4-формилбицикло[3.2.1]октан-1 карбоновой кислоты (3,85 ммоль, 0,81 г) медленно добавляли реактив Джонса (2,7 М, 1,43 мл). Реакционную смесь перемешивали при температуре льда 20 мин, после чего останавливали добавлением изоРrОН, разбавляли Н 2 О и экстрагировали Et2O (3 раза). Объединенные органические экстракты промывали Н 2 О (2 раза), насыщенным солевым раствором (1 раз) и сушили (MgSO4). Фильтрование и выпаривание дали вязкий маслянистый 1-этиловый эфир бицикло-[3.2.1]октан-1,4-дикарбоновой кислоты(0,76 г, 87%) в виде смеси аксиальной и экваториальной кислот. 13 С ЯМР (100 МГц, CDCl3): 14,16 (кв),19,86 (т), 21,07 (т), 25,98 (т), 29,20 (т), 31,52 (т),31,87 (т), 32,27 (т), 33,39 (т), 37,80 (д), 38,07 (т),38,10 (д), 42,06 (т), 44,80 (д), 45,78 (д), 49,38 (с),49,60 (с), 60,31 (т), 60,36 (т), 177,08 (с), 180,01(2,52 ммоль, 0,57 г), t-BuOH (7,56 ммоль, 0,56 г) и DMAP (2,02 ммоль, 0,247 г) в СН 2 Сl2 (15 мл). После перемешивания в течение ночи при комнатной температуре, реакционную смесь фильтровали для удаления твердых частиц и фильтрат промывали 5% лимонной кислотой, насыщенным NаНСО 3 и сушили (MgSO4). Фильтрование и выпаривание дали продукт (0,71 г, 100%) в виде масла. МС (ES+) 225,24 (M+H-tBu). Раствор 1-этилового эфира 4-третбутилового эфира бицикло[3.2.1]октан-1,4 дикарбоновой кислоты (2,52 ммоль, 0,71 г) в ТГФ (12 мл) обрабатывали 1 н. LiOH (12,6 мл) и перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали для удаления ТГФ и водный остаток экстрагировали Et2O для удаления нейтральных примесей. Водную фазу подкисляли (рН 2-3) при 0 С добавлением 1 н. НСl и затем сразу же экстрагировали EtOAc. Объединенные органические фракции промывали Н 2 О, насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание дали продукт (0,48 г,75%). Пользуясь методикой примера 8, 4-третбутиловый эфир бицикло[3.2.1]октан-1,4 дикарбоновой кислоты (1,89 ммоль, 0,48 г) подвергали взаимодействию с 5,6-диамино-1,3 дипропил-1 Н-пиримидин-2,4-дионгидрохлоридом (1,89 ммоль, 0,597 г) с получением продукта (0,81 г, 93%). МС (ES+) 463,14 (М+Н). Пользуясь методикой примера 8, третбутиловый эфир 5-(6-амино-2,4-диоксо-1,3 дипропил-1,2,3,4-тетрагидропиримидин-5-илкарбамоил)бицикло[3.2.1]октан-2-карбоновой 45 кислоты (1,75 ммоль, 0,81 г) превращали в продукт (0,501 г, 70%). Раствор трет-бутилового эфира 5-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[3.2.1]октан-2-карбоновой кислоты (1,13 ммоль, 0,501 г) в СН 2 Сl2 (5 мл) обрабатывали TFA (5 мл). После перемешивания при комнатной температуре в течение ночи,реакционную смесь концентрировали досуха. Обращеннофазовой ВЭЖХ разделяли экваториальный (первая полоса, 0,010 г) и аксиальный[3.2.1]окт-1-ил]пропионовая кислота. Суспензию метилового эфира 3-[5-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[3.2.1]окт-1-ил]акриловой кислоты (пример 12) (0,58 ммоль, 0,25 г) и 10%(2,8 кг/см 2) в течение ночи. Отработанную реакционную смесь фильтровали через целит и промывали МеОН. Выпаривание дало требуемый продукт (0,196 г, 79%) в виде масла. МС (ES+) 431,18 (М+Н). Раствор метилового эфира 3-[5-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[3.2.1]окт-1-ил]пропионовой кислоты (0,456 ммоль, 0,196 г) в ТГФ (10 мл) обрабатывали 20% NaOH (2 мл) и перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали для удаления ТГФ. Водный остаток подкисляли (рН 2-3) концентрированной НСl и добавляли изоРrОН для получения гомогенной смеси. Раствор концентрировали на роторном испарителе до начала отделения твердых частиц. После охлаждения на льду в течение 1 ч выпавшие в осадок твердые частицы собирали вакуумным фильтрованием, промывали небольшим количеством Н 2O и вытесняли с помощью Et2O. Твердые частицы сушили на фильтре с получением требуемого продукта (0,061 г, 32%). 13 С ЯМР (100 МГц, CDCl3): 11,11 (кв),11,26 (кв), 20,04 (т), 21,25 (т), 21,31 (т), 29,51 (с),33,97 (т), 35,15 (с), 36,16 (т), 36,39 (т), 43,32 (т),43,41 (т), 45,38 (т), 49,18 (т), 106,01 (с), 149,40(с), 150,90 (с), 156,30 (с), 161,56 (с), 178,54 (с). Пример 33. (1RS,2R,5SR)-[5-(2,6-Диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[3.2.1]октан-1-карбонил]аминофенилуксусная кислота. Пользуясь методикой, описанной в примере 8, осуществляли взаимодействие между 5(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро 1 Н-пурин-8-ил)бицикло[3.2.1]октан-1-карбоновой кислотой (пример 8) (0,052 ммоль, 0,020 г) и 46 гидрохлоридом сложного метилового эфира (R)фенилглицина (0,064 ммоль, 0,013 г) с получением указанного в заголовке соединения (0,0134 г, 48%) в виде смеси диастереомеров. МС (ES+) 536,36 (М+Н). Раствор метилового эфира (1RS,2R,5SR)[5-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.2.1]октан-1-карбонил]аминофенилуксусной кислотыLiOH (0,22 мл) в течение 3 дней. Удаляли на роторном испарителе ТГФ, водный остаток подкисляли (рН 2) добавлением 1 н. НСl и экстрагировали EtOAc. Объединенные органические фракции промывали Н 2 О, насыщенным солевым раствором и сушили (MgSO4). Фильтрование и выпаривание с последующей очисткой обращеннофазовой ВЭЖХ дали требуемый продуктTFA), колонка YMC 120 A/S-5 ODS-AM, 100 мм 4,6 мм, 1,5 мл/мин: Rt=6,88 мин. Аналогичным образом было получено следующее соединение. Пример 33 а. (1RS,2S,5SR)-[5-(2,6-Диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8 ил)бицикло[3.2.1]октан-1-карбонил]аминофенилуксусной кислоты. Пример 34. 8-(4-Гидроксибицикло[3.2.1] окт-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6 дион. Пользуясь методикой, описанной в примере 8, 4-гидроксибицикло[3.2.1]октан-1-карбоновую кислоту (Kraus, W., et al. Liebigs Ann.Chem., 1981, 10, 1826) (0,50 ммоль, 0,085 г) подвергали взаимодействию с 5,6-диамино-1,3 дипропил-1 Н-пиримидин-2,4-дионгидрохлоридом (0,50 ммоль, 0,132 г) с получением требуемого продукта (0,081 г, 44%). Пользуясь методикой, описанной в примере 8, (6-амино-2,4-диоксо-1,3-дипропил-1,2,3,4 тетрагидропиримидин-5-ил)амид 4-гидроксибицикло[3.2.1]октан-1-карбоновой кислоты(0,21 ммоль, 0,081 г) превращали в требуемый продукт. МС (ES+) 361,36 (М+Н). Пример 35. 3-[4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт-1-ил]пропионовая кислота. Винилмагнийбромид (1,0 М в ТГФ, 100 мл) охлаждали до 0 С и дитозилатное производное 4,4-бисгидроксиметилциклогексанона концентрировали при пониженном давлении. Очистка хроматографией (1:1 гексаны/EtOAc) дала 5,0 г промежуточного спирта. Полученный продукт (5,0 г) растворяли в 200 мл безводного ДМФ и добавляли 730 мгNaH (3 экв.). Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 18 ч. Затем ее охлаждали до комнатной температуры и останавливали насыщенным водным раствором NH4Cl и экстрагировалиEtOAc. Органический слой сушили (Na2SO4) иNаОАс 3 Н 2 О (18,0 г, 10 экв.). Реакционную смесь перемешивали при 60 С в течение 2 дней. Затем ее разбавляли Н 2 О и экстрагировалиEtOAc. Органический слой промывали Н 2 О,сушили (Na2SO4) и концентрировали с получением 2,60 г ацетата, 1-винил-2-оксабицикло(8,5 г, 5 экв.) в виде раствора в 50 мл Н 2 О. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем ее концентрировали и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали. Очистка хроматографией (2:1 EtOAc/гексаны) дала 1,20 г спирта, (1-винил-2-оксабицикло[2.2.2]окт 4-ил)метанола. Полученный продукт (1,20 г, 7,14 ммоль) растворяли в 20 мл ацетона и охлаждали до 10 С. Добавляли СrО 3 (2,1 г, 3 экв.) в виде раствора в 10 мл 1,5 н. H2SO4 (водный раствор). Реакционную смесь перемешивали при 10 С в течение 15 мин, нагревали до комнатной температуры и перемешивали 45 мин. Затем ее разбавляли Н 2 О и экстрагировали EtOAc. Объединенные органические слои промывали Н 2 О и затем экстрагировали разбавленным водным раствором КОН. Водный слой подкисляли до рН 1 концентрированной НСl и экстрагировалиEtOAc. Органический слой сушили (Na2SO4) и концентрировали с получением 920 мг производного карбоновой кислоты, 1-винил-2 оксабицикло[2.2.2]октан-4-карбоновой кислоты. Полученный продукт обрабатывали 5,6 диамино-1,3-дипропил-1 Н-пиримидин-2,4-дионом так же, как описано выше, с получением соответствующего производного ксантина, 1,3 дипропил-8-(1-винил-2-оксабицикло[2.2.2]окт 4-ил)-3,7-дигидропурин-2,6-диона. 1,3-Дипропил-8-(1-винил-2-оксабицикло[2.2.2]окт-4-ил)-3,7-дигидропурин-2,6-дион (400 мг, 1,08 ммоль) суспендировали в 8 мл диоксана и добавляли 1 мл 2,5% раствора OsO4 в t-BuOH,a затем 3 мл Н 2 О. Через 10 мин добавляли NaIO4 и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем ее разбавляли Н 2 О и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали с получением промежуточного альдегида, 4(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро 1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]октан-1 карбальдегида. Полученный продукт растворяли в 8 мл ТГФ и добавляли метил(трифенилфосфоранилен)ацетат (720 мг, 2 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли LiOH (155 мг, 6 экв.) в 48 виде раствора в 8 мл Н 2 О и полученную реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Затем реакционную смесь экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали с получением 250 мг 3-[4-(2,6-диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-2-оксабицикло[2.2.2]окт-1-ил]акриловой кислоты. Полученный продукт растворяли в 25 мл 95% ТГФ и 5% Н 2 О. Добавляли 10% Pd/C (80 мг) и реакционную смесь гидрировали при давлении водорода 50 фунтов на кв.дюйм (3,5 кг/см 2) в течение 3 ч. Реакционную смесь фильтровали через целит и фильтрат концентрировали. Очистка препаративной ВЭЖХ с использованием водного раствора CH3CN дала указанное в заголовке соединение. МС (ES+) 419. Пример 36. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)адамантан-1 карбоновой кислоты 4-аминометилбензиламид. Стадия 1. К смоле Ванга (Wang) (10 г, производство Advanced ChemTech, замещение 0,7 ммоль/г) в 100 мл ТГФ добавляли CDI (10 г) и смолу встряхивали в течение ночи. На следующий день смолу фильтровали, промывали ТГФ(3100 мл) и сушили. Стадия 2. Смолу 2,5 г каждая (1,75 ммоль) со стадии 1 обрабатывали восемью разными диаминами (8,75 ммоль, 5 экв.) в ТГФ (25 мл). Для данного примера использовали 4-аминометилбензиламин. После встряхивания в течение ночи смолу промывали ТГФ (325 мл),МеОН (325 мл), СН 2 Сl2 (325 мл) и МеОН (325 мл) и сушили. Стадия 3. Адамантан-1,3-дикарбоновую кислоту (3,5 г) растворяли в ДМФ (20 мл), добавляли DIC (1,36 мл) и перемешивали в течение 1 ч. Полученный ангидрид добавляли к смоле со стадии 2. Смолу встряхивали в течение ночи. На следующий день смолу фильтровали,промывали ДМФ (325 мл), СН 2 Сl2 (325 мл) и МеОН (325 мл) и сушили. Стадия 4. 1,3-Дипропил-5,6-диаминоурацил-НСl связывали со смолой со стадии 3, используя РуВОР, N-метилморфолин в ДМФ, в течение ночи. Смолу промывали ДМФ (325 мл), CH2Cl2 (325 мл) и МеОН (325 мл) и сушили. Стадия 5. К смоле со стадии 4 добавляли 2 мл раствора КОН (7,5 г КОН в 200 мл смеси вода:МеОН:ТГФ = 10:90:100, 10 экв.) и смесь нагревали при 60 С в течение ночи. На следующий день после охлаждения до комнатной температуры смолу промывали МеОН (32 мл),ТГФ (32 мл) и СН 2 Сl2 (32 мл) и сушили. Смолу расщепляли, используя смесь (1:1)(ES+ 533). Пример 37. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)адамантан-1 карбоновой кислоты 3-аминометилбензиламид. Следовали методике из примера 36. На стадии 2 использовали 3-аминометилбензиламин. МС (ES+ 533). Пример 38. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)адамантан-1 карбоновой кислоты (3-аминопропил) амид. Следовали методике примера 36. На стадии 2 использовали 1,3-диаминопропан. МС(ES+ 471). Пример 39. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-адамантан-1 карбоновой кислоты 3-[4-(3-аминопропил) пиперазин-1-ил]пропиламид. Следовали методике примера 36. На стадии 2 использовали 3-[4-(3-аминопропил)пиперазин-1-ил]пропиламин. МС (ES+ 599). Пример 40. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)адамантан-1 карбоновой кислоты [4-(4-аминоциклогексилметил)циклогексил]амид. Следовали методике примера 36. На стадии 2 использовали 4,4'-метиленбис(циклогексиламин). МС (ES+ 607). Пример 41. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)адамантан-1 карбоновой кислоты (4-аминоциклогексил) амид. Следовали методике из примера 36. На стадии 2 использовали циклогексил-1,4-диамин. МС (ES+ 511). Пример 42. 8-[3-(Пиперазин-1-карбонил) адамагеган-1-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. Следовали методике примера 36. На стадии 2 использовали пиперазин. МС (ES+ 483). Пример 43. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)адамантан-1 карбоновой кислоты амид. Следовали методике примера 36, стадия 3. Вместо смолы Ванга использовали смолу Ринка. МС (ES+ 414). Пример 44. 3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)адамантан-1 карбоновая кислота. Симметричный ангидрид, полученный из адамантан-1,3-дикарбоновой кислоты с использованием DIC в ДМФ, связывали с 1,3 дипропил-5,6-диаминоурацилНСl. Продукт подвергали циклизации с использованием КОН в смеси изопропанол/вода. МС (ES+ 415). Пример 45. 8-(3-Гидроксиметиладамантан 1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. Следовали методике примера 46. МС (ES+ 401).[3.3.1]нонан-1-карбоновая кислота. Монометиловый эфир бицикло[3.3.1] нонан-1,5-дикарбоновой кислоты (900 мг) растворяли в СН 2 Сl2 (25 мл), добавляли оксалилхлорид (417 мкл) и 2 капли ДМФ и перемешивали при комнатной температуре в течение 2 ч. Через 2 ч удаляли растворитель на роторном испарителе. Остаток растворяли в 20 мл СН 2 Сl2. Добавляли диаминоурацилНСl (1,25 г) и диизопропилэтиламин (1,7 мл) и перемешивали при комнатной температуре в течение ночи. На следующий день реакционную смесь разбавляли водой, экстрагировали CH2Cl2, промывали насыщенным солевым раствором, сушили надNa2SO4 и концентрировали. Неочищенный продукт растворяли в смеси изопропанол:вода (2:1,100 мл) и, добавив КОН (890 мг), кипятили с обратным холодильником в течение ночи. На следующий день после охлаждения до комнатной температуры удаляли растворитель на роторном испарителе, разбавляли водой, подкисляли 1 н. НСl. Образовавшийся осадок отфильтровывали и сушили. Выход 900 мг. МС (ES+ 403). Пример 47. 8-(5-Гидроксиметилбицикло(25 мл). Добавляли ВН 3 ТГФ (1 М, 3,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. На следующий день реакцию останавливали добавлением МеОН. На роторном испарителе удаляли растворитель. Разбавляли водой и экстрагировали этилацетатом,промывали водой, насыщенным солевым раствором, сушили над Na2SO4 и концентрировали. Выход 690 мг. МС (ES+ 389). Пример 48. 8-5-[(2-Диметиламиноэтиламино)метил]бицикло[3.3.1]нон-1-ил-1,3-дипропил-3,7-дигидропурин-2,6-дион. Стадия 1. 8-(5-Гидроксиметилбицикло[3.3.1]нон-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион (690 мг) растворяли в 50 мл ДМСО. Добавляли пиридинSО 3 (844 мг) и триэтиламин (1,6 мл) и перемешивали в течение ночи. Добавляли дополнительное количество пиридинSО 3 (844 мг) и перемешивали в течение ночи. Реакционную смесь разбавляли этилацетатом (100 мл) и промывали 1 н. НСl, водой, насыщенным солевым раствором и сушили надNa2SO4. После концентрирования неочищенный продукт использовали на следующей стадии без очистки. Стадия 2. 5-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.3.1]нонан-1-карбальдегид (40 мг) растворяли в 5 мл CH2Cl2. Добавляли N1,N1-диметилэтан 51 1,2-диамин (40 мг), Nа(ОАс)3 ВН (100 мг), 2 капли уксусной кислоты и перемешивали при комнатной температуре в течение ночи. На следующий день реакционную смесь разбавляли этилацетатом,промывали насыщеннымNаНСО 3, насыщенным солевым раствором и сушили над MgSO4. Удаляли при пониженном давлении растворитель. Неочищенный продукт очищали препаративной ВЭЖХ. МС (ES+ 459). Пример 49. 3-[5-(2,6-диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.3.1]нон-1-ил]акриловая кислота. 5-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.3.1]нонан-1 карбальдегид (355 мг) растворяли в ТГФ (25 мл). Добавляли метиловый эфир трифенилфосфанилиден уксусной кислоты (614 мг) и кипятили с обратным холодильником в течение ночи. На следующий день добавляли еще 460 мг метилового эфира трифенилфосфанилиден уксусной кислоты и кипятили с обратным холодильником в течение 24 ч. Охладив смесь до комнатной температуры, добавляли LiOH (210 мг), воду (2 мл), МеОН (5 мл) и перемешивали ее при комнатной температуре в течение ночи. Удаляли при пониженном давлении растворитель. Разбавляли водой (25 мл), экстрагировали этилацетатом (325 мл). Водный слой подкисляли 1 н. НСl и экстрагировали этилацетатом (350 мл), сушили над Na2SO4 и концентрировали. Выход 254 мг. МС (ES+ 429). Пример 50. 3-[5-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[3.3.1]нон-1-ил]пропионовая кислота. 3-[5-(2,6-Диоксо-1,6-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)бицикло[3.3.1]нон-1 ил]акриловую кислоту (150 мг) гидрировали в присутствии 10% Pd/C в смеси ТГФ:МеОН (2:1,5 мл) при 60 фунтах на кв.дюйм (4,22 кг/см 2) в течение ночи. Отфильтровывали через целит катализатор и выпаривали растворитель. Твердое вещество очищали кристаллизацией из эфира. Выход 105 мг. МС (ES+ 431). Пример 51. 5-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-9-оксабицикло[3.3.1]нонан-2-карбоновая кислота. Стадия 1. 1,3-Дипропил-7-пирролидин-1 илметил-3,7-дигидропурин-2,6-дион (638 мг) растворяли в сухом ТГФ (10 мл) при -78 С. Медленно добавляли nBuLi (0,88 мл, 2,5 М в гексане). Реакционная смесь становилась оранжевой и ее перемешивали 30 мин при -78 С. Циклоокт-4-енон (298 мг) растворяли в 3 мл сухого ТГФ и добавляли к реакционной смеси. Перемешивали при -78 С в течение 30 мин,медленно нагревали до комнатной температуры и перемешивали 2 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl и экстрагировали этилацетатом (350 мл). Объединенный органический слой промывали 1 н. НСl,водой и насыщенным солевым раствором. Су 005211 52 шили над безводным Nа 2SО 4 и концентрировали. Неочищенный продукт очищали на колонке с силикагелем,элюируя смесью(1:1) этилацетат:гексан. МС (ES+ 361). Стадия 2. 8-(1-Гидроксициклоокт-4-енил)1,3-дипропил-3,7-дигидропурин-2,6-дион (180 мг, со ступени 1) растворяли в сухом МеОH (15 мл) при комнатной температуре. Через раствор барботировали моноксид углерода. ДобавлялиPdCl2 (9 мг), а затем СuСl2 (201 мг). СО барботировали 4 ч при комнатной температуре. Реакционная смесь становилась прозрачной через 3 ч. Через 4 ч удаляли при пониженном давлении МеОН. Разбавляли водой, экстрагировали этилацетатом. Этилацетатный слой промывали водой, насыщенным солевым раствором и сушили над Na2SO4. После концентрирования неочищенный продукт очищали хроматографией на силикагеле с элюированием смесью (1:1) этилацетат:гексан. Выход 120 мг. МС (ES+ 419). Стадия 3. Метиловый эфир 5-(2,6-диоксо 1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8 ил)-9-оксабицикло[3.3.1]нонан-2-карбоновой кислоты (50 мг, со стадии 2) растворяли в МеОН (5 мл). Добавляли LiOH (15 мг) и перемешивали при комнатной температуре в течение ночи. На следующий день удаляли при пониженном давлении МеОН, разбавляли водой и экстрагировали этилацетатом. Водный слой подкисляли 1 н. НСl, экстрагировали этилацетатом (325 мл). Объединенный органический слой промывали насыщенным солевым раствором и сушили над Na2SO4. Выпаривание растворителя дало белое твердое вещество, которое очищали кристаллизацией из эфира. МС (ES+ 405). Пример 52. 8-(5-Гидрокси-9-оксабицикло[3.3.1]нон-1-ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. 1,3-Дипропил-7-пирролидин-1-илметил 3,7-дигидропурин-2,6-дион (638 мг) растворяли в сухом ТГФ (10 мл) при -78 С. Медленно добавляли nBuLi (0,88 мл, 2,5 М в гексане). Реакционная смесь становилась оранжевой и ее перемешивали 30 мин при -78 С. Циклооктан-1,5 дион (280 мг) растворяли в 3 мл сухого ТГФ и добавляли к реакционной смеси. Перемешивали при -78 С в течение 30 мин, медленно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь останавливали насыщенным водным раствором NH4Cl и экстрагировали этилацетатом (350 мл). Объединенный органический слой промывали 1 н. НСl, водой и насыщенным солевым раствором. Сушили над безводным Na2SO4 и концентрировали. Неочищенный продукт очищали на колонке с силикагелем, элюируя смесью (1:1) этилацетат:гексан. МС (ES+ 377). Пример 53. 5-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)-8-оксабицикло[3.2.1]октан-2-карбоновая кислота. 53 Стадия 1. Следовали методике примера 51,стадия 1. Вместо циклоокт-4-енона использовали циклогепт-4-енон. МС (ES+ 347). Стадия 2. 8-(1-Гидроксициклогепт-4-енил)1,3-дипропил-3,7-дигидропурин-2,6-дион(50 мг) растворяли в 10 мл МеОН при комнатной температуре. Через МеОН барботировали моноксид углерода в течение 10 мин. ДобавлялиPdCl2 (25 мг), СuСl2 (58 мг) и СО барботировали 3 ч. Перемешивали при комнатной температуре в течение ночи. Разбавляли МеОН, водой и образовавшийся осадок отфильтровывали через целит. Удаляли МеОН на роторном испарителе и остаток экстрагировали этилацетатом. Этилацетатный слой промывали водой, насыщенным солевым раствором и сушили над Na2SO4. После концентрирования неочищенный продукт растворяли в МеОН (5 мл) и воде (1 мл). ДобавлялиLiOH (25 мг) и перемешивали при комнатной температуре в течение ночи. На следующий день удаляли на роторном испарителе МеОН,остаток растворяли в воде (20 мл) и экстрагировали этилацетатом (225 мл). Водный слой подкисляли 1 н. НСl, экстрагировали этилацетатом (250 мл). Этилацетатный слой промывали насыщенным солевым раствором и сушили. После концентрирования продукт растворяли в эфире и фильтровали через слой силикагеля. Концентрирование дало 30 мг продукта. МС(ES+ 391). Пример 54. Моно-[4-(2,6-диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[2.2.2]окт-1-ил]эфир фосфорной кислоты. 8-(4-Гидроксибицикло[2.2.2]окт-1-ил)-1,3 дипропил-3,7-дигидропурин-2,6-дион (пример 13 а) (180 мг, 0,5 ммоль) растворяли в смеси 1 Нтетразол (350 мг, 5 ммоль) в 10 мл сухого ацетонитрила и 10 мл сухого метиленхлорида. При комнатной температуре добавляли дибензилдиэтилфосфорамидит (476 мг, 1,5 ммоль) в атмосфере азота и смесь перемешивали 2 ч. Затем добавляли 70% трет-бутиловый раствор гидропероксида (1 мл) и смесь перемешивали 1 ч. При 0 С добавляли 15 мл 10% NaНSО 3 и смесь перемешивали еще 15 мин. Затем смесь экстрагировали три раза CH2Cl2 и органический слой промывали водой. Выпаривание растворителя дало 4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]-окт-1-иловый эфир сложного дибензилового эфира фосфорной кислоты в виде желтого масла, которое очищали колоночной хроматографией. Фракции, содержащие 4-(2,6-диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1H-пурин-8-ил)бицикло[2.2.2]окт-1-иловый эфир дибензилового эфира фосфорной кислоты объединяли и концентрировали в вакууме с получением 280 мг продукта. МС (М+1) 621. 4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ило 005211 54 вый эфир дибензилового эфира фосфорной кислоты растворяли в смеси 15 мл метанола и 10 мл ТГФ и к смеси добавляли Pd/C (10%, 50 мг). Проводили гидрирование при 50 фунтах на кв.дюйм (3,5 кг/см 2) в течение 8 ч. Отфильтровывали Pd/C и выпаривали растворитель. Остаток перекристаллизовывали из смеси метанола и этилацетата с получением 190 мг указанного в заголовке соединения (выход 86%). МС (М+1) 441. Пример 55. 3-[4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло(5 мл) интенсивно перемешивали при 0 С. Через 10 мин к реакционной смеси добавляли раствор хлорметилхлорсульфата в дихлорметане (1 мл),давали ей возможность достичь температуры окружающей среды и продолжали интенсивно перемешивать. Через 2 ч органический слой отделяли и промывали насыщенным солевым раствором. Органические экстракты сушили над сульфатом натрия. Затем удаляли в вакууме растворитель и остаток очищали колоночной хроматографией на SiO2 с использованием смеси (1:5) этил/гексан в качестве элюента, получая(200 мг, выход 86%) хлорметиловый эфир 3-[4(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро 1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]пропионовой кислоты. МС (М+1) 465. К раствору 4-хлор-2-[(фуран-2-илметил) амино]-5-сульфамоилбензойной кислоты (142,5 мг, 0,43 ммоль) в ДМФ (3 мл) добавляли триэтиламин (10 мг, 0,95 ммоль) и смесь перемешивали 1 ч. К реакционной смеси добавляли полученный хлорметиловый эфир (200 мг, 0,43 ммоль) и NaI (130 мг, 0,86 ммоль). Реакцию оставляли протекать при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме. Остаток распределяли между этилацетатом и водой. Органический слой концентрировали и очищали колоночной хроматографией с получением указанного в заголовке соединения (190 мг, выход 58%) в виде твердого белого вещества. МС (М+1) 759. Пример 56. Трифторацетат 1-карбокси-33-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил] пропионилоксиметоксикарбонилпропиламмония. Следуя методике примера 54, получали 53-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло-[2.2.2]окт-1-ил] пропионилоксиметилэфир 1-трет-бутилового эфира 2-трет-бутоксикарбониламинопентан 55 диовой кислоты, используя 1-трет-бутиловый эфир 2-трет-бутоксикарбониламинопентандиовой кислоты, хлорметиловый эфир 3-[4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]окт-1-ил]пропионовой кислоты, триэтиламин и NaI в ДМФ. Сняв защиту в CH2Cl2/TFA (50/50) при комнатной температуре в течение 8 ч, очищали препаративной ВЭЖХ с получением указанного в заголовке соединения в виде соли TFA (выход 201). МС (М+1) 576. Пример 57. Трифторацетат 1-карбокси-3(N'-3-[4-(2,6-диоксо-1,3-дипропил-2,3,6,7 тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1 ил]пропионилгидразинокарбонил)пропиламмония. К смеси 3-[4-(2,6-диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бициклоN-метилморфолин (56 мг, 0,55 ммоль) и изобутилхлорформиат (75 мг, 0,55 ммоль) и смесь перемешивали 1 ч. Добавляли к реакционной смеси трет-бутиловый эфир гидразинкарбоновой кислоты (100 мг, 0,75 ммоль). Реакцию оставляли протекать в течение 2 ч. Реакционную смесь промывали NаНSО 3, NaHCO4 и насыщенным солевым раствором соответственно. ТГФ удаляли в вакууме и остаток очищали колоночной хроматографией с последующим снятием защиты в (CH2Cl2/TFA), получая гидразид 3-[4(2,6-диоксо-1,3-дипропил-2,3,6,7-тетрагидро 1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]пропионовой кислоты в виде соли TFA. МС (М+1) 431. Полученную соль TFA подщелачивали триэтиламином, используя такую же методику со смешанным ангидридом, как при описанном выше взаимодействии с 1-трет-бутиловым эфиром 2-трет-бутоксикарбониламинопентандиовой кислоты, с последующими колоночной хроматографией, снятием защиты в CH2Cl2/TFA,препаративной ВЭЖХ с получением указанного в заголовке соединения в виде соли TFA. МС(М+1) 599. Пример 58. [3-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-илметил)адамантан-1-ил]уксусная кислота. Следовали методике примера 45 с использованием (3-метоксикарбонилметиладамантан 1-ил)уксусной кислоты вместо монометилового эфира бицикло[3.3.1]нонан-1,5-дикарбоновой кислоты. МС (ES+ 443). Пример 59. 4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)кубан-1-карбоновая кислота. К раствору метилового эфира 4-(6-амино 2,4-диоксо-1,3-дипропил-1,2,3,4-тетрагидропиримидин-5-илкарбамоил)кубан-1-карбоновой кислоты (400 мг, 0,966 ммоль) в МеОН (20 мл) добавляли 4 мл 20% водного раствора NaOH и полученную мутную смесь кипятили с обратным холодильником в течение ночи (12 ч). Хо 005211 56 лодную реакционную смесь концентрировали в вакууме, разбавляли несколькими мелкими кусочками льда и подкисляли добавлением по каплям концентрированной НСl. Полученный белый осадок собирали, сушили и промывали эфиром с получением белого твердого вещества(м, 2 Н), 4,08 (м, 2 Н), 4,27 (м, 3 Н), 4,38 (м, 3 Н). МС: 383 (МН+). Пример 60. 8-(1-Гидроксиметилкубан-4 ил)-1,3-дипропил-3,7-дигидропурин-2,6-дион. К перемешиваемой суспензии 4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)кубан-1-карбоновой кислоты (100 мг, 0,261 ммоль) и HATU (1,1 экв., 0,288 ммоль,110 мг) в 6 мл MeCN добавляли аккуратно с помощью шприца основание Хюнига (Hunig) (l,l экв., 0,288 ммоль, 37 мг). Полученную гетерогенную смесь перемешивали 3 ч и добавляли одной порцией NaBH4 (2 экв., 0,522 ммоль, 20 мг). Смесь перемешивали еще 2 ч, охлаждали с помощью бани со льдом и подкисляли добавлением по каплям концентрированной НСl. Полученный бледно-желтый осадок собирали, сушили и вновь суспендировали в MeCN. После перемешивания в течение ночи, продукт собирали и сушили с получением не совсем белого порошка (50 мг, 52%). МС: 369 (МН+). Пример 61. 4-(7-Бензил-2,6-диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[2.2.2]октан-1-карбоновая кислота. К перемешиваемому раствору метилового эфира 4-[(6-амино-2,4-диоксо-1,3-дипропил 1,2,3,4-тетрагидропиримидин-5-ил)бензилкарбамоил]бицикло[2.2.2]октан-1-карбоновой кислоты (430 мг, 0,843 ммоль) в изоРrОН (20 мл) добавляли 2 н. КОН (4,0 экв., 3,37 ммоль, 1,7 мл) и полученную смесь кипятили с обратным холодильником в течение 26 ч. Холодную реакционную смесь концентрировали в вакууме с получением полутвердого остатка, который разбавляли водой и экстрагировали СНСl3. Водную фазу подкисляли концентрированной НСl с получением белого осадка, который собирали и сушили (381 мг, 91%). МС: 479 (МН+). Пример 62. 4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]октан-1-карбальдегидоксим. К перемешиваемому раствору 4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]октан-1-карбальдегида (1,6 г, 4,3 ммоль) в МеОН (30 мл) добавляли гидроксиламингидрохлорид (1,2 экв., 5,16 ммоль, 356 мг) и раствор NaOAc (тригидрат, 1,5 экз., 6,45 ммоль, 890 мг) в воде (10 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали в вакууме и твердый остаток суспендировали в воде (15 мл), собирали, промывали водой и сушили с получением белого порошка(1,4 г, 84%). Данный способ использовали также, чтобы получить Пример 62 а. [4-(2,6-Диоксо-1,3-дипропил 2,3,6,9-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]акрилонитрил. К перемешиваемой суспензии 4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]октан-1-карбальдегида (535 мг, 1,44 ммоль) и (цианметил)трифенилфосфонийхлорида (1,2 экв., 1,73 ммоль, 582 мг) в ТГФ (30 мл) при 0 С добавляли KHMDS (0,5 М в толуоле, 2,2 экв., 3,16 ммоль, 6,3 мл). Полученную смесь перемешивали 1,5 ч при указанной температуре, после чего нагревали при 55 С в течение 5 ч. Холодную реакционную смесь распределяли между EtOAc (10 мл) и насыщенным водным раствором NH4Cl(20 мл) и водную фазу экстрагировали EtOAc(20 мл). Объединенные органические слои промывали насыщенным водным раствором NaCl (220 мл), сушили (MgSO4), фильтровали и выпаривали с получением твердого остатка, который очищали радиальной хроматографией (2 мм пластинка) с использованием 5% МеОН в СН 2 Сl2 в качестве элюента, получая 425 мг(75%) хрупкого пенообразного вещества (смесь цис/транс-изомеров). МС: 396 (МН+). Данный способ использовали, чтобы синтезировать Пример 63 а. 2-[4-(2,6-Диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил) бицикло[2.2.2]окт-1-ил]винилфосфоновой кислоты диэтиловый эфир. МС: 507 (МН+). Пример 64. 3-[4-(2,6-Диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]акрилонитрила (110 мг, 0,278 ммоль) в МеОН (20 мл) и СН 2 Сl2 (5 мл) гидрировали с использованием Pd на углероде (10 мол.%) и к переходнику из матового стекла с 3 ходовым запорным краном присоединяли баллон с водородом. После перемешивания в течение ночи смесь дегазировали, фильтровали через целит и концентрировали в вакууме с получением хрупкого пенообразного вещества (100 мг, 90%). 1 Н ЯМР (400 МГц, CDCl3)0,93 (совмещенные триплеты, 6 Н), 1,53 (м, 6 Н), 1,57 (т, 2 Н),1,67 (м, 2 Н), 1,77 (м, 2 Н) , 2,00 (м, 6 Н), 2,24 (т,2 Н), 3,99 (т, 2 Н), 4,05 (т, 2 Н), 12,17 (с, 1 Н). Аналогичным образом были получены следующие соединения Пример 64 а. 4-[4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]октан-1-карбонитрил. К перемешиваемой суспензии 4-(2,6 диоксо-1,3-дипропил-2,3,6,9-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]октан-1-карбальдегидоксима (400 мг, 1,03 ммоль) в СНСl3 (20 мл),охлаждаемой с помощью бани со льдом, добавляли РОСl3 (неразбавленный, 1,5 экв., 237 мг) и полученной смеси давали достичь температуры окружающей среды в течение ночи (17 ч). Реакционную смесь вливали в воду, разделяли фазы и органическую фазу промывали насыщенным водным раствором NаНСО 3, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением белого хрупкого пенообразного вещества (360 мг, 95%). МС: 370 (МН+). Пример 66. [4-(2,6-Диоксо-1,3-дипропил 2,3,6,9-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]ацетальдегид. К перемешиваемой суспензии метоксиметилтрифенилфосфонийхлорида (1,1 г, 3,2 ммоль) в ТГФ (60 мл) при -78 С добавляли раствор KHMDS (0,5 М в толуоле, 10 мл, 5 ммоль). Полученную желтую смесь перемешивали при указанной температуре 1,5 ч и добавляли за 20 мин раствор 4-(2,6-диоксо-1,3-дипропил-2,3,6,9 тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]октан 1-карбальдегида (372 мг, 1,0 ммоль) в ТГФ (12 мл). Смесь выдерживали при -78 С 6 ч и давали ей достичь температуры окружающей среды в течение ночи (12 ч). Реакционную смесь распределяли между насыщенным водным раствором NH4Cl (100 мл) и EtOAc (100 мл) и водную фазу экстрагировали EtOAc (50 мл). Объединенные органические фазы промывали насыщенным водным раствором NaCl (100 мл), концентрировали в вакууме, вновь растворяли в ТГФ и концентрировали до объема приблизительно 20 мл. К раствору добавляли равный объем 1 н. НСl и смесь перемешивали в течение ночи. Смесь разбавляли EtOAc (20 мл), водную фазу отделяли и экстрагировали EtOAc (10 мл). Объединенные органические фазы промывали насыщенным водным раствором NaCl (225 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме. Полученное оранжевое масло очищали порциями радиальной хроматографией (2 мм пластинка) с использованием 3% МеОН и 3% ТГФ в СН 2 Сl2 в качестве элюента. Фракции, содержавшие продукт, объединяли и концентрировали, получая 290 мг (75%) белого твердого вещества. МС: 387 (МН+). Пример 67. [4-(2,6-Диоксо-1,3-дипропил 2,3,6,9-тетрагидро-1 Н-пурин-8-ил)бицикло(10 экв., 4,4 ммоль, 470 мкл), охлаждаемому с помощью бани со льдом, добавляли NaClO2 (1,5 экв., 0,66 ммоль). Полученному желтому раствору давали достичь температуры окружающей среды за 14 ч, после чего концентрировали его в вакууме. Полученный маслянистый остаток распределяли между водой (10 мл) и CH2Cl2 (10 мл). Водную фазу подкисляли добавлением по каплям концентрированной НСl и полученный осадок собирали, промывали водой и сушили с получением 105 мг (59%) белого порошка. 1 Н ЯМР (400 МГц, CDCl3)0,91 (т, 3 Н),0,93 (т, 3 Н), 1,63 (м, 2 Н), 1,77 (м, 2 Н, не полностью ясный), 1,82 (м, 6 Н), 2,01 (м, 6 Н), 2,32 (с,2 Н), 3,95 (м, 2 Н), 4,07 (м, 2 Н), 12,74 (с, 1 Н). Пример 68. Моноэтиловый эфир 2-[4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]окт-1-ил]этилфосфоновой кислоты. Растворяли диэтиловый эфир 2-[4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]окт-1-ил]этилфосфоновой кислоты (30 мг, 59 мкмоль) в 1 н. NaOH (4 мл) и раствор нагревали при 80 С в течение 3 ч. Смеси давали остыть до комнатной температуры и медленно подкисляли ее концентрированной НСl. Полученный осадок собирали и сушили (22 мг, 79%). 1 Н ЯМР (400 МГц, CDCl3)0,93 (совмещенные триплеты, 6 Н), 1,31 (т, 3 Н), 1,48 (м, 8 Н),1,70 (ш.м, 6 Н), 1,95 (м, 6 Н), 3,95 (т, 2 Н), 4,07 (т,2 Н), 12,2 (ш.с, 1 Н). Пример 69. 8-[4-(3-Гидроксипропил) бицикло[2.2.2]окт-1-ил]-1,3-дипропил-3,7-дигидропурин-2,6-дион. К раствору 3-[4-(2,6-диоксо-1,3-дипропил 2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]пропионовой кислоты (417 мг,1,0 ммоль) в ТГФ (25 мл), охлажденному до 0 С с помощью бани со льдом, добавляли ВН 3 (1,0 М в ТГФ, 3,0 ммоль). Полученной смеси давали достичь температуры окружающей среды и перемешивали в течение 60 ч. После добавления МеОН (10 мл) смесь концентрировали в вакууме с получением белого твердого вещества, которое растворяли в МеОН (20 мл), перемешивали при комнатной температуре в течение 2 ч и выпаривали досуха в вакууме. Полученное белое твердое вещество перекристаллизовывали из EtOAc с получением 345 мг (86%) белого порошка. МС: 403 (МН+). Данный способ также использовали, чтобы получить Пример 69 а. 8-[4-(2-Гидроксиэтил) бицикло[2.2.2]окт-1-ил]-1,3-дипропил-3,9 дигидропурин-2,6-дион. МС: 389 (МН+).[2.2.2]окт-1-ил]пропионовой кислоты (510 мг,1,22 ммоль) и HATU (1,1 экв., 1,34 ммоль, 511 мг) в ДМФ (10 мл) добавляли основание Хюнига (1,3 экв., 1,60 ммоль, 205 мг). После перемешивания полученной суспензии в течение 1 ч,добавляли избыточный аммиак (0,5 М в диоксане, 4,0 мл) и смесь перемешивали в течение ночи (14 ч), удаляли в вакууме растворитель и полученный остаток распределяли между СН 2 Сl2(10 мл) и 1 н. НСl (10 мл) с помощью 2 мл МеОН для способствования переносу вещества и улучшения растворимости. Водную фазу экстрагировали СН 2 Сl2 (210 мл), объединенные органические фазы промывали 1 н. НСl (210 мл), сушили (MgSO4), фильтровали и выпаривали в вакууме с получением не совсем белого твердого вещества (455 мг, 90%). МС: 416(МН+). Данный способ использовали, чтобы синтезировать следующие соединения Пример 70 а. 3-[4-(2,6-Диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)бицикло[2.2.2]окт-1-ил]этилфосфоновая кислота. К раствору диэтилового эфира 2-[4-(2,6 диоксо-1,3-дипропил-2,3,6,7-тетрагидро-1 Нпурин-8-ил)бицикло[2.2.2]окт-1-ил]этилфосфоновой кислоты (30 мг, 59 мкмоль) в СН 2 Сl2 (8 мл) добавляли TMSBr (избыточный) и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительный TMSBr и реакционную смесь нагревали при 55 С в течение 6 ч. Растворитель удаляли в вакууме с получением оранжевого твердого вещества, которое обесцвечивалось при растирании с водой. Продукт собирали, промывали водой и сушили (20 мг, 77%). МС: 453 (МН+). Пример 72. 3-(5-2-[4-(2,6-Диоксо-1,3 дипропил-2,3,6,7-тетрагидро-1 Н-пурин-8-ил)
МПК / Метки
МПК: C07D 493/08, A61P 9/00, A61K 31/52
Метки: антагонистов, полициклоалкилпурины, рецепторов, аденозиновых, качестве
Код ссылки
<a href="https://eas.patents.su/30-5211-policikloalkilpuriny-v-kachestve-antagonistov-adenozinovyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Полициклоалкилпурины в качестве антагонистов аденозиновых рецепторов</a>
Предыдущий патент: Сульфонамиды гидроксидифенилмочевины в качестве антагонистов рецептора ил-8
Следующий патент: Азаиндолы
Случайный патент: Химически индуцируемое усиление образования трещин в подземных каменноугольных отложениях












