Азабициклические, азатрициклические и азаспироциклические производные аминоциклогексана в качестве антагонистов рецепторов nmda, 5ht и нейронных никотиновых рецепторов
Номер патента: 7098
Опубликовано: 30.06.2006
Авторы: Гольд Маркус, Хенрих Маркус, Калвиньш Ивар, Даныш Войцех, Каусс Валерьянс, Йиргенсонс Айгарс, Парсонс Кристофер Грахам Рафаэль, Ванейевс Максимс
Формула / Реферат
1. Соединения формулы (1)
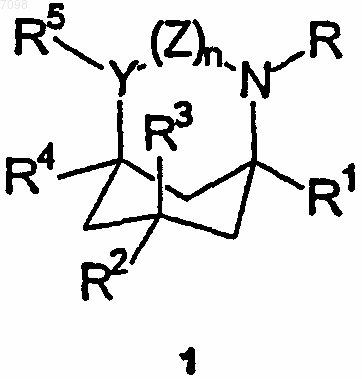
где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, С2-6-алкенильных групп, С2-6-алкинильных групп, С6-12-арил-С1-4-алкильных групп, необязательно замещенных С6-12-арильных групп и в случае R и R2-R5 - из атомов водорода, с условием, что по меньшей мере один из R2 и R3 и по меньшей мере один из R4 и R5 не является водородом, или R и R1 вместе представляют С3-5-алкиленовую или алкениленовую группу, причем R2-R5 имеют указанные выше значения;
Y представляет собой СН и
Z представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно;
и их оптические изомеры и фармацевтически приемлемые кислотно- и основно-аддитивные соли.
2. Соединение по п.1, представляющее собой
1,экзо-3,5-триметил-6-азабицикло[3,2,1]октан и его гидрохлорид;
5-этил-1,экзо-3-диметил-6-азабицикло[3,2,1]октан и его гидрохлорид;
экзо-3-этил-1,5-диметил-6-азабицикло[3,2,1]октан и его гидрохлорид;
1,3,3,5-тетраметил-6-азабицикло[3,2,1]октан и его гидрохлорид;
1,3,3,5,6-пентаметил-6-азабицикло[3,2,1]октан и его гидрохлорид;
5-этил-1,3,3-триметил-6-азабицикло[3,2,1]октан и его гидрохлорид;
1,экзо-3,5-экзо,эндо-7-тетраметил-6-азабицикло[3,2,1]октан и его гидрохлорид;
1,экзо-3,5-триметил-экзо,эндо-7-фенил-6-азабицикло[3,2,1]октан и его гидрохлорид;
1,5,экзо-7-триметил-2-азабицикло[3,3,1]нонан и его гидрохлорид;
7,7,9,9-тетраметил-1-азаспиро[4,5]декан и его гидрохлорид;
8,8,10,10-тетраметил-1-азаспиро[5,5]ундекан и его гидрохлорид и
8,10,10-триметил-6-азатрицикло[6,3,1,01,6]додекан и его гидрохлорид.
3. Фармацевтическая композиция, содержащая соединение по п.1 или 2, в комбинации с одним или несколькими фармацевтически приемлемыми разбавителями, эксципиентами или носителями.
4. Применение соединения формулы (1)

где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, С2-6-алкенильных групп, С2-6-алкинильных групп, С6-12-арил-С1-4-алкильных групп, необязательно замещенных С6-12-арильных групп, и в случае R и R2-R5 - из атомов водорода, или R и R1 вместе представляют С3-5-алкиленовую или алкениленовую группу, причем, R2-R5 имеют указанные выше значения;
Y представляет собой СН и
Z представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно;
или их оптических изомеров, или фармацевтически приемлемых кислотно- и основно-аддитивных солей в качестве иммуномодуляторного, антималярийного, антивирусного (против вируса Воrnа), антигепатитного (против гепатита С), антитрипаносомного или анти-HSV (против вируса простого герпеса) лекарственного средства или лекарственного средства для облегчения состояния, которое можно лечить антагонистом рецептора NMDA, 5НТ3 или нейронного никотинового рецептора.
5. Применение по п.4, где указанным состоянием, которое можно лечить антагонистом рецептора NMDA является эксцитотоксичность, выбранная из ишемии во время удара, травмы, гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии; хроническое нейродегенеративное заболевание, выбранное из болезни Альцгеймера, васкулярной деменции, болезни Паркинсона, болезни Хантингтона, рассеянного склероза, амиотрофического бокового склероза, СПИД-нейродегенерации, оливопонтоцеребральной атрофии, синдрома Туретта, моторного нейронного заболевания, митохондриальной дисфункции, корсаковского синдрома и болезни Крейтцфельда-Якоба; нарушение, относящееся к продолжительным пластичным изменениям в центральной нервной системе, выбранное из хронической боли, толерантности к лекарственному средству, зависимости от лекарственного средства и привыкания к лекарственному средству; эпилепсия; поздняя дискинезия; L-DOPA-индуцированная дискинезия; шизофрения; тревога; депрессия; острая боль; мышечная спастичность или шум в ушах.
6. Применение по п.4, где указанное состояние, которое можно лечить антагонистом рецептора 5НТ3, выбрано из нарушений, проявляющихся в чувстве тревоги, депрессивных нарушений, шизофрении и психоза, связанного с лечением, нарушений, проявляющихся в злоупотреблениях лекарственными средствами и алкоголем, нарушений познавательной способности, болезни Альцгеймера, болезни Паркинсона, церебрального тремора, мигрени, нарушений аппетита, синдрома воспаленного кишечника и рвоты.
7. Применение по п.4, где указанное состояние, которое можно лечить антагонистом нейронного, никотинового рецептора, выбрано из синдрома Туретта, нарушений, проявляющихся в чувстве тревоги, шизофрении, злоупотребления лекарственным средством, злоупотребления никотином, злоупотребления кокаином, дискинезии Morbus Huntington, L-DOPA-индуцированной дискинезии, нарушения гиперактивности дефицита внимания, болезни Альцгеймера, болезни Паркинсона и боли.
8. Применение соединения формулы (1)
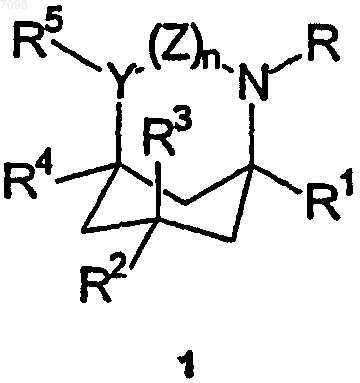
где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, С2-6-алкенильных групп, С2-6-алкинильных групп, С6-12-арил-С1-4-алкильных групп, необязательно замещенных С6-12-арильных групп, и в случае R и R2-R5 - из атомов водорода, или R и R1 вместе представляют С3-5-алкиленовую или алкениленовую группу, причем, R2-R5 имеют указанные выше значения;
Y представляет собой СН и
Z представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно;
или их оптических изомеров, или фармацевтически приемлемых кислотно- и основно-аддитивных солей при изготовлении иммуномодуляторного, антималярийного, антивирусного (против вируса Воrnа), антигепатитного (против гепатита С), антитрипаносомного или анти-HSV (против вируса простого герпеса) лекарственного средства или лекарственного средства для облегчения состояния, которое можно лечить антагонистом рецептора NMDA, 5НТ3 или нейронного никотинового рецептора.
9. Применение по п.8, где указанным состоянием, которое можно лечить антагонистом рецептора NMDA является эксцитотоксичность, выбранная из ишемии во время удара, травмы, гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии; хроническое нейродегенеративное заболевание, выбранное из болезни Альцгеймера, васкулярной деменции, болезни Паркинсона, болезни Хантингтона, рассеянного склероза, амиотрофического бокового склероза, СПИД-нейродегенерации, оливопонтоцеребральной атрофии, синдрома Туретта, моторного нейронного заболевания, митохондриальной дисфункции, корсаковского синдрома и болезни Крейтцфельда-Якоба; нарушение, относящееся к продолжительным пластичным изменениям в центральной нервной системе, выбранное из хронической боли, толерантности к лекарственному средству, зависимости от лекарственного средства и привыкания к лекарственному средству; эпилепсия; поздняя дискинезия; L-DOPA-индуцированная дискинезия; шизофрения; тревога; депрессия; острая боль; мышечная спастичность или шум в ушах.
10. Применение по п.8, где указанное состояншх, которое можно лечить антагонистом рецептора 5НТ3, выбрано из нарушений, проявляющихся в чувстве тревоги, депрессивных нарушений, шизофрении и психоза, связанного с лечением, нарушений, проявляющихся в злоупотреблениях лекарственными средствами и алкоголем, нарушений познавательной способности, болезни Альцгеймера, болезни Паркинсона, церебрального тремора, мигрени, нарушений аппетита, синдрома воспаленного кишечника и рвоты.
11. Применение по п.8, где указанное состояние, которое можно лечить антагонистом нейронного, никотинового рецептора, выбрано из синдрома Туретта, нарушений, проявляющихся в чувстве тревоги, шизофрении, злоупотребления лекарственным средством, злоупотребления никотином, злоупотребления кокаином, дискинезии Morbus Huntington, L-DOPA-индуцированной дискинезии, нарушения гиперактивности дефицита внимания, болезни Альцгеймера, болезни Паркинсона и боли.
12. Способ лечения человека-субъекта или не являющегося человеком животного для достижения иммуномодуляторных, антималярийных, антивирусных (против вируса Воrnа) или анти-HSV (против вируса гепатита С) эффектов или облегчения состояния, которое можно лечить антагонистами рецептора NMDA, 5НТ3 или нейронного никотинового рецептора, включающий стадию введения указанному субъекту эффективного количества соединения формулы (1)
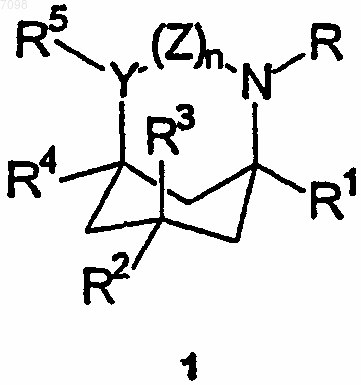
где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, C2-6-алкенильных групп, С2-6-алкинильных групп, С6-12-арил-С1-4-алкильных групп, необязательно замещенных С6-12-арильных групп, и в случае R и R2-R5 - из атомов водорода, или R и R1 вместе представляют С3-5-алкиленовую или алкениленовую группу, причем R2-R5 имеют указанные выше значения;
Y представляет собой СН и
Z представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно,
или их оптических изомеров, или фармацевтически приемлемых кислотно- и основно-аддитивных солей.
Текст
007098 Область изобретения Предложены азабициклические, азатрициклические и азаспироциклические производные аминоциклогексанов, которые являются системно действующими в качестве антагонистов рецепторов NMDA,5HT и никотиновых рецепторов, фармацевтические композиции, содержащие их, способ их получения и способ лечения нарушений ЦНС, которые включают нарушения глутаматергической, серотонинергической и никотиновой трансмиссии, и лечения иммуномодуляторных нарушений и лечения инфекционных заболеваний. Предпосылки создания изобретения Антагонисты NMDA Антагонизм глутаматных рецепторов типа N-метил-D-аспартата (NMDA) имеет потенциально широкий диапазон терапевтических применений [19]. Функциональное ингибирование рецепторов NMDA может быть достигнуто посредством действий при различных сайгах узнавания, таких как сайт первичного трансмиттера, не чувствительный к стрихнину сайт глицина (глицинаB), сайт полиамина и сайт фенилциклидина, расположенный внутри катионного канала. Блокаторы каналов рецептора NMDA действуют неконкурентным, зависимым от использования способом, это означает, что они обычно блокируют каналы только в открытом состоянии. Эта зависимость от использования интерпретируется многими так, что более сильная активация рецептора должна привести к более высокой степени антагонизма. Такой тип действия дополнительно принимается для обозначения того, что этот класс антагонистов может быть особенно полезным, когда может ожидаться сверхактивация рецепторов NMDA, например, при эпилепсии, ишемии и травме. Однако первоначальный клинический опыт с селективным, имеющим высокую аффинность, сильно зависимым от использования, неконкурентным антагонистом рецептораNMDA, малеатом (+)-5-метил-10,11-дигидро-5 Н-дибензоциклогептен-5,10-имина +)-МК-801), был разочаровывающим. А именно, терапевтическая эффективность его при эпилепсии была слабой, тогда как при применении его в терапевтических дозах очевидными были некоторые психотропные побочные действия. Эти наблюдения вместе с тем фактом, что субъекты, злоупотребляющие фенциклидином, испытывают похожие психотропные симптомы, привели к заключению, что неконкурентный антагонизм рецептора NMDA не может быть перспективным терапевтическим подходом. Однако применение более тщательно разработанных электрофизиологических способов показывает, что не имеется равенства между различными неконкурентными антагонистами, так как такие факторы, как скорость блокирования рецептора (кинетика по принципу включено-выключено) и зависимость этого эффекта от напряжения, могут определять фармакодинамические характеристики in vivo, т.е. также терапевтическую безопасность. Парадоксально, что могут быть желательны агенты с аффинностью от низкой до умеренной, а не агенты с высокой аффинностью. Такие данные вызывают пересмотр концепции неконкурентного антагонизма рецепторов NMDA при разработке лекарственных средств [19, 22]. Неконкурентные антагонисты рецепторов NMDA, такие как амантадин и мемантин, которые удовлетворяют указанным выше критериям, использовали клинически в течение нескольких лет при лечении болезни Паркинсона и деменции, соответственно, и, действительно, они редко вызывали побочные действия при терапевтических дозах, используемых при их соответствующих показаниях. Ввиду указанных выше данных авторами был разработан ряд новых неконкурентных антагонистов рецепторов NMDA на основе соединений с азабициклической, азатрициклической и азаспироциклической структурой. Антагонисты рецепторов 5-НТ 3 Рецепторы 5-НТ 3 являются открываемыми лигандами ионотропными рецепторами, проницаемыми для катионов. В организме человека рецепторы 5-НТ 3 обнаруживают самую высокую плотность на энтерохромаффинных клетках в желудочно-кишечной слизистой оболочке, которые иннервируются вагусными афферентами и в area postrema ствола мозга, которая образует триггерную (пусковую) зону хеморецепторов. Поскольку рецепторы 5-НТ 3 имеют высокую плотность не только в area postrema, но также в области гиппокампа и миндалины лимбической системы, было предположено, что селективные антагонисты 5-НТ 3 могут иметь психотропные действия (GreenshawSilverstone, 1997). Действительно, ранние исследования на животных позволили предположить, что антагонисты рецептора 5-НТ 3, кроме их хорошо признанного противорвотного использования, могут быть вполне клинически полезными в ряде областей применения. Они включают нарушения, проявляющиеся в чувстве тревоги, шизофрению, нарушения, проявляющиеся в злоупотреблениях лекарственными средствами и алкоголем, депрессивные нарушения, нарушения познавательной способности, болезнь Альцгеймера,церебральный тремор, психоз, связанный с лечением болезни Паркинсона, боль (мигрень и синдром раздраженной толстой кишки) и нарушения аппетита. Антагонисты нейронного никотинового рецептора В настоящее время известны десять -субъединиц ( 1-10) и четыре -субъединицы ( 1-4) никотиновых рецепторов. Рецепторы 42 являются, вероятно, наиболее распространенными в ЦНС, особенно в гиппокампе и полосатом теле. Они образуют неселективные катионные каналы с медленно, неполно-1 007098 стью десенсибилизирующими токами (тип II). Гомомерные рецепторы 7 являются как до-, так и послесинаптическими, их обнаруживают в гиппокампе, двигательной области коры головного мозга и лимбической системе, а также в периферической нервной автономной системе. Эти рецепторы характеризуются их высокой Са 2+-проницаемостью и быстрыми, сильно десенсибилизирующими реакциями (тип 1 А). Изменения в никотиновых рецепторах имеют место при ряде заболеваний. Они включают болезнь Альцгеймера, болезнь Паркинсона, синдром Туретта, шизофрению, злоупотребление лекарственным средством, злоупотребление никотином и боль. На основании наблюдения того, что, как оказалось, никотиновый агонист самого никотина обладает полезными действиями, разработка лекарственного средства до сих пор предпринимается при обнаружении селективных никотиновых агонистов. С другой стороны, не ясно, обусловлены ли действия никотиновых агонистов, например, при синдроме Туретта и шизофрении, активацией или инактивацией/десенсибилизацией нейронных никотиновых рецепторов. Влияниe агонистов на нейронные никотиновые рецепторы сильно зависит от периода экспозиции. Быстрая обратимая десенсибилизация протекает за миллисекунды, снижение происходит за секунды,необратимая инактивация 4- и 7-содержащих рецепторов протекает за часы и их позитивная регуляция происходит через несколько дней. Другими словами, действия никотиновых агонистов могут фактически быть обусловлены частичным агонизмом, инактивацией и/или десенсибилизацией нейронных никотиновых рецепторов. В свою очередь, умеренные концентрации блокаторов каналов нейронных никотиновых рецепторов могут вызывать такие же действия, какие указывались для никотиновых агонистов в упомянутых выше показаниях. Настоящее изобретение Теперь обнаружено, что некоторые азабициклические, азатрициклические и азаспироциклические производные аминоциклогексанов обладают резко выраженной и непредсказуемой антагонистической активностью для рецепторов NMDA, 5HT и никотиновых рецепторов. Благодаря вышеуказанному свойству такие соединения являются подходящими для лечения широкого диапазона нарушений ЦНС, которые включают нарушения глутаматергической, серотонинергической и никотиновой трансмиссии, иммуномодуляторного заболевания и инфекционных заболеваний. Эти соединения находятся предпочтительно в форме их фармацевтической композиции, в которых они присутствуют вместе с одним или несколькими фармацевтически приемлемыми разбавителями, носителями или эксципиентами. Цели изобретения Целью настоящего изобретения является предложение новых фармацевтических соединений, которые представляют собой азабициклические, азатрициклические и азаспироциклические производные аминоциклогексана и являются антагонистами рецепторов NMDA, 5 НТ 3 и никотиновых рецепторов и их фармацевтических композиций. Следующей целью изобретения является предложение нового способа лечения, устранения, ослабления, временного облегчения или уменьшения интенсивности симптомов нежелательных нарушений ЦНС, которые включают нарушение глутаматергической, серотонинергической и никотиновой трансмиссии, лечения иммуномодуляторных нарушений и лечения инфекционных заболеваний посредством использования соединения изобретения или содержащей его фармацевтической композиции. Дополнительной целью изобретения является предложение способа получения азабициклических, азатрициклических и азаспироциклических производных аминоциклогексана, являющихся активными соединениями. Дополнительные цели станут очевидными после данного описания, другие цели будут также очевидными специалисту в данной области. Краткое изложение сущности изобретения Таким образом, авторы считают, что данное изобретение может быть суммировано, inter alia, следующим образом. Соединение, выбранное из соединений формулы 1 где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп с неразветвленной или разветвленной цепью (например, метильных, этильных, пропильных или бутильных групп), С 2-6-алкенильных групп с неразветвленной или разветвленной цепью (например, этенильных или пропенильных групп), С 2-6 алкинильных групп с неразветвленной или разветвленной цепью (например, этинильных или пропинильных групп), С 6-12-арильных групп (например, фенильных или нафтильных групп), замещенных С 6-12 арильных групп (например, имеющих один или несколько заместителей, выбранных из C1-6-алкила, такого как метил или этил, C1-6-алкокси, такого как метокси или этокси, гидрокси и галогена, такого как хлор-2 007098 или бром), С 6-12-арил-С 1-4-алкильных групп (например, бензильных или фенетильных групп), и в случаеR и R2-R5 - также из атомов водорода;Z представляет собой СН 2;Y представляет собой СН; и при условии, что по меньшей мере один из R2 и R3 не являются водородом и по меньшей мере один изR4 и R5 не является водородом; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X, что приводит к образованию структуры, представленной формулой 2 где Х представляет собой СН 2;m равно 0, 1 или 2; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; их оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; такой способ лечения животного для облегчения состояния, в котором соединение выбрано по его иммуномодуляторной, антималярийной, антивирусной (вирус Воrnа), антигепатитной (гепатит С), антитрипаносомной активности и активности против вируса герпеса простого, включающий стадию введения животному количества соединения, выбранного из соединений формулы 1 где R выбран из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;R1 выбран из группы, состоящей из алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-С 6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила; радикалы от R2 до R5 независимо выбраны из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (С 2-С 6) с неразветвленной или разветвленной цепью,алкинила (С 2-С 6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;Y представляет собой СН; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X, что приводит к образованию структуры, представленной формулой 2 где Х представляет собой СН 2;-3 007098 или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; его оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; которое является эффективным для облегчения указанного состояния; такой способ лечения животного для облегчения состояния, которое можно лечить антагонистомNBDA, и которое выбрано из группы, состоящей из эксцитотоксичности, выбранной из ишемии во время удара, травмы, гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии, хронических нейродегенеративных заболеваний, выбранных из болезни Альцгеймера, васкулярной деменции, болезни Паркинсона, болезни Гентингтона, рассеянного склероза, бокового амиотрофического склероза, СПИДнейродегенерации, оливопонтоцеребеллярной атрофии, болезни Туретта, моторного нейронного заболевания, митохондриальной дисфункции, корсаковского синдрома и болезни Крейтцфельда-Якоба, других нарушений, относящихся к длительным пластическим изменениям в центральной нервной системе и выбранных из хронической боли, толерантности к лекарственному средству, зависимости от лекарственного средства и привыкания к лекарственному средству (например, опиоидам, кокаину, бензодиазепину,никотину и алкоголю) и эпилепсии, поздней дискинезии, L-DOPA-индуцированной дискинезии, шизофрении, тревоги, депрессии, острой боли, мышечной спастичности и шума в ушах, включающий стадию введения животному количества соединения, выбранного из соединений формулы 1 где R выбран из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (С 2-С 6) с неразветвленной или разветвленной цепью, алкинила (С 2-С 6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;R1 выбран из группы, состоящей из алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (С 2-С 6) с неразветвленной или разветвленной цепью, алкинила (С 2-С 6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила; радикалы от R2 до R5 независимо выбраны из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (С 2-С 6) с неразветвленной или разветвленной цепью,алкинила (С 2-С 6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;Z представляет собой СН 2;Y представляет собой СН; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X, что приводит к образованию структуры, представленной формулой 2m равно 0, 1, 2; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3-4 007098 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; его оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; которое является эффективным для облегчения указанного состояния; такой способ лечения животного для облегчения состояния, которое можно лечить антагонистом рецептора 5 НТ 3, включающий стадию введения животному количества соединения, выбранного из соединений формулы 1 где R выбран из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;R1 выбран из группы, состоящей из алкила (C1-С 6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (С 2-С 6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила; радикалы от R2 до R5 независимо выбраны из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью,алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;Z представляет собой СН 2;Y представляет собой СН; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X, что приводит к структуре, представленной формулой 2m равно 0, 1, 2; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; его оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; которое является эффективным для облегчения указанного состояния; такой способ лечения живого животного для облегчения состояния, которое можно лечить антагонистом нейронного никотинового рецептора, включающий стадию введения животному количества соединения, выбранного из соединений формулы 1 где R выбран из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;R1 выбран из группы, состоящей из алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила; радикалы от R2 до R5 независимо выбраны из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью,алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;Y представляет собой СН; или из тех соединений, у которых R и R1 соединяются с образованием C3-C5-алкиленового или алкениленового мостика U-V-W-X, что приводит к образованию структуры, представленной формулой 2m равно 0, 1, 2; или из тех соединений, у которых R и R1 соединяются с образованием C3-C5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; его оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; которое является эффективным для облегчения указанного состояния; такой способ лечения животного для облегчения состояния, которое можно лечить антагонистом 5 НТ 3 и которое выбрано из группы, состоящей из нарушений, проявляющихся в чувстве тревоги, депрессивных нарушений, шизофрении и психозу, связанному с лечением нарушений из-за злоупотребления лекарственным средством и алкоголем, нарушений познавательной способности, болезни Альцгеймера,болезни Паркинсона, церебрального тремора, мигрени, нарушений аппетита, синдрома воспаленного кишечника (IBS) и рвоты, включающий стадию введения животному количества соединения, выбранного из соединений формулы 1 где R выбран из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;R1 выбран из группы, состоящей из алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила; радикалы от R2 до R5 независимо выбраны из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью,алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;Z представляет собой СН 2;Y представляет собой СН; или из тех соединений, у которых R и R1 соединяются с образованием C3-C5-алкиленового или алкениленового мостика U-V-W-X, что приводит к образованию структуры, представленной формулой 2 где Х представляет собой СН 2;m равно 0, 1, 2; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; его оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; которое является эффективным для облегчения указанного состояния; такой способ лечения животного для облегчения состояния, которое можно лечить антагонистом нейронного никотинового рецептора и которое выбрано из группы, состоящей из синдрома Туретта, нарушений, проявляющихся в чувстве тревоги, шизофрении, нарушений из-за злоупотребления лекарственным средством, нарушений из-за злоупотребления никотином, нарушений из-за злоупотребления кокаином, дискинезии (Morbus Huntinton, вызванной L-DOPA), нарушения гиперфункции дефицита внимания (ADHD), болезни Альцгеймера, болезни Паркинсона и боли, включающий стадию введения животному количества соединения, выбранного из соединений формулы 1 где R выбран из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;R1 выбран из группы, состоящей из алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила; радикалы от R2 до R5 независимо выбраны из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью,алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;Y представляет собой СН; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X, что приводит к образованию структуры, представленной формулой 2m равно 0, 1, 2; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; его оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; которое является эффективным для облегчения указанного состояния; и такая фармацевтическая композиция, которая состоит из соединения, выбранного из соединений формулы 1 где R выбран из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;R1 выбран из группы, состоящей из алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью, алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила; радикалы от R2 до R5 независимо выбраны из группы, состоящей из водорода, алкила (C1-C6) с неразветвленной или разветвленной цепью, алкенила (C2-C6) с неразветвленной или разветвленной цепью,алкинила (C2-C6) с неразветвленной или разветвленной цепью, арила, замещенного арила и арилалкила;Z представляет собой СН 2;Y представляет собой СН; или из тех соединений, у которых R и R1 соединяются с образованием С 3-С 5-алкиленового или алкениленового мостика U-V-W-X, что приводит к образованию структуры, представленной формулой 2m равно 0, 1, 2; или из тех соединений, у которых R и R1 соединяются с образованием C3-C5-алкиленового или алкениленового мостика U-V-W-X и члены кольца N и Y не соединяются с образованием мостика, что приводит к образованию основной структуры, представленной формулой 3 где член кольца N является насыщенным и член кольца Y является насыщенным или может соединяться вместе с R5 с образованием углерод-водородной связи с атомом углерода кольца, к которому он присоединен; его оптических изомеров и их фармацевтически приемлемых кислотно- или основно-аддитивных солей; в комбинации с одним или несколькими фармацевтически приемлемыми разбавителями, эксципиентами или носителями. Подробное описание изобретения Нижеследующие подробности и подробные примеры приводятся только с целью иллюстрации и не должны истолковываться как ограничение. Ниже приводятся общая синтетическая схема и таблица для 6-азабицикло[3,2,1]октанов (относящихся к структуре формулы 1 краткого изложения изобретения).a). 1,Экзо-3,5-триметил-6-азабицикло[3,2,1]окт-6-ен (5-1). Смесь 1,3,3,транс-5-тетраметилциклогексанамина (4-1) (3,88 г, 25 ммоль), K2 СО 3 (28 г, 0,2 моль) и тетраацетата свинца (22,2 г, 50 ммоль) в сухом бензоле (125 мл) перемешивают в течение 3 ч при кипячении с обратным холодильником. Затем ее охлаждают ледяной водой и фильтруют. Осадок промывают диэтиловым эфиром и фильтрат упаривают при пониженном давлении. Маслянистый остаток разделяют колоночной хроматографией на силикагеле (дихлорметан-изопропиловый спирт, 20:1, 10:1). Фракцию сRf 0,7 (EtOAc) собирают, получая при этом после концентрирования при пониженном давлении 1,0 гb). Гидрохлорид 1,экзо-3,5-триметил-6-азабицикло[3,2,1]октана (1-1). Раствор имина 5-1 (0,8 г, 5,3 ммоль) в МеОН (2 мл) добавляют по каплям к суспензии боргидрида натрия (0,4 г, 10,6 ммоль) в МеОН (6 мл). Смесь перемешивают при комнатной температуре в течение 24 ч, затем добавляют 10 мл 5% водного NaOH. Смесь экстрагируют диэтиловым эфиром. Органическую фазу промывают водным NaCl и сушат над гранулами NaOH. Фильтрованный раствор обрабатывают сухим раствором НСl в диэтиловом эфире, упаривают при пониженном давлении и остаток перекристаллизовывают из сухого СН 3 СN, получая при этом соединение 1-1 в виде бесцветного твердого веществаa). 1-Азидо-1-этил-3,3,транс-5-триметилциклогексан (7). Охлажденную (0 С) смесь 1-этил-3,3,транс-5-триметилциклогексанола (6) (3,3 г, 18,1 ммоль), азида натрия (2,36 г, 36,3 ммоль) и трифторуксусной кислоты (10,7 мл) в хлороформе (50 мл) перемешивают в течение 24 ч. Затем ее делают основной добавлением разбавленного водного аммиака. Органическую фазу отделяют, промывают водой и сушат над K2 СО 3. Фильтрование и выпаривание растворителя при пониженном давлении дают маслянистый остаток, который разделяют флэш-хроматографией на силикагеле при элюировании легким петролейным эфиром, получая при этом азид 7 (2,0 г, 56%) в виде легкого бесцветного масла. 1b). 1-Этил-3,3,транс-5-триметилциклогексанамин (4-2). Раствор азида 7 (1,97 г, 10 ммоль) в диэтиловом эфире (10 мл) добавляют по каплям к суспензии литийалюминийгидрида (1,13 г, 30 ммоль) в диэтиловом эфире (30 мл). Смесь перемешивают в течение 20 ч при комнатной температуре. Затем ее осторожно гасят 10% водным NaOH. Органическую фазу отделяют и водную фазу экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают насыщенным водным NaCl и сушат над NaOH. Фильтрование и выпаривание растворителя при пониженном давлении дает амин 4-2 (1,36 г, 80%) в виде масла. 1H ЯМР (СDСl3, ТМС) : 0,82-0,95 (1 Н, м, СН кольца); 0,91 (3 Н, д, 6 Гц, 3-СН 3), 0,94 (3 Н, т, 7,5 Гц,Et-СН 3); 1,15-1,75 (6 Н, м, СН кольца); 1,15 (3 Н, с, 1-СН 3); 1,71 (2 Н, кв, 7,5 Гц, Et-CH2) и 7,38 м.д. (1 Н, с,НС=). Пример 3. Гидрохлорид экзо-3-этил-1,5-диметил-6-азабицикло[3,2,1]октана (1-3). а). трет-Бутил-транс-5-этил-1,3,3-триметилциклогексилкарбамат (8-1). К раствору гидрохлорида 1,3,3-триметил-транс-5-этилциклогексанамина (4-3) (1,54 г, 7,5 ммоль) в ТГФ (20 мл) добавляют Na2CO3 (3,18 г, 30 ммоль) и смесь перемешивают в течение 30 мин. Затем ее охлаждают ледяной водой, добавляют ди-трет-бутилдикарбонат (1,7 г, 7,65 ммоль) и перемешивание продолжают в течение 20 ч. Добавляют воду и смесь дважды экстрагируют диэтиловым эфиром. Объединенные экстракты промывают насыщенным водным NaCl, сушат над MgSO4 и упаривают. Твердый остаток обрабатывают гексаном, фильтруют и промывают гексаном, получая при этом карбамат 8-1. Дополнительное количество 8-1 выделяют после того, как фильтрат упаривают и обрабатывают ацетонитрилом. Карбамат 8-1 (1,18 г, 57%) получают в виде бесцветного твердого вещества с т.пл. 70-71 С. 1 Н ЯМР (CDCl3, ТМС) : 0,65-1,65 (7 Н, м, CH2-Et и СН кольца); 0,88 (3 Н, т, 6,5 Гц, СН 3-Et); 0,88 и 0,99 (оба 3 Н, с, 3,3-СН 3); 1,42 (9 Н, с, t-Bu); 1,85 (1 Н, д кв, 13,5 и 2,5 Гц, 6-СНэкв.); 2,24 (1 Н, д, 14 Гц, 2 СНэкв.) и 4,30 м.д. (1 Н, уш.с, NH).b). трет-Бутил-экзо-3-этил-1,5-диметил-6-азабицикло[3,2,1]октан-6-карбоксилат (9-1). К смеси карбамата 8-1 (1,05 г, 3,85 ммоль) и иода (1,95 г, 1,1 ммоль) в сухом бензоле (35 мл) добавляют тетраацетат свинца (3,92 г, 8,85 ммоль) в виде одной порции. Смесь перемешивают при кипячении с обратным холодильником в течение 4 ч, затем охлаждают ледяной водой и фильтруют. Осадок промывают диэтиловым эфиром и фильтрат осторожно промывают насыщенным водным метабисульфитом калия, затем насыщенным водным NaHCO3. Органическую фазу промывают насыщенным водным NaCl,сушат над МgSO4 и упаривают. Остаток очищают флэш-хроматографией на силикагеле (легкий петролейный эфир-этилацетат, 20:1), получая при этом соединение 9-1 (0,76 г, 73%) в виде бесцветного масла. 1c). Гидрохлорид экзо-3-этил-1,5-диметил-6-азабицикло[3,2,1]октана (1-3). Карбамат 9-1 (0,73 г, 2,7 ммоль) добавляют к раствору трифторуксусной кислоты (3 мл) в дихлорметане (15 мл) и смесь перемешивают при комнатной температуре в течение 10 ч. Раствор упаривают при пониженном давлении и остаток обрабатывают 10% водным NaOH (5 мл) и экстрагируют диэтило- 10007098 вым эфиром. Экстракт промывают насыщенным водным NaCl и сушат над NaOH. Отфильтрованный раствор обрабатывают сухим раствором НСl в диэтиловом эфире. Растворитель выпаривают при пониженном давлении и остаток обрабатывают сухим ацетонитрилом, получая при этом гидрохлорид амина 1-3 в виде бесцветного твердого вещества (0,34 г, 62%). 1b). Гидрохлорид 1,3,3,5,6-пентаметил-6-азабицикло[3,2,1]октана (1-5). Раствор карбамата 11 (1,0 г, 4,44 ммоль) в диэтиловом эфире (10 мл) добавляют к суспензии литийалюминийгидрида (0,34 г, 9 ммоль) в диэтиловом эфире (25 мл). Смесь перемешивают в течение 20 ч при комнатной температуре. Затем ее охлаждают ледяной водой и осторожно гасят 10% водным NaOH. Органическую фазу отделяют и водную фазу экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают насыщенным водным NaCl и сушат над NaOH. Отфильтрованный раствор обрабатывают избыточным количеством сухого раствора НСl в диэтиловом эфире. Растворитель выпаривают при пониженном давлении и остаток обрабатывают сухим ацетонитрилом и диэтиловым эфиром (2:1) и охлаждают в холодильнике в течение 24 ч. Осадок отфильтровывают и промывают диэтиловым эфиром,получая при этом гидрохлорид амина 1-5 (0,25 г, 26%) в виде бесцветного твердого вещества. 1a). 3-Бензил-3,5-диметилциклогексанон (13). К охлажденному (-20 С) 1 М раствору бензилмагнийбромида в диэтиловом эфире (50 мл) в атмосфере аргона добавляют CuCl (0,52 г, 5,3 ммоль) и смесь перемешивают в течение 5 мин. Затем по каплям добавляют раствор 3,5-диметил-2-циклогексен-1-она (12) (4,4 г, 35,1 ммоль) в диэтиловом эфире (15 мл), поддерживая при этом температуру ниже -10 С. Смесь перемешивают в течение 2 ч и гасят 10% водной уксусной кислотой (40 мл). Органический слой отделяют, промывают водой, насыщенным водным NaHCO3 и насыщенным водным NaCl и сушат над MgSO4. Фильтрование и концентрирование в вакууме дает маслянистый остаток, который разделяют флэш-хроматографией на силикагеле (легкий петролейный эфир-этилацетат, 10:1). Циклогексанон 13 (4,0 г, 53%) получают в виде бесцветного масла. 1b). цис-3-Бензил-1,3,транс-5-триметилциклогексанол (14). Раствор кетона 13 (3,9 г, 18,1 ммоль) в диэтиловом эфире (10 мл) добавляют по каплям к 1 М МеМgI в диэтиловом эфире (40 мл). Смесь перемешивают в течение 1 ч при комнатной температуре. Эфирный экстракт, полученный после традиционной обработки продукта реакции Гриньяра, сушат надNa2SO4, фильтруют и упаривают, получая при этом маслянистый остаток, который очищают флэшхроматографией на силикагеле (легкий петролейный эфир-этилацетат). Циклогексанол 14 (3,2 г, 76%) получают в виде бесцветного масла. 1H ЯМР (СDСl3, ТМС) : 0,75 (3 Н, с, 3-СН 3); 0,95-1,25 (3 Н, м, СН кольца); 0,92 (3 Н, д, 6,6 Гц, 5 СН 3), 1,23 (3 Н, с, 1-СН 3); 1,45-1,75 (3 Н, м, СН кольца); 2,05-2,25 (1 Н, м, 5-СН); 2,77 и 3,04 (оба 1 Н, д, 13 Гц, CH2Ph) и 7,05-7,35 м.д. (5 Н, м, СН арила). с). N-(цис-3-бензил-1,3,транс-5-триметилциклогексил)-2-хлорацетамид (15). Серную кислоту (2,1 мл, 3,83 г, 39 ммоль) добавляют по каплям к перемешиваемому раствору циклогексанола 14 (3,0 г, 13 ммоль) и хлорацетонитрила (4,0 г, 52 ммоль) в уксусной кислоте (2,1 мл) при охлаждении ледяной водой. Смесь перемешивают в течение 24 ч при комнатной температуре, затем выливают в ледяную воду (10 мл). Смесь нейтрализуют 20% водным NaOH и экстрагируют диэтиловым эфиром (3 х 15 мл). Объединенные органические фазы промывают насыщенным водным NaCl и сушат надMgSO4. Экстракт фильтруют и растворитель выпаривают. Остаток очищают флэш-хроматографией на силикагеле при элюировании смесью легкого петролейного эфира и этилацетата (10:1), получая при этом амид 15 (1,32 г, 33%) в виде бесцветного масла. 1 Н ЯМР (СDСl3, ТМС) : 0,73 (3 Н, с, 3-СН 3); 0,90-1,40 (3 Н, м, СН кольца); 0,98 (3 Н, д, 6,6 Гц, 5 СН 3), 1,42 (3 ЗН, с, 1-СН 3); 1,63 (1 Н, м, СН кольца); 1,80-2,05 (1 Н, м, 5-СН); 2,12 (1 Н, д кв, 13,8 и 3 Гц, 6 СН); 2,33 (1 Н, д, 12,7 Гц, CH2Ph); 2,51 (1 Н, дт, 15 и 2,2 Гц, 2-СН); 3,17 (1 Н, д, 12,7 Гц, CH2Ph); 3,95 и 3,96d). Гидрохлорид цис-3-бензил-1,3,транс-5-триметилциклогексанамина (4-7). Раствор амида 15 (0,62 г, 2 ммоль) и тиомочевины (0,18 г, 2,4 ммоль) в смеси этанола (5 мл) и уксусной кислоты (1 мл) кипятят с обратным холодильником в течение 10 ч. Реакционную смесь охлаждают до комнатной температуры и при перемешивании добавляют 20 мл 10% водного NaOH. Образовавшуюся смесь экстрагируют диэтиловым эфиром (310 мл). Объединенные экстракты промывают насыщенным водным NaCl, сушат над NaOH, фильтруют и обрабатывают сухим раствором НСl в диэтиловом эфире. Растворитель выпаривают при пониженном давлении и остаток обрабатывают сухим диэтиловым эфиром, получая при этом гидрохлорид амина 4-7 (0,33 г, 35%) в виде бесцветного твердого вещества.e). 1,Экзо-3,5-триметил-7-фенил-6-азабицикло[3,2,1]окт-6-ен (5-4). Получают с выходом 40% из свободного амина 4-7 по процедуре, описанной в примере 1 а. Масло. 1H ЯМР (СDСl3, ТМС) : 0,75-1,95 (4 Н, м, СН кольца); 0,86 (3 Н, д, 5,8 Гц, 3-СН 3); 1,20 (3 Н, с, 1-СН 3); 1,56 (3 Н, с, 5-СН 3); 1,99 (1 Н, д, 14,4 Гц, 8-СН); 2,05-2,15 (1 Н, м, СН кольца); 2,20-2,30 (1H, м, СН кольца); 4,57 (1 Н, м, 7-СН); 7,24 и 7,65 (общий 5 Н, оба уш.с, Ph); 9,15 и 10,40 м.д. (общий 2 Н, оба уш.с, NH2+). Ниже приводятся общая синтетическая схема и таблица для 5-азабицикло[3,2,1]нонанов (относящихся к структуре формулы 1 раздела Краткое изложение изобретения). Схема 2(получен из фракции с Rf 0,7-0,8 (гексаны-EtOAc, 2:1), выделенного после синтеза соединения 15, пример 8 с) в смеси ацетонитрила (16 мл), тетрахлорметана (16 мл) и воды (23 мл) добавляют периодат натрия (10,5 г, 49 ммоль) и диоксид рутения (7 мг, 0,06 ммоль). Смесь перемешивают при комнатной температуре в течение 72 ч, затем ее фильтруют и лепешку на фильтре промывают дихлорметаном. Органическую фазу фильтрата отделяют и водную фазу экстрагируют дихлорметаном. Объединенные органические фазы сушат над CaCl2, фильтруют и упаривают. Остаток очищают флэш-хроматографией на силикагеле при элюировании хлороформом, получая при этом кислоту 16 (0,55 г, 41%) в виде масла. 1- 13007098 Тионилхлорид (0,73 мл, 10 ммоль) добавляют по каплям к раствору кислоты 16 (0,55 г, 1,99 ммоль) в сухом этаноле (5 мл) при охлаждении ледяной водой. Образовавшийся раствор перемешивают в течение 15 ч при комнатной температуре, затем упаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле при элюировании смесью легкого петролейного эфира и этилацетата (6:1), получая при этом этиловый сложный эфир 17 (0,32 г, 54%) в виде масла. 1c). 1,5,Экзо-7-триметил-2-азабицикло[3,3,1]нонан-3-он (18). Раствор этилового сложного эфира 17 (0,32 г, 1,07 ммоль) и тиомочевины (0,098 г, 1,3 ммоль) в смеси этанола (5 мл) и уксусной кислоты (1,2 мл) кипятят с обратным холодильником в течение 20 ч. Реакционную смесь охлаждают до комнатной температуры и растворители выпаривают. Добавляют 10% водный NaOH и смесь экстрагируют хлороформом (310 мл). Объединенные органические экстракты сушат над CaCl2, фильтруют и упаривают. Остаток очищают флэш-хроматографией на силикагеле при элюировании смесью легкого петролейного эфира и этилацетата (6:1, 3:1). Фракцию с Rf 0,4 (гексанEtOAc, 2:1) собирают, получая при этом лактам 18 (0,12 г, 39%) в виде бесцветного твердого вещества с т.пл. 176-177 С. 1d). Гидрохлорид 1,5,7-триметил-2-азабицикло[3,3,1]нонана (1-9). 1 М Раствор борана в тетрагидрофуране (2 мл, 2 ммоль) добавляют к раствору лактама 18 (0,07 г,0,385 ммоль) в тетрагидрофуране (2 мл) и кипятят с обратным холодильником в течение 15 ч. Смесь охлаждают до комнатной температуры и делают кислотной добавлением конц. водной НСl. Растворители выпаривают при пониженном давлении и к остатку добавляют гексан (10 мл) и 20% водный NaOH (10 мл). Органическую фазу отделяют и водную фазу экстрагируют гексаном (25 мл). Объединенные органические фазы промывают насыщенным водным NaCl (10 мл) и сушат над NaOH. Экстракт фильтруют и добавляют раствор сухого НСl в диэтиловом эфире. Растворитель выпаривают и остаток обрабатывают диэтиловым эфиром (5 мл). Осадок собирают на фильтре, получая при этом гидрохлорид амина 1-9 (0,02 г,25%) в виде бесцветного твердого вещества. 1H ЯМР (CDCl3, ТМС) : 0,80-1,85 (7 Н, м, СН кольца); 0,88 (3 Н, д, 6,5 Гц, 7-СН 3); 0,96 (3 Н, с, 5 СН 3); 1,50 (3 Н, с, 1-СН 3); 2,10-2,40 (2 Н, м, 7-СН и 8-СН); 3,15-3,35 и 3,30-3,55 (оба 1 Н, м, 3-CH2); 9,15 и 9,55 м.д. (оба 1 Н, уш.с, NH2+). Ниже приводятся общая синтетическая схема и таблица для 1-азаспиросоединений (относящихся к структуре формулы 3 в разделе Краткое изложение изобретения). Схема 3 Пример 10. Гидрохлорид 7,7,9,9-тетраметил-1-азаспиро[4,5]декана (3-1). а). 3,3,5,5-Тетраметил-1-(2-фенилэтил)циклогексанол (20-1). Раствор 3,3,5,5-пентаметилциклогексанона (19) (1,54 г, 10 ммоль) в диэтиловом эфире (10 мл) добавляют к 0,85 М раствору фенилэтилмагнийбромида в диэтиловом эфире (25 мл, 20 ммоль) при охлаждении ледяной баней. Образовавшуюся смесь перемешивают в течение 0,5 ч и осторожно добавляют насыщенный водный NH4Cl (30 мл). Органическую фазу отделяют и водную фазу промывают диэтиловым эфиром (220 мл). Объединенные органические фазы промывают насыщенным водным раствором NaCl(20 мл) и сушат над МgSO4. Фильтрование и упаривание раствора дает остаток, который очищают флэшхроматографией на силикагеле при элюировании смесью легкого петролейного эфира и этилацетата(10:1), получая при этом циклогексанол 20-1 (2,1 г, 82%) в виде масла. 1e). 7,7,9,9-Тетраметил-1-азаспиро[4,5]декан-2-он (24-1). Получают с выходом 54% из сложного эфира 23-1 по процедуре, описанной в примере 9 с. Бесцветное твердое вещество с т.пл. 158-160 С. 1b). 2-Xлop-N-[3,3,5,5-тетраметил-1-(3-фенилпропил)циклогексил]ацетамид (21-2). Получают с выходом 37% из циклогексанола 20-2 по процедуре, описанной в примере 8 с. Бесцветное твердое вещество с т.пл. 83-85 С. 1c). 4-1-[(2-Хлорацетил)амино]-3,3,5,5-тетраметилциклогексилбутановая кислота (22-2). Получают с выходом 74% из амида 21-2 по процедуре, описанной в примере 9 а. Бесцветное твердое вещество с т.пл. 140-141 С.e). 8,8,10,10-Тетраметил-1-азаспиро[5,5]ундекан-2-он (24-2). Получают с выходом 76% из сложного эфира 23-2 по процедуре, описанной в примере 9 с. Бесцветное твердое вещество с т.пл. 126-128 С. 1H ЯМР (CDCl3, ТМС) : 1,01 (6 Н, с, 8,10-СН 3); 1,09 (6 Н, с, 8,10-СН 3); 1,0-2,1 (12 Н, м, 3,4,5,7,9,11 СН 2); 3,1 (2 Н, уш.с, 2-СН 2) и 9,1 м.д. (2 Н, уш.с, NH2+). Ниже приводятся общая синтетическая схема и таблица для 6-азатрицикло[6,3,1,01,6]додеканов (относящихся к структуре формулы 2 в разделе Краткое изложение изобретения). Схема 4H ЯМР (СDСl3, ТМС) : 0,85-2,45 (12 Н, м, 2,3,4,9,11,12-СН 2); 0,99 (3 Н, с, 10-СН 3); 1,05 (3 Н, с, 10 СН 3); 1,19 (3 Н, с, 8-СН 3); 3,12 (2 Н, м, 5-СН 2); 3,20-3,75 (2 Н, м, 7-СН 2) и 9,05 м.д. (1 Н, уш. с, NH+). Фармацевтические композиции Активные ингредиенты изобретения вместе с одним или несколькими общепринятыми адъювантами, носителями или разбавителями могут быть превращены в форму фармацевтических композиций и их единичных доз и в такой форме они могут быть использованы в твердом виде, таком как таблетки с покрытием или без покрытия или заполненных капсул, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или капсулы, заполненные ими, все такие композиции и их единичные дозы используют для перорального введения, в форме суппозиториев или капсул их применяют для ректального введения, в форме стерильных инъецируемых растворов - для парентерального (включая внутривенное или подкожное) введения. Такие фармацевтические композиции и их единичные дозированные формы могут содержать общепринятые или новые ингредиенты в общепринятых или специальных пропорциях, с дополнительными активными соединениями или ингредиентами или без них, такие единичные дозированные формы могут содержать любое подходящее эффективное количество активного ингредиента, соразмерное с заданной применяемой суточной дозой. Таблетки, содержащие от двадцати (20) до ста (100) миллиграммов активного ингредиента или, в более широком диапазоне, от десяти (10) до двухсот пятидесяти (250) миллиграммов на таблетку, являются соответственно пригодными репрезентативными единичными дозированными формами. Способ лечения Вследствие их высокой степени активности и низкой токсичности, вместе представляющих наиболее благоприятный терапевтический индекс, активные ингредиенты изобретения могут быть введены в эффективном количестве субъекту, например животному (включая человека), нуждающемуся в этом, для лечения, ослабления или улучшения состояния, временного облегчения или устранения симптомов или состояния, восприимчивого к ним, или, соответственно, симптомов или состояния, изложенного гделибо еще для такого применения, предпочтительно, совместно, одновременно, или вместе с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями, особенно и предпочтительно, в форме их фармацевтической композиции, независимо от того, вводят ли их пероральным, ректальным или парентеральным (в том числе внутривенным или подкожным) или в некоторых случаях даже местным путем. Подходящие дозы находятся в диапазоне 1-1000 мг в день, предпочтительно 10-500 мг в день и особенно 50-500 мг в день, в зависимости, как обычно, от определенного способа введения, формы, в которой их вводят, показания, для лечения которого направлено введение, подвергаемого лечению субъекта и массы тела этого субъекта и предпочтения и квалификации врача или ветеринара. Примеры репрезентативных фармацевтических композиций С помощью обычно используемых растворителей, вспомогательных агентов и носителей продукты реакции могут быть превращены в таблетки, таблетки с покрытием, капсулы, растворы для закапывания,суппозитории, препараты для инъекции и инфузии и тому подобное и могут быть терапевтически использованы пероральным, ректальным, парентеральным и дополнительными путями введения. Ниже представлены репрезентативные фармацевтические композиции.(a). Таблетки, подходящие для перорального введения, которые содержат активный ингредиент, могут быть получены общепринятыми способами таблетирования.(b). Для суппозиториев может быть использована обычная основа для суппозиториев с целью включения в нее обычной процедурой активного ингредиента, такая как полиэтиленгликоль, который является твердым при нормальной комнатной температуре, но который плавится при температуре тела или около такой температуры.(с). Для парентеральных (в том числе внутривенных и подкожных) стерильных растворов активный ингредиент используют вместе с общепринятыми ингредиентами в обычных количествах, такими как,например, хлорид натрия и бидистиллированная вода (до баланса), растворы получают по общепринятой процедуре, такой как фильтрация, асептическое наполнение в ампулы или сосуды для капельного внутривенного вливания и обработка в автоклаве для стерилизации. Другие подходящие фармацевтические композиции должны быть сразу же очевидны специалисту в данной области. Следующие примеры снова приводятся только с целью иллюстрации и не должны истолковываться,как ограничивающие изобретение. Пример 1. Композиция в форме таблеток. Подходящая композиция в форме таблетки, содержащей 10 мг активного ингредиента, имеет следующий состав: Пример 2. Композиция в форме таблеток. Другая подходящая композиция в форме таблетки, содержащей 100 мг активного ингредиента, имеет следующий состав: Пример 3. Композиция в форме капсул. Подходящая композиция для наполнения капсулы, содержащей 50 мг активного ингредиента, имеет следующий состав: Такой композицией наполняют желатиновую капсулу. Пример 4. Раствор для инъекции. Подходящая композиция в виде инъецируемого раствора, содержащая 1% активного ингредиента,имеет следующий состав: Пример 5. Жидкая пероральная композиция. Подходящая композиция в виде 1 л жидкой смеси, содержащая 2 мг активного ингредиента в 1 мл смеси, имеет следующий состав: Пример 6. Жидкая пероральная композиция. Другая подходящая композиция в виде 1 л жидкой смеси, содержащая 20 мг активного ингредиента в 1 мл смеси, имеет следующий состав: Пример 7. Жидкая пероральная композиция. Другая подходящая композиция в виде 1 л жидкой смеси, содержащая 2 мг активного ингредиента в 1 мл смеси, имеет следующий состав: 15 мл раствора помещают в алюминиевые аэрозольные контейнеры, закрытые дозирующим клапаном и действующие под давлением 3,0 бара. Пример 9. Композиция TDS. 100 г раствора содержат 1,8 г раствора помещают на ворсистую ткань, покрытую клейкой, являющейся подложкой, фольгой. Систему закрывают защитным материалом, который удаляют перед использованием. Пример 10. Композиция с наночастицами. 10 г композиции с наночастицами полибутилцианоакрилата содержат Наночастицы полибутилцианоакрилата получают эмульсионной полимеризацией в смеси вода/0,1 н.HCl/этанол в качестве среды для полимеризации. Наночастицы в суспензии в заключение лиофилизуют в вакууме. Фармакология - краткое изложение Активные ингредиенты настоящего изобретения и их фармацевтические композиции и способ лечения с их применением характеризуются уникальными полезными и непредсказуемыми свойствами,делающими рассматриваемый предмет в целом, заявляемый здесь, неочевидным. Соединения и их фармацевтические композиции обнаруживают в стандартных общепринятых надежных процедурах испытания следующие ценные свойства и характеристики. Они являются системно активными неконкурентными антагонистами NMDA-рецептора с быстрой кинетикой блокирования/деблокирования и сильной зависимостью от напряжения, в соответствии с этим, их используют при лечении, ослаблении или уменьшении интенсивности симптомов, временном облегчении или устранении восприимчивых состояний нанесением или введением животному-хозяину для лечения широкого диапазона нарушений ЦНС, которые заключаются в нарушении глутаматергической трансмиссии. Эти соединения являются также системно активными, неконкурентными антагонистами рецептора 5 НТ 3 и нейронных никотиновых рецепторов и, в соответствии с этим, имеют применение при лечении,ослаблении или уменьшении интенсивности симптомов, временном облегчении или устранении восприимчивых состояний нанесением или введением животному-хозяину для лечения широкого диапазона нарушений ЦНС, которые заключаются в нарушении трансмиссии серотонина или никотиновой трансмиссии. Способы Изучение связывания рецепторов Самцов крыс Sprague-Dawley (200-250 г) обезглавливали и их мозг быстро извлекали. Кору головного мозга рассекали и гомогенизировали в 20 объемах охлажденной льдом 0,32 М сахарозы с использованием гомогенизатора из стекла и тефлона. Гомогенат центрифугировали при 1000 х g в течение 10 мин. Осадок после центрифугирования выгружали и супернатант центрифугировали при 20000 х g в течение 20 мин. Образовавшийся осадок снова суспендировали в 20 объемах дистиллированной воды и центрифугировали в течение 20 мин при 8000 х g. Затем супернатант и светлый слой кровяного сгустка центрифугировали при 48000 х g в течение 20 мин в присутствии 50 мМ трис-HCl, рН 8,0. Осадок затем снова суспендировали и центрифугировали 2 или 3 раза при 48000 х g в течение 20 мин в присутствии 50 мМ трис-HCl, рН 8,0. Все стадии центрифугирования проводили при 4 С. После ресуспендирования в 5 объемах 50 мМ трис-HCl, рН 8,0, суспензию мембран быстро замораживали при -80 С. В день анализа мембраны размораживали и промывали 4 раза ресуспендированием в 50 мМ трисHCl, рН 8,0, и центрифугировали при 48000 х g в течение 20 мин и, наконец, ресуспендировали в 50 мМ трис-HCl, рН 7,4. Количество белка в конечном препарате мембран (250-500 мкг/мл) определяли по способу Lowry et al. (1951). Инкубации начинали добавлением [3H]-(+)-МК-801 (23,9 Ки/ммоль, 5 нМ, DupontNEN) в пробирки с глицином (10 мкМ), глутаматом (10 мкМ) и 125-250 мкг белка (общий объем 0,5 мл) и различными концентрациями испытуемых агентов (10 концентраций в двух повторностях). Инкубацию- 20007098 продолжали при комнатной температуре в течение 120 мин (при используемых условиях достигали равновесие). Неспецифическое связывание определяли добавлением немеченого (+)-МК-801 (10 мкМ). Инкубации завершали с использованием системы фильтрования Millipore. Образцы дважды споласкивали 4 мл охлажденного льдом буфера для анализа с использованием фильтров из стеклянных волокон (SchleicherSchuell) при постоянном вакууме. После отделения и ополаскивания фильтры помещали в сцинтилляционную жидкость (5 мл; Ultima Gold) и радиоактивность, оставшуюся на фильтрах, определяли общепринятым сцинтилляционным счетчиком (Hewlett Packard, Liquid Scintillation Analyser). Kd [3H]-(+)-MK801 4,6 нМ определяли анализом Scatchard и использовали в соответствии с зависимостью Cheng Prussoff для вычисления аффинности вытеснителей как величины Kd. Большинство антагонистов испытывали в 3-7 отдельных экспериментах. Экспрессия подтипа рецептора NMDA и нейронного никотинового рецептора в ооцитах Xenopus Зрелых самок Xenopus laevis анестезировали в 0,2% трикаине на льду в течение 15 мин перед хирургической операцией. Ооциты удаляли и инкубировали в 2 мг/мл коллагеназы (тип II) в растворе Рингера без Са 2+ для ооцитов (82,5 мМ NaCl, 2 мМ КСl, 2 мМ MgCl2, 5 мМ HEPES, pH 7,5) в течение 30 мин при комнатной температуре и тщательно промывали OR-2 (100 мМ NaCl, 2 мМ КСl, 1 мМ MgCl2, 2 мМCaCl2, 5 мМ HEPES, pH 7,5). Оставшийся клеточный слой фолликул удаляли ручным способом чистыми пинцетами и ооциты сохраняли в OR-2. РНК растворяли в DEPC-обработанной, стерильной дистиллированной воде. РНК для субъединицы NR1a NMDA смешивали при 1:1 с РНК для субъединицы NR2A. Подобным образом РНК нейронной никотиновой 4 смешивали при 1:1 с РНК для субъединицы 2. От пятидесяти до ста нанолитров каждой смеси РНК инъецировали в цитоплазму ооцитов с использованием нанолитрового шприца (World Precision Instruments). Ооциты инкубировали при 19 С в OR-2 в течение следующих 3-6 дней. Электрофизиологические реакции получали с использованием стандартного вольт-кламп-способа с двумя электродами (GeneClamp 500 amplifier) через 2-6 дней после инъекции. Электроды имели сопротивление между 0,2 и 0,4 М и были заполнены 3 М КСl. Регистрации проводили в изготовленной на заказ камере с временами обмена 2-3 с. Раствор бани готовили без Са 2+, чтобы избежать Са 2+индуцированного тока Сl- (100 мМ NaCl, 2 мМ КСl, 5 мМ HEPES, 2 мМ BaCl2, pH 7,35). РецепторыNMDA активировали совместным нанесением ручным способом 1 мМ глутамата и 10 мкМ глицина в течение 30-40 с каждые 2-3 мин на ооциты с фиксацией напряжения при -70 мВ. Нейронные никотиновые рецепторы активировали нанесением 100 мкМ ацетилхолина в течение 20-30 с каждые 2-3 мин на ооциты с фиксацией напряжения при -70 мВ. После получения стабильных контрольных реакций получали полные кривые концентрация-реакция с антагонистами посредством предварительной инкубации при 6-7 разных концентрациях при log 3-интервалах. Для включения в конечный анализ были пригодны только результаты от стабильных клеток, т.е. показывающие по меньшей мере 50% возврат реакций на NDMA после удаления испытуемого антагониста. Несмотря на это, возврат от действий лекарственного средства не всегда был 100% из-за небольшого снижения или увеличения в некоторых клетках. В случае присутствия такой факт всегда компенсировался посредством базирования % антагонизма при каждой концентрации как на контроле, так и возврате, и допущения линейного хода времени для этого снижения. Все антагонисты оценивали при блокаде в стационарном состоянии с 6 или 7 концентрациями по меньшей мере на 4 клетках. Равновесную блокаду достигали с применением 1-3 агонистов в зависимости от концентрации антагониста. Кинетические эксперименты проводили посредством применения различных концентраций ненасыщенных аминоалкилциклогексанов (обычно 5 в log 3-режиме дозирования) в течение 10-20 с при непрерывном присутствии глутамата (100 мкМ) и глицина (10 мкМ) в течение 90-180 с в ооцитах Xenopus,экспрессирующих рецепторы NR1a/2A. Используемая система перфузии для этих экспериментов была модифицированной ооцитной карусельной системой, которая позволяет быстро промывать в агонисте и антагонисте или отмывать от них с изменением времени меньше чем 1 с. Экспоненциальный подбор проводили с использованием программы TIDA для Windows и большинство реакций хорошо апроксимировалось единственным экспоненциалом. Такую же систему использовали для оценки зависимого от напряжения блокирования, а раствор бани, содержащий флуфенамовую кислоту (100 мкМ), использовали для блокирования эндогенных активированных напряжением и Са 2+-активированных токов Сl-1. Кроме того, Ba2+ (2 мМ) заменяли низкими концентрациями Са 2+ (0,2 мМ). После равновесного блокирования при более высоких концентрациях антагониста (обычно приблизительно в 10 раз выше IC50) пять линейных изменений возбуждались от -70 до +30 мВ на протяжении 2 с. Сходные изменения возбуждались в растворах бани и для глутамата без антагониста, как перед нанесением антагониста, так и после восстановления реакций. Токи утечки в отсутствие глутамата были вычтены из кривых для глутамата и для глутамата + антагониста. Зависимость от напряжения затем определяли сравниванием кривых для глутамата и для глутамата плюс антагонист. Пэтч-кламп для NMDA и никотина Гиппокампы получали из крысиных эмбрионов (Е 20 и Е 21) и затем переносили в свободный от кальция и магния буферный солевой раствор Ханка (Gibco) на льду. Клетки механически диссоциирова- 21007098 ли в смеси 0,05% ДНКаза/0,3% овомукоид (Sigma) с последующей предварительной 8-минутной инкубацией со смесью 0,66% трипсин/0,1% ДНКаза (Sigma). Диссоциированные клетки затем центрифугировали при 18 х g в течение 10 мин, ресуспендировали в минимальной эссенциальной среде (Gibco) и высевали при плотности 150000 клетоксм-2 на предварительно покрытых поли-L-лизином (Sigma) пластиковых чашках Петри (Falcon). Клетки растили на NaHCO3/HEPES-зaбyфepeннoй минимальной эссенциальной среде, дополненной 5% фетальной бычьей сывороткой и 5% лошадиной сывороткой (Gibco) и инкубировали при 37 С с 5% СО 2 при влажности 95%. Среду полностью заменяли с последующим ингибированием дальнейшего глиального митоза цитозин-D-арабинофуранозидом (20 М Sigma) после приблизительно 7 дней выдерживания in vitro. После этого среду заменяли частично дважды в неделю. Пэтч-кламп-регистрацию этих нейронов проводили полированными стеклянными электродами (4-6 м) способом целых клеток при комнатной температуре (20-22 С) с помощью усилителя ЕРС-7 (List). Испытуемые вещества применяли посредством переключения каналов изготовленной на заказ системы быстрого суперслияния с обычным выходящим потоком (время замены 10-20 мс). Внутриклеточный раствор имел следующий состав (мМ): CsCl (120), TEACI (20), ЭГТУ (EGTA) (10), MgCl2 (1), CaCl2 (0,2),глюкоза (10), АТФ (АТР) (2), цАМФ (сАМР) (0,25); рН регулировали до 7,3 при помощи СsОН или НСl. Внеклеточные растворы имел следующий основной состав (мМ): NaCl (140), KСl (3), CaCl2 (0,2), глюкоза(10), HEPES (10), сахароза (4,5), тетродотоксин (ТТХ 310-4). Глицин (1 М) присутствовал во всех растворах: концентрация была достаточной для индуцирования приблизительно 80-85% активации рецепторов глицинав. Только результаты от стабильных клеток были пригодными для включения в конечный анализ, т.е. после восстановления реакций на NMDA по меньшей мере на 75% их подавления испытуемыми антагонистами. Пэтч-кламп для 5-НТ 3 Клетки N1E-115 приобретали из Европейской коллекции клеточных культур (ЕСАСС, Salisbury, UK) и сохраняли при -80 С до дальнейшего их использования. Клетки высевали при плотности 100000 клетоксм-2 на пластиковых чашках Петри (Falcon) и растили на NaHCO3/HEPES-зaбyфepeннoй минимальной эссенциальной среде, дополненной (MEM) 15% фетальной бычьей сывороткой (Gibco), и инкубировали при 37 С с 5% СO2 при влажности 95%. Среду полностью заменяли ежедневно. Один раз каждые 3 дня клетки снова засевали на свежих чашках Петри с последующей обработкой смесью трипсин-ЭДТУ(EDTA) (1% в PBS), ресуспендированием в MEM и центрифугированием при 1000 об./мин в течение 4 мин. Пэтч-кламп-регистрации при -70 мВ проводили со всплывшими клетками через 2-3 дня после засевания с использованием полированных стеклянных электродов (2-6 M) способом целых клеток при комнатной температуре (20-22 С) с усилителем ЕРС-7 (List). Внутриклеточный раствор имел следующий состав (мМ): CsCl (130), HEPES (10), ЭГТУ (EGTA) (10), MgCl2 (2), CaCl2 (2), К-АТР (К-АТФ) (2), трисГТФ (трис-GTP) (0,2), D-глюкоза (10); рН регулировали до 7,3 с помощью CsOH или НСl. Внеклеточный раствор имел следующий основной состав (мМ): NaCl (124), КСl (2,8), HEPES (10), рН регулировали до 7,3 при помощи NaOH или НСl. После установления конфигурации целых клеток клетки поднимали со стеклянного субстрата и наносили серотонин (10 мкМ), мемантин и ненасыщенные производные аминоалкилциклогексана при различных концентрациях с использованием устройства быстрого суперслияния. Для воздействия на поднятые клетки либо раствора без серотонина, либо содержащего серотонин раствора использовали для нанесения двухканальную, перемещаемую пьезо-транслятором пипетку. Двухсекундный импульс серотонина подавали каждые 60 с. Предполагаемые антагонисты растворяли в бидистиллированной воде и раствор разводили раствором бани до требуемой концентрации. Только результаты от стабильных клеток были приемлемы для включения в конечный анализ, т.е. клетки, обнаруживающие по меньшей мере 50% восстановление реакций на серотонин после удаления соединений. Несмотря на это, восстановление из-за действий лекарственных средств не всегда было 100% из-за снижения в некоторых клетках (10% на протяжении 10 мин). В случае присутствия такой факт всегда компенсировался посредством базирования% антагонизма при каждой концентрации как на контроле, так и возврате, и допущения линейного хода времени для этого снижения. Все антагонисты оценивали при блокаде в стационарном состоянии с 3-6 концентрациями по меньшей мере на пяти клетках. Равновесную блокаду достигали с применением 2-5 агонистов в зависимости от концентрации антагониста.In vivo Противосудорожная активность Самок мышей NMR (18-28 г), помещенных по 5 штук в клетки, использовали для испытаний на максимальный электрошок (MES) и ослабление двигательной способности. Всех животных содержали в режиме воды и корма ad libitum при 12-часовом цикле свет-темнота (свет включали в 6 ч до полудня) и при регулируемой температуре (200,5 С). Все эксперименты проводили между 10 ч до полудня и 5 ч после полудня. Испытуемые агенты инъецировали внутрибрюшинным (i.p.) способом за 30 мин перед индуцированном судорог, если не оговорено особо (см. ниже). Все соединения растворяли в 0,9% солевом растворе.- 22007098 Испытание MES проводили вместе с испытаниями на миорелаксантное действие (рефлекс на мышечную тягу) и согласованную мышечную координацию (вращающийся стержень). Для испытания на рефлекс на мышечную тягу мышей помещали их передними лапами на горизонтальный стержень и требовали, чтобы они поместили все 4 лапы на проволоку в течение 10 с. Для испытания на атаксию (согласованную мышечную координацию) мышей помещали на стержень с ускоряющимся вращением и требовали, чтобы они оставались на стержне в течение 1 мин. Считалось, что только мыши, не достигшие критерия во всех трех повторах каждого испытания, проявляют миорелаксацию или атаксию соответственно. За этими испытаниями следовали испытания MES (200 Гц, продолжительность шока 0,5 с, интенсивность шока 50 мА и продолжительность импульса 0,9 мс, Ugo Basile). Присутствие тонических судорог оценивали в баллах (тоническое вытягивание задних лапок с минимальным углом относительно тела 90). Целью испытания было получение ЕD50 для всех оцененных параметров (противосудорожная активность и моторные побочные действия) с использованием критерия Litchfield Wilcoxon для квантальных дозовых ответов. Деление ED50 для побочных действий (атаксия или миорелаксация) на ЕD50 для антагонизма электрошоковых судорог использовали в качестве терапевтического индекса (TI). Статистический анализIC50 в исследованиях пэтч-клампа и связывания вычисляли по логистическому уравнению с четырьмя параметрами с использованием компьютерной программы Grafit (Erithacus Software, England). Величину Ki для исследований связывания затем определяли по Cheng и Prusoff. Представленные величины связывания являются средними значениямиSEM (средняя ошибка среднего) 3-5 определений(каждое проводили в двух повторностях). 4-7 доз антагонистов испытывали в каждом их испытаний in vivo (5-8 животных на дозу), чтобы провести вычисление ступенчатых ED50 по пробит-анализу (Litchfield and Wilicoxon) с коррекцией для 0100% действий. ED50 представляли с 95% границами доверительного интервала (CI). Для сравнения активностей in vitro и противосудорожной активности in vivo использовали корреляционный анализ смешанного момента Pearson (Sigma Stat, Jandel Scientific). Результаты Номера MRZ Номера MRZ использовали для обозначения химических названий. Номера MRZ и их соответствующие химические названия показаны в списке MRZ и перекрестно упоминаются в примерах. Список MRZ Результаты для репрезентативных соединений представлены на фиг. 1. Экспрессия подтипа рецептора NMDA в ооцитах XENOPUS Блокирование рецептора NMDA посредством MRZ 2/1010 определяли нанесением различных концентраций (от 0,3 до 30 мкМ в режиме log 3-дозирования) в течение 10 с при непрерывном присутствии глутамата (100 мкМ) и глицина (10 мкМ) при -70 мВ в течение 100 с в ооциты Xenopus, экспрессирующие NR1a/2A-рецепторы (фиг. 2, левая). Активность MRZ 2/1010 (IС 50=0,76 мкМ, Hill 0,63) определяли построением графика зависимости процентного блокирования от концентрации антагониста и затем подгонкой кривой в соответствии с логистическим уравнением (фиг. 2, правая).In vivo Противосудорожная активность Результаты действия MES и миорелоксанта представлены в табл. 6. Таблица 6 В заключение, из указанного выше очевидно, что настоящее изобретение предлагает новые, ценные и непредсказуемые применения и использования соединений настоящего изобретения, причем эти соединения включают активные соединения настоящего изобретения, а также их новые фармацевтические композиции и способы их получения и лечения ими, причем все указанные выше соединения и их препараты имеют более конкретно перечисленные характеристики и преимущества. Высокая степень активности активного агента настоящего изобретения и его композиций, подтверждаемая указанными испытаниями, свидетельствует о пригодности их, основанной на ценной активности, для людей, а также более низших животных. Клиническая оценка на людях, однако, не была полной. Легко можно понять, что распространение и маркетинг любого соединения или композиции, включаемой в объем настоящего изобретения с целью использования их для лечения людей, конечно, должны быть утверждены после предварительного утверждения правительственными учреждениями, такими как U.S.Federal Food и Drug Administration, которые являются ответственными за вынесение решения по таким вопросам и санкционируют такое решение. Заключение Описанные азабициклические, азатрициклические и азаспироциклические производные аминоциклогексанов представляют собой новый класс системно активных, неконкурентных антагонистов рецептора NMDA с быстрой кинетикой блокирование/деблокирование и сильной зависимостью от напряжения. С точки зрения их умеренной активности и связанной с этим быстрой кинетикой они могут быть полезными терапевтическими средствами в широком диапазоне нарушений ЦНС, которые включают нарушения глутаматергической трансмиссии. Соответственно, эти соединения находят применение при лечении следующих нарушений у животного, особенно человека. 1. Эксцитотоксичность, такая как ишемия во время удара, травма, гипоксия, гипогликемия, глаукома и печеночная энцефалопатия. 2. Хронические нейродегенеративные заболевания, такие как болезнь Альцгеймера, васкулярная деменция, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз, амиотрофический боковой склероз, СПИД-нейродегенерация, оливопонтоцеребральная атрофия, синдром Туретта, моторное нейронное заболевание, митохондриальная дисфункция, корсаковский синдром, болезнь КрейтцфельдаЯкоба. 3. Другие нарушения, относящиеся к долгосрочным пластичным изменениям в центральной нервной системе, выбранные из хронической боли, толерантности к лекарственному средству, зависимости и привыкания к нему (к опиоидам, кокаину, бензодиазепинам, никотину и алкоголю). 4. Эпилепсия, поздняя дискинезия, шизофрения, тревога, депрессия, острая боль, мышечная спастичность и шум в ушах. Кроме того, обнаружено, что эти соединения являются антагонистами нейронных никотиновых рецепторов, а также рецепторов 5-НТ 3. Таким образом, соединения изобретения находят применение при лечении нарушений в организме животного, особенно человека, при показаниях, опосредованных как никотиновым рецептором, так и рецептором 5-НТ 3, как для симптоматических, так и для нейрозащитных целей (например, рвоты, никотинового привыкания, шизофрении, церебрального тремора, IBS, мигрени,депрессивных нарушений, нарушений познавательной способности, психозов, связанных с лечением болезни Паркинсона и нарушений аппетита). Кроме того, как уже указывалось, вследствие, по меньшей мере, частично их аминного заместителя соединения настоящего изобретения являются также эффективными при показаниях, не относящимся к вышеуказанному механизму действия, проявляя иммуномодуляторную активность, антималярийную и антитрипаносомную активность, антивирусную активностью (против вируса Воrnа), действие против простого герпеса и активность против вируса гепатита С. Способ лечения животного соединением изобретения для ингибирования у него развития или ослабления выбранного заболевания, является, как ранее указывалось, любым обычно приемлемым фармацевтическим путем, использующим выбранную дозу, которая является эффективной при ослаблении определенного заболевания, которое нужно ослабить. Применение соединений настоящего изобретения при изготовлении лекарственного средства для лечения животного с целью ингибирования развития или ослабления выбранных заболеваний или состояний, особенно заболеваний или состояний, восприимчивых к лечению антагонистом рецептораNMDA, антагонистом нейронного никотинового рецептора, антагонистом 5 НТ 3 или соединением, проявляющим иммуномодуляторную активность, антималярийную и антитрипаносомную активность, антивирусную активность (против вируса Воrnа), действие против простого герпеса и активность против вируса гепатита С проводят обычным образом, включающим стадию смешивания эффективного количества соединения изобретения с фармацевтически приемлемым разбавителем, эксципиентом или носителем. Описан также способ лечения, фармацевтические композиции и применение соединения настоящего изобретения при изготовлении лекарственного средства. Репрезентативные фармацевтические композиции, полученные смешиванием активного ингредиента с подходящим фармацевтически приемлемым эксципиентом, разбавителем или носителем, включают таблетки, капсулы, растворы для инъекции, жидкие пероральные композиции, аэрозольные композиции,TDS-композиции и композиции наночастиц, которые, таким образом, являются лекарственными средствами для перорального, инъецируемого или кожного применения, также в соответствии с вышеизложенным. Ссылки 1. R.L. Frank, H.K. Hall (1950) J. Am. Chem. Soc. 72: 1645-1648. 2. G.A. Hiegel, P. Burk. (1973) J. Org. Chem. 38: 3637-3639. 3. N.F. Firrell, P.W. Hickmott. (1970) J. Chem. Soc. C: 716-719. 4. G.H. Posner, L.L. Frye. (1984) Isr. J. Chem. 24: 88-92. 5. G.L. Lemiere, Т.A. van Osselaer, F.C. Anderweireldt. (1978) Bull. Soc. Chim. Belg. 87: 771-782. 6. H.O. House, J.M. Wilkins. (1976) J. Org. Chem. 41: (25) 4031-4033. 7. A.R. Greenaway, W.B. Whalley. (1976) J. Chem. Soc. P.T. 1: 1385-1389. 8. S. Matsuzawa, Y. Horiguchi, E. Nakamura, I. Kuwajima. (1989) Tetrahedron 45: (2) 349-362. где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, С 2-6-алкенильных групп, С 2-6 алкинильных групп, С 6-12-арил-С 1-4-алкильных групп, необязательно замещенных С 6-12-арильных групп и в случае R и R2-R5 - из атомов водорода, с условием, что по меньшей мере один из R2 и R3 и по меньшей мере один из R4 и R5 не является водородом, или R и R1 вместе представляют С 3-5-алкиленовую или алкениленовую группу, причем R2-R5 имеют указанные выше значения;Y представляет собой СН иZ представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно; и их оптические изомеры и фармацевтически приемлемые кислотно- и основно-аддитивные соли. 2. Соединение по п.1, представляющее собой 1,экзо-3,5-триметил-6-азабицикло[3,2,1]октан и его гидрохлорид; 5-этил-1,экзо-3-диметил-6-азабицикло[3,2,1]октан и его гидрохлорид; экзо-3-этил-1,5-диметил-6-азабицикло[3,2,1]октан и его гидрохлорид; 1,3,3,5-тетраметил-6-азабицикло[3,2,1]октан и его гидрохлорид; 1,3,3,5,6-пентаметил-6-азабицикло[3,2,1]октан и его гидрохлорид; 5-этил-1,3,3-триметил-6-азабицикло[3,2,1]октан и его гидрохлорид; 1,экзо-3,5-экзо,эндо-7-тетраметил-6-азабицикло[3,2,1]октан и его гидрохлорид; 1,экзо-3,5-триметил-экзо,эндо-7-фенил-6-азабицикло[3,2,1]октан и его гидрохлорид; 1,5,экзо-7-триметил-2-азабицикло[3,3,1]нонан и его гидрохлорид; 7,7,9,9-тетраметил-1-азаспиро[4,5]декан и его гидрохлорид; 8,8,10,10-тетраметил-1-азаспиро[5,5]ундекан и его гидрохлорид и 8,10,10-триметил-6-азатрицикло[6,3,1,01,6]додекан и его гидрохлорид. 3. Фармацевтическая композиция, содержащая соединение по п.1 или 2, в комбинации с одним или несколькими фармацевтически приемлемыми разбавителями, эксципиентами или носителями. 4. Применение соединения формулы (1) где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, С 2-6-алкенильных групп, С 2-6 алкинильных групп, С 6-12-арил-С 1-4-алкильных групп, необязательно замещенных С 6-12-арильных групп, и в случае R и R2-R5 - из атомов водорода, или R и R1 вместе представляют С 3-5-алкиленовую или алкениленовую группу, причем, R2-R5 имеют указанные выше значения;Y представляет собой СН иZ представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно; или их оптических изомеров, или фармацевтически приемлемых кислотно- и основно-аддитивных солей в качестве иммуномодуляторного, антималярийного, антивирусного (против вируса Воrnа), антигепатитного (против гепатита С), антитрипаносомного или анти-HSV (против вируса простого герпеса) лекарственного средства или лекарственного средства для облегчения состояния, которое можно лечить антагонистом рецептора NMDA, 5 НТ 3 или нейронного никотинового рецептора. 5. Применение по п.4, где указанным состоянием, которое можно лечить антагонистом рецептораNMDA является эксцитотоксичность, выбранная из ишемии во время удара, травмы, гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии; хроническое нейродегенеративное заболевание, выбранное из болезни Альцгеймера, васкулярной деменции, болезни Паркинсона, болезни Хантингтона, рассеянного склероза, амиотрофического бокового склероза, СПИД-нейродегенерации, оливопонтоцеребральной атрофии, синдрома Туретта, моторного нейронного заболевания, митохондриальной дисфункции, корсаковского синдрома и болезни Крейтцфельда-Якоба; нарушение, относящееся к продолжительным пластичным изменениям в центральной нервной системе, выбранное из хронической боли, толерантности к лекарственному средству, зависимости от лекарственного средства и привыкания к лекарственному средству; эпилепсия; поздняя дискинезия; L-DOPA-индуцированная дискинезия; шизофрения; тревога; депрессия; острая боль; мышечная спастичность или шум в ушах. 6. Применение по п.4, где указанное состояние, которое можно лечить антагонистом рецептора 5 НТ 3, выбрано из нарушений, проявляющихся в чувстве тревоги, депрессивных нарушений, шизофрении и психоза, связанного с лечением, нарушений, проявляющихся в злоупотреблениях лекарственными средствами и алкоголем, нарушений познавательной способности, болезни Альцгеймера, болезни Паркинсона, церебрального тремора, мигрени, нарушений аппетита, синдрома воспаленного кишечника и рвоты. 7. Применение по п.4, где указанное состояние, которое можно лечить антагонистом нейронного,никотинового рецептора, выбрано из синдрома Туретта, нарушений, проявляющихся в чувстве тревоги,шизофрении, злоупотребления лекарственным средством, злоупотребления никотином, злоупотребления кокаином, дискинезии Morbus Huntington, L-DOPA-индуцированной дискинезии, нарушения гиперактивности дефицита внимания, болезни Альцгеймера, болезни Паркинсона и боли. 8. Применение соединения формулы (1) где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, С 2-6-алкенильных групп, С 2-6 алкинильных групп, С 6-12-арил-С 1-4-алкильных групп, необязательно замещенных С 6-12-арильных групп, и в случае R и R2-R5 - из атомов водорода, или R и R1 вместе представляют С 3-5-алкиленовую или алкениленовую группу, причем, R2-R5 имеют указанные выше значения;Y представляет собой СН иZ представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно; или их оптических изомеров, или фармацевтически приемлемых кислотно- и основно-аддитивных солей при изготовлении иммуномодуляторного, антималярийного, антивирусного (против вируса Воrnа),антигепатитного (против гепатита С), антитрипаносомного или анти-HSV (против вируса простого герпеса) лекарственного средства или лекарственного средства для облегчения состояния, которое можно лечить антагонистом рецептора NMDA, 5 НТ 3 или нейронного никотинового рецептора. 9. Применение по п.8, где указанным состоянием, которое можно лечить антагонистом рецептораNMDA является эксцитотоксичность, выбранная из ишемии во время удара, травмы, гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии; хроническое нейродегенеративное заболевание, выбранное из болезни Альцгеймера, васкулярной деменции, болезни Паркинсона, болезни Хантингтона, рассеянного склероза, амиотрофического бокового склероза, СПИД-нейродегенерации, оливопонтоцеребральной атрофии, синдрома Туретта, моторного нейронного заболевания, митохондриальной дисфункции, корсаковского синдрома и болезни Крейтцфельда-Якоба; нарушение, относящееся к продолжительным пластичным изменениям в центральной нервной системе, выбранное из хронической боли, толерантности к лекарственному средству, зависимости от лекарственного средства и привыкания к лекарственному средству; эпилепсия; поздняя дискинезия; L-DOPA-индуцированная дискинезия; шизофрения; тревога; депрессия; острая боль; мышечная спастичность или шум в ушах.- 27007098 10. Применение по п.8, где указанное состояние, которое можно лечить антагонистом рецептора 5 НТ 3, выбрано из нарушений, проявляющихся в чувстве тревоги, депрессивных нарушений, шизофрении и психоза, связанного с лечением, нарушений, проявляющихся в злоупотреблениях лекарственными средствами и алкоголем, нарушений познавательной способности, болезни Альцгеймера, болезни Паркинсона, церебрального тремора, мигрени, нарушений аппетита, синдрома воспаленного кишечника и рвоты. 11. Применение по п.8, где указанное состояние, которое можно лечить антагонистом нейронного,никотинового рецептора, выбрано из синдрома Туретта, нарушений, проявляющихся в чувстве тревоги,шизофрении, злоупотребления лекарственным средством, злоупотребления никотином, злоупотребления кокаином, дискинезии Morbus Huntington, L-DOPA-индуцированной дискинезии, нарушения гиперактивности дефицита внимания, болезни Альцгеймера, болезни Паркинсона и боли. 12. Способ лечения человека-субъекта или не являющегося человеком животного для достижения иммуномодуляторных, антималярийных, антивирусных (против вируса Воrnа) или анти-HSV (против вируса гепатита С) эффектов или облегчения состояния, которое можно лечить антагонистами рецептораNMDA, 5 НТ 3 или нейронного никотинового рецептора, включающий стадию введения указанному субъекту эффективного количества соединения формулы (1) где R и R1-R5, каждый независимо, выбран из C1-6-алкильных групп, C2-6-алкенильных групп, С 2-6 алкинильных групп, С 6-12-арил-С 1-4-алкильных групп, необязательно замещенных С 6-12-арильных групп, и в случае R и R2-R5 - из атомов водорода, или R и R1 вместе представляют С 3-5-алкиленовую или алкениленовую группу, причем R2-R5 имеют указанные выше значения;Y представляет собой СН иZ представляет собой валентную связь или метиленовую группу или в случае, когда R и R1 вместе представляют собой указанную алкиленовую или алкениленовую группу, Z может дополнительно представлять атомы водорода, присоединенные к Y и N соответственно,или их оптических изомеров, или фармацевтически приемлемых кислотно- и основно-аддитивных солей.
МПК / Метки
МПК: C07D 221/20, C07D 487/08, A61K 31/40, A61P 25/16, C07D 209/02, C07D 221/22, C07D 209/54, A61P 25/18
Метки: азабициклические, рецепторов, нейронных, азатрициклические, никотиновых, качестве, антагонистов, аминоциклогексана, азаспироциклические, производные, nmda
Код ссылки
<a href="https://eas.patents.su/30-7098-azabiciklicheskie-azatriciklicheskie-i-azaspirociklicheskie-proizvodnye-aminociklogeksana-v-kachestve-antagonistov-receptorov-nmda-5ht-i-nejjronnyh-nikotinovyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Азабициклические, азатрициклические и азаспироциклические производные аминоциклогексана в качестве антагонистов рецепторов nmda, 5ht и нейронных никотиновых рецепторов</a>
Предыдущий патент: Способ взаимодействия алкалоидов и применение продуктов реакции в получении лекарственных средств
Следующий патент: Сульфонилпроизводные в качестве ингибиторов гистон-деацетилазы
Случайный патент: Замороженное аэрированное кондитерское изделие и способ его получения












