Ингибиторы репликации респираторно-синцитиального вируса
Номер патента: 5027
Опубликовано: 28.10.2004
Авторы: Мерсман Катлен Петрус Мари-Жозе, Андрис Кунрад Йозеф Лодевейк Марсель, Соммен Франсуа Мария, Янссенс Франс Эдуард
Формула / Реферат
1. Соединение формулы
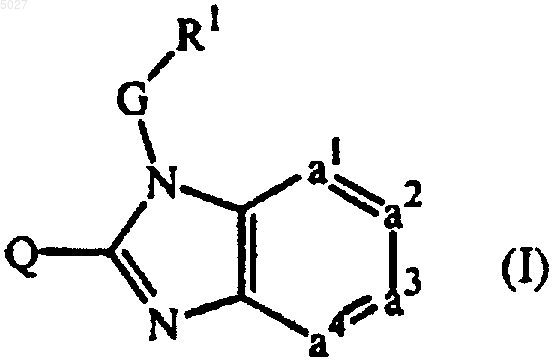
его пролекарство, N-оксид, аддитивная соль, четвертичный амин, комплекс с металлом или стереохимический изомер, где в указанной формуле
-a1=a2-a3=a4- представляет двухвалентный радикал формулы
| -CH=CH-CH=CH- | (a-1); |
| -N=CH-CH=CH- | (a-2); |
| -CH=N-CH=CH- | (a-3); |
| -CH=CH-N=CH- | (a-4) или |
| -CH=CH-CH=N- | (a-5); |
где каждый атом водорода в радикалах (a-1), (a-2), (a-3), (a-4) и (a-5) может быть, необязательно, замещен галогеном, C1-6-алкилом, нитро, амино, гидрокси, C1-6-алкилокси, полигалоген-C1-6-алкилом, карбоксилом, амино-C1-6-алкилом, моно- или ди(C1-4-алкил)амино-C1-6-алкилом, C1-6-алкилоксикарбонилом, гидрокси-C1-6-алкилом или радикалом формулы
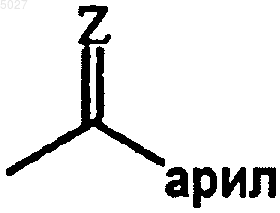
где =Z представляет собой =O, =CH-C(=O)-NR5aR5b, =CH2, =CH-C1-6-алкил, =N-OH или =N-O-C1-6-алкил;
Q представляет собой радикал формулы
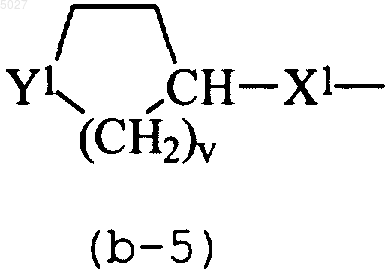
Y1 представляет собой двухвалентный радикал формулы -NR2-;
X1 представляет собой NH или CH2;
v равен 2; и
при этом каждый атом водорода в гетероцикле, указанном в радикале (b-5), может быть, необязательно, замещен R3; при условии, что когда R3 представляет собой гидрокси или C1-6-алкилокси, тогда R3 не может замещать атом водорода в положении a относительно атома азота;
G представляет собой C1-10-алкандиил, замещенный одним или несколькими гидрокси, C1-6-алкилокси, арил-C1-6-алкилокси, C1-6-алкилтио, арил-C1-6-алкилтио, HO(-CH2-CH2-O)n-, C1-6-алкилокси-(-CH2-CH2-O)n- или арил-C1-6-алкилокси(-CH2-CH2-O)n-;
R1 представляет собой, необязательно, замещенный моноциклический гетероцикл или арил, причем указанный гетероцикл выбирают из пиридила, пиразинила, пиридазинала, пиримидинила; и каждый гетероцикл может быть, необязательно, замещен 1 или, где это возможно, несколькими, например 2, 3 или 4, заместителями, выбранными из галогена, гидрокси, амино, циано, карбокси, C1-6-алкила, C1-6-алкилокси, C1-6-алкилтио, C1-6-алкилокси-C1-6-алкила, арила, арил-C1-6-алкила, арил-C1-6-алкилокси, гидрокси-C1-6-алкила, моно- или ди(C1-6-алкил)амино, моно- или ди(C1-6-алкил)амино-C1-6-алкила, полигалоген-C1-6-алкила, C1-6-алкилкарбониламино, C1-6-алкил-SO2-NR5c-, арил-SO2-NR5c-, C1-6-алкилоксикарбонила, -C(=O)-NR5cR5d, HO(-CH2-CH2-O)n-, галоген(-CH2-CH2-O)n-, C1-6-алкилокси(-CH2-CH2-O)n-, арил-C1-6-алкилокси(-CH2-CH2-O)n- и моно- или ди(C1-6-алкил)амино(-CH2-CH2-O)n-;
каждый n, независимо, равен 1, 2, 3 или 4;
R2 представляет собой водород, формил, C1-6-алкилкарбонил, Het-карбонил, пирролидинил, пиперидинил, гомопиперидинил, C3-7-циклоалкил, замещенный N(R6)2, или C1-10-алкил, замещенный N(R6)2 и, необязательно, вторым, третьим или четвертым заместителем, выбранным из амино, гидрокси, C3-7-циклоалкила, C2-5-алкандиила, пиперидинила, моно- или ди(C1-6-алкил)амино, C1-6-алкилоксикарбониламино, арила и арилокси;
R3 представляет собой водород, гидрокси, C1-6-алкил, C1-6-алкилокси, арил-C1-6-алкил или арил-C1-6-алкилокси;
R4 представляет собой водород, C1-6-алкил или арил-C1-6-алкил;
R5a, R5b, R5c и R5d представляют собой, каждый независимо, водород или C1-6-алкил; или
R5a и R5b или R5c и R5d, взятые вместе, образуют двухвалентный радикал формулы -(CH2)s-, где s равен 4 или 5;
R6 представляет собой водород, C1-4-алкил, формил, гидрокси-C1-6-алкил, C1-6-алкилкарбонил или C1-6-алкилоксикарбонил;
арил представляет собой фенил или фенил, замещенный 1 или несколькими, например 2, 3 или 4, заместителями, выбранными из галогена, гидрокси, C1-6-алкила, гидрокси-C1-6-алкила, полигалоген-C1-6-алкила и C1-6-алкилокси;
Het представляет собой пиридил,пиримидинил, пиразинил, пиридазинил.
2. Соединение по п.1, где -a1=a2-a3=a4- представляет собой радикал формулы (a-1) или (a-2).
3. Соединение по п.1 или 2, где R1 представляет собой фенил, необязательно замещенный галогеном, C1-6-алкилом или C1-4-алкокси; или пиридил, необязательно замещенный 1 или несколькими заместителями, выбранными из арил-C1-6-алкилокси, C1-6-алкилокси-C1-6-алкила, арила, моно- или ди(C1-6-алкил)амино, C(=O)-NR5cR5d, галогена или C1-6-алкила.
4. Соединение по любому из пп.1-3, где G представляет собой C1-4-алкандиил, замещенный гидрокси, C1-6-алкилокси, HO(-CH2-CH2-O)n-, C1-6-алкилокси(-CH2-CH2-O)n- или арил-C1-6-алкилокси(-CH2-CH2-O)n-.
5. Соединение по любому из пп.1-4, где R2 представляет собой водород или C1-10-алкил, замещенный NHR6, где R6 представляет собой водород или C1-6-алкилоксикарбонил.
6. Соединение по п.1, где указанное соединение представляет собой
[(A),(S)]-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]-1H-бензимидазол-2-амин;
[(A),(S)]-N-[1-(2-аминопропил)-4-пиперидинил]-1-[этокси(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амин;
(+)-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(2-метоксиэтокси)(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амин;
тригидрат тригидрохлорида N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-6-хлор-1-[(2-метоксиэтокси)(6-метил-2-пиридинил)метил]-4-метил-1H-бензимидазол-2-амина;
моногидрат [(A),(R)]-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[этокси(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амина;
(+)-N-[1-(2-аминопропил)-4-пиперидинил]-1-[этокси-(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амин;
моногидрат [(A),(S)]-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[этокси-(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амина;
(+)-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[этокси(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амин;
моногидЁрт [(A),(R)]-N-[1-(2-аминопропил)-4-пиперидинил]-1-[этокси(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амина;
(+)-N-[1-(2-аминоэтил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]-2-бензимидазол-2-амин;
(+)-N-[1-(2-аминоэтил)-4-пиперидинил]-1-[(2-этоксиэтокси)-(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амин;
моногидрат [(B),(S)]-N-[1-(2-аминопропил)-4-пиперидинил]-1-[этокси(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амина;
(+)-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-3-[(2-метоксиэтокси)(6-метил-2-пиридинил)метил]-7-метил-3H-имидазо[4,5-b]пиридин-2-амин;
(+)-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(2-этоксиэтокси)(6-фенил-2-пиридинил)метил]-1H-бензимидазол-2-амин;
(+)-N-[1-(2-аминоэтил)-4-пиперидинил]-1-[(2-метоксиэтокси)(6-метил-2-пиридинил)метил]-1H-бензимидазол-2-амин;
моногидрат (+)-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]-4-метил-1H-бензимидазол-2-амина;
[(A),(R)]-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]-1H-бензимидазол-2-амин;
(+)-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]-1H-бензимидазол-2-амин;
его пролекарство, N-оксид, аддитивную соль, четвертичный амин, комплекс с металлом и стереохимически изомерная форма.
7. Применение соединения по любому из пп.1-6 в качестве лекарственного средства.
8. Применение по п.7, где лекарственное средство является средством для лечения или профилактики вирусных инфекций.
9. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-6.
10. Способ получения композиции по п.9, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-6.
11. Промежуточное соединение формулы
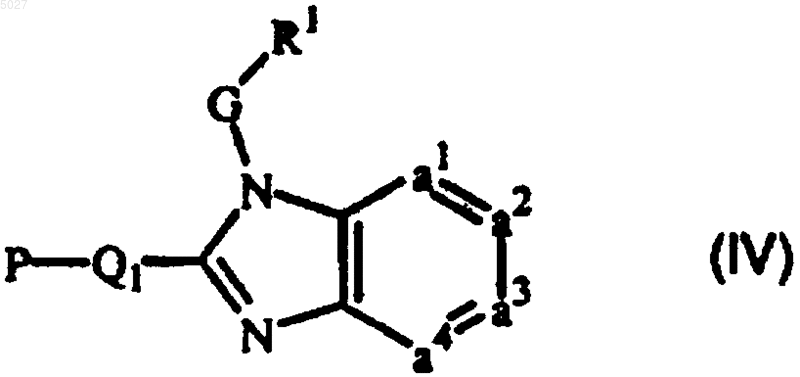
где R1, G и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем P представляет собой защитную группу, и Q1 соответствует Q по п.1, но лишенному заместителя R2 или R6.
12. Промежуточное соединение формулы
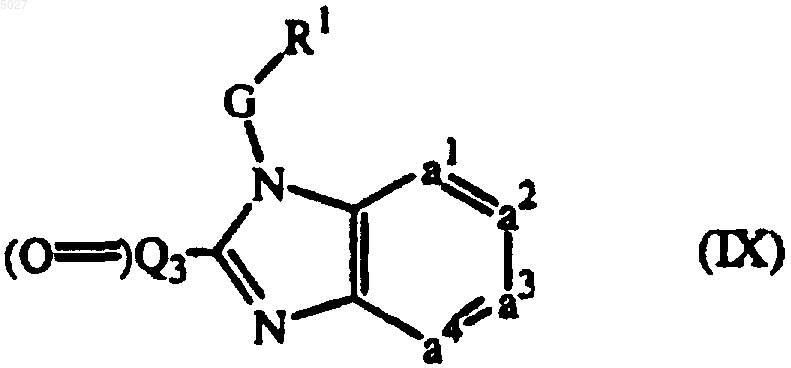
где R1, G и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем (O=)Q3 представляет собой карбонильное производное Q, и указанный Q имеет значения, указанные в п.1, при условии, что он лишен заместителя -NR2R4 или -NR2-.
13. Промежуточное соединение формулы

где R1, Q и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем (O=)G2 представляет собой карбонильное производное G, и указанный G имеет значения, указанные в п.1.
14. Способ получения соединения по п.1, отличающийся тем, что включает
аминирование промежуточного соединения формулы (IX)
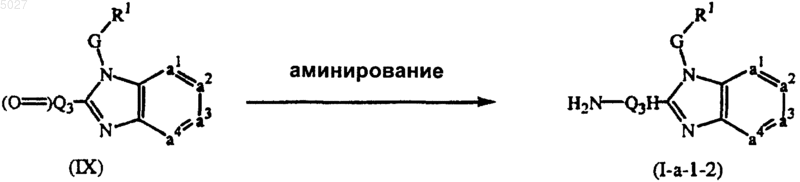
где R1, G и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем H2N-Q3H соответствует Q по п.1, при условии, что оба заместителя R6 представляют собой водород, или оба заместителя R2 и R4 представляют собой водород, и атом углерода, соседний с атомом азота, к которому присоединяются заместители R6 или R2 и R4, содержит по меньшей мере один водород, в присутствии подходящего агента аминирования;
и, при необходимости, превращение соединений формулы (I) друг в друга согласно известным в технике способам трансформации и затем, при необходимости, превращение соединения формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты путем обработки кислотой или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием или, напротив, превращение формы аддитивной соли кислоты в свободное основание путем обработки щелочью или превращение формы аддитивной соли основания в свободную кислоту путем обработки кислотой; и, при необходимости, получение его стереохимически изомерных форм, комплексов с металлами, четвертичных аминов или N-оксидных форм.
15. Продукт, содержащий (a) соединение по п.1 и (b) другое антивирусное соединение, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении или предупреждении вирусных инфекций.
16. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, (a) соединение по п.1 и (b) другое антивирусное соединение.
Текст
1 Настоящее изобретение относится к бензимидазолам и имидазопиридинам, обладающим антивирусной активностью, в частности такие соединения обладают ингибирующей активностью в отношении репликации респираторно-синцитиального вируса. Изобретение также относится к получению таких соединений и содержащим их композициям, а также к их применению в качестве лекарственных средств.RSV, или респираторно-синцитиальный вирус человека, является большим РНКвирусом - членом семейства Paramyxoviridae,подсемейство Pneumovirinae, наряду с бычьим вирусом RSV. RSV человека ответственен за ряд заболеваний дыхательных путей у людей всех возрастов во всем мире. Он является главной причиной болезней нижних дыхательных путей в младенчестве и детстве. Свыше половины всех младенцев сталкиваются с RSV на первом году жизни и почти все в течение первых 2 лет. Заражение в раннем детстве может вызвать повреждение легких, которое сохраняется на протяжении многих лет и может внести вклад в хроническую болезнь легких в старческие годы(хроническое затруднение дыхания, астма). Дети старшего возраста и взрослые после RSVинфекции часто страдают от (сильного) насморка. В пожилом возрасте чувствительность снова повышается, и RSV влечет за собой многочисленные вспышки пневмонии у престарелых,приводящие к существенной смертности. Заражение вирусом данной подгруппы не защищает от последующего заражения изолятом RSV из той же подгруппы в следующий зимний сезон. Таким образом, повторное заражение RSV является обычным, несмотря на существование только двух подтипов А и В. В настоящее время для применения противRSV-инфекции одобрены только три лекарственных средства. Нуклеозидный аналог рибавирин обеспечивает аэрозольное лечение госпитализированных детей в случае тяжелой RSVинфекции. Аэрозольный способ введения, токсичность (опасность тератогенности), стоимость и весьма переменная эффективность ограничивают его применение. Два других лекарственных средства - RespiGam и паливизумаб, иммуностимуляторы на основе поликлональных и моноклональных антител, предназначаются для применения при профилактике. Все другие попытки разработать безопасную и эффективную вакцину против RSV до сих пор терпели неудачу. Инактивированные вакцины не защищают от заболевания, а в действительности в некоторых случаях усиливают болезнь во время последующего заражения. Живые ослабленные вакцины испытываются с ограниченным успехом. Ясно, что существует необходимость в эффективном нетоксичном и легком для введения лекарственном средстве против репликации RSV. 2 В ЕР-А-0005318, ЕР-А-0099139, ЕР-А 0145037, ЕР-А-0144101, ЕР-А-0151826, ЕР-А 0151824, ЕР-А-0232937, ЕР-А-0295742, ЕР 0297661, ЕР-А-0307014, WO 92 01697 в качестве антигистаминных средств, антиаллергических средств или антагонистов серотонина описываются бензимидазол- и имидазопиридинзамещенные производные пиперидина и пиперазина. Настоящее изобретение относится к соединениям формулы (I) его пролекарствам, N-оксидам, аддитивным солям, четвертичным аминам, комплексам с металлами и стереохимическим изомерным формам, где в указанной формуле -a1=a2-a3=a4 представляет двухвалентный радикал формулы-CH=CH-CH=N(а-5); где каждый атом водорода в радикалах (а-1), (а-2),(а-3), (а-4) и (а-5) может быть, необязательно,замещен галогеном, C1-6-алкилом, нитро, амино,гидрокси, C1-6-алкилокси, полигалоген-С 1-6-алкилом, карбоксилом, амино-С 1-6-алкилом, моноили ди(C1-4-алкил)амино-С 1-6-алкилом, C1-6-алкилоксикарбонилом, гидрокси-С 1-6-алкилом или радикалом формулыQ представляет собой радикал формулыY1 представляет собой двухвалентный радикал формулы -NR2-;v равен 2; и при этом каждый атом водорода в гетероцикле, указанном в радикале (b-5), может быть,необязательно, замещен R3; при условии, что когда R3 представляет собой гидрокси или C1-6-алкилокси, тогда R3 не может замещать атом водорода в положенииотносительно атома азота;G представляет собой C1-10-алкандиил, замещенный одним или несколькими гидрокси,C1-6-алкилокси, арил-С 1-6-алкилокси, C1-6-алкилтио, арил-С 1-6-алкилтио, НО(-СН 2-СН 2-O)n-, C1-6 алкилокси-(-СН 2-СН 2-О)n- или арил-С 1-6-алкилокси (-СН 2-СН 2-О)n-;R1 представляет собой необязательно замещенный моноциклический гетероцикл или арил, причем указанный гетероцикл выбирают из пиридила, пиразинила, пиридазинала, пиримидинила; и каждый гетероцикл может быть,необязательно, замещен 1 или, где это возможно, несколькими, например 2, 3 или 4, заместителями, выбранными из галогена, гидрокси,амино, циано, карбокси, C1-6-алкила, C1-6-алкилокси, C1-6-алкилтио, С 1-6-алкилокси-С 1-6-алкила,арила, арил-С 1-6-алкила, арил-С 1-6-алкилокси,гидрокси-С 1-6-алкила, моно- или ди(C1-6-алкил) амино, моно- или ди(C1-6-алкил)амино-С 1-6-алкила,полигалоген-С 1-6-алкила, C1-6-алкилкарбониламино,C1-6-алкил-SO2-NR5c-, арил-SO2-NR5c-, C1-6-алкилоксикарбонила, -С(=O)-NR5cR5d, НО(-СН 2-СН 2-O)n-,галоген(-СН 2-СН 2-O)n-, C1-6-алкилокси(-СН 2-СН 2-O)n-,арил-С 1-6-алкилокси(-СН 2-СН 2-O)n- и моно- или ди(С 1-6-алкил)амино(-СН 2-СН 2-O)n-; каждый n, независимо, равен 1, 2, 3 или 4;R2 представляет собой водород, формил,C1-6-алкилкарбонил, Het-карбонил, пирролидинил,пиперидинил, гомопиперидинил, С 3-7-циклоалкил, замещенный N(R6)2, или C1-10-алкил, замещенный N(R6)2 и, необязательно, вторым, третьим или четвертым заместителем, выбранным из амино, гидрокси, С 3-7-циклоалкила, С 2-5-алкандиила, пиперидинила, моно- или ди(C1-6-алкил) амино, C1-6-алкилоксикарбониламино, арила и арилокси;R5a и R5b или R5c и R5d, взятые вместе, образуют двухвалентный радикал формулы -(CH2)s-,где s равен 4 или 5;R6 представляет собой водород, C1-4-алкил,формил, гидрокси-C1-6-алкил, C1-6-алкилкарбонил или C1-6-алкилоксикарбонил; арил представляет собой фенил или фенил,замещенный 1 или несколькими, например 2, 3 или 4, заместителями, выбранными из галогена,гидрокси, C1-6-алкила, гидрокси-С 1-6-алкила, полигалоген-С 1-6-алкила и C1-6-алкилокси;"пролекарство" обозначает фармакологически приемлемые производные, например сложные эфиры и амиды, такие, что получающийся при биотрансформации этого производного продукт представляет собой активное лекарственное средство, указанное в определении соединений формулы (I). В общих чертах, пролекарства описываются в работе Goodman and Gilman (TheDrugs", p. 13-15), включенной в настоящее описание в качестве ссылки. Используемое здесь для группы или части группы обозначение "C1-3-алкил" относится к линейным или разветвленным насыщенным углеводородным радикалам с 1-3 атомами углерода, таким как метил, этил, пропил, 1 метилэтил и т.п.; обозначение для группы или части группы "C1-4-алкил" определяет линейные или разветвленные насыщенные углеводородные радикалы с 1-4 атомами углерода, такие как группы, указанные в случае C1-3-алкила, и бутил и т.п.; "С 2-4-алкил" как группа или часть группы обозначает линейные или разветвленные насыщенные углеводородные радикалы с 2-4 атомами углерода, такие как этил, пропил, 1 метилэтил, бутил и т.п.; "C1-6-алкил" как группа или часть группы обозначает линейные или разветвленные насыщенные углеводородные радикалы с 1-6 атомами углерода, такие как группы,указанные в случае C1-4-алкила, и пентил, гексил, 2-метилбутил и т.п.; "C1-9-алкил" как группа или часть группы обозначает линейные или разветвленные насыщенные углеводородные радикалы с 1-9 атомами углерода, такие как группы,указанные в случае C1-6-алкила, и гептил, октил,нонил, 2-метилгексил, 2-метилгептил и т.п.;"C1-10-алкил" как группа или часть группы обозначает линейные или разветвленные насыщенные углеводородные радикалы с 1-10 атомами углерода, такие как группы, указанные в случаеC1-9-алкила, и децил, 2-метилнонил и т.п.; "С 3-7 циклоалкил" является общим обозначением циклопропила, циклобутила, циклопентила,циклогексила и циклогептила; обозначение "С 2-5 алкандиил" относится к двухвалентным линейным или разветвленным насыщенным углеводородным радикалам с 2-5 атомами углерода,таким как, например, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил, 1,5-пентандиил, и т.п., для C2-5-алкандиила, являющегося заместителем при C1-10 алкиле, как указано при определении R2, подразумевается, что он является заместителем при 1 атоме углерода, образуя тем самым циклическую часть; "C1-4-алкандиил" обозначает двухвалентные линейные или разветвленные насыщенные углеводородные радикалы с 1-4 атомами углерода, такие как, например, метилен, 1,2 этандиил, 1,3-пропандиил, 1,4-бутандиил и т.п.;"C1-6-алкандиил" обозначает C1-4-алкандиил и его высшие гомологи с 5-6 атомами углерода,такие как, например, 1,5-пентандиил, 1,6 гександиил, и т.п.; "C1-10-алкандиил" обозначаетC1-6-алкандиил и его высшие гомологи с 7-10 атомами углерода, такие как, например, 1,7 гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10 декандиил, и т.п. Использующееся выше обозначение "(=O)" относится к карбонильной группе в случае присоединения к атому углерода, сульфоксидной группе в случае присоединения к атому серы и 5 сульфонильной группе в случае соединения с атомом серы двух указанных обозначений. Обозначение "(=N-OH)" относится к гидроксилиминной группе в случае присоединения к атому углерода. Термин "галоген" является общим для фтора, хлора, брома и иода. Используемое в описании выше и ниже обозначение "полигалоген-С 1-6-алкил" для группы или части группы является определением моно- или полигалогензамещенного C1-6-алкила, в частности метила,замещенного 1 или несколькими атомами фтора, например дифторметила или трифторметила. В случае присоединения к алкильной группе свыше 1 атома галогена в рамках определения"полигалоген-С 1-4-алкил" они могут быть одинаковыми или различными. Когда любой изменяющийся заместитель(например, арил, R2, R3, R4, R5a, R5b и т.д.) встречается в любой группе более 1 раза, каждое значение является независимым. Следует иметь в виду, что некоторые соединения формулы (I) и их пролекарства, Nоксиды, аддитивные соли, четвертичные амины,комплексы с металлами и стереохимически изомерные формы могут содержать один или несколько центров хиральности и существуют в стереохимически изомерных формах. Используемый здесь термин "стереохимически изомерные формы" определяет все возможные стереоизомерные формы, которыми могут обладать соединения формулы (I) и их пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами или физиологически функциональные производные. Если нет иных указаний или определений, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, а также каждую отдельную изомерную форму соединений формулы (I) и их пролекарств, N-оксидов, солей,сольватов, четвертичных аминов, по существу, в свободном виде, т.е. ассоциированную менее чем с 10%, предпочтительно менее чем с 5%, в частности менее чем с 2%, и наиболее предпочтительно менее чем с 1% других изомеров. Очевидно, что стереохимически изомерные формы соединений формулы (I) входят в объем данного изобретения. Используемые здесь значения "S" и "R" хорошо известны специалистам в этой области техники. Для некоторых соединений формулы (I),их пролекарств, N-оксидов, солей, сольватов,четвертичных аминов или комплексов с металлами и промежуточных соединений, используемых при их получении, абсолютная стереохимическая конфигурация экспериментально не определялась. В этих случаях стереозиомерная форма, которую выделяли первой, называют 6 к фактической стереохимической конфигурации. Однако указанные стереоизомерные формы "А" и "В" можно однозначно охарактеризовать, например, с помощью их оптического вращения, в случае энантиомерного соотношения "А" и "В". Специалист в этой области техники может определить абсолютную конфигурацию таких соединений с использованием методов, известных в технике, таких как, например, рентгенография. В случае, когда "А" и "В" являются стереоизомерными смесями, их можно далее разделить, при этом соответствующие первые выделенные фракции обозначают "А 1" и"В 1", а вторые - "А 2" и "В 2", без дальнейшего обращения к фактической стереохимической конфигурации. Солями соединений формулы (I) для терапевтического применения являются соли, где противоион является фармацевтически приемлемым. Однако солям кислот и оснований, которые не являются фармацевтически приемлемыми, также можно найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, входят в сферу действия настоящего изобретения. Фармацевтически приемлемые аддитивные соли кислот и оснований, как указано выше,включают терапевтически активные нетоксичные формы аддитивных солей кислот и оснований, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые аддитивные соли кислот удобно получать путем обработки основной формы подходящей кислотой. Подходящими кислотами являются, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлороводородная или бромоводородная кислота, серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная,пировиноградная, щавелевая (т.е. этандиовая),малоновая, янтарная (т.е. бутандиовая), малеиновая, фумаровая, яблочная (т.е. гидроксибутандиовая), винная, лимонная, метансульфоновая,этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. И наоборот, указанные солевые формы можно превратить в форму свободного основания путем обработки соответствующим основанием. Соединения формулы (I), содержащие кислотный протон, также можно превратить в их нетоксичные солевые формы с металлами или аддитивные солевые формы с аминами путем обработки подходящими органическими и неорганическими основаниями. Подходящими солевыми формами являются, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например литиевые, натриевые, ка 7 лиевые, магниевые, кальциевые соли и т.п., соли органических оснований, например соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли аминокислот, таких как, например, аргинин, лизин и т.п. Используемый здесь термин "аддитивные соли" также включает сольваты, которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются,например, гидраты, алкоголяты и т.п. Используемый здесь термин "четвертичный амин" определяет четвертичные соли аммония, которые соединения формулы (I) могут образовывать путем взаимодействия основного азота соединения формулы (I) и подходящего агента кватернизации, такого как, например,необязательно замещенный алкилгалогенид,арилгалогенид или арилалкилгалогенид, например метилиодид или бензилиодид. Также можно использовать другие реагенты с легко уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-птолуолсульфонаты. Четвертичный амин содержит положительно заряженный азот. Фармацевтически приемлемыми противоионами являются хлор-, бром-, иод-, трифторацетат- и ацетат-ион. Выбранный противоион можно ввести с использованием ионообменных смол. Следует иметь в виду, что соединения формулы (I) могут обладать свойствами связывания металлов, хелатообразования и комплексообразования и, следовательно, могут существовать в виде комплексов или хелатов с металлами. Подразумевается, что такие металлированные производные соединений формулы (I) входят в объем настоящего изобретения. Некоторые соединения формулы (I) также могут существовать в своих таутомерных формах. Подразумевается, что такие формы, хотя они точно не указаны в приведенной выше формуле, входят в объем настоящего изобретения. Особую группу соединений составляют соединения формулы (I), к которым применимо одно или несколько следующих ограничений:R6 представляет собой водород, C1-4-алкил,формил, C1-6-алкилкарбонил или C1-6-алкилоксикарбонил. Также интересную группу соединений составляют соединения формулы (I), где применимы одно или несколько следующих ограничений:-a1=a2-a3=a4- представляет собой радикал формулы (а-1) или (а-2);R2 представляет собой C1-10-алкил, замещенный NHR6, где R6 представляет собой водород или C1-6-алкилоксикарбонил. Особыми соединениями являются соединения формулы (I), где R2 представляет собойC1-10-алкил, замещенный NH2. Другими особыми соединениями являются соединения формулы (I), где G представляет собой метилен или 1,2-этандиил, замещенные гидрокси, C1-6-алкилокси, НО(-СН 2-СН 2-О)n-, C1-6 алкилокси(-СН 2-СН 2-O)n- или арил-С 1-6-алкилокси(-СН 2-СН 2-О)n-. Также особыми соединениями являются соединения формулы (I), где R1 представляет собой пиридил, предпочтительно 2-пиридил,замещенный 1 или 2 заместителями, выбранными из галогена, гидрокси, амино, циано, карбокси, C1-6-алкила, C1-6-алкилокси, C1-6-алкилтио,C1-6-алкилокси-С 1-6-алкила, арила, арил-С 1-6 алкила, арил-С 1-6-алкилокси, гидрокси-С 1-6-алкила, моно- или ди(С 1-6-алкил)амино, моно- или ди(C1-6-алкил)амино-С 1-6-алкила, полигалогенС 1-6-алкила, C1-6-алкилкарбониламино, C1-6-aлкил-SO2-NR5 с-, apил-SO2-NR5c-, C1-6-алкилоксикарбонила, -С(=O)-NR5cR5d, НО(-СН 2-СН 2-O)n-,галоген(-СН 2-СН 2-O)n-, C1-6-алкилокси(-СН 2-СН 2O)n-, арил-С 1-6-алкилокси(-СН 2-СН 2-O)n- и моноили ди(C1-6-алкил)амино(-СН 2-СН 2-O)n-, предпочтительно,выбранными из арил-С 1-6 алкилокси, С 1-6-алкилокси-С 1-6-алкила, арила,моно- или ди(C1-6-алкил)амино-С 1-6-алкила,-С(=O)-NR5cR5d, галогена или C1-6-алкила. Предпочтительными соединениями являются соединения формулы (I), где R1 представляет собой необязательно замещенную 2-пиридильную группу, в частности 2-пиридильную, 6 замещенную 2-пиридильную или 3,6-замещенную 2-пиридильную группу. Предпочтительными соединениями являются-N-[1-(2-аминоэтил)-4-пиперидинил]-1[(2-метоксиэтокси)(6-метил-2-пиридинил)метил]-1 Н-бензимидазол-2-амин (соединение 82); их пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы. Наиболее предпочтительны моногидрат -N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(6-бром-2-пиридинил) этоксиметил]-4-метил-1 Н-бензимидазол-2-амина (соединение 87);-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]-1 Н-бензимидазол-2-амин (соединение 10); их пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы. В целом, соединения формулы (I) можно получить посредством взаимодействия проме 005027 10 жуточного соединения формулы (II-а) или (II-b),где Р представляет защитную группу, такую как,например, C1-4-алкилоксикарбонил, или защитные группы, указанные в главе 7 в "ProtectiveWuyts (John WileySons Inc., 1991), с промежуточным соединением формулы (III), где W1 представляет собой подходящую удаляемую группу, такую как атом галогена, например хлора, брома, в присутствии подходящего основания, такого как, например, гидрид натрия. Указанное взаимодействие можно осуществить в растворителе, инертном для реакции, таком как Соединения формулы (I), где, при определении Q, R2 или, по меньшей мере, 1 заместитель R6 представляет собой водород, причем указанный Q соответствует H-Q1, и указанные соединения изображаются формулой (I-а), можно получить, удаляя защитную группу из промежуточного соединения формулы (IV), где Р представляет защитную группу, например C1-4 алкилоксикарбонил, бензил или защитные группы, указанные в главе 7 в "Protective Groups Когда Р представляет, например, C1-4-алкилоксикарбонил, указанную реакцию удаления защитной группы можно осуществить, например, как кислотный гидролиз в присутствии подходящей кислоты, такой как бромоводородная, хлороводородная, серная, уксусная или трифторуксусная кислота, или смеси таких кислот, или как щелочной гидролиз в присутствии подходящего основания, такого как, например,гидроксид калия, в подходящем растворителе,таком как вода, спирт или водно-спиртовая смесь, метиленхлорид. Подходящими спиртами являются метанол, этанол, 2-пропанол, 1 бутанол и т.п. Для того чтобы повысить скорость такой реакции, выгодно нагревать реакционную смесь, в частности, до температуры кипения. С другой стороны, когда имеется Р,например бензил, реакцию удаления защитной 11 группы можно осуществить путем каталитического гидрирования в присутствии водорода и подходящего катализатора в растворителе,инертном для реакции. Подходящим катализатором для указанной выше реакции является,например, платина-на-угле, палладий-на-угле и т.п. Подходящим инертным растворителем для указанной реакции является, например, спирт,например метанол, этанол, 2-пропанол и т.п.,сложный эфир, например этилацетат и т.п., кислота, например уксусная кислота и т.п. Описанную выше реакцию каталитического гидрирования также можно использовать для получения соединения формулы (I-а) через удаление защитной группы и восстановление промежуточного соединения формулы (IV), где Q1 содержит ненасыщенную связь, причем указанный Q1 соответствует Q1a(CH=CH), и указанное промежуточное соединение изображается формулой (IV-a). Соединения формулы (I), где, при определении Q, оба заместителя R6 представляют собой водород или оба заместителя R2 и R4 представляют собой водород, причем указанный Q соответствует H2N-Q2, и указанные соединения изображаются формулой (I-a-1), также можно получить посредством удаления защитной группы из промежуточных соединений формулы (V). Указанную реакцию удаления защитной группы можно осуществить в присутствии подходящего основания, такого как, например, гидразин, или в присутствии подходящей кислоты,такой как, например, хлороводородная кислота и т.п., в подходящем растворителе, таком как спирт, уксусная кислота и т.п. Соединения формулы (I-a-1) также можно получить посредством удаления защитной группы из промежуточных соединений формулы (VI) в соответствии с методикой, описанной для получения соединений формулы (I-a).Q1 или Q2 содержат гидроксизаместитель, причем указанные Q1 или Q2 соответствуют Q1'(ОН) или Q2'(ОН), и указанные соединения изображаются формулой (I-а-2) или (I-a-1-1), можно получить посредством удаления защитной группы из промежуточных соединений форму 005027 12 лы (VII) или (VIII), как описано выше для получения соединений формулы (I-a). Соединения формулы (I), где, при определении Q, оба заместителя R6 представляют собой водород или оба заместителя R2 и R4 представляют собой водород и углерод, соседний с азотом, к которому присоединяются заместители R6 или R2 и R4, содержит, по меньшей мере,один водород, причем указанный Q соответствует Н 2N-Q3 Н, и указанные соединения изображаются формулой (I-a-1-2), можно также получить посредством гидроаминирования промежуточных соединений формулы (IX) в присутствии подходящего агента аминирования, такого как, например, аммиак, гидроксиламин или бензиламин, и в присутствии подходящего восстановителя, такого как, например, водород, и подходящего катализатора. Подходящими катализаторами для вышеуказанной реакции являются, например, платина-на-угле, палладий-наугле, родий-на-Аl2 О 3 и т.п., необязательно, в присутствии каталитического яда, такого как раствор тиофена. Подходящим инертным растворителем для вышеуказанной реакции является спирт, например метанол, этанол, 2-пропанол и т.п. Соединения формулы (I), где Q содержит группу -CH2NH2, причем указанный Q соответствует H2N-CH2-Q4, и указанные соединения изображаются формулой (I-a-1-3), можно получить посредством восстановления промежуточных соединений формулы (X). Указанное восстановление можно осуществить с помощью подходящего восстановителя, такого как алюмогидрид лития или водород,необязательно в присутствии подходящего катализатора, такого как никель Ренея. Подходящим растворителем для указанной выше реакции является, например, тетрагидрофуран или раствор аммиака в спирте. Подходящими спиртами являются метанол, этанол, 2-пропанол и т.п. Указанную реакцию восстановления, осу 13 ществляемую в растворе аммиака в спирте, также можно использовать для получения соединений формулы (I-a-1-3), где R1 замещен С 1-6 алкилокси-С 1-6-алкилом, причем указанный R1 соответствует R1'-С 1-6-алкилокси-С 1-6-алкилу, и указанные соединения представляются формулой (I-a-1-3-1), исходя из промежуточного соединения формулы (Х-а). 14 щитными группами, как в формуле (XVI), или комбинированной защитной группой, как в формуле (XVI-a), также можно объединить в одном промежуточном соединении, как представлено в формуле (XVI-b). Соединения формулы (I), где Q содержит группу -CH2-CHOH-CH2-NH2, причем указанный Q соответствует H2N-CH2-CHOH-CH2-Q4', и указанные соединения изображаются формулой(I-a-1-3-2), можно получить посредством взаимодействия промежуточных соединений формулы (XI) с аммиаком в присутствии подходящего инертного для реакции растворителя, такого как спирт, например метанол. Соединения формулы (I), где, при определении Q, заместитель R2 или один R6 представляет собой формил, причем указанный Q соответствует H-C(=O)-Q1, и указанные соединения изображаются формулой (I-b), можно получить посредством взаимодействия промежуточных соединений формулы (XII) с муравьиной кислотой, формамидом и аммиаком. Соединения формулы (I), где, при определении Q, R2 или один заместитель R6 представляет собой водород, причем указанный Q соответствует H-Q1, и где R1 представляет собой арил или моноциклический гетероцикл, замещенный 1 или несколькими заместителями, выбранными из гидрокси, гидрокси-С 1-6-алкила или НО(-СН 2-СН 2-O)n-, причем указанные заместители соответствуют А-ОН, указанный R1 соответствует R1a-(A-OH)w, где w указывает число заместителей в R1a, равное 1-4, и указанные соединения изображаются формулой (I-d),можно получить посредством удаления защитной группы из промежуточных соединений формулы (XVI) с помощью подходящей кислоты, такой как хлороводородная кислота и т.п.,необязательно, в присутствии подходящего растворителя, такого как спирт. Подходящими спиртами являются метанол, этанол, 2-пропанол и т.п. Альтернативно, одна защитная группа может также защищать несколько заместителейR1a, причем указанная защитная группа соответствует P1, как в формуле (XVI-a). Оба способа защиты заместителей R1a, т.е. отдельными за Соединения формулы (I), где G замещен гидрокси или НО-(-СН 2 СН 2O)n-, причем указанный G соответствует G1-OH, и указанные соединения изображаются формулой (I-q), можно получить посредством удаления защитной группы из промежуточных соединений формулы (XXI), где Р представляет подходящую защитную группу, например бензил. Указанную реакцию удаления защитной группы можно осуществить посредством каталитического гидрирования в присутствии водорода и соответствующего катализатора в инертном для реакции растворителе. Подходящим катализатором для указанной выше реакции является, например,платина-на-угле, палладий-на-угле и т.п. Соответствующим инертным для указанной реакции растворителем является, например, спирт, например метанол, этанол, 2-пропанол и т.п.,сложный эфир, например этилацетат и т.п., кислота, например уксусная кислота и т.п. Соединения формулы (I), где G замещен гидрокси и к атому углерода, к которому присоединяется гидрокси, также присоединяется,по меньшей мере, один водород, причем указанный G соответствует H-G2-OH, и указанные соединения изображаются формулой (I-q-1),также можно получить посредством восстановления промежуточных соединений формулы (XXII). Указанную реакцию восстановления можно осуществить в присутствии подходящего восстановителя, такого как, например, борогидрид натрия, в инертном для реакции растворителе, таком как спирт или тетрагидрофуран или их смесь. Подходящими спиртами являются метанол, этанол, 2-пропанол и т.п. Соединения формулы (I) можно превратить одно в другое, следуя известным в технике реакциям трансформации функциональных групп, включая реакции, описанные далее. Соединения формулы (I) можно превратить в соответствующие N-оксидные формы,следуя известным в технике методикам превращения трехвалентного азота в его N-оксидную форму. Указанную реакцию N-окисления можно, как правило, осуществить через взаимодействие исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящими органическими пероксидами могут являться пероксикислоты, такие как,например, пероксибензойная кислота или галогензамещенная пероксибензойная кислота, например 3-хлорпероксибензойная кислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогензамещенные углеводороды, например дихлорметан, и смеси таких растворителей. Соединения формулы (I), где R1 представляет собой моноциклический гетероцикл, замещенный C1-6-алкилоксикарбонилом, причем указанный R1 соответствует R1'-С(=O)OC1-6 алкилу, и указанные соединения изображаются формулой (I-f), можно получить путем этерификации соединений формулы (I-g) в присутствии подходящего спирта, например метанола, этанола, пропанола, бутанола, пентанола, гексанола и т.п., и в присутствии подходящей кислоты,такой как хлороводородная кислота и т.п. 16 лении Q, R2 или, по меньшей мере, 1 заместитель R6 иной, чем водород, причем указанные R2 или R6 соответствуют Z1, указанный Q соответствует Z1-Q1, и указанные соединения изображаются формулой (I-h), посредством взаимодействия с реагентом формулы (XXIII), где W2 представляет собой подходящую удаляемую группу, такую как атом галогена, например брома, или 4-метилбензолсульфонатная группа,в присутствии подходящего основания, такого как, например, карбонат натрия, карбонат калия,гидроксид натрия и т.п., в инертном для реакции растворителе, например 3-метил-2-бутаноне, ацетонитриле, N,N-диметилформамиде. Соединения формулы (I-h), где, при определении Z1, R2 представляет собой СН 2-С 1-9-алкил, замещенный N(R6)2, причем указанные соединения изображаются формулой (I-h-1), также можно получить посредством взаимодействия соединения формулы (I-а), где, при определенииH-Q1, R2 представляет собой водород, причем указанный H-Q1 соответствует H-Q1b, и указанные соединения изображаются формулой (I-а-3),с промежуточными соединениями формулы(XXIV) в присутствии подходящего восстановителя, такого как цианоборогидрид натрия, в подходящем инертном для реакции растворителе, таком как спирт.Z1 соответствует Z1a, и указанные соединения изображаются формулой (I-h-2), можно превратить в соединения формулы (I-а) посредством кислотного гидролиза в присутствии подходящей кислоты, такой как бромоводородная, хлороводородная, серная, уксусная или трифторуксусная кислота, или смеси указанных кислот,или щелочного гидролиза в присутствии подходящего основания, такого как, например, гидроксид калия, в подходящем растворителе, таком как вода, спирт, смесь воды и спирта, метиленхлорид. Подходящими спиртами являются метанол, этанол, 2-пропанол, 1-бутанол, вторбутанол и т.п. Для того чтобы увеличить скорость реакции, выгодно работать при повышенных температурах. 17 Соединения формулы (I-b) можно получить посредством взаимодействия соединения формулы (I-а) с муравьиной кислотой. Соединения формулы (I), где R1 представляет собой моноциклический гетероцикл или арил, замещенный гидрокси, причем указанныйR1 соответствует HO-R1', и указанные соединения изображаются формулой (I-i), можно получить путем удаления защитной группы из соединений формулы (I-j), где R1 представляет собой моноциклический гетероцикл или арил, замещенныйC1-6-алкилокси или арил-С 1-6-алкилокси, причем указанный C1-6-алкил или арил-С 1-6-алкил соответствует Z2, и указанный R1 соответствует Z2-OR1'. Указанное удаление защитной группы можно осуществить в инертном для реакции растворителе, таком как, например, метиленхлорид, в присутствии подходящего агента для удаления защитной группы, например трибромборана. Соединения формулы (I), где R1 представляет собой моноциклический гетероцикл, замещенный галоген(-СН 2-СН 2-O)n, причем указанные соединения изображаются формулой (I-k),можно превратить в соединения формулы (I-1-1) или (I-1-2) посредством взаимодействия с соответствующим амином формулы (XXV) или(XXVI) в подходящем инертном для реакции растворителе, например тетрагидрофуране. Соединения формулы (I), где R1 представляет собой моноцикличекий гетероцикл или арил, замещенный галогеном, причем указанные соединения изображаются формулой (I-m),можно превратить в соединения формулы (I) посредством взаимодействия с 1-бутантиолом в присутствии палладия-на-угле и СаО в подходящем инертном для реакции растворителе, таком как тетрагидрофуран. 18 Соединения формулы (I), где атом водорода в радикалах формул (а-1), (а-2), (а-3), (а-4) или (а-5) заменен на нитро, причем указанные соединения изображаются формулой (I-n), можно восстановить до соединений формулы (I-о) в присутствии подходящего восстановителя, такого как водород, необязательно, в присутствии подходящего катализатора, такого как платинана-угле, и, необязательно, в присутствии подходящего каталитического яда, например раствора тиофена. Реакцию можно осуществить в подходящем инертном для реакции растворителе, таком как спирт. В дальнейших разделах описываются некоторые способы получения промежуточных соединений при описанных выше способах получения. Ряд промежуточных соединений и исходных веществ являются коммерчески доступными или известными соединениями, которые можно получить согласно обычным методам,обычно используемым в технике, или аналогично методикам, описанным в ЕР-А-0005318, ЕРА-0099139, ЕР-А-0151824, ЕР-А-0151826, ЕР-А 0232937, ЕР-А-0295742, ЕР-А-0297661, ЕР-А 0539420, ЕР-А-0539421, US 4634704 и US 4695569. В описанных выше и ниже способах получения реакционную смесь обрабатывают, следуя известным в технике способам, и продукт реакции выделяют и затем, при необходимости,очищают. Промежуточные соединения формулы (III) можно получить посредством взаимодействия промежуточных соединений формулы (XXVII) с агентом, вводящим подходящую удаляемую группу, т.е. W1, например 1-галоген-2,5-пирролидиндионом, в присутствии дибензоилпероксида в инертном для реакции растворителе, например тетрахлорметане.(XXVII), где R1 представляет собой моноциклический гетероцикл или арил, замещенный хлором, причем указанный R1 соответствует Cl-R1',и указанные промежуточные соединения изображаются формулой (XXVII-а), можно получить путем взаимодействия промежуточных соединений формулы (XXVIII), где (O=)R1bH имеет значение карбонильного производногоR1', где к атому углерода или азота, соседнему с карбонилом, присоединяется, по меньшей мере, 19 один водород, с оксихлоридом фосфора. Промежуточные соединения формулы (XXVIII) также могут реагировать как их енольные таутомерные формы.(III), где W1 представляет собой хлор, присоединенный к атому углерода, к которому присоединен, по меньшей мере, один водород, причем указанный G соответствует G3 Н, и указанные промежуточные соединения изображаются формулой (III-a), также можно получить посредством взаимодействия промежуточных соединений формулы (XXIX) с тионилхлоридом в инертном для реакции растворителе, например метиленхлориде.(XXIX) можно получить посредством восстановления промежуточных соединений формулы(XXX) в инертном для реакции растворителе,например спирте, в присутствии подходящего восстановителя, например борогидрида натрия. С другой стороны, промежуточные соединения формулы (XXIX) также можно получить,удаляя защитную группу из промежуточных соединений формулы (XXXI), где Р представляет собой подходящую защитную группу, например C1-4-алкилкарбонил, в инертном для реакции растворителе, таком как спирт, в присутствии подходящего основания, например гидроксида натрия.(XXX), где G3(=O) представляет собой СН(=O),причем указанные промежуточные соединения изображаются формулой (ХХХ-а), можно получить посредством взаимодействия промежуточных соединений формулы (XXXII), где W3 представляет собой подходящую удаляемую группу, такую как, например, атом галогена,например брома, с N,N-диметилформамидом в присутствии бутиллития в инертном для реакции растворителе, например тетрагидрофуране,диэтиловом эфире или их смеси. Промежуточные соединения формулы (IV) можно получить посредством взаимодействия промежуточных соединений формулы (XXXIII-a) 20 или (XXXIII-b), где Р представляет подходящую защитную группу, такую как, например, C1-4-алкилоксикарбонил, с промежуточными соединениями формулы (III) в соответствии с взаимодействием, описанным для общего получения соединений формулы (I). Промежуточные соединения формулы (IV) также можно получить посредством взаимодействия промежуточных соединений формулы(XXXIII-a) с промежуточными соединениями формулы (XXXIV), прореагировавшими с метансульфонилхлоридом, в присутствии подходящего основания, такого как гидрид натрия, и в присутствии подходящего инертного для реакции растворителя, например N,N-диметилформамида. Промежуточные соединения формулы (IV) также можно получить посредством циклизации промежуточных соединений формулы (XXXV) в инертном для реакции растворителе, например в спирте или N,N-диметилформамиде, в присутствии оксида ртути и серы. Промежуточные соединения формулы (IV),где Q1 содержит ненасыщенную связь, причем указанный Q1 соответствует Q1a(CH=CH), и указанные промежуточные соединения изображаются формулой (IV-a), можно получить посредством взаимодействия промежуточных соединений формулы (XXXVI) с промежуточными соединениями формулы (III) в присутствии подходящего основания, такого как карбонат калия.NH, причем указанный Q1 соответствует Q1c-NH,и указанные промежуточные соединения изображаются формулой (IV-b), также можно получить посредством взаимодействия промежуточ 21 ных соединений формулы (XXXVII) с промежуточными соединениями формулы (XXXVIII). Промежуточные соединения формулы (IV),где R1 представляет собой моноциклический гетероцикл, замещенный амино или моно- или ди(С 1-6-алкил)амино, причем указанный R1 соответствует R5aR5bN-R1', где R5a и R5b имеют значения, указанные выше, и указанные промежуточные соединения изображаются формулой(IV-c), можно получить посредством взаимодействия промежуточных соединений формулы(XXXIX) с соответствующими аминами, представленными формулой (XL), в присутствии соответствующего катализатора, например палладия, и (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'бинафтила в подходящем инертном для реакции растворителе, например тетрагидрофуране. Промежуточные соединения формулы (IV),где R1 представляет собой моноциклический гетероцикл, замещенный С(=O)-NR5aR5b, где R5 и R5b имеют значения, указанные выше, причем указанный R1 соответствует R5aR5bN-C(=O)-R1',и указанные промежуточные соединения изображаются формулой (IV-d), можно получить посредством взаимодействия промежуточных соединений формулы (XXXIX) с соответствующими аминами, представленными формулой (XL), в атмосфере монооксида углерода в присутствии подходящего катализатора, например ацетата палладия(II), и 1,3-бис(дифенилфосфино)пропана в подходящем инертном для реакции растворителе, например тетрагидрофуране. Промежуточные соединения формулы (IV),где P-Q1 содержит C1-10-алкил или С 3-7-циклоалкил,замещенный NR6-P, причем указанный C1-10 алкил или С 3-7-циклоалкил соответствует Z3,указанный P-Q1 соответствует P-NR6-Z3-Q1b, и указанные промежуточные соединения изображаются формулой (IV-e), можно получить посредством взаимодействия соединений формулы(I-а-3) с промежуточными соединениями формулы (XLI), где W4 представляет подходящую удаляемую группу, такую как п-толуолсульфонатная. Указанное взаимодействие можно осуществить в инертном для реакции растворителе,например ацетонитриле, в присутствии подходящего основания, например карбоната калия. Промежуточные соединения формулы (IV-e),где R6 представляет собой гидрокси-С 1-6-алкил,причем указанные промежуточные соединения изображаются формулой (IV-e-1), можно получить посредством взаимодействия промежуточных соединений формулы (XLII) с промежуточными соединениями формулы (XLIII) в присутствии подходящего основания, например карбоната калия, и подходящего растворителя, например ацетонитрила.(XXXIII-a) или (XXXIII-b) можно получить,вводя подходящую защитную группу в промежуточные соединения формулы (XLIV), такую как, например, C1-4-алкилоксикарбонил, в инертном для реакции растворителе, таком как метиленхлорид или спирт, например метанол, этанол, 2-пропанол и т.п., в присутствии подходящего реагента, например ди-С 1-4-алкилдикарбоната, и, необязательно, в присутствии подходящего основания, например ацетата натрия. Альтернативно, промежуточные соединения формулы (XXXIII-a) или (XXXIII-b) можно превратить в промежуточные соединения формулы(XLIV) при взаимодействии с подходящей кислотой, такой как хлороводородная или бромоводородная кислота и т.п., или их смесями, в присутствии подходящего растворителя, например воды. Промежуточные соединения формулыQ1 соответствует Q1c-NH, и указанные промежуточные соединения изображаются формулами(XXXIII-a-1) или (XXXIII-b-1), можно получить посредством взаимодействия промежуточных соединений формулы (XLV-a) или (XLV-b), гдеW5 представляет подходящую удаляемую группу, такую как, например, атом галогена, например хлора, с промежуточными соединениями формулы (XLVI).(XLV-a) или (XLV-b) можно получить посредством взаимодействия промежуточных соединений формулы (XLVII-a) или (XLVII-b) с Н 2 Р(=O)(W5)3 в присутствии подходящей кислоты, например хлороводородной кислоты.(XLVII-a) или (XLVII-b) можно получить посредством взаимодействия промежуточных соединений формулы (XLVIII-a) или (XLVIII-b) с промежуточными соединениями формулы (IL). Промежуточные соединения формулы (L) можно получить посредством восстановления промежуточных соединений формулы (LI) в инертном для реакции растворителе, например спирте, в присутствии подходящего восстановителя, например водорода, и соответствующего катализатора, например никеля Ренея. Промежуточные соединения формулы (LI) можно получить посредством взаимодействия промежуточных соединений формулы (LII) с промежуточными соединениями формулы(LIII), где W6 представляет подходящую удаляемую группу, такую как атом галогена, например хлора. Взаимодействие можно осуществить в инертном для реакции растворителе, например ацетонитриле, в присутствии подходящего основания, например карбоната калия. Промежуточные соединения формулы (LII) можно получить посредством взаимодействия промежуточных соединений формулы (LIV) с подходящей кислотой, такой как хлороводородная кислота, в присутствии подходящего растворителя, такого как спирт, например этанол. Промежуточные соединения формулы(XXXIII-a) также можно получить посредством взаимодействия промежуточных соединений формулы (XLVIII-a) с P-Q1-C(=NH)-O-СН 2-СН 3 в инертном для реакции растворителе, таком как спирт.(XXXV) можно получить посредством взаимодействия промежуточных соединений формулыP-Q1=C=S, которые синтезируют согласно методикам, описанным в ЕР 0005318, в инертном для реакции растворителе, таком как спирт, например этанол. Для того чтобы повысить скорость реакции, реакцию можно осуществлять при повышенных температурах.(LIV) можно получить посредством взаимодействия промежуточных соединений формулы Промежуточные соединения формулы (LI) также можно получить посредством взаимодействия промежуточных соединений формулы(LIII) с промежуточными соединениями формулы (LV) (J. Оrg. Сhеm., 25, р.1138, 1960) в инертном для реакции растворителе, например(XXXVI) также можно получить дегидратацией промежуточных соединений формулы (LVI) с помощью подходящей кислоты, такой как серная кислота.X2 представляют собой СН 2, причем указанныйQ1a соответствует Q1a', и указанные промежуточные соединения изображаются формулой(LVI-a), можно получить при взаимодействии карбонильной группы формулы (LVII) с промежуточным соединением формулы (LVIII) в присутствии N,N-диизопропиламина и бутиллития в подходящем инертном для реакции растворителе, например тетрагидрофуране. Промежуточные соединения формулы (IV),где G представляет собой C1-10-алкандиил, замещенный C1-6-алкилокси, арил-С 1-6-алкилокси,НО(-СН 2 СН 2O)n-, C1-6-алкилокси(-СН 2 СН 2O)n- или арил-С 1-6-алкилокси(-СН 2 СН 2O)n-, причем указанная группа заместителей соответствует O-Z4,указанный G соответствует Z4-O-G1, и указанные промежуточные соединения изображаются формулой (IV-f), можно получить посредством взаимодействия промежуточных соединений формулы (XXXIII-a) с промежуточными соединениями формулы (LIX), необязательно, в присутствии подходящей кислоты, такой как п-толуолсульфоновая кислота и т.п., и, необязательно,в присутствии подходящего растворителя, такого как N,N-диметилформамид. Для того чтобы повысить скорость реакции, реакцию можно осуществлять при повышенных температурах. 26 инертном для реакции растворителе, таком как метиленхлорид. Промежуточные соединения формулы (IV-f) также можно получить посредством взаимодействия промежуточных соединений формулы (IV),где G представляет собой C1-10-алкандиил, замещенный гидрокси, причем указанный G соответствует G1-OH, и указанные промежуточные соединения изображаются формулой (IV-g), с промежуточными соединениями формулы (LXIV),где W7 представляет собой подходящую удаляемую группу, такую как атом галогена, например иода, в присутствии подходящего основания,например гидрида натрия, в инертном для реакции растворителе, например тетрагидрофуране. Промежуточные соединения формулы (IV-g),где к атому углерода, к которому присоединяется G1, содержащий гидрокси, также присоединяется атом водорода, причем указанный G1-OH соответствует H-G2-OH, и указанные промежуточные соединения изображаются формулой(IV-g-1), можно получить посредством восстановления промежуточных соединений формулы(LXV) в присутствии подходящего восстановителя, например борогидрида натрия, в инертном для реакции растворителе, таком как спирт, тетрагидрофуран или их смесь. Можно также сначала удалить защитную группу из промежуточных соединений формулы (LXV), например, в присутствии подходящей кислоты, такой как хлороводородная кислота и т.п., причем, в результате, получают промежуточные соединения формулы (LXVI), а затем осуществить восстановление, причем, в результате, получают соединения формулы (I-q-1), где Q представляетH-Q1, причем указанные промежуточные соединения изображаются формулой (I-q-1-1).(LIX) можно получить посредством взаимодействия промежуточных соединений формулы(LX) с реагентом формулы (LXI) или (LXII) в инертном для реакции растворителе, таком как спирт или толуол, в присутствии кислоты, например 4-метилбензолсульфоновой кислоты. Промежуточные соединения формулы (LX) можно получить посредством окисления промежуточных соединений формулы (LXIII) подходящим окислителем, например MnO2, в Промежуточные соединения формулы (IV),где G представляет собой этил, замещенный гид 27 рокси, причем указанные промежуточные соединения изображаются формулой (IV-g-2), также можно получить посредством взаимодействия промежуточных соединений формулы (XXXIII-a) с промежуточными соединениями формулы(LXVII) в присутствии подходящего основания,такого как гидрид натрия, в инертном для реакции растворителе, таком как N,N-диметилформамид. Промежуточные соединения подгруппы формулы (IV-g-2), представленные формулой(IV-g-2-1), также можно получить посредством взаимодействия промежуточных соединений формулы (LXVIII) с промежуточными соединениями формулы (LXIX) в присутствии 1,3-дициклогексилкарбодиимида в инертном для реакции растворителе, например толуоле.(LXV) можно получить посредством взаимодействия промежуточных соединений формулы(XXXIII-a) с промежуточными соединениями формулы (LXX), где W8 представляет собой подходящую удаляемую группу, такую как атом галогена, например брома, в присутствии подходящего основания, например гидрида натрия,в инертном для реакции растворителе, например Промежуточные соединения формулы (V) можно получить посредством взаимодействия промежуточных соединений формулы (LXXI) с 1 Н-изоиндол-1,3(2 Н)-дионом в присутствии трифенилфосфина и диэтилазодикарбоксилата. Промежуточные соединения формулы (V) также можно получить посредством взаимодействия промежуточных соединений формулы(LXXII) с 1 Н-изоиндол-1,3(2 Н)-дионом в присутствии подходящего основания, такого как гидрид натрия, и подходящего растворителя,такого как N,N-диметилформамид.(LXXII) можно получить посредством взаимодействия промежуточных соединений формулы(LXXI) с промежуточными соединениями формулы (LXXIII), где W9 представляет подходящую удаляемую группу, такую как атом галогена, например хлора, в присутствии подходящего основания, такого как N,N-диэтилэтанамин, и подходящего растворителя, такого как метиленхлорид. Промежуточные соединения формулы (V),где, при определении Q2, R2 представляет собойC1-10-алкил, причем указанный Q2 соответствует С 1-10-алкил-Q1b, и указанные промежуточные соединения изображаются формулой (V-a),можно получить посредством взаимодействия соединений формулы (I-а-3) с промежуточными соединениями формулы (LXXIV), где W10 представляет подходящую удаляемую группу, такую как атом галогена, например хлора, в присутствии подходящего основания, такого как карбонат калия, и подходящего растворителя, такого как ацетонитрил.(LXXI), где, при определении Q2, к атому углерода, к которому присоединяется гидрокси,также присоединяются 2 атома водорода, причем указанный HO-Q2 соответствует HO-CH2-Q2',и указанные промежуточные соединения изображаются формулой (LXXI-a), можно получить посредством восстановления промежуточных соединений формулы (LXXV) в присутствии подходящего восстановителя, такого как алюмогидрид лития, в подходящем инертном для реакции растворителе, например тетрагидрофуране.(LXXI), где, при определении Q2, к атому углерода, к которому присоединяется гидрокси,также присоединяется, по меньшей мере, 1 атом водорода, причем указанный HO-Q2 соответст 29 вует НО-Q3 Н, и указанные промежуточные соединения изображаются формулой (LXXI-b),можно получить посредством восстановления промежуточных соединений формулы (IX) подходящим восстановителем, например борогидридом натрия, в инертном для реакции растворителе, например спирте.(LXXX) с промежуточными соединениями формулы (III) в присутствии подходящего основания, например карбоната калия, в подходящем инертном для реакции растворителе, например ацетонитриле.Q3'-NH, и указанные промежуточные соединения изображаются формулой (LXXX-a), можно получить посредством циклизации промежуточных соединений формулы (LXXXI) в присутствии оксида ртути и серы в подходящем инертном для реакции растворителе, например спирте.(VI), где, при определении Q2, R2 представляет собой C1-10-алкил, замещенный N(P)2, и к атому углерода, соседнему с атомом азота, к которому присоединяется заместитель R2, также присоединяется, по меньшей мере, 1 атом водорода,причем указанный Q2 соответствует (Р)2 Н-С 1-10 алкил-NН-Q2 аН, и указанные промежуточные соединения изображаются формулой (VI-a),можно получить посредством гидроаминирования промежуточных соединений формулы (LXXVI) промежуточными соединениями формулы(LXXVII) в присутствии подходящего восстановителя, такого как водород, и подходящего катализатора, такого как палладий-на-угле, платина-на-угле и т.п., и, необязательно, в присутствии подходящего каталитического яда, такого как раствор тиофена. Подходящим растворителем при таком взаимодействии является инертный к реакции растворитель, такой как спирт.(LXXXI) можно получить, восстанавливая промежуточные соединения формулы (LXXXII) в присутствии подходящего восстановителя, такого как водород, в присутствии подходящего катализатора, такого как палладий-на-угле, платинана-угле и т.п., в подходящем растворителе, например смеси аммиака и спирта. Подходящими спиртами являются метанол, этанол, 2-пропанол и т.п.(LXXVI) можно получить, удаляя защитную группу из промежуточных соединений формулы(LXXVIII) в присутствии подходящей кислоты,такой как хлороводородная кислота и т.п., в подходящем растворителе, например воде.(LXXXII) можно получить посредством взаимодействия промежуточных соединений формулы(LXXXIII) с промежуточными соединениями формулы (LXXXIV) в подходящем инертном для реакции растворителе, например этаноле. Промежуточные соединения формулы (IX) можно получить, удаляя защитную группу из промежуточных соединений формулы (LXXIX) в присутствии подходящей кислоты, такой как хлороводородная кислота и т.п.(LXXIX) можно получить посредством взаимодействия промежуточных соединений формулы Промежуточные соединения формулы (IX),где, при определении Q3, R2 содержит C1-10-алкил, причем указанный Q3 соответствует С 1-10 алкил-Q1b, и указанные промежуточные соединения изображаются формулой (IХ-а), можно получить посредством взаимодействия соединений формулы (I-а-3) с реагентом формулы(LXXXV), где (O=С)C1-10-алкил представляет карбонильное производное C1-10-алкила и гдеW11 представляет собой подходящую удаляемую группу, такую как атом галогена, например брома, в инертном для реакции растворителе,например ацетонитриле, в присутствии подходящего основания, например карбоната калия. Промежуточные соединения формулы (X),где Q4 содержит C1-9-алкил, причем указанныйQ4 соответствует С 1-9-алкил-Q1b, и указанные промежуточные соединения изображаются формулой (Х-а), можно получить посредством взаимодействия соединений формулы (I-а-3) с реагентом формулы (LXXXVI), где W12 представляет подходящую удаляемую группу, такую как атом галогена, например хлора, в инертном для реакции растворителе, например 3-метил-2-бутаноне, в присутствии подходящего основания, например карбоната калия, карбоната натрия и т.п. Промежуточные соединения формулы (X),где NC-Q4 представляет NC-(C1-9-алкил)(R4)NC(=O)-Alk-X1, причем указанные промежуточные соединения изображаются формулой (Х-b),можно получить посредством взаимодействия промежуточных соединений формулы (LXXXVII) с промежуточными соединениями формулы Промежуточные соединения формулы (XI),где Q4' представляет Q1b, причем указанные промежуточные соединения изображаются формулой(ХI-а), можно получить посредством взаимодействия соединений формулы (I-а-3) с промежуточными соединениями формулы (LXXXIX),где W13 представляет подходящую удаляемую группу, такую как атом галогена, например хлора,в присутствии подходящего основания, такого как карбонат натрия, и в присутствии подходящего растворителя, такого как 3-метил-2-бутанон. Стереохимически чистые изомерные формы соединений формулы (I) можно получить,применяя известные в технике методики. Диастереомеры можно разделить физическими способами, такими как селективная кристаллизация, и хроматографическими методами, например противоточным распределением, жидкостной хроматографией и т.п. 32 Соединения формулы (I), полученные описанными выше способами, представляют собой,как правило, рацемические смеси энантиомеров,которые можно отделить один от другого, следуя известным в технике методикам разрешения. Рацемические соединения формулы (I),являющиеся достаточно основными или кислотными, можно превратить в соответствующие формы диастереомерных солей путем взаимодействия, соответственно, с подходящей хиральной кислотой или хиральным основанием. Затем указанные формы диастереомерных солей разделяют, например, селективной или фракционной кристаллизацией, и высвобождают из них энантиомеры с помощью щелочи или кислоты. Другой способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы также можно получить из соответствующих стереохимически чистых изомерных форм соответствующих исходных веществ, при условии, что реакция происходит стереоспецифически. Предпочтительно,когда нужен конкретный стереоизомер, указанное соединение нужно синтезировать стереоспецифическими способами получения. При таких способах будет выгодным использованием энатиомерно чистых исходных веществ. Соединения формулы (I) обладают антивирусными свойствами. Вирусные инфекции,которые можно лечить с использованием соединений и способов настоящего изобретения,включают инфекции, привносимые орто- и парамиксовирусами, и в частности респираторносинцитиальным вирусом человека и коровы (RSV). Антивирусную активность против RSV соединений настоящего изобретения in vitro проверяют при испытании, описанном в экспериментальной части описания, и ее также можно показать при анализе на снижение урожая вируса. Антивирусную активность против RSV соединений настоящего изобретения in vivo можно продемонстрировать на опытной модели с использованием хлопковых крыс, как описывают(I) или любой их подгруппы, их пролекарства,N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы полезны при лечении индивидуумов, переносящих вирусную инфекцию, в частности RSV-инфекцию, и для профилактики таких инфекций. В целом, соединения настоящего изобретения могут быть полезны при лечении теплокровных животных, зараженных вирусами, в частности респираторно-синцитиальным вирусом. Соединения формулы (I) или любой их подгруппы могут быть следовательно полезны в 33 качестве лекарственных средств. Указанное применение в качестве лекарственного средства или способ лечения включает системное введение субъектам, зараженным вирусом, или субъектам, восприимчивым к вирусным инфекциям,количества соединений настоящего изобретения, эффективного для борьбы с состояниями,связанными с вирусной инфекцией, в частностиRSV-инфекцией. Настоящее изобретение также относится к применению соединений настоящего изобретения или любой их подгруппы при получении лекарственного средства для лечения или предупреждения вирусных инфекций, в частностиRSV-инфекции. Соединения настоящего изобретения или их любую подгруппу можно включать в различные фармацевтические формы для целей введения. В качестве подходящих композиций можно назвать все композиции, обычно используемые для системного введения лекарственных средств. Для того чтобы получить фармацевтические композиции данного изобретения, эффективное количество конкретного соединения,необязательно, в форме аддитивной соли и в виде комплекса с металлом как активный ингредиент соединяют при тщательном перемешивании с фармацевтически приемлемым носителем, который может иметь самые разные формы в зависимоcти от формы препарата, требуемого для введения. Такие фармацевтические композиции нужны в стандартной лекарственной форме, подходящей, в частности, для введения пероральным, ректальным, чрескожным способом или парентеральной инъекцией. Например, при получении композиций в пероральной лекарственной форме можно использовать любые обычные фармацевтические среды,такие как, например, вода, гликоли, масла,спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии,сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара,каолин, смазывающие вещества, связующие вещества, вещества, способствующие рассыпанию, и т.п., в случае порошков, пилюль, капсул и таблеток. В силу легкости введения таблетки и капсулы представляют наиболее выгодные пероральные стандартные лекарственные формы, в которых, очевидно, используются твердые фармацевтические носители. В случае парентеральных композиций носитель, как правило,будет содержать стерильную воду, по меньшей мере, в значительной части, хотя можно включать другие ингредиенты, например, способствующие растворению. Например, можно получить растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, и в таком случае можно использовать соответствующие жидкие 34 носители, суспендирующие вещества и т.п. Также включаются препараты в твердой форме,которые предназначены для превращения непосредственно перед применением в препараты жидкой формы. В композициях, предназначенных для чрескожного введения, носитель, необязательно, содержит средство, усиливающее проникание, и/или подходящее смачивающее вещество, необязательно, в сочетании с подходящими добавками любого характера в небольших количествах, которые не оказывают существенного вредного действия на кожу. Соединения настоящего изобретения также можно вводить посредством пероральной ингаляции или инсуффляции с помощью способов и композиций, используемых в технике для введения таким путем. Так, вообще, соединения настоящего изобретения можно вводить в легкие в форме раствора, суспензии или сухого порошка, причем предпочтителен раствор. Любая система, разработанная для доставки растворов, суспензий или сухих порошков посредством пероральной ингаляции или инсуффляции, подходит для введения соединений настоящего изобретения. Таким образом, настоящее изобретение также относится к фармацевтической композиции, приспособленной для введения посредством ингаляции или инсуффляции через рот, содержащей соединение формулы (I) и фармацевтически приемлемый носитель. Предпочтительно, соединения настоящего изобретения вводят посредством ингаляции раствора распыляемых или подаваемых в форме аэрозоля дозах. Особенно выгодно получать вышеуказанные фармацевтические композиции в стандартной лекарственной форме для облегчения введения и равномерности дозировки. Здесь под стандартной лекарственной формой подразумеваются физически дискретные единицы, подходящие в качестве единичных дозировок, причем каждая единица содержит предварительно установленное количество активного ингредиента,рассчитанное на получение желательного лечебного эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (в том числе без покрытия или с покрытием), капсулы, пилюли, суппозитории, пакетики с порошком, облатки, растворы или суспензии для инъекций и т.п., и их разделенные множества. В целом, предполагается, что антивирусно эффективное суточное количество будет составлять от 0,01 до 500 мг на кг массы тела,предпочтительнее - от 0,1 до 50 мг на кг массы тела. Может быть уместным введение требуемой дозы в виде 2, 3, 4 или более субдоз в течение суток с соответствующими интервалами. Указанные субдозы можно составить в виде стандартных лекарственных форм, например,содержащих 1-1000 мг, и в частности 5-200 мг, 35 активного ингредиента на стандартную лекарственную форму. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы (I), конкретного состояния, которое лечат, тяжести состояния, которое лечат, возраста, пола, степени расстройства и общего физического состояния конкретного пациента, а также от других лекарственных средств, которые может принимать индивидуум, что хорошо известно специалистам в этой области техники. Кроме того, очевидно, что указанное эффективное суточное количество можно уменьшить или увеличить, в зависимости от реакции субъекта,которого лечат, и/или в зависимости от оценки врача, прописывающего соединения настоящего изобретения. Интервалы эффективного суточного количества, указанные выше, являются,следовательно, только ориентировочными. Также в качестве лекарственного средства можно использовать сочетание другого антивирусного средства и соединения формулы (I). Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение формулы (I) и (b) другое антивирусное средство, как комбинированному препарату для одновременного, раздельного или последовательного применения при антивирусном курсе лечения. Различные лекарственные средства могут быть объединены в один препарат вместе с фармацевтически приемлемыми носителями. Например, соединения настоящего изобретения можно объединить с интерфероном-бета или фактором некроза опухолей альфа для того,чтобы лечить или предупреждать RSVинфекцию. Приведенные далее примеры предназначены для пояснения настоящего изобретения. А. Получение промежуточных соединений. Пример А 1. а) В растворе этил-4-(1 Н-бензимидазол-2 иламино)-1-пиперидинкарбоксилата (0,0347 моль) и 2-бром-1-(4-хлорфенил)этанона (0,0647 моль) в ацетонитриле (150 мл) суспендируют К 2 СО 3CH2Cl2. Органический слой отделяют, сушат,фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH/NH4OH,97,5/2,5/0,1). Чистые фракции собирают и растворитель выпаривают. Часть полученной фракции (3 г) растворяют в 2-пропаноне и диэтиловом эфире. Выпавшее в осадок вещество отфильтровывают и сушат и получают 2 г этил-41-[2-(4-хлорфенил)-2-оксоэтил]-1 Н-бензимидазол-2-ил]амино]-1-пиперидинкарбоксилатаb) Смесь промежуточного соединения (1) 36 12 ч и затем растворитель выпаривают. Добавляют этилацетат. Смесь подщелачивают насыщенным раствором NаНСО 3. Выпавшее в осадок вещество отфильтровывают, промывают Н 2O и этилацетатом и сушат. Остаток (5,5 г) кристаллизуют из этилацетата. Выпавшее в осадок вещество отфильтровывают и сушат и получают 4,8 г дигидрата 1-(4-хлорфенил)-2-[2-(4 пиперидиниламино)-1 Н-бензимидазол-1-ил]этанона (80%) (пром. соед. 2). Пример А 2.a) К смеси -1,1-диметилэтил-4-1-(2 оксо-2-фенилэтил)-1 Н-бензимидазол-2-ил]амино]-1-пиперидинкарбоксилата (0,034 моль) в тетрагидрофуране (250 мл) и метанола (250 мл) при 5 С по частям добавляют NaBH4 (0,034 моль). Смесь перемешивают при 5 С и затем гидролизуют холодной водой. Растворитель выпаривают и остаток переносят в H2O. Выпавшее в осадок вещество отфильтровывают, промывают диизопропиловым эфиром и сушат, получают 11,3 г -1,1-диметилэтил-4-1-(2-гидрокси-2 фенилэтил)-1 Н-бензимидазол-2-ил]амино]-1-пиперидинкарбоксилата (76%) (пром. соед. 3).b) Смесь промежуточного соединения (3)(0,0183 моль) и тетрагидрофурана (50 мл) охлаждают до 0 С в токе N2. Добавляют по частям 80% NaH (0,0366 моль). Смесь доводят до комнатной температуры, затем перемешивают при комнатной температуре в течение 30 мин и снова охлаждают до 0 С. Добавляют по каплям раствор СН 3I (0,0183 моль) в тетрагидрофуране(50 мл). Смесь перемешивают при комнатной температуре в течение 2 ч, затем охлаждают,гидролизуют и экстрагируют этилацетатом. Органический слой отделяют, промывают H2O,сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH/NH4OH,98,5/1,5/0,1). Нужные фракции собирают, и выпаривают растворитель, и получают 5 г -1,1 диметилэтил-4-1-(2-метокси-2-фенилэтил)-1Hбензимидазол-2-ил]амино]-1-пиперидинкарбоксилата (пром. соед. 4). Пример A3.a) К смеси дигидробромида N-(4-пиперидинил)-1H-бензимидазол-2-амина (0,1 моль) и метанола (389 мл) добавляют NаОСН 3 (0,2 моль),смесь охлаждают на ледяной бане и перемешивают в течение 2 ч. К смеси при охлаждении на ледяной бане добавляют бис(1,1-диметилэтил) дикарбоноат (0,1 моль) и затем смесь перемешивают в течение 18 ч при комнатной температуре. Растворитель выпаривают и остаток суспендируют в воде и диизопропиловом эфире. Остаток отфильтровывают, промывают водой и диизопропиловым эфиром и сушат. Остаток кипятят в СН 3 ОН и получают 17,46 г 1,1-диметилэтил-4-(1 Н-бензимидазол-2-иламино)-1-пиперидинкарбоксилата (55,2%) (пром. соед. 5).CH2Cl2 (100 мл) перемешивают при комнатной температуре в течение ночи и затем очищают на силикагеле на стеклянном фильтре (элюентc) Смесь промежуточного соединения (6)d) Промежуточное соединение (7) (0,03185 моль) и промежуточное соединение (5) (0,03185 моль) нагревают до 150 С и очищают на силикагеле на стеклянном фильтре (элюент CH2Cl2/(0,03 моль) и 4-метилбензолсульфоновой кислоты (2 г) в толуоле (700 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч с использованием сепаратора для воды. Добавляют 4-метилбензолсульфоновую кислоту и смесь перемешивают и кипятят с обратным холодильником в течение 48 ч. Снова добавляют 4-метилбензолсульфоновую кислоту и смесь перемешивают и кипятят с обратным холодильником еще в течение 48 ч. Снова добавляют 4 метилбензолсульфоновую кислоту. Смесь перемешивают и кипятят с обратным холодильником еще в течение 24 ч, затем охлаждают и промывают разбавленным раствором NaOH. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле(элюент CH2Cl2/C2H5OH, 95/5). Чистые фракции собирают и растворитель выпаривают. Остаток суспендируют в петролейном эфире. Выпавшее в осадок вещество отфильтровывают и сушат и получают 1,4 г -1,1-диметилэтил-4-1-[(6 бром-2-пиридинил)этоксиметил]-1 Н-бензимидазол-2-ил]амино]-1-пиперидинкарбоксилата (9%)a) Смесь 2,3-пиридиндиамина (0,05 моль) и моногидрохлорида этил-4-(2-этокси-2-иминоэтил)-1-пиперидинкарбоксилата (0,05 моль) в метаноле (150 мл) перемешивают и кипятят с обратным холодильником в течение 3 суток. Растворитель выпаривают и остаток растворяют в CH2Cl2. Органический раствор промывают 10% 38 раствором К 2 СО 3, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/ СН 3 ОН/NН 4OН, 94/6/0,1). Чистые фракции собирают, и растворитель выпаривают, и получают 7,6 г 4-[(1 Н-имидазо[4,5-b]пиридин-2-ил)метил]1-пиперидинкарбоксилата (52%) (пром. соед. 9).b) К смеси промежуточного соединения (9)(0,023 моль) и N,N-диметилформамида (75 мл) при 0 С добавляют по частям NaH (0,028 моль). Добавляют 2-бром-1-фенилэтанон (0,028 моль). Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют Н 2 О и смесь экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/ СН 3 ОН/NН 4OН, 97,5/2,5/0,1). Чистые фракции собирают, и растворитель выпаривают, и получают 4,7 г этил-4-1-(2-оксо-2-фенилэтил)-1Hимидазо[4,5-b]пиридин-2-ил]метил]-1-пиперидинкарбоксилата (50,5%) (пром. соед. 10). с) К смеси промежуточного соединения(10) (0,0137 моль) и метанола (100 мл) при 5 С в токе N2 добавляют по частям NaBH4 (0,0137 моль). Смесь гидролизуют Н 2 О и экстрагируют этилацетатом. Органический слой отделяют,сушат, фильтруют, и растворитель выпаривают,и получают 5,6 г -этил-4-1-(2-гидрокси-2 фенилэтил)-1H-имидазо[4,5-b]пиридин-2-ил]метил]-1-пиперидинкарбоксилата (пром. соед. 11). Пример А 5. Смесь -1-[этокси(6-метил-2-пиридинил) метил]-N-(4-пиперидинил)-1 Н-бензимидазол-2 амина (0,00205 моль), 1-хлор-2-пропанона(0,00308 моль) и К 2 СО 3 (0,0041 моль) в ацетонитриле (8 мл) перемешивают и кипятят с обратным холодильником в течение 8 ч. Добавляют Н 2 О и смесь экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле(элюент СН 2 Сl2/СН 3 ОН/NН 4OН, 97/3/0,1). Чистые фракции собирают, и растворитель выпаривают,и получают 0,67 г -1-[4-1-[этокси(6-метил-2 пиридинил)метил]-1 Н-бензимидазол-2-ил]амино]1-пиперидинил]-2-пропанона (77%) (пром. соед. 12). Пример А 6. К смеси 1,1-диметилэтил[1-(гидроксиметил)-2-метилпропил]карбамоата (0,202 моль) и пиридина (65 мл) при 10 С добавляют по частям 4-метилбензолсульфонилхлорид (0,2222 моль). Смесь перемешивают при 10 С в течение 2 ч. При 10 С добавляют H2O (75 мл). Выпавшее в осадок вещество отфильтровывают, промывают Н 2 О и переносят в CH2Cl2. Органический раствор промывают H2O, сушат, фильтруют, и растворитель выпаривают, и получают 49 г -1,1-диметилэтил-[1-(4-метилфенил)сульфонил]окси] метил]-2-метилпропил]карбамата (68%) (пром. соед. 13).(0,046 г) и газообразного NH(CH3)2 (10 г) в тетрагидрофуране (200 мл) перемешивают в автоклаве при 100 С в течение 16 ч при давлении СО 30 атм. Смесь фильтруют и фильтрат упаривают. Остаток очищают на силикагеле на стеклянном фильтре (элюент CH2Cl2/(СН 3 ОН/NН 3),99/1). Чистые фракции собирают, и растворитель выпаривают, и получают 0,8 г -1,1-диметилэтил-4-1-(6-(диметиламино)-2-пиридинил] этоксиметил]-1 Н-бензимидазол-2-ил]амино]-1 пиперидинкарбоксилата (86%) (пром. соед. 14).b) Смесь промежуточного соединения 33(0,0032 моль) Рd(ОАс)2 (0,030 г) и 1,3-пропандиилбис[дифенилфосфина] (0,110 г) в тетрагидрофуране (100 мл) в аммиаке (жидк., 10 атм) и СО (газ, 30 атм) перемешивают в течение 16 ч при 100 С. Выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре(0,065 мол.) и смесь перемешивают и кипятят с обратным холодильником в течение ночи. Выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюентCH2Cl2/CH3OH/NH4OH, 96/4/0,2). Чистые фракции собирают и растворитель выпаривают. Часть остатка (1,5 г) кристаллизуют из диизопропилового эфира. Выпавшее в осадок вещество отфильтровывают и сушат и получают 1,35 гNaH (0,02 моль). Смесь перемешивают при 40 С в течение 1 ч. Добавляют 6-(эпоксиэтил)-2-пиколин (0,02 моль) в небольшом количестве N,Nдиметилформамида. Смесь перемешивают при 100 С в течение ночи. Выпаривают растворитель. Остаток переносят в Н 2O и CH2Cl2. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле 40 и получают 3,5 г -1,1-диметилэтил-4-1-[2 гидрокси-2-(6-метил-2-пиридинил)этил]-1 Н-бензимидазол-2-ил]амино]-1-пиперидинкарбоксилата (пром. соед. 16). В табл. 1, 2 и 3 приводится перечень промежуточных соединений, получаемых способами, аналогичными описанным в одном из приведенных выше примеров. Таблица 1 В. Получение конечных соединений. Пример В 1. Смесь промежуточного соединения (4)(10 мл) перемешивают при 40 С в течение 2 ч. Смесь охлаждают до комнатной температуры и выливают на лед. Добавляют СН 2 Сl2. Смесь подщелачивают твердым К 2 СО 3, перемешивают при комнатной температуре в течение 1 ч и экстрагируют CH2Cl2. Органический слой отделяют, промывают Н 2 О, сушат, фильтруют и растворитель выпаривают. Остаток кристаллизуют из диэтилового эфира и СН 3 ОН. Выпавшее в осадок вещество отфильтровывают и сушат и получают 2,9 г -1-(2-метокси-2-фенилэтил)N-(4-пиперидинил)-1 Н-бензимидазол-2-амина(81%) (соединение 1). Пример В 2. Смесь промежуточного соединения (11)(200 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/ СН 3 ОН/NН 4OН, 80/20/3). Чистые фракции собирают и растворитель выпаривают. Остаток превращают в соль этандиовой кислоты (1:2) с помощью этандиовой кислоты. Смесь кристаллизуют из 2-пропанона. Выпавшее в осадок вещество отфильтровывают и сушат и получают 3,9 г этандиоата фенил-2-(4-пиперидинилметил)-1Hимидазо[4,5-b]пиридин-1-этанола (соединение 2). Пример В 3.a) Смесь промежуточного соединения (8)(0,00175 моль) в трифторуксусной кислоте (20 мл) и СН 2 Сl2 (50 мл) перемешивают при комнатной температуре в течение 2 ч, выливают в смесь воды со льдом и подщелачивают растворомNaOH. Добавляют CH2Cl2. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают на силикагеле на стеклянном фильтре (элюент CH2Cl2/(СН 3 ОН/NН 3), 90/10). Чистые фракции собирают и растворитель выпаривают. Остаток превращают в 42 гидрохлорид (1:3). Выпавшее в осадок вещество отфильтровывают и сушат и получают 0,48 г 2 пропанолата дигидрата тригидрохлорида -1[этокси[6-метил-(3-фенилметокси)-2-пиридинил] метил]-N-(4-пиперидинил)-1 Н-бензимидазол-2 амина (1:1) (соединение 3).NaOH. Органический слой отделяют, промывают Н 2 О, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/NН 3,90/10). Чистые фракции собирают и растворитель выпаривают. Остаток суспендируют в петролейном эфире. Выпавшее в осадок вещество отфильтровывают и сушат. Полученную фракцию перекристаллизовывают из небольшого количества СН 3 СN. Выпавшее в осадок вещество отфильтровывают и сушат и получают 0,22 г(соединение 4). Пример В 4. Смесь -1-[этокси(2-пиридинил)метил]N-[1-(фенилметил)-4-пиперидинил]-1 Н-бензимидазол-2-амина (0,011 моль) и метанола (150 мл) гидрируют в течение 4 суток с 10% Pd/C (2 г) в качестве катализатора. После поглощения Н 2 (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/(СН 3 ОН/NН 3), 90/10). Чистые фракции собирают, и растворитель выпаривают, и получают 1,5 г -1-[этокси(2-пиридинил)метил]-N(4-пиперидинил)-2-бензимидазол-2-амина (39%)(соединение 5). Пример В 5. К смеси промежуточного соединения (2)(0,0078 моль) в тетрагидрофуране (50 мл) и метанола (50 мл) добавляют по частям NaBH4(0,0078 моль) и смесь перемешивают при 5 С в токе N2 в течение 2 ч. Смесь гидролизуют холодной Н 2 О (3 мл) и растворитель выпаривают. Выпавшее в осадок вещество отфильтровывают,промывают H2O и сушат. Остаток (3 г) кристаллизуют из диизопропилового эфира. Выпавшее в осадок вещество отфильтровывают и сушат и получают 2,9 г (4-хлорфенил)-2-(4-пиперидиниламино)-1 Н-бензимидазол-1-этанола(100%) (соединение 6). Пример В 6. Смесь соединения (4) (0,0035 моль), 1,1-диметилэтил-(2-бромметил)карбамоата (0,005 моль) и Na2CO3 (0,01 моль) в 2-бутаноне (100 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч. Добавляют Н 2 О. Органиче 43 ский слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюентN,N-диметилформамиде (4 мл) перемешивают при 60 С в течение 4 ч (каждый час добавляют 1 эквивалент промежуточного соединения (13 и затем охлаждают. Растворитель выпаривают. Остаток переносят в CH2Cl2. Органический раствор промывают Н 2 О, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH/NH4OH, 96,5/3,5/0,1). Собирают две чистые фракции, и выпаривают из них растворители, и получают 1 г -1,1-диметилэтил-[1-41-[(6-бром-2-пиридинил)этоксиметил]-1H-бензимидазол-2-ил]амино]-1-пиперидинил]метил]2-метилпропил]карбамата (47%) (соединение 8). Пример В 8. Смесь соединения (7) (0,0026 моль) в 2 пропаноле (30 мл) и раствора НВr в уксусной кислоте (2 мл) перемешивают и кипятят с обратным холодильником в течение 90 мин и затем охлаждают. Растворитель выпаривают. Остаток переносят в CH2Cl2 и Н 2O. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/(СН 3 ОН/NH3), 90/10). Чистые фракции собирают и растворитель выпаривают. Остаток суспендируют в диизопропиловом эфире. Выпавшее в осадок вещество отфильтровывают и сушат. Полученную фракцию снова очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/(СН 3 ОН/NН 3), 90/10). Чистые фракции собирают и растворитель выпаривают. Остаток суспендируют в диизопропиловом эфире. Выпавшее в осадок вещество отфильтровывают и сушат и получают 0,23 г -N-[1-(2-аминоэтил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]1H-бензимидазол-2-амина (соединение 9). Пример В 9. Смесь соединения (8) (0,00162 моль) в растворе НСl в 2-пропаноле (1 мл) и 2-пропанола(10 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч и затем охлаждают. Растворитель выпаривают. Остаток переносят в СН 2 Сl2. Органический раствор промывают 10% раствором К 2 СО 3 и Н 2 О, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле[6-метил-3-(фенилметокси)-2-пиридинил]метил]1 Н-бензимидазол-2-ил]амино]-1-пиперидинил] этил]карбамата (0,0016 моль) и КОH (1 г) во втор-бутаноле (25 мл) перемешивают и кипятят с обратным холодильником в течение 6 ч. Растворитель выпаривают. Остаток очищают на силикагеле на стеклянном фильтре (элюентCH2Cl2/(СН 3 ОН/NН 3), от 95/5 к 93/7 и к 90/10). Чистые фракции собирают и растворитель выпаривают. Остаток превращают в гидрохлорид(1:3). Выпавшее в осадок вещество отфильтровывают и сушат и получают 0,5 г дигидрата тригидрохлорида -N-[1-(2-аминоэтил)-4-пиперидинил]-1-[этокси[6-метил-3-(фенилметокси)-2 пиридинил]метил]-1 Н-бензимидазол-2-амина(соединение 11). Пример В 11. Смесь промежуточного соединения (12)(0,0016 моль) и бензолметанамина (0,0048 моль) в метаноле (7 мл) гидрируют при 40 С и давлении 5 бар в течение 8 ч с Pd/C (0,07 г) в качестве катализатора. После поглощения Н 2 (1 эквивалент) катализатор отфильтровывают через целит,промывают СН 3 ОН и СН 2 Сl2 и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH/NH4OH, 93/7/0,7). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из диэтилового эфира. Выпавшее в осадок вещество отфильтровывают и сушат и получают 0,4 г -N-[1-(2-аминопропил)-4-пиперидинил]1-[этокси[6-метил-2-пиридинил]метил]-1 Н-бензимидазол-2-амина (59%) (соединение 12). Пример В 12. Смесь -N-[1-(2-аминоэтил)-4-пиперидинил]-1-[(6-метил-2-пиридинил)[2-(фенилметокси) этокси]метил]-1 Н-бензимидазол-2-амина (0,003 моль) и метанола (150 мл) перемешивают при комнатной температуре с 10% Pd/C (0,5 г) в качестве катализатора. После поглощения Н 2 (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюентCH2Cl2/(СН 3 ОН/NН 3), 90/10). Чистые фракции собирают и растворитель выпаривают. Остаток суспендируют в петролейном эфире. Выпавшее в осадок вещество отфильтровывают и сушат и получают 0,23 г моногидрата -2-2-1-(2 аминоэтил)-4-пиперидинил]амино]-1 Н-бензимидазол-2-ил](6-метил-2-пиридинил)метокси]этанола (18%) (соединение 13). Пример В 13. Смесь -1-[4-1-(2-этоксиэтокси)(6-метил 2-пиридинил)метил]-1 Н-бензимидазол-2-ил]амино-1-пиперидинил]-3-метил-2-бутанона (0,0032 моль) и NН 3/СН 3 ОН (200 мл) гидрируют в тече 45 ние 3 суток при 20 С с 5% Rh/Al2O3 (1 г) в качестве катализатора в присутствии раствора тиофена (2 мл). После поглощения Н 2 (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/(СН 3 ОН/NН 3), 95/5). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из диизопропилового эфира, отфильтровывают и сушат и получают 0,58 г -N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(2-этоксиэтокси)(6-метил-2-пиридинил)метил]-1 Н-бензимидазол-2-амина (соединение 14). В табл. 4-8 приводится перечень соединений формулы (I), которые получают согласно одному из вышеприведенных примеров. Таблица 4(A) показывает первую выделенную стереоизомерную форму(B) показывает вторую выделенную стереоизомерную форму(A) показывает первую выделенную стереоизомерную форму(B) показывает вторую выделенную стереоизомерную форму(A) показывает первую выделенную стереоизомерную форму(B) показывает вторую выделенную стереоизомерную форму С. Фармакологический пример. Пример С 1. Скрининг in vitro на активность против респираторно-синцитиального вируса. Защиту, в процентах, от цитопатологии,вызываемой вирусами (антивирусную активность или IC50), достигаемую с помощью испытываемых соединений, и их цитотоксичность(CC50) вычисляют из кривых "доза-отклик". Селективность антивирусного действия представляют с помощью индекса селективности (SI),вычисляемого путем деления CC50 (цитотоксичная доза для 50% клеток) на IC50 (антивирусная активность в отношении 50% клеток). Для определения IC50 и CC50 испытываемых соединений используют автоматизированный колориметрический анализ на основе тетразолия. Плоскодонные лунки титрационных 96 луночных микропланшетов заполняют 180 мкл минимальной среды Игла с добавлением 5%FCS (0% в случае FLU) и 20 мМ буфера HEPES. Затем исходные растворы (конечная концентрация при испытаниях 7,8 х) соединений в объеме 45 мкл добавляют в группы из трех лунок с тем,чтобы одновременно оценить их действие на инфицированные вирусом и псевдоинфицированные клетки. Осуществляют 5 пятикратных разведений непосредственно в титрационных микропланшетах с использованием роботосистемы. В каждое испытание включают необработанный вирусом контроль и контрольные клетки HeLa. В два из трех рядов добавляют приблизительно 100 TCID50 (средних цитопатогенных доз) респираторно-синцитиального вируса в объеме 50 мкл. В третий ряд добавляют среду в таком же объеме для того, чтобы измерить цитотоксичность соединений при тех же концентрациях, которые используются для измерения антивирусной активности. После инкубации в течение 2 ч во все лунки добавляют суспензию клеток HeLa (4 х 105 клеток/мл) в объеме 50 мкл. Культуры инкубируют при 37 С в атмосфере с 5% СО 2. Через 7 суток после заражения проверяют цитотоксичность и антивирусную активность методом спектрофотометрии. В каждую лунку титрационного микропланшета добавляют 25 мкл раствора МТТ (3(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид). Планшеты инкубируют при 37 С еще в течение 2 ч, после чего удаляют среду из каждой лунки. Солюбилизации кристаллов формазана достигают, добавляя 100 мкл 2-пропанола. Полное растворение кристаллов форма 49 зана получают после помещения планшетов на планшетный шейкер на 10 мин. Наконец, снимают показатели поглощения на восьмиканальном управляемом компьютером фотометре(Multiskan MCC, Flow Laboratories) при двух длинах волн (540 и 690 нм). Поглощение, измеренное при 690 нм, автоматически вычитают из поглощения при 540 нм с тем, чтобы устранить влияние неспецифического поглощения. Конкретные величины IC50, CC50 и SI приводятся ниже в табл. 9. Таблица 9 соед. его пролекарство, N-оксид, аддитивная соль, четвертичный амин, комплекс с металлом или стереохимический изомер, где в указанной формуле-a1=a2-a3=a4- представляет двухвалентный радикал формулы-CH=CH-CH=N(а-5); где каждый атом водорода в радикалах (а-1), (а-2),(а-3), (а-4) и (а-5) может быть, необязательно,замещен галогеном, C1-6-алкилом, нитро, амино,гидрокси, C1-6-алкилокси, полигалоген-С 1-6 алкилом, карбоксилом, амино-C1-6-алкилом, моно- или ди(C1-4-алкил)амино-С 1-6-алкилом, C1-6 алкилоксикарбонилом, гидрокси-С 1-6-алкилом или радикалом формулыQ представляет собой радикал формулыY1 представляет собой двухвалентный радикал формулы -NR2-;v равен 2; и при этом каждый атом водорода в гетероцикле, указанном в радикале (b-5), может быть,необязательно, замещен R3; при условии, что когда R3 представляет собой гидрокси или C1-6 алкилокси, тогда R3 не может замещать атом водорода в положенииотносительно атома азота;G представляет собой C1-10-алкандиил, замещенный одним или несколькими гидрокси,C1-6-алкилокси, арил-С 1-6-алкилокси, C1-6-алкилтио, арил-С 1-6-алкилтио, НО(-СН 2-СН 2-O)n-, C1-6 алкилокси-(-СН 2-СН 2-O)n- или арил-С 1-6-алкилокси(-СН 2-СН 2-O)n-;R1 представляет собой, необязательно, замещенный моноциклический гетероцикл или арил, причем указанный гетероцикл выбирают из пиридила, пиразинила, пиридазинала, пиримидинила; и каждый гетероцикл может быть,необязательно, замещен 1 или, где это возможно, несколькими, например 2, 3 или 4, заместителями, выбранными из галогена, гидрокси,амино, циано, карбокси, C1-6-алкила, C1-6-алкилокси, C1-6-алкилтио, С 1-6-алкилокси-С 1-6-алкила,арила, арил-С 1-6-алкила, арил-С 1-6-алкилокси,гидрокси-С 1-6-алкила, моно- или ди(С 1-6-алкил) амино, моно- или ди(C1-6-алкил)амино-С 1-6-алкила, полигалоген-С 1-6-алкила, C1-6-алкилкарбониламино, C1-6-алкил-SO2-NR5c-, apил-SO2-NR5c-, C1-6 алкилоксикарбонила, -С(=O)-NR5cR5d, НО(-СН 2 СН 2-O)n-, галоген(-СН 2-СН 2-O)n-, C1-6-алкилоксиR5a и R5b или R5c и R5d, взятые вместе, образуют двухвалентный радикал формулы -(СН 2)s-,где s равен 4 или 5;R6 представляет собой водород, C1-4-алкил,формил, гидрокси-C1-6-алкил, C1-6-алкилкарбонил или C1-6-алкилоксикарбонил; арил представляет собой фенил или фенил,замещенный 1 или несколькими, например 2, 3Het представляет собой пиридил, пиримидинил, пиразинил, пиридазинил. 2. Соединение по п.1, где -a1=a2-a3=a4 представляет собой радикал формулы (а-1) или(а-2). 3. Соединение по п.1 или 2, где R1 представляет собой фенил, необязательно замещенный галогеном, C1-6-алкилом или C1-4-алкокси; или пиридил, необязательно замещенный 1 или несколькими заместителями, выбранными из арил-С 1-6-алкилокси, С 1-6-алкилокси-С 1-6-алкила,арила, моно- или ди(C1-6-алкил)амино, С(=O)NR5cR5d, галогена или C1-6-алкила. 4. Соединение по любому из пп.1-3, где G представляет собой C1-4-алкандиил, замещенный гидрокси, C1-6-алкилокси, НО(-СН 2-СН 2-O)n-, С 1-6 алкилокси(-СН 2-СН 2-O)n- или арил-С 1-6-алкилокси(-CH2-CH2-O)n-. 5. Соединение по любому из пп.1-4, где R2 представляет собой водород или C1-10-алкил,замещенный NHR6, где R6 представляет собой водород или C1-6-алкилоксикарбонил. 6. Соединение по п.1, где указанное соединение представляет собой-N-[1-(2-амино-3-метилбутил)-4-пиперидинил]-1-[(6-бром-2-пиридинил)этоксиметил]1 Н-бензимидазол-2-амин; его пролекарство, N-оксид, аддитивную соль, четвертичный амин, комплекс с металлом и стереохимически изомерная форма. 7. Применение соединения по любому из пп.1-6 в качестве лекарственного средства. 8. Применение по п.7, где лекарственное средство является средством для лечения или профилактики вирусных инфекций. 9. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-6. 10. Способ получения композиции по п.9,отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-6. 11. Промежуточное соединение формулы где R1, G и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем Р представляет собой защитную группу, и Q1 соответствует Q по п.1, но лишенному заместителя R2 или R6. 12. Промежуточное соединение формулы где R1, G и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем (O=)Q3 представляет собой карбонильное производное Q, и указанный Q имеет значения, указанные в п.1, при условии,что он лишен заместителя -NR2R4 или -NR2-. где R1, Q и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем (O=)G2 представляет собой карбонильное производное G, и указанный G имеет значения, указанные в п.1. 14. Способ получения соединения по п.1,отличающийся тем, что включает аминирование промежуточного соединения формулы (IX) где R1, G и -a1=a2-a3=a4- имеют значения, указанные в п.1, причем Н 2N-Q3 Н соответствует Q по п.1, при условии, что оба заместителя R6 представляют собой водород, или оба заместителя R2 и R4 представляют собой водород, и атом углерода, соседний с атомом азота, к которому присоединяются заместители R6 или R2 иR4, содержит по меньшей мере один водород, в присутствии подходящего агента аминирования; 54 и, при необходимости, превращение соединений формулы (I) друг в друга согласно известным в технике способам трансформации и затем, при необходимости, превращение соединения формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты путем обработки кислотой или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием или, напротив, превращение формы аддитивной соли кислоты в свободное основание путем обработки щелочью или превращение формы аддитивной соли основания в свободную кислоту путем обработки кислотой; и, при необходимости, получение его стереохимически изомерных форм,комплексов с металлами, четвертичных аминов или N-оксидных форм. 15. Продукт, содержащий (а) соединение по п.1 и (b) другое антивирусное соединение, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении или предупреждении вирусных инфекций. 16. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, (а) соединение по п.1 и (b) другое антивирусное соединение.
МПК / Метки
МПК: A61P 11/00, C07D 471/04, C07D 401/12, A61K 31/437
Метки: ингибиторы, вируса, респираторно-синцитиального, репликации
Код ссылки
<a href="https://eas.patents.su/28-5027-ingibitory-replikacii-respiratorno-sincitialnogo-virusa.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы репликации респираторно-синцитиального вируса</a>
Предыдущий патент: Многосекционный хедер с гибким режущим устройством для уборки сельскохозяйственных культур
Следующий патент: Пиримидинкарбоксамиды, используемые в качестве ингибиторов изозимов pde4
Случайный патент: Устройство я.м.адигезалова для предотвращения образования зубного камня на язычной поверхности передних нижних зубов












