Соединения – ингибиторы фермента
Номер патента: 23038
Опубликовано: 29.04.2016
Авторы: Карли Эллисон, Стюарт Элисон, Эванс Дэвид, Нордлинг Эрик, Хиггинботтом Майкл, Нильссон Марианне, Симпсон Айан, Харальдссон Мартин, Сейвори Эдвард, Коолмайстер Тобиас
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
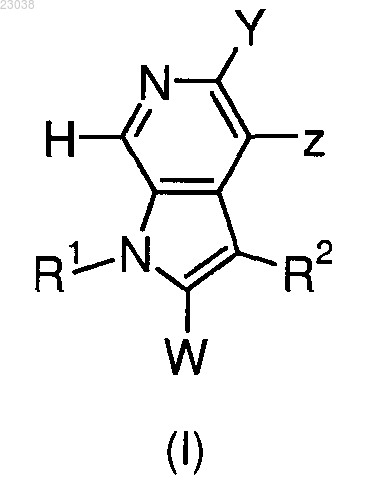
где R1 представляет собой фенил или 6-членный гетероарил, необязательно замещенный одним или более заместителями, выбранными из галогена, циано, гидроксила, C1-4-алкила, галогено-С1-4-алкила, C1-4-алкокси-C1-4-алкила, гидрокси-С1-4-алкила, циано-С1-4-алкила, амино-С1-4-алкила, С1-4-алкиламино-С1-4-алкила, ди(C1-4-алкил)амино-С1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5 и -NR6S(O)2R5;
R2 представляет собой -B-Q-[R3]n или -B-R3,
где n=1, 2, 3 или 4,
В представляет собой связь, О или С1-3-алкилен;
Q представляет собой насыщенное или частично ненасыщенное моноциклическое 3-7-членное гетероциклическое кольцо или С3-7-циклоалкильное кольцо;
когда R2 представляет собой -B-Q-[R3]n, R3 выбран из водорода, галогена, циано, амино, гидроксила, оксо, C1-4-алкила, галогено-С1-4-алкила, C1-4-алкокси, C1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, циано-С1-4-алкила, амино-C1-4-алкила, С1-4-алкиламино-С1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5, -S(O)2R5, фенил-C1-4-алкила и гетероарил-C1-4-алкила, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более чем одним заместителем, выбранным из галогена, циано, C1-4-алкила, галогено-C1-4-алкила, C1-4-алкокси, C1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, циано-С1-4-алкила, амино-С1-4-алкила, С1-4-алкиламино-С1-4-алкила, ди(C1-4-алкил)амино-С1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5;
когда R2 представляет собой -B-R3, R3 выбран из амино, С1-4-алкокси, С1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, циано-С1-4-алкила, амино-С1-4-алкила, С1-4-алкиламино-С1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)NR4AR4B, -C(O)R5, -NR6S(O)2R5, фенил-С1-4-алкила и гетероарил-С1-4-алкила, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более заместителями, выбранными из галогена, циано, C1-4-алкила, галогено-С1-4-алкила, C1-4-алкокси, C1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, циано-C1-4-алкила, амино-С1-4-алкила, C1-4-алкиламино-C1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5, при условии, что когда R2 представляет собой -B-R3 и В представляет собой связь, а R3 представляет собой -C(O)R5, тогда R5 не является водородом;
R4A, R4B и R5, каждый независимо, выбраны из водорода, C1-4-алкила, гидрокси-C1-4-алкила, галогено-С1-4-алкила, циано-C1-4-алкила, амино-C1-4-алкила, С1-4-алкиламино-С1-4-алкила, гидрокси-С1-4-алкиламино-С1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила или C1-4-алкокси-C1-4-алкила; либо R4A и R4B вместе с атомом азота, к которому они присоединены, образуют циклическую аминогруппу, выбранную из группы, состоящей из пиперидинила, морфолинила и гомопиперидинила;
R6 представляет собой водород или C1-4-алкил;
Y выбран из водорода, гидроксила, амино, -NHR6, -ОСН3;
Z выбран из водорода, фтора, гидроксила, C1-4-алкокси, галогено-С1-4-алкила, CONH2, циано, SO2NH2, амино, -NHR6 и
W выбран из Н, C1-4-алкила, галогено-C1-4-алкила; и где
термин "гетероарил" означает моноциклическое гетероароматическое кольцо, содержащее 5 или 6 кольцевых атомов, в котором один или более чем один из этих кольцевых атомов выбран из атома азота, серы или кислорода, и
термин "гетероциклический" означает насыщенную или частично ненасыщенную моноциклическую кольцевую структуру, имеющую от 3 до 7 кольцевых атомов, в которой один или более чем один из этих кольцевых атомов выбран из атома азота, серы или кислорода.
2. Соединение по п.1, где В представляет собой связь или метилен.
3. Соединение по п.1 или 2, где R1 необязательно замещен одним или более заместителями, выбранными из галогена, циано, гидроксила, С1-4-алкила, галогено-C1-4-алкила, C1-4-алкокси-C1-4-алкила, гидрокси-С1-4алкила, циано-С1-4-алкила, амино-С1-4-алкила, C1-4-алкиламино-C1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила, -NR4AR4B.
4. Соединение по п.1 или 2, где R1 представляет собой гетероарил, необязательно замещенный одним или более заместителями, выбранными из фтора, хлора и С1-4-алкила.
5. Соединение по любому из пп.1-3, где R1 представляет собой фенил, необязательно замещенный в пара-, мета- и орто-положениях одним или более заместителями, выбранными из водорода, фтора, хлора, циано, гидроксила, C1-4-алкила, фторметила, дифторметила или трифторметила.
6. Соединение по любому из пп.1-5, где R2 представляет собой -B-Q-[R3]n и Q представляет собой насыщенное или частично ненасыщенное 7-членное гетероциклическое или 7-членное циклоалкильное кольцо.
7. Соединение по п.1, где Q выбран из тетрагидрофуранила, тетрагидропиранила, пиперидинила, пиперазинила, морфолинила, циклогексила или любого из вышеуказанных колец, содержащего мостиковую связь, образованную этиленовым или пропиленовым радикалом.
8. Соединение по любому из пп.1-5, где R2 представляет собой морфолин-4-ил, морфолин-4-илметил, оксолан-3-ил, оксолан-3-илметил, оксан-4-илметил, оксан-4-ил или тетрагидропиридинил или где R2 представляет собой пиперидин-4-ил, пиперазин-1-ил, пиперидин-4-илметил, оксопиперазин или пиперазин-1-илметил, каждый из которых необязательно может быть замещен радикалом R3 на кольце или на кольцевом атоме азота в 1 положении.
9. Соединение по любому из пп.1-5, где R2 представляет собой:
(i) пиперидин-1-ил или пирролидин-1-ил; или
(ii) морфолин; или
(iii) циклопропил, циклобутил, циклопентил или циклогексил.
10. Соединение по п.1, где R2 представляет собой:
(i) одно- или двузамещенную аминогруппу, где заместители выбраны из С1-4-алкила, гидрокси-C1-4-алкила, галогено-C1-4-алкила, циано-C1-4-алкила, амино-C1-4-алкила, C1-4-алкиламино-C1-4-алкила, гидрокси-С1-4алкиламино-С1-4-алкила, ди(С1-4-алкил)амино-С1-4-алкила или C1-4-алкокси-C1-4-алкила; или
(ii) группу C1-4-алкокси-С1-4-алкил, гидрокси-C1-4-алкил, циано-С1-4-алкил, амино-С1-4-алкил, С1-4-алкиламино-C1-4-алкил или ди(C1-4-алкил)амино-C1-4-алкил.
11. Соединение по п.6, где Q представляет собой гомоморфолиновое кольцо или мостиковое гомоморфолиновое кольцо, где мостиковая связь образована этиленовым или пропиленовым радикалом.
12. Соединение по п.1, которое представляет собой
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-1,2,3,6-тетрагидропиридин;
трет-бутил-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксилат;
1-(4-хлорфенил)-3-пиперидин-4-ил-1Н-пирроло[2,3-с]пиридин;
трет-бутил-{N-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]циклогексил}карбамат;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]циклогексан-1-амин;
4-[1-(4-хлор-2-метилфенил)-1H-пирроло[2,3-с]пиридин-3-ил]циклогексан-1-амин;
1-{4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}-2-(диметиламино)этан-1-он;
1-{4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}-2-гидроксиэтан-1-он;
2-амино-1-{4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}этан-1-он;
3-амино-1-{4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}пропан-1-он;
2-{4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}этан-1-ол;
4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-(1H-пиразол-3-илметил)пиперидин;
4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-[(1-метил-1Н-пиразол-4-ил)метил]пиперидин;
3-{4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}пропаннитрил;
4-{4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}бутаннитрил;
[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метанол;
1-{[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метил}-4-метилпиперазин;
трет-бутил-4-{[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]метил}пиперазин-1-карбоксилат;
1-{[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метил}пиперазин;
2-(1-{[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метил}пиперидин-4-ил)этан-1-ол;
(1-{[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метил}пиперидин-4-ил)метанол;
4-{[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]метил}морфолин;
1-{[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метил}пиперидин-4-ол;
2-({[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метил}амино)этан-1-ол;
1-(4-хлорфенил)-3-(оксан-4-ил)-1Н-пирроло[2,3-с]пиридин;
1-(4-метилфенил)-3-(оксан-4-ил)-1Н-пирроло[2,3-с]пиридин;
5-хлор-2-[3-(оксан-4-ил)-1Н-пирроло[2,3-с]пиридин-1-ил]пиридин;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]морфолин;
4-амино-1-{4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}бутан-1-он;
2-аминоэтил-4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксилат;
3-(3,6-дигидро-2Н-пиран-4-ил)-2-метил-1-(4-метилфенил)-1Н-пирроло[2,3-с]пиридин
или их фармацевтически приемлемую соль.
13. Фармацевтическая композиция для лечения воспаления, воспалительного заболевания, иммунного или аутоиммунного расстройства или ингибирования опухолевого роста, содержащая соединение по любому из пп.1-12 и один или более фармацевтически приемлемых носителей и/или эксципиентов.
14. Применение соединения по любому из пп.1-12 для лечения воспаления, воспалительного заболевания, иммунного или аутоиммунного расстройства или ингибирования опухолевого роста.
15. Применение по п.14, где воспаление, либо воспалительное заболевание, либо иммунное или аутоиммунное расстройство выбрано из группы, состоящей из артрита, синовита, васкулита, состояния, связанного с воспалением кишечника, атеросклероза, рассеянного склероза, болезни Альцгеймера, сосудистой деменции, легочного воспалительного заболевания, фиброзного заболевания, воспалительного заболевания кожи, синдрома системного воспалительного ответа, сепсиса, воспалительного и аутоиммунного состояния печени, диабета типа I или II и его осложнений, хронической сердечной недостаточности, застойной сердечной недостаточности, ишемического заболевания, удара и повреждения при ишемии-реперфузии, инфаркта миокарда и его осложнений.
16. Применение по п.15, где артрит выбран из ревматоидного артрита, ювенильного ревматоидного артрита, остеоартрита и псориатического артрита.
17. Применение по п.15, где состояние, связанное с воспалением кишечника, выбрано из болезни Крона, неспецифического язвенного колита, воспалительного кишечного заболевания и синдрома раздраженной кишки.
18. Применение по п.15, где легочное воспалительное заболевание выбрано из астмы, хронической обструктивной болезни легких и острого респираторного дистресс-синдрома.
19. Применение по п.15, где фиброзное заболевание выбрано из идиопатического легочного фиброза, сердечного фиброза и системного склероза склеродермы.
20. Применение по п.15, где воспалительное заболевание кожи выбрано из контактного дерматита, атопического дерматита и псориаза.
21. Применение по п.15, где воспалительное и аутоиммунное состояние печени выбрано из аутоиммунного гепатита, первичного билиарного цирроза, алкогольного заболевания печени, склерозирующего холангита и аутоиммунного холангита.
Текст
Область изобретения Настоящее изобретение относится к соединениям, которые являются ингибиторами активности семикарбазид-чувствительной аминоксидазы (SSAO). Изобретение также относится к фармацевтическим композициям, содержащим эти соединения, и к применению этих соединений для лечения или профилактики медицинских состояний, где полезно ингибирование SSAO, таких как воспалительные заболевания, иммунные расстройства и ингибирование опухолевого роста. Предшествующий уровень техники Активность семикарбазид-чувствительной аминоксидазы (SSAO) представляет собой ферментативную активность, экспрессируемую васкулярным белком адгезии-1 (VAP-1) или аминоксидазой, содержащей медь 3 (АОС 3), принадлежащей к семейству ферментов медьсодержащих аминоксидаз(ЕС.1.4.3.6). Следовательно, ингибиторы фермента SSAO могут также модулировать биологические функции белка VAP-1. Члены этого семейства ферментов чувствительны к ингибированию семикарбазидом и используют ион меди и кофактор топахинон белкового происхождения (TPQ) в окислительном деаминировании первичных аминов до альдегидов, пероксида водорода и аммиака в соответствии с приведенной ниже реакциейR-CH2-NH2 + O2R-CHO + H2O2 + NH3 Известные субстраты для SSAO человека включают эндогенный метиламин и аминоацетон, а также некоторые ксенобиотические амины, такие как бензиламин [Lyles, Int. J. Biochem. Cell. Biol. 1996, 28,259-274; Klinman, Biochim. Biophys. Acta 2003, 1647(1-2), 131-137; Mtyus et al., Curr. Med. Chem. 2004,11(10), 1285-1298; O'Sullivan et al., Neurotoxicology 2004, 25(1-2), 303-315]. По аналогии с другими медьсодержащими аминоксидазами анализ последовательности ДНК и определение структуры позволяют предположить, что связывающаяся с тканью SSAO человека представляет собой гомодимерный гликопротеин, состоящий из двух субъединиц 90-100 кДа, заякоренный в плазматической мембране единственным N-концевым трансмембранным доменом [Morris et al., J. Biol. Chem. 1997, 272, 9388-9392; SmithCrystallogr. D Biol. Crystallogr. 2005, 61 (Pt 11), 1550-1562]. Активность SSAO обнаружена в ряде тканей, включающих васкулярную гладкомышечную ткань,эндотелий и жировую ткань [Lewinsohn, Braz. J. Med. Biol. Res. 1984, 17, 223-256; NakosGossrau, FoliaHistochem. Cytobiol. 1994, 32, 3-10; Yu et al., Biochem. Pharmacol. 1994, 47, 1055-1059; Castillo et al.,Neurochem. Int. 1998, 33, 415-423; LylesPino, J. Neural. Transm. Suppl. 1998, 52, 239-250; Jaakkola et al.,Am. J. Pathol. 1999, 155, 1953-1965; Morin et al., J. Pharmacol. Exp. Ther. 2001, 297, 563-572; SalmiJalkanen, Trends Immunol. 2001, 22, 211-216]. Кроме того, белок SSAO обнаружен в плазме крови, и оказывается, что эта растворимая форма обладает свойствами, подобными свойствам связанной с тканью формы [Yu et al., Biochem. Pharmacol. 1994, 47,1055-1059; Kurkijrvi et al., J. Immunol. 1998, 161, 1549-1557]. Недавно показано, что циркулирующая SSAO человека и грызунов имеет происхождение от формы, связанной с тканью [Gkturk et al., Am. J. Pathol. 2003, 163(5), 1921-1928; Abella et al., Diabetologia 2004,47(3), 429-438; Stolen et al., Circ. Res. 2004, 95(1), 50-57], тогда как у других млекопитающих плазматический/сывороточный SSAO также кодируется отдельным геном, названным АОС 4 [Schwelberger, J. Neural.Transm. 2007, 114(6), 757-762]. Точная физиологическая роль этого распространенного фермента еще не полностью определена,но, по-видимому, SSAO и продукты его реакции могут обладать несколькими функциями в клеточной передаче сигнала и регуляции. Например, недавние открытия позволяют предположить, что SSAO играет роль как в GLUT4-опосредованном захвате глюкозы [Enrique-Tarancon et al., J. Biol. Chem. 1998, 273,8025-8032; Morin et al., J. Pharmacol. Exp. Ther. 2001, 297, 563-572], так и в дифференциации адипоцитов[Fontana et al., Biochem. J. 2001, 356, 769-777; Mercier et al., Biochem. J. 2001, 358, 335-342]. Кроме того,показано, что SSAO вовлечен в воспалительные процессы, где он действует как белок адгезии для лейкоцитов [SalmiJalkanen, Trends Immunol. 2001, 22, 211-216; SalmiJalkanen, in "Adhesion Molecules:Functions and Inhibition" K. Ley (Ed.), 2007, pp. 237-251], a также может играть роль в развитии и поддержании матрикса соединительной ткани [Langford et al., Cardiovasc. Toxicol. 2002, 2(2), 141-150; Gkturk etal., Am. J. Pathol. 2003, 163(5), 1921-1928]. Кроме того, недавно открыта связь между SSAO и ангиогенезом [Noda et al., FASEB J. 2008, 22(8), 2928-2935], и на основании этой связи ожидают, что ингибиторыSSAO обладают антиангиогенным эффектом. В нескольких исследованиях на людях продемонстрировано, что активность SSAO в плазме крови повышена при таких состояниях, как застойная сердечная недостаточность, сахарный диабет, болезнь Альцгеймера и воспаление [Lewinsohn, Braz. J. Med. Biol. Res. 1984, 17, 223-256; Boomsma et al., Cardiovasc. Res. 1997, 33, 387-391; Ekblom, Pharmacol. Res. 1998, 37, 87-92; Kurkijrvi et al., J. Immunol. 1998,161, 1549-1557; Boomsma et al., Diabetologia 1999, 42, 233-237; Meszaros et al., Eur. J. Drug Metab. Pharmacokinet. 1999, 24, 299-302; Yu et al., Biochim. Biophys. Acta 2003, 1647(1-2), 193-199; Mtyus et al., Curr.Med. Chem. 2004, 11(10), 1285-1298; O'Sullivan et al., Neurotoxicology 2004, 25(1-2), 303-315; del Mar Hernandez et al., Neurosci. Lett. 2005, 384(1-2), 183-187]. Механизмы, лежащие в основе этих изменений активности фермента, неясны. Предположили, что реактивные альдегиды и пероксид водорода, продуцируемые эндогенными аминоксидазами, вносят вклад в прогрессирование сердечно-сосудистых заболева-1 023038 ний, осложнений диабета и болезни Альцгеймера [Callingham et al., Prog. Brain Res. 1995, 106, 305-321;al., Neuropathol Appl Neurobiol. 2008, 34(2), 194-204]. Кроме того, ферментативная активность SSAO вовлечена в процесс экстравазации лейкоцитов в сайтах воспаления, где показана сильная экспрессияSSAO на эндотелии кровеносных сосудов [Salmi et al., Immunity 2001, 14(3), 265-276; SalmiJalkanen, in"Adhesion Molecules: Functions and Inhibition" K. Ley (Ed.), 2007, pp. 237-251]. Соответственно, предположили, что ингибирование SSAO обладает терапевтической ценностью для профилактики диабетических осложнений и при воспалительных заболеваниях [Ekblom, Pharmacol. Res. 1998, 37, 87-92; Salmi etal., Immunity 2001, 14(3), 265-276; Salter-Cid et al., J. Pharmacol. Exp. Ther. 2005, 315(2), 553-562]. Нокаут-животные по SSAO являются фенотипически очевидно нормальными, но проявляют заметное снижение в воспалительных ответах, вызванных в ответ на различные воспалительные стимулы [Stolen et al., Immunity 2005, 22(1), 105-115]. Кроме того, показано, что антагонизм его функции у животных дикого типа во множестве животных моделей заболевания человека (например, индуцированное каррагенаном воспаление лапы, индуцированный оксазолоном колит, индуцированное липополисахаридом воспаление легких, индуцированный коллагеном артрит, индуцированный эндотоксином увеит) в результате использования антител и/или малых молекул является защитным при снижении инфильтрации лейкоцитов, уменьшении тяжести болезненного фенотипа и снижении уровней воспалительных цитокинов и хемокинов [Kirton et al., Eur. J. Immunol. 2005, 35(11), 3119-3130; Salter-Cid et al., J. Pharmacol. Exp.al., FASEB J. 2008 22(4), 1094-1103; Noda et al., FASEB J. 2008, 22(8), 2928-2935]. По-видимому, эта противовоспалительная защита получена на протяжении широкого ряда моделей воспаления, всех с независимыми причинными механизмами, вероятнее, чем ограничена одним конкретным заболеванием или моделью заболевания. Это позволило бы предположить, что SSAO может быть ключевой узловой точкой для регуляции воспалительного ответа, и, следовательно, вероятно, что ингибиторы SSAO являются эффективными противовоспалительными лекарственными средствами при широком ряде заболеваний человека.SSAO (VAP-1) претерпевает повышающую регуляцию при раке ЖКТ и идентифицирован в опухолевой сосудистой сети меланомы, гепатомы и опухолей головы и шеи человека (Yoong KF, McNab G,Hubscher SG, Adams DH. (1998), J Immunol 160, 3978-88.; Irjala H, Salmi M, Alanen K, Gre'nman R,Jalkanen S (2001), Immunol. 166, 6937-6943; Forster-Horvath C, Dome В, Paku S, et al. (2004), MelanomaRes. 14, 135-40.). В одном сообщении (Marttila-lchihara F, Castermans K, Auvinen К, Oude Egbrink MG,Jalkanen S, Griffioen AW, Salmi M. (2010), J Immunol. 184, 3164-3173.) показано, что у мышей, несущих ферментативно неактивный VAP-1, меланомы растут медленнее, и они имеют сниженное число и диаметр опухолевых кровеносных сосудов. Сниженный рост этих опухолей также отражался в сниженной(на 60-70%) инфильтрации миелоидных супрессорных клеток. Благоприятно, что дефицит VAP-1 не обладает эффектом на формирование кровеносных или лимфатических сосудов в нормальной ткани. Малые молекулы различных структурных классов ранее раскрыты как ингибиторы SSAO, например, в WO 02/38153 (производные тетрагидроимидазо[4,5-с]пиридина), в WO 03/006003 (производные 2 инданилгидразина), в WO 2005/014530 (аллилгидразиновые и гидроксиламинные (аминоокси) соединения) и в WO 2007/120528 (аллиламиносоединения). Дополнительные ингибиторы SSAO раскрыты в РСТ/ЕР 2009/062011 и РСТ/ЕР 2009/062018. Изобретение, описанное в данной заявке, относится к новому классу ингибиторов SSAO с биологическими, фармакологическими и фармакокинетическими характеристиками, которые делают их пригодными для применения в качестве профилактических или терапевтических агентов при широком ряде воспалительных заболеваний и иммунных расстройств человека. Их терапевтическая способность предназначена для блокирования действия фермента SSAO, снижения уровня провоспалительных продуктов фермента (альдегидов, пероксида водорода и аммиака), также снижая при этом способность иммунных клеток к адгезии и, соответственно, их активацию и конечную экстравазацию. Заболевания, где ожидают,что такая активность обладает терапевтической пользой, включают все заболевания, где иммунные клетки играют выраженную роль в инициации, поддержании или купировании патологии, такие как рассеянный склероз, артрит и васкулит. Подробное описание изобретения Неожиданно обнаружено, что соединения приведенной ниже формулы (I) являются ингибиторамиSSAO. Следовательно, они полезны для лечения или профилактики заболеваний, при которых благоприятно ингибирование активности SSAO, таких как воспаление, воспалительные заболевания, иммунные или аутоиммунные расстройства и ингибирование опухолевого роста. В соответствии с изобретением предложено соединение формулы (I) или его фармацевтически приемлемая соль где R1 представляет собой фенил или 6-членный гетероарил, необязательно замещенный одним или более заместителями, выбранными из галогена, циано, гидроксила, C1-4-алкила, галогено-С 1-4-алкила, С 1-4 алкокси-С 1-4-алкила, гидрокси-C1-4-алкила, циано-С 1-4-алкила, амино-С 1-4-алкила, С 1-4-алкиламино-С 1-4 алкила, ди(С 1-4-алкил)амино-С 1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B,-C(O)NR4AR4B, -C(O)R5, -C(O)OR5 и -NR6S(O)2R5;Q представляет собой насыщенное или частично ненасыщенное моноциклическое 3-7-членное гетероциклическое кольцо или С 3-7-циклоалкильное кольцо; когда R2 представляет собой -B-Q-[R3]n, R3 выбран из водорода, галогена, циано, амино, гидроксила,оксо, С 1-4-алкила, галогено-С 1-4-алкила, С 1-4-алкокси, С 1-4-алкокси-С 1-4-алкила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила,амино-С 1-4-алкила,C1-4-алкиламино-С 1-4-алкила,ди(С 1-4-алкил)амино-С 1-4-алкила,-NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5,-S(O)2R5, фенил-С 1-4-алкила и гетероарил-С 1-4-алкила, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более чем одним заместителем, выбранным из галогена, циано, С 1-4 алкила, галогено-С 1-4-алкила, C1-4-алкокси, C1-4-алкокси-C1-4-алкила, гидрокси-С 1-4-алкила, циано-С 1-4 алкила, амино-С 1-4-алкила, С 1-4-алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкила, -NR4AR4B,-NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5; когда R2 представляет собой -B-R3, R3 выбран из амино, С 1-4-алкокси, С 1-4-алкокси-С 1-4-алкила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, амино-С 1-4-алкила, С 1-4-алкиламино-С 1-4-алкила, ди(С 1-4-алкил) амино-С 1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)NR4AR4B, -C(O)R5, -NR6S(O)2R5, фенил-С 1-4-алкила и гетероарил-С 1-4-алкила, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более заместителями, выбранными из галогена, циано, С 1-4-алкила, галогено-С 1-4-алкила, С 1-4 алкокси, С 1-4-алкокси-С 1-4-алкила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, амино-С 1-4-алкила, С 1-4 алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5,-NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5, при условии, что, когда R2 представляет собой -B-R3, и В представляет собой связь, a R3 представляет собой C(O)R5, тогда R5 не является водородом;R6 представляет собой водород или С 1-4-алкил;W выбран из Н, C1-4-алкила, галогено-С 1-4-алкила; и где термин "гетероарил" означает моноциклическое гетероароматическое кольцо, содержащее 5 или 6 кольцевых атомов, в котором один или более чем один из этих кольцевых атомов выбран из атома азота,серы или кислорода, и термин "гетероциклический" означает насыщенную или частично ненасыщенную моноциклическую кольцевую структуру, имеющую от 3 до 7 кольцевых атомов, в которой один или более чем один из этих кольцевых атомов выбран из атома азота, серы или кислорода. Очевидно, что соединения по изобретению могут быть получены в форме гидратов и сольватов. Любая ссылка в данной заявке, включая формулу изобретения, на "соединения, к которым относится изобретение", или "соединения по изобретению", или "настоящие соединения" и т.п. включает ссылку на соли, гидраты и сольваты таких соединений. Термин "сольват" используют в данной заявке для описания молекулярного комплекса, содержащего соединение по изобретению и стехиометрическое количество молекул одного или более чем одного фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" используют, где растворителем является вода. Индивидуальные соединения по изобретению могут существовать в аморфной форме и/или в нескольких полиморфных формах и могут быть получены в различных кристаллических формах. Любая-3 023038 ссылка в данной заявке, включая формулу изобретения, на "соединения, к которым относится изобретение", или "соединения по изобретению", или "настоящие соединения" и т.п. включает ссылку на соединения независимо от аморфной или полиморфной формы. Определения Приведенные ниже определения применяют на протяжении всего описания и прилагаемой формулы изобретения, если не утверждается или не указано иное. Термин "С 1-4-алкил" означает прямоцепочечную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Для частей интервала С 1-4-алкил рассмотрены все его подгруппы, такие как C1-3 алкил, C1-2-алкил, С 2-4-алкил, С 2-3-алкил и С 3-4-алкил. Примеры C1-4-алкила включают метил, этил, нпропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Термин "C1-4-алкокси" относится к прямоцепочечной или разветвленной C1-4-алкильной группе, которая присоединена к остальной части молекулы через атом кислорода. Для частей интервала C1-4 алкокси рассмотрены все его подгруппы, такие как C1-3-алкокси, C1-2-алкокси, С 2-4-алкокси, С 2-3-алкокси и С 3-4-алкокси. Примеры C1-4-алкокси включают метокси, этокси, н-пропокси, изопропокси, н-бутокси,изобутокси, втор-бутокси и трет-бутокси. Термин "гидрокси-С 1-4-алкил" означает прямоцепочечную или разветвленную С 1-4-алкильную группу, один или более чем один атом водорода, которой замещен ОН. Примеры гидрокси-С 1-4-алкила включают гидроксиметил, 2-гидроксиэтил и 2,3-дигидроксипропил. Термин "галогено-С 1-4-алкил" означает прямоцепочечную или разветвленную C1-4-алкильную группу, один или более чем один атом водорода, которой замещен атомом галогена. Примеры галогено-С 1-4 алкила включают фторметил, трифторметил, трихлорметил и 2-фторэтил. Термин "циано-С 1-4-алкил" означает прямоцепочечную или разветвленную C1-4-алкильную группу,один или более чем один атом водорода, которой замещен циано. Примеры циано-С 1-4-алкила включают цианометил, 2-цианоэтил и 3-цианопропил. Термин "амино-С 1-4-алкил" означает прямоцепочечную или разветвленную C1-4-алкильную группу,замещенную аминогруппой. Примеры амино-С 1-4-алкильной группы включают аминометил и 2 аминоэтил. Термин "С 1-4-алкиламино-С 1-4-алкил" означает амино-С 1-4-алкильную группу, как определено выше,где аминогруппа замещена прямоцепочечной или разветвленной C1-4-алкильной группой. Примеры С 1-4 алкиламино-С 1-4-алкила включают метиламиноэтил и этиламинопропил. Термин "ди(С 1-4-алкил)амино-С 1-4-алкил" означает амино-С 1-4-алкильную группу, как определено выше, где аминогруппа является двухзамещенными прямоцепочечными или разветвленными С 1-4 алкильными группами, которые могут быть одинаковыми или разными. Примеры ди(С 1-4-алкил)аминоС 1-4-алкила включают N,N-диметиламинометил, N-этил-N-метиламиноэтил и N,N-диэтиламинометил. Термин "С 1-4-алкоксикарбониламино-С 1-4-алкил" означает амино-С 1-4-алкильную группу, как определено выше, где аминогруппа замещена прямоцепочечной или разветвленной C1-4-алкоксикарбонильной группой, C1-4-алкокси-С(О)-. Примеры С 1-4-алкоксикарбониламино-С 1-4-алкила включают метоксикарбониламинометил и трет-бутоксикарбониламиноэтил. Термины "гетероарил" и "гетероароматическое кольцо" означают моноциклическое гетероароматическое кольцо, содержащее от 5 до 6 кольцевых атомов, в котором один или более чем один их этих кольцевых атомов является иным, чем атом углерода, таким как атом азота, серы или кислорода. Примеры гетероарильных групп включают фурил, пирролил, тиенил, оксазолил, изоксазолил, имидазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, тетразолил, пиразолил, пиридазинил, пиразинил и тиадиазолил. Термины "гетероциклический" и "гетероциклическое кольцо" включают гетероарил и относятся к моноциклической кольцевой структуре, имеющей от 3 до 7 кольцевых атомов, в частности 5 или 6 кольцевых атомов, в котором один или более чем один их этих кольцевых атомов является иным, чем атом углерода, таким как атом азота, серы или кислорода. Примеры гетероциклических групп включают гетероарильные группы, упомянутые в предыдущем параграфе, а также группы пиперидинил, морфолинил,гомоморфолинил, азепанил, пиперазинил, оксопиперазинил, диазепинил, тетрагидропиридинил, тетрагидропиранил, пирролидинил, тетрагидрофуранил и дигидропирролил. Термин "фенил-С 1-4-алкил" относится к фенильной группе, которая прямо связана с прямоцепочечной или разветвленной C1-4-алкильной группой. Примеры фенил-С 1-4 алкила включают фенилметил (т.е. бензил), 2-фенилэтил и 2-фенилпропил. Термин "гетероциклил-С 1-4-алкил" относится к гетероциклическому кольцу, которое прямо связано с прямоцепочечной или разветвленной C1-4-алкильной группой через атом углерода или азота этого кольца. Примеры гетероциклил-С 1-4-алкила включают пиперидин-4-илметил, пиперидин-1-илметил,морфолин-4-ил-метил и пиперазин-4-илметил. Термин "гетероарил-С 1-4-алкил" относится к гетероарильному кольцу, которое прямо связано с прямоцепочечной или разветвленной С 1-4-алкильной группой через атом углерода или азота этого кольца. Примеры гетероарил-С 1-4-алкила включают пиразолилметил, тиазолилметил и пиридинилэтил. Термин "C1-3-алкилен" означает прямоцепочечную или разветвленную двухвалентную насыщенную-4 023038 углеводородную цепь, имеющую от 1 до 3 атомов углерода. C1-3-алкиленовая цепь может быть присоединена к остальной молекуле и к радикальной группе через один атом углерода внутри цепи или через любые два атома углерода внутри цепи. Примеры C1-3-алкиленовых радикалов включают метилен [-СН 2-],1,2-этилен [-СН 2-СН 2-], 1,1-этилен [-СН(СН 3)-], 1,2-пропилен [-СН 2-СН(СН 3)-] и 1,3-пропилен [-СН 2 СН 2-СН 2-]. При ссылке на радикал "С 1-3-алкилен" рассмотрены все его подгруппы, такие как С 1-2-алкилен и С 2-3-алкилен."Необязательный" или "необязательно" означает, что описанное после того событие или обстоятельство может, но не обязательно, произойти, и что это описание включает случаи, где это событие или обстоятельство происходит, и случаи, где оно не происходит."Фармацевтически приемлемый" означает применимый для получения фармацевтической композиции, т.е. в целом безопасный, не токсичный и не являющийся ни биологически, ни иначе нежелательным,и включает пользу как для ветеринарного применения, так и для фармацевтического применения для человека."Лечение", как используют в данной заявке, включает профилактику названного расстройства или состояния, либо облегчение или устранение этого расстройства, как только оно установлено."Эффективное количество" относится к количеству соединения, которое оказывает терапевтический эффект на субъекта, подлежащего лечению. Терапевтический эффект может быть объективным (т.е. измеримым каким-либо тестом или маркером) или субъективным (т.е. субъект дает указание на то, что он ощущает эффект)."Пролекарства" относятся к соединениям, которые могут быть преобразованы в физиологических условиях или посредством сольволиза в биологически активное соединение по изобретению. Пролекарство может быть неактивным при введении субъекту, нуждающемуся в этом, но преобразуется in vivo в активное соединение по изобретению. Пролекарства типично быстро преобразуются in vivo с получением исходного соединения по изобретению, например в результате гидролиза в крови. Пролекарственное соединение обычно дает преимущества растворимости, тканевой совместимости или замедленного высвобождения в организме млекопитающего (см. Silverman, R.В., The Organic Chemistry of Drug Design andDrug Action, 2nd Ed., Elsevier Academic Press (2004), pp. 498-549). Пролекарства соединения по изобретению могут быть получены путем модифицирования функциональных групп, таких как гидрокси, амино или меркаптогруппы, присутствующие в соединении по изобретению, таким путем, что эти модификации расщепляются либо при рутинных манипуляциях, либо in vivo в исходное соединение по изобретению. Примеры пролекарств включают, но не ограничены ими, ацетатные, формиатные и сукцинатные производные функциональных групп гидрокси или фенилкарбаматные производные функциональных групп амино. На протяжении всего описания и прилагаемой формулы изобретения данная химическая формула или название должны включать все их соли, гидраты, сольваты и пролекарственные формы. Кроме того,данная химическая формула или название должны включать все их таутомерные и стереоизомерные формы. Таутомеры включают енольные и кетоформы. Стереоизомеры включают энантиомеры и диастереомеры. Энантиомеры могут быть представлены в их чистых формах или в виде рацемических (равных) или неравных смесей двух энантиомеров. Диастереомеры могут быть представлены в их чистых формах или в виде смесей диастереомеров. Диастереомеры также включают геометрические изомеры, которые могут быть представлены в их чистых цис- или транс-формах или в виде их смесей. Соединения формулы (I) можно использовать как таковые или, где целесообразно, в виде их фармацевтически приемлемых солей (солей присоединения кислоты или основания). Фармацевтически приемлемые соли присоединения, упомянутые ниже, подразумевают как включающие терапевтически активные нетоксичные солевые формы присоединения кислоты или основания, которые соединения способны образовать. Соединения, которые обладают основными свойствами, могут быть преобразованы в их фармацевтически приемлемые соли присоединения кислоты путем обработки основной формы подходящей кислотой. Примерные кислоты включают неорганические кислоты, такие как хлорид водорода,бромид водорода, йодид водорода, серная кислота, фосфорная кислота; и органические кислоты, такие как муравьиная кислота, уксусная кислота, пропановая кислота, гидроксиуксусная кислота, молочная кислота, пировиноградная кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, щавелевая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, метансульфоновая кислота,трифторуксусная кислота, фумаровая кислота, янтарная кислота, яблочная кислота, винная кислота, лимонная кислота, салициловая кислота, парааминосалициловая кислота, памовая кислота, бензойная кислота, аскорбиновая кислота и тому подобное. Примерными солевыми формами присоединения основания являются соли натрия, калия, кальция и соли с фармацевтически приемлемыми аминами, такими как,например, аммиак, алкиламины, бензатин и аминокислоты, такие как, например, аргинин и лизин. Тер-5 023038 мин соль присоединения, как используют в данной заявке, также включает сольваты, которые соединения и их соли способны образовать, такие как, например, гидраты, алкоголяты и тому подобное. Группа В. В форме осуществления изобретения В представляет собой связь, О или С 1-3 алкилен, как, например метиленовый, этиленовый или пропиленовый радикал. В предпочтительной форме осуществления В представляет собой связь или метилен. В другой предпочтительной форме осуществления В представляет собой связь. Группа Y. В предпочтительной форме осуществления изобретения Y выбран из водорода, гидроксила, амино(NH2), -NHR6, как, например, NHCH3, NHCH2CH3 или -ОСН 3. В другой предпочтительной форме осуществления Y представляет собой Н, ОН или NH2. В альтернативной предпочтительной форме осуществления Y представляет собой водород. Группа Z.Z выбран из водорода, фтора, гидроксила, C1-4-алкокси, такого как метокси или этокси, галогено-С 1-4 алкила, такого как фторметил, дифторметил или трифторметил, CONH2, циано, SO2NH2, амино, -NHR6,как, например, NHCH3, NHCH2CH3. В предпочтительной форме осуществления изобретения Z представляет собой водород или гидроксил. Группа W. В предпочтительной форме осуществления изобретения W выбран из H, C1-4-алкила, такого как метил, этил, пропил, изопропил, или галогено-С 1-4-алкила, такого как фторметил, дифторметил или трифторметил. В другой предпочтительной форме осуществления изобретения W представляет собой водород. Группа R1. В одной форме осуществления изобретения R1 представляет собой фенил или 6-членный гетероарил, такой как пиридин, пиридазин, пиримидин, пиразин, необязательно замещенный одним или более чем одним заместителем, выбранным из галогена, такого как атом хлора или фтора, циано, гидроксила,C1-4-алкила, такого как метил, этил, пропил или изопропил, галогено-С 1-4-алкила, такого как фторметил,дифторметил или трифторметил, С 1-4-алкокси-С 1-4-алкила, гидрокси-С 1-4-алкила, такого как гидроксиметил или гидроксиэтил, циано-С 1-4-алкила, такого как цианометил или цианоэтил, амино-С 1-4-алкила, такого как аминометил, аминоэтил или аминопропил, С 1-4-алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4 алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5 и-NR6S(O)2R5. В предпочтительной форме осуществления изобретения R1 необязательно замещен одним или более чем одним заместителем, выбранным из галогена, такого как атом фтора или хлора, циано, гидроксила,С 1-4-алкила, такого как метил или этил, галогено-С 1-4-алкила, такого как фторметил, дифторметил или трифторметил, С 1-4-алкокси-С 1-4-алкила, гидрокси-С 1-4-алкила, цианоС 1-4-алкила, такого как цианометил или цианоэтил, амино-С 1-4-алкила, С 1-4-алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкила,-NR4AR4B. В другой предпочтительной форме осуществления R1 представляет собой гетероарил, такой как пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, необязательно замещенный одним или более чем одним заместителем, выбранным из фтора, хлора и С 1-4-алкила, такого как метил, этил, пропил или изопропил. В альтернативной форме осуществления R1 представляет собой фенил, необязательно замещенный в одном или более чем одном из пара-, мета- и орто-положений одним или более чем одним заместителем, выбранным из водорода, фтора, хлора, циано, гидроксила, С 1-4-алкила, такого как метил, этил, пропил или изопропил, или фторметила, дифторметила или трифторметила. В предпочтительной форме осуществления R1 представляет собой фенил, замещенный в параположении заместителем, выбранным из фтора, хлора, циано, гидроксила, С 1-4-алкила, такого как метил,этил, пропил или изопропил, или фторметила, дифторметила или трифторметила. В альтернативной предпочтительной форме осуществления паразаместитель выбран из фтора, хлора или метила. В другой предпочтительной форме осуществления R1 представляет собой фенил, замещенный в мета-положении атомом водорода. В следующей предпочтительной форме осуществления R1 представляет собой фенил, замещенный в орто-положении заместителем, выбранным из водорода, фтора, метила, фторметила, дифторметила или трифторметила. В другой предпочтительной форме осуществления R1 представляет собой фенил, замещенный в орто-положении атомом водорода, фтора или метилом. В предпочтительной форме осуществления изобретения R1 представляет собой одно-, двух- или трехзамещенное фенильное кольцо, где орто-, мета- и/или пара-положения могут представлять собой любую комбинацию заместителей, приведенных выше. В предпочтительной форме осуществления необязательные заместители R1 имеют длину 4 атома или менее, предпочтительно 3 атома или менее, более предпочтительно 2 атома или менее. Группа R2. В одной предпочтительной форме осуществления изобретения R2 представляет собой -B-Q-[R3]n, n-6 023038 может быть равно 1, 2, 3 или 4. В другой предпочтительной форме осуществления n равно 1 или 2. Кольцо Q представляет собой насыщенное или частично ненасыщенное моноциклическое 3-7 членное гетероциклическое или С 3-7-циклоалкильное кольцо, замещенное R3. В предпочтительной форме осуществления Q представляет собой насыщенное или частично ненасыщенное 7-членное гетероциклическое кольцо, такое как гомоморфолиновое кольцо, или мостиковое гомоморфолиновое кольцо, где мостиковая связь образована этиленовым или пропиленовым радикалом, либо 7-членное циклоалкильное кольцо, такое как циклогептан. В альтернативной предпочтительной форме осуществления Q представляет собой насыщенное или частично ненасыщенное 5- или 6-членное гетероциклическое кольцо, такое как тетрагидрофуранил, тетрагидропиранил, пиперидинил, пиперазинил, морфолинил, циклогексил, или любое из вышеуказанных колец, содержащего мостиковую связь, образованную этиленовым или пропиленовым радикалом, либо 5- или 6-членное циклоалкильное кольцо, такое как циклопентил или циклогексил. В предпочтительной форме осуществления R2 представляет собой -B-Q-[R3]n, где R3 выбран из водорода, галогена, такого как фтор или хлор, циано, амино (-NH2), гидроксила, оксо (=O), C1-4-алкила, такого как метил, этил, пропил, изопропил, бутил, галогено-С 1-4-алкила, такого как фторметил, дифторметил или трифторметил, C1-4-алкокси, такого как метокси, этокси, пропокси или изопропокси, С 1-4 алкокси-С 1-4-алкила, такого как метоксиметил, метоксиэтил или этоксиэтил, гидрокси-С 1-4-алкила, такого как гидроксиметил или гидроксилэтил, циано-С 1-4-алкила, такого как цианометил или цианоэтил, аминоС 1-4-алкила, такого как аминометил или аминоэтил, С 1-4-алкиламино-С 1-4-алкила, такого как метиламиноэтил, ди(С 1-4-алкил)амино-С 1-4-алкила, такого как диметиламиноэтил, -NR4AR4B, где R4A и R4B представляют собой, например, водород, метил или этил, либо, взятые с атомом азота, к которому они присоединены, образуют циклическую аминогруппу, выбранную из группы, состоящей из пиперидинила, морфолинила или гомопиперидинила, -NR6C(O)OR5, -NR6C(O)R5, где R6 представляет собой, например, водород, и R5 представляет собой, например, метил, этил или н- или изопропил, -NR6C(O)NR4AR4B или-C(O)NR4AR4B, где R6 представляет собой, например, водород, и R4A и R4B представляют собой, например,водород, метил или этил, либо взятые с атомом азота, к которому они присоединены, образуют циклическую аминогруппу, выбранную из группы, состоящей из пиперидинила, морфолинила или гомопиперидинила, -C(O)R5 или -C(O)OR5, -NR6S(O)2R5, -S(O)2R5, где R5 представляет собой, например, водород,метил, этил, фенил-С 1-4-алкил, такой как бензил или фенилэтил, и гетероарил-С 1-4-алкил, имеющий 5 или 6 кольцевых атомов в гетероарильной части, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более заместителями, выбранными из галогена, циано, C1-4-алкила, галогено-С 1-4-алкила, С 1-4-алкокси, С 1-4-алкокси-С 1-4-алкила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, амино-С 1-4 алкила, С 1-4-алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкила, -NR4AR4B, NR6C(O)OR5,-NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5. В альтернативной предпочтительной форме осуществления R2 представляет собой -B-R3, где R3 выбран из амино (-NH2), C1-4-алкокси, такого как метокси, этокси, пропокси или изопропокси, С 1-4-алкоксиС 1-4-алкила, такого как метоксиметил, метоксиэтил или этоксиэтил, гидрокси-С 1-4-алкила, такого как гидроксиметил или гидроксилэтил, циано-С 1-4-алкила, такого как цианометил или цианоэтил, амино-С 1-4 алкила, такого как аминометил или аминоэтил, С 1-4-алкиламино-С 1-4-алкила, такого как метиламиноэтил,ди(С 1-4-алкил)амино-С 1-4-алкила,такого как диметиламиноэтил,-NR4AR4B,-NR6C(O)OR5,6 4A 4B 5 6 5-NR C(O)NR R , -C(O)R , -NR S(O)2R , фенил-С 1-4-алкила и гетероарил-С 1-4-алкила, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более заместителями, выбранными из галогена, циано, С 1-4-алкила, галогено-С 1-4-алкила, С 1-4-алкокси, С 1-4-алкокси-С 1-4-алкила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, амино-С 1-4-алкила, С 1-4-алкиламино-С 1-4-алкила, ди(С 1-4-алкил)аминоС 1-4-алкила,-NR4AR4B,-NR6C(O)OR5,-NR6C(O)R5,-NR6C(O)NR4AR4B,-C(O)NR4AR4B,5 5 6 5 2 3-C(O)R , -C(O)OR , -NR S(O)2R , при условии, что, когда R представляет собой -B-R и В представляет собой связь, a R3 представляет собой -C(O)R5, тогда R5 не является водородом. В предпочтительных формах осуществления изобретения R4A, R4B и R5 являются такими, как определено выше. В предпочтительной форме осуществления изобретения R2 выбран из морфолина, включающего морфолин-4-ил, морфолин-4-илметил, оксолана, включающего оксолан-3-ил, оксолан-3-илметил, оксана,включающего оксан-4-илметил, оксан-4-ил, тетрагидропиридинила, пиперидина, включающего пиперидин-4-ил, пиперидин-4-илметил, оксопиперидина, пиперазина, включающего пиперазин-1-ил, оксопиперазина или пиперазин-1-илметила, где любой из них замещен R3 на кольце или на кольцевом атоме азота в 1 положении. В альтернативной предпочтительной форме осуществления R2 выбран из(i) пиперидина, включающего пиперидин-1-ил, пирролидина, включающего пирролидин-1-ил, и циклопропила, циклобутила, циклопентила или циклогексила, где любой из них замещен R3 на кольце;(ii) одно- или двузамещенной аминогруппы, где заместители выбраны из C1-4-алкила, гидрокси-C1-4 алкила, галогено-C1-4-алкила, циано-С 1-4-алкила, амино-C1-4-алкила, C1-4-алкиламино-C1-4-алкила, гидрокси-C1-4-алкиламино-C1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила или C1-4-алкокси-C1-4-алкила, где в любом из вышеуказанного C1-4-алкильная часть может представлять собой метил, этил или н- или изопро-7 023038 пил, а C1-4-алкокси часть может представлять собой этокси или метокси;(iii) C1-4-алкокси-C1-4-алкильной, гидрокси-С 1-4-алкильной, циано-С 1-4-алкильной, амино-C1-4 алкильной, C1-4-алкиламино-C1-4-алкильной или ди(C1-4-алкил)амино-C1-4-алкильной группы, где в любом из вышеуказанного C1-4-алкильная часть может представлять собой метил, этил или н- или изопропил, аC1-4-алкокси часть может представлять собой этокси или метокси. В любом из соединений по изобретению группа R2 может представлять собой любую из конкретных групп R2 соответствующего положения любого из нижеописанных примеров. Конкретные предпочтительные формы осуществления изобретения включают 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1,2,3,6-тетрагидропиридин; трет-бутил-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксилат; 1-(4-хлорфенил)-3-пиперидин-4-ил-1 Н-пирроло[2,3-с]пиридин; трет-бутил-N-1-(4-хпорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]циклогексилкарбамат; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]циклогексан-1-амин; 4-[1-(4-хлор-2-метилфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]циклогексан-1-амин; 1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил-2-(диметиламино)этан-1 он; 1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил-2-гидроксиэтан-1-он; 2-амино-1-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илэтан-1-он; 3-амино-1-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илпропан-1-он; 2-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илэтан-1-ол; 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-(1 Н-пиразол-3-илметил)пиперидин; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]-1-[(1-метил-1 Н-пиразол-4-ил)метил]пиперидин; 3-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илпропаннитрил; 4-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илбутаннитрил;(1-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилпиперидин-4-ил)метанол; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилморфолин; 1-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метилпиперидин-4-ол; 2-([1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метиламино)этан-1-ол; 1-(4-хлорфенил)-3-(оксан-4-ил)-1 Н-пирроло[2,3-с]пиридин; 1-(4-метилфенил)-3-(оксан-4-ил)-1 Н-пирроло[2,3-с]пиридин; 5-хлор-2-[3-(оксан-4-ил)-1 Н-пирроло[2,3-с]пиридин-1-ил]пиридин; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]морфолин; 4-амино-1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илбутан-1-он; 2-аминоэтил-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксилат; 3-(3,6-дигидро-2 Н-пиран-4-ил)-2-метил-1-(4-метилфенил)-1 Н-пирроло[2,3-с]пиридин или их фармацевтически приемлемую соль. В одном аспекте изобретение относится к соединению формулы (I) для применения в терапии. Соединения, как определено выше, полезны в качестве ингибиторов активности SSAO. Как таковые они полезны для лечения или профилактики состояний и заболеваний, при которых полезно ингибирование активности SSAO. Более конкретно они полезны для лечения или профилактики воспаления, воспалительного заболевания, иммунного или аутоиммунного расстройства или ингибирования опухолевого роста. В частности, считают, что соединения формулы (I) полезны для лечения или профилактики артрита(такого как ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит и псориатический артрит), синовита, васкулита, состояний, связанных с воспалением кишечника (таких как болезнь Крона,неспецифический язвенный колит, воспалительное кишечное заболевание и синдром раздраженной кишки), атеросклероза, рассеянного склероза, болезни Альцгеймера, сосудистой деменции, легочных воспалительных заболеваний (таких как астма, хроническая обструктивная болезнь легких и острый респираторный дистресс-синдром), фиброзных заболеваний (включая идиопатический легочный фиброз, сердечный фиброз и системный склероз склеродерму), воспалительных заболеваний кожи (таких как контактный дерматит, атопический дерматит и псориаз), синдрома системного воспалительного ответа, сепсиса,воспалительных и аутоиммунных состояний печени (таких как аутоиммунный гепатит, первичный билиарный цирроз, алкогольное заболевание печени, склерозирующий холангит и аутоиммунный холангит),диабета (типа I или II) и его осложнений, хронической сердечной недостаточности, застойной сердечной недостаточности, ишемического заболевания, удара и повреждения при ишемии-реперфузии, инфаркта миокарда и его осложнений.-8 023038 Считают, что соединения по изобретению особенно полезны для лечения или профилактики васкулита, включающего, но не ограниченного ими, гигантоклеточный артериит, артериит Такаясу, нодозный полиартериит, болезнь Кавасаки, гранулематоз Вегенера, синдром Черджа-Стросс, микроскопический полиангиит, пурпуру Шенлейна-Геноха, криоглобулинемия, кожный лейкоцитокластический ангиит и первичный ангиит центральной нервной системы. Также считают, что соединения по изобретению особенно полезны для лечения ревматоидного артрита, хронической обструктивной болезни легких или атопического дерматита. В свете данных, цитируемых в приведенном выше введении, VAP1 претерпевает повышающую регуляцию при нескольких раках, включая рак ЖКТ, меланому, гепатому и опухоли головы и шеи, и что у мышей, несущих ферментативно неактивный VAP-1, меланомы растут медленнее, а также в свете связи между VAP1 и ангиогенезом также ожидают, что соединения по изобретению являются антиангиогенными и, следовательно, обладают пользой при лечении раков посредством ингибирования опухолевого роста. Изобретение, таким образом, включает применение соединения формулы (I) выше для лечения или профилактики вышеупомянутых состояний и заболеваний. Изобретение также включает применение указанных соединений при изготовлении лекарственного средства для лечения или профилактики вышеупомянутых состояний и заболеваний. Изобретение, кроме того, включает способы лечения или профилактики таких состояний и заболеваний, включающие введение млекопитающему, включая человека,нуждающемуся в таком лечении, эффективного количества соединения, как определено выше. Способы, описанные в данной заявке, включают те, где субъект идентифицирован как нуждающийся в конкретном указанном лечении. Идентификация субъекта, нуждающегося в таком лечении, может осуществляться на основании мнения субъекта или специалиста здравоохранения и может быть субъективной (например, мнение) или объективной (например, измеряемой с помощью теста или способа диагностики). В других аспектах способы в данной заявке включают способы, дополнительно включающие мониторинг ответа субъекта на введения терапии. Такой мониторинг может включать периодический отбор образцов ткани, жидкостей, проб, клеток, белков, химических маркеров, генетических материалов и т.д. субъекта в качестве маркеров или индикаторов схемы лечения. При других способах субъекта предварительно подвергают скринингу или идентифицируют как нуждающегося в таком лечении путем оценки релевантного маркера или индикатора пригодности для такого лечения. В одной форме осуществления в изобретении предложен способ мониторинга хода лечения. Этот способ включает стадию определения уровня диагностического маркера (Маркера) (например, любой мишени или типа клеток, описанного в данной заявке, модулируемого соединением, описанным в данной заявке) или диагностического измерения (например, скрининга, анализа) у субъекта, страдающего расстройством или его симптомами, описанными в данной заявке, или подозреваемого на них, при котором субъекту введено терапевтически эффективное количество соединения, описанного в данной заявке, достаточное для лечения заболевания или его симптомов. Уровень Маркера, определенный при этом способе, можно сравнивать с известными уровнями Маркера либо в здоровых нормальных контролях, либо у других пораженных пациентов, чтобы установить статус заболевания субъекта. В предпочтительных формах осуществления второй уровень Маркера у субъекта определяют в более поздний момент времени, чем определение первого уровня, и два уровня сравнивают для мониторинга течения заболевания или эффективности терапии. В некоторых предпочтительных формах осуществления уровень Маркера у субъекта до лечения определяют перед началом лечения в соответствии с изобретением, а затем этот уровень Маркера до лечения можно сравнивать с уровнем Маркера у субъекта после того, как лечение началось, чтобы определить эффективность лечения. В некоторых формах осуществления этого способа уровень Маркера или активность Маркера у субъекта определяют по меньшей мере один раз. Сравнение уровней Маркера, например, с другим измерением уровня Маркера, полученным ранее или позже от того же пациента, другого пациента или нормального субъекта, может быть полезно при определении, имеет ли терапия в соответствии с изобретением желаемый эффект, и, следовательно, дает возможность регулировать уровни дозировки по целесообразности. Определение уровней Маркера можно осуществлять с использованием любого подходящего способа отбора образцов/анализа экспрессии, известного в данной области техники или описанного в данной заявке. Предпочтительно сначала у субъекта отбирают образец ткани или жидкости. Примеры подходящих образцов включают кровь, мочу, ткань, клетки полости рта или щеки и образцы волос, содержащие корни. Другие подходящие образцы должны быть известны специалисту в данной области техники. Определение уровней белка и/или уровней мРНК (например, уровней Маркера) с образце можно осуществлять, используя любой подходящий метод, известный в данной области техники, включающий, но не ограниченный ими, иммуноферментный анализ, ELISA (твердофазный иммуноферментный анализ), методы анализа с радиоактивным мечением, методы блоттинга/хемилюминесценции, ПЦР в реальном времени и тому подобное. Композиции Предпочтительную форму осуществления изобретения составляет фармацевтическая композиция,-9 023038 содержащая соединение формулы (I) вместе с одним или более чем одним фармацевтически приемлемым носителем и/или эксципиентом. Для клинического применения соединения по изобретению включают в фармацевтические препараты для различных режимов введения. Понятно, что соединения по изобретению можно вводить вместе с физиологически приемлемым носителем, эксципиентом или разбавителем. Фармацевтические композиции по изобретению можно вводить любым подходящим путем, предпочтительно пероральным, ректальным, назальным, местным (включая трансбуккальный и подъязычный), подъязычным, чрескожным,подоболочечным, введением в слизистую оболочку или парентеральным (включая подкожный, внутримышечный, внутривенный и внутрикожный) путем введения. Другие препараты могут быть удобно представлены в стандартной лекарственной форме, например в таблетках и в капсулах пролонгированного высвобождения, а также в липосомах, и могут быть получены любыми способами, хорошо известными в области фармации. Фармацевтические препараты обычно готовят путем смешивания активного вещества или его фармацевтически приемлемой соли с общепринятыми фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Примерами эксципиентов являются вода, желатин, аравийская камедь, лактоза, микрокристаллическая целлюлоза,крахмал, натриевая соль гликолята крахмала, гидрофосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и тому подобное. Такие препараты могут также содержать другие фармакологически активные агенты и общепринятые добавки, такие как стабилизаторы, увлажняющие агенты, эмульгаторы, корригенты, буферы и тому подобное. Обычно количество активных соединений составляет 0,1-95% мас./мас. препарата, предпочтительно 0,2-20% мас./мас. в препаратах для парентерального применения и более предпочтительно 1-50% мас./мас. в препаратах для перорального введения. Препараты можно, кроме того, готовить известными способами, такими как грануляция, прессование, микроинкапсуляция, покрытие распылением и т.д. Препараты можно готовить общепринятыми способами в лекарственной форме таблеток, капсул, гранул, порошков, сиропов, суспензий, суппозиториев или инъекций. Жидкие препараты можно готовить путем растворения или суспендирования активного вещества в воде или в других подходящих растворителях. Таблетки и гранулы можно покрывать общепринятым способом. Для поддержания терапевтически эффективных концентраций в плазме в течение продолжительных периодов времени соединения по изобретению можно включать в препараты медленного высвобождения. Уровень дозы и частота дозирования конкретного соединения варьирует в зависимости от ряда факторов, включая эффективность конкретного применяемого соединения, метаболическую стабильность и длительность действия этого соединения, возраст, массу тела, общее состояние здоровья, пол,режим питания пациента, режим и время введения, скорость выделения, сочетание с лекарственными средствами, тяжесть состояния, подлежащего лечению, и прохождение терапии пациентом. Суточная дозировка может, например, находиться в диапазоне от примерно 0,001 до примерно 100 мг на 1 кг массы тела, вводимая однократно или многократно в дозах, например, от примерно 0,01 до примерно 25 мг каждой. Обычно такую дозировку дают перорально, но также может быть выбрано парентеральное введение. Получение соединений по изобретению Соединения приведенной выше формулы (I) могут быть получены общепринятыми способами или по аналогии с ними. Получение промежуточных соединений и соединений в соответствии с примерами настоящего изобретения может быть, в частности, освещено прилагаемыми ниже схемами. Определения переменных в структурах на схемах в данной заявке соразмерны соответствующим положениям в формулах, изображенных в данной заявке.- 10023038 Схема 1 Общие пути синтеза для получения соединений формулы (Ia) где W,Y, Z, R1 и R2 являются такими, как определено в формуле (I). Соединения общей формулы (Ia) могут быть легко получены из 1H-пирроло[2,3-с]пиридинов (IIa) либо путем взаимодействия с кетоном для введения функциональной группы в R2 с последующим введением R1 (например, путем реакции Сузуки) с получением соединений формулы (IIIa/IVa), либо путем первоначального введения R1 с последующим введением функциональной группы в R2, которая может быть модифицирована с получением альтернативного R2, как в (Va). Соединения формул (IIIa), (IVa) и(Va) можно легко преобразовать в соединения общей формулы (Ia) стандартными способами синтеза. Альтернативно, 4-хлор-3-аминопиридины (VIa) могут быть циклизованы с подходящим альдегидом с получением соединений общей формулы (VIIa) с последующим введением R1 (например, путем реакции арилирования). Последний подход известен специалистам в данной области техники, например, в Xu etal., Synthesis, 24, 3981-3987, 2008. Необязательно соединение формулы (I) может быть также преобразовано в другое соединение формулы (I) в одну или более чем в одну стадию синтеза. Использованы приведенные ниже сокращения: Примеры и промежуточные соединения Экспериментальные методы. Реакции проводили при комнатной температуре, если не указано иное. Микроволновые реакции проводили в микроволновом реакторе Personal Chemistry/Biotage, используя аналитические флаконы,- 12023038 оборудованные алюминиевыми крышками и септами. Гидрогенизации проводили, используя Thales HCube. Препаративную флэш-хроматографию проводили на силикагеле Merck 60 (230-400 меш) или с использованием системы Flash Master Personal, оборудованной трубками силикагеля GigaTubes Strata SI-1. Колоночную хроматографию с обращенной фазой проводили на системе Gilson (насос Gilson 321 и коллектор фракций Gilson FC204), оборудованной колонками Merck LiChroprep RP-18 (40-63 мкм). ВЭЖХ с обращенной фазой проводили на системе Gilson с УФ-детектором, оборудованной колонками Phenomenex Synergi Hydro RP 15010 мм или YMC ODS-A 100/15020 мм, либо на системе XTerra Prep MCC18 5 мкм 1950 мм. Самые чистые фракции собирали, концентрировали и высушивали в вакууме. Метансульфонатные промежуточные соединения получали из соответствующих спиртов и метансульфонилхлорида и триэтиламина в ДХМ. Соединения обычно высушивали в вакуумной печи при 40 С перед анализом чистоты. Анализ соединений проводили с помощью ВЭЖХ/ЖХМС, используя либо жидкостный хроматограф с селективным детектором массы Agilent 1100/1200 Series (MSD) (одноквадрупольный)(1946 А/1946 С/1956 С/6110), оборудованный интерфейсом электрораспыления, либо с использованием системы ВЭЖХ Agilent 1100/масс-спектрометр Waters ZQ, соединенный с системой ВЭЖХ Agilent 1100,либо с колонкой АСЕ 3 С 8 (503,0 мм, 1 мл/мин, градиент 10-97% MeCN в воде (+0,1% ТФУ) в течение 3 мин, 215-395 нм, способ А), либо колонкой Phenomenex Synergi, RP-Hydro (1504,6 мм, 4 мкм, 1,5 мл в мин, 30 С, градиент 5-100% MeCN (+0,085% ТФУ) в воде (+0,1% ТФУ) в течение 7 мин, 200-300 нм,способ В). Точные массы (МСВР) измеряли, используя либо Agilent MSD-TOF, соединенный с системой ВЭЖХ Agilent 1100 (во время анализов калибровку проверяли по двум массам и автоматически корректировали при необходимости. Спектры снимали в положительном режиме ионизации электрораспылением. Полученный диапазон масс составлял m/z 100-1100. Использовали определение профилей массовых пиков), либо используя Thermo Scientific LTQ Orbitrap XL, оборудованный источником ионов с электрораспылением Advio TriVersa NanoMate (во время анализов калибровку проверяли по трем массам. Спектры снимали в положительном режиме ионизации электрораспылением. Полученный диапазон масс составлял m/z 100-2000. Образцы растворяли в ДМСО с получением 10 мМ растворов, которые затем дополнительно разводили МеОН или 10 мМ NH4OAc в МеОН примерно до 0,1M растворов перед анализом). Полученные соединения называли с использованием программы ACD Name 6.0, 7.0 или 10.0. Промежуточное соединение 7. трет-Бутил-4-1H-пирроло[2,3-с]пиридин-3-ил-1,2,3,6-тетрагидропиридин-1-карбоксилат Суспензию 1H-пирроло[2,3-с]пиридина (0,95 г, 8,05 ммоль), трет-бутил-4-оксопиперидин-1 карбоксилата (1,70 г, 8,54 ммоль) и KOH (0,95 г, 17,0 ммоль) в МеОН (10 мл) нагревали с обратным холодильником в течение ночи. Смесь добавляли в смесь льда и воды (50 мл), а затем добавляли МеОН (50 мл). Полученный в результате раствор концентрировали примерно до 50 мл, а затем экстрагировали три раза ДХМ/МеОН (9:1, 50 мл). Органические слои объединяли и концентрировали, остаток очищали флэш-хроматографией (9:1 ДХМ/МеОН) с получением соединения, указанного в заголовке, в виде светло-желтого твердого вещества (2,21 г, 92%). МС (ИЭР+) m/z = 300 (М+Н)+. Промежуточное соединение 8. трет-Бутил-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]1,2,3,6-тетрагидропиридин-1-карбоксилат Суспензию промежуточного соединения 7 (30,0 мг, 0,10 ммоль), (4-хлорфенил)бороновой кислоты(1 мл) перемешивали в течение 72 ч. Смесь концентрировали, а затем очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (5,20 мг, 13%). МС (ИЭР+) m/z = 410, 412 (М+Н)+. Промежуточное соединение 9. трет-Бутил-4-1H-пирроло[2,3-с]пиридин-3-илпиперидин-1 карбоксилат- 13023038 Суспензию промежуточного соединения 7 (598 мг, 2,00 ммоль) и 10% Pd/C (кат) в EtOH (3 мл) и циклогексене (1,5 мл) нагревали при 150 Св течение 25 мин в микроволновом реакторе. Смесь фильтровали и выпаривали с получением соединения, указанного в заголовке, в виде бесцветного масла (540 мг,89%). МС (ИЭР+) m/z = 302 (М+Н)+. Промежуточное соединение 10. трет-Бутил-N-(4-1H-пирроло[2,3-с]пиридин-3-илциклогекс-3-ен 1-ил)карбамат Суспензию 1H-пирроло[2,3-с]пиридина (0,95 г, 8,05 ммоль), трет-бутил(4-оксоциклогексил) карбамата (1,82 г, 8,54 ммоль) и KOH (0,95 г, 17,0 ммоль) в МеОН (10 мл) нагревали с обратным холодильником в течение ночи. Раствор добавляли к смеси льда и воды (50 мл), а затем добавляли МеОН (50 мл). Полученный в результате раствор концентрировали примерно до 50 мл и экстрагировали три раза ДХМ/МеОН (9:1, 50 мл), органические слои объединяли и концентрировали. Остаток очищали флэшхроматографией (9:1 ДХМ/МеОН) с получением соединения, указанного в заголовке, в виде белого твердого вещества (1,96 г, 78%). МС (ИЭР+) m/z = 314 (М+Н)+. Промежуточное соединение 11. трет-Бутил-N-(4-1H-пирроло[2,3-с]пиридин-3-илциклогексил)карбамат Суспензию промежуточного соединения 10 (235 мг, 0,75 ммоль) и 10% Pd/C (кат) в EtOH (2,5 мл) и циклогексене (1 мл) нагревали при 140 Св течение 20 мин в микроволновом реакторе. Смесь фильтровали и концентрировали с получением диастереоизомерной смеси соединения, указанного в заголовке (229 мг, 97%). МС (ИЭР+) m/z = 316(М+Н)+. Промежуточное соединение 12. трет-Бутил-N-4-[1-(4-хлор-2-метилфенил)-1H-пирроло[2,3 с]пиридин-3-ил]циклогексилкарбамат Суспензию промежуточного соединения 11 (32,0 мг, 0,10 ммоль), (4-хлор-2-метилфенил)бороновой кислоты (17,0 мг, 0,10 ммоль), ацетата меди(II) (18,0 мг, 0,10 ммоль) и триэтиламина (20,0 мг, 0,20 ммоль) в ДХМ (1 мл) перемешивали в течение 72 ч. Смесь концентрировали, а затем очищали препаративной ВЭЖХ с получением диастереоизомерной смеси соединения, указанного в заголовке (1,30 мг,2,9%). МС (ИЭР+) m/z = 440, 442 (М+Н)+. Промежуточное соединение 13. 1-(4-Хлорфенил)-1-пирроло[2,3-с]пиридин 4-Хлор-3-аминопиридин (200 мг, 1,56 ммоль) растворяли в ДМА (4 мл) и добавляли Pd2(dba)3 (71,2 мг, 0,08 ммоль), X-Phos (74,2 мг, 0,16 ммоль), ацетат калия (458 мг, 4,67 ммоль) и (тетрагидропиран-4- 14023038 ил)ацетальдегид (598 мг, 4,67 ммоль) в атмосфере азота. Реакционную смесь нагревали при 120 С в течение ночи, охлаждали до кт и распределяли между водой (100 мл) и ДХМ (100 мл). Водную фракцию концентрировали в вакууме и остаток растворяли в ДХМ (100 мл), высушивали (MgSO4) и концентрировали в вакууме с получением сырого соединения, указанного в заголовке, в виде оранжевого/коричневого твердого вещества (314 мг, 99,8%). ЖХМС (ES+): 203,1 (М+Н)+. Промежуточное соединение 104. 1-(4-Хлорфенил)-3-нитро-1 Н-пирроло[2,3-с]пиридин Промежуточное соединение 13 (1,54 г, 6,74 ммоль) добавляли порциями к серной кислоте (5,85 мл) при 0 С. Реакционную смесь нагревали до 55 С и осторожно добавляли азотную кислоту (0,42 мл, 69%aq раствор, 6,40 ммоль). Реакционную смесь нагревали при 55 С в течение 3 ч, а затем охлаждали до комнатной температуры, наливали в смесь льда и воды (100 мл) и осторожно нейтрализовали 6M aqNaOH. Полученный в результате осадок собирали фильтрованием с получением сырого соединения, указанного в заголовке, в виде коричневого твердого вещества (1,01 г, 55%). ЖХМС (ES+): 274,0 (М+Н)+. Промежуточное соединение 105. 1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-амин Промежуточное соединение 104 (900 мг, 3,29 ммоль) растворяли в EtOAc/EtOH (130 мл, 1:1) и подвергали гидрогенизации при 70 С над 10% Ru/C, используя Thales H-cube (0,5 мл/мин, 70 бар). Растворители удаляли в вакууме и остаток очищали колоночной хроматографией с нормальной фазой с получением соединения, указанного в заголовке, в виде коричневой смолы (156 мг, 20%). ЖХМС (ES+): 244,0 2-Метил-1 Н-пирроло[2,3-с]пиридин (100 мг, 0,76 ммоль) растворяли в CHCl3 (5 мл), добавляли Nйодосукцинимид (179 мг, 0,79 ммоль) и реакционную смесь перемешивали в течение 2 ч. Реакционную смесь гасили 1M aq тиосульфатом натрия (5 мл) и CHCI3 удаляли в вакууме. Реакционную смесь распределяли между насыщенным aq NaHCO3 (40 мл) и EtOAc (40 мл). Водный слой экстрагировали EtOAc (40 мл) и объединенные органические фракции промывали насыщенным aq NaHCO3 (50 мл) и рассолом (50 мл), высушивали (MgSO4) и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде кремового твердого вещества (179 мг, 92%). ЖХМС (ES+): 258,9 (М+Н)+. Промежуточное соединение 107. трет-Бутил-3-йод-2-метил-1 Н-пирроло[2,3-с]пиридин-1 карбоксилат Промежуточное соединение 106 (317 мг, 1,23 ммоль) растворяли в ДХМ (10 мл), добавляли 4 диметиламинопиридин (15,0 мг, 0,12 ммоль) и ди-трет-бутилдикарбонат (295 мг, 1,35 ммоль) и реакционную смесь перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и остаток очищали колоночной хроматографией с получением соединения, указанного в заголовке, в виде белого твердого вещества (369 мг, 84%). ЖХМС (ES+): 358,9 (М+Н)+. Промежуточное соединение 108. 3-(3,6-Дигидро-2 Н-пиран-4-ил)-2-метил-1 Н-пирроло[2,3 с]пиридин- 15023038 Промежуточное соединение 107 (369 мг, 1,03 ммоль), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)-3,6-дигидро-2 Н-пиран (260 мг, 1,24 ммоль), тетракис(трифенилфосфин)палладий(0) (95,2 мг, 0,08 ммоль) и Na2CO3 (328 мг, 3,09 ммоль) растворяли в диоксане (2 мл) и воде (2 мл) и реакционную смесь нагревали в микроволновом реакторе при 160 С в течение 15 мин. Реакционную смесь концентрировали в вакууме и остаток очищали колоночной хроматографией с получением соединения, указанного в заголовке, в виде бледно-желтого твердого вещества (161 мг, 73%). ЖХМС (ES+): 215,1 (М+Н)+. Промежуточное соединение 109. трет-Бутил-N-(2-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин 3-ил]пиперидин-1-ил-2-оксоэтил)карбамат Суспензию примера 10 (30,0 мг, 0,070 ммоль), N-(трет-бутоксикарбонил)глицина (15,0 мг, 0,085 ммоль), EDC (27,0 мг, 0,14 ммоль), НОВТ (19,0 мг, 0,14 ммоль) и триэтиламина (40,0 мкл, 0,28 ммоль) в ТГФ (2 мл) и МеОН (0,5 мл) перемешивали в течение ночи. Смесь концентрировали в вакууме и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (13,5 мг, 41%). МСВР Суспензию примера 10 (30,0 мг, 0,070 ммоль), N-(трет-бутоксикарбонил)аланина (16,0 мг, 0,085 ммоль), EDC (27,0 мг, 0,14 ммоль), НОВТ (19,0 мг, 0,14 ммоль) и триэтиламина (40,0 мкл, 0,28 ммоль) в ТГФ (2 мл) и МеОН (0,5 мл) перемешивали в течение ночи. Смесь концентрировали в вакууме и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (11,5 мг, 41%). МСВР Промежуточное соединение 13 (229 мг, 1,00 ммоль) растворяли в сухом ДМФ (770 мкл, 10,0 ммоль) и охлаждали в ледяной бане. Фосфорилхлорид (920 мкл, 10,0 ммоль) добавляли по каплям в атмосфере азота и реакционную смесь перемешивали при кт в течение 10 мин, а затем нагревали при 100 С в течение 6 ч. После охлаждения реакционную смесь добавляли по каплям к 10% aq Na2CO3 (30 мл). Образовавшийся осадок собирали фильтрованием, промывали водой (35 мл) и высушивали в вакууме с получением сырого продукта (чистота 80%) в виде коричневого твердого вещества (240 мг). Небольшой образец (12 мг) очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (3,80 мг, 30%). МСВР (ИЭР+) вычислено для C14H9ClN2O 256,0403, обнаружено 256,0413. ВЭЖХ (способ A): Rf 1,30 мин, чистота 100%. Пример 8. 4-[1-(4-Хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1,2,3,6-тетрагидропиридина гидрохлорид Суспензию промежуточного соединения 8 (3,50 мг, 0,0085 ммоль) в 1,25M HCl в МеОН (1 мл) перемешивали в течение ночи. Смесь концентрировали, растворяли в МеОН, снова концентрировали, а затем высушивали в вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (2,70 мг, 92%). МСВР (ИЭР+) вычислено для C18H16ClN3 309,1033, обнаружено 309,1035. ВЭЖХ (способ A): Rf 1,19 мин, чистота 94%. Пример 9. трет-Бутил-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксилат Суспензию промежуточного соединения 9 (497 мг, 1,65 ммоль), 1-хлор-4-йодбензола (472 мг, 1,98 ммоль), йодида меди(I) (94,0 мг, 0,50 ммоль), N,N'-диметилэтилендиамина (44,0 мг, 0,50 ммоль) и K3PO4(595 мг, 2,80 ммоль) в толуоле (15 мл) нагревали при 110 С в течение 72 ч. Смесь охлаждали до кт и разбавляли МеОН (15 мл), фильтровали и концентрировали. Остаток очищали флэш-хроматографией(EtOAc) с получением соединения, указанного в заголовке, в виде желтого твердого вещества (606 мг,89%). МСВР (ИЭР+) вычислено для C23H26ClN3O2 411,1714, обнаружено 411,1725. ВЭЖХ (способ A): Rf 2,14 мин, чистота 97%. Пример 10. 1-(4-Хлорфенил)-3-пиперидин-4-ил-1H-пирроло[2,3-с]пиридина трифторацетат Суспензию промежуточного соединения 11 (32,0 мг, 0,10 ммоль), (4-хлорфенил)бороновой кислоты(1 мл) перемешивали в течение 72 ч. Смесь концентрировали и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (6 мг, 14%). МСВР (ИЭР+) вычислено для C24H28ClN3O2 425,1870, обнаружено 425,1878. ВЭЖХ (способ A): Rf 2,19 мин, чистота 99%. Пример 12. 4-[1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]циклогексан-1-амина гидрохлорид Суспензию примера 11 (3,50 мг, 0,0082 ммоль) в 1,25M HCl в МеОН (1 мл) перемешивали в течение ночи. Смесь концентрировали, растворяли в МеОН и концентрировали в вакууме с получением диастереоизомерной смеси соединения, указанного в заголовке (2,80 мг, 94%). МСВР (ИЭР+) вычислено для Суспензию промежуточного соединения 12 (1,20 мг, 0,0027 ммоль) в 1,25M HCl в МеОН (1 мл) перемешивали в течение ночи. Смесь концентрировали, растворяли в МеОН и концентрировали в вакууме с получением диастереоизомерной смеси соединения, указанного в заголовке (1 мг, 98%). МСВР (ИЭР+) вычислено для C20H22ClN3 339,1502, обнаружено 339,1505. ВЭЖХ (способ A): Rf 1,33, 1,39 мин, чистота 94%. Пример 14. 1-4-[1-(4-Хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил-2-(диметиламино)этан-1-он(27,0 мг, 0,14 ммоль), НОВТ (19,0 мг, 0,14 ммоль) и триэтиламина (40,0 мкл, 0,28 ммоль) в ТГФ (2 мл) и МеОН (0,5 мл) перемешивали в течение ночи. Смесь концентрировали, а затем очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (13,0 мг, 47%). МСВР (ИЭР+) вычислено для Суспензию примера 10 (30,0 мг, 0,070 ммоль), гидроксиуксусной кислоты (6,00 мг, 0,085 ммоль),EDC (27,0 мг, 0,14 ммоль), НОВТ (19,0 мг, 0,14 ммоль) и триэтиламина (40,0 мкл, 0,28 ммоль) в ТГФ (2 мл) и МеОН (0,5 мл) перемешивали в течение ночи. Смесь концентрировали в вакууме и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (11,9 мг, 46%). МСВР (ИЭР+) вычислено для C20H20ClN3O2 369,1244, обнаружено 369,1252. ВЭЖХ (способ A): Rf 1,52 мин, чистота 98%. Пример 16. 2-Амино-1-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илэтан 1-она гидрохлорид Суспензию промежуточного соединения 109 (9,50 мг, 0,020 ммоль) в 1,25M HCl в МеОН (1,5 мл) перемешивали в течение ночи. Смесь концентрировали в вакууме, растворяли в МеОН и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (8 мг,97%). МСВР (ИЭР+) вычислено для C20H21ClN4O 368,1404, обнаружено 368,1401. ВЭЖХ (способ A): Rf 1,24 мин, чистота 99%. Пример 17. 3-Амино-1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илпропан-1-она гидрохлорид Суспензию промежуточного соединения 110 (7,50 мг, 0,018 ммоль) в 1,25M HCl в МеОН (1,5 мл) перемешивали в течение ночи. Смесь концентрировали в вакууме, растворяли в МеОН и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (7,10 мг, 95%). МСВР (ИЭР+) вычислено для C21H23ClN4O 382,1560, обнаружено 382,1564. ВЭЖХ (способ A):NaBH(OAc)3 (37,0 мг, 0,18 ммоль) в МеОН (1,5 мл) перемешивали в течение ночи и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (14,8 мг, 71%). МСВР (ИЭР+) вычислено для C20H22ClN3O 355,1451, обнаружено 355,1456. ВЭЖХ (способ A): Rf 1,17 мин, чистота 99%.NaBH(OAc)3 (37,0 мг, 0,18 ммоль) в МеОН (1,5 мл) перемешивали в течение ночи и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (6,80 мг, 30%). МСВР (ИЭР+) вычислено для C22H22ClN5 391,1564, обнаружено 391,1568. ВЭЖХ (способ A): Rf 1,24 мин, чистота 100%. Пример 20. 4-[1-(4-Хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-[(1-метил-1H-пиразол-4-ил)метил]пиперидин Суспензию примера 10 (25,0 мг, 0,059 ммоль), 1-метил-1H-пиразол-4-карбальдегида (19,0 мг, 0,18 ммоль) и NaBH(OAc)3 (37,0 мг, 0,18 ммоль) в МеОН (1,5 мл) перемешивали в течение ночи и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (4,90 мг, 21%). МСВР (ИЭР+) вычислено для C23H24ClN5 405,1720, обнаружено 405,1735. ВЭЖХ (способ A): Rf 1,26 мин, чистота 100%. Пример 21. 3-4-[1-(4-Хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илпропаннитрила гидрохлорид(избыток) в сухом ДМФ (2 мл) перемешивали в течение ночи. Добавляли дополнительное количество 3 бромпропионитрила (1 каплю) и реакционную смесь перемешивали в течение 24 ч, а затем очищали препаративной ВЭЖХ. Добавляли 1,25M HCl в МеОН (1,5 мл) и смесь концентрировали в вакууме с получением соединения, указанного в заголовке (9,80 мг, 42%). МСВР (ИЭР+) вычислено для C21H21ClN4 364,1455, обнаружено 364,1459. ВЭЖХ (способ A): Rf 1,28 мин, чистота 99%. Пример 22. 4-4-[1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илбутаннитрила гидрохлорид(избыток) в сухом ДМФ (2 мл) перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и очищали препаративной ВЭЖХ. Добавляли 1,25M HCl в МеОН (1,5 мл) и смесь концентрировали в вакууме с получением соединения, указанного в заголовке (9 мг, 37%). МСВР (ИЭР+) вычислено для C22H23ClN4 378,1611, обнаружено 378,1616. ВЭЖХ (способ A): Rf 1,32 мин, чистота 99%. Пример 23. [1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метанол- 19023038 мл) добавляли к промежуточному соединению 13 (180 мг, 0,80 ммоль). Смесь нагревали с обратным холодильником в течение 30 ч. После охлаждения смесь добавляли к 2M NaOH (30 мл). Образовавшийся осадок собирали фильтрованием, промывали водой (45 мл) и высушивали в вакууме. Остаток очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде желтого твердого вещества (60,0 мг, 29%). МСВР (ИЭР+) вычислено для C14H11CIN2O 258,0560, обнаружено 258,0570. ВЭЖХ Смесь промежуточного соединения 111 (12,8 мг, 0,05 ммоль) и 1-метилпиперазина (20,0 мг, 0,20 ммоль) в 1,2-дихлорэтане (200 мкл) и ДМФ (100 мкл) встряхивали в течение 1 ч. Добавляли растворNaBH(OAc)3 (25,0 мг, 0,12 ммоль) в ДМФ (100 мкл) с последующим добавлением АсОН (9,50 мкл, 0,20 ммоль). Реакционную смесь встряхивали в течение 1 ч, а затем разбавляли МеОН (1,5 мл) и водой (0,5 мл). Раствор очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (6 мг, 35%). МСВР (ИЭР+) вычислено для C19H21ClN4 340,1455, обнаружено 340,1465. ВЭЖХ (способ A): Rf 1,07 мин, чистота 94%. Пример 25. трет-Бутил-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилпиперазин-1 карбоксилат Смесь промежуточного соединения 111 (15,0 мг, 0,06 ммоль) и трет-бутилпиперазин-1 карбоксилата (45,0 мг, 0,24 ммоль) в 1,2-дихлорэтане (200 мкл) и ДМФ (100 мкл) встряхивали в течение 1 ч. Добавляли раствор NaBH(OAc)3 (25,0 мг, 0,120 ммоль) в ДМФ (100 мкл) с последующим добавлением АсОН (11,0 мкл, 0,24 ммоль). Реакционную смесь встряхивали в течение 1 ч, а затем разбавляли МеОН (1,5 мл) и водой (0,5 мл). Раствор очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (9,60 мг, 38%). МСВР (ИЭР+) вычислено для Пример 25 (7,80 мг, 0,024 ммоль) растворяли в МеОН (500 мкл) и добавляли 2M HCl в диэтиловом эфире (1 мл). Смесь держали при комнатной температуре в течение 1,5 ч. Реакционную смесь концентрировали в вакууме и остаток растворяли в МеОН (1 мл) и добавляли 2M аммиак в МеОН (1 мл). Раствор очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белого твердого вещества (4,30 мг, 55%). МСВР (ИЭР+) вычислено для C18H19ClN4 326,1298, обнаружено 326,1303. ВЭЖХ (способ A): Rf 1,02 мин, чистота 81%. Пример 27. 2-(1-[1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилпиперидин-4-ил)этан-1-ол Смесь промежуточного соединения 111 (15,0 мг, 0,06 ммоль) и 4-пиперидинэтанола (31,0 мг, 0,24 ммоль) в 1,2-дихлорэтане (200 мкл) и ДМФ (100 мкл) встряхивали в течение 1 ч. Добавляли растворNaBH(OAc)3 (25,0 мг, 0,12 ммоль) в ДМФ (100 мкл) с последующим добавлением АсОН (11,0 мкл, 0,24 ммоль). Реакционную смесь встряхивали в течение ночи, а затем разбавляли МеОН (1,5 мл) и водой (0,5 мл). Раствор очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде светло-желтого твердого вещества (9,80 мг, 44%). МСВР (ИЭР+) вычислено для C21H24ClN3O 369,1608,обнаружено 369,1619. ВЭЖХ (способ A): Rf 1,11 мин, чистота 91%. Пример 28. (1-[1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилпиперидин-4-ил)метанол Смесь промежуточного соединения 111 (15,0 мг, 0,06 ммоль) и 4-пиперидинметанола (28,0 мг, 0,24 ммоль) в 1,2-дихлорэтане (200 мкл) и ДМФ (100 мкл) встряхивали в течение 1 ч. Добавляли растворNaBH(OAc)3 (25,0 мг, 0,12 ммоль) в ДМФ (100 мкл) с последующим добавлением АсОН (11,0 мкл, 0,24 ммоль). Реакционную смесь встряхивали в течение ночи, а затем разбавляли МеОН (1,5 мл) и водой (0,5 мл). Раствор очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (8,10 мг, 38%). МСВР (ИЭР+) вычислено для C20H22ClN3O 355,1451, обнаружено 355,1460. ВЭЖХ (способ A): Rf 1,06 мин, чистота 98%. Пример 29. 4-[1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилморфолин Смесь промежуточного соединения 111 (15,0 мг, 0,06 ммоль) и морфолина (21,0 мг, 0,24 ммоль) в 1,2-дихлорэтане (200 мкл) и ДМФ (100 мкл) встряхивали в течение 1 ч. Добавляли раствор NaBH(OAc)3(25,0 мг, 0,12 ммоль) в ДМФ (100 мкл) с последующим добавлением АсОН (11,0 мкл, 0,24 ммоль). Реакционную смесь встряхивали в течение ночи, а затем разбавляли МеОН (1,5 мл) и водой (0,5 мл). Раствор очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде светло-желтого твердого вещества (7,60 мг, 39%). МСВР (ИЭР+) вычислено для C18H18ClN3O 327,1138, обнаружено 327,1153. ВЭЖХ (способ A): Rf 1,06 мин, чистота 97%. Пример 30. 1-[1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилпиперидин-4-ол Смесь промежуточного соединения 111 (15,0 мг, 0,06 ммоль) и 4-гидроксипиперидина (24,0 мг, 0,24 ммоль) в 1,2-дихлорэтане (200 мкл) и ДМФ (100 мкл) встряхивали в течение 1 ч. Добавляли растворNaBH(OAc)3 (25,0 мг, 0,12 ммоль) в ДМФ (100 мкл) с последующим добавлением АсОН (11,0 мкл, 0,24 ммоль). Реакционную смесь встряхивали в течение ночи, а затем разбавляли МеОН (1,5 мл) и водой (0,5 мл). Раствор очищали препаративной ВЭЖХ (Xterra С 18, 50 мМ NH4HCO3 (рН 10) - CH3CN), a затем повторно очищали (АСЕ С 8, 0,1% ТФУ- CH3CN). Объединенные кислые фракции подщелачивали 2MNaOH (1,5 мл) и экстрагировали ДХМ (6 мл). Органическую фазу собирали, высушивали (MgSO4) и кон- 21023038 центрировали в вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (3,70 мг, 18%). МСВР (ИЭР+) вычислено для C19H20ClN3O 341,1295, обнаружено 341,1304. ВЭЖХ Смесь промежуточного соединения 111 (15,0 мг, 0,06 ммоль) и этаноламина (15,0 мг, 0,24 ммоль) в 1,2-дихлорэтане (200 мкл) и ДМФ (100 мкл) встряхивали в течение 1 ч. Добавляли раствор NaBH(OAc)3(25,0 мг, 0,12 ммоль) в ДМФ (100 мкл) с последующим добавлением АсОН (11,0 мкл, 0,24 ммоль). Реакционную смесь встряхивали в течение ночи, а затем разбавляли МеОН (1,5 мл) и водой (0,5 мл). Раствор очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде светло-желтого твердого вещества (6,50 мг, 36%). МСВР (ИЭР+) вычислено для C16H16ClN3O 301,0982, обнаружено 301,0984. ВЭЖХ (способ A): Rf 1,01 мин, чистота 100%. Пример 100. 1-(4-Фторфенил)-3-(оксан-4-ил)-1 Н-пирроло[2,3-с]пиридин(14,7 мг, 0,08 ммоль), N,N'-диметилэтилендиамин (16,6 мкл, 0,15 ммоль) и фосфат калия (344 мг, 1,62 ммоль) растворяли в ДМФ (5 мл) и нагревали в микроволновом реакторе при 160 С в течение 40 мин. Реакционную смесь охлаждали до комнатной температуры, фильтровали через целлит и концентрировали в вакууме. Остаток растворяли в ДХМ (100 мл), промывали насыщенным aq NaHCO3 (100 мл), водой(100 мл), высушивали (MgSO4) и концентрировали в вакууме. Остаток очищали ВЭЖХ с обращенной фазой с получением соединения, указанного в заголовке, в виде красной смолы (4,34 мг, 1,9%). МСВР(ИЭР+) вычислено для C18H17FN2O 297,1398, обнаружено 297,1401. ВЭЖХ (способ В): Rf 4,74 мин, чистота 100%. Примеры 101-103. Примеры 101-103 были получены подобно примеру 100 путем взаимодействия промежуточного соединения 103 с соответствующим йодбензолом или бромбензолом; см. табл. 8 ниже. Таблица 8 Арильные сочетания(21,3 мг, 0,13 ммоль) и дихлордиэтиловый эфир (75,0 мкл, 0,64 ммоль). Реакционную смесь нагревали,используя микроволновой реактор, при 150 С в течение 30 мин. Добавляли NaH (76,8 мг, 60% в минеральном масле, 1,92 ммоль), и реакционную смесь нагревали, используя микроволновой реактор, при 150 С в течение 15 мин. Растворители удаляли в вакууме и остаток очищали ВЭЖХ с обращенной фазой с получением соединения, указанного в заголовке, в виде коричневого твердого вещества (5,10 мг, 1,9%). МСВР (ИЭР+) вычислено для C17H16ClN3O 314,1055, обнаружено 314.1057, ВЭЖХ (способ В): Rf 4,55 мин, чистота 97%. Пример 105. 2,2,2-Трифторуксусная кислота; 4-амино-1-4-[1-(4-хлорфенил)-1H-пирроло[2,3 с]пиридин-3-ил]пиперидин-1-илбутан-1-он Пример 105 был получен подобно примеру 17 из примера 10 с использованием 4-[(третбутокси)карбонил]аминобутановой кислоты вместо N-(трет-бутоксикарбонил)аланина перед стадией удаления защиты Вос с получением соединения, указанного в заголовке, в виде желтой смолы (12%). МСВР (ИЭР+) вычислено для C22H25ClN4O 397,1783, обнаружено 397,1790. ВЭЖХ (способ В): Rf 3,84 мин, чистота 99%. Пример 106. 2-Аминоэтил-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1 карбоксилат(155 мг, 0,96 ммоль) и DIPEA (167 мкл, 0,96 ммоль) в ДХМ (1 мл). Реакционную смесь перемешивали в течение 18 ч и добавляли раствор примера 10 (свободное основание, 200 мг, 0,64 ммоль) и DIPEA (167 мкл, 0,96 ммоль) в ДХМ (1 мл). Реакционную смесь перемешивали в течение 1 ч, разбавляли EtOAc (50 мл), промывали 10% aq лимонной кислотой (50 мл) и 1M aq Na2CO3 (50 мл), высушивали (MgSO4) и концентрировали в вакууме. Остаток растворяли в ДХМ (5 мл), добавляли ТФУ (1 мл) и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь концентрировали в вакууме и очищали ВЭЖХ с обращенной фазой. Остаток растворяли в 1M aq Na2CO3 (20 мл) и экстрагировали ДХМ (320 мл). Объединенные органические фракции высушивали (MgSO4) и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде бесцветной смолы (10,0 мг, 3,9%). МСВР (ИЭР+) вычислено для Промежуточное соединение 108 (59,0 мг, 0,28 ммоль), 4-йодотолуол (72,0 мг, 0,33 ммоль), N,N'диметилэтилендиамин (5,93 мкл, 0,06 ммоль) и K3PO4 (123 мг, 0,58 ммоль) суспендировали в ДМФ (1 мл) в атмосфере азота и добавляли CuI (5,24 мг, 0,03 ммоль). Реакционную смесь нагревали в микроволновом реакторе при 170 С в течение 9 ч и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением соединения, указанного в заголовке, в виде коричневой смолы (10,3 мг, 12%). ЖХМС (ES+): 305,0 (М+Н)+. ВЭЖХ (способ В): Rf 5,01 мин, чистота 98,5%. Биологические тесты Биологические анализы ингибиторов фермента SSAO. Все первичные анализы проводили при кт с очищенной рекомбинантно экспрессированной SSAO человека. Фермент был получен, по существу, как описано в hman et al. (Protein Expression and Purification 46 (2006) 321-331). Кроме того, вторичные анализы и анализы на селективность проводили, используя SSAO, полученную из различных тканей, или очищенную рекомбинантную SSAO крысы. Фермента- 23023038 тивную активность оценивали с бензиламином в качестве субстрата либо путем измерения образования бензальдегида с использованием 14 С-меченого субстрата, либо путем использования образования пероксида водорода в сопряженной реакции с пероксидазой хрена (HRP). Кратко, тестируемые соединения растворяли в диметилсульфоксиде (ДМСО) до концентрации 10 мМ. Измерения доза-ответ оценивали либо путем создания серийных разведений 1:10 в ДМСО с получением кривой по 7 точкам, либо путем создания серийных разведений 1:3 в ДМСО с получением кривых по 11 точкам. Высшие концентрации регулировали в зависимости от эффективности соединений, и путем последующего разведения в реакционном буфере получали конечную концентрацию ДМСО не более 2%. Определение пероксида водорода. В сопряженной реакции с пероксидазой хрена (HRP) в результате окисления пероксидом водорода 10-ацетил-3,7-дигидроксифеноксазина образовывался резоруфин, который является соединением с высокой флуоресценцией (Zhout and Panchuk-Voloshina. Analytical Biochemistry 253 (1997) 169-174; AmplexRed Hydrogen Peroxide/peroxidise Assay kit, Invitrogen A22188). Фермент и соединения в 50 мМ фосфате натрия, рН 7,4 ставили на предварительную инкубацию в микротитрационных планшетах с плоским дном примерно на 15 мин, после чего инициировали реакцию добавлением смеси HRP, бензиламина и реагента Amplex. Концентрация бензиламина была фиксирована при концентрации, соответствующей константе Михаэлиса, определенной с использованием стандартных методов. Затем интенсивность флуоресценции измеряли в нескольких временных точках в течение 1-2 ч с возбуждением при 544 нм и считыванием испускания при 590 нм. Для анализа SSAO человека конечные концентрации реагентов в аналитических лунках составляли фермент SSAO 1 мкг/мл, бензиламин 100 мкМ, реагент Amplex 20 мкМ,HRP 0,1 ед./мл и варьирующие концентрации тестируемого соединения. Ингибирование измеряли в виде% снижения сигнала по сравнению с контролем без ингибитора (только разведенный ДМСО). Фоновый сигнал от образца, не содержащего фермент SSAO, вычитали из всех данных по всем точкам. Данные приводили в соответствие с четырехпараметрической логистической моделью, и значения IC50 вычисляли с использованием программ GraphPad Prism 4 или XLfit 4. Определение альдегида. Активность SSAO количественно определяли, используя бензиламин, меченный 14 С, и анализировали путем измерения радиоактивного бензальдегида. В белом 96-луночном планшете OptiPlate (Packard) 20 мкл разведенного тестируемого соединения предварительно инкубировали при кт с 20 мкл ферментаSSAO в течение примерно 15 мин при непрерывном встряхивании. Все разведения готовили с ФСБ. Реакцию инициировали добавлением 20 мкл раствора субстрата бензиламина, содержащего [7-14 С] бензиламина гидрохлорид (CFA589, GE Healthcare). Планшет инкубировали в течение 1 ч, как описано выше,после чего реакцию останавливали подкислением (10 мкл 1 M HCl). Затем в каждую лунку добавляли 90 мкл раствора Micro Scint-E (Perkin-Elmer), и планшет непрерывно перемешивали в течение 15 мин. Разделение фаз происходило сразу, и активность считывали в сцинтилляционном счетчике Topcount (PerkinElmer). В конечной реакционной лунке концентрация рекомбинантной SSAO человека составляла 10 мкг/мл. В целях оптимизации чувствительности концентрацию субстрата снижали по сравнению с сопряженным анализом HRP, чтобы получить более высокую долю радиоактивного продукта. В анализеSSAO человека концентрация бензиламина составляла 40 мкМ (0,2 мкКи/мл). Данные анализировали,как описано выше. Все примерные соединения по изобретению имели значение IC50 1-2500 нМ в отношении SSAO (см. табл. 9). Таблица 9 Ингибиторная активность в отношении SSAO- 24023038 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль где R1 представляет собой фенил или 6-членный гетероарил, необязательно замещенный одним или более заместителями, выбранными из галогена, циано, гидроксила, C1-4-алкила, галогено-С 1-4-алкила, C1-4 алкокси-C1-4-алкила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, амино-С 1-4-алкила, С 1-4-алкиламино-С 1-4 алкила, ди(C1-4-алкил)амино-С 1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B,-C(O)NR4AR4B, -C(O)R5, -C(O)OR5 и -NR6S(O)2R5;Q представляет собой насыщенное или частично ненасыщенное моноциклическое 3-7-членное гетероциклическое кольцо или С 3-7-циклоалкильное кольцо; когда R2 представляет собой -B-Q-[R3]n, R3 выбран из водорода, галогена, циано, амино, гидроксила,оксо, C1-4-алкила, галогено-С 1-4-алкила, C1-4-алкокси, C1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, циаамино-C1-4-алкила,С 1-4-алкиламино-С 1-4-алкила,ди(C1-4-алкил)амино-C1-4-алкила,но-С 1-4-алкила,-NR4AR4B, -NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5,-S(O)2R5, фенил-C1-4-алкила и гетероарил-C1-4-алкила, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более чем одним заместителем, выбранным из галогена, циано, C14-алкила, галогено-C1-4-алкила, C1-4-алкокси, C1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, циано-С 1-4 алкила, амино-С 1-4-алкила, С 1-4-алкиламино-С 1-4-алкила, ди(C1-4-алкил)амино-С 1-4-алкила, -NR4AR4B,-NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5; когда R2 представляет собой -B-R3, R3 выбран из амино, С 1-4-алкокси, С 1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила,циано-С 1-4-алкила,амино-С 1-4-алкила,С 1-4-алкиламино-С 1-4-алкила,ди(C1-4 алкил)амино-C1-4-алкила, -NR4AR4B, -NR6C(O)OR5, -NR6C(O)NR4AR4B, -C(O)R5, -NR6S(O)2R5, фенил-С 1-4 алкила и гетероарил-С 1-4-алкила, и где любой фенильный или гетероарильный остаток необязательно замещен одним или более заместителями, выбранными из галогена, циано, C1-4-алкила, галогено-С 1-4 алкила, C1-4-алкокси, C1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, циано-C1-4-алкила, амино-С 1-4 алкила, C1-4-алкиламино-C1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила, -NR4AR4B, -NR6C(O)OR5,-NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5, -NR6S(O)2R5, при условии, что когдаR6 представляет собой водород или C1-4-алкил;W выбран из Н, C1-4-алкила, галогено-C1-4-алкила; и где термин "гетероарил" означает моноциклическое гетероароматическое кольцо, содержащее 5 или 6 кольцевых атомов, в котором один или более чем один из этих кольцевых атомов выбран из атома азота,серы или кислорода, и термин "гетероциклический" означает насыщенную или частично ненасыщенную моноциклическую кольцевую структуру, имеющую от 3 до 7 кольцевых атомов, в которой один или более чем один из этих кольцевых атомов выбран из атома азота, серы или кислорода. 2. Соединение по п.1, где В представляет собой связь или метилен. 3. Соединение по п.1 или 2, где R1 необязательно замещен одним или более заместителями, выбранными из галогена, циано, гидроксила, С 1-4-алкила, галогено-C1-4-алкила, C1-4-алкокси-C1-4-алкила,гидрокси-С 1-4 алкила, циано-С 1-4-алкила, амино-С 1-4-алкила, C1-4-алкиламино-C1-4-алкила, ди(C1-4 алкил)амино-C1-4-алкила, -NR4AR4B. 4. Соединение по п.1 или 2, где R1 представляет собой гетероарил, необязательно замещенный од- 25023038 ним или более заместителями, выбранными из фтора, хлора и С 1-4-алкила. 5. Соединение по любому из пп.1-3, где R1 представляет собой фенил, необязательно замещенный в пара-, мета- и орто-положениях одним или более заместителями, выбранными из водорода, фтора, хлора,циано, гидроксила, C1-4-алкила, фторметила, дифторметила или трифторметила. 6. Соединение по любому из пп.1-5, где R2 представляет собой -B-Q-[R3]n и Q представляет собой насыщенное или частично ненасыщенное 7-членное гетероциклическое или 7-членное циклоалкильное кольцо. 7. Соединение по п.1, где Q выбран из тетрагидрофуранила, тетрагидропиранила, пиперидинила,пиперазинила, морфолинила, циклогексила или любого из вышеуказанных колец, содержащего мостиковую связь, образованную этиленовым или пропиленовым радикалом. 8. Соединение по любому из пп.1-5, где R2 представляет собой морфолин-4-ил, морфолин-4 илметил, оксолан-3-ил, оксолан-3-илметил, оксан-4-илметил, оксан-4-ил или тетрагидропиридинил или где R2 представляет собой пиперидин-4-ил, пиперазин-1-ил, пиперидин-4-илметил, оксопиперазин или пиперазин-1-илметил, каждый из которых необязательно может быть замещен радикалом R3 на кольце или на кольцевом атоме азота в 1 положении. 9. Соединение по любому из пп.1-5, где R2 представляет собой:(i) одно- или двузамещенную аминогруппу, где заместители выбраны из С 1-4-алкила, гидрокси-C1-4 алкила, галогено-C1-4-алкила, циано-C1-4-алкила, амино-C1-4-алкила, C1-4-алкиламино-C1-4-алкила, гидрокси-С 1-4 алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкила или C1-4-алкокси-C1-4-алкила; или(ii) группу C1-4-алкокси-С 1-4-алкил, гидрокси-C1-4-алкил, циано-С 1-4-алкил, амино-С 1-4-алкил, С 1-4 алкиламино-C1-4-алкил или ди(C1-4-алкил)амино-C1-4-алкил. 11. Соединение по п.6, где Q представляет собой гомоморфолиновое кольцо или мостиковое гомоморфолиновое кольцо, где мостиковая связь образована этиленовым или пропиленовым радикалом. 12. Соединение по п.1, которое представляет собой 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]-1,2,3,6-тетрагидропиридин; трет-бутил-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксилат; 1-(4-хлорфенил)-3-пиперидин-4-ил-1 Н-пирроло[2,3-с]пиридин; трет-бутил-N-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]циклогексилкарбамат; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]циклогексан-1-амин; 4-[1-(4-хлор-2-метилфенил)-1H-пирроло[2,3-с]пиридин-3-ил]циклогексан-1-амин; 1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил-2-(диметиламино)этан-1-он; 1-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил-2-гидроксиэтан-1-он; 2-амино-1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илэтан-1-он; 3-амино-1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илпропан-1-он; 2-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илэтан-1-ол; 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-(1H-пиразол-3-илметил)пиперидин; 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-[(1-метил-1 Н-пиразол-4 ил)метил]пиперидин; 3-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илпропаннитрил; 4-4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илбутаннитрил;(1-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метилпиперидин-4-ил)метанол; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]метилморфолин; 1-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метилпиперидин-4-ол; 2-([1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]метиламино)этан-1-ол; 1-(4-хлорфенил)-3-(оксан-4-ил)-1 Н-пирроло[2,3-с]пиридин; 1-(4-метилфенил)-3-(оксан-4-ил)-1 Н-пирроло[2,3-с]пиридин; 5-хлор-2-[3-(оксан-4-ил)-1 Н-пирроло[2,3-с]пиридин-1-ил]пиридин; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]морфолин; 4-амино-1-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-илбутан-1-он; 2-аминоэтил-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксилат; 3-(3,6-дигидро-2 Н-пиран-4-ил)-2-метил-1-(4-метилфенил)-1 Н-пирроло[2,3-с]пиридин или их фармацевтически приемлемую соль. 13. Фармацевтическая композиция для лечения воспаления, воспалительного заболевания, иммун- 26023038 ного или аутоиммунного расстройства или ингибирования опухолевого роста, содержащая соединение по любому из пп.1-12 и один или более фармацевтически приемлемых носителей и/или эксципиентов. 14. Применение соединения по любому из пп.1-12 для лечения воспаления, воспалительного заболевания, иммунного или аутоиммунного расстройства или ингибирования опухолевого роста. 15. Применение по п.14, где воспаление, либо воспалительное заболевание, либо иммунное или аутоиммунное расстройство выбрано из группы, состоящей из артрита, синовита, васкулита, состояния,связанного с воспалением кишечника, атеросклероза, рассеянного склероза, болезни Альцгеймера, сосудистой деменции, легочного воспалительного заболевания, фиброзного заболевания, воспалительного заболевания кожи, синдрома системного воспалительного ответа, сепсиса, воспалительного и аутоиммунного состояния печени, диабета типа I или II и его осложнений, хронической сердечной недостаточности, застойной сердечной недостаточности, ишемического заболевания, удара и повреждения при ишемии-реперфузии, инфаркта миокарда и его осложнений. 16. Применение по п.15, где артрит выбран из ревматоидного артрита, ювенильного ревматоидного артрита, остеоартрита и псориатического артрита. 17. Применение по п.15, где состояние, связанное с воспалением кишечника, выбрано из болезни Крона, неспецифического язвенного колита, воспалительного кишечного заболевания и синдрома раздраженной кишки. 18. Применение по п.15, где легочное воспалительное заболевание выбрано из астмы, хронической обструктивной болезни легких и острого респираторного дистресс-синдрома. 19. Применение по п.15, где фиброзное заболевание выбрано из идиопатического легочного фиброза, сердечного фиброза и системного склероза склеродермы. 20. Применение по п.15, где воспалительное заболевание кожи выбрано из контактного дерматита,атопического дерматита и псориаза. 21. Применение по п.15, где воспалительное и аутоиммунное состояние печени выбрано из аутоиммунного гепатита, первичного билиарного цирроза, алкогольного заболевания печени, склерозирующего холангита и аутоиммунного холангита.
МПК / Метки
МПК: A61P 9/10, C07D 471/04, A61P 37/06, A61K 31/437, A61P 25/28, C07D 487/04, C07D 498/08, A61P 35/00, A61P 11/08
Метки: фермента, ингибиторы, соединения
Код ссылки
<a href="https://eas.patents.su/28-23038-soedineniya-ingibitory-fermenta.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения – ингибиторы фермента</a>
Предыдущий патент: Рекомбинантный белок эксендина-4 и его аналога, способ их приготовления и применение
Следующий патент: Бензазепиновое соединение, фармацевтическая композиция, включающая его, и его применение
Случайный патент: Система и способ гидратации алкиленоксида












