Соединения-ингибиторы дипептидилпептидазы-iv, способы их получения, а также фармацевтические композиции, содержащие указанные соединения в качестве активного ингредиента
Номер патента: 12591
Опубликовано: 30.10.2009
Авторы: Бу Сеонг Чеол, Ким Геун Тае, Хур Гвонг-Чеунг, Хонг Санг Йонг, Ким Мин-Дзунг, Хан Хее Оон, Ким Дзи Янг, Кох Дзонг Сунг, Ким Сунгсуб, Ли Чанг-Сеок, Ким Сунг Хо, Коо Ки Донг, Йим Хиеон Дзоо, Ким Киоунг-Хее, Квон Ох Хван, Йео Донг-Дзун, Йеом Зи-Хо, Ким Хие Дзин, Лим Донгчул
Формула / Реферат
1. Соединение формулы (1) или его фармацевтически приемлемая соль

где
(А) А выбран из группы, состоящей из заместителей следующих формул со (2) по (7):
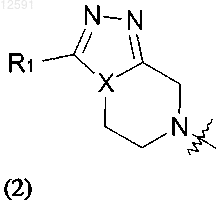
где R1 представляет собой водород или С1-С4алкил, необязательно замещенный галогеном или гидроксилом; и X представляет собой углерод или азот;

где R2 представляет собой водород или С1-С4алкил, необязательно замещенный галогеном или гидроксилом;
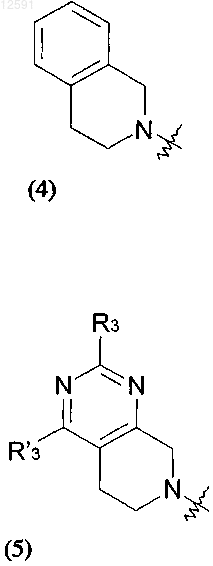
где R3 представляет собой водород или С1-С4алкил, С3-7циклоалкил, фенил или 5- или 6-членный гетероарил, содержащий в качестве гетероатомов N, S, О, необязательно замещенные галогеном или гидроксилом; и R'3 представляет собой водород или CF3;
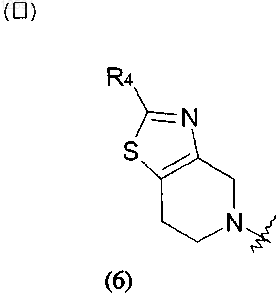
где R4 представляет собой водород, галоген или С1-С4алкил, необязательно замещенный галогеном или гидроксилом, или выбран из заместителей следующих формул (6а) и (6b):
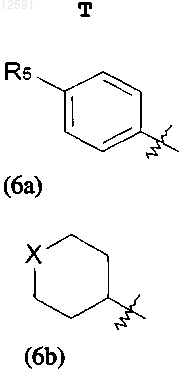
где R5 представляет собой водород, галоген или С1-С4алкил, необязательно замещенный галогеном или гидроксилом; и X представляет собой кислород, серу или сульфон;
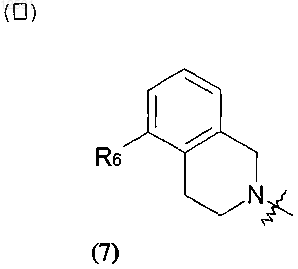
где R6 представляет собой галоген или С1-С4алкил, необязательно замещенный галогеном или гидроксилом;
(В) В выбран из группы, состоящей из заместителей следующих формул с (8) по (11):
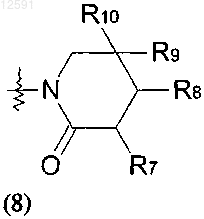
где R7, R8, R9 и R10, каждый независимо, представляет собой водород, галоген или С1-С4алкил, необязательно замещенный галогеном или гидроксилом;

где R11, R12 и R13, каждый независимо, представляет собой водород, галоген или С1-С4алкил, необязательно замещенный галогеном или гидроксилом; и
Y представляет собой кислород, серу или SO2;
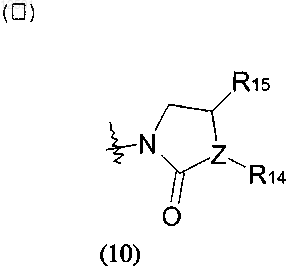
где R14 и R15, каждый независимо, представляет собой водород, галоген или С1-С4алкил, необязательно замещенный галогеном или гидроксилом; и
Z представляет собой -СН- или кислород, причем, когда Z представляет собой кислород, R14 отсутствует;
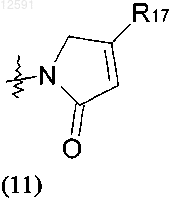
где R17 представляет собой С1-С4алкил, необязательно замещенный галогеном или гидроксилом.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где замещенный С1-С4алкил представляет собой алкил, замещенный галогеном.
3. Соединение по п.2 или его фармацевтически приемлемая соль, где галоген представляет собой фтор.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где А представляет собой заместитель формулы (5) и R3 выбран из группы, состоящей из следующих заместителей:
![]() водород;
водород;
![]() С1-С4алкил, необязательно замещенный галогеном или гидроксилом;
С1-С4алкил, необязательно замещенный галогеном или гидроксилом;
![]() группа формулы -CH2-R18, где R18 представляет собой С1-С4алкоксиалкил или С3-С7циклоалкил, незамещенный или замещенный галогеном или гидрокси, или фенил, незамещенный или замещенный галогеном или гидроксилом, или 5- или 6-членный гетероарил;
группа формулы -CH2-R18, где R18 представляет собой С1-С4алкоксиалкил или С3-С7циклоалкил, незамещенный или замещенный галогеном или гидрокси, или фенил, незамещенный или замещенный галогеном или гидроксилом, или 5- или 6-членный гетероарил;
![]() С3-С7циклоалкил, необязательно замещенный галогеном или гидроксилом;
С3-С7циклоалкил, необязательно замещенный галогеном или гидроксилом;
![]() группа формулы
группа формулы
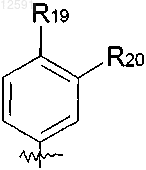
где R19 и R20, каждый, независимо представляет собой водород, галоген, или С1-С4алкил, необязательно замещенный галогеном или гидроксилом; и
![]() 5-членный или 6-членный гетероарил, незамещенный или замещенный галогеном или гидрокси.
5-членный или 6-членный гетероарил, незамещенный или замещенный галогеном или гидрокси.
5. Соединение по п.4 или его фармацевтически приемлемая соль, где замещенный С3-С7циклоалкил и С1-С4алкил представляют собой циклоалкил иалкил, замещенный галогеном или гидрокси.
6. Соединение по п.1 или его фармацевтически приемлемая соль, где гетероарил представляет собой 2-фуран, 3-фуран, 2-тиофен, 3-тиофен, 2-пиридин, 3-пиридин, 4-пиридин, 2-пиррол или 3-пиррол.
7. Соединение по п.1 или его фармацевтически приемлемая соль, где соединение представляет собой стереоизомер, как представлено в следующей формуле (1a):

где А и В являются такими же, как в формуле (1).
8. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из группы, состоящей из следующих соединений:
3-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил] оксазолидин-2-он;
3-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-5-метилоксазолидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил] пиперидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-4-метилпиролидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-4,4-диметилпиролидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-3-фторпиролидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил] пиролидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-3-фторпиперидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-3-метилпиролидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-4-метил-1,5-дигидропиррол-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-4-метилпиперидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-5,5-дифторпиперидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-5R-метилпиперидин-2-он;
3-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-3-азабицикло[3,1,0]гексан-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-4-трифторметилпиролидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-4-трифторметилпиперидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-5-трифторметилпиперидин-2-он;
4-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]-6-метилморфолин-3-он;
1-[2S-амино-4-(3,4-дигидро-1Н-изохинолин-2-ил)-4-оксобутил]пиперидин-2-он;
1-[2S-амино-4-(3,4-дигидро-1Н-изохинолин-2-ил)-4-оксобутил]-4-метилпиролидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-4,5-дигидро-7Н-изоксазоло[3,4-с]пиридин-6-ил)бутил]пиперидин-2-он;
1-[2S-амино-4-оксо-4-(3-трифторметил-1,4,5,7-тетрагидропиразоло[3,4-с]пиридин-6-ил)бутил]пиперидин-2-он;
1-[2S-амино-4-оксо-4-(4-трифторметил-5,8-дигидро-6Н-пиридо[3,4-d]пиримидин-7-ил)бутил]-5R-метил-1-пиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-фенил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[2-фенил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-оксо-4-[2-фенил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
1-{(2S)-2-амино-4-[2-циклопропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
1-{(2S)-2-амино-4-[2-циклопропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-циклопропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-оксо-4-[5-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[5-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]бутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-[2-(4-фторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-(4-фторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-2-он;
1-{(2S)-2-амино-4-[2-(3-фторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-(3-фторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
(5R)-1-{(2S)-2-амино-4-[2-(4-фторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-(3,4-дифторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-(3,4-дифторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
(5R)-1-{(2S)-2-амино-4-[2-(3,4-дифторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-циклопентил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-циклопентил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-[2-циклопентил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-1-[(2S)-2-амино-4-оксо-4-{2-[4-(трифторметил)фенил]-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил}бутил]-5-метилпиперидин-2-он;
(6S)-4-[(2S)-2-амино-4-оксо-4-{2-[4-(трифторметил)фенил]-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил}бутил]-6-метилморфолин-3-он;
1-[(2S)-2-амино-4-оксо-4-{2-[4-(трифторметил)фенил]-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил}бутил]-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-(4-фторфенил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[2-(4-фторфенил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]бутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-[2-(4-фторфенил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-(тетрагидро-2Н-пиран-4-ил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]бутил}-5-метилпиперидин-2-он;
(6S)-4-{(2R)-2-амино-4-оксо-4-[2-(тетрагидро-2Н-пиран-4-ил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]бутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-оксо-4-[2-(тетрагидро-2Н-пиран-4-ил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[2-(трифторметил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]бутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-оксо-4-[2-(трифторметил)-6,7-дигидро[1,3]тиазоло[4,5-с]пиридин-5(4Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-(2-метоксиэтил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-(2-метоксиэтил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-(циклопропилметил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-(циклопропилметил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-пиридин-4-ил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-оксо-4-[2-пиридин-4-ил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-(4-фторбензил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-(4-фторбензил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-(3-тиенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-оксо-4-[2-(3-тиенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-(2-тиенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-оксо-4-[2-(2-тиенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-(2-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-(2-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-(1Н-пиррол-2-ил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-оксо-4-[2-(1Н-пиррол-2-ил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-пиридин-3-ил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-оксо-4-[2-пиридин-3-ил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
1-{(2S)-2-амино-4-[2-этил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-этил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиридин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-[2-изопропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
1-{(2S)-2-амино-4-[2-изопропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-изопропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
(6R)-4-{(2S)-2-амино-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазолю[4,3-а]пиразин-7(8Н)-ил]бутил}-6-метилморфолин-3-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8Н)-ил]бутил}-6-метилморфолин-3-он;
(5S)-1-{(2S)-2-амино-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8Н)-ил]бутил}-5-метилпиперидин-2-он;
(5S)-1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-метил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(5R)-4-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-[2-метил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-метил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-оксо-4-[4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-оксо-4-[3-(пентафторэтил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[3-(пентафторэтил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8Н)-ил]бутил}-6-метилморфолин-3-он;
4-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилтиоморфолин-3-он;
1-{(2S)-2-амино-4-[2-трет-бутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-[2-трет-бутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-он;
4-{(2S)-2-амино-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8Н)-ил]бутил}-6-метилтиоморфолин-3-он;
(5R)-1-{(2S)-2-амино-4-[2-этил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиридин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-(пентафторэтил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
(6S)-4-{(2S)-2-амино-4-оксо-4-[2-(пентафторэтил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-6-метилморфолин-3-он;
1-{(2S)-2-амино-4-оксо-4-[2-(пентафторэтил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-оксо-4-[2-пропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-оксо-4-[2-пропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-(фторметил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-(фторметил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он;
1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-метил-1,5-дигидро-2Н-пиррол-2-он;
1-{(2S)-2-амино-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-метил-1,5-дигидро-2Н-пиррол-2-он;
1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-метилоксопиролидин-2-он;
1-{(2S)-2-амино-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-метилпиролидин-2-он;
1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-(трифторметил)пиперидин-2-он;
1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-(трифторметил)пиролидин-2-он;
1-{(2S)-2-амино-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-(трифторметил)пиролидин-2-он;
1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-метилоксопиперидин-2-он;
1-{(2S)-2-амино-4-[2-(3-фурил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-4-метилпиперидин-2-он;
(5R)-1-{(2S)-2-амино-4-[2-циклобутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-он;
1-{(2S)-2-амино-4-[2-циклобутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиридин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-он.
9. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (5R)-1-{(2S)-2-амино-4-[2-метил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
10. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (5R)-1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
11. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из 1-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
12. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (6S)-4-{(2S)-2-амино-4-[2,4-бис(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
13. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из 1-{(2S)-2-амино-4-[2-метил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
14. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (6S)-4-{(2S)-2-амино-4-[2-метил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
15. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (6S)-4-{(2S)-2-амино-4-[2-(4-фторфенил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
16. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из 1-{(2S)-2-амино-4-[2-трет-бутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
17. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (6S)-4-{(2S)-2-амино-4-[2-трет-бутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-она и его соли малеиновой кислоты, фосфорэющ кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
18. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (6S)-4-{(2S)-2-амино-4-[2-циклопропил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-6-метилморфолин-3-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
19. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (5R)-1-{(2S)-2-амино-4-оксо-4-[2-(пентафторэтиил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5-метилпиперидин-2-он и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
20. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (6S)-4-{(2S)-2-амино-4-оксо-4-[2-(пентафторэтил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-6-метилморфолин-3-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
21. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из 1-{(2S)-2-амино-4-оксо-4-[2-(пентафторэтил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]бутил}-5,5-дифторпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
22. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из (5R)-1-{(2S)-2-амино-4-[2-(фторметил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5-метилпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
23. Соединение по п.1 или его фармацевтически приемлемая соль, отличающиеся тем, что выбраны из 1-{(2S)-2-амино-4-[2-(фторметил)-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6Н)-ил]-4-оксобутил}-5,5-дифторпиперидин-2-она и его соли малеиновой кислоты, фосфорной кислоты, винной кислоты, хлороводородной кислоты, метансульфоновой кислоты или лимонной кислоты.
24. Фармацевтическая композиция для ингибирования дипептидилпептидазы-IV (DPP-IV), содержащая эффективное количество соединения формулы 1, как определено в п.1, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
25. Фармацевтическая композиция по п.24, отличающаяся тем, что композиция предназначена для лечения или профилактики сахарного диабета или ожирения.
Текст
012591 Область изобретения Данное изобретение относится к соединениям с новой структурой, которые обладают выраженной ингибирующей активностью в отношении дипептидилпептидазы-IV (DPP-IV), способам их получения, а также фармацевтическим композициям, содержащим указанные соединения в виде активного ингредиента. Уровень техники Сахарный диабет оказывает существенное влияние на здоровье людей и сопровождается различными осложнениями. Существует два основных типа сахарного диабета: сахарный диабет I типа, который характеризуется незначительной или полностью отсутствующей способностью к секреции инсулина в результате разрушения клеток поджелудочной железы, и диабет II типа, который характеризуется недостатком инсулина и инсулинорезистентностью вследствие других причин. Распространенность сахарного диабета II типа составляет 90% или более среди всех пациентов, заболевших сахарным диабетом. Типичные примеры осложнений, сопровождающих диабет, включают гиперлипидемию, гипертензию, ретинопатию и почечную недостаточность (Paul Zimmer, et al., Nature,2001, 414, 782). Препараты сульфонилмочевины (стимулирующие секрецию инсулина в клетках поджелудочной железы), бигуаниды (ингибирующие образование глюкозы в печени), ингибиторы глюкозидазы (ингибирующие всасывание глюкозы в кишечнике) и прочие используют для лечения диабета. В последнее время агонисты ядерных гамма-рецепторов, активируемых пролифератором пероксисом (PPAR), (тиазолидиндионы, увеличивающие чувствительность к инсулину) привлекают внимание как терапевтические агенты для лечения диабета. Однако данные препараты вызывают такие побочные реакции, как гипогликемию, увеличение веса и др. (David E. Moller, Nature, 2001, 414, 821). Соответственно, существует большая потребность в разработке терапевтических агентов для лечения диабета, обладающих меньшими побочными эффектами, в частности, не вызывающих гипогликемию и увеличение веса. Недавно было обнаружено, что у мышей, дефицитных к дипептидилпептидазе-IV (DPP-IV), поддерживается активность глюкагоноподобного протеина 1 (GLP-I) и высокий уровень инсулина, приводящий к пониженному уровню глюкозы крови, что свидетельствует о возможности использования указанного соединения в качестве терапевтического агента для лечения диабета (Marguet D. et al., Natl. Acad.Sd. USA, (2000) 97, 6874-6879). GLP-I индуцирует дифференцировку и рост р-клеток поджелудочной железы in vivo, а также играет важную роль в образовании и секреции инсулина. GLP-I инактивируетсяDPP-IV, a кроме того было показано, что ингибиторы DPP-IV усиливают секрецию инсулина посредством ингибирования вышеуказанного механизма инактивации. Ингибиторы DPP-IV также разрабатываются для лечения ожирения, поскольку они приводят к возникновению чувства насыщения у крыс и уменьшают усвоение пищи в кишечнике, что приводит к потере веса. Более того, многие исследования и эксперименты на животных показали, что ингибиторы DPP-IV контролируют уровень глюкозы и липидов крови (Pospislik J.А., et al., Diabetes, (2002) 51, 943-950). В этой связи ингибиторы DPP-IV могут быть рассмотрены в качестве потенциально полезных агентов для лечения диабета. До настоящего времени множество исследований, направленных на разработку ингибиторов DPPIV, были сосредаточены на соединениях, в которых цианогруппа связана с пирролидиновым кольцом. Например, WO 00/34241 раскрывает ингибиторы DPP-IV, представленные следующей формулой где R представляет собой адамантильную группу и n имеет значение от 0 до 3. Другие ингибиторы раскрыты в WO 04/064778, WO 03/004498, WO 03/082817 и так далее, и среди них WO 04/064778 раскрывает DPP-IV ингибиторы, представленные формулой, указанной ниже где Ar представляет собой незамещенную или замещенную фенильную группу; R15, R16 и R17 представляют собой водород или алкильную группу и U, V и W представляют собой азот, кислород или замещенный азот или углерод. где Ar представляет собой незамещенную или замещенную фенильную группу; R18 представляет собой водород или алкильную группу и Т представляет собой азот или замещенный углерод. где Ar представляет собой незамещенную или замещенную фенильную группу; R19, R20 и R21 представляют собой водород или алкильную группу и Q представляет собой азот или замещенный углерод. Указанные DPP-IV ингибиторы в своих молекулярных структурах имеют амидную связь аналогично настоящему изобретению; тем не менее, незамещенные или замещенные фенильные группы, которые представлены как Ar в указанных выше формулах данных ингибиторов, полностью отличаются от замещенных или незамещенных, 5-членных или 6-членных гетероциклических заместителей настоящего изобретения. Кроме того, DPP-IV ингибиторы настоящего изобретения, имеющие лактамовое кольцо у положения фенильной группы указанных выше ингибиторов, не раскрыты в уровне техники. Раскрытие изобретения Техническая задача В настоящем изобретении при выполнении обширных исследований и многочисленных экспериментов для разработки соединений, обладающих DPP-IV ингибиторными эффектами, было найдено, что соединения, имеющие необязательно замещенную лактамовую кольцевую структуру, демонстрируют отличную ингибирующую активность в отношении DPP-IV. Настоящее изобретение осуществлено на основе такого заключения. Следовательно, объектом изобретения являются новые соединения с необязательно замещенной лактамовой кольцевой структурой, имеющие высокую ингибирующую активность в отношении DPP-IV. Кроме того, объектом настоящего изобретения являются способы получения указанных соединений. Другим объектом настоящего изобретения являются фармацевтические композиции для ингибирования DPP-IV активности, содержащие фармацевтически эффективное количество таких соединений в качестве активного ингредиента, и также способы лечения или профилактики заболеваний, вызванных несоответствующей активностью DPP-IV за счет применения соединений настоящего изобретения. Другие объекты и преимущества настоящего изобретения будут очевидны среднему специалисту из последующего детального описания. Техническое решение В соответствии с настоящим изобретением обеспечено соединение формулы 1, представленное ниже где А выбран из группы, состоящей из заместителей формул со 2 по 7, представленных ниже где R1 представляет собой водород или замещенный или незамещенный C1-C4 алкил и X представляет собой углерод или азот; где R2 представляет собой водород или замещенный или незамещенный С 1-С 4 алкил; где R3 представляет собой водород или замещенный или незамещенный алкил, циклоалкил, арил или гетероарил и R'3 представляет собой водород, CF3; где R4 представляет собой водород, галоген или замещенный или незамещенный C1-C4 алкил или выбран из заместителей формул 6 а и 6b, представленных ниже где R5 представляет собой водород, галоген или замещенный или незамещенный C1-C4 алкил и X представляет собой кислород, серу или сульфон;-3 012591 где R6 представляет собой галоген или замещенный или незамещенный C1-C4 алкил;(В) В выбран из группы, состоящей из заместителей формул с 8 по 11, представленных ниже где R7, R8, R9 и R10, каждый независимо, представляет собой водород, галоген или замещенный или незамещенный C1-C4 алкил; где R11, R12 и R13, каждый независимо, представляет собой водород, галоген или замещенный или незамещенный С 1-С 4 алкил и Y представляет собой кислород, серу или SO2; где R14 и R15, каждый независимо, представляет собой водород, галоген или замещенный или незамещенный C1-C4 алкил и Z представляет собой -СН- или кислород, где Z представляет собой кислород, R отсутствует; где R представляет собой замещенный или незамещенный C1-C4 алкил,где С 1-С 4 алкил является замещенным, как определено в указанной выше формуле, предпочтительно является, что алкил замещен галогеном, и более предпочтительно, что алкил замещен фтором. В предпочтительном воплощении R5 в формуле 5 выбран из группы, состоящей из представленных ниже заместителей водорода; замещенного или незамещенного C1-C4 алкила; группы формулы -CH2-R18, где R18 представляет собой С 1-С 4 алкоксиалкил или С 3-С 7 циклоалкил, незамещенный или замещенный галогеном или гидрокси, или фенил, незамещенный или замещенный галогеном или гидрокси; замещенного или незамещенного С 3-С 7 циклоалкила; группы формулы где R19 и R20, каждый независимо, представляет собой водород, галоген или замещенный или незаме-4 012591 щенный C1-C4 алкил; и 5-членного или 6-членного гетероарила, незамещенного или замещенного галогеном или гидрокси. В указанном выше воплощении, где С 3-С 7 циклоалкил и C1-C4 алкил представляют собой замещенную форму, они предпочтительно представляют собой циклоалкил и алкил, замещенный галогеном или гидрокси. Предпочтительные примеры гетероарила, как определено выше, включают, но без ограничения 2 фуран, 3-фуран, 2-тиофен, 3-тиофен, 2-пиридин, 3-пиридин, 4-пиридин, 2-пиррол, 3-пиррол и так далее. Соединения по настоящему изобретению включают их изомеры, и предпочтительно изомер представляет собой соединение формулы 1a, представленной ниже, в которой атом углерода, смежный с группой NH2, является хиральным центром где А и В являются теми же самыми, как в формуле 1. Соединение настоящего изобретения может образовывать кислотный аддукт с фармацевтически приемлемой кислотой. Как используют в настоящем изобретении, фармацевтически приемлемая соль включает неорганические соли, органические соли, соли аминокислоты, и так далее и более конкретно,соли с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, фосфорная кислота или серная кислота; соли с органическими карбоновыми кислотами, такими как уксусная кислота, лимонная кислота, трифторуксусная кислота, муравьиная кислота, малеиновая кислота, щавелевая кислота, янтарная кислота, бензойная кислота, винная кислота, фумаровая кислота, миндальная кислотная, аскорбиновая кислота, яблочная кислота и им подобные; соли с метансульфоновой кислотой, птолуолсульфоновой кислотой и им подобные. Соединение настоящего изобретения или его фармацевтически приемлемые соли могут быть представлены в виде гидрата или сольвата. В особенно предпочтительном воплощении соединения формулы 1 по настоящему изобретению представляют собой соединения, как определено ниже 3-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил] оксазолидин-2-он; 3-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]5-метилоксазолидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил] пиперидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]4-метилпиролидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]4,4-диметилпиролидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]3-фторпиролидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил] пиролидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]3-фторпиперидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]3-метилпиролидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]4-метил-1,5-дигидропиррол-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]4-метилпиперидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]5,5-дифторпиперидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]5R-метилпиперидин-2-он; 3-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]3-азабицикло[3,1,0]гексан-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]4-трифторметилпиролидин-2-он; 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)бутил]4-трифторметилпиперидин-2-он;(5R)-1-(2S)-2-амино-4-[2-циклобутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин 7(6 Н)-ил]-4-оксобутил-5-метилпиперидин-2-он; 1-(2S)-2-амино-4-[2-циклобутил-4-(трифторметил)-5,8-дигидропиридо[3,4-d]пиримидин-7(6 Н)-ил]4-оксобутил-5,5-дифторпиперидин-2-он. Настоящее изобретение также относится к способам получения соединения формулы 1. В первом иллюстративном способе получения соединение формулы 1 может быть получено способом, включающим стадию взаимодействия соединения формулы 12, представленной ниже, с соединением формулы 13 и стадию удаления аминозащитной группы P1 где R21 выбран из группы, состоящей из заместителей формул с 13 а по 13d где А, В, Y, Z, R7, R8, R9, R10, R11, R12, R13, R14, R15 и R17 являются теми же самыми, как определено выше;P1 представляет собой аминозащитную группу иG1 отсутствует или представляет собой соляную кислоту, серную кислоту или трифторуксусную кислоту. Указанная выше реакция может быть проведена в присутствии органического растворителя, такого как дихлорэтан или циклический эфир (например, тетрагидрофуран (ТГФ в интервале температур от-10 до 4 С. Продукт реакции может быть выделен и очищен от реагентов известными способами, такими как хроматография. Соединение формулы 12, указанной выше, может быть получено в соответствии с реакционной схемой 1, представленной ниже.f представляет собой реагент Сверна [О] (Swern) или реагент Десс Мартина [О] (Dess Martin); А и Р 1 являются теми же самыми, как определено выше; и Р 2 представляет собой бензил, метил или этил. Более конкретно, карбоновую кислоту формулы 14, указанной выше, превращают в ангидрид эфира, который затем обрабатывают, используя NaBH4 в присутствии метанольного растворителя для получения первичного спирта в качестве продукта. Полученный первичный спирт защищают третбутилдиметилсилильной группой, затем в случае образования бензилового эфира, проводят реакцию гидролиза, используя платиновый комплекс и водород, а в случае образования метила или этила, проводят реакцию гидролиза, используя гидроксид лития, таким образом получая карбоновую кислоту. При этом, желаемая аминовая группа может быть подвергнута превращению через реакцию связывания, используя EDC и НОВТ, после чего TBS группу удаляют, с последующим окислением с помощью методик по Сверну или Десс-Мартину, чтобы получить альдегид формулы 12. В случае, если аминозащитная группа представляет собой Вос-группу, она может быть удалена с использованием TFA или HCl, а в случае, если аминозащитная группа представляет собой Cbz, она может быть удалена с использованием смеси H2/Pd/C или TMSI, а в случае, если аминозащитная группа представляет собой Fmoc, она может быть удалена с использованием Et2NH. Амин А в формуле 12 может быть получен способами, изложенными в WO 04/064778, WO 03/004498, WO 03/082817 и так далее, или могут быть использованы коммерчески доступные амины. Альтернативно, соединение формулы 12 может быть синтезировано из соединения формулы 14, как описано в известной методике (например, J. Med. Chem. 1999, 42(18), 3557-3571; WO 04/069162 и так далее). Согласно второму иллюстративному способу получения соединение формулы 1 может быть получено способом, включающим стадию взаимодействия соединения формулы 13, указанной выше, с соединением формулы 15, представленной ниже, стадию удаления кислотно-защитной группы Р 3 и стадию взаимодействия полученного продукта с соединением формулы АН (где А является тем же самым, как в формуле 1), с последующим удалением аминозащитной группы где P1 является тем же самым, как определено выше; и Р 3 представляет собой бензил или трет-бутил. Например, указанный выше способ может быть проведен с помощью реакционной схемы 2, представленной ниже. Реакционная схема 2d) представляет собой смесь HCl/диоксан; А и В являются теми же самыми, как определено выше;P1 представляет собой аминозащитную группу, такую как Вос-группа, Cbz или Fmoc; Р 2 представляет собой бензил или трет-бутил;G1 отсутствует или представляет собой соляную кислоту, серную кислоту или трифторуксусную кислоту. Способ получения соединения формулы 16 известен (например, J. Med. Chem. 1999, 42(18), 35573571). Реакцию а) проводят в присутствии органического растворителя, такого как дихлорэтан или циклический эфир (например, тетрагидрофуран (ТГФ в интервале температур от -10 до 40 С путем взаимодействия соединения формулы 15 предпочтительно с первичным амином, взятым в количестве от 0,7 до 1,5 экв. (соединение формулы 13). При этом, далее реакцию циклизации проводят в тех же самых условиях, как указано выше, чтобы синтезировать соединение формулы 16, и затем соединение формулы 16 превращают в карбоновую кислоту формулы 17 через реакцию b). При этом, в случае, если защитная группа Р 2 представляет собой бензил, Р 2 удаляют с помощью смеси H2/Pd/C, чтобы синтезировать карбоновую кислоту. В случае, если защитная группа Р 2 представляет собой трет-бутил и Р 1 представляет собой Boc-группу, эти защитные группы вместе удаляют, используя смесь дихлорметан/TFA, группу амина снова защищают с помощью Вос-группы, чтобы синтезировать карбоновую кислоту. Используя таким образом полученную карбоновую кислоту и амин АН,соединение формулы 18 получают с помощью известной реакции с). В случае, если аминозащитная группа Р 1 представляет собой Вос-группу, соединение формулы 1a получают с помощью реакции d). В случае, если P1 представляет собой Cbz, P1 удаляют, используя смесьH2/Pd/C или TMSI, и в случае, если Р 1 представляет собой Fmoc, P1 удаляют, используя Et2NH, таким образом получая соединение формулы 1a. Амин АН в реакции с) может быть получен способами, изложенными в WO 04/064778, WO 04/007468 и так далее, или могут быть использованы коммерчески доступные амины. Среди аминов в реакции с) амин, как определено ниже, может быть синтезирован, например, с помощью реакционной схемы 3, представленной ниже. Реакционная схема 3(4) R21C=NH(NH2), пиридин, температура кипения с обратным холодильником; с представляет собой смесь HCl/диоксан или HCl/этилацетат;R21 представляет собой водород, алкил или арил. Более конкретно, соединение формулы 20 может быть получено путем образования енолята из соединения формулы 19 с использованием LHMDS, с последующим добавлением трифторацетата (ссылка:J. Fluorine Chem. 2003, 123(2), 267-272). Имеются различные способы получения соединения формулы 21, имеющего пиримидиновое кольцо, из соединения формулы 20, и среди них способ, использующийBF3OEt2 в качестве катализатора (Synthesis 2000, 12, 1738-1748), и способ, использующий пиридин в качестве растворителя (Tetrahedron 1983, 39(19), 3197-3199), являются предпочтительными с точки зрения получения хорошего выхода. Используя, таким образом, полученное соединение формулы 21, может быть получено желаемое соединение формулы 22. Согласно третьему иллюстративному способу получения соединение формулы 1 может быть получено способом, включающим стадию взаимодействия соединения формулы 15, указанной выше, с соединением формулы 23, представленной ниже. где G2 отсутствует или представляет собой кислоту, предпочтительно соляную кислоту, серную кислоту или трифторуксусную кислоту;R26 представляет собой водород, замещенный или незамещенный C1-C4 алкил. В случае, если соединение формулы 15 взаимодействует с соединением формулы 23, происходит реакция циклизации соединения, которое получают в соответствии с методикой, аналогичной методике получения соединения формулы 13 во втором иллюстративном способе, используя COCl2, чтобы образовать остаток В, и последующую реакцию проводят в соответствии с методикой, аналогичной методике второго иллюстративного способа, чтобы синтезировать соединение формулы 1. Из указанной реакции может быть получено соединение формулы 15 и соединение формулы 12, соединение формулы 1, в котором Z представляет собой О в формуле 10. В качестве исходных продуктов используют известные соединения, за исключением случая, когда способы их получения являются особенно желательными в настоящем изобретении, или они могут быть синтезированы из известных соединений известными способами или способами, подобными им. Соединение формулы 1 может быть выделено и очищено от реакционного продукта известными способами, такими как перекристаллизация, ионный электрофорез, хроматография на колонке с силикагелем, хроматография на ионообменной смоле и им подобные. Как описано выше, соединения по настоящему изобретению, исходные продукты для их получения и промежуточные соединения могут быть синтезированы различными способами, которые должны интерпретироваться, как включенные в объем настоящего изобретения в связи с получением соединения формулы 1. Также настоящее изобретение обеспечивает фармацевтическую композицию для ингибированияDPP-IV, содержащую соединение формулы 1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Соединение формулы 1 может быть введено в различных лекарственных (стандартных фармацевтических) формах в соответствии с предназначенным применением. В полученных фармацевтических композициях в соответствии с настоящим изобретением активный агент, более конкретно, соединение формулы 1, может быть смешано с одним или большим количеством фармацевтически приемлемых носителей, которые могут быть выбраны в зависимости от полученной лекарственной формы. Например,фармацевтическая композиция по настоящему изобретению может быть составлена в формах, подходящих для инъекций или орального введения. Соединение формулы 1 может быть введено в соответствии с обычными методиками, используя известные фармацевтически приемлемые носители и наполнители и представлено в форме единичной стандартной дозы или контейнера с множеством доз. Составы могут принимать такие формы, как растворы, суспензии или эмульсии с маслянистыми или водными наполнителями, и могут содержать обычные диспергирующие, суспендирующие или стабилизирующие агенты. Альтернативно, перед применением активный ингредиент может находиться в порошкообразной форме для соединения со стерильной не содержащей пироген водой. Соединение формулы 1 может также быть введено в суппозитории, содержащие обычные суппозиторные основы, такие как масло какао или другие глицериды. Твердые формы для орального введения включают капсулу, таблетку, пилюлю, порошок и гранулу. Предпочтительными лекарственными формами являются капсула и таблетка. Предпочтительным является то, что таблетки и пилюли имеют оболочку. Твердые формы для орального введения могут быть получены путем смешивания соединения формулы 1 в качестве активного ингредиента, с неактивными разбавителями,такими как сахароза, лактоза, крахмал и им подобные, и носителями, такими как смазка, например стеарат магния, включая разрыхлитель, связующее вещество и им подобные. При необходимости, соединение формулы 1 и композиции, содержащие указанное соединение по настоящему изобретению, могут быть введены в комбинации с другими фармацевтическими агентами,например другими агентами для лечения диабета. Когда состав представлен в форме единичной стандартной дозы, соединение формулы 1 в качестве активного ингредиента может предпочтительно содержаться в количестве приблизительно от 0,1 до 1,500 мг в стандартной дозе. Количество соединения формулы 1 в дозе будет зависеть от веса субъекта и возраста, характера и серьезности болезни и решения лечащего врача. Для введения взрослому субъекту требуемое количество ежедневной дозы будет в диапазоне от 1 до 500 мг в зависимости от частоты и интенсивности дозирования. Для внутримышечного или внутривенного введения взрослому субъекту полное количество ежедневной дозы будет достаточным приблизительно в пределах 5-300 мг. Для некоторых пациентов количество ежедневной дозы будет более высоким, чем это. Кроме того, настоящее изобретение обеспечивает применение соединения формулы 1, как определено в п.1 формулы изобретения, для изготовления лекарственного средства для лечения или профилактики заболеваний, связанных с несоответствующей активностью DPP-IV. Представленные примеры заболеваний, вызванных несоответствующими уровнями DPP-IV, включают, не ограничиваясь ими, сахарные диабеты, ожирение и им подобные, как описано выше. Среди сахарных диабетов, настоящее изобретение является предпочтительным для лечения и профилактики сахарного диабета типа II. Воплощение изобретения Настоящее изобретение представлено более подробно последующим изложением приготовлений и- 12012591 примеров. Тем не менее, понятно, что настоящее изобретение не ограничено указанными конкретными приготовлениями и примерами, но представляет возможность для различных модификаций, которые очевидны среднему специалисту в области, имеющей отношение к настоящему изобретению. Приготовление 1. Синтез гидрохлорида 3-аминометил-4,4,4-трифторбутановой кислоты этилового эфира.(1) Синтез 4,4,4-трифтор-3-нитрометилбутановой кислоты этилового эфира. Смешивают 1,0 г (5,94 ммоль) 4,4,4-трифтор-2-бутеновой кислоты этилового эфира и 0,15 мл (1,19 ммоль) 1,1,3,3-тетраметилгуанидина и 1,6 мл (29,8 ммоль) нитрометана. Полученную смесь охлаждают до температуры 0 С и затем перемешивают в течение 3 ч при комнатной температуре с последующим добавлением 100 мл этилацетоацетата. Реакционную смесь промывают водой и затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, что дает 1,1 г (4,80 ммоль) названного соединения с выходом 81%. ЯМР: 1H-ЯМР (CDCl3)5,21-4,59 (2 Н, м), 4,22 (2 Н, кв., J=8 Гц), 3,67-3,64 (1 Н, м), 2,82-2,72 (1 Н, м),2,63-2,57 (1 Н, м), 1,28 (3 Н, т, J=8 Гц). Масса (EI) 176 (М 1).(2) Синтез N-гидрокси-3-(трет-бутоксикарбониламинометил)-4,4,4-трифторбутановой кислоты этилового эфира. 1,1 г (4,80 ммоль) 4,4,4-Трифтор-3-нитрометилбутановой кислоты этилового эфира, полученного на указанной выше стадии (1), растворяют в 20 мл метанола и затем к ранее образованному раствору добавляют 1,85 г (8,47 ммоль) ди-трет-бутилгидрокарбоната. Реакцию проводят в присутствии 180 мг 10% палладия на угле при атмосферном давлении в течение 15 ч. Реакционный раствор фильтруют через целит и отгоняют при пониженном давлении без последующей очистки, что дает 1,5 г (4,80 ммоль) названного соединения с выходом 100%. ЯМР: 1 Н-ЯМР (CDCl3)6,48 (1 Н, с), 4,20 (2 Н, кв., J=8 Гц), 3,89-3,83 (1 Н, м), 3,66-3,62 (1 Н, м), 3,243,17 (1 Н, м), 2,76-2,68 (1 Н, м), 2,53 (1 Н, дд, J=8 Гц, 16 Гц), 1,48 (9 Н, с), 1,25 (3 Н, т, J=8 Гц). Масса (EI) 262 (M1).(3) Синтез 3-(трет-бутоксикарбониламинометил)-4,4,4-трифторбутановой кислоты этилового эфира. 760 мг (2,41 ммоль) N-Гидрокси-3-(трет-бутоксикарбониламинометил)-4,4,4-трифторбутановой кислоты этилового эфира, полученного на указанной выше стадии (2), растворяют в 80 мл метанола и 40 мл воды, затем к ранее образованному раствору добавляют 2,4 г (28,9 ммоль) ацетата натрия с последующим добавлением по каплям 4 мл (4,81 ммоль) 20% водного раствора трихлорида титана при комнатной температуре. Через 20 мин к ранее образованному раствору добавляют 300 мл этилацетоацетата и реакционный раствор промывают водой, затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и затем остаток очищают хроматографией на колонке,что дает 550 мг (2,24 ммоль) названного соединения с выходом 92%. ЯМР: 1 Н-ЯМР (CDCl3)4,70 (1 Н, с), 4,18 (2 Н, кв., J=6,8 Гц), 3,64-3,53 (1 Н, м), 3,35-3,34 (1 Н, м),3,05-2,90 (1 Н, м), 2,60 (1 Н, дд, J=5,2 Гц, 16,4 Гц), 2,48 (1 Н, дд, J=8 Гц, 16,4 Гц), 1,43 (9 Н, с), 1,27 (3 Н, т,J=6,8 Гц). Масса (EI) 246 (М 1).(4) Синтез гидрохлорида 3-аминометил-4,4,4-трифторбутановой кислоты этилового эфира. 170 мг (0,69 ммоль) 3-(трет-Бутоксикарбониламинометил)-4,4,4-трифторбутановой кислоты этилового эфира, полученного на указанной выше стадии (3), растворяют в 6 мл этилацетата, насыщенного хлористым водородом, а затем перемешивают при комнатной температуре в течение 3 ч. Растворитель отгоняют при пониженном давлении и затем остаток очищают хроматографией на колонке, что дает 110 мг (0,69 ммоль) названного соединения с выходом 86%. ЯМР: 1H-ЯМР (CDCl3)8,50 (2 Н, ушир.с), 4,18 (2 Н, кв., J=4 Гц), 3,50-3,20 (3 Н, м), 2,97-2,64 (2 Н, м),1,24 (3 Н, т, J=4 Гц). Масса (EI) 182 (М 1). Приготовление 2. Синтез гидрохлорида 4-амино-3-метилбутановой кислоты метилового эфира.(1) Синтез 3-метил-4-нитробутановой кислоты метилового эфира. Смешивают 3 г (29,9 ммоль) транс-2-бутеновой кислоты метилового эфира и 0,69 г (5,99 ммоль) тетраметилгуанидина и 9,14 г (149 ммоль) нитрометана. Полученную смесь перемешивают при комнатной температуре в течение 24 дней. К ранее образованному раствору добавляют 100 мл этилацетоацетата и реакционный раствор промывают водой, затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 5,7 г (23,6 ммоль) названного соединения с выходом 100%. ЯМР: 1H-ЯМР (CDCl3)4,48 (1 Н, дд, J=4 Гц, 12 Гц), 4,35 (1 Н, дд, J=4 Гц, 12 Гц), 3,71 (3 Н, с), 2,842,74 (1 Н, м), 2,47 (1 Н, дд, J=4 Гц, 16 Гц), 2,37 (1 Н, дд, J=8 Гц, 16 Гц), 1,11 (3 Н, д, J=8 Гц). Масса (EI) 162 (М 1).- 13012591 4 г (24,8 ммоль) 3-Метил-4-нитробутановой кислоты метилового эфира, полученного на указанной выше стадии (1), растворяют в 50 мл метанола и затем к ранее образованному раствору добавляют 10,4 г(47,6 ммоль) ди-трет-бутилдикарбоната. Реакцию проводят в присутствии 500 мг 10% палладия на угле при давлении 50 пси в течение 9 ч. Реакционный раствор фильтруют через целит и отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 3,6 г (10,3 ммоль) названного соединения и 1,1 г (4,45 ммоль) N-гидрокси-4-трет-бутоксикарбониламино-3,3-диметилбутановой кислоты метилового эфира с выходом 62%. Масса (EI) 348 (М 1).(3) Синтез N-гидрокси-4-трет-бутоксикарбониламино-3,3-диметилбутановой кислоты метилового эфира. 600 мг (1,72 ммоль) N-трет-Бутилоксикарбонилгидрокси-4-трет-бутоксикарбониламино-3,3 диметилбутановой кислоты метилового эфира, полученного на указанной выше стадии (2), растворяют в 80 мл метанола с последующим добавлением гидрокарбоната натрия 250 и перемешиванием при температуре 80 С в течение 9 ч. К ранее образованному раствору добавляют 200 мл этилацетата и реакционный раствор промывают водой и затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и затем остаток очищают хроматографией на колонке,что дает 332 мг (1,34 ммоль) названного соединения с выходом 77%. ЯМР: 1H-ЯМР (CDCl3)7,27 (1 Н, ушир.с), 3,49 (3 Н, с), 3,46 (1 Н, дд, J=4 Гц, 12 Гц), 3,33 (1 Н, дд,J=5,6 Гц, 14,4 Гц), 2,51-2,42 (1 Н, м), 2,39 (1 Н, дд, J=4 Гц, 16 Гц), 2,22 (1 Н, дд, J=4 Гц, 16 Гц), 1,48 (9 Н, с),0,98 (3 Н, д, J=8 Гц). Масса (EI) 248 (М 1).(4) Синтез 4-трет-бутоксикарбониламино-3-метилбутановой кислоты метилового эфира. 213 мг (0,92 ммоль) Названного соединения получают с выходом 47% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(3), за исключением того,что используют 330 мг (1,33 ммоль) N-гидрокси-4-трет-бутоксикарбониламино-3,3-диметилбутановой кислоты метилового эфира, полученного на указанной выше стадии (3). ЯМР: 1H-ЯМР (CDCl3)4,65 (1 Н, ушир.с), 3,68 (3 Н, с), 3,10-3,00 (2 Н, м), 2,38-2,33 (1 Н, м), 2,20-2,05(5) Синтез гидрохлорида 4-амино-3-метилбутановой кислоты метилового эфира. 62 мг (0,36 ммоль) Названного соединения получают с выходом 83% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что используют 100 мг (0,43 ммоль) 4-трет-бутоксикарбониламино-3-метилбутановой кислоты метилового эфира, полученного на указанной выше стадии (4). ЯМР: 1H-ЯМР (CDCl3)8,26 (2 Н, ушир.с), 3,68 (3 Н, с), 3,10-2,99 (2 Н, м), 2,77-2,35 (3 Н, м), 1,13 (3 Н,д, J=8 Гц). Масса (EI) 168 (М 1). Приготовление 3. Синтез гидрохлорида 4-амино-2-фторбутановой кислоты метилового эфира.(1) Синтез 2-оксопиролидин-1-карбоновой кислоты трет-бутилового эфира. 1 г (11,7 ммоль) 2-Пиролидинона растворяют в 15 мл дихлорметана и затем к ранее образованному раствору добавляют 2,5 мл (17,8 ммоль) триэтиламина и 107 мг (0,87 ммоль) диметиламинопиридина и 2,7 г (12,3 ммоль) ди-трет-бутилгидрокарбоната. Реакционный раствор перемешивают при комнатной температуре в течение 8 ч. К ранее образованному раствору добавляют 100 мл этилацетата и реакционный раствор промывают водой и затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и затем остаток очищают хроматографией на колонке,что дает 1,2 г (6,47 ммоль) названного соединения с выходом 55%. ЯМР: 1H-ЯМР (CDCl3)3,76-3,73 (2 Н, м), 2,53-2,49 (2 Н, м), 2,04-1,88 (2 Н, м), 1,53 (9 Н, с). Масса (EI) 186 (М 1).(2) Синтез 3-фтор-2-оксопиролидин-1-карбоновой кислоты трет-бутилового эфира. 300 мг (1,61 ммоль) 2-Оксопиролидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (1), растворяют в тетрагидрофуране и охлаждают до температуры -78 С. К ранее образованному раствору по каплям добавляют 1,7 мл (1,7 ммоль) 1,0 М бис(триметилсилил)амида лития в тетрагидрофуране, а затем перемешивают в течение часа. К ранее образованному раствору добавляют 561 мг (1,78 ммоль) N-фторбензолсульфонимида и затем температуру постепенно повышают до-30 С в течение 2 ч. К ранее образованному раствору добавляют 100 мл этилацетоацетата и реакционный раствор промывают водным раствором хлорида аммония и затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 60 мг (0,29 ммоль) названного соединения с выходом 18%. ЯМР: 1H-ЯМР (CDCl3)5,16-5,12 (0,5 Н, м), 5,01-4,94 (0,5 Н, м), 3,91-3,85 (1 Н, м), 3,64-3,57 (1 Н, м),2,50-2,45 (1 Н, м), 2,25-2,13 (1 Н, м), 1,54 (9 Н, с). Масса (EI) 204 (М 1).(3) Синтез 4-трет-бутоксикарбониламино-2-фторбутановой кислоты метилового эфира. 60 мг (0,29 ммоль) 3-Фтор-2-оксопиролидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (2), растворяют в 3 мл метанола и затем к ранее образованному раствору добавляют 32 мг (0,59 ммоль) метилата натрия при температуре 0 С. Через час к ранее образованному раствору добавляют 10 мл этилацетата, реакционный раствор промывают водным раствором хлорида аммония и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 49 мг (0,29 ммоль) названного соединения с выходом 18%. Масса (EI) 236 (М 1).(4) Синтез гидрохлорида 4-амино-2-фторбутановой кислоты метилового эфира. 17 мг (0,099 ммоль) Названного соединения получают с выходом 47% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что используют 50 мг (0,21 ммоль) 4-трет-бутоксикарбониламино-2-фторбутановой кислоты метилового эфира, полученного на указанной выше стадии (3). ЯМР: 1H-ЯМР (CD3OD)5,24-5,20 (0,5 Н, м), 5,15-4,95 (0,5 Н, м), 3,81 (3 Н, с), 3,21-3,08 (2 Н, м), 2,402,10 (2 Н, м). Масса (EI) 172 (М 1). Приготовление 4. Синтез гидрохлорида 5-амино-2-фторпентановой кислоты метилового эфира.(1) Синтез 2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира. 1,17 г (8,88 ммоль) Названного соединения получают с выходом 88% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 3(1), за исключением того,что используют 1 г (10,08 ммоль) 2-пиперидинона. ЯМР: 1H-ЯМР (CDCl3)3,67-3,64 (2 Н, м), 2,52-2,49 (2 Н, м), 1,86-1,78 (4 Н, м), 1,53 (9 Н, с). Масса (EI) 200 (М 1).(2) Синтез 3-фтор-2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира. 160 мг (0,73 ммоль) Названного соединения получают с выходом 48% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 3(2), за исключением того,что используют 300 мг (1,5 ммоль) 2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (1). ЯМР: 1 Н-ЯМР (CDCl3)5,03-4,75 (1 Н, м), 3,75-3,55 (2 Н, м), 2,35-2,22 (1 Н, м), 2,05-1,78 (3 Н, м), 1,54(3) Синтез 5-трет-бутоксикарбониламино-2-фторпентановой кислоты метилового эфира. 56 мг (0,22 ммоль) Названного соединения получают с выходом 30% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 3(3), за исключением того,что в указанной выше стадии (2) используют 160 мг (0,73 ммоль) 3-фтор-2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира. ЯМР: 1 Н-ЯМР (CDCl3)5,02-4,87 (1 Н, м), 4,63 (1 Н, ушир.с), 3,80 (3 Н, с), 3,25-3,05 (2 Н, м), 1,99-1,88(4) Синтез гидрохлорида 5-амино-2-фторпентановой кислоты метилового эфира. 40 мг (0,21 ммоль) Названного соединения получают с выходом 95% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что в указанной выше стадии (3) используют 56 мг (0,224 ммоль) 5-трет-бутоксикарбониламино-2 фторпентановой кислоты метилового эфира. ЯМР: 1H-ЯМР (CDCl3)5,15-4,95 (1 Н, м), 3,81 (3 Н, с), 3,00-2,90 (2 Н, м), 2,10-1,73 (4 Н, м). Масса (EI) 186 (М 1). Приготовление 5. Синтез гидрохлорида 4-амино-2-метилбутановой кислоты метилового эфира.(1) Синтез 3-метил-2-оксопиролидин-1-карбоновой кислоты трет-бутилового эфира. 300 мг (1,61 ммоль) 2-Оксопиролидин-1-карбоновой кислоты трет-бутилового эфира растворяют в тетрагидрофуране и затем охлаждают до температуры -78 С. К ранее образованному раствору по каплям добавляют 1,7 мл (1,7 ммоль) раствора 1,0 М литий бис(триметилсилил)амид-тетрагидрофуран, а затем перемешивают в течение часа. К ранее образованному раствору добавляют по каплям 0,19 мл (3,05 ммоль) йодметана. После этого температуру постепенно повышают до -30 С в течение 2 ч. К ранее образованному раствору добавляют 50 мл этилацетата, реакционный раствор промывают водным раствором хлорида аммония и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 130 мг (0,65 ммоль) названного соединения с выходом 40%. ЯМР: 1H-ЯМР (CDCl3)3,79-3,74 (1 Н, м), 3,61-3,54 (1 Н, м), 2,59-2,53 (1 Н, м), 2,25-2,17 (1 Н, м),1,67-1,59 (1 Н, м), 1,53 (9 Н, с), 1,20 (3 Н, д, J=12 Гц). Масса (EI) 200 (М 1).(2) Синтез 4-трет-бутоксикарбониламино-2-метилбутановой кислоты метилового эфира. 120 мг (0,51 ммоль) Названного соединения получают с выходом 78% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 3(3), за исключением того,что используют 130 мг (0,65 ммоль) 3-метил-2-оксопиролидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (1). ЯМР: 1H-ЯМР (CDCl3)4,58 (1 Н, ушир.с), 3,68 (3 Н, с), 3,17-3,14 (2 Н, м), 2,55-2,47 (1 Н, м), 1,89-1,80(3) Синтез гидрохлорида 4-амино-2-метилбутановой кислоты метилового эфира. 80 мг (0,47 ммоль) Названного соединения получают с выходом 92% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что используют 120 мг (0,51 ммоль) 4-трет-бутоксикарбониламино-2-метилбутановой кислоты метилового эфира, полученного на указанной выше стадии (2). ЯМР: 1 Н-ЯМР (CD3OD)3,70 (3 Н, с), 3,05-2,90 (2 Н, м), 2,65-2,55 (1 Н, м), 2,05-1,70 (2 Н, м), 1,23(1) Синтез (2-гидроксипропил)карбаминовой кислоты трет-бутилового эфира. 1 г (13,3 ммоль) 1-Аминопропан-2-ола растворяют в 40 мл метанола и 10 мл воды и затем к ранее образованному раствору добавляют 3,7 г (16,9 ммоль) ди-трет-бутилгидрокарбоната, а затем перемешивают в течение 3 ч при комнатной температуре. К раствору добавляют 200 мл этилацетата и реакционный раствор промывают водой и затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 2,24 г (12,8 ммоль) названного соединения с выходом 96%. ЯМР: 1H-ЯМР (CDCl3)4,91 (1 Н, ушир.с), 3,95-3,85 (1 Н, м), 3,30-3,22 (1 Н, м), 3,05-2,95 (1H, м),1,43 (9H, с), 1,16 (3 Н, д, J=4 Гц). Масса (EI) 176 (М 1).(2) Синтез (2-оксопропил)карбаминовой кислоты трет-бутилового эфира. 2,24 г (12,7 ммоль) (2-Гидроксипропил)карбаминовой кислоты трет-бутилового эфира, полученного на указанной выше стадии (1), растворяют в 30 мл дихлорметана и затем по каплям добавляют 3,6 мл(25,7 ммоль) триэтиламина. К ранее образованному раствору добавляют 6,05 г (19 ммоль) 50% пиридинсульфотриоксид, который растворяют в 15 мл диметилсульфоксида. Через 6 ч к ранее образованному раствору добавляют 200 мл этилацетата и реакционный раствор промывают водой, затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 1,15 г (6,64 ммоль) названного соединения с выходом 52%. ЯМР: 1 Н-ЯМР (CDCl3)5,20 (1 Н, ушир.с), 4,05-4,00 (2 Н, м), 2,17 (3 Н, с), 1,43 (9 Н, с). Масса (EI) 174 (М 1).(3) Синтез цис-4-трет-бутоксикарбониламино-3-метил-2-бутеновой кислоты метилового эфира. 500 мг (2,88 ммоль) (2-Оксопропил)карбаминовой кислоты трет-бутилового эфира, полученного на указанной выше стадии (2), растворяют в 8 мл бензола и затем к ранее образованному раствору добавляют 1,45 г (4,33 ммоль) метил-(трифенилфосфоранилиден)ацетата и 35 мг (0,28 ммоль) бензойной кислоты. Реакционный раствор нагревают до температуры 80 С в течение 3 ч. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 54 мг (6,64 ммоль) названного соединения с выходом 23% и 301 мг (1,31 ммоль) транс-изомера с выходом 45%. ЯМР: 1H-ЯМР (CDCl3)5,77 (1 Н, с), 5,17 (1 Н, ушир.с), 4,16 (2 Н, д, J=6,4 Гц), 3,69 (3 Н, с), 2,05 (3 Н,с), 1,44 (9 Н, с). Масса (EI) 230 (М 1).(4) Синтез гидрохлорида 4-амино-3-метил-2-бутеновой кислоты метилового эфира. 30 мг (0,23 ммоль) Названного соединения получают с выходом 97% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что используют 54 мг (0,235 ммоль) цис-4-трет-бутоксикарбониламино-3-метил-2-бутеновой кислоты метилового эфира, полученного на указанной выше стадии (3). ЯМР: 1 Н-ЯМР (CD3OD)6,05 (1 Н, с), 4,00 (2 Н, с), 3,72 (3 Н, с), 3,29-3,28 (2 Н, м), 2,05 (3 Н, с). Масса (EI) 130 (М 1). Приготовление 7. Синтез гидрохлорида (R)-5-амино-4-метилпентановой кислоты метилового эфира.(1) Синтез (S)-3-метансульфонилокси-2-метилпропановой кислоты метилового эфира. 3 г (25,3 ммоль) (S)-3-Гидрокси-2-метилпропановой кислоты метилового эфира растворяют в 50 мл дихлорметана, затем в полученный раствор по каплям добавляют 5,3 мл (37,9 ммоль) триэтиламина. После этого к ранее образованному раствору добавляют 2,16 мл (27,9 ммоль) метансульфонилхлорида при температуре 0 С. Через час к ранее образованному раствору добавляют 200 мл этилацетоацетата и затем- 16012591 реакционный раствор промывают водой и затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 4,97 г (25,3 ммоль) названного соединения с выходом 100%. Масса (EI) 197 (М 1).(2) Синтез (S)-3-азидо-2-метилпропановой кислоты метилового эфира. 4,97 г (25,3 ммоль) (S)-3-Метансульфонилокси-2-метилпропановой кислоты метилового эфира, полученного на указанной выше стадии (2), растворяют в 40 мл диметилформамида и затем к ранее образованному раствору добавляют 5 г (76,8 ммоль) азида натрия, а затем перемешивают при температуре 60 С в течение 24 ч. К ранее образованному раствору добавляют 200 мл этилацетоацетата и реакционный раствор промывают водой, затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 3,5 г(3) Синтез (S)-3-трет-бутоксикарбониламино-2-метилпропановой кислоты метилового эфира. 3,9 г (26,8 ммоль) (S)-3-Азидо-2-метилпропановой кислоты метилового эфира, полученного на указанной выше стадии (2), растворяют в 50 мл метанола с последующим добавлением 8,8 г (40,3 ммоль) ди-трет-бутилгидрокарбоната. Реакцию проводят в присутствии 40 мг 20% палладия на угле в атмосфере водорода в течение 9 ч. Реакционный раствор фильтруют через целит и отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 2,6 г (11,9 ммоль) названного соединения с выходом 44%. ЯМР: 1 Н-ЯМР (CDCl3)4,92 (1 Н, ушир.с), 3,70 (3 Н, с), 3,31-3,20 (2 Н, м), 2,70-2,55 (1 Н, м), 1,43 (9 Н,с), 1,15 (3 Н, д, J=12 Гц). Масса (EI) 218 (М 1).(4) Синтез (S)-(3-гидрокси-2-метилпропил)карбаминовой кислоты трет-бутилового эфира. 500 мг (2,30 ммоль) (S)-3-трет-Бутоксикарбониламино-2-метилпропановой кислоты метилового эфира, полученного на указанной выше стадии (3), растворяют в 30 мл тетрагидрофурана и затем в полученный раствор медленно добавляют 262 мг (6,9 ммоль) литийалюминийгидрида при температуре 0 С. После нагревания до комнатной температуры реакцию проводят в течение 4 ч. Реакционный раствор охлаждают до температуры 0 С и затем в полученный раствор медленно добавляют 0,26 мл воды и 0,26 мл раствора гидроксида натрия и 0,78 мл воды. Реакционный раствор фильтруют через целит и отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 430 мг (2,27 ммоль) названного соединения с выходом 98%. ЯМР: 1H-ЯМР (CDCl3)4,78 (1 Н, ушир.с), 3,55-3,50 (1 Н, м), 3,33-3,20 (2 Н, м), 3,05-2,98 (1 Н, м),1,75-1,65 (1 Н, м), 1,46 (9 Н, с), 0,87 (3 Н, д, J=12 Гц). Масса (EI) 190 (М 1).(5) Синтез (S)-(2-метил-3-оксопропил)карбаминовой кислоты трет-бутилового эфира. 423 мг (2,26 ммоль) Названного соединения получают с выходом 99% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 6(2), за исключением того,что используют 430 мг (2,27 ммоль) (S)-(3-гидрокси-2-метилпропил)карбаминовой кислоты третбутилового эфира, полученного на указанной выше стадии (4). Масса (EI) 188 (М 1).(6) Синтез (R)-5-трет-бутоксикарбониламино-4-метил-2-пентеновой кислоты метилового эфира. 380 мг (2,26 ммоль) Названного соединения получают с выходом 99% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 6(3), за исключением того,что используют 423 мг (2,26 ммоль) (S)-(2-метил-3-оксопропил)карбаминовой кислоты трет-бутилового эфира, полученного на указанной выше стадии (5). ЯМР: 1H-ЯМР (CDCl3)6,84 (1 Н, дд, J=15 Гц, 10 Гц), 5,84 (1 Н, д, J=15 Гц), 4,55 (1 Н, ушир.с), 3,72(7) Синтез (R)-5-трет-бутоксикарбониламино-4-метилпентановой кислоты метилового эфира. 370 мг (2,26 ммоль) (R)-5-трет-бутоксикарбониламино-4-метил-2-пентеновой кислоты метилового эфира, полученного на указанной выше стадии (6), растворяют в 50 мл метанола. Реакцию проводят в присутствии 40 мг 20% гидроксида палладия в атмосфере водорода в течение 9 ч и реакционный раствор фильтруют через целит. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 310 мг (1,26 ммоль) названного соединения с выходом 55%. ЯМР: 1 Н-ЯМР (CDCl3)4,87 (1 Н, ушир.с), 3,67 (3 Н, с), 3,05-2,96 (2 Н, м), 2,39-2,27 (2 Н, м), 1,75-1,40(8) Синтез гидрохлорида (R)-5-амино-4-метилпентановой кислоты метилового эфира. 220 мг (1,21 ммоль) Названного соединения получают с выходом 96% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что используют 310 мг (1,26 ммоль) (R)-5-трет-бутоксикарбониламино-4-метилпентановой кислоты метилового эфира, полученного на указанной выше стадии (7). ЯМР: 1 Н-ЯМР (CD3OD)3,87 (3 Н, с), 2,96-2,91 (1 Н, м), 2,81-2,76 (1 Н, м), 2,47-2,40 (2 Н, м), 1,881,76 (2 Н, м), 1,56-1,50 (1 Н, м), 1,04 (3 Н, д, J=6,4 Гц). Масса (EI) 182 (М 1). Приготовление 8. Синтез гидрохлорида 5-амино-3-метилпентановой кислоты метилового эфира.(1) Синтез 4-метилпиперидин-1-карбоновой кислоты трет-бутилового эфира. 3,5 г (17,5 ммоль) Названного соединения получают с выходом 87% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 6(1), за исключением того,что используют 2 г (20,1 ммоль) 4-метилпиперидина. Масса (EI) 200 (М 1).(2) Синтез 4-метил-2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира. 1 г (5,02 ммоль) 4-Метилпиперидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (1), растворяют в 70 мл этилацетата. К ранее образованному раствору по каплям добавляют раствор, в котором растворяют в 40 мл воды, 5,4 г (25,2 ммоль) периодата натрия и и 247 мг(1,85 ммоль) диоксида рутения. Через 3 ч к ранее образованному раствору добавляют 5% тиосульфат натрия и полученный раствор экстрагируют этилацетатом, затем органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 750 мг (3,52 ммоль) названного соединения с выходом 70%. ЯМР: 1H-ЯМР (CDCl3)4,11-3,77 (1 Н, м), 3,53-3,49 (1 Н, м), 2,62-2,56 (1 Н, м), 2,15-1,90 (3 Н, м), 1,49(3) Синтез 5-трет-бутоксикарбониламино-3-метилпентановой кислоты метилового эфира. 410 мг (1,67 ммоль) Названного соединения получают с выходом 97% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 3(3), за исключением того,что используют 368 мг (1,72 ммоль) 4-метил-2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (2). 1 Н ЯМР (CDCl3)4,5-4,6 (1 Н, ушир.с), 3,65 (3 Н, с), 3,0-3,2 (2 Н, м), 2,3 (1 Н, м), 2,15 (1 Н, м), 2,0 (1 Н,м), 1,4-1,5 (2 Н, м), 1,45 (9 Н, с). Масса (м/е) 268 (M+Na).(4) Синтез гидрохлорида 5-амино-3-метилпентановой кислоты метилового эфира. 226 мг (1,24 ммоль) Названного соединения получают с выходом 74% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что используют 410 мг (1,24 ммоль) 5-трет-бутоксикарбониламино-3-метилпентановой кислоты метилового эфира, полученного на указанной выше стадии (3). 1 Н ЯМР (CD3OD)3,65 (3 Н, с), 2,9-3,0 (2 Н, м), 2,34 (1 Н, дд, J=15,7 Гц), 2,27 (1 Н, дд, J=15,7 Гц), 2,0(1) Синтез 5-трифторметилпиперидин-2-она. 1 г (6,13 ммоль) 5-Трифторметил-2-пиридинола растворяют в 20 мл уксусной кислоты. Реакцию проводят в присутствии 300 мг оксида платины при давлении 50 пси водорода (г) в течение 9 ч. Реакционный раствор фильтруют через целит и отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке, что дает 920 мг (5,50 ммоль) названного соединения с выходом 89%. ЯМР: 1 Н-ЯМР (CDCl3)3,56-3,51 (1 Н, м), 3,42-3,36 (1 Н, м), 2,59-2,53 (2 Н, м), 2,45-2,41 (1 Н, м),2,19-2,13 (1 Н, м), 1,95-1,87 (1 Н, м). Масса (EI) 168 (М 1).(2) Синтез 2-оксо-5-трифторметилпиперидин-1-карбоновой кислоты трет-бутилового эфира. 1,3 г (7,7 ммоль) 5-Трифторметилпиперидин-2-она, полученного на указанной выше стадии (1), растворяют в 10 мл ацетонитрила. К раствору добавляют 2,0 г (14,3 ммоль) триэтиламина, 48 мг (0,39 ммоль) диметиламинопиридина и 1,8 г (8,2 ммоль) ди-трет-бутилгидрокарбоната. После перемешивания при температуре 80 С в течение 4 ч к ранее образованному раствору добавляют 100 мл этилацетата и реакционный раствор промывают водой. Органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и затем остаток очищают хроматографией на колонке,что дает 669 мг (2,5 ммоль) названного соединения с выходом 32%. ЯМР: 1H-ЯМР (CDCl3)4,09-3,97 (1 Н, м), 3,77-3,71 (1 Н, м), 2,70-2,47 (3 Н, м), 2,15-2,10 (1 Н, м),1,97-1,89 (1 Н, м), 1,50 (9 Н, с).(3) Синтез 4-(трет-бутоксикарбониламинометил)-5,5,5-трифторпентановой кислоты метилового эфира. 500 мг (1,67 ммоль) Названного соединения получают с выходом 66% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 3-(3), за исключением того,что используют 669 мг (2,5 ммоль) 2-оксо-5-трифторметилпиперидин-1-карбоновой кислоты третбутилового эфира, полученного на указанной выше стадии (2). ЯМР: 1H-ЯМР (CDCl3)4,76 (1 Н, с), 3,68 (3 Н, с), 3,45-3,30 (2 Н, м), 2,55-2,48 (2 Н, м), 2,40-2,32 (1 Н,м), 2,00-1,95 (1 Н, м), 1,90-1,80 (1 Н, м), 1,43 (9 Н, с). Масса (EI) 300 (М 1).(4) Синтез гидрохлорида 4-аминометил-5,5,5-трифторпентановой кислоты метилового эфира. 335 мг (1,42 ммоль) Названного соединения получают с выходом 85% в соответствии с методикой,аналогичной методике получения соединения, описанной в проготовлении 1(4), за исключением того,что используют 500 мг (1,67 ммоль) 4-(трет-бутоксикарбониламинометил)-5,5,5-трифторпентановой кислоты метилового эфира, полученного на указанной выше стадии (3). ЯМР: 1H-ЯМР (CDCl3)8,48 (2 Н, с), 3,69 (3 Н, с), 3,503,40 (1 Н, м), 3,30-3,15 (1 Н, м), 2,99-2,89 (1 Н,м), 2,65-2,52 (2 Н, м), 2,11-1,91 (2 Н, м). Масса (EI) 236 (М 1). Приготовление 10. Синтез гидрохлорида (2-амино-1-метилэтокси)уксусной кислоты этилового эфира.(1) Синтез (2-трет-бутоксикарбониламино-1-метилэтокси)уксусной кислоты этилового эфира. 500 мг (2,85 ммоль) (2-гидроксипропил)карбаминовой кислоты трет-бутилового эфира растворяют в 10 мл дихлорэтана, затем к ранее образованному раствору добавляют 0,44 мл (4,24 ммоль) этилдиазоацетата. К реакционной смеси добавляют 38 мг (0,085 ммоль) ацетата родия и затем смесь нагревают до температуры 80 С в течение 2 ч. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке, что дает 381 мг (1,45 ммоль) названного соединения с выходом 50%. ЯМР: 1H-ЯМР (CDCl3)5,39 (1 Н, с), 4,23 (2 Н, кв., J=8 Гц), 4,09 (1 Н, д, J=16 Гц), 4,00 (1 Н, д, J=16 Гц), 3,60-3,35 (1 Н, м), 3,35-3,15 (1 Н, м), 3,10-3,04 (1 Н, м), 1,46 (9 Н, с), 1,31 (3 Н, т, J=4 Гц), 1,16 (3 Н, д, J=4 Гц). Масса (EI) 262 (М 1).(2) Синтез гидрохлорида (2-амино-1-метилэтокси)уксусной кислоты этилового эфира. 130 мг (0,65 ммоль) Названного соединения получают с выходом 44% в соответствии с методикой,аналогичной методике получения соединения, описанной в приготовлении 1(4), за исключением того,что используют 381 мг (1,45 ммоль) (2-трет-бутоксикарбониламино-1-метилэтокси)уксусной кислоты этилового эфира, полученного на указанной выше стадии (1). ЯМР: 1H-ЯМР (CDCl3)8,47 (2 Н, с), 4,23 (2 Н, кв., J=8 Гц), 4,22-3,99 (2 Н, м), 3,80-3,70 (1 Н, м), 3,253,20 (1 Н, м), 3,10-2,98 (1 Н, м), 1,29 (3 Н, т, J=7,5 Гц), 1,20 (3 Н, д, J=8 Гц). Масса (EI) 200 (М 1). Приготовление 11. Синтез гидрохлорида 5-амино-3-трифторметилпентановой кислоты этилового эфира.(1) Синтез 2-оксо-4-трифторметилпиперидин-1-карбоновой кислоты трет-бутилового эфира. 2,82 г (3,2 ммоль) Метапериодата натрия (NaIO4) растворяют в 20 мл воды с последующим добавлением 117 мг (0,88 ммоль) оксида рутения (RuO2). К реакционной смеси добавляют раствор, в котором в 35 мл этилацетата растворено 660 мг (2,6 ммоль) 4-трифторметилпиперидин-1-карбоновой кислоты третбутилового эфира, а затем перемешивают в течение 2 ч и 20 мин. Реакционный раствор разбавляют избытком этилацетата и промывают один раз водой и водным раствором NaCl соответственно, и затем сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (2:1 смесь гексан:этилацетат),что дает 0,63 г названного соединения с выходом 90%. 1 Н ЯМР (CDCl3)3,86 (1 Н, дд, J=13,5, 5,5 Гц), 3,62 (1 Н, м), 2,6-2,8 (2 Н, м), 2,56 (1 Н, дд, J=17, 10 Гц), 2,1-2,2 (1 Н, м), 1,8-1,9 (1 Н, м), 1,53 (9 Н, с). Масса (м/е) 290 (M+Na).(2) Синтез 5-трет-бутоксикарбониламино-3-трифторметилпентановой кислоты этилового эфира. 630 мг (2,36 ммоль) 2-оксо-4-Трифторметилпиперидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (1), растворяют в метаноле, затем к ранее образованному раствору добавляют 255 мг (4,5 ммоль) этилата натрия, а затем перемешивают в течение 15 мин. После концентрации реакционный раствор разбавляют избытком этилацетатаи реакционный раствор промывают один раз водным раствором 1 н. соляной кислоты и водным раствором NaCl, соответственно, и сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (5:1 смесь гексан:этилацетат), что дает 0,48 г названного соединения с выходом 65%.(3) Синтез гидрохлорида 5-амино-3-трифторметилпентановой кислоты этилового эфира. 477 мг (1,5 ммоль) 5-трет-Бутоксикарбониламино-3-трифторметилпентановой кислоты этилового эфира, полученного на указанной выше стадии (2), взаимодействует со смесью этилацетат/соляная кислота, а затем перемешивают в течение 35 мин. Затем реакционный раствор концентрируют и высаживают диэтиловым эфиром, что дает 0,220 г названного соединения с выходом 68%. 1(1) Синтез 3,3-дифторпиперидин-1-карбоновой кислоты трет-бутилового эфира. 400 мг (2,0 ммоль) 3-Оксопиперидин-1-карбоновой кислоты трет-бутилового эфира растворяют в дихлорметане и охлаждают до температуры -78 С и затем в полученный раствор по каплям добавляют 0,53 мл диэтиламиносульфотрифторид (DAST, 4,0 ммоль), а затем перемешивают в течение 19 ч. После этого температуру повышают до комнатной температуры и к реакционному раствору добавляют приблизительно 0,3 мл воды. После концентрации остаток очищают хроматографией на колонке (10:1 смесь гексан:этилацетат), что дает 0,29 г названного соединения с выходом 64%. 1 Н ЯМР (CDCl3)3,61 (2 Н, т, J=11 Гц), 3,4 (2 Н, м), 1,9-2,0 (2 Н, м), 1,7-1,8 (2 Н, м), 1,45 (9 Н, с). Масса (м/е) 244 (M+Na).(2) Синтез 5,5-дифтор-2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира. 0,53 г (2,5 ммоль) Метапериодата натрия (NaIO4), растворяют в 4 мл воды и затем к ранее образованному раствору добавляют 22 мг (0,17 ммоль) оксида рутения (RuO2). Полученный раствор разбавляют в 7 мл этилацетата. К указанному раствору добавляют 110 мг (0,5 ммоль) 3,3-дифторпиперидин-1 карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (1), а затем перемешивают при комнатной температуре в течение 21 ч. После перемешивания реакционный раствор разбавляют избытком этилацетата и промывают один раз водой и водным раствором NaCl, соответственно,сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (2:1 смесь гексан:этилацетат), что дает 91 мг названного соединения с выходом 78%. 1 Н ЯМР (CDCl3)3,97 (2 Н, т, J=13 Гц), 2,66 (2 Н, т, J=7,0 Гц), 2,3-2,4 (2 Н, м), 1,53 (9 Н, с). Масса (м/е) 258 (M+Na).(3) Синтез 5-трет-бутоксикарбониламино-4,4-дифторпентановой кислоты метилового эфира. 91 мг (0,39 ммоль) 5,5-Дифтор-2-оксопиперидин-1-карбоновой кислоты трет-бутилового эфира, полученного на указанной выше стадии (2), растворяют в метаноле, затем к ранее образованному раствору добавляют 42 мг (0,78 ммоль) метилата натрия, а затем перемешивают в течение 20 мин. После концентрации реакционный раствор разбавляют избытком этилацетата и промывают один раз водным раствором 1 н. соляной кислоты и водным раствором NaCl, соответственно, затем сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (2:1 смесь гексан:этилацетат), что дает 73 мг названного соединения с выходом 71%. 1 Н ЯМР (CDCl3)4,83 (1 Н, ушир.с), 3,69 (3 Н, с), 3,4-3,6 (2 Н, м), 2,55 (2 Н, т, J=8 Гц), 2,1-2,3 (2 Н, м),1,44 (9 Н, с). Масса (м/е) 290 (M+Na).(4) Синтез гидрохлорида 5-амино-4,4-дифторпентановой кислоты метилового эфира. 73 мг (0,27 ммоль) 5-трет-Бутоксикарбониламино-4,4-дифторпентановой кислоты метилового эфира, полученного на указанной выше стадии (3), взаимодействует со смесью этилацетат/соляная кислота, а затем перемешивают в течение 25 мин. После этого реакционный раствор концентрируют и высаживают диэтиловым эфиром, что дает 40 мг названного соединения с выходом 88%. 1 Н ЯМР (CD3OD)3,68 (3 Н, с), 3,48 (2 Н, т, J=15 Гц), 2,59 (2 Н, т, J=7,5 Гц), 2,3-2,4 (2 Н, м). Масса (м/е) 168 (М+1). Приготовление 13. Синтез 3S-трет-бутоксикарбониламино-4-гидроксибутановой кислоты бензилового эфира. 6,46 г (20 ммоль) 2S-трет-Бутоксикарбониламиноянтарной кислоты 4-бензилового эфира растворяют в тетрагидрофуране и затем охлаждают до температуры 0 С. К полученному раствору по каплям добавляют последовательно 1,9 мл (20 ммоль) этилхлорформиата и 2,79 мл триэтиламина. Через 30 мин к ранее образованному раствору добавляют 1,5 г (40 ммоль) боргидрида натрия и реакционный раствор медленно выливают в метанол, а затем перемешивают в течение часа. Затем реакционный раствор разбавляют избытком этилацетата и промывают один раз водным раствором 1 н. HCl и водным растворомNaCl, соответственно, затем сушат над безводным сульфатом магния и отфильтровывают. Отфильтро- 20012591 ванный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (4:1 смесь гексан:этилацетат), что дает 4,44 г названного соединения с выходом 72%. 1 Н ЯМР (CDCl3)7,3-7,4 (5 Н, м), 5,21 (1 Н, д, J=8 Гц), 5,12 (2 Н, с), 4,0 (1 Н, м), 3,69 (2 Н, д, J=5 Гц),2,67 (2 Н, д, J=5,5 Гц), 1,42 (9 Н, с). Масса (м/е) 310 (М+1). Приготовление 14. Синтез 3S-трет-бутоксикарбониламино-4-оксобутановой кислоты бензилового эфира. 0,31 г (1,0 ммоль) 3S-трет-Бутоксикарбониламино-4-гидроксибутановой кислоты бензилового эфира растворяют в дихлорметане, полученного в приготовлении 13, и затем к ранее образованному раствору добавляют 6 мл реагента Десс-Мартина (0,3 М), а затем перемешивают в течение 4 ч. После концентрации остаток очищают хроматографией на колонке (2:1 смесь гексан:этилацетат), что дает 0,23 г названного соединения с выходом 75%. 1 Н ЯМР (CDCl3)9,64 (1 Н, с), 7,3-7,4 (5 Н, м), 5,6 (1 Н, д, J=7,5 Гц), 5,12 (2 Н, с), 4,35 (1 Н, м), 3,05(1 Н, дд, J=15,0, 5,0 Гц), 2,88 (1 Н, дд, J=15,0, 5,0 Гц), 1,44 (9 Н, с). Масса (м/е) 308 (М+1). Приготовление 15. Синтез 3S-трет-бутоксикарбониламино-4-(2-гидроксиэтиламино)бутановой кислоты бензилового эфира. 0,68 г (2,2 ммоль) 3S-трет-Бутоксикарбониламино-4-оксобутановой кислоты бензилового эфира,полученного в приготовлении 14, растворяют в дихлорэтане и затем охлаждают до температуры 0 С,затем к ранее образованному раствору добавляют 2-аминоэтанол (130 л, 2,2 ммоль), а затем перемешивают в течение приблизительно 30 мин. После этого к ранее образованному раствору добавляют 1,4 г(6,6 ммоль) триацетоксиборгидрида натрия, а затем перемешивают в течение приблизительно 1 1/6 ч. Полученный раствор разбавляют дихлорметаном и промывают насыщенным водным раствором гидрокарбоната натрия, затем сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (1:1 смесь гексан:этилацетат 10:1 смесь CH2Cl2: МеОН), что дает 0,14 г названного соединения с выходом 18%. 1H ЯМР (CDCl3)7,3-7,4 (5 Н, м), 5,8-6,1 (1 Н, м), 5,12 (2 Н, с), 4,15-4,35 (1 Н, м), 3,7-3,8 (2 Н, м), 2,93,15 (4 Н, м), 2,6-2,8 (2 Н, м), 1,42 (9 Н, с). Масса (м/е) 353 (М+1). Приготовление 16. Синтез 3S-трет-бутоксикарбониламино-4-(2-оксооксазолидин-3-ил)бутановой кислоты бензилового эфира. 140 мг (0,4 ммоль) 3S-трет-Бутоксикарбониламино-4-(2-гидроксиэтиламино)бутановой кислоты бензилового эфира, полученного в приготовлении 15, растворяют в дихлорметане и затем охлаждают до температуры 0 С, затем к образованному раствору добавляют 280 л (1,6 ммоль) N,Nдиизопропилэтиламина и 49 мг (0,4 ммоль) диметиламинопиридина, с последующим добавлением 0,4 г(0,6 ммоль) фосгена (в 20% растворе толуола) а затем перемешивают в течение 2 ч и 40 мин. После этого полученный раствор разбавляют дихлорметаном и промывают водным раствором NaCl, затем сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (1:1 смесь гексан:этилацетат), что дает 30 мг названного соединения с выходом 20%. 1 Н ЯМР (CDCl3)7,3-7,4 (5 Н, м), 5,12 (2 Н, с), 5,1 (1 Н, м), 4,3 (2 Н, м), 4,2 (1 Н, м), 3,76 (1 Н, м), 3,5(2 Н, м), 3,22 (1 Н, м), 2,63 (1 Н, дд, J=16, 5,5 Гц), 2,58 (1 Н, дд, J=16, 6,5 Гц), 1,41 (9 Н, с). Масса (м/е) 379 (М+1). Приготовление 17. Синтез [3-оксо-1-(2-оксооксазолидин-3-илметил)-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 30 мг (0,079 ммоль) 3S-трет-Бутоксикарбониламино-4-(2-оксооксазолидин-3-ил)бутановой кислоты бензилового эфира, полученного в приготовлении 16, растворяют в метаноле, затем к ранее образованному раствору добавляют 3 мг палладия на угле (Pd/C), а затем перемешивают в атмосфере водорода в течение 3 ч 40 мин. После завершения реакции реакционный раствор фильтруют через целит и затем промывают метанолом, концентрируют. К указанной реакционной смеси немедленно добавляют 15 мг(0,079 ммоль) 3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразина и затем растворяют в дихлорметане. Реакционный раствор охлаждают до температуры 0 С, затем добавляют 13 мг (0,095 ммоль) НОВТ и перемешивают в течение 10 мин, к ранее образованному раствору добавляют 23 мг (0,12 ммоль)EDC. После удаления бани со льдом реакционный раствор перемешивают в течение около 17 ч, затем концентрируют, остаток очищают препаративной ТСХ (10:1 смесь CH2Cl2:МеОН), что дает 21 мг названного соединения с общим выходом 57%. 1 Н ЯМР (CDCl3)5,6-5,8 (1 Н, м), 4,9-5,1 (2 Н, м), 4,0-4,4 (6 Н, м), 3,6-3,8 (2 Н, м), 3,3-3,5 (2 Н, м), 2,62,9 (2 Н, м), 1,39 (9 Н, с). Масса (м/е) 463 (М+1). 21 мг (0,045 ммоль) [3-Оксо-1-(2-оксооксазолидин-3-илметил)-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутиловый эфир, полученный в приготовлении 17, растворяют в смеси этилацетат/соляная кислота, а затем перемешивают в течение около 17 ч и затем раствор концентрируют, что дает твердое вещество белого цвета. После этого твердое вещество промывают диэтиловым эфиром и сушат, что дает 15 мг названного соединения с выходом 91%. 1 Н ЯМР (CD3OD)5,06 (2 Н, с), 4,4 (3 Н, м), 4,26 (1 Н, м), 4,05-4,15 (2 Н, м), 3,9 (1 Н, м), 3,5-3,8 (4 Н,м), 3,0-3,1 (1 Н, м), 2,85-2,95 (1 Н, м). Масса (м/е) 363 (М+1). Приготовление 18. Синтез 3S-трет-бутоксикарбониламино-4-(2-гидроксипропиламино)бутановой кислоты бензилового эфира. 0,68 г (2,2 ммоль) 3S-трет-Бутоксикарбониламино-4-оксобутановой кислоты бензилового эфира,полученного в приготовлении 14, растворяют в дихлорэтане и затем охлаждают до температуры 0 С,затем к ранее образованному раствору добавляют 2-аминоэтанол (170 л, 2,2 ммоль), а затем перемешивают в течение 30 мин. После этого к ранее образованному раствору добавляют 1,4 г (6,6 ммоль) триацетоксиборгидрида натрия, а затем перемешивают приблизительно в течение 1 ч 10 мин. После этого раствор разбавляют дихлорметаном, затем промывают насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (1:1 смесь гексан:этилацетат 10:1 смесь CH2Cl2:МеОН), что дает 0,36 г названного соединения с выходом 45%. 1 Н ЯМР (CDCl3)7,3-7,4 (5 Н, м), 5,8-6,0 (1 Н, м), 5,10 (2 Н, м), 3,9-4,0 (1 Н, м), 2,5-3,1 (6 Н, м), 1,40(9 Н, с), 1,15 (3 Н, д, J=7 Гц). Масса (м/е) 367 (М+1). Приготовление 19. Синтез 3S-трет-бутоксикарбониламино-4-(5-метил-2-оксооксазолидин-3-ил)бутановой кислоты бензилового эфира. 360 мг (0,98 ммоль) 3S-трет-бутоксикарбониламино-4-(2-гидроксипропиламино)бутановой кислоты бензилового эфира, полученного в приготовлении 18, растворяют в дихлорметане и затем охлаждают до температуры 0 С, затем к ранее образованному раствору добавляют 120 мг (0,98 ммоль) N,Nдиизопропилэтиламина и 680 л (3,92 ммоль) диметиламинопиридина, с последующим добавлением 1,0 г(1,5 ммоль) фосгена (20% толуол) и затем перемешивают в течение 2 ч и 40 мин. Реакционный раствор разбавляют дихлорметаном и промывают водным раствором NaCl, затем сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (1:1 смесь гексан:этилацетат), что дает 120 мг названного соединения с выходом 31%. 1 Н ЯМР (CDCl3)7,3-7,4 (5 Н, м), 5,10 (2 Н, с), 5,10 (1 Н, м), 4,55-4,65 (1 Н, м), 4,1-4,2 (1 Н, м), 3,0-3,8(3 Н, м), 2,5-2,8 (2 Н, м), 1,41 (12 Н, м). Масса (м/е) 393 (М+1). Приготовление 20. Синтез [1-(5-метил-2-оксооксазолидин-3-илметил)-3-оксо-3-(3-трифторметил 5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 120 мг (0,31 ммоль) 3S-трет-Бутоксикарбониламино-4-(5-метил-2-оксооксазолидин-3-ил)бутановой кислоты бензилового эфира, полученного в приготовлении 19, растворяют в метаноле, затем к ранее образованному раствору добавляют 12 мг палладия на угле (Pd/C), а затем перемешивают в атмосфере водорода в течение 3 ч 40 мин. После завершения реакции, реакционный раствор фильтруют через целит,затем промывают метанолом с последующей концентрацией. В полученную смесь немедленно добавляют 9 мг (0,31 ммоль) амина, затем смесь растворяют в дихлорметане. Реакционный раствор охлаждают до температуры 0 С, затем в него добавляют 50 мг (0,37 ммоль) НОВТ. После перемешивания в течение 10 мин к ранее образованному раствору добавляют 88 мг (0,47 ммоль) EDC. После удаления бани со льдом реакционный раствор перемешивают в течение около 17 ч, затем концентрируют, остаток очищают препаративной ТСХ (10:1 смесь CH2Cl2:МеОН), что дает 88 мг названного соединения с общим выходом 60%. 1 Н ЯМР (CDCl3)5,6-5,9 (1 Н, м), 4,9-5,1 (2 Н, м), 4,6-4,8 (1 Н, м), 3,9-4,3 (5 Н, м), 3,6-3,8 (1 Н, м), 3,1- 22012591 3,5 (3 Н, м), 2,5-2,9 (2 Н, м), 1,40 (12 Н, м). Масса (м/е) 477 (М+1). Пример 2. Синтез 3-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-5-метилоксазолидин-2-она. 88 мг (0,045 ммоль) [1-(5-Метил-2-оксооксазолидин-3-илметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 20, растворяют в смеси этилацетат/соляная кислота. После перемешивания в течение около 30 мин реакционный раствор концентрируют, что дает твердое вещество белого цвета. После этого твердое вещество промывают диэтиловым эфиром и сушат, что дает 42 мг названного соединения с выходом 60%. 1 Н ЯМР (CD3OD)5,1-5,2 (2 Н, м), 4,7-4,8 (1 Н, м), 4,45 (1 Н, м), 4,3 (1 Н, м), 4,0-4,2 (3 Н, м), 3,8-3,9(2 Н, м), 3,4-3,7 (2 Н, м), 2,9-3,1 (2 Н, м), 1,41 (3 Н, м). Масса (м/е) 377 (М+1). Приготовление 21. Синтез 3S-трет-бутоксикарбониламино-4-(трет-бутилдиметилсиланилокси)бутановой кислоты бензилового эфира. 4,0 г (12,9 ммоль) 3S-трет-Бутоксикарбониламино-4-гидроксибутановой кислоты бензилового эфира, полученного в приготовлении 13, растворяют в диметилформамиде, затем к ранее образованному раствору добавляют 2,34 г (15,5 ммоль) имидазола и 2,34 г (32,3 ммоль) третбутилдиметилсилилхлорида, а затем перемешивают в течение около 2 ч. После этого раствор разбавляют избытком этилацетата и промывают один раз водой и водным раствором NaCl, соответственно, затем сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (5:1 смесь гексан:этилацетат), что дает 4,0 г названного соединения с выходом 73%. 1 Н ЯМР (CDCl3)7,3-7,4 (5 Н, м), 5,21 (1 Н, д, J=8 Гц), 5,08 (1 Н, м), 4,0-4,1 (1 Н, м), 3,6-3,7 (2 Н, м),2,6-2,7 (2 Н, м), 1,42 (9 Н, с), 0,86 (9 Н, с), 0,01 (6 Н, с). Масса (м/е) 424 (М+1). Приготовление 22. Синтез [1-(трет-бутилдиметилсиланилоксиметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира.(1) Синтез 3S-трет-бутоксикарбониламино-4-(трет-бутилдиметилсиланилокси)бутановой кислоты. 1,0 г (2,36 ммоль) 3S-трет-бутоксикарбониламино-4-(трет-бутилдиметилсиланилокси)бутановой кислоты бензилового эфира, полученного в приготовлении 21, растворяют в метаноле, затем к ранее образованному раствору добавляют 120 мг палладия на угле (Pd/C), а затем перемешивают в атмосфере водорода в течение 3 ч и 25 мин. После завершения реакции реакционный раствор фильтруют через целит и промывают метанолом, затем концентрируют. 1 Н ЯМР (CDCl3)5,10 (1 Н, м), 4,02 (1H, м), 3,6-3,7 (2H, м), 2,61 (2 Н, м), 1,43 (9 Н, с), 0,88 (9 Н, с),0,04 (6 Н, с). Масса (м/е) 356 (M+Na).(2) Синтез [1-(трет-бутилдиметилсиланилоксиметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. К 333 мг (1 ммоль) 3S-трет-бутоксикарбониламино-4-(трет-бутилдиметилсиланилокси)бутановой кислоты, которую получают из стадии (1), добавляют 192 мг (1 ммоль) 3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразина, и полученную смесь растворяют в дихлорметане. Реакционный раствор охлаждают до температуры 0 С и добавляют 162 мг (1,2 ммоль) НОВТ, а затем перемешивают в течение 10 мин и затем добавляют 288 мг (1,5 ммоль) EDC. После удаления бани со льдом реакционный раствор перемешивают в течение около 13 ч и затем остаток, который получают после концентрации, очищают хроматографией на колонке (1:1 смесь гексан:этилацетат), что дает 0,27 г названного соединения с выходом 53%. 1 Н ЯМР (CDCl3)5,1-5,3 (1 Н, м), 4,9-5,1 (2 Н, м), 3,9-4,3 (4 Н, м), 3,7-3,8 (2 Н, м), 2,6-2,9 (2 Н, м), 1,40[1-гидроксиметил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 2,3 г (4,53 ммоль) [1-(трет-Бутилдиметилсиланилоксиметил)-3-оксо-3-(3-трифторметил-5,6- 23012591 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 22, растворяют в тетрагидрофуране, затем в полученный раствор по каплям добавляют 9 мл тетрабутиламмонийфторида (1M в ТГФ), а затем перемешивают в течение приблизительно 12 мин. Затем раствор разбавляют избытком этилацетата, разбавленный раствор промывают один раз водой и водным раствором NaCl, соответственно, и сушат над безводным сульфатом магния и отфильтровывают. Отфильтрованный раствор отгоняют при пониженном давлении, затем остаток очищают хроматографией на колонке (15:1 CH2Cl2:МеОН), что дает 1,78 г [1-гидроксиметил-3-оксо-3-(3 трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира с выходом 99%. 1 Н ЯМР (CDCl3)5,3-5,5 (1 Н, м), 5,0-5,2 (2 Н, м), 3,9-4,3 (4 Н, м), 3,6-3,8 (2 Н, м), 2,7-3,0 (2 Н, м), 1,41(2) Синтез [1-формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7 ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 500 мг (1,27 ммоль) [1-гидроксиметил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, который получают из стадии (1), растворяют в дихлорметане и затем к ранее образованному раствору добавляют 10 мл реагента Десс-Мартина (0,3 М), а затем перемешивают в течение 2 ч и 40 мин. После концентрации остаток очищают хроматографией на колонке (1:2 смесь гексан:этилацетат), что дает 0,33 г названного соединения с выходом 66%. 1 Н ЯМР (CDCl3)9,67 (1 Н, с), 5,7-5,9 (1 Н, м), 4,9-5,1 (2 Н, м), 3,9-4,5 (5 Н, м), 3,1-3,2 (1 Н, м), 2,9-3,0(1 Н, м), 1,42 (9 Н, с). Масса (м/е) 392 (М+1). Приготовление 24. Синтез [3-оксо-1-(2-оксопиперидин-1-илметил)-3-(3-трифторметил-5,6-дигидро 8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 77 мг (0,2 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира добавляют к 33 мг (0,2 ммоль) гидрохлорида 5-аминопентановой кислоты метилового эфира, растворяют в дихлорэтане, а затем перемешивают в течение 30 мин. К ранее образованному раствору добавляют 83 мг (0,4 ммоль) триацетоксиборгидрида натрия, а затем перемешивают в течение приблизительно 1 ч и 40 мин. Полученный раствор нагревают до температуры 80 С в течение приблизительно 7 ч и концентрируют, затем остаток очищают препаративной ТСХ (10:1 смесь CH2Cl2:МеОН), что дает приблизительно 20 г названного соединения с общим выходом 21%. 1 Н ЯМР (CD3OD)6,5 (1 Н, м), 4,9-5,1 (2 Н, м), 4,0-4,4 (5 Н, м), 3,35-3,5 (3 Н, м), 2,6-2,8 (2 Н, м), 2,28 88 мг (0,045 ммоль) [3-Оксо-1-(2-оксопиперидин-1-илметил)-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 24, растворяют в смеси этилацетат/соляная кислота, а затем перемешивают в течение приблизительно 30 мин и затем концентрируют. Остаток очищают препаративной ТСХ (10:1 смесьCH2Cl2:МеОН), что дает приблизительно 10,4 мг названного соединения с выходом 66%. 1H ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,6 (1 Н, ушир.), 4,0-4,4 (4 Н, м), 3,8-3,9 (2 Н, м), 3,35-3,5 (2 Н, м),2,8-3,0 (2 Н, м), 2,0-2,4 (2 Н, м), 1,8-1,9 (4 Н, м). Масса (м/е) 375 (М+1). Приготовление 25. Синтез [1-(4-метил-2-оксопиролидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 50 мг (0,13 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23 и 21 мг (0,13 ммоль) гидрохлорида 4-амино-3-метилбутановой кислоты метилового эфира (указанный продукт получен в приготовлении 2) взаимодействуют в соответствии с методикой, аналогичной методике, изложенной в приготовлении 24, что дает 18 мг названного соединения с выходом 30%. 1[1-(4-Метил-2-оксопиролидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 25, взаимодействует со смесью этилацетат/соляная кислота в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 5,8 мг названного соединения с выходом 37%. 1[1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]1S-карбаминовой кислоты трет-бутилового эфира 39 мг (0,1 ммоль), полученного в приготовлении 23 и 17 мг (0,1 ммоль) гидрохлорида 4-амино-2-фторбутановой кислоты метилового эфира (указанный продукт получен в приготовлении 3) и 42 мг (0,2 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 5,8 мг названного соединения с выходом 37%. 1 Н ЯМР (CDCl3)5,7-5,9 (1 Н, м), 4,9-5,1 (3 Н, м), 3,8-4,3 (5 Н, м), 3,3-3,7 (4 Н, м), 2,4-2,8 (3 Н, м), 2,12,2 (1 Н, м), 1,40 (9 Н, с). Масса (м/е) 479 (М+1). Пример 5. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-3-фторпиролидин-2-она.[1-(3-Фтор-2-оксопиролидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 26 и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 5,9 мг амина с выходом 45%. 1 Н ЯМР (CD3OD)5,0-5,3 (3 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,4-3,7 (5 Н, м), 2,5-2,8 (3 Н, м),2,1-2,3 (1 Н, м). Масса (м/е) 379 (М+1). Пример 6. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]пиролидин-2-она. 77 мг (0,2 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, добавляют к 23 мг (0,2 ммоль) 4-аминобутановой кислоты метилового эфира, затем полученную смесь растворяют в дихлорэтане, а затем перемешивают в течение 30 мин. После этого к ранее образованному раствору добавляют 84 мг (0,4 ммоль) триацетоксиборгидрида натрия, а затем перемешивают в течение приблизительно 2 ч. После концентрации остаток взаимодействует со смесью этилацетат/соляная кислота в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 15 мг названного соединения с выходом 21%. 1 Н ЯМР (CD3OD)5,00-4,95 (2 Н, м), 4,31-4,22 (2 Н, м), 4,10-4,01 (2 Н, м), 3,74 (1 Н, ушир.с), 3,53-3,41- 25012591 Масса (м/е) 361 (М+1). Приготовление 27. Синтез [1-(3-фтор-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 90 мг (0,1 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, 43 мг (0,1 ммоль) гидрохлорида 5-амино-2-фторпентановой кислоты метилового эфира (указанный продукт получен в приготовлении 4) и 98 мг (0,2 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 24 мг названного соединения с выходом 21%. 1 Н ЯМР (CDCl3)5,8-6,1 (1 Н, м), 4,6-5,2 (3 Н, м), 3,8-4,4 (5 Н, м), 3,2-3,6 (4 Н, м), 2,6-3,0 (2 Н, м), 1,72,1 (4 Н, м), 1,40 (9 Н, с). Масса (м/е) 493 (М+1). Пример 7. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-3-фторпиперидин-2-она.[1-(3-Фтор-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 27, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 6 мг названного соединения с выходом 31%. 1H ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,7-4,9 (1 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,7-3,8 (1 Н, м),3,3-3,6 (4 Н, м), 2,7-3,0 (2 Н, м), 1,8-2,2 (4 Н, м). Масса (м/е) 393 (М+1). Приготовление 28. Синтез [1-(3-метил-2-оксопиролидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 75 мг (0,1 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 25 и 32 мг (0,1 ммоль) гидрохлорида 4-амино-2-метилбутановой кислоты метилового эфира (указанный продукт получен в приготовлении 5) и 81 мг (0,2 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 20 мг названного соединения с выходом 22%. 1 Н ЯМР (CDCl3)5,8-6,0 (1 Н, м), 4,8-5,1 (2 Н, м), 3,8-4,3 (5 Н, м), 3,3-3,5 (4 Н, м), 2,5-2,9 (2 Н, м), 2,12,4 (2 Н, м), 1,5-1,6 (1 Н, м), 1,40 (9 Н, с), 1,09-1,1 (3 Н, м). Масса (м/е) 475 (М+1). Пример 8. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-3-метилпиролидин-2-она.[1-(3-Метил-2-оксопиролидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 28, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 4,5 мг названного соединения с выходом 29%. 1 Н ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,6-3,7 (1 Н, м), 3,4-3,5 (4 Н, м),2,6-2,9 (2 Н, м), 2,2-2,5 (2 Н, м), 1,6-1,7 (1 Н, м), 1,3 (1 Н, м), 1,1-1,2 (3 Н, м). Масса (м/е) 375 (М+1). Приготовление 29. Синтез [1-(4-метил-2-оксо-2,5-дигидропиррол-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты третбутилового эфира. 85 мг (0,22 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, 36 мг (0,22 ммоль) гидрохлорида 4-амино-3-метил-2-бутеновой кислоты метилового эфира (указан- 26012591 ный продукт получен в приготовлении 6) и 92 мг (0,44 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 34 мг названного соединения с выходом 33%. 1 Н ЯМР (CDCl3)5,9-6,2 (1 Н, м), 5,72 (1 Н, м), 4,9-5,1 (2 Н, м), 3,9-4,4 (7 Н, м), 3,6-3,7 (1 Н, м), 3,4-3,5 34 мг [1-(4-Метил-2-оксо-2,5-дигидропиррол-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро 8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 29, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 25 мг названного соединения с выходом 93%. 1 Н ЯМР (CD3OD) 5,81 (1 Н, м), 5,0 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,1 (4 Н, м), 3,8-3,9 (1 Н, м), 3,65-3,75(2 Н, м), 2,9-3,0 (1 Н, м), 2,75-2,85 (1 Н, м), 2,10 (3 Н, с). Масса (м/е) 373 (М+1). Приготовление 30. Синтез [1-(4-метил-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 85 мг (0,22 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 25, 39 мг (0,22 ммоль) гидрохлорида 5-амино-3-метилпентановой кислоты метилового эфира (указанный продукт получен в приготовлении 8) и 92 мг (0,44 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 46 мг названного соединения с выходом 43%. 1 Н ЯМР (CDCl3)5,9-6,0 (1 Н, м), 4,8-5,1 (2 Н, м), 3,9-4,3 (6 Н, м), 3,5-3,6 (1 Н, м), 3,3-3,5 (3 Н, м), 2,72,9 (1 Н, м), 2,3-2,6 (2 Н, м), 1,8-1,9 (2 Н, м), 1,4-1,5 (1 Н, м), 1,39 (9 Н, с), 0,95 (3 Н, м). Масса (м/е) 489 (М+1). Пример 10. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-4-метилпиперидин-2-она.[1-(4-Метил-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 30, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 29 мг названного соединения с выходом 79%. 1 Н ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,8-3,9 (2 Н, м), 3,3-3,8 (3 Н, м),2,8-3,0 (2 Н, м), 2,4 (1 Н, м), 1,8-2,0 (3 Н, м), 1,5-1,6 (1 Н, м), 1,0 (3 Н, м). Масса (м/е) 389 (М+1). Приготовление 31. Синтез [1-(5,5-дифтор-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил 5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 85 мг (0,22 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, 44 мг (0,22 ммоль) гидрохлорида 5-амино-4,4-дифторпентановой кислоты метилового эфира (указанный продукт получен в приготовлении 12) и 92 мг (0,44 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 25 мг названного соединения с выходом 23%. 1 25 мг [1-(5,5-Дифтор-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 31, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 7,9 мг названного соединения с выходом 39%. 1 Н ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,7-3,9 (2 Н, м), 3,6-3,7 (2 Н, м),3,4-3,5 (1 Н, м), 2,8 (1 Н, тд, J=16, 5 Гц), 2,6-2,7 (1 Н, м), 2,5-2,6 (2 Н, м), 2,3-2,4 (2 Н, м). Масса (м/е) 411 (М+1). Приготовление 32. Синтез [1-(5R-метил-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 80 мг (0,20 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, и 37 мг (0,20 ммоль) гидрохлорида (R)-5-амино-4-метилпентановой кислоты метилового эфира (указанный продукт получен в приготовлении 7) и 87 мг (0,40 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 33 мг названного соединения с выходом 33%. 1 Н ЯМР (CDCl3)5,9-6,0 (1 Н, м), 4,8-5,1 (2 Н, м), 3,8-4,3 (5 Н, м), 3,2-3,7 (3 Н, м), 2,9-3,1 (1 Н, м), 2,12,9 (4 Н, м), 1,7-2,0 (2 Н, м), 1,3-1,5 (1 Н, м), 1,40 (9 Н, с), 0,98 (3 Н, м). Масса (м/е) 489 (М+1). Пример 12. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-5R-метилпиперидин-2-она.[1-(5R-Метил-2-оксопиперидин-1-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 32, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 15,3 мг названного соединения с выходом 58%. 1 Н ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,8-3,9 (1 Н, м), 3,7-3,8 (1 Н, м),3,55-3,65 (1 Н, м), 3,3-3,4 (1 Н, м), 2,8-3,1 (3 Н, м), 2,3-2,4 (2 Н, м), 2,0-2,1 (1 Н, м), 1,8-1,9 (1 Н, м), 1,5-1,6(указанный продукт получен в приготовлении 1) и 87 мг (0,40 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 4,6 мг названного соединения с выходом 40%. 1 Н ЯМР (CDCl3)5,6-5,7 (1 Н, м), 4,8-5,1 (2 Н, м), 3,9-4,3 (5 Н, м), 3,3-3,8 (4 Н, м), 3,0-3,1 (1 Н, м), 2,42,9 (4 Н, м), 1,4 (9 Н, с). Масса (м/е) 529 (М+1). Пример 13. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-4-трифторметилпиролидин-2-она. 18 мг [3-Оксо-4-(2-оксо-4-трифторметилпиролидин-1-илметил)-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 33, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 7 мг названного соединения с выходом 48%. 1 Н ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,7-3,9 (2 Н, м), 3,5-3,7 (3 Н, м),3,3-3,4 (1 Н, м), 2,8-3,0 (2 Н, м), 2,5-2,7 (2 Н, м). Масса (м/е) 429 (М+1). Приготовление 34. Синтез[3-оксо-1-(2-оксо-4-трифторметилпиперидин-1-илметил)-3-(3 трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 80 мг (0,20 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, 51 мг (0,20 ммоль) гидрохлорида 5-амино-3-трифторметилпентановой кислоты этилового эфира (указанный продукт получен в приготовлении 11) и 87 мг (0,40 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 41 мг названного соединения с выходом 37%. 1 41 мг [3-Оксо-1-(2-оксо-4-трифторметилпиперидин-1-илметил)-3-(3-трифторметил-5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 34, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 28,3 мг названного соединения с выходом 85%. 1 Н ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,7-3,9 (2 Н, м), 3,4-3,7 (3 Н, м),2,8-3,1 (3 Н, м), 2,5-2,7 (1 Н, м), 2,3-2,5 (1 Н, м), 2,1-2,2 (1 Н, м), 1,8-2,0 (1 Н, м), 1,3 (1 Н, м). Масса (м/е) 443 (М+1). Приготовление 35. Синтез[3-оксо-1-(2-оксо-5-трифторметилпиперидин-1-илметил)-3-(3 трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 286 мг (0,73 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, 172 мг (0,73 ммоль) гидрохлорида 4-аминометил-5,5,5-трифторпентановой кислоты метилового эфира (указанный продукт получен в приготовлении 9) и 310 мг (1,46 ммоль) триацетоксиборгидрида натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 260 мг названного соединения с выходом 37%. 1 Н ЯМР (CDCl3)5,7-6,0 (1 Н, м), 4,8-5,1 (2 Н, м), 4,1-4,3 (4 Н, м), 3,7-4,0 (2 Н, м), 3,3-3,7 (3 Н, м), 2,22,9 (5 Н, м), 2,0-2,1 (1 Н, м), 1,8-1,9 (1 Н, м), 1,39 (9 Н, с). Масса (м/е) 543 (М+1). Пример 15. Синтез 1-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-5-трифторметилпиперидин-2-она. 260 мг [3-Оксо-1-(2-оксо-5-трифторметилпиперидин-1-илметил)-3-(3-трифторметил-5,6-дигидро- 29012591 8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 35, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, изложенной в примере 3, что дает 15 мг названного соединения с выходом 7%. 1H ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,0-4,2 (2 Н, м), 3,8-3,9 (2 Н, м), 3,4-3,8 (3 Н, м),2,8-3,0 (3 Н, м), 2,4-2,5 (2 Н, м), 2,0-2,1 (1 Н, м), 1,8-2,0 (1 Н, м). Масса (м/е) 443 (М+1). Приготовление 36. Синтез [1-(2-метил-5-оксоморфолин-4-илметил)-3-оксо-3-(3-трифторметил-5,6 дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира. 140 мг (0,36 ммоль) [1-Формил-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 23, 71 мг (0,36 ммоль) гидрохлорида (2-амино-1-метилэтокси)уксусной кислоты этилового эфира (указанный продукт получен в приготовлении 10) и 151 мг (0,72 ммоль) триацетоксиборгидрид натрия взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 24, что дает 78 мг названного соединения с выходом 44%. 1 Н ЯМР (CDCl3)5,8-6,0 (1 Н, м), 4,8-5,1 (2 Н, м), 3,9-4,3 (7 Н, м), 3,7-3,9 (1 Н, м), 3,5-3,7 (1 Н, м), 3,13,5 (3 Н, м), 2,5-2,9 (2 Н, м), 1,33 (9 Н, с), 1,19 (3 Н, ушир.с). Масса (м/е) 491 (М+1). Пример 16. Синтез 4-[2S-амино-4-оксо-4-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4]триазоло[4,3 а]пиразин-7-ил)бутил]-6-метилморфолин-3-она. 78 мг [1-(2-Метил-5-оксоморфолин-4-илметил)-3-оксо-3-(3-трифторметил-5,6-дигидро-8 Н-[1,2,4] триазоло[4,3-а]пиразин-7-ил)пропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 36, и смесь этилацетат/соляная кислота взаимодействуют в соответствии с методикой,аналогичной методике получения соединения, изложенной в примере 3, что дает 25,7 мг названного соединения с выходом 45%. 1 Н ЯМР (CD3OD)4,9-5,1 (2 Н, м), 4,2-4,4 (2 Н, м), 4,1-4,2 (2 Н, м), 3,8-4,1 (4 Н, м), 3,68 (1 Н, м), 3,23,5 (3 Н, м), 2,8-3,1 (2 Н, м), 1,24 (3 Н, д, J=6,5 Гц). Масса (м/е) 391 (М+1). Приготовление 37. Синтез[1-(трет-бутилдиметилсиланилоксиметил)-3-(3,4-дигидро-1 Низохинолин-2-ил)-3-оксопропил]-1S-карбаминовой кислоты трет-бутилового эфира. 100 мг 3S-трет-Бутоксикарбоксиламино-4-(трет-бутилдиметилсиланилокси)бутановой кислоты, полученной в приготовлении 22(1), и 110 л 3,4-дигидро-1 Н-изохинолина взаимодействуют в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 22(2), что дает 34 мг названного соединения с выходом 87%. 1 Н ЯМР (CDCl3)7,1-7,3 (4 Н, м), 5,5-5,6 (1 Н, м), 4,7-4,8 (2 Н, м), 4,0-4,1 (1 Н, м), 3,6-3,9 (4 Н, м), 2,83,0 (3 Н, м), 2,6-2,7 (1 Н, м), 1,47 (9 Н, с), 0,92 (9 Н, с), 0,19 (3 Н, с), 0,14 (3 Н, с). Масса (м/е) 449 (М+1). Приготовление 38. Синтез [3-(3,4-дигидро-1 Н-изохинолин-2-ил)-1-формил-3-оксопропил]-1Sкарбаминовой кислоты трет-бутилового эфира.(1) Синтез [3-(3,4-дигидро-1 Н-изохинолин-2-ил)-1-гидроксиметил-3-оксопропил]-1S-карбаминовой кислоты трет-бутилового эфира. 250 мг [3-(3,4-Дигидро-1 Н-изохинолин-2-ил)-1-гидроксиметил-3-оксопропил]-1S-карбаминовой кислоты трет-бутилового эфира получают с выходом 96% в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовлении 23(1), используя 349 мг [1-(третбутилдиметилсиланилоксиметил)-3-(3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропил]-1S-карбаминовой кислоты трет-бутилового эфира, полученного в приготовлении 37. 1(2) Синтез [3-(3,4-дигидро-1 Н-изохинолин-2-ил)-1-формил-3-оксопропил]-1S-карбаминовой кислоты трет-бутилового эфира. 250 мг [3-(3,4-Дигидро-1 Н-изохинолин-2-ил)-1-гидроксиметил-3-оксопропил]-1S-карбаминовой кислоты трет-бутилового эфира (продукт, полученный на стадии 1), полученного в соответствии с методикой, аналогичной методике получения соединения, описанной в приготовления 23(2), и 10 мл реагента Десс-Мартина (0,3 М) взаимодействуют в соответствии с методикой, аналогичной методике получения
МПК / Метки
МПК: C07D 471/04, A61P 3/10, A61K 31/444, A61K 31/452
Метки: композиции, дипептидилпептидазы-iv, указанные, активного, соединения-ингибиторы, также, получения, способы, ингредиента, фармацевтические, содержащие, качестве, соединения
Код ссылки
<a href="https://eas.patents.su/30-12591-soedineniya-ingibitory-dipeptidilpeptidazy-iv-sposoby-ih-polucheniya-a-takzhe-farmacevticheskie-kompozicii-soderzhashhie-ukazannye-soedineniya-v-kachestve-aktivnogo-ingredienta.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения-ингибиторы дипептидилпептидазы-iv, способы их получения, а также фармацевтические композиции, содержащие указанные соединения в качестве активного ингредиента</a>
Предыдущий патент: 2-оксо-1,2,4,5-тетрагидро-1,3-бензодиазепин-3-илпиперидины в качестве cgrp-антагонистов
Следующий патент: Смягчающее раздражение средство от кашля, содержащее экстракты из исландского мха и просвирника
Случайный патент: Способ производства очищенного природного газа












