Производные тетрагидрохинолина в качестве антагонистов глицина
Формула / Реферат
1. Соединение формулы (I)
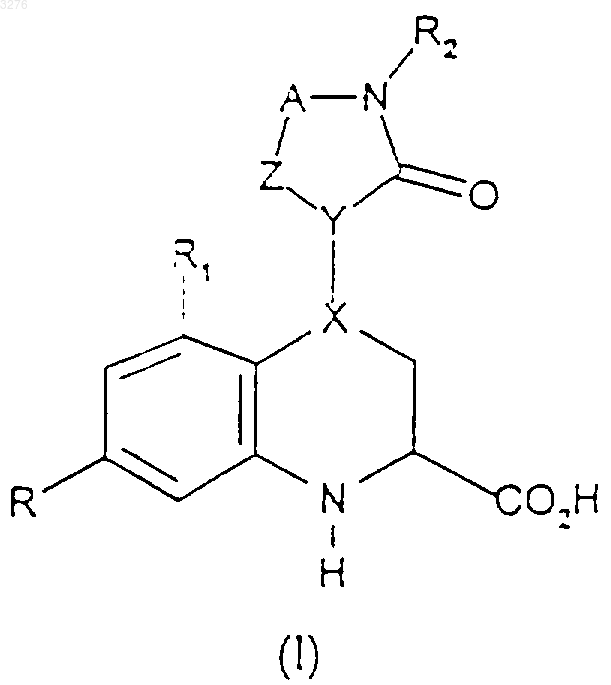
или его соль, или нетоксичные метаболически лабильные сложные эфиры,
где Y представляет собой атом углерода,
Z представляет собой группу CH, которая связана с группой Y посредством двойной связи, а X представляет собой CH или
Z представляет собой метилен или NR11, a X представляет собой атом углерода, связанный с группой Y посредством двойной связи,
A представляет собой C1-2алкиленовую цепь, которая может быть замещена одной или двумя группами, выбранными из C1-6алкила, возможно замещенного гидрокси, амино, C1-4алкиламино или C1-4диалкиламино, или может быть замещена группой =O,
R представляет собой атом галогена или C1-4алкильную группу,
R1 представляет собой атом водорода, атом галогена или C1-4алкильную группу,
R2 представляет собой фенил, который может быть замещен группами в количестве до 3, выбранными из галогена, водорода или (CH2)nR3, где R3 представляет собой COR4, NR6R5, NHCOR7, NHCONR9R8 или группу NHSO2R10, или
R2 представляет собой 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, или 6-членную гетероарильную группу, содержащую от 1 до 3 атомов азота,
R4 представляет собой аминогруппу, гидроксильную или C1-4алкоксигруппу,
R5 и R6, каждый независимо, представляет собой водород или C1-4алкильную группу или R5 и R6 вместе с атомом азота, к которому они присоединены, представляют собой насыщенную 5-7-членную гетероциклическую группу, возможно содержащую дополнительный гетероатом, выбранный из кислорода, серы или азота,
R7 представляет собой атом водорода или C1-4алкил, C1-4алкокси или фенил,
R8 представляет собой водород или C1-4алкильную группу,
R9 представляет собой водород, возможно замещенный C1-4алкил (возможно замещенный одной или более чем одной гидроксигруппой, карбоксильной и аминогруппой), фенил,
R11 представляет собой водород или C1-4алкильную группу,
R10 представляет собой водород, C1-4алкил или защитную группу азота,
n равно нулю или целому числу от 1 до 2.
2. Соединение по п.1, где R представляет собой хлор, a R1 представляет собой водород или атом хлора.
3. Соединение по п.1 или 2, где A представляет собой цепь, выбранную из -CH2-, -(CH2)2- или C=O.
4. Соединение по любому из пп.1-3, где Z представляет собой группу CH, которая связана с группой Y посредством двойной связи, метиленовую группу или группу NH.
5. Соединение по любому из пп.1-4, где R2 представляет собой группу, выбранную из фенила (возможно замещенного ацетиламино, метансульфониламино) или 3-пиридила.
6. Соединение по любому из пп.1-5, где R2 представляет собой фенил.
7. Соединение по любому из пп.1-6, где A представляет собой цепь, выбранную из -CH2-, -(CH2)2-, а Z представляет собой группу CH, которая связана с группой Y посредством двойной связи, или метиленовую группу или A представляет собой C=O, a Z представляет собой группу NH, R представляет собой хлор, R1 представляет собой хлор или водород, a R2 представляет собой фенил (возможно замещенный ацетиламино или метансульфониламино) или 3-пиридил.
8. Соединение по п.1, представляющее собой (+)7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту, ее физиологически приемлемые соли или нетоксичные метаболически лабильные сложные эфиры.
9. Соединение по п.1, представляющее собой (+)7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия.
10. Соединение по п.1, представляющее собой (-)7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия.
11. Соединение по п.1, представляющее собой (+)7-хлор-4-(1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту, ее физиологически приемлемые соли или нетоксичные метаболически лабильные сложные эфиры.
12. Соединение по п.1, представляющее собой (+)7-хлор-4-(1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия.
13. Соединение по п.1, представляющее собой (-)7-хлор-4-(1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия.
14. Соединение по п.1, представляющее собой (+)7-хлор-4-(1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия.
15. Соединение по п.1, выбранное из
(+)-7-хлор-4-(1-(3-пиридин)-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,
(+)-7-хлор-4-(1-фенил-D 3-5,6-дигидропиридин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,
(+)-5,7-дихлор-4-(1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,
(+/-)-7-хлор-4-(1-(4-ацетиламинo)-1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,
(+/-)7-хлор-4-(1-(4-метансульфониламинo)-1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,
(+)-7-хлор-4-(2-оксо-1-фенил-3-пиперидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,
(+)-7-хлор-4-(2,5-диоксо-1-фенилимидазолидин-4-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,
(+)-7-хлор-4-(2-оксо-1-(пиридин-3-ил)пирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилата,
(+)-7-хлор-4-(2-оксо-1-(4-ацетиламино)фенилпирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,
(+)7-хлор-4-(2-оксо-1-(4-метансульфониламино)фенилпирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,
5,7-дихлор-4-(2-оксо-1-(фенил)пирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,
5,7-дихлор-4-(2-оксо-1-фенил-D 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты
и их физиологически приемлемых солей (например натриевых солей), нетоксичных метаболически лабильных сложных эфиров или энантиомеров.
16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-15 в смеси с одним или более чем одним физиологически приемлемым носителем или эксципиентом.
17. Способ получения соединений по любому из пп.1-15, при котором осуществляют циклизацию соединения формулы (II), в которой R, R1, R2, A, X, Y, Z имеют значения, определенные в п.1, а R12 представляет собой защитную группу карбоксила, R13 представляет собой атом брома или иода, R14 представляет собой водород или защитную группу азота

после чего, если необходимо или желательно, осуществляют одну или более чем одну из следующих стадий, на которых:
(1) удаляют защитную группу,
(2) выделяют соединение в виде его соли,
(3) превращают соединение формулы (I) или его соль в его метаболически лабильный сложный эфир,
(4) разделяют соединение формулы (I) или его производное на его энантиомеры.
Текст
1 Настоящее изобретение относится к производным 1,2,3,4-тетрагидрохинолина, способам их получения, фармацевтическим композициям,содержащим их, и их применению в медицине. В частности, изобретение относится к производным 1,2,3,4-тетрагидрохинолина, которые являются мощными и специфическими антагонистами возбуждающих аминокислот.NMDA рецепторного комплекса (NMDANМетил-D-аспарагиновая кислота), но, в лучшем случае, обладают только слабой активностью invivo. В более частном случае, сообщается о том,что такие производные, замещенные по положению 4 группой CH2CO2H или CH2CONHPh,обладают небольшой активностью in vivo или вовсе не обладают таковой при системном введении (внутрибрюшинно). В WO 97/12870 и WO 98/07704 описаны новые производные 4-замещенного-2-карбокситетрагидрохинолина, которые обладают не только хорошим сродством in vitro к стрихниннечувствительному сайту связывания глицина,ассоциированного с NMDA рецепторным комплексом, но также обладают хорошей активностью in vivo при внутривенном введении (в/в). В настоящее время авторы изобретения обнаружили новую группу 4-замещенных-2 карбокситетрагидрохинолинов, имеющих, в частности, полезный профиль активности в качестве селективных антагонистов стрихниннечувствительного сайта связывания глицина,ассоциированного с NMDA рецепторным комплексом. Таким образом, в настоящем изобретении предложено соединение формулы (I) или его соль, или нетоксичные метаболически лабильные сложные эфиры, гдеY представляет собой атом углерода,Z представляет собой группу СН, которая связана с группой Y посредством двойной связи, а Х представляет собой СН, или Z представляет собой метилен или NR11, a X представляет собой атом углерода, связанный с группой Y посредством двойной связи,А представляет собой С 1-2 алкиленовую цепь, которая может быть замещена одной или двумя группами, выбранными из C1-6 алкила,возможно замещенного гидрокси, амино, С 1-4 2 алкиламино или С 1-4 диалкиламино, или может быть замещена группой = О,R представляет собой атом галогена или С 1-4 алкильную группу,R1 представляет собой атом водорода, атом галогена или С 1-4 алкильную группу,R2 представляет собой фенил, который может быть замещен группами в количестве до 3, выбранными из галогена, водорода илиNHSO2R10, или R2 представляет собой 5 членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, или 6-членную гетероарильную группу, содержащую от 1 до 3 атомов азота,R4 представляет собой амино, гидроксильную или С 1-4 алкоксигруппу,R5 и R6 каждый независимо представляет собой водород или C1-4 алкильную группу, илиR5 и R6 вместе с атомом азота, к которому они присоединены, представляют собой насыщенную 5-7-членную гетероциклическую группу, возможно содержащую дополнительный гетероатом, выбранный из кислорода, серы или азота,R7 представляет собой атом водорода или С 1-4 алкил, С 1-4 алкокси или фенил,R8 представляет собой водород или С 1-4 алкильную группу,R9 представляет собой водород, возможно замещенный С 1-4 алкил (возможно замещенный одной или более чем одной гидроксильной, карбоксильной и аминогруппой), фенил,R11 представляет собой водород или С 1-4 алкильную группу,R10 представляет собой водород, С 1-4 алкил или защитную группу азота,n равно нулю или целому числу от 1 до 2. В следующем воплощении данного изобретения предложены соединения формулы (I) или их соль, или нетоксичные метаболически лабильные сложные эфиры, гдеY представляет собой атом углерода,Z представляет собой группу СН, которая связана с группой Y посредством двойной связи, а Х представляет собой СН, или Z представляет собой метилен или NR11, a X представляет собой атом углерода, связанный с группой Y посредством двойной связи,А представляет собой С 1-2 алкиленовую цепь, которая может быть замещена одной или двумя группами, выбранными из C1-6 алкила,возможно замещенного гидрокси, амино, С 1-4 алкиламино или С 1-4 диалкиламино, или может быть замещена группой = О,R представляет собой атом галогена,R1 представляет собой атом водорода или атом галогена,R2 представляет собой фенил, который может быть замещен группами в количестве до 3,выбранными из галогена, водорода илиNHSO2R10, или R2 представляет собой 5 членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, или 6-членную гетероарильную группу, содержащую от 1 до 3 атомов азота,R4 представляет собой амино или гидроксил,R5 и R6 каждый независимо представляет собой водород или C1-4 алкильную группу, илиR5 и R6 вместе с атомом азота, к которому они присоединены, представляют собой насыщенную 5-7-членную гетероциклическую группу, возможно содержащую дополнительный гетероатом, выбранный из кислорода, серы или азота,R7 представляет собой атом водорода или С 1-4 алкил, С 1-4 алкокси или фенил,R8 представляет собой водород или С 1-4 алкильную группу,R9 представляет собой водород, возможно замещенный С 1-4 алкил (возможно замещенный одной или более чем одной гидроксильной, карбоксильной или аминогруппой), фенил,R11 представляет собой водород или С 1-4 алкильную группу,R10 представляет собой водород, С 1-4 алкил или защитную группу азота,n равно нулю или целому числу от 1 до 2 при условии, что когда Х представляет собой атом углерода, связанный с группой Y посредством двойной связи, тогда R1 представляет собой водород. Для применения в медицине соли соединений формулы (I) должны быть физиологически приемлемыми. Другие соли, однако, могут быть полезны при получении соединений формулы(I) или их физиологически приемлемых солей. Следовательно, если не указано иначе, ссылки на соли включают в себя и физиологически приемлемые соли, и физиологически неприемлемые соли соединений формулы (I). Подходящие физиологически приемлемые соли соединений по изобретению включают в себя соли присоединения оснований и, когда подходит, соли присоединения кислот. Подходящие физиологически приемлемые соли присоединения оснований соединений формулы (I) включают в себя соли щелочных металлов или щелочно-земельных металлов, таких как соли натрия, калия, кальция, магния и аммония, образованные аминокислотами (например лизином и аргинином) и органическими основаниями (например прокаином, фенилбензиламином, этаноламином,диэтаноламином иN-метилглюкозамином). Соединения формулы (I) и/или их соли могут образовывать сольваты (например гидраты),и данное изобретение включает в себя все такие сольваты. 4 Термин "галоген" относится к атомам фтора, хлора, брома или иода. Термин "С 1-4 алкил" при использовании здесь в качестве группы или части группы относится к алкильной группе с прямой или разветвленной цепью, содержащей от 1 до 4 атомов углерода; примеры таких групп включают в себя метил, этил, пропил, изопропил, н-бутил,изобутил, вторичный бутил или третичный бутил. Когда R2 является 5- или 6-членной гетероарильной группой, это может быть, например,фуранил, тиофенил, имидазолил, тиазолил, оксазолил, пиридил или пиримидинил. Когда R5 и R6 вместе с атомом азота, к которому они присоединены, образуют насыщенную 5-7-членную гетероциклическую группу,возможно содержащую дополнительный гетероатом, выбранный из кислорода, серы или азота, это может быть морфолино, 2,6 диметилморфолино, тиоморфолино, пиперидино, пирролидино, пиперазино или N-метилпиперазино. Когда R2 является замещенной фенильной группой, это преимущественно монозамещенная фенильная группа. Заместитель находится преимущественно в мета-положении или более преимущественно в пара-положении. Когда X-Y представляет собой двойную связь, соединения формулы (I) имеют, по меньшей мере, один асимметрический атом углерода(а именно, атом углерода, занимающий положение 2 в 1,2,3,4-тетрагидрохинолиновой кольцевой системе), а другие асимметрические атомы углерода возможны в группе R2. Очевидно, что все энантиомеры и диастереомеры и их смеси охвачены объемом настоящего изобретения. Когда X-Y представляет собой одинарную связь, соединения формулы (I) имеют, по меньшей мере, два асимметрических атома углерода(а именно, атом углерода, занимающий положение 2 и 4 в 1,2,3,4-тетрагидрохинолиновой кольцевой системе), и они могут быть представлены формулами (1 а, 1 б, 1 в и 1 г). Сплошная клиновидная связь указывает на то, что связь находится над плоскостью бумаги,и относится к -конфигурации. Прерывистая указывает на то, что связь находится за плоскостью бумаги, и относится к -конфигурации. 5 Другие дополнительные асимметрические атомы углерода возможны в группах R2. Очевидно, что все энантиомеры и диастереомеры и их смеси охвачены объемом настоящего изобретения. Нетоксичные метаболически лабильные сложные эфиры соединения формулы (I) являются сложными эфирами соединений формулы(I), которые гидролизуются in vivo с получением указанного соединения формулы (I) и физиологически приемлемого спирта. Нетоксичные метаболически лабильные сложные эфиры соединения формулы (I) могут быть образованы этерификацией, например, любой из групп карбоновых кислот в исходном соединении общей формулы (I), когда нужно, с предварительной защитой любых других реакционноспособных групп, имеющихся в молекуле, с последующим удалением защиты, если требуется. Примеры таких метаболически лабильных сложных эфиров включают в себя С 1-4 алкильные сложные эфиры, например метиловые или этиловые эфиры, замещенные или незамещенные аминоалкильные сложные эфиры, например аминоэтиловый, 2-(N,N-диэтиламино)этиловый или 2-(4 морфолино)этиловый эфиры или алкоксиалкильные эфиры, такие как ацилоксиметиловый или 1-ацилоксиэтиловый, например пивалоилоксиметиловый, 1-пивалоилоксиэтиловый, ацетоксиметиловый, 1-ацетоксиэтиловый, 1-(1-метокси-1-метил)этилкарбонилоксиэтиловый, 1 бензоилоксиэтиловый, изопропоксикарбонилоксиметиловый, 1-изопропоксикарбонилоксиэтиловый, циклогексилкарбонилоксиметиловый, 1 циклогексилкарбонилоксиэтиловый эфир, циклогексилоксикарбонилоксиметиловый, 1-циклогексилоксикарбонилоксиэтиловый, 1-(4-тетрагидропиранилокси)карбонилоксиэтиловый или 1-(4-тетрагидропиранил)карбонилоксиэтиловый. Группа R является преимущественно хлором. Группа R1 является преимущественно атомом водорода или хлора. Предпочтительным классом соединений формулы (I) является тот, где R является хлором, а R1 является атомом водорода или хлора. Еще одним предпочтительным классом соединений формулы (I) является тот, где R является хлором, а R1 является атомом водорода. Когда X-Y представляет собой одинарную связь, предпочтительным классом соединений формулы (I) является тот, в котором атом углерода в 4-ом положении находится в конфигурации, а атом углерода во 2-ом положении находится в -конфигурации (1 а), и тот, в котором атом углерода в 4-ом положении находится в -конфигурации, а атом углерода во 2 ом положении находится в -конфигурации 6 Когда А возможно замещена С 1-2 алкиленовой цепью, это может быть, например, метилен, этилен или С=O. Предпочтительный класс соединений формулы (I) включает в себя те соединения, в которых А является цепью, выбранной из -СН 2-, (СН 2)2-, С=O. Когда Z является группой NR11, это преимущественно группа NH. Предпочтительный класс соединений формулы (I) включает в себя те соединения, в которых Z является СН, которая связана с группой Y посредством двойной связи, метиленовой или группой NH. Когда R2 является возможно замещенной фенильной группой, это преимущественно фенил, замещенный одним заместителем, выбранным из (CH2)nNR6R5, в котором R5 является водородом, и R6 является водородом, C1-4 алкилом(например метилом, этилом), или NR6R5 представляет собой насыщенное 6-членное кольцо,содержащее кислород, например морфолино;R10 является алкилом, например метилом, n равно нулю или целому числу от 1 до 2. Примеры таких R2 групп включают в себя фенил (возможно замещенный амино, трет-бутоксикарбониламино, ацетиламино или метансульфониламино). Когда R2 является замещенным фенилом,заместители находятся преимущественно в мета- или более предпочтительно в параположении. Когда R2 является 5- или 6-членной гетероарильной группой, как определено выше, это преимущественно пиридил, например 3 пиридил. Предпочтительным классом соединений формулы (I) является тот, где R2 представляет собой фенил (возможно замещенный ацетиламино, метансульфониламино) или 3-пиридил. В пределах этого класса, в частности предпочтительны те соединения, где R2 представляет собой фенил. Еще одним предпочтительным классом соединений формулы (I) является тот, где Х представляет собой атом углерода, связанный с группой Y посредством двойной связи. Предпочтительной группой соединений формулы (I) является та, где А является цепью,выбранной из -СН 2- или -(СН 2)2-, Z является группой СН, которая связана с группой Y посредством двойной связи, или метиленовой группой, или А является цепью СО, a Z является группой NH, R является хлором, R1 является хлором или водородом, a R2 представляет собой фенил (возможно замещенный ацетиламино или метансульфониламино) или 3-пиридил. 7 Конкретные предпочтительные соединения по изобретению включают в себя: 7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту,7-xлop-4-(1-фeнил-3-пиppoлин-2-oн-3 ил)-1,2,3,4-тeтpaгидpo-2-хинолинкарбоновую кислоту,и их физиологически приемлемые соли(например натриевая соль), нетоксичные метаболически лабильные сложные эфиры или энантиомеры,(-)-7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия,(-)-7-хлор-4-(1-фенил-3-пирролин-2-он-3 ил)-1,2,3,4-тетрагидрохинолин-2-карбоксилат натрия,(+)-7-xлop-4-(1-фeнил-3-пиppoлин-2-oн-3 ил)-1,2,3,4-тeтpaгидpoxинoлин-2-карбоксилат натрия. Кроме того, конкретные предпочтительные соединения по изобретению включают в себя:-7-xлop-4-(1-(3-пиpидин)-3-пиppoлин 2-oн-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновую кислоту,-7-xлop-4-(1-фeнил-3-5,6-дигидpoпиpидин-2-oн-3-ил)-1,2,3,4-тетрагидрохинолин 2-карбоновую кислоту,-5,7-дихлор-4-(1-фенил-3-пирролин-2 он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновую кислоту,(+/-)-7-хлор-4-(1-(4-ацетиламино)-1-фенил 3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновую кислоту,(+/-)7-xлop-4-(1-(4-мeтaнcyльфoнилaминo)1-фeнил-3-пиppoлин-2-oн-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновую кислоту,-7-хлор-4-(2-оксо-1-фенил-3-пиперидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту,-7-хлор-4-(2,5-диоксо-1-фенил-имидазолидин-4-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту,-7-хлор-4-(2-оксо-1-(пиридин-3-ил)пирролидин-3-илиден)-1,2,3,4-тетрагидро-2 хинолинкарбоксилат,-7-хлор-4-(2-оксо-1-(4-ацетиламино)фенилпирролидин-3-илиден)-1,2,3,4-тетрагидро-2 хинолинкарбоновую кислоту,7-хлор-4-(2-оксо-1-(4-метансульфониламино)фенилпирролидин-3-илиден)-1,2,3,4 тетрагидро-2-хинолинкарбоновую кислоту,5,7-дихлор-4-(2-оксо-1-(фенил)-пирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту (энантиомер А),5,7-дихлор-4-(2-оксо-1-фенил-3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2 карбоновую кислоту (энантиомер А) и их физиологически приемлемые соли 8 болически лабильные сложные эфиры или энантиомеры. Соединения формулы (I) и/или их физиологически приемлемые соли являются антагонистами возбуждающих аминокислот. В более частном случае они являются мощными антагонистами стрихнин-нечувствительного сайта связывания глицина, ассоциированного с NMDA рецепторным комплексом. В качестве таковых они являются мощными антагонистами NMDA рецепторного комплекса. Следовательно, такие соединения полезны при лечении или предотвращении нейротоксического поражения или нейродегенеративных заболеваний. Так, эти соединения полезны для лечения нейротоксического повреждения, являющегося следствием церебрального удара, тромбоэмболического удара, геморрагического удара, церебральной ишемии, церебрального вазоспазма, гипогликемии, амнезии, гипоксии, кислородной недостаточности, перинатальной асфиксии, остановки сердца. Соединения полезны при лечении хронических нейродегенеративных заболеваний,таких как болезнь Хантингдона, старческая деменция Альцгеймера, боковой амиотрофический склероз, тип глутаровой ацидемии, мультиинфарктная деменция, эпилептическое состояние, контузионные повреждения (например повреждение спинного мозга и повреждение головы), вирусная инфекция, вызывающая нейродегенерацию (например СПИД, энцефалопатии), синдром Дауна, нейродегенерация глаз"гистаминовые" головные боли и или головные боли, вызванные давлением, тревога, боль (например боль при воспалении и невропатическая боль), нейрогенный мочевой пузырь, рвота, расстройства раздраженного мочевого пузыря, лекарственная зависимость, включая симптомы абстиненции алкоголя, кокаина, опиатов, никотина (например прекращения курения), бензодиазепинов и подавление толерантности, вызываемой опиоидами (то есть морфином). Мощное и селективное действие соединения по данному изобретению на стрихниннечувствительный сайт связывания глицина,имеющегося на NMDA рецепторном комплексе,может быть легко определено с использованием традиционных методов исследования. Так, способность связываться на стрихнин-нечувствительном сайте связывания глицина определяли,используя метод Kishimoto H. et al., J. Neurochem. 1981, 37, 1015-1024. Селективность действия соединений по изобретению на стрихниннечувствительный сайт связывания глицина подтверждали в исследованиях на других ионотропных известных рецепторах возбуждающих аминокислот. Так, было обнаружено, что соединения по изобретению проявляют незначительное сродство к рецептору каиновой кислоты(каинату), рецептору а-амино-3-гидрокси-5 9 метил-4-изоксазолпропионовой кислоты (АМРА) или к сайту связывания NMDA или не проявляют его вовсе. Можно обнаружить, что соединения по изобретению подавляют вызванные NMDA конвульсии у мышей, используя метод Chiamulera С. et al., Psychopharmacology, (1990), 102, 551552. Нейрозащитное действие соединений по изобретению можно продемонстрировать на препарате окклюзии средней церебральной артерии у мышей, используя метод, описанныйChiamulera С. et al., European Journal of Pharmacology, 216 (1992), pp. 335-336. Способность соединений по изобретению облегчать симптомы абстиненции никотина,следующие за прекращением курения, можно продемонстрировать в традиционных исследованиях рецидива, вызванного никотином, используя метод, описанный в С. Chiamulera. et al.,Arch. Pharmacol., 358,1998. Следовательно, в изобретении предложено применение соединения формулы (I) и/или его физиологически приемлемых солей или нетоксичных метаболически лабильных сложных эфиров для использования в терапии и, в частности, использования в качестве лекарственного средства для антагонизации воздействий возбуждающих аминокислот на NMDA рецепторный комплекс. Способность соединений по изобретению подавлять боль можно продемонстрировать в традиционной аналгезирующей защите, такой как описана Dubuisson and Dennis, Pain, 1977,4:161-174; J.J. Bennet and J.K. Xue, Pain,1988,41,87-107. Также в изобретении предложено применение соединения формулы (I) и/или его физиологически приемлемой соли или нетоксичных метаболически лабильных сложных эфиров для производства лекарства для антагонизации воздействий возбуждающих аминокислот наNMDA рецепторный комплекс. В соответствии со следующим аспектом, в изобретении также предложен способ антагонизации воздействий возбуждающих аминокислот на NMDA рецепторный комплекс, при котором нуждающемуся в этом пациенту вводят антагонистическое количество соединения формулы(I) и/или его физиологически приемлемой соли. Специалистам очевидно, что ссылка здесь на лечение распространяется на профилактику,а также на лечение установленных заболеваний или симптомов. Очевидно также, что количество соединения по изобретению, необходимое для применения в лечении, будет меняться в зависимости от природы состояния, которое лечат, способа введения и возраста и состояния пациента и, в конечном счете, находится на усмотрении лечащего врача. В общем, однако, дозы, применяемые для лечения взрослых, обычно находятся в пре 003276 10 делах от 2 до 800 мг в сутки, в зависимости от способа введения. Так, для парентерального введения суточная доза обычно находится в пределах 20-100 мг, предпочтительно 60-80 мг в сутки. Для перорального введения суточная доза обычно находится в пределах 200-800 мг, например 400600 мг в сутки. Желаемая доза может быть удобным образом представлена в виде разовой дозы или в виде разделенных общих доз, вводимых через подходящие интервалы, например в виде двух,трех, четырех или более четырех субдоз в сутки. Хотя возможно, для применения в терапии,соединение по изобретению вводить в виде необработанного химического продукта, предпочтительно представить активный ингредиент в виде фармацевтического препарата. Таким образом, далее в изобретении предложен фармацевтический препарат, содержащий соединение формулы (I) или его фармацевтически приемлемую соль или нетоксичные метаболически лабильные сложные эфиры вместе с одним или более чем одним фармацевтически приемлемым носителем и, возможно, другими терапевтическими и/или профилактическими ингредиентами. Носитель(ли) должен быть"приемлемым" в смысле быть совместимым с другими ингредиентами препарата и не вредным для его реципиента. Композиции по изобретению включают в себя композиции в форме, главным образом приготовленной для перорального, трансбуккального, парентерального, ингаляционного или инсуффляционного, имплантационного или ректального введения. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты, например,сироп, аравийская камедь, желатин, сорбит, трагакант, крахмальный клейстер или поливинилпирролидон; наполнители, например, лактозу,сахар, микрокристаллическую целлюлозу, кукурузный крахмал, фосфат кальция или сорбит; смазывающие вещества, например, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители,например, картофельный крахмал или натрийгликолят крахмала, или увлажняющие агенты,такие как лаурилсульфат натрия. Таблетки можно покрывать оболочкой в соответствии со способами, известными в этой области. Пероральные жидкие препараты могут быть в форме,например, водных или масляных суспензий,растворов, эмульсий, сиропов или эликсиров,или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим растворителем перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например, сироп сорбита, метилцеллюлозу, глюкоза/сахарный сироп, желатин, гидро 11 ксиэтилцеллюлозу, карбоксиметилцеллюлозу,гель стеарата алюминия или гидрогенизированные съедобные жиры; эмульгирующие агенты,например, лецитин, сорбитанмоноолеат или аравийскую камедь; неводные растворители(которые могут включать в себя съедобные жиры), например, миндальное масло, фракционированное кокосовое масло, жирные эфиры, пропиленгликоль или этиловый спирт; солюбилизаторы, такие как поверхностно-активные вещества, например полисорбаты или другие агенты,такие как циклодекстрины; и консерванты, например, метил- или пропилпарагидроксибензоат или аскорбиновую кислоту. Композиции могут быть также приготовлены в виде суппозиториев, например содержащих традиционные суппозиторные основы, такие как масло какао или другие глицериды. Для трансбуккального введения композиция может принимать форму таблеток или лепешек, приготовленных традиционным способом. Композиция по данному изобретению может быть приготовлена для парентерального введения путем инъекции или непрерывной инфузии. Препараты для инъекций могут быть представлены в стандартной лекарственной форме в ампулах или упаковках для многократного введения с добавленными консервантами. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляном или водном растворителе, и могут содержать используемые в приготовлении лекарственной формы агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В качестве альтернативы, активный ингредиент может находиться в форме порошка для разведения подходящим растворителем, например стерильной, апирогенной водой, перед применением. Для введения ингаляцией соединения согласно изобретению удобным образом выпускают представленными в форме аэрозоля из упаковки под давлением, с использованием подходящего пропеллента, такого как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, углекислый газ или другие подходящие пропелленты, такие как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, углекислый газ или другие подходящие газы, или из распылителя. В случае аэрозоля под давлением единица дозировки может быть определена снабжением аэрозоля клапаном,выпускающим отмеренное количество. В качестве альтернативы, для введения ингаляцией или инсуффляцией, соединения по изобретению могут принимать форму сухой порошковой композиции, например порошковой смеси соединения и подходящего носителя,такого как лактоза или крахмал. Порошковая композиция может быть представлена в стандартной лекарственной форме, например, в кап 003276 12 сулах или картриджах, например из желатина,или блистерных упаковках, из которых можно вводить порошок при помощи ингалятора или инсуффлятора. Композиция по изобретению может быть также приготовлена в виде депо-препарата. Такие препараты пролонгированного действия могут быть введены путем имплантации (например подкожно или внутримышечно) или внутримышечной инъекции. Так, например, соединения по изобретению могут быть приготовлены в виде препарата с подходящими полимерными или гидрофобными материалами (например в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимых солей. Композиции по изобретению могут содержать от 0,1 до 99% активного ингредиента,удобно от 30 до 95% для таблеток и капсул и от 3 до 50% для жидких препаратов. Энантиомеры соединений общей формулы(I) и их соли могут быть получены общими способами, описанными ниже. В нижеследующем описании группы R, R1, R2, A, Z, Х и Y являются такими, как определены для соединений формулы (I), если не указано иначе. Соединения формулы (I) и их энантиомеры могут быть получены путем циклизации соединения формулы (II), в которой R12 является защитной группой карбоксила, R13 представляет собой атом брома или иода, R14 представляет собой водород или защитную группу азота, с последующим, если необходимо или желательно, удалением одной или более чем одной защитной группы. В одном воплощении этого способа, реакцию можно провести, используя каталитическое количество палладиевого (О) комплекса, такого как тетракис(трифенилфосфин)палладий, и подходящее органическое основание, такое как триалкиламин, например триэтиламин, или неорганическое основание, например карбонат калия. Реакцию удобным образом проводят в апротонном полярном растворителе, таком как ацетонитрил, диметилформамид, или в апротонном неполярном растворителе, таком как углеводород (то есть толуол, ксилол, гексан),при температуре в пределах от 60 до 150 С с последующим, если необходимо или желатель 13 но, удалением защитной группы карбоксила R12 и любой защитной группы R14. В следующем воплощении способа реакцию проводят с использованием каталитического количества соли Pd(II), такой как ацетат палладия или дихлорид палладия, в присутствии подходящего органического основания, такого как триалкиламин, например триэтиламин, и триарилфосфина, такого как трифенилфосфин. Реакцию проводят в апротонном растворителе, таком как ацетонитрил или диметилформамид, и предпочтительно с нагреванием с последующим, если необходимо или желательно,удалением защитной группы карбоксила R12 и любой защитной группы азота R14. Соединения формулы (I), где X-Y является двойной связью, могут быть региоселективно получены путем проведения реакции циклизации в апротонном неполярном растворителе,таком как толуол, в присутствии каталитического количества палладиевого (О) комплекса, такого как тетракис(трифенилфосфин)палладий, и подходящего органического основания, такого как триалкиламин, например триэтиламин, или неорганического основания, например карбоната калия. Соединения формулы (I), где X-Y является одинарной связью, могут быть получены путем проведения реакции циклизации в апротонном полярном растворителе (таком как ацетонитрил,диметилформамид) в присутствии каталитического количества соли Pd(II), такой как ацетат палладия или дихлорид палладия, в присутствии подходящего органического основания, такого как триалкиламин, например триэтиламин, и триарилфосфина, такого как трифенилфосфин. Подходящие защитные группы карбоксилаR12 для использования в этой реакции включают в себя алкильные, такие как этил, трихлоралкил,триалкилсилилалкил, или арилметильные группы, такие как бензил, нитробензил или тритил. Кроме того, пригодными защитными группами карбоксила являются те, которые имеют хиральную группу, производную от хиральных спиртов, таких как (+)-S-инданол, (+)S-метилманделат, хиральный (С 1-4)алкиллактат: то есть (+)-R- или (-)-S-метиллактат, (+)-R-третбутиллактат, (+)-R- или (-)-S-этиллактат, (-)-Sизопропиллактат,(-)-S-бутиллактат,(+)-Rизобутиллактат или хиральный аралкиллактатR12 предпочтительно является этильной, бензильной группой или группой, производной от хирального (С 1-4)алкиллактатного спирта (например(+)-R-трет-бутиллактатный, (-)-S-бутиллактатный,(+)-R-изобутиллактатный спирт). Когда R14 является защитой для азота,примеры подходящих групп включают в себя алкоксикарбонил, например трет-бутоксикар 003276 14 бонил, арилсульфонил, например фенилсульфонил, или 2-триметилсилилэтоксиметил. Соединения формулы (II) могут быть получены из соединения формулы (III), в которойR12 является защитной группой карбоксила, аR14 является водородом или защитной группой азота, как определено в формуле (II), и R13 представляет собой атом брома или иода, путем взаимодействия с подходящим фосфорным реагентом, способным превратить группу СНО в группу с последующим, если необходимо или желательно, удалением защитной группы карбоксилаR12 и защитной группы азота R13. В одном воплощении этого способа реакцию можно проводить, используя фосфор-илид формулы (IV) где R15 является алкильной или фенильной группой. Эту реакцию проводят в апротонном растворителе, таком как ацетонитрил или диметилформамид, при температуре в пределах от -20 С до температуры дефлегмации растворителя. Соединения формулы (III) и (IV) являются либо известными соединениями, либо могут быть получены способами, аналогичными используемым для известных соединений. Удобным способом получения соединений формулы (III) является взаимодействие соединения формулы (V), в которой R12 является защитной группой карбоксила, и R14 является водородом или защитной группой азота, как определено в формуле (II), и R13 представляет собой атом брома или иода, с аллилтригалогенидом олова (VI) с последующей реакцией озонирования. Реакцию удобно проводить в таком растворителе, как углеводород, например толуол,или галогенозамещенный углеводород (например дихлорметан, при температуре в пределах от -78 С до комнатной температуры). Озонирование можно провести путем пропускания потока озона в раствор в присутствии диметилсульфида или трифенилфосфина в под 15 ходящем растворителе, таком как галогеноуглеводород (например дихлорметан) при низкой температуре, например -78 С. В качестве альтернативы, соединения (III) можно получить альдольной реакцией иминосоединения (V) с енольным эфиром (VII), гдеR16 является С 1-4 алкильной группой. Реакцию можно проводить в растворителе,таком как метиленхлорид или ацетонитрил в присутствии кислоты Льюиса, такой как трифлат иттербия. В любой из вышеуказанных реакций защитную группу карбоксила можно удалить традиционными методами, применяемыми для удаления таких групп. Так, соединения, где R12 является бензилом, этил или (+)-R- или (-)-S-третбутиллактатная группа могут быть удалены гидролизом с использованием гидроксида щелочного металла, например гидроксида лития или гидроксида натрия, в подходящем растворителе, таком как этанол или изопропанол, вода или их смеси, с последующим, если желательно или необходимо, добавлением подходящей кислоты, например соляной кислоты, с получением соответствующей свободной карбоновой кислоты. В любой из вышеуказанных реакций защитную группу азота можно удалить традиционными методами, применяемыми для удаления таких групп, например кислотным или основным гидролизом. Так, когда R14 является алкоксикарбонилом, например трет-бутоксикарбонилом или фенилсульфонилом, он может быть удален щелочным гидролизом с использованием, например, гидроксида лития в подходящем растворителе, таком как тетрагидрофуран, или алканол, например изопропанол. В качестве альтернативы, алкоксикарбонильную группу можно удалить кислотным гидролизом. Физиологически приемлемые соли соединений формулы (I) можно получить обработкой соответствующей кислоты подходящим основанием в подходящем растворителе. Например,соль натрия или калия можно получить обработкой раствора соответствующей кислоты соединения формулы (I) 2-этилгексаноатом натрия или калия, гидроксидом щелочного или щелочно-земельного металла, или соответствующим их карбонатом или бикарбонатом. В качестве альтернативы, соли щелочных или щелочноземельных металлов можно получить прямым гидролизом карбоксил-защищенных производных соединений формулы (I) подходящим гидроксидом щелочного или щелочно-земельного металла. Метаболически лабильные сложные эфиры соединений формулы (I) можно получить этерификацией карбоксильной группы кислоты или ее соли или трансэтерификацией, используя традиционные методы. Так, например, ацилок 003276 16 сиалкильные сложные эфиры можно получить путем взаимодействия свободной карбоновой кислоты или ее соли с подходящим ацилоксиалкилгалогенидом в подходящем растворителе,таком как диметилформамид. Для этерификации свободной карбоксильной группы эту реакцию предпочтительно проводят в присутствии четвертичного аммонийгалогенида, такого как хлорид тетрабутиламмония или хлорид бензилтриэтиламмония. Конкретные энантиомеры соединения формулы (I) также могут быть получены из соответствующих рацемических соединений формулы (I), используя метод хиральной ВЭЖХ(высокоэффективной жидкостной хроматографии). В качестве альтернативы, энантиомеры можно получить этерификацией соответствующих рацемических соединений формулы (I) подходящим хиральным спиртом, разделяя образованные в результате диастереомерные сложные эфиры традиционными способами,например хроматографией или кристаллизацией, с последующим гидролизом диастереомерных сложных эфиров. Подходящие хиральные спирты для использования в этом способе включают в себя(-)-S-этиллактат, (-)-S-изопропиллактат, (-)-Sбутиллактат, (+)-R-изобутиллактат или хиральный аралкиллактат (то есть бензиллактат), (-)-Sпериллиловый спирт, (-)-метил-(R)-3-гидрокси 2-метилпропионат, (-)-(R)-2-бутанол, (-)-(S)-2 метил-1-бутанол. Диастереомерные сложные эфиры соединений формулы (I) можно получить традиционными способами, такими как взаимодействие хирального спирта с активированным производным соединения формулы (I) в апротонном растворителе, таком как эфир, например тетрагидрофуран. Активированное производное соединения формулы (I) можно получить из соединений (I),используя традиционные способы получения активированных производных по карбоксильным группам кислот, таких как удобным образом используемые в пептидном синтезе. В частности, удобным способом получения диастереомерных сложных эфиров соединений(I) является получение активированного производного соединений формулы (I) в присутствии хирального спирта. Так, например, рацемическую смесь соединений (I) можно обработать комбинацией реагентов Мицунобу, то есть диалкилазодикарбоксилатом, таким как диэтилазодикарбоксилат, и триарилфосфином, например трифенилфосфином или триалкилфосфином (то есть трибутилфосфином) в присутствии хирального спирта. 17 Реакцию удобно проводить в присутствии подходящего растворителя, такого как эфир(например диэтиловый эфир или тетрагидрофуран), галогеноуглеводород (например дихлорметан) или нитрил (например ацетонитрил) или их смесь, при температуре в пределах от 0-30 С. Требуемый единственный диастереомерный сложный эфир соединений (I) можно получить из их смеси традиционными методами,например используя традиционные хроматографические методы, такие как препаративная ВЭЖХ или фракционная кристаллизация. В качестве альтернативы, требуемый единственный диастереомерный сложный эфир соединения формулы (I) можно получить, используя подходящую хиральную защитную группуR12, как определено в формуле (II). Конкретные энантиомеры соединений формулы (I) могут быть получены из соответствующего единственного диастереомерного сложного эфира соединений (I) с помощью гидролиза, например щелочного гидролиза. Так,например, гидролиз можно проводить, используя гидроксид щелочного металла, например гидроксид натрия или гидроксид лития, в растворителе, таком как эфир, например тетрагидрофуран, и вода. В качестве альтернативы, конкретные энантиомеры соединений формулы (I) можно получить стереоселективным ферментным гидролизом соединений формулы (VIII) где R17 является защитной группой карбоксила. Подходящая защитная группа карбоксилаR17 для использования в этой реакции включает в себя С 1-4 алкил, такой как метил, этил, пропил,бутил, или арилметильные группы, такие как бензил, нитробензил или тритил. Подходящими ферментами для использования в этой реакции являются ферменты липазы, такие как IЛипаза-DS Aspergillus niger (АР 12) (Aspergillus niger, Amano), липаза Candida(Themogen), липаза Е-17 (Thermogen). Кроме того, подходящими ферментами, которые могут быть использованы в этой реакции, являются свиная панкреатическая липаза,альфахимотрипсин или трипсин. Конкретным предпочтительным ферментом для использования в этой реакции являетсяAspergillus niger (АР-12). Покоящиеся клетки следующих организмов также могут быть использованы в этой ре 003276 18 акции Aspergillus ochraceus, Aspergillus niger,Aspergillus chevalieri и Aspergillus cervinus. Реакцию удобно проводить в апротонном растворителе, таком как DMSO, тетрагидрофуран, в присутствии подходящего водного буфера (то есть фосфатного буфера или CaCl2). Если необходимо, солюбилизирующий агент, такой как Твин-80, может быть добавлен к реакционной смеси. В еще одном способе фермент может быть иммобилизован и реакцию проводят, по существу, в "чистых" водонасыщенных органических растворителях, таких как метил-трет-бутиловый эфир или трет-амиловый спирт. С тем, чтобы данное изобретение можно было более полно понять, следующие примеры приведены только в качестве иллюстрации. В промежуточных соединениях и примерах, если не указано иначе: температуры плавления определены с помощью аппарата Gallenkamp и являются неоткорректированными. Все температуры приведены в С. Инфракрасные спектры получены с помощью инфракрасной спектроскопии с преобразованием Фурье. Спектры протонного магнитного резонанса (1 Н-ЯМР) записаны при 400 МГц, химические сдвиги указаны в млн-1 (миллионные доли) вниз (d) от Me4Si, используемого в качестве внутреннего стандарта, и обозначены как синглеты (s), дублеты (d), дублеты дублетов(dd), триплеты (t), квартеты (q) или мультиплеты (m). Колоночную хроматографию проводили на силикагеле (Merck AG Darmstaadt, Germany). Следующие аббревиатуры использованы в тексте: ЕА = этилацетат, СН = циклогексан, DCM = дихлорметан, THF = тетрагидрофуран, TFA = трифторуксусная кислота, TEA = триэтиламин,DMF = диметилформамид, Аc2O = ангидрид уксусной кислоты, РРА = полифосфорная кислота, DBU = 1,8-диазобицикло[5.4.0]ундец-7 ен, DMSO = диметилсульфоксид, IMS = смесь этанола с 5% метанолом, LHDMS = литийбис(триметилсилил)амид, DIPEA = диизопропилэтиламин, Tlc относится к тонкослойной хроматографии на пластинках с диоксидом кремния, и высушенный относится к раствору, высушенному над безводным сульфатом натрия;r.t. (RT) относится к комнатной температуре. Энантиомер А или диастереоизомер А относится к единственному энантиомеру или единственному диастереизомеру соответственно, абсолютная стереохимическая конфигурация которых не была охарактеризована. Промежуточное соединение 1-Этил 2-(5-хлор-2-иоданилино)-4-пентеноат К раствору 2-иод-4-хлоранилина (9,1 г) в сухом толуоле (150 мл) добавляли этилглиоксилат (50% раствор в толуоле, 14,6 мл) и МgSO4 (2 г), и полученную в результате суспензию нагревали с обратным холодильником в течение ночи. Затем ее фильтровали и концентрировали до сухости под глубоким вакуумом при 50 С в те 19 чение 1,5 ч. Полученное в результате коричневое масло растворяли в дихлорметане (150 мл),охлажденном до -78 С, и добавляли шприцемTiCl4 (чистота 99,995%, 4 мл). Суспензию перемешивали 15 мин при -78 С, затем оставляли нагреваться до комнатной температуры в течение 15 мин, перед охлаждением вновь до -78 С. Затем добавляли аллилтрибутилолово (17 мл) и реакции позволяли протекать в течение 1 ч. Черный раствор вливали в 200 мл этилацетата и промывали сначала насыщенным растворомNH4Cl (2 х 150 мл), затем водой и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который очищали колоночной хроматографией (циклогексан, затем циклогексан/этилацетат 98/2) с образованием указанного в заголовке соединения (10.4 г) в виде бесцветного масла. ЯМР (CDCl3)(млн-1) 7,57 (d, 1 Н), 6,49-Этил 2-(5-хлор-2-иоданилино)-4-оксобутаноат Раствор промежуточного соединения 1 (5,2 г) в дихлорметане (150 мл) охлаждали до -78 С и через него барботировали озон до тех пор,пока прозрачный раствор не становился кирпично-красным. В этот момент прерывали ток озона и раствор продували азотом в течение нескольких минут. Добавляли трифенилфосфин(7,1 г) и перемешивание продолжали в течение 1,5 ч без контроля за температурой. Полученный в результате раствор вливали в 200 мл этилацетата и промывали сначала насыщенным раствором NH4Cl (2 х 150 мл), затем водой и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который очищали колоночной хроматографией (циклогексан/этилацетат 80/20) с получением указанного в заголовке соединения (2.4 г) в виде бесцветного масла. ЯМР (DMSO)(млн-1) 9,80 (t, 1 Н), 7,57 (d,1 Н), 6,55 (d, 1H), 6,51 (dd, 1H), 4,99 (d, 1H), 4,46-Этил 2-(3,5-дихлор-2-иоданилино)-4 оксобутаноат Раствор этилглиоксилата (50% раствор в толуоле, 1 мл) и МgSO4 (7 г) в толуоле (30 мл) нагревали с обратным холодильником в аппарате Дина-Старка в течение 0,5 ч. Затем добавляли 3,5-хлор-2-иоданилин и смесь нагревали с обратным холодильником в течение 1 ч. Затем смесь охлаждали, фильтровали через целит для удаления MgSO4 и концентрировали. Полученное в результате коричневое масло растворяли в дихлорметане (15 мл), охлажденном до -78 С, и добавляли Yb(ОТf)3 хН 2O (0,186 г). Суспензию перемешивали в течение 5 мин при -78 С, затем 20 добавляли винилокситриметилсилан (0,29 г) и температуру повышали до 20 С. Через час при этой температуре добавляли насыщенный раствор NH4Cl (20 см 3) и затем этилацетат (30 мл). Органическую фазу промывали рассолом (20 мл) и сушили над сульфатом натрия, и концентрировали с получением неочищенного продукта, который очищали колоночной хроматографиейN,N,N1N1-Тетраметилэтилендиамин (23,3 мл) добавляли к раствору N-фенилпирролидинона (5 г) в дихлорметане (50 мл). Раствор охлаждали до 0-5 С и добавляли триметилсилилтрифлат (8,4 мл) за приблизительно 20 мин, поддерживая температуру в пределах 05 С. Полученный в результате раствор перемешивали в течение 10 мин и добавляли раствор пербромида пиридинийбромида (13 г) в ацетонитриле (20 мл) за приблизительно 20 мин, поддерживая температуру в пределах 0-10 С. Полученную в результате суспензию перемешивали при 0-5 С в течение приблизительно 60 мин. Осторожно добавляли водный раствор бикарбоната натрия (50 мл). Смесь перемешивали в течение приблизительно 5 мин и слои разделяли. Водную фазу разбавляли водой (20 мл) и экстрагировали обратно дихлорметаном (20 мл). Объединенные органические фазы промывали далее раствором натрия бикарбоната (50 мл), 2 М соляной кислотой (2 х 50 мл) и водой (50 мл),обратно экстрагируя каждую промывку дихлорметаном (10 мл). Органический раствор сушили (МgSO4) и концентрировали на роторном испарителе. Красное/коричневое твердое вещество перемешивали с этилацетатом (50 мл) и подогревали с получением раствора, который затем охлаждали, и добавляли трибутилфосфин(8,5 мл). Раствор нагревали до температуры дефлегмации и выдерживали при температуре дефлегмации в течение 2,5 ч. Раствор оставляли охлаждаться до комнатной температуры и затем охлаждали до 0-5 С. Полученную в результате суспензию выдерживали при 0-5 С в течение приблизительно 60 мин. Продукт отделяли вакуум-фильтрацией и затем промывали смесью этилацетат: бутилметиловый эфир (1:1, 40 мл) и сушили под вакуумом при 45 С с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (10,12 г), температура плавления 127-128 С. Промежуточное соединение 4-Z-Этил 2-(5-хлор-2-иоданилино)-4-(2-оксо-1-фенил-3-пирролидинилиден)бутаноат (4 б) К раствору промежуточного соединения 2(2,4 г) в ацетонитриле (100 мл) при комнатной температуре добавляли промежуточное соединение 3 (3,7 г) и DBU (13 мл) и перемешивание продолжали в течение ночи при -20 С. Неочищенный раствор вливали в 200 мл этилацетата и промывали насыщенным раствором NH4Cl (2 х 150 мл), затем водой и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта в виде 4/1 смеси 4 а/4 б соединений. После очистки колоночной хроматографией (циклогексан/этилацетат 80/20) были получены указанные в заголовке 4 а (2,16 г) и 4 б(1R)-2-(трет-бутокси)-1-метил-2-оксоэтил-2-(5 хлор-2-иоданилино)-4-пентеноат (5 б) Раствор промежуточного соединения 1 трет-бутил-(R)-2(оксоацетокси)-2-метилацетата(4,1 г) в толуоле (200 мл) нагревали с обратным холодильником в аппарате Дина-Старка в течение 2 ч. После охлаждения до комнатной температуры добавляли 5-хлор-2-иоданилин (4,3 г), и раствор нагревали с обратным холодильником в присутствии MgSO4 в течение 3 ч. Прозрачный раствор охлаждали, фильтровали через хлопок для удаления MgSO4, концентрировали до сухости и вновь растворяли в дихлорметане (150 мг). Раствор охлаждали до -78 С и добавляли медленно из шприца TiCl4 (1,9 мл). Через 15 мин добавляли аллилтрибутилолово (7,9 мл) и полученную в результате черную суспензию перемешивали в течение 1 ч. Затем ее вливали в этилацетат (300 мл) и добавляли насыщенныйNH4Cl (150 мл). Органическую фазу отделяли,промывали водой и рассолом, сушили и концентрировали. После заключительной очистки колоночной хроматографией (циклогексан/этилацетат 95/5) получали указанное в заголовке соединение (4,1 г) (65/35 смесь диастереомеров) в виде бесцветного масла (7,01 г). ЯМР (CDCl3)(млн-1) 7,54 (1H), 6,46 (dd,1H), 5,86 (m, 1H), 5,3-5,2 (m, 2H), 5,03 (m, 1H),4,77 (шир.d, 1H), 4,16 (m, 1H), 2,8-2,68 (m, 2H),1,50 (d, 3 Н), 1,45(s, 9H). Промежуточное соединение 5 аSnCl4 в DCM (10 мл) при -78 С. Смесь перемешивали в течение 20 мин, затем добавляли промежуточное соединение трет-бутиловый эфир 2[2-(5-хлор-2-иод-фенилимино)-ацетокси]-1-(R)метилуксусной кислоты (2,39 г) в сухом DCM(50 мл). Реакции позволяли идти при -78 С в течение 20 мин, затем добавляли насыщенный раствор NH4Cl и полученную в результате смесь экстрагировали этилацетатом (2 х 200 мл). Органический слой промывали раствором KF 10% в воде, затем добавляли диэтиловый эфир и полученное в результате твердое вещество отфильтровывали. Раствор сушили и выпаривали под вакуумом. После заключительной очистки флэшхроматографией (СН/ЕА 95:5) получали указанное в заголовке соединение как чистый диастереомер в виде бесцветного масла (1,3 г). ЯМР (CDCl3): 7,55 (d, 1H); 6,47 (d, 1H); 6,43 (d, 1H); 5,88 (m, 1H); 5,27 (m, 2 Н); 5,05 (q,1H); 4,78 (d, 1H); 4,18 (m, 1H); 2,74 (m, 2H); 1,52(1R)-2-(трет-бутокси)-1-метил-2-оксоэтил-2-(5 хлор-2-иоданилино)-4-оксобутаноат (6 б) Раствор промежуточного соединения 5 (7,1 г) в дихлорметане (200 мл) охлаждали до -78 С и через него барботировали озон до тех пор,пока раствор не становился красным. Добавляли трифенилфосфин (8 г) и реакционную смесь оставляли при перемешивании в течение 2 ч без контроля за температурой. Неочищенную смесь выпаривали до сухости и очищали несколько раз колоночной хроматографией (циклогексан/этилацетат 85/15) с получением указанного в заголовке соединений 6 а (2,75 г) и 6 б (0,87 г) в виде бесцветных масел. Соединение 6 а: ЯМР (CDCl3)(млн-1) 9,85 (t, 1H), 7,57 (d,1H), 6,58 (d, 1H), 6,51 (dd, 1H), 5,04 (q, 1H), 4,96 23 Указанное в заголовке соединение получали, начиная с промежуточного соединения 5 а,следуя методу, описанному для промежуточного соединения 6. Промежуточное соединение 7(Е)-(1R)-2-(трет-бутокси)-1-метил-2 оксоэтил 2-(5-хлор-2-иоданилино)-4-(2-оксо-1 фенил-3-пирролидинилиден)бутаноат (диастереоизомер А) К раствору промежуточного соединения 6 а(2,7 г) в ацетонитриле (60 мл) добавляли 26 (3 г) и DBU (1 мл) и в этой смеси проходила реакция при -20 С в течение ночи. 3 атем смесь растворяли этилацетатом (300 мл) и промывали 1 н.HCl, водой и рассолом, сушили и концентрировали. После заключительной очистки колоночной хроматографией (циклогексан/этилацетат 85/15) получали указанное в заголовке соединение (2,1 г) в виде белого твердого вещества. Температура плавления 36-39 С, []D 22[1-(R)-(1-трет-бутоксикарбонил)]этиловый эфир (-)7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолин-2 карбоновой кислоты (8 б) К раствору промежуточного соединения 7(2,1 г) в DMF (40 мл) добавляли Pd(PPh3)4 (0,393 г) и триэтиламин (0,95 мл) и смесь нагревали до 150 С в течение 1 ч. Неочищенный раствор растворяли этилацетатом и промывали 1 н HCl,водой и рассолом, сушили и выпаривали. После заключительной очистки колоночной хроматографией (циклогексан/дихлорметан/этилацетат 50/40/10) получали указанное в заголовке соединение 8 а (0,7 г) в виде белого твердого вещества; Температура плавления = 69-73 С(q, 1H), 4,49 (m, 2 Н), 4,02 (m, 1H), 3,87 (m, 1H),2,44 (m, 1H), 2,00 (m, 1H), 1,39 (s, 9H), 1,38 (d,3 Н). ИK(Hyйoл)(cм-1) 3380, 1741, 1681, 1601; и указанное в заголовке соединение 8 б (0,8 г) в виде желтого твердого вещества; Температура плавления = 59-64 С-Е-Этил 2-(5-хлор-2-иоданилино)-4-(2 оксо-1-фенилпиперидинилиден)бутаноат К раствору трибутил-3-(1-фенил-2-пиперидинон)фосфонийбромида (0,83 г) в ацетонитриле (20 мл) добавляли DBU (0,27 мл) и через 15 мин раствор промежуточного соединения 2(0,35 г) в ацетонитриле (20 мл). Реакционную смесь перемешивали в течение 30 мин, затем разбавляли этилацетатом и промывали 1 н. раствором HCl и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который очищали колоночной флэш-хроматографией с получением указанного в заголовке соединения (0,29 г) в виде бледно-желтой пены. ЯМР (CDCl3)(млн-1) 7,56 (dd, 1H), 7,38(0,22 мл) и через 10 мин раствор промежуточного соединения 2 (0,46 г) в ацетонитриле (10 мл). Реакционную смесь перемешивали в течение 3 ч, затем разбавляли этилацетатом и промывали насыщенным раствором NH4Cl и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который очищали колоночной флэш-хроматографией с получением указанного в заголовке соединения-Z-Этил 2-(3,5-дихлор-2-иоданилино)-4-(2 оксо-1-фенил-3-пирролидинилиден)бутаноат (11 б) К раствору промежуточного соединения 2 а в ацетонитриле (10 мл) при комнатной температуре добавляли 2 б (0,726 г) и DBU (0,33 мл) и перемешивание продолжали в течение ночи при-20 С. Неочищенный раствор вливали в 20 мл этилацетата и промывали сначала насыщенным раствором NH4Cl (2 х 15 мл), затем водой и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта в виде 4/1 смеси Z/E-изомеров. После очистки колоночной хроматографией (циклогексан/этилацетат 85/15) получали указанное в заголовке соединение 11 а (0,498 г) и указанное в заголовке соединение 11 б (0,122 г) в виде бесцветных масел. Промежуточное соединение 11 а-(1R)-2-(трет-бутокси)-1-метил-2-оксоэтил 2(5-хлор-2-иоданилино)-4-(2-оксо-1-фенил-3-пирролидинилиден)бутаноат (диастереоизомер Б) К раствору промежуточного соединения 6 б(0,87 г) в ацетонитриле (20 мл) добавляли трибутил-3-(N-фенил-1-пирролидонил)фосфонийбромид (1,6 г) и DBU (0,33 мл) и в этой смеси проходила реакция при -20 С в течение ночи. Ее затем растворяли этилацетатом (100 мл) и промывали 1 н. HCl, водой и рассолом, сушили и концентрировали. После заключительной очистки колоночной хроматографией (циклогексан/этилацетат 85/15) получали указанное в заголовке соединение (0.47 г) в виде белого твердого масла. Температура плавления = 38-42 С ЯМР (CDCl3)(млн-1) 7,72 (d, 2H), 7,55 (d,1H), 7,38 (t, 2H), 7,16 (t, 1H), 6,60 (m, 1H), 6,56(диастереоизомер Б) К раствору промежуточного соединения 12(0,46 г) в DMF (8 мл) добавляли Pd(PPh3)4 (0,043 г) и триэтиламин (0,21 мл) и смесь нагревали до 150 С в течение 1 ч. Неочищенный раствор растворяли этилацетатом и промывали 1 н, HCl,водой и рассолом, сушили и выпаривали. После заключительной очистки колоночной хроматографией (циклогексан/дихлорметан/этилацетат 50/40/10) получали указанное в заголовке соединение (0,441 г) в виде белого твердого вещества. Температура плавления = 62-67 С ЯМР (DMSO)(млн-1) 7,79 (m, 2 Н), 7,38 26 2,4-дибром-N-(4-трет-бутоксикарбониламино)фенил-бутирамид К производному 2,4-дибромбутирилбромиду (3,1 г) в сухом дихлорметане (60 мл) добавляли пиридин (3,2 мл), смесь оставляли при 0 С в атмосфере азота на 10 мин и затем по каплям добавляли N-трет-бутоксикарбонил-1,4 фенилендиамин (2,08 г). Через 1 ч смесь вливали в насыщенный раствор NH4Cl (200 мл), экстрагировали ЕА (3 х 150 мл) и органическую фазу промывали рассолом (200 мл), сушили и концентрировали под вакуумом, неочищенное вещество очищали флэш-хроматографией (элюируя СН/ЕА 80:20) с получением указанного в заголовке соединения в виде желтой пены (3,5 г). Tlc СН/ЕА 8:2, Rf = 0,53. 1H-ЯМР: 7,89 (sa); 7,44 (d); 7,35 (d); 6,46 (sa); 4,66 (dd); 3,60 (m); 2,76 (m); 2,55 (m); 1,51 (s). Промежуточное соединение 15 3-бром-1-4-(трет-бутоксикарбониламино) фенил-2-оксопирролидин К раствору промежуточного соединения 14(3,5 г) в сухом охлажденном (0 С) THF (50 мл) по каплям добавляли раствор LHMDS (9,6 мл 1 М раствора в тетрагидрофуране). Смесь перемешивали в атмосфере азота в течение 2 ч, пока температура не достигла комнатной. Затем ее быстро охлаждали в насыщенном раствореNH4Cl (200 мл), экстрагировали ЕА (3 х 150 мл) и органические экстракты промывали рассолом(+/-)-Z-Этил 2-(5-хлор-2-иоданилино)-4-(2 оксо-1-(4-трет-бутоксикарбониламино)фенилпирролидин-3-илиден)бутаноат Раствор промежуточного соединения 15(2,6 г) в сухом DMF (100 мл) и трибутилфосфин нагревали с обратным холодильником при 110 С в атмосфере азота в течение 4 ч, до окончания реакции (Tlc). Смесь концентрировали под вакуумом с получением неочищенного 1-(4 трет-бутоксикарбониламино)фенил-2-оксопирролидин-3-ил-трибутилфосфонийбромида(100 мл), охлаждали при -30 С и перемешивали в атмосфере азота, после чего добавляли DBU(0,44 мл) и промежуточное соединение 2 (1,0 г). Смесь перемешивали в течение 1 ч, затем вливали в насыщенный раствор NH4Cl (200 мл),экстрагировали ЕА (3 х 150 мл) и органические экстракты промывали рассолом (200 мл), сушили и концентрировали под вакуумом с получением желтого масла, которое очищали флэшхроматографией (элюируя СН/ЕА 80:20) с получением указанного в заголовке соединения(0,085 г) в виде белого твердого вещества.DBU (0,1 мл) и через 10 мин раствор бензилового эфира (+/-)-2-(5-хлор-2-иод-фениламино)-4 оксо-масляной кислоты (0,1 г) в ацетонитриле (2 мл). Реакционную смесь перемешивали в течение 1,5 ч, затем разбавляли этилацетатом и промывали 1 н. раствором HCl и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который очищали колоночной флэш-хроматографией с получением указанного в заголовке соединения-Бензил 7-хлор-4-(2,5-диоксо-1-фенилимидазолидин-4-илиден)-1,2,3,4-тетрагидро-2 хинолинкарбоксилат К раствору промежуточного соединения 17(0,065 г) в DMF (5 мл) добавляли Pd(PPh3)4 (16 мг) и TEA (0,05 мл) и полученный в результате раствор нагревали до 110 С в течение 1 ч. Неочищенный раствор вливали в этилацетат и промывали 1 н. HCl и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который очищали колоночной флэш-хроматографией с получением указанного в заголовке соединения (0,015 г) в виде желтого порошка. Температура плавления более 220 С ЯМР (DMSO)(млн-1) 10,5 (s, 1H), 7,5-7,2(3,7 г) в THF/H2O добавляли OsO4 4% в Н 2O (4 мл). Черную суспензию затем обрабатывали порциями NalO4 (10,5 г). Через 5 ч, раствор растворяли этилацетатом (2 х 50 мл) и промывали водой (2 х 50 мл). 28 Органическую фазу выпаривали под вакуумом и неочищенную смесь очищали флэш-хроматографией (СН/ЕА 1:1) с получением изобутилового эфира 2-(2-оксоацетокси)-1-(R)-метилуксусной кислоты в виде бесцветного масла (3 г). 24,8 г Изобутилового эфира 2-(2-оксоацетокси)-1-(R)-метилуксусной кислоты растворяли в толуоле (1000 мл) и нагревали с обратным холодильником в аппарате Дина-Старка в течение 2 ч. После охлаждения до комнатной температуры, добавляли 5-хлор-2-иод-анилин(22 г), и раствор нагревали с обратным холодильником в присутствии MgSO4 в течение 3 ч. Прозрачный раствор охлаждали, фильтровали через хлопок для удаления MgSO4, концентрировали до сухости с получением указанного в заголовке соединения (38 г) в виде желтого масла. ЯМР (CDCl3)(млн-1) 7,83 (1 Н, d), 7,79 (s,1H), 7,02 (dd, 1 Н), 6,96 (d, 1H), 5,373 (q, 1H),4,00 (m, 2H), 2,00 (m, 1H), 1,67 (d, 3 Н), 0,96 (2d,6H). ИК(СDCl3): 1749, 1730. Промежуточное соединение 20 1-Изобутоксикарбонил-1(R)-метилметиловый эфир 2-(5-хлор-2-иод-фениламино)4-оксомасляной кислоты (20 а и 20 б) Раствор промежуточного соединения 19(38 г) в толуоле (1 мл) охлаждали до -20 С и добавляли Yb(ОТf)3 (16,5 г) и через несколько минут добавляли по каплям винилокситриметилсилан (12,5 г), растворенный в толуоле (50 мл). Убирали баню и реакционную смесь оставляли перемешиваться в течение 2 ч. Неочищенную смесь растворяли этилацетатом (500 мл) и органическую фазу промывали насыщенным раствором хлорида аммония (300 мл) и выпаривали. Затем смесь очищали колоночной хроматографией (циклогексан/этилацетат 85/15) с получением указанных в заголовке соединений 20 а (14 г) и 20 б (4 г) в виде бесцветных масел. Промежуточное соединение 20 а ЯМР (CDCl3)(млн-1) 9,85 (s, 1H), 7,57 (d,1H), 6,58 (d, 1H), 6,51 (dd, 1H), 5,19 (m, 1H), 4,97(d, 1H), 4,57 (m, 1H), 3,92 (m, 2H), 3,11 (m, 2H); 1,92 (m, 1H); 1,50(d, 3H), 0,90(d, 6H). ИК (CDCl3) (см-1) 3375, 1734. Промежуточное соединение 21 1-Изобутоксикарбонил-1(R)-метилметиловый эфир (Е)-2-(5-хлор-2-иод-фениламино)4-(2-оксо-1-фенилпирролидин-3-илиден)-масляной кислоты К раствору промежуточного соединения 3DBU (4,43 мл) при комнатной температуре и смесь перемешивали в течение 10 мин. Смесь затем охлаждали при -25 С и добавляли промежуточное соединение 31 а (12,98 г) в 60 мл СН 3 СN за 15 мин по каплям. После этого реакционную смесь перемешивали при этой температуре в течение 2 ч. Затем смесь растворяли этилацетатом (100 мл) и органическую фазу промывали насыщенным раствором NH4Cl (150 мл), и HCl 2% (200 мл), и рассолом (2 х 200 мл). Раствор затем сушили и концентрировали. После заключительной очистки колоночной хроматографией[1-(R)-Метил-1-изобутоксикарбонил]-метиловый эфир 7-хлор-4-(2-оксо-1-фенилпирролидин-3-илиден)-1,2,3,4-тетрагидрохинолин 2-карбоновой кислоты (диастереоизомер А) К раствору промежуточного соединения 21Pd(PPh3)4 (3,52 г) и триэтиламин (5,1 мл) и смесь нагревали до 110 С в течение 3,5 ч. Неочищенный раствор растворяли этилацетатом (600 мл) и промывали NH4Cl и рассолом, сушили и выпаривали. После очистки колоночной хроматографией (циклогексан/дихлорметан/этилацетат 6,5/3/0,5) получали указанное в заголовке соединение (6,08 г) в виде желтой пены. ЯМР (DMSO)(млн-1) 7,71 (d, 2H), 7,35 (t,2H), 7,20 (d, 1H), 7,11 (t, 1H), 7,00 (s, 1H), 6,74[1-(R)-Метил-1-изобутоксикарбонил]метиловый эфир 7-хлор-4-(2-оксо-1-фенил-2,5 дигидро-1 Н-пиррол-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты К раствору промежуточного соединения 22(0,340 г) и триэтиламин (2 мл) и смесь нагревали до 110 С в течение 2 ч. Неочищенный раствор растворяли этилацетатом (2 х 200 мл) и промывали NН 4 Сl и рассолом, сушили и выпаривали. После заключительной очистки колоночной хроматографией (циклогексан/дихлорметан/этилацетат 6,5/3/0,5) получали указанное в заголовке соединение (1,289 г) в виде желтой пены. ЯМР (DMSO)(млн-1) 7,79 (d, 2 Н), 7,38 (t,2 Н), 7,11 (t, 1H), 6,79 (d, 1H), 6,57 (d, 1H), 6,74 30 4,49 (m, 2H); 4,06 (m, 1H); 3,92-3,82 (m, 3 Н); 2,45 (m, 1H); 2,019 (m, 1H); 1,84 (m, 1H); 1,42 (d,3 Н); 0,84 (d, 6H). ИК (Нуйол): 3375, 1749, 1683. Промежуточное соединение 24 1-н-Бутоксикарбонил-1(S)-метил-метиловый эфир 2-(3,5-дихлор-2-иод-фениламино)-4 оксомасляной кислоты (24 а и 24 б) К раствору промежуточного соединения 1 н-бутоксикарбонил-1-(S)-метил-метиловому эфиру акриловой кислоты (4,9 г) в THF/H2O(100 мл, 2/1) добавляли OsO4 4% в Н 2 О (2,8 г). Черную суспензию затем обрабатывали порциями NalO4 (13 г). Через 5 ч раствор растворяли этилацетатом (2 х 50 мл) и промывали водой(2 х 50 мл). Органическую фазу выпаривали под вакуумом и неочищенную смесь очищали флэшхроматографией (СН/ЕА 1:1) с получением нбутилового эфира 2-(2-оксоацетокси)-1-(S)метил-уксусной кислоты в виде бесцветного масла (4,85 г), (2,5 г) которого растворяли в толуоле (200 мл) и нагревали с обратным холодильником в аппарате Дина-Старка в течение 2 ч. После охлаждения до комнатной температуры добавляли 3,5-дихлор-2-иоданилина (2,46 г) и раствор нагревали с обратным холодильником в присутствии MgSO4 в течение 3 ч. Прозрачный раствор охлаждали, фильтровали через хлопок для удаления MgSO4, концентрировали до сухости с получением н-бутилового эфира 2-[2-(5 хлор-2-иод-фенилимино)ацетокси]-1-(S)метилуксусной кислоты (4 г) в виде желтого масла. Раствор такого желтого масла в СН 3 СN (70 мл) охлаждали до -30 С и добавляли Yb(OTf)3(2,1 г), и через несколько минут добавляли по каплям винилокситриметилсилан (1,1 г), растворенный в СН 3 СN (20 мл). Реакционную смесь перемешивали в течение 10 мин. Неочищенную смесь растворяли этилацетатом (500 мл) и органическую фазу промывали насыщенным раствором хлорида аммония (2 х 50 мл) и выпаривали. Затем смесь очищали колоночной хроматографией (циклогексан/этилацетат 90/10) с получением указанных в заголовке соединений 24 а (1,4 г) и 24 б (0,7 г) в виде бесцветных масел. Промежуточное соединение 24 а ЯМР (CDCl3)(млн-1) 9,84 (t, 1 Н), 6,92 (d,1H); 6,45 (d, 1 Н); 5,33 (da, 1H); 5,17 (q, 1H); 4,60 31 1-н-Бутоксикарбонил-1-(S)-метил-метиловый эфир (Е)-2-(3,5-дихлор-2-иод-фениламино)4-(2-оксо-1-фенил-пирролидин-3-илиден)-масляной кислоты (диастереоизомер А) К раствору промежуточного соединения 2 а(0,25 мл) при комнатной температуре и смесь перемешивали в течение 10 мин. Затем смесь охлаждали при -25 С и добавляли промежуточное соединение 6 б (0,8 г) в 10 мл СН 3 СN по каплям за 15 мин. Затем реакционную смесь перемешивали при этой температуре в течение 30 мин. Затем смесь растворяли этилацетатом (50 мл) и органическую фазу промывали насыщенным раствором NH4Cl (50 мл), и HCl 2% (10 мл),и рассолом (2 х 20 мл). Затем раствор сушили и концентрировали. После заключительной очистки колоночной хроматографией (циклогексан/этилацетат 8/2) получали указанное в заголовке соединение (0,734 г) в виде белой пены. ЯМР (СDСl3)(млн-1) 7,72 (d; 2H); 7;39 (t,2H); 7,17 (t, 1H); 6,92 (d, 1H); 6,60 (m, 1H); 6,43[1-(S)-Метил-1-н-бутоксикарбонил]-метиловый эфир 5,7-дихлор-4-(2-оксо-1-фенил-2,5 дигидро-1 Н-пиррол-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты (26 а), [1-(S)метил-1-н-бутоксикарбонил]-метиловый эфир 5,7-дихлор-4-(2-оксо-1-фенил-пирролидин-3 илиден)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты (26 б) К раствору промежуточного соединения 25Pd(OAc)2 (0,110 г) и триэтиламин (0,37 г), и смесь нагревали до 120 С в течение 3 ч. Неочищенный раствор растворяли этилацетатом (1000 мл) и промывали NH4Cl и рассолом, сушили и выпаривали. После заключительной очистки колоночной хроматографией (циклогексан/дихлорметан/этилацетат 7/2,5/0,5) получали указанное в заголовке соединение 26 а (0,35 г) и 26 б-7-Хлор-4-(1-фенил-3-пирролин-2-он 3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоксилат натрия К раствору из примера 31 а (540 мг) в IMS(5% метанол в абсолютном этаноле, 7 мл) добавляли NaOH (1 н, 1,4 мл) и перемешивание продолжали в течение 2 ч. Полученный в результате раствор сушили на роторном испарителе и полученное в результате твердое вещество растирали в порошок с диэтиловым эфиром. После фильтрации и сушки получали указанное в заголовке соединение (440 мг) в виде беловатого порошка. Температура плавления более 200 С. ЯМР (DMSO)(млн-1) 7,80 (m, 2H), 7,39(-)-7-Хлор-4-(1-фенил-3-пирролин-2-он-3 ил)-1,2,3,4-тетрагидро-хинолин-2-карбоксилат натрия К раствору промежуточного соединения 8 аLiOH (65 мг) и перемешивание продолжали в течение 1 ч. Полученный в результате раствор концентрировали до сухости, растворяли этилацетатом и добавляли 1 н. HCl. После энергичного перемешивания органическую фазу отделяли, промывали водой и рассолом и концентрировали. Полученное в результате твердое вещество растворяли в THF (15 мл) и обрабатывали этилгексаноатом натрия (232 мг) в течение 30 мин. После сушки полученное в результате твердое вещество растирали в порошок с горячим диэтиловым эфиром и фильтровали с получением указанного в заголовке соединения (160 мг) в виде белого твердого вещества. э.и.(энантиомерный избыток)=99%[]D =-102,3 (с=0,09% мас./об. в DMSO) Температура плавления более 200 С. ЯМР (DMSO)(млн-1) 7,80 (m, 2H), 7,39 33 К раствору промежуточного соединения 9(0,2 г) в DMF (5 мл) добавляли Рd(РРh3)4 (41 мг) и TEA (0,1 мл) и полученный в результате раствор нагревали до 110 С в течение 2 ч. Неочищенный раствор вливали в этилацетат и промывали 1 н. раствором HCl и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который очищали колоночной флэш-хроматографией с получением указанного в заголовке соединения 3 а(0,055 г) в виде бледно-желтого порошка Температура плавления = 99-101 С ЯМР (DMSO)(млн-1) 7,4-7,2 (m, 5H), 7,01-Этил 7-хлор-4-(2-оксо-1-(пиридин-3 ил)-пирролидин-3-илиден)-1,2,3,4-тетрагидро-2 хинолинкарбоксилат (4 б) К раствору из примера 3 (0,47 г) в DMF (20 мл) добавляли Pd(PPh3)4 (100 мг) и TEA (0,38 мл) и полученный в результате раствор нагревали до 110 С в течение 1,5 ч. Неочищенный раствор вливали в этилацетат и промывали насыщенным раствором NH4Cl и рассолом. Органическую фазу сушили и концентрировали с получением неочищенной смеси, которую растворяли в этилацетате (2 мл) и обрабатывали керосином (2 мл), твердое вещество отфильтровывали с получением указанного в заголовке соединения 4 а (0,08 г) в виде белого порошка. Температура плавления = 132-134 С ЯМР (DMSO)(млн-1) 8,99 (d, 1H), 8,32(dd, 1H), 8,21 (m, 1H), 7,41 (dd, 1 Н), 6,80 (d, 1H),6,77 (m, 1H), 6,75 (d, 1H), 6,47 (dd, 1H), 6,45 (m,1H), 4,56 (m, 1H), 4,50 (m, 1H), 4,2-4,02 (m, 2H),3,99 (m, 1H), 3,81 (t, 1H), 2,31 (m, 1H), 1,97 (m,1H), 1,18(t, 3H). ИK(Hyйoл)(cм-1) 3391, 1728, 1679 Маточную жидкость очищали флэшхроматографией с получением продукта, который растирали в порошок в циклогексане, с получением указанного в заголовке соединения 4 б-Этил 5,7-дихлор-4-(1-фенил-3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2 карбоксилат К раствору промежуточного соединения 11 а (0,430 г) в DMF (10 мл) добавляли Pd(OAc)2(11,6 мг) и TEA (0,12 г), и полученный в результате раствор нагревали до 130 С в течение 2 ч. Неочищенный раствор вливали в 20 мл этилацетата и промывали сначала насыщенным раствором NH4Cl (2 х 15 мл), затем водой и рассолом. Органическую фазу сушили Na2SO4 и концентрировали с получением неочищенного продукта. После очистки колоночной хроматографией(0,087 г) в виде беловатого твердого вещества. ЯМР (DMSO)(млн-1) 7,81 (m, 2H), 7,40(+/-)-Этил 7-хлор-4-(1-(4-трет-бутоксикарбониламино)-фенил-3-пирролин-2-он-3-ил)1,2,3,4-тетрагидрохинолин-2-карбоксилат Раствор промежуточного соединения 16(0,085 г) в сухом DMF (5 мл) перемешивали в присутствии TEA (0,018 мл) и Pd(OAc)2 (0,0015 г) в атмосфере азота при 110 С в течение 1 ч. Смесь разбавляли насыщенным водным раствором хлорида аммония (100 мл) и ЕА (100 мл); органический слой промывали рассолом (100 мл), сушили и концентрировали под вакуумом. Неочищенную смесь очищали флэшхроматографией (элюируя СН/ЕА 8:2) с получением указанного в заголовке соединения в виде желтого твердого вещества (0,050 г).(+/-)-Этил 7-хлор-4-(1-(4-амино)-фенил-3 пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоксилат К раствору из примера 6 (0,070 г) в этилацетате (35 мл) добавляли концентрированнуюHCl (2,0 мл). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 1 ч. Смесь вливали в насыщенный водный раствор NaHCO3 (100 мл) и экстрагировали ЕА (200 мл); органический слой сушили и концентрировали под вакуумом. Неочищенную смесь очищали флэш-хроматографией (элюируя СН/ЕА 35 1:1) с получением указанного в заголовке соединения в виде желтого твердого вещества(+/-)-Этил 7-xлop-4-(1-(4-aцeтилaмино)фeнил-3-пиppoлин-2-oн-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоксилат К раствору из примера 7 (0,030 г) в сухом пиридине (1 мл) добавляли Ас 2 О (0,012 мл). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 30 мин. Смесь вливали в насыщенный водный раствор NH4Cl(50 мл) и экстрагировали ЕА (50 мл); органический слой сушили и концентрировали под вакуумом. Неочищенную смесь растирали в порошок с ЕА с получением указанного в заголовке соединения в виде белого твердого вещества(+/-)-Этил 7-хлор-4-(1-(4-метансульфониламино)-фенил-3-пирролин-2-он-3-ил)-1,2,3,4 тетрагидрохинолин-2-карбоксилат К раствору из примера 7 (0,040 г) в сухом СН 2 Сl2 (10 мл) добавляли DIPEA (0,021 мл) и СН 3SO2 Сl (0,008 мл). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 1 ч. Смесь вливали в насыщенный водный раствор NH4Cl (50 мл) и экстрагировали ЕА (50 мл), органический слой сушили и концентрировали под вакуумом. Неочищенную смесь очищали флэш-хроматографией (элюируя СН/ЕА(1:1 с получением указанного в заголовке соединения в виде желтого твердого вещества-1,2,3,4-тетрагидро-2-хинолинкарбоксилат Раствор промежуточного соединения 16(1,02 г) в сухом DMF (100 мл) перемешивали в присутствии TEA (0,018 мл) и Pd(PPh3)4 (0,184 г) в атмосфере азота при 110 С в течение 2 ч до окончания реакции (Tlc). Смесь разбавляли на 003276 36 сыщенным водным раствором хлорида аммония(100 мл) и ЕА (200 мл); органический слой промывали рассолом (200 мл), сушили и концентрировали под вакуумом. Неочищенную смесь очищали флэш-хроматографией(+)-Этил 7-хлор-4-(2-оксо-1-(4-амино)фенилпирролидин-3-илиден)-1,2,3,4-тетрагидро-2 хинолинкарбоксилат К раствору из примера 10 (0,280 г) в этилацетате (100 мл) добавляли концентрированнуюHCl (9,5 мл). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 1 ч до окончания реакции (Tlc). Смесь вливали в насыщенный водный раствор NаНСО 3 (100 мл) и экстрагировали ЕА (200 мл); органический слой сушили и концентрировали под вакуумом. Неочищенную смесь растирали в порошок с СН/ЕА 1:1 с получением указанного в заголовке соединения в виде желтого твердого вещества(+)-Этил 7-хлор-4-(2-оксо-1-(4-ацетиламино)-фенилпирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат К раствору промежуточного соединения 19 в сухом пиридине (1 мл) добавляли Аc2O (0,010 мл). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 30 мин. Смесь вливали в насыщенный водный растворNH4Cl (50 мл) и экстрагировали ЕА (50 мл); органический слой сушили и концентрировали под вакуумом. Неочищенную смесь растирали в порошок с ЕА с получением указанного в заголовке соединения в виде желтого твердого вещества (0,027 г).-1,2,3,4-тетрагидро-2-хинолинкарбоксилат К раствору из примера 12 (0,040 г) в сухом 37 комнатной температуре в атмосфере азота в течение 1 ч (Tlc). Смесь вливали в насыщенный водный раствор NH4Cl (50 мл) и экстрагировали ЕА (50 мл), органический слой сушили и концентрировали под вакуумом. Неочищенная смесь кристаллизовалась в СН/ЕА 1:1 с получением указанного в заголовке соединения в виде желтого твердого вещества (0,023 г).(+/-)-7-Хлор-4-(1-(3-пиридин)-3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2 карбоксилат натрия К раствору из примера 4 а (70 мг) в IMS(5% метанол в этаноле) (10 мл) добавляли 1 н раствор NaOH (0,18 мл) и реакционную смесь перемешивали в течение 1,5 ч. Растворитель выпаривали и неочищенный продукт сначала растирали в порошок в метаноле/этилацетате 0,5 мл/2 мл, затем в изопропиловом спирте (3 мл) с получением указанного в заголовке соединения(40 мг) в виде бледно-желтого твердого вещества. Температура плавления более 220 С. ЯМР (DMSO)(млн-1) 8,98 (d, 1H), 8,31(+/-)-7-Xлор-4-(1-фенил-3-5,6-дигидропиридин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин 2-карбоксилат натрия К раствору из примера 3 а (80 мг) в IMS(5% метанол в этаноле) (6 мл) добавляли 0,1 н раствор NaOH (2,9 мл) и реакционную смесь перемешивали в течение 1 ч. Раствор вливали в этилацетат и промывали 1 н. раствором HCl и рассолом. Органическую фазу сушили Na2SO4 и концентрировали с получением неочищенного кислого соединения. Последнее суспендировали в этилацетате (2 мл) и добавляли 2 этилгексаноат натрия (35 мг), получая раствор. Добавляли диэтиловый эфир (4 мл) и керосин (3 мл) для осаждения указанного в заголовке соединения (42 мг) в виде белого твердого вещества. Температура плавления более 163-166 С ЯМР (DMSO)(млн-1) 7,4-7,34 (m, 4H),7,19 (m, 1H), 6,72 (d, 1H), 6,67 (d, 1 Н), 6,32 (d,1H), 6,32 (dd, 1H), 5,71 (t, 1H), 5,64 (s, 1H), 3,96(+/-)-5,7-Дихлор-4-(1-фенил-3-пирролин 2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоксилат натрия К раствору из примера 5 (87 мг) в IMS (5% метанол в абсолютном этаноле, 5 мл) добавлялиNaOH (1 н, 0,22 мл) и перемешивание продолжали в течение 3 ч. Полученный в результате раствор сушили на роторном испарителе и полученное в результате твердое вещество растирали в порошок с диэтиловым эфиром. После фильтрации и сушки получали указанное в заголовке соединение (78 мг) в виде беловатого твердого вещества. ЯМР (DMSO)(млн-1) 7,80 (m, 2H), 7,38 (t,2H), 7,10 (t, 1H), 6,82 (d, 1H), 6,46 (d, 1H), 6,37(+)-7-Xлop-4-(1-фeнил-3-пиppoлин-2-oн 3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоксилат натрия Способ А К раствору промежуточного соединения 13(11 мг) и перемешивание продолжали в течение 1 ч. Полученный в результате раствор концентрировали до сухости, растворяли этилацетатом и добавляли 1 н. HCl. После энергичного перемешивания органическую фазу отделяли, промывали водой и рассолом и концентрировали. Полученное в результате твердое вещество растворяли в THF (15 мл) и обрабатывали этилгексаноатом натрия (39 мг) в течение 30 мин. После сушки полученное в результате твердое вещество растирали в порошок с горячим диэтиловым эфиром и отфильтровывали с получением указанного в заголовке соединения (69 мг) в виде белого твердого вещества. э.и.=98%[]D=92,5 (с=0,420% мас./об. в DMSO) Температура плавления более 200 С. ЯМР (DMSO)(млн-1) 7,80 (m, 2 Н), 7,39(+/-)-7-Xлop-4-(1-(4-aцeтилaминo)-фeнил 3-пиppoлин-2-oн-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновая кислота К раствору из примера 8 (0,023 г) в IMS (5 мл) добавляли NaOH (0,150 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. 39 Смесь вливали в раствор 6 н. HCl (50 мл) и экстрагировали ЕА (50 мл), органический слой промывали рассолом (30 мл), сушили и концентрировали под вакуумом. Неочищенную смесь растирали в порошок с EtO2 с получением указанного в заголовке соединения в виде желтого твердого вещества (0,019 г).(+/-)-7-Хлор-4-(1-метансульфониламино)фенил-3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновая кислота К раствору из примера 9 (0,027 г) в IMS (5 мл) добавляли NaOH (0,142 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь вливали в раствор 6 н. НСl (50 мл) и экстрагировали ЕА (50 мл), органический слой промывали рассолом (30 мл), сушили и концентрировали под вакуумом. Неочищенная смесь кристаллизовалась в СН/ЕА 1:1 с получением указанного в заголовке соединения в виде желтого твердого вещества (0,015 г).-7-Хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия К раствору из примера 31 б (540 мг) в IMS(5% метанол в абсолютном этаноле, 7 мл) добавляли NaOH (1 н, 1,4 мл) и перемешивание продолжали в течение 2 ч. Полученную в результате суспензию фильтровали и твердое вещество промывали небольшими порциями диэтилового эфира. После сушки получали указанное в заголовке соединение (450 мг) в виде желтого твердого вещества. Температура плавления более 200 С. ЯМР (DMSO)(млн-1) 7,74 (d, 2H), 7,37 (t,2H), 7,11 (t, 1H), 7,12 (d,1H), 6,77 (d, 1H), 6,38(-)-7-Хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия Способ А К раствору промежуточного соединения 8 б 40 течение 1 ч. Полученный в результате раствор концентрировали до сухости, растворяли этилацетатом и добавляли 1 н. HCl. После энергичного перемешивания органическую фазу отделяли, промывали водой и рассолом и концентрировали. Полученное в результате твердое вещество растворяли в THF (15 мл) и обрабатывали этилгексаноатом натрия (265 мг) в течение 30 мин. После сушки полученное в результате твердое вещество растирали в порошок с горячим диэтиловым эфиром и фильтровали с получением указанного в заголовке соединения (400 мг) в виде желтого твердого вещества. э.и.=88,8%[]D=603,7 (с=0,316% мас./об. в DMSO) Температура плавления более 200 С. ЯМР (DMSO)(млн-1) 7,74 (d, 2 Н), 7,37 (t,2 Н), 7,11 (t, 1H), 7,12 (d, 1H), 6,77 (d, 1H), 6,38(dd, 1H), 6,13 (шир.s, 1H), 4,48 (dd, 1H), 3,78 (m,2H), 3,2-3,4 (m, 2H), 2,90 (m, 1H), 1,98 (m, 1H). ИК (Нуйол)(см-1) 3425, 1666, 1592. Способ Б К раствору из примера 27 (3,18 г) в IMS(5% метанол в этаноле) (100 мл) добавляли 1 н. раствор NaOH (8,64 мл): натриевая соль выпадала в осадок через 5 мин. К полученной в результате суспензии добавляли диэтиловый эфир(50 мл) и твердое вещество отфильтровывали. Раствор выпаривали и полученное твердое вещество смешивали с предыдущим и растирали в порошок с диэтиловым эфиром с получением указанной в заголовке натриевой соли (3,2 г) в виде желтого твердого вещества. Температура плавления более 200 С. ЯМР (DMSO)(млн-1) 7,74 (d, 2H), 7,37 (t,2H), 7,11 (t, 1H); 7,11 (d,1H); 6,76 (d, 1H); 6,38AP12) суспендировали в 650 мл 100 мМ раствора хлорида кальция в реакторе с перемешиванием. Суспензию охлаждали до 15 С. 50 г соединения из примера 31 б затем растворяли в диметилсульфоксиде (350 мл) и этот раствор добавляли в реактор. Затем реактор нагревали до 37 С и смесь перемешивали в течение 24 ч. Температуру реактора затем снижали до 20 С и в реактор медленно добавляли 1 л 0,2 М соляной кислоты. Затем реактор освобождали и к реакционной смеси добавляли 50 г вспомогательного порошка для фильтрования (Dicalite). Смесь затем фильтровали и осадок после фильтрации перед сушкой промывали водой. 20 г образца высушенного осадка после фильтрации диспергировали в 390 мл метил-третбутилового эфира и добавляли 10 мл 2 М соляной кислоты. Все это перемешивали в течение 3 41 ч и фильтровали, осадок после фильтрации промывали 100 мл метил-трет-бутилового эфира. Продукт обратно экстрагировали из метилтрет-бутилового эфира в 500 мл 0,05 М раствора гидроксида натрия. Затем водный слой отделяли, подкисляли 6 мл 5 М соляной кислоты и продукт экстрагировали 500 мл этилацетата. Этилацетат удаляли выпариванием и остаток растворяли в IMS (80 мл). Указанное в заголовке соединение идентифицировали в этом растворе при помощи количественной ВЭЖХ следующим образом: 0,5 Мл реакционной смеси разбавляли в 2 мл DMSO и смешивали до растворения. 5 Мкл этого раствора далее разбавляли 1 мл подвижной фазы (70% ацетонитрил в 20 мМ ацетате аммония рН 3,0), колонка: Spherisorb C6 50 х 4,6 мм, скорость потока: 1 мл/мин, детекция: УФпоглощение при 254 нм, объем введения: 10 мкл, время удерживания: 0,8 мин. Раствор разбавляли до 96 мл IMS и перемешивали во время добавления по каплям 10 мл 1 М гидроксида натрия за 15 мин. Добавляли 40 мл диэтилового эфира за 10 мин и перемешивание продолжали в течение 1 ч. Затем смесь помещали в холодильник на 1 ч и продукт отфильтровывали, промывали 50 мл холодного диэтилового эфира перед сушкой в течение ночи под вакуумом с получением указанного в заголовке соединения (3,3 г). ВЭЖХ-анализы: указанное в заголовке соединение растворяли в DMSO в количестве 1 мг/мл. 10 Мкл этого раствора разбавляли в 990 мкл подвижной фазы. Колонка: Phenomenex Luna Phenyl hexyl 150 х 4,6 мм, объем введения: 50 мкл, время удерживания: 3,4 мин. Пример 22.-7-Хлор-4-(2-оксо-1-(пиридин-3-ил)пирролидин-3-илиден)-1,2,3,4-тетрагидро-2 хинолинкарбоксилат натрия К раствору из примера 4 б (55 мг) в IMS(5% метанол в этаноле) (10 мл) добавляли 1 н. раствор NaOH (0,145 мл) и реакционную смесь перемешивали в течение 1,5 ч. Растворитель выпаривали и неочищенный продукт растирали в порошок в 2 мл этилацетата с получением указанного в заголовке соединения (38 мг) в виде желтого твердого вещества. Температура плавления более 200 С. ЯМР (DMSO)(млн-1) 8,96 (d, 1H), 8,32-7-Хлор-4-(2-оксо-1-фенил-3-пиперидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновая кислота К раствору из примера 3 б (48 мг) в IMS 42 раствор NaOH (1,2 мл) и реакционную смесь перемешивали в течение 2,5 ч. Раствор вливали в этилацетат и промывали 1 н. раствором HCl и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта, который растирали в порошок в этилацетате/керосине 2 мл/5 мл, с получением указанного в заголовке соединения (14 мг) в виде желтого твердого вещества. Температура плавления более 130-133 С. ЯМР (DMSO)(млн-1) 12,64 (s, 1H), 7,38-7-Хлор-4-(2,5-диоксо-1-фенилимидазолидин-4-илиден)-1,2,3,4-тетрагидро-2 хинолинкарбоновая кислота К раствору промежуточного соединения 18(10 мг) в CH2Cl2 (5 мл) добавляли 1 М раствор ВСl3 в гексане (0,1 мл) при -78 С и реакционную смесь перемешивали в течение 1,5 ч, поддерживая температуру между -20 и -10 С. Раствор вливали в этилацетат и промывали 3 н. раствором HCl и рассолом. Органическую фазу сушили Na2SO4 и концентрировали с получением неочищенного продукта, который растирали в порошок в диэтиловом эфире/керосине (1 мл/3 мл), с получением указанного в заголовке соединения (6 мг) в виде желтого твердого вещества. Температура плавления более 190 С (разложение). ЯМР (DMSO)(млн-1) 12,75 (шир.s, 1 Н),10,50 (шир.s, 1 Н), 7,50-7,39 (m, 6 Н), 6,99 (шир.s,1 Н), 6,76 (d, 1 Н), 6,57 (dd, 1 Н), 4,15 (m, 1 Н), 3,77(+/-)-7-Хлор-4-(2-оксо-1-(4-ацетиламино)фенил-пирролидин-3-илиден)-1,2,3,4 тетрагидро-2-хинолинкарбоновая кислота К раствору из примера 12 (0,027 мг) вTHF/H2O (3:1) (10 мл) добавляли LiOH (0,010 г). Смесь перемешивали при комнатной температуре в течение 1 ч. Смесь вливали в насыщенный водный раствор NH4Cl (50 мл) и экстрагировали ЕА (50 мл), органический слой промывали рассолом (30 мл), сушили и концентрировали под вакуумом. Неочищенную смесь растирали с ЕА с получением указанного в заголовке соединения в виде желтого твердого вещества(+/-)-7-Хлор-4-(2-оксо-1-(4-метансульфониламино)фенил-пирролидин-3-илиден)-1,2,3,4 тетрагидро-2-хинолинкарбоновая кислота К раствору из примера 13 (0,023 мг) в IMS(5 мл) добавляли NaOH (0,120 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь вливали в раствор 6 н. HCl (50 мл) и экстрагировали ЕА (50 мл), органический слой промывали рассолом (30 мл), сушили и концентрировали под вакуумом. Неочищенную смесь хроматографировали с Et2O с получением указанного в заголовке соединения в виде желтого твердого вещества (0,007 г).(m), 2,9 (s). Пример 27. 7-Хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновая кислота (энантиомер А) К раствору промежуточного соединения 22(6,2 г) в THF/H2O (100 мл, 3/1) при комнатной температуре добавляли LiOH (1 г) и перемешивание продолжали в течение 1 ч. THF выпаривали и добавляли Н 2 О (100 мл). Полученный в результате раствор промывали диэтиловым эфиром (2 х 50 мл). Водную фазу подкисляли до рН=4 10% HCl и продукт экстрагировали этилацетатом (2 х 100 мл). Органическую фазу промывали водой и рассолом, сушили и выпаривали с получением указанного в заголовке соединения (4.2 г) в виде желтого твердого вещества. Температура плавления более 200 С ЯМР (DMSO)(млн-1) 12,62 (шир.s, 1 Н); 7,72 (d, 2H), 7,38 (t, 2H), 7,20 (d, 1 Н), 7,13 (t, 1 Н),6,86 (d, 1H), 6,74 (d, 1 Н), 6,54 (dd, 1H), 4,06 (m,1H), 3,86-3,68 (m, 3H), 3,3 (m, 1H), 3,18-2,88 (m,2H). ИК (Нуйол) (см-1) 3356, 1724. Пример 28. 7-Xлop-4-(2-oкco-1-фeнил-3-пиppoлин-2oн-3-ил)-1,2,3,4-тeтpaгидpoхинолин-2-карбоновая кислота, (энантиомер А) К раствору промежуточного соединения 10(1,289 г) в THF/H2O (30 мл, 3/1) при комнатной температуре добавляли LiOH (0,24 г) и перемешивание продолжали в течение 1 ч. THF выпаривали и добавляли Н 2O (80 мл). Полученный в результате раствор промывали диэтиловым эфиром (2 х 50 мл). Водную фазу подкисляли до рН=4 10% HCl и продукт отфильтровывали и промывали водой (10 мл). Продукт сушили под вакуумом при 60 С в течение 12 ч с получением 0,734 г в виде белого твердого вещества. Температура плавления: 190 С э.и.: 100%(s, 1 Н); 4,46 (m, 1H), 3,82-3,79 (m, 2H), 2,34 (m,1H); 1,92 (m, 1H). ИК (Нуйол): 3356, 1724. Пример 29. 5,7-Дихлор-4-(2-оксо-1-фенил-3-пирролин-2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2 карбоксилат натрия, (энантиомер А) К раствору промежуточного соединения 26 а (0,35 г) в THF/H2O (10 мл, 3/1) при комнатной температуре добавляли LiOH (0,06 г) и перемешивание продолжали в течение 30 мин.THF выпаривали и добавляли Н 2O (5 мл). Полученный в результате раствор промывали диэтиловым эфиром (2 х 50 мл). Водную фазу подкисляли до рН=4 10% HCl и продукт отфильтровывали и сушили под вакуумом при 60 С в течение 12 ч с получением указанного в заголовке соединения (0,134 г) в виде белого твердого вещества. Твердое вещество растворяли в IMS (5% метанол в этаноле) (10 мл) и добавляли 1 н. раствор NaOH (0,33 мл). К полученной суспензии добавляли диэтиловый эфир (10 мл) и твердое вещество отфильтровывали, промывали диэтиловым эфиром (10 мл) и сушили под вакуумом в течение 12 ч с получением указанного в заголовке соединения (0,082 г) в виде белого твердого вещества. Температура плавления более 220 С ЯМР (D2O)(млн-1) 7,49 (d, 2H); 7,40 (t,2H); 7,23 (t, 1H); 6,74 (d, 1H); 6,70 (d, 1H); 6,51(m, 1H); 4,40-4,35 (m, 2H); 4,11 (m, 1H), 3,53 (dd,1H); 2,18 (m, 1H); 1,74(td, 1H). Колонка для ВЭЖХ: Cyclobond I, R, SHydroxypropyl ether 25 см х 4,6 мм; Подвижная фаза: Метанол=50 20 мМ ацетатно-аммониевый буфер рН 5 = 50% по объему; скорость потока: 1 мл/мин; время удерживания: 12 мин. Пример 30. 5,7-Дихлор-4-(2-оксо-1-(фенил)пирролидин-3-илиден)-1,2,3,4-тетрагидро-2 хинолин-карбоксилат натрия (энантиомер А) К раствору промежуточного соединения 26 б (0,052 г) в THF/H2O (4 мл, 3/1) при комнатной температуре добавляли LiOH (0,01 г) и перемешивание продолжали в течение 30 мин.THF выпаривали и добавляли H2O (2 мл). Полученный в результате раствор промывали диэтиловым эфиром (2 х 50 мл). Водную фазу подкисляли до рН=4 10% HCl и продукт отфильтровывали и промывали водой (10 мл) и сушили под вакуумом при 60 С в течение 12 ч с получением 5,7-дихлор-4-(2-оксо-1-(пиридин-3-ил)-пирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолин карбоновой кислоты 0,033 г в виде желтого твердого вещества. 45 Твердое вещество растворяли в IMS (5% метанол в этаноле) (5 мл) и добавляли 1 н. раствор NaOH (0,08 мл). Через 5 мин растворитель выпаривали и твердое вещество растирали в порошок с диэтиловым эфиром (5 мл), отфильтровывали, сушили под вакуумом в течение 12 часов с получением указанного в заголовке соединения (0.01 г) в виде желтого твердого вещества. Температура плавления более 200 С ЯМР (DMSO)(млн-1) 7,74 (d, 2 Н); 7,39 (t,2 Н); 7,15 (t, 1H); 6,76 (d, 1H); 6,51 (d, 1H); 6,20-Этил 7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат (31 б) К раствору промежуточного соединения 4(2,2 г) в DMF (50 мл) добавляли Pd(PPh3)4 (244 мг) и TEA (1,2 мл) и полученный в результате раствор нагревали до 110 С в течение 2 ч. Неочищенный раствор вливали в 200 мл этилацетата и промывали сначала насыщенным раствором NН 4 Сl (2 х 150 мл), затем водой и рассолом. Органическую фазу сушили и концентрировали с получением неочищенного продукта. После очистки колоночной хроматографией (циклогексан/дихлорметан/этилацетат 50/40/10) Rf=0,41 получали указанное в заголовке соединение 31 а (540 мг) в виде беловатого твердого вещества; Температура плавления = 150-153 С ЯМР (DMSO)(млн-1) 7,80 (m, 2 Н), 7,39(475 мг) Rf=0,29 в виде желтого твердого вещества. Температура плавления = 152-156 С ЯМР (DMSO)(млн-1) 7,72 (m, 2H), 7,39-Этил 7-хлор-4-1-(фенил-3-пирролин 2-он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоксилат К раствору промежуточного соединения 4 а 46 110 С в течение 2 ч, затем разбавляли насыщенным раствором NH4Cl и экстрагировали этилацетатом (2 х 10 мл). Растворитель выпаривали и неочищенное вещество очищали флэш-хроматографией (Циклогексан/ЕА 8:2) с получением указанного в заголовке соединения в виде белого твердого вещества (40 мг). Пример 31 б-Этил 7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат К раствору промежуточного соединения 4 б(248 мл), трифенилфосфин (7,4 г) и PdCl2 (2,52 г). Полученный в результате раствор подогревали до 110 С и перемешивали в течение 2 ч. Суспензию охлаждали до 20-25 С и добавляли толуол (2,6 мл). Реакционную смесь промывали 8% NH4Cl(3 х 5,2 л) и водой (5,2 л). Органический слой фильтровали через целитовую набивку и промывали толуолом (1 л); затем его перегоняли под вакуумом (Т=50 С; Р=60 мбар (6 х 103 Па до достижения объема 6,3 л. После охлаждения до Т=20-25 С добавляли каплями изооктан (5,2 л) за 30 мин. Осадок перемешивали в течение 2 ч 30 мин, затем его отфильтровывали и промывали смесью толуол/изооктан 1/1 (1,85 л). Желтое твердое вещество сушили под вакуумом при Т=40 С в течение 18 ч с получением указанного в заголовке соединения в виде 210 г желтого твердого вещества. Температура плавления = 160-162 С ЯМР (DMSO): 7,72 (m, 2 Н); 7,39 (m, 2 Н); 7,20 (d, 2H); 7,15 (m, 2H); 6,96 (dd, 1H); 6,74 (d,1H); 6,57 (dd, 1H); 4,29 (dd, 1H); 4,21 (m, 1H),4,02 (m, 1H); 3,93 (m, 1H), 3,82 (m, 1H); 3,69 (m,1H); 3,20 (m, 1H), 2,92 (m, 2H);. 2,92 (m, 2H); 0,93 (t, 3 Н). Фармацевтические примеры А. Капсулы/Таблетки Активный ингредиент Крахмал 1500 Микрокристаллическая целлюлоза Натрийкросскармеллоза Стеарат магния Активный ингредиент смешивают с другими эксципиентами. Смесь может быть использована для заполнения желатиновых капсул или спрессована с получением таблеток с использованием подходящих пуансонов. Таблетки можно покрыть оболочкой, используя традиционные методики и покрытия. Б. Таблетки Активный ингредиент Лактоза Микрокристаллическая целлюлоза Повидон Натрийкросскармеллоза Стеарат магния Активный ингредиент смешивают с лактозой, микрокристаллической целлюлозой и частью натрий-кросскармеллозы. Смесь гранулируют с повидоном, после диспергирования в подходящем растворителе (то есть воде). Гранулы после сушки и измельчения смешивают с остальными эксципиентами. Смесь может быть спрессована с использованием подходящих пуансонов, и таблетки могут быть покрыты оболочкой с использованием традиционных методик и покрытий. В. Болюс Активный ингредиент 0,1-32 мг/мл Фосфат натрия 1,0-50,0 мг/мл Вода для инъекций сколько требуется до 1 мл 48 Характерные результаты, полученные для соединений по изобретению, вводимых перорально, приведены в следующей таблице: ПримерED50 (мг/кг, перорально) 21 0,14 17 0,3 2 0,03 Не наблюдалось никаких неблагоприятных воздействий, когда соединения по изобретению вводили мышам в фармакологически активных дозах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) Препарат можно упаковывать в стеклянные ампулы или флаконы или шприцы с резиновой пробкой и пластмассовой/металлической закаткой (только флаконы). Г. Инфузии Активный ингредиент 5% декстроза для инъекций 0,01-3,2 мг/мл сколько требуется до 100 мл Препарат можно упаковывать в стеклянные флаконы или пластмассовую упаковку. Сродство соединения по изобретению к стрихнин-нечувствительному сайту связывания глицина определяли, используя методику Kishimoto H. et al J. Значения pki, полученные для характерных соединений по изобретению, приведены в следующей таблице: Пример 1 14 15 16 17 18 19 21 22 24 25 30 29 8,7 Способность соединений по изобретению подавлять боль у мышей оценивалась в формалиновом тесте, как описано у Dubuisson andDennis (Pain, 1977, 4:161-174). В этом тесте 20 мкл 1% формалина вводили путем инъекции в подошвенную поверхность левой задней лапы мыши. Промежуток времени, в секундах, в течение которого животные лизали инъецированную лапу в течение первых 5 мин (ранняя фаза) и затем от 20 до 60 мин (поздняя фаза) после введения формалина, служил для измерения интенсивности боли. Соединения по изобретению вводили перорально за 1 ч до инъекции формалина. Из этих результатов, доза, требуемая для сокращения времени лизания на 50%, выраженная в мг/кг, обозначена как величина ED50. или его соль, или нетоксичные метаболически лабильные сложные эфиры,где Y представляет собой атом углерода,Z представляет собой группу СН, которая связана с группой Y посредством двойной связи, а Х представляет собой СН илиZ представляет собой метилен или NR11, aX представляет собой атом углерода, связанный с группой Y посредством двойной связи,А представляет собой С 1-2 алкиленовую цепь, которая может быть замещена одной или двумя группами, выбранными из С 1-6 алкила,возможно замещенного гидрокси, амино, С 1-4 алкиламино или С 1-4 диалкиламино, или может быть замещена группой =O,R представляет собой атом галогена или С 14 алкильную группу,R1 представляет собой атом водорода, атом галогена или С 1-4 алкильную группу,R2 представляет собой фенил, который может быть замещен группами в количестве до 3,выбранными из галогена, водорода илиR2 представляет собой 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота,или 6-членную гетероарильную группу, содержащую от 1 до 3 атомов азота,R4 представляет собой аминогруппу, гидроксильную или С 1-4 алкоксигруппу,R5 и R6, каждый независимо, представляет собой водород или С 1-4 алкильную группу или R5 и R6 вместе с атомом азота, к которому они присоединены, представляют собой насыщенную 57-членную гетероциклическую группу, возможно содержащую дополнительный гетероатом,выбранный из кислорода, серы или азота,R7 представляет собой атом водорода или С 1-4 алкил, С 1-4 алкокси или фенил, 49R8 представляет собой водород или С 1-4 алкильную группу,R9 представляет собой водород, возможно замещенный С 1-4 алкил (возможно замещенный одной или более чем одной гидроксигруппой,карбоксильной и аминогруппой), фенил,R11 представляет собой водород или С 1-4 алкильную группу,R10 представляет собой водород, С 1-4 алкил или защитную группу азота,n равно нулю или целому числу от 1 до 2. 2. Соединение по п.1, где R представляет собой хлор, a R1 представляет собой водород или атом хлора. 3. Соединение по п.1 или 2, где А представляет собой цепь, выбранную из -СН 2-, (СН 2)2- или С=O. 4. Соединение по любому из пп.1-3, где Z представляет собой группу СН, которая связана с группой Y посредством двойной связи, метиленовую группу или группу NH. 5. Соединение по любому из пп.1-4, где R2 представляет собой группу, выбранную из фенила (возможно замещенного ацетиламино, метансульфониламино) или 3-пиридила. 6. Соединение по любому из пп.1-5, где R2 представляет собой фенил. 7. Соединение по любому из пп.1-6, где А представляет собой цепь, выбранную из -СН 2-, (СН 2)2-, а Z представляет собой группу СН, которая связана с группой Y посредством двойной связи, или метиленовую группу или А представляет собой С=O, a Z представляет собой группу NH, R представляет собой хлор, R1 представляет собой хлор или водород, a R2 представляет собой фенил (возможно замещенный ацетиламино или метансульфониламино) или 3 пиридил. 8. Соединение по п.1, представляющее собой 7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту, ее физиологически приемлемые соли или нетоксичные метаболически лабильные сложные эфиры. 9. Соединение по п.1, представляющее собой 7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия. 10. Соединение по п.1, представляющее собой (-)7-хлор-4-(2-оксо-1-фенил-3-пирролидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилат натрия. 11. Соединение по п.1, представляющее собой 7-хлор-4-(1-фенил-3-пирролин-2-он-3 ил)-1,2,3,4-тетрагидро-2-хинолинкарбоновую кислоту, ее физиологически приемлемые соли или нетоксичные метаболически лабильные сложные эфиры. 12. Соединение по п.1, представляющее собой 7-хлор-4-(1-фенил-3-пирролин-2-он-3 003276-7-хлор-4-(1-(3-пиридин)-3-пирролин-2-он 3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,-7-xлop-4-(1-фeнил-3-5,6-дигидpoпиpидин-2-oн-3-ил)-1,2,3,4-тетрагидрохинолин-2 карбоновой кислоты,-5,7-дихлор-4-(1-фенил-3-пирролин-2 он-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,(+/-)-7-xлop-4-(1-(4-aцeтилaминo)-1-фeнил 3-пиppoлин-2-oн-3-ил)-1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты,(+/-)7-xлop-4-(1-(4-мeтaнcyльфoнилaминo)1-фeнил-3-пиppoлин-2-oн-3-ил)-1,2,3,4 тетрагидрохинолин-2-карбоновой кислоты,-7-хлор-4-(2-оксо-1-фенил-3-пиперидинилиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,-7-хлор-4-(2,5-диоксо-1-фенилимидазолидин-4-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,-7-хлор-4-(2-оксо-1-(пиридин-3-ил)-пирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоксилата,-7-хлор-4-(2-оксо-1-(4-ацетиламино)фенилпирролидин-3-илиден)-1,2,3,4 тетрагидро-2-хинолинкарбоновой кислоты,7-хлор-4-(2-оксо-1-(4-метансульфониламино)фенилпирролидин-3-илиден)-1,2,3,4 тетрагидро-2-хинолинкарбоновой кислоты,5,7-дихлор-4-(2-оксо-1-(фенил)-пирролидин-3-илиден)-1,2,3,4-тетрагидро-2-хинолинкарбоновой кислоты,5,7-диxлop-4-(2-oкco-1-фeнил-3-пиppoлин-2-oн-3-ил)-1,2,3,4-тeтpaгидpoхинолин-2 карбоновой кислоты и их физиологически приемлемых солей(например натриевых солей), нетоксичных метаболически лабильных сложных эфиров или энантиомеров. 16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-15 в смеси с одним или более чем одним физиологически приемлемым носителем или эксципиентом. 17. Способ получения соединений по любому из пп.1-15, при котором осуществляют циклизацию соединения формулы (II), в которой R, R1, R2, A, X, Y, Z имеют значения, определенные в п.1, a R12 представляет собой защитную группу карбоксила, R13 представляет собой атом брома или иода, R14 представляет собой водород или защитную группу азота(1) удаляют защитную группу,(2) выделяют соединение в виде его соли,(3) превращают соединение формулы (I) или его соль в его метаболически лабильный сложный эфир,(4) разделяют соединение формулы (I) или его производное на его энантиомеры. после чего, если необходимо или желательно,осуществляют одну или более чем одну из следующих стадий, на которых:
МПК / Метки
МПК: C07D 401/04, A61K 31/4709, A61P 25/28, C07D 401/14
Метки: производные, глицина, антагонистов, качестве, тетрагидрохинолина
Код ссылки
<a href="https://eas.patents.su/27-3276-proizvodnye-tetragidrohinolina-v-kachestve-antagonistov-glicina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тетрагидрохинолина в качестве антагонистов глицина</a>
Предыдущий патент: Ароматические амиды, способ их получения и их применение в качестве лекарственных средств
Следующий патент: Сложный эфир-ингибитор spla2
Случайный патент: Яйцесборочный транспортер































