Тиеноазепиновые производные в качестве антагонистов вазопрессина.
Номер патента: 1427
Опубликовано: 26.02.2001
Формула / Реферат
1. Тиеноазепиновые производные общей формулы I

где E-Y выбраны из радикалов -СН=СН-, -СН2-СН2- и
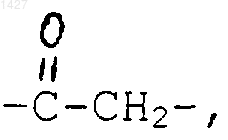
R1 выбран из водорода и галогена;
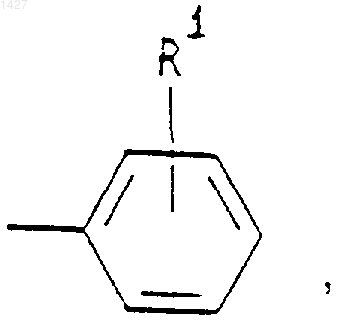
R3 представляет собой -СОАr, где Аr представляет собой радикал, выбранный из группы, включающей
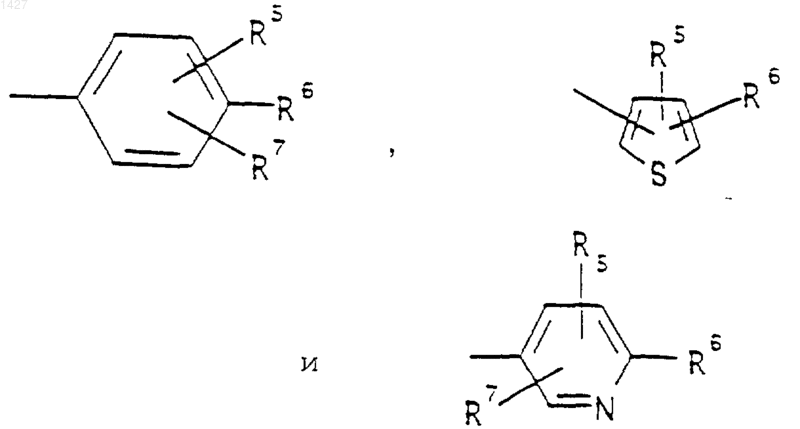
R5 выбран из водорода, (C1-С3)алкила, (C1-С3)алкокси и галогена; R6 выбран из (а) радикалов формул:
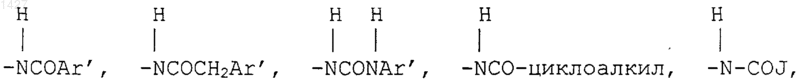
где J представляет
Ar' выбран из радикалов формул
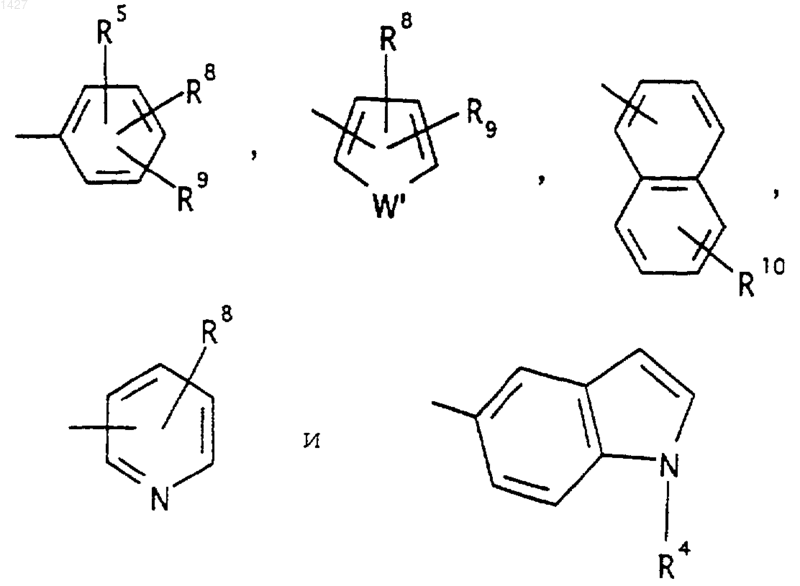
где W' выбран из О или S;
(b) радикала формулы -M-Rd ,
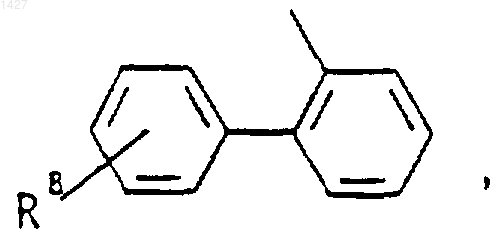
где Rd представляет собой алкил(С3-С8) или -(CH2)p-циклоалкил(С3-C6), когда М представляет собой О, и Rd представляет собой
когда М представляет собой связь;
R7 выбран из водорода и галогена; R8 и R9 независимо выбраны из водорода, алкила (C1-С3), -S-алкила (C1-С3), галогена, -NH-алкила (C1-С3), -N-[алкила (C1-С3)]2, -ОСF3, -NO2, -NH2, -O-алкила (C1-С3); R10 выбран из водорода, галогена и -O-алкила (C1-С3), и их фармацевтически приемлемые соли.
2. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил) карбонил]фенил]-3,4-дихлорбензамид.
3. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2-хлорбензолацетамид.
4. Соединение по п.1, представляющее собой N-[4-[(5,6,7, 8-тетрагидро-4Н-тиено [3,2-b] азепин-4-ил)карбонил]фенил]-2-метилбензамид.
5. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2-фуранкарбоксамид.
6. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-4-трет-бутилбензамид.
7. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-4-(н-бутил)бензамид.
8. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-3-метил-2-тиофенкарбоксамид.
9. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2,5-диметилбензамид.
10. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2,5-дихлорбензамид.
11. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2,3-диметилбензамид.
12. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2,4-диметилбензамид.
13. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]бензолацетамид.
14. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2-метилбензолацетамид.
15. Соединение по п.1, представляющее собой N-[4-[(5,6,7, 8-тетрагидро-4Н-тиено [3,2-b]азепин-4-ил)карбонил]фенил]-2,4-дихлорбензамид.
16. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-3-циклогексенкарбоксамид.
17. Соединение по п.1, представляющее собой 2,4-дихлор-N-[4-[(2-хлор-5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]бензамид.
18. Соединение по п.1, представляющее собой N-[4-[(2-хлор-5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-3-фтор-2-метилбензамид.
19. Соединение по п.1, представляющее собой N-[4-[(2-хлор-5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2,6-дихлорбензамид.
20. Соединение по п.1, представляющее собой N-[4-[(2-хлор-5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2-метилбензамид.
21. Соединение по п.1, представляющее собой N-[4-[(2-хлор-5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2-хлорбензолацетамид.
22. Соединение по п.1, представляющее собой N-[4-[(2-хлор-5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]-3-хлорфенил]-5-фтор-2-метилбензамид.
23. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-8-оксо-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-3-фтор-2-метилбензамид.
24. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-8-оксо-4Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2,4-дихлорбензамид.
25. Соединение по п.1, представляющее собой N-[4-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]-3-хлорфенил]-2-хлор-4-фторбензамид.
26. Соединение по п.1, представляющее собой N-[4-[(5,6-дигидро-4Н-тиено [3, 2-b] азепин-4-ил)карбонил]-3-хлорфенил]-3-фтор-2-метилбензамид.
27. Соединение по п.1, представляющее собой N-[5-[(5,6,7,8-тетрагидро-4Н-тиено[3,2-b]азепин-4-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид.
28. Способ получения соединений общей формулы I
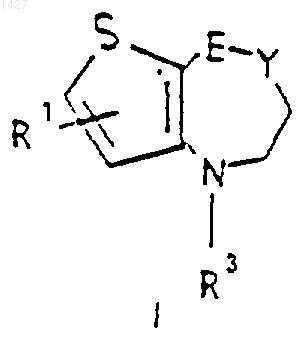
где E-Y выбраны из радикалов -СН=СН-, -СН2-СН2- и

R1 выбран из водорода и галогена;
R3 представляет собой -СОАr, где Аr представляет собой радикал, выбранный из группы, включающей
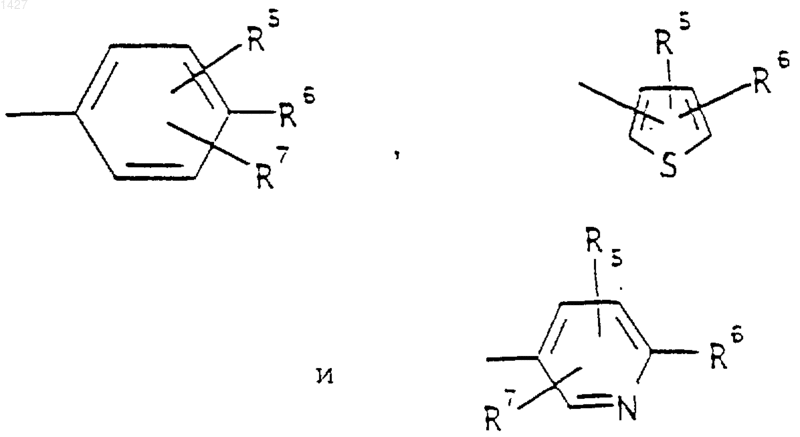
R5 выбран из водорода, (C1-С3)алкила, (C1-С3)алкокси и галогена; R6 выбран из (а) радикалов формулы

где J представляет
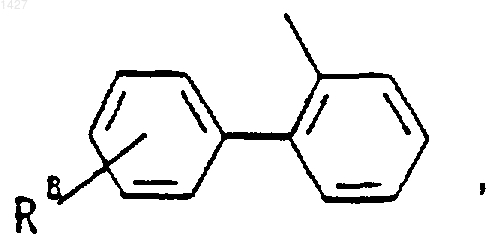
Ar' выбран из радикалов формулы

где W' выбран из О или S;
(b) радикала формулы -M-Rd ,
где Rd представляет собой алкил(С3-С8) или -(СН2)p-циклоалкил (С3-С6), когда М представляет собой О, и Rd представляет собой
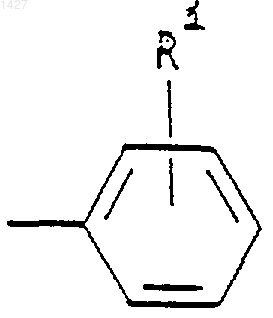
когда М представляет собой связь;
R7 выбран из водорода и галогена; R8 и R9 независимо выбраны из водорода, алкила (C1-С3), -S-алкила (C1-С3), галогена, -NH-алкила (C1-С3), -N-[алкила (C1-С3)]2, -ОСF3, -NO2, -NH2, -O-алкила (C1-С3); R10 выбран из водорода, галогена и -O-алкила(C1-С3) и их фармацевтически приемлемых солей, который включает взаимодействие соединения формулы:
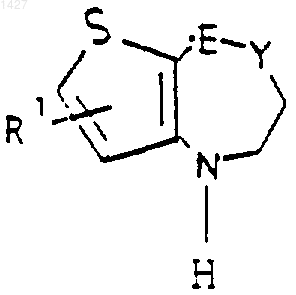
где -E-Y- и R' определены выше, с соединением формулы
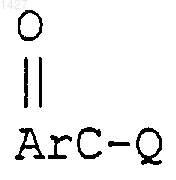
где Q представляет собой галоген или активирующую группу, которая образуется путем преобразования арилкарбоновой кислоты в хлорангидрид, смешанный ангидрид или путем активации пептидно-связывающшь реагентом.
Евразийский патент действует на территории всех Договаривающихся государств, кроме АМ и МD.
Текст
1 1. Область изобретения Данное изобретение относится к новым тиелоазепиновым непептидным антагонистам вазопрессина, которые могут использоваться при лечении состояний, при которых желателен пониженный уровень вазопрессина, как, например, при застойной сердечной недостаточности,при патологических состояниях с избыточной реабсорбцией воды в почках и при состояниях с повышенным сосудистым сопротивлением и сужением сосудов сердца. 2. Предпосылки изобретения Вазопрессин секретируется задней долей гипофиза либо в ответ на повышенное осмотическое давление плазмы, что определяется осморецепторами головного мозга, либо в ответ на пониженный объем крови и кровяное давление, что определяется волюморецепторами низкого давления и артериальными барорецепторами. Гормон оказывает свое действие посредством двух хорошо определенных подтипов рецепторов: сосудистых рецепторов V1 и рецепторов почечного эпителия V2. Индуцированное вазопрессином антидиуретическое действие,опосредованное рецепторами почечного эпителия V2, позволяет поддерживать нормальное осмотическое давление плазмы, объем крови и кровяное давление. Вазопрессин оказывается вовлеченным в патогенез некоторых случаев застойной сердечной недостаточности, когда повышено периферическое сопротивление. Антагонисты V1 могут понижать системное сосудистое сопротивление,повышать сердечный выброс и предотвращать вазопрессин-индуцированное сужение сосудов сердца. Таким образом, при состояниях с индуцированным вазопрессином повышением общего периферического сопротивления и изменением местного кровотока V1-антагонисты могут представлять собой лекарственные средства. Антагонисты V1 могут понижать кровяное давление, оказывать индуцированное гипотензивное действие и, таким образом, могут находить терапевтическое применение для лечения некоторых типов гипертензии. Блокада рецепторов V2 применима для лечения заболеваний, характеризующихся избыточной реабсорбцией несвязанной воды в почках. Угнетение диуреза регулируется посредством секреции гипоталамусом вазопрессина (антидиуретического гормона), который связывается со специфичными рецепторами на клетках прямых почечных канальцев. Данное связывание активирует аденилатциклазу и способствует цАМФ-опосредованному включению водяных пор в поверхность данных клеток, выходящую в просвет канальца. Антагонисты V2 способны устранить задержку жидкости при застойной сердечной недостаточности, циррозе печени,нефритическом синдроме, травмах центральной нервной системы, заболеваниях легких и гипонатриемии. 2 Повышенные уровни вазопрессина имеют место при застойной сердечной недостаточности, которая наиболее часто встречается у больных пожилого возраста с хронической сердечной недостаточностью. В случае больных с гипонатриемической застойной сердечной недостаточностью и повышенными уровнями вазопрессина антагонист V2 может быть предпочтительным для ускорения выведения несвязанной воды путем антагонистического действия по отношению к антидиуретическому гормону. На основании биохимических и фармакологических эффектов гормона ожидается, что антагонисты вазопрессина найдут терапевтическое применение для лечения и/или предотвращения гипертензии, сердечной недостаточности, спазма сосудов сердца, ишемии миокарда, спазма сосудов почек, цирроза печени, застойной сердечной недостаточности, нефритического синдрома, отека головного мозга, ишемии головного мозга, геморрагического инфаркта головного мозга, синдрома диссеминированного внутрисосудистого свертывания и патологических состояний, сопровождающихся задержкой воды. Следующие ссылки на предшествующие работы в данной области описывают пептидные антагонисты вазопрессина: М. Manning et al., J. Med.(1991). P.D. Williams et al. сообщали о сильных гексапептидных антагонистах окситоцина [J.Med. Chem., 35, 3905 (1992)], которые также проявляли слабую вазопрессинантагонистическую активность, выражавшуюся в связывании с рецепторами V1 и V2. Недостатком пептидных антагонистов вазопрессина является отсутствие активности при пероральном применении, а многие из данных пептидов не являются избирательными антагонистами, поскольку они также проявляют частичную агонистическую активность. Недавно были описаны непептидные антагонисты вазопрессина, Y. Yamamura et al., Science, 252, 579 (1991); Y. Yamamura et al., Br. J.Pharm. Co.) в EP 470514A описаны карбостирильные производные и содержащие их же фармацевтические композиции. Непептидный антагонист окситоцина и вазопрессина был описан Merck and Co.; M.G. Bock и P.D. Williams,EP 0533242A; M.G. Bock et al., EP 0533244A; 3 Преждевременные роды могут явиться причиной проблем со здоровьем и смерти ребенка, а ключевым медиатором в механизме родов является пептидный гормон окситоцин. На основании фармакологического действия окситоцина антагонисты данного гормона применимы для предотвращения преждевременных родов, В.Е. Evans et al., J. Med. Chem., 35, 3919(1992), J. Med. Chem., 36, 3993 (1993) и данные там ссылки. Соединения по данному изобретению являются антагонистами пептидного гормона окситоцина и применимы для подавления преждевременных родов. Настоящее изобретение относится к новым трициклическим производным, которые проявляют антагонистическую активность по отношению к рецепторам V1 и/или V2 и проявляют in vivo вазопрессинантагонистическую активность. Соединения также проявляют антагонистическую активность по отношению к рецепторам окситоцина. Краткое описание изобретения Данное изобретение относится к новым соединениям, выбранным из соединений общей формулы I где E-Y выбраны из радикалов -СН=СН-, -CH2CH2- и -С-СН 2-, R1 выбран из водорода и галогена;R6 выбран из (а) радикалов формулы где J представляет Аr' выбран из радикалов формулыR7 выбран из водорода и галогена; R8 и R9 независимо выбраны из водорода, алкила (С 1 С 3), -S-алкила (C1-С 3), галогена, -NH-алкила (C1 С 3), -N-[алкила (C1-С 3)]2, -ОСF3, -NO2, -NH2, -Oалкила (C1-С 3); R10 выбран из водорода, галогена и -O-низшего алкила(C1-С 3) и их фармацевтически приемлемых солей. Подробное описание изобретения В пределах группы соединений, определяемых формулой I, пределенные соединения являются более предпочтительными. Наиболее предпочтительными являются следующие соединения:N-[5-[(5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепин-4-ил]карбонил]-2-пиридинил]-5-фтор 2-метилбензамид; Объектом изобретения является также способ получения соединений общей формулы I где E-Y выбраны из радикалов -СН=СН-, -СН 2 СН 2- и -С-СН 2-, R1 выбран из водорода и галогена; Аr' выбран из радикалов формулыR7 выбран из водорода и галогена; R8 и R9 независимо выбраны из водорода, алкила (C1 С 3), -S-алкила(C1-С 3), галогена, -NH-алкила(С 1 С 3), -N- [алкила (C1-С 3)]2, -ОСF3, -NO2, -NH2, -Oалкила(С 1-С 3); R10 выбран из водорода, галогена и -O-алкила(C1-С 3) и их фармацевтически приемлемых солей, который включает взаимодействие соединения формулы где Q представляет собой галоген или активирующую группу, которая образуется путем преобразования арилкарбоновой кислоты в хлорангидрид, смешанный ангидрид или путем активации пептидно-связывающим реагентом. Представленные далее примеры иллюстрируют данное изобретение, но не ограничивают его. Ссылочный пример 1. 6,7-Дигидробензо[b] тиофен-4(5 Н)-он, оксим. К раствору 4-кето-4,5,6,7-тетрагидротионафтена в 260 мл этанола добавляют 27,4 г гидроксиламингидрохлорида. К смеси добавляют 16,5 г ацетата натрия и 66 мл воды и затем смесь нагревают с обратным холодильником в течение 3,5 ч; охлаждают на ледяной бане и 7 фильтруют. Твердое вещество промывают водой и этанолом с получением 13 г твердого вещества, которое сушат при 65 С в вакууме с получением 11,7 г кристаллов, т.пл. 124-126 С(большей частью, один изомер, син- или анти-). Фильтрат концентрируют в вакууме и экстрагируют добавлением 250 мл дихлорметана. Экстракт промывают по 100 мл воды, солевого раствора и затем сушат (Na2SO4). Растворитель удаляют и твердое вещество сушат при 65 С в вакууме с получением 32 г кристаллов, т.пл. 106-109 С (большей частью, один изомер, синили анти-). Ссылочный пример 2. 6,7-Дигидробензо[b]тиофен-4(5 Н)-он, оксим-O-тозилат. К перемешиваемому раствору 12,2 г 6,7 дигидробензо[b]тиофен-4(5 Н)-она, оксима (смеси изомеров) в 26 мл сухого пиридина, охлажденного до 0 С, добавляют 15,3 г п-тоуолсульфонилхлорида (сразу весь). Через 5 мин твердое вещество отделяют и смесь перемешивают при 0 С в течение 1 ч. К холодной смеси добавляют 195 мл 2 н. НСl и смесь фильтруют с получением твердого вещества, которое промывают водой и сушат (в вакууме) с получением 21,5 г продукта в виде кристаллов, т.пл. 117-120 С. Ссылочный пример 3. 5,6,7,8-Тетрагидро 4 Н-тиено[3,2-b]азепин-5-он. Смесь 21,45 г 6,7-дигидробензо[b]тиофен 4(5 Н)-она, оксим-O-тозилата, 136,1 г ацетата калия, 528 мл этанола и 904 мл воды нагревают с обратным холодильником в течение 22 ч. Смесь концентрируют в вакууме (в целях удаления этанола), охлаждают и фильтруют с получением твердого вещества. Твердое вещество промывают водой, сушат (на воздухе) и перекристаллизовывают путем растворения в горячем этилацетате и разбавления раствора гексаном. Охлаждение и фильтрование дают 7,1 г кристаллов, т.пл. 128-132 С. Ссылочный пример 4. 5,6,7,8-Тетрагидро 4 Н-тиено[3,2-b]азепин.(1) К смеси 4,54 г литийалюминийгидрида в 400 мл сухого тетрагидрофурана в атмосфере аргона добавляют по каплям раствор 10,0 г 5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин-5-она в 200 мл тетрагидрофурана. После добавления смесь нагревают при 45-50 С (экзотермическая реакция) и охлаждают до комнатной температуры. Смесь охлаждают на ледяной бане (0 С) и по каплям в течение 1 ч добавляют 4,5 мл воды с последующим капельным добавлением 4,5 мл 2 н. гидроксида натрия и капельным добавлением 14 мл воды. Смесь фильтруют через диатомовую землю и осадок на фильтре промывают тетрагидрофураном. Фильтрат концентрируют с получением твердого вещества. Твердое вещество кристаллизуют из гексана с получением 5,5 г не совсем белых кристаллов, т.пл. 66-68 С. 8 фурана в атмосфере аргона, охлажденной до 0 С добавляют 25,2 мл 10,0 молярного раствора боран-диметилсульфида в тетрагидрофуране. Раствор перемешивают при комнатной температуре в течение 16 ч и нагревают с обратным холодильником в течение 5 ч. Смесь охлаждают до комнатной температуры и по каплям добавляют 85 мл метанола (выделение тепла). Растворитель удаляют и добавляют 100 мл метанола (2 раза) и после каждого добавления удаляют растворитель. К оставшемуся твердому веществу (высушенному в вакууме) добавляют 126 мл 2 н. NaOH и смесь нагревают с обратным холодильником в течение 3 ч. Смесь охлаждают (2 ч) и экстрагируют добавлением дихлорметана. Экстракт сушат (Nа 2SO4) и растворитель удаляют с получением 15,4 г коричневого твердого вещества, т.пл. 55-57 С. Образец (3 г) возгоняют с получением 2,6 г кристаллов, т.пл. 64-65 С. Ссылочный пример 5. 4-(4-Нитробензоил)5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. К раствору 10,71 г 5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепина и 19,4 мл триэтиламина в 150 мл дихлорметана в атмосфере аргона малыми порциями добавляют 4-нитробензоилхлорид(выделение тепла). Смесь перемешивают в течение 3 ч при 25 С и затем промывают водой,раствором бикарбоната натрия, солевым раствором и сушат (Na2SO4). Растворитель удаляют, остаток сушат в вакууме и перекристаллизовывают путем растворения в горячем этилацетате и разбавления гексаном. Охлаждение в течение ночи и фильтрование дают 16 г светлокоричневых кристаллов, т.пл. 141-142 С. Ссылочный пример 6. 4-(4-Нитробензоил)4,5,6,7-тетрагидро-8 Н-тиено[З,2-b]-азепин-8-он. К раствору 9,0 г 4-(4-нитробензоил)5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепина в 713 мл ацетона добавляют 6,74 г МgSO4 и 351 мл воды с последующим добавлением 8,2 г КМnO4 и нагреванием при 70 С в течение 18 ч. Добавляют еще 6,24 г МgSO4 и 8,2 г КМnO4 и нагревание продолжают при 70 С в течение 8 ч. Добавляют дополнительные 6,24 г MgSO4 и 8,2 г КМnО 4 и нагревание продолжают при 70 С в течение 18 ч. Реакционную смесь фильтруют через диатомовую землю и осадок на фильтре промывают ацетоном и 500 мл метиленхлорида. Объединенные фильтраты выпаривают в вакууме до остатка, который промывают водой и сушат на воздухе с получением 5,7 г твердого вещества. Твердое вещество кристаллизуют из этилацетата с получением 5,1 г не совсем белого твердого вещества, т.пл. 184-186 С. Ссылочный пример 6. 4-(4-Аминобензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2-b]азепин-8-он. К смеси 2,0 г 4-(4-нитробензоил)-4,5,6,7 тетрагидро-8 Н-тиено[3,2-b]азепин-8-она в 40 мл ледяной уксусной кислоты добавляют 20 мл 6 н соляной кислоты. Смесь охлаждают и порциями добавляют 3,53 г порошкообразного железа. 9 Смеси дают нагреться до комнатной температуры и нагревают ее при 70-80 С в течение 1 ч и затем охлаждают до 0 С. Смесь подщелачивают с помощью 10 н. NaOH (pH 14) и экстрагируют добавлением 200 мл этилацетата. Водный слой еще раз экстрагируют 200 мл этилацетата и экстракты объединяют. Объединенный экстракт промывают по 100 мл H2O и солевого раствора и сушат (Nа 2SO4). Экстракт фильтруют через тонкий пад водного силиката магния и фильтрат концентрируют с получением твердого вещества, которое кристаллизуют из этилацетатагексана с получением 1,24 г кристаллов, т.пл. 216-218 С. Ссылочный пример 8. 2-Хлор-4-(4-нитробензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепин. Раствор 6,04 г 4-(4-нитробензоил)-5,6,7,8 тетрагидро-4 Н-тиено[3,2-b]азепина в 40 мл тетрагидрофурана охлаждают до 0 С и порциями добавляют 5,34 г N-хлорсукцинимида. После добавления смесь нагревают при 70 С в течение ночи. Смесь концентрируют, разбавляют 300 мл дихлорметана и смесь промывают по 100 мл насыщенного раствора К 2 СО 3, H2O, 1 н. НСl и солевым раствором. Органический слой сушат(Nа 2SO4) и фильтруют через тонкий пад водного силиката магния. Фильтрат концентрируют и остаток подвергают хроматографии по методу ВЭЖХ на силикагеле (2-колонки) с приборомWaters-Prep-500 и системой растворителей этилацетат-дихлорметан (1:1), содержащей 2% диэтиловый эфир. Средние фракции объединяют и концентрируют с получением 0,135 г 2,3 дихлор-4-(4-нитробензоил)-5,6,7,8-тетрагидро 4 Н-тиено[3,2-b]азепина, т.пл. 140-142C. Поздние фракции объединяют, концентрируют и остаток кристаллизуют из этилацетата-гексана с получением 2,8 г кристаллов, 119-120 С. Ссылочный пример 9. 2-Хлор-4-(4-аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено-[3,2-b] азепин. К раствору 2,6 г 2-хлор-4-(4-нитробензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепина в смеси 52 мл уксусной кислоты и 26 мл 6 н НС 1, охлажденной до 0 С, малыми порциями добавляют 4,32 г порошкообразного железа. После добавления смесь нагревают при 70-80 С в течение 2 ч. Смесь охлаждают на ледяной бане(0 С) и защелачивают 10 н NaOH (pH 14). Смесь экстрагируют добавлением 250 мл этилацетата и затем 150 мл этилацетата. Объединенный экстракт промывают по 100 мл Н 2 О и солевого раствора. Экстракт сушат (Na2SO4) и фильтруют через тонкий пад водного силиката магния. Фильтрат концентрируют досуха и остаток кристаллизуют из этилацетата-гексана с получением 1,7 г не совсем белых кристаллов, т.пл. 146149 С. Ссылочный пример 10. 2-Хлор-4-(4-нитробензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2-b] азепин-8-он. 10 К перемешиваемому раствору 0,336 г 4-(4 нитробензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2b]азепин-8-она в 36 мл ацетона-воды (2:1) добавляют 0,21 г безводного сульфата магния и 0,275 г перманганата калия. Смесь нагревают при 70 С в течение ночи. Добавляют дополнительные 0,275 г перманганата калия и 0,21 г сульфата магния и смесь нагревают при 70 С в течение 6 ч. Добавляют дополнительные 0,275 г перманганата калия и 0,21 г сульфата магния и смесь перемешивают и нагревают при 70 С в течение 24 ч. Горячую смесь фильтруют и фильтрат выпаривают. Остаток нагревают в нескольких мл этилацетата, охлаждают и фильтруют с получением 0,20 г продукта в виде твердого вещества. Реакцию повторяют 10 раз thescale с получением 1,3 г не совсем белых кристаллов, т.пл. 165-168 С. Ссылочный пример 11. 4-(4-Аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. Раствор 9,97 г 4-(4-нитробензоил)-5,6,7,8 тетрагидро-4 Н-тиено[3,2-b]азепина в 110 мл ледяной уксусной кислоты и 0,997 г 10% палладия на угле гидрируют в аппарате Парра при давлении 30-50 фунтов в течение 4,5 ч. Смесь фильтруют через пад из диатомовой земли и фильтрат концентрируют досуха в вакууме. Смолистый остаток (8,1 г) очищают по методу ВЭЖХ на приборе Waters-Prep-500 с силикагелем и этилацетатом-гексаном (1:1) в качестве растворителя. Фракции, содержащие продукт,объединяют и растворитель удаляют. Остаток кристаллизуют с получением 4,0 г кристаллов,т.пл. 168-172 С. Ссылочный пример 12. Метил-4-[2-(2 хлорфенил)-2-циано-2-(4-морфолинил)этил] бензоат. Навеску 0,876 г 60% гидрида натрия в масле промывают гексаном с последующим добавлением 60 мл сухого N,N-диметилформамида. Реакционную смесь перемешивают в течение 1 ч в атмосфере аргона при комнатной температуре после добавления 4,73 г -(2-хлорфенил)-4 морфолинацетонитрила. К реакционной смеси добавляют 4,58 г метил-4-(бромметил)-бензоата и перемешивание продолжают в течение 3 ч. Несколько капель уксусной кислоты добавляют в ледяную воду и реакция гасится. рН равна 3-4,и в целях довести рН до 6-7 добавляют насыщенный NaHCO3. При охлаждении образуется твердое вещество, которое фильтруют, промывают водой и сушат с получением 5,92 г желтого твердого вещества. Кристаллизация из метиленхлорида-гексана дает 2,10 г желаемого продукта в виде кристаллического твердого вещества, т.пл. 116-118 С. Ссылочный пример 13. Метил-4-[2-(2 хлорфенил)-2-оксоэтил]бензоат. Смесь 1,0 г метил-4-[2-(2-хлорфенил)-2 циано-2-(4-морфолинил)этил]бензоата и 14 мл уксусной кислоты и 6 мл воды нагревают с обратным холодильником в течение 20 мин, затем 11 выливают на колотый лед. После перемешивания в течение 15 мин полученное твердое вещество собирают, промывают водой и сушат на воздухе с получением 0,63 г желто-коричневого твердого вещества, т.пл. 40-42 С. Ссылочный пример 14. 4-[2-(2-Хлорфенил)-2-оксоэтил]бензойная кислота. Смесь 18,78 г метил-4-[2-(2-хлорфенил)-2 оксоэтил]-бензоата в 288,8 мл СН 3 ОН, 72,2 мл воды и 5,2 г NaOH нагревают с обратным холодильником в течение 3 ч, затем подкисляют 2 н. лимонной кислотой. Реакционную смесь выпаривают в вакууме для удаления СН 3 ОН. Водную фазу экстрагируют добавлением СН 2 Сl2 и подкисляли 1 н. НСl. Полученное твердое вещество собирают и сушат в вакууме с получением 17,27 г желаемого продукта, т.пл. 168-172 С. Ссылочный пример 15. Метил-4,5,6,7 тетрагидро-4-оксо-3-бензофуранкарбоксилат. К раствору 2,11 г 4-оксо-4,5,6,7-тетрагидробензо[b]-фуран-3-карбоновой кислоты в 100 мл метанола добавляют 202 мг гидрата птолуолсульфоновой кислоты и смесь нагревают с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры и метанол концентрируют в вакууме до остатка. Остаток растворяют в 100 мл этилацетата и промывают 30 мл насыщенного бикарбоната натрия и 30 мл солевого раствора. Органический слой сушат с помощью Na2SO4,фильтруют и фильтрат концентрируют в вакууме до остатка, который кристаллизуют из этилацетата-гексана с получением 1,75 г желаемого продукта в виде белого кристаллического твердого вещества, т.пл. 100-102 С. Ссылочный пример 16. Метил-5,6,7,8 тетрагидро-5-оксо-4 Н-фуро[3,2-b]азепин-3 карбоксилат. К смеси 1,0 г метил-4,5,6,7-тетрагидро-4 оксо-3-бензо-фуранкарбоксилата и 502 мг азида натрия в 5 мл хлороформа добавляют по каплям 1,4 мл серной кислоты при 32-36 С в атмосфере аргона. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь разбавляют 14 мл воды и делают щелочной с помощью NH4 ОH и экстрагируют добавлением хлороформа. Отделенный органический слой промывают водой, солевым раствором и сушат с помощью Na2SO4 и концентрируют в вакууме с получением 1,0 г желаемого продукта в виде белого твердого вещества. Ссылочный пример 17. (Е)-4,5,6,7-Тетрагидро-4-(4-метилфенил)сульфонил]окси] имино]-3-бензофуранкарбоновая кислота. К частично растворенному 2,8 г (Е)4,5,6,7-тетрагидро-4-(гидроксиимино)-3-бензофуранкарбоновой кислоты в 7 мл пиридина порциями добавляют при 0 С 3,01 г п-толуолсульфонилхлорида в атмосфере аргона. Смесь перемешивают в течение 1 ч, затем разбавляют 40 мл холодной 1 н. НСl, фильтруют, промывают водой и сушат с помощью Na2SO4. Фильтрат 12 концентрируют в вакууме с получением 4,78 г желаемого продукта в виде не совсем белого твердого вещества, т.пл. 155-165 С. Ссылочный пример 18. 5,6,7,8-Тетрагидро 5-оксо-4 Н-фуро[3,2-b]азепин-3-карбоновая кислота. Смесь 1,0 г (Е)-4,5,6,7-тетрагидро-4-(4 метилфенил)сульфонил]окси]имино]-3-бензофуранкарбоновой кислоты, 5,9 г ацетата калия,23 мл этанола и 39 мл воды нагревают с обратным холодильником в течение 48 ч. Реакционную смесь концентрируют в вакууме, добавляют 80 мл метиленхлорида и отделяют органический слой, промывают водой, солевым раствором и сушат с помощью Na2SO4. Органический слой концентрируют в вакууме до твердого вещества, которое очищают методом хроматографии на препаративной силикагелевой пластине путем элюции 0,5% уксусной кислотой в этилацетате. Элюированную полосу промывают 1% уксусной кислотой в этилацетате. Органический слой сушат с помощью Na2SO4 и концентрировали в вакууме с получением 200 мг не совсем белого твердого вещества, которое кристаллизуют из этилацетата-гексана с получением 165 мг желаемого продукта в виде белого твердого вещества. Ссылочный пример 19.(Е)- и (Z)-4,5,6,7-Тетрагидро-(4-гидроксиимино)-3-бензофуранкарбоновая кислота. К раствору 30,0 г 4,5,6,7-тетрагидро-4 оксо-3-бензофуранкарбоновой кислоты в 225 мл этанола добавляют 22,97 мл гидроксиламингидрохлорида с последующим добавлением 18,10 г ацетата натрия и 55 мл воды. Реакционную смесь нагревают с обратным холодильником в течение 2,5 ч и концентрируют в вакууме до остатка, который разбавляют 600 мл этилацетата, промывают 2 х 200 мл воды, солевым раствором и сушат над Na2SO4. Органический слой концентрируют в вакууме с получением 31,0 г желаемого продукта в виде твердого вещества. Ссылочный пример 20. (Е)- и (Z)-6,7-Дигидро-4-(5 Н)-бензофуранон,О-[(4-метилфенил) сульфонил]оксим. К частично растворенному 28,0 г (Е)- и(Z)-4,5,6,7-тетрагидро-4-(гидроксиимино)бензофурана в 54 мл пиридина порциями при 0 С добавляют 38,8 г п-толуолсульфонилхлорида в атмосфере аргона. Смесь перемешивают в течение 1 ч, затем разбавляют 600 мл этилацетата и 400 мл холодной 2 н. НСl. Органический слой промывают 200 мл воды и 200 мл солевого раствора и сушат с помощью Nа 2SO4. Фильтрат концентрируют в вакууме с получением 50 г желаемого продукта в виде твердого вещества. Кристаллизация из этилового спирта путем выдерживания при комнатной температуре дает 19, 9 г не совсем белых игл, т.пл. 123-125 С. Фильтрат оставляют стоять и собирают кристаллы и сушат с получением 10,0 г желаемого 13 продукта в виде не совсем белого твердого вещества, 83-85 С. Ссылочный пример 21. 4-(2-Хлор-4-нитробензоил)-5,6,7,8-тетрагидро-4 Н-тиено-[3,2-b] азепин. К раствору 15,0 г 5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепина в 150 мл дихлорметана,охлажденного до 0 С, добавляют 27,2 мл триэтиламина. После перемешивания в течение 5 мин медленно добавляют раствор 28,0 г 2-хлор 4-нитробензоилхлорида в 140 мл дихлорметана. Раствор перемешивают при комнатной температуре в течение ночи, разбавляют 450 мл дихлорметана и раствор промывают по 200 мл воды, 2 н. лимонной кислоты, 1 М бикарбоната натрия и солевого раствора. Органический слой сушат над Na2SO4, фильтруют через тонкий пад водного силиката магния и фильтрат концентрируют в вакууме. Остаток кристаллизуют из этилацетата с получением 24,3 г не совсем белых кристаллов, т.пл. 131-134 С. Ссылочный пример 22. 4-(2-Хлор-4-аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено-[3,2-b] азепин. Смесь 5,0 г 4-(2-хлор-4-нитробензоил)5,6,7,8-тетра-гидро-4 Н-тиено[3,2-b]азепина 16,8 г дигидрата хлорида олова в 184 мл этанола нагревают при 80 С в атмосфере аргона в течение 1 ч. Раствор охлаждают на ледяной бане и защелачивают путем медленного осторожного добавления 1 М NаНСО 3 (около 380 мл). Смесь перемешивают в течение 1 ч при комнатной температуре и экстрагируют добавлением 400 мл этилацетата. Водный слой экстрагируют добавлением дополнительных 250 мл этилацетата. Экстракты объединяют и промывают 300 мл солевого раствора, сушат (Na2SO4) и фильтруют через тонкий пад водного силиката магния. Фильтрат концентрируют в вакууме с получением белого твердого вещества, которое перекристаллизовывают из этилацетата с получением 4,23 г не совсем белых кристаллов, т.пл. 176179 С. Ссылочный пример 23. 4-(2-Хлор-4-нитробензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2-b] азепин-8-он. К раствору 2,02 г 4-(2-хлор-4-нитробензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепина в 144 мл ацетона добавляют 1,56 г сульфата магния, 72 мл воды и 1,89 г перманганата калия. Смесь перемешивают и нагревают при 70-75 С в течение 4 ч. Добавляют дополнительное количество сульфата магния (1,56 г) и перманганата калия (1,89 г) и смесь перемешивают и нагревают при 75 С в течение 16 ч. Добавляют сульфат магния (1,56 г) и перманганат калия (1,89 г) и смесь перемешивают и нагревают при 75 С в течение 5 ч. Смесь фильтруют через диатомовую землю и остаток на фильтре промывают ацетоном и дихлорметаном. Фильтрат концентрируют и остаток (1,4 г) нагревают с этилацетатом, смесь (с нерастворимым твердым веще 001427 14 ством) охлаждают и фильтруют с получением 1,0 г продукта в виде твердого вещества. Твердое вещество промывают водой и сушат с получением кристаллов, т.пл. 180-185 С. Ссылочный пример 24. 4-(2-Хлор-4 нитробензоил)-8-гидрокси-5,6,7,8-тетрагидро 4 Н-тиено[3,2-b]азепин. К раствору 1,0 г 4-(2-хлор-4-нитробензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2-b]азепин 8-она в 10 мл тетрагидрофурана добавляют 1 мл этанола и смесь охлаждают до 0 С. К смеси порциями добавляют 0,129 г боргидрида натрия и смесь перемешивают при 0 С в течение 1 ч. К смеси медленно добавляют 4,2 мл насыщенного раствора хлорида аммония при 0 С. После перемешивания при комнатной температуре в течение 10 мин растворитель удаляют в вакууме и к остатку добавляют 80 мл этилацетата. Смесь промывают по 20 мл Н 2 О, 2 н. лимонной кислоты, 1 М NаНСО 3 и солевого раствора. Органический слой сушат (Na2SO4) и фильтруют через тонкий пад водного силиката магния. Фильтрат концентрируют в вакууме с получением продукта в виде белого стеклообразного вещества. Ссылочный пример 25. 4-(2-Хлор-4-нитробензоил)-5,6-дигидро-4 Н-тиено[3,2-b]азепин. К раствору 0,90 г 4-(2-хлор-4-нитробензоил)-8-гидрокси-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепина в 5 мл дихлорметана, охлажденного до -10 С, в атмосфере аргона добавляют 533 мкл триэтиламина и капельно 296 мкл метансульфонилхлорида. Через один час охлаждающую баню удаляют и смесь оставляют стоять при комнатной температуре в течение ночи. Смесь разбавляют 10 мл дихлорметана и 5 мл воды. Органический слой отделяют, сушат(Na2SО 4) и фильтруют через тонкий пад водного силиката магния. Фильтрат концентрируют в вакууме с получением масла, которое кристаллизуют путем добавления гексана. Фильтрование дает светло-желтые кристаллы (0,80 г). Ссылочный пример 26. 5-Фтор-2-метилбензоилхлорид. Смесь 8,0 г 5-фтор-2-метилбензойной кислоты и 52 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Летучие компоненты удаляют в вакууме и дважды добавляют по 50 мл толуола и растворитель удаляют в вакууме с получением 8,5 г продукта в виде смолистого вещества. Ссылочный пример 27. 2-Хлор-5-(метилтио)бензоилхлорид. Смесь 2,03 г 2-Хлор-5-(метилтио) бензойной кислоты и 10 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Летучие компоненты удаляют в вакууме и добавляют 20 мл толуола и удаляют в вакууме (2 раза) с получением 2,2 г коричневых игл. Ссылочный пример 28. 2-Хлор-4-нитробензоилхлорид. Как описано в случае ссылочного примера 26, 25 г 2-хлор-4-нитробензойной кислоты 15 взаимодействуют с тионилхлоридом (124 мл) с получением продукта (27,0 г) в виде коричневого масла. Ссылочный пример 29. 2-Хлор-5-нитробензоилхлорид. Как описано в случае ссылочного примера 26, 5,0 г 2-хлор-5-нитробензойной кислоты взаимодействуют с 50 мл тионилхлорида с получением 5,6 г продукта в виде не совсем белого твердого вещества. Ссылочный пример 30. 2,3-Диметилбензоилхлорид. Как описано в случае ссылочного примера 26, 3,0 г 2,3-диметилбензойной кислоты взаимодействуют с 40 мл тионилхлорида с получением 3,2 г продукта в виде бесцветного масла. Ссылочный пример 31. 2-Хлорбензоилхлорид. Как описано в случае ссылочного примера 26, 3,13 г 2-хлорбензойной кислоты взаимодействуют с 40 мл тионилхлорида с получением 3,32 г продукта в виде не совсем белого полутвердого вещества. Ссылочный пример 32. 4-(2-Хлор-4-аминобензоил)-5,6-дигидро-4 Н-тиено[3,2-b]азепин. К раствору 2,36 г SnСl22 Н 2 О в 13 мл этанола добавляют 0,70 г 4-(2-хлор-4-нитробензоил)-5,6-дигидро-4 Н-тиено[3,2-b]азепина. Смесь нагревают при 75 С в течение одного часа, охлаждают до комнатной температуры и концентрируют в вакууме до 10 мл. Смесь охлаждают на ледяной бане и медленно добавляют 1 М NаНСО 3. Смесь экстрагируют добавлением 100 мл этилацетата и затем 80 мл этилацетата. Экстракты объединяют, промывают солевым раствором и сушат (Na2SO4). Экстракт пропускают через тонкий пад водного силиката магния и пад промывают этилацетатом. Фильтрат концентрируют с получением твердого вещества,которое кристаллизуют из этилацетата с получением белых кристаллов, т.пл. 192-200 С. Ссылочный пример 33. 4-[(2-Метилбензоил)амино]бензойная кислота. Смесь 43,42 г (0,26 моль) этил-4 аминобензоата и 40,8 г (0,26 моль) 2 метилбензоилхлорида в 150 мл дихлорметана охлаждают на ледяной бане и по каплям добавляют 26,56 г (0,26 моль) триэтиламина. После добавления раствор перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и органический слой отделяют. Органический слой промывают водой, 1 н. HCl, 1MNаНСО 3 и сушат (Nа 2SO4). Растворитель удаляют и твердое вещество суспендируют в этилацетате и фильтруют с получением 57 г этил-4[(2-метил-бензоил)амино]бензоата в виде кристаллов, т.пл. 110-115 С. Смесь 50,7 г (0,20 моль) предыдущего соединения, 280 мл этанола и 55 мл 10 н. NaOH нагревают с обратным холодильником в течение 5 мин. Смесь охлаждают до комнатной температуры, разводят 200 мл воды и подкисляют кон 001427 16 центрированной соляной кислотой (рН 1-2). Смесь фильтруют и твердое вещество промывают водой и сушат с получением 51 г продукта в виде белых кристаллов, т.пл. 270-275 С. Ссылочный пример 34. 4-[(2-Метилбензоил)амино]бензоилхлорид. Смесь 10,3 г 4-[(2-метилбензоил)амино] бензойной кислоты и 32 мл тионилхлорида нагревают с обратным холодильником в течение 1,5 ч. Раствор концентрируют в вакууме. Добавляют толуол и растворитель удаляют в вакууме. Добавляют толуол и смесь охлаждают и фильтруют с получением желтого твердого вещества,т.пл. 135-141 С. Ссылочный пример 35. 4-[(2,6-Диметоксибензоил)амино]бензойная кислота. Смесь 2 г (10 ммоль) 2,6-диметоксибензоилхлорида, 1,65 г (10 ммоль) этил-4 аминобензоата, 1,11 г триэтиламина и 61 мг 4 диметиламинопиридина в 10 мл дихлорметана нагревают с обратным холодильником в течение 20 ч. Смесь разбавляют водой и органический слой отделяют. Органический слой промывают водой, 1 н. HCl, 1M NаНСО 3, солевым раствором и сушат (Na2SO4). Растворитель удаляют с получением твердого вещества, которое кристаллизуют из этилацетата с получением 1,22 г этил 4-[(2,6-диметоксибензоил)амино]бензоата в виде кристаллов, т.пл. 183-185 С. Смесь 3,88 г (11,79 ммоль) предыдущего соединения, 17,3 мл 2 н. NaOH и 20 мл метанола перемешивают при комнатной температуре в течение ночи. Добавляют метанол (30 мл) и воду (10 мл) и раствор нагревают с обратным холодильником в течение 1,2 ч. Растворители удаляют в вакууме и оставшееся твердое вещество растирают с эфиром, а эфир декантируют. Твердое вещество растворяют в 30 мл воды и подкисляют 2 н. НСl (рН 3). Смесь фильтруют, твердое вещество промывают водой и сушат при 60 С в вакууме с получением 3,0 г твердого вещества, т.пл. 236-240 С. Ссылочный пример 36. 4-[(4-Пиридинилкарбонил)амино]бензойная кислота. К охлажденной смеси 1,78 г (0,01 моль) гидрохлорида изоникотиноилхлорида в 5 мл дихлорметана добавляют 2,52 г (0,025 моль) триэтиламина. К раствору добавляют раствор 1,65 г этил-4-аминобензоата в 5 мл дихлорметана. После перемешивания при комнатной температуре в течение ночи добавляют и 50 мг 4 диметиламинопиридина и смесь нагревают с обратным холодильником в течение 24 ч. Смесь выливают в воду и фильтруют с получением 3,4 г коричневого твердого вещества. Образец 0,50 г растирают с этилацетатом с получением 0,37 г этил-4-[(4-пиридинилкарбонил)амино]-бензоата в виде желтых кристаллов, т.пл. 143-145 С. Ссылочный пример 37. 2-Метилфуран-3 карбонилхлорид. Смесь 4,0 г метил-2-метилфуран-3-карбоксилата, 30 мл 2 н. NaOH и 15 мл метанола на 17 гревают с обратным холодильником в течение 1,5 ч. Растворитель удаляют в вакууме с получением твердого вещества. Твердое вещество экстрагируют добавлением дихлорметана (отбрасывают). Твердое вещество растворяют в воде и раствор подкисляют 2 н. лимонной кислотой с получением твердого вещества. Твердое вещество промывают водой и сушат с получением 1,05 г кристаллов 2-метилфуран-3 карбоновой кислоты. Предыдущее соединение(0,95 г) и 3 мл тионилхлорида нагревают с обратным холодильником в течение 1 ч. Растворитель удаляют, добавляют толуол (20 мл, три раза) и растворитель удаляют с получением продукта в виде масла. Ссылочный пример 38. 4-[N-Метил-N-(2 метилбензоил)амино]бензойная кислота. Навеску 1,51 г гидрида натрия (60% в масле) промывают гексаном в атмосфере аргона в целях удаления масла. К промытому гидриду натрия по каплям добавляют раствор 8,69 г этил-4-[(2-метилбензоил)амино]бензоата в 20 мл диметилформамида. Смесь перемешивают при комнатной температуре в течение 0,5 ч и затем добавляют 5,23 г метилиодида. Смесь перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют водой и экстрагируют добавлением дихлорметана. Экстракт сушат (Na2SO4), концентрируют для уменьшения объема и раствор фильтруют через тонкий пад водного силиката магния. Фильтрат концентрируют в вакууме с получением 11 г масла (1:1 смесь продукта иNaOH. Смесь нагревают с обратным холодильником в течение 2 ч и растворитель удаляют. Остаток экстрагируют добавлением эфира (отбрасывают) и полученный остаток растворяют в 50 мл воды. Основный раствор подкисляют с помощью 2 н. лимонной кислоты и твердое вещество отфильтровывают и промывают водой. Продукт сушат на воздухе с получением 6,72 г кристаллов, т.пл. 187-190 С. Ссылочный пример 39. 4-[N-Метил-N-(2 метилбензоил)амино]бензоилхлорид. Раствор 6,72 г 4-[N-метил-N-(2-метилбензоил)амино]-бензойной кислоты в 20 мл тионилхлорида нагревают с обратным холодильником в течение одного часа. Летучие компоненты удаляют в вакууме. К остатку добавляют толуол и затем толуол удаляют в вакууме (повторяют несколько раз) с получением 7,3 г продукта в виде коричневого масла. Следующие соединения получают, как описывается в случае ссылочного примера 38,заменяя подходящий этил-4-[(N-ароил)амино] бензоат. Ссылочный пример 40. 4-[N-Метил-N-(2 хлорбензоил)амино]бензойная кислота. 18 Ссылочный пример 41. N-[N-Метил-N(2,5-дихлорбензоил)амино]бензойная кислота. Ссылочный пример 42. N-[N-Метил-N(2,4-дихлорбензоил)амино]бензойная кислота. Ссылочный пример 43. 4-[N-Метил-N-(2 хлор-4-метилбензоил)амино]бензойная кислота. Ссылочный пример 44. 4-[N-Метил-N-(2 метил-4-хлорбензоил)амино]бензойная кислота. Ссылочный пример 45. 4-[N-Метил-N-(2,4 диметилбензоил)амино]бензойная кислота. Ссылочный пример 46. 4-[N-Метил-N-(2,3 диметилбензоил)амино]бензойная кислота. Ссылочный пример 47. 4-[N-Метил-N-(2 метоксибензоил)амино]бензойная кислота. Ссылочный пример 48. 4-[N-Метил-N-(2 трифторметоксибензоил)амино]бензойная кислота. Ссылочный пример 49. 4-[N-Метил-N-[2,4 диметоксибензоил)амино]бензойная кислота. Ссылочный пример 50. 4-[N-Метил-N-(2 метокси-4-хлорбензоил)амино]бензойная кислота. Ссылочный пример 51. 4-[N-Метил-N-(2 метилтиобензоил)амино]бензойная кислота. Ссылочный пример 52. 4-[N-Метил-N-(2 метилтиофен-3-илкарбонил)амино]бензойная кислота. Ссылочный пример 53. 4-[N-Метил-N-(3-метилтиофен-2 илкарбонил)амино]бензойная кислота. Ссылочный пример 54. 4-[N-Метил-N-(2 метилфуран-3-илкарбонил)амино]бензойная кислота. Ссылочный пример 55. 4-[N-Метил-N-(3 метилфуран-2-илкарбонил)амино]бензойная кислота. Ссылочный пример 56. 4-[N-Метил-N(фенилацетил)амино]бензойная кислота. Ссылочный пример 57. 4-[N-Метил-N-(2 хлорфенилацетил)амино]бензойная кислота. Ссылочный пример 58. 4-[N-Meтил-N-(2 метоксифенилацетил)амино]бензойная кислота. Ссылочный пример 59. 4-[N-Метил-N-(2 метилфенилацетил)амино]бензойная кислота. Ссылочный пример 60. 4-[N-Метил-N(циклогексилкарбонил)амино]бензойная кислота. Ссылочный пример 61. 4-[N-Метил-N-(3 циклогексенкарбонил)амино]бензойная кислота. Ссылочный пример 62. 4-[N-Метил-N(циклогексилацетил)амино]бензойная кислота. Ссылочный пример 63. 4,5,6,7-Тетрагидро 4-(4-нитробензоил)-3 Н-тиено[3,2-b]азепин-8-он,8-оксим. К суспензии 2,0 г 4,5,6,7-тетрагидро-4-(4 нитробензоил)-8 Н-тиено[3,2-b]азепин-8-она в 7 мл этанола добавляют 0,681 г гидроксиламингидрохлорида; 0,400 г ацетата натрия и 2 мл воды. Смесь нагревают с обратным холодильником в течение 2 ч, охлаждают, фильтруют и твердое вещество промывают водой. Твердое вещество сушат при комнатной температуре в 19 вакууме с получением 2,0 г желтого твердого вещества. Ссылочный пример 64. 4,5,6,7-Тетрагидро 4-(4-аминобензоил)-8 Н-тиено[3,2-b]азепин-8-он,8-оксим. Смесь 1,0 г 4,5,6,7-тетрагидро-4-(4 нитробензоил)-8 Н-тиено[3,2-b]азепин-8-она, 8 оксима, 6,8 г SnCl22H2O и 14 мл этанола нагревают с обратным холодильником в течение 2 ч. Смесь охлаждают (ледяная баня) и добавляют 1 М NаНСО 3 до тех пор, пока значение рН не достигнет приблизительно 8. Смесь перемешивают в течение 1 ч и затем экстрагируют добавлением этилацетата. Экстракт промывают солевым раствором, сушат (Na2SO4) и растворитель удаляют в вакууме. Остаток хроматографируют на препаративных пластинах из силикагеля,применяя этилацетат-гексан (2:1) в качестве растворителя с получением твердого вещества. Кристаллизация из этилацетата дает 0,37 г не совсем белых кристаллов, т.пл. 156-160 С. Ссылочный пример 65. 8-Амино-4-(4 аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепин. Следуют методике из Synthetic Communications, 18(8), 777-782 (1988). К смеси 0,50 г 5,6,7,8-тетрагидро-4-(4 нитробензоил)-8 Н-тиено[3,2-b]азепин-8-она, 8 оксима, 0,50 г ацетата аммония и 0,283 г цианоборгидрида натрия в 25 мл метанола по каплям добавляют 2,54 мл трихлорида титана (20% водный раствор) при перемешивании. Смесь готовят и повторяют процесс несколько раз с получением твердого вещества. Ссылочный пример 66. N-[4-[5,6,7,8 Тетрагидро-8-(2-метилбензоил)окси]имино]4 Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2 метилбензамид. К охлажденному (0 С) раствору 0,18 г 4,5,6,7-тетрагидро-4-(4-аминобензоил)-8 Н-тиено[3,2-b]азепин-8-она, 8-оксима, и 261 мкл триэтиламина в 4 мл дихлорметана добавляют 204 мкл 2-метилбензоилхлорида. Смесь перемешивают в атмосфере аргона в течение 16 ч и разбавляют 40 мл дихлорметана. Смесь промывают по 20 мл Н 2 О, 2 н. лимонной кислоты, солевого раствора и сушат (Na2SO4). Растворитель удаляют и остаток хроматографируют на силикагеле, применяя этилацетат-гексан в качестве растворителя с получением 0,22 г белого аморфного твердого вещества. Ссылочный пример 67. N-[4-[(5,6,7,8 Тетрагидро-8-оксо-4 Н-тиено[3,2-b]азепин-4 ил)карбонил]фенил]-2-метилбензамид, 8-оксим. К перемешиваемому раствору изcсылочного примера 66 (0,20 г) в 4 мл метанола добавляют 0,93 мл 1 н. NaOH. Смесь перемешивают в течение ночи и концентрируют в вакууме. Остаток разделяют между водой и этилацетатом. Органический слой промывают солевым раствором и концентрируют в вакууме. Охлаждение дает продукт в виде кристаллов (0,10 г). 20 Ссылочный пример 68. 5-(2-Пиридинил) тиофен-2-карбонилхлорид. Смесь 1,0 г 5-(2-пиридинил)тиофен-2 карбоновой кислоты и 5 мл тионилхлорида нагревают с обратным холодильником в течение 2,5 ч. Смесь концентрируют досуха в вакууме. Добавляют толуол (2 раза) и растворитель удаляют в вакууме с получением продукта в виде не совсем белого твердого вещества. Ссылочный пример 69. 6-[(Циклогексилкарбонил)амино]пиридин-3-карбоновая кислота. К охлажденному (0 С) раствору 5,0 г метил-6-амино-пиридин-3-карбоксилата и 12,6 мл диизопропилэтиламина в 50 мл дихлорметана в атмосфере аргона добавляют раствор 9,7 мл циклогексилкарбонилхлорида в 10 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение ночи и разбавляют 200 мл дихлорметана и 60 мл воды. Органический слой отделяют, промывают 60 мл солевого раствора и сушат (Nа 2SО 4). Раствор фильтруют через тонкий пад водного силиката магния и фильтрат концентрируют в вакууме с получением 12,8 г твердого вещества. Вышеупомянутое твердое вещество (12,0 г) в смеси 150 мл тетрагидрофурана-метанола(1:1) охлаждают (0 С) и добавляют 62 мл 2 н. гидроксида натрия. Смесь перемешивают при комнатной температуре в течение 3 ч, нейтрализуют 10 мл ледяной уксусной кислоты и концентрируют в вакууме. Смесь (содержащую твердое вещество) закисляют до рН 1 с помощью 1 н. НСl и экстрагируют добавлением 250 мл этилацетата и дважды 100 мл этилацетата. Объединенный экстракт промывают 100 мл солевого раствора, сушат (Na2SO4) и концентрируют до белого твердого вещества. Растирание с гексаном дает 6,5 г продукта в виде белого твердого вещества. Ссылочный пример 70. Метил-6 аминопиридин-3-карбоксилат. Сухой метанол (400 мл) охлаждают на ледяной бане и смесь барботируют газообразным НСl в течение 25 мин. К МеОН-НСl добавляют 30 г 6-аминопиридин-3-карбоновой кислоты и затем смесь перемешивают и нагревают при 90 С в течение 2 ч (все твердое вещество растворяется). Растворитель удаляют в вакууме и оставшееся твердое вещество растворяют в 100 мл воды. Кислый раствор нейтрализуют насыщенным бикарбонатом натрия (выделяется твердое вещество) и смесь охлаждают и фильтруют с получением 30 г белых кристаллов, т.пл. 150-154 С. Ссылочный пример 71. 6-[(5-Фтор-2-метилбензоил)амино]пиридин-3-карбоновая кислота. К смеси 4,5 г метил-6-аминопиридин-3 карбоксилата и 5,53 мл триэтиламина в 40 мл дихлорметана (охлажденной на ледяной бане) добавляют 6,38 г 5-фтор-2-метилбензоилхлорида в 10 мл дихлорметана. Смесь переме 21 шивают при комнатной температуре в атмосфере аргона в течение 18 ч и добавляли дополнительные 3,4 г 5-фтор-2-метилбензоилхлорида. После перемешивания при комнатной температуре в течение 3 ч смесь фильтруют с получением 3,0 г метил-6-бис(5-фтор-2-метилбензоил)]-амино]пиридин-3-карбоксилата. Фильтрат концентрируют досуха и остаток растирают с гексаном и этилацетатом с получением дополнительных 9,0 г бис-ацилированного соединения. Смесь 12,0 г метил-6-бис(5-фтор-2 метилбензоил)]-амино]пиридин-3-карбоксилата,60 мл метанола-тетрагидрофурана (1:1) и 23 мл 5 н. NaOH перемешивают при комнатной температуре в течение 16 ч. Смесь концентрируют в вакууме, разбавляют 25 мл воды, охлаждают и подкисляют 1 н. НСl. Смесь фильтруют и твердое вещество промывают водой с получением 6,3 г продукта в виде белого твердого вещества. Следующие 6-[(ароил)амино]пиридин-3 карбоновые кислоты, 6-[(гетероароил)амино] пиридин-3-карбоновые кислоты и родственные 6-[(ацилированные)амино]пиридин-3 карбоновые кислоты получают, как описывается в случае cсылочного примера 71, заменяя подходящие ароилхлорид, гетероароилхлорид, циклоалканоилхлориды, фенилацетилхлориды и родственные подходящие галогенангидриды. Ссылочный пример 72. 6-[(3-Метил-2 тиенилкарбонил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 73. 6-[(2-Метил-3 тиенилкарбонил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 74. 6-[(3-Метил-2 фуранилкарбонил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 75. 6-[(2-Метил-3 фуранилкарбонил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 76. 6-[(3-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 77. 6-[(2-Метилбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 78. 6-[(2-Хлорбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 79. 6-[(2-Фторбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 80. 6-[(2-Хлор-4 фторбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 81. 6-[(2,4-Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 82. 6-[(4-Хлор-2-фторбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 83. 6-[(3,4,5-Триметоксибензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 84. 6-[(2,4-Дифторбензоил)амино]пиридин-3-карбоновая кислота. 23 Ссылочный пример 108. 6-[(2-(Трифторметил)бензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 109. 6-[(2,6-Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 110. 6-[(2,6-Диметилбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 111. 6-[(2-Метилтиобензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 112. 6-[(4-Фтор-2(трифторметил)бензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 113. 6-[(2,3-Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 114. 6-[(4-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 115. 6-[(2,3,5-Трихлорбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 116. 6-[(5-Фтор-2 хлорбензоил)амино]пиридин-3-карбоновая кислота. Ссылочный пример 117. 6-[(2-Фтор-5(трифторметил)бензоил)амино]пиридин-3 карбоновая кислота. Ссылочный пример 118. 6-[(5-Фтор-2-метилбензоил)амино]пиридин-3-карбонилхлорид. Смесь 6,2 г 6-[(5-фтор-2-метилбензоил) амино]пиридин-3-карбоновой кислоты и 23 мл тионилхлорида нагревают с обратным холодильником в течение 1 ч. Добавляют дополнительные 12 мл тионилхлорида и смесь нагревают с обратным холодильником в течение 0,5 ч. Смесь концентрируют досуха в вакууме и к остатку добавляют 30 мл толуола. Толуол удаляют в вакууме и процесс (добавление и удаление толуола) повторяют с получением 7,7 г сырого продукта в виде твердого вещества. Следующие 6-ацил)амино)пиридин-3-карбонилхлориды получают, как описывается в случае ссылочного примера 118. Ссылочный пример 119. 6-[(3-Метил-2 тиенилкарбонил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 120. 6-[(2-Метил-3 тиенилкарбонил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 121. 6-[(3-Метил-2 фуранилкарбонил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 122. 6-[(2-Метил-3 фуранилкарбонил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 123. 6-[(3-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 124. 6-[(2-Метилбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 125. 6-[(2-Хлорбензоил)амино]пиридин-3-карбонилхлорид белые кристаллы. 25 Ссылочный пример 149. 6-[(2,5-Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 150. 6-[(3,5-Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 151. 6-[(2-Метил-4 хлорбензоил)амино]пиридин-3 карбонилхлорид. Ссылочный пример 152. 6-[(2,3-Диметилбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 153. 6-[(2-Метоксибензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 154. 6-[(2-Трифторметоксибензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 155. 6-[(4-Хлор-2 метоксибензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 156. 6-[(2-(Трифторметил)бензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 157. 6-2,6-Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 158. 6-[(2, 6-Диметилбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 159. 6-[(2-Метилтиобензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 160. 6-[(4-Фтор-2(трифторметил)бензоил)амино]пир и дин-3-карбонилхлорид. Ссылочный пример 161. 6-[(2,3-Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 162. 6-[(4-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 163. 6-[(2,3,5-Трихлорбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 164. 6-[(5-Фтор-2 хлорбензоил)амино]пиридин-3-карбонилхлорид. Ссылочный пример 165. 6-[(2-Фтор-5-(трифторметил)бензоил)амино]пиридин-3-карбонилхлорид. Следующие бис-ацилированные продукты получают и очищают по методу хроматографии на силикагеле, как описывается в случае ссылочного примера 71. Данные соединения затем подвергаются гидролизу до кислот, как описывается в ссылочном примере 71 (таблица Б). Таблица АM+ представляет собой молекулярный ион, обнаруженный в массспектре FAB. Ссылочный пример 190. 6-Амино-5 бромпиридин-3-карбоновая кислота. К перемешиваемому раствору 6 аминоникотиновой кислоты (13,8 г, 0,1 моль) в ледяной уксусной кислоте (100 мл) медленно добавляют бром (16 г, 5 мл, 0,1 моль) в уксусной кислоте (20 мл). Реакционную смесь перемешивают в течение 8 ч при комнатной температуре и уксусную кислоту удаляют в условиях пониженного давления. Остаток в виде желтого твердого вещества растворяют в воде и осторожно нейтрализуют с помощью 30% NH4OH. Выделившееся твердое вещество отфильтровывают и промывают водой с получением 18 г твердого вещества; масс-спектр: 218 (М+). Ссылочный пример 191. Метил-6-амино-5 бромпиридин-3-карбоксилат. 6-Амино-5-бромпиридин-3-карбоновую кислоту (10 г, 50 ммоль) растворяют в насыщенной метаноловой НСl (100 мл) и нагревают с обратным холодильником в течение 24 ч. Растворитель, метанол, удаляют в условиях пониженного давления и остаток растворяют в ледяной воде. Водный раствор нейтрализуют 0,1 н.NaOH и твердое вещество, которое выделяется,отфильтровывают; хорошо промывают водой и 27 сушат на воздухе с получением 10 г продукта в виде твердого вещества: масс-спектр 231 (М+). Ссылочный пример 192. 6-[(2-Метилбензолацетил)амино]пиридин-3-карбоновая кислота. К охлажденной (0 С) смеси 5,0 г метил-6 аминопиридин-3-карбоксилата, 12,6 мл N,Nдиизопропилэтиламина в 40 мл дихлорметана добавляют раствор 12,2 г 2-метилбензолацетилхлорида в 10 мл дихлорметана. Смесь перемешивают в атмосфере аргона при комнатной температуре в течение ночи. Смесь разбавляют 200 мл дихлорметана и 50 мл воды и органический слой отделяют. Органический слой промывают по 50 мл 1 М NаНСО 3, солевого раствора и сушат (Na2SO4). Раствор фильтруют через тонкий пад водного силиката магния и фильтрат концентрируют досуха. Остаток (9,0 г) хроматографируют на колонке с силикагелем,применяя гексан-этилацетат (3:1) в качестве элюента с получением 8,6 г твердого вещества. Данное твердое вещество, главным образом,метил-6-бис(2-метил-бензолацетил)]амино] пиридин-3-карбоксилат, растворяют в 60 мл тетрагидрофурана-метанола (1:1) и к раствору добавляют 23 мл 5 н. NaOH. Смесь перемешивают при комнатной температуре в течение ночи и смесь концентрируют в вакууме. Добавляют воду (25 мл) и смесь перемешивают и подкисляют холодной 1 н. НСl. Смесь охлаждают и отфильтровывают твердое вещество и промывают водой с получением 5,9 г не совсем белого твердого вещества. Ссылочный пример 193. 6-[(2-Метилбензолацетил)амино]пиридин-3-карбонилхлорид. Смесь 4,5 г 6-[(2-метилбензолацетил) амино]пиридин-3-карбоновой кислоты и 25 мл тионилхлорида нагревают с обратным холодильником в течение 1 ч и затем концентрируют досуха в вакууме. К остатку добавляют 20 мл толуола и растворитель удаляют в вакууме. Добавление и удаление толуола повторяют и оставшееся твердое вещество сушат при комнатной температуре в вакууме с получением 5,3 г темнокоричневого твердого вещества. Ссылочный пример 194. 2-(2-Пиридинил) бензойная кислота. Смесь метил-2-иодбензоата (12 г, 47 ммоль), 2-пиридинил-три-н-бутилолова (20 г, 55 ммоль) и тетракис(трифенил-фосфина) палладия(0) (2 г) нагревают с обратным холодильником в толуоле (дегазированном) в течение 48 ч. Реакционную смесь концентрируют в вакууме и остаток хроматографируют на колонке с силикагелем, применяя 50% этилацетат:гексан в качестве элюента. Начальные фракции (2 lits) отбрасывают и в итоге продукт метил-2-(2 пиридинил)бензоат элюируют и выделяют в виде масла. (Выход: 5,5 г): масс-спектр, 213(М+). Смесь предыдущего соединения (3,0 г, 14 ммоль) и NaOH (600 мг, 15 ммоль) нагревают с(50 мл) в течение 4 ч. Когда реакция завершается, ее концентрируют в вакууме и остаток растворяют в 50 мл холодной воды. Нейтрализация с помощью ледяной уксусной кислоты позволяет получить твердое вещество, которое отфильтровывают и промывают водой с получением 2,5 г коричневого твердого вещества; малорастворимое в воде; масс-спектр (CI) 200(M+1). Пример 1. N-[4-[5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил)карбонил]фенил]-3,4 дихлорбензамид. К раствору 0,30 г 4-(4-аминобензоил)5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепина и 0,208 мл триэтиламина в 10 мл дихлорметана добавляли в атмосфере аргона 0,251 г 3,4 дихлорбензоилхлорида. Смесь перемешивают в течение ночи и концентрируют досуха в вакууме. Остаток растворяют в этилацетате и раствор промывают Н 2 О, 2 н. лимонной кислотой, раствором NаНСО 3, солевым раствором и сушат(Na2SO4). Растворитель удаляют и оставшееся желтое твердое вещество кристаллизуют из этилацетата-гексана с получением 0,254 г кристаллов, т.пл. 154-160 С. Пример 2. N-[4-[5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил)карбонил]фенил]-2 хлорбензолацетамид. Раствор 0,307 г 2-хлорфенилуксусной кислоты в 3 мл тионилхлорида перемешивают в течение 2 ч при комнатной температуре. Избыток тионилхлорида удаляют в вакууме и добавляют 5 мл толуола и удаляют (в вакууме) три раза. Остаток растворяют в 5 мл дихлорметана и 0,3 мл триэтиламина. К раствору добавляют (в атмосфере аргона) 0,49 г 4-(4-амино-бензоил)5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепина и смесь перемешивают в течение ночи. Летучие компоненты удаляют в вакууме и остаток растворяют в этилацетате. Раствор промывают 1 н. НСl, раствором Na2 СО 3, солевым раствором и сушат (Nа 2SO4). Растворитель удаляют и оставшееся твердое вещество кристаллизуют из этилацетата-гексана с получением 0,36 г желтокоричневых кристаллов, т.пл. 178-180 С. Пример 3. N-[4-[5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил)карбонил]фенил]-2 метилбензамид. Как описывается в случае примера 1, 4-(4 аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепин (0,001 мл) вступает в реакцию с 2 метилбензоилхлоридом в дихлорметане с получением продукта. Кристаллизация из этилацетата-гексана дает кристаллы, т.пл. 181-182 С. Следующие соединения получают, как описано в примере 1. Пример 4. N-[4-[(5,6,7,8-Тетрагидро-4 Н-тиено[3,2b]азепин-4-ил]карбонил]фенил]-2-фуранкарбоксамид, бежевое твердое вещество.[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-3 фтор-5-(трифторметил)бензамид. Пример 93. 2,4-Дихлор-N-[4-[(2-хлор 5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин-4-ил] карбонил]фенил]бензамид. К охлажденному (ледяная баня) раствору 0,245 г (0,8 ммоль) 2-хлор-4-(4-аминобензоил)5,6,7,8-тетрагидро-4 Н-тиено-[3,2-b]азепина и 167 мкл (1,2 ммоль) триэтиламина в 5 мл дихлорметана добавляют 140 мкл (1 ммоль) 2,4 дихлорбензоилхлорида. Раствор перемешивают в атмосфере аргона при комнатной температуре в течение ночи и разбавляют 60 мл дихлорметана. Смесь промывают по 20 мл 2 н. лимонной кислоты, Н 2O, 1 М NаНСО 3, солевым раствором и сушат (Na2SO4). Растворитель удаляют в вакууме и остаток кристаллизуют из этилацетатагексана с получением 0,315 г белых кристаллов,т.пл. 187-189 С. Следующие соединения получают, как описано в примере 93. Пример 94. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]фенил]-3 фтор-2-метилбензамид, т.пл. 186-188 С. 95. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-2,6 дихлорбензамид, т.пл. 245-248 С. 96. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-2 метилбензамид, т.пл. 169-170 С. 97. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-2,5 дихлорбензамид. 98. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-3,5 дихлорбензамид. 36 139. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-2 фтор-5-(трифторметил)бензамид. 140. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-2 фтор-6-(трифтор-метил)бензамид. 141. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-3 фтор-5-(трифторметил)бензамид. 142. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-3-фтор-2-метилбензамид. 143. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2,3-дихлорбензамид. 144. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2,4-дихлорбензамид. 145. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2-диметилбензамид. 146. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-4-фтор-2-метилбензамид. 147. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-5-фтор-2-метилбензамид. 148. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2,3-диметилбензамид. 149. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2-метил-3-хлорбензамид. 150. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2-фтор-4-(трифторметил)бензамид. 151. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2-(трифторметил)бензамид. 152. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2-(метилтио)бензамид. 153. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-метоксифенил]-5-фтор-3-метилбензамид. 154. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-метоксифенил]-3-фтор-2-метилбензамид. Пример 155. N-[4-[(5,6,7,8-Тетрагидро-8 оксо-4 Н-тиено[3,2-b]азепин-4-ил]карбонил] фенил]-3-фтор-2-метилбензамид. К смеси 287 мг 4,5,6,7-тетрагидро-4-(4 аминобензоил)-8 Н-тиено[3,2-b]азепин-8-она в 3 мл метиленхлорида и 209 мкл триэтиламина,который охлаждают до 0C, добавляют 207,1 мг 2-метил-3-фторбензоилхлорида. Охлаждающую баню удаляют и реакционную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 18 ч. Добавляют дополнительные 50 мл метиленхлорида и 20 мл воды и отделенный органический слой промывают 2 н. лимонной кислотой, 1 М NаНСО 3 и солевым рас 37 твором. Органический слой сушат с помощьюNa2SO4 и пропускают через тонкий пад водного силиката магния и фильтрат выпаривают в вакууме до белой пены, которую кристаллизуют из этилацетата-гексана с получением 305 мг желаемого продукта в виде белого твердого вещества, т.пл. 200-202 С. Следующие соединения получают, как описано в примере 155. Пример 156. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]фенил]-2,4 дихлорбензамид, т.пл. 233-235 С. 157. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]фенил]-2 метилбензамид. 158. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]фенил]-2(трифторметил)-4-фторбензамид. 159. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]фенил]-4 фтор-2-метилбензамид. 160. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]фенил]-5 фтор-2-метилбензамид. 161. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-3-фтор-2-метилбензамид. 162. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-2,3-диметилбензамид. 163. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-2,3-дихлорбензамид. 164. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-2-(трифторметокси)бензамид. 165. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-2,6-дихлорбензамид. 166. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-2-метилтиобензамид. 167. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-3-метил-2-тиофенкарбоксамид. 168. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-3-метил-2-фуранкарбоксамид. 169. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-хлорфенил]-2-метил-3-хлорбензамид. 170. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метоксифенил]-3-фтор-2-метилбензамид. 171. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метоксифенил]-5-фтор-2-метилбензамид. 172. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-2-хлорфенил]-2,4-дихлорбензамид. 38 173. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-2-хлорфенил]-2-метилбензамид. 174. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-2-хлорфенил]-3-фтор-2-метилбензамид. 175. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-2-хлорфенил]-5-фтор-2-метилбензамид. 176. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-2-хлорфенил]-2-(трифторметил)бензамид. 177. N-[4-[(5,6,7,8-Тетрагидро-8-оксо-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-2-хлорфенил]-2-метил-4-фторбензамид. Пример 178. 4-[(2-(3-Пиридинил)тиазол-4 илкарбонил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепин. К охлажденному (0 С) раствору 2 ммоль 5,6,7,8-тетра-гидро-4 Н-тиено[3,2-b]азепина,6 ммоль N,N-диизопропилэтиламина в 8 мл дихлорметана добавляют 2,2 ммоль 2-(3 пиридинил)тиазол-4-карбонилхлорида. Смесь перемешивают при комнатной температуре в течение 16 ч и разбавляют 50 мл дихлорметана и 25 мл воды. Органический слой отделяют,промывают H2O, 1 н. NаНСО 3, солевым раствором и сушат (Na2SO4). Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле, применяя этилацетат-гексан в качестве растворителя с получением продукта в виде твердого вещества. Пример 179. N-[4-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-4 оксо-4,5,6,7-тетрагидробензо[b]фуран-3-карбоксамид. Раствор 240 мг 4-оксо-4,5,6,7-тетрагидробензо[b]-фуран-3-карбонилхлорида в 3 мл метиленхлорида охлаждают до 0 С и при перемешивании добавляют 209 мкл триэтиламина с последующим добавлением 273 мг 4-(4 аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепина. Перемешивание продолжают при комнатной температуре в атмосфере аргона в течение 18 ч. Добавляют дополнительные 240 мг хлорангидрида кислоты и 209 мкл триэтиламина в 1 мл метиленхлорида. Перемешивание продолжают в течение 2 ч, нагревание с обратным холодильником - в течение 3 ч и перемешивание при комнатной температуре - в течение 18 ч. Реакционную смесь концентрируют в вакууме, разбавляют 30 мл этилацетата и промывают по 12 мл воды, 2 н. лимонной кислоты, 1 М бикарбоната натрия, солевого раствора и сушат над Na2SO4. Органический слой концентрируют в вакууме до пены, которую хроматографируют на препаративной пластине из силикагеля, применяя 1:1 этилацетат-гексан в качестве растворителя с получением 60 мг желаемого продукта в виде белого твердого вещества, т.пл. 188192 С. 39 Пример 180. N-[4-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]индол 5-карбоксамид. К раствору 250 мг индол-5-карбоновой кислоты в 5 мл тетрагидрофурана при 0 С добавляют 327 мг N,N-карбонил-диимидазола с последующим перемешиванием в течение 2 ч. Летучие компоненты выпаривают до остатка в вакууме. К остатку добавляют 352 мг 4-(4 аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепина с последующим нагреванием при 100 С в течение 18 ч. Температуру повышают до 120 С и нагревание продолжают в течение дополнительных 4 ч. Реакционную смесь охлаждают до комнатной температуры и разбавляют 40 мл этилацетата, который промывают водой. Органический слой сушат с помощью Nа 2SO4 и концентрируют в вакууме до остатка, который очищают методом хроматографии на препаративных пластинах, применяя 1:1 этилацетатгексан в качестве растворителя с получением 175 мг желаемого продукта в виде белого твердого вещества (из этилацетата). Пример 181. N-[5-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-2-пиридинил]-2-метилфуран-3-карбоксамид. Раствор 2 ммоль 5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепина, 5 ммоль N,N-диизопропилэтиламина и 2,2 ммоль 6-[(3-метил-2 фуранилацетил)амино]пиридин-3-карбонилхлорида в 10 мл CH2Cl2 перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют 50 мл CH2Cl2 и 25 мл воды и органический слой отделяют. Органический слой промывают Н 2 О, 1 н. NаНСО 3, солевым раствором и сушат(Na2SO4). Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле, применяя этилацетат-гексан в качестве растворителя с получением продукта в виде твердого вещества. Пример 182. N-[4-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]фенил]-2 диметиламино)пиридин-3-карбоксамид. Смесь 1,0 г N-[4-[(5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]фенил]-2 хлорпиридин-3-карбоксамида, 1 г К 2 СО 3, 10 мл водного диметиламина (40% по массе раствор в воде) в 25 мл диметилсульфоксида нагревают при 100 С в течение 8 ч. Смесь выливают в ледяную воду и фильтруют. Твердое вещество промывают водой, сушат и хроматографируют на силикагеле, применяя этилацетат-гексан в качестве растворителя с получением продукта в виде твердого вещества. Пример 183. N-[4-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-2-хлор-4-фторбензамид. К раствору 0,50 г 4-(2-хлор-4-аминобензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепина и 342 мкл триэтиламина в 3,5 мл дихлорметана, охлажденному до 0 С, добавляют 40 раствор 0,394 г 2-хлор-4-фторбензоилхлорида в 1,5 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение ночи в атмосфере аргона и добавляют 50 мл дихлорметана и 20 мл Н 2 О. СН 2 Сl2 отделяют и промывают по 20 мл 2 н. лимонной кислоты, 1 М NаНСО 3 и солевого раствора. Из CH2Cl2 получают 0,59 г белых кристаллов, т.пл. 219-221 С. Пример 184. N-[4-[(5,6-Дигидро-4 Н-тиено[3,2-b]азепин-4-ил]карбонил]-3-хлорфенил]-5 фтор-2-метилбензамид. К охлажденному раствору 0,20 г 4-(2-хлор 4-аминобензоил)-5,6-дигидро-4 Н-тиено[3,2-b] азепина и 137 мкл три-этиламина в 3 мл дихлорметана добавляют раствор 0,142 г 5-фтор-2 метилбензоилхлорида в 1 мл дихлорметана. Смесь перемешивают в атмосфере аргона в течение 2 суток и разбавляют 30 мл дихлорметана и 15 мл Н 2 О. Органический слой отделяют и промывают по 15 мл 2 н. лимонной кислоты, 1 МNаНСО 3, солевого раствора и сушат (Na2SО 4). Раствор фильтруют через тонкий пад водного силиката магния, пад фильтра промывают дихлорметаном и фильтрат выпаривают. Остаток кристаллизуют из этилацетата с получением 0,215 г белых кристаллов, т.пл. 125-132 С. Следующие соединения получают, как описано в примере 184. Пример 185.[3,2-b]азепин-4-ил]карбонил]фенил]-3-метил-2 тиофенкарбоксамид. Следующие соединения получают, как описано в примере 183. Пример 221. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-3-фтор-2-метилбензамид. 222. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-5-фтор-2-метилбензамид. 223. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-2-хлор-4-фторбензамид. 224. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-2,3-диметилбензамид. 225. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-2,5-дихлорбензамид. 226. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-2,4-дихлорбензамид. 227. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-2-(трифторметил)бензамид. 228. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3 метилфенил]-2-хлорбензамид. 229. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфенил]-2-хлор-5-фторбензамид. 230. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-метилфенил]-2-(трифторметил)бензамид. 231. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-4-ил]карбонил]-3-метилфенил]-2-метилбензолацетамид. 232. N-[4-[(2-Хлор-5,6,7,8-тетрагидро-4 Нтиено[3,2-b]-азепин-4-ил]карбонил]-3-метилфеил]-3-метил-2-тиофенкарбоксамид. Пример 233. 4-[4-(н-Бутилокси)бензоил]5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. К охлажденному (0 С) раствору 0,306 г 5,6,7,8-тетра-гидро-4 Н-тиено[3,2-b]азепина и 417 мкл триэтиламина добавляют 474 мкл 4-(н 43 бутокси)бензоилхлорида. Смесь перемешивают в течение 3 суток при комнатной температуре,разбавляют 50 мл дихлорметана и 20 мл Н 2 О. Органический слой отделяют и промывают по 20 мл 2 н. лимонной кислоты, 1 М NaHCO3, солевого раствора и сушат (Nа 2SO4). Раствор фильтруют через тонкий пад водного силиката магния, пад промывают CH2Cl2 и фильтрат выпаривают. Остаток кристаллизуют из гексана, содержащего небольшое количество этилацетата. Кристаллы (0,585 г) очищают методом хроматографии на силикагелевых пластинах, применяя гексан-этилацетат (2:1) в качестве растворителя с получением 0,40 г кристаллов (из этилацетатагексана), т.пл. от 87 до 90 С. Следующие соединения получают, как описано в примере 233. Пример 234. 4-[4-(2-Метилбутилокси)бензоил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. 235. 4-[4-(3-Метилбутилокси)бензоил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. 236. 4-[4-(Бензилокси)бензоил]-5,6,7,8 тетрагидро-4 Н-тиено[3,2-b]азепин. 237. 4-[4-(2-Хлорбензилокси)бензоил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. 238. 4-[4-[2-(Циклопентил)этилокси)бензоил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. 239. 4-[4-[2-(Циклогексил)этилокси)бензоил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. 240. 4-[4-[2-(Циклопентил)метокси)бензоил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. 241. 4-[4-[2-(Циклогексил)метокси)бензоил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. 242. 4-[4-(3-Диметилбутилокси)бензоил]5,6,7,8-тетрагидро-4 Н-тиено[3,2-b]азепин. Пример 243. N-[5-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид. К охлажденной (0 С) смеси 0,306 г 5,6,7,8 тетрагидро-4 Н-тиено [3,2-b] азепина и 1,11 мкл триэтиламина в 5 мл дихлорметана добавляют 1,17 г 6-[(5-фтор-2-метилбензоил)амино]пиридин-3-карбонилхлорида и смесь перемешивают в течение ночи при комнатной температуре в атмосфере аргона. Смесь разбавляют 50 мл дихлорметана и 20 мл воды и органический слой отделяют. Органический слой промывают по 20 мл 1 М NаНСО 3, солевого раствора и сушат(Na2SO4). Раствор фильтруют через тонкий пад водного силиката магния и фильтрат выпаривают, концентрируют досуха в вакууме с получением стекловидного вещества. Кристаллизация из этилацетата-гексана дает 0,35 г белых кристаллов, т. пл. 178-180 С. Следующие соединения получают, как описано в примере 243 (таблица А). 45 Пример 288. N-[5-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил)карбонил]-2-пиридинил]-2-метилбензолацетамид. К охлажденной (0 С) смеси 0,306 г 5,6,7,8 тетрагидро-4 Н-тиено[3,2-b]азепина и 1,11 мкл триэтиламина в 5 мл дихлорметана добавляют 1,2 г 6-[(2-метилфенилацетил)амино]пиридин-3 карбонилхлорида. Смесь перемешивают при комнатной температуре в течение 16 ч и разбавляют 50 мл дихлорметана. Смесь промывают Н 2 О, 1 М NаНСО 3, Н 2 О, солевым раствором и сушат (Na2SO4). Раствор концентрируют досуха в вакууме и остаток хроматографируют на силикагеле с получением продукта в виде твердого вещества. Следующие соединения получают, как описано в примере 288 (таблица Б). Таблица Б 46 Пример 325. 5,6,7,8-Тетрагидро-4-[4-(2 метилфенил)амино]карбонил]амино]бензоил]4 Н-тиено[3,2-b]азепин. Смесь 0,409 г 4-(4-аминобензоил)-5,6,7,8 тетрагидро-4 Н-тиено[3,2-b]азепина и 0,60 г 2 метилфенилизоцианата в 2 мл тетрагидрофурана нагревают на масляной бане при 110 С в течение 16 ч. Смесь концентрируют в вакууме и остаток хроматографируют на препаративных силикагелевых пластинах, применяя этилацетатгексан (1:1) в качестве растворителя с получением твердого вещества. Кристаллизация из этилацетата-гексана дает 0,33 г белых кристаллов, т.пл. 179-182 С. Следующие соединения получают, как описано в примере 325 (таблица В). Таблица В[3,2-b]азепина и 432 мкл N,N-диизопропилэтиламина в 5 мл дихлорметана добавляют 0,336 г N-фенил-N-метилкарбамоилхлорида. Смесь перемешивают при комнатной температуре в течение 16 ч и разбавляют 50 мл дихлорметана в атмосфере аргона. Смесь перемешивают в течение ночи и добавляют дополнительные 0,672 гN-фенил-N-метилкарбамоил 47 хлорида, 864 мкл N,N-диизопропилэтиламина и 10 мл толуола. Смесь нагревают с обратным холодильником в течение 16 ч и растворитель удаляют в вакууме. Остаток хроматографируют на силикагеле, применяя этилацетат-гексан (1:1) в качестве растворителя, с получением твердого вещества. Кристаллизация из этилацетатагексана дает 0,34 г не совсем белых кристаллов,т.пл. 160-162 С. Пример 360. N-[4-[(5,6,7,8-Тетрагидро-4 Нтиено[3,2-b]азепин-4-ил)карбонил]-3-хлорфенил][1,1'-бифенил]-2-карбоксамид. Как описывается в случае примера 1, раствор 2 ммоль 4-(2-хлор-4-аминобензоил)-5,6,7,8 тетрагидро-4 Н-тиено[3,2-b]-азепина и 5 ммоль триэтиламина в 10 мл дихлорметана в атмосфере аргона вступают в реакцию с [1,1'-бифенил]2-карбонилхлоридом в течение 16 ч при комнатной температуре с получением продукта в виде твердого вещества. Пример 361. 4-[5-(2-Пиридинил)тиен-2 илкарбонил]-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепин. К охлажденному раствору (0 С) 0,23 г 5,6,7,8-тетра-гидро-4 Н-тиено[3,2-b]азепина, 523 мкл N,N-диизопропилэтиламина в 5 мл дихлорметана добавляют 0,436 г 5-(2 пиридинил)тиофен-2-карбонилхлорида. Смесь перемешивают при комнатной температуре в течение 16 ч в атмосфере аргона и разбавляют 40 мл CH2Cl2 и 20 мл воды. Органический слой отделяют и промывают по 20 мл 1 н. NаНСО 3,солевого раствора и сушат (Na2SO4). Раствор фильтруют через тонкий пад водного силиката магния и фильтрат концентрируют досуха. Остаток кристаллизуют из этилацетата с небольшим количеством гексана с получением 0,485 г желто-коричневых кристаллов, т.пл. 150-154 С. Пример 362. 4-([1,1'-Бифенил]-4-ил) карбонил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепин. Как описывается в случае примера 1, раствор 2 ммоль 5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепина, 5 ммоль триэтиламина и 2,1 ммольCH2Cl2 перемешивают при комнатной температуре в течение 16 ч с получением продукта в виде твердого вещества. Рассматриваемые соединения по настоящему изобретению тестируют на предмет биологической активности. Анализ связывания с рецепторами V1 из печени крыс. Плазматические мембраны из печени крыс, экспрессирующие подтипы VI рецепторов вазопрессина, выделяют на градиенте плотности сахарозы в соответствии с методикой, описанной Lesko et al., (1973). Данные мембраны быстро суспендируют в 50,0 мМ буфере ТрисHCl, рН 7,4, содержащем 0,2% бычий сывороточный альбумин (БСА) и 0,1 мМ фенилметилсульфонил-фторид (ФМСФ), и хранят замороженными при -70 С до тех пор, пока не 48 начинают работать с ними в последующем в экспериментах по изучению связывания. Для проведения экспериментов по изучению связывания в лунки девяностошестилуночного планшета для микротитрования добавляют следующие компоненты: 100 мкл 100,0 мМ буфера ТрисHCl, содержащего 10,0 мМ MgCl2, 0,2% температурно инактивированного БСА и смесь ингибиторов протеаз : лейпептина, 1,0 мг%; апротинина, 1,0 мг%, 1,10-фенан-тролина, 2,0 мг%; ингибитора трипсина, 10,0 мг% и 0,1 мМ ФМСФ, 20,0 мкл [фенилаланил-3,4,5-3H] вазопрессина (Уд. А 45,1 Ки/ммоль) при 0,8 нМ и реакцию начинали добавлением 80 мкл тканевых мембран, содержащих 20 мкг тканевого белка. Планшеты выдерживают в покое на верхней полке шкафа при комнатной температуре в течение 120 мин для достижения равновесия. Неспецифические образцы анализируют в присутствии 0,1 мкМ немеченого антагониста фенилаланил-вазопрессина, добавляемого в объеме 20,0 мкл до конечного инкубационного объема 200 мкл. По окончании связывания содержимое каждой лунки фильтруют, применяя харвестер клеток Brandel (Gaithersburg, MD). Радиоактивность, создаваемую комплексом лиганд-рецептор, уловленную диском фильтра,оценивают методом измерения в жидком сцинтилляторе на счетчике Packard LS с эффективностью 65% для трития. Данные анализируют по значениям ИК 50 с помощью программыLUNDON-2 на предмет конкуренции (LUNDONSOFTWARE, ОН). Анализ связывания с рецепторами V2 из мозгового вещества почек крыс Мозговое вещество из почек крыс иссекают, разрезают на небольшие кусочки дают пропитаться 0,154 мМ раствором хлорида натрия,содержащим 1,0 мМ ЭДТА, с многочисленными сменами жидкой фазы, до тех пор, пока раствор не очистится от крови. Ткань гомогенизируют в 0,25 М растворе сахарозы, содержащем 1,0 мМ ЭДТА и 0,1 мМ ФМСФ, применяя гомогенизатор с тефлоновым пестиком Potter-Elvehjem. Гомогенат фильтруют через несколько слоев (4 слоя) марли. Фильтрат гомогенизируют вновь,применяя гомогенизатор Даунса с плотно притертым пестиком. Итоговый гомогенат центрифугируют при 1500 хg в течение 15 мин. Осадок из ядер отбрасывают и надосадочную жидкость центрифугируют вновь при 40000 хg в течение 30 мин. Полученный образовавшийся осадок содержит темную внутреннюю часть с наружной, светло-розовой. Розовую наружную часть суспендируют в небольшом количестве 50,0 мМ буфера ТрисНСl, рН 7,4. Содержание белка определяют по методу Lowry (Lowry et al., J.Biol. Chem., 1953). Суспензию мембран хранят при -70 С, в 50,0 мМ буфере ТрисНСl, содержащем 0,2% инактивированный БСА и 0, 1 мМ ФМСФ в аликвотах 1,0 мл, содержащих 10,0 мг 49 белка на мл суспензии до тех пор, пока не начинают работать с ними в последующем в экспериментах по изучению связывания. Для проведения экспериментов по изучению связывания в мкл объеме в лунки девяностошестилуночного планшета для микротитрования добавляют следующие компоненты: 100 мкл 100,0 мМ буфера ТрисHCl, содержащего 0,2% температурно инактивированного БСА,10,0 мМ MgCl2 и смесь ингибиторов протеаз: лейпептина, 1,0 мг%; апротинина, 1,0 мг%, 1,10 фенантролина, 2,0 мг%; ингибитора трипсина,10,0 мг% и 0,1 мМ ФМСФ, 20,0 мкл [3H]apгинин 8-вaзoпpeccинa (Уд. А 75,0 Ки/ммоль) при 0,8 нМ и реакцию начинали добавлением 80 мкл тканевых мембран (200,0 мкг тканевого белка). Планшеты выдерживают в покое на верхней полке шкафа при комнатной температуре в течение 120 мин для достижения равновесия. Неспецифические образцы оценивают в присутствии 0,1 мкМ немеченого лиганда, добавляемого в объеме 20,0 мкл. Что касается тестируемых соединений, их растворяют в 50% диметилсульфоксиде (ДМСО) и добавляют в объеме 20,0 мкл до конечного инкубационного объема 200 мкл. По окончании связывания содержимое каждой лунки фильтруют, применяя харвестер клеток Brandel (Gaithersburg, MD). Радиоактивность, создаваемую комплексом лиганд-рецептор, уловленную диском фильтра,оценивают методом измерения в жидком сцинтилляторе на счетчике Packard LS с эффективностью 65% для трития. Данные анализируют по значениям ИК 50 с помощью программыLUNDON-2 на предмет конкуренции (LUNDONSOFTWARE, ОН). Эксперименты по связыванию радиолигандов с мембранами тромбоцитов человека. Тромбоциты получают из Hudson ValleyBlood Services, Westchester Medical Center, Valhalla, NY. Получение мембран тромбоцитов Замороженную богатую тромбоцитами плазму (БТП), полученную из Hudson ValleyBlood Services, оттаивают при комнатной температуре. Пробирки, содержащие БТП, центрифугируют при 16000 хg в течение 10 мин при 4 С и надосадочную жидкость отбрасывают. Тромбоциты ресуспендируют в равном объеме 50,0 мМ ТрисНСl, рН 7,5, содержащего 120 мМNaCl и 20,0 мМ ЭДТА. Суспензию центрифугируют вновь при 16000 хg в течение 10 мин. Данную стадию промывания повторяют еще один раз. Смыв отбрасывают и лизированный осадок гомогенизируют в буфере ТрисНСl с низкой ионной силой, 5,0 мМ, рН 7,5, содержащем 5,0 мМ ЭДТА. Гомогенат центрифугируют при 39000 хg в течение 10 мин. Полученный осадок ресуспендируют в буфере ТрисНСl, 70,0 мМ,рН 7,5, и вновь центрифугируют при 39000 хg в течение 10 мин. 50 Полученный в итоге осадок ресуспендируют в буфере 50,0 мМ ТрисHCl, рН 7,4, содержащем 120 мМ NaCl и 5,0 мМ НСl с получением 1,0-2,0 мг белка на мл суспензии. Связывание с рецепторами вазопрессина подтипа V1 мембран тромбоцитов человека В лунки девяностошестилуночного планшета для микротитрования добавить 100 мкл 50,0 мМ буфера ТрисHCl, содержащего 0,2% БСА и смесь ингибиторов протеаз (апротинина,лейпептина и т.д.). Затем добавить 20 мкл[3H]лиганда: (Manning или Аrg8 вазопрессин) с получением конечной концентрации, колеблющейся в пределах от 0,01 до 10,0 нМ. Инициировать связывание добавлением 80,0 мкл суспензии тромбоцитов (приблиз. 100 мкг белка). Смешать все реагенты путем пипетирования смеси несколько раз. Неспецифическое связывание измеряют в присутствии 1,0 мкМ немеченого лиганда (Manning или Аrg8 вазопрессина). Выдержать смесь в покое при комнатной температуре в течение девяноста (90) мин. По истечении данного времени быстро профильтровать инкубируемую смесь с вакуумным отсосом через фильтры GF/B, применяя харвестерBrandel. Определить радиоактивность, уловленную дисками фильтров, путем добавления жидкого сцинтиллятора и измерения в жидком сцинтилляторе. Связывание с мембранами мышиных фибробластов клеточной линии (LV-2 ), трансфицированных кДНК, экспрессирующей вазопрессиновый рецептор V2 человека Получение мембран Колбы емкостью 175 мл, содержащие прикрепленные клетки, выращенные до слияния,освобождали от культуральной среды путем аспирации. Колбы, содержащие прикрепленные клетки, промывают 2 х 5 мл фосфатно-буферного раствора (ФБР) и жидкость каждый раз аспирируют. В итоге добавляют 5 мл свободного от ферментов диссоциирующего раствора Хэнка(Specialty Media, Inc., Lafayette, NJ) и колбы выдерживают в покое в течение 2 мин. Содержимое всех колб выливают в центрифужную пробирку и клетки осаждают при 300 хg в течение 15 мин. Раствор Хэнка аспирируют и клетки гомогенизируют с помощью polytron в режиме 6 в течение 10 с в 10,0 мМ буфере ТрисНСl,рН 7,4, содержащем 0,25 М сахарозу и 1,0 мМ ЭДТА. Гомогенат центрифугируют при 1500 хg в течение 10 мин для удаления теней мембран. Надосадочную жидкость центрифугируют при 100000 хg в течение 60 мин для осаждения белка рецептора. По завершении осадок ресуспендируют в небольшом объеме 50,0 мМ буфера ТрисНСl, рН 7,4. Содержание белка определяют по методу Лоури и мембраны, содержащие рецептор, суспендируют в 50,0 мМ буфере ТрисНСl, содержащем 0,1 мМ фенилметилсульфонилфторид (ФМСФ) и 0,2% бычий сыво 51 роточный альбумин (БСА) с получением 2,5 мг белка рецептора на мл суспензии. Связывание с рецептором Для проведения экспериментов по изучению связывания в мкл объеме в лунки девяностошестилуночного планшета для микротитрования добавляют следующие компоненты: 100 мкл 100,0 мМ буфера ТрисHCl, содержащего 0,2% температурно инактивированного БСА,10,0 мМ MgCl2 и смесь ингибиторов протеаз: лейпептина, 1,0 мг%; апротинина, 1,0 мг%, 1,10 фенантролина, 2,0 мг%; ингибитора трипсина,10,0 мг% и 0,1 мМ ФМСФ, 20,0 мкл [3 Н] аргинин 8-вазопрессина (Уд. А 75,0 Ки/ммоль) при 0,8 нМ и реакцию начинали добавлением 80,0 мкл тканевых мембран (200,0 мкг тканевого белка). Планшеты выдерживают в покое на верхней полке шкафа в течение 120 мин для достижения равновесия. Неспецифическое связывание оценивают в присутствии 1,0 мкМ немеченого лиганда, добавляемого в объеме 20 мкл. Что касается тестируемых соединений, их растворяют в 50% диметилсульфоксиде(ДМСО) и добавляют в объеме 20,0 мкл до конечного инкубационного объема 200 мкл. По окончании связывания содержимое каждой лунки фильтруют, применяя харвестер клеток Brandel (Gaithersburg, MD). Радиоактивность, создаваемую комплексом лиганд-рецептор, уловленную диском фильтра, оценивают методом измерения в жидком сцинтилляторе на счетчикеPackard LS с эффективностью 65% для трития. Данные анализируют по значениям ИК 50 с помощью программы LUNDON-2 на предмет конкуренции (LUNDON SOFTWARE, ОН). Активность антагонистов вазопрессиновых рецепторов V2 у взрослых гидратированных(conscious hydrated) крыс Взрослым гидратированным крысам вводят исследуемые соединения в дозировках от 0,1 до 100 мг/кг перорально или с носителем. Для каждого соединения использовали от двух до четырех крыс. Одним часом позже вводят аргининвазопрессин (АВП, антидиуретический гормон, АДГ), растворенный в арахисовом масле, в дозировке 0,4 мкг/кг внутрибрюшинно. Две крысы в каждом тесте не получают аргининвазопрессин, а получают только носитель(арахисовое масло), чтобы служить в качестве контроля поступления воды. Через двадцать минут каждая крыса перорально через желудочный зонд получает 30 мл/кг деионированной воды и помещается отдельно в клетку для исследования метаболизма, оборудованную воронкой и градуированным стеклянным цилиндром для сбора мочи в течение четырех часов. Объем мочи измеряют и осмотическое давление анализируют, применяя осмометр Fiske One-Ten 52 В следующих результатах сниженный объем мочи и повышенное осмотическое давление,взаимосвязанные с подавлением АВП свидетельствуют о присутствующей активности. Результаты данного теста на примере показательных соединений по данному изобретению показаны в таблице 3. Активность антагонистов вазопрессиновых рецепторов V1 у взрослых (conscious) крыс Взрослых крыс фиксируют в положении лежа на спине с помощью эластичной ленты. Область у основания хвоста подвергают местной анестезии путем подкожной инфильтрации 2% прокаином (0,2 мл). Применяя асептическую методику, выделяют вентрально-каудальную хвостовую артерию и канюлю, сделанную из ПЭ 10 и 20 (сплавленных) трубок, проводят в нижнюю брюшную аорту. Канюлю закрепляют,гепаринизируют (1000 МЕ/см 3), изолируют и рану закрывают одним или двумя швами, применяя Dexon 4-0. Хвостовую вену также канюлируют таким же образом для внутривенного введения лекарственных средств. Продолжительность операции составляет приблизительно 5 мин. При необходимости осуществляют дополнительную местную анестезию (2% прокаин или лидокаин). Животных помещают в ограничивающие клетки в прямостоячем положении. Канюлю присоединяют к датчику давления StathamP23Db и записывают пульсовое кровяное давление. Ответные реакции в виде повышения систолического кровяного давления на инъекции 0,01 и 0,2 международных единиц (ME) (350 МЕ=1 г) аргининвазопрессина записывают до введения любого лекарственного средства (соединения), после чего каждой крысе вводят перорально 0,1-100 мг/кг (10 см 3/кг) или внутривенно 0,1-30 мг/кг (1 см 3/кг) исследуемых соединений. Инъекции вазопрессина повторяют через 30, 60, 90, 120, 180, 240 и 300 мин. антагонистическое действие соединений в процентах рассчитывают, принимая сосудосуживающий эффект вазопрессина до введения лекарственного средства за 100%. Результаты данного теста на примере показательных соединений по данному изобретению показаны в таблице 4. Таблица 1 Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Таблица 1 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Таблица 1 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Таблица 1 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс илисвязывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), транс Таблица 1 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Таблица 2 Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Анализ связывания с рецепторами V1 печени крыс. Таблица 2 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Анализ связывания с рецепторами V1 печени крыс. Таблица 2 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Анализ связывания с рецепторами V1 печени крыс. Таблица 2 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Анализ связывания с рецепторами V1 печени крыс. Таблица 2 (прод.) Анализ связывания с рецепторами V1 печени крыс и рецепторами V2 мозгового вещества почек крыс или связывание с рецепторами подтипа V1 тромбоцитов человека и связывание с мембранами мышиных фибробластов клеточной линии (LV-2), трансфицированных кДНК, экспрессирующей рецептор V2 человека. Анализ связывания с рецепторами V1 печени крыс. Таблица 3. Активность антагонистов вазопрессиновых рецепторов V2 у взрослых гидратированных крысПримера 3 7 2 11 96 99 13 14 15 93 94 157 156 155 95 70 183 68 Дозировка при пероральном введении, мг/кг 100 100 10 30 30 30 30 30 30 10 10 10 10 10 10 10 10 10 Таблица 4. Сосудосуживающий эффект вазопрессина (VAS)Примера 2 9 10(в/м) вводят диэтилстилбестрол (ДЭС) из расчета 0,3 мг/кг массы тела. Крыс забивают через 18 ч в состоянии пентобарбитальной анестезии. Матки иссекают, очищают от жировой и соединительной тканей и промывают в 50 мл обычного солевого раствора. Ткань, собранную от шести крыс, гомогенизируют в 50 мл 0,01 мМ ТрисНСl, содержащего 0,5 мМ дитиотреитол и 1,0 мМ ЭДТА, доведенного до рН 7,4, применяяpolytron в режиме 6 с тремя пропусканиями, по 10 с каждое. Гомогенат пропускают через два(2) слоя марли и фильтрат центрифугируют при 1000 хg в течение 10 мин прозрачный супернатант удаляют и центрифугируют вновь при 165000 хg в течение 30 мин. Полученный осадок,содержащий окситоциновые рецепторы ресуспендируют в 50,0 мМ ТрисHCl, содержащем 5,0 мМ MgCl2 при рН 7,4 с получением концентрации белка 2,5 мг/мл суспензии ткани. Данный препарат применяют в последующих анализах связывания с [3 Н] окситоцином.(б) Связывание радиолиганда. Связывание 3,5- [3H] окситоцина ([3H]ОТ) с его рецепторами проводят в планшетах для микротитрования, применяя [3H]OT в различных концентрациях в аналитическом 50,0 мМ буфере ТрисHCl, рН 7,4, содержащем 5,0 мМMgCl2 и смесь ингибиторов протеаз: БСА, 0,1 мг; апротинина, 1,0 мг; 1,10-фенантролина, 2,0 мг; ингибитора трипсина, 10,0 мг; и ФМСФ, 0,3 мг на 100 мл буферного раствора. Неспецифическое связывание оценивают в присутствии 1,0 мкМ немеченого ОТ. Реакцию связывания останавливают через 60 мин при 22 С путем быстрого фильтрования через стекловолоконные фильтры, применяя харвестер клеток Brandel(Biomedical Research and Development Laboratories, Inc., Gaithersburg, MD). Эксперименты по изучению конкуренции проводят в равновесии,применяя 1,0 нМ [3H]OT и различные концентрации замещающих агентов. Концентрации агента, замещающего 50% [3H]OT в местах его связывания (ИК 50), рассчитывают с помощью компьютерной программы LUNDON-2 (LUNDON SOFTWARE INC., Ohio, USA). Результаты данного анализа на показательных примерах показаны в таблице 5. Таблица 5. Анализ связывания окситоцинаПримера Соединения по настоящему изобретению могут применяться в форме солей, являющихся производными фармацевтически или физиологически приемлемых кислот или оснований. Данные соли включают, но не ограничиваются,следующее: соли неорганических кислот, таких как соляная кислота, серная кислота, азотная кислота, фосфорная кислота и, в некоторых случаях, таких органических кислот, как уксусная кислота, щавелевая кислота, янтарная кислота и малеиновая кислота. Другие соли включают в себя соли щелочных металлов и щелочноземельных металлов, таких как натрий, калий,кальций или магний, или органических оснований. Соединения также могут применяться в форме сложных эфиров, карбаматов и других традиционных "пролекарственных" формах,которые, будучи введены в такой форме, преобразуются в активную молекулу in vivo. Когда соединения применяются в вышеперечисленных целях, они могут быть объединены с одним или более фармацевтически приемлемых носителей, например, растворителей, разбавителей и тому подобного, и могут вводиться перорально в таких формах, как таблетки, капсулы, диспергируемые порошки, гранулы или суспензии, содержащие, например, приблизительно от 0,05 до 5% суспендирующего агента,сиропы, содержащие, например, приблизительно от 10 до 50% сахара, и эликсиры, содержащие, например, приблизительно от 20 до 50% этанола, и тому подобное, или парентерально в форме стерильных растворов для инъекций или суспензий, содержащих приблизительно от 0,05 до 5% суспендирующего агента в изотонической среде. Такие фармацевтические препараты могут содержать, например, от приблизительно 25 до приблизительно 90% активного ингредиента в сочетании с носителем, более обычно в интервале приблизительно между 5 и 60% по массе. 60 Эффективная дозировка применяемого активного ингредиента может варьировать в зависимости от конкретного применяемого вещества, способа введения и тяжести подвергающегося лечению состояния. Однако главным образом, удовлетворительные результаты достигаются, когда соединения по изобретению вводят в суточной дозе от приблизительно 0,5 до приблизительно 500 мг/кг массы тела животного,предпочтительно введенной в раздельных дозах от двух до четырех раз в сутки, или в виде формы длительного высвобождения. Для наиболее крупных млекопитающих общая суточная доза составляет приблизительно от 1 до 100 мг,предпочтительно приблизительно от 2 до 80 мг. Дозированные формы, подходящие для внутреннего применения, содержат приблизительно от 0,5 до 500 мг активного соединения в однородной смеси с твердым или жидким фармацевтически приемлемым носителем. Данная схема приема лекарственного средства может быть адаптирована так, чтобы обеспечивать оптимальный терапевтический эффект. Например,несколько раздельных доз могут вводиться 'в сутки, или доза может быть пропорционально снижена, если этого требует сложившаяся терапевтическая ситуация. Данные активные соединения могут вводиться перорально, так же как и внутривенным,внутримышечным или подкожным путями. Твердые носители включают в себя крахмал,лактозу, фосфат дикальция, микрокристаллическую целлюлозу, сахарозу и каолин, тогда как жидкие носители включают в себя стерильную воду, полиэтиленгликоли, неионогенные поверхностно-активные вещества и съедобные масла, такие как кукурузное, арахисовое и кунжутное масла, которые подходят к природе активного ингредиента и конкретного желаемого способа введения. Преимущественно могут быть включены адъюванты, обычно применяемые в приготовлении фармацевтических композиций, такие как ароматизаторы, красители,консерванты и антиоксиданты, например, витамин Е, аскорбиновая кислота, ВНТ и ВНА. Предпочтительными фармацевтическими композициями с точки зрения простоты приготовления и введения являются твердые композиции, в частности, таблетки и капсулы с твердым или жидким наполнением. Предпочтительным является пероральный способ введения. Данные активные соединения могут также вводиться парентерально или внутрибрюшинно. Растворы или суспензии данных активных соединений в качестве свободной основы или фармацевтически приемлемая соль могут быть приготовлены в воде, надлежащим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Также дисперсии могут быть приготовлены в глицерине, жидких полиэтиленгликолях и их смесях в маслах. В обычных условиях хранения и
МПК / Метки
МПК: C07D 495/04, A61K 31/55, A61P 9/00, C07D 487/04, C07D 513/04, C07D 471/04
Метки: вазопрессина, качестве, антагонистов, производные, тиеноазепиновые
Код ссылки
<a href="https://eas.patents.su/30-1427-tienoazepinovye-proizvodnye-v-kachestve-antagonistov-vazopressina.html" rel="bookmark" title="База патентов Евразийского Союза">Тиеноазепиновые производные в качестве антагонистов вазопрессина.</a>
Предыдущий патент: Способы терапевтического введения анти-cd40l соединений
Следующий патент: Пирролопиримидины и фармацевтические композиции, включающие эти соединения.
Случайный патент: Способ и аппарат для отделения жидкости от питающего газового потока в каталитическом реакторе












