Производные пиридилкарбамоилиндолинов в качестве антагонистов 5-нт2с-рецепторов
Формула / Реферат
1. Соединение формулы (I) или его соль
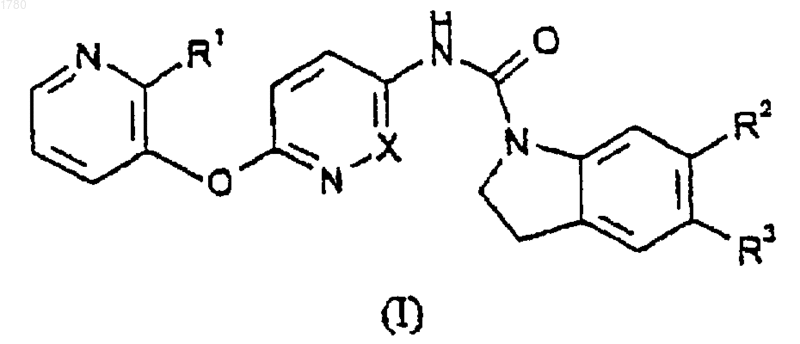
где Х обозначает СН или N;
R1 обозначает водород или C1-6-алкил;
R2 и R3 обозначают независимо C1-6-алкил или трифторметил.
2. Соединение по п.1, в котором Х обозначает СН.
3. Соединение по п.1 или 2, в котором R1 обозначает метил.
4. Соединение по любому из пп.1-3, в котором R2 обозначает СF3.
5. Соединение по любому из пп.1-4, в котором R3 обозначает C1-6-алкил.
6. Соединение по любому из пп.1-5, в котором R3 обозначает метил.
7. Соединение по п.1, которое представляет собой
5-метил-6-трифторметил-1-[6-(2-метилпиридин-3-илокси)-пиридин-3-илкарбамоил]индолин,
5-метил-6-трифторметил-1-[6-(2-метилпиридин-3-илокси)-пиридазин-3-илкарбамоил]индолин,
и их фармацевтически приемлемые соли.
8. Соединение по п.1, которое представляет собой гидрохлорид 5-метил-6-трифторметил-1-[6-(2-метилпиридин-3-илокси)пиридин-3-илкарбамоил]индолина.
9. Способ получения соединения по любому из пп.1-6, включающий реакцию соединения формулы
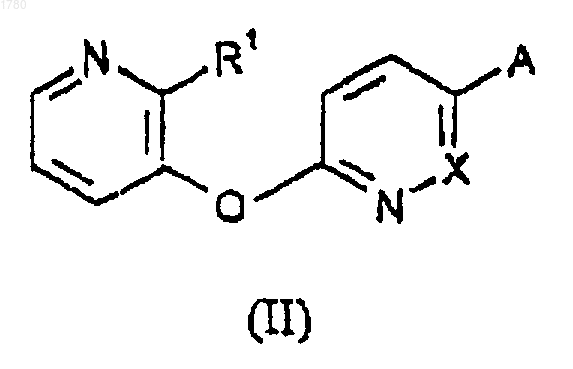
с соединением формулы
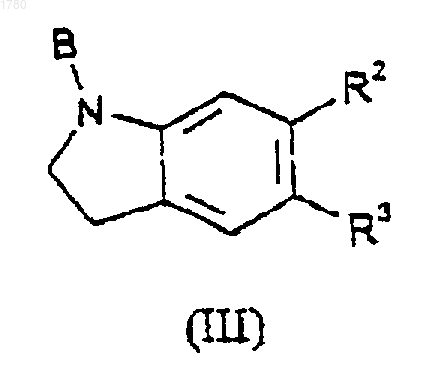
в которой R1, R2 и R3 имеют указанные в формуле (I) значения и А и В имеют следующие значения:
(i) А обозначает -N=C=O и В обозначает водород,
(ii) А обозначает -NHCOL и В обозначает водород,
(iii) А обозначает -NH2 и В обозначает COL, или
(iv) А обозначает галоген и В обозначает -CONH2,
где L является уходящей (отщепляемой) группой;
с последующим необязательным образованием фармацевтически приемлемой соли.
10. Применение соединений по любому из пп.1-8 в качестве антагонистов 5НТ2С-рецепторов при терапевтическом лечении.
11. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 и фармацевтически приемлемый носитель или наполнитель.
12. Применение соединения по любому из пп.1-8 для приготовления лекарственного средства для лечения тревожного состояния и/или депрессии.
13. Соединение формулы

в которой R1 и Х имеют указанные в формуле (I) значения и А обозначает -N=C=O, NHCOL, где L является уходящей группой, NH2 или галогеном.
Текст
Это изобретение относится к соединениям,имеющим фармакологическую активность, способам их получения, композициям, содержащим их, и к их использованию в лечении расстройств ЦНС (центральной нервной системы). РСТ/ЕР 96/00368(WO-A-96/23783,08.08.96) (Smith Kline Beecham plc) описывает производные индола и индолина, которые описаны, как обладающие активностью антагониста 5 НТ 2C/2B-рецептора. Теперь обнаружен новый класс соединений, который охватывается объемом РСТ/ЕР 96/00368, но не раскрыт специально в нем, и, как было обнаружено, проявляет необычно высокую антагонистическую активность в отношении 5 НТ 2C-рецептора (повышенную активность и продолжительность действия при пероральной дозе). Антагонисты 5 НТ 2Cрецептора предположительно могут быть потенциально использованы при лечении расстройств ЦНС, таких как тревожное состояние,депрессия,эпилепсия,навязчиво-компульсивные расстройства, мигрень, болезнь Альцгеймера, расстройства сна, расстройства питания, такие как анорексия и булимия, приступы паники, синдром отмены лекарственного средства при токсикомании, например кокаина, этанола, никотина и бензодиазепинов, шизофрения и также расстройств, связанных со спинальной травмой и/или травмой головы, таких как гидроцефалия. Соединения изобретения также предположительно могут быть использованы для лечения определенных желудочнокишечных расстройств, таких как IBS (IrritableBowel syndrome) (синдром раздраженной толстой кишки), а также болезней капилляров, таких как макулярный отек и ретинопатия. Настоящее изобретение, следовательно, в первом аспекте представляет соединение формулы (I) или его соль 5-метил-1-[2-(2-метилпиридин-3-илокси)-5 пиридилкарбамоил]-6-трифторметилиндолин или 2,3-дигидро-5-метил-N-[2-(2-метил-3-пиридинил)окси]-5-пиридинил]-6-(трифторметил)1H-индол-1-карбоксамид,5-метил-1-[6-(2-метилпиридин-3-илокси)пиридазин-3-илкарбамоил]-6-трифторметилиндолин,и их фармацевтически приемлемые соли. Соединения формулы (I) могут образовывать кислотно-аддитивные соли с общепринятыми фармацевтически приемлемыми кислотами, например с такими как малеиновая, хлористо-водородная, бромисто-водородная, фосфорная, уксусная, фумаровая, салициловая, лимонная, молочная, миндальная, винная и метансульфоновая кислоты. Особенно предпочтительной солью является моногидрохлорид 5 метил-6-трифторметил-1-[6-(2-метилпиридин-3 илокси)пиридин-3-илкарбамоил]индолина. Соединения формулы (I) могут также образовывать N-оксиды или сольваты, такие как гидраты, и изобретение также распространяется и на эти формы. Изобретение также распространяется на любые таутомерные формы соединений формулы (I) и их смеси. В применении здесь подразумевается, что термин "соединения формулы (I)" включает также все эти формы. Соединения изобретения могут быть получены с использованием стандартных процедур,таких как описанные в РСТ/ЕР 96/00368 (WO-А 96/23783), например, реакцией сочетания соединения формулы (II) где X обозначает СН или N;R1 обозначает водород или C1-6-алкил;C1-6-алкил, либо самостоятельно, либо как часть другой группы, может быть в виде прямой или разветвленной цепи. Предпочтительно Х обозначает СН. Предпочтительно R1 обозначает метил. Предпочтительно R2 обозначает СF3(трифторметил). Предпочтительно R3 обозначает С 1-6-алкил,в частности, метил. Конкретные соединения изобретения включают 5-метил-6-трифторметил-1-[6-(2-метилпиридин-3-илокси)-пиридин-3-илкарбамоил]индолин. Это соединение может быть также названо где R1, R2 и R3 имеют значения, указанные в формуле (I), и А и В содержат соответствующую функциональную группу(ы), необходимую-NHCO- при реакции сочетания, и после этого необязательно образуют фармацевтически приемлемую соль. Соответствующие примеры групп А и В включают: 3 где L - это удаляемая группа. Примеры соответствующих удаляемых групп L включают галоген, например, хлор или бром, имидазол или фенокси-, или фенилтио-,необязательно замещенные, например, галогеном. Предпочтительно А обозначает -NHCOL и В обозначает водород; особенно предпочтительно А обозначает NHCOOPh и В обозначает водород. Соединения формулы (II) и (III) могут быть получены известными методами или методами, аналогичными известным, и методами,раскрытыми в следующих описаниях, например,при помощи процедур, описанных в WO 95/01976 и РСТ/ЕР 96/00368 (WO-A-96/23783). Новые промежуточные соединения формулы (II) также составляют часть изобретения. Фармацевтически приемлемые соли могут быть получены по общепринятой методике реакцией с соответствующими кислотой или производным кислоты. N-оксиды могут быть получены в стандартных условиях реакцией с пероксидом водорода или перкарбоновыми кислотами. Соединения формулы (I) и их фармацевтически приемлемые соли имеют активность антагониста 5 НТ 2C-рецептора и предположительно могут быть потенциально использованы для лечения или профилактики таких расстройств ЦНС, как тревожное состояние, депрессия, эпилепсия, навязчиво-компульсивное расстройство,мигрень, болезнь Альцгеймера, нарушения сна(включая нарушение циркадного ритма), расстройства питания, такие как анорексия и булимия, панические состояния, синдром отмены лекарственного средства при токсикомании,например кокаина, этанола, никотина и бензодиазепинов, шизофрения, и также расстройств,связанных со спинальной травмой и/или травмами головы, такими как гидроцефалия. Соединения изобретения также, предположительно,могут быть использованы в лечении соответствующих желудочно-кишечных расстройств,таких как IBS (Irritable Bowel Syndrome - синдром раздраженной толстой кишки), а также болезней капилляров, таких как макулярный(глазной) отек или ретинопатия. Таким образом, изобретение также предусматривает использование соединения формулы(I) или его фармацевтически приемлемой соли в качестве терапевтического средства, в частности при лечении или профилактике вышеуказанных расстройств. Кроме того, изобретение дает способ лечения или профилактики вышеописанных расстройств у млекопитающих, в том числе у человека, включающий в себя введение больному терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. 4 В другом аспекте изобретение предусматривает использование соединения формулы (I) или его фармацевтически приемлемой соли в производстве медикамента для лечения или профилактики вышеуказанных расстройств. Настоящее изобретение также обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Фармацевтическая композиция изобретения, которая может быть приготовлена смешиванием должным образом при нормальном атмосферном давлении и температуре, обычно приспособлена для перорального, парентерального или ректального введения и, следовательно, может быть в форме таблеток, капсул, пероральных жидких препаратов, порошков, гранул,лепешек, полупродуктов порошков, растворов для инъекций или инфузий, или суспензий или суппозиториев. Композиции, вводимые перорально, как правило, предпочтительны. Таблетки и капсулы для перорального введения могут быть в форме стандартных доз и могут содержать общепринятые наполнители,такие как связывающие вещества, смазки для таблетированных препаратов, дезинтегрирующие агенты и приемлемые увлажняющие средства. Таблетки могут иметь покрытия, нанесенные согласно способам, хорошо известным в обычной фармацевтической практике. Пероральные жидкие препараты могут быть, например, в форме водной или масляной суспензии, растворов, эмульсий, сиропов или эликсиров, или могут быть в форме сухого продукта для воссоздания водой или другим подходящим носителем перед использованием. Такие жидкие препараты могут содержать стандартные добавки, такие как суспендирующие вещества, эмульгирующие вещества, неводные растворители (которые могут включать пищевые масла), консерванты, и, если требуется, стандартные отдушки и красители. Для парентерального введения жидкие дозированные препараты готовят с использованием соединения изобретения или его фармацевтически приемлемой соли и стерильного растворителя. В зависимости от растворителя и используемой концентрации, соединение может быть либо суспендировано, либо растворено в носителе. В приготовлении растворов соединение может быть растворено для инъекции и простерилизовано фильтрованием перед заполнением подходящего сосуда или ампулы и герметизацией. Лучше, чтобы добавки, такие как местные анестетики, консерванты и буферные вещества, растворялись в носителе. Для повышения стабильности композиция может быть заморожена после заполнения сосуда и вода удалена под вакуумом. Парентеральные суспензии готовят, по существу, тем же способом, за исключением того, что соединение суспенди 5 руют в носителе вместо растворения, и стерилизация не может быть осуществлена фильтрованием. Соединение может быть простерилизовано выдерживанием в окиси этилена перед суспендированием в стерильном носителе. Лучше,чтобы поверхностно-активное вещество или увлажняющее вещество было включено в композицию, что способствует однородному распределению соединения. Композиция может содержать от 0,1 до 99% по массе, предпочтительно от 10 до 60% по массе, активного материала в зависимости от способа введения. Доза соединения, используемая в лечении вышеупомянутых расстройств, будет, как обычно, варьировать в зависимости от серьезности расстройства, веса больного и других подобных факторов. Тем не менее, в общих случаях подходящей разовой дозой может быть доза 0,051000 мг, более подходящей доза 0,05-20,0 мг,например 0,2-5 мг; и такие разовые дозы могут вводиться более одного раза в день, например 2 или 3 раза в день, так что общая суточная доза будет в пределах от 0,5 до 100 мг; и такая терапия может продолжаться несколько недель или месяцев. При введении, в соответствии с изобретением, не ожидается никаких нежелательных токсикологических эффектов с соединениями изобретения. Следующие описания и примеры иллюстрируют получение соединений изобретения. Описание 1. (5-Метокси-2-нитро-4-трифторметилфенил)ацетонитрил (D1). Смесь 1-метокси-4-нитро-2-трифторметилбензола (92 г, 0,421 моль) и 4-хлорфеноксиацетонитрила (77,55 г, 0,463 моль) в сухом ДМФ (500 мл) добавляли по каплям на протяжении 0,75 ч к перемешиваемому раствору КОtВu (103,85 г, 0,927 моль) в сухом ДМФ (400 мл) при -10 С. После завершения добавления полученный пурпурный раствор выдерживали при -10 С в течение 1 ч и затем выливали в смесь воды со льдом (1,5 л) и 5 М водного раствора НСl (1,5 л). Полученную смесь экстрагировали дихлорметаном (31 л). Объединенные органические экстракты промывали водой (3,1 л), сушили (Na2SO4) и выпаривали при пониженном давлении. Остаток хроматографировали на силикагеле с использованием смеси 10-40% этилацетат/петролейный эфир в качестве элюента с получением неочищенного продукта, который перекристаллизовывали из смеси этилацетат/петролейный эфир с получением указанного в заголовке соединения (85,13 г, 78%) в виде белого твердого вещества. Т. пл. 103104 С. 1(5-Метокси-2-нитро-4-трифторметилфенил)ацетонитрил (D1) (85 г, 0,327 моль) в смеси этанол/вода (9:1, 1,6 л) и ледяной уксусной кислоты (16 мл) гидрировали над 10% палладием на угле (50 г) при 50 psi в течение 0,5 ч при комнатной температуре. Реакционную смесь фильтровали и выпаривали в вакууме. Остаток распределяли между водным раствором К 2 СО 3(1 л) и дихлорметаном (21 л) и объединенный органический экстракт сушили (Na2SO4) и выпаривали с получением указанного в заголовке индола (67,63 г, 96%) в виде серого твердого вещества. 1(1H, br.s). Описание 3. 5-Метокси-6-трифторметилиндолин (D3). Индол (D2) (67,63 г, 0,315 моль) в ледяной уксусной кислоте (500 мл) обрабатывали цианоборгидридом натрия (40 г, 0,637 моль) порциями при комнатной температуре при перемешивании. После 3 ч при комнатной температуре реакционную смесь разбавляли водой (500 мл) и подщелачивали 40% водным раствором NaOH при охлаждении. Затем эту смесь экстрагировали дихлорметаном (3500 мл) и объединенные экстракты сушили (Na2SO4) и выпаривали с получением указанного в заголовке соединения(67,73 г, 99%) в виде твердого вещества нестандартного белого цвета. 1(12,5 мл, 89,3 ммоль) в сухом хлороформе (70 мл) нагревали с обратным холодильником в течение 65 ч. Затем к охлажденной смеси осторожно добавляли метанол при перемешивании и затем растворитель удаляли в вакууме. Остаток обрабатывали насыщенным раствором бикарбоната натрия и водой до щелочной реакции и затем экстрагировали смесью дихлорметан/метанол. Органический экстракт промывали рассолом, сушили и выпаривали. Остаток экстрагировали эфиром в аппарате Сокслета и концентрирование полученного раствора давало указанное в заголовке соединение в виде трех порций (всего 2,85 г, 41%), т. пл. 180 С (разл.). 1H ЯМР (СDСl3/CD3OD) : 3.02 (2 Н, d,J=8), 3.52 (2H, d, J=8), 4.00 (3H, s), 6.77 (1H, s),6.83 (1H, s). Описание 5. 1-Ацетил-5-гидрокси-6 трифторметилиндолин (D5). Смесь индолина (D4, 2,84 г, 14 ммоль) и уксусного ангидрида (1,32 мл, 14 ммоль) в сухом дихлорметане (50 мл) перемешивали при комнатной температуре в течение 3 ч, затем вы 7 паривали. Остаток осторожно обрабатывали насыщенным раствором бикарбоната натрия,затем твердый продукт отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (3,28 г, 96%), т. пл. 244-247 С. 1(1,52 г, 5,4 ммоль). Затем смесь перемешивали в течение ночи при медленном нагревании ее до комнатной температуры. Смесь частично выпаривали, оставшуюся жидкость разбавляли хорошо водой и осадок отфильтровывали. Неочищенный продукт растворяли в дихлорметане и раствор промывали 1 н хлористо-водородной кислотой и рассолом, сушили и выпаривали с получением указанного в заголовке соединения(0,60 г, 14,1 ммоль) и хлорида бис(трифенилфосфин)палладия (II) (0,10 г, 0,14 ммоль) в сухом диметилформамиде (15 мл) добавляли тетраметилолово (0,72 мл, 5,2 ммоль). Смесь нагревали при 110 С в течение 3,5 ч, затем охлаждали и выпаривали. Остаток распределяли между дихлорметаном и водой и органическую фазу промывали рассолом, сушили и выпаривали. Неочищенный продукт растворяли в этаноле (30 мл), добавляли 10% водный раствор гидроксида натрия (7,5 мл) и твердый гидроксид натрия (1 г) и смесь нагревали с обратным холодильником в течение ночи. Этанол удаляли в вакууме и остаток разбавляли водой и экстрагировали дихлорметаном. Органический экстракт промывали рассолом, сушили и выпаривали. Остаток хроматографировали на силикагеле (50 г), элюировали при отсасывании смесью 2:1 эфир/петролейный эфир с получением указанного в заголовке соединения (0,70 г,74%), т. пл. 43-44 С. 1H ЯМР (СDСl3) : 2.34 (3H, s), 3.02 (2 Н, t,J=8), 3.57 (2 Н, t, J=8), 3.78 (1H, broad), 6.85 (1H,s), 7.00 (1H, s). Описание 8. 2-(2-Метилпиридин-3-илокси)-5-нитропиридин (D8). 3-Гидрокси-2-метилпиридин (40 г, 0,37 моль) в сухом ДМФ (1,3 л) в атмосфере аргона охлаждали до 0 С. Порциями добавляли гидрид натрия (11,1 г 80% дисперсии в масле, 0,37 8 моль) и смесь перемешивали при 0 С в течение 15 мин и затем при комнатной температуре в течение 3 ч. Добавляли 2-хлор-5-нитропиридинCH2Cl2, промывали 10% водным раствором гидроксида натрия и водой, сушили (Na2SО 4) и выпаривали в вакууме с получением указанного в соединении заголовка (81,1 г, 95%) в виде желтого твердого вещества. 1(1 Н, dd, J=8), 8.25 (1 Н, dd, J=1,5), 8.32 (1H, dd,J=3,8), 8.79 (1H, d, J=3). Описание 9. 5-Амино-2-(2-метилпиридин 3-илокси)пиридин (D9). 2-(2-Метилпиридин-3-илокси)-5-нитропиридин (D8, 81,1 г, 0,35 моль) в этаноле (2 л) обрабатывали хлоридом олова (II) (232 г, 1,23 моль) в концентрированной хлористоводородной кислоте (500 мл) и нагревали до 50 С в течение 1 ч. После охлаждения до температуры окружающей среды смесь подщелачивали 40% водным раствором гидроксида натрия,экстрагировали этилацетатом, сушили (Na2SО 4) и выпаривали в вакууме с получением указанного в заголовке соединения (60,3 г, 86%) в виде коричневого твердого вещества. 1(2,5 л) охлаждали до -20 С в атмосфере аргона. Добавляли триэтиламин (46 мл, 0,33 моль) с последующим добавлением по каплям фенилхлорформиата (41 мл, 0,33 моль) и смесь перемешивали при -20 С в течение 1 ч. После нагревания до комнатной температуры смесь промывали разбавленным водным раствором NaHCO3,сушили (Na2SO4) и выпаривали в вакууме. Остаток перекристаллизовывали из смеси этилацетат/60-80 петролейный эфир с получением указанного в заголовке соединения (53,7 г, 56%) в виде розового твердого вещества. 1(3H, s), 6.94 (1H, d, J=7), 7.08-7.29 (4H, m), 7.337.45 (3H, m), 7.90 (1H, br.s), 7.98-8.13 (2 Н, s),8.39 (1H, d, J=5). Описание 11. Этиловый эфир 6-(2 метилпиридин-3-илокси)пиридазин-3-карбоновой кислоты (D11). Гидрид натрия (0,21 г 80% дисперсии в масле, 7,0 ммоль) добавляли к раствору 3 гидрокси-2-метилпиридина (0,88 г, 8,0 ммоль) в ДМФ (15 мл). После 1,5 ч при комнатной тем 9 пературе добавляли раствор этилового эфира 6 хлорпиридазин-3-карбоновой кислоты (Chem.Pharm.Bull., 1994, 42(2), 371) (1,0 г, 5,4 ммоль) в ДМФ (10 мл) и смесь перемешивали еще в течение 1,5 ч. ДМФ удаляли в вакууме и остаток распределяли между разбавленным водным раствором NaOH (50 мл) и CH2Cl2 (100 мл). После высушивания (Na2SO4) органические вещества выпаривали с получением указанного в заголовке соединения в виде твердого вещества нестандартного белого цвета (1,09 г, 78%). 1(1,07 г, 4,13 ммоль) и гидразинмоногидрат (0,23 мл, 7,22 ммоль) в этаноле (100 мл) перемешивали при комнатной температуре в течение 1 ч,затем нагревали при 50 С в течение 1 ч и наконец нагревали с обратным холодильником в течение 4 ч. Добавляли вторую порцию гидразинмоногидрата (0,23 мл, 7,22 ммоль) и смесь нагревали с обратным холодильником еще в течение 2 ч. После остывания растворитель удаляли в вакууме. Твердый остаток нестандартного белого цвета подвергали колоночной хроматографии с использованием смеси 25%MeOH/EtOAc в качестве элюента с получением белого кристаллического продукта (0,63 г, 62%). 1(0,62 г, 2,53 ммоль) в концентрированной хлористо-водородной кислоте (9 мл) и воде (7,5 мл), охлажденный до 0 С в бане со льдом, обрабатывали раствором нитрита натрия (0,18 г, 2,53 ммоль) в воде (1,5 мл) по каплям с поддержанием температуры ниже 5 С. После 10 мин добавляли насыщенный раствор карбоната калия до щелочной реакции. Осадок отфильтровывали,промывали водой и сушили на воздухе с получением твердого вещества кремового цвета 10 Смесь индолина (D7, 20 г, 99,5 ммоль),фенилкарбамата (D10, 31,9 г, 99,5 ммоль) и триэтиламина (13,9 мл, 100 ммоль) в сухом диметилформамиде (1 л) нагревали при 95-105 С в течение 1 ч, затем охлаждали и выпаривали в вакууме. Остаток разбавляли дихлорметаном и промывали 10% водным раствором гидроксида натрия с добавлением метанола для сохранения продукта в растворе. Органическую фазу промывали водой и рассолом, сушили и выпаривали. Неочищенный продукт перекристаллизовывали из дихлорметана с получением указанного в заголовке соединения (32,5 г, 76%), т. пл. 112114 С. 1(1H, d, J=8), 7.25 (1H, s), 7.30 (1H, dd, J=8,5),7.49 (1H, d, J=8), 8.06 (1H, dd, J=8,2), 8.16 (1H,s), 8.20 (1H, d, J=2), 8.31 (1H, d, J=5), 8.78 (1H,s). Пример 2. Гидрохлорид 5-метил-6 трифторметил-1-[6-(2-метилпиридин-3-илокси) пиридин-3-илкарбамоил]индолина (Е 2). К перемешиваемой суспензии свободного основания (Е 1, 32,5 г, 75,9 ммоль) в метаноле (1 л) добавляли раствор хлористо-водородной кислоты (отн. плотн. 1,18, 7 мл, 84 ммоль) в метаноле (50 мл) по каплям на протяжении 15 мин. Полученный раствор концентрировали в вакууме до приблизительно половины исходного объема, затем упаривали дополнительно на паровой бане с добавлением эфира до стойкого помутнения. Раствор охлаждали окончательно на льду и осадок отфильтровывали, промывали эфиром и сушили с получением указанного в заголовке соединения (33,8 г, 96%) в виде белого твердого вещества, т. пл. 241-246 С. 1(1H, d, J= 2), 8.51 (1H, d, J=8), 9.00 (1H, s). Указанное в заголовке соединение может быть также получено обработкой раствора свободного основания в пропаноле концентрированной хлористо-водородной кислотой. Пример 3. Метилсульфонат 5-метил-6 трифторметил-1-[6-(2-метилпиридин-3-илокси) пиридин-3-илкарбамоил]индолина (Е 3). Свободное основание (Е 1, 2 г, 4,7 ммоль) в нагреваемом с обратным холодильником 3% водном ацетоне (50 мл) обрабатывали метансульфоновой кислотой (0,47 г). Полученный раствор концентрировали в вакууме, помещали в кипящий метанол (50 мл) и затем упаривали дополнительно на паровой бане с добавлением эфира до начала образования осадка. Раствор охлаждали окончательно на льду и осадок отфильтровывали, промывали эфиром и сушили с получением указанного в заголовке соединения(2,35 г, 96%) в виде белого твердого вещества,т.пл. 159-161 С. 1(D7) (0,26 г, 1,29 ммоль) в толуоле (20 мл) нагревали при 100 С в течение 1 ч, затем давали ему остыть. Растворитель удаляли в вакууме с получением бледно-коричневого твердого вещества. Его подвергали колоночной хроматографии с использованием смеси 5% MeOH/DCM в качестве элюента и продукт перекристаллизовывали из смеси EtOAc/петролейный эфир с получением белого порошка (0,30 г, 54%), т. пл. 216-217 С. 1(1H, s), 8.38 (1H, dd, J=2,6), 8.48 (1H, d, J=10). Фармакологические данные Связывание [3 Н]-месулергина с клонами 5 НТ 2C и человека, экспрессируемыми в клетках 293 in vitro. Соединения могут быть испытаны согласно процедуре, описанной в общих чертах в WO 94/04533. Соединения примеров имели величины pKi 8,6-9,5 в клетках человека. Реверсирование (обратное развитие) индуцированной МСРР гиполокомоции. Соединения могут быть испытаны согласно процедуре, описанной в общих чертах в WO 94/04533. Соединения примеров показали хорошую активность после введения перорально дозы 1-5 мг/кг на крысах с увеличенной продолжительностью действия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его соль где Х обозначает СН или N;R1 обозначает водород или C1-6-алкил; 12 4. Соединение по любому из пп.1-3, в котором R2 обозначает СF3. 5. Соединение по любому из пп.1-4, в котором R3 обозначает C1-6-алкил. 6. Соединение по любому из пп.1-5, в котором R3 обозначает метил. 7. Соединение по п.1, которое представляет собой 5-метил-6-трифторметил-1-[6-(2-метилпиридин-3-илокси)-пиридин-3-илкарбамоил]индолин,5-метил-6-трифторметил-1-[6-(2-метилпиридин-3-илокси)-пиридазин-3-илкарбамоил]индолин,и их фармацевтически приемлемые соли. 8. Соединение по п.1, которое представляет собой гидрохлорид 5-метил-6-трифторметил 1-[6-(2-метилпиридин-3-илокси)пиридин-3-илкарбамоил]индолина. 9. Способ получения соединения по любому из пп.1-6, включающий реакцию соединения формулы-CONH2,где L является уходящей (отщепляемой) группой; с последующим необязательным образованием фармацевтически приемлемой соли. 10. Применение соединений по любому из пп.1-8 в качестве антагонистов 5 НТ 2 Срецепторов при терапевтическом лечении. 11. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 и фармацевтически приемлемый носитель или наполнитель. 12. Применение соединения по любому из пп.1-8 для приготовления лекарственного средства для лечения тревожного состояния и/или депрессии. 13. Соединение формулы
МПК / Метки
МПК: A61P 25/28, A61K 31/4439, C07D 401/14
Метки: производные, 5-нт2с-рецепторов, антагонистов, пиридилкарбамоилиндолинов, качестве
Код ссылки
<a href="https://eas.patents.su/8-1780-proizvodnye-piridilkarbamoilindolinov-v-kachestve-antagonistov-5-nt2s-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридилкарбамоилиндолинов в качестве антагонистов 5-нт2с-рецепторов</a>
Предыдущий патент: Способ лечения заболеваний, связанных с фактором роста сосудистого эндотелия
Следующий патент: Способ осуществления каротажа












