Гетероарильные производные сукцинамидов и их применение в качестве ингибиторов металлопротеиназы
Номер патента: 3127
Опубликовано: 27.02.2003
Авторы: Абрео Мелвин А., Бендер Стивен Л., Чен Джиан Джеффри, Чонг Уэсли К.М., Билледо Рональд Дж., Кастелано Арлиндо Л., Дил Юдит Г.
Формула / Реферат
1. Соединение с формулой
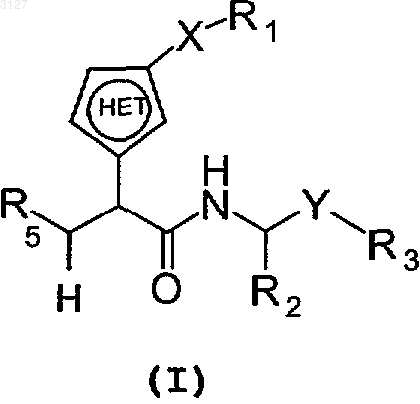
где X является одинарной связью или группой -C(O)CH2-;
Y является -CH(OH)-;
R1 является H, фенилом, возможно замещенным C3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;
R2 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,
где R10 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,
где R11 является H, алкильной группой, O-алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой и
где R12 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой
или где R11 и R12 образуют вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; и
R3 является H или алкильной группой
или R2 и R3 вместе с атомами, к которым они присоединены, образуют циклоалкильную группу или гетероциклоалкильную группу;
R5 является C(O)NHOH, C(O)OR13 или N(OH)CHO;
R13 является H или C3-алкильной группой, и

является гетероарильной группой, имеющей в кольце пять атомов, включая только один атом N в качестве гетероатома;
или фармацевтически приемлемые соль или сольват этого соединения.
2. Соединение по п.1, отличающееся тем, что R2 и R3 вместе с атомами, к которым они присоединены, образуют циклоалкильную группу или фармацевтически приемлемые соль или сольват этого соединения.
3. Соединение с формулой I
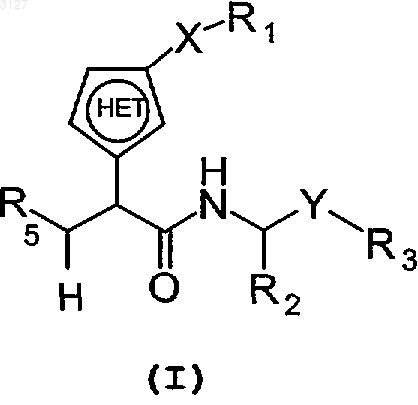
где X является одинарной связью или группой -C(O)CH2-;
Y является -C(O)-;
R1 является H, фенилом, возможно замещенным C3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;
R2 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,
где R10 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,
где R11 является H, алкильной группой, O-алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой и
где R12 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой
или где R11 и R12 образуют вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; и
R3 является алкильной группой или O-алкильной группой,
или R2 и R3 вместе с атомами, к которым они присоединены, образуют циклоалкильную группу или гетероциклоалкильную группу;
R5 является C(O)NHOH, C(O)OR13 или N(OH)CHO;
R13 является H, или C3-алкильной группой, и

является гетероарильной группой, имеющей в кольце пять атомов, включая только один атом N в качестве гетероатома;
или фармацевтически приемлемые соль или сольват этого соединения, с условием, что если соединение с формулой (I) является

где R1 и R5 такие, как определено выше;
W является H, OH, галогруппой, алкильной группой или O-алкильной группой, и, кроме того, где,
если m равно 2, 3 или 4, n равно 1, 2, 3 или 4, а A является CH2, O, NH или N-алкилом; или
если m равно 4, 5 или 6, n равно 0, а A является -CHJ-, где J является карбоксильной, алкоксикарбонильной или карбамоильной группой;
или фармацевтически приемлемой солью или сольватом этого соединения, то

является пирролилом.
4. Соединение по п.3, в котором R2 и R3 вместе с атомами, с которыми они связаны, образуют гетероциклоалкильную группу.
5. Соединение по п.3, в котором R5 является C(O)OR13, где R13 является H или C3-алкильной группой.
6. Фармацевтическая рецептура, содержащая
(а) терапевтически эффективное количество соединения по п.3 или его фармацевтически приемлемой соли или сольвата и
(б) фармацевтически приемлемый переносчик, разбавитель, носитель или наполнитель.
7. Фармацевтическая рецептура, содержащая
(а) терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли или сольвата и
(б) фармацевтически приемлемый переносчик, разбавитель, носитель или наполнитель.
8. Соединение с формулой I
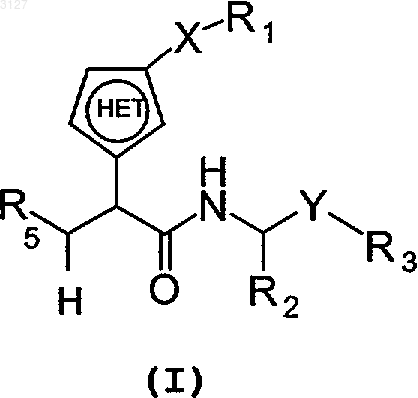
где X является одинарной связью или группой -C(O)CH2-;
Y является одинарной связью;
R1 является H, фенилом, возможно замещенным C3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;
R2 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,
где R10 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,
где R11 является H, алкильной группой, O-алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой и
где R12 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой
или где R11 и R12 образуют вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; и
R3 является гетероарильной группой,
R5 является C(O)NHOH, C(O)OR13 или N(OH)CHO;
R13 является H, или C3-алкильной группой, и

является гетероарильной группой, имеющей в кольце пять атомов, включая только один атом N в качестве гетероатома;
или фармацевтически приемлемые соль или сольват этого соединения.
9. Соединение по п.8, в котором R3 является гетероарильной группой формулы

где R21 и R22 вместе с атомами углерода, к которым они присоединены, образуют арильную группу, гетероарильную группу, циклоалкильную группу или гетероциклоалкильную группу;
или фармацевтически приемлемые соль или сольват этого соединения.
10. Соединение по п.8, в котором
R3 является гетероарильной группой формулы
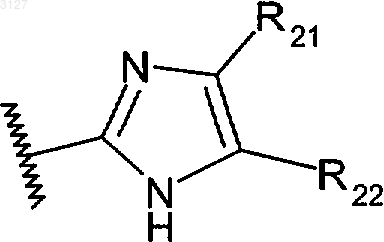
где R21 и R22 независимо выбраны из водорода, алкильной группы, арильной группы, гетероарильной группы, галогрупяы, C(O)O-алкильной группы, карбамоильной группы, циклоалкильной группы или гетероциклоалкильной группы;
или фармацевтически приемлемые соль или сольват этого соединения.
11. Фармацевтическая рецептура, содержащая
(а) терапевтически эффективное количество соединения по п.8 или его фармацевтически приемлемой соли или сольвата и
(б) фармацевтически приемлемый переносчик, разбавитель, носитель или наполнитель.
12. Соединение с формулой
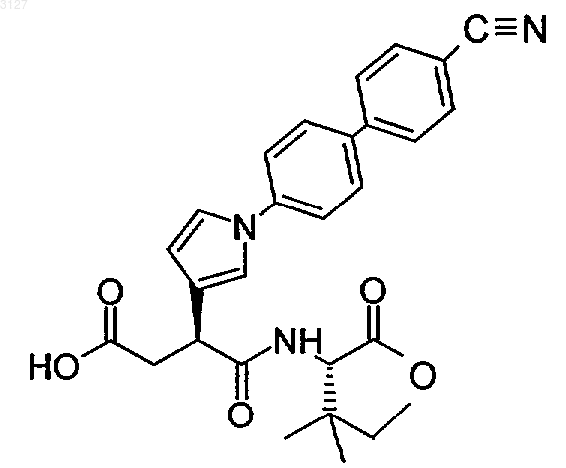
или фармацевтически приемлемые соль или сольват этого соединения.
13. Фармацевтическая рецептура, содержащая
(а) терапевтически эффективное количество соединения по п.12 или его фармацевтически приемлемой соли или сольвата и
(б) фармацевтически приемлемый переносчик, разбавитель, носитель или наполнитель.
14. Фармацевтическая рецептура, содержащая
(а) терапевтически эффективное количество соединения по п.12 или его фармацевтически приемлемой соли или сольвата и
(б) фармацевтически приемлемый переносчик, разбавитель, носитель или наполнитель.
15. Соединение, выбранное из группы, включающей
3(R)-[3-(бифенил-4-ил)-1H-пиррол-1-ил]-N-[2-гидрокси-1(S)-[(1H-имидазол-4-ил)метил]этил]полуамид янтарной кислоты;
N-[2,2-диметил-1(S)-(гидроксиметил)пропил]-3(R)-[3-[4-(пиридин-4-ил)фенил]-1H-пиррол-1-ил]полуамид янтарной кислоты;
N-(2-гидрокси-1(S)-фенилэтил)-3(R)-[3-[4-(пиридин-4-ил)фенил]-1H-пиррол-1-ил]полуамид янтарной кислоты;
3(R)-[3-(4'-цианобифенил-4-ил)-1H-пиррол-1-ил]-N-[2,2-диметил-1(S)-(гидроксиметил)пропил]полуамид янтарной кислоты;
N-(2(R)-гидроксииндан-1(R)-ил)-3(R)-[3-[4-(пиридин-4-ил)фенил]-1H-пиррол-1-ил]полуамид янтарной кислоты;
N-(4,4-диметил-2-оксотетрагидрофуран-3(S)-ил)-3(R)-[3-[4-(пиридин-4-ил)фенил]-1H-пиррол-1-ил]полуамид янтарной кислоты;
N-[1(S)-(1H-имидазол-2-ил)-3-метилбутил]-3(R)-[3-(4-(пиридин-4-ил)фенил)-1H-пиррол-1-ил]полуамид янтарной кислоты;
N1-[2,2-диметил-1(S)-(гидроксиметил)пропил]-N4-гидрокси-2(R)-[3-[4-(пиридин-4-ил)фенил]-1H-пиррол-1-ил]сукцинамид;
3(S)-[1-(4'-цианобифенил-4-ил)-1H-пиррол-3-ил]-N-[1(S)-(1H-имидазол-2-ил)-3-метилбутил]полуамид янтарной кислоты;
3(S)-[1-(4'-цианобифенил-4-ил)-1H-пиррол-3-ил]-N-(4,4-диметил-2-оксотетрагидрофуран-3(S)-ил)полуамид янтарной кислоты;
3(R)-[3-(4'-цианобифенил-4-ил)-1H-пиррол-1-ил]-N-[1(S)-(1H-имидазол-2-ил)-3-метилбутил]полуамид янтарной кислоты;
3(R)-[3-(4-цианофенил)-1H-пиррол-1-ил]-N-[1(S)-(1H-имидазол-2-ил)-3-метилбутил]полуамид янтарной кислоты;
N-[2,2-диметил-1(S)-(гидроксиметил)пропил]-3(S)-[1-[4-(пиридин-4-ил)фенил]-1H-пиррол-3-ил]полуамид янтарной кислоты; и
N1-гидрокси-N4-метил-3(R)-[3-[4-(пиридин-4-ил)фенил]-1H-пиррол-1-ил]сукцинамид;
и фармацевтически приемлемые соли и сольваты этих соединений.
16. Соединение с формулой
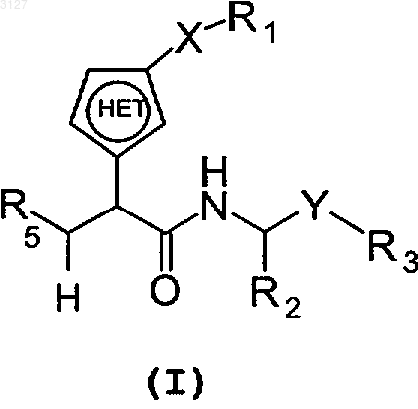
где X является одинарной связью или группой -C(O)CH2-;
Y является -CH(OH)-;
R1 является H, фенилом, возможно замещенным C3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;
R2 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,
где R10 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,
где R11 является H, алкильной группой, O-алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой и
где R12 является H, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой
или где R11 и R12 образуют вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; и
R3 является H,
R5 является C(O)NHOH, C(O)OR13 или N(OH)CHO;
R13 является H или C3-алкильной группой, и

является гетероарильной группой, имеющей в кольце пять атомов, включая только один атом N в качестве гетероатома;
или фармацевтически приемлемые соль или сольват этого соединения.
17. Фармацевтическая рецептура, содержащая
(а) терапевтически эффективное количество соединения по п.15 или его фармацевтически приемлемой соли или сольвата и
(б) фармацевтически приемлемый переносчик, разбавитель, носитель или наполнитель.
Текст
1 Уровень техники Матриксные металлопротеазы (ММП) являются семейством протеаз (ферментов), участвующих в деградации и перестройке соединительных тканей. Представители этого семейства ферментов эндопептидаз секретируются в качестве проферментов из различных типов клеток,которые принадлежат или связаны с соединительной тканью, таких как фибробласты, моноциты, макрофаги, эндотелиальные клетки и инвазивные или метастатические клетки опухолей. Экспрессия ММП стимулируется факторами роста и цитокинами в локальной среде, окружающей ткань, где эти ферменты действуют,специфически разрушая белковые компоненты межклеточного матрикса, такие как коллаген,протеогликаны (протеиновое ядро), фибронектин и ламинин. Эти повсеместно присутствующие компоненты межклеточного матрикса присутствуют в выстилках суставов, интерстициальных соединительных тканях, основных мембранах и хрящах. ММП обладают рядом общих свойств,включая зависимость от цинка и кальция, секрецию в качестве зимогенов и 40-50%-ную гомологию аминокислотных последовательностей. Одиннадцать металлоферментов человека были достоверно охарактеризованы как ММП,включая три коллагеназы, три стромелизина,две желатиназы, матрилизин, металлоэластазу и ММП мембранного типа, что более детально будет обсуждено ниже. Интерстициальные коллагеназы катализируют начальное и ограничивающее скорость расщепление нативного коллагена I, II и III типов. Коллаген, основной структурный белок млекопитающих, является необходимым компонентом матрикса многих тканей, например,хряща, кости, сухожилий и кожи. Интерстициальные коллагеназы являются очень специфичными матриксными металлопротеазами, которые расщепляют эти коллагены с образованием двух фрагментов, которые спонтанно денатурируют при физиологических температурах и поэтому становятся доступными для расщепления менее специфичными ферментами. Расщепление коллагеназами приводит к потере структурной целостности ткани-мишени, по существу необратимому процессу. В настоящее время известны три коллагеназы человека, первые две из которых относительно хорошо охарактеризованы (FASEB J., 5, 2145-54 (1991. Коллагеназа фибробластов человека (КФЧ, ММП-1 или коллагеназа-1) продуцируется очень разнообразными клетками, включая фибробласты и макрофаги. Коллагеназа нейтрофилов человека (КНЧ,ММП-8 или коллагеназа-2), как до сих пор было показано, продуцируется только нейтрофилами. Последним обнаруженным членом этой группы ММП является коллагеназа-3 человека (ММП 13), которая первоначально была обнаружена в 2 карциномах молочной железы (J. Biol. Chem.,269, 16, 766-16, 773) (1994), но с тех пор уже было показано, что она продуцируется хондроцитами (J. Clin. Invest, 97, 761-768, 1996). Желатиназы включают два различных, но очень близкородственных, фермента: фермент с молекулярной массой 72 кД (желатиназа А,ЖФЧ, ММП-2), секретируемый фибробластами и множеством других типов клеток, и фермент с молекулярной массой 92 кД (желатиназа В,ЖНЧ, ММП-9), выделяемый мононуклеарными фагоцитами, нейтрофилами, клетками эпителия роговицы, клетками опухолей, цитотрофобластами и кератиноцитами. Было показано, что эти желатиназы расщепляют желатины (денатурированные коллагены), коллагены типов IV(основная мембрана) и V, фибронектин и нерастворимый эластин. Было показано, что стромелизины 1 и 2 расщепляют широкий диапазон субстратов матрикса, включая ламинин, фибронектин, протеогиканы и коллагены типов IV и IX в их не спирализированных доменах. Было показано, что матрилизин (ММП-7,PUMP-1) разрушает широкий диапазон субстратов матрикса, включая протеогликаны, желатины, фибронектин, эластин и ламинин. Его экспрессия подтверждена в мононуклеарных фагоцитах, эксплантатах матки крыс и спорадически- в опухолях. Другие, в меньшей степени охарактеризованные ММП включают металлоэластазу макрофагов (ММЭ, ММП-12), ММП мембранного типа (ММП-14) и стромелизин-3(ММП-11). Чрезмерная деградация экстраклеточного матрикса посредством ММП участвует в патогенезе многих заболеваний как хронической, так и острой природы. Например, многочисленные исследования, как сообщалось в Exp. Opin. Invest. Drugs, 5, 323-335, (1996), показали, что экспрессия и активация ММП являются критическими событиями при росте, инвазии и метастазировании опухолей. Кроме того, было обнаружено, что активность ММП требуется для ангиогенеза, который необходим для роста опухолей, а также других патологических состояний, таких как дегенерация желтого пятна. ММП, особенно стромелизин-1, коллагеназы-1 и коллагеназа-3, принимают большое участие в деструкции суставного хряща, которая является критерием ревматоидного артрита и остеоартрита. См., например, J. Clin. Invest., 97,761-768 (1996). Кроме того, считается, что деструкция ткани, связанная с гигивитом и заболеванием периодонта, опосредуется избыточной экспрессией ММП в ответ на провоспалительные цитокины. См. Molecular Pathogenesis ofPeriodontal Disease, Ch. 17, 191-202 (1994). Другие заболевания, при которых была установлена критическая роль ММП, включают рассеянный склероз (J. Neuroimmunol., 41, 29-34 (1992,изъязвление роговицы (Invest. Ophtalmot andMetab., 16, 360-366 (1996, вызываемое солнечным светом старение кожи (Nature, 379, 335-339(1996, хроническое обструктивное заболевание легких, такое как эмфизема (Am. J. respir.Cell. Mol. Biol. 7, 5160-5165 (1994, хронические язвы (J. Clin. Invest., 94, 79-88 (1994,аритмия сердца и эндометриоз. Наконец, предполагается роль опосредуемой ММП деградации основных мембран в разрыве атеросклеротических бляшек (Basic Res. Cardiol., 89(SUPPL. 1), 59-70, (1994 и в развитии заболевания почечных клубочков (J. Clin. Invest, 97,1094-1101 (1996. Ожидается, что ингибиторы ММП обеспечат успешное лечение болезней, описанных выше, для которых деградация межклеточного матрикса при помощи ММП участвует в патогенезе заболевания. В целом, избирательные ингибиторы определенных подгрупп ММП могут предоставить терапевтические преимущества, поскольку обычно наблюдалось, что в каждом из патологических состояний, перечисленных выше, участвует ограниченное число представителей семейства ММП. Например, участие отдельных коллагеназ в деградации тканевых коллагенов, по-видимому, в значительной степени зависит от типа ткани. Распределение коллагеназ человека по тканям показывает, что коллагеназа-3 является основным участником деградации коллагенового матрикса хряща, тогда как коллагеназа-1, более вероятно, участвует в перестройке кожи и других мягких тканей. Кроме того, стромелизин-1, по-видимому, в высокой степени ответственен за избыточную потерю протеогликанов хрящом. Таким образом,соединения, являющиеся предметом изобретения, сущность которых раскрыта здесь, являющиеся избирательными ингибиторами коллагеназы-3 и стромелизина по сравнению с коллагеназой-1, предпочтительны для лечения заболеваний, связанных с эрозией хряща, таких, как ревматоидный артрит и остеоартрит. Аналогично, среди ММП, металлоэластаза специфически участвовала в патологии эмфиземы легких. См.,J. Biol. Chem., 270, 14568-14575 (1995). Разработка и применения ингибиторов ММП описаны, например, в J. Enzyme Inhibition,2, 1-22 (1987); Progress in Medicinal Chemistry 29, 271-334 (1992); Current Medicinal Chemistry,2, 743-762 (1995); Exp. Opin. Ther. Patents, 5,1287-1296 (1995); и Drug Discovery Today, 1, 1626 (1996). Ингибиторы ММП также являются предметом многочисленных патентов и заявок на патенты. В большинстве этих публикаций предпочтительными соединениями, являющимися предметом изобретения, являются гидроксамовые кислоты, поскольку было определенно установлено, что функция гидроксамата заключается в оптимальном координировании цинка для связывания с активным центром 4 ММП. Например, гидроксаматные ингибиторы,описанные в литературе, обычно в 100-1000 раз более эффективны, чем соответствующие ингибиторы, где функциональная группа гидроксамовой кислоты заменена на функциональную группу карбоновой кислоты. Однако гидроксамовые кислоты имеют тенденцию к относительно низкой биодоступности. Предпочтительными соединениями, сущность которых раскрыта здесь, являются ингибиторы типа карбоновых кислот, которые обладают ингибирующим действием по отношению к некоторым ММП, которое сопоставимо с активностью ингибиторов типа гидроксамовых кислот, описанной в литературе. Следующие патенты и заявки на патенты раскрывают сущность ингибиторов типа карбоновых кислот, которые являются, как и ингибиторы типа карбоновых кислот, сущность которых раскрыта в настоящем изобретении,моноаминовыми производными замещенной янтарной кислоты: Celltech Ltd.: ЕР-А-0489577Ltd.: WO 95/32944, WO 95/19961; Sterling Wintrop, Inc.: US 5,256,657; Sanofi Wintrop, Inc.: WO 95/22966; и Syntex (USA) Inc.: WO 94/04735,WO 95/12603 и WO 96/16027. Сущность изобретения Настоящее изобретение направлено на соединения с формулой где Х является одинарной связью или группойR1 является Н, фенилом, возможно замещенным С 3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;R2 является Н, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,где R10 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,где R11 является Н, алкильной группой, Oалкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой, и где R12 является Н, алкильной группой,арильной группой, гетероарильной группой, 5 циклоалкильной группой или гетероциклоалкильной группой,или где R11 и R12 образуют вместе с азотом,к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; иO-алкильной группой, или гетероарильной группой,или R2 и R3, вместе с атомами, к которым они присоединены, образуют циклоалкильную группу или гетероциклоалкильную группу;R13 является Н или С 3-алкильной группой и является гетероарильной группой, имеющей в кольце пять атомов, включая только один атомN в качестве гетероатома; или фармацевтически приемлемые соль или сольват этого соединения. При этом если Y является -СН(ОН)-, то R3 является Н или алкильной группой. Если Y является -С(O)-, то R3 является алкильной группой или O-алкильной группой, с условием, что если соединение с формулой (I) является где R1 и R5 такие как определено выше; W является Н, ОН, галогруппой, алкильной группой,или O-алкильной группой и, кроме того, где если m равно 2, 3, или 4, n равно 1, 2, 3,или 4, а А является CH2, О, NH или N-алкилом; или если m равно 4, 5 или 6, n равно 0, а А является -CHJ-, где J является карбоксильной, алкоксикарбонильной или карбамоильной группой; или фармацевтически приемлемой солью или сольватом этого соединения, тоR2 является Н, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,где R10 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,где R11 является Н, алкильной группой, Oалкильной группой, арильной группой, гетероа 003127 6 рильной группой, циклоалкильной группой или гетероциклоалкильной группой, и где R12 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой или гетероциклоалкильной группой,или где R11 и R12 образуют, вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; a R3 является гетероарильной группой. Настоящее изобретение, кроме того, направлено на фармацевтические рецептуры, содержащие терапевтически эффективное количество соединения с формулой I, или его фармацевтически приемлемой соли или сольвата. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение направлено на соединения с формулой I где Х является одинарной связью или группойR1 является Н, фенилом, возможно замещенным С 3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;R2 является Н, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10 ,где R10 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,где R11 является Н, алкильной группой, Oалкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой, и где R12 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой или гетероциклоалкильной группой,или где R11 и R12 образуют, вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; иR3 является Н или алкильной группой,или R2 и R3, вместе с атомами, к которым они присоединены, образуют циклоалкильную группу или гетероциклоалкильную группу;R13 является Н или С 3-алкильной группой, является гетероарильной группой, имеющей в кольце пять атомов, включая только один атомN в качестве гетероатома; или фармацевтически приемлемые соль или сольват этого соединения. Предпочтительно в этом соединении R2 иR3 вместе с атомами, к которым они присоединены, образуют циклоалкильную группу, или фармацевтически приемлемые соль или сольват этого соединения. В другом предпочтительном варианте указанного соединения R2 является Н, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,где R10 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,где R11 является Н, алкильной группой, Oалкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой, и где R12 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой или гетероциклоалкильной группой,или где R11 и R12 образуют, вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу, аR3 является Н. Другим вариантом соединения в соответствии с настоящим изобретением является соединение с формулой I где Х является одинарной связью или группойR1 является Н, фенилом, возможно замещенным С 3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;R2 является Н, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или C(O)R10,где R10 является Н, алкильной группой,арильной группой, гетероарильной группой, 003127 8 циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,где R11 является Н, алкильной группой, Oалкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой, и где R12 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой или гетероциклоалкильной группой,или где R11 и R12 образуют, вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; иR3 является алкильной группой или Oалкильной группой,или R2 и R3, вместе с атомами, к которым они присоединены, образуют циклоалкильную группу или гетероциклоалкильную группу;R13 является Н или С 3-алкильной группой,и является гетероарильной группой, имеющей в кольце пять атомов, включая только один атомN в качестве гетероатома; или фармацевтически приемлемые соль или сольват этого соединения с условием, что,если соединение с формулой (I) является где R1 и R5 такие как определено выше; W является Н, ОН, галогруппой, алкильной группой,или O-алкильной группой, и, кроме того, где если m равно 2, 3 или 4, n равно 1, 2, 3 или 4, а А является СН 2, О, NH или N-алкилом; или если m равно 4, 5 или 6, n равно 0, а А является -CHJ-, где J является карбоксильной, алкоксикарбонильной или карбамоильной группой; или фармацевтически приемлемой солью или сольватом этого соединения, то является пирролилом. Предпочтительно в этом соединении R2 иR5 является C(O)OR13, где R13 является Н или С 3 алкильной группой. Еще одним вариантом соединения в соответствии с настоящим изобретением является соединение с формулой I 10 Другим предпочтительным вариантом этого соединения является соединение с формулойI, в котором R3 является гетероарильной группой формулы где X является одинарной связью или группойR1 является Н, фенилом, возможно замещенным С 3-алкилом, цианогруппой, фтором или пиридинилом; бифенилом, возможно замещенным цианогруппой или карбамоилом; или пиридинилом;R2 является Н, алкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой, гетероциклоалкильной группой или С(O)R10,где R10 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой, гетероциклоалкильной группой, O-арильной группой, O-алкильной группой или NR11R12,где R11 является Н, алкильной группой, Oалкильной группой, арильной группой, гетероарильной группой, циклоалкильной группой или гетероциклоалкильной группой, и где R12 является Н, алкильной группой,арильной группой, гетероарильной группой,циклоалкильной группой или гетероциклоалкильной группой,или где R11 и R12 образуют, вместе с азотом, к которому они присоединены, гетероарильную группу или гетероциклоалкильную группу; иR13 является Н или С 3-алкильной группой и является гетероарильной группой, имеющей в кольце пять атомов, включая только один атомN в качестве гетероатома; или фармацевтически приемлемые соль или сольват этого соединения. Предпочтительным вариантом этого соединения является соединение с формулой I, в котором R3 является гетероарильной группой формулы где R21 и R22, вместе с атомами углерода, к которым они присоединены, образуют арильную группу, гетероарильную группу, циклоалкильную группу или гетероциклоалкильную группу; или фармацевтически приемлемые соль или сольват этого соединения. где R21 и R22 независимо выбраны из водорода,алкильной группы, арильной группы, гетероарильной группы, галогруппы, С(O)O-алкильной группы, карбамоильной группы, циклоалкильной группы или гетероциклоалкильной группы; или фармацевтически приемлемые соль или сольват этого соединения. В соединениях по настоящему изобретению, и фармацевтически приемлемых солях и сольватах этих соединений Х предпочтительно является одинарной связью. Также в соединениях формулы I в соответствии с настоящим изобретением предпочтительно является пирролилом. Предпочтительно R5 является C(O)NHOH или C(O)OR13, где R13 является водородом. Особо предпочтительным соединением согласно настоящему изобретению является соединение с формулой или фармацевтически приемлемые соль или сольват этого соединения. Другие особо предпочтительные соединения, соответствующие изобретению, включаютN1-гидpoкcи-N4-мeтил-3(R)-[3-[4-(пиpидин-4-ил)фeнил]-1H-пиppoл-1-ил]aмид янтарной кислоты; 3(R)-[3-(4'-цианобифенил-4-ил)-1 Н-пиррол-1-ил]-2(S)-циклопропил-N-(2,2-диметил 1(S)(метилкарбамоил)пропил)полуамид янтарной кислоты; 3(S)-[2-(4'-цианобифенил-4-ил)фуран-4 ил]-N-[2,2-диметил-1(S)-(метилкарбамоил)пропил]полуамид янтарной кислоты; 3(S)-[1-(4'-цианобифенил-4-ил)-1H-пиррол-3-ил]-N-(2,2-диметил-1(S)-(метилкарбамоил)пропил)-2(R)-(гидроксиметил)полуамид янтарной кислоты; 3(S)-[1-(4'-цианобифенил-4-ил)-1H-пиррол-3-ил]-N-(2,2-диметил-1(S)-(метилкарбамоил)пропил)-2(S)-(гидрокси)полуамид янтарной кислоты; 3(R)-[3-(4'-цианобифенил-4-ил)-1 Н-пиррол-1-ил]-N-(2,2-диметил-1(S)-(метилкарбамоил)пропил)-2(S)-(гидрокси)полуамид янтарной кислоты; и фармацевтически приемлемые соли и сольваты этих соединений, и фармацевтически приемлемые провещества для этих соединений. В контексте настоящего изобретения используются следующие определения. Термин "алкильная группа" означает одновалентный радикал с прямой или разветвленной цепью, состоящей из насыщенных и/или ненасыщенных атомов углерода и атомов водорода,такой, как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, винил, пентенил, бутенил, пропенил, этинил, бутинил, пропинил,пентинил, гексинил и тому подобные, который может быть незамещенным (то есть содержать только углерод и водород) или замещенным одним или несколькими подходящими заместителями, определенными ниже. Термин "O-алкильная группа" означает кислород, соединенный с алкильной группой, где алкильная группа является такой, как определено выше. Термин "циклоалкильная группа" означает неароматический, одновалентный моноциклический, бициклический или трициклический радикал, содержащий в кольце 3, 4, 5, 6, 7, 8, 9,10, 11, 12, 13 или 14 атомов углерода, каждый из которых может быть незамещенным или замещенным одним или несколькими подходящими 13 заместителями, определенными ниже, и к которому могут быть присоединены одна или несколько гетероциклоалкильных групп, арильных групп, или гетероарильных групп, которые сами по себе могут быть незамещенными или замещенными одним или несколькими подходящими заместителями. Иллюстративные примеры циклоалкильных групп включают, но не ограничиваются ими, циклопропил, циклобутил,циклопентил, циклопентенил, циклогексил,циклогексенил, циклогептил, циклооктил, бицикло[2.2.1]гептил, бицикло[2.2.1]гепт-2-ен-5 ил, бицикло[2.2.2]октил, бицикло[3.2.1]нонил,бицикло[4.3.0]нонил, бицикло[4.4.0]децил, индан-1-ил, индан-2-ил, тетралин-1-ил, тетралин 2-ил, адамантил и тому подобные. Термин "гетероциклоалкильная группа" означает неароматический, одновалентный моноциклический, бициклический или трициклический радикал, который является насыщенным или ненасыщенным, содержащим в кольце 3, 4,5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 атомов углерода, и который включает 1, 2, 3, 4 или 5 гетероатомов, выбранных из азота, кислорода и серы, где радикал является незамещенным или замещенным одним или несколькими подходящими заместителями, определенными ниже, и к которому могут быть присоединены одна или более циклоалкильных групп, арильных групп или гетероарильных групп, которые сами по себе могут быть незамещенными или замещенными одним или несколькими подходящими заместителями. Иллюстративные примеры гетероциклоалкильных групп включают,но не ограничиваются ими, азетидинил, пирролидил, пиперидил, пиперазинил, морфолинил,тетрагидро-2 Н-1.4-тиазинил, тетрагидрофурил,дигидрофурил, тетрагидропиранил, дигидропиранил, 1.3-диоксоланил, 1,3-диоксанил, 1,4-диоксанил, 1,3-оксатиоланил, 1,3-оксатианил, 1,3 дитианил, азабицикло[3.2.1]октил, азабицикло[3.3.1]нонил, азабицикло[4.3.0]нонил, оксабицикло[2.2.1]гептил, 1,5,9-триазабициклододецил и тому подобные. Термин "арильная группа" означает ароматический, одновалентный моноциклический,бициклический или трициклический радикал,содержащий в кольце 6, 10, 14 или 18 атомов углерода, который может быть замещенным или незамещенным одним или несколькими подходящими заместителями, определенными ниже, и к которому могут быть присоединены одна или более циклоалкильных групп, гетероциклоалкильных групп или гетероарильных групп, которые сами по себе могут быть незамещенными или замещенными одним или несколькими подходящими заместителями. Иллюстративные примеры арильных групп включают, но не ограничиваются ими, фенил, нафтил, флуорен-2 ил, индан-5-ил и тому подобные. Термин "гетероарильная группа" означает ароматический моновалентный моноцикличе 003127 14 ский, бициклический или трициклический радикал, содержащий в кольце 5, 6, 7, 8, 9, 10, 11, 12,13, 14, 15, 16, 17 или 18 атомов углерода, включая 1, 2, 3, 4 или 5 гетероатомов, выбранных из азота, кислорода и серы, который может быть незамещенным или замещенным одним или несколькими подходящими заместителями, определенными ниже, и к которому могут быть присоединены одна или несколько циклоалкильных групп, гетероциклоалкильных групп, или арильных групп, которые сами по себе могут быть незамещенными или замещенными одним или несколькими подходящими заместителями. Иллюстративные примеры гетероарильных групп включают, но не ограничиваются ими,пирролил, имидазолил, пиразолил, фурил, тиенил, тиазолил, оксазолил, изооксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил,пиразинил, пиридил, пиримидил, пиридазинил,индолил, изоиндолил, бензимидазолил, бензофурил, изобензофурил, бензотиенил, хинолил,изохинолил, фталазинил, карбазолил, пуринил,птеридинил, акридинил, фенантролинил, феноксазинил, фенотиазинил и тому подобные. Термин "оксигруппа" означает радикал-ОН. Термин "галогруппа" означает любой из радикалов -F, -Cl, -Вr или -I. Термин "цианогруппа" означает радикал-CN. Термин "триалкилсилильная группа" означает радикал -SiRpRqRs, где Rp, Rq и Rs каждый независимо является алкильной группой. Термин "карбоксильная группа" означает группу с формулой (В), где Ra является водородом. Термин "алкоксикарбонильная группа" означает группу с формулой (В), где Ra является алкильной группой, определенной выше. Термин "карбамоильная группа" означает группу с формулой (С), где Rb и Rc оба являются атомами водорода. Термин "аминогруппа" означает радикал-NH2. Термин "алкиламиногруппа" означает радикал -NHRu, где Ru является алкильной группой, определенной выше. Термин "диалкиламиногруппа" означает радикал -NRuRv, где Ru и Rv, которые являются одинаковыми или разными, являются каждый алкильной группой, определенной выше. Термин "фармацевтически приемлемый сольват" означает сольват, который сохраняет биологическую эффективность и свойства био 15 логически активных компонентов соединений с формулой I. Примеры фармацевтически приемлемых сольватов включают, но не ограничиваются ими, соединения с формулой I в комбинации с водой, изопропанолом, этанолом, метанолом,ДМСО, этилацетатом, уксусной кислотой или этаноламином. Ясно, что в случае твердых рецептур соединения, являющиеся предметом изобретения,могут существовать в различных формах, таких как стабильные и метастабильные кристаллические формы и изотропные и аморфные формы,которые все входят в объем настоящего изобретения. Термин "фармацевтически приемлемая соль" означает такие соли, которые сохраняют биологическую эффективность и свойства свободных кислот и оснований и которые не являются нежелательными с биологической и другой точек зрения. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими,сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, дизамещенные фосфаты, однозамещенные фосфаты, метафосфаты,пирфосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себацинаты, фумараты, малеаты, бутин-1.4-диоаты, гексин-1.6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты,фталаты, сульфонаты, ксиленсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты,цитраты, лактаты, -гидроксибутираты, гликолаты, тартраты, метансульфонаты, пропансульфонаты, нафтален-1-сульфонаты, нафтален-2 сульфонаты и манделаты. Если соединение, являющееся предметом изобретения, представляет собой основание,желаемую соль можно получить при помощи любого подходящего метода, известного специалистам в данной области техники, включая обработку свободного основания неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобные, или органической кислотой,такой как уксусная кислота; малеиновая кислота; янтарная кислота; миндальная кислота; фумаровая кислота; малоновая кислота; пировиноградная кислота; щавелевая кислота; гликолевая кислота; салициловая кислота; пиранозидиловые кислоты, такие как глюкуроновая кислота и галактуроновая кислота; альфа-гидроксикислоты, такие как лимонная кислота и винная кислота; аминокислоты, такие как аспарагиновая кислота и глутаминовая кислота; ароматические кислоты, такие как бензойная кислота и коричная кислота; сульфокислоты, такие как парато 003127 16 луолсульфокислота или этансульфокислота, или тому подобные. Если соединение, являющееся предметом изобретения, является кислотой, желаемую соль можно получить при помощи любого подходящего метода, известного в данной области техники, включая обработку свободной кислоты неорганическим или органическим основанием,таким, как амин (первичный, вторичный, или третичный), гидроокись щелочного или щелочноземельного металла, или тому подобные соединения. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин; аммиака; первичных, вторичных и третичных аминов; и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди,цинка, алюминия и лития. Все соединения, являющиеся предметом изобретения, могут существовать в качестве отдельных стереоизомеров, рацематов, и/или смесей энантиомеров и/или диастереомеров. Все эти отдельные стереоизомеры, рацематы и их смеси входят в объем настоящего изобретения. Предпочтительно, соединения по настоящему изобретению используются в форме, которая содержит, по меньшей мере, 90% отдельного изомера (80%-ный избыток энантиомера или диастереомера), более предпочтительно, по меньшей мере, 95% (90%-ный избыток энантиомера или диастереомера), еще более предпочтительно, по меньшей мере, 97,5% (95% избыток энантиомера или диастереомера) и наиболее предпочтительно, по меньшей мере, 99%(98%-ный избыток энантиомера или диастереомера). Соединения, идентифицированные здесь,как отдельные стереоизомеры, означают соединения, используемые в форме, которая содержит, по меньшей мере, 90% отдельного изомера. Настоящее изобретение, кроме того, направлено на способы ингибирования активности матриксной металлопротеиназы, которые включают контакт протеазы с эффективным количеством соединения с формулой I или фармацевтически приемлемого провещества или фармацевтически приемлемой соли или сольвата этого соединения. Например, активность матриксной металлопротеиназы в тканях млекопитающих можно ингибировать путем введения соединения с формулой I или фармацевтически приемлемого провещества или фармацевтически приемлемой соли или сольвата этого соединения. Активность соединений, являющихся предметом изобретения, как ингибиторов активности матриксной металлопротеиназы может быть измерена любым из способов, имеющихся у специалистов в данной области техники,включая анализы in vivo и in vitro. Примеры подходящих для измерения активности анализов включают флюориметрическое определение 17 скорости гидролиза пептидного субстрата с флуоресцентной меткой, который описан здесь. Введение соединений с формулой I, или фармацевтически приемлемого провещества или фармацевтически приемлемых солей или сольватов этих соединений, может быть выполнено в соответствии с любым из общепринятых способов введения, имеющихся в распоряжении специалистов в данной области техники. Иллюстративные примеры подходящих способов введения включают, но не ограничиваются ими,оральный, назальный, внутриглазной, парентеральный, местный, чрескожный и ректальный. Соединения с формулой I, являющиеся предметом изобретения, и их фармацевтически приемлемые провещества и фармацевтически приемлемые соли и сольваты, могут быть введены как фармацевтическая рецептура в любой подходящей фармацевтической форме, известной специалистам в данной области техники. Подходящие фармацевтические формы включают, но не ограничиваются ими, твердые, полутвердые, жидкие или лиофилизированные рецептуры, такие как таблетки, порошки, капсулы, суппозитории, суспензии и аэрозоли. Фармацевтическая рецептура может также включать подходящие наполнители, разбавители, носители и переносчики, а также другие фармацевтически активные агенты, в зависимости от цели использования. Приемлемые способы приготовления подходящих фармацевтических форм фармацевтических прописей известны специалистам в данной области техники. Например, фармацевтические препараты могут быть приготовлены в соответствии с традиционными химико-фармацевтическими методиками, включающими такие стадии, как смешивание, гранулирование и прессование, если это необходимо для получения таблетированных форм, или смешивание,наполнение и растворение ингредиентов соответствующим образом, с получением желаемых продуктов для орального, парентерального, местного, интравагинального, интраназального,интрабронхиального, внутриглазного, внутриушного и/или ректального введения. В фармацевтических прописях могут быть использованы твердые или жидкие фармацевтически приемлемые носители, разбавители, переносчики или наполнители. Наглядные примеры твердых носителей включают крахмал, лактозу,дигидрат сульфата кальция, белую глину, сахарозу, тальк, желатин, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Наглядные примеры жидких носителей могут включать патоку, арахисовое масло, оливковое масло, солевой раствор и воду. Носитель или разбавитель могут включать подходящий материал, обеспечивающий длительное выделение,такой, как глицерила моностеарат или глицерила дистеарат, по отдельности или вместе с воском. Если используют жидкий носитель, препа 003127 18 рат может быть в форме сиропа, эликсира,эмульсии, мягкой желатиновой капсулы, стерильной жидкости для инъекций (например,раствора), или неводной или водной жидкой суспензии. Доза фармацевтической рецептуры содержит, как минимум, терапевтически эффективное количество активного соединения (например,соединения с формулой I или фармацевтически приемлемого провещества, или фармацевтически приемлемой соли или сольвата этого соединения) и предпочтительно изготовлено в виде одной или нескольких фармацевтических дозировочных единиц. Выбранную дозу можно ввести млекопитающему, например больному человеку, нуждающемуся в лечении, опосредуемом ингибированием активности матриксной металлопротеиназы, любым известным способом введения дозы, включая местное, например,в виде мази или крема; оральное, ректальное,например в виде суппозитория; парентеральное путем инъекции; или непрерывное путем интравагинальной, интраназальной, интрабронхиальной, интраауральной или интраокулярной инфузии."Терапевтически эффективное количество" означает, что количество соединения с формулами I или II, будучи введено млекопитающему,нуждающемуся в нем, будет достаточным для лечебного эффекта на болезненные состояния,облегчающиеся при ингибировании активности одной или нескольких матриксных металлопротеиназ, такие как рост, инвазия или метастазирование опухолей, остеоартрит, ревматоидный артрит, остеопороз, периодонтит, гингивит,хронические поражения кожи, изъязвление роговицы, дегенеративные заболевания кожи, рассеянный склероз, инсульт, диабетическая ретинопатия, дегенерация желтого пятна сетчатки,ангиофибромы, гемангиомы, хронические обструктивные заболевания легких, такие как эмфизема, атеросклероз, заболевание клубочков почек, аритмия сердца, эндометриоз или болезненные состояния, характеризующиеся нежелательным ангиогенезом. Количество вводимого соединения с формулой I, которое будет соответствовать "терапевтически эффективному количеству", будет изменяться в зависимости от таких факторов, как характер соединения, вид болезненного состояния и его тяжесть, вид млекопитающего, нуждающегося в нем, однако,легко может быть определено специалистом в данной области техники."Воздействие" или "лечение" означает, по крайней мере, облегчение состояния болезни у млекопитающего, такого как человек, которое достигается за счет ингибирования активности одной или нескольких матриксных металлопротеиназ, таких как рост, инвазия или метастазирование опухолей, остеоартрит, ревматоидный артрит, остеопороз, периодонтит, гингивит,хронические поражения кожи, изъязвление ро 19 говицы, дегенеративные заболевания кожи, рассеянный склероз, инсульт, диабетическая ретинопатия, дегенерация желтого пятна сетчатки,ангиофибромы, гемангиомы, или болезненные состояния, характеризующиеся нежелательным ангиогенезом, и включает:(а) профилактическое лечение у млекопитающих, особенно, если обнаружено, что млекопитающее предрасположено к болезненному состоянию, но еще не диагностировано наличие этого состояния;(в) облегчение, полное или частичное, болезненного состояния. Соединения, являющиеся предметом изобретения, и их соли, сольваты и провещества,могут быть получены путем использования методик, имеющихся в данной области техники, с использованием легко доступных исходных материалов. Некоторые новые и образцовые способы получения соединений, являющихся предметом изобретения, описаны ниже. Способы получения карбоксилсодержащих ингибиторов матриксной металлопротеазы Получение соединения с формулой I Способы получения соединений с формулой I, где R5 является карбоксильной группой,имеют кульминацией снятие эфирной защиты(1) с образованием соответствующих карбоксилсодержащих соединений, как показано на схеме реакции I, приведенной ниже. Соответствующие типы эфиров (1) и образование R5 описаны, например, в работах Greene, Т; Wuts,P.G.M. "Protective Groups in Organic Synthesis",Wiley: 1991 и Kocienski, P.J. "Protective Groups",Thieme: 1994, которые включены сюда посредством ссылок. Некоторые примеры и условия,встречающиеся здесь, приведены ниже. Схема реакции I В одном из примеров расщепления типичного сложного эфира, сложный эфир с формулой (1), где R6 является бензилом, помещают в виде суспензии в растворителе, например, этилацетате, содержащем также металлический ка 003127 20 тализатор, предпочтительно палладий(0), в источник водородных атомов, такой как газообразный водород при давлении, равном одной атмосфере или выше, при температуре окружающей среды на время от 30 мин до трех дней,предпочтительно - на четыре часа. Карбоксилсодержащие соединения с формулой I, где R5 является -СООН, легко поддаются обычному выделению и очистке. В случае сложных эфиров с формулой (1),где R6 является трет-бутилом, с эфира (1) снимают защитную группу в растворителе, предпочтительно хлороформе или дихлорметане с избытком трифторуксусной кислоты, при температуре окружающей среды в течение периода от 15 мин до 12 ч с получением карбоксилсодержащего соединения с формулой I. В случае сложных эфиров с формулой (1),где R6 является аллилом, эфир (1) подвергают расщеплению в инертном растворителе, предпочтительно - ацетонитриле, с каталитическим количеством палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0), с избытком вторичного амина, такого как морфолин, в течение периода от 15 мин до 12 ч при температуре окружающей среды. Если вышеуказанные условия несовместимы с функциональными группами, содержащимися либо в R4, либо в R5, могут быть использованы другие стратегии защиты. Например, одновременная защита, при которой R4 является олефином, а R5-карбоксильной группой, может осуществляться через их связь, как в галолактоне с формулой (2), где Х является галогеном,как показано на cхеме реакции II ниже. Галолактон (2) подвергается восстановительному разрыву с образованием соединений с формулойR4 является аллилом, a R5 является карбоксильной группой. Раствор галолактона (2) подвергают воздействию восстанавливающей среды, предпочтительно - избытка порошкообразного цинка в уксусной кислоте. Образующееся карбоксилсодержащее соединение с формулой I, где R4 является аллилом, выделяют и очищают традиционными способами. Соединения (5) с формулой I, где R5 является гидроксамовой кислотой (-С(О)NНОН) могут быть получены из соединений (3) с формулой I, где R5 является карбоксильной груп 21 пой. Любой из многочисленных сочетающих агентов, имеющихся в продаже, может быть использован для конверсии либо в защищенный вариант соединения с формулой (4), где R7 является алкилом, либо непосредственно в гидроксамат (5), как изображено на схеме реакции III ниже. Схема реакции III Стадия 1. Получение соединений с формулами (4) или (5). Карбоновые кислоты с формулой (3) и гидроксиламин или его O-алкильные производные в инертном растворителе, предпочтительно диметилформамиде (ДМФ), сочетают с любым из многочисленных имеющихся в продаже сочетающих агентов, предпочтительно с бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфатом (БОФ) при температуре окружающей среды в течение периода от одного до 24 ч с получением либо гидроксаматов (5),либо O-алкилгидроксаматов (4), соответственно. Продукты легко поддаются обычной обработке и очистке. Стадия 2. Получение соединений с формулой (5) из соединений с формулой (4). С защищенных гидроксаматов с формулой(4) снимают защиту способом, который определяется природой защитной группы R7. Если R7 является триалкилсилилом, достаточно произвести гидролиз слабой кислотой или отщепление фтора в протонном или апротонном растворителе при температуре окружающей среды или более низкой в течение периода от одного до 12 ч. Если R7 является бензилом, избирательное снятие защиты без расщепления N-O связи происходит в присутствии палладия на угле с источником водорода, таким как газообразный водород при атмосферном давлении, в подходящем растворителе, таком как диметилформамид или метанол. Получение соединений с формулой II Пиррольные соединения с формулой II могут быть получены путем циклоконденсации аминов с формулой (6) с тетрагидрофуранами с формулой (7), как показано ниже на схеме реакции IV. Схема реакции IV Получение соединений с формулой II Конденсация солей аминов с формулой (6) и 2,5-диметокситетрагидрофуранов с формулой(7) может быть выполнена в уксусной кислоте в течение периода от одного до 24 ч при температурах от 40 до 90 С. Другой набор эффективных 22 условий включает нагревание раствора соединений (6) и (7) в инертном органическом растворителе, например 1,2-дихлорэтане, без кислоты или с кислотой, такой как трифторуксусная кислота, и без или со стехиометрическими количествами воды, в течение периода от одного до 48 ч при 40-90 С. Продукт с формулой II выделяют и очищают традиционными способами. Альтернативное получение соединений с формулой II Другой способ получения пиррольных соединений с формулой II включает более раннее образование кольца. Циклоконденсация Dаминокислот с формулой (8) с тетрагидрофуранами с формулой (7) и последующее сочетание показаны ниже на схеме реакции V: Схема реакции V Стадия 1. Получение соединений с формулой (9). Аминокислоты с формулой (8) и 2,5 диметокситетрагидрофураны с формулой (7) растворяют или суспендируют в инертном органическом растворителе, например 1,2-дихлорэтане, с хлортриметилсиланом, без или в присутствии кислоты, такой как трифторуксусная кислота, и без или в присутствии основания,такого как пиридин, в течение периода от одного до 48 ч при температуре в диапазоне от температуры окружающей среды до 80 С, предпочтительно при последней. Продукт (9) выделяют и очищают традиционными способами. Стадия 2. Получение соединений с формулой II из соединений с формулами (9) и (10). Карбоксилсодержащие соединения с формулой (9) и амины с формулой (10) сочетают при типичных условиях сочетания. Кислоты с формулой (9) вначале можно конвертировать в соответствующие активированные эфиры (например, фторангидрид) или использовать вместе с реагентом, например БОФ, и амином (10) в инертном растворителе, таком как хлороформ,при отсутствии или в присутствии основания,такого как N-метилморфолин (NMM), в течение периода от одного до 48 ч при температуре от 0 С до температуры окружающей среды, предпочтительно при последней. Продукт II выделяют и очищают традиционными способами. Получение исходных материалов Получение аминов с формулой (6)(-COOR6), можно получить в две стадии, как показано на схеме реакции VI: сочетание имеющихся в продаже производных Dаспарагиновой кислоты (11) и различных аминов (10), имеющихся в продаже или синтезируемых. Последующее снятие защитной группы с защищенных аминов (12) дает соли аминов Стадия 1. Получение соединений с формулой (12). Карбоксилсодержащие соединения с формулой (11) и амины (10) конденсируют, как описано выше для получения соединений с формулой II в соответствии со схемой реакцииNметилморфолин, при температуре от 0 С до температуры окружающей среды, предпочтительно при последней, в течение периода от одного до 48 ч с получением продукта с формулой(6). С трет-бутоксикарбониламинов с формулой (12) снимают защитную группу традиционными способами, например, в инертном растворителе, предпочтительно дихлорметане или хлороформе, с избытком трифторуксусной кислоты при температуре от 0 С до температуры окружающей среды, предпочтительно при первой, в течение периода от 30 мин до 18 ч, с получением солей аминов (6), которые можно использовать сразу же, без дальнейшей очистки,но они также легко поддаются обработке и очистке. Получение соединений с формулой (18) Аспартаты с формулой (8), где R4 является водородом, можно купить или получить путем синтеза в соответствии со способами, понятными специалистам в данной области техники,такими как способы, описанные в литературе. Однако аспартаты с формулой (8), где R4 является алкилом, необходимо синтезировать. Пример такого синтеза изображен на схеме реакцииVII ниже. D-аспарагиновую кислоту (13) через диаллиловый эфир (14) конвертируют в аспартат (15), который подвергается перегруппировке-эфира в аллиловое соединение (16) по Айрленду-Клейзену. Соответствующая обработка дает карбоксилсодержащие соединения с формулой (18), где R4 является аллилом, которые пригодны для последующей конверсии в низ 003127 Стадия 1. Получение соединений с формулой (14). Двойные сложные эфиры D-аспарагиновой кислоты можно получить любым из многочисленных способов. Например, D-аспарагиновую кислоту этерифицируют в избытке аллилового спирта, предпочтительно в инертном растворителе, таком как бензол, со стехиометрическими количествами кислоты, такой как п-толуолсульфокислота, в течение периода от одного до 12 ч с обратным холодильником при условиях,подходящих для азеотропного удаления воды. Соль (14) преципитирует, или ее выделяют другим способом и очищают стандартными способами. Стадия 2. Получение соединений с формулой (15). Защита амина хорошо описана в литературе и понятна специалистам в данной области техники. Например, соль амина (14) обрабатывают избытком ди-трет-бутилдикарбоната в соответствующем растворителе, предпочтительно- дихлорметане, в присутствии основания, предпочтительно - триэтиламина, в течение периода от одного до 24 ч при температуре окружающей среды. Продукт (15) выделяют и очищают традиционными способами. Стадия 3. Получение соединений с формулой (16). Сложные эфиры с формулой (15) обрабатывают специфическим стехиометрическим количеством основного амида лития, предпочтительно двумя эквивалентами гексаметилдисилазида лития, в инертном апротонном растворителе, предпочтительно тетрагидрофуране, при-78 С в течение 15-45 мин, после чего добавляют предпочтительно два эквивалента или более триалкилсилилхлорида, предпочтительно хлортриметилсилана, а затем реакционный раствор нагревают до 50-70 С или с обратным холодильником в течение периода от 30 мин до 4 ч,затем дают ему остыть и гасят метанолом. Последующая обычная обработка водой приводит к выделению аллилового соединения (16), которое очищают традиционными методами. Стадия 4. Получение соединений с формулой (17). Кислоты с формулой (16) этерифицируют для выделения карбоксильных концевых групп. Эта этерификация может быть выполнена мно 25 гочисленными способами, понятными специалистам в данной области техники, предпочтительно с соответствующим производным изомочевины для предотвращения рацемизации,например, с O-бензил-N,N'-диизопропилмочевиной, в инертном растворителе, таком как хлороформ, с обратным холодильником в течение 3-6 ч. Двойной эфир (17) выделяют и очищают обычными способами. Стадия 5. Получение соединений с формулой (18). Избирательное снятие одной из защитных групп с двойных эфиров с формулой (17) предпочтительно выполняется при использовании обычных условий расщепления аллиловых эфиров, как обсуждалось выше для схемы реакцииI. Раствор двойного эфира (17) помещают в полярный апротонный растворитель, предпочтительно ацетонитрил, с палладиевым катализатором, например, с палладия(0)тетракис(трифенилфосфином) и избытком основного вторичного амина, предпочтительно морфолина,при температуре окружающей среды в течение периода от 15 мин до четырех часов, предпочтительно 30 мин. Образующуюся кислоту с формулой (18) выделяют и очищают традиционным способом. Получение соединений с формулой (2) Для одновременной защиты функциональных групп R4 и R5 в определенных соединениях с формулой I, например, тех, где R4 является аллилом, a R5 -карбоксильной группой, получают галолактонамид с формулой (2). При синтезе таких соединений с формулой (2) используют способы, описанные для соединений с формулой II в схеме реакции V, как показано на схемах реакций VIII и IX ниже. На схеме реакции VIII, одноосновную кислоту (19) подвергают обычному сочетанию(как описано для схемы реакции V) с амином с формулой (10) с получением амида с формулой(20), с которого снимают защитную группу с получением амина с формулой (21). Пиррольное кольцо (как при получении пирролов в схеме реакции V) на амине (21) образуется при реакции с диметоксифураном (7) с получением продуктов с формулой (2). Схема реакции VIII Стадия 1. Получение соединений с формулой (20). Сочетание кислоты (19) и амина (10) проводят при обычных условиях образования пептидной связи, как описано выше в схеме реакции V, стадия 2. 26 Стадия 2. Получение соединений с формулой (21). Снятие защитной группы с амина (20) с образованием соли амина (21) проводят, как описано выше для получения аминов с формулой (6) в схеме реакции VI, стадия 2. Стадия 3. Получение соединений с формулой (2). Образование пирролов с формулой (2) из соединений с формулами (21) и (7) может быть выполнено, как описано выше в схеме реакцииV, стадия 1. Альтернативный путь получения соединений с формулой (2) проходит через образование пиррола (23) до реакции сочетания, что проиллюстрировано схемой реакции IX ниже. Схема реакции IX Стадия 1. Получение соединений с формулой (22). Снятие защитной группы с одноосновной кислоты (19) с образованием соли амина (22) происходит, как описано выше для получения аминов с формулой (6) в схеме реакции VI, стадия 2. Стадия 2. Получение соединений с формулой (23). Конденсация и циклизация соединений(22) и (7) дает пирролы с формулой (23) таким же образом, как обсуждалось выше для схемы реакции V, стадия 1. Стадия 3. Альтернативное получение соединений с формулой (2). Сочетание кислоты (23) и амина (10) выполняется при обычных условиях образования пептидной связи, описанных выше для схемы реакции V, стадия 2. Для получения промежуточных соединений для последней стадии образования соединений с формулой (2), необходимы производные аспарагиновой кислоты с формулой (19),как показано на схеме реакции Х ниже, промежуточное соединение (16) альтернативно циклизуют с получением галолактонов (25), которые одновременно защищают элементарную Стадия 1. Получение соединений с формулой (25). Карбоксиолефины с формулой (16) в виде суспензии в инертном растворителе, например,тетрагидрофуране или ацетонитриле, и избытке водного раствора щелочи, предпочтительно бикарбоната натрия, подвергают воздействию избытка галогена, предпочтительно иода, вначале при температуре от -10 до 0 С, а затем давая смеси нагреться и уравновеситься с температурой окружающей среды в течение периода от 2 до 24 ч. Образующийся галолактон выделяют и очищают в соответствии с традиционными способами. Стадия 2. Получение соединений с формулой (19). Соединение (19) получают из соединения с формулой (25) способом, идентичным способу,описанному выше для получения соединений с формулой (18) в схеме реакции VII, стадия 5. Получение тетрагидрофуранов с формулой (7) Тетрагидрофуран с формулой (7), где R1 является водородом, а Х является простой связью, имеется в продаже. Чаще 3-замещенные фураны (26) обрабатывают бромом в метаноле с получением 2,5-диметоксидигидрофуранов (27),которые в свою очередь гидрогенируют с получением тетрагидрофуранов (7). Весь подход проиллюстрирован на схеме реакции XI ниже. Схема реакции XI Стадия 1. Получение соединений с формулой (27). Фураны с формулой (26) обрабатывают стехиометрическими количествами брома в метаноле в качестве растворителя или в смесях с менее полярными растворителями при температурах от -20 С до температуры окружающей среды, предпочтительно при -10 С, в течение периода от 10 мин до 8 ч, предпочтительно в течение 90 мин. Продукты (27) выделяют и очищают традиционными способами. Стадия 2. Получение соединений с формулой (7). Олефины с формулой (27) восстанавливают в подходящем протонном или апротонном растворителе под водородом с давлением в одну атмосферу или выше в присутствии металлического катализатора, предпочтительно родия на алюминии или палладия на угле, при температуре в диапазоне от 0 до 40 С в течение 1-8 ч, 003127 28 предпочтительно 3 ч. Соединения (7) выделяют и очищают обычными способами. Тетрагидрофуран (7 а) с формулой (7), где Х является простой связью, а R1 является формилом (-СНО), имеется в продаже. Возможно создание различных комбинаций Х и R1 путем перестройки карбоксальдегида. Одна из возможных схем изображена на схеме реакции XII ниже. Схема реакции XII(7 а) добавляют к смеси, по крайней мере, двух эквивалентов реагента, образовавшегося из тетрабромистого углерода, трифенилфосфина и порошкообразного цинка в дихлорметане в течение 24 ч при температуре окружающей среды. Через 60 мин при температуре окружающей среды желаемое промежуточное соединение 1,1 дибромолефин может быть выделено и очищенно обычным способом. Алкиновый продукт с формулой (28) получают путем обработки 1,1 дибромолефина алкиллитием, предпочтительно н-бутиллитием, в инертном, апротонном растворителе, предпочтительно тетрагидрофуране,при низкой температуре от -78 до 0 С в течение 60 мин, и последующей обработке галогенированным триалкилстаннилом, таким как хлортрибутилолово (IV). Продукт (28) можно обрабатывать и очищать обычными способами. Стадия 2. Получение соединений с формулой (29). Алкин (28) обрабатывают путем алкилирования с соответствующим анионом с образованием соединений с формулой (7), где Х является-СС-, a R1 является алкилом, или алкин (28) сочетают в реакции Стилле с соединением с формулой (7), где Х является -СС-, а R1 является арилом. Для образования соединений с формулой (29), где R1 является алкилом, в растворе алкина (28) в инертном растворителе при низкой температуре, температуре окружающей среды или более низкой, производят замену металла с использованием подходящего алкиллития, а затем - алкилирование подходящим алкилирующим реагентом, например, первичным галоидным алкилом. Для образования соединений с формулой (29), где R1 является винилом или арилом, алкин (28) и галоидные арил или винил сочетают в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0), в апротонном растворите 29 ле при температуре ниже или выше температуры окружающей среды. Продукты с формулой(29) можно выделить и очистить при помощи традиционных методик. Стадия 3. Получение соединений с формулой (7 б). Алкин (29) можно гидрогенировать в подходящем растворителе с источником водорода,таким как газообразный водород при атмосферном давлении, в присутствии катализатора, такого как палладий на угле, с получением, например, соединений (7 б) с формулой (7), где Х является -CH2CH2-. Продукты с формулой (7 б) можно обрабатывать и очищать обычными способами. Другие тетрагидрофураны с формулой (7),где Х является простой связью, а R1 является винилом или арилом, можно получить из соответствующих фуранов. Фураны с соответствующими функциональными группами образуются при заместительном видоизменении путем сочетания с соответствующими винил- или арилсодержащими партнерами: тщательно разработанные последовательные сочетания по Сузуки, Хекку или Стилле с олефинами, галоарилами, арилборными кислотами, арилтрифлатами и/или арилалкилоловом могут быть использованы для получения арилфуранов (22),как показано на схемах реакции XIII, XIV, XV иXVI ниже. Пример сочетания по Сузуки с образованием R1 показан ниже на схеме реакции XIII. Схема реакции XIII Получение соединений с формулой (32) 3-Бромфуран (30) и борные кислоты с формулой (31), где R8 является арилом или винилом, в смеси с инертным растворителем, например, бензолом, и водным раствором щелочи,предпочтительно - карбоната натрия, в присутствии подходящего металлического катализатора подогревали от 30 С до температуры рефлюкса в течение 1-24 ч. Подходящие металлические катализаторы включают палладия(0) тетракис(трифенилфосфин) или палладия (II) ацетат в качестве примеров. Продукт (32) можно выделить и обрабатывать традиционным способом. Альтернативно, роли реакционных партнеров можно поменять на противоположные,например, как показано на схеме XIV ниже, где сочетаются фуран-3-ил-борная кислота (33) и ненасыщенные галогенсодержащие соединения с формулой (34), где Х является бромидом, иодидом или трифлатом, a R8 является винилом или арилом, с образованием соединений (32). Получение соединений с формулой (32) Фуран-3-илборную кислоту (33) и галоидные винилы или арилы с формулой (34) реагируют при условиях, сходных с условиями, описанными выше для схемы реакции XIII. Сочетание по Хекку представляет собой дополнительную полезную методологию введения и перестройки заместителей на ненасыщенных системах, как изображено на схеме реакции Альтернативное получение соединений с формулой (32) 3-Бромфуран (30) и олефиновые соединения с формулой (35), где R8 является арилом или винилом, помещают в виде суспензии в инертный растворитель в присутствии металлического катализатора, предпочтительно - палладия(0) тетракис(трифенилфосфин) или палладия(II) ацетат, с каталитическим количеством третичного фосфина, предпочтительно три(отолил)фосфина или три(о-толил)арсина, при температуре от температуры окружающей среды до температуры рефлюкса на период от одного до 24 ч. Продукт (32) можно выделить и обрабатывать обычным способом. При получении более крупных R1-групп,дальнейшая перестройка более мелких R1-групп может быть выполнена при различных условиях сочетания, дополнительно к реакциям, изображенным выше на схемах реакций XIII, XIV иXV. Например, поскольку вышеприведенные методы используют для получения фурана с формулой (36), его, в свою очередь, можно использовать для присоединения дополнительной винильной или арильной группы, как показано на схеме реакции XVI ниже. Схема реакции XVI-10 С и выше, предпочтительно при 0 С, обра 31 батывают стехиометрическим количеством трифторметансульфоангидрида. Образующийся трифлат (37) является потенциально реакционноспособным; его можно выделить и очистить при безводных условиях в инертной атмосфере,и следует быстро использовать. Стадия 2. Альтернативное получение соединений с формулой (32 б). Либо трифлат с формулой (37), либо галоидный винил с формулой (37 а) сочетают с триалкилвинил- или арилоловом (IV) с формулой(38) в инертном растворителе, таком как бензол,в присутствии металлического катализатора,такого как ацетат палладия (II), со стехиометрическим количеством хлорида лития при температуре окружающей среды или более высокой. Продукт сочетания (32 б) пригоден для обычного выделения и очистки. Фуранобразующие компоненты в схемах реакции XIII, XIV, XV и XVI легко доступны. 3 бромфуран (30) можно купить в фирме Aldrich. Фуран-3-ил-борную кислоту можно получить,например, так, как описано в работе Thompson,W.J.; Gaudino, G. J. Org. Chem. 1984, 49, 52375243. Фураны с формулой (36) можно синтезировать с использованием методологии, содержание которой раскрыто выше для схем реакции XIII, XIV, XV и XVI. Борные кислоты с формулой (31) известны в литературе или могут быть синтезированы. Органические соединения олова (IV) с формулой (38) также известны в литературе или могут быть синтезированы. Получение соединений с формулами III, IV,V, VI, VII и VIII Все соединения с формулами III, IV, V, VI,VII и VIII, где R5 является карбоксильной группой, могут быть получены из соответствующих сложных эфиров, как описано выше для соединений с формулой I в схеме реакции I. Соединения с формулами III, IV, V, VI, VII и VIII, где R5 является N-гидроксикарбамоилом (-С(О)NНОН),могут быть получены способом, описанным выше для схемы реакции II. Гетероциклические производные уксусной кислоты с формулой (40), где R9 является алкоксигруппой, алкиламиногруппой или оксазолидин-3-илом, алкилируют -галоидными эфирами с формулой (39), где Х является хлоридом,бромидом, иодидом или трифлатом, с образованием сложных эфиров с формулой (41), как показано ниже на схеме реакции XVII. R9 группа соединений с формулой (40) может служить в качестве дополнительного хирального центра,помогая установить абсолютную стереохимию соединений с формулой (41). Схема реакции XVII 32 Растворы соединений с формулой (40) в инертном растворителе, предпочтительно тетрагидрофуране, добавляют к растворам со стехиометрическими и/или определенными количествами подходящего основания, например, гексаметилдисилазана натрия или диизопропиламида лития, в инертном растворителе, предпочтительно тетрагидрофуране, при низкой температуре, предпочтительно от -78 до -15 С, на период от пяти минут до одного часа, и такие условия были подходящими для образования соответствующего аниона. Затем добавляют галоидные эфиры с формулой (39) отдельно или в виде раствора в инертном растворителе. Холодную реакционную смесь перемешивают в течение периода от 30 мин до 24 ч, предпочтительно 1 ч, с образованием желаемых эфиров(41), которые выделяют и очищают традиционными способами. В качестве примера процесса алкилирования, изображенного на схеме реакции XVII, гдеR9 является хиральным центром, смотри схему реакции XVIII ниже. В соответствии с этой схемой, амиды с формулой (40), где R9 являются хиральными оксазолидинами (см. формулу (42) ниже) можно подвергнуть стереоселективному алкилированию с образованием продуктов с формулой (43), которые, в свою очередь, могут дать гидроксиэтиламиды с формулой (44) (формула I, где R5 является сложным эфиром, Y является -СН(ОН)-. Схема реакции XVIII Стадия 1. Получение соединений с формулой (43). Соединения с формулой (43) получали из соединений с формулой (40), где R9 является хиральным оксазолидином, при условиях, идентичных условиям, описанным выше для получения соединений с формулой (41) из соединений с формулами (39) и (40) в схеме реакции XVII,за исключением того, что соединения с формулой (42) заменяли соединениями с формулой(40). Продукт с формулой (43) был пригоден для выделения и очистки обычными способами. Стадия 2. Получение соединений с формулой (44). Соединения с формулой (43) в растворителе, таком как тетрагидрофуран, обрабатывали избытком кислоты, предпочтительно - разведенной, 0,5 молярной хлористо-водородной кислоты, при температуре от температуры окружающей среды до температуры рефлюкса,предпочтительно при первой. Продукт с форму 33 лой (44) выделяли и очищали традиционными способами. Двузамещенные гетероциклические соединения с формулой (41) также могут быть использованы как варианты с целью выполнения вышеуказанной схемы реакции XVIII. Алкилирование в вышеуказанных схемах XVII и XVIII может предшествовать встраиванию или перестройке участка, который содержит Х и R1. Последующие стадии используют соответствующие последовательности способов сочетания,обсуждавшиеся для схем реакций XIII, XIV, XV и XVI. Например, в схеме реакции XIX, приведенной ниже, однозамещенный гетероцикл с формулой (46) может быть галогенирован с образованием соответственно дизамещенного гетероцикла с формулой (47), который в свою очередь является партнером в реакции сочетания по методологии, представленной на схемах реакций XIII, XIV, XV и XVI. В этом примере используется реакция сочетания по Сузуки с борной кислотой, имеющей формулу (31), для получения соединения с формулой (48). Схема реакции XIXR4 является галогеном, имеются в продаже. Если R4 является алкилом, многие соединения с формулой (39) могут быть получены путем синтезов, описанных в литературе. Например, многие аминокислоты могут быть конвертированы в оптически активные соединения с формулойamino acids; J. WileySons: New York, 1987. Некоторые гетероциклические производные уксусной кислоты с формулой (40) имеются в продаже (например, 2- или 3-тиофенуксусная кислота), однако, обычно должны быть синтезированы различными способами, как описано ниже. Прямое алкилирование азота соответствующего гетероциклического соединения с формулой (49), где Т, U и V являются независимо атомами углерода или азота, при помощи галоидных производных уксусной кислоты с формулой (50), где Х является галогеном или трифлатом, дает желаемые промежуточные соединения с формулой (51), как показано на схеме реакции XX ниже. Стадия 1. Получение соединений с формулой (51). Азотсодержащие гетероциклические соединения с формулой (49) (например, пиразол) помещают в апротонный растворитель, такой как N,N-диметилформамид, и, если это оправдано, отнимают от них протоны при помощи основания, такого как гидрид натрия, и обрабатывают -галогенацетамидами с формулой (50),где Х является галогеном или трифлатом, при комнатной или более высокой температуре в течение периода от одного до 24 ч. Продукты с формулой (51) поддаются обычным способам выделения и очистки. Аналогичное прямое замещение гетероциклического кольца включает алкилирование металлорганического производного с формулой(53), где М является, например, литием, магнием или медью, производным -галогенуксусной кислоты с формулой (50), как показано на схеме реакции XXI ниже Схема реакции XXI Стадия 1. Получение соединений с формулой (53). Гетероциклические металлопроизводные с формулой (53) можно получить обычным способом из гетероциклического соединения с формулой (52). Принципиальные способы включают отщепление протона от исходного вещества с формулой (52), где W является водородом, или замену галогена на металл в соответствующем галоидном гетероциклическом соединении с формулой (52), где W является галогеном. Эти реакции типично выполняют в инертном, апротонном растворителе, таком как тетрагидрофуран, при температуре окружающей среды или более низкой, в течение периода от 15 мин до 24 ч. Металлорганические соединения с формулой (53) обычно нестабильны при действии атмосферного воздуха и влажности. Обычно их образуют in situ и сразу же используют без выделения. 35 Стадия 2. Альтернативное получение соединений с формулой (40). Металлорганические соединения с формулой (53) алкилируют при стехиометрическом или избыточном количестве ацетата или ацетамида с формулой (50) в инертном растворителе,предпочтительно тетрагидрофуране, при низких температурах от -78 до 0 С в течение периода от десяти до 90 мин. Продукт с формулой (40) выделяют и очищают традиционными способами. В качестве еще одной альтернативы ацилирование может быть выполнено с использованием оксалатов или оксаматов с формулой(54), где R10, например, является галогеном, алкоксигруппой или имидазол-1-илом, с образованием кетоэфиров или кетоамидов с формулой(55), которые впоследствии деоксигенируют в несколько стадий до сложных эфиров или амидов с формулой (40), как показано на схеме реакции XXII ниже. Схема реакции XXII Стадия 1. Получение соединений с формулой (55). Гетероциклические металлорганические производные с формулой (53), где М является литием, могут быть получены, как показано выше на схеме реакции XXI, и ацилированы при помощи оксалата или оксамата с формулой (54),где R10 типично является галогеном, алкоксигруппой или имидазол-1-илом, в инертном растворителе, предпочтительно - тетрагидрофуране, при низких температурах от -78 до 0 С, в течение периода от десяти до 90 мин. Продукт с формулой (55) выделяют и очищают традиционными методами. Стадия 2. Получение соединений с формулой (56). Кетоэфир или амид с формулой (55) в растворителе, предпочтительно -этаноле, при температурах от -15 до 0 С обрабатывают восстанавливающим агентом типа гидрида, предпочтительно боргидридом натрия, в течение периода от пяти минут до четырех часов с получением продуктов с формулой (56), которые можно выделить и очистить по обычным методикам. Стадия 3. Получение соединений с формулой (57). Спирты с формулой (56) можно обрабатывать перед деоксигенированием путем конверсии до различных частей, обозначенных Q,предпочтительно, где Q является сложным эфи 003127 36 ром или галоидом. Типично их ацилируют в апротонном растворе, например, в хлороформе,с избытком ацилирующего агента, например,уксусного ангидрида или хлористого ацетила, в присутствии избытка основного амина, предпочтительно - пиридина, без или с каталитическим количеством (4-диметиламино)пиридина с получением ацетатов с формулой (57), где Q является ацетоксигруппой, которые можно обрабатывать и очищать обычным способом. Стадия 4. Получение соединений с формулой (40).-Галоиды или ацетаты с формулой (57),где Q является галогеном или ацетоксигруппой,соответственно, восстанавливают до продуктов с формулой (40) с металлическим катализатором, предпочтительно - палладием на угле, и источником водорода, предпочтительно - формиатом аммония. Продукты (40) обрабатывают и очищают обычным способом. Дизамещенные гетероциклические соединения с формулой (40) также можно создать при измененной последовательности реакций: позднее формирование участка, который содержит Х и R1, с использованием соответствующих последовательностей способов сочетания, обсуждавшихся в схемах реакций XIII, XIV, XV иXVI. Многие из монозамещенных гетероциклов,которые имеются в продаже, имеют в заместителе только один атом углерода, и необходима дополнительная обработка для получения дизамещенных гетероциклических соединений с формулой (40), как показано на схеме реакцииXXIII ниже. Имеющиеся в продаже монозамещенные гетероциклы с формулой (58), где R11 является водородом, гидроксилом или алкоксигруппой (например, 3-фуранкарбоксальдегид или 3-фурфурал, где R11 является водородом) могут быть гомологизированы любым из многочисленных имеющихся способов, известных специалистам в данной области техники, например, так, как описано в работе Martin, S.F.Synthesis 1979, 633-665, с получением 2 гетероциклических производных уксусной кислоты (59), которые могут быть замещены далее, например, как галоиды с формулой (60). Альтернативно, гетероциклы с формулой (58) замещаются с образованием галидов с формулой (61), затем гомологизируясь до производных с формулой (60). Последующее соединение соединения с формулой (60) с соответствующим партнером в реакции сочетания, таким как соединение с формулой (31), дает сложные эфиры или амиды с формулой (62). Как известно специалистам в данной области техники, многосторонность методов в схеме реакции XXIII позволяет взаимозаменять стадии. Например, реакция замещения галоидов с формулой (61) с борной кислотой с формулой (31) может предшествовать гомологизации до желаемых промежуточ 37 ных соединений с формулой (62) (не изображено). Схема реакции XXIII Стадия 1. Получение соединений с формулами (59) и (60). Гетероциклические соединения с формулами (58) и (61) гомологизируют в соединения с формулами (59) и (60), соответственно, в зависимости от природы R1 и R9. См., например,Martin, S.F. Synthesis 1979, 633-665. Например, в случае соединений (58) и (61), если R11 является водородом, анион 2-триметилсилил-1,3-дитиана используют в инертном апротонном растворителе, предпочтительно тетрагидрофуране, при низкой температуре от 0 до -78 С в течение периода от 30 мин до нескольких часов для получения соответствующего продукта присоединения дитиана, который в последствии конвертируют с использованием разнообразных методик в производные с формулой (59). В одном из примеров удаления дитиана используют хлорид ртути в воде и спирте для получения сложного эфира с формулой (59), где R9 является алкоксигруппой. Продукты с формулой (59) легко обрабатываются и очищаются обычными способами. Стадия 2. Получение соединений с формулами (60) и (61). В качестве примера внедрения вторых гетероароматических заместителей, соединения с формулами (59) и (58) в инертном растворителе галогенируют, например, с источником брома,таким как бром или N-бромсукцинамид, при температуре окружающей среды или более низкой в течение периода от одного часа до дня. Образующиеся галоидные гетероарилы с формулами (60) и (61), соответственно, подлежат обычной очистке и обработке. Стадия 3. Получение соединений с формулой (62). Сочетание гетероарилов с формулой (60) проводят аналогично сочетанию, описанному для схем реакций XIII, XV или XVI, с получением соединений с формулой (62). Амиды с тривиальной формулой (40), гдеR9 является алкиламиногруппой, часто можно получить из соответствующей карбоновой кислоты или активированных сложных эфиров с формулой (40), где R9 является алкокси- или 38 оксигруппой, как изображено на схеме реакции Образование амидов (64) (например, с формулой (40), где R9 является алкиламином) является результатом сочетания кислот с формулой (63) с аминами с формулой (10) при тех же условиях, что описаны выше для схемы реакции V, стадия 2. Продукты с формулой (64) выделяют и очищают обычными методами. Оксазолидины с формулой (42) могут быть получены из ацетамидов с формулой (65), где Y с точки зрения формулы I является -СН(ОН)-,как показано на схеме реакции XXV ниже. Схема реакции XXV Оксиамиды с формулой (65) помещают в раствор, содержащий ацетон или его эквивалент, предпочтительно 2-метоксипропилен, с каталитическим количеством кислоты, такой как п-толуолсульфокислота, в дегидратирующих условиях, таких как улавливание воды аппаратом Дина-Штарка, при температуре от температуры внешней среды до рефлюкса в течение достаточного времени для конверсии исходного материала (65). Продукт (42) легко поддается обычной обработке с целью выделения и очистки. Предпочтительный путь к оксазолидинам с формулой (42) включает сочетание оксазолидинов с формулой (67) с производными уксусной кислоты с формулой (63), как показано на схеме реакции XXVI ниже. Оксазолидины (67), в свою очередь, происходят от аминоспиртов с формулой (66) покупного или синтетического происхождения. Схема реакции XXVI 39 Соединения с формулой (67) получают из соединений с формулой (66) с использованием способа, сходного с описанным выше для получения соединений с формулой (42) в схеме реакции XXV, за исключением того, что предпочтительны более низкие температуры. Продукты с формулой (67) могут быть до некоторой степени нестабильны и обычно используются insitu или сразу же в следующей реакции без очистки. Стадия 2. Альтернативное получение соединений с формулой (42). Условия образования амидов с типичными для реакции сочетания реагентами, обсуждавшиеся выше для схемы реакции V, стадия 2,подходят для получения соединений с формулой (42). Для монозамещенных гетероциклических соединений, которых нет в продаже, кольца могут быть сконструированы. Например, для соединений с формулой III, как показано ниже на схеме реакции XXVII, тетрагидрофураны с формулой (68), где R12 является водородом или алкилом, конденсируют с аминами с формулой(69) с образованием пирролов с формулой (70). В зависимости от природы Х и R1, R12 пиррола(70) может быть конвертирован из водорода в галоген, а затем в алкил (как, например, на схеме реакции XXII). Схема реакции XXVII Получение соединений с формулой (70) Соединения с формулой (70) могут быть получены из соединений с формулами (68) и(69) при использовании условий, идентичных условиям, описанным для получения пирролов с формулой II в схеме реакции IV. Примеры Нижеследующие примеры лишь иллюстрируют изобретение и не должны рассматриваться как ограничивающие изобретение. Примеры включают предпочтительные способы осуществления соединений, являющихся предметом изобретения. Специалист в данной области техники может, без излишнего экспериментирования, осуществить разнообразные замены и изменения. Пример 1(а). N-(1(S)-Бензил-2-гидроксиэтил)-3(R)-[3-(бифенил-4-ил)-1 Н-пиррол-1-ил] полуамид янтарной кислоты.(68 мг, 0,12 ммоль) в этилацетате (5 мл) перемешивали под водородом в течение 20 ч. Катализатор отфильтровывали на Целит и промывали метиловым спиртом. Фильтрат концентрировали при пониженном давлении с получением желтого масла, которое очищали при помощи хроматографии на испарительной колонке с элюированием в ступенчатом градиенте 1% уксусной кислоты/2-5% метилового спирта/СН 2 Сl2 с получением 47 мг (82%) N-(1(S)-бензил-2 гидроксиэтил)-3(R)-[3-(бифенил-4-ил)-1 Н-пиррол-1-ил]полуамида янтарной кислоты в виде белого твердого вещества. 1(M+Cs+): 643,1209. Обнаружено: 643,1185. Аналитически рассчитано для C29H28N2O4 0,1 СНСl30,35 Н 2O: С 71,80; Н 5,96; N 5,75. Обнаружено: С 71,92; Н 5,87; N 5,77. Исходный материал, бензиловый эфир N(1(S)-бензил-2-гидроксиэтил)-3(R)-[3-(бифенил 4-ил)-1 Н-пиррол-1-ил]полуамида янтарной кислоты, получали следующим образом: Бензиловый эфир N-(1(S)-бензил-2-гидроксиэтил)-3(R)-(трет-бутоксикарбониламино) полуамида янтарной кислоты(ЭДК, 1,30 г, 6,82 ммоль) и N-гидроксибензотриазола гидрат (HOBtН 2 О, 1,04 г, 6,82 ммоль). Через 10 мин при 0 С добавляли 2Sамино-3-фенил-1-пропанол (936 мг, 6,20 ммоль),и образовавшейся смеси давали нагреться до температуры окружающей среды в течение ночи. Через 20 ч смесь перемешивали с 10% водным раствором HCl (5 мл) и насыщенным водным раствором NH4Cl (25 мл). Отделенный водный слой экстрагировали дополнительным количеством СНСl3 (2 х 10 мл). Объединенные органические экстракты промывали насыщен 41 ным водным раствором NаНСО 3:H2 О (25:25 мл) два раза, высушивали над Na2SO4 и концентрировали в ваккуме до образования желтой пены,2,84 г, которую перекристаллизовывали из этилацетата/гексана с получением 2,34 г (83%) бензилового эфира N-(1(S)-бензил-2-гидроксиэтил)3(R)-(трет-бутоксикарбониламино)полуамида янтарной кислоты в виде белых микроскопических игольчатых кристаллов, точка плавления 94-95 С. 1IR (KBr): 3442, 3381, 3307, 1729, 1676, 1656,1554, 1522, 1300, 1164, 1041, 701 см-1. Аналитически рассчитано для С 25 Н 32N2O6: С 65,77; Н 7,07; N 6,14. Обнаружено: С 65,74; Н 710; N 6,20. 4-Бифенилборная кислотаBranch, G.E.; Bettman, В.J. Am. Chem. Soc., 1934,56,1850-1857). К раствору 4-бромбифенила (2,00 г, 8,58 ммоль) в ТГФ (20 мл) при -78 С добавляли н-бутиллитий (4,0 мл 2,5 М раствора в гексане) медленной струй через шприц. Через 15 мин медленной струй через шприц добавляли триизопропилборат (3,0 мл, 13 ммоль). Через 10 мин образовавшемуся гомогенному раствору давали нагреться до температуры окружающей среды в течение 45 мин и распределяли между этилацетатом (950 мл) и 10% водным растворомHCl (50 мл). Водный слой отделяли и экстрагировали дополнительным количеством этилацетата. Объединенные органические слои промывали рассолом, высушивали над Na2SO4 и концентрировали с получением сырого продукта,который растирали в порошок с гексаном с выходом 1,53 г (90%) 4-бифенилборной кислоты в виде белого твердого вещества. 1(6,36 г, 32,1 ммоль) в этиловом спирте (50 мл). Смесь держали нагретой до 80 С в течение 18 ч,давали ей остыть и распределяли между CH2Cl2 и Н 2 О. Водный слой отделяли и экстрагировалиCH2Cl2 два раза. Объединенные органические слои промывали рассолом, сушили над Na2SO4 и концентрировали до неочищенного продукта,который растворяли в минимальном количествеCH2Cl2 и подавали на испарительную хроматографическую колонку, упакованную гексаном. Элюирование 10% CH2Cl2/гексаном давало несколько смешанных фракций, которые повторно хроматографировали. Всего было получено 5,37 г (76%) 3-(бифенил-4-ил)фурана в виде светложелтого масла. 1H-ЯМР:8,28 (s, 1 Н), 7,64-7,55 (m, 6H),7,50 (s, 1H), 7,45 (t, 2 Н, J=7,35 Гц), 7,40 (t, 1H,J=7,35 Гц), 6,75 (s, 1 Н). Аналитически рассчитано для С 16 Н 12 О: С 87,25; Н 5,49. Обнаружено: С 87,15; Н 5,52. 3-(Бифенил-4-ил)-2,5-дигидро-2,5 диметоксифуран-10 С добавляли бром (22 мкл, 0,43 ммоль) по каплям через шприц. Через 30 мин при -10 С смесь разводили этилацетатом и дважды фильтровали. Фильтрат концентрировали с получением неочищенного твердого вещества, которое очищали посредством хроматографии на испарительной колонке с элюентом в виде градиента 0-1% этилацетата/ CH2Cl2 с получением 90 мг(m, 1H, основной+побочный изомеры), 5,71 (d,0,75 Н, основной изомер, J=0,9 Гц), 3,60-3,40 (m,6H). Аналитически рассчитано для С 18 Н 18 О 3: С 76,57; Н 6,43. Обнаружено: С 76,52; Н 6,38. 3-(Бифенил-4-ил)-2,5-диметокситетрагидрофуран Смесь 3-бифенил-4-ил-2,5-дигидро-2,5-диметоксифурана (1,00 г, 3,55 ммоль) и 5% Pd/C в этиловом спирте : этилацетате (1:2) перемешивали под атмосферой азота в течение 1,75 ч. 43 Катализатор отфильтровывали на Целит. Фильтрат концентрировали с получением 0,97 г(97%) диастереомерной смеси 3-бифенил-4-ил 2,5-диметокситетрагидрофурана в виде бесцветного масла, которое обычно использовали без очистки. 1H-ЯМР:7,60-7,53 (m, 4 Н), 7,45-7,28 (m,5H), 5,26 (t, 1H, J=5,5 Гц), 5,02 (d, 1H, J=4,4 Гц),3,54 (s, 3 Н), 3,36 (s, 3 Н), 2,63-2,53 (m, 1H), 2,412,30 (m, 1H). Аналитически рассчитано для С 18 Н 20 О 3: С 76,03; Н 7,09. Обнаружено: С 75,74; Н 6,92. Бензиловый эфир N-(1(S)-бензил-2-гидроксиэтил)-3(R)-[3-(бифенил-4-ил)-1 Н-пиррол-1 ил]полуамида янтарной кислоты К раствору бензилового эфира N-(1(S)бензил-2-гидроксиэтил)-3(R)-(трет-бутоксикарбониламино)полуамида янтарной кислоты (389 мг, 0,851 ммоль) в CH2Cl2 (5 мл) добавляли трифторуксусную кислоту (1 мл). Через 2,5 ч при температуре окружающей среды растворитель удаляли в вакууме с получением трифторуксуснокислой соли бензилового эфира 3(R)амино-N-(1(S)-бензил-2-гидроксиэтил)полуамида янтарной кислоты в виде желтой пены, которую помещали с 3-(бифенил-4-ил)-2,5-диметокситетрагидрофураном (182 мг, 0,641 ммоль) в уксусную кислоту (1 мл) и нагревали до 50 С. Через 2 ч смеси давали остыть, тщательно перемешивали с насыщенным водным растворомNаНСО 3 (25 мл) и экстрагировали в СНСl3 (3 х 15 мл). Объединенные органические фазы высушивали над Na2SO4 и испаряли с получением коричневого масла, 685 мг. Хроматография на испарительной колонке с 10% метанолом/ СН 2Cl2 в качестве элюента давала 276 мг (64%) бензилового эфира N-(1(S)-бензил-2-гидроксиэтил)-3(R)-[3-(бифенил-4-ил)-1 Н-пиррол-1-ил] полуамида янтарной кислоты в виде желтого твердого вещества. 1IR (KBr): 3314, 3029, 2925, 1731, 1658,1656, 1548, 1495, 1355, 1196, 1165, 761, 698 см-1; Аналитически рассчитано для С 36 Н 34N2O4 0,5 H2O: С 76,17; Н 6,22; N 4,94. Обнаружено: С 76,24; Н 6,18; N 4,97. 44 Нижеследующие вещества получали сходным образом. Пример 1(б). N-[2,2-Диметил-1(S)-(метилкарбамоил)пропил]-3(R)-(3-фенил-1 Н-пиррол-1 ил)полуамид янтарной кислоты.Czech. Chem. Commun. 1983, 48, 2844-2861; 886 мг, 6,15 ммоль) в ДМФ (10 мл). Через 3 ч при температуре окружающей среды смесь перемешивали с 10% водным раствором KHSO4 (25 мл) и водой (100 мл) и экстрагировали СНСl3(100 мл) три раза. Экстракты СНСl3 промывали 10% водным раствором KHSO4:H2O (10:250 мл), насыщенным водным раствором NаНSO3:Н 2 О(90%) бензилового эфира 3(R)-трет-бутоксикарбониламино-N-(2,2-диметил-1(S)-(метилкарбамоил)пропил)полуамида янтарной кислоты в виде желтой пены, обычно использовавшейся без дальнейшей очистки. Хроматография на испарительной колонке с 3% метанолом/СНСl3 в качестве элюента дала аналитически чистое аморфное твердое вещество. 1= 9,0 Гц), 5,90 (bd, 1H, J=4,7 Гц), 5,56 (bd, 1H,J=8,5 Гц), 5,13 (dd, 2H, J = 2,5, 17,4 Гц), 4,56 (bd,1H, J=7,5 Гц), 4,11 (d, 1H, J=9,0 Гц), 3,00 (dd, 2H,J=4,0, 16,2 Гц), 2,85 (d, 3 Н, J=4,7 Гц), 1,00 (s,9H). Аналитически рассчитано для C23H35N3O6: С 61,45; Н 7,85; N 9,35. Обнаружено: С 61,56; Н 7,83; N 9,27. 2,5-Дигидро-2,5-диметокси-3-фенилфуран(см. Pridgen, L.N.; Jones, S.S. J. Org. Chem. 1982,47, 1590-1592 и Yang, Y.; Wong, H.N.C. Tetrahedron 1994, 32, 9583-9608; 848 мг, 5,89 ммоль) дал 1,00 г (82%) 2,5-дигидро-2,5-диметокси-3 фенилфурана в виде желтого масла, которое представляло собой, по данным 1H-ЯМР, смесь диастереомеров в соотношении примерно 80:20 и использовалось без дальнейшей очистки. 1 Н-ЯМР (CdCl3):7,64-7,52 (m, 2H), 7,447,30 (m, 3 Н), 6,36-6,30 (m, 0,9 Н, основной+ побочный изомер), 6,28 (dd, 0,1H, побочный изомер, J= 1,2, 3,7 Гц), 6,04-6,00 (m, 0,9H, основной+побочный изомер), 5,70 (d, 0,8H, основной изомер, J= 1,2 Гц), 3,52 (s, 2,2 Н, основной изомер), 3,46 (s, 0,60 Н, побочный изомер), 3,43 (s,2,2H, основной изомер), 3,40 (s, 0,60H, побочный изомер); Аналитически рассчитано для C12H14O3 0,04 Вr2: С 67,78; Н 6,64. Обнаружено: С 67,79; Н 6,45. 2,5-Диметокси-3-фенилтетрагидрофуран(110 мг) в этилацетате (10 мл) перемешивали под атмосферой Н 2 в течение 24 ч. Катализатор отфильтровывали на Целит и промывали этилацетатом. Фильтрат концентрировали в вакууме с получением 583 мг (98%) 2,5-диметокси-3-фенилтетрагидрофурана в виде бесцветного масла, которое обычно использовали без дальнейшей очистки.(ddd, 0,75H, J = 5,6, 12,7, 18,3 Гц), 2,17 (dd, 0,1H,J=8,4, 12,8 Гц). Аналитически рассчитано для С 12 Н 16 О 3 0,2H2O: С 68,03; Н 7,80. Обнаружено: С 68,11; Н 7,60. Трифторуксуснокислая соль бензилового эфира 3(R)-амино-N-(2,2-диметил-1(S)-(метилкарбамоил)пропил)полуамида янтарной кислоты К раствору бензилового эфира 3(R)бутоксикарбониламино-N-(2,2-диметил-1(S)(метилкарбамоил)пропил)полуамида янтарной кислоты (2,05 г, 4,57 ммоль) в СНСl3 (15 мл) добавляли трифторуксусную кислоту (3 мл). Через 2,5 ч при температуре окружающей среды добавляли дополнительное количество трифторуксусной кислоты (3 мл) и через 90 мин растворитель удаляли в вакууме с получением неочищенной соли - трифторацетата бензилового эфира 3(R)-амино-N-(2,2-диметил-1(S)(метилкарбамоил)пропил)полуамида янтарной кислоты в виде желтого масла, которое использовали без дальнейшей очистки. 1 Н-ЯМР:7,50-7,20 (m, 5H), 5,14 (dd, 2H,J= 12,1, 15,6 Гц), 4,57 (t, 1 Н, J = 6,2 Гц), 4,33 (d,1H, J=8,7 Гц), 3,13 (d, 1H, J=6,2 Гц), 2,74 (d, 3H,J=4,7 Гц), 0,93 (s, 9H). Бензиловый эфир N-[2,2-диметил-1(S)(метилкарбамоил)пропил]-3(R)-(3-фенил-1 Нпиррол-1-ил)полуамида янтарной кислоты Раствор неочищенной соли - трифторацетата бензилового эфира 3(R)-амино-N-[2,2 диметил-1(S)-(метилкарбамоил)пропил]полуамида янтарной кислоты (2,33 ммоль), 2,5 диметокси-3-фенилтетрагидрофурана (583 мг,2,80 ммоль), трифторуксусной кислоты (216 мкл, 2,80 ммоль) и воды (50 мкл, 2,8 ммоль) в 1,2-дихлорэтане (1 мл) нагревали до 70 С. Через 20 ч смеси давали остыть и концентрировали ее в вакууме с получением коричневого масла,которое очищали при помощи хроматографии на испарительной колонке с 0,5% уксусной кислотой/35% этилацетатом/гексаном в качестве элюента с получением 407 мг (37%) бензилового эфира N-(2,2-диметил-1(S)-(метилкарбамоил) пропил)-3(R)-(3-фенил-1 Н-пиррол-1-ил)полуамида янтарной кислоты в виде желтой пены. 1 Н ЯМР:7,52-7,44 (m, 2H), 7,38-7,15 (m,3 Н), 7,04 (dd, 1H, J= 1,8, 1,8 Гц), 6,78 (t, 1H, J= 2,5 Гц), 6,56 (dd, 1H, J= 1,6, 2,5 Гц), 6,42 (d, 1H,J=9,0 Гц), 5,95 (bd, J=4,0 Гц), 5,18-5,04 (m, 3 Н), 47 4,30 (d, 1H, J=9,0 Гц), 3,38 (dd, 1H, J=5,9, 16,8 Гц), 3,10 (dd, 1H, J=8,4, 16,8 Гц), 2,72 (d, 3 Н,J=5,0 Гц), 0,93 (s, 9H). IR: 3301, 2960, 1736,1645, 1542, 1166, 752, 695 см-1.(M+Cs+): 608,1525. Обнаружено: 608,1549. Аналитически рассчитано для C28H33N3O40,2H2O: С 70,18; Н 7,03; N 8,77. Обнаружено: С 70,45; Н 6,99; N 8,84. Пример 1(в). N-(8-Окco-4-oкca-1,7-диaзaтpициклo[9.6.1.012,17]oктaдeкa-11(18),12,14,16 тетраен-9(S)-ил)-3(R)-(3-фенил-1 Н-пиррол-1-ил) полуамид янтарной кислоты.(18),12,14,16-тетраен-9S-ил)-3(R)-(3-фенил-1 Нпиррол-1-ил)полуамида янтарной кислоты подвергали гидрогенолизу с получением 94%-ного выхода N-(8-оксо-4-окса-1,7-диазатрицикло [9.6. 1.012,17]октадека-11(18),12,14,16-тетраен-9(S)ил)-3(R)-(3-фенил-1 Н-пиррол-1-ил)полуамида янтарной кислоты в виде аморфного твердого вещества. 1(m, 5H), 3,07-2,76 (m, 5H). Аналитически рассчитано для С 29 Н 30N4O5 0,35 Н 2O0,1 МТВЕ: С 66,89; Н 6,07; N 10,58. Обнаружено: С 66,99; Н 6,06; N 10,33. Исходный материал, бензиловый эфир N(8-оксо-4-окса-1,7-диазатрицикло[9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9S-ил)-3(R)-(3 фенил-1 Н-пиррол-1-ил)полуамида янтарной кислоты получали следующим образом. Бензиловый эфир 3(R)-трет-бутоксикарбониламино-N-(8-оксо-4-окса-1,7-диазатрицикло В соответствии с процедурой, описанной в примере 1(б) для получения соли - трифторацетата бензилового эфира 3(R)-амино-N-(2,2 диметил-1(S)-(метилкарбамоил)пропил)полуамида янтарной кислоты, с 9S-трет-бутокси 003127Yuan, Z.; Krantz, A. Int. Patent Appl. WО 95/04735-A1, 16 февраля 1995) снимали защиту при помощи трифторуксусной кислоты. В соответствии с процедурой, описанной в примере 1(б) для получения бензилового эфира N-(2,2 диметил-1(S)-(метилкарбамоил)пропил)-3(R)трет-бутоксикарбониламинополуамида янтарной кислоты, неочищенную соль амина и бензиловый эфир N-трет-бутоксикарбонил-Dаспарагиновой кислоты сочетали с ТБТУ с получением 70%-ного выхода бензилового эфира 3(R)-трет-бутоксикарбониламино-N-(8-оксо-4 окса-1,7-диазатрицикло-[9.6.1.012,17]-октадека 11(18),12,14,16-тетраен-9S-ил)полуамида янтарной кислоты. Растирание с МТВЕ давало грязно-белое аморфное твердое вещество, которое было пригодно для дальнейшего использования без дополнительной очистки. 1(s, 1H), 7,04 (d, 1H, J=7,7 Гц ), 6,98 (t, 1H, J=7,0 Гц), 5,07 (s, 2H), 4,38-4,15 (m, 4H), 3,47-3,38 (m,2 Н), 2,96-2,75 (m, 5 Н), 2,65-2,53 (m, 2H), 1,34 (s,9H). Аналитически рассчитано для С 31 Н 38N4O7: С 64,34; Н 6,62; N 9,68. Обнаружено: С 64,24; Н 6,65; N 9,61. Бензиловый эфир N-(8-оксо-4-окса-1,7 диазатрицикло[9.6.1.012,17]октадека 11(18),12,14,16-тетраен-9S-ил)-3(R)-(3-фенил 1 Н-пиррол-1-ил)сукцинамовой кислоты В соответствии с процедурой, описанной в примере 1(б) для получения трифторуксуснокислой соли бензилового эфира 3(R)-амино-N(2,2-диметил-1(S)-(метилкарбамоил)пропил) полуамида янтарной кислоты, с бензилового эфира 3(R)-трет-бутоксикарбониламино-N-(8 оксо-4-окса-1,7-диазатрицикло-[9.6.1.012,17]октадека-11(18),12,14,16-тетраен-9S-ил)полуамида янтарной кислоты (157 мг, 0,27 ммоль) снимали защиту трифторуксусной кислотой. Раствор высушенной неочищенной соли амина и 2,5-диметокси-3-фенилтетрагидрофурана (67 мг, 0,32 ммоль, из примера 1(б в безводном 1,2-дихлорэтане (2 мл) нагревали до 75 С в течение 17 ч, давали остыть и распределяли между этилацетатом/фосфатным буфером с рН 7. Объединенные органические фазы высушивали над Na2SO4 и концентрировали с получением остатка, который очищали с помощью хроматографии на испарительной колонке с градиентом 0-25% этилацетата/СН 2 Сl2 в качестве элюента и 49 растирали с МТВЕ с получением 70 мг (43%) бензилового эфира N-(8-оксо-4-окса-1,7-диaзaтpициклo-[9.6.1.012,17]oктaдeкa-11(18),12,14,16 тeтpaeн-9S-ил)-3(R)-(3-фeнил-1 Н-пиррол-1 ил)полуамида янтарной кислоты в виде грязнобелого твердого вещества, точка плавления 163166 С. 1(m, 3 Н), 2,92-2,85 (m, 2H), 2,77-2,69 (m, 1H). Аналитически рассчитано для C36H36N4O5 0,4 Н 2O: С 70,66; Н 6,06; N 9,16. Обнаружено: С 70,69; Н 6,11; N 8,99. Пример 1(г). N-[2,2-Диметил-1(S)-(метилкарбамоил)пропил]-3(R)-[3-(пиридин-4-ил)-1 Нпиррол-1-ил]полуамид янтарной кислоты. В соответствии с процедурой, описанной в примере 1(а), бензиловый эфир N-[2,2-диметил 1(S)-(метилкарбамоил)пропил]-3(R)-[3-(пиридин-4-ил)-1 Н-пиррол-1-ил]полуамида янтарной кислоты подвергали гидрогенолизу в метиловом спирте с получением 60 мг (95%) N-[2,2 диметил-1(S)-(метилкарбамоил)пропил]-3(R)-[3(пиридин-4-ил)-1 Н-пиррол-1-ил]полуамида янтарной кислоты в виде желтого порошка, точка плавления 145-148 С. 1(M+Cs)+: 519, 1008. Обнаружено: 519, 1026. Аналитически рассчитано для C20H26N4O40,1 ЕtOАс 0,2CHCl3: С 59,03; Н 6,49; N 13,37. Обнаружено: С 59,24; Н 6,75; N 13,10. Исходные материалы были получены следующим образом. 4-Фуран-3-ил-пиридин В соответствии с процедурой, описанной в примере 1(а) для получения 3-бифенил-4-илфурана, 4-бромпиридина гидрохлорид (500 мг,2,57 ммоль) сочетали со свежей 3-фуранборной кислотой (см. Thompson, W.J.; Gaudino, G. J.Org. Chem. 1984, 49, 5237-5243) с получением 373 мг (100%) неочищенного 4-фуран-3-илпиридина в виде нестабильного твердого веще 003127 50 ства, которое сразу же использовали. ЯМР и IR соответствовали литературным данным (см. В соответствии с процедурой, описанной в примере 1(а) для получения 3-бифенил-4-ил-2,5 дигидро-2,5-диметоксифурана, неочищенный 4 фуран-3-ил-пиридин (2,57 ммоль) обрабатывали бромом в метиловом спирте при -15 С в присутствии Nа 2 СО 3 с получением 450 мг (85%) смеси диастереомеров 4-(2,5-диметокси-2,5-дигидрофуран-3-ил)пиридина в виде желтого масла,которое использовали без дальнейшей очистки. 1 Раствор неочищенной трифторацетатной соли бензилового эфира 3(R)-амино-N-(2,2 диметил-1(S)-метилкарбамоилпропил)полуамида янтарной кислоты (0,44 ммоль), 4-(2,5 диметокситетрагидрофуран-3-ил)пиридина (101 мг, 0,482 ммоль), пиридина (156 мкл, 1,92 51 ммоль) и хлортриметилсилана (366 мкл, 288 ммоль) в 1,2-дихлорэтане (5 мл) нагревали до 90 С. Через 3 дня смеси давали остыть и концентрировали в вакууме с получением коричневого масла, которое очищали при помощи хроматографии на испарительной колонке с 0,5% уксусной кислотой/10% метанолом/СН 2 Сl2 в качестве элюента с получением 90 мг (43%) бензилового эфира N-(2,2-диметил-1(S)-метилкарбамоилпропил)-3(R)-(3-пиридин-4-ил-1 Нпиррол-1-ил)полуамида янтарной кислоты в виде светло-желтого порошка, точка плавления 130-133 С. 1 Н ЯМР (CD3OD):8,36 (bs, 2H), 7,98 (d,2H, J=4,4 Гц), 7,51 (d, 2H, J=5,0 Гц), 7,48 (t, 1H,J=1,8 Гц), 6,93 (t, 1 Н, J=2,5 Гц), 6,61 (dd, 1H,J=1,7, 3,0 Гц), 5,34 (t, 1H, J=7,6 Гц), 5,10 (dd, 2H,J=2,5, 14,3 Гц), 4,16 (s, 1H), 3,14 (dd, 1H, J=7,8 Гц, 16,5 Гц), 2,60 (d, 3H, J=3,4 Гц), 0,92 (s, 9 Н). В соответствии с процедурой, описанной в примере 1(а), бензиловый эфир 3(R)-[3-(бифенил-4-ил)-1 Н-пиррол-1-ил]-N-[2,2-диметил 1(S)-(метилкарбамоил)пропил]полуамида янтарной кислоты подвергали гидрогенолизу с получением 310 мг (95%) 3(R)-[3-(бифенил-4 ил)-1 Н-пиррол-1-ил]-N-[2,2-диметил-1(S)-(метилкарбамоил)пропил]полуамида янтарной кислоты в виде аморфного твердого вещества. 1H ЯМР (CDCl3):7,56 (d, 2H, J=7,4 Гц),7,51 (s, 4H), 7,40 (t, 2H, J=7,4 Гц), 7,32-7,26 (m,2H), 7,11 (s, 1H), 6,81 (s, 1H), 6,51 (s, 1H), 5,965,93 (bm, 1 Н), 5,23 (t, 1H, J=6,8 Гц), 4,17 (d, 1H,J=9,6 Гц), 3,34 (dd, 1H, J=6,4, 17,1 Гц), 3,09 (dd,1H, J=7,6, 17,5 Гц), 2,71 (d, 3H, J=4,8 Гц), 0,90 (s,9H). Аналитически рассчитано для: С 27 Н 31N3O4 0,3 МТВЕ 0,1 Н 2O: С 69,89; Н 7,16; N 8,58. Обнаружено: С 70,02; Н 7,33; N 8,25. Исходный материал получали следующим образом. В соответствии с процедурой, описанной в примере 1(в) для получения бензилового эфира(полученным, как описано в примере 1(а в 1,2 дихлорэтане с трифторуксусной кислотой с получением 35%-ного выхода бензилового эфира 3(R)-[3-(бифенил-4-ил)-1H-пиррол-1-ил]-N-[2,2 диметил-1(S)-(метилкарбамоил)пропил] полуамида янтарной кислоты в виде аморфного твердого вещества. 1 В соответствии с процедурой, описанной в примере 1(а), бензиловый эфир N-(1(S)-бензил 2-метоксиэтил)-3(R)-[3-(бифенил-4-ил)-1Hпиррол-1-ил]полуамида янтарной кислоты подвергали гидрогенолизу с 90%-ным выходом N(1(S)-бензил-2-метоксиэтил)-3(R)-[3-(бифенил 4-ил)-1H-пиррол-1-ил]полуамида янтарной кислоты в виде аморфного твердого вещества,точка плавления 247 С. 1J=6,6, 16,5 Гц), 3,29-3,16 (m, 5H), 3,00 (dd, 1H,J=7,4, 16,9 Гц), 2,78 (d, 2H, J=7,0 Гц); Аналитически рассчитано для: С 30 Н 30N2O40,25 Н 2O: С 73,97; Н 6,31; N 5,75. Обнаружено: С 73,99; Н 6,59; N 5,45. Исходные материалы были получены следующим образом. Бензиловый эфир N-(1(S)-бензил-2-метоксиэтил)-3(R)-(трет-бутоксикарбониламино) полуамида янтарной кислоты(480 мг, 1,50 ммоль), 2S-амино-1-метокси-3 фенилпропана гидрохлорида (300 мг, 1,50 ммоль),бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфата (БОФ; 663 мг, 1,50 ммоль) и триэтиламина (0,5 мл, 3,6 ммоль) в ДМФ (5 мл) перемешивали при температуре окружающей среды в течение 4 ч. Смесь переносили в H2O (75 мл) и экстрагировали этилацетатом:гексаном (3:1; 2 х 50 мл). Объединенные органические экстракты промывали 1N водным раствором NaHSO4 (2 х 25 мл), насыщенным водным раствором NaHCO3 (25 мл) два раза и рассолом (25 мл), сушили над NaSO4 и выпаривали с получением после растирания с гексаном 545 мг (76%) бензилового эфира N(1(S)-бензил-2-метоксиэтил)-3(R)-(трет-бутоксикарбониламино)полуамида янтарной кислоты в виде твердого вещества, точка плавления 60-63 С. 1 В соответствии с процедурой, описанной в примере 1(а) для получения бензилового эфира 54 кислоты, с бензилового эфира N-(1(S)-бензил-2 метоксиэтил)-3(R)-(трет-бутоксикарбониламино)полуамида янтарной кислоты снимали защиту, и неочищенную соль конденсировали в уксусной кислоте с 3-(бифенил-4-ил)-2,5-диметокситетрагидрофураном (полученным, как описано в примере 1(а с получением 54%-ного выхода бензилового эфира N-(1(S)-бензил-2 метоксиэтил)-3(R)-[3-(бифенил-4-ил)-1 Н-пиррол-1-ил]полуамида янтарной кислоты в виде масла, которое использовали без дальнейшей очистки. 1 В соответствии с процедурой, описанной в примере 1(а), бензиловый эфир 3(R)-[3(бифенил-4-ил)-1H-пиррол-1-ил]-N-[2-гидрокси 1(S)-[(1H-имидазол-4-ил)метил]этил]полуамида янтарной кислоты подвергали гидрогенолизу и,после очистки с помощью обратнофазной жидкостной хроматографии высокого давления, был получен 12%-ный выход соли - трифторацетата 3(R)-[3-(бифенил-4-ил)-1 Н-пиррол-1-ил]-N-[2 гидрокси-1(S)-[(1H-имидазол-4-ил)метил]этил] полуамида янтарной кислоты в виде аморфного твердого вещества ржавого цвета. 1(m, 6H), 7,41 (t, 2H, J=7,5 Гц), 7,34-7,27 (m, 2H),7,19 (s, 1H), 6,81 (t, 1 Н, J=2,2 Гц), 6,48 (s, 1H),5,00 (dd, 1H, J=5,9, 8,8 Гц), 4,17-4,12 (m, 1H),3,58-3,46 (m, 2H), 3,30-3,21 (m, 1H), 3,06 (dd, 1H,J=4,8, 15,1 Гц), 2,95-2,87 (m, 2H). Аналитически рассчитано для: С 26 Н 26N4O4 1,0 TFA1,4 Н 2 О 0,15 С 6 Н 14: С 56,84; Н 5,27; N 9,17. Обнаружено: С 57,04; Н 5,00; N 8,94. Исходный материал был получен следующим образом. В соответствии с процедурой, описанной в примере 1(б) для получения бензилового эфира 3(R)-mpem-бутоксикарбониламино-N-(2,2-диметил-1(S)-(метилкарбамоил)пропил)полуамида янтарной кислоты, -бензиловый эфир N-третбутоксикарбонил-D-аспарагиновой кислоты иL-гистидинола дигидрохлорид сочетали с ТБТУ с получением 410 мг (92%) бензилового эфира 3(R)-(трет-бутоксикарбониламино)-N-[2-гидрокси-1(S)-[(1 Н-имидазол-4-ил)метил]этил]полуамида янтарной кислоты в виде твердого вещества, которое использовали без дальнейшей очистки. Бензиловый эфир 3(R)-[3-(бифенил-4-ил)-1Hпиррол-1-ил]-N-[2-гидрокси-1(S)-[(1 Н-имидазол-4-ил)метил]этил]полуамида янтарной кислоты В соответствии с процедурой, описанной в примере 1(в) для получения бензилового эфираN-(8-оксо-4-окса-1,7-диазатрицикло-[9.6.1.012,17] октадека-11(18),12,14,16-тетраен-9S-ил)-3(R)-(3 фенил-1H-пиррол-1-ил)полуамида янтарной кислоты, с бензилового эфира 3(R)-(третбутоксикарбониламино)-N-[2-гидрокси-1(S)[(1 Н-имидазол-4-ил)метил]этил]полуамида янтарной кислоты снимали защиту, и образующуюся неочищенную соль амина конденсировали с 3-(бифенил-4-ил)-2,5-диметокситетрагидрофураном (полученным как описано в примере 1(а в 1,2-дихлорэтане в присутствии трифторуксусной кислоты с получением 37%-ного выхода бензилового эфира 3(R)-[3-(бифенил-4-ил)1H-пиррол-1-ил]-N-[2-гидpoкcи-1(S)-[(1H-имидазол-4-ил)метил]этил]полуамида янтарной кислоты в виде желтого твердого вещества. 1 В соответствии с процедурой, описанной в примере 1(а), бензиловый эфир 3(R)-[3(бифенил-4-ил)-1H-пиррол-1-ил]-N-(2(R)-гидроксициклогекс-1(R)-ил)полуамида янтарной кислоты подвергали гидрогенолизу с получением 81%-ного выхода 3(R)-[3-(бифенил-4-ил)-1Hпиррол-1-ил]-N-(2(R)-гидроксициклогекс-1(R)ил)полуамида янтарной кислоты в виде аморфного твердого вещества. 1H ЯМР (CD3OD):8,00 (d, 1H, J=8,9 Гц), 7,61 (d, 2H, J=7,4 Гц), 7,56(s, 4H), 7,40 (t, 2H, J=7,5 Гц), 7,28 (t, 1H, J=7,5 Гц), 7,23 (s, 1H), 6,86 (t, 1H, J=2,6 Гц), 6,48 (t,1H, J=2,2 Гц), 5,07 (t, 1H, J=7,4 Гц), 3,59-3,53 (m,1H), 2,98 (dd, 1H, J=7,7, 16,9 Гц), 2,01-1,95 (m,1H), 1,83-1,78 (m, 1H), 1,72-1,61 (m, 2H), 1,341,11 (m, 4H). Аналитически рассчитано для: C26H28N2O4 0,5 Н 2O: С 70,73; Н 6,62; N 6,35. Обнаружено: С 70,79; Н 6,61; N 6,26. Исходный материал был получен следующим образом. Бензиловый эфир 3(R)-трет-бутоксикарбониламино-N-(2(R)-гидроксициклогекс-1R-ил) полуамида янтарной кислоты В соответствии с процедурой, описанной в примере 1(е) для получения бензилового эфираN-(1(S)-бензил-2-метоксиэтил)-3(R)-трет-бутоксикарбониламинополуамида янтарной кислоты, -бензиловый эфир N-трет-бутоксикарбонил-D-аспарагиновой кислоты и рацемический транс-2-аминоциклогексанол сочетали с БОФ с получением неочищенного твердого вещества, которое растирали с МТВЕ/гексаном, а затем последовательно перекристаллизовывали из МТВЕ/изооктана и МТВЕ/циклогексана/изооктана с получением 260 мг (20%) отдельного диастереомера бензилового эфира 3(R)-третбутоксикарбониламино-N-(2(R)-гидроксициклогекс-1R-ил)полуамида янтарной кислоты в виде грязно-белого твердого вещества, точка плавления 124-125 С. 1 Как описано в примере 1(а) для получения бензилового эфира N-(1(S)-бензил-2-гидроксиэтил)-3(R)-(3-(бифенил-4-ил)-1H-пиррол-1-ил) полуамида янтарной кислоты, бензиловый эфир 3(R)-трет-бутоксикарбониламино-N-(2(R)-гидроксициклогекс-1(R)-ил)полуамида янтарной кислоты и 3-бифенил-4-ил-2,5-диметокситетрагидрофуран (полученный, как описано в примере 1(а конденсировали в уксусной кислоте с получением 41%-ного выхода бензилового эфира 3(R)-[3-(бифенил-4-ил)-1H-пиррол-1-ил]-N(2(R)-гидроксициклогекс-1(R)-ил)полуамида янтарной кислоты в виде аморфного грязно-белого твердого вещества. 1 В соответствии с процедурой, описанной в примере 1(а), смесь бензилового эфира 3(R)-[3(бифенил-4-ил)-1H-пиррол-1-ил]-N-[2-гидрокси 1(S)-(гидроксиметил)-2-метилпропил]полуамида янтарной кислоты (137 мг, 0,26 ммоль) в этиловом спирте (2,5 мл) и этилацетате (2,5 мл) подвергали гидрогенолизу в течение 110 мин с получением белого твердого вещества, которое растирали с СН 2 Сl2/гексаном с получением 85 58 мг (75%) 3(R)-[3-(бифенил-4-ил)-1H-пиррол-1 ил]-N-[2-гидрокси-1(S)-(гидроксиметил)-2-метилпропил]полуамида янтарной кислоты в виде белого твердого вещества, точка плавления 150152 С. 1H ЯМР (ацетон-d6):7,67-7,61 (m, 6H),7,46-7,39 (m, 3H), 7,33 (t, 1H, J=7,4 Гц), 7,09 (bd,1H, J=8,5 Гц), 6,97 (t, 1H, J=2,4 Гц), 6,53 (t, 1H,J=2,2 Гц), 5,28 (t, 1H, J=7,2 Гц), 3,81-3,67 (m,3H), 3,35 (dd, 1H, J=7,4, 16,9 Гц), 1,24 (s, 3H),1,12 (s, 3H). Аналитически рассчитано для: С 25 Н 28N2O5: С 68,79; Н 6,47; N 6,42. Обнаружено: С 68,54; Н 6,50; N 6,39. Исходный материал был получен следующим образом. 3-Бензилоксикарбонил-2,2-диметил-4R-(1 гидрокси-1-метилэтил)оксазолидинDelacotte, J.-M.; Galons, H.; Schott, D.; Morgat, J.L. J. Labelled Соmр. Radiopharm. 1991, 29, 11411146; 500 мг, 1,70 ммоль) в сухом ТГФ (10 мл) при -78 С добавляли по каплям через шприц раствор бромистого метилмагния (1,5 мл 3 М раствора в эфире). Через 15 мин реакционный сосуд помещали в ванну со льдом при 0 С. Через 2 ч смесь охлаждали до -78 С и добавляли дополнительное количество бромистого метилмагния (0,5 мл 3 М раствора в эфире). Смеси давали нагреться до 0 С в течение 2 ч, затем гасили ацетоном (1 мл) и распределяли между этилацетатом (50 мл) и 1 М фосфатным буфером с рН 7 (50 мл). Отделенный органический слой промывали 1 М фосфатным буфером с рН 7 (50 мл) и рассолом (25 мл), высушивали над Na2SO4 и концентрировали до остатка, который очищали при помощи испарительной хроматографии на колонке с использованием в качестве элюента градиента 0-12% этилацетата/СН 2 Сl2 с получением 280 мг (56%) 3-бензилоксикарбонил-2,2 диметил-4R-(1-гидрокси-1-метилэтил)оксазолидина в виде бесцветного масла. 1 59 3-Бензилоксикарбонил-2,2-диметил-4(R)(1-гидрокси-1-метилэтил)оксазолидин подвергали гидрогенолизу в присутствии HCl в соответствии с условиями, описанными в примере 1(а), с получением неочищенного 2(R)-амино-3 метил-бутан-1,3-диола гидрохлорида. В соответствии с процедурой, описанной в примере 1(б) для получения бензилового эфира 3(R)трет-бутоксикарбониламидо-N-(2,2-диметил 1(S)-(метилкарбамоил)пропил)полуамида янтарной кислоты, неочищенную соль амина сочетали с -бензиловым эфиром N-трет-бутоксикарбонил-D-аспарагиновой кислоты в присутствии ТБТУ. Очистка при помощи хроматографии на колонке с элюированием в градиенте от этилацетата/СН 2 Сl2 (1:1) до 10% метанола/СН 2 Сl2 привела к выделению с 52%-ным выходом бензилового эфира 3(R)-трет-бутоксикарбониламино-N-[2-гидрокси-1(S)-(гидроксиметил)-2-метилпропил]полуамида янтарной кислоты, который использовали без дальнейшей очистки. 1 В соответствии с процедурой, описанной в примере 1(в) для бензилового эфира N-(8-оксо 4-окса-1,7-диазатрицикло-[9.6.1.012,17]-октадека 11(18),12,14,16-тетраен-9S-ил)-3(R)-(3-фенил 1 Н-пиррол-1-ил)полуамида янтарной кислоты, с бензилового эфира 3(R)-трет-бутоксикарбониламино-N-(2-гидрокси-1(S)-гидроксиметил-2-метилпропил)полуамида янтарной кислоты снимали защиту при помощи трифторуксусной кислоты. Неочищенную соль амина и 3-бифенил-4 ил-2,5-диметокси-тетрагидрофуран(полученный, как описано в примере 1(а конденсировали в безводном 1,2-дихлорэтане с трифторуксусной кислотой с получением 11%-ного выхода бензилового эфира 3(R)-[3-(бифенил-4-ил)1 Н-пиррол-1-ил]-N-[2-гидрокси-1(S)(гидроксиметил)-2-метилпропил]полуамида янтарной кислоты в виде аморфного твердого вещества. 1 В соответствии с процедурой, описанной в примере 1(а), бензиловый эфир N-[2,2-диметил 1(S)-(метилкарбамоил)пропил]-3(R)-[3-(4-пропилфенил)-1 Н-пиррол-1-ил]полуамида янтарной кислоты в метаноле и этилацетате подвергали гидрогенолизу с получением 30 мг (91%) N-[2,2 диметил-1(S)-(метилкарбамоил)пропил]-3(R)-[3(4-пропилфенил)-1 Н-пиррол-1-ил]полуамида янтарной кислоты в виде желтого порошка, точка плавления 104-106 С. 1(M+Cs+): 560,1525. Обнаружено: 560,1509. Аналитически рассчитано для С 24 Н 33N3O40,3 ЕtOАс: С 66,67; Н 7,86; N 9,26. Обнаружено: С 66,93; Н 7,78; N 8,89. Исходные материалы были получены следующим образом. 3-(4-Пропилфенил)фуран(500 мг, 2,03 ммоль) сочетали с 3-фуранборной кислотой для получения высокого выхода 3-(4 пропилфенил)фурана в виде светло-коричневого масла, которое было нестабильным и использовалось сразу же без дальнейшей очистки. 1
МПК / Метки
МПК: C07D 207/327, A61K 31/40, A61P 35/00
Метки: применение, сукцинамидов, гетероарильные, производные, качестве, ингибиторов, металлопротеиназы
Код ссылки
<a href="https://eas.patents.su/30-3127-geteroarilnye-proizvodnye-sukcinamidov-i-ih-primenenie-v-kachestve-ingibitorov-metalloproteinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероарильные производные сукцинамидов и их применение в качестве ингибиторов металлопротеиназы</a>
Предыдущий патент: Антивирусная фармацевтическая композиция, содержащая глицирризиновую кислоту и, по меньшей мере, один белок, имеющий активность в отношении вируса простого герпеса типа 1
Следующий патент: Способ лечения рассеянного склероза и фармацевтический состав, содержащий сополимер-1
Случайный патент: Модифицированные полипептиды эритропоэтина животных и их применение












