Новые сложные эфиры, производные (rr, ss)-3-(2-диметиламинометил -1-гидроксициклогексил)фенил 2-гидроксибензоата
Номер патента: 4770
Опубликовано: 26.08.2004
Авторы: Де Рамон Амат Элизабет, Хугуэт Клотет Хуан, Моурелье Мансини Марисабель
Формула / Реферат
1. Соединение общей формулы I
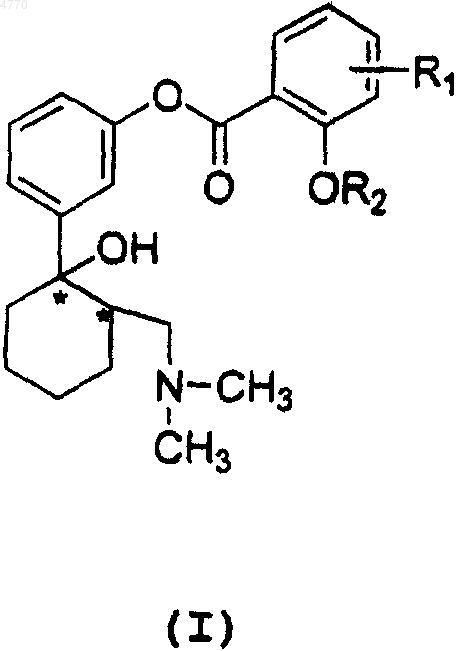
где R1 - атом галогена, C1-C6алкилгруппа, незамещенная или частично или полностью замещенная атомом галогена, OR3-группа, NO2-группа или фенилгруппа, незамещенная или частично или полностью замещенная атомом галогена, где R3 - C1-C6алкилгруппа,
R2 - атом водорода или CH3CO-группа, и его соли или оптические изомеры.
2. Соединение по п.1, отличающееся тем, что R1 - атом галогена, как, например, атом фтора, хлора или брома, галогензамещенная фенилгруппа или гидро(C1-C6фторалкил)группа.
3. Соединение по п.1, отличающееся тем, что его выбирают из следующих соединений:
сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-ацетокси-4-трифторметилбензойной кислоты,
сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-4-трифторметилбензойной кислоты,
сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 4-хлор-2-гидроксибензойной кислоты,
сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-4-метилбензойной кислоты,
сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-4-метоксибензойной кислоты,
сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-5-нитробензойной кислоты,
сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2',4'-дифтор-3-гидроксибифенил-4-карбоновой кислоты.
4. Способ получения соединения общей формулы (I) по п.1, отличающийся тем, что соединение формулы (II) вводят в реакцию с соединением общей формулы (III)
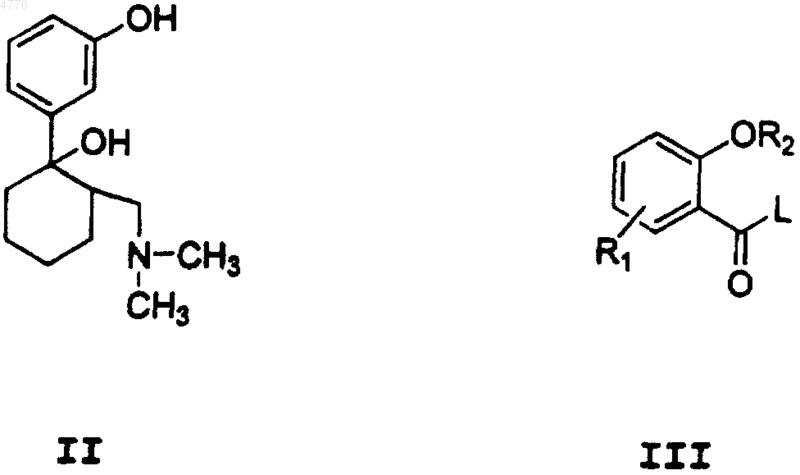
где R1 и R2 имеют значения, указанные выше, и
L - OH-группа, атом галогена  , O-R4 или -CO-R5-группа, где
, O-R4 или -CO-R5-группа, где
R4 - C1-C6алкил-, фенил-, возможно, замещенная фенилгруппа и
R5 - алкилгруппа, фенильное кольцо, возможно, замещенное одним или несколькими заместителями, или гетероциклическое кольцо, возможно, замещенное одним или несколькими заместителями, причем реакцию проводят в среде инертного растворителя при температуре от -20 до 120шC.
5. Способ по п.4, отличающийся тем, что прибавляют агент, промотирующий конденсацию.
6. Способ по п.4, отличающийся тем, что инертный растворитель выбирают из группы, состоящей из дихлорметана, тетрагидрофурана, ацетонитрила, 1,2-дихлорэтана, этилацетата, диметоксиэтана или диоксана, предпочтительно дихлорметана или тетрагидрофурана.
7. Способ по п.5, отличающийся тем, что агент, промотирующий конденсацию, выбирают из группы, состоящей из карбонилдиимидазола, дициклогексилкарбодиимида, триэтиламина этилхлорформиата, триэтиламина бензотриазолтозилата или диэтилхлорфосфата, предпочтительно карбонилдиимидазола или дициклогексилкарбодиимида.
8. Способ по п.4, отличающийся тем, что температурный интервал составляет 0-35шC.
9. Применение соединения общей формулы (I) по любому из пп.1-3 для получения медикамента для лечения боли.
10. Фармацевтическая композиция, которая включает соединение общей формулы (I) по любому из пп.1-3 и фармацевтически приемлемый наполнитель, для лечения боли.
Текст
1 Область изобретения Данное изобретение относится к новым сложным эфирам, производным (RR,SS)-3-(2 диметиламинометил-1-гидроксициклогексил)фенил 2-гидроксибензоата, аналогам трамадола. Полученные соединения проявляют аналгезирующую активность более высокую, чем трамадол. Предпосылки изобретения Лечение боли является самой важной областью медицины. Фармакологические агенты,используемые в настоящее время для лечения боли, могут включаться, большей частью, в две большие группы: опиоидные соединения и нестероидные противовоспалительные препаратыNSAIDs пригодны только в случае легкой или умеренной боли: сильные боли традиционно лечат опиоидными соединениями. Однако указанные опиоидные соединения дают ряд нежелательных побочных эффектов, как, например,запор, угнетение дыхания, а также толерантность и склонность к привыканию. В патенте США 3652589 описан класс болеутоляющих соединений со структурой замещенных циклоалканолфенольных эфиров с аминогруппой щелочного характера в циклоалкильном кольце. Среди них соединение (1R,2R или 1S,2S)2-[(диметиламино)метил]-1-(3-метоксифенил) циклогексанол, обычно известное как трамадол, может приводить к ослаблению боли, и это, в частности, заявлено в данном патенте. Серии продуктов, полученных из предыдущего соединения, в которых имеет место дегидратация циклоалканольного кольца вместе с деметилированием 3-метоксигруппы фенильного кольца, имеющие структуру описаны в патенте Нидерландов 6610022. В указанном патенте также описаны продукты, полученные из продуктов вышеупомянутого патента США, в котором метоксигруппа в 3-положении фенильного кольца деметилирована. А именно, продукты со структурой 2 Среди продуктов, описанных в данном патенте, включен О-деметилтрамадол, данное соединение описано в качестве одного из продуктов метаболизма трамадола (Von W.Lintz and(1981. Его (+) изомеру приписывают аналгезирующую активность трамадола (Lars Poulsen andcol. Clin. Pharmacol. Ther. (St.Louis) 1996, 60 (6),636-644). Однако не существует данных по клиническому применению метаболита О-деметилтрамадола. Позднее, в ЕР 753506 описаны новые Одеметилзамещенные, 1-галогенированные и/или 3-циклогексилзамещенные производные трамадола. Трамадол обладает опиоидным эффектом агониста. Однако клиническая практика с трамадолом указывает, что, несмотря на этот факт,он не имеет некоторых типичных побочных эффектов опиоидных агонистов, как, например,угнетение дыхания (W. Vogel and col. Arzneim.Forsch./Drug Res. 28 (I), 183 (1978, запор (I.Arend and col. Arzneim.-Forsch./Drug Res. 28 (I),199 (1978, толерантность (L. Flohe et al., Arzneim.-Forsch./ Drug Res. 28 (I), 213 (1978 и возможность злоупотребления (T. Yenagita et al.,Arzneim.-Forsch./Drug Res. 28 (I), 158 (1978. Обнаружены некоторые специфические побочные эффекты трамадола, вызывающие при быстром внутривенном введении (i.v.), например асфиксию и потоотделение. К другим недостаткам трамадола относится короткая продолжительность его действия (T."The experimental toxicology of tramadol: an overview", Toxicology Letters, 95, 63-71, (1998. В патенте США 5733936 в общей части раздела описания приведены некоторые сложные эфиры 6-диметиламинометил-1-фенилциклогексана с аналгезирующей активностью и низкой токсичностью. Цель патента США 5733936 - получить сложные эфиры, фосфонаты, простые эфиры,фенолы, карбонаты, карбаматы и т.д. производных, замещенных в 5-положении циклогексильной группы, а также их дегидроксилированные,хлорированные, фторированные аналоговые соединения. Кроме того, хотя патент США 5733936 описывает некоторые сложные эфиры 6 диметиламинометил-1-фенилциклогексана, ни один из примеров, описанных в указанном патенте 5733936, не относится к сложному эфиру О-деметилтрамадола. Во всех сложных эфирах, приведенных в примерах (примеры 13,14, 15, 16), отсутствует третичная гидроксильная группа О-деметилтрамадола. Поэтому данные по стабильности, активности и побочным эффектам нельзя ни предвидеть, ни предположить. Согласно данной заявке неожиданный эффект достигается с соединениями формулы I данного изобретения. 3 Вследствие изложенных выше причин новые соединения с улучшенной аналгезирующей активностью все еще представляют интерес. Описание изобретения Данное изобретение относится к новым производным (RR-SS)-3-(2-диметиламинометил 1-гидроксициклогексил)фенил 2-гидроксибензоата, аналогам трамадола. Аналгезирующая активность данных соединений оказывается более высокой, чем у трамадола. В особенности, в данном изобретении описываются и заявляются продукты общей формулы (I), их соли и оптические изомеры, а также способ их получения. Данное изобретение также относится к применению данных соединений для производства медикаментов, предназначенных для лечения боли. Продукты, описанные в данном изобретении,представлены следующей общей формулой (I): 4 сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2',4'-дифтор 3-гидроксибифенил-4-карбоновой кислоты. Соединения общей формулы (I) можно получить с помощью следующих способов, находящихся также в пределах объема данного изобретения. Описание способов Способ А. Соединения общей формулы (I), описанные в данном изобретении, можно получить с помощью общего способа, заключающегося во взаимодействии соединения формулы (II) с соответствующей кислотой или производным кислоты общей формулы (III)( yказывает возможность асимметрических атомов углерода), гдеR1 - атом галогена; C1-С 6 алкилгруппа, незамещенная или частично или полностью замещенная атомом галогена; ОR3-группа; NO2 группа или фенилгруппа, незамещенная или частично или полностью замещенная атомом галогена; где R3 - C1-С 6 алкилгруппа;R2 - атом водорода или СН 2 СО-группа. Предпочтительно, когда R1 - атом галогена, как, например, фтор, хлор, бром; фенилгруппа, замещенная галогеном; или гидро(C1 С 6 фторалкил)группа. Особенно предпочтительными соединениями, описанными в данном изобретении, являются сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-ацетокси 4-трифторметилбензойной кислоты; сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси 4-трифторметилбензойной кислоты; сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 4-хлор-2-гидроксибензойной кислоты; сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси 4-метилбензойной кислоты; сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси 4-метоксибензойной кислоты; сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси 5-нитробензойной кислоты;L - ОН-группа, атом галогена,-CO-R5-группа, гдe R4 - С 1-С 6 алкил, фенил- или замещенная фенилгруппа и R5 - алкилгруппа,фенильное кольцо, возможно, замещенное одним или несколькими заместителями, или гетероциклическое кольцо, возможно, замещенное одним или несколькими заместителями. Предпочтительно, когда L - ОН-группа или атом галогена. Реакцию проводят в инертном растворителе, как, например, дихлорметане, тетрагидрофуране, ацетонитриле, 1,2-дихлорэтане, этилацетате, диметоксиэтане или диоксане, предпочтительно дихлорметане или тетрагидрофуране, в температурном интервале от -20 до 120 С,предпочтительно от 0 до 35 С, с получением соединений большей степени чистоты и предпочтительно в присутствии реагента, промотирующего конденсацию, для ускорения реакции,как, например, карбонилдиимидазола, дициклогексилкарбодиимида, триэтиламина этилхлорформиата, триэтиламина бензотриазолтозилата или диэтилхлорфосфата, предпочтительно карбонилдиимидазола или дициклогексилкарбодиимида. Соединения формулы (II) получают способами, описанными в литературе (патент Нидерландов 6610022 или Flick el аl., Arzneim.Forsch./Drug Res. (1978), 28 (I), 107-113). Способ Б. Данный способ состоит в том, что соединение общей формулы (Iа), где R2 - СН 3 СОгруппа, подвергают гидролизу в кислой среде с получением соединения общей формулы (Iб), в которой R2 - атом водорода: где R1 имеет значения, указанные выше. Далее описывают методы, применяемые для установления фармакологической активности соединений. Проверка аналгезирующей активности Способ горячей пластинки. Применяемым способом является способ,описанный в работе Eddy N.B., Leimbach D. (J.Pharm. Exp. Ther. 107: 385-393, 1953). Аналгезирующий эффект продуктов оценивали, анализируя поведение животных на горячей поверхности при температуре 551 С. Использовали мужские особи швейцарских мышей весом 20-25 г. Проверяемые соединения вводили орально за 1 ч до начала проверки. Способ состоял в помещении животных на горячую пластинку при выдерживании их в цилиндре из органического стекла диаметром 25 см и высотой 21 см и в определении времени, в течение которого животные выпрыгивали с горячей поверхности. Животных отбирали перед началом проверки так, чтобы те животные, которые оставались более 10 с без выпрыгивания, не включались в группу, которая получала лечение. После введения исследуемого продукта проверку повторяли и снова определяли максимальное время нахождения на горячей пластинке. Тех животных, которые не выпрыгивали более 60 с, удаляли с пластинки, чтобы избежать повреждения животного, и они были приняты,как 100% защищенные. Результаты выражались в виде % увеличения времени прыжка, вычисленного следующим образом: Целью данного изобретения является применение соединения общей формулы (I) для получения медикамента, предназначенного для лечения боли. Аналогично, целью данного изобретения также является фармацевтическая композиция,которая содержит данное соединение общей формулы (I) вместе с фармацевтически приемлемым наполнителем, для лечения боли. Экспериментальная часть Далее изложены следующие иллюстративные примеры, но их нельзя истолковывать, как ограничивающие объем изобретения. Примеры синтеза Пример 1. Сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-ацетокси-4-трифторметилбензойной кислоты. К раствору 15,0 г (60,5 ммолей) 4-трифторметилацетилсалициловой кислоты в 150 мл безводного тетрагидрофурана прибавляли 9,3 г(57,5 ммолей) карбонилдиимидазола при комнатной температуре в инертной атмосфере. После 30 мин прибавляли 13,1 г (52,6 ммолей) 3-(2 диметиламинометил-1-гидроксициклогексил) фенола. Полученный раствор выдерживали при комнатной температуре в течение 3 дней. Смесь прибавляли к водному раствору NаНСО 3 при рН 8 и экстрагировали дихлорметаном (3 х 50 мл). Собранные органические экстракты сушили надNa2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка,который очищали хроматографией на колонке с силикагелем (элюент: смесь 9:1 дихлорметана/ацетона и увеличивающиеся количества ацетона),получая 20 г названного соединения в виде масла. 1 Н-ЯМР (CDCl3): 1,20-2,25 (м, 16 Н), включая 2,15 (с, 6 Н); 2,30 (с, 3 Н); 2,45 (дд, 1 Н); 7,08 Соединение, описанное в примере 1, растворяли в 600 мл изопропанола и 25 мл 35% соляной кислоты. Полученный раствор перемешивали в течение 16 ч при 40 С. Изопропанол упаривали, остаток растворяли в 100 мл дихлорметана и добавляли к 100 мл водного раствора NaHCО 3 при рН 8. Проводили экстракцию продукта и водную фазу промывали порциями свежего дихлорметана (2 х 50 мл). Собранные органические экстракты сушили над Na2SO4,затем фильтровали и концентрировали при пониженном давлении. Полученный технический продукт очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/ацетон 9:1 и увеличивающиеся количества ацетона), получая 12,4 г (57%) названного соединения в виде белых хлопьев. 1 Н-ЯМР (CDCl3): 1,20-2,30 (м, 16 Н), включая 2,15 (с, 6 Н); 2,45 (дд, 1 Н); 7,08 (м, 1 Н); 7,157,35 (м, 2 Н); 7,45 (м, 3 Н); 8,20 (м, 1 Н); 10,50 К раствору 10,0 г (58,0 ммолей) 4-хлорсалициловой кислоты в 150 мл безводного тетрагидрофурана прибавляли 8,9 г (54,9 ммолей) карбонилдиимидазола при комнатной температуре в инертной атмосфере. После 30 мин прибавляли 12,6 г (50,6 ммолей) 3-(2-диметиламинометил-1-гидроксициклогексил)фенола. Полученный раствор выдерживали при комнатной температуре в течение 3 дней. Смесь прибавляли к водному раствору NаНСО 3 при рН 8 и экстрагировали дихлорметаном (3 х 50 мл). Собранные органические экстракты сушили надNa2SO4, затем фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелeм (элюент: дихлорметан/ацетон 9:1 и увеличивающиеся количества ацетона), получали 12,2 г (66%) названного соединения в виде белых хлопьев. 1 Н-ЯМР (CDCl3): 1,20-2,20 (м, 16 Н), включая 2,12 (с, 6 Н); 2,45 (дд, 1H); 6,95 (дд, 1H); 7,05 Действуя аналогичным образом, как описано при получении соединения примера 3, и начиная с 10,0 г (65,7 ммолей) 4-метилсалициловой кислоты, 10,0 г (61,7 ммолей) карбонилдиимидазола, 14,3 г (57,4 ммолей) 3-(2-диметиламинометил-1-гидроксициклогексил)фенола и 165 мл безводного тетрагидрофурана, и после хроматографии на колонке с силикагелем (элюент: 9:1 дихлорметан/ацетон и увеличивающиеся количества ацетона) получали 14,6 г (66%) названного соединения в виде белых хлопьев. 1 Н-ЯМР (СDСl3): 1,20-2,60 (м, 20 Н), включая 2,15 (с, 6 Н) и 2,20 (с, 3 Н); 6,80 (м, 2 Н); 7,05 Действуя аналогичным образом, как описано при получении соединения примера 3, и начиная с 10,0 г (59,5 ммолей) 4-метоксисалициловой кислоты, 9,1 г (56,2 ммолей) карбонилдиимидазола, 12,9 г (51,8 ммолей) 3-(2-диметиламинометил-1-гидроксициклогексил)фенола и 150 мл безводного тетрагидрофурана, и после хроматографии на колонке с силикагелем (элюент: 9:1 дихлорметан/ацетон и увеличивающиеся количества ацетона) получали 13,7 г (66%) названного соединения в виде белых хлопьев. 1 Н-ЯМР (CDCl3): 1,20-2,30 (м, 16 Н), включая 2,15 (с, 6 Н); 2,45 (дд, 1 Н); 3,85 (с, 3 Н); 6,55 Действуя аналогичным образом, как описано при получении соединения примера 3, и начиная с 10,0 г (54,6 ммолей) 5-нитросалициловой кислоты, 8,3 г (51,2 ммолей) карбоиилдиимидазола, 11,9 г (47,8 ммолей) 3-(2-диметиламинометил-1-гидроксициклогексил)фенола и 135 мл безводного тетрагидрофурана, и послеxромaтографии на колонке с силикагелем (элюент: 1:1 дихлорметан/ацетон и увеличивающиеся количества ацетона) получали 326 мг (2%) названного соединения в виде желтого твердого вещества. 1 Н-ЯМР (CDCl3): 1,20-2,30 (м, 16 Н),включая 2,15 (с, 6 Н); 2,45 (дд, 1 Н); 7,00-7,25 (м,2 Н); 7,45 (м, 3 Н); 8,40 (дд, 1 Н); 9,05 (д, 1 Н). Пример 7. Сложный эфир (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2',4'-дифтор-3-гидроксибифенил-4-карбоновой кислоты. Действуя аналогичным образом, как описано при получении соединения примера 3, и начиная с 5,0 г 2',4'-дифтор-3-гидроксибифенил 4-карбоновой кислоты, 3,5 г карбонилдиимидазола, 5,0 г 3-(2-диметиламинометил-1-гидроксициклогексил)фенола и 50 мл безводного тетрагидрофурана, и после хроматографии на колонке с силикагелем получали 4,1 г названного соединения в виде белых хлопьев. 1 Н-ЯМР (CDCl3): 1,20-2,30 (м, 16 Н), включая 2,15 (с, 6 Н); 2,45 (дд, 1 Н); 6,85-7,55 (м, 9 Н); 7,70 (м, 1 Н); 8,22 (д, 1 Н); 10,60 (уш.с, 1 Н). Фармакологические результаты В следующей таблице представлены результаты фармакологической активности для некоторых примеров продуктов, описанных в данном изобретении, а также для трамадола. Результаты выражены в виде % увеличения времени ответа в тесте на горячей пластинке. Как видно, соединения, описанные в изобретении, имеют активность до 3 раз более высокую, чем активность трамадола. Аналгезирующая активность продуктов в тесте с мышами на горячей пластинке Продукт, 80 мкмолей/кг р.о. Трамадол Пример 1 Пример 2 Пример 3 Пример 4 Пример 5 Пример 6 Пример 7% увеличения времени ответа 218 710 724 400 525 688 661 686 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I где R1 - атом галогена, C1-С 6 алкилгруппа, незамещенная или частично или полностью замещенная атомом галогена, OR3-группа, NO2 группа или фенилгруппа, незамещенная или частично или полностью замещенная атомом галогена, где R3 - C1-С 6 алкилгруппа,R2 - атом водорода или СН 3 СО-группа, и его соли или оптические изомеры. 2. Соединение по п.1, отличающееся тем,что R1 - атом галогена, как, например, атом фтора, хлора или брома, галогензамещенная фенилгруппа или гидро(С 1-С 6 фторалкил)группа. 3. Соединение по п.1, отличающееся тем,что его выбирают из следующих соединений: 10 сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-ацетокси-4-трифторметилбензойной кислоты,сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-4-трифторметилбензойной кислоты,сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 4-хлор 2-гидроксибензойной кислоты,сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-4-метилбензойной кислоты,сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-4-метоксибензойной кислоты,сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-гидрокси-5-нитробензойной кислоты,сложного эфира (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2',4'-дифтор-3-гидроксибифенил-4-карбоновой кислоты. 4. Способ получения соединения общей формулы (I) по п.1, отличающийся тем, что соединение формулы (II) вводят в реакцию с соединением общей формулы (III)L - ОН-группа, атом галогена или -CO-R5-группа, гдеR5 - алкилгруппа, фенильное кольцо, возможно, замещенное одним или несколькими заместителями, или гетероциклическое кольцо,возможно, замещенное одним или несколькими заместителями, причем реакцию проводят в среде инертного растворителя при температуре от -20 до 120 С. 5. Способ по п.4, отличающийся тем, что прибавляют агент, промотирующий конденсацию. 6. Способ по п.4, отличающийся тем, что инертный растворитель выбирают из группы,состоящей из дихлорметана, тетрагидрофурана,ацетонитрила, 1,2-дихлорэтана, этилацетата,диметоксиэтана или диоксана, предпочтительно дихлорметана или тетрагидрофурана. 7. Способ по п.5, отличающийся тем, что агент, промотирующий конденсацию, выбирают из группы, состоящей из карбонилдиимидазола,дициклогексилкарбодиимида, триэтиламина этилхлорформиата, триэтиламина бензотриазолтозилата или диэтилхлорфосфата, предпочтительно карбонилдиимидазола или дициклогексилкарбодиимида. 8. Способ по п.4, отличающийся тем, что температурный интервал составляет 0-35 С. 9. Применение соединения общей формулы (I) по любому из пп.1-3 для получения медикамента для лечения боли. 12 10. Фармацевтическая композиция, которая включает соединение общей формулы (I) по любому из пп.1-3 и фармацевтически приемлемый наполнитель, для лечения боли.
МПК / Метки
МПК: A61K 31/24, A61P 25/04, C07C 219/28
Метки: 2-гидроксибензоата, эфиры, производные, ss)-3-(2-диметиламинометил, 1-гидроксициклогексил)фенил, новые, сложные
Код ссылки
<a href="https://eas.patents.su/7-4770-novye-slozhnye-efiry-proizvodnye-rr-ss-3-2-dimetilaminometil-1-gidroksiciklogeksilfenil-2-gidroksibenzoata.html" rel="bookmark" title="База патентов Евразийского Союза">Новые сложные эфиры, производные (rr, ss)-3-(2-диметиламинометил -1-гидроксициклогексил)фенил 2-гидроксибензоата</a>
Предыдущий патент: Новый фармацевтический препарат
Следующий патент: Производные мочевины и их применение в качестве ингибиторов инозин-5`-монофосфат- дегидрогеназы
Случайный патент: Вальцовый станок











