Пиримидины, ингибирующие репликацию вич
Номер патента: 4049
Опубликовано: 25.12.2003
Авторы: Каваш Роберт В., Андрис Конрад Йозеф Лодевийк Марсель, Де Корт Барт, Де Жонж Марк Рене, Хэрес Ян, Кукла Майкл Джозеф, Лудовики Дональд Вилльям, Хо Чих Юнг, Койманс Люсьен Мария Хенрикус, Ван Акен Кун Жанн Альфонс, Жанссен Поль Адриан Ян
Формула / Реферат
1. Соединение, имеющее формулу

его N-оксид, аддитивная соль, четвертичный амин или стереохимически изомерная форма,
где R1 представляет водород; арил; формил; C1-6алкилкарбонил; C1-6алкил, C1-6алкилоксикарбонил, C1-6алкил, замещенный формилом, C1-6-алкилкарбонилом, C1-6алкилоксикарбонилом, C1-6алкилкарбонилокси; C1-6алкилоксиC1-6алкилкарбонил, замещенный C1-6алкилоксикарбонилом;
R2a представляет циано или аминокарбонил;
L представляет -X-R3, где
R3 представляет фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных для R2, где
каждый R2 независимо представляет гидрокси, галоген, C1-6алкил, необязательно замещенный циано или -C(=O)R6, C3-7циклоалкил, C2-6алкенил, необязательно замещенный одним или более атомами галогена или циано, C2-6алкинил, необязательно замещенный одним или более атомами галогена или циано, C1-6алкилокси, C1-6алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(C1-6алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S (=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или радикал формулы
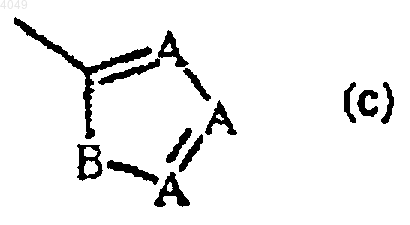
в котором
каждый A независимо представляет N, CH или CR6;
B представляет NH, O, S или NR6;
p равно 1 или 2 и
R6 представляет метил, амино, моно- или диметиламино или полигалогенметил;
X представляет -NR1-, -O- или -S-;
Q представляет водород, C1-6алкил, галоген, полигалогенC1-6алкил или -NR4R5 и
R4 и R5, каждый независимо, выбран из водорода, гидрокси, C1-12алкила, C1-12алкилокси, C1-12алкилкарбонила, C1-12алкилоксикарбонила, арила, амино, моно- или ди(C1-12алкил)амино, моно- или ди(C1-12алкил)аминокарбонила, в которых каждая из указанных выше C1-12алкильных групп может быть необязательно и каждая индивидуально замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6алкилокси, гидроксиC1-6алкилокси, карбоксила, C1-6алкилоксикарбонила, циано, амино, имино, моно- или ди(C1-6алкил)амино, полигалогенметила, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6, арила и Het; или
R4 и R5, взятые вместе, могут образовывать пирролидинил, пиперидинил, морфолинил, азидо или моно- или ди(C1-12алкил)аминоC1-4алкилиден;
Y представляет гидрокси, галоген, C3-7циклоалкил, C2-6алкенил, необязательно замещенный одним или более атомами галогена, C2-6алкинил, необязательно замещенный одним или более атомами галогена, C1-6алкил, замещенный циано или -C(=O)R6 группой, C1-6алкилокси, C1-6алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(C1-6алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или арил;
арил представляет фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, C3-7циклоалкила, C1-6алкилокси, циано, нитро, полигалогенC1-6алкила и полигалогенС1-6алкилокси;
Het представляет алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый из указанных алифатических гетероциклических радикалов может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила, пиримидинила, пиразинила и пиридазинила, где каждый из указанных ароматических гетероциклических радикалов может быть необязательно замещен гидрокси.
2. Соединение по п.1, в котором R1 представляет водород, арил, формил, C1-6алкилкарбонил, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкил, замещенный формилом, C1-6алкилкарбонилом, C1-6алкилоксикарбонилом.
3. Соединение по п.1 или 2, в котором L представляет -X-R3, где R3 представляет 2,4,6-тризамещенный фенил.
4. Соединение по любому из пп.1-3, в котором Y представляет циано, -C(=O)NH2 или галоген.
5. Соединение по любому из пп.1-4, в котором Q представляет водород или NR4R5.
6. Соединение по любому из пп.1-5, представляющее
4-[[4-амино-5-хлор-6-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[5-хлор-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[5-бром-4-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-5-хлор-6-[(4-циано-2,6-диметилфенил}амино]-2-пиримидинил]амино]бензонитрил;
4-[[5-бром-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-5-хлор-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил или
4-[[4-амино-5-бром-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил;
их N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы.
7. Соединение по п.6, представляющее 4-[[4-амино-5-бром-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил, его N-оксид или аддитивную соль.
8. Применение соединения по любому из пп.1-7 в качестве лекарственного средства.
9. Применение соединения формулы (I)
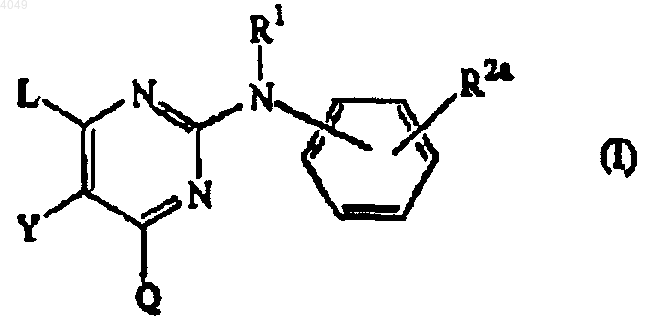
его N-оксида, фармацевтически приемлемой аддитивной соли, четвертичного амина или стереохимически изомерной формы, где
R1 представляет водород, арил, формил, C1-6алкилкарбонил; C1-6алкил, C1-6алкилоксикарбонил, C1-6алкил, замещенный формилом, C1-6алкилкарбонилом, C1-6алкилоксикарбонилом, C1-6алкилкарбонилокси; C1-6алкилоксиC1-6алкилкарбонил, замещенный C1-6алкилоксикарбонилом;
R2a представляет циано или аминокарбонил;
L представляет -X-R3, где
R3 представляет фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных для R2, где
каждый R2 независимо представляет гидрокси, галоген, C1-6алкил, необязательно замещенный циано или -C(=O)R6, C3-7циклоалкил, C2-6алкенил, необязательно замещенный одним или более атомами галогена или циано, C2-6алкинил, необязательно замещенный одним или более атомами галогена или циано, C1-6алкилокси, C1-6алкилоксикарбонил, карбоксшы, циано, нитро, амино, моно- или ди(C1-6алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или радикал формулы
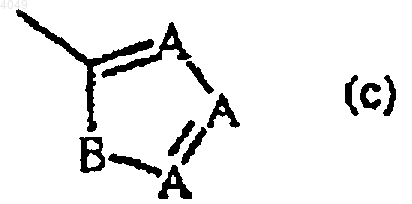
в котором
каждый A независимо представляет N, CH или CR6;
B представляет NH, O, S или NR6;
p равно 1 или 2; и
R6 представляет метил, амино, моно- или диметиламино или полигалогенметил; и
X представляет -NR1-, -O- или -S-;
Q представляет водород, C1-6алкил, галоген, полигалогенC1-6алкил или -NR4R5; и
R4 и R5, каждый независимо, выбран из водорода, гидрокси, C1-12алкила, C1-12алкилокси, C1-12алкилкарбонила, C1-12алкилоксикарбонила, арила, амино, моно- или ди(C1-12алкил)амино, моно- или ди (C1-12алкил)аминокарбонила, в которых каждая из указанных выше C1-12алкильных групп может быть необязательно и каждая индивидуально замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6алкилокси, гидроксиC1-6алкилокси, карбоксила, C1-6алкилоксикарбонила, циано, амино, имино, моно- или ди(C1-6алкил)амино, полигалогенметила, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S (=O)PR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6, арила и Het; или
R4 и R5, взятые вместе, могут образовывать пирролидинил, пиперидинил, морфолинил, азидо или моно- или ди(C1-12алкил)аминоC1-4алкилиден;
Y представляет гидрокси, галоген, C3-7циклоалкил, C2-6алкенил, необязательно замещенный одним или более атомами галогена, C2-6алкинил, необязательно замещенный одним или более атомами галогена, C1-6алкил, замещенный циано или -C(=O)R6 группой, C1-6алкилокси, C1-6алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(C1-6алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или арил;
арил представляет фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, C3-7циклоалкила, C1-6алкилокси, циано, нитро, полигалогенC1-6алкила и полигалогенC1-6алкилокси;
Het представляет алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый из указанных алифатических гетероциклических радикалов может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила, пиримидинила, пиразинила и пиридазинила, где каждый из указанных ароматических гетероциклических радикалов может быть необязательно замещен гидрокси;
для производства лекарственных средств для лечения субъектов (пациентов), страдающих от инфекции ВИЧ (вирус иммунодефицита человека).
10. Применение соединения по любому из пп.1-7 для производства лекарственных средств для лечения субъектов, страдающих от инфекции вируса иммунодефицита человека.
11. Применение соединения по любому из пп.1-7 для производства лекарственных средств для лечения от инфекции ВИЧ-1, устойчивой к ненуклеозидным ингибиторам обратной транскриптазы иным, чем соединения, определённые в пп.1-7.
12. Применение соединения по любому из пп.1-7, в котором R1 представляет водород, арил, формил, C1-6алкилкарбонил, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкил, замещенный формилом, C1-6алкилкарбонилом, C1-6алкилоксикарбонилом, для производства лекарственных средств для лечения пациентов, страдающих от инфекции ВИЧ (вирус иммунодефицита человека).
13. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-7.
14. Способ получения фармацевтической композиции, заявленной в п.13, отличающийся тем, что терапевтически эффективное количество соединения по любому из пп.1-7 тщательно смешивают с фармацевтически приемлемым носителем.
15. Способ получения соединения, заявленного в п.1, характеризующийся взаимодействием промежуточного соединения формулы (II) с аминопроизводным формулы (III) в условиях, свободных от растворителя, или в реакционно-инертном растворителе в реакционно-инертной атмосфере
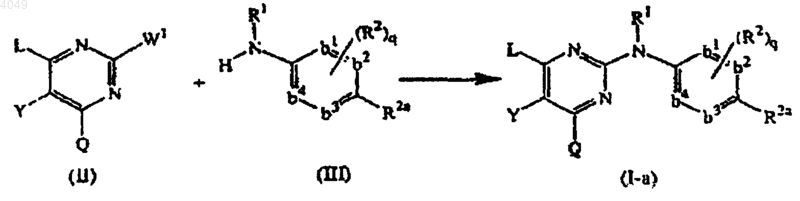
где W1 представляет подходящую уходящую группу и L, Y, Q, R1, R2, R2a имеют значения, определенные в п.1, q=0 и -b1=b2-С(R2a)=b3-b4= представляет двухвалентный радикал формулы -CH=CH-C(R2a)=CH-CH=; и, при желании, превращением соединений формулы (I-а) друг в друга, следуя реакциям преобразования, известным из уровня техники; и далее, при желании, превращением соединения формулы (I-а) в аддитивную соль кислоты обработкой кислотой или наоборот, превращением формы аддитивной соли кислоты в свободное основание обработкой щелочью; и, при желании, получением их стереохимически изомерных форм.
16. Способ получения соединения, заявленного в п.1, характеризующийся взаимодействием промежуточного соединения формулы (IV) с промежуточным соединением формулы (V) в условиях, свободных от растворителя, или в соответствующем растворителе в реакционно-инертной атмосфере
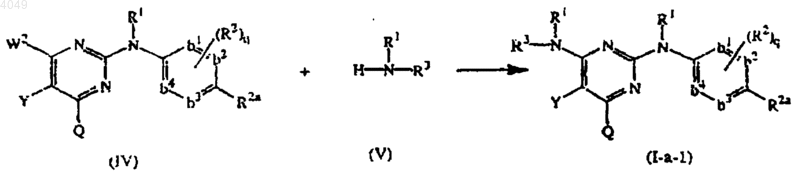
где W2 представляет подходящую уходящую группу и Y, Q, R1, R2, R2a, R3 имеют значения, определенные в п.1, q=0 и -b1=b2-C(R2a)=b3-b4= представляет двухвалентный радикал формулы -CH=CH-C(R2a)=CH-CH=; и при желании превращением соединений формулы (I-а) друг в друга, следуя реакциям преобразования, известным из уровня техники; и далее, при желании, превращением соединения формулы (I-а) в аддитивную соль кислоты обработкой кислотой или наоборот, превращением формы аддитивной соли кислоты в свободное основание обработкой щелочью; и, при желании, получением их стереохимических изомерных форм.
17. Способ получения соединения, заявленного в п.1, характеризующийся взаимодействием промежуточного соединения формулы (IV) с промежуточным соединением формулы (VI) в соответствующем растворителе в реакционно-инертной атмосфере в присутствии подходящего основания
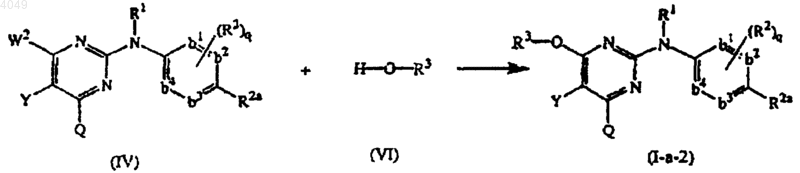
где W2 представляет подходящую уходящую группу и Y, Q, R1, R2, R2a, R3 имеют значения, определенные в п.1, q=0 и -b1=b2-C(R2a)=b3-b4= представляет двухвалентный радикал формулы -CH=CH-C(R2a)=CH-CH=; и, при желании, превращением соединений формулы (I-а) друг в друга, следуя реакциям преобразования, известным из уровня техники; и далее, при желании, превращением соединения формулы (I-а) в аддитивную соль кислоты обработкой кислотой или наоборот, превращением формы аддитивной соли кислоты в свободное основание обработкой щелочью; и, при желании, получением их стереохимически изомерных форм.
18. Комбинация соединения, определенного в п.1 или 9, и еще одного антиретровирусного соединения.
19. Применение комбинации по п.18 в качестве лекарственного средства.
20. Продукт, содержащий (а) соединение, определенное в п.1 или 9, и (b) еще одно антиретровирусное соединение, и представляющий комбинированный препарат для одновременного, раздельного или последовательного использования при лечении ВИЧ.
21. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и в качестве активных ингредиентов (а) соединение, определенное в п.1 или 9, и (b) еще одно антиретровирусное соединение.
Текст
1 Настоящее изобретение относится к использованию производных пиримидина, имеющих свойства ингибирования репликации вируса иммунодефицита человека (ВИЧ). Оно также относится к новой группе производных пиримидина, их использованию в качестве лекарственных средств, способам их получения и фармацевтическим композициям, включающим их. ЕР-0834507 описывает производные замещенного диамино-1,3,5-триазина, имеющие свойства ингибирования репликации ВИЧ. Настоящие соединения отличаются от известных 1,3,5-триазинов структурой и своими улучшенными свойствами ингибирования репликации ВИЧ. Настоящее изобретение относится к использованию соединений формулы (I) их N-оксидов, фармацевтически приемлемых аддитивных солей, четвертичных аминов и стереохимически изомерных форм, гдеR3 представляет фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя,тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных для R2, где каждый R2 независимо представляет гидрокси, галоген, C1-6 алкил, необязательно замещенный циано или -C(=O)R6, С 3-7 циклоалкил,С 2-6 алкенил, необязательно замещенный одним или более атомами галогена или циано, С 2-6 алкинил, необязательно замещенный одним или более атомами галогена или циано, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбоксил,циано, нитро, амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6,-NH-S(=O)pR6,-C(=O)R6,-NHC(=O)H,-C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или радикал формулыR6 представляет метил, амино, моно- или диметиламино или полигалогенметил;R4 и R5, каждый независимо, выбран из водорода, гидрокси, С 1-12 алкила, С 1-12 алкилокси,С 1-12 алкилкарбонила, С 1-12 алкилоксикарбонила,арила, амино, моно- или ди(С 1-12 алкил)амино,моно- или ди(С 1-12 алкил)аминокарбонила, где каждая из указанных выше С 1-12 алкильных групп может быть необязательно и каждая индивидуально замещена одним или двумя заместителями, каждый из которых выбран из гидрокси, C1-6 алкилокси, гидроксиС 1-6 алкилокси, карбоксила, C1-6 алкилоксикарбонила, циано, амино,имино, моно- или ди(С 1-6 алкил)амино, полигалогенметила, полигалогенметилокси, полигало-NH-S(=O)pR6,генметилтио,-S(=O)pR6,6Y представляет гидрокси, галоген, С 3-7 циклоалкил, С 2-6 алкенил, необязательно замещенный одним или более атомами галогена,С 2-6 алкинил, необязательно замещенный одним или более атомами галогена, C1-6 алкил, замещенный циано или -C(=O)R6, C1-6 алкилокси,C1-6 алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио,-S(=O)pR6,-NH-S(=O)pR6,6-C(=O)R ,-NHC(=O)H,-C(=O)NHNH2,-NHC(=O)R6, -C(=NH)R6 или арил; арил представляет фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, С 3-7 циклоалкила, C1-6 алкилокси, циано, нитро, полигалогенС 1-6 алкила и полигалогенC1-6 алкилокси;Het представляет алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила,гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила,где каждый из указанных алифатических гетероциклических радикалов необязательно может быть замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила,пиримидинила, пиразинила и пиридазинила, где каждый из указанных ароматических гетероциклических радикалов необязательно может быть замещен гидрокси; 3 для производства лекарственных средств для лечения людей, страдающих от инфекции ВИЧ(вирус иммунодефицита человека). Настоящее изобретение также относится к способу лечения теплокровных животных, страдающих от ВИЧ (вирус иммунодефицита человека) инфекции. Указанный способ включает введение терапевтически эффективного количества соединения формулы (I) или формы его Nоксида, фармацевтически приемлемой аддитивной соли или стереохимически изомерной формы в смеси с фармацевтическим носителем. Данное изобретение также относится к новым соединениям, имеющим формулу их N-оксидам, фармацевтически приемлемым аддитивным солям, четвертичным аминам и стереохимически изомерным формам, гдеR3 представляет фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец необязательно может быть замещено одним, двумя,тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных для R2, где каждый R2 независимо представляет гидрокси, галоген, C1-6 алкил, необязательно замещенный циано или -C(=O)R6, С 3-7 циклоалкил,С 2-6 алкенил, необязательно замещенный одним или более атомами галогена или циано, С 2-6 алкинил, необязательно замещенный одним или более атомами галогена или циано, С 1-6 алкилокси, C1-6 алкилоксикарбонил, карбоксил,циано, нитро, амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6,-NH-S(=O)pR6,-C(=O)R6,-NHC(=O)H,-C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или радикал формулыR6 представляет метил, амино, моно- или диметиламино или полигалогенметил;R4 и R5, каждый независимо, выбран из водорода, гидрокси, С 1-12 алкила, С 1-12 алкилокси,С 1-12 алкилкарбонила, С 1-12 алкилоксикарбонила,арила, амино, моно- или ди(С 1-12 алкил)амино,моно- или ди(С 1-12 алкил)аминокарбонила, где каждая из указанных выше С 1-12 алкильных групп может быть необязательно и каждая индивидуально замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6 алкилокси, гидроксиС 1-6 алкилокси,карбоксила,C1-6 алкилоксикарбонила, циано, амино, имино, моно- или ди(C1-6 алкил)амино, полигалогенметила, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6,-C(=O)R6,-NHC(=O)H,-NH-S(=O)pR6,-C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6, арила и Het; илиY представляет гидрокси, галоген, С 3-7 циклоалкил, С 2-6 алкенил, необязательно замещенный одним или более атомами галогена, С 2-6 алкинил, необязательно замещенный одним или более атомами галогена, C1-6 алкил, замещенный циано или -C(=O)R6, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбоксил, циано, нитро,амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио,-S(=O)pR6,-NH-S(=O)pR6,6-C(=O)R ,-NHC(=O)H,-C(=O)NHNH2,-NHC(=O)R6, -C(=NH)R6 или арил; арил представляет фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, С 3-7 циклоалкила, C1-6 алкилокси, циано, нитро, полигалогенС 1-6 алкила и полигалогенС 1-6 алкилокси;Het представляет алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила,гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила,где каждый из указанных алифатических гетероциклических радикалов необязательно может быть замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила,пиримидинила, пиразинила и пиридазинила, где каждый из указанных ароматических гетероциклических радикалов необязательно может быть замещен гидрокси. Используемый здесь в качестве группы или части группы C1-6 алкил определяет насы 5 щенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как метил, этил, пропил,1-метилэтил, бутил, пентил, гексил, 2-метилпропил, 2-метилбутил и аналогичные; C1-10 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 10 атомов углерода, такие как группы, определенные для C1-6 алкила, и гептил, октил, нонил,децил и аналогичные; С 1-12 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 12 атомов углерода, такие как группы, определенные для C1-10 алкила, и ундецил, додецил и аналогичные; С 1-4 алкилиден определяет насыщенные двухвалентные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как метилен, 1,2 этандиил или 1,2-этилиден, 1,3-пропандиил или 1,3-пропилиден, 1,4-бутандиил или 1,4-бутилиден и аналогичные; С 3-7 циклоалкил является общим обозначением для циклопропила, циклобутила, циклопентила, циклогексила и циклогептила; С 2-6 алкенил определяет углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 до 6 атомов углерода, содержащие двойную связь, такие как этенил,пропенил, бутенил, пентенил, гексенил и аналогичные; С 2-10 алкенил определяет углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 до 10 атомов углерода, содержащие двойную связь, такие как группы,определенные для С 2-6 алкенила, и гептенил, октенил, ноненил, деценил и аналогичные; С 2-6 алкинил определяет углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 до 6 атомов углерода, содержащие тройную связь, такие как этинил, пропинил, бутинил,пентинил, гексинил и аналогичные; С 2-10 алкинил определяет углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 до 10 атомов углерода, содержащие тройную связь, такие как группы, определенные для С 2-6 алкинила, и гептинил, октинил, нонинил, децинил и аналогичные. Используемый выше термин (=O) образует карбонильную группу, когда он присоединен к атому углерода, сульфоксидную группу, когда один раз присоединен к атому серы, и сульфонильную группу, когда дважды присоединен к атому серы. Термин галоген является общим для фтора,хлора, брома и иода. Используемый выше и далее в качестве группы или части группы термин полигалогенметил определяется как моно- или полигалогензамещенный метил, в частности,метил с одним или более атомами фтора, например дифторметил или трифторметил; полигалогенС 1-6 алкил в качестве группы или части группы определяется как моно- или полигало 004049 6 гензамещенный C1-6 алкил, например группы,определенные для галогенметила,1,1 дифторэтил и аналогичные. В случае, когда к алкильной группе присоединен более чем один атом галогена, в определении полигалогенметил или полигалогенС 1-6 алкил, атомы галогена могут быть одинаковыми или различными. Имеется в виду, что Het включает все возможные изомерные формы гетероциклов, указанные в определении Het, например, пирролил также включает 2H-пирролил. Радикал Het может быть присоединен соответствующим образом к остатку молекулы формулы (I) или (I-а) через любой атом углерода кольца или гетероатом. Так, например, когда гетероцикл представляет пиридинил, он может быть 2-пиридинилом, 3-пиридинилом или 4 пиридинилом. Когда в какой-либо составляющей имеет место переменная (например, арил, R2, R6 и т.д.) более чем один раз, то каждое определение является независимым. Линии, нарисованные от заместителей внутрь кольцевых систем, показывают, что связь может присоединяться к любым подходящим атомам кольца. Очевидно понятно, что некоторые соединения формулы (I) или (I-а) и их N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы могут содержать один или более центров хиральности и существовать в виде стереохимически изомерных форм. Используемый выше термин стереохимически изомерные формы определяет все возможные стереоизомерные формы, которыми могут обладать соединения формулы (I) или (Iа), их N-оксиды, аддитивные соли, четвертичные амины или физиологически функциональные производные. Если не упоминается или не указывается иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, а также каждую из индивидуальных изомерных форм соединений формулы (I) или (I-а) и их Nоксидов, солей, сольватов или четвертичных аминов, по существу свободных, т.е. ассоциированных менее чем с 10%, предпочтительно менее чем с 5%, в частности менее чем с 2% и наиболее предпочтительно менее чем с 1% других изомеров. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь цисили трансконфигурацию. Соединения, включающие двойные связи, могут иметь Е- или Zстереохимию при указанной двойной связи. Явно следует иметь в виду, что стереохимически изомерные формы соединений формулы (I) или(I-а) охватываются объемом настоящего изобретения. Для терапевтического использования солями соединений формулы (I) или (I-а) являются соли, в которых противоион является фармацевтически приемлемым. Однако также могут найти применение соли кислот или оснований,которые не являются фармацевтически приемлемыми, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Имеется в виду, что фармацевтически приемлемые аддитивные соли кислоты или основания, как указывалось выше, включают терапевтически активные нетоксичные формы аддитивных солей кислоты и основания, которые способны образовать соединения формулы (I) или(I-а). Фармацевтически приемлемые аддитивные соли кислоты можно удобно получать обработкой основной формы такой соответствующей кислотой. Соответствующие кислоты включают,например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородную или бромисто-водородную кислоту, серную, азотную, фосфорную и аналогичные кислоты; или органические кислоты,например уксусную, пропионовую, гидроксиуксусную, молочную, пировиноградную, щавелевую (т.е. этандиовую), малоновую, янтарную(т.е. бутандиовую), малеиновую, фумаровую,яблочную, винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфокислоту,п-толуолсульфокислоту, цикламовую, салициловую, п-аминосалициловую, памовую и аналогичные кислоты. Наоборот, указанные солевые формы можно превращать обработкой соответствующим основанием в свободную основную форму. Соединения формулы (I) или (I-а), содержащие кислый протон, можно также превратить в их нетоксичные формы аддитивной соли металла или амина обработкой соответствующими органическими или неорганическими основаниями. Соответствующие основные солевые формы включают, например, соли аммония,соли щелочных и щелочно-земельных металлов,например соли лития, натрия, калия, магния,кальция и аналогичные, соли с органическими основаниями, например соли бензатина, Nметил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и аналогичные. Используемый выше термин аддитивная соль также включает сольваты, которые могут образовать соединения формулы (I) или (I-а), а также их соли. Такими сольватами, например,являются гидраты, алкоголяты и аналогичные. Некоторые соединения формулы (I) или (Iа) могут также существовать в их таутомерной форме. Подразумевается, что такие формы, хотя 8 они не показаны в вышеприведенной формуле в ясном виде, включены в объем настоящего изобретения. Имеется в виду, что всякий раз, когда его используют в дальнейшем, термин соединения формулы (I) или соединения формулы (I-а) включает также N-оксиды, фармацевтически приемлемые аддитивные соли кислоты, четвертичные амины и все стереоизомерные формы. Особая группа соединений содержит те соединения формулы (I), в которых R1 представляет водород, арил, формил, C1-6 алкилкарбонил, C1-6 алкил, C1-6 алкилоксикарбонил,С 1-6 алкил, замещенный формилом, С 1-6 алкилкарбонилом, C1-6 алкилоксикарбонилом. Другая особая группа соединений содержит соединения формулы (I), на которые налагается одно или более из следующих ограничений:i) -a1=a2-a3=a4- представляет радикал формулы (а-1);vi) Q представляет водород или -NR4R5,где R4 и R5 предпочтительно представляют водород;vii) L представляет -X-R3, где X предпочтительно представляет NR1, О или S, наиболее предпочтительно X представляет NH, и R3 представляет фенил, замещенный С 1-6 алкилом, галогеном и циано в качестве предпочтительных заместителей. Еще одна особая группа соединений содержит те соединения формулы (I-а), в которыхR1 представляет водород, арил, формил, C1-6 алкилкарбонил,C1-6 алкил,C1-6 алкилоксикарбонил, С 1-6 алкил, замещенный формилом,С 1-6 алкилкарбонилом,С 1-6 алкилоксикарбонилом. Следующая особая группа соединений содержит также соединения формулы (I-а), на которые налагается одно или более из следующих ограничений:i) -b1=b2-C(R2a)=b3-b4= представляет радикал формулы (b-1);iii) R2a представляет циано или -C(=O)NH2,предпочтительно R2a представляет циано;v) Q представляет водород или -NR4R5, где 4vi) L представляет -X-R3, где X предпочтительно представляет NR1, О или S, наиболее предпочтительно X представляет NH, и R3 представляет фенил, замещенный С 1-6 алкилом, гало 9 геном и циано в качестве предпочтительных заместителей. Интересной группой соединений являются такие соединения формулы (I) или (I-а), в которых L представляет -X-R3, где R3 представляет 2,4,6-тризамещенный фенил, причем каждый заместитель независимо выбран из хлора, брома, фтора, циано или С 1-4 алкила. Также интересными являются такие соединения формулы (I) или (I-а), в которых Y представляет хлор или бром, и Q представляет водород или амино. Особыми соединениями являются такие соединения формулы (I) или (I-а), в которых часть молекулы в 2 положении кольца пиримидина представляет 4-цианоанилино. Предпочтительными соединениями являются соединения формулы (I) или (I-а), в которых часть молекулы в 2 положении кольца пиримидина представляет 4-цианоанилино, L представляет -X-R3, где R3 представляет 2,4,6 тризамещенный фенил, Y представляет галоген и Q представляет водород или NH2. Наиболее предпочтительными соединениями являются 4-4-амино-5-хлор-6-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил; 4-5-хлор-4-[(2,4,6-триметилфенил) амино]-2-пиримидинил]амино]бензонитрил; 4-5-бром-4-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил; 4-4-амино-5-хлор-6-[(4-циано-2,6 диметилфенил)амино]-2-пиримидинил] амино]бензонитрил; 4-5-бром-6-[(4-циано-2,6-диметилфенил) амино]-2-пиримидинил]амино]бензонитрил; 4-4-амино-5-хлор-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил и 4-4-амино-5-бром-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил; их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы. В общем, соединения формулы (I-а) можно получить по реакции промежуточного соединения формулы (II), в которой W1 представляет подходящую уходящую группу, такую как, например, галоген, гидрокси, трифторацетил, тозилат, тиометил, метилсульфонил, трифторметилсульфонил и аналогичные, с аминопроизводным формулы (III) необязательно в условиях, свободных от растворителя или в инертном по отношению к реакции растворителе, таком как, например, этанол, 1-метил-2-пирролидинон, N,N-диметилформамид, 1,4-диоксан, тетрагидрофуран, диметилсульфоксид, тетралин,сульфолан, анцетонитрил и аналогичные, в инертной по отношению к реакции атмосфере,такой как, например, свободный от кислорода 10 аргон или азот, и необязательно в присутствии кислоты, например, 1N хлористо-водородной кислоты в диэтиловом эфире или аналогичных. Данную реакцию можно проводить при температуре в диапазоне между 50 и 250 С. В данном и последующих получениях реакционные продукты можно выделять из реакционной среды и, если необходимо, далее очищать по методикам, как правило, известным из уровня техники, таким как, например, экстракция, кристаллизация, перегонка, растирание и хроматография. Соединения формулы (I-а), в которой L представляет радикал формулы -NR1-R3, причем указанные соединения представлены формулой(I-а-1), можно получать с помощью реакции промежуточного соединения формулы (IV), в которой W2 представляет подходящую уходящую группу, такую как, например, галоген или трифторацетил, с промежуточным соединением формулы (V) в условиях, свободных от растворителя, или в соответствующем растворителе,таком как, например, этанол, 1-метил-2 пирролидинон, N,N-диметилформамид, 1,4 диоксан, тетрагидрофуран, диметилсульфоксид,тетралин, сульфолан, ацетонитрил и аналогичные, в реакционно-инертной атмосфере, такой как, например, свободный от кислорода аргон или азот, и необязательно в присутствии кислоты такой как, например, 1N хлористоводородная кислота в диэтиловом эфире. Данную реакцию можно проводить при температуре в диапазоне между 50 и 250 С. Соединения формулы (I-а), в которой L представляет радикал формулы -O-R3, причем указанные соединения представлены формулой(I-а-2), можно получать с помощью реакции промежуточного соединения формулы (IV), в которой W2 представляет подходящую уходящую группу, такую как, например, галоген или трифторацетил, с промежуточным соединением формулы (VI), в соответствующем растворителе, таком как, например, 1,4-диоксан, диметилсульфоксид, тетралин, сульфолан и аналогичные, в реакционно-инертной атмосфере, такой как, например, свободный от кислорода аргон или азот, и в присутствии основания, такого как,например, гидрид натрия, гидрид калия, гидроксид натрия или аналогичные. Данная реакция может проводиться при температуре в диапазоне между 50 и 250 С. Соединения формулы (I-а) далее можно получать превращением соединений формулы(I-а) друг в друга по известным из уровня техники реакциям преобразования. Соединения формулы (I-а) можно превратить в соответствующие формы N-оксидов, следуя известным в технике процедурам превращения трехвалентного азота в форму его N-оксида. Указанную реакцию N-окисления, обычно,можно осуществлять с помощью реакции исходного вещества формулы (I-а) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, перекись водорода, пероксиды щелочных или щелочноземельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать надкислоты,такие как, например, бензолкарбопероксо кислота или галогензамещенная бензолкарбопероксо кислота, например 3-хлорбензолкарбопероксо кислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и аналогичные, углеводороды, например толуол,кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Например, соединения формулы (I-а), в которой Q представляет галоген, можно превратить в соответствующие соединения, в которыхQ представляет -NR4H, используя NH2R4 в качестве реагента в инертном растворителе, например 1,4-диоксане и аналогичном, необязательно в присутствии подходящего основания, такого как, например, триэтиламин или N,Nдиизопропилэтиламин или аналогичные. В случае, если R4 содержит гидроксигруппу, может быть удобным проводить вышеуказанную реакцию с защищенной формой NH2R4, в которой гидроксигруппа несет подходящую защитную группу Р, представляющую, например, триалкилсилильную группу, с последующим удалением защитной группы по известным из уровня техники методикам. Некоторые соединения формулы (I-а) и некоторые промежуточные продукты настоящего изобретения могут содержать асимметричный атом углерода. С использованием известных из уровня техники процедур можно получать чистые стереохимически изомерные формы указанных соединений и указанных промежуточных продуктов. Например, диастереоизомеры можно разделять физическими методами, такими как селективная кристаллизация, или хроматографическими методами, например противоточным 12 распределением, жидкостной хроматографией и аналогичными методами. Энантиомеры можно получать из рацемических смесей, сначала превращая указанные рацемические смеси с подходящими разделяющими агентами, такими как,например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физически разделяя указанные смеси диастереомерных солей или соединений с помощью, например, селективной кристаллизации или хроматографических приемов, например жидкостной хроматографией и аналогичными методами; и,наконец, превращая указанные разделенные диастереомерные соли или соединения в соответствующие энантиомеры. Чистые стереохимически изомерные формы также можно получать из чистых стереохимически изомерных форм соответствующих промежуточных продуктов и исходных материалов, при условии,что происходящие реакции протекают стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I-а) и промежуточных продуктов включает жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной стационарной фазы. Некоторые из промежуточных соединений и исходных материалов являются известными соединениями и могут быть промышленно доступными, или их можно получить известными из уровня техники процедурами. Промежуточные соединения формулы (II),в которой L представляет -X-R3, причем указанные промежуточные продукты представлены формулой (II-1), можно получить реакцией производного пиримидина формулы (VII), в которой каждый W1 имеет значения, определенные выше, с HXR3 (VIII) в инертном растворителе,таком как, например, 1,4-диоксан, 2-пропанол или аналогичные, и в присутствии основания,такого как, например, триэтиламин или N,Nдиизопропилэтиламин или аналогичные. Различные региоспецифические изомеры могут получаться и отделяться один от другого с использованием подходящих методов разделения,таких как, например, хроматография. Промежуточные продукты формулы (IV) можно получить взаимодействием промежуточного соединения формулы (VII-а), в которой W2 представляет подходящую уходящую группу,такую как, например, галоген, с промежуточным соединением формулы (IX) в подходящем растворителе, таком как, например, 1-метил-2 пирролидинон, 1,4-диоксан или аналогичные, в присутствии кислоты, такой как, например, 1N хлористо-водородная кислота в диэтиловом 13 эфире. Данная реакция может осуществляться при температуре в интервале между 50 и 250 С. Альтернативно, промежуточные продукты формулы (IV) можно получать по реакции промежуточного соединения формулы (X) с оксихлоридом фосфора, трифторуксусным ангидридом или их функциональным производным в реакционно-инертной атмосфере, такой как,например, свободный от кислорода аргон или азот. Данная реакция может осуществляться при температуре в диапазоне между 20 и 150 С. Промежуточные соединения формулы (X) можно получать по реакции промежуточного соединения формулы (XI) или его функционального производного с промежуточным соединением формулы (IX). Данная реакция может проводиться в условиях, свободных от растворителя, или в соответствующем растворителе, например, диглиме, тетралине или аналогичном, в реакционно-инертной атмосфере, такой как, например, свободный от кислорода аргон или азот, и необязательно в присутствии основания, такого как, например, гидрид натрия,гидрид калия или аналогичные. Данную реакцию можно проводить при температуре в диапазоне между 100 и 250 С. Промежуточные соединения формулы (X) также можно получать по реакции промежуточного соединения формулы (XII), в которой W2 представляет подходящую уходящую группу, aY и Q имеют значения, определенные для соединения формулы (I-а), с промежуточным соединением формулы (XIII) в соответствующем растворителе, например этаноле или аналогичном, и в присутствии основания, например этоксида натрия или аналогичного, в реакционноинертной атмосфере, такой как, например, свободный от кислорода аргон или азот. Реакцию можно проводить при температуре в диапазоне между 20 и 125 С. Удобный способ получения промежуточного соединения формулы (IV), в которой Y представляет атом брома или хлора, причем указанные промежуточные соединения пред 004049 14 ставлены формулой (IV-1), включает введение атома брома или хлора в промежуточное соединение формулы (XIV), в которой W2 имеет значения, определенные выше, используя Nбромсукцинимид или N-хлорсукцинимид в инертном по отношению к реакции растворителе, таком как, например, хлороформ, четыреххлористый углерод или аналогичные. Данную реакцию можно проводить при температуре в диапазоне между 20 и 125 С. Аналогично превращению соединений формулы (I-а), в которой Q представляет галоген, в соединения формулы (I-а), в которой Q представляет -NHR4, также можно превращать промежуточные соединения формулы (II), (IV) и(VII). Соединения формулы (I-а), полученные в вышеописанных способах, можно синтезировать в виде смесей стереоизомерных форм, в частности, в форме рацемических смесей энантиомеров, которые можно отделить друг от друга, следуя процедурам разделения, известным из уровня техники. Рацемические соединения формулы (I-а) можно превращать в соответствующие диастереомерные солевые формы по реакции с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, с помощью селективной или фракционной кристаллизации, и энантиомеры высвобождают из них щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I-а) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы также можно получать из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов при условии, что реакция протекает стереоспецифически. Предпочтительно, если желателен конкретный стереоизомер, указанное соединение синтезируют с помощью стереоспецифических способов получения. В этих способах преимущественно применяют энантиомерно чистые исходные материалы. Специалистам в данной области очевидно понятно, что в вышеописанных способах может быть необходимо блокировать функциональные группы промежуточных соединений защитными группами. Функциональные группы, которые желательно защищать, включают гидрокси, амино и карбоновую кислоту. Подходящие защитные группы для гидрокси включают триалкилсилильные группы (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), бензил и тетрагидропиранил. Подходя 15 щие защитные группы для амино включают трет-бутилоксикарбонил или бензилоксикарбонил. Подходящие защитные группы для карбоновой кислоты включают сложные C1-6 алкиловые или бензиловые эфиры. Защита функциональных групп и снятие с них защиты может иметь место до или после реакционной стадии. Использование защитных групп полностью описывается в Protective Groups in Organic Chemistry, edited by J.W.F.McOmie, Plenum Press (1973), и Protective Groups in Organic(ВИЧ), который является этиологическим агентом синдрома приобретенного иммунодефицита(СПИД) у людей. Вирус ВИЧ преимущественно инфицирует Т-4 клетки человека и разрушает их или изменяет их нормальную функцию, особенно координацию иммунной системы. В результате инфицированный пациент имеет постоянно уменьшающееся число Т-4 клеток, которые,кроме того, ведут себя аномально. Следовательно, иммунологическая защитная система не способна бороться с инфекциями и опухолями, и инфицированный ВИЧ субъект обычно умирает от условно-патогенных инфекций, таких как пневмония, или от раковых опухолей. Другие состояния, связанные с ВИЧ инфекцией, включают тромбоцитопению, саркому Капоши и инфекцию центральной нервной системы, характеризующуюся прогрессивной демиелинизацией, приводящей к слабоумию и симптомам, таким как прогрессивная дизартрия, атаксия и дезориентация. Далее инфекция ВИЧ также связана с периферической невропатией, прогрессивной генерализованной лимфаденопатией(PGL) и связанным со СПИД комплексом(ARC). Настоящие соединения также показывают активность против штаммов ВИЧ-1, которые приобрели устойчивость к известным из уровня техники ненуклеозидным ингибиторам обратной транскриптазы. Также они почти или совсем не имеют сродства связывания с -1 кислотным гликопротеином человека. Благодаря их антиретровирусным свойствам, в частности, анти-ВИЧ свойствам, особенно их анти-ВИЧ-1 активности, соединения формулы (I) или (I-а), их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и их стереохимически изомерные формы являются полезными при лечении пациентов, инфицированных ВИЧ, и для профилактики этих инфекций. В общем, соединения настоящего изобретения могут быть полезными при лечении теплокровных животных, инфицированных вирусами, существование которых опосредуется ферментом обратной транскрипта 004049 16 зы или зависит от него. Состояния, которые можно предотвращать или лечить соединениями настоящего изобретения, особенно состояния,связанные с ВИЧ и другими патогенными ретровирусами, включают СПИД, комплекс, связанный со СПИД (ARC), прогрессивную генерализованную лимфаденопатию (PGL), a также хронические ЦНС заболевания, вызываемые ретровирусами, такие как, например, слабоумие и рассеянный склероз, посредником которых является ВИЧ. Следовательно, соединения настоящего изобретения или их какая-либо подгруппа могут использоваться в качестве лекарственных средств против вышеуказанных состояний. Указанное использование в качестве лекарственных средств или способов лечения включает системное введение субъектам, инфицированным ВИЧ, эффективного для борьбы с состояниями,связанными с ВИЧ и другими патогенными ретровирусами, особенно ВИЧ-1, количества. Из соединений настоящего изобретения или их любых подгрупп можно составлять различные готовые фармацевтические формы для целей введения. В качестве соответствующих композиций можно привести все композиции,обычно применяемые для системного введения лекарственных средств. Для приготовления фармацевтических композиций настоящего изобретения эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента тщательно смешивают с фармакологически приемлемым носителем, который может принимать широкое разнообразие форм в зависимости от формы препарата, желаемой для введения. Данные фармацевтические композиции желательно представлены в виде единичной дозированной формы, подходящей особенно для введения перорально, ректально, чрескожно или с помощью парентеральной инъекции. Например, при приготовлении композиций в дозированной форме для перорального приема можно применять любые из обычных фармацевтических сред, например воду, гликоли, масла, спирты и аналогичные, в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры,эмульсии и растворы; или твердые носители,такие как крахмалы, сахара, каолин, разбавители, смазывающие агенты, связующие агенты,дезинтегрирующие агенты и аналогичные, в случае порошков, пилюль, капсул и таблеток. Благодаря легкости их введения, таблетки и капсулы представляют наиболее преимущественные пероральные единичные дозированные формы, в данном случае явно применяются твердые фармацевтические носители. Для парентеральных композиций, носитель обычно включает стерильную воду, по крайней мере, в большей части, хотя могут быть включены и другие ингредиенты, например, чтобы способствовать растворимости. Можно приготавли 17 вать, например, растворы для инъекций, в которых носитель включает солевой (физиологический) раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также можно приготавливать суспензии для инъекций, в случае которых могут применяться соответствующие жидкие носители, суспендирующие агенты и аналогичные. Изобретением охватываются также твердые формы препаратов, которые предполагается превращать, непосредственно перед использованием, в жидкие формы препаратов. В композициях, подходящих для чрескожного введения, носитель необязательно включает агент, способствующий проникновению, и/или подходящий смачивающий агент,необязательно в сочетании с подходящими в незначительных пропорциях добавками любой природы, которые не оказывают значительного вредного воздействия на кожу. Указанные добавки могут облегчать нанесение на кожу и/или быть полезными для приготовления желаемых композиций. Данные композиции можно вводить различными способами, например, в виде трансдермальных пластырей, препарата для местного нанесения (spot-on), в виде мази. Для того чтобы способствовать растворимости соединений формулы (I-а), в композиции могут включаться подходящие ингредиенты,например, циклодекстрины. Соответствующими циклодекстринами являются -, -, -циклодекстрины или их эфиры и смешанные эфиры, в которых одна или более гидроксигрупп ангидроглюкозных звеньев циклодекстрина замещены C1-6 алкилом, в частности метилом, этилом или изопропилом, например случайно метилированный -CD; гидроксиС 1-6 алкилом, в частности гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбоксиС 1-6 алкилом, в частности карбоксиметилом или карбоксиэтилом;C1-6 алкилкарбонилом, в частности ацетилом. Особенно заслуживающими внимания в качестве агентов комплексообразования и/или солюбилизаторов являются -CD, случайно метилированные -CD, 2,6-диметилCD, 2-гидроксиэтилCD, 2-гидроксиэтилСD, 2-гидроксипропилСD и (2-карбоксиметокси)пропил-CD и особенно 2-гидроксипропилCD (2-HP-CD). Термин смешанные эфиры обозначает производные циклодекстринов, в которых, по крайней мере, две гидроксигруппы циклодекстрина этерифицированы различными группами,такими как, например, гидроксипропил и гидроксиэтил. Среднее молярное замещение (M.S.) используется как мера среднего числа молей алкокси звеньев на моль ангидроглюкозы. Средняя степень замещения (D.S.) относится к среднему числу замещенных гидроксилов на звено ангидроглюкозы. Значения M.S. и D.S. могут определяться различными аналитическими ме 004049 18 тодами, такими как ядерный магнитный резонанс (ЯМР), масс-спектрометрия (МС) и инфракрасная спектроскопия (ИК). В зависимости от используемого приема могут получаться слегка различающиеся значения для заданного производного циклодекстрина. Предпочтительно при измерении с помощью масс-спектрометрии M.S. составляет диапазон от 0,125 до 10 и D.S. - диапазон от 0,125 до 3. Другие подходящие композиции для перорального или ректального приема включают частицы, получаемые экструзией из расплава смеси, включающей соединение формулы (I-а) и соответствующий водорастворимый полимер, и последующим дроблением указанной экструдированной из расплава смеси. Указанные частицы затем можно преобразовывать с помощью обычных приемов в фармацевтическую дозированную форму, такую как таблетки и капсулы. Указанные частицы состоят из твердой дисперсии, включающей соединение формулы(I-а) и один или более фармацевтически приемлемых водорастворимых полимеров. Предпочтительным приемом получения твердых дисперсий является способ экструзии из расплава,включающий следующие стадии:a) смешение соединения формулы (I-а) и соответствующего водорастворимого полимера,b) необязательное смешивание добавок с полученной таким образом смесью,c) нагревание полученной таким образом смеси до получения гомогенного расплава,d) экструзию полученного таким образом расплава через одно или более литьевых отверстий; иe) охлаждение расплава до тех пор, пока он не затвердеет. Твердый дисперсионный продукт измельчают или размалывают до частиц, имеющих размер частиц менее чем 1500 мкм, предпочтительно менее чем 400 мкм, более предпочтительно менее чем 250 мкм и наиболее предпочтительно менее чем 125 мкм. Водорастворимые полимеры в частицах представляют полимеры, которые имеют кажущуюся вязкость при растворении при 20 С в водном растворе при 2% (м/о), 1-5000 мПас,более предпочтительно 1-700 мПас и наиболее предпочтительно 1-100 мПас. Например, подходящие водорастворимые полимеры включают алкилцеллюлозы,гидроксиалкилцеллюлозы,гидроксиалкилалкилцеллюлозы, карбоксиалкилцеллюлозы, соли щелочных металлов карбоксиалкилцеллюлоз, карбоксиалкилалкилцеллюлозы, сложные эфиры карбоксиалкилцеллюлозы,крахмалы, пектины, производные хитина, полисахариды, полиакриловые кислоты и их соли,полиметакриловые кислоты и их соли и сложные эфиры, сополимеры метакрилата, поливиниловый спирт, полиалкиленоксиды и сополимеры этиленоксида и пропиленоксида. Пред 19 почтительными водорастворимыми полимерами являются Eudragit E (Rhm GmbH, Germany) и гидроксипропилметилцеллюлоза. В качестве водорастворимого полимера при получении вышеуказанных частиц можно также использовать один или более циклодекстринов, как описывается в WO 97/18839. Указанные циклодекстрины включают известные из уровня техники фармацевтически приемлемые незамещенные и замещенные циклодекстрины,более конкретно ,илициклодекстрины или их фармацевтически приемлемые производные. Замещенные циклодекстрины, которые можно использовать, включают полиэфиры,описанные в патенте США 3459731. Дополнительными замещенными циклодекстринами являются эфиры, в которых водород одной или более гидроксигрупп циклодекстрина замещен С 1-6 алкилом, гидроксиС 1-6 алкилом, карбокси С 1-6 алкилом или С 1-6 алкилоксикарбонилС 1-6 алкилом или их смешанными эфирами. В частности, такими замещенными циклодекстринами являются простые эфиры, в которых водород одной или более гидроксигрупп циклодекстрина замещен C1-3 алкилом, гидроксиС 2-4 алкилом или карбоксиС 1-2 алкилом или более конкретно метилом, этилом, гидроксиэтилом, гидроксипропилом, гидроксибутилом, карбоксиметилом или карбоксиэтилом. Особенно полезными являются эфиры циклодекстринов, например, диметилциклодекстрин, описанный в Drugs of the Future, Vol. 9,8, p. 577-578 by M. Nogradi (1984), и полиэфиры, например, примерами являются гидроксипропилциклодекстрин и гидроксиэтил-циклодекстрин. Таким алкиловым эфиром может быть метиловый эфир со степенью замещения, равной примерно 0,125-3, например около 0,3-2. Такой гидроксипропилциклодекстрин,например, может получаться по реакции между-циклодекстрином и пропиленоксидом и может иметь значение MS примерно 0,125-10, например около 0,3-3. Более новым типом замещенных циклодекстринов являются сульфобутилциклодекстрины. Отношение соединения формулы (I-а) к циклодекстрину может широко варьировать. Например, могут использоваться отношения 1/100 до 100/1. Интересные отношения активного ингредиента к циклодекстрину находятся в диапазоне примерно 1/10 до 10/1. Более интересные отношения активного ингредиента к циклодекстрину находятся в диапазоне примерно 1/5 до 5/1. Далее может быть удобно составить рецептуру из соединений формулы (I-а) в форме наночастиц, которые имеют модификатор поверхности, адсорбированный на их поверхности, в количестве, достаточном для поддержания эффективного среднего размера частиц ме 004049 20 нее чем 1000 нм. Считается, что полезные модификаторы поверхности включают те, которые физически приклеиваются к поверхности соединения формулы (I-а), но не связываются химически с указанным соединением. Подходящие модификаторы поверхности предпочтительно могут быть выбраны из известных органических и неорганических фармацевтических наполнителей (эксципиентов). Такие наполнители включают различные полимеры, олигомеры с низкой молекулярной массой,природные продукты и поверхностно-активные вещества. Предпочтительные модификаторы поверхности включают неионные и анионные поверхностно-активные вещества. Еще один интересный путь составления рецептуры соединений формулы (I-а) предусматривает фармацевтическую композицию, в которой соединения формулы (I-а) вводят в гидрофильные полимеры, и нанесение данной смеси в виде пленки покрытия на множество мелких шариков, получая таким образом композицию, которую можно удобно производить и которая является подходящей для получения фармацевтических дозированных форм для перорального приема. Указанные шарики включают центральное круглое или сферическое ядро, покрывающую пленку из гидрофильного полимера и соединения формулы (I-а) и герметично покрывающий полимерный слой. Материалы, подходящие для использования в качестве ядер в шариках, могут быть разнообразными при условии, что указанные материалы являются фармацевтически приемлемыми и имеют соответствующие размеры и твердость. Примерами таких материалов являются полимеры, неорганические вещества, органические вещества и сахариды и их производные. Особенно благоприятно составлять рецептуру вышеуказанных фармацевтических композиций в дозированной форме для простоты введения и равномерности дозировки. Используемый здесь термин единичная дозированная форма относится к физически дискретным единицам, подходящим в качестве унифицированных доз, причем каждая единица содержит предопределенное количество активного ингредиента, вычисленное для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных форм являются таблетки (включая таблетки с бороздками или с покрытием) капсулы, пилюли, пакеты с порошком, облатки, суппозитории, инъецируемые растворы или суспензии и аналогичные, и их сегрегированные множества. Квалифицированные специалисты в области лечения ВИЧ инфекции могут определить эффективное суточное количество с учетом представленных здесь результатов испытаний. Вообще предполагается, что эффективное су 21 точное количество составляет от 0,01 до 50 мг/кг массы тела, более предпочтительно от 0,1 до 10 мг/кг массы тела. Может быть подходящим введение требуемой дозы в виде двух,трех, четырех или более субдоз с соответствующими интервалами на протяжении всего дня. Указанные субдозы могут быть составлены в виде единичных дозированных лекарственных форм, например, содержащих 1-1000 мг и, в частности, 5-200 мг активного ингредиента на дозированную форму. Точная дозировка и частота приема зависит от конкретного используемого соединения формулы (I) или (I-а), конкретного состояния,подвергаемого лечению, тяжести состояния,возраста, веса и общего физического состояния конкретного пациента, а также от других средств лечения, которые человек, возможно,принимает, как это хорошо известно специалистам в данной области. Более того, очевидно,что указанное эффективное ежедневное количество может снижаться или увеличиваться в зависимости от реакции субъекта, подвергаемого лечению, и/или в зависимости от оценки врача,прописывающего соединения настоящего изобретения. Следовательно, указанные выше диапазоны эффективного ежедневного количества являются только рекомендуемыми и не предназначены для ограничения в какой-либо степени объема или использования изобретения. Кроме того, в качестве лекарственного средства можно использовать комбинацию антиретровирусного соединения и соединения формулы (I) или (I-а). Таким образом настоящее изобретение также относится к продукту, содержащему (а) соединение формулы (I) или (Iа), и (b) еще одно антиретровирусное соединение в качестве комбинированного препарата для одновременного, раздельного или последовательного использования при лечении ВИЧ. В единый препарат вместе с фармацевтически приемлемыми носителями можно комбинировать различные лекарственные средства. Указанными другими антиретровирусными соединениями могут быть известные антиретровирусные соединения, такие как нуклеозидные ингибиторы обратной транскриптазы, например,зидовудин (3'-азидо-3'-деокситимидин, AZT),диданозин (дидеоксиинозин, ddI), зальцитабин(дидеоксицитидин, ddC) или ламивудин (3'-тиа 2',3'-дидеоксицитидин, 3 ТС) и аналогичные; ненуклеозидные ингибиторы обратной транскриптазы, такие как сурамин, пентамидин, тимопентин, кастаноспермин, декстран (декстрансульфат), фоскарнетнатрий (тринатрийфосфоноформиат), невирапин (11-циклопропил-5,11 дигидро-4-метил-6H-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он), такрин (тетрагидроаминоакридин) и аналогичные; соединения TIBO-типа 22 нил)имидазо[4,5,1-jk][1,4]бензодиазепин-2(1H)тион; соединения типа -АРА (-анилинофенилацетамид), например -[(2-нитрофенил) амино]-2,6-дихлорбензолацетамид и аналогичные; ингибиторы ТАТ, например RO-5-3335 и аналогичные; ингибиторы протеазы, например индинавир, ритановир, саквиновир и аналогичные; или иммуномодулирующие агенты, например левамизол и аналогичные. Соединение формулы (I) или (I-а) можно также комбинировать с другим соединением формулы (I) и (I-а). Следующие примеры предназначены для иллюстрации настоящего изобретения. Экспериментальная часть А Получение промежуточных соединений Пример А 1. Реакция в атмосфере аргона. Раствор 2,4,6 триметилбензоламина (0,00461 моль) в 1,4 диоксане (5 мл) добавляют к раствору 5-бром 2,4-дихлорпиримидина (0,00439 моль) в 1,4 диоксане (5 мл). Добавляют N,N-бис(1 метилэтил)этанамин (0,00548 моль). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 20 ч. Растворитель выпаривают. Остаток растворяют в этилацетате,промывают насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли, сушат сульфатом натрия, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: 1:5, 1:2 и 1:1 СН 2 Сl2:гексан). Собирают две группы чистых фракций и выпаривают растворитель, получая 0,35 г (24%) 5 бром-4-хлор-N-(2,4,6-триметилфенил)-2-пиримидинамина (промежуточное соединение 1) и 0,93 г (65%) 5-бром-2-хлор-N-(2,4,6-триметилфенил)-4-пиримидинаминаa). 4-Гидрокси-5-хлор-2-метилтиопиримидин (0,0156 моль) и 4-аминобензонитрил (0,078 моль) комбинируют в расплаве и перемешивают при 180-200 С в течение 6 ч. Реакционную смесь охлаждают и последовательно растирают с кипящим СН 2 Сl2 и CH3CN, получая соединение с 95% чистотой, которое сушат, получая 1,27 г (33%) 4-[(5-хлор-4-гидрокси-2-пиримидинил)амино]бензонитрила (промежуточное соединение 3; т.пл.300 С).(0,0028 моль) добавляют РОСl3 (10 мл). Колбу оборудуют холодильником и нагревают до 80 С в течение 35 мин. Вещество гасят льдом и выдерживают и полученный в результате осадок собирают и промывают водой (50 мл). Образец сушат. Фракцию его далее очищают колоночной хроматографией. Собирают чистые фракции и выпаривают растворитель, получая 4-[(4,5 дихлор-2-пиримидинил)амино]бензонитрилc). Смесь промежуточного соединения (4)(0,0145 моль) и смесь перемешивают в течение 5 мин. Удаляют растворитель при пониженном давлении, получая 3,98 г моногидрохлорида 4[(4,5-дихлор-2-пиримидинил)амино]бензонитрила (промежуточное соединение 5). Пример A3. а). 2,4,5,6-Тетрахлорпиримидин (0,0134 моль), 1,4-диоксан (30 мл), 2,4,6-триметиланилин (0,0134 моль) и N,N-бис(1-метилэтил) этанамин (0,0136 моль) добавляют в колбу в атмосфере аргона и перемешивают при 55 С в течение 16 ч. Растворитель выпаривают и остаток растворяют в СН 2 Сl2, затем очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/гексан 1/4 и 1/2). Необходимые фракции собирают и выпаривают растворитель, получая 0,15 г 4,5,6-трихлор-N-(2,4,6-триметилфенил)-2 пиримидинамина (промежуточное соединение 6) и 3,15 г 2,5,6-трихлор-N-(2,4,6-триметилфенил)-4-пиримидинамина (промежуточное соединение 7).b). Смесь промежуточного соединения 7(0,00474 моль) с NH3 (2,0 М в 2-пропаноле; 20 мл) нагревают в сосуде для работы под давлением при 75-80 С в течение 40 ч. Увеличивают температуру до 110-115 С. Выпаривают растворитель, получая 1,85 г остатка. Образец нагревают с NН 3 (0,5 М в 1,4-диоксане; 20 мл) при 125 С в течение 18 ч. Растворитель выпаривают,получая 1,7 г смеси двух изомеров, т.е. 2,5 дихлор-N4-(2,4,6-триметилфенил)-4,6-пиримидиндиамина (промежуточное соединение 8) и 5,6-дихлор-N4-(2,4,6-триметилфенил)-2,4-пиримидиндиамина (промежуточное соединение 9). Пример А 4.a). Смесь 4-[(1,4-дигидро-4-оксо-2-пиримидинил)амино]бензонитрила (0,12 моль) в РОСl3 (90 мл) перемешивают и кипятят с обратным холодильником в атмосфере аргона в течение 20 мин. Реакционную смесь медленно выливают в 750 мл смеси лед/вода и твердое вещество отделяют фильтрованием. Твердое вещество суспендируют в 500 мл воды и рН суспензии доводят до нейтрального значения добавлением 20% раствора NaOH. Твердое вещество снова отделяют фильтрованием, суспендируют в 200 мл 2-пропанона и добавляют 1000 мл СН 2 Сl2. Смесь нагревают до тех пор, пока не растворится все твердое вещество. После охлаждения до комнатной температуры отделяют водный слой и сушат органический слой. Во время удаления осушающего агента фильтрованием в фильтрате образуется белое твердое вещество. Дальнейшее охлаждение фильтрата в холодильнике, сопровождаемое фильтрованием, дает 21,38 г (77,2%) 4-[(4-хлор-2-пиримидинил)амино]бензонитрилаb). Промежуточное соединение (10) (0,005 моль), 1-бром-2,5-пирролидиндион (0,006 моль) и трихлорметан (10 мл) смешивают в герметично закрытой трубке и нагревают при 100 С в течение ночи. Дают реакционной смеси охладиться до комнатной температуры. Добавляют силикагель (2 г) и выпаривают растворитель. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюент: СН 2 Сl2/гексан 9/1). Собирают чистые фракции и выпаривают растворитель, получая 1,31 г (84,5%) 4-[(5-бром 4-хлор-2-пиримидинил)амино]бензонитрила(промежуточное соединение 11). Пример А 5. В колбу в атмосфере аргона добавляют 4 амино-2,5,6-трихлорпиримидин (0,08564 моль),4-аминобензонитрил (0,1071 моль), 1-метил-2 пирролидинон (17 мл) и HCl в диэтиловом эфире (1 М; 85,6 мл). Смесь помещают в масляную баню при 130 С под током азота до тех пор,пока эфир не будет удален. Добавляют дополнительно 10 мл 1-метил-2-пирролидинона. Смесь нагревают при 145 С в течение 16 ч в атмосфере аргона. Добавляют 1,4-диоксан. Смесь кипятят с обратным холодильником, охлаждают, затем фильтруют. Фильтрат выпаривают. Остаток растворяют в CH2Cl2, промывают 1N NaOH, затем фильтруют. Твердое вещество растворяют в 2-пропаноне, выпаривают на силикагель и хроматографируют, используя 1-3% 2-пропанон в гексане в качестве элюента. Собирают чистые фракции и выпаривают растворитель, получая 1,63 г (6,8%) 4-[(4-амино-5,6 дихлор-2-пиримидинил)амино]бензонитрила(промежуточное соединение 12). В. Получение конечных соединений Пример В 1. а). В колбу в атмосфере аргона, содержащую промежуточное соединение (1) (0,00107 моль), добавляют эфир. К данному гомогенному раствору добавляют НСl/диэтиловый эфир (1 М; 0,00109 моль). Растворитель выпаривают и добавляют 1,4-диоксан (35 мл) и 4-аминобензонитрил (0,00322 моль). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 4 дней. Растворитель выпаривают. Остаток растворяют в СН 2 Сl2, промывают насыщенным раствором бикарбоната натрия,сушат, фильтруют и выпаривают растворитель,получая 0,79 г масла янтарного цвета. Масло очищают с помощью ВЭЖХ с обращенной фазой. Собирают желаемые фракции и выпаривают растворитель, получая остатки 1 и 2. Остаток 1 очищают колоночной хроматографией на силикагеле (элюент: 0 и 2%CH3OH:CH2Cl2). Собирают чистые фракции и выпаривают растворитель, получая 0,0079 г(соединение 1). Остаток 2 очищают колоночной хроматографией на силикагеле (элюент: 0 и 2% 25 СН 3 ОН:СН 2 Сl2) . Собирают чистые фракции и выпаривают растворитель, получая 0,0044 гb). В колбу, содержащую промежуточное соединение 2 (0,00285 моль), добавляют эфир. К данному гомогенному раствору добавляют HCl в диэтиловом эфире (1 М; 0,00855 моль). Выпаривают растворитель и добавляют 1,4-диоксан(15 мл) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение семи дней. Выпаривают растворитель, остаток растворяют в СН 2 Сl2, промывают 1 М NaOH и выпаривают растворитель. Остаток растворяют в СН 2 Сl2 (10 мл) и осадок отфильтровывают и сушат, получая 0,15 г (13%) 4-5-бром-4-[(2,4,6 триметилфенил)амино]-2-пиримидинил]амино] бензонитрила (соединение 3). Пример В 2. а). Смесь 3:1 промежуточного соединения(0,01422 моль) нагревают в сосуде для работы под давлением при 180 С в течение 5 ч. Образец распределяют между СН 2 Сl2 и разбавленнымNaHCO3, сушат над K2 СO3, фильтруют и выпаривают. Перемешивают в СН 3 СN и полученный в результате осадок удаляют фильтрованием. Фильтрат далее очищают с помощью ВЭЖХ с обращенной фазой. Собирают чистые фракции и выпаривают растворитель, получая 0,17 г трифторацетата 4-4-амино-5-хлор-6-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрила (соединение 4). Пример В 3. К суспензии промежуточного соединенияHCl в диэтиловом эфире (1 М; 0,0045 моль), перемешивают в атмосфере аргона в герметизируемой трубке. Смесь подогревают для выпаривания диэтилового эфира и добавляют 2,4,6 триметилбензоламин (0,009 моль). Трубку герметизируют и реакционную смесь нагревают до 150 С в течение 12 ч. Дают реакционной смеси охладиться до комнатной температуры. Последовательно добавляют силикагель (2,2 г) и СН 3 ОН (50 мл). После выпаривания растворителя остаток очищают флэш-хроматографией(градиент элюента: СН 2 Сl2:СН 3 ОН:NН 4 ОН 99,5:0,45:0,05 до 99:0,9:0,1). Собирают чистые фракции и выпаривают растворитель. Остаток сушат, получая 0,80 г (73,4%) 4-5-хлор-4[(2,4,6-триметилфенил)амино]-2-пиримидинил] амино]бензонитрила (соединение 5). Пример В 4. Смесь промежуточного соединения (5) 26 и перемешивают при 160 С в течение 16 ч. Реакционную смесь концентрируют с помощью роторного испарения на силикагель (2,0 г). Вещество очищают флэш-хроматографией (элюент 1:1 гексаны: СН 2 Сl2; чистый СН 2 Сl2; 0,5%, 1%(10% МН 4 ОН в СН 3 ОН) в СН 2 Сl2) до 90% чистоты. Перекристаллизация дает 0,15 г (12,2%) 45-хлор-4-[(2,6-дибром-4-метилфенил)амино]2-пиримидинил]амино]бензонитрила (соединение 10; 95% чистота). Пример В 5. К суспензии 2,4,6-триметилфенола (0,0075 моль) в 1,4-диоксане (5 мл) в герметизируемой трубке в атмосфере аргона добавляют NaH(0,0075 моль; 60% суспензия в масле). Смесь перемешивают в течение 15 мин и добавляют промежуточное соединение (4) (0,0025 моль). Трубку герметизируют и реакционную смесь нагревают до 150 С в течение 15 ч. Реакционной смеси дают охладиться до комнатной температуры. После того как добавляют силикагель(2,0 г), выпаривают растворитель. Остаток очищают колоночной флэш-хроматографией на силикагеле (градиент элюента: СН 2 Сl2: гексаны 9:1 до 100:1; затем CH2Cl2:CH3OH:NH4OH 100:0:0 до 97:2,7:0,3). Собирают чистые фракции и выпаривают растворитель. Остаток сушат,получая 0,73 г (80,2%) 4-5-хлор-4-(2,4,6 триметилфенокси)-2-пиримидинил]амино] бензонитрила (соединение 6). Пример В 6.a). К суспензии 4-гидрокси-3,5 диметилбензонитрила (0,003 моль) в 1,4 диоксане (3 мл) в герметизируемой трубке в атмосфере аргона добавляют NaH, 60% суспензия в масле, (0,003 моль) и 1-метил-2 пирролидинон (3 мл). После того как выделится Н 2, добавляют промежуточное соединение (11)(0,001 моль). Трубку герметизируют и реакционную смесь нагревают до 160 С в течение 16 ч. Смесь охлаждают до комнатной температуры,переносят в химический стакан и разбавляют метанолом (20 мл). По каплям добавляют воду(200 мл). Водную смесь экстрагируют смесью СН 2 Сl2/СН 3 ОН 90/10 (3300 мл). Органический слой отделяют, сушат, фильтруют и адсорбируют на силикагель (1 г). Выпаривают растворитель и остаток очищают колоночной флэшхроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 100/0/0 до 98/1,8/0,2). Собирают желаемые фракции и выпаривают растворитель. Остаток растирают с горячим(250 мл), перемешиваемому при 0 С, добавляют н-бутиллитий (0,010 моль). После перемешивания на холоде в течение 30 мин добавляют соединение (17) (0,005 моль). Полученную в ре 27 зультате смесь перемешивают холодной в течение 15 мин, после чего добавляют этил-2 бромэтаноат (0,015 моль) и дают температуре подняться до комнатной температуры и реакционную смесь перемешивают в течение 16 ч, что доводит реакцию до 50% завершения. Гасят 0,5 мл Н 2O, образец концентрируют роторным испарением на силикагель и очищают флэшхроматографией (Biotage Flash 40M, элюирование 0; 0,5; 1% (10% NH4OH в СН 3 ОН) в СН 2 Сl2),получая белое твердое вещество, которое представляет смесь 1:1 исходный материал А : продукт. Очистка препаративной ВЭЖХ с элюированием в пробирки, содержащие 1 ммольNaHCO3, дает конечную очистку. Подвергнутое лиофилизации вещество берут в смесь вода/СН 2 Сl2 (1:1 (50 мл общего раствора и разделяют. Водную фазу экстрагируют еще 2 раза 25 мл СН 2 Сl2. Органические слои объединяют и сушат над сульфатом натрия, фильтруют и выпаривают в роторном испарителе до белого твердого вещества, высушенного в вакууме при 65 С 18 ч. Выход: 0,33 г(соединение 59). с). Реакцию проводят под током аргона.(17) (0,00476 моль) и смесь перемешивают в течение 15 мин. Добавляют хлорметил-2,2 диметилпропаноат (0,00600 моль) и реакционную смесь перемешивают в течение 16 ч при комнатной температуре, затем перемешивают и кипятят с обратным холодильником в течение 4,5 ч, затем охлаждают. Добавляют тетрагидрофуран (20 мл). Добавляют NaH 60% (0,00600 моль) и хлорметил-2,2-диметилпропаноат(0,00600 моль) и полученную в результате реакционную смесь перемешивают в течение 24 ч. Выпаривают растворитель. Остаток растворяют в CH2Cl2, промывают водой и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент: СH2Cl2/ СН 3 ОН 100/0 и 99,5/0,5). Собирают необходимые фракции и выпаривают растворитель. Остаток очищают на Gilson. Данную фракцию кристаллизуют из 2-пропанола, отфильтровывают и сушат. Выход: 0,60 гd). Суспензию соединения (17) (0,0020 моль) в тетрагидрофуране (40 мл) обрабатывают одной порцией 0,24 г NaH. Вскипающую смесь перемешивают в течение 2 ч, получая яркожелтую суспензию. Приготавливают раствор 2,2'-оксибисацетилхлорида (0,020 моль) в тетрагидрофуране (10 мл) и охлаждают на ледяной бане. С помощью трубки (канюли) полученную в результате А/В суспензию по каплям переносят в холодный раствор 2,2'-оксибисацетилхлорида на протяжении 10 мин. Смесь подогревают до комнатной температуры и перемешивают в течение 3 дней. Добавляют еще 0,24 г NaH и спустя 2 дня реакционную смесь охлаждают на ледяной бане и обрабатывают смесью метанола(0,150 моль) и N,N-диэтилэтанамина (0,150 моль) добавлением по каплям в течение 30 мин. Реакционную смесь подогревают до комнатной температуры и спустя 16 ч выливают в эфир и экстрагируют насыщенным NаНСО 3. Водную фракцию экстрагируют 2 раза эфиром и объединенные эфирные экстракты промывают 3 раза водой и сушат над MgSO4. Концентрирование дает 2,91 г маслянистого остатка, который подвергают препаративной ВЭЖХ с обращенной фазой. Лиофилизация соответствующих фракций дает 0,16 г образца в виде бежевого порошка (14,5% выход чистого продукта) (соединение 61). Пример В 7. В сосуд для работы под давлением в атмосфере аргона добавляют промежуточный продукт 12 (0,00286 моль), 4-циано-2,6-диметиланилин (0,00571 моль), 1 М HCl в диэтиловом эфире (0,00140 моль) и 1,4-диоксан (8 мл). Реакционную смесь нагревают на масляной бане под током азота до тех пор, пока не будут выпарены все растворители. Добавляют 1-метил-2 пирролидинон (3 мл) и реакционную смесь нагревают при 220-240 С в течение 3 ч. Нагревание продолжают при 210-220 С в течение 6 ч. Остаток растворяют в 1,4-диоксане, выпаривают, распределяют между СН 2 Сl2 и 1N NaOH,фильтруют, органические слои сушат карбонатом калия и выпаривают. Выделяют желаемое соединение и очищают препаративной хроматографией с обращенной фазой. Собирают чистые фракции и выпаривают растворитель, получая 0,0165 г (1,1% после лиофилизации) трифторацетата 4-4-амино-5-хлор-6-[(4-циано-2,6 диметилфенил)амино]-2-пиримидинил]амино] бензонитрила (1:1) (соединение 19). 29 Пример В 8. Смесь промежуточного соединения (11)(0,0011 моль), 2,6-диметил-4-(2-пропил)бензоламина (0,0011 моль), N,N,N',N'-тетраметил-1,8 нафталиндиамина (0,0022 моль) и 1 М HCl в эфире (2,3 мл) (0,0023 моль) в 1,4-диоксане (25 мл) перемешивают и нагревают до 95 С в течение 16 ч. Удаляют растворитель роторным испарением и остаток очищают препаративной ВЭЖХ с обращенной фазой. Объединенные фракции, содержащие желаемое вещество, лиофилизуют, получая 0,23 г(0,0024 моль). Ампулу с реакционной смесью герметизируют и нагревают до 155-160 С при перемешивании в течение 1,5 дней. Образец охлаждают до комнатной температуры. Образец подвергают колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2). Очистку завершают препаративной ВЭЖХ, получая 0,05 г 4(5-бром-4-хлор-6-[(4-циано-2,6-диметилфенил) амино]-2-пиримидинил]амино]бенэонитрила(0,00218 моль) в 1,4-диоксане (10 мл) последовательно добавляют 2,4,6-триметилбензоламин (0,0022 моль) и N,N-ди(метилэтил)этанамин (0,0024 моль). Трубку герметизируют и суспензию нагревают до 120-130 С на масляной бане при перемешивании в течение 90 ч. Смесь охлаждают до комнатной температуры. Добавляют ещеN,N-ди(метилэтил)этанамин (15 мл) и образец снова нагревают до 120-130 С в течение 64 ч. Реакционную смесь нагревают при 150 С в течение 6 дней. Образец охлаждают до комнатной температуры. Образец разбавляют этилацетатом и экстрагируют холодным 1 М NaOH. Водную фазу промывают этилацетатом. Объединенные органические фазы сушат и концентрируют. Проводят колоночную флэш-хроматографию на силикагеле (элюент: СН 2 Сl2). Далее образец очищают препаративной ВЭЖХ, получая 0,53 г 4-5-бром-4-хлор-6-[(2,4,6-триметилфенил) амино]-2-пиримидинил]амино]бензонитрила(0,0021 моль) в 1,4-диоксане (30 мл) перемешивают при 100 С в течение 16 ч. Растворитель удаляют роторным испарением. Растирают твердый остаток и остаток сушат в вакууме при 40 С в течение 16 ч, получая 0,452 г т.пл. 300 С (соединение 43). Пример В 12. В сосуд для работы под давлением добавляют(0,00567 моль), 4-аминобензонитрил (0,01163 моль) и 1-метил-2-пирролидинон (20 мл). Реакционную смесь нагревают при 140 С в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют ацетонитрил и воду. Полученный в результате осадок отфильтровывают и твердое вещество перекристаллизовывают из ацетонитрила, получая 1,27 г 4-5 бром-4-(4-циано-2,6-диметилфенокси)-6-метил 2-пиримидинил]амино]бензонитрила(52%); т.пл.=260-262 С (соединение 44). Пример В 13. Объединяют промежуточный продукт (11)(0,00473 моль) и нагревают до 150 С при перемешивании в течение 16 ч. Образец растворяют в СН 3 ОН и выпаривают на силикагель (1 г) и элюируют смесью 1:1 гексаны:СН 2 Сl2, 4:1 СН 2 Сl2:гексаны и чистым СН 2 Сl2 (2 л). Выпаривают желаемые фракции и остаток сушат в вакууме в течение 16 ч при 45 С. Полученный таким образом продукт переносят в 4 мл ампулу с CH2Cl2 и выпаривают растворитель, получая 0,120 г 4-5-бром-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрила (28,6%); т.пл.=277-280 С (соединение 45). Пример В 14. 4-5-Бром-4-(4-циано-2,6-диметилфенокси)-6-хлор-2-пиримидинил]амино]бензонитрил(0,00250 моль) и NH3/1,4-диоксан 0,5 М (0,015 моль) нагревают в сосуде для работы под давлением при 150 С в течение 4 дней. Образец оставляют стоять в условиях окружающей среды в течение 2 дней. Затем к смеси медленно добавляют воду до тех пор, пока не образуется оса 31 док. Смесь перемешивают в течение 2 ч и фильтруют. Твердое вещество перекристаллизовывают из СН 3 СN, получая 0,58 г (фракция 1). Фильтрат выпаривают (фракция 2). Обе фракции объединяют и очищают колоночной хроматографией, элюируя CH2Cl2. Полученный в результате остаток желаемой фракции перекристаллизовывают из CH3CN, получая 0,44 г 4-4 амино-5-бром-6-(4-циано-2,6-диметилфенокси)2-пиримидинил]амино]бензонитрила (40,5%). Образец сушат при 80 С в течение 16 ч при 0,2 мм Нg (соединение 46). Пример В 15. В сосуд для работы под давлением добавляют 4-5-бром-4-(4-циано-2,6-диметилфенокси)-6-хлор-2-пиримидинил]амино]бензонитрил(0,000660 моль), тетрагидрофуран (1 мл) и 1 пирролидинэтанамин (0,00198 моль). Смесь нагревают при 75 С в течение 16 ч. Добавляют СН 2 Сl2 и смесь промывают водой, сушат,фильтруют и фильтрат выпаривают. Очистка с использованием колоночной флэшхроматографии с элюированием смесью 1:9 метанол:метиленхлорид дает твердое вещество,которое повторно растворяют в CH3CN. Добавляют HCl/диэтиловый эфир 1,0 М (0,48 мл) и смесь охлаждают на льду. Фильтрование дает 0,19 г гидрохлорида 4-5-бром-4-(4-циано-2,6 диметилфенокси)-6-[(1-пирролидинил)этиламино]-2-пиримидинил]амино]бензонитрила (1:1)(50,6%); т.пл.=208-210 С (соединение 47). Пример В 16. В сосуд для работы под давлением добавляют 4-5-бром-4-(4-циано-2,6-диметилфенокси)-6-хлор-2-пиримидинил]амино]бензонитрил(0,00064 моль), тетрагидрофуран (3 мл), Oметилгидроксиламин (0,06 г), тетрагидрофуран и NaOH 1N (0,00067 моль). Реакционную смесь перемешивают в течение 3 дней при комнатной температуре, затем в течение 1 дня при 75 С, 1 дня при 90 С и двух дней при 110 С. К Ометилгидроксиламину (0,60 г) добавляют тетрагидрофуран (4 мл) и NaOH 50% (0,00719 моль). Жидкость декантируют в реакционную колбу и реакционную смесь нагревают при 110 С в течение 3 дней. Выпаривают растворитель. Остаток растворяют в СН 2 Сl2, промывают насыщенным раствором NаНСО 3 и водой, сушат(Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 98/2). Собирают чистые фракции и выпаривают растворитель. Остаток кристаллизуют из 32 н-бутиллитий (2,0 мл, 0,005 моль). После перемешивания на холоде в течение 30 мин добавляют соединение (17) (0,005 моль). Полученную в результате смесь перемешивают холодной в течение 30 мин, после чего добавляют 1,1 диметилэтилбромацетат (1,5 мл, 10 ммоль),температуре дают подняться до комнатной температуры и реакционную смесь перемешивают в течение трех дней. В отдельной колбе к перемешиваемому при 0 С раствору 1-(метилэтил)2-пропанамина (0,70 мл, 5 ммоль) в тетрагидрофуране (50 мл) добавляют н-бутиллитий (2,0 мл,5 ммоль) оставляют реагировать в течение 30 мин, после чего смесь переносят для реакции при комнатной температуре. Данную процедуру повторяют. Погашенный 0,5 мл Н 2O образец концентрируют роторным испарением на силикагель и очищают флэш-хроматографией(элюирование 0, 10, 20% этилацетатом в гексанах), получая белое твердое веществоb) Суспензию соединения (17) в 40 мл N,Nдиметилформамида обрабатывают 0,24 г NaH. Кипящую смесь перемешивают в течение 90 мин. Приготавливают раствор 1,4-дихлор-1,4 бутандиона в 10 мл N,N-диметилформамида и охлаждают на ледяной бане. Полученную из соединения (17) смесь переносят в холодный раствор 1-(метилэтил)-1-пропанамина и подогревают до комнатной температуры при перемешивании в течение 42 ч. Добавляют еще 0,24 г NaH, реакционную смесь перемешивают в течение 3 дней, разбавляют эфиром и выливают на лед. Осадок удаляют фильтрованием. Отделяют двухфазный фильтрат и кислую водную фракцию еще два раза экстрагируют эфиром. Объединенные эфирные фракции промывают небольшими объемами дистиллированной воды и сушат. Выпаривают растворитель и остаток подвергают колоночной хроматографии на силикагеле. Препаративная ВЭЖХ с обращенной фазой с немедленным охлаждением для лиофилизации соответствующих фракций дает 0,07 гNaH 60% и тетрагидрофуран. Реакционную смесь перемешивают при комнатной температуре в течение 10 мин и добавляют соединение(17). После перемешивания в течение 1 ч добавляют этилкарбонохлоридат. Реакционную смесь перемешивают при комнатной температуре еще в течение 16 ч и выпаривают растворитель. Остаток частично растворяют в диметилсульфоксиде и фильтруют. Фильтрат очищают хроматографией с обращенной фазой и лиофилизуют,получая 0,47 г (18%)d). Смесь 4-5-амино-4-(4-циано-2,6 диметилфенокси)-2-пиримидинил]амино]бензонитрила (0,00147 моль) в ангидриде уксусной кислоты (10 мл) и 2-пропанона (10 мл) перемешивают при комнатной температуре в течение 16 ч. Затем смесь нагревают до 55 С и добавляют еще ангидрид уксусной кислоты (3 мл). Смесь удаляют от нагрева через 18 ч и перемешивают в течение 6 дней при комнатной температуре. Образец концентрируют роторным испарением до твердого вещества. Очистка колоночной хроматографией (элюирование 0; 0,5; 1; 1,5; 2% (10% NH4OH в СН 3 ОН) в метиленхлориде) дает т.пл.=290-295 С. Твердое вещество сушат в вакууме в течение 16 ч при 60 С (соединение 49). Пример В 18. Смесь 4-4-(4-циано-2,6-диметилфенокси)-5-нитро-2-пирими-динил]амино]бензонитрила (0,0005 моль) в тетрагидрофуране (20 мл) гидрируют в течение ночи над Pd/C 10% (0,100 г) в качестве катализатора. После потребления Н 2 (3 экв., 0,0015 моль) катализатор отфильтровывают, фильтрат концентрируют роторным испарением и сушат в вакууме в течение 16 ч при 40 С, получая 0,15 г 4-5-амино-4-(4 циано-2,6-диметилфенокси)-2-пиримидинил] амино]бензонитрила (84%); т.пл.300 С (соединение 50). Пример В 19. 4-4-[(2,4,6-триметилфенил)амино]-5 нитро-2-пиримидинил]амино]бензонитрил(0,001 моль), Pd/C 10% (0,025 г), этанол (20 мл) и гидразин (0,030 моль) объединяют с получением суспензии и перемешивают при комнатной температуре в течение 16 ч. Удаляют растворитель роторным испарением. Остаток берут в тетрагидрофуран (20 мл) и метанол (1 мл). Добавляют вторую порцию гидразина (0,5 г) и ре 004049 34 акционную смесь перемешивают в течение 16 ч при комнатной температуре. Добавляют третью порцию гидразина (0,5 мл) и реакционную смесь перемешивают еще в течение 16 ч при комнатной температуре. Образец концентрируют роторным испарением на силикагеле (1 г) и очищают флэш-хроматографией (элюент 0,5; 1,2% (10% NH4OH в СН 3 ОН) в СН 2 Сl2). Желаемые фракции очищают препаративной ВЭЖХ,получая 0,24 г 4-5-амино-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрила (70%); т.пл.=224-225 С (соединение 51). Пример В 20. Соединение (3) (0,001 моль), триметилсиланкарбонитрил (0,0012 моль), Pd(PPh3)2Cl2(0,020 г), CuI (0,010 г) и CF3COOH/H2O (3 мл) смешивают в герметичной трубке и нагревают до 110 С в течение 10 ч. Добавляют еще порции катализаторов Pd(PPh3)2Cl2 (0,020 г) и CuI (0,010 г) и СF3 СООН/Н 2O (3 мл) и реакционную смесь перемешивают в течение 10 ч при 110 С. Материал концентрируют роторным испарением. Остаток очищают препаративной ВЭЖХ с обращенной фазой. Необходимые фракции концентрируют, очищают препаративной ВЭЖХ с обращенной фазой и сушат струей N2, затем в вакууме при 40 С в течение 16 ч. Выход: 0,011 г 4-5-этинил-4-[(2,4,6-триметилфенил)амино]-2 пиримидинил]амино]бензонитрила; т.пл.=165175 С (соединение 52). Пример В 21. Соединение (3) (0,000906 моль), трибутилфенилстаннан (0,000906 моль), Pd(PPh3)4(0,002718 моль) и 1,4-диоксан (3 мл) объединяют в атмосфере азота в герметичной трубке и нагревают при 110 С в течение 16 ч. Реакционную смесь охлаждают и концентрируют роторным испарением. Образец очищают препаративной ВЭЖХ с обращенной фазой, затем сушат в токе аргона. Сушка в вакууме дает 0,0845 г 45-фенил-4-[(2,4,6-триметилфенил)амино]-2 пиримидинил]амино]бензонитрила; т.пл.=209214 С (соединение 53). Пример В 22. Соединение (3) (0,001 моль), тетраэтенилстаннан (0,22 мл), 1,4-диоксан (2 мл) и Pd(PPh3)4(0,112 г) объединяют в атмосфере аргона в герметичной трубке. Смесь перемешивают и нагревают до 100 С в течение 16 ч. Добавляют еще тетраэтенилстаннан и Рd(РРh3)4. Реакционную смесь помещают в атмосферу аргона, перемешивают и нагревают. Реакционную смесь концентрируют роторным испарением и очищают препаративной ВЭЖХ. Вещество сушат под струей N2, сушат в вакууме в течение 4 ч при 60 С, получая 0,422 г 4-5-этенил-4-[(2,4,6 триметилфенил)амино]-2-пиримидинил]амино] бензонитрила; т.пл.=237-242 С (соединение 54). Пример В 23. Соединение (3) (0,001225 моль), CuCN аргона, затем перемешивают и нагревают до 160 С в течение 16 ч. Остаток очищают колоночной хроматографией (элюент: СН 2 Сl2/гексан,1/1, затем чистый СН 2 Сl2). Собирают требуемые фракции и выпаривают растворитель. Остаток растирают с СН 2 Сl2 при комнатной температуре. Твердое вещество сушат (вакуум, 40 С, 24 ч), получая 0,0864 г(24%); т.пл.=254-259 С (соединение 55). В табл. 1, 2, 3 и 4 перечисляются соединения формулы (I-а), которые получают аналогично одному из вышеприведенных примеров. Таблица 1 С. Фармакологический пример Пример С 1. Быструю, чувствительную и автоматизированную процедуру анализа используют для оценки in vitro анти-ВИЧ агентов. Ранее показано (Koyanagi et al., Int. J. Cancer, 36, 45-451,1985), что ВИЧ-1 трансформированная Т 4 клеточная линия, МТ-4, является чувствительной и пермиссивной в отношении инфекции ВИЧ, она служила в качестве линии клетокмишеней. Ингибирование вызванного ВИЧ цитопатического эффекта используют в качестве конечной цели. Жизнеспособность как ВИЧ-,так и ложно инфицированных клеток оценивают 39 спектрофотометрически восстановлением in situ 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида (МТТ). 50% цитотоксичную концентрацию (CC50 в мкМ) определяют как концентрацию соединения, которая уменьшает поглощение ложно инфицированного контрольного образца на 50%. Процент защиты, достигаемый соединением на инфицированных ВИЧ клетках, вычисляют по следующей формуле: где (ODт)вич представляет оптическую плотность, измеренную с заданной концентрацией испытуемого соединения на клетках, инфицированных ВИЧ; (ОDс)вич представляет оптическую плотность, измеренную для контрольных необработанных клеток, инфицированных ВИЧ;(ODc)ложно представляет оптическую плотность,измеренную для контрольных необработанных ложно инфицированных клеток; значения всех оптических плотностей определяют при 540 нм. Дозу, достигающую 50% защиты по вышеприведенной формуле, определяют как 50% ингибирующую концентрацию (IC50 в мкМ). Отношение CC50 к IC50 определяют как индекс селективности (SI). Было показано, что соединения формулы (I) эффективно ингибируют ВИЧ-1. Конкретные значения IC50, CC50 и SI показаны в приведенной ниже табл. 5. Таблица 5 его N-оксид, аддитивная соль, четвертичный амин или стереохимически изомерная форма,где R1 представляет водород; арил; формил; C1-6 алкилкарбонил; C1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкил, замещенный формилом, C1-6-алкилкарбонилом, C1-6 алкилоксикарбонилом, C1-6 алкилкарбонилокси; С 1-6 алкилокси С 1-6 алкилкарбонил, замещенный C1-6 алкилоксикарбонилом;R2a представляет циано или аминокарбонил;R3 представляет фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя,тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных для R2, где каждый R2 независимо представляет гидрокси, галоген, C1-6 алкил, необязательно замещенный циано или -C(=O)R6, С 3-7 циклоалкил,С 2-6 алкенил, необязательно замещенный одним или более атомами галогена или циано, С 2-6 алкинил, необязательно замещенный одним или более атомами галогена или циано, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбоксил,циано, нитро, амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6,-NH-S(=O)pR6,-C(=O)R6,-NHC(=O)H,-C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или радикал формулыR6 представляет метил, амино, моно- или диметиламино или полигалогенметил;R4 и R5, каждый независимо, выбран из водорода, гидрокси, C1-12 алкила, С 1-12 алкилокси,С 1-12 алкилкарбонила, С 1-12 алкилоксикарбонила,арила, амино, моно- или ди(С 1-12 алкил)амино,моно- или ди(С 1-12 алкил)аминокарбонила, в которых каждая из указанных выше С 1-12 алкильных групп может быть необязательно и каждая индивидуально замещена одним или двумя заместителями, каждый из которых неза 41 висимо выбран из гидрокси, C1-6 алкилокси, гидроксиС 1-6 алкилокси, карбоксила, C1-6 алкилоксикарбонила, циано, амино, имино, моно- или ди(С 1-6 алкил)амино, полигалогенметила, полигалогенметилокси,полигалогенметилтио,-S(=O)pR6,-NH-S(=O)pR6,-C(=O)R6,-NHC(=O)H,-C(=O)NHNH2,-NHC(=O)R6,6Y представляет гидрокси, галоген, С 3-7 циклоалкил, С 2-6 алкенил, необязательно замещенный одним или более атомами галогена, С 2-6 алкинил, необязательно замещенный одним или более атомами галогена, C1-6 алкил, замещенный циано или -C(=O)R6 группой, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбоксил, циано, нитро,амино, моно- или ди(C1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио,-S(=O)pR6,-NH-S(=O)pR6,6-C(=O)R ,-NHC(=O)H,-C(=O)NHNH2,-NHC(=O)R6, -C(=NH)R6 или арил; арил представляет фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, С 3-7 циклоалкила, C1-6 алкилокси, циано, нитро, полигалогенС 1-6 алкила и полигалогенС 1-6 алкилокси;Het представляет алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила,гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила,где каждый из указанных алифатических гетероциклических радикалов может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила,пиримидинила, пиразинила и пиридазинила, где каждый из указанных ароматических гетероциклических радикалов может быть необязательно замещен гидрокси. 2. Соединение по п.1, в котором R1 представляет водород, арил, формил, C1-6 алкилкарбонил, C1-6 алкил, С 1-6 алкилоксикарбонил,C1-6 алкил, замещенный формилом, C1-6 алкилкарбонилом, C1-6 алкилоксикарбонилом. 3. Соединение по п.1 или 2, в котором L представляет -X-R3, где R3 представляет 2,4,6 тризамещенный фенил. 4. Соединение по любому из пп.1-3, в котором Y представляет циано, -C(=O)NH2 или галоген. 5. Соединение по любому из пп.1-4, в котором Q представляет водород или NR4R5. 6. Соединение по любому из пп.1-5, представляющееN-оксид или аддитивную соль. 8. Применение соединения по любому из пп.1-7 в качестве лекарственного средства. 9. Применение соединения формулы (I) его N-оксида, фармацевтически приемлемой аддитивной соли, четвертичного амина или стереохимически изомерной формы, гдеR2a представляет циано или аминокарбонил;R3 представляет фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя,тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных для R2, где каждый R2 независимо представляет гидрокси, галоген, С 1-6 алкил, необязательно замещенный циано или -C(=O)R6, С 3-7 циклоалкил,С 2-6 алкенил, необязательно замещенный одним или более атомами галогена или циано, С 2-6 алкинил, необязательно замещенный одним или более атомами галогена или циано, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбоксил,циано, нитро, амино, моно- или ди(С 1-6R6 представляет метил, амино, моно- или диметиламино или полигалогенметил; иR4 и R5, каждый независимо, выбран из водорода, гидрокси, C1-12 алкила, С 1-12 алкилокси,С 1-12 алкилкарбонила, С 1-12 алкилоксикарбонила,арила, амино, моно- или ди(С 1-12 алкил)амино,моно- или ди (С 1-12 алкил)аминокарбонила, в которых каждая из указанных выше С 1-12 алкильных групп может быть необязательно и каждая индивидуально замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6 алкилокси, гидроксиС 1-6 алкилокси, карбоксила, С 1-6 алкилоксикарбонила, циано, амино, имино, моно- или ди(C1-6 алкил)амино, полигалогенметила, полигалогенметилокси,полигалогенметилтио,-S(=O)pR6,-NH-S(=O)PR6,-C(=O)R6,-NHC(=O)H,-C(=O)NHNH2,-NHC(=O)R6,6Y представляет гидрокси, галоген, С 3-7 циклоалкил, С 2-6 алкенил, необязательно замещенный одним или более атомами галогена, С 2-6 алкинил, необязательно замещенный одним или более атомами галогена, C1-6 алкил, замещенный циано или -C(=O)R6 группой, C1-6 алкилокси,C1-6 алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(C1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио,-S(=O)pR6,-NH-S(=O)pR6,6-C(=O)R ,-NHC(=O)H,-C(=O)NHNH2,-NHC(=O)R6, -C(=NH)R6 или арил; арил представляет фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, С 3-7 циклоалкила, C1-6 алкилокси, циано, нитро, полигалогенС 1-6 алкила и полигалогенС 1-6 алкилокси;Het представляет алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический ра 004049 44 дикал выбран из пирролидинила, пиперидинила,гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила,где каждый из указанных алифатических гетероциклических радикалов может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила,пиримидинила, пиразинила и пиридазинила, где каждый из указанных ароматических гетероциклических радикалов может быть необязательно замещен гидрокси; для производства лекарственных средств для лечения субъектов (пациентов), страдающих от инфекции ВИЧ (вирус иммунодефицита человека). 10. Применение соединения по любому из пп.1-7 для производства лекарственных средств для лечения субъектов, страдающих от инфекции вируса иммунодефицита человека. 11. Применение соединения по любому из пп.1-7 для производства лекарственных средств для лечения от инфекции ВИЧ-1, устойчивой к ненуклеозидным ингибиторам обратной транскриптазы иным, чем соединения, определнные в пп.1-7. 12. Применение соединения по любому из пп.1-7, в котором R1 представляет водород,арил, формил, С 1-6 алкилкарбонил, C1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкил, замещенный формилом, C1-6 алкилкарбонилом, C1-6 алкилоксикарбонилом, для производства лекарственных средств для лечения пациентов, страдающих от инфекции ВИЧ (вирус иммунодефицита человека). 13. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-7. 14. Способ получения фармацевтической композиции, заявленной в п.13, отличающийся тем, что терапевтически эффективное количество соединения по любому из пп.1-7 тщательно смешивают с фармацевтически приемлемым носителем. 15. Способ получения соединения, заявленного в п.1, характеризующийся взаимодействием промежуточного соединения формулы где W1 представляет подходящую уходящую группу и L, Y, Q, R1, R2, R2a имеют значения,определенные в п.1, q=0 и -b1=b2-С(R2a)=b3-b4= представляет двухвалентный радикал формулы вращением соединений формулы (I-а) друг в друга, следуя реакциям преобразования, известным из уровня техники; и далее, при желании,превращением соединения формулы (I-а) в аддитивную соль кислоты обработкой кислотой или наоборот, превращением формы аддитивной соли кислоты в свободное основание обработкой щелочью; и, при желании, получением их стереохимически изомерных форм. 16. Способ получения соединения, заявленного в п.1, характеризующийся взаимодействием промежуточного соединения формулы где W2 представляет подходящую уходящую группу и Y, Q, R1, R2, R2a, R3 имеют значения,определенные в п.1, q=0 и -b1=b2-С(R2a)=b3-b4= представляет двухвалентный радикал формулы-СН=СН-С(R2a)=CH-CH=; и при желании превращением соединений формулы (I-а) друг в друга, следуя реакциям преобразования, известным из уровня техники; и далее, при желании,превращением соединения формулы (I-а) в аддитивную соль кислоты обработкой кислотой или наоборот, превращением формы аддитивной соли кислоты в свободное основание обработкой щелочью; и, при желании, получением их стереохимических изомерных форм. 17. Способ получения соединения, заявленного в п.1, характеризующийся взаимодействием промежуточного соединения формулы где W2 представляет подходящую уходящую группу и Y, Q, R1, R2, R2a, R3 имеют значения,определенные в п.1, q=0 и -b1=b2-С(R2a)=b3-b4= представляет двухвалентный радикал формулы-СН=СН-С(R2a)=СН-СН=; и, при желании, превращением соединений формулы (I-а) друг в друга, следуя реакциям преобразования, известным из уровня техники; и далее, при желании,превращением соединения формулы (I-а) в аддитивную соль кислоты обработкой кислотой или наоборот, превращением формы аддитивной соли кислоты в свободное основание обработкой щелочью; и, при желании, получением их стереохимически изомерных форм. 18. Комбинация соединения, определенного в п.1 или 9, и еще одного антиретровирусного соединения. 19. Применение комбинации по п.18 в качестве лекарственного средства. 20. Продукт, содержащий (а) соединение,определенное в п.1 или 9, и (b) еще одно антиретровирусное соединение, и представляющий комбинированный препарат для одновременного, раздельного или последовательного использования при лечении ВИЧ. 21. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и в качестве активных ингредиентов (а) соединение, определенное в п.1 или 9, и (b) еще одно антиретровирусное соединение.
МПК / Метки
МПК: A61K 31/505, C07D 239/48, C07D 401/12, C07D 239/46, C07D 239/50
Метки: ингибирующие, пиримидины, вич, репликацию
Код ссылки
<a href="https://eas.patents.su/24-4049-pirimidiny-ingibiruyushhie-replikaciyu-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Пиримидины, ингибирующие репликацию вич</a>
Предыдущий патент: Новые производные бензола, способ их получения и фармацевтические композиции, содержащие их
Следующий патент: Способ изготовления состава местных бета-блокаторов улучшенного действия
Случайный патент: Трубное резьбовое соединение












