(имидазол-5-ил) метил-2-хинолиноновые производные, ингибирующие фарнезилпротеин-трансферазу.
Номер патента: 710
Опубликовано: 28.02.2000
Авторы: Вене Марк Гастон, Санз Жерар Шарль, Анжибо Патрик Рене, Мюллер Филипп
Формула / Реферат
1. Соединение формулы (I)
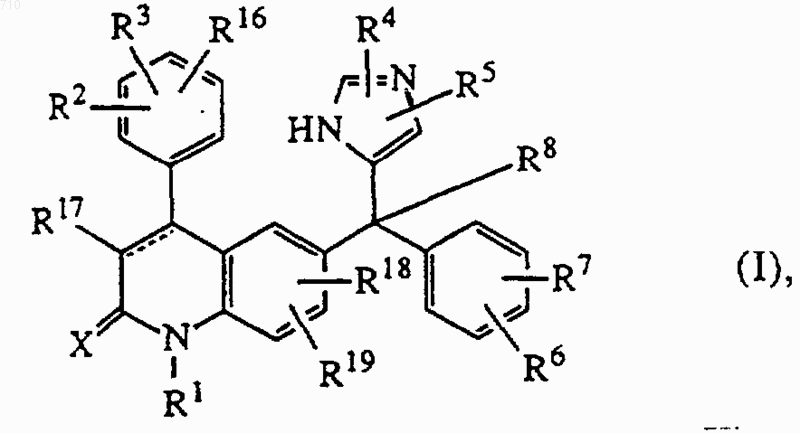
его стереоизомерная форма, фармацевтически приемлемая кислотно-аддитивная или основно-аддитивная соль,
где пунктирная линия означает необязательную связь;
Х представляет кислород или серу;
R1 представляет водород, С1-12алкил, Аr1, Аr2C1-6алкил, хинолинил-C1-6алкил, пиридилС1-6алкил, гидроксиС1-6алкил, C1-6алкилокси-C1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, аминоС1-6алкил или радикал формулы -Alk1-C(=O)-R9, -Alk1-S(О)-R9 или -Alk1-S(O)2-R9,
где -Alk1 обозначает C1-6алкандиил,
R9 представляет гидрокси, C1-6алкил, C1-6алкилокси, амино, С1-8алкиламино или С1-8алкиламино, замещенный C1-6алкилоксикарбонилом;
каждый из R2, R3 и R16, независимо, представляет водород, гидрокси, галоген, циано, C1-6алкил, C1-6алкилокси, гидроксиС1-6алкилокси, С1-6алкилоксиС1-6алкилокси, аминоС1-6алкилокси, моно- или ди(C1-6алкил)аминоС1-6алкилокси, Аr1, Аr2C1-6алкил, Ar2oкcи, Ar2C1-6aлкилoкcи, гидроксикарбонил, C1-6алкилоксикарбонил, тригалогенметил, тригалогенметокси, C2-6алкенил, 4,4-диметилоксазолил; или
когда R2 и R3 находятся в соседних положениях, взятые вместе они могут образовывать бивалентный радикал формулы
| -О-СН2-О- | (а-1), | |
| -O-CH2-CH2-O- | (а-2), | |
| -О-СН=СН- | (а-3), | |
| -O-CH2-CH2- | (а-4), | |
| -O-CH2-CH2-CH2- | (а-5), или | |
| -СН=СН-СН=СН- | (а-6); |
каждый из R4 и R5, независимо, представляет водород, галоген, Аr1, C1-6алкил, гидроксиС1-6алкил, С1-6алкилоксиС1-6алкил, C1-6алкилокси, C1-6алкилтио, амино, гидроксикарбонил, C1-6алкилоксикарбонил, С1-6алкилS(О)C1-6алкил или C1-6алкилS(О)2C1-6алкил;
каждый из R6 и R7, независимо, представляет водород, галоген, циано, C1-6алкил, C1-6алкилокси, Ar2-oкcи, тригалогенметил, C1-6алкилтио, ди(C1-6алкил)амино, или
когда R6 и R7, находятся в соседних положениях, взятые вместе могут образовывать бивалентный радикал формулы
| -O-CH2-O- | (с-1), или | |
| -СН=СН-СН=СН- | (с-2); |
R8 представляет водород, C1-6алкил, циано, гидроксикарбонил, C1-6алкилоксикарбонил, С1-6алкилкарбонилС1-6алкил, циано-С1-6алкил, С1-6алкилоксикарбонилС1-6алкил, карбоксиС1-6алкил, гидроксиC1-6алкил, аминоС1-6алкил, моно- или ди(C1-6алкил)аминоС1-6алкил, имидазолил, галогенС1-6алкил, С1-6алкилоксиС1-6алкил, аминокарбонилC1-6алкил или радикал формулы
| -O-R10 | (b-1), | |
| -S-R10 | (b-2), | |
| -N-R11R12 | (b-3), |
где R10 представляет водород, С1-6алкил, C1-6алкилкарбонил, Аr1, Аr2C1-6алкил, C1-6алкилоксикарбонил
С1-6алкил или радикал формулы -Alk2-OR13, или -Alk2-NR14R15;
R11 представляет водород, С1-12алкил, Аr1 или Аr2C1-6алкил;
R12 представляет водород, C1-6алкил, С1-16алкилкарбонил, C1-6алкилоксикарбонил,C1-6алкиламинокарбонил, Аr1, Ar2C1-6aлкил, C1-6алкилкарбонилС1-6алкил, остаток природной аминокислоты, Аr1карбонил, Ar2C1-6aлкилкapбoнил, аминокарбонилкарбонил, С1-6алкилоксиС1-6 алкилкарбонил, гидрокси, C1-6алкилокси, аминокарбонил, ди(С1-6алкил)аминоС1-6алкилкарбонил, амино, C1-6алкиламино, C1-6 алкилкарбониламино или радикал формулы -Alk2-OR13 или -Аlk2-NR14R15;
где -Alk2 обозначает C1-6алкандиил;
R13 представляет водород, C1-6алкил, C1-6алкилкарбонил, гидроксиС1-6 алкил, Аr1 или Ar2C1-6aлкил;
R14 представляет вюдород, C1-6алкил, Аr1 или Аr2C1-6алкил;
R15 представляет водород, C1-6алкил, C1-6алкилкарбонил, Аr1 или Ar2C1-6aлкил;
R17 представляет водород, галоген, циано, C1-6алкил, C1-6алкилоксикарбонил, Аr1;
R18 представляет водород, C1-6алкил, C1-6алкилокси или галоген;
R19 представляет водород или C1-6алкил;
Аr1 представляет фенил или фенил, замещенный C1-6алкилом, гидрокси, амино, C1-6алкилокси или галогеном; и Аr2 представляет фенил или фенил, замещенный C1-6алкилом, гидрокси, амино, C1-6алкилокси или галогеном.
2. Соединение по п.1, где Х представляет кислород.
3. Соединение по п.1 или 2, где пунктирная линия обозначает связь.
4. Соединение по пп.1,2 или 3, где R1 представляет водород, C1-6 алкил, С1-6алкилоксиС1-6алкил или моно- или ди(C1-6алкил)аминоС1-6 алкил.
5. Соединение по любому из пп.1-4, где R3 представляет водород и R2 представляет галоген, C1-6алкил, C2-6алкенил, C1-6 алкилокси, тригалогенметокси или гидроксиС1-6алкилокси.
6. Соединение по любому из пп.1-5, где R8 представляет водород, гидрокёш, галогенС1-6алкил, гидроксиС1-6алкил, цианоС1-6 алкил, С1-6алкилоксикарбонилС1-6алкил, имидазолил или радикал формулы -NR11R12, где R11 представляет водород или С1-12алкил и R12 представляет водород, C1-6алкил, C1-6алкилокси, С1-6алкилоксиС1-6алкилкарбонил, гидрокси или радикал формулы -Alk2-OR13, где R13 представляет водород или C1-6алкил.
7. Соединение по п.1, которое представляет собой
4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метил-1Н-имидазол-5-ил)метил]-1-метил-2(1Н)-хинолинон;
6-[амино(4-хлорфенил)-1-метил-1Н-имидазол-5-илметил]-4-(3-хлорфенил)-1-метил-2(1Н)-хинолинон;
6-[(4-хлорфенил)гидрокси(1-метил-1Н-имидазол-5-ил)метил]-4-(3-этоксифенил)-1-метил-2(1Н)-хинолинон;
моногидрат моногидрохлорида 6-[(4-хлорфенил)-(1-метил-1Н-имидазол-5-ил)метил]-4-(3-этоксифенил)-1-метил-2(1Н)-хинолинона;
6-[амино(4-хлорфенил)(1-метил-1H-имидазол-5-ил)метил]-4-(3-этоксифенил)-1-метил-2(1Н)-хинолинон; и
6-[амино(4-хлорфенил)(1-метил-1Н-имидазол-5-ил)метил]-1-метил-4-(3-пропилфенил)-2(1Н)-хинолинон; его стереоизомерная форма или фармацевтически приемлемая кислотно-аддитивная или основно-аддитивная соль.
8. Соединение по п.7, где указанным соединением является (В)-6-[амино(4-хлорфенил)(1-метил-1Н-имидазол-5-ил)-метил]-4-(3-хлорфенил)-1-метил-2(1Н)-хинолинон; или его фармацевтически приемлемая кислотно-аддитивная соль.
9. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по пп.1-8.
10. Способ получения фармацевтической композиции по п.9, отличающийся тем, что терапевтически эффективное количество соединения по пп.1-8 тщательно перемешивают с фармацевтически приемлемым носителем.
11. Применение соединения по любому из пп.1-8 в качестве лекарственного средства.
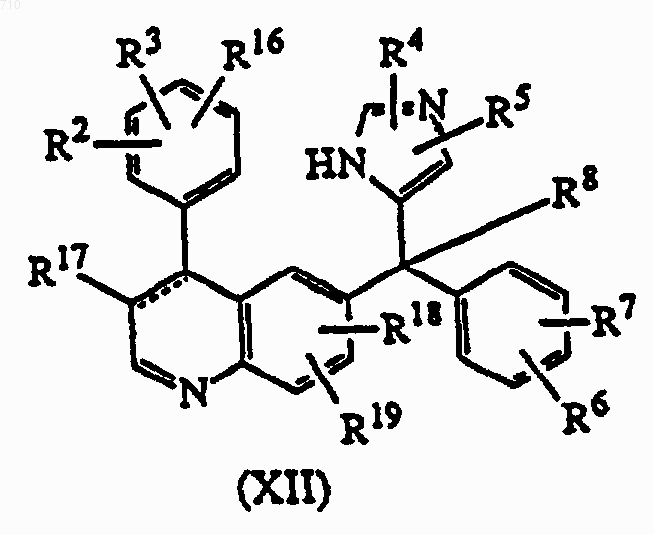
12. Соединение формулы (XII), где радикалы R2, R3, R4, R5, R6, R7, R8, R16, R17, R18 и R19 такие, как определены в п.1; его стереоизомерная форма или фармацевтически приемлемая кислотно- или основно-аддитивная соль.
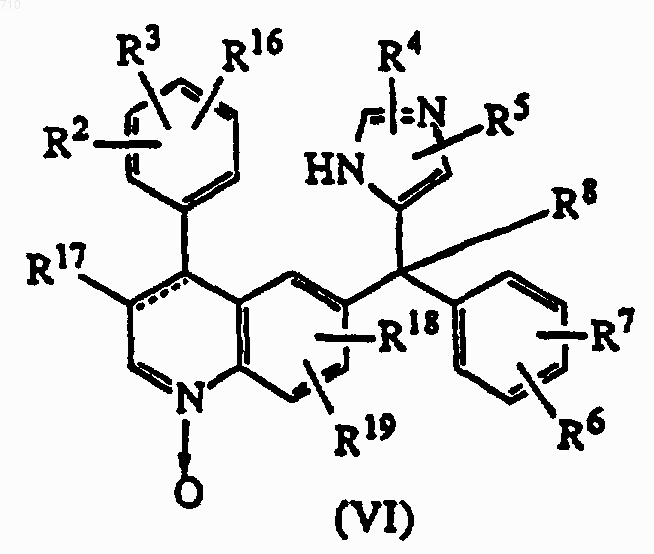
13. Соединения формулы (VI), где радикалы R2, R3, R4, R5, R6, R7, R8, R16, R17, R18 и R19 такие, как определены в п.1; его стереоизомерная форма или фармацевтически приемлемая кислотно- или основно-аддитивная соль.
14. Способ получения соединения общей формулы (I) по п.1, отличающийся тем, что
а) гидролизуют промежуточный эфир формулы (II), где R представляет C1-6алкил, в кислом водном растворе, получают соединение формулы (I-а), где R1 представляет водород; и, необязательно, соединение формулы (I-а), где R1 представляет водород, подвергают N-алкилированию в соединение формулы (I-а), где R1 имеет значения, указанные в п.1, кроме водорода.
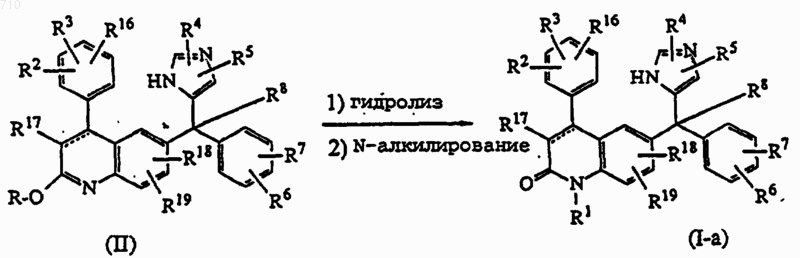
15. Способ по п.14, отличающийся тем, что в качестве кислоты используют соляную кислоту.
16. Способ получения соединений общей формулы (I), отличающийся тем, что промежуточный кетон формулы (III) подвергают взаимодействию с промежуточным соединением формулы (IV-a), где Р представляет необязательную защитную группу, которую удаляют после реакции присоединения, в присутствии подходящего сильного основания в соответствующем растворителе, и получают соединение формулы (I-b);
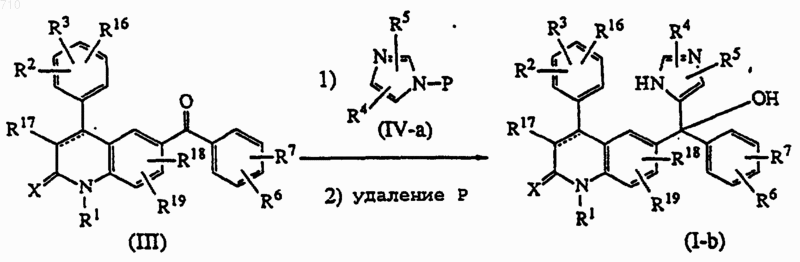
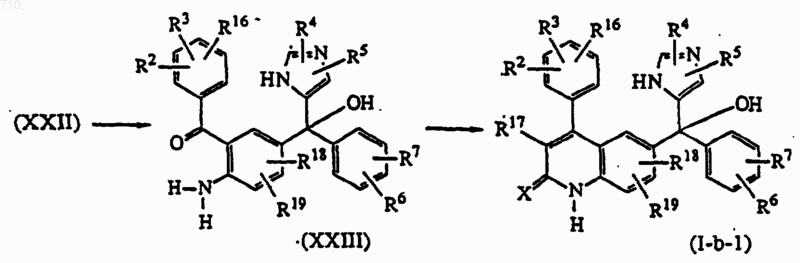
17. Способ получения соединений общей формулы (I) по п.1, отличающийся тем, что промежуточное соединение формулы (XXI) подвергают взаимодействию с промежуточным соединением формулы (IV-a), где Р представляет необязательную защитную группу, которую удаляют после реакции присоединения, с последующей обработкой кислотой, такой как, например, ТiСl3, в присутствии воды, и полученное таким образом промежуточное соединение формулы (XXIII) подвергают взаимодействию с подходящим реагентом, таким как, например, R17CH2COCl или R17CH2COOC2H5, с последующей необязательной обработкой основанием, таким как, например, трет-бутоксид калия и получают соединение формулы (I-b-1),
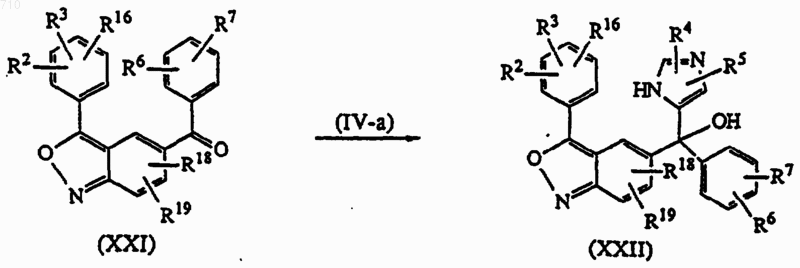
18. Способ получения соединений общей формулы (I) по п.1, отличающийся тем, что промежуточное соединение формулы (XIII), где W представляет подходящую группу, подвергают взаимодействию с реагентом формулы (XIV) в подходящем растворителе, получают соединение формулы (I-g);
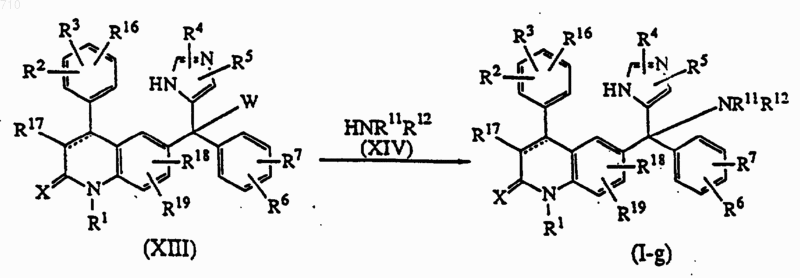
где заместители R1-R16 определены в п.1.
19. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединения формулы (I) преобразуют друг в друга; или соединение формулы (I) преобразуют в его фармацевтически приемлемую кислотно-аддитивную соль, или кислотно-аддитивную соль соединения формулы (I) с помощью щелочи преобразуют в свободное основание; и/или получают его стереохимически изомерные формы.
Текст
1 Настоящее изобретение относится к новым(имидазол-5-ил)-2-хинолиноновым производным, к их получению, к фармацевтическим композициям, содержащим указанные новые соединения, и к применению этих соединений в качестве лекарственных средств, а также к способам лечения путем введения указанных соединений. В большинстве своем онкогены кодируют белковые компоненты каскада трансдукции сигнала, что приводит к стимуляции роста клеток и их митогенезу. Экспрессия онкогенов в культивированных клетках приводит к трансформации клеток, заключающейся в способности этих клеток к росту в мягком агаре и к образованию в процессе их роста очагов плотности,в которых отсутствует контактное торможение,свойственное нетрансформированным клеткам. Мутация и/или сверхэкспрессия некоторых онкогенов часто ассоциируется с раковым заболеванием человека. Конкретная группа онкогенов,известная как ras, была идентифицирована у млекопитающих, птиц, насекомых, моллюсков,растений, грибов и дрожжей. Семейство онкогенов ras млекопитающих состоит из трех основных видов онкогенов (изоформ):H-ras, Kras и N-ras. Эти онкогены ras кодируют в высокой степени генетически родственные белки,известные как p21ras. После связывания с плазматическими мембранами, мутантные или онкогенные формы p21ras продуцируют сигнал для трансформации и неконтролируемого роста злокачественных опухолевых клеток. Для выявления способности к такой трансформации, предшественник p21ras-oнкoпpoтeинa должен быть подвергнут ферментативно катализируемому фарнезилированию цистеинового остатка, расположенного в карбокси-концевом тетрапептиде. Поэтому, ингибиторы фермента, который катализирует такую модификацию, фарнезилпротеин-трансферазы, будут предупреждать связывание p21ras с мембраной и блокировать аномальный рост ras-трансформированных опухолей. Следовательно, как обычно считают специалисты, ингибиторы фарнезилтрансферазы могут быть весьма успешно использованы в качестве противораковых средств для лечения опухолей, трансформация которых была обусловлена онкогеном ras. Поскольку мутированные онкогенные формы ras часто обнаруживаются во многих раковых опухолях человека, а особенно более чем в 50% карцином толстой кишки и поджелудочной железы (Kohl et al., Science, vol 260,1834-1837, 1993), было высказано предположение, что для успешного лечения рака этого типа могут быть использованы ингибиторы фарнезилтрансферазы. В ЕР-0371564 были описаны (1 Н-азол-1 илметил) замещенные хинолиновые и хинолиноновые производные, которые супрессируют элиминирование ретиноевых кислот в плазме. 2 Некоторые из этих соединений также обладают способностью ингибировать образование андрогенов из прогестинов и/или ингибировать действие ароматазного ферментного комплекса. Неожиданно было обнаружено, что все соединения по настоящему изобретению, которые имеют фенильный заместитель в 4-положении 2-хинолинонового радикала, и в которых имидазольный радикал присоединен к остальной молекуле через атом углерода, проявляют фарнезилпротеинтрансферазную ингибирующую активность. Настоящее изобретение относится к соединениям формулы (I) и к их фармацевтически приемлемым кислотноаддитивным или основно-аддитивным солям, а также к их стереохимически изомерным формам, где пунктирная линия означает необязательную связь; Х представляет кислород или серу;R1 представляет водород, C1-12 алкил, Ar1,2 Аr C1-6 алкил, хинолинилС 1-6 алкил, пиридилС 1-6 алкил, гидроксиС 1-6 алкил, С 1-6 алкилоксиС 1-6 алкил, моно- или ди(C1-6 алкил)аминоС 1-6 алкил,аминоС 1-6 алкил, или радикал формулы -Alk1C(=O)-R9, -Alk1-S(O)-R9 или -Alk1-S(O)2-R9, где-Alk1 обозначает C1-6 алкандиил,R9 представляет гидрокси, C1-6 алкил, C1-6 алкилокси, амино, C1-8 алкиламино или С 1-8 алкиламино, замещенный C1-6 алкилоксикарбонилом; каждый из R2, R3 и R16, независимо, представляет водород, гидрокси, галоген, циано, C1-6 алкил, C1-6 алкилокси, гидроксиС 1-6 алкилокси,С 1-6 алкилоксиС 1-6 алкилокси, аминоС 1-6 алкилокси, моно- или ди(С 1-6 алкил)аминоС 1-6 алкилокси,Аr1, Ar2C1-6aлкил, Ar2oкcи, Аr2C1-6 алкилокси,гидроксикарбонил,C1-6 алкилоксикарбонил,тригалогенметил, тригалогенметокси, С 2-6 алкенил, 4,4-диметилоксазолил; или когда R2 и R3, находятся в соседних положениях, взятые вместе они могут образовывать двухвалентный радикал формулы:C1-6 алкилS(О)2C1-6 алкил; каждый из R6 и R7, независимо, представляет водород, галоген, циано, C1-6 алкил, C1-6 алкилокси, Ar2oкcи, тригалогенметил, C1-6 алкилтио, ди (C1-6 алкил) амино, или когда R6 и R7 находятся в соседних положениях, взятые вместе могут образовывать двухвалентный радикал формулы:R12 представляет водород, C1-6 алкил, С 1-16 алкилкарбонил, C1-6 алкилоксикарбонил, C1-6 алкиламинокарбонил, Аr1, Ar2C1-6aлкил, С 1-6 алкилкарбонилС 1-6 алкил, природную аминокислоту, Аr1 карбонил, Ar2C1-6aлкилкapбoнил, аминокарбонилкарбонил, C1-6 алкилокси C1-6 алкилкарбонил, гидрокси, C1-6 алкилокси, аминокарбонил, ди(С 1-6 алкил)аминоС 1-6 алкилкарбонил,амино, C1-6 алкиламино, C1-6 алкилкарбониламино или радикал формулы -Alk2-OR13, илиR19 представляет водород или C1-6 алкил; Аr1 представляет фенил или фенил, замещенный C1-6 алкилом, гидрокси, амино, C1-6 алкилокси или галогеном; и Аr2 представляет фенил или фенил, замещенный C1-6 алкилом, гидрокси, амино, C1-6 алкилокси или галогеном.R4 или R5 могут быть также присоединены к одному из атомов азота в имидазольном кольце. В этом случае водород на азоте заменен R4 или R5, а значения R4 и R5, присоединенных к 4 азоту, ограничены водородом, Аr1, C1-6 алкилом,гидроксиС 1-6 алкилом, С 1-6 алкилоксиС 1-6 алкилом,C1-6 алкилоксикарбонилом,C1-6-алкилS(О)C1-6 алкилом, C1-6 алкилS(О)2 алкилом. Используемый в настоящем описании галоген означает фтор, хлор, бром и йод; C1-6 алкил означает прямые и разветвленные насыщенные углероводородные группы, имеющие от 1 до 6 атомов углерода, такие как, например,метил, этил, пропил, бутил, пентил, гексил и т.п.; C1-8 алкил включает прямые и разветвленные насыщенные углероводородные группы,определенные выше для C1-6 алкила, а также их высшие гомологи, содержащие 7 или 8 атомов углерода, такие как, например, гептил или октил; С 1-12 алкил также включает в себя C1-8 алкил,а также его высшие гомологи, содержащие 9-12 атомов углерода, например, такие как нонил,децил, ундецил, додецил; С 1-16 алкил также включает в себя С 1-12 алкил и его высшие гомологи, содержащие 13-16 атомов углерода, такие как например, тридецил, тетрадецил, пентадецил и гексадецил; С 2-6 алкенил означает прямые или разветвленные углероводородные группы,содержащие одну двойную связь и имеющие от 2 до 6 атомов углерода, например, такие как этенил, 2-пропенил, 3-бутенил, 2-пентенил, 3 пентенил, 3-метил-2-бутенил и тому подобное;C1-6 алкандиил означает бивалентные прямые или разветвленные насыщенные углероводородные группы, имеющие от 1 до 6 атомов углерода, такие как, например, метилен, 1,2 этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5 пентандиил, 1,6-гександиил, и их разветвленные изомеры. Термин "С(=O)" относится к карбонильной группе, "S(O)" относится к сульфоксиду, a S(O)2 к сульфону. Термин природная аминокислота относится к природной аминокислоте, связанной посредством ковалентной амидной связи, образованной путем потери молекулы воды из карбоксильной группы аминокислоты и аминогруппы остатка молекулы. Примерами природных аминокислот являются глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан, серин, треонин, цистеин, тирозин, аспарагин, глутамин, аспарагиновая кислота, глутаминовая кислота, лизин, аргинин и гистидин. Фармацевтически приемлемыми кислотноили основно-аддитивными солями, указанными выше, являются терапевтически активные нетоксичные кислотно-аддитивные и нетоксичные основно-аддитивные соли, которые способны образовывать соединения формулы (I). Соединения формулы (I), обладающие основными свойствами, могут быть преобразованы в их фармацевтически приемлемые кислотноаддитивные соли путем обработки указанной основной формы соответствующей кислотой. Подходящими кислотами являются, например,неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводо 5 родная или бромистоводородная кислота; серная; азотная; фосфорная и тому подобные кислоты; или органические кислоты, такие как,например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая,малоновая, янтарная (то есть бутандионовая кислота), малеиновая, фумаровая, яблочная,винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, паминосалициловая, памовая и тому подобные кислоты. Соединения формулы (I), обладающие свойствами кислот, могут быть образованы в их фармацевтически приемлемые основноаддитивные соли путем обработки указанных кислотных форм соответствующим органическим или неорганическим основанием. Подходящими основными формами солей являются,например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и тому подобное, соли органических оснований, например, бензатиновые, N-метил-D-глюкаминовые, гидрабаминовые соли, и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное. Термины кислотно-аддитивная соль или основно-аддитивная соль также включает гидраты и сольватно-аддитивные формы, которые могут образовывать соединения формулы (I) . Примерами таких форм являются, например,гидраты, алкоголяты и тому подобное. Как здесь используется, термин стереохимически изомерные формы соединений формулы (I) означает все возможные соединения, образованные одними и теми же атомами, связанными в той же последовательности связей, но имеющие разные трехмерные структуры, которые не взаимопревращаемы и которые могут иметь формулу (I) . Если это не оговорено особо, то химическое обозначение соединения включает смесь всех возможных стереохимически изомерных форм, которые может иметь данное соединение. Такая смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений формулы (I) как в чистой форме, так и в смеси с любым другим соединением, входят в объем настоящего изобретения. Некоторые соединения формулы (I) могут также существовать в их таутомерных формах. Хотя такие формы явно не обозначены в вышеуказанной формуле, однако, все эти формы также включены в объем настоящего изобретения. Используемый здесь термин соединения формулы (I) означает также фармацевтически приемлемые кислотно-аддитивные или основноаддитивные соли и все стереоизомерные формы. Предпочтительно, заместитель R18 находится в 5 или 7 положении хинолиноновой час 000710 6 ти, и заместитель R19 находится в 8 положении,в том случае, когда R18 находится в 7 положении. Из этих соединений представляют интерес соединения формулы (I), где Х обозначает кислород. Представляют интерес также такие соединения формулы (I), в которых пунктирная линия обозначает связь, а особенно двойную связь. Другой группой представляющих интерес соединений являются соединения формулы (I),где R1 обозначает водород, C1-6 алкил, С 1-6 алкилоксиС 1-6 алкил, ди (C1-6 алкил) аминоС 1-6 алкил или радикал формулы -Alk1-C(=O)-R9, где Alk1 обозначает метилен, a R9 обозначает С 1-8 алкиламино, замещенный C1-6 алкилоксикарбонилом. Еще одной группой представляющих интерес соединений являются соединения формулы (I), где R3 обозначает водород или галоген; иR2 обозначает галоген, C1-6 алкил, C1-6 алкенил,C1-6 алкилокси, тригалогенметокси или гидроксиС 1-6 алкилокси. Другой группой представляющих интерес соединений являются соединения формулы (I),где R2 и R3 находятся в смежных положениях, и,взятые вместе, образуют бивалентный радикал формулы (а-1), (а-2) или (а-3). Еще одной группой представляющих интерес соединений являются соединения формулы (I), где R5 обозначает водород и R4 обозначает водород или C1-6 алкил. И еще одной группой представляющих интерес соединений являются соединения формулы (I), где R7 обозначает водород; и R6 обозначает C1-6 алкил или галоген, предпочтительно,хлор, особенно, 4-хлор. Конкретной группой соединений являются соединения формулы (I), где R8 обозначает водород, гидрокси, галогенС 1-6 алкил, гидроксиС 1-6 алкил, цианоС 1-6 алкил, С 1-6 алкилоксикарбонилС 1-6 алкил, имидазолил или радикал формулы-NR11R12, где R11 обозначает водород или С 1-12 алкил, и R12 обозначает водород, C1-6 алкил, C1-6 алкилокси, гидрокси, С 1-6 алкилоксиС 1-6 алкилкарбонил или радикал формулы -Alk2-OR13, гдеR13 обозначает водород или C1-6 алкил. Предпочтительными являются соединения,где R1 представляет водород, C1-6 алкил, С 1-6 алкилоксиС 1-6 алкил, ди(C1-6 алкил)аминоС 1-6 алкил или радикал формулы -Alk1-C(=O)-R9, где -Alk1 обозначает метилен, и R9 обозначает С 1-8 алкиламино,замещенныйC1-6 алкилоксикарбонилом; R2 представляет галоген, C1-6 алкил, С 2-6 алкенил, C1-6 алкилокси, тригалогенметокси,гидроксиС 1-6 алкилокси или Ar1; R3 представляет водород; R4 представляет метил, присоединенный к азоту в 3-положении имидазола, R5 представляет водород, R6 представляет хлор; R7 представляет водород; R8 представляет водород,гидрокси, галогенС 1-6 алкил, гидроксиС 1-6-алкил,цианоС 1-6 алкил, С 1-6 алкилоксикарбонилС 1-6 алкил, имидазолил или радикал формулы-NR13R12, где R11 представляет водород или С 1-12 алкил, и R12 представляет водород, C1-6 алкил,C1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилкарбонил или радикал формулы -Alk2-OR13, где R13 представляет C1-6 алкил; R17 представляет водород иR18 представляет водород. Наиболее предпочтительными соединениями являются: 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1 Н)хинолинон; 6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-1-метил-4-(3-пропилфенил)2(1 Н)-хинолинон; их стереоизомерная форма или фармацевтически приемлемая кислотноаддитивная или основно-аддитивная соль; и(В)-6-[амино(4-хлорфенил)(1-метил-1 Нимидазол-5-ил)-метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинон; или их фармацевтически приемлемая кислотно-аддитивная соль. Соединения формулы (I), где Х представляет кислород, указанные соединения представлены формулой (1-а), могут быть получены путем гидролиза промежуточного эфира формулы(II), где R представляет C1-6 алкил, известными способами, таким как перемешивание промежуточного соединения формулы (II) в кислом водном растворе. Подходящей кислотой является,например, хлористоводородная кислота. Затем полученный хинолинон, где R1 представляет водород, может быть образован известным методом N-алкилирования в хинолинон, где R1 является таким, как указано выше, за исключением водорода. Соединения формулы (I), где R8 представляет гидрокси, указанные соединения относятся к соединениям формулы (I-b), могут быть получены путем взаимодействия промежуточного кетона формулы (III) с промежуточным соединением формулы (IV-a), где Р обозначает необязательную защитную группу, такую как, например, сульфонильную группу, например, диметиламиносульфонильную группу, которая может быть удалена после реакции присоединения. 8 Указанная реакция требует присутствия подходящего сильного основания, такого как, например бутиллитий, в соответствующем растворителе, таком как, например, тетрагидрофуран, и присутствия соответствующего силанового производного, такого как, например, триэтилхлорсилан. В процессе обработки промежуточное силановое производное гидролизуется. Могут быть также использованы другие процессы защитными группами, аналогичными силановым производным. Соединения формулы (I-b-1), являющиеся соединениями формулы (I-b), где пунктирная линия обозначает связь и R1 обозначает водород, могут быть получены путем взаимодействия промежуточного соединения формулы(IV-a), как описано выше для синтеза соединений формулы (1-b). Полученное таким образом промежуточное соединение формулы (XXII) подвергают реакции размыкания кольца изоксазолового радикала путем перемешивания с кислотой, такой как ТiСl3, в присутствии воды. Последующая обработка промежуточного соединения формулы (XXIII) подходящим реагентом, таким как, например, R17CH2COCl илиR17CH2COOC2H5, дает либо сразу соединение формулы (I-b-1), либо промежуточное соединение, которое может быть образовано в соединение формулы (I-b-1) путем обработки основанием, таким как, например, трет-бутоксид калия.(XXI) могут быть легко получены путем обработки промежуточного соединения формулы(XVI), описанного выше, в кислых условиях. Соединения формулы (I), где R8 представляет радикал формулы -N-R11R12, указанные соединения представлены формулой (I-g), могут быть получены путем взаимодействия промежуточного соединения формулы (XIII), где W обозначает соответствующую уходящую группу,такую как, например, галоген, с реагентом формулы (XIV). Указанная реакция может быть осуществлена путем перемешивания реагентов в Соединения формулы (I) могут быть также получены путем преобразования соединений формулы (I) в другие соединения формулы (I). Соединения, где пунктирная линия означает связь, могут быть преобразованы в соединения, где пунктирная линия не обозначает связь,известными методами гидрирования. И, наоборот, соединения, в которых пунктирная линия не обозначает связь, могут быть преобразованы в соединения, где пунктирная линия обозначает связь, известными методами окисления. Соединения формулы (I), где R8 обозначает гидрокси, указанные соединения представлены формулой (I-b), могут быть преобразованы в соединения формулы (I-с), где R8a имеет те же значения, что и R10, за исключением водорода,могут быть получены известными методами Oалкилирования или O-ацилирования; такими как, например, взаимодействие соединения формулы (I-b) с алкилирующим агентом, таким как R8a-W, в соответствующих условиях, например, в диполярном апротонном растворителе, таком как ДМФ, в присутствии основания,например, гидрида натрия. W обозначает подходящую удаляемую группу, такую как, например, галоген или сульфонильная группа. В качестве альтернативы вышеуказанному реакционному методу, соединение формулы (Iс) может быть также получено путем взаимодействия промежуточного соединения формулы(I-b) с реагентом формулы R8a-OH в кислых условиях. Соединения формулы (I-b) могут быть также преобразованы в соединения формулы (Ig) где R11 представляет водород, R12 представляет С 1-16 алкилкарбонил, путем взаимодействия соединений формулы (I-b) в кислой среде, такой как серная кислота, с C1-16 алкил-CN по реакции типа Риттера. Кроме того, соединения формулы(I-b) могут быть также преобразованы в соединения формулы (I-g), где R11 и R12 представляют водород путем взаимодействия соединений (I-b) с ацетатом аммония и последующей обработкойNН 3 (водн.). Соединения формулы (I-b) могут быть также преобразованы в соединения формулы (Id), где R8 представляет водород, помещая со 000710 10 единения формулы (I-b) в соответствующие условия для восстановления, такие как, перемешивание в трифторуксусной кислоте в присутствии подходящего восстановителя, такого как,боргидрид натрия или, альтернативно, перемешивание соединений формулы (I-b) в уксусной кислоте в присутствии формамида. Кроме того,соединения формулы (I-d), где R8 представляет водород, могут быть преобразованы в соединения формулы (I-е), где R8b представляет C16 алкил, путем взаимодействия соединений формулы (I-d) с реагентом формулы (V) в подходящем растворителе, таком как, например, диглим, в присутствии основания, такого как, например, бутоксид калия. Соединение формулы (I-f), определенное как соединение формулы (I), где Х представляет серу, может быть получено путем взаимодействия соответствующего соединения формулы (Iа) с реагентом типа пентасульфида фосфора или реагента Лавессона в подходящем растворителе,таком как, например, пиридин. Соединения формулы (I), где R1 представляет водород и Х представляет кислород, указанные соединения определены как соединения формулы (I-а-1), могут быть получены путем взаимодействия нитрона формулы (VI) с ангидридом карбоновой кислоты, таким как, например, уксусный ангидрид, с образованием, таким образом, соответствующего сложного эфира по 2-положению хинолинового радикала. Этот сложный эфир хинолина может быть гидролизован in situ в соответствующий хинолинон с использованием основания, такого как, например, карбонат калия. Альтернативно, соединения формулы (I-а 1) могут быть получены путем взаимодействия нитрона формулы (VI) с сульфонилсодержащим электрофильным реагентом, таким как, например, п-толуолсульфонилхлорид, в присутствии основания, такого как, например, водный карбонат калия. Взаимодействие сначала включает образование 2-гидроксихинолинового производного, которое затем таутомеризуют до же 11 лаемого хинолинонового производного. Использование известных условий межфазного катализа может повысить скорость реакции. Соединения формулы (I-а-1) могут быть также получены путем внутримолекулярной фотохимической перегруппировки соединений формулы (VI). Такая перегруппировка может быть осуществлена путем растворения реагентов в реакционно-инертном растворителе и воздействия излучением длиной волны 366 нм. С целью сведения к минимуму нежелательных побочных реакций или снижения квантового выхода, удобно использовать дегазированные растворы и проводить реакцию в инертной атмосфере, такой как, например, в атмосфере газа аргона или азота, не содержащего кислород. Соединения формулы (I) могут быть также преобразованы друг в друга известными реакциями или преобразованиями функциональных групп. Ряд таких преобразований был уже описан выше. Другими примерами являются гидролиз карбоновых сложных эфиров до соответствующей карбоновой кислоты или спирта; гидролиз амидов до соответствующих карбоновых кислот или аминов; гидролиз нитрилов до соответствующих амидов; аминогруппы на имидазоле или фениле могут быть замещены водородом путем известных реакций диазотирования и последующей заменой диазогрупп водородом; спирты могут быть преобразованы в сложные и простые эфиры; первичные амины могут быть преобразованы во вторичные или третичные амины; двойные связи могут быть гидрированы до соответствующей одинарной связи. Промежуточные соединения формулы (III) могут быть получены путем взаимодействия хинолинонового производного формулы (VIII) с промежуточным соединением формулы (IX) или его функциональным производным в подходящих условиях, таких как, например, сильная кислота, например, полифосфорная кислота в подходящем растворителе. Промежуточное соединение формулы (VIII) может быть образовано циклизацией промежуточного соединения формулы (VII) при перемешивании в присутствии сильной кислоты, например, полифосфорной кислоты. Указанная реакция циклизации необязательно может сопровождаться стадией окисления, которая может быть проведена путем перемешивания промежуточного соединения, образовавшегося после циклизации, в подходящем растворителе, таком как, например,галогенированный ароматический растворитель,например, бромбензол, в присутствии окислителя, например, бром или йод. На этой стадии,может быть также подходящим замена замести 000710 12 теля R1 путем хорошо известной реакции преобразования функциональных групп. Промежуточные соединения формулы (IIIа-1), являющиеся промежуточными соединениями формулы (III), где пунктирная линия обозначает связь R1 и R17 представляют водород и Х представляет кислород, могут быть получены исходя из промежуточного соединения формулы (XVII), которое может быть легко получено путем защиты соответствующего кетона. Указанное промежуточное соединение формулы(XVII) перемешивают с промежуточным соединением формулы (XVIII) в присутствии основания, такого, как гидроксид натрия, в соответствующем растворителе, таком как спирт, например, метанол. Полученное таким образом промежуточное соединение формулы (XVI) подвергают гидролизу кеталя и размыканию кольца изоксазолового радикала путем перемешивания промежуточного соединения формулы (XVI)с кислотой, такой как, например, ТiСl3, в присутствии воды. Затем используют уксусный ангидрид для получения промежуточного соединения формулы (XV), которое подвергают реакции замыкания кольца в присутствии основания,такого как, например, трет-бутоксид калия. Промежуточные соединения формулы (IIIa-1) могут быть легко преобразованы в промежуточные соединения формулы (III-a), указанные как промежуточные соединения формулы(III), где пунктирная линия обозначает связь, Х представляет кислород, R17 представляет водород и R1 является иным, чем водород, с использованием известных методов N-алкилирования. 13 Альтернативный путь получения промежуточных соединений формулы (III-a-1), где Х представляет кислород и R1 представляет водород, исходит из промежуточного соединения формулы (XVI), которое легко преобразуют в промежуточные соединения формулы (XIX),используя условия каталитического гидрирования, например, используя газообразный водород и палладий-на-угле в реакционно-инертном растворителе, таком как, например, тетрагидрофуран. Промежуточные соединения формулы(XIX) преобразуют в промежуточные соединения формулы (XX), подвергая промежуточные соединения (XIX) реакции ацилирования, например, путем обработки ангидридом карбоновой кислоты, например, уксусным ангидридом в реакционно-инертном растворителе, например,толуоле и последующей обработки основанием,таким как, например, трет-бутоксид калия в реакционно-инертном растворителе, например, в 1,2-диметоксиэтане. Промежуточные соединения формулы (III-a-1) могут быть получены путем обработки промежуточных соединений формулы (XX) в кислых условиях. Промежуточные соединения формулы (II) могут быть получены путем взаимодействия промежуточного соединения формулы (X), гдеW является подходящей удаляемой группой,такой как, например, галоген, с промежуточным кетоном формулы (XI). Эту реакцию осуществляют путем преобразования промежуточного соединения формулы (X) в металлорганическое соединение путем его перемешивания с сильным основанием, таким как бутиллитий, и последующим добавлением промежуточного кетона формулы (XI). Хотя эта реакция дает сначала гидроксипроизводное (т.е., R8 представляет гидрокси), указанное гидроксипроизводное может быть преобразовано в другие промежуточные соединения, где R8 имеет другое определение, путем осуществления известных преобразований (функциональных групп). Промежуточные нитроны формулы (VI) могут быть получены путем N-окисления хинолиновых производных формулы (XII) соответствующим окислителем, таким как, например,м-хлорпероксибензойная кислота или H2O2, в подходящем растворителе, таком как, например,дихлорметан. Указанное N-окисление может быть также проведено при использовании предшественника хинолина формулы (XII). Предполагают, что промежуточные соединения формулы (XII) подвергаются метаболизму in vivo в соединения формулы (I) через промежуточные соединения формулы (VI). Поэтому промежуточные соединения формул (XII) и(VI) могут действовать как пролекарства соединений формулы (I). Соединения формулы (I) и некоторые промежуточные соединения имеют в своей структуре, по крайней мере, один стерический центр. Этот стерический центр может иметь R- или Sконфигурацию. Соединения формулы (I), полученные по способам, описанным выше, являются, обычно,рацемическими смесями энантиомеров, которые могут быть отделены один от другого известными методами. Рацемические соединения формулы (I) могут быть преобразованы в соответствующие формы диастереомерных солей путем взаимодействия с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, путем селективной или фракционной кристаллизации, и энантиомеры выделяют с помощью щелочи. Альтернативный метод разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных соединений, при условии,что эта реакция протекает стереоизбирательно. В случае, если желательно получить конкретный стереоизомер, указанное соединение, предпочтительно, синтезировать путем стереоселективных способов синтеза. Такие способы предусматривают преимущественно использование энантиомерно чистых исходных соединений. Настоящее изобретение относится к способу ингибирования аномального роста клеток,включая трансформированные клетки, путем введения эффективного количества соединения по настоящему изобретению. Под аномальным ростом клеток подразумевается рост клеток,независимый от нормальных механизмов регулирования (например, утрата контактного ингибирования). Это включает аномальный рост: (1) опухолевых клеток (опухолей), экспрессирующих активированный онкоген ras; (2) опухолевых клеток, в которых ras-белок активируется в результате онкогенной мутации другого гена;(3) доброкачественных и злокачественных клеток, связанных с другими пролиферативными нарушениями, в которых происходит аберрантная активация ras. Кроме того, в литературе было высказано предположение, что онкогены ras вносят свой вклад в рост опухолей in vivo не только посредством прямого воздействия на рост опухолевых клеток, но также и опосредованно, то есть путем содействия опухольиндуцированному ангиогенезу (Rak J. et al.,Cancer Research, 55, 4575-4580, 1995). Поэтому,мутантные онкогены ras, являющиеся фармакологическими мишенями, должны, предположительно, подавлять рост твердых опухолей invivo, частично, путем ингибирования опухольиндуцированного ангиогенеза. Настоящее изобретение также относится к способу ингибирования опухолевого роста путем введения эффективного количества соединения по настоящему изобретению субъекту,например, животному (и, более предпочтительно, человеку), нуждающемуся в таком введении. В частности, настоящее изобретение относится к способу ингибирования роста опухолей, экспрессирующих активированный онкоген ras,предусматривающему введение эффективного количества соединений по настоящему изобретению. Примерами опухолей, которые могут быть ингибированы, являются, но не ограничиваются ими, рак легкого (например, аденокарцинома), рак поджелудочной железы (например,карцинома поджелудочной железы, такая как,например, экзокринная карцинома поджелудочной железы), рак толстой кишки (такой как, например, колоректальные карциномы, такие как,например, аденокарцинома толстой кишки и аденома толстой кишки), гемопоэтические опухоли лимфоидной линии дифференцировки (например, острый лимфоцитарный лейкоз, Вклеточная лимфома, лимфома Беркитта), миелоидный лейкоз (например, острый миелоидный лейкоз (ОМЛ), фолликулярный рак щитовидной железы, миелодиспластический синдром (МСС),опухоли мезенхимального происхождения (например, фибросаркомы и рабдомиосаркомы),меланомы, тератокарциномы, нейробластомы,глиомы, доброкачественные опухоли кожи (например, кератоакантомы), карцинома молочной железы, карцинома почек, карцинома яичника,карцинома мочевого пузыря и эпидермальная карцинома. Настоящее изобретение может также включать способ ингибирования пролиферативных заболеваний, как доброкачественных, так и злокачественных, при которых ras-белки аберрантно активируются в результате онкогенной мутации генов, то есть сам по себе ген ras не активируется путем мутации по типу онкогенной мутации с образованием онкогенной формы, где указанное ингибирование осуществляют путем введения эффективного количества со 000710 16 единений, описанных выше, индивидууму, нуждающемуся в таком введении. Например, доброкачественное пролиферативное заболевание нейрофиброматоз, или опухоли, в которых ras активируется благодаря мутации или сверхэкспрессии онкогенов тирозинкиназы, могут быть ингибированы соединениями настоящего изобретения. Поэтому, настоящее изобретение относится к соединениям формулы (I), которые могут быть использованы в качестве лекарственных средств, а также к использованию этих соединений формулы (I) для изготовления лекарственных средств для лечения одного или нескольких из вышеуказанных состояний. Некоторые из промежуточных соединений формулы (XIII), где W представляет галоген,могут также обладать активностью, ингибирующей фарнезилпротеин-трансферазу. Так, как соединения настоящего изобретения обладают ценными фармакологическими свойствами, они могут быть включены в различные фармацевтические препараты для введения. Для получения фармацевтических композиций по настоящему изобретению, эффективное количество конкретного соединения в его основно- или кислотно-аддитивной соли, в виде активного ингредиента, тщательно смешивают с фармацевтически приемлемым носителем, который может быть использован в широком разнообразии форм в зависимости от формы препарата, предпочитаемой для введения. Эти фармацевтические композиции, предпочтительно, представляют собой стандартную лекарственную форму, подходящую для перорального, ректального, чрескожного введения или путем парентеральной инъекции. Например, при получении композиций для перорального стандартного препарата в случае жидких препаратов, таких как, например, суспензии, сиропы,эликсиры и растворы, может быть использована любая подходящая среда, такая как, например,вода, гликоли, масла, спирты и т.п.; а в случае порошков, пилюль, капсул и таблеток могут быть использованы твердые носители, такие как крахмал, сахар, каолин, смазывающие агенты,связующие вещества, разрыхлители и т.п. Благодаря легкости их введения, таблетки и капсулы являются наиболее предпочтительными пероральными стандартными лекарственными формами, в которых обычно используют твердые фармацевтические носители. В парентеральных композициях носитель обычно содержит стерильную воду, которая составляет, по крайней мере, большую часть, хотя, например,для повышения растворимости могут быть также включены и другие ингредиенты. Например,могут быть получены растворы для инъекций в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также получены суспензии для инъекций, 17 в которых могут быть использованы соответствующие жидкие носители, суспендирующие агенты и т.п. В композициях, предназначенных для чрескожного введения, носитель необязательно содержит агент, усиливающий проницаемость, и/или подходящий смачивающий агент, необязательно вместе с подходящими добавками любой природы, взятыми в малых количествах, и не оказывающих неблагоприятного воздействия на кожу. Указанные добавки могут облегчать введение лекарственного средства в кожу и/или могут быть полезными для получения желаемых композиций. Эти композиции могут быть введены различными путями,например, в виде пластыря для чрескожного введения, в виде локального нанесения на кожу или в виде мази. Особенно предпочтительно,чтобы вышеуказанные фармацевтические композиции были изготовлены в виде стандартной лекарственной формы для облегчения введения лекарственного средства и унификации доз. Используемый в настоящем описании, а также в формуле изобретения термин стандартная лекарственная форма относится к физически дробимым единицам, подходящим для введения в виде однократных доз, при этом каждая содержит предварительно определенное количество активного ингредиента, которое в сочетании с соответствующим фармацевтическим носителем продуцирует желаемый терапевтический эффект. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечками или таблетки с покрытием),капсулы, пилюли, порошки, тампоны, облатки,растворы или суспензии для инъекций и готовые дозы, соответствующие чайной и столовой ложке, и т.п., а также их отдельные дробные дозы. Исходя из результатов проведенных испытаний, представленных ниже, каждый специалист может легко определить эффективное количество активного ингредиента. Обычно предполагается, что эффективное количество должно составлять от 0,0001 мг/кг до 100 мг/кг веса тела, и, в частности, от 0,001 мг/кг до 10 мг/кг веса тела. При этом, может оказаться предпочтительным вводить эту дозу в виде двух, трех,четырех или большей кратности субдоз в течение суток с соответствующими интервалами времени. Указанные субдозы могут быть изготовлены в виде стандартных лекарственных форм, содержащих, например, 0,01 - 500 мг, и, в частности, 0,1 - 200 мг активного ингредиента на одну стандартную лекарственную форму. Экспериментальная часть Используемые ниже ТГФ обозначают тетрагидрофуран, ДИПЭ обозначает диизопропиловый эфир, ДХМ обозначает дихлорметан, ДМФ обозначает N,N-диметилформамид и АЦН обозначает ацетонитрил. У некоторых соединений формулы (I) абсолютную стереохимическую конфигурацию эксперимен 000710 18 тально не определяли. В этих случаях стереохимически изомерную форму, которая была выделена первой, обозначали как А, а вторую как В, без какого-либо дополнительного указания на реальную стереохимическую конфигурацию. А. Получение промежуточных соединений. Пример А.1. 1a) N-Фенил-3-(3-хлорфенил)-2-пропенамид (58,6 г) и полифосфорную кислоту (580 г) перемешивали в течение ночи при 100 С. Продукт использовали без дополнительной очистки,выход количественный. -4-(3-хлорфенил)-3,4 дигидро-2(1 Н)-хинолинон (пром. соед. 1-а). 1b) Промежуточное соединение (1-а) (58,6 г), 4-хлорбензойную кислоту (71,2 г) и полифосфорную кислоту (580 г) перемешивали в течение 48 ч при 140 С. Эту смесь выливали в ледяную воду и отфильтровывали. Осадок промывали водой, затем разбавленным растворомNH4 ОH и обрабатывали в ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле(элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 99/1/0,1). Чистые фракции собирали и выпаривали, а затем перекристаллизовывали из СН 2 Сl2/СН 3 ОН/ДИПЭ с получением 2,2 г -6-(4-хлорбензоил)-4-(3 хлорфенил)-3,4-дигидро-2(1 Н)-хинолинона(пром. соед. 1-b, т.пл.194,8 С). 1 с) Бром (3,4 мл) в бромбензоле (80 мл) при комнатной температуре по каплям добавляли к раствору промежуточного соединения (1-b)(26 г) в бромбензоле (250 мл) и смесь перемешивали в течение ночи при 160 С. Эту смесь охлаждали до комнатной температуры и подщелачивали NH4OH. Смесь упаривали, остаток обрабатывали АЦН и отфильтровывали. Осадок промывали водой и сушили на воздухе с получением 24 г (92,7%) продукта. Образец перекристаллизовывали из СН 2 Сl2/СН 3 ОН/ДИПЭ с получением 2,8 г 6-(4-хлорбензоил)-4-(3-хлорфенил)-2(1 Н)-хинолинона, т.пл. 234,8 С (пром. соед. 1-с). 1d) Иодметан (6,2 мл) добавляли к смеси промежуточного соединения (1-с) (20 г) и хлорида бензилтриэтиламмония (5,7 г) в тетрагидрофуране (200 мл) и гидроксиде натрия (10 н)(200 мл) и смесь перемешивали при комнатной температуре в течение ночи. После добавления этилацетата, смесь декантировали. Органический слой промывали водой, сушили (MgSO4),отфильтровывали и выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99,75/ 0,25/0,1). Чистые фракции собирали и выпаривали с получением 12,3 г (75%) 6-(4 хлорбензоил)-4-(3-хлорфенил)-1-метил-2(1 Н)хинолинона/ т.пл.154,7 С (пром. соед. 1-d).-6-(4-Хлорбензоил)-4-(3-хлорфенил)3,4-дигидро-1-метил-2(1 Н)-хинолинон (Промежуточное соединение 1-е) получали аналогич 19 ным способом, за исключением того, что использовали промежуточное соединение (1-b). Пример А.2. Бутиллитий в гексане (1,6 М) (12,75 мл) при -20 С в атмосфере N2 по каплям добавляли к раствору 6-бром-4-(3-хлорфенил)-2-метоксихинолина (6,7 г) в ТГФ (60 мл), и полученную смесь перемешивали при -20 С в течение 30 мин. Затем добавляли раствор (1-бутил-1 Нимидазол-5-ил)(4-хлорфенил)метанона (3,35 г) в тетрагидрофуране (30 мл) при -20 С в атмосфере N2, и смесь перемешивали при комнатной температуре в течение одной ночи. После добавления воды, смесь экстрагировали этилацетатом. Органический слой сушили (MgSO4),отфильтровывали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 97/3/0,1). Чистые фракции собирали и выпаривали, в результате чего получали 2,5 г (всего 48%) -(1-бутил-1 Н-имидазол-5-ил)-4(3-хлорфенил)- (4-хлорфенил)-2-метокси-6-хинолинметанола)(промежуточное соединение 2). Пример А.3. 3 а) Бутиллитий (30,1 мл) медленно добавляли при -78 С к раствору N,N-диметил-1 Нимидазол-1-сульфонамида (8,4 г) в тетрагидрофуране (150 мл), и смесь перемешивали при-78 С в течение 15 мин. После добавления хлортриэтилсилана (8,1 мл) смесь перемешивали до тех пор, пока температура не достигала 20 С. Полученную смесь охлаждали до -78 С, добавляли бутиллитий (30,1 мл), и смесь перемешивали в течение одного часа при -78 С, а затем оставляли для повышения температуры-15 С. Смесь снова охлаждали до -78 С, добавляли раствор 6-(4-хлорбензоил)-1-метил-4 фенил-2(1 Н)-хинолинона (15 г) в тетрагидрофуране (30 мл), и смесь перемешивали до тех пор,пока температура не достигала 20 С. Смесь гидролизовали и экстрагировали этилацетатом. Органический слой сушили (MgSO4), отфильтровывали и выпаривали досуха. Продукт 26 г(100%) -4-[(4-хлорфенил)(1,2-дигидро-1-метил-2-оксо-4-фенил-6-хинолинил)гидроксиметил]-N,N-диметил-2-(триэтилсилил)-1 Н-имидазол-1-сульфонамида (промежуточное соединение 3-а), использовали без дополнительной очистки. Смесь промежуточного соединения (3-а)(26 г) в серной кислоте (2,5 мл) и воде (250 мл) перемешивали и нагревали при 110 С в течение 2 ч. Смесь выливали на лед, подщелачивалиNH4OH и экстрагировали ДХМ. Органический слой сушили (MgSO4), отфильтровывали и выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/СН 3 ОН/NH4OН 99/1/0,2). Чистые фракции собирали и выпаривали с получением 2,4 г 20 тил]-N,N-диметил-1 Н-имидазол-1-сульфонамида (промежуточное соединение 3-b). Пример А.4. Соединение (3) (3 г) добавляли при комнатной температуре к тионилхлориду (25 мл). Смесь перемешивали и нагревали с обратным холодильником при 40 С в течение ночи. Растворитель выпаривали досуха. Продукт 3,49 г гидрохлорида -4-(3-хлорфенил)-1-метил-6-[1(4-метилфенил)-1-(4-метил-4 Н-пиррол-3 ил)этил]-2(1 Н)-хинолинона(промежуточное соединение 4) использовали без дополнительной очистки. Пример А.5. а) Толуол (1900 мл) перемешивали в круглодонной колбе (5 л) с использованием водоотделителя. Порциями добавляли(4 хлорфенил)(4-нитрофенил)метанон (250 мг). Порциями добавляли п-толуолсульфоновую кислоту (54,5 г). В смесь выливали этиленгликоль (237,5 г). Эту смесь перемешивали и нагревали с обратным холодильником в течение 48 ч. Растворитель выпаривали. Остаток растворяли в этилацетате (5 л) и дважды промывали 10% раствором К 2 СО 3. Органический слой отделяли,сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток перемещали в DIPE, отфильтровывали, сушили (вакуум, 40 С, 24 ч), и получали 265 г (91%) 2-(4-хлорфенил)-2-(4 нитрофенил)-1,3-диоксоланаb) Гидроксид натрия (16,4 г) и (3 метоксифенил)ацетонитрил (20,6 мл) добавляли при комнатной температуре к раствору промежуточного соединения (5-а) (25 г) в метаноле(100), и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду,остаток отфильтровывали, промывали холодным метанолом и сушили. Продукт 30 г (90%) 5-[2-(4-хлорфенил)-1,3-диоксолан-2-ил]-3-(3-метоксифенил)-2,1-бензизоксазола (промежуточное соединение 5-b) использовали без дополнительной очистки.c) Промежуточное соединение (5-b) (30 г) в ТГФ (250 мл) гидрировали в присутствии палладия-на-угле (3 г) как катализатора при комнатной температуре в течение 12 ч под давлением 2,6 х 105 Па в аппарате Парра. После поглощения Н 2 (1 эквивалент) катализатор фильтровали через целит и фильтрат выпаривали досуха. Продукт, 31,2 г (100%) (3-метоксифенил)[2 амино-5-[2-(4-хлорфенил)-1,3-диоксолан-2-ил) фенил]метанона (промежуточное соединение 5 с) использовали без дополнительной очистки.d) Уксусный ангидрид (13,9 мл) добавляли к раствору промежуточного соединения (5-с)(31,2 г) в толуоле (300 мл) и смесь перемешивали и нагревали с обратным холодильником в течение двух часов. Смесь выпаривали досуха и получали 36,4 г (100%) N-[2-(3-метоксибензоил)-4-[2-(4-хлорфенил)-1,3-диоксолан-2-ил] фенил]ацетамида (промежуточного соединения 21 5-d), который использовали без дополнительной очистки. е) Трет-бутоксид калия (33 г) при комнатной температуре порциями добавляли к раствору промежуточного соединения (5-d) (36,4 г) в 1,2-диметоксиэтане (350 мл), и смесь перемешивали при комнатной температуре в течение ночи. Смесь гидролизовали и экстрагировали ДХМ. Органический слой сушили (MgSO4), отфильтровывали и выпаривали досуха. Продукт 43 г 6-[2-(4-хлорфенил)-1/3-диоксолан-2-ил)]-4(3-метоксифенил)-2(1 Н)-хинолинона (промежуточное соединение 5-е) использовали без дополнительной.f) Смесь промежуточного соединения (5-е)(43 г) в НСl (3 н., 400 мл) и метаноле (150 мл) перемешивали и нагревали с обратным холодильником в течение ночи. Смесь охлаждали и отфильтровывали. Осадок промывали водой и диэтиловым эфиром и сушили. Продукт 27 г(94%) 6-(4-хлорбензоил)-4-(3-метоксифенил)2(1 Н)-хинолинона (промежуточное соединение 5-f) использовали без дополнительной очистки.d) Метилиодид (1,58 мл) добавляли к раствору промежуточного соединения (5-f) (7,6 г) и хлорида бензилтриэтиламмония (ВТЕАС) (2,23 г) в ТГФ (80 мл) и гидроксида натрия (40%, 80 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили (МgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: 100% ДХМ). Целевые фракции собирали, растворитель выпаривали с получением 7,1 г (90%) 6-(4-хлорбензоил)-4-(3-метоксифенил)-1-метил 2(1 Н)-хинолинона (промежуточного соединения 5-g). Пример А.6.a) 3-(3-Хлорфенил)-5-[2-(4-хлорфенил)1,3-диоксолан-2-ил]-2,1-бензизоксазол (промежуточное соединение 6-а) был получен аналогично промежуточному соединению (5-b).b) Смесь промежуточного соединения (6-а)(30 г) в 3 н. НСl (220 мл) и метаноле (165 мл) перемешивали в течение 5 ч при 100 С. Смесь выливали на лед и подщелачивали NН 3 (водный). Осадок отфильтровывали, промывали водой и диэтиловым эфиром и сушили с получением 24,9 (93%) (4-хлорфенил)[3-(3-хлорфенил)-2,1-бензизоксазол-5-ил]метанона (промежуточное соединение 6-b). Этот продукт использовали без дополнительной очистки.-70 С. Добавляли хлортриэтилсилан (2,7 мл). Смесь оставляли для нагревания до 15 С и охлаждали до -70 С. Медленно добавляли бутиллитий (10 мл). Смесь перемешивали в течение одного часа при -70 С, давали нагреться до 000710 22 15 С и охлаждали до -70 С. Добавляли раствор промежуточного соединения (6-b) (4,9 г) в ТГФ(60 мл). Смесь перемешивали в течение 30 мин при -70 С, а затем гидролизовали водой, экстрагировали этилацетатом и декантировали. Органический слой сушили (МgSO4), фильтровали, а растворитель выпаривали. Остаток (8,2 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 96/4/0,2) и кристаллизовали из смеси 2-пропанон/диэтиловый эфир. Осадок отфильтровывали и сушили с получением 1,5 г (25%) -3-(3-хлорфенил)-(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)2,1-бензизоксазол-5-метанона (промежуточное соединение 6-с).d) ТiСl3/15% в Н 2 О (200 мл) добавляли при комнатной температуре к раствору промежуточного соединения (6-с) (38 г) в ТГФ (300 мл). Полученную смесь перемешивали при комнатной температуре в течение 90 мин. Смесь выливали на лед, подщелачивали К 2 СО 3, фильтровали через целит, промывали этилацетатом и декантировали. Органический слой сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/(49%) -[2-амино-5-[(4-хлорфенил)гидрокси(1 метил-1 Н-имидазол-5-ил)метил]фенил](3-хлорфенил)метанона (промежуточного соединения 6-d). В. Получение целевых соединений. Пример В.1. 1-Метилимидазол (4,69 мл) в тетрагидрофуране (100 мл) перемешивали при -78 С. Добавляли по каплям раствор бутиллития в гексане (2,5 М) (36,7 мл) и смесь перемешивали в течение 15 мин при -78 С. Добавляли хлортриэтилсилан (9,87 мл) и смесь доводили до комнатной температуры. Смесь охлаждали до-78 С, по каплям добавляли раствор бутиллития в гексане (2,5 М) (36,7 мл) и смесь перемешивали в течение 1 ч при -78 С, и доводили до -15 С. Смесь охлаждали до -78 С, добавляли раствор промежуточного соединения (1-d) (20 г) в ТГФ(40 мл) и смесь доводили до комнатной температуры. Смесь гидролизовали при 0 С и экстрагировали этилацетатом. Органический слой сушили (MgSO4), отфильтровывали и выпаривали досуха с получением 36 г продукта. Продукт очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 97/3/ 0/1). Чистые фракции собирали, выпаривали и кристаллизовали из 2-пропанона, СН 3 ОН и(1-метил-1 Н-имидазол-5-ил)метил]-1-метил 2(1 Н)-хинолинона (соединение 3, т.пл. 233,6 С). Аналогичным способом, но с использованием промежуточного соединения (5-g) или 23 промежуточного соединения (1-е) вместо промежуточного соединения (1-d), были получены,соответственно, -6-[(4-хлорфенил)гидроксиN2, и смесь перемешивали в течение 15 мин. Добавляли иодметан (1,5 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Смесь гидролизовали и экстрагировали диэтиловым эфиром и метанолом. Органический слой сушили (МgSO4), отфильтровывали и выпаривали досуха с получением 4,4 г остатка. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95,5/4,5/0,2). Чистые фракции собирали и выпаривали. Продукт преобразовывали в соль этандиовой кислоты (1:1) в 2-пропаноне и отфильтровывали. Остаток кристаллизовали из 2 пропанона, диэтилового эфира и DIPE. Осадок отфильтровывали, промывали диэтиловым эфиром, сушили и перекристаллизовывали из 2 пропанона, метанола, и DIPE. Осадок отфильтровывали, промывали диэтиловым эфиром и сушили с получением 0,95 г (25%) дигидрата этандиоата (1:1)-4-(3-хлорфенил)-6-[(4 хлорфенил)-метокси(1-метил-1 Н-имидазол-5 ил)метил]-1-метил-2(1 Н)-хинолинона (соединение 4, т.пл. 154,6 С). Пример В.4. Иодметан (0,38 мл) при комнатной температуре добавляли по каплям к раствору соединения (8) (2,44 г) и хлорида N,N,N-триэтилбензолметанаммония (0,54 г) в тетрагидрофуране (30 мл) и гидроксиде натрия (40%) (30 мл). Смесь перемешивали в течение 3 ч при комнатной температуре. Добавляли воду, смесь экстрагировали этилацетатом. Органический слой сушили МgSO4, отфильтровывали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4 ОН 96,5/3,5/0,1). Чистые фракции собирали, выпаривали и кристаллизовали из 2-пропанона иDIPE. Осадок отфильтровывали, промывали диэтиловым эфиром и сушили с получением 1,4(соединение 9,т.пл.174,6 С). Пример В.5. Иодметан (1/4 мл) добавляли к смеси -6[(4-хлорфенил)-1 Н-имидазол-4-илметил]-1-метил-4-фенил-2(1 Н)-хинолинона (7,5 г) и хлорида бензилтриэтиламмония (2 г) в ТГФ (75 мл) и гидроксиде натрия (75 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили (MgSO4),отфильтровывали и упаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюент: СH2 Сl2/СН 3 ОН/NH4 ОН 98,5/1,5/ 0,1). Чистые фракции собирали и выпаривали. Фракцию 1 (3/5 г) перекристаллизовывали из диэтилового эфира и получали 3,3 г (42%) -6[(4-хлорфенил)(1-метил-1 Н-имидазол-4-ил)метил-1-метил-4-фенил-2(1 Н)-хинолинона, т.пл. 149,9 С (соединение 44). Фракцию 2 перекристаллизовывали из 2-пропанона, метанола и диэтилового эфира с получением 1,6 г (20%) -6[(4-хлорфенил)(7,2 г), растворенному в трифторуксусной кислоте (150 мл), и смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали на лед, подщелачивали 3 н. NaOH, концентрировали NaOH и экстрагировали этилацетатом. Органический слой сушили (MgSO4),отфильтровывали и выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН, 95/5). Чистые фракции собирали и выпаривали с получением 4,3 г (62%) фракции 1; 0,2 г (3%) фракции 2; и 2 г (29%) фракции 3. Фракцию 1 преобразовывали в соль этандиовой кислоты (1:1) в 2 пропаноне и диэтиловом эфире. Осадок отфильтровывали, промывали диэтиловым эфиром и сушили с получением 4,7 г (55%) моногидрата этандиоата (1:1) -4-(3-хлорфенил)-6[(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-1-метил-2(1 Н)-хинолинона (соединение 5,т.пл. 157,4 С). Пример В.7. Раствор соединения 90 (4,2 г) в 1,2 диметоксиэтане (70 мл) перемешивали в атмосфере азота в течение 30 мин. Порциями добавляли иодметан (0,83 мл), а затем, трет-бутоксид калия (2 г) и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили (MgSO4), отфильтровывали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: циклогексан/2-пропанол/NН 4OН, 85/5/0,5 - 80/20/1) и-4-(3-хлорфенил)-6-[1-(4-[хлорфенил)-1-(1 метил-1H-имидазол-5-ил)этил]-1-метил-2(1 Н)хинолинона (соединение 12, т.пл. 203,9 С). Аналогичным способом были получены этандиоат (1:1) -6-[2-хлор-1-(4-хлорфенил)-1(1-метил-1 Н-имидазол-5-ил)этил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона (соединение 69) и -6-[2-бром-1-(4-хлорфенил)-1-(1-метил-1 Нимидазол-5-ил)этил]-4-(3-хлорфенил)-1-метил 2(1 Н)-хинолинон (соединение 70), за исключением того, что иодметан заменяли на дихлорметан и дибромметан, соответственно. Пример В.8. а) Соединение 3 (3 г) разделяли (на его энантиомеры) и очищали путем высокоразрешающей жидкостной хроматографии на ChiracelLCl: 99%). (А)-остаток растворяли в 2 пропаноле и преобразовывали в соль этандиовой кислоты (1:1). Осадок отфильтровывали и сушили с получением 0,6 г (17%) этандиоата(1 Н)-хинолинона (1:1); []D20 = + 17,96 (с = 1% в метаноле) (соединение 23). (В)-остаток растворяли в 2-пропаноле и превращали в соль этандиовой кислоты (1:1). Осадок отфильтровывали, сушили и получали 0,6 г (17%) этандиоатаb) Соединение 14 (4 г) разделяли (на его энантиомеры) и очищали хиральной колоночной хроматографией на Chiralcel OD (25 см,элюент: 100% этанол; скорость потока: 0,5 мл/мин; длина волны: 220 нм). Чистые (А)фракции собирали, а растворитель выпаривали. Остаток растворяли в ДХМ (100 мл), фильтровали, и фильтрат выпаривали. Остаток перемешивали в DIPE (100 мл), отфильтровывали и сушили, в результате чего получали 1,3 г (А)-6[амино-(4-хлорфенил)(1-метил-1 Н-имидазол-5 ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона (соед.74). Чистые (В)-фракции собирали и выпаривали. Остаток кристаллизовали из 2-пропанола. Осадок отфильтровывали и получали 1,3 г (В)6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5 ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона, []D20 = +22,86 (с = 49,22 мг/5 мл в метаноле)(соединение 75). 26 Пример В.9. Через раствор соединения (47) (3,6 г) в ТГФ (40 мл) барботировали воздух в течение 30 мин. Добавляли калиевую соль 2-метил-2 пропанола (4,4 г). Смесь перемешивали при комнатной температуре в течение 3 ч, гидролизовали и затем экстрагировали DXM. Органический слой отделяли, сушили (МgSO4), фильтровали и растворитель выпаривали с получением 2,9 г продукта. Продукт очищали колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/СН 3 ОН/NН 4 ОН 97,5/2,5/0,1). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из смеси 2-пропанонаDIPE. Осадок отфильтровывали, сушили и получали 1,3 г (35%) -4-(3-хлорфенил)-6-[(4 хлорфенил)гидрокси(1-метил-1 Н-имидазол-4 ил)метил]-1-метил-2(1 Н)-хинолинона (соединение 48). Пример В.10. Смесь -4-[(4-хлорфенил)(1,2-дигидро-1 метил-2-оксо-4-фенил-6-хинолинил)гидроксиметил]-N,N-диметил-1 Н-имидазол-1-сульфонамида (2,4 г) в соляной кислоте (10 мл), воде (30 мл) и метаноле (15 мл) перемешивали и нагревали при 110 С в течение 14 ч. Полученную смесь охлаждали, подщелачивали NН 3 (водным) и экстрагировали ДХМ. Органический слой сушили (МgSO4), отфильтровывали и выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 95/5/0,2). Чистые фракции собирали и выпаривали. Остаток (1,25 г) кристаллизовали из смеси 2-пропанон/DIРЕ и получали 1 г(48,3%) моногидрата -6-[(4-хлорфенил)гидрокси(1 Н-имидазол-4-ил)метил]-1-метил-4-фенил 2(1 Н)-хинолинона (соединение 43). Пример В.11. Соединение (3) (4 г) растворяли в ДХМ (10 мл) и уксусной кислоте (5,6 мл) при 45 С. Добавляли хлорид цинка (5,5 г), а затем цианоуксусную кислоту (3,5 г). Смесь перемешивали в течение 3 ч при 120 С, а затем в течение 10 ч при 160 С. Добавляли воду и смесь экстрагировали ДХМ. Органический слой промывали 10% К 2 СО 3, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 96/4/0,2), кристаллизовали из смеси 2-пропанон/диизопропиловый эфир, отфильтровывали, сушили и получали 1,95 г (45%) -4-(3-хлорфенил)(4-хлорфенил)-1,2-дигидро-1-метил(1-метил-1 Н-имидазол-5-ил)-2-оксо-6-хинолинпропаннитрила (соединение 25, т.пл. 151,3 С). Пример В.12. К ацетонитрилу (30 мл) при перемешивании по каплям добавляли серную кислоту (1 мл). Добавляли соединение 3 (3 г). Смесь перемешивали в течение 3 ч при 80 С, а затем охлаждали. Добавляли 10% К 2 СО 3 и смесь экстраги 27 ровали этилацетатом. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (3,58 г) растворяли в 2-пропаноне и преобразовывали в соль этандиовой кислоты (1:1). Остаток отфильтровывали, сушили и кристаллизовали из смеси 2-пропанон/СН 3 ОН. Осадок отфильтровывали, сушили и получали 3,5 г (92%) этандиоата (1:1) -N-[(4-хлорфенил)[4-(3-хлорфенил)-1,2-дигидро-1-метил-2-оксо-6-хинолинил](соединение 56). Пример В.13. К смеси промежуточного соединения 4 (7 г) в ТГФ (40 мл) при комнатной температуре добавляли NН 3 (вод.) (40 мл). Смесь перемешивали в течение 1 ч при 80 С, гидролизовали и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: толуол/2-пропанол/NН 4OН, 80/20/1). Чистые фракции собирали, растворитель выпаривали и получали 4,4 г -6-[амино(4-хлорфенил)(1 метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона(соединение 14). Пример В.14. Раствор соединения 36 (6,2 г) в ДХМ (140 мл) охлаждали и по каплям добавляли трибромборан (32 мл). Смесь перемешивали в течение двух дней при комнатной температуре. Смесь выливали в ледяную воду, подщелачивали NН 3(водный) и экстрагировали CH2Cl2/CH3OH. Органический слой отделяли, сушили (MgSO4),фильтровали и растворитель выпаривали досуха с получением 6 г (100%) -6-[(4-хлорфенил)гидрокси(1-метил-1 Н-имидазол-5-ил)метил]-4(3-гидроксифенил)-1-метил-2(1 Н)-хинолинона(2,2 г) в ACN (50 мл) и ДМФ (50 мл) перемешивали в течение ночи при 100 С. Растворитель выпаривали досуха. Остаток растворяли в смеси метиленхлорид/вода и декантировали. Органический слой сушили, фильтровали и растворитель выпаривали. Остаток (2,7 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NH4OН 97/3/0,1 - 90/10/0,1). Чистые фракции собирали, а растворитель упаривали. Остаток образовывали в соль этандиовой кислоты (1:1) в 2-пропаноне. Осадок отфильтровывали, промывали смесью 2-пропанон/диэтиловый эфир и сушили. Остаток образовывали в свободное основание. Осадок отфильтровывали и сушили. Остаток кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили с получением 0,35 г (12%) -6-[(4 хлорфенил)гидрокси(1-метил-1 Н-имидазол-5 ил)метил]-4-[3-[2-(диметиламино)-этокси]фе 000710(МgSO4), фильтровали, а растворитель выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/СН 3 ОН/NH4 ОН 97,5/2,5/0,1). Чистые фракции собирали, а растворитель выпаривали. Остаток кристаллизовали из смеси 2-пропанон/ диэтиловый эфир. Осадок отфильтровывали и сушили с получением 1 г -4-(3-хлорфенил)-6[(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-1-метил-2(1 Н)-хинолинтиона (соединение 128). Пример В.17. Смесь этилмалонилхлорида (6,4 мл) в ДХМ (50 мл) по каплям при комнатной температуре добавляли к раствору промежуточного соединения (6-d) (15 г) и пиридина (10,7 мл) в ДХМ (150 мл). Смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду и смесь декантировали. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (21 г) очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/2-пропанол/NН 4OН 92/8/0,4). Целевые фракции собирали и растворитель выпаривали с получением 10,9 г (60%) -этил-4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метил-1 Нимидазол-5-ил)метил]-1,2-дигидро-2-оксо-3 хинолинкарбоксилата (соед.144). Пример В.18.(25 мл) при комнатной температуре по каплям добавляли к раствору промежуточного соединения (6-d) (7 г) и пиридина (5 мл) в ДХМ (70 мл). Смесь перемешивали при комнатной температуре в течение 45 мин. Добавляли воду, смесь декантировали. Органический слой сушили(промежуточного соединения 7). Полученный продукт был использован без дополнительной очистки.b) К смеси промежуточного соединения 7(16,68 г) в ТГФ (150 мл). Смесь перемешивали при комнатной температуре в течение 2 ч, декантировали и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Эту реакцию проводили два раза. Остатки объединяли и очищали колоночной хроматографией на силикагеле (элюент: толуол/2-пропанол/NН 4OН 70/29/1). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из СН 2 Сl2/СН 3 ОН/СН 3 СN. Осадок отфильтровывали, а маточный слой выпаривали досуха и очищали колоночной хроматографией (элюент: СН 3 ОН/NН 4OАс (0,5% в Н 2 О), 70/30). Две чистые фракции собирали и их растворители выпаривали досуха. Фракцию 2 перекристаллизовывали из смеси СН 2 Сl2/диэтиловый эфир. Осадок отфильтровывали, сушили и получали 0,8 г 6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5 ил)метил]-3-хлор-4-(3-хлорфенил)-1-метил 2(1 Н)-хинолинона (соединение 143). Пример В.20. К раствору соединения 3 (3,5 г) в метоксиацетонитриле (10 мл) при комнатной температуре добавляли серную кислоту (1 мл) и смесь перемешивали, и нагревали при 80 С в течение 3 ч. Смесь охлаждали, выливали на лед, подщелачивали NH3 (вод.) и отфильтровывали. Осадок растворяли в дихлорметане. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 96/4/0,3). Чистые фракции собирали и растворитель выпаривали. Остаток преобразовывали в соль хлористоводородной кислоты (1:1) и кристаллизовали из ACN. Осадок отфильтровывали, сушили и получали 2,5 г (58%) моногидрохлорида -N-[(4 хлорфенил)[4-(3-хлорфенил)-1,2-дигидро-1-метил-2-оксо-6-хинолинил](1-метил-1 Н-имидазол 5-ил)метил]2-метоксиацетамида (соед.89). Пример В.21. К раствору метанамина в воде (40 мл) при комнатной температуре по каплям добавляли раствор промежуточного соединения (4) (3,3 г) в ТГФ (10 мл). Смесь перемешивали в течение 45 мин при 80 С, растворяли в воде и экстрагировали дихлорметаном. Органический слой отделяли, сушили (MgSO4), фильтровали, и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NH4OН 97/3/0,3 и 95/5/0,3). Чистые фракции собирали, и растворитель выпаривали. Остаток кристаллизовали из диэтилового эфира. Осадок отфильтровывали, сушили и получали 0,89 г (28%) моногидрата -4-(3 хлорфенил)-6-[(4-хлорфенил)(метиламино)(1 метил-1 Н-имидазол-5-ил)метил]-1-метил-2(1 Н)хинолинона (соединение 61). В таблицах 1-8 перечислены соединения,которые были получены методами, описанными в одном из вышеприведенных примеров, а в таблице 9 перечислены величины элементного анализа для углерода, водорода и азота, полученные как экспериментально (столбец озаглавлен ехр), так и теоретически (столбец озаглавлен Theor), для соединений, полученных,как описано выше в экспериментальной части.-NHC6H5 Примечания к таблице 1: получено путем преобразования функциональных групп соединения 70 получено путем преобразования функциональных групп соединения 25.OH Примечания к таблице 2: получено путем преобразования функциональных групп соединения 54 получено путем преобразования функциональных групп соединения 104.R6 и R7, взятые вместе, образуют бивалентный радикал между 3- и 4-положениями фенильного радикала.Enzymology, vol 1, 241-245, 1990). В качестве источника человеческого фермента были использованы трансформированные вирусом Кирстена клетки (Американская коллекция типовых культур, Rockville, MD, USA) остеосаркомы человека (KHOS), выращенные в виде твердых опухолей в голых мышах, либо выращенные в виде монослойных клеточных культур. Для этого клетки или опухоли гомогенизировали в буфере, содержащем 50 мМ Трис, 1 мМ EDTA, 1 мМ EGTA и 0,2 мМ фенилметилсульфонилфторид (рН 7,5). Гомогенаты центрифугировали при 28000 хг в течение 60 мин. и супернатанты собирали. Получали 30-50% фракцию сульфата аммония и полученный осадок ресуспендировали в небольшом объеме (10-20 мл) буфера для диализа, содержащего 20 мМ Трис, 1 мМ дитиотреит и 20 мкМ ZnCl2. Фракцию с сульфатом аммония диализовали в течение ночи против двух замен одного и того же буфера. Диализованный материал наносили на колонку 10 х 1 смQ Fast Flow с сефарозой (Pharmacia LKB Biotechnology Inc., Piscataway, NJ, USA), предварительно уравновешенную 100 мл буфера для диализа, в который был добавлен 0,05 М NaCl. Эту колонку промывали еще 50 мл буфера для диализа + 0,05 М NaCl, а затем градиентом от 0,05 М до 0,25 М NaCl, полученным в буфере для диализа. Ферментативную активность элюировали линейным градиентом от 0,25 М до 1,0 МNaCl, полученным в буфере для диализа. Фракции, содержащие 4-5 мл объемов колоночного элюата, собирали и анализировали на фарнезилпротеин-трансферазную активность. Фракции с ферментативной активностью собирали в пул и добавляли 100 мкМ ZnCl2. Образцы фермента хранили в замороженном состоянии при -70 С. Активность фарнезилпротеин-трансферазы измеряли с использованием набора для [3H] сцинтилляционного проксимального анализа на фарнезилпротеин-трансферазу (Amersham International plc., England) в условиях, указанных производителем. Для проведения анализа на присутствие ингибиторов фермента, 0,20 мкКи[3 Н]-фарнезилпирофосфатного субстрата и биотинилированный пептидный субстрат ламина В(биотин-YRASNRSCAIM) смешивали с испытуемыми соединениями в буфере для реакции,содержащем 50 мМ HEPES, 30 мМ MgCl2, 20 мМ КСl, 5 мМ дитиотреит, 0,01% Тритон Х-100. Испытуемые соединения разводили в 10 мклобъеме диметилсульфоксида (ДМСО) до концентраций от 1 до 10 мкг/мл в конечном объеме 100 мкл. Реакционную смесь нагревали до 37 С. Ферментативную реакцию стимулировали добавлением 20 мкл разведенной фарнезилпротеин-трансферазы человека. Достаточное количество ферментного препарата добавляли для продуцирования 4000-15000 им./мин. реакционного продукта в течение 60 мин инкубирования 43 для проведения реакции при 37 С. Реакцию прерывали путем добавления реагента в видеSTOP/сцинтилляционных проксимальных гранул (Amersham). Реакционный продукт, [3 Н]фарнезил-(Cys)-биотинилированный пептид ламина В, иммобилизовали на стрептавидине,связанном со сцинтилляционными проксимальными гранулами. Количество [3 Н]-фарнезил(Cys)-биотинилированного пептида ламина В,синтезированного в присутствии или в отсутствие испытуемых соединений, определяли как число импульсов в минуту (им./мин.) с помощью жидкостного сцинтилляционного счетчикаCounter). Считалось, что число импульсов в минуту данного продукта соответствует фарнезилпротеин-трансферазной активности. Фарнезилпротеин-трансферазную активность, наблюдаемую в присутствии испытуемого соединения,нормализовали к фарнезилпротеин-трансферазной активности в присутствии 10% ДМСО и выражали как процент ингибирования. В отдельных экспериментах, некоторые испытуемые соединения, обнаруживающие 50%-ное или выше ингибирование фарнезилпротеинтрансферазной активности, оценивали на зависимое от концентрации ингибирование ферментативной активности. В этих экспериментах,эффект испытуемых соединений вычисляли какIC50 (концентрация испытуемого соединения,продуцирующая 50%-ное ингибирование ферментативной активности) с использованием компьютерной программы LGIC50, составленной научно-информационным отделом (ScienceIC50 (нМ) 1 6,0 58 2,8 2 8,0 59 0,14 3 1,7 60 0,62 4 24 61 1,1 5 25 63 1,0 7 1,6 64 11,6 12 4,2 66 4,0 15 18,4 67 5,9 24 2,7 69 3,4 25 2,2 71 26 29 57 74 100 34 1,6 75 0,86 35 0,39 95 57 36 2,8 96 0,11 37 10,1 97 2,9 39 0,59 98 6,4 42 910 99 1,7 45 1000 100 0,52 52 5,7 146 68 Пример С.2. Анализ на реверсию фенотипа 44 Введение активированных онкогенов, таких как мутантный ген ras, в мышиные клеткиNIH ЗТЗ, приводит к трансформации фенотипа этих клеток. Эти клетки становятся онкогенными, приобретают способность к свободному(безъякорному) росту в полутвердой среде и теряют способность к контактному торможению роста. Потеря контактного торможения приводит к продуцированию клеточных культур, которые больше не способны образовывать однородные монослои. Вместо этого, эти клетки скапливаются с образованием многоклеточных узлов и в пластиковых чашках с тканевой культурой растут до очень высокой плотности популяции. Такие агенты, как ингибиторы фарнезилпротеин-трансферазы, которые способствуют обратному переключению ras-трансформированного фенотипа, восстанавливают однородномонослойный характер роста клеток в культуре. Эта реверсия легко прослеживается путем подсчета числа клеток в чашках с тканевой культурой. Число трансформированных клеток будет превышать число клеток с восстановленным нетрансформированным фенотипом. Соединения, способствующие обратному переключению трансформированного фенотипа на не трансформированный фенотип, должны оказывать противоопухолевое действие на опухоли,несущие мутации гена ras. Метод. Соединения скринировали в тканевых культурах клеток NIH 3 Т 3, трансформированных Т 24-активированным геном H-ras человека. Клетки высевали с начальной плотностью 200.000 клеток на лунку (площадь поверхности= 9,6 см 2) в 6-луночные планшеты для культивирования кластерных тканей. Испытуемые соединения непосредственно добавляли в 3,0 мл среды для культивирования клеток в 3,0 мклобъеме ДМСО с конечной концентрацией ДМСО в культуральной среде 0,1%. Испытуемые соединения тестировали в концентрациях 5,10, 50, 100 и 500 нМ, а в качестве контроля использовали обработку наполнителем ДМСО. (В случае если при 5 нМ наблюдалась высокая активность, то испытуемое соединение тестировали при еще меньших концентрациях). Клетки оставляли на 72 ч для пролиферации. Затем клетки отделяли друг от друга в 1,0 мл трипсинЕDТА-содержащей среде для диссоциации клеток и подсчитывали число клеток с использованием счетчика Coulter. Измерения. Число клеток, определенное как число клеток на лунку, измеряли с помощью счетчикаCoulter Particle Counter. Все данные по подсчету клеток были скорректированы на первоначальную плотность исходных клеток путем вычитания 200000. Число контрольных клеток = [число клеток, полученных после инкубирования с наполнителем ДМСО - 200000]. 45 Число клеток, обработанных испытуемым соединением, = [число клеток после инкубирования с испытуемым соединением - 200000].% ингибирования испытуемым соединением = [1-число клеток после инкубирования с испытуемым соединением / число контрольных клеток] x 100%.IС 50 (то есть, концентрацию испытуемого соединения, необходимую для ингибирования ферментативной активности на 50%) вычисляли в том случае, если имелись достаточные данные, и полученные результаты систематизировали в таблице 11. Таблица 11 Соед.IC50 (нМ) 5 32 88 136 12 66 89 24 14 3,8 91 47 22 63 92 218 23 395 93 45 24 16 94 62 25 86 96 0,78 29 345 98 15 34 3,0 100 11 35 3,4 101 366 39 104 102 24 40 340 104 4,5 56 23 105 3,8 58 96 107 12 59 0,4 109 409 60 70 111 16 61 310 112 18 63 53 119 46 66 19 120 7 67 51 122 133 68 35 123 41 69 14 125 128 71 288 126 208 72 4,6 128 177 73 6,1 130 3,2 74 100 130 547 75 1,7 137 655 76 18 143 82 78 4,6 146 65 79 657 148 25 80 500 152 67 81 83 153 3,5 83 174 154 4,5 84 231 155 69 86 91 156 25 87 251 160 40 Пример С.3. Вторичная опухолевая модель для анализа на ингибирование фарнезилпротеин-трансферазы. Фермент фарнезилпротеин-трансфераза катализирует ковалентное связывание фарнизильной части, происходящей от фарнезилпирофосфата, с онкогенным продуктом p21ras. В результате этого p21ras связывается с плазматическими мембранами. После связывания с плаз 000710 46 матическими мембранами, мутантные или онкогенные формы p21ras продуцируют сигнал для трансформации и неконтролируемого роста злокачественных опухолевых клеток. Поэтому ингибиторы фарнезилпротеин-трансферазы будут препятствовать связыванию p21ras с плазматическими мембранами и ингибировать рост rasтрансформированных опухолей. Бестимусным (голым) мышам подкожно инъецировали в паховую область 1 х 106 трансформированных активированным геном H-ras фибробластных клеток NIH 3 Т 3 (Т 24-клеток). Через три дня, в течение которых образовывались опухоли, животным начали перорально вводить испытуемые соединения. Эти испытуемые соединения растворяли в 20% циклодекстрине в 0,1 н. растворе НСl и перорально вводили в виде 0,1 мл раствора соединения на 10 г веса тела мыши. Обычно используемые дозы составляли 6,25, 12,5 и 25 мг/кг. Вес тела и размеры опухолей измеряли в течение последующих 15 дней обработки. После завершения обработки животных умерщвляли и опухоли взвешивали. Среднюю массу обработанной наполнителем опухоли определяли как среднюю массу опухолей от 10-15 мышей, обработанных наполнителем. Среднюю массу опухоли определяли как среднюю массу опухоли от 10-15 мышей, обработанных испытуемым соединением.% Снижения конечной массы опухоли =[1-средняя масса опухоли / средняя масса обработанной наполнителем опухоли] x 100%. Таблица 12 Соединение% Уменьшения конечной опухолевой массы после обработки дозой 25 мг/кг дважды в день, пероральноD. Примеры композиций. Ниже приводятся примеры типичных фармацевтических композиций, изготавливаемых в соответствии с настоящим изобретением в виде унифицированных лекарственных форм, подходящих для системного или местного введения теплокровным животным. Используемый в нижеследующих примерах термин активный ингредиент (A.I.) означает соединения формулы (I), его фармацевтически приемлемую кислотно- или основноаддитивную соль, или стереохимически изомерную форму. Пример D.1. Пероральные растворы 9 г метил-4-гидроксибензоата и 1 г пропил-4 гидроксибензоата растворяли в 4 л кипящей очищенной воды. В 3 л этого раствора растворяли сначала 10 г 2,3-дигидроксибутандиовой 47 кислоты, а затем 20 г A.I. Последний раствор объединяли с остальной частью первого раствора и в него добавляли 12 л 1,2,3-пропантриола и 3 л 70%-ного раствора сорбита. 40 г натриевого производного сахарина растворяли в 0,5 л воды и добавляли 2 мл малиновой и 2 мл крыжовниковой эссенции. Последний раствор объединяли с первым раствором и добавляли воду в количестве, достаточном для получения 20 л перорального раствора, содержащего 5 мг A.I. на одну чайную ложку (5 мл). Полученный раствор заливали в подходящие контейнеры. Пример D.2. Капсулы. 20 г A.I., 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидной двуокиси кремния, и 1,2 г стеарата магния тщательно перемешивали. Полученной смесью наполняли 1000 подходящих жестких желатиновых капсул, каждая из которых содержала 20 мгA.I. Пример D.3. Таблетки, покрытые оболочкой. Получение сердцевины таблетки. Смесь 100 г A.I., 570 г лактозы и 200 г крахмала тщательно перемешивали, а затем увлажняли раствором, содержащим 5 г додецилсульфата натрия и 10 г поливинилпирролидона примерно в 200 мл воды. Увлажненную порошкообразную смесь просеивали через сито, сушили и снова просеивали. Затем добавляли 100 г микрокристаллической целлюлозы и 15 г гидрогенизированного растительного масла. Всю смесь тщательно перемешивали и прессовали в таблетки, в результате чего получали 10000 таблеток, каждая из которых содержала 10 мг активного ингредиента. Покрытие. К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляли раствор 5 г этилцеллюлозы в 150 мл дихлорметана. Затем добавляли 75 мл дихлорметана и 2,5 мл 1,2,3 пропантриола. 10 г полиэтиленгликоля расплавляли и растворяли в 75 мл дихлорметана. Последний раствор добавляли к первому раствору,после чего добавляли 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной суспензии красителя, и полученную смесь гомогенизировали. Сердцевины уже готовых таблеток покрывали полученной таким образом смесью в аппарате для покрытия. Пример D.4. Раствор для инъекций. 1,8 г метил-4-гидроксибензоата и 0,2 г пропил-4-гидроксибензоата растворяли примерно в 0,5 л кипящей воды для инъекций. После охлаждения до около 50 С добавляли при размешивании 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г A.I.Раствор охлаждали до комнатной температуры и добавляли воду для инъекции в количестве, достаточном для получения 1 л раствора с концентрацией 4 мг/мл A.I. Этот раствор стерилизовали путем фильтрации и выливали в стерильные контейнеры. 48 Пример D.5. Суппозитории. 3 г A.I. растворяли в растворе 3 г 2,3 дигидроксибутандиовой кислоты в 25 мл полиэтиленгликоля 400. 12 г поверхностноактивного вещества и 300 г триглицеридов расплавляли вместе. Эту расплавленную смесь хорошо перемешивали с первым раствором. Полученную таким образом смесь выливали в соответствующие формы при температуре 37-38 С для образования 100 суппозиториев, каждый из которых содержал 30 мг/мл A.I. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) его стереоизомерная форма, фармацевтически приемлемая кислотно-аддитивная или основноаддитивная соль,где пунктирная линия означает необязательную связь; Х представляет кислород или серу;R1 представляет водород, С 1-12 алкил, Аr1,2 Аr C1-6 алкил, хинолинил-C1-6 алкил, пиридил С 1-6 алкил, гидроксиС 1-6 алкил, C1-6 алкилокси-C1-6 алкил, моно- или ди(С 1-6 алкил)аминоС 1-6 алкил,аминоС 1-6 алкил или радикал формулы -Alk1C(=O)-R9, -Alk1-S(О)-R9 или -Alk1-S(O)2-R9,где -Alk1 обозначает C1-6 алкандиил,R9 представляет гидрокси, C1-6 алкил, C1-6 алкилокси, амино, С 1-8 алкиламино или С 1-8 алкиламино, замещенный C1-6 алкилоксикарбонилом; каждый из R2, R3 и R16, независимо, представляет водород, гидрокси, галоген, циано,C1-6 алкил, C1-6 алкилокси, гидроксиС 1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилокси, аминоС 1-6 алкилокси, моно- или ди(C1-6 алкил)аминоС 1-6 алкилокси, Аr1, Аr2C1-6 алкил, Ar2oкcи, Ar2C1-6aлкилoкcи, гидроксикарбонил, C1-6 алкилоксикарбонил, тригалогенметил, тригалогенметокси,C2-6 алкенил, 4,4-диметилоксазолил; или когда R2 и R3 находятся в соседних положениях, взятые вместе они могут образовывать бивалентный радикал формулы-СН=СН-СН=СН(а-6); каждый из R4 и R5 независимо представляет водород, галоген, Аr1, C1-6 алкил, гидроксиС 1-6 алкил, С 1-6 алкилоксиС 1-6 алкил, C1-6 алкилокси, C1-6 алкилтио, амино, гидроксикарбонил, C1-6 алки 49 локсикарбонил, С 1-6 алкилS(О)C1-6 алкил или C1-6 алкилS(О)2C1-6 алкил; каждый из R6 и R7 независимо представляет водород, галоген, циано, C1-6 алкил, C1-6 алкилокси, Ar2-oкcи, тригалогенметил, C1-6 алкилтио, ди(C1-6 алкил)амино, или когда R6 и R7 находятся в соседних положениях, взятые вместе могут образовывать бивалентный радикал формулыR8 представляет водород, C1-6 алкил, циано,гидроксикарбонил, C1-6 алкилоксикарбонил, С 1-6 алкилкарбонилС 1-6 алкил, циано-С 1-6 алкил, С 1-6 алкилоксикарбонилС 1-6 алкил,карбоксиС 1-6 алкил, гидроксиC1-6 алкил, аминоС 1-6 алкил, моноили ди(C1-6 алкил)аминоС 1-6 алкил, имидазолил,галогенС 1-6 алкил, С 1-6 алкилоксиС 1-6 алкил, аминокарбонилC1-6 алкил или радикал формулы(b-3),где R10 представляет водород, С 1-6 алкил,C1-6 алкилкарбонил, Аr1, Аr2C1-6 алкил, C1-6 алкилоксикарбонилС 1-6 алкил или радикал формулы Alk2-OR13, или -Alk2-NR14R15;R12 представляет водород, C1-6 алкил, С 1-16 алкилкарбонил, C1-6 алкилоксикарбонил, C1-6 алкиламинокарбонил, Аr1, Ar2C1-6aлкил, C1-6 алкилкарбонилС 1-6 алкил, остаток природной аминокислоты, Аr1 карбонил, Ar2C1-6 aлкилкapбoнил,аминокарбонилкарбонил, С 1-6 алкилоксиС 1-6 алкилкарбонил, гидрокси, C1-6 алкилокси, аминокарбонил, ди(С 1-6 алкил)аминоС 1-6 алкилкарбонил, амино, C1-6 алкиламино, C1-6 алкилкарбониламино или радикал формулы -Alk2-OR13 или Аlk2-NR14R15; где -Alk2 обозначает C1-6 алкандиил;R19 представляет водород или C1-6 алкил; Аr1 представляет фенил или фенил, замещенный C1-6 алкилом, гидрокси, амино, C1-6 алкилокси или галогеном; и Аr2 представляет фенил или фенил, замещенный C1-6 алкилом,гидрокси, амино, C1-6 алкилокси или галогеном. 2. Соединение по п.1, где Х представляет кислород. 3. Соединение по п.1 или 2, где пунктирная линия обозначает связь. 50 4. Соединение по пп.1,2 или 3, где R1 представляет водород, C1-6 алкил, С 1-6 алкилоксиС 1-6 алкил или моно- или ди(C1-6 алкил)аминоС 1-6 алкил. 5. Соединение по любому из пп.1-4, где R3 представляет водород и R2 представляет галоген, C1-6 алкил, C2-6 алкенил, C1-6 алкилокси, тригалогенметокси или гидроксиС 1-6 алкилокси. 6. Соединение по любому из пп.1-5, где R8 представляет водород, гидрокси, галогенС 1-6 алкил, гидроксиС 1-6 алкил, цианоС 1-6 алкил, С 1-6 алкилоксикарбонилС 1-6 алкил, имидазолил или радикал формулы -NR11R12, где R11 представляет водород или С 1-12 алкил и R12 представляет водород, C1-6 алкил, C1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилкарбонил, гидрокси или радикал формулыC1-6 алкил. 7. Соединение по п.1, которое представляет собой 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1 Н)-хинолинон; 6-[(4-хлорфенил)гидрокси(1-метил-1 Нимидазол-5-ил)метил]-4-(3-этоксифенил)-1 метил-2(1 Н)-хинолинон; моногидрат моногидрохлорида 6-[(4 хлорфенил)-(1-метил-1 Н-имидазол-5-ил)метил]4-(3-этоксифенил)-1-метил-2(1 Н)-хинолинона; 6-[амино(4-хлорфенил)(1-метил-1H-имидазол-5-ил)метил]-4-(3-этоксифенил)-1-метил 2(1 Н)-хинолинон; и 6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-1-метил-4-(3-пропилфенил)2(1 Н)-хинолинон; его стереоизомерная форма или фармацевтически приемлемая кислотноаддитивная или основно-аддитивная соль. 8. Соединение по п.7, где указанным соединением является (В)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)-метил]-4-(3 хлорфенил)-1-метил-2(1 Н)-хинолинон; или его фармацевтически приемлемая кислотноаддитивная соль. 9. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по пп.1-8. 10. Способ получения фармацевтической композиции по п.9, отличающийся тем, что терапевтически эффективное количество соединения по пп.1-8 тщательно перемешивают с фармацевтически приемлемым носителем. 11. Применение соединения по любому из пп.1-8 в качестве лекарственного средства. 12. Соединение формулы (XII), где радикалы R2, R3, R4, R5, R6, R7, R8, R16, R17, R18 и R19 такие, как определены в п.1; его стереоизомер 51 ная форма или фармацевтически приемлемая кислотно- или основно-аддитивная соль. 13. Соединения формулы (VI), где радикалы R2, R3, R4, R5, R6, R7, R8, R16, R17, R18 и R19 такие, как определены в п.1; его стереоизомерная форма или фармацевтически приемлемая кислотно- или основно-аддитивная соль. 14. Способ получения соединения общей формулы (I) по п.1, отличающийся тем, что а) гидролизуют промежуточный эфир формулы (II), где R представляет C1-6 алкил, в кислом водном растворе, получают соединение формулы (I-а), где R1 представляет водород; и,необязательно, соединение формулы (I-а), где 15. Способ по п.14, отличающийся тем, что в качестве кислоты используют соляную кислоту. 16. Способ получения соединений общей формулы (I), отличающийся тем, что промежуточный кетон формулы (III) подвергают взаимодействию с промежуточным соединением формулы (IV-a), где Р представляет необязательную защитную группу, которую удаляют после реакции присоединения, в присутствии подходящего сильного основания в соответствующем растворителе, и получают соединение формулы (I-b); 52 17. Способ получения соединений общей формулы (I) по п.1, отличающийся тем, что промежуточное соединение формулы (XXI) подвергают взаимодействию с промежуточным соединением формулы (IV-a), где Р представляет необязательную защитную группу, которую удаляют после реакции присоединения, с последующей обработкой кислотой, такой как, например, ТiСl3, в присутствии воды, и полученное таким образом промежуточное соединение формулы (XXIII) подвергают взаимодействию с подходящим реагентом, таким как, например,R17CH2COCl или R17CH2COOC2H5, с последующей необязательной обработкой основанием,таким как, например, трет-бутоксид калия и получают соединение формулы (I-b-1), 18. Способ получения соединений общей формулы (I) по п.1, отличающийся тем, что промежуточное соединение формулы (XIII), гдеW представляет подходящую группу, подвергают взаимодействию с реагентом формулы (XIV) в подходящем растворителе, получают соединение формулы (I-g); где заместители R1-R16 определены в п.1. 19. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединения формулы (I) преобразуют друг в друга; или соединение формулы (I) преобразуют в его фармацевтически приемлемую кислотноаддитивную соль, или кислотно-аддитивную соль соединения формулы (I) с помощью щелочи преобразуют в свободное основание; и/или получают его стереохимически изомерные формы.
МПК / Метки
МПК: A61K 31/47, C07D 401/06
Метки: ингибирующие, метил-2-хинолиноновые, производные, фарнезилпротеин-трансферазу, имидазол-5-ил
Код ссылки
<a href="https://eas.patents.su/27-710-imidazol-5-il-metil-2-hinolinonovye-proizvodnye-ingibiruyushhie-farnezilprotein-transferazu.html" rel="bookmark" title="База патентов Евразийского Союза">(имидазол-5-ил) метил-2-хинолиноновые производные, ингибирующие фарнезилпротеин-трансферазу.</a>
Предыдущий патент: Таксоиды, способы их получения и фармацевтическая композиция на их основе и промежуточные соединения
Следующий патент: Производные триазина, способ их получения и применение в качестве гербицидов
Случайный патент: Ингибиторы пептиддеформилазы












