Производные 2-хинолона, ингибирующие фарнезилтрансферазу
Номер патента: 719
Опубликовано: 28.02.2000
Авторы: Энд Девид Вилльям, Анжибо Патрик Рене, Санз Жерар Шарль, Вене Марк Гастон
Формула / Реферат
1. Соединение формулы (I)
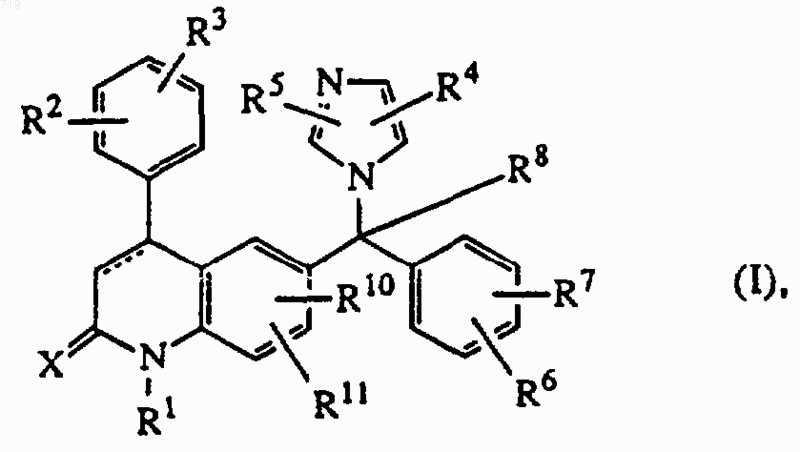
его стереоизомерная форма, фармацевтически приемлемая соль присоединения кислоты или основания, в которых пунктирная линия обозначает необязательную связь;
Х представляет кислород или серу;
R1 представляет водород, С1-12алкил, Аr1, Аr2C1-6алкил, хинолинилС1-6алкил, пиридилС1-6алкил, гидроксиС1-6алкил, C1-6-алкилоксиC1-6алкил, моно- или ди(C1-6алкил)аминоC1-6алкил, аминоС1-6алкил, или радикал формулы -Аlk1-С(=О)-R9, -Alk1-S(О)-R9 или -Alk1-S(О)2-R9,
где Alk1 представляет C1-6алкандиил,
R9 представляет гидрокси, C1-6алкил, C1-6алкилокси, амино, C1-8алкиламино или С1-8алкиламино, замещенный С1-6алкилоксикарбонилом;
R2 и R3, каждый независимо, представляет водород, гидрокси, галоген, циано, C1-6алкил, C1-6алкилокси, гидроксиC1-6алкилокси, C1-6алкилоксиC1-6алкилокси, аминоС1-6алкилокси, моно- или ди(C1-6алкил)аминоC1-6алкилокси, Аr1, Аr2C1-6алкил, Аr2окси, Аr2С1-6алкилокси, гидроксикарбонил, C1-6алкилоксикарбонил, тригалогенметил, тригалогенметокси, С2-6алкенил; или когда они находятся в смежных положениях, R2 и R3, взятые вместе, могут образовывать двухвалентный радикал формулы
| -О-СН2-О- | (а-1), |
| -О-СН2-СН2-О- | (а-2), |
| -O-СН=СН- | (а-3), |
| -О-СН2-СН2- | (а-4), |
| -О-СН2-СН2-СН2- | (а-5) или |
| -СН=СН-СН=СН- | (а-6); |
R4 и R5, каждый независимо, представляет водород, Аr1, C1-6алкил, C1-6алкилоксиС1-6алкил, C1-6алкилокси, C1-6алкилтио, амино, гидроксикарбонил, C1-6алкилоксикарбонил, C1-6алкилS(О) C1-6алкил или C1-6алкилS(О)2С1-6 алкил;
R6 и R7, каждый независимо, представляет водород, галоген, циано, C1-6алкил, C1-6алкилокси или Аr2окси;
R8 представляет водород, C1-6алкил, циано, гидроксикарбонил, C1-6алкилоксикарбонил, С1-6 алкилкарбонилС1-6алкил, цианоС1-6алкил, C1-6алкилоксикаробонилC1-6алкил, гидроксикарбонилС1-6алкил, гидроксиС1-6алкил, аминоС1-6алкил, моно- или ди(C1-6алкил)аминоC1-6алкил, галогенС1-6алкил, С1-6алкилоксиС1-6алкил, аминокарбонилС1-6-алкил, Аr1, Ar2C1-6aлкилoкcиC1-6aлкил, С1-6алкилтиоС1-6алкил;
R10 представляет водород, C1-6алкил, C1-6алкилокси или галоген;
R11 представляет водород или C1-6алкил;
Ar1 представляет фенил или фенил, замещенный C1-6алкилом, гидрокси, амино, C1-6алкилокси или галогеном;
Аr2 представляет фенил или фенил, замещенный C1-6алкилом, гидрокси, амино, C1-6алкилокси или галогеном;
2. Соединение по п.1, в котором Х представляет кислород.
3. Соединение по п.1, в котором R1 представляет водород, C1-6алкил или С1-6алкилоксиС1-6алкил.
4. Соединение по п.1, в котором R6 представляет водород, а R7 представляет галоген.
5. Соединение по п.1, в котором R8 представляет водород, C1-6алкил или гидроксиС1-6алкил.
6. Соединение по п.1, которое представляет
4-(3-хлорфенил)-6-[(4-хлорфенил)-1Н-имидазол-1-илметил]-1-метил-2(1Н)-хинолинон;
4-(3-хлорфенил)-6-[(4-хлорфенил)-1Н-имидазол-1-илметил]-2(1Н)-хинолинон;
6-[1-(4-хлорфенил)-2-гидрокси-1-(1Н-имидазол-1-ил)этил]-1-метил-4-фенил-2(1Н)-хинолинон;
4-(3-хлорфенил)-6-[1-(4-хлорфенил)-1-(1Н-имидазол-1-ил)-этил]-1-метил-2(1Н)-хинолинон;
4-(3-хлорфенил)-6-[1-(4-хлорфенил)-1-(5-метил-1Н-имидазол-1-ил)этил]-1-метил-2(1Н)-хинолинон;
4-(3-хлорфенил)-6-[1-(4-хлорфенил)-2-гидрокси-1-(1H-имидазол-1-ил)этил]-1-метил-2(1Н)-хинолинон;
моногидрат этандиоата (2:3) 4-(3-хлорфенил)-6-[(4-хлорфенил)(1Н-имидазол-1-ил)метил]-1-(2-метоксиэтил)-2(1Н)-хинолинона;
этандиоат (1:1) 6-[(4-хлорфенил)(1Н-имидазол-1-ил)метил]-4-(1,3-бензодиоксол-5-ил)-1-метил-2(1Н)-хинолинона;
его стереоизомерные формы и фармацевтически приемлемые соли присоединения кислот или оснований.
7. Фармацевтическая композиция, включающая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по пп.1-6.
8. Способ получения фармацевтической композиции, заявленной в п.7, согласно которому фармацевтически приемлемые носители и соединение по пп.1-6 тщательно смешивают.
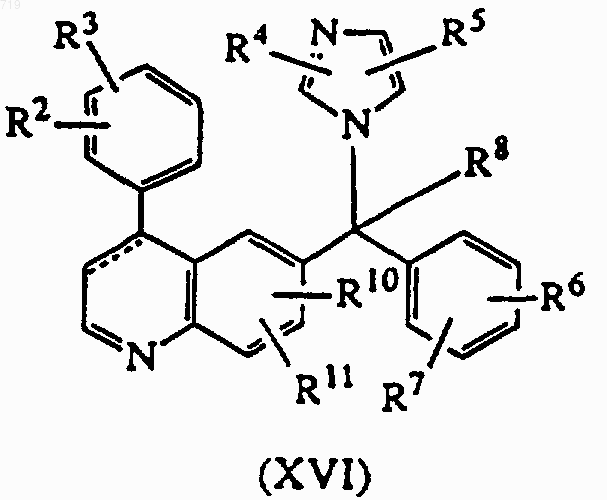
9. Соединение формулы (XVI), в котором радикалы R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, определенные в п.1, или его фармацевтически приемлемая соль присоединения кислоты
10. Соединение формулы (XV), в котором радикалы R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, определенные в п.1, или его фармацевтически приемлемая соль присоединения кислоты

11. Применение соединения, заявленного в пп.1-6, в качестве лекарственного средства.
12. Способ получения соединения, заявленного в п.1, включающий N-алкилирование имидазола формулы (II) или его соли со щелочным металлом производным формулы (III)
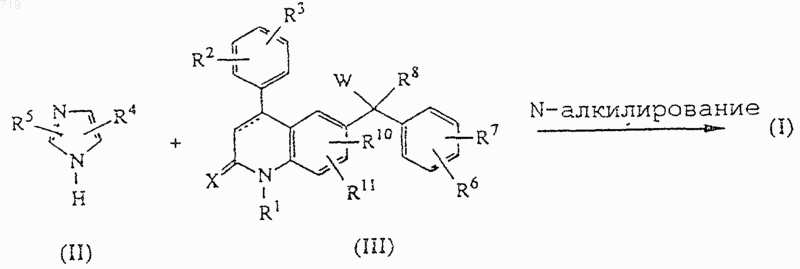
и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или наоборот превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы.
13. Способ получения соединения, заявленного в п.1, включающий реакцию промежуточного соединения формулы (IV) с соединением формулы (V), в которой Y представляет углерод или серу, таким как, например, 1,1'-карбонил-бис[1Н-имидазол]
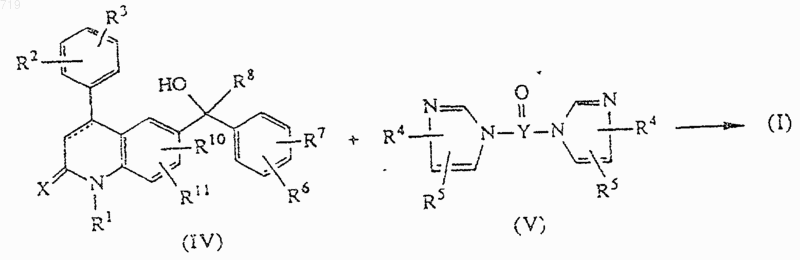
и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или наоборот превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы.
14. Способ получения соединения, заявленного в п.1, включающий реакцию циклизации промежуточного соединения формулы (VI) с получением таким образом соединения формулы (I-а), определенного как соединение формулы (I), в которой пунктирная линия представляет связь
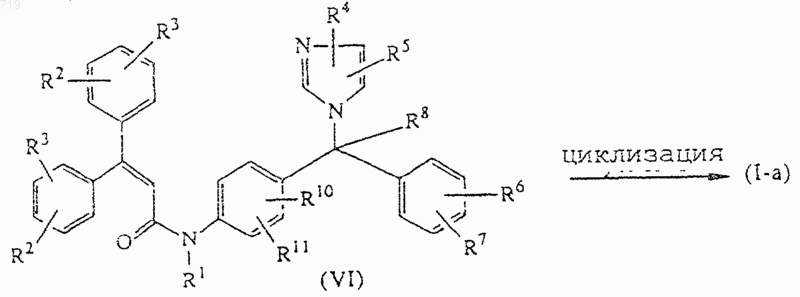
и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или наоборот превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы.
15. Способ получения соединения, заявленного в п.1, включающий гидролиз промежуточного соединения формулы (XXVI), в которой R представляет С1-6алкил, в водном растворе кислоты, с получением соединения формулы (I-а-1), определенного как соединение формулы (I-a), в которой R1 представляет водород
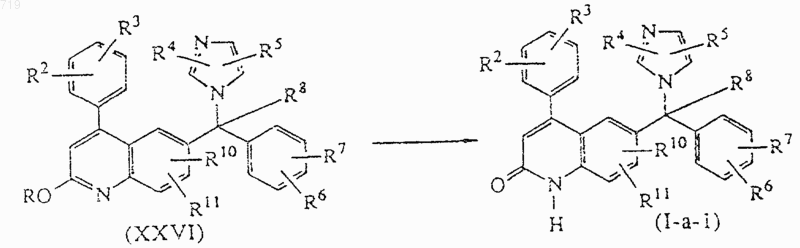
и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или наоборот превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы.
16. Способ получения соединения, заявленного в п.1, включающий раскрытие эпоксида формулы (VII) имидазолом формулы (II) с получением соединения формулы (I-b), определенного как соединение формулы (I), в которой R8 представляет гидроксиметилен,
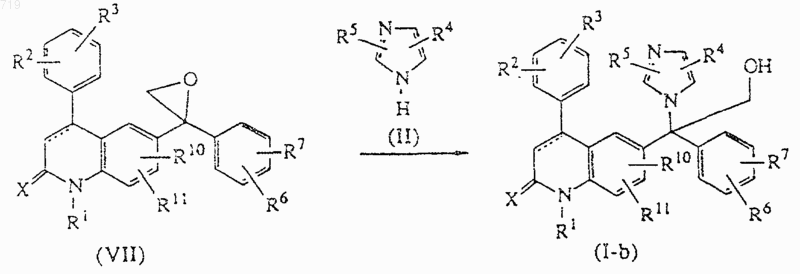
и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или, наоборот, превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы.
17. Способ получения соединения, заявленного в п.1, включающий реакцию преобразования промежуточных нитронов формулы (XV), полученных N-окислением хинолиновых производных формулы (XVI), с помощью или образования сложного эфира с последующим гидролизом, или внутримолекулярной фотохимической перегруппировки с получением соединения формулы (I-f-1)
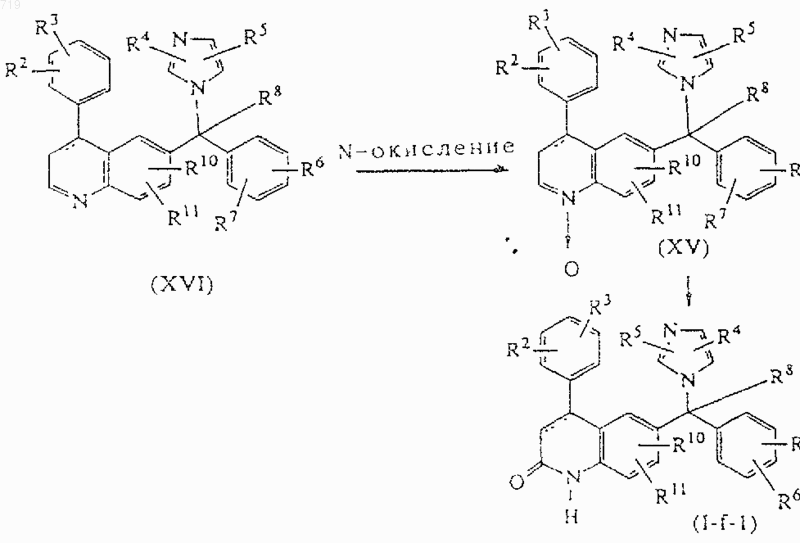
и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или наоборот превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы.
Текст
1 Настоящее изобретение относится к новым производным 2-хинолона, их получению, фармацевтическим композициям, включающим указанные новые соединения, и применению этих соединений в качестве лекарственного средства, а также к способам лечения путем введения указанных соединений. Онкогены часто кодируют белковые компоненты сигнальных путей трансдукции, что приводит к стимуляции роста клеток и митогенеза. Экспрессия онкогенов в культивируемых клетках приводит к трансформации клеток, которая характеризуется способностью клеток к росту на мягком агаре и к росту в форме плотных фокусов без контактного ингибирования,присущего нетрансформированным клеткам. Мутация и/или чрезмерная экспрессия определенных онкогенов часто связана с раковыми опухолями человека. Известна определенная группа онкогенов, как ras, которые идентифицированы у млекопитающих, птиц, насекомых,моллюсков, растений, грибков и дрожжей. Семейство ras онкогенов млекопитающих состоит из трех основных представителей ("изоформ"):H-ras, K-ras и N-ras онкогенов. Эти ras онкогены кодируют близкородственные белки, известные под родовым названием р 21ras. Присоединяясь к плазматическим мембранам, мутантные или онкогенные формы p21ras подают сигнал к трансформации и неконтролируемому росту злокачественных опухолевых клеток. Для приобретения данного трансформирующего потенциала предшественник онкопротеина p21ras должен подвергаться катализируемому ферментом фарнезилированию остатка цистеина, расположенного в карбоксил-терминальном тетрапептиде. Следовательно, ингибиторы фермента,который катализирует данное превращение или модифицирование фарнезилпротеинтрансферазы, будут предотвращать присоединение p21ras к мембране и блокировать аберрантный рост rasтрансформированных опухолей. Таким образом,распространено мнение о том, что ингибиторы фарнезилтрансферазы могут быть весьма полезны в качестве противораковых агентов для опухолей, в которых ras способствуют трансформации. Поскольку подвергшиеся мутации онкогенные формы ras часто обнаруживаются во многих опухолях человека, наиболее заметно в более чем 50% карцином толстого кишечника и поджелудочной железы (Kohl et al., Science, том 260, 1834-1837, 1993), было высказано предположение о том, что ингибиторы фарнезилтрансферазы могут быть весьма полезны против этих типов опухолей. В ЕР-0 371 564 описываются (1 Н-азол-1 илметил) замещенные производные хинолина и хинолинона, которые подавляют элиминирование из плазмы ретиноевых кислот. Некоторые из этих соединений обладают также способностью ингибировать образование андрогенов из 2 прогестинов и/или ингибировать действие ферментного комплекса ароматазы. Неожиданно было найдено, что новые соединения настоящей заявки, все имеющие фенильный заместитель в 4-положении фрагмента 2-хинолона, обладают ингибирующей активностью в отношении фарнезилтрансферазы. Настоящее изобретение охватывает соединения формулы их фармацевтически приемлемые соли присоединения кислот или оснований и стереохимически изомерные формы, где пунктирная линия обозначает необязательную связь; Х представляет кислород или серу;R2 и R3, каждый независимо, представляет водород, гидрокси, галоген, циано, C1-6 алкил,C1-6 алкилокси, гидроксиС 1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилокси, аминоС 1-6 алкилокси, моно- или ди(С 1-6-алкил) аминоС 1-6 алкилокси, Аr1,Ar2C1-6aлкил, Ar2oкcи, Аr2C1-6 алкилокси, гидроксикарбонил, C1-6 алкилоксикарбонил, тригалогенметил, тригалогенметокси, С 2-6 алкенил или находясь в смежных положениях, R2 и R3,взятые вместе, могут образовывать двухвалентный радикал формулыR11 представляет водород или C1-6 алкил;Ar1 представляет фенил или фенил, замещенный С 1-6 алкилом, гидрокси, амино, C1-6 алкилокси или галогеном;Ar2 представляет фенил или фенил, замещенный С 1-6 алкилом, гидрокси, амино, C1-6 алкилокси или галогеном; В предыдущих определениях и далее галоген означает фтор, хлор, бром и иод; C1-6 алкил определяет прямые и разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 6 атомов углерода, такие как, например, метил, этил, пропил, бутил, пентил, гексил и т.п.;C1-8 алкил охватывает прямые или разветвленные насыщенные углеводородные радикалы, как определено для C1-6-алкила, а также его высшие гомологи, содержащие 7 или 8 атомов углерода,такие как, например, гептил или октил; С 1-12 алкил также охватывает C1-8 алкил и его высшие гомологи, содержащие от 9 до 12 атомов углерода, такие как, например, нонил, децил, ундецил, додецил; С 2-6 алкенил определяет прямые и разветвленные углеводородные радикалы, содержащие одну двойную связь и имеющие от 2 до 6 атомов углерода, такие как, например, этенил, 2-пропенил, 3-бутенил, 2-пентенил, 3 пентенил, 3-метил-2-бутенил и т.п.;C1-6 алкандиил определяет двухвалентные прямые и разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 6 атомов углерода, такие как, например, метилен, 1,2 этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5 пентандиил, 1,6-гександиил и их разветвленные изомеры. Термин "С(=O)" относится к карбонильной группе. Термин "S(O)" относится к сульфоксиду, а термин "S(O)2" - к сульфону. Подразумевается, что фармацевтически приемлемые соли присоединения кислот или оснований, упомянутые выше, включают терапевтически активные нетоксичные соли присоединения кислот и нетоксичные соли присоединения оснований, которые соединения формулы(I) способны образовывать. Соединения формулы (I), имеющие основные свойства, могут превращаться в свои фармацевтически приемлемые соли присоединения кислот путем обработки указанной основной формы соответствующей кислотой. Соответствующие кислоты включают,например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористоводородная или бромистоводородная кислота, серная, азотная, фосфорная и т.п. кислоты; или органические кислоты, такие как, например, 000719 4 уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (т.е. бутандиоевая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и т.п. кислоты. Соединения формулы (I), имеющие кислотные свойства, могут превращаться в их фармацевтически приемлемые соли присоединения оснований путем их обработки указанной кислой формы подходящим органическим или неорганическим основанием. Подходящие формы солей оснований включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия,магния, кальция и т.п.; соли с органическими основаниями, например с бензатином, N-метилD-глюкамином, гидрабаминовые соли и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термины "соль присоединения кислоты или основания" также включают гидраты и формы присоединения растворителя, которые могут образовывать соединения формулы (I). Примерами таких форм являются гидраты, алкоголяты и т.п. Термин "стереохимически изомерные формы" соединений формулы (I), используемый здесь выше, определяет все возможные соединения, построенные из тех же атомов, соединенных той же последовательностью связей, но имеющие различные пространственные структуры, которые не являются взаимозаменяемыми, которыми могут обладать соединения формулы (I) . Если не указывается иное, химическое обозначение соединения включает смесь всех возможных стереохимически изомерных форм,которые может иметь указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Имеется в виду, что все стереохимически изомерные формы соединений формулы (I), как в чистом виде, так и в виде смесей, охватываются объемом настоящего изобретения. Некоторые из соединений формулы (I) могут существовать также в их таутомерных формах. Такие формы, хотя и не указываются явным образом в приведенной выше формуле,также включены в объем настоящего изобретения. Во всех случаях использования в настоящем документе подразумевается, что термин"соединения формулы (I)" включает также фармацевтически приемлемые соли присоединения кислот или оснований и все стереоизомерные формы. Х предпочтительно представляет кислород.R1 подходящим образом представляет водород, C1-6 алкил, предпочтительно метил, этил,пропил; Аr1 предпочтительно фенил; Аr2C1-6 алкил, предпочтительно бензил, метоксифенилэтил; радикал формулы -Alk-C(=O)-R9, где Alk предпочтительно представляет метилен, а R9 предпочтительно представляет гидроксильную группу; C1-6 алкилокси, например этокси; C1-8 алкиламино, замещенный C1-6 алкилоксикарбонилом.R2 и R3, каждый независимо, представляет подходящим образом водород, галоген, предпочтительно фтор, хлор, бром; C1-6 алкил, предпочтительно метил; тригалогенметил, предпочтительно трифторметил; C1-6 алкилокси, предпочтительно метокси или этокси; Аr2 окси, предпочтительно фенокси; Аr2R4 и R5, каждый независимо, представляет подходящим образом водород; Аr1, предпочтительно, фенил; C1-6 алкил, предпочтительно метил; C1-6 алкилтио, предпочтительно метилтио; амино; С 1-6 алкилоксикарбонил, предпочтительно метоксикарбонил.R6 и R7, каждый независимо, представляет подходящим образом водород; галоген, предпочтительно хлор, фтор; C1-6 алкил, предпочтительно метил; C1-6 алкилокси, предпочтительно метокси.R8 представляет подходящим образом водород; C1-6 алкил, предпочтительно метил, этил или пропил; Аr1 предпочтительно хлорфенил;R10 и R11 представляют водород. Предпочтительно, заместитель R10 расположен в 5- или 7-положении хинолинонового фрагмента, а заместитель R11 расположен в 8 положении, когда R10 расположен в 7 положении. Интересной группой соединений являются такие соединения формулы (I), в которых R1 представляет, водород, С 1-12 алкил или С 1-6 алкилоксиС 1-6 алкил. Еще одной интересной группой соединений являются такие соединения, в которых R3 представляет водород, а R2 представляет галоген, предпочтительно хлор, особенно 3-хлор. Еще одной интересной группой соединений являются такие соединения, в которых R2 иR3 находятся в смежных положениях и образуют двухвалентный радикал формулы (а-1). 6 Еще одной интересной группой соединений являются такие соединения, в которых R5 представляет водород, R4 представляет водород,C1-6 алкил или Аr1, предпочтительно фенил. Еще одной интересной группой соединений являются соединения формулы (I), в которых R7 представляет водород, a R6 представляет галоген, предпочтительно хлор, особенно 4 хлор. Особого внимания заслуживают соединения формулы (I), в которых R2 представляет водород, C1-6 алкил или гидроксиС 1-6 алкил. Более интересными являются соединения формулы (I), в которых R1 представляет метил,R2 представляет 3-хлор, R4 представляет водород или 5-метил, R5 представляет водород, R6 представляет 4-хлор, a R8 представляет водород,C1-6 алкил или гидроксиС 1-6 алкил. Предпочтительными соединениями являются 4-(3-хлорфенил)-6-[(4-хлорфенил)-1Hимидазол-1-илметил]-1-метил-2(1 Н)-хинолинон; 4-(3-хлорфенил)-6-[(4-хлорфенил)-1 Нимидазол-1-илметил]-2(1H)-хинолинон; 6-[1-(4-хлорфенил)-2-гидрокси-1-(1 Нимидазол-1-ил)этил]-1-метил-4-фенил-2(1H)хинолинон; 4-(3-хлорфенил)-6-[1-(4-хлорфенил)-1-(1 Нимидазол-1-ил)-этил]-1-метил-2(1H)-хинолинон; 4-(3-хлорфенил)-6-[1-(4-хлорфенил)-1-(5 метил-1 Н-имидазол-1-ил)этил]-1-метил-2(1H)хинолинон; 4-(3-хлорфенил)-6-[1-(4-хлорфенил)-2 гидрокси-1-(1H-имидазол-1-ил)этил]-1-метил 2(1H)-хинолинон; 4-(3-хлорфенил)-6-[(4-хлорфенил)(1 Нимидазол-1-ил)метил]-1-(2-метоксиэтил)-2(1H)хинолинон этандиоат (2:3) моногидрат; 6-[(4-хлорфенил)(1 Н-имидазол-1-ил)метил]-4-(1,3-бензодиоксол-5-ил)-1-метил-2(1H)хинолинон этандиоат (1:1); их стереоизомерные формы и фармацевтически приемлемые соли присоединения кислот или оснований. Соединения формулы (I) могут быть получены путем N-алкилирования имидазола формулы (II) или его соли со щелочным металлом производным формулы (III). В формуле (III) W представляет подходящую реакционноспособную удаляемую группу,такую как, например, галоген, например фтор,хлор, бром, иод, или сульфонилоксигруппу, например 4-метилбензолсульфонилокси, бензолсульфонилокси, 2-нафталинсульфонилокси, метансульфонилокси, трифторметансульфонилок 7 си, и подобные реакционноспособные удаляемые группы. Описанное выше N-алкилирование удобно выполнять путем перемешивания реагентов в присутствии подходящего растворителя, такого как, например, полярный апротонный растворитель, например N,N-диметилформамид, N,Nдиметилацетамид, диметилсульфоксид, ацетонитрил; предпочтительно в присутствии подходящего основания, такого как карбонат калия,или органического основания, такого как, например, N,N-диметил-4-пиридинамин, пиридин,N,N-диэтилэтанамин. В некоторых случаях может быть выгодным использовать избыток имидазола (II) или сначала превратить имидазол в его подходящую соль, такую как, например,соль со щелочным или щелочно-земельным металлом, путем реакции (II) с соответствующим основанием, как определено выше, и в дальнейшем использовать указанную соль в реакции с алкилирующим реагентом формулы (III). Соединения формулы (I) могут быть получены также путем реакции промежуточного соединения формулы (IV) с реагентом формулы(V), в которой Y представляет углерод или серу,таким как, например, 1,1'-карбонил-бис[1Hимидазол]. Указанную реакцию можно удобно проводить в подходящем растворителе, таком как,например, эфир, например тетрагидрофуран; необязательно в присутствии основания, такого как гидрид натрия. Во всех предыдущих и последующих описаниях получений продукты реакции могут быть выделены из реакционной смеси и, если это необходимо, подвергнуты дополнительной очистке согласно методикам, известным специалистам, таким как, например, экстракция,перегонка, кристаллизация, порошкование и хроматография. Соединения формулы (I), в которых пунктирная линия обозначает связь, определяются как соединения формулы (I-а) и могут быть получены также путем циклизации промежуточного соединения формулы (VI). Реакцию циклизации (VI) можно проводить согласно процедурам циклизации, известным специалистам, как описано, например, вSynthesis, 739 (1975). Предпочтительно, реакцию проводят в присутствии подходящей ки 000719 8 слоты Льюиса, например хлорида алюминия,или чистого или в подходящем растворителе,таком как, например, ароматический углеводород, например хлорбензол. Несколько повышенные температуры могут повысить скорость реакции. Также, в зависимости от природы заместителей R2/R3, эти заместители у одного фенильного фрагмента могут отличаться от заместителей R2/R3 у другого фенильного фрагмента,как описано в работе Natarajian M., et al., IndianJournal of Chemistry, 23B:720-727 (1984). Соединения формулы (I-a-1), в которых R1 представляет водород, Х представляет кислород, а пунктирная линия обозначает связь, могут быть получены путем гидролиза промежуточных соединений формулы (XXVI), в которых R представляет C1-6 алкил, согласно известным методикам, таким как перемешивание промежуточного соединения (XXVI) в водном растворе кислоты. Подходящей кислотой является, например, хлористоводородная кислота. Затем соединения формулы (I-a-1) могут превращаться в соединения формулы (I-а) согласно способам Соединение формулы (I-b), определяемое как соединение формулы (I), в котором R8 представляет гидроксиметилен, может быть получено путем раскрытия кольца эпоксида формулы Соединения формулы (I), в которых R1 представляет водород,а Х представляет кислород, определяемые как соединения формулы (I-f-1), могут быть получены путем реакции нитрона формулы (XV) с ангидридом карбоновой кислоты, таким как,например, уксусный ангидрид, образуя, таким образом, соответствующий сложный эфир 2 положения хинолинового фрагмента. Указанный хинолиновый сложный эфир может гидролизоваться in situ в соответствующий хинолинон с использованием основания, такого как,например, карбонат калия. Альтернативно, соединения формулы (I-f1) могут быть получены путем реакции нитрона 9 формулы (XV) с сульфонилсодержащим электрофильным реагентом, таким как, например, птолуолсульфонилхлорид, в присутствии основания, такого как, например, водный карбонат калия. Реакция вначале включает образование производного 2-гидроксихинолина, который впоследствии таутомеризуется в желаемое производное хинолинона. Применение известных специалистам условий катализа фазового переноса может повысить скорость реакции. Соединения формулы (I-f-1) могут быть получены также путем внутримолекулярной фотохимической перегруппировки соединений формулы (XV). Указанную перегруппировку можно осуществить путем растворения реагентов в реакционно-инертном растворителе и облучения при длине волны 366 нм. Благоприятно использовать дегазированные растворы и проводить реакцию в инертной атмосфере, такой как, например, газ аргон или азот, свободный от кислорода, для того, чтобы свести к минимуму нежелательные побочные реакции или снижение количественного выхода. Соединение формулы (I), в которых R1 представляет водород, определяемые как соединения формулы (I-c-1), могут быть превращены в соединения формулы (I-с-2), в которых R1b имеет значения, определенные для R1, за исключением водорода. Например, соединения формулы (I-c-1) могут N-алкилироваться с помощью R1b-W1, где W1 представляет реакционноспособную удаляемую группу, такую как,например, галоген или группа сульфонилокси, в присутствии основания, такого как, например,гидрид натрия. Указанную реакцию удобнее выполнять путем смешивания реагентов в реакционноинертном растворителе, таком как, например,N,N-диметилформамид. Может быть целесообразным проводить реакцию при слегка пониженных температурах. Помимо этого, может быть выгодным проведение указанного Nалкилирования в инертной атмосфере, такой как, например, газ аргон или азот. Указанную реакцию можно также выполнять с использованием известных в технике условий катализа фазового переноса (РТС), таких как перемешивание реагентов в смеси концентрированного водного раствора гидроксида натрия и органиче 000719 10 ского растворителя, такого как тетрагидрофуран, в присутствии катализатора фазового переноса, такого как бензилтриэтиламмонийхлорид(БТЭАХ). В том случае, если R1b является арилом, Nалкилирование можно проводить путем реакции соединения формулы (I-c-1) с таким реагентом,как дифенилиодонийхлорид, в присутствии хлорида меди (1) (CuCl) в подходящем растворителе, например метаноле, в присутствии основания, такого как метоксид натрия. Соединения формулы (I), в которых R1 представляет R1b, a R8 представляет водород,определяемые как соединения формулы (I-d-1),также могут превращаться в соединения формулы (I-d-2), в которых R8a представляет гидроксиС 1-6 алкил,C1-6 алкил,C1-6-алкилоксиC1-6 алкил, аминоС 1-6 алкил, моно- или ди-С 1-6 алкиламиноС 1-6-алкил. Например, соединения формулы (I-d-1) могут алкилироваться реагентом формулы R8a-W1, где W1 представляет реакционноспособную удаляемую группу, такую как, например, галоген или группа сульфонилокси, и в присутствии основания, такого как, например, гидрид натрия. Указанное алкилирование удобно выполнять путем смешивания реагентов в реакционно-инертном растворителе, таком как,например,тетрагидрофуран илиN,Nдиметилформамид, в присутствии основания,такого как трет-бутоксид калия. Помимо этого,может быть выгодным проведение указанного алкилирования в инертной атмосфере, такой как, например, аргон или азот. Соединение формулы (I-е), определяемое как соединение формулы (I), в котором Х представляет серу, может быть получено путем реакции соответствующего соединения формулы(I-f), определяемого как соединение формулы Указанную реакцию можно проводить путем перемешивания и, необязательно, нагревания соединения формулы (I-f) в присутствии пятисернистого фосфора (Р 4S10) или реагента 11 Соединения формулы (I) также можно получить путем построения имидазольного кольца в качестве конечной стадии. Такие реакции циклизации иллюстрируются в примерах 19 и 21. Соединения формулы (I) также можно превращать друг в друга посредством известных в технике реакций или преобразований функциональных групп. Ряд таких преобразований уже был описан выше. Другие примеры представляют гидролиз эфиров карбоновых кислот в соответствующую карбоновую кислоту или спирт; гидролиз амидов в соответствующие карбоновые кислоты или амины; аминогруппы у имидазола или фенила можно замещать водородом посредством известных в технике реакций диазотирования и последующего замещения диазогруппы водородом; спирты могут превращаться в сложные и простые эфиры; первичные амины могут превращаться во вторичные или третичные амины; двойные связи могут гидрироваться в соответствующую одинарную связь. Промежуточные соединения, описанные выше, могут быть получены способами, известными в технике. Некоторые из этих способов приводятся ниже. Промежуточные соединения формулы (IV) могут быть получены путем реакции замещенного производного 4-фенил-2-хинолона формулы (VIII) с карбоновой кислотой формулы (IX) или ее функциональным производным, например хлорангидридом кислоты, с получением кетона формулы (X). Указанную реакцию осуществляют путем перемешивания реагентов в подходящем растворителе в присутствии кислоты, такой как полифосфорная кислота. Впоследствии кетон может восстанавливаться, давая промежуточные соединения, в которых R8 представляет водород или которые реагируют с подходящим реагентом присоединения. Промежуточные соединения формулы (III) могут быть получены, исходя из промежуточных соединений формулы (IV), путем реакции промежуточного соединения формулы (IV) с соответствующим реагентом для превращения гидроксильной группы в реакционноспособную удаляемую группу. Подходящими реагентами превращения являются, например, тионилхлорид для получения промежуточных соединений формулы (III), в которых W представляет хлор или хлорсульфит; или п-толуолсульфонилхлорид для получения промежуточных соединений формулы (III), в которых W представляет группу п-толуолсульфонил. Промежуточные соединения формулы(VII) могут быть получены путем реакции кетона формулы (X) с сероилидом, например диметилоксосульфонийметилидом, в подходящих условиях. Промежуточные соединения формулы (VI) могут быть получены, как изображено на схеме(XII). Указанное нитрофенильное производное затем восстанавливается, давая производное анилина формулы (XIII), которое затем подвергается реакции с кислотным производным формулы (XIV), давая промежуточное соединение формулы (VI). Схема II Промежуточные нитроны формулы (XV) могут быть получены путем N-окисления хинолиновых производных формулы (XVI) соответствующим окисляющим агентом, таким как,например, м-хлорпероксибензойная кислота, в подходящем растворителе, таком как, например,дихлорметан. Хинолины формулы (XVI) могут быть получены по аналогии с превращением промежуточных соединений формулы (X) в промежуточные соединения формулы (III) и последующим их N-алкилированием промежуточными соединениями формулы (II), но, исходя из хинолиновых производных, полученных согласно известным приемам, например, как описано в работе J.Kenner et al., J.Chem.Soc., 299(1935). Указанное N-окисление может также выполняться с использованием предшественника хинолина формулы (XVI). Полагают, что промежуточные соединения формулы (XVI) метаболизируются в соединения формулы (I). Следовательно, промежуточные соединения формулы (XVI) могут действовать как пролекарства соединений формулы (I). Промежуточные соединения формулы (Ха), являясь промежуточными соединениями формулы (X), в которых пунктирная линия обозначает связь, могут быть получены по схеме На схеме III промежуточные соединения формулы (XVII) подвергаются реакции с промежуточными соединениями формулы (XVIII),в которых Z является соответствующим образом защищенной оксогруппой, такой как, например,1,3-диоксолан, давая промежуточные соединения формулы (XIX), которые впоследствии превращаются в промежуточные соединения формулы (XX) с использованием условий каталитического гидрирования, например используя газообразный водород и палладий-на-угле в реакционно-инертном растворителе, таком как, например, тетрагидрофуран. Промежуточные соединения формулы (XX) превращаются в промежуточные соединения формулы (XXI), с помощью подвержения промежуточных соединений (XX) реакции ацетилирования, например путем обработки их ангидридом карбоновой кислоты, например уксусным ангидридом, в реакционно-инертном растворителе, например толуоле, необязательно в присутствии основания для улавливания кислоты, высвобождающейся во время реакции, и последующей обработки основанием, таким как, например, третбутоксид калия, в реакционно-инертном растворителе, например 1,2-диметоксиэтане. Промежуточные соединения формулы (Х-а-1), являясь промежуточными соединениями формулы (Х-а), 000719 14 в которых R1 представляет водород, могут быть получены путем удаления защитной группы Z из промежуточных соединений формулы (XXI) с помощью известных условий реакции, например, кислотных условий. Промежуточные соединения формулы (Х-а-1) могут превращаться в промежуточные соединения формулы (Х-а) с помощью известных реакций N-алкилирования. Промежуточные соединения формулы (Ха-1) также можно получить обработкой промежуточных соединений формулы (XIX) ТiСl3 в присутствии воды, в реакционно-инертном растворителе, таком как, например, тетрагидрофуран, или путем каталитического гидрирования,получая промежуточные соединения формулы(XXII), которые впоследствии превращаются в промежуточные соединения (Х-1) с использованием тех же реакций, которые описаны выше для превращения промежуточных соединений Схема IV изображает синтез промежуточных соединений формулы (XXVI-a), в которыхR8b представляет заместитель, соответствующим образом выбранный из R8 так, чтобы быть подходящим в реакции присоединения литийорганического производного соединения (XXIII) к оксогруппе промежуточного соединения На схеме IV промежуточное соединение формулы (XXIII), в которой W2 представляет галоген, обрабатывается литийорганическим реагентом, таким как, например, н-бутиллитий,в реакционно-инертном растворителе, например тетрагидрофуране, и впоследствии подвергается реакции с промежуточным соединением формулы (XXIV), давая промежуточное соединение формулы (XXV), которое впоследствии превращается в промежуточное соединение формулы(XXVI) с помощью обработки промежуточным соединением формулы (V). Соединения формулы (I) и некоторые из промежуточных соединений имеют в своей структуре, по меньшей мере, один стереоген 15 ный центр. Этот стереогенный центр может присутствовать в конфигурации R или S. Соединения формулы (I) , полученные согласно описанным выше способам, обычно представляют рацемические смеси энантиомеров, которые можно отделить друг от друга с помощью известных специалистам способов разделения. Рацемические соединения формулы(I) можно превратить в соответствующие диастереомерные солевые формы с помощью реакции с подходящей хиральной кислотой. Указанные диастереомерные солевые формы впоследствии разделяют, например, путем селективной или фракционной кристаллизации, и энантиомеры высвобождают из них щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, при условии, что реакция протекает стереоспецифически. Предпочтительно, если желательно получение конкретного стереоизомера, указанное соединение синтезируют с помощью стереоспецифических способов получения. В этих способах преимущественно используются энантиомерно чистые исходные материалы. Настоящее изобретение обеспечивает способ ингибирования аномального роста клеток,включая трансформированные клетки, путем введения эффективного количества соединения настоящего изобретения. Аномальный или патологический рост клеток относится к росту клеток, не зависящему от нормальных регуляторных механизмов (например, при утрате контактного ингибирования). Это включает патологический рост:(2) опухолевых клеток, в которых ras белок активируется в результате онкогенной мутации другого гена;(3) доброкачественных и злокачественных клеток других пролиферативных заболеваний,при которых происходит аберрантная активацияras. Далее, в научной литературе было высказано положение о том, что ras онкогены способствуют росту опухолей in vivo не только путем прямого воздействия на рост опухолевых клеток, но также и косвенных путем, т.е. посредством облегчения индуцированного опухолью ангиогенеза (Rak J., et al., Cancer Research, 55,4575-4580, 1995). Таким образом, фармакологическое нацеливание на мутантные ras онкогены предположительно могло бы подавлять рост твердых опухолей in vivo, частично путем ингибирования индуцированного опухолью ангиогенеза. 16 Настоящее изобретение обеспечивает также способ ингибирования роста опухолей путем введения эффективного количества соединения настоящего изобретения пациенту, например млекопитающему (и более конкретно, человеку), который нуждается в подобном лечении. В частности, данное изобретение предоставляет способ ингибирования роста опухолей, экспрессирующих активированный ras онкоген, путем введения эффективного количества соединений настоящего изобретения. Примерами опухолей,которые могут быть ингибированы, но которые не ограничиваются ими, могут служить рак легкого (например, аденокарцинома), злокачественные опухоли поджелудочной железы (например, карцинома поджелудочной железы,такая как, например, экзокринная карцинома поджелудочной железы), злокачественнные опухоли толстого кишечника (например, колоректальные карциномы, такие как, например,аденокарцинома и аденома толстого кишечника), гематопоетические опухоли лимфоидного ряда (например, острый лимфолейкоз, Вклеточная лимфома, лимфома Burkitt), миелоидные лейкозы (например, острый миелолейкоз(ОМЛ, фолликулярный рак щитовидной железы, миелодиспластический синдром (МДС),опухоли мезенхимального происхождения (например, фибросаркомы и рабдомиосаркомы),меланомы, тератокарциномы, нейробластомы,глиомы, доброкачественные опухоли кожи (например, кератоакантомы), рак молочной железы, рак почки, рак яичника, рак мочевого пузыря и рак эпидермиса. Настоящее изобретение может также предоставить способ ингибирования пролиферативных заболеваний, как доброкачественных,так и злокачественных, при которых происходит аберрантная активация ras белков в результате онкогенной мутации в генах, т.е., когда сам генras не активируется онкогенной мутацией в онкогенную форму; указанное ингибирование осуществляется путем введения эффективного количества соединений, описанных в настоящем документе, пациенту, который нуждается в подобном лечении. Например, доброкачественное пролиферативное заболевание нейрофиброматоз или опухоли, при которых ras активируется вследствие мутации или повышенной экспрессии онкогенов тирозинкиназы, можно ингибировать соединениями настоящего изобретения. Настоящее изобретение также относится к соединениям формулы (I), определенным выше,для применения в качестве лекарственного средства. Ввиду их полезных фармакологических свойств заявляемые соединения можно изготавливать в виде различных фармацевтических форм для введения. Для изготовления фармацевтических композиций настоящего изобретения эффективное количества конкретного соединения в форме соли присоединения основа 17 ния или кислоты в качестве активного ингредиента комбинируется в форме гомогенной смеси с фармацевтически приемлемым носителем,который может иметь различные формы, в зависимости от требующейся для введения формы препарата. Эти фармацевтические композиции желательны в виде единичных доз, подходящих,предпочтительно, для введения пероральным,ректальным, кожным путем или путем парентеральной инъекции. Например, при изготовлении композиции в форме для перорального введения можно использовать любую из обычных фармацевтических сред, таких как, например, вода,гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие агенты, связующие агенты, разрыхлители и т.п. в случае порошков,пилюль, капсул и таблеток. В силу простоты их введения, таблетки и капсулы представляют наиболее выгодную дозированную лекарственную форму, для которой, как это ясно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере, в большей части, хотя могут добавляться и другие ингредиенты, например для улучшения растворимости. Например, могут изготавливаться растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Могут изготавливаться также суспензии для инъекций, в которых могут использоваться соответствующие жидкие носители, суспендирующие агенты и т.п. В композициях, подходящих для кожного введения, носитель, необязательно, включает агент, усиливающий проникновение и/или подходящий смачивающий агент,необязательно в сочетании с подходящими добавками любой природы в незначительных количествах, которые не оказывают значительного вредного действия на кожу. Указанные добавки могут облегчить введение в кожу и/или могут способствовать изготовлению желаемых композиций. Эти композиции могут вводиться различными путями, например в форме трансдермального пластыря, в форме аппликации, в форме мази. Особенно благоприятно приготавливать вышеупомянутые фармацевтические композиции в виде единичных доз лекарственных форм для простоты введения и равномерности дозировок. Используемый в описании и формуле изобретения термин "единичная доза лекарственной формы" относится к физически дискретным единицам, удобным для применения в виде стандартных дозировок; эти единицы содержат каждая заранее известное количество активного ингредиента, рассчитанное для оказания желаемого терапевтического действия, в сочетании с требующимся для этой цели фармацевтическим носителем. Примерами таких еди 000719 18 ничных доз лекарственных форм являются таблетки (включая таблетки с зарубками и таблетки с покрытием), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, растворы, отмеряемые для приема чайными ложками, столовыми ложками и т.п., а также агрегированные множественные дозы перечисленных форм. Специалисты легко могут определить эффективное количество по результатам испытаний, представленных ниже в настоящем документе. В целом предполагается, что эффективное количество будет составлять от 0,01 до 100 мг/кг веса тела, и, в особенности, от 0,05 до 10 мг/кг веса тела. Может быть удобно вводить требующееся количество в течение дня в виде раздельных доз в два, три, четыре или более приемов, с нужными интервалами. Указанные раздельные дозы могут быть в виде дозированных лекарственных форм, например, содержащих от 0,5 до 500 мг, и в особенности, от 1 до 200 мг активного ингредиента в дозированной единице. Экспериментальная часть В настоящем документе ниже "ТГФ" означает тетрагидрофуран, "ДИПЭ" означает диизопропиловый эфир, "ДХМ" означает дихлорметан, "ДМФ" означает N,N-диметилформамид и "АЦН" означает ацетонитрил. Для некоторых соединений формулы (I) абсолютная стереохимическая конфигурация экспериментально не определялась. В этих случаях стереохимически изомерная форма, которая была выделена первой, обозначается как "А", а вторая - как "В",без дополнительной ссылки на действительную стереохимическую конфигурацию. А. Получение промежуточных соединений. Пример 1. а) Имидазол (121,8 г) добавляли к смеси 1(хлорфенилметил)-4-нитробензола (88,7 г) и АЦН (1000 мл) и реакционную смесь перемешивали и нагревали с обратным холодильником в течение 24 ч. Растворитель удаляли выпариванием. Остаток растворяли в толуоле, промывали 10% раствором К 2 СО 3, сушили (MgSO4), фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле(элюент: CH2Cl2/CH3OH 98/2). Чистые фракции собирали и растворитель выпаривали, получая 53 г (53%) 1-[(4-нитрофенил)фенилметил]-1 Нимидазола (промежуточное соединение 1-а).b) Смесь промежуточного соединения (1-а)(39 г) и этанола (300 мл) гидрировали (3,9 х 105 Па Н 2) с никелем Ренея (20 г) в качестве катализатора. После поглощения водорода (3 эквивалента) катализатор отфильтровывали, а фильтрат выпаривали, получая 34,6 г -4-[(1 Нимидазол-1-ил)фенилметил]бензоламина (промежуточное соединение 1-b).c) Смесь промежуточного соединения (1-b) 19 комнатной температуре в течение ночи. Смесь выливали в 10% раствор NаНСО 3. Эту смесь экстрагировали ДХМ и разделяли. Органический слой сушили (MgSO4), фильтровали и выпаривали, получая 22,85 г (100%) -N-[4-[(1 Нимидазол-1-ил)-фенилметил]фенил]-3,3-дифенил-2-пропенамида (промежуточное соединение 1-с). Этот продукт в дальнейшем использовали без дополнительной очистки. Пример 2.a) 4-Хлорбензойную кислоту (21,23 г) и 3,4-дигидро-4-фенил-2(1 Н)-хинолинон (15 г) нагревали в полифосфорной кислоте (150 г) при 140 С в течение 24 ч. Смесь выливали в ледяную воду и фильтровали. Осадок поглощали ДХМ. Органический слой промывали NаНСО 3(10%) и водой, сушили (MgSO4) и выпаривали. Остаток кристаллизовали из 2-пропанона, получая 12,34 г (50%) -6-(4-хлорбензоил)-3,4 дигидро-4-фенил-2(1 Н)-хинолинона; т.пл. 204 Сb) Боргидрид натрия (12,5 г) при 0 С добавляли порциями к раствору промежуточного соединения (2-а) (20 г) в метаноле (200 мл) и ТГФ (5 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Смесь гасили водой и выпаривали. Остаток брали в ДХМ и промывали К 2 СО 3 (10%). Органический слой сушили (MgSO4), фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/ СН 3 ОН 96/4). Чистые фракции собирали и выпаривали, получая 2,8 г (14%) -6-[(4 хлорфенил)гидроксиметил]-3,4-дигидро-4-фенил-2(1 Н)-хинолинона (промежуточное соединение 2-b). Пример 3. Смесь-6-[гидрокси(3-фторфенил)метил]-4-фенил-2(1 Н)-хинолинона (11 г) в тионилхлориде (11 мл) и ДХМ (120 мл) перемешивали при комнатной температуре в течение 12 ч. Растворитель выпаривали досуха и использовали в дальнейшем без дополнительной очистки, получая 11,6 г -6-[хлор(3-фторфенил)метил]-4 фенил-2(1 Н)-хинолинона (100%) (промежуточное соединение 3). Пример 4. Смесь гидрида натрия (1,75 г) и ТГФ (30 мл) перемешивали в течение 5 мин. Тетрагидрофуран удаляли выпариванием. Затем добавляли диметилсульфоксид (120 мл), а после него триметилсульфоксония иодид (12,1 г) и полученную смесь перемешивали в течение 30 мин при комнатной температуре в токе N2. По частям добавляли 6-(4-хлорбензоил)-1-метил-4 фенил-2(1 Н)-хинолинон (17 г) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Добавляли этилацетат и воду. Органический слой отделяли, дважды промывали водой, сушили (MgSO4), фильтровали и растворитель выпаривали. Сырой продукт использовали без дополнительной очистки на следую 000719(MgSO4), фильтровали и выпаривали досуха. Продукт в дальнейшем использовали без дополнительной очистки, получая 24,2 г (93%) -N[(4-хлорфенил)-(1,2-дигидро-1-метил-2-оксо-4 фенил-6-хинолинил)метил]формамида (промежуточное соединение 5-а).b) Смесь промежуточного соединения (5-а)(21,2 г) в хлористоводородной кислоте (3N) (150 мл) и 2-пропанола (150 мл) перемешивали и нагревали с обратным холодильником в течение ночи. Смесь выливали в лед, подщелачивали с помощью NH4OH и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали досуха. Остаток очищали посредством колоночной хроматографии на силикагеле(элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1). Чистые фракции собирали и выпаривали, получая 11,6 г (59%) -6-[амино-(4-хлорфенил)метил]1-метил-4-фенил-2(1 Н)-хинолинона (промежуточное соединение 5-b).c) Этил N-цианметанимидат (3,6 г) добавляли по каплям при комнатной температуре к раствору промежуточного соединения (5-b)(10,6 г) в этаноле (90 мл) и смесь перемешивали при комнатной температуре в течение 48 ч. Добавляли воду и этилацетат, органический слой сливали, промывали водой, сушили (MgSО 4),фильтровали и выпаривали досуха. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/ СН 3 ОН/NН 4OН 97/3/0,1). Чистые фракции собирали и выпаривали, получая 10,5 г (88%) -N-(4 хлорфенил)(1,2-дигидро-1-метил-2-оксо-4 фенил-6-хинолинил)метил]амино]метилен]цианамида (промежуточное соединение 5-с).d) Этил 2-бромацетат (2,45 мл) добавляли по каплям при 5 С к раствору промежуточного соединения (5-с) (9 г) и калиевой соли 2-метил 2-пропанола (2,37 г) в диметилсульфоксиде (100 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и этилацетат, органический слой сливали, сушили(MgSO4), фильтровали и выпаривали досуха. Продукт в дальнейшем использовали без дополнительной очистки, получая -этил N-[(4 хлорфенил)(2,3-дигидро-1-метил-2-оксо-4 фенил-6-хинолинил)-метил]-N-[(цианимино)метил]глицин(промежуточное соединение 5-d).a) 2-Изотиоцианат-1,1-диметоксиэтан (5,3 г) медленно добавляли к раствору -6[амино(4-хлорфенил)метил]-4-фенил-2(1 Н)хинолинона (11 г) в метаноле (100 мл) и смесь перемешивали и нагревали при 80 С в течение 5 ч. Смесь выпаривали досуха и продукт в дальнейшем использовали без дополнительной очистки, получая 15,4 г (100%) -N-[(4-хлорфенил)(1,2-дигидро-2-оксо-4-фенил-6-хинолинил) метил]-N'-(2,2-диметоксиэтил) тиомочевиныb) Смесь промежуточного соединения (6-а)(5 г) в 2-пропаноне (50 мл) перемешивали при комнатной температуре в течение одной ночи. Смесь выпаривали, остаток брали в ДХМ и промывали 10% раствором К 2 СО 3. Органический слой сушили (MgSO4), фильтровали и выпаривали, получая 17,8 г (100%) -метил N[(4-хлорфенил)(1,2-дигидро-2-оксо-4-фенил-6 хинолинил)метил-N'-(2,2-диметоксиэтил) карбамимидотиоата (промежуточное соединение 6b), который в дальнейшем использовали без дополнительной очистки. Пример 7. а) Толуол (1900 мл перемешивали в круглодонной колбе (5 л) с использованием водного сепаратора. Порциями добавляли (4 хлорфенил)(4-нитрофенил)метанон (250 г). Порциями добавляли п-толуолсульфоновую кислоту (54,5 г). В смесь приливали этиленгликоль (237,5 г). Смесь перемешивали и нагревали с обратным холодильником в течение 48 ч. Растворитель выпаривали. Остаток растворяли в этилацетате (5 л) и дважды промывали 10% раствором К 2 СО 3. Органический слой отделяли,сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток перемешивали в ДИПЭ,фильтровали и сушили (вакуум, 40 С, 24 ч), получая 265 г (91%) 2-(4-хлорфенил)-2-(4 нитрофенил)-1,3-диоксоланаb) Гидроксид натрия (16,4 г) и (3 метоксифенил)ацетонитрил (20, 6 мл) добавляли при комнатной температуре к раствору промежуточного соединения (7-а) (25 г) в метаноле(100 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду,осадок отфильтровывали, промывали холодным метанолом и сушили. Продукт в дальнейшем использовали без дополнительной очистки, получая 30 г (90%) 5-[2-(4-хлорфенил)-1,3 диоксолан-2-ил]-3-(3-метоксифенил)-2,1-бензизоксазола (промежуточное соединение 7-b).c) Промежуточное соединение (7-b) (30 г) в ТГФ (250 мл) гидрировали с палладием-наугле (3 г) в качестве катализатора при комнатной температуре в течение 12 ч, в аппарате Парра при давлении 2,6 х 105 Па. После поглощения Н 2 (1 эквивалент) катализатор отфильтровывали 22 через целит, а фильтрат выпаривали досуха. Продукт в дальнейшем использовали без дополнительной очистки, получая 31,2 г (100%) (3 метоксифенил)[2-амино-5-[2-(4-хлорфенил)-1,3 диоксолан-2-ил]фенил]метанона (промежуточное соединение 7-с).d) Уксусный ангидрид (13,9 мл) добавляли к раствору промежуточного соединения (7-с)(31,2 г) в толуоле (300 мл) и смесь перемешивали и нагревали с обратным холодильником в течение 2 ч. Смесь выпаривали досуха и продукт в дальнейшем использовали без дополнительной очистки, получая 36,4 г (100%) N-[2-(3 метоксибензоил)-4-[2-(4-хлорфенил)-1,3 диоксолан-2-ил]фенил]-ацетамида(промежуточное соединение 7-d). е) Трет-бутоксид калия (33 г) добавляли по частям при комнатной температуре к раствору промежуточного соединения (7-d) (36,4 г) в 1,2 диметоксиэтане (350 мл) и смесь перемешивали при комнатной температуре в течение ночи. Смесь гидролизовали и экстрагировали ДХМ. Органический слой сушили (МgSO4), фильтровали и выпаривали досуха. Продукт в дальнейшем использовали без дополнительной очистки,получая 43 г (100%) 6-[2-(4-хлорфенил)-1,Здиоксолан-2-ил]-4-(3-метоксифенил)-2(1H)хинолинона (промежуточное соединение 7-е).f) Смесь промежуточного соединения (7-е)(43 г) в НСl (3N, 400 мл) и метанола (150 мл) перемешивали и нагревали с обратным холодильником в течение ночи. Смесь охлаждали и фильтровали. Осадок промывали водой и диэтиловым эфиром и сушили. Продукт в дальнейшем использовали без дополнительной очистки, получая 27 г (94%) 6-(4-хлорбензоил)-4-(3 метоксифенил)-2(1 Н)-хинолинонаg) Метилиодид (1,58 мл) добавляли к раствору промежуточного соединения (7-f) (7,6 г) и бензилтриэтиламмонийхлорида (БТЭАХ) (2,23 г) в ТГФ (80 мл) и гидроксиде натрия (40%, 80 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: ДХМ 100%). Нужные фракции собирали и растворитель выпаривали, получая 7,1 г (90%) 6-(4-хлорбензоил)-4-(3-метоксифенил)-1-метил 2(1 Н)-хинолинона (промежуточное соединение 7-g).h) Промежуточное соединение (7-g) (6,8 г) добавляли к ДХМ (210 мл), перемешивали при 0 С. Добавляли по каплям трибромборан (67,3 мл) и реакционную смесь перемешивали при 0 С в течение 15 мин. Смесь доводили до комнатной температуры, перемешивали при комнатной температуре в течение 30 мин и добавляли 10% К 2 СО 3. Органический слой отделяли,сушили (MgSO4), фильтровали и растворитель(промежуточное соединение 7-h) (количественный выход; использовалось на следующей стадии реакции без дополнительной очистки).i) Смесь промежуточного соединения (7-h)j) Раствор промежуточного соединения (7i) (3,55 г) в метаноле (20 мл) и ТГФ (20 мл) охлаждали. Порциями добавляли борогидрид натрия (0,37 г). Смесь перемешивали при комнатной температуре в течение 30 мин, гидролизовали и экстрагировали ДХМ. Органический слой отделяли, сушили (МgSO4), фильтровали и растворитель выпаривали досуха, получая 3,5 гk) Раствор промежуточного соединения (8 а) (3,5 г) в тионилхлориде (30 мл) перемешивали и нагревали с обратным холодильником в течение ночи. Растворитель выпаривали досуха и продукт в дальнейшем использовали без дополнительной очистки, получая 3,7 г (100%) 6-[хлор(4-хлорфенил)метил]-1-метил-4-(3-пропоксифенил)-2(1 Н)-хинолинона (промежуточное соединение 7-k). Пример 8. а) HCl/диэтиловый эфир (30,8 мл) добавляли к раствору 4-амино-4'-хлорбензофенона(35 г) в этаноле (250 мл) при комнатной температуре и смесь перемешивали в течение 15 мин. Порциями добавляли FеСl36 Н 2O (69,4 г), а затем ZnCl2 (2,05 г) и смесь перемешивали при 65 С в течение 30 мин. Добавляли 3-хлор-1 фенил-1-пропанон (25,46 г) и смесь перемешивали и нагревали с обратным холодильником в течение одной ночи. Смесь выливали в лед и экстрагировали ДХМ. Органический слой промывали 10% К 2 СО 3, сушили (МgSO4), фильтровали и выпаривали. Остаток кристаллизовали из АЦН. Маточные слои очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 99/1). Чистые фракции собирали и выпаривали, получая 19,4 г (37%) (4 хлорфенил)(4-фенил-6-хинолинил)метанонаb) С помощью той же процедуры реакций,которая описана в примере 7j, промежуточное соединение (8-а) превращали в (4 хлорфенил)-4-фенил-6-хинолинметанол 24 с) С использованием той же процедуры реакций, которая описана в примере 7k, промежуточное соединение (8-b) превращали в гидрохлоридd) Смесь промежуточного соединения (8-с)(12,6 г) и 1 Н-имидазола (11,8 г) в АЦН (300 мл) перемешивали и нагревали с обратным холодильником в течение 16 ч. Смесь выпаривали досуха и остаток брали с ДХМ. Органический слой промывали 10% К 2 СО 3, сушили (MgSO4),фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 97,5/ 2,5/0,1). Чистые фракции собирали и выпаривали. Остаток превращали в соль азотной кислоты(1:2) и кристаллизовали из СН 3 ОН/2 пропанол/диэтилового эфира, получая 4,28 гa) Промежуточное соединение (7-а) (50 г),а затем (3-хлорфенил)ацетонитрил (34,8 мл) добавляли к смеси гидроксида натрия (32,8 г) в метаноле (100 мл). Смесь перемешивали и нагревали с обратным холодильником до полного растворения. Реакцию проводили дважды в одних и тех же количествах. Смеси объединяли. Добавляли лед, а затем этанол. Смесь оставляли кристаллизоваться. Осадок отфильтровывали,промывали этанолом и сушили, получая 58 гb) ТiСl3/15%Н 2O (308 мл) добавляли при комнатной температуре к смеси промежуточного соединения (9-а) (51 г) в ТГФ (308 мл). Смесь перемешивали при комнатной температуре в течение двух дней. Добавляли воду и смесь экстрагировали ДХМ. Органический слой отделяли, промывали 10% К 2 СО 3, сушили (MgSO4),фильтровали и растворитель выпаривали. Часть этой фракции (5,9 г) кристаллизовали из 2 пропанон/СН 3 ОН/диэтилового эфира. Осадок отфильтровывали и сушили, получая 1,92 гc) С использованием той же процедуры реакций, что описана в примере 7d, промежуточное соединение (9-b) превращали в N-[2-(3 хлорбензоил)-4-(4-хлорбензоил)фенил]ацетамидd) С использованием той же процедуры реакций, что описана в примере 7 е, промежуточное соединение (9-с) превращали в 6-(4 хлорбензоил)-4-(3-хлорфенил)-2(1 Н)-хинолинон(200 мл). Смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли 2 хлорэтилметиловый эфир (25,2 мл). Смесь перемешивали при 50 С в течение 72 ч, выливали в лед и экстрагировали этилацетатом. Органический слой отделяли, промывали водой, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: циклогексан/этилацетат 70/30). Чистые фракции собирали и растворитель выпаривали, получая 6,2 г (36%) 6-(4-хлорбензоил)-4-(3-хлорфенил)1-(2-метоксиэтил)-2(1 Н)-хинолинона (промежуточное соединение 9-е).f) С использованием той же процедуры реакций, что описана в примере 7j, промежуточное соединение (9-е) превращали в -4-(3 хлорфенил)-6-[(4-хлорфенил)гидроксиметил]-1(2-метоксиэтил)-2(1 Н)-хинолинонg) С использованием той же процедуры реакций, что описана в примере 7k, промежуточное соединение (9-f) превращали в -6[хлор(4-хлорфенил)метил]-4-(3-хлорфенил)-1(2-метоксиэтил]-2(1 Н)-хинолинон(промежуточное соединение 9-g). Пример 10. а) Н-бутиллитий (37,7 мл) медленно добавляли при -20 С в токе N2 к смеси 6-бром-4(3-хлорфенил)-2-метоксихинолина (20 г) и ТГФ(150 мл). Смесь перемешивали при -20 С в течение 30 мин, а затем медленно добавляли при 20 С в токе N2 к смеси этил 4-хлор-оксобензолацетата (12,2 г) и ТГФ (80 мл). Смесь оставляли стоять до достижения комнатной температуры и перемешивали при комнатной температуре в течение 1 ч. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой отделяли, сушили (МgSO4), фильтровали и растворитель выпаривали. Остаток (26,3 г) очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/ циклогексан 90/10). Чистые фракции собирали и растворитель выпаривали, получая 9,3 г (33,5%)b) Промежуточное соединение (10-а) (9,3 г) и 1,1'-карбонилбис-1 Н-имидазол (22 г) нагревали до 120 С в течение 1 ч. Смесь охлаждали. Медленно добавляли лед и смесь экстрагировали ДХМ. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток (10,6 г) очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/2-пропанол/NН 4OН 95/5/0,5), получая 7,15 г -этил 4-(3-хлорфенил)(4 хлорфенил)(1 Н-имидазол-1-ил)-2-метокси-6 хинолинацетата (промежуточное соединение 10b). 26 В. Получение конечных соединений. Пример 11. Смесь промежуточного соединения (1-с)(22,85 г) и хлорида алюминия (48 г) в хлорбензоле (200 мл) нагревали до 95 С в течение ночи. Смесь охлаждали, выливали в ледяную воду,подщелачивали с помощью NH4OH и выпаривали досуха. Остаток брали в ДХМ и этанол. Остаток фильтровали и выпаривали. Остаток брали в ДХМ и перемешивали с НС 1 3N в течение ночи. Смесь экстрагировали, водный слой промывали этилацетатом, подщелачивали с помощью NH4OAc, а затем экстрагировали этилацетатом и органический слой сушили (MgSO4) и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: CH2Cl2/-СН 3 ОН/NН 4OН 95/5/0,05). Чистые фракции собирали и выпаривали, получая 2,13 г(16%) -6-[(1 Н-имидазол-1-ил)фенилметил]-4 фенил-2(1 Н)-хинолинона; т.пл. 253,0 С (соединение 1). Пример 12. Гидрид натрия (0,002 г), а затем 1,1'карбонилбис-1H-имидазол (2,5 г) порциями добавляли при комнатной температуре к промежуточному соединению (2-b) (2,8 г), растворенному в ТГФ (30 мл) и смесь перемешивали и нагревали до 60 С в течение 1 ч. Смесь гидролизовали водой и выпаривали. Остаток брали в ДХМ и промывали водой. Органический слой сушили (MgSO4), фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: толуол/ 2 пропанол/NН 4 ОН 90/10/0,5). Чистые фракции собирали и выпаривали. Остаток (2,1 г) кристаллизовали из 2-пропанона, получая 1,55 г(48%) -6-[(4-хлорфенил)-1 Н-имидазол-1-илметил]-3,4-дигидро-4-фенил-2(1 Н)-хинолинона; т.пл. 225,0 С (соединение 57). Пример 13. Смесь промежуточного соединения (3)(13,8 г) в АЦН (150 мл) нагревали с обратным холодильником в течение 12 ч. Смесь выпаривали досуха, остаток брали в воду и экстрагировали дихлорметаном. Органический слой сушили (MgSO4) и остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH 95/5) (70-200 мкм). Чистые фракции собирали и выпаривали, получая 9 г(71%) -6-[(3-хлорфенил)(1 Н-имидазол-1-ил) метил]-4-фенил-2(1 Н)-хинолинона (соединение 5). Пример 14. Гидрид натрия (1,15 г) добавляли порциями при 10 С в токе N2 к смеси соединения (2)(10 г) и ДМФ (100 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. По каплям добавляли иодметан (1,5 мл) при 15 С и смесь перемешивали при комнатной температуре в течение 1 ч. Смесь выливали в ледяную воду и фильтровали. Осадок брали в 27 смесь ДХМ и метанола. Органический слой сушили (MgSO4), фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: этилацетат/ СН 3 ОН 95/5). Чистые фракции собирали и выпаривали. Остаток (3,3 г) перекристаллизовывали из СН 3 СN/ДИПЭ, получая 1,9 г (19%) -6[(4-хлорфенил)-1 Н-имидазол-1-ил-метил]-1 метил-4-фенил-2 (1 Н)-хинолинона; т.пл. 154,7 С(соединение 8). Пример 15. Раствор метоксида натрия в метаноле (2,8 мл) добавляли по каплям к смеси соединения (2)(6 г) и дифенилиодонийхлорида (6,9 г) в метаноле (400 мл). Добавляли хлорид меди (I) (1,72 г) и смесь перемешивали и нагревали до 60 С в течение 12 ч. Смесь фильтровали через целит и фильтрат выпаривали. Остаток брали в ДХМ и 10% NH4OH. Водный слой экстрагировали ДХМ. Объединенные органические соли промывали водой, сушили (MgSO4), фильтровали и выпаривали в вакууме досуха. Остаток очищали посредством колоночной хроматографии на силикагеле(элюент: СН 2 Сl2/СН 3 ОН/NН 4OН 98/2/0,1). Чистые фракции собирали и выпаривали. Остаток (1,1 г) растворяли в СН 3 ОН и превращали в соль азотной кислоты (1:1) в СН 3 ОН,получая 0,9 г (11,2%) мононитрата -6-[(4 хлорфенил)-1 Н-имидазол-1-илметил]-1,4-дифенил-2(1 Н)-хинолинона; т.пл. 212,4 С (соединение 19). Пример 16. 2-Метил-2-пропанол, калиевую соль (1,35 г) добавляли порциями при 0 С в токе N2 к смеси соединения (15) (2,8 г) и иодметана (1,9 мл) в тетрагидрофуране (85 мл) и смесь перемешивали при комнатной температуре в течение 5 мин. Смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой сушили(MgSO4), фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/ СН 3 ОН/NН 4OН 97,5/2,5/0,1). Чистые фракции собирали и выпаривали. Остаток (2,3 г) перекристаллизовывали из СН 3 ОН и диэтилового эфира, получая 1,7 г (60%) -4-(3-хлорфенил)-6-[1-(4-хлорфенил)-1-(1 Н-имидазол-1-ил)этил]-1-метил-2(1 Н)-хинолинона; т.пл. 120,2 С (соединение 62). Пример 17. Смесь промежуточного соединения (4)(17,6 г) и имидазола (9,3 г) в АЦН (250 мл) перемешивали и нагревали с обратным холодильником в течение ночи, затем охлаждали до комнатной температуры. Осадок отфильтровывали,промывали 10% водным раствором К 2 СО 3 и диэтиловым эфиром, затем сушили на воздухе,получая 11,2 г (55%) продукта. Образец (3 г) перекристаллизовывали из ТГФ, метанола, диэтилового эфира. Осадок отфильтровывали и сушили, получая 2 г (37%) моногидрата -6-[1(4-хлорфенил)-2-гидрокси-1-(1 Н-имидазол-1 000719 28 ил)этил]-1-метил-4-фенил-2(1 Н)-хинолинона; т.пл. 180 С (соединение 59). Пример 18. 1-Хлор-4-хлорметилбензол (3,2 г) добавляли к раствору соединения (59) (7 г) и бензилтриэтиламмонийхлорида (1,75 г) в гидроксиде натрия (40%) (100 мл) и ТГФ (100 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и этилацетат. Органический слой сливали, промывали водой, сушили (MgSO4), фильтровали и выпаривали досуха. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98,5/1,5/0,1). Чистые фракции собирали и выпаривали. Остаток (3,7 г) перекристаллизовывали из 2-пропанона/-(С 2 Н 5)2O,получая 2,1 г (24%) -6-[1-(4-хлорфенил)-2[(4-хлор-фенил)метокси]-1-(1 Н-имидазол-1-ил) этил]-1-метил-4-фенил-2(1 Н)-хинолинона; т.пл. 176,8C (соединение 61). Пример 19. Метоксид натрия (0,8 мл) добавляли при комнатной температуре к раствору промежуточного соединения (5-d) в метаноле (100 мл),смесь перемешивали при комнатной температуре в течение ночи, а затем перемешивали и нагревали с обратным холодильником в течение 2 ч. Добавляли воду и смесь экстрагировали ДХМ. Органический слой сушили (MgSO4),фильтровали и выпаривали досуха. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: CH2Cl2/ CH3OH/NH4OH 98/2/0,1). Чистые фракции собирали и выпаривали, получая 8,3 г (79%) продукта. Образец (2,3 г) превращали в соль этандиоевой кислоты (2:3) и перекристаллизовывали из 2 пропанона, получая 2,35 г (63%) -метил 4 амино-1-[(4-хлорфенил)(1,2-дигидро-1-метил-2 оксо-4-фенил-6-хинолинил)метил]-1 Н-имидазол-5-карбоксилат этандиоата (2:3); т.пл. 168,7 С (соединение 70). Пример 20. Азотную кислоту (30 мл), а затем нитрит натрия (0,64 г), добавляли при 0 С к раствору соединения (70) (4,6 г) в фосфорной кислоте (45 мл) и смесь перемешивали при 0 С в течение 45 мин. Осторожно по частям добавляли гипофосфористую кислоту (30 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Смесь выливали в лед, подщелачивали с помощью NH4OH и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и выпаривали досуха. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: CH2Cl2/ CH3OH/ NH4OH 98,5/1,5/0,1). Чистые фракции собирали и выпаривали. Остаток (1,5 г) превращали в соль этандиоевой кислоты(2:3); т.пл. 140,8 С (соединение 54). Пример 21. Промежуточное соединение (6-b) (15,66 г) добавляли к серной кислоте (120 мл), которая была охлаждена до 0 С, и смесь перемешивали при комнатной температуре в течение одной ночи. Смесь осторожно добавляли к охлажденному раствору при 0 С во льду и концентрированном NH4OH. Основной водный слой экстрагировали ДХМ. Органический слой сушили(MgSO4), фильтровали и выпаривали досуха. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/ СН 3 ОН/NН 4OН 97,5/2,5/0,2). Чистые фракции собирали и выпаривали, получая 7,4 г (52%) продукта. Образец перекристаллизовывали из 2 пропанона, получая 2 г моногидрата -6-[(4 хлорфенил)[2-(метилтио)-1 Н-имидазол-1-ил]метил]-4-фенил-2(1 Н)-хинолинона; т.пл. 205,6 С(соединение 51). Пример 22. Раствор соединения (17) (12,7 г) в гидроксиде натрия (3N) (130 мл) перемешивали при 120 С в течение ночи. Смесь охлаждали до комнатной температуры и добавляли NH4OH до рH=5,2. Осадок отфильтровывали, промывали водой и сушили на воздухе, получая 12 г -6[(4-хлорфенил)-1 Н-имидазол-1-илметил]-2 оксо-4-фенил-1(2 Н)-хинолин-1-уксусную кислоту (соединение 38). Пример 23.(5,3 г) в ДХМ добавляли по каплям при комнатной температуре к смеси соединения (38) (12,4 г) и метил 2-амино-4-метил-пентаноата (6 г) в ТГФ (120 мл) и 1-гидроксибензотриазолгидрате и смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в воду и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4 ОН 97/3/0,1). Чистые фракции собирали и выпаривали, получая 6,8 г (43%) продукта. Образец кристаллизовали из ДИПЭ,получая 1 г -метил 2-2-[6-[(4-хлорфенил)1 Н-имидазол-1-илметил]-1,2-дигидро-2-оксо-4 фенил-1-хинолинил]-2-оксоэтил]амино]-4 метил-пентаноата; т.пл. 117,9 С (соединение 39). Пример 24. Соединение (2) (1 г) растворяли в нгексане (81 мл) и этаноле (54 мл). Данный раствор разделяли и очищали посредством колоночной хроматографии на колонке Chiralcel AD(250 г, 20 мкм, Daicel; элюент: н-гексан/этанол 60/40 об.%). Было собрано две группы желательных фракций. Фракции, соответствующие первому хроматографическому пику, выпаривали. Остаток растворяли в небольших количествах ДХМ. Добавляли диэтиловый эфир до тех 30 пор, пока не выпадал осадок. Осадок отфильтровывали через фильтр Millipore (10 мкм), затем сушили (вакуум; 40 С; 2 ч), получая 0,430 г(43%). Данную фракцию растворяли в 2 пропаноне и осаждали с помощью ДИПЭ. Осадок отфильтровывали и сушили, получая 0,25 г(соединение 6). Фракции, соответствующие второму хроматографическому пику, выпаривали. Остаток растворяли в малых количествах ДХМ. Добавляли диэтиловый эфир до тех пор,пока не выпадал осадок. Осадок отфильтровывали через фильтр Millipore (10 мкм), затем сушили (вакуум; 40 С; 2 ч), получая 0,410 г (41%). Фракцию растворяли в 2-пропаноне и осаждали с помощью ДИПЭ. Осадок отфильтровывали и сушили, получая 0,20 г (20%) (-)-(В)-6-[(4 хлорфенил)-1H-имидазол-1-ил-метил]-4-фенил 2 (1 Н) -хинолинона; т.пл 155,8 С; []20D = -6,32(с=0,1% в метаноле (соединение 7). Пример 25. Пятисернистый фосфор (4,45 г) по частям добавляли при комнатной температуре к раствору -4-(3-хлорфенил)-6-[(4-хлорфенил)-1 Нимидазол-1-илметил]-2(1 Н)-хинолинона (4,5 г) в пиридине (54 мл) и смесь перемешивали и нагревали с обратным холодильником в течение 4 ч. Смесь выпаривали досуха и остаток брали в этилацетат. Органический слой промывали НСl и водой, сушили (MgSO4), фильтровали и выпаривали досуха. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 97/3). Чистые фракции собирали и выпаривали. Остаток (2,7 г) кристаллизовали из ДМФ, получая 1,6 г (33%) моногидрата-4-(3-хлорфенил)-6-[(4-хлорфенил)-1H-имидазол-1-илметил]-2(1 Н)-хинолинтиона; т.пл. 263,5 С (соединение 72). Пример 26. Имидазол (3,34 г) добавляли к раствору промежуточного соединения (8-b) (3,7 г) в АЦН(50 мл). Смесь перемешивали и нагревали с обратным холодильником в течение 4 ч. Добавляли воду и смесь экстрагировали ДХМ. Органический слой отделяли, сушили (MgSО 4), фильтровали и растворитель выпаривали досуха. Остаток (3,8 г) очищали посредством колоночной хроматографии на силикагеле(элюент: СН 2 Сl2/СН 3 ОН 98/2). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из 2-пропанона/ДИПЭ, отфильтровывали и сушили, получая 1,8 г (45%) полуторагидрата-6-[(4-хлорфенил)-1 Н-имидазол-1-илметил]1-метил-4-(3-пропоксифенил)-2(1 Н)хинолинона этандиоата (2:3) (соединение 74). Пример 27. Смесь промежуточного соединения (10-b) 37 С. Фармакологический пример Пример 28. Изучение ингибирования фарнезилпротеинтрансферазы in vitro. Фарнезилпротеинтрансферазу человека получали, в главных чертах, как описано уin Enzymology, vol.1, 241-245, 1990). В качестве источника человеческого фермента использовали клетки остеосаркомы человека, трансформированные вирусом Кирстена (KHOS) (Американская коллекция типовых культур, Rockville,MD, USA), которые росли в виде солидных опухолей у бестимусных мышей или в виде монослойных клеточных культур. Кратко, клетки или опухоли гомогенизировали в буферном растворе, содержавшем 50 мМ Трис, 1 мМ ЭДТК, 1 мМ ЭГТК и 0,2 мМ фенилметилсульфонилфторида (рН 7,5). Гомогенаты центрифугировали на 28000 х g в течение 60 мин и собирали надосадочную жидкость. Приготавливали фракцию 3050% сульфата аммония и полученный осадок ресуспендировали в малом (от 10 до 20 мл) объеме диализного буферного раствора, содержавшего 20 мМ Трис, 1 мМ дитиотреита и 20 мкМZnCl2. Фракцию сульфата аммония диализировали в течение ночи с двумя заменами одного и того же буфера. Анализированный материал помещали в колонку 10 х 1 см Q Fast FlowSepharose (Pharmacia LKB Biotechnology Inc.,Piscataway, NJ, USA), которая была предварительно откалибрована 100 мл диализного буфера с добавлением 0,05 М NaCl. Эту колонку промывали сначала дополнительными 50 мл диализного буфера плюс 0,05 М NaCl, а затем градиентом от 0,05 М до 0,25 М NaCl, приготовленным на диализном буфере. Активность фермента элюировали с помощью линейного градиента от 0,25 до 1,0 М NaCl, приготовленного на диализном буфере. Фракции, содержавшие объемы колоночного элюата от 4 до 5 мл, собирали и анализировали на активность фарнезилпротеинтрансферазы. Фракции, обладавшие ферментативной активностью, объединяли и добавляли в них 100 мкМ ZnCl2. Образцы ферментов хранили замороженными при -70 С. Активность фарнезилпротеинтрансферазы измеряли с помощью системы Farnesyl Transferase [3H] Scintillation Proximity Assay (Amersham Internationalpls., England) при условиях, описанных производителем. Для изучения ингибиторов этого фермента 0,20 мкКи субстрата [3 Н]-фарнезилпирофосфата и субстрата биотинилированного пептида lamin В (biotin-YRASNRSCAIM) смешивали с испытуемыми соединениями в реакционном буфере, состоящем из 50 мМ HEPES,30 мМ MgCI2, 20 мМ КCl, 5 мМ дитиотреита,0,01% Triton X-100. Испытуемые соединения вносили в 10 мкл объеме диметилсульфоксида(ДМСО) до достижения концентраций 1 и 10 мкг/мл в конечном объеме 100 мкл. Реакционную смесь подогревали до 37 С. Ферментативную реакцию начинали путем добавления 20 38 мкл разведенной фарнезилпротеинтрансферазы человека. Добавляли ферментный препарат в количестве, достаточном для получения от 4000 до 15000 импульсов в минуту продукта реакции в течение 60 мин инкубирования реакции при 37 С. Реакции заканчивали путем добавления реагента STOP/scintillation proximity bead (Amersham). Продукт реакции [3H]-фарнезил-(Цис)биотин пептид lamin В улавливали в сцинтилляционном слое, связанном со стрептавидином. Количество [3H]-фарнезил-(Цис)-биотин пептидlamin В, синтезированного в присутствии или отсутствие испытуемых соединений, количественно оценивали как количество импульсов в минуту, зафиксированное жидкостным сцинтилляционным счетчиком Wallac Model 1480Micro-beta. Количество импульсов в минуту продукта расценивалось как активность фарнезилпротеинтрансферазы. Активность фарнезилпротеинтрансферазы, наблюдавшаяся в присутствии испытуемого соединения, нормализовали по активности фарнезилпротеинтрансферазы в присутствии 10% ДМСО и выражали в процентах ингибирования. В отдельных исследованиях некоторые испытуемые соединения, демонстрировавшие 50% или большее ингибирование активности фарнезилпротеинтрансферазы, оценивали на зависимое от концентрации ингибирование ферментной активности. Эффекты испытуемых соединений в этих исследованиях подсчитывали как IC50 (концентрацию испытуемого соединения, вызывавшую 50% ингибирование ферментной активности) с помощью компьютерной программы LGIC50, написанной отделом научной информации R.W. Jhonson Pharmaceutical Research Institute (Spring House, PA,USA), на компьютере VAX. Таблица 7 Соед.ras-трансформированных клеток. Инсерция активированных онкогенов, таких как мутантный ras ген, в клетки мыши NIH 3 Т 3 превращает эти клетки в трансформированный фенотип. Эти клетки становятся онкогенными, демонстрируют независимый от якорной подложки рост на полутвердой среде и утрачивают контактное ингибирование. Утрата контактного ингибирования приводит к появлению клеточных культур, которые больше не образуют монослои. Эти клетки скорее группируются в многоклеточные узелки и растут на пластиковых планшетах для культур клеток до очень высоких плотностей насыщения. Агенты, такие как ингибиторы фарнезилпротеинтрансферазы,которые реверсируют ras-трансформированный фенотип, восстанавливают монослойный характер роста клеток в культуре. Эта реверсия легко отслеживается путем подсчета количества клеток на планшетах для культур ткани. Трансформированные клетки будут достигать больших количеств клеток по сравнению с клетками, которые вернулись к нетрансформированному фенотипу. Соединения, которые реверсируют трансформированный фенотип, должны оказывать противоопухолевое действие в отношении опухолей, несущих мутации гена ras. Метод. Соединения подвергали скринингу на тканевой культуре клеток NIH 3 Т 3, трансформированных Т 24-активированным геном Н-ras человека. Клетки засевали при исходной плотности 200000 клеток на лунку (площадь поверхности 9,6 см 2) на шестилуночные кластерные планшеты для культур ткани. Испытуемые соединения немедленно добавляли к 3,0 мл клеточной ростовой среды в объеме 3,0 мл ДМСО, с конечной концентрацией ДМСО в клеточной ростовой среде 0,1%. Испытуемые соединения изучали в концентрациях 5, 10, 50 и 100 нМ наряду с контролем - носителем, обработанным ДМСО. (В случае, если высокая активность наблюдалась при 5 нМ, испытуемое соединение изучали и при более низких концентрациях). Эти клетки оставляли делиться в течение 72 ч. Затем клетки снимали с помощью 1,0 мл разъединяющей клетки Среды трипсин/ЭДТК и подсчитывали на счетчике частиц Coulter. Измерения. Количества клеток, выраженные как количество клеток на лунку, определяли с помощью счетчика частиц Coulter. Все подсчитанные количества клеток корректировались на первоначальную плотность клеток путем вычитания 200000. Контрольные подсчитанные количества клеток = [подсчитанные количества клеток, инкубированных с носителем ДМСО - 200000]. Подсчитанные количества клеток, росших с испытуемыми соединениями = [подсчитанные% ингибирования испытуемых соединений =[1 -количество клеток, росших с испытуемыми соединениями х 100% контрольные подсчитанные количества клетокIC50 (т.е. концентрация испытуемого соединения, которая требуется для ингибирования ферментной активности на 50%) подсчитывалась,если имелось достаточное количество данных, и приведена в таблице 8. Таблица 8 Соед.D. Примеры композиций. Следующие рецептуры иллюстрируют типичные фармацевтические комопзиции в виде дозированных лекарственных форм, удобных для системного или местного введения теплокровным животным в соответствии с настоящим изобретением."Активный ингредиент" (АИ) в настоящем документе относится к соединению формулы(I), его фармацевтически приемлемой соли присоединения кислоты или основания или его стереохимически изомерной форме. Пример 30. Растворы для перорального введения. 9 г Метил 4-гидроксибензоата и 1 г пропил 4-гидроксибензоата растворяли в 4 л кипящей очищенной воды. В 3 л этого раствора растворяли первые 10 г 2,3-дигидроксибутандиоевой кислоты, а затем - 20 г АИ. Последний раствор объединяли с оставшейся частью предыдущего раствора и добавляли 12 л 1,2,3-пропантриола и 3 л 70% раствора сорбитола. 40 г натрий сахарина растворяли в 0,5 л воды и добавляли 2 мл малиновой эссенции и 2 мл эссенции крыжовника. Последний раствор объединяли с предыдущим, добавляли воду до общего количества 20 л, получая раствор для перорального введения, содержащий 5 мг АИ в одной чайной ложке(5 мл). Полученным раствором наполняли подходящие контейнеры. Пример 31. Капсулы. 20 г АИ, 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидного диоксида кремния и 1,2 г стеарата магния интенсивно перемешивали. Полученной смесью затем наполняли 1000 подходящих твердых желатиновых капсул, каждая из которых содержала 20 мг АИ. Пример 32. Таблетки с пленочным покрытием. Изготовление ядра таблетки. 41 Смесь 100 г АИ, 570 г лактозы и 200 г крахмала хорошо перемешивали, а затем увлажняли раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона в приблизительно 200 мл воды. Влажную порошкообразную смесь просеивали, сушили и вновь просеивали. Затем добавляли 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все вместе хорошо перемешивали и прессовали в таблетки, получая 10000 таблеток, каждая из которых содержала 10 мг активного ингредиента. Покрытие. К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляли раствор 5 г этилцеллюлозы в 150 мл дихлорметана. Затем добавляли 75 мл дихлорметана и 2,5 мл 1,2,3 пропантриола. 10 г полиэтиленгликоля расплавляли и растворяли в 75 мл дихлорметана. Последний раствор добавляли к предыдущему, а затем добавляли 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной суспензии красителя, и все вместе гомогенизировали. На таблеточные ядра наносили полученную описанным способом смесь в аппарате для нанесения покрытия. Пример 33. Раствор для инъекций. 1,8 г Метил 4-гидроксибензоата и 0,2 г пропил 4-гидрокси-бензоата растворяли в приблизительно 0,5 л кипящей воды для инъекций. После охлаждения приблизительно до 50 С добавляли при перемешивании 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г АИ. Раствор охлаждали до комнатной температуры и добавляли воду для инъекций до объема 1 л,получая раствор, содержащий 4 мг АИ в мл. Раствор стерилизовали фильтрованием и наполняли им стерильные контейнеры. Пример 34. Суппозитории. 3 г АИ растворяли в растворе 3 г 2,3 дигидроксибутандиоевой кислоты в 25 мл полиэтиленгликоля 400. 12 г поверхностноактивного вещества и 300 г триглицеридов расплавляли вместе. Последнюю смесь хорошо перемешивали с предыдущим раствором. Полученную таким образом смесь наливали в формы при температуре 37-38 С для получения 100 суппозиториев, каждый из которых содержал 30 мг АИ в мл. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) его стереоизомерная форма, фармацевтически приемлемая соль присоединения кислоты или 42 основания, в которых пунктирная линия обозначает необязательную связь; Х представляет кислород или серу;C1-6 алкил, аминоС 1-6 алкил, или радикал формулы -Аlk1-С(=О)-R9, -Alk1-S(О)-R9 или -Alk1S(О)2-R9,где Alk1 представляет C1-6 алкандиил,R9 представляет гидрокси, C1-6 алкил, C1-6 алкилокси, амино, C1-8 алкиламино или С 1-8 алкиламино,замещенный С 1-6 алкилоксикарбонилом;R2 и R3, каждый независимо, представляет водород, гидрокси, галоген, циано, C1-6 алкил,C1-6 алкилокси,гидроксиC1-6 алкилокси,C1 алкилоксиC1-6 алкилокси, аминоС 1-6 алкилокси,6 моно- или ди(C1-6-алкил)аминоC1-6 алкилокси,Аr1, Аr2C1-6 алкил, Аr2 окси, Аr2 С 1-6 алкилокси,гидроксикарбонил, C1-6 алкилоксикарбонил, тригалогенметил, тригалогенметокси, С 2-6 алкенил; или когда они находятся в смежных положениях, R2 и R3, взятые вместе, могут образовывать двухвалентный радикал формулыR11 представляет водород или C1-6 алкил;Ar1 представляет фенил или фенил, замещенный C1-6 алкилом, гидрокси, амино, C1-6 алкилокси или галогеном; Аr2 представляет фенил или фенил, замещенный C1-6 алкилом, гидрокси, амино, C1-6 алкилокси или галогеном; 2. Соединение по п.1, в котором Х представляет кислород. 43 3. Соединение по п.1, в котором R1 представляет водород, C1-6 алкил или С 1-6 алкилоксиС 1-6 алкил. 4. Соединение по п.1, в котором R6 представляет водород, а R7 представляет галоген. 5. Соединение по п.1, в котором R8 представляет водород, C1-6 алкил или гидроксиС 1-6 алкил. 6. Соединение по п.1, которое представляет 4-(3-хлорфенил)-6-[(4-хлорфенил)-1 Н-имидазол-1-илметил]-1-метил-2(1 Н)-хинолинон; 4-(3-хлорфенил)-6-[(4-хлорфенил)-1 Нимидазол-1-илметил]-2(1 Н)-хинолинон; 6-[1-(4-хлорфенил)-2-гидрокси-1-(1 Нимидазол-1-ил)этил]-1-метил-4-фенил-2(1 Н)хинолинон; 4-(3-хлорфенил)-6-[1-(4-хлорфенил)-1-(1 Нимидазол-1-ил)-этил]-1-метил-2(1 Н)-хинолинон; 4-(3-хлорфенил)-6-[1-(4-хлорфенил)-1-(5 метил-1 Н-имидазол-1-ил)этил]-1-метил-2(1 Н)хинолинон; 4-(3-хлорфенил)-6-[1-(4-хлорфенил)-2 гидрокси-1-(1H-имидазол-1-ил)этил]-1-метил 2(1 Н)-хинолинон; моногидрат этандиоата(2:3) 4-(3 хлорфенил)-6-[(4-хлорфенил) (1 Н-имидазол-1 ил)метил]-1-(2-метоксиэтил)-2(1 Н)-хинолинона; этандиоат (1:1) 6-[(4-хлорфенил)(1 Н-имидазол-1-ил)метил]-4-(1,3-бензодиоксол-5-ил)-1 метил-2(1 Н)-хинолинона; его стереоизомерные формы и фармацевтически приемлемые соли присоединения кислот или оснований. 7. Фармацевтическая композиция, включающая фармацевтически приемлемые носители и, в качестве активного ингредиента, терапевтически эффективное количество соединения по пп.1-6. 8. Способ получения фармацевтической композиции, заявленной в п.7, согласно которому фармацевтически приемлемые носители и соединение по пп.1-6 тщательно смешивают. 9. Соединение формулы (XVI), в котором радикалы R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, определенные в п.1, или его фармацевтически приемлемая соль присоединения кислоты. 10. Соединение формулы (XV), в котором радикалы R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, определенные в п.1, или его фармацевтически приемлемая соль присоединения кислоты. 11. Применение соединения, заявленного в пп. 1-6, в качестве лекарственного средства. 12. Способ получения соединения, заявленного в п.1, включающий N-алкилирование имидазола формулы (II) или его соли со щелочным металлом производным формулы (III) и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или, наоборот, превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы. 13. Способ получения соединения, заявленного в п.1, включающий реакцию промежуточного соединения формулы (IV) с соединением формулы (V), в которой Y представляет углерод или серу, таким как, например, 1,1'карбонил-бис[1 Н-имидазол] и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или, наоборот, превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы. 14. Способ получения соединения, заявленного в п.1, включающий реакцию циклизации промежуточного соединения формулы (VI) с получением таким образом соединения формулы (I-а), определенного как соединение формулы (I), в которой пунктирная линия представляет связь и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или, наоборот, превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы. 15. Способ получения соединения, заявленного в п.1, включающий гидролиз промежуточного соединения формулы (XXVI), в которойR представляет С 1-6 алкил, в водном растворе кислоты, с получением соединения формулы (Iа-1), определенного как соединение формулы (Ia), в которой R1 представляет водород и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или, наоборот, превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы. 16. Способ получения соединения, заявленного в п.1, включающий раскрытие эпоксида формулы (VII) имидазолом формулы (II) с получением соединения формулы (I-b), определенного как соединение формулы (I), в которойR8 представляет гидроксиметилен, 46 и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или, наоборот, превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы. 17. Способ получения соединения, заявленного в п.1, включающий реакцию преобразования промежуточных нитронов формулы(XV), полученных N-окислением хинолиновых производных формулы (XVI), с помощью или образования сложного эфира с последующим гидролизом, или внутримолекулярной фотохимической перегруппировки с получением соединения формулы (I-f-1) и при желании превращают соединение формулы (I) в фармацевтически приемлемую соль присоединения кислоты или, наоборот, превращают фармацевтически приемлемую соль присоединения кислоты в свободное основание с помощью щелочи; и/или получают его стереохимически изомерные формы.
МПК / Метки
МПК: C07D 401/06, A61K 31/47
Метки: 2-хинолона, производные, ингибирующие, фарнезилтрансферазу
Код ссылки
<a href="https://eas.patents.su/24-719-proizvodnye-2-hinolona-ingibiruyushhie-farneziltransferazu.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-хинолона, ингибирующие фарнезилтрансферазу</a>
Предыдущий патент: Двустворчатый обратный клапан
Следующий патент: Промотированное алюминием гидрирование шламов алкилирования для извлечения хлорида алюминия
Случайный патент: Способ и устройство для получения полимеров












