Новые производные бензола, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 4048
Опубликовано: 25.12.2003
Авторы: Лер Пьер, Бурри Мартин, Верньер Жан-Клод, Поль Раймон, Буажегрен Роберт, Понселе Мартин
Формула / Реферат
1. Соединения формулы

где A представляет собой группу, выбранную из следующего: -Cу C-; -CH=CH-; -CH2-CH2-;
n равно 1 или 2;
X представляет собой атом водорода, хлора или фтора или метильную или метоксигруппу;
Y представляет собой атом водорода или атом хлора или фтора;
R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или (C1-C3)алкокси или трифторметильной группой; циклогептильную, трет-бутильную, дициклопропилметильную, бицикло[3.2.1]октанильную, 4-тетрагидропиранильную, 4-тетрагидротиопиранильную или 1- или 2-адамантильную группу; или R1 представляет собой фенильную группу, причем подразумевается, что в этом случае X или Y является отличным от водорода; или R1 представляет собой циклогексильную группу, причем подразумевается, что в этом случае X и Y являются отличными от водорода;
R2 и R3 образуют вместе с атомом азота, к которому они присоединены, 5-8-членное аминное кольцо; морфолинильную группу, возможно замещенную в положениях 3 и 5 метилом; или 4-фенил-1,2,3,6-тетрагидропиридильную группу, возможно замещенную по фенилу галогеном или трифторметильной, (C1-C4)алкильной или (C1-C4)алкоксигруппой;
и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты.
2. Соединения по п.1, где
A представляет собой группу, выбранную из следующего: -Cу C-, -CH=CH-; -CH2-CH2-;
n равно 1;
X представляет собой атом водорода или хлора или метильную группу;
Y представляет собой атом водорода или хлора;
R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или метокси или трифторметильной группой; трет-бутильную или 1- или 2-адамантильную группу; или R1 представляет собой фенильную группу, причем подразумевается, что в этом случае X и Y являются отличными от водорода; или же R1 представляет собой циклогексильную группу, причем подразумевается, что в этом случае X и Y являются отличными от водорода;
R2 и R3 образуют вместе с атомом азота, к которому они присоединены, 6-8-членное аминное кольцо;
и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты.
3. Соединения по любому из пп.1 и 2 формулы
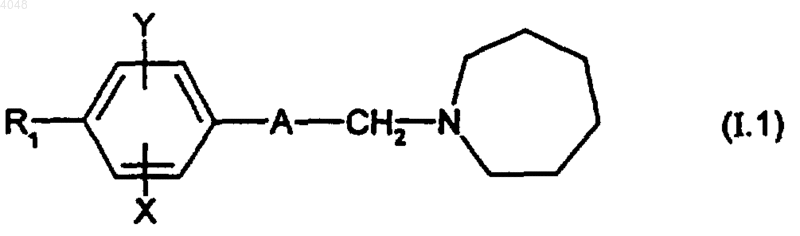
где A представляет собой группу, выбранную из следующего: -Cу C-; -CH=CH-; -CH2-CH2-;
X представляет собой атом водорода или хлора;
Y представляет собой атом водорода или атом хлора;
R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, моно- или дизамещенную атомом фтора или хлора или метоксигруппой; трет-бутильную или 1- или 2-адамантильную группу; R1 представляет собой циклогексильную или фенильную группу, причем подразумевается, что в этом случае X и Y являются отличными от водорода;
и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты.
4. Соединения по любому из пп.1-3, где A представляет собой группу -CH=CH-, в частности в (Z) конфигурации.
5. Соединения по любому из пп.1-4, где X представляет собой атом хлора, а Y представляет собой атом водорода.
6. Соединения по любому из пп.1-5, где R1 представляет собой фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или метоксигруппой, и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты.
7. Соединения
1-[(Z)-3-(2-хлор-3'-фторбифенил-4-ил)пропен-2-ил]азепан;
1-[(Z)-3-(2-хлор-3'-5'-дифторбифенил-4-ил)пропен-2-ил]азепан;
1-[(Z)-3-(2-хлор-3'-метоксибифенил-4-ил)пропен-2-ил]азепан
по п.1, а также их соли с фармацевтически приемлемыми кислотами, сольваты и гидраты.
8. Соединение 1-[(Z)-3-(2-хлор-3'-метоксибифенил-4-ил)пропен-2-ил]азепан по п.1, а также его соли с фармацевтически приемлемыми кислотами, сольваты и гидраты.
9. Способ получения соединения по п.1, где A представляет собой группу -Cу C-, отличающийся тем, что когда n = 1, то проводят реакцию Манниха между производным фенилацетилена формулы
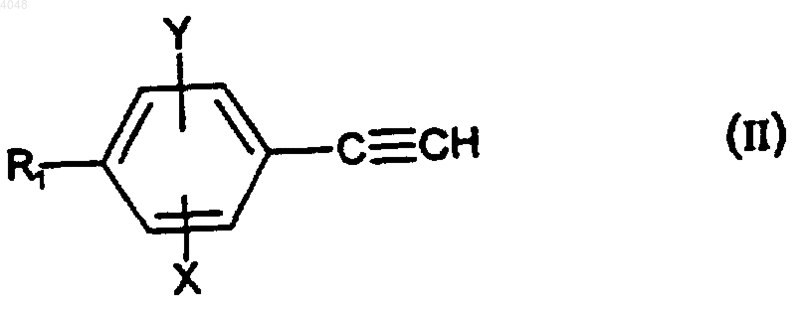
где R1, X и Y такие, как определено для (I), формальдегидом и амином (1) HNR2R3, причем R2 и R3 такие, как определено для (I).
10. Способ получения соединения по п.1, где A представляет собой группу -Cу C-, отличающийся тем, что осуществляют сочетание Сузуки между соединением формулы
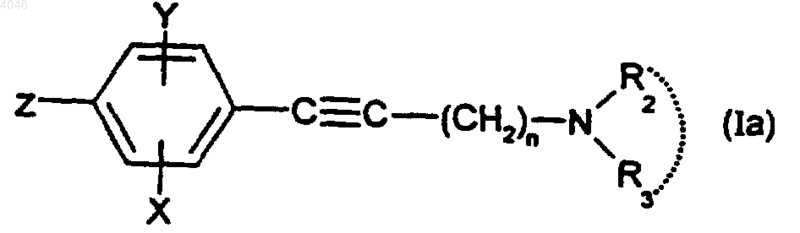
где X, Y, n, R2 и R3 такие, как определено для (I), и Z представляет собой бром, йод или трифторметансульфонатную (OTf) группу, и производным бора (2) формулы R1-B(OR)2, где R1 такой, как определен для (I), a R представляет собой атом водорода, алкильную или арильную группу, в присутствии основания и металлического катализатора.
11. Способ получения соединения по п.1, где A представляет собой группу -Cу C-, отличающийся тем, что когда R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; циклогептильную, 4-тетрагидропиранильную, 4-тетрагидротиопиранильную или адамантильную группу, то тогда осуществляют сочетание между соединением (Ia), где Z представляет собой атом йода или брома, и кетоном (3), соответствующим R1, представленным 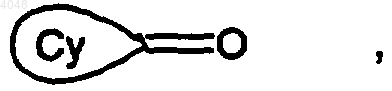 в присутствии основания, с получением промежуточного соединения формулы
в присутствии основания, с получением промежуточного соединения формулы
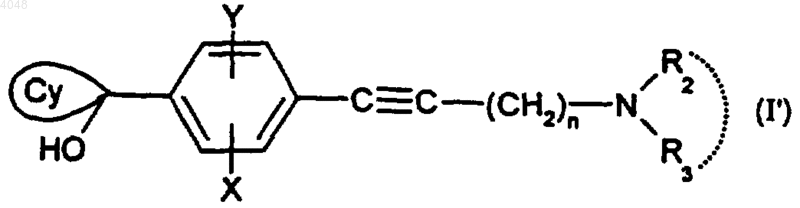
где X, Y, n, R2 и R3 такие, как определено для (I); а указанное соединение (I') затем восстанавливают в селективных условиях.
12. Способ получения соединения по п.1, где A представляет собой группу -Cу C-, отличающийся тем, что проводят реакцию сочетания между амином формулы
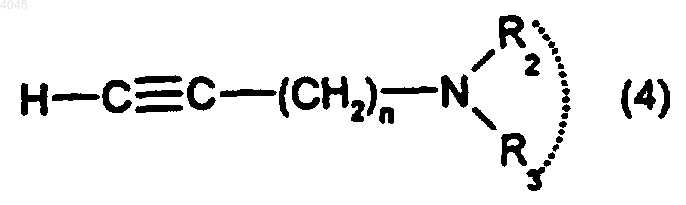
где n, R2 и R3 такие, как определено для (I), и соединением формулы
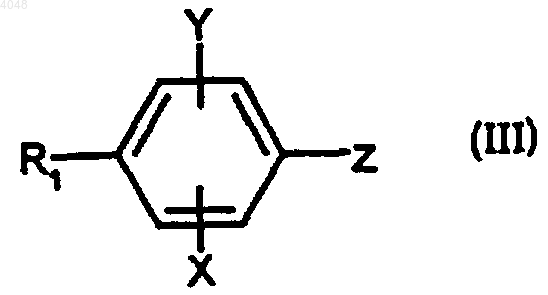
где R1, X и Y такие, как определено для (I), и Z представляет собой атом брома или йода или трифторметилсульфонатную (трифлатную или OTf) группу.
13. Способ получения соединения по п.1, где A представляет собой группу -CH=CH-, отличающийся тем, что осуществляют гидрирование соединения (I), где A представляет собой ацетиленовую группу -Cу C-, водородом в момент его выделения или в присутствии циклогексена для получения этиленового соединения (I) в форме смеси Z и E изомеров, или это гидрирование проводят в присутствии металлического катализатора на носителе для получения этиленового соединения (I) в Z форме, или, альтернативно, соединение (I), где A представляет собой ацетиленовую группу -Cу C-, подвергают взаимодействию с гидридом металла для получения этиленового соединения (I) в E форме.
14. Споёюс получения соединения по п.1, где A представляет собой группу -CH2-CH2-, отличающийся тем, что осуществляют гидрирование соединения (I), где A представляет собой группу -CH=CH- или -Cу C-.
15. Фармацевтическая композиция, содержащая в качестве активного начала соединение по любому из пп.1-8.
16. Применение соединения по любому из пп.1-8 для получения лекарственного продукта, предназначенного для лечения психотических расстройств.
17. Применение соединения по любому из пп.1-8 для получения лекарственного продукта, предназначенного для лечения позитивных и негативных симптомов шизофрении.
Текст
1 Настоящее изобретение относится к производным бензола, содержащим циклический амин, который специфически связывается с сигма-рецепторами, в частности с сигмарецепторами центральной нервной системы, к способу получения этих соединений и к их применению в фармацевтических композициях и,более конкретно, в качестве антипсихотических агентов. Сигма-рецепторы были выявлены с помощью некоторых лигандов. Во-первых, следует упомянуть опиатные соединения, 6,7-бензоморфаны или SKF-10047, в частности хиральное соединение (+) SKF-10047 (W. R. Martin et al., J.Martin et al., J. Pharmacol. Exp. Ther. 1984, 231,539-544). Из числа этих соединений, как правило, наиболее часто используют (+) N-аллилнорметазоцин, или (+) NANM +) N-allylnormetazocin), и (+) пентазоцин +) pentazocin). Нейролептический агент, галоперидол (haloperidol),также представляет собой лиганд сигмарецепторов, как и (+) 3-(3-гидроксифенил)-1 пропилпиперидин и (+) 3-РРР (В. L. Largent etal., Proc. Nat. Acad. Sci. USA 1984, 81, 49834987). Патент США 4709094 описывает производные гуанидина, которые очень активны в качестве специфических лигандов сигмарецепторов, в частности можно упомянуть ди(орто-толил)гуанидин, или DTG (di-(o-tolyl)guanidine). Анатомическое распределение сигма-рецепторов в мозгу изучали с помощью авторадиографии после мечения этих рецепторов посредством DTG согласно Е. Weber et al., Proc.Nat. Acad. Sci. USA 1986, 83, 8784-8788, а также посредством лигандов (+) SKF-10047 и (+) 3 РРР, согласно В. L. Largent et al., J. Pharmacol.Exp. Ther. USA 1986, 238, 739-748. Авторадиографическое исследование дает возможность четко идентифицировать сигма-рецепторы в мозгу и отличить их от других опиатных рецепторов, а также от фенциклидиновых рецепторов. Сигма-рецепторы особенно многочисленны в центральной нервной системе и сконцентрированы в стволе мозга, лимбической системе и областях, вовлеченных в регулирование эмоций. Сигма-рецепторы также обнаружены в различных периферических тканях. Таким образом, различают два вида сигмарецепторов. Лиганды типа (+) SKF-10047 селективно связываются с сигма-1 рецепторами, в то время как другие лиганды, такие как DTG, галоперидол или (+) 3-РРР, обладают высоким сродством как к сигма-1, так и к сигма-2 рецепторам. Патент ЕР 461986 описывает соединения формулы 2 которые селективно связывается с сигмарецепторами и которые обладают антипсихотической активностью. Среди этого ряда соединений, в частности,изучали (Z)-1-[3-(3-хлор-4-циклогексилфенил) аллил]азепана гидрохлорид формулы В качестве ссылки можно указать, например, Neuropharmacology 1993, 32 (6), 605-615 иEur. J. Pharmacol. 1993, 231 (3), 465-467. Однако соединения формулы (А) обладают специфическим свойством, которое можно считать недостатком. Это свойство, которое проявляется в процессе метаболизма, а именно зависимость от цитохрома Р 450, называемого CYP 2D6. В 1957 году впервые было высказано предположение о том, что наследственные различия могут быть ответственными за различия в ответе на лекарственные продукты. Окислительный метаболизм демонстрирует большие различия между индивидами и расами. Исследование, проводимое последние 15 лет, показало, что причиной этих различий являются различия в функциональной экспрессии мультигенного семейства цитохрома Р 450(CYP). Только несколько изоформ цитохрома Р 450 среди тех, которые уже описаны у людей,играют роль в окислительном метаболизме лекарственных продуктов. В качестве ссылки можно указать Xenobiotica 1986, 16, 367-378. К настоящему времени на основании их клинической значимости были идентифицированы CYP 1A2, CYP 2 А 6, CYP 2C9, CYP 2D6, CYP 2C19,CYP 2E1 и CYP 3A4. Сейчас установлено, чтоCYP 3A4, CYP 2D6 и CYP 2C9 сами по себе ответственны (и в разной степени) за 90% окислительного метаболизма лекарственных продуктов. Хотя функциональная экспрессия этих изоформ регулируется и находится под влиянием большого количества факторов окружающей среды и физиологических факторов, генетические факторы оказывают наиболее явное влияние, которое лежит в основе той важной роли,которую играет полиморфизм в окислении лекарственных продуктов. Изучали некоторое число таких полиморфизмов (в частности полиморфизмы CYP 2C19 и CYP 2D6). В частности,была продемонстрирована клиническая значимость полиморфизма CYP 2D6 в 4-гидро ксилировании дебризохина (debrisoquine) (Clin.Pharmacol. Ther. 1991, 50, 233-238). Генетический полиморфизм CYP 2D6 ответственен за проблематичный метаболизм более чем 30 важных лекарственных продуктов и имеет место у приблизительно 10% кавказского населения(медленные метаболизаторы). Было показано,что эта изоформа регулирует биотрансформацию таких лекарственных продуктов, как анти 3 аритмические агенты, -блокаторы, антигипертензивные агенты, антиангинальные агенты,нейролептические агенты и антидепрессанты. Не считая нескольких исключений, эти лекарственные продукты применяют в психиатрической и сердечно-сосудистой терапии для долговременного лечения. Фармакокинетические последствия имеют сугубо количественный порядок: индивидуумы с медленным метаболизмом имеют уровни неизмененного продукта более высокий, чем другие. Эти количественные различия оказывают значительное клиническое влияние на молекулы с низким терапевтическим индексом. Таким образом, генетика сильно влияет на различия в эффективности и побочных эффектах, наблюдаемые у разных индивидуумов. Таким образом, важно установить, можно ли изменить метаболизм лекарственного продукта в случае генетического дефицита фермента. Согласно настоящему изобретению, предложены новые перспективные производные бензола для сигма-рецепторов, в частности сигма-рецепторов центральной нервной системы,обладающие антипсихотической активностью,но имеющие низкую скорость метаболизации и/или низкое либо отсутствующее вовлечениеCYP 2D6 в окислительный процесс. Таким образом, согласно одному из своих аспектов, настоящее изобретение относится к соединениям формулы (I)- Х представляет собой атом водорода,хлора или фтора или метильную или метоксигруппу;- Y представляет собой атом водорода или атом хлора или фтора;- R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или(С 1-С 3)алкокси или трифторметильной группой; циклогептильную, трет-бутильную, дициклопропилметильную, бицикло[3.2.1]октанильную,4-тетрагидропиранильную, 4-тетрагидротиопиранильную или 1- или 2-адамантильную группу; или R1 представляет собой фенильную группу,причем подразумевается, что в этом случае Х или Y является отличным от водорода; или жеR1 представляет собой циклогексильную группу, причем подразумевается, что в этом случае Х и Y являются отличным от водорода;- R2 и R3 образуют вместе с атомом азота, к которому они присоединены, 5-8-членное аминное кольцо; морфолинильную группу, возможно замещенную в положении 3 и 5 метилом; или 4 фенил-1,2,3,6-тетрагидропиридильную группу,возможно замещенную по фенилу галогеном или трифторметильной, (С 1-С 4)алкильной или(С 1-С 4)алкоксигруппой; и к солям присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольватам и гидратам."Алкил" означает линейный или разветвленный, насыщенный одновалентный радикал на основе углеводорода."Алкокси" означает O-алкильный радикал. Среди этих соединений формулы (I) предпочтительными являются те, в которых:- X представляет собой атом водорода или хлора или метильную группу;- Y представляет собой атом водорода или хлора;- R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или метокси или трифторметильной группой; третбутильную или 1-или 2-адамантильную группу; или R1 представляет собой фенильную группу,причем подразумевается, что в этом случае Х иY являются отличными от водорода; или же R1 представляет собой циклогексильную группу,причем подразумевается, что в этом случае Х иY являются отличными от водорода;- R2 и R3 образуют вместе с атомом азота, к которому они присоединены, 6-8-членное аминное кольцо; и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты. Среди последних соединений формулы (I) соединения формулы:- Х представляет собой атом водорода или хлора;- Y представляет собой атом водорода или атом хлора;- R1 представляет собой циклогексил, монозамещенный, дизамещенный, тризамещенный или тетразамещенный метильной группой; фе 5 нильную группу, моно- или дизамещенную атомом фтора или хлора или метоксигруппой; третбутильную или 1- или 2-адамантильную группу;R1 представляет собой циклогексильную или фенильную группу, причем подразумевается,что в этом случае Х и Y являются отличными от водорода; и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты, являются особенно предпочтительными. Среди последних соединений (I.1) соединения, где А представляет собой группу-СН=СН-, в частности с конфигурацией (Z), являются предпочтительными. Также предпочтительными являются соединения формулы (I.1), где Х представляет собой атом хлора, предпочтительно в положении 3 фенила, а Y представляет собой атом водорода, и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты. Особенно предпочтительными являются соединения формулы (I.1), где R1 представляет собой фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или метоксигруппой, и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты. Следующие соединения являются особенно предпочтительными: 1-[(Z)-3-(2-хлор-3'-фторбифенил-4-ил) пропен-2-ил]азепан;- и особенно 1-[(Z)-3-(2-хлор-3'-метоксибифенил-4-ил)пропен-2-ил]азепан; а также их соли с фармацевтически приемлемыми кислотами, их сольваты и гидраты. Соли соединений по изобретению получают согласно методикам, хорошо известным специалистам в данной области техники. Соли соединений формулы (I) по настоящему изобретению включают в себя соли неорганических или органических кислот, которые обеспечивают возможность разделения или подходящей кристаллизации соединений формулы (I), а также фармацевтически приемлемых солей. Подходящими кислотами, которые можно упомянуть, являются: пикриновая кислота,щавелевая кислота или оптически активная кислота, например винная кислота, дибензоилвинная кислота, миндальная кислота или камфорсульфоновая кислота, и кислоты, которые образуют физиологически приемлемые соли, такие как гидрохлорид, гидробромид, сульфат, гидросульфат, дигидрофосфат, малеат, фумарат, 2 нафталинсульфонат или паратолуолсульфонат. Гидрохлориды являются наиболее предпочтительными среди солей соединений формулы (I). Когда соединение по изобретению имеет один или более чем один асимметрический уг 004048 6 лерод, оптические изомеры этого соединения составляют неотъемлемую часть данного изобретения. Когда соединение по настоящему изобретению обладает стереоизомерией, например аксиально-экваториальной или Z-E типа, данное изобретение включают в себя все стереоизомеры этого соединения. Настоящее изобретение включает в себя соединения формулы (I) в форме чистых изомеров, а также в форме смеси изомеров в любом соотношении. Соединения (I) выделяют в форме чистых изомеров с помощью традиционных методик разделения: например, можно применить фракционную перекристаллизацию соли из рацемический смеси с оптически активной кислотой или основанием, принципы которой хорошо известны, или традиционные методики хроматографии на хиральной и нехиральной фазе; например, можно применить разделение на силикагеле или C18-связанном силикагеле,элюируя такими смесями, как хлорированные растворители/спирт. Соединения формулы (I) выше также включают в себя те соединения, в которых один или более атомов водорода, углерода или галогенов, в частности атомы хлора или фтора, заменены их радиоактивным изотопом, например тритием или углеродом-14. Такие меченые соединения пригодны для научных исследований метаболизма или фармокинетики и для биохимических анализов в качестве лигандов рецепторов. Функциональные группы,возможно имеющиеся в молекуле соединений формулы (I) и промежуточных соединений реакции, можно защитить как в перманентной форме, так и во временной форме, защитными группами, которые гарантирует однозначный синтез ожидаемых соединений. Реакции установления и снятия защиты проводят согласно методикам, хорошо известным специалистам в данной области техники. Выражение "временная защитная группа для аминов, спиртов, фенолтиолов или карбоновых кислот" означает такие защитные группы, как описанные в Protective Groups inVeriag. Специалисты могут подобрать подходящие защитные группы. Соединения формулы (I) могут содержать группы-предшественники для других функций, которые затем образуются в одну или более чем одну стадию. Объектом настоящего изобретения также является способ получения соединений формулы (I), отличающийся тем, что 1) когда А представляет собой группу 7 а) либо, если n = 1, проводят реакцию Манниха (Mannich) между производным фенилацетилена формулы где R1, Х и Y такие, как определено для (I),формальдегидом и амином (1) HNR2R3, a R2 и R3 такие, как определено для (I); б) либо осуществляют сочетание Сузуки(I), и Z представляет собой бром, йод или трифторметансульфонатную (OTf) группу, и производным бора (2) формулы R1-B(OR)2, где R представляет собой атом водорода, алкильную или арильную группу, в присутствии основания и металлического катализатора; в) либо, когда R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метальной группой; циклогептильную, 4 тетрагидропиранильную,4-тетрагидротиопиранильную или адамантильную группу, тогда осуществляют сочетание между соединением(la), где Z представляет собой атом иода или брома, и кетоном (3), соответствующим R1,представленным в присутствии основания, с получением промежуточного соединения формулы(I); а указанное соединение (I') затем восстанавливают в селективных условиях; г) либо проводят реакцию сочетания между амином формулы: где n, R2 и R3 такие, как определено для (I), и соединением формулы где R1, X и Y такие, как определено для (I), и Z представляет собой атом брома или йода или трифторметилсульфонатную (трифлатную или-СН=СН-, то тогда осуществляют гидрирование соединения (I), где А представляет собой ацетиленовую группу -СC-, водородом в момент его выделения или в присутствии циклогексена для получения этиленового соединения (I) в форме 8 смеси Z и Е изомеров, либо это гидрирование осуществляют в присутствии металлического катализатора на носителе для получения этиленового соединения (I) в Z форме, или, альтернативно, осуществляют взаимодействие соединения (I), где А представляет собой ацетиленовую группу -CC-, с гидридом металла для получения этиленового соединения (I) в Е форме; 3) когда А представляет собой группу СН 2-СН 2-, то тогда осуществляют гидрирование соединения (I), где А представляет собой группу-СН=СН- или -СС-. Стадию 1 а способа по изобретению осуществляют при нагревании. предпочтительно при температуре между 80 и 90 С, в полярном растворителе, таком как 1,2-диметоксиэтан или 1,4 диоксан. Для облегчения реакции конденсации можно использовать катализатор, например соль металла, такую как хлорид меди II или хлорид меди III. На стадии 16 данного способа сочетание Сузуки предпочтительно осуществляют между соединением (la), где Z представляет собой OTf,и производным бора (2) формулы R1-B(OH)2. Реакцию проводят в присутствии основания,такого как гидроксиды, алкоголяты, фосфаты или карбонаты щелочных или щелочноземельных металлов, более конкретно фосфата калия или карбоната натрия. Реакцию проводят в присутствии металлического катализатора, например медного, оловянного или, предпочтительно,палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий, возможно с галогенидом, таким как хлорид лития, действующим как сокатализатор. Процесс проводят при нагревании, при температуре между 60 и 80 С, в инертном растворителе, таком как толуол или 1,2-диметоксиэтан, или предпочтительно в двухфазной среде толуол/водный раствор,возможно с долей спирта, такого как этанол. Сочетание Сузуки освещено во многих публикациях, таких как, например, Synth. Commun. 1981, 11 (7), 513-519 и J. Org. Chem. 1993,58 (8), 2201-2208. Бороновые кислоты (2) R1B(OH)2 имеются в продаже, или их синтезируют традиционными способами из соответствующих галогенопроизводных, предпочтительно бромопроизводных R1Br, путем воздействия, например, триметилбората в присутствии основания,такого как трет-бутиллитий. На стадии 1 в предпочтительно осуществляют сочетание соединения (la), где Z представляет собой атом брома, в присутствии основания, такого как н-бутиллитий, в инертном растворителе, предпочтительно диэтиловом эфире,при низкой температуре, предпочтительный температурный диапазон составляет от -80 до 9 и йодидом натрия в смеси ацетонитрил/хлорированный растворитель, такой как дихлорметан, с последующей обработкой уксусной кислотой в присутствии цинка, или альтернативно, путем воздействия йодистоводородной кислотой или посредством ионного гидрирования путем воздействия тетраборгидридом натрия в трифторметансульфоновой кислоте. На стадии 1 г данного способа сочетание осуществляют в присутствии палладиевого катализатора, одного или более чем одного четвертичного амина и, возможно, хлорида лития. Предпочтительно используют соединение (III),где Z представляет собой трифлат, и процесс проводят в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин) палладий или дихлорди(трифенилфосфин)палладий, и возможно сокатализатора, такого как йодид меди. Когда Z представляет собой трифлат, также можно использовать хлорид лития. Это сочетание предпочтительно осуществляют в присутствии триэтиламина и пиридина при дефлегмации реакционной смеси. Для этого типа сочетания, известного как сочетание Соногашира (Sonogashira), можно указать в качестве ссылки J. Org. Chem. 1993, 58, 7368-7376 и 1998,63, 1109-1118; Syn. Lett. 1995,1115-1116 и Synthesis, 1987, 981. Для получения соединений (I), где А представляет собой группу -СН=СН-, в Z форме,гидрирование обычно проводят в присутствии циклогексена и металлического катализатора на носителе, такого как палладий на сульфате бария или карбонате кальция, или никель Ренея(Raney), или, предпочтительно, катализатор Линдлара (Lindlar), в растворителе, который является инертным для взаимодействия, таком как петролейный эфир или спиртовой растворитель. Для получения соединений (I) в Е форме предпочтительно используемым гидридом металла является диизобутилалюминийгидрид(DIBALH) в инертном растворителе, таком как толуол. Для получения соединений (I), где А представляет собой группу -СН 2-СН 2-, гидрирование обычно проводят в спирте, например этаноле, в присутствии катализатора, такого как оксид платины или, предпочтительно, палладий на угле. Для методик восстановления алкенов и алкинов, используемых выше, можно в качестве ссылок указать "Catalytic Hydrogenation. Techniques and Applications in Organic Chemistry",Robert L. Augustine, 1965, Marcel Dekker, Inc.New York. Общий способ получения соединений (I),где А представляет собой ацетиленовую группу-СС-, представлен на схеме 1 ниже:R3 такие, как определено для (I), R представляет собой атом водорода или алкильную или арильную группу, Z представляет собой атом брома или йода или трифлат, а Z' представляет собой трифлат, когда Z представляет собой бром или йод, или же Z представляет собой атом брома или йода. Важность природы заместителей Z иZ в реакции сочетания, обозначенной как ПУТЬ Г, будет детально разобрана ниже. Соединение (II) получают обработкой в основной среде хлоракролеина формулы где X, Y и R1 такие, как определено для (I),предпочтительно путем воздействия гидроксида натрия в растворителе, таком как тетрагидрофуран или, предпочтительно, 1,4-диоксан, при температуре флегмы растворителя. Хлоракролеин (IV) получают из ацетофенона формулы где X, Y и R1 такие, как определено для (I), путем воздействия комплексом Вилсмейера(Vilsmeier). Используют, например (хлорметилен) диметиламмоний хлорид, имеющийся в продаже комплекс Вилсмейера, или комплекс Вилсмейера, полученный из дизамещеного формамида, объединенного с оксалилхлоридом,оксихлоридом фосфора или фосгеном. Этот способ обычно осуществляют в хлорированном растворителе или в эфире при температуре между-20 С и 40 С. Чаще используют комплекс Вилсмейера, полученный из диметилформамида и оксалилхлорида, в растворителе, таком как ди 11 хлорметан или 1,2-диметоксиэтан, при температурах между -10 С и 10 С. Для этого типа реакции можно в качестве ссылки указать, например, J. Chem. Soc. (С) 1970, 2484-2488 и Angew. Chem. Internal Ed. 1963, 2, 98-99. Ацетофеноны (V) известны или получаются известными способами, такими как способы,описанные в Gazz. Chim. Ital. 1949, 79, 453-457 иJ. Am. Chem. Soc. 1947, 69,1651-1652. Схема 2 иллюстрирует способы, используемые для получения соединений (V). Схема 2 На схеме 2 X, Y и R1 такие, как определено для (I), Су такой, как определен выше для (I'), Z представляет собой атом брома или йода илиOTf, R представляет собой атом водорода или алкильную или арильную группу, и Р представляет собой защитную группу для кетонной функции, такую как метил. Соединения (V) можно получить прямо из соединений (Va) путем воздействия соединением бора R1-B(OR)2 (2), как описано для превращения (la) в (I). Кетонную функцию соединения(Va) можно также защитить традиционно, например путем воздействия триалкил-ортоформиатом в соответствующем спирте в присутствии кислоты, такой как паратолуолсульфоновая кислота. Таким образом получают соединение (Vp), которое взаимодействует с кетоном в условиях, описанных для превращения (la) в(I'). С кетонной функции удаляют защиту путем гидролиза в кислой среде с получением соединения (V'). Указанное соединение (V') затем восстанавливают в мягких условиях, описанных для превращения (I') в (I). В некоторых случаях, например, когда R1 представляет собой 4,4-диметилциклогексильную или 4-тетрагидропиранильную группу,может образоваться промежуточное соединение формулы где Х = О или -С(СН 3)2, из которого получают,после предварительной защиты кетонной функции и гидрирования, например в присутствии палладия на угле в метаноле, с последующим удалением защиты с кетонной функции, желаемое соединение (V). Соединения (V), где Х и/или Y являются отличными от водорода, можно получить из соединений (V), где Х = Y = Н, способами, хорошо известными специалистам в данной области техники. Например, когда Х и/или Y представляет собой атом хлора, проводят хлорирование ароматического ядра путем воздействия газообразным хлором в присутствии кислоты Льюиса (Lewis), предпочтительно трихлорида алюминия, в хлорированном растворителе, таком как дихлорметан, предпочтительно при 0 С. Соединения (Va) имеются в продаже или их можно получить способами, известными специалистам в данной области техники. Например, когда Z представляет собой трифлат, соединение (Va) можно получить, как показано на схеме 3: Схема 3 На схеме 3 X и Y такие, как определено для (I). Соединения (VIII) имеются в продаже,или их получают традиционными способами. Согласно другим его аспектам, объектом настоящего изобретения также являются соединения формулы (Iа)(I), и Z представляет собой атом брома или иода или OTf. Эти соединения являются новыми и представляют собой ключевые промежуточные соединения в синтезе соединений (I). Настоящее изобретение также относится к способу получения производных (Iа), отличающемуся тем, что- когда n = 1, то тогда проводят реакцию Манниха между производным фенилацетилена формулы где X и Y такие, как определено для (I), и Z представляет собой атом брома или йода или- или проводят реакцию сочетания между амином формулы где R2, R3 и n такие, как определено для (I), и производным формулы где Х и Y такие, как определено для (I), Z представляет собой атом брома или йода или трифлат, и Z' представляет собой атом брома или йода, если Z представляет собой трифлат, иначеZ' представляет собой трифлат, в присутствии палладиевого катализатора, одного или более чем одного четвертичного амина и, возможно,хлорида лития. Реакцию Манниха проводят в таких же условиях, как условия, описанные для превращения (II) в (I). Реакцию Соногашира, описанную для сочетания соединений (III) и (4), применяют для осуществления сочетания между соединениями(IlIa) и (4). Когда Z представляет собой трифлат,и Z' представляет собой атом брома или йода,процесс проводят при отсутствии хлорида лития. С другой стороны, когда Z представляет собой атом брома или йода, и Z' представляет собой трифлат, процесс проводят в присутствии хлорида лития. Использование хлорида лития делает возможным направлять реакцию сочетания. Пропаргиламины (4) (в случае, когда n = 1) получают традиционно, например согласно Tetrahedron Lett. 1989, 30 (13), 1679-1682, начиная с амина (1) HNR2R3 и 3-бромпропина, путем воздействия карбонатом калия в ацетонитриле при температуре между 50 и 80 С. Соединения (III), где Z = OTf, традиционно получают из соответствующих спиртов формулы: где X, Y и R1 такие, как определено для (I), путем воздействия трифторметансульфоновым ангидридом (трифликовым ангидридом) в пиридине. Сами спирты (IX) получают из соединений формулы где Z" представляет собой атом брома или йода,согласно способам, описанными ранее для превращения (Ia) в (I) или (Va) в (V). Соединения(IXa) имеются в продаже или их получают согласно методикам, хорошо известным специалистам в данной области техники. Соединения (IIа) получают из хлоракролеина формулы где Х и Y такие, как определено для (I), и Z представляет собой атом брома или йода илиOTf, который в свою очередь получают из ацетофенона формулы где X, Y и Z такие, как определено для (IVa),согласно способам, описанным для превращения (IV) в (II) и (V) в (IV). Соединения по изобретению подвергали биохимическим и фармакологическим исследованиям. Соединения формулы (I) и их фармацевтически приемлемые соли, гидраты и сольваты специфически связываются с сигмарецепторами, в частности с сигма-рецепторами центральной нервной системы. Сродство к сигма-1 рецепторам изучали invitro на мозговых мембранах морских свинок,используя 3H-(+)-пeнтaзoцин в качестве лиганда, согласно De Haven-Hudkins et al., Life Science 1993, 53, 41-48. (+)-Пентазоцин специфически связывается с сигма-1 рецепторами. Фрагмент мозговой мембраны морской свинки готовят обычными способами. Мембранный препарат (0,3 мг белка/мл) инкубируют в течение 150 минут при 37 С в присутствии 0,5 нМ [3H]-(+)пентазоцина. Неспецифическое связывание определяют в присутствии 10 мкМ (+)пентазоцина. Мембраны затем отфильтровывают и промывают 3 раза. Отфильтрованный материал анализируют для определения фракции специфически связанного [3 Н]-(+)-пентазоцина. В этих условиях соединения по настоящему изобретению, примеры которых следуют далее,имеют значения IC50 между 0,1 нМ и 100 нМ. Способность соединений по изобретению взаимодействовать с сигма-2 рецепторами испытывали in vitro на мембранах крысиных селезенок, используя в качестве лиганда [3H]-DTG,согласно R. Paul et al., Journal of Neuroimmunology 1994, 52, 183-192. Мембранный препарат (1 мл) инкубируют с 2 нМ [3H]-DTG в течение 90 мин при 20 С. Величину неспецифического связывания определяют в присутствии 10 мкМDTG или галоперидола. Мембраны отфильтровывают и дважды промывают, и отфильтрованный материал анализируют для определения количества специфически связанного [3H]-DTG. Соединения по изобретению имеют сигма-2 активность между 1 нМ и 500 нМ. Сигма-1 активность также изучали in vivo на мышах, используя модель вращения, индуцированного лигандом (+)-3 РРР (0,05 мкг/мл) согласно Р. Worms et al., Life Science 1986, 39,2199-2208. Соединения по изобретению вводили внутрибрюшинно в дозах 0,25 мг/кг и перорально в дозах 1 мг/кг. 15 Потенциальную антипсихотическую активность соединений по изобретению изучали следующим образом, согласно различным тестам, описанным в Neuropharmacology 1993, 32(6), 605-615. Соединения по изобретению изучали в соответствии с моделью гиперактивности, индуцированной у мышей амфетамином(внутрибрюшинно в дозах 16 мг/кг). Также применяли тест активного избегания у крыс. Эти испытания продемонстрировали антипсихотическую активность соединений по настоящему изобретению, примеры которых приведены ниже. Соединения по настоящему изобретению также являлись объектом электрофизиологических исследований, которые показали, что существует сходство между соединениями по изобретению и традиционными нейролептическим агентами, как после разового введения, так и после неоднократного введения. Для некоторых соединений полученные результаты демонстрируют высокую селективность продуктов по изобретению в А 10 (вентральная тегментальная область (ventral tegmental area) = VTA) по отношению к А 9 (черная субстанция), то есть увеличение количества спонтанно активных дофаминергических нейронов исключительно в А 10, но не в А 9. Это свойство представляется очень интересным, так как А 9 структура активно вовлечена в экстрапирамидальные эффекты, полученные с традиционными антипсихотическим агентами (L.A. Chiodo and B.S. Bunney; Catecholamines: Neuropharmacology and CentralNervous System - Theoretical aspects 1984, 369391). Согласно результатам, полученным в ходе этих биохимических и поведенческих тестов,соединения по изобретению обладают антипсихотической активностью. Вовлечение CYP206 можно продемонстрировать в исследованиях метаболизма in vitro на микросомальных фракциях человеческой печени. Наиболее общеупотребительной концепцией является ингибирование фермента его специфическим ингибитором: хинидином (quinindine), применяемым 20-кратно к его Ki, причем Кi представляет собой абсолютное значение константы ингибирования активного начала по отношению к ферменту. Различные модели дают возможность продемонстрировать в конкретных метаболических реакциях вовлечение CYP2D6.- Можно использовать микросомальные фракции человеческой печени, которые содержат все человеческие печеночные изоформы,которые инкубируют в присутствии окислительно-восстановительного кофактора (NADPH) и в присутствии или в отсутствие хинидина 20 кратно к его Ki по отношению к CYP2D6. Снижение метаболизации, наблюдаемое в присутствии хинидина, может быть связано с ингибированием изоформы CYP2D6, что, таким образом, 004048 16 подтверждает его возможное вовлечение в изучаемый(е) метаболический(е) путь(и).- Также можно использовать микросомальные фракции, которые получают из трансфицированных клеток, экспрессирующих только одну изоформу человеческого цитохрома Р 450 (GENTEST Corp.).- Также можно использовать человеческие гепатоциты в первичной культуре, которые способны осуществлять I и II фазу метаболических реакций. Затем проводят инкубацию в течение промежутка времени 24 часа в присутствии или в отсутствие хинидина, который является сильным и специфическим ингибитором CYP2D6. В качестве ссылки можно указать J. Pharm. Exp.- указанное соединение инкубируют с микросомальными фракциями человеческой печени, NADPH (окислительно-восстановительный ко-фактор) и в присутствии или в отсутствие хинидина. Степень ингибирования метаболизации, которую наблюдают в присутствии хинидина, отражает вовлечение CYP2D6 в метаболизацию указанного соединения. Этот подход можно применять, когда метаболизация на микросомальных фракциях печени имеет достаточную величину (то есть больше или равна 10% количества исходного субстрата).- Когда метаболизация указанного соединения на микросомах печени слишком низка для того, чтобы с точностью количественно оценить ингибирование, или когда необходимы дополнительные подтверждения, проводят более широкие исследования на человеческих гепатоцитах в первичной культуре, в течение промежутка времени 24 ч. Степень вовлечения CYP2D6 в общую метаболизацию в печени затем выявляют по уменьшению внутреннего клиренса указанного соединения, возможно наблюдаемому в присутствии хинидина.- Полученные результаты показывают, что соединения по изобретению имеют низкую скорость метаболизации и/или имеет место слабое вовлечение CYP2D6 в окислительный процесс. Не наблюдается никаких признаков токсичности у этих соединений в фармакологически активных дозах, и их токсичность, таким образом, совместима с их применением в качестве лекарственных продуктов. Соединения по данному изобретению, таким образом, являются особенно полезными и могут эффективно применяться в качестве лекарственных продуктов, в частности антипсихотических агентов, для лечения нарушений, связанных с церебральной ишемией и позитивными или негативными симптомами шизофрении. Соединения по изобретению также являются очень полезными, благодаря их нейропротекторной активности, в частности по отношению к апоптозу. Соединения по изобретению 17 также можно применять как анальгетики или для лечения злоупотребления лекарственными средствами и симптомов, связанных с зависимостью от лекарственных средств и их отменой. Кроме того, соединения по изобретению также проявляют активность в сердечнососудистой области, в частности в регулировании нарушений сердечного ритма. Объектом настоящего изобретения, таким образом, также являются фармацевтические композиции, содержащие эффективную дозу соединения по изобретению или фармацевтически приемлемой соли, сольвата или гидрата этого соединения и подходящие эксципиенты. Указанные эксципиенты выбирают в соответствии с лекарственной формой и желаемым способом введения. В фармацевтических композициях по настоящему изобретению для перорального, подъязычного,подкожного,внутримышечного,внутривенного, местного, внутритрахеального,интраназального, чрескожного, ректального или внутриглазного введения активные начала вышеуказанной формулы (I) или их возможные соли, сольваты или гидраты можно вводить в стандартных формах введения, в смеси с традиционными фармацевтическими носителями,животным и людям для профилактики или лечения вышеуказанных нарушений или состояний. Подходящие стандартные формы введения включают в себя пероральные формы, такие как таблетки, желатиновые капсулы, порошки, гранулы или пероральные растворы или суспензии,подъязычные, защечные, внутритрахеальные и внутриназальные формы введения, подкожные,внутримышечные или внутривенные формы введения и ректальные формы введения. Для местного применения соединения по изобретению можно применять в кремах, мазях, лосьонах или глазных каплях. Для того, чтобы получить желаемый профилактический или терапевтический эффект,доза активного начала может колебаться в пределах от 0,02 до 1 мг на кг массы тела и в сутки. Каждая стандартная доза может содержать от 1 до 25 мг, предпочтительно от 5 до 12 мг,активных ингредиентов в комбинации с фармацевтическим носителем. Эту стандартную дозу можно вводить от 1 до 5 раз в сутки таким образом, чтобы ввести суточную дозу от 1 до 100 мг,предпочтительно от 5 до 60 мг. Когда изготавливают твердые композиции в форме таблеток, главный активный ингредиент смешивают с фармацевтическим наполнителем, таким как желатин, крахмал, лактоза, стеарат магния, тальк, гуммиарабик или подобным. Таблетки могут быть покрыты сахарозой, производным целлюлозы или другими подходящими веществами, или альтернативно, их можно обработать таким образом, чтобы они обладали пролонгированной или отсроченной активностью и таким образом, чтобы они непрерывно 18 высвобождали предопределенное количество активного начала. Препарат в желатиновых капсулах получают, смешивая активный ингредиент с разбавителем и помещая полученную смесь в мягкие или твердые желатиновые капсулы. Препарат в форме сиропа или эликсира или для введения в форме капель может содержать активный ингредиент вместе с подсластителем, предпочтительно бескалорийным подсластителем, метил парабеном и пропилпарабеном в качестве антисептиков, а также усилителем вкуса и подходящим красителем. Диспергируемые в воде порошки или гранулы могут содержать активный ингредиент,смешанный с диспергаторами, увлажняющими агентами или суспендирующими агентами, такими как поливинилпирролидон, а также с подсластителями или усилителями вкуса. Для ректального введения применяют суппозитории, которые готовят со связующими веществами, плавящимися при ректальной температуре, например с маслом какао и полиэтиленгликолями. Для парентерального введения применяют водные суспензии, изотонические солевые растворы или инъекционные стерильные растворы,которые содержат фармакологически совместимые диспергаторы и/или увлажняющие агенты,например пропиленгликоль или бутиленгликоль. Активное начало также можно приготовить в виде препарата в форме микрокапсул,возможно с одним или более чем одним носителем или добавкой, или альтернативно, с матрицей, такой как полимер или циклодекстрин(пластырь, формы с замедленным высвобождением). Композиции по настоящему изобретению могут содержать, наряду с продуктами вышеуказанной формулы (I) или их фармацевтически приемлемыми солями, сольватами и гидратами,другие активные начала, которые можно применять при лечении нарушений или состояний,указанных выше. Таким образом, объектом настоящего изобретения также являются фармацевтические композиции, содержащие комбинацию нескольких активных начал, одним из которых является соединение по изобретению. Получения и примеры ниже иллюстрируют данное изобретение, однако, не ограничивая его. Точки плавления определяли согласно микрометодике Кофлера (Kofler). Спектры ядерного магнитного резонанса получали в диметилсульфоксиде, если не указано иного, при 200 МГц, и химические сдвиги выражены в м.д. (миллионных долях). Ниже были использованы следующие сокращения: s = синглет; m = мультиплет; d = дублет; t = триплет; q = квартет. Фенильную группу в соединениях (I) ниже традиционно нумеруют следующим образом: 1(Vp): X=Y=H; Z=Br; P=CH3. Смесь 19,905 г 1-(4-бромфенил)этанона,101,4 мл метанола, 0,22 г гидрата паратолуолсульфоновой кислоты и 19,9 мл триметилортоформиата перемешивают в течение 6 ч при комнатной температуре. Раствор нейтрализуют 1%-ным раствором гидроксида калия в метаноле и концентрируют при пониженном давлении. Полученное масло переносят в петролейный эфир, осадок удаляют фильтрацией и фильтрат упаривают при пониженном давлении. Соединение Vp очищают дистилляцией; выход = 96%; точка кипения = 82 С (при давлении 0,003 мбар 27,5 мл 1,6 М раствора н-бутиллития в гексане добавляют по каплям при -78 С к раствору 10 г 1-бром-4-(1,1-диметоксиэтил)бензола (соединение Vp) в 100 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 2 ч при этой температуре. Раствор 6,92 мл 3,3,5,5 тетраметилциклогексанона в 20 мл тетрагидрофурана добавляют в течение 20 мин и реакционную смесь перемешивают при -78 С в течение 1 ч. После подогрева до комнатной температуры добавляют 140 мл насыщенного водного раствора хлорида аммония. Фазы разделяют после расслаивания, водную фазу экстрагируют диэтиловым эфиром, органические фазы объединяют и сушат над сульфатом магния, растворители выпаривают при пониженном давлении. Полученное масло очищают хроматографией на колонке с силикагелем, элюируя смесью 95/5(об./об.) циклогексан/этилацетат; выход = 88%; точка плавления =135 С. Таким же путем получают следующие соединения: 38,1 мл хлортриметилсилана добавляют в течение 45 мин к раствору 40,45 г 1-[4(гидрокси-3,3,5,5-тетраметилциклогексил)фенил]этанона (соединение V'.1) и 56,21 г йодида натрия в 230 мл безводного ацетонитрила. Во время добавления температуру поддерживают между 35 и 40 С. После перемешивания в течение 2 ч добавляют 40 мл ацетонитрила и 39,4 мл уксусной кислоты. Затем 29,4 г цинка в виде тонкого порошка добавляют по частям при перемешивании и при комнатной температуре. Реакционную смесь кипятят с обратным холодильником при интенсивном перемешивании в течение 4 ч. После охлаждения до комнатной температуры реакционную среду фильтруют через целит (Celite) и затем промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу концентрируют при пониженном давлении и полученное масло очищают хроматографией на колонке с силикагелем,элюируя смесью 95/5 (об./об.) циклогексан/ этилацетат; выход = 68%; точка плавления = 54 С. Таким же путем получают следующие соединения: 1-[4-(3,3-Диметилциклогексил)фенил]этанон, соединение V.2. 40,25 г хлорида алюминия добавляют при 0 С в инертной атмосфере к 350 мл дихлорметана, затем добавляют 5 г 1-[4-(3,3,5,5-тетраметилциклогексил)фенил]этанона (соединениеV.1), растворенного в дихлорметане. После пе 21 ремешивания в течение 2 ч при 0 С газообразный хлор (d = 1,565, измерено в жидком состоянии при -78 С) барботируют через реакционную смесь. После нагревания до комнатной температуры к реакционной смеси добавляют смесь вода/лед. Полученную в результате смесь экстрагируют дихлорметаном, фазы разделяют после расслаивания и органическую фазу сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя смесью 7/3H ЯМР: 7.6 (s, 1H); 7.2 (s, 1H); 3.3 (m, 1H); 2.6 (s, 3H); 1.5 (m, 2H); 1.2 (m, 4H); 1.1 (s, 6H); 0.9 (s, 6H). Согласно методике, описанной для соединения V.4, получают следующие соединения: 1-[3-Хлор-4-(3,3-диметилциклогексил)фенил]этанон, соединение V.7.(VII.1): X=3-Cl; Y=H. 167 г трихлорида алюминия добавляют в инертной атмосфере к 63,5 мл 2-хлор-1 метоксибензола в 500 мл 1,2-дихлоэтана, затем добавляют по каплям 167 г ацетилхлорида, рас 004048 22 творенного в 200 мл 1,2-дихлорэтана. Реакционную смесь нагревают при 45 С в течение 48 ч. Реакционную смесь выливают на смесь вода/лед и экстрагируют дихлорметаном, растворители выпаривают при пониженном давлении, а полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 90/10 18,8 мл 80%-ного раствора 3-бромпропина в толуоле добавляют по каплям к 20,8 мл гексаметиленамина и 27,9 г карбоната калия в 300 мл ацетонитрила. Реакционную смесь нагревают при 50 С в течение 12 ч и 6 ч при 80 С. Реакционную смесь фильтруют, а растворители выпаривают при пониженном давлении. Соединение 4.1 очищают дистилляцией; точка кипения = 61 С при давлении 26,7 Па. 1H ЯМР: 3.3 (s, 2H); 3.0 (s, 1H); 2.5 (m, 4H); 1.5 (m, 8H). Таким же путем получают: 1-Проп-2-инилазокан, соединение 4.2.(Va.1): X = 3-Cl; Y = H; Z = Otf. 26,2 мл трифликового ангидрида добавляют по каплям при 0 С к 26,7 г 1-[(3-хлор-4 гидрокси)фенил]этанона (соединение VII.1) в 700 мл пиридина. Реакционную смесь перемешивают при 0 С в течение 36 ч, растворители выпаривают при пониженном давлении, а остаток переносят в 0,1 н. раствор соляной кислоты в дихлорметане. После расслаивания фазы разделяют, органические фазы сушат над сульфатом магния, а растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем,элюируя смесью 95/5 (об./об.) циклогексан/ этилацетат. 1H ЯМР: 8.2 (s, 1H); 8.0 (d, 1H); 7.8(d, 1H). Таким же путем получают следующие соединения: 4-Ацетил-2,6-дихлорфенилтрифторметансульфонат, соединение Va.2.(соединение IIIа.1), 0.062 г йодида меди, 10 мл пиридина и 20 мл триэтиламина, затем добавляют 0,457 г катализатора дихлорбис(трифенилфосфин)палладия. Реакционную смесь нагревают при температуре флегмы в течение 2 ч,растворители выпаривают при пониженном давлении, а полученный остаток переносят в дихлорметан, промывают водой и сушат над сульфатом магния. После выпаривания растворителей при пониженном давлении полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 80/20 (об./об.) циклогексан/этилацетат; точка плавления = 192 С. 1H ЯМР: 7.8 (s, 1 Н); 7.5 (m, 2 Н); 3.6 (s,2 Н); 2.6 (m, 4H); 1.5 (m, 8H). Таким же путем получают следующие соединения: 4-[3-(1-азепанил)проп-1-инил]-3-хлорфенилтрифторметансульфонат, соединение Ia.2. Получение 9. 1-[3-Хлор-4-(4-фторфенил) фенил]этанон, соединение V.10. 19,7 г 4-ацетил-2-хлорфенилтрифторметансульфоната (соединение Va.1), 10 г 4-фторбензолбороновой кислоты, 2 г тетракис(трифенилфосфин)палладия, 17,9 г карбоната натрия в 84,5 мл воды, 591 мл толуола, 200 мл этанола и 5,51 г хлорида лития перемешивают в инертной атмосфере при 60 С в течение 8 ч. Реакционную смесь затем перемешивают в течение 12 ч при комнатной температуре. Полученную в результате смесь фильтруют, а растворители выпаривают из фильтрата при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 97/3(2 Н, m); 2.6 (3H, s). Таким же путем получают соединения 3,51 мл оксалилхлорида добавляют по каплям при температуре между -5 С и 2 С к раствору 3,72 мл диметилформамида и 20 мл безводного дихлорметана, и реакционную смесь затем перемешивают при комнатной температуре в течение 30 минут. Затем быстро добавляют 3,92 г 1-[3-хлор-4-(3,3,5,5-тетраметилциклогексил)фенил]этанона (соединение V.6), растворенного в 10 мл дихлорметана, после чего реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Реакционную смесь вливают в смесь вода/лед и затем добавляют 20 мл водного 2,84 М раствора этилата натрия. Полученную в результате смесь промывают 50 мл раствора гидрокарбоната натрия и 50 мл воды,после расслаивания фазы разделяют, органическую фазу сушат над сульфатом магния, и растворители выпаривают при пониженном давлении. Полученное масло очищают хроматографией на колонке с силикагелем, элюируя смесью 97/3 (об./об.) циклогексан/этилацетат. 1H ЯМР: 10.2 (d, 1 Н); 7.7 (s, 1 Н); 7.5 (d,1H); 7.3 (d, 1 Н); 6.6 (d, 1H); 3.4 (m, 1H); 1.5 (m,2 Н); 1.3 (m, 4 Н); 1.1 (s, 6 Н); 0.9 (s, 6H). Таким же путем получают соединения 5,3 г гидроксида натрия растворяют в 150 мл в инертной атмосфере и при интенсивном перемешивании. Добавляют 80 мл 1,4-диоксана,и смесь кипятят с обратным холодильником. Быстро добавляют 15 г 3-хлор-3-[3-хлор-4 27(3,3,5,5-тетраметилциклогексил)фенил]пропеналя (соединение IV.1), растворенного в 130 мл 1,4-диоксана, и реакционную смесь поддерживают при кипении с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры реакционную смесь вливают в большой объем дихлорметана. Фазы разделяют после расслаивания, органическую фазу сушат над сульфатом магния и растворители выпаривают при пониженном давлении. Очистку проводят хроматографией на колонке с силикагелем, элюируя циклогексаном; выход: 80%. 1H ЯМР: 7.5 (1 Н, s); 7.3 (2 Н, m); 4.2 (1 Н, s); 3.2 (1 Н, m); 1.4 (2 Н, m); 1.2 (4 Н, m); 1.0(6H,s); 0.9(6H, s). Таким же путем получают соединения II.2II.16, приведенные в табл. 4 и 5 ниже. Таблица 4-78 С к 20 г 1-бром-3,5-дифторбензола в 300 мл диэтилового эфира. Реакционную смесь перемешивают в течение 1 ч при -78 С и затем добавляют 14,2 мл триметилбората. Реакционную смесь перемешивают в течение 1 ч при -78 С и затем в течение 12 ч при комнатной температуре. Добавляют 200 мл водного 1 н. раствора соляной кислоты. Полученную в результате смесь экстрагируют диэтиловым эфиром, органическую фазу промывают насыщенным водным раствором гидрокарбоната натрия и сушат над сульфатом магния, а растворители выпаривают при пониженном давлении. Остаток переносят в циклогексан, и полученный осадок отделяют фильтрацией. 1H ЯМР: 7.4 (m, 3 Н); 7.2 (m, 2H). Получение 13. 4-Бром-3-хлорацетофенон,соединение Va.3.(Va.3); X = 3-Cl; Y = H; Z = Вr. Раствор 100 г 4-бромацетофенона в 250 мл дихлорметана добавляют по каплям при 0 С к 133,34 г хлорида алюминия в 600 мл дихлорметана. После перемешивания в течение 2 ч при 0 С через среду при 0 С барботируют 28,3 мл предварительно охлажденного (-78 С) хлора. Реакционную смесь перемешивают при комнатной температуре в течение 12 ч и затем гидролизуют. Фазы разделяют после расслаивания,водную фазу экстрагируют дихлорметаном, органическую фазу сушат над сульфатом магния и растворители выпаривают при пониженном давлении. Полученный осадок перекристалли 29 зуют из гексана; выход = 57%; точка плавления(IVa.1): X=3-Cl; Y=H; Z=Br. 15,08 мл оксалилхлорида добавляют при температуре между 3 и 6 С при интенсивном перемешивании к 16 мл диметилформамида в 200 мл дихлорметана. После нагревания до комнатной температуры смесь перемешивают в течение 30 минут, затем добавляют раствор 13,4 г 4-бром-3-хлорацетофенона (соединение Va.3) в 40 мл дихлорметана. Реакционную смесь перемешивают в течение 12 ч при комнатной температуре и затем гидролизуют добавлением раствора 18,9 г ацетата натрия в 50 мл воды. После перемешивания в течение 30 мин при комнатной температуре фазы разделяют после расслаивания, водную фазу экстрагируют дихлорметаном. органические фазы сушат над сульфатом магния и растворители выпаривают при пониженном давлении. Полученный остаток перекристаллизуют из циклогексана; выход = 87%; точка плавления = 134 С. Получение 15. 1-[3-(4-Бром-3-хлорфенил) проп-2-инил]азепан, соединение Iа.7. а) 1-Бром-2-хлор-4-этинилбензол, соединение IIа.1. 6,9 г гидроксида натрия растворяют в инертной атмосфере в 220 мл воды, добавляют 100 мл 1,4-диоксана, и реакционную смесь нагревают до 75 С. Добавляют 16 г 3-хлор-3-(4 бром-3-хлорфенил)пропеналяIVa.1), растворенного в 400 мл 1,4-диоксана, и реакционную смесь перемешивают в течение 30 мин при 85 С. Реакционную смесь оставляют охлаждаться до комнатной температуры, затем добавляют 1300 мл дихлорметана. Фазы разделяют после расслаивания, органическую фазу промывают водой и сушат над сульфатом магния, растворители выпаривают. Полученное соединение непосредственно используют на следующей стадии. б) 1-[3-(4-Бром-3-хлорфенил)проп-2-инил] азепан, соединение Ia.7. 2,53 мл водного 36%-ного раствора формальдегида добавляют к 2,46 мл гексаметиленимина в 40 мл 1,2-диметоксиэтана. Этот раствор добавляют к 4,28 г соединения, полученного выше, в присутствии 0,17 г дигидратированного хлорида меди (II) в 120 мл 1,2 диметоксиэтана. Реакционную смесь перемешивают в течение 1 ч при кипячении с обратным холодильником, растворители выпаривают при пониженном давлении, и затем полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью циклогексан/этилацетат, которая изменяется от 90/10 до 80/20 (об./об.); выход = 82%. 1H ЯМР: 7.7 (d, 004048 К 3,1 г 1-[3-(4-бром-3-хлорфенил)проп-2 инил]азепана (соединение Ia.7) в 50 мл диэтилового эфира добавляют 5,6 мл 15%-ного раствора н-бутиллития в гексане при -78 С и поддерживают перемешивание при -75 С в течение 1 ч. Все еще при -78 С добавляют 1,38 г 2 адамантанона в 25 мл диэтилового эфира, реакционную смесь затем перемешивают в течение 1 ч при -78 С. Реакционную смесь оставляют возвращаться к комнатной температуре, а затем добавляют смесь вода/лед. Фазы разделяют после расслаивания, их экстрагируют диэтиловым эфиром, органическую фазу сушат над сульфатом натрия, растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 85/15 (об./об.) циклогексан/этилацетат; выход = 73%; точка плавления = 95 С. Получение 17. 4,4-Диметилциклогексанон,соединение 3.1. а) 4,4-Диметилциклогекс-2-енон. 1 мл концентрированной серной кислоты добавляют при комнатной температуре к 81 мл бут-3-ен-2-она и 88 мл 2-метилпропиональдегида в 450 мл бензола, и затем реакционную смесь кипятят с обратным холодильником в течение 13 ч для удаления воды путем азеотропного уноса. После охлаждения до комнатной температуры реакционную смесь промывают насыщенным водным раствором бикарбоната натрия и затем водой. Органическую фазу сушат над сульфатом магния, и растворители выпаривают при пониженном давлении. После дистилляции получают 31,1 г ожидаемого соединения; точка кипения = 78 С (при давлении 22 мбар (2,2 кПа. б) 31,1 г 4,4-Диметилциклогекс-2-енона в 100 мл пентана гидрируют в автоклаве при давлении 5 бар (500 кПа) в присутствии 1,6 г 5% палладия на угле. Реакционную смесь фильтруют, а растворители выпаривают при пониженном давлении. Получение 18. 2-Хлор-4-(4,4-диметилциклогексил)фенол, соединение IХ.1 а) 2-Хлор-4-(1-гидрокси-4,4-диметилциклогексил)фенол 100 мл 1,6 М раствора бутиллития в гексане добавляют при -78 С к 15,1 г 4 бром-2-хлорфенола в 150 мл тетрагидрофурана и реакционную смесь перемешивают в течение 1 ч при -78 С. Добавляют 10,1 г 4,4 диметилциклогексанона (соединение 3.1) и реакционную смесь перемешивают при -78 С в течение еще 30 мин и затем при комнатной тем 31 пературе в течение 12 ч. Реакционную смесь гидролизуют 1 н. раствором соляной кислоты и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния, а растворители выпаривают при пониженном давлении. Полученное твердое вещество очищают хроматографией на колонке с силикагелем, элюируя смесью циклогексан/этилацетат, которая меняется от 98/2 до 90/10 (об./об.). Получают 11,8 г твердого вещества. 1H ЯМР: 7.4 (s, 1 Н); 7.2 (d, 2 Н); 6.9 (d, 2H); 4.5 (s, 1 Н); 1.9-1.1 (m, 8H); 0.9 (s,6H). б) 50 мл водного 57%-ного раствора йодистоводородной кислоты добавляют к 11,8 г 2 хлор-4-(1-гидрокси-4,4-диметилциклогексил) фенола в 200 мл уксусной кислоты. Реакционную смесь нагревают с обратным холодильником в течение 3 ч, растворители выпаривают при пониженном давлении. Добавляют водный 40%-ный раствор гидроксида натрия, водный раствор карбоната натрия и затем водный раствор гидросульфата натрия, и полученную в результате смесь экстрагируют диэтиловым эфиром. Органическую фазу сушат над сульфатом магния и растворители выпаривают при пониженном давлении. Полученное соединение очищают хроматографией на колонке с силикагелем, элюируя смесью 95/5 (об./об.) циклогексан/этилацетат. 1H ЯМР: 9.8 (s, 1 Н); 7.1 (s, 1 Н); 7 (d. 1 Н); 6.9 (d, 1 Н); 1.9 (m, 1H); 1.6-1.2 (m, 8H); 0.9 (s,6H). Получение 19. 2-Хлор-4-(4,4-диметилциклогексил)фенилтрифторметансульфонат,соединение III.1. 8,2 мл трифликового ангидрида добавляют при 5 С к 9,7 г 2-хлор-4-(4,4-диметилциклогексил)фенола (соединение IX. 1) в 60 мл пиридина, реакционную смесь оставляют стоять в течение 30 мин при 0 С, и затем реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Реакционную смесь гидролизуют и затем экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния,растворители выпаривают при пониженном давлении. Полученный остаток переносят в толуол, и затем растворители выпаривают при пониженном давлении. Полученное остаток очищают хроматографией на колонке с силикагелем, элюируя смесью циклогексан/этилацетат,которая меняется от 100/0 до 99/1 (об./об.). Получают 15 г соединения. 1 К 2,57 г 3-хлор-4-(3,3,5,5-тетраметилциклогексил)фенилэтина (соединение II.1) в 20 мл 1,2-диметоксиэтана (DME) добавляют 0,08 г дигидрата хлорида меди (II) в инертной атмосфере. Затем быстро добавляют раствор 1,19 мл формальдегида и 1,162 мл гексаметиленимина в 10 мл DME. Реакционную смесь кипятят с обратным холодильником в течение одного часа. После охлаждения до комнатной температуры растворители выпаривают при пониженном давлении. Остаток переносят в диэтиловый эфир и при быстром перемешивании барботируют газообразную соляную кислоту. Полученный осадок отделяют фильтрацией. Осадок сушат при пониженном давлении и затем перекристаллизуют из толуола; выход = 75%; точка плавления = 187 С (HCl). Таким же путем получают примеры 2-16,приведенные в табл. 6 и 7. Таблица 6 34 ниженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 87,5/12,5 (об./об.) циклогексан/этилацетат; точка плавления = 218 С Таблица 7 9,5 г 4-[3-(1-Азепанил)проп-1-инил]-2 хлорфенилтрифторметансульфоната (соединение 1 а.1), 5 г 3,5-дифторбензолбороновой кислоты (соединение 2.1), 31 мл 2 М водного раствора карбоната натрия, 2,1 г хлорида лития,300 мл толуола, 100 мл этанола и 0,7 г тетракис(трифенилфосфин)палладия перемешивают в течение 12 ч при 80 С в инертной атмосфере. Растворители выпаривают при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 99/1 (об./об.) толуол/этанол. Полученное соединение переносят в диэтиловый эфир и барботируют через него соляную кислоту. Полученный осадок отфильтровывают и перекристаллизуют из толуола, точка плавления = 196 С (HCl). Таким же путем получают соединения примеров 19-32, приведенные ниже. Таблица 8 3,46 г йодида калия добавляют в инертной атмосфере к 3,68 г 2-2-хлор-4-[3-(1-азепанил) проп-1-инил]фениладамантан-2-ола (соединение I'.1) в 20 мл ацетонитрила и 10 мл дихлорметана, а затем добавляют 2,35 мл хлортриметилсилана. Реакционную смесь перемешивают в течение 2 ч при 30 С, и затем добавляют 1,06 мл уксусной кислоты, затем 10 мл ацетонитрила и затем 1,81 г порошкового цинка. Реакционную смесь нагревают при 80 С в течение 3 ч, оставляют охлаждаться до комнатной температуры,фильтруют и промывают диэтиловым эфиром. Органические фазы сушат над сульфатом натрия, а затем растворители выпаривают при по 35 0,76 г дихлорбис(трифенилфосфин)палладия добавляют в инертной атмосфере к 3,6 г 1 проп-2-инилазепана (соединение 4.1), 8 г [4(4,4-диметилциклогексил)-3-хлорфенил]трифторметансульфоната (соединение III.1), 0,103 г йодида меди, 1,83 г хлорида лития в 200 мл триэтиламина и 100 мл пиридина. Реакционную смесь нагревают с обратным холодильником в течение 12 ч. Растворители выпаривают при пониженном давлении, а полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 95/5 (об./об.) циклогексан/этилацетат. Полученный остаток переносят в диэтиловый эфир и получают гидрохлорид путем барботирования соляной кислоты через раствор. После фильтрации полученный остаток перекристаллизуют из толуола. Пример 34. 1-(Z)-3-[3-Хлор-4-(3,3,5,5 тетраметилциклогексил)фенил]пропен-2-ил азепана гидрохлорид. 2,28 г соединения из примера 1 в 40 мл петролейного эфира гидрируют в инертной атмосфере и при атмосферном давлении в присутствии 2,3 мл циклогексена и 0,23 г палладия на карбонате кальция, отравленного 3,5% свинца(катализатор Линдлара). Реакционную смесь фильтруют через целит, полученный масляный остаток переносят в диэтиловый эфир, и через раствор барботируют соляную кислоту. Осадок отфильтровывают и сушат при пониженном давлении; точка плавления = 190 С (HCl). Таким же путем получают соединения примеров 35-64 ниже. К раствору 3 г соединения из примера 1 в 25 мл толуола добавляют по каплям 19,5 мл 1 М раствора диизобутилалюминийгидрида (DIBALH) в толуоле в инертной атмосфере. Реакционную смесь перемешивают при 40 С в течение 1 ч и затем вливают в смесь вода/лед. Полученную в результате смесь экстрагируют дихлорметаном, фазы разделяют после расслаивания, органическую фазу сушат над сульфатом магния и растворители выпаривают при пониженном давлении. Остаток переносят в диэтиловый эфир и барботируют через него хлористый водород. Полученный осадок отфильтровывают и сушат; выход = 74%; точка плавления= 205 С (HCl). Таким же путем получают соединения из примеров 66-69, приведенные в таблице 10 ниже. Таблица 10 3,6 г соединения из примера 1 гидрируют в присутствии 0,36 г 10% палладия на угле и 50 мл этанола. Реакционную смесь фильтруют и фильтрат выпаривают при пониженном давлении. Полученный маслянистый остаток переносят в диэтиловый эфир и барботируют через раствор соляную кислоту. Полученный осадок отфильтровывают и сушат; выход = 59%; точка плавления =215 С (НСl). Таким же путем получают соединения из примеров 71-85, приведенные в табл. 11 ниже. Таблица 11n равно 1 или 2; Х представляет собой атом водорода, хлора или фтора или метильную или метоксигруппу;Y представляет собой атом водорода или атом хлора или фтора;R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или(С 1-С 3)алкокси или трифторметильной группой; циклогептильную, трет-бутильную, дициклопропилметильную, бицикло[3.2.1]октанильную,4-тетрагидропиранильную,4-тетрагидротиопиранильную или 1- или 2-адамантильную группу; или R1 представляет собой фенильную группу, причем подразумевается, что в этом случае Х или Y является отличным от водорода; или R1 представляет собой циклогексильную группу, причем подразумевается, что в этом случае Х и Y являются отличными от водорода; 42 ное кольцо; морфолинильную группу, возможно замещенную в положениях 3 и 5 метилом; или 4-фенил-1,2,3,6-тетрагидропиридильную группу, возможно замещенную по фенилу галогеном или трифторметильной, (C1-С 4)алкильной или(С 1-С 4)алкоксигруппой; и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты. 2. Соединения по п.1, где А представляет собой группу, выбранную из следующего: -СС-, -CH=CH-; -CH2-CH2-;X представляет собой атом водорода или хлора или метильную группу;Y представляет собой атом водорода или хлора;R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или метокси или трифторметильной группой; третбутильную или 1- или 2-адамантильную группу; или R1 представляет собой фенильную группу,причем подразумевается, что в этом случае Х иY являются отличными от водорода; или же R1 представляет собой циклогексильную группу,причем подразумевается, что в этом случае Х иY являются отличными от водорода;R2 и R3 образуют вместе с атомом азота, к которому они присоединены, 6-8-членное аминное кольцо; и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты. 3. Соединения по любому из пп.1 и 2 формулы где А представляет собой группу, выбранную из следующего: -CC-; -CH=CH-; -CH2-CH2-; Х представляет собой атом водорода или хлора;Y представляет собой атом водорода или атом хлора;R1 представляет собой циклогексильную группу, монозамещенную, дизамещенную, тризамещенную или тетразамещенную метильной группой; фенильную группу, моно- или дизамещенную атомом фтора или хлора или метоксигруппой; трет-бутильную или 1- или 2 адамантильную группу; R1 представляет собой циклогексильную или фенильную группу, причем подразумевается, что в этом случае Х и Y являются отличными от водорода; и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты. 4. Соединения по любому из пп.1-3, где А представляет собой группу -СН=СН-, в частности в (Z) конфигурации. 5. Соединения по любому из пп.1-4, где Х представляет собой атом хлора, а Y представляет собой атом водорода. 6. Соединения по любому из пп.1-5, где R1 представляет собой фенильную группу, монозамещенную или дизамещенную атомом фтора или хлора или метоксигруппой, и соли присоединения этих соединений с фармацевтически приемлемыми кислотами, а также их сольваты и гидраты. 7. Соединения 1-[(Z)-3-(2-хлор-3'-фторбифенил-4-ил)пропен-2-ил]азепан; 1-[(Z)-3-(2-хлор-3'-5'-дифторбифенил-4-ил) пропен-2-ил]азепан; 1-[(Z)-3-(2-хлор-3'-метоксибифенил-4-ил) пропен-2-ил]азепан по п.1, а также их соли с фармацевтически приемлемыми кислотами, сольваты и гидраты. 8. Соединение 1-[(Z)-3-(2-хлор-3'-метоксибифенил-4-ил)пропен-2-ил]азепан по п.1, а также его соли с фармацевтически приемлемыми кислотами, сольваты и гидраты. 9. Способ получения соединения по п.1,где А представляет собой группу -CС-, отличающийся тем, что когда n = 1, то проводят реакцию Манниха между производным фенилацетилена формулы где R1, X и Y такие, как определено для (I),формальдегидом и амином (1) HNR2R3, причемR2 и R3 такие, как определено для (I). 10. Способ получения соединения по п.1,где А представляет собой группу -CC-, отличающийся тем, что осуществляют сочетание Сузуки между соединением формулы(I), и Z представляет собой бром, йод или трифторметансульфонатную (OTf) группу, и производным бора (2) формулы R1-B(OR)2, где R1 такой, как определен для (I), a R представляет собой атом водорода, алкильную или арильную группу, в присутствии основания и металлического катализатора. 11. Способ получения соединения по п.1,где А представляет собой группу -СС-, отличающийся тем, что когда R1 представляет собой циклогексильную группу, монозамещенную,дизамещенную, тризамещенную или тетразамещенную метильной группой; циклогептильную, 4-тетрагидропиранильную, 4-тетрагидротиопиранильную или адамантильную группу, 44 то тогда осуществляют сочетание между соединением (Ia), где Z представляет собой атом йода или брома, и кетоном (3), соответствующим R1,представленным в присутствии основания, с получением промежуточного соединения формулы(I); а указанное соединение (I') затем восстанавливают в селективных условиях. 12. Способ получения соединения по п.1,где А представляет собой группу -СС-, отличающийся тем, что проводят реакцию сочетания между амином формулы где n, R2 и R3 такие, как определено для (I), и соединением формулы где R1, Х и Y такие, как определено для (I), и Z представляет собой атом брома или йода или трифторметилсульфонатную (трифлатную, илиOTf) группу. 13. Способ получения соединения по п.1,где А представляет собой группу -СН=СН-, отличающийся тем, что осуществляют гидрирование соединения (I), где А представляет собой ацетиленовую группу -СС-, водородом в момент его выделения или в присутствии циклогексена для получения этиленового соединения(I) в форме смеси Z и Е изомеров, или это гидрирование проводят в присутствии металлического катализатора на носителе для получения этиленового соединения (I) в Z форме, или, альтернативно, соединение (I), где А представляет собой ацетиленовую группу -СС-, подвергают взаимодействию с гидридом металла для получения этиленового соединения (I) в Е форме. 14. Способ получения соединения по п.1,где А представляет собой группу -СН 2-СН 2-,отличающийся тем, что осуществляют гидрирование соединения (I), где А представляет собой группу -СН=СН- или -СС-. 15. Фармацевтическая композиция, содержащая в качестве активного начала соединение по любому из пп.1-8. 16. Применение соединения по любому из пп.1-8 для получения лекарственного продукта,предназначенного для лечения психотических расстройств. 17. Применение соединения по любому из пп.1-8 для получения лекарственного продукта,предназначенного для лечения позитивных и негативных симптомов шизофрении.
МПК / Метки
МПК: A61K 31/55, C07D 295/06, A61P 25/00
Метки: новые, производные, содержащие, фармацевтические, бензола, способ, композиции, получения
Код ссылки
<a href="https://eas.patents.su/23-4048-novye-proizvodnye-benzola-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные бензола, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Применение глицинбетаина в качестве антитромботического средства
Следующий патент: Пиримидины, ингибирующие репликацию вич
Случайный патент: Способ улучшения качества картофеля












