Производные фениламинопиримидина как ингибиторы bcr-abl
Номер патента: 13328
Опубликовано: 30.04.2010
Авторы: Адибхатла Кали Сатьа Бхуджанга Рао, Подили Кхадгапатхи, Венкайах Чоудари Наннапанени, Рачаконда Сринивас, Компелла Амала Кишан
Формула / Реферат
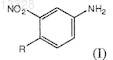
1. Фениламинопиридинилпиримидин общей формулы I
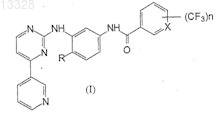
где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН3, или его фармацевтически приемлемые соли.
2. Соединение по п.1, где X представляет собой N, n=1 и R представляет собой Н или СН3, или его фармацевтически приемлемые соли.
3. Соединение по п.1, где X представляет собой СН, n=1 или 2 и R представляет собой Н или СН3, или его фармацевтически приемлемые соли.
4. Соединение по любому из пп.1-3, где, когда n=1, трифторметильная группа связана с ароматическим кольцом в положении 3; и когда n=2 и X представляет собой СН, трифторметильная группа связана с ароматическим кольцом в положении 3 и вторая трифторметильная группа связана с ароматическим кольцом в положении 5.
5. Соединение по любому из пп.1-4, у которого R представляет собой СН3.
6. Соединения по любому из пп.1-5,
где R представляет собой метил, X представляет собой СН и n=1;
где R представляет собой метил, X представляет собой СН и n=2;
где R представляет собой метил, X представляет собой N и n=1;
где R представляет собой метил, X представляет собой N и n=2;
или или их фармацевтически приемлемые соли.
7. Соединение по п.1, которое представляет собой
(3-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид;
[3,5-бис(трифторметил)]-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид;
(2-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид;
(6-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамид;
(5-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамид
или их фармацевтически приемлемые соли.
8. Соединение по п.7, которое представляет собой [3,5-бис(трифторметил)]-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид или его фармацевтически приемлемые соли.
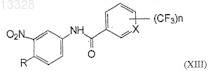
9. Соединение формулы XIII
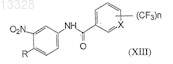
где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН3, при условии, что X не является СН, когда n=1 и R представляет собой СН3, или или его фармацевтически приемлемые соли.
10. Соединение по п.9,
где R представляет собой метил, X представляет собой СН и n=2;
где R представляет собой метил, X представляет собой СН и n=1
или где R представляет собой метил, X представляет собой N и n=1.
11. Соединение формулы XIV
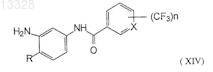
где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН3, при условии, что X не является СН, когда n=1 и R представляет собой СН3, или его фармацевтически приемлемые соли.
12. Соединение по п.11, где R представляет собой метил, X представляет собой СН и n=2; где R представляет собой метил, X представляет собой N и n=1.
13. Соединение формулы XV
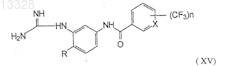
где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН3, или его фармацевтически приемлемые соли.
14. Соединение по п.13,
где R представляет собой метил, X представляет собой СН и n=1;
где R представляет собой метил, X представляет собой СН и n=2;
где R представляет собой метил, X представляет собой N и n=1;
где R представляет собой метил, X представляет собой N и n=2.
15. Соединение по любому из пп.1-4, которое представляет собой [3,5-бис(трифторметил)]-N-(3-гуанидино-4-метилфенил)бензамид; (3-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамид; (2-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамид; (6-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамид; (5-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамид или их фармацевтически приемлемые соли.
16. Соединение по любому пп.13-15, где соединение представляет собой [3,5-бис(трифторметил)]-N-(3-гуанидино-4-метилфенил)бензамид, или его фармацевтически приемлемая соль.
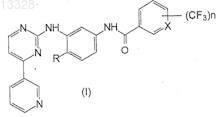
17. Способ получения фениламинопиридинилпиримидинов формулы I
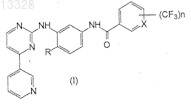
где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН3, или их фармацевтически приемлемых солей, включающий
конденсацию 4-метил-3-нитроанилина формулы (XI)
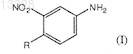
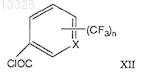
где R имеет указанные выше значения, с трифторметилароилхлоридами формулы (XII)
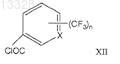
где X и n имеют указанные выше значения, в присутствии хлоруглеводорода в качестве растворителя и основания при температуре 30-40°С с образованием промежуточных нитротрифторметилароиламидов формулы (XIII)
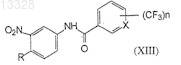
где X, n, R имеют указанные выше значения,
восстановление полученных соединений формулы (XIII) с применением восстановителя металл-кислота при температуре 0-5°С с образованием промежуточных аминотрифторметилароиламидов формулы (XIV)
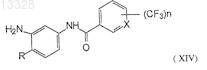
где R и n имеют указанные выше значения;
конденсацию соединений формулы (XIV) с цианамидом (CNNH2) при температуре 60-95°С в полярном растворителе и в присутствии неорганической кислоты с образованием промежуточных солей гуанидинотрифторметилароиламидов формулы (XV)
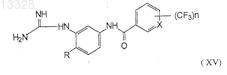
где R, X и n имеют указанные выше значения, и
конденсацию соединений формулы (XV) с соединением формулы (XVI)
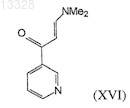
в присутствии основания при температуре 30-40°С с образованием соединений формулы (I) и, необязательно, получение фармацевтически приемлемых солей соединений формулы I.
18. Способ по п.17, где в качестве основания в процессе конденсации соединения формулы (XV) с соединением (XVI) используют гидроксид калия или гидроксид натрия.
19. Способ по п.17 или 18, где хлоруглеводородный растворитель представляет собой хлороформ, хлористый метилен или хлористый этилен; основание в процессе преобразования соединения формулы XII в соединение формулы (XIII) представляет собой триэтиламин, дипропиламин или диизопропиламин.
20. Способ по любому из пп.17-19, где хлоруглеводородный растворитель представляет собой хлороформ и основание в процессе преобразования соединения формулы XII в соединение формулы (XIII) представляет собой триэтиламин.
21. Способ по любому из пп.17-20, где восстановитель металл-кислота представляет собой хлорид олова/конц. HCl, железо/конц. HCl, цинк/конц. HCl.
22. Способ по любому из пп.17-21, где восстановитель металл-кислота представляет собой хлорид олова/конц. HCl.
23. Способ по пп.17-22, где полярный растворитель выбирают из н-пропанола, изопропанола, этанола, н-бутанола или их смесей, температура в процессе конденсации соединения формулы XIV с цианамидом составляет 90-95°С.
24. Способ по любому из пп.17-23, где полярный растворитель представляет собой н-бутанол.
25. Способ получения соединений формулы (XIII)
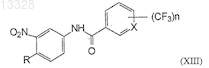
где X представляет собой СН или N, n=1 или 2, R представляет собой Н или СН3, включающий конденсацию 4-метил-3-нитроанилина формулы (XI)
где R имеет указанные выше значения, с трифторметилароилхлоридами формулы (XII)
где X и n имеют указанные выше значения, в присутствии хлоруглеводородного растворителя и основания при температуре 30-40°С с образованием промежуточных нитротрифторметилароиламидов формулы (XIII).
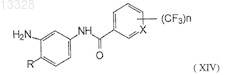
26. Способ получения соединений формулы (XIV)
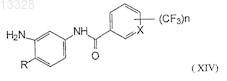
где X представляет собой СН или N, n=1 или 2, R представляет собой Н или СН3; или их фармацевтически приемлемой соли, включающий восстановление соединения формулы (XIII)
где X, n и R имеют указанные выше значения; с использованием восстановителя металл-кислота при температуре 0-5°С с образованием аминотрифторметилароиламида формулы (XIV).
27. Способ получения соли гуанидинотрифторметилароиламидов формулы (XV)
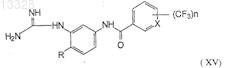
где X представляет собой СН или N, n=1 или 2, R представляет собой Н или СН3, включающий конденсацию соединения формулы (XIV)
где X, n, R имеют указанные выше значения; с цианамидом (CNNH2) при температуре 60-95°С в полярном растворителе и в присутствии неорганической кислоты с образованием промежуточных солей гуанидинотрифторметилароиламидов формулы (XV).
28. Способ по п.27, где полярный растворитель выбирают из н-пропанола, изопропанола, этанола, н-бутанола или их смесей и температура в процессе конденсации соединения формулы XIV с цианамидом составляет 90-95°С.
29. Способ по п.27 или 28, где полярный растворитель представляет собой н-бутанол.
30. Способ получения фениламинопиридинилпиримидина формулы I
где X представляет собой СН или N, n=1 или 2 и R представляет собой СН3, или его фармацевтически приемлемых солей, включающий получение N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина формулы (XVII)
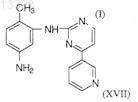
и конденсацию его с трифторметилароилхлоридами формулы (XII)
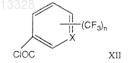
где X имеет указные выше значения, с получением соединения формулы (I).
31. Фармацевтическая композиция для лечения хронической миелоидной лейкемии, содержащая соединение формулы (I)
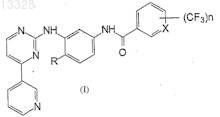
где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН3, или его фармацевтически приемлемые соли и фармацевтически приемлемый носитель.
32. Фармацевтическая композиция по п.31, где фармацевтически приемлемый носитель пригоден для топического, энтерального или парентерального применения или представляет собой неорганические или органические, твердые или жидкие носители.
33. Фармацевтическая композиция по п.31, которая дополнительно содержит эксципиент или адъювант, разбавитель, связующее, ароматизатор, корригент (улучшитель вкуса и запаха) или фармацевтически приемлемый краситель.
34. Фармацевтическая композиция по п.33, где разбавитель представляет собой микрокристаллическую целлюлозу, микрочастицы целлюлозы, лактозу, крахмал, прежелатинизированный крахмал, карбонат кальция, сульфат кальция, сахар, декстраты, декстрин, декстрозу, дигидрат гидроортофосфата (двухосновного фосфата) кальция, ортофосфат (трехосновный фосфат) кальция, каолин, карбонат магния, оксид магния, мальтодекстрин, маннит, полиметакрилаты, хлорид калия, порошковую целлюлозу, хлорид натрия, сорбит или тальк.
35. Фармацевтическая композиция по п.33, где связующее представляет собой аравийскую камедь (гуммиарабик), альгиновую кислоту, карбомер, натрийкарбоксиметилцеллюлозу, декстрин, этилцеллюлозу, желатин, смолу гувара, гидрированное растительное масло, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, жидкую глюкозу, силикат магния и алюминия, мальтодекстрин, метилцеллюлозу, полиметакрилаты, повидон (например, коллидонÒ, плаздонÒ), прежелатинизированный крахмал, альгинат натрия и крахмал.
36. Фармацевтическая композиция по п.33, где ароматизатор или корригент (улучшитель вкуса и запаха) представляет собой мальтол, ванилин, этилванилин, ментол, лимонную кислоту, фумаровую кислоту, этилмальтол и винную кислоту.
Текст
013328 Настоящее изобретение относится к новым промежуточным, пригодным для получения новых производных фениламинопиримидина, фармацевтической композиции, содержащей новые производные фениламинопиримидина и способам их получения. Изобретение относится, в частности, к новым производным фениламинопиримидина общей формулы I, представленной ниже: В формуле символы имеют следующие значения: Изобретение также охватывает фармацевтически приемлемые соли формулы I по определению выше. Кроме того, настоящее изобретение также включает способ получения вышеуказанных новых соединений и их фармацевтически приемлемых солей. Изобретение также включает фармацевтическую композицию, содержащую новые соединения общей формулы I наряду с обычно применяемыми фармацевтически приемлемыми эксципиентами, и способ их получения. Новые соединения формулы I можно применять в терапии хронического миелоидного лейкоза(ХМЛ, CML). Так как величины IC50 этих молекул находятся в пределах 0.1-10.0 нМ, эти новые соединения являются потенциально пригодными для лечения ХМЛ (CML). Предпосылки создания изобретения Из международных заявок WO 9509851, WO 9509853, европейской заявки ЕР 0588762, международных заявок WO 9509847, WO 9903854 и европейского патента ЕР-В-0-564409 известно, что производные фениламинопиридина являются эффективными соединениями для лечения опухолей. Например, в WO 9509851 раскрываются соединения общей формулы II где R1 обозначает замещенный циклический радикал, причем этот циклический радикал в каждом случае связан с циклическим углеродным атомом, выбранный из фенила, пиридила, пиразинила, тиазолила, пиримидила, пиридазинила и имидазолила, а заместители в вышеуказанном циклическом радикале выбирают из одного или более заместителей из группы: галоген, циано, карбамоил, -C(=O)-OR3,-C(=O)R4, -SO2-N(R5)-, -N(R7)-R8, -OR9 и фторзамещенный низший алкил,где R3, R4, R5, R6, R7, R8 и R9, каждый независимо от других, обозначает водород или низший алкил, незамещенный или замещенный моно- или динизшим алкиламино; иR2 выбирают из галогена, циано, карбамоила,-С(=О)-OR10, -C(=O)-R11, -SO2-N(R12)-R13, -N(R14)R15, -OR16 и фторзамещенного низшего алкила, причем R10, R11, R12, R13, R14, R15 и R16, каждый независимо от других, обозначает водород или низший алкил, незамещенный или замещенный моно- или динизшим алкиламино,или соль такого соединения, содержащая по меньшей мере одну солеобразующую группу. В международной заявке WO 9509853 раскрываются соединения производного N-фенил-2 пиримидинамина общей формулы III Производное N-фенил-2-пиримидинамина формулы III, где R0 обозначает водород, галоген, низший алкокси или низший алкил,R1 обозначает: а) N-(аминонизший алкил)карбамоил,б) N-(гидроксинизший алкил)карбамоил,в) гидразино,г) циклогексиламино, незамещенный или замещенный аминогруппой,-1 013328 д) пиперазинил, незамещенный или замещенный аминонизшим алкилом,е) морфолинил, или ж) низший алкиламино, имеющий в качестве заместителя морфолинил, гидроксинизший алкиламино, циано, имидазолил, гуанидил, амино, низший алканоиламино, низший алкиламинокарбониламино,амидино, динизший алкиламиноциклогексил, карбокси, низший алкоксикарбонил, карбамоил, Nгидроксикарбамоил, гидрокси, низший алкокси, дигидроксифосфорилокси, пиперазинил, низший алканоилпиперазинил, формилпиперазинил, пролиламидо или радикал формулы Н 2N-CH(R)-C(=O)-NH-, гдеR обозначает водород, С 1-С 4 алкил, бензил, гидроксиметил, 1-гидроксиэтил, меркаптометил, 2 метилтиоэтил, индол-3-илметил, фенилметил, 4-гидроксифенилметил, карбамоилметил, 2-карбамоилэтил, карбоксиметил, 2-карбоксиэтил, 4-аминобутил, 3-гуанидилпропил, или R обозначает 1H-имидазол 4-илметил, и R2 обозначает С 1-С 6 алкил, С 1-С 3 алкокси, хлор, бром, йод, трифторметил, гидрокси, фенил, амино, моно(С 1-С 3 алкил)амино, ди(С 1-С 3 алкил)амино, С 2-С 4 алканоил, пропенилокси, карбокси,карбоксиметокси, этоксикарбонилметокси, сульфаниламидо, N,N-ди-(C1-C3 алкил)сульфаниламидо, Nметилпиперазинил, пиперидинил, 1 Н- имидазол-1-ил, 1H- триазол-1-ил, 1H-бензимидазол-2-ил, 1 нафтил, циклопентил, 3,4-диметилбензил или радикал одной из формул:-CO2R3, -NH-C(=O)-R3, -N(R3)-C(=O)-R4, -O-(CH2)n-N(R3)-R4, -C(dbd.O)-NH-(CH2)n-R4a,-C(=O)-NH-(CH2)n-N(R3)-R4, -CH(CH3)-NH-CHO, -C(CH3).dbd.N-OH, -C(CH3)=N-O-CH3, -CH(CH3)-NH2,-NH-CH2-C(=O)-N(R3)-R4, где R3 и R4, каждый независимо, обозначает С 1-С 3 алкил, R4a обозначает гидрокси, амино или имидазолил, X обозначает кислород или серу, m обозначает 1, 2 или 3, п обозначает 2 или 3, R5 обозначает водород, С 1-С 3 алкил, С 1-С 3 алкокси, хлор, бром, йод или трифторметил, R6 обозначает 1H-имидазол-1-ил или морфолинил и R7 обозначает С 1-С 3 алкил или фенил, незамещенный или монозамещенный, имеющий в качестве заместителя С 1-С 3 алкил, галоген или трифторметил, или его соль. Производное N-фенил-2-пиримидинамин формулы III, гдеR0 обозначает водород, галоген, низший алкокси или низший алкил,R1 обозначает: а) N-(аминонизший алкил)карбамоил,б) N-(гидроксинизший алкил)карбамоил,в) гидразино,г) циклогексиламино, незамещенный или замещенный аминогруппой,д) пиперазинил, незамещенный или замещенный аминонизшим алкилом,е) морфолинил или ж) низший алкиламино, имеющий в качестве заместителя морфолинил, гидроксинизший алкиламино, циано, имидазолил, гуанидил, амино, низший алканоиламино, низший алкиламинокарбониламино,амидино, динизший алкиламиноциклогексил, карбокси, низший алкоксикарбонил, карбамоил, N-гидроксикарбамоил, гидрокси, низший алкокси, дигидроксифосфорилокси, пиперазинил, низший алканоилпиперазинил, формилпиперазинил, пролиламидо или радикал формулы H2N-CH(R)-C(=O)-NH-, где R обозначает водород, С 1-С 4 алкил, бензил, гидроксиметил, 1-гидроксиэтил, меркаптометил, 2-метилтиоэтил,индол-3-илметил, фенилметил, 4-гидроксифенилметил, карбамоилметил, 2-карбамоилэтил, карбоксиметил, 2-карбоксиэтил, 4-аминобутил, 3-гуанидилпропил, или R обозначает 1H-имидазол-4-илметил, иR2 обозначает С 1-С 6 алкил, С 1-С 3 алкокси, хлор, бром, йод, трифторметил, гидрокси, фенил, амино, моно(С 1-С 3 алкил)амино, ди(С 1-С 3 алкил)амино, С 2-С 4 алканоил, пропенилокси, карбокси, карбоксиметокси, этоксикарбонилметокси, сульфаниламидо, N,N-ди-(С 1-С 3 алкил)сульфаниламидо, N-метилпиперазинил, пиперидинил, 1 Н-имидазол-1-ил, 1H-триазол-1-ил, 1H-бензимидазол-2-ил, 1-нафтил, циклопентил, 3,4-диметилбензил или радикал одной из формул:-CO2R3, -NH-C(=O)-R3, -N(R3)-C(=O)-R4, -O-(CH2)n-N(R3)-R4, -C(=O)-NH-(CH2)n-R4a, -C(=O)NH-(CH2)n-N(R3)-R4, -CH(CH3)-NH-CHO, -C(CH3)=N-OH, -C(CH3)=N-O-CH3, -CH(CH3)-NH2, -NH-CH2C(=O)-N(R3)-R4, где R3 и R4, каждый независимо, обозначает С 1-С 3 алкил, R4a обозначает гидрокси,амино или имидазолил, X обозначает кислород или серу, m обозначает 1, 2 или 3, п обозначает 2 или 3,R5 обозначает водород, С 1-С 3 алкил, С 1-С 3 алкокси, хлор, бром, йод или трифторметил, R6 обозначает 1H-имидазол- 1- ил или морфолинил и R7 обозначает С 1-С 3 алкил или фенил, незамещенный или монозамещенный, имеющий в качестве заместителя С 1-С 3 алкил, галоген или трифторметил,или его соль. В европейской заявке ЕР 0588762, патенте США 5516775 раскрываются соединения формулы IV где R1 обозначает водород или С 1-С 3 алкил, R2 обозначает водород или С 1-С 3 алкил, R3 обознача-2 013328 ет 2-пиридил, 3-пиридил, 4-пиридил, 2-метил-3-пиридил, 4-метил-3-пиридил, 2-фурил, 5-метил-2-фурил,2,5-диметил-3-фурил, 2-тиенил, 3-тиенил, 5-метил-2-тиенил, 2-фенотиазинил, 4-пиразинил, 2-бензофурил, N-оксидо-2-пиридил, N-оксидо-3-пиридил, N-оксидо-4-пиридил, 1H-индол-2-ил, 1H-индол-3-ил, 1 метил-1 Н-пиррол-2-ил, 4-хинолинил, 1-метилпиридиний-4-илиодид, диметиламинофенил или N-ацетилN-метиламинофенил, R4 обозначает водород, С 1-С 3 алкил, -СО-СО-O-С 2 Н 5 или N,N-диметиламиноэтил,по меньшей мере один из R5, R6, R7 и R8 обозначает С 1-С 6 алкил, С 1-С 3 алкокси, хлор, бром, йод,трифторметил, гидрокси, фенил, амино, моно-(С 1-С 3 алкил)амино, ди(С 1-С 3 алкил)амино, С 2-С 4 алканоил, пропенилокси, карбокси, карбоксиметокси, этоксикарбонилметокси, сульфаниламидо, N,N-ди(С 1 С 3 алкил)сульфаниламидо, N-метилпиперазинил, пиперидинил, 1H-имидазолил-1-ил, 1 Н-триазол-1-ил,1 Н-бензимидазол-2-ил, 1-нафтил, циклопентил, 3,4-диметилбензил или радикал одной из формул:-CO2R, -NH-C(=O)-R, -N(R)-C(=O)-R,-O-(CH2)n-N(R)-R, -C(=O)-NH-(CH2)n-N(R)-R, -CH(CH3)-NH-CHO, -C(CH3)=N-OH,-C(CH3)=N-O-CH3, -C(CH3)-NH2, -NH-CH2-C(=O)-N(R)-R,-(CH2)m-R10, -X-(CH2)m-R10, или где R обозначает С 1-С 3 алкил, X обозначает кислород или серу,m обозначает 1, 2 или 3,n обозначает 2 или 3, R9 обозначает водород, С 1-С 3 алкил, С 1-С 3 алкокси, хлор, бром, йод или трифторметил, R10 обозначает 1H-имидазол-1-или морфолинил и R11 обозначает С 1-С 3 алкил или незамещенный фенил, или монозамещенный фенил, имеющий в качестве заместителя С 1-С 3 алкил, галоген или трифторметил, а другие заместители, R5, R6, R7 и R8, представляют собой водород,или их фармацевтически приемлемые соли. В европейской заявке ЕР 0564409 раскрываются соединения общей формулы V где R1 обозначает пиразинил, 1-метил-1 Н-пирролил, фенил, замещенный аминогруппой или группой аминонизший алкил-, где в каждом случае аминогруппа является свободной, алкилированной или ацилированной, 1H-индолил или 1H-имидазолил, связанный по циклическому углеродному атому пятичленного цикла, или пиридил, незамещенный, или замещенный низшим алкилом, связанный по циклическому углеродному атому, и незамещенный или замещенный кислородом по атому азота,R2, R3, каждый независимо, обозначают водород или низший алкил, один или два из радикалов R4,R5, R6, R7 и R8, каждый, обозначают нитрогруппу, фторзамещенную низшую алкоксигруппу или радикал формулы (Va)-N(R9)-C(=X)-(Y)n-R10 (Va) где R9 обозначает водород или низший алкил,X обозначает оксо, тио, имино, N-низший алкилимино, гидроксимино или О-низший алкилгидроксимино,Y обозначает кислород или группу NH,N обозначает 0 или 1 иR10 обозначает алифатический радикал, содержащий по меньшей мере 5 углеродных атомов, или ароматический, ароматический-алифатический, циклоалифатический, циклоалифатический-алифатический, гетероциклический или гетероциклоалифатический радикал,А остальные радикалы, R4, R5, R6, R7 и R8, каждый независимо, обозначают водород, низший алкил, незамещенный или имеющий в качестве заместителя свободную или алкилированную аминогруппу,пиперазинил, пиперидинил, пирролидинил или морфолинил, или низший алканоил, трифторметил, свободный, этерифицированный (с образованием простого или сложного эфира) гидроксил, свободную, алкилированную или ацилированную аминогруппу или этерифицированную карбоксигруппу, или соль такого соединения, содержащая по меньшей мере одну солеобразующую группу. В международной заявке WO 9509847 раскрываются производные N-фенил-2-пиримидинамина общей формулы VI где R1 обозначает нафтил, флуоренил, антраценил или замещенный циклический радикал, причем циклический радикал в каждом случае связан с циклическим углеродным атомом и выбирается из фенила, пиридила, 1H-индолила, пиразинила, тиазолила, пиримидинила, пиридазинила и имидазолила, а за-3 013328 местители в вышеуказанном фенильном радикале выбирают из гидрокси, галогена, нитро, циано, незамещенной или галогензамещенной низшей алкоксигруппы, из радикала формулы VIaR3 обозначает водород, бензил, низший алкил или аминонизший алкил, причем аминогруппа является свободной, содержащей в качестве заместителя низший алкил или низший алканоил, из радикала формулы m-C(=O)-N(R4)R5 (VIb) где R4 и R5, каждый независимо, обозначает водород или незамещенный или амино- или гидроксизамещенный низший алкил, из радикала формулы VIc(VIc) где R6 и R7, каждый независимо, обозначает водород, низший алкил или аминонизший алкил, или где R6 и R7 вместе образуют двухвалентный радикал -(CH2)2-NH-(CH2)2-, и из радикала формулы(VId),где R8 и R9, каждый независимо, обозначает низший алкил, или где R8 обозначает водород, a R9 обозначает амино или аминогексил, или обозначает низший алкил,имеющий в качестве заместителя имидазолил, гуанидил, низший алкиламинокарбониламино, амидино,динизший алкиламиноциклогексил, N-гидроксикарбамоил, гидрокси, низший алкокси, дигидрофосфорилокси или формилпиперазинил, а заместители в других вышеуказанных циклических радикалах выбирают из групп: гидрокси, галоген, циано, аминонизший алкил, незамещенный или галогензамещенный низший алкокси, фталимидозамещенный низший алкил, из радикала вышеуказанных формул VIa, m илиVIc и из радикала формулы VII(VII) где R10 и R11, каждый независимо, обозначает водород или низший алкил, или где R10 обозначает водород, аR11 обозначает аминоциклогексил, или обозначает низший алкил, замещенный группами: амино,низший алкиламино, динизший алкиламино, низший алкиламино, имидазолил, гуанидил, низший алкиламинокарбониламино, амидино, динизший алкиламиноциклогексил, пиперазинил, формилпиперазинил,карбокси, низший алкоксикарбонил, карбамоил, N-гидроксикарбамоил, гидрокси, низший алкокси, дигидроксифосфорилокси или глициламидо; иR2 обозначает нитро, фторзамещенный низший алкокси или радикал формулы VIII -N(R12)-C(=X)(Y)n-R13 (VIII) гдеR12 обозначается водород или низший алкил,X обозначает оксо, тио, имино, N-низший алкилимино, гидроксимино или О-низший алкилгидроксимино,Y обозначает кислород или группу NH, n обозначает 0 или 1, и R13 обозначает алифатический радикал, содержащий по меньшей мере 5 углеродных атомов, или ароматический, ароматическийалифатический, циклоалифатический, циклоалифатический-алифатический, гетероциклический или гетероциклический-алифатический,или соль такого соединения, имеющего по меньшей мере одну солеобразующую группу. Далее в европейском патенте ЕР 0564409 раскрывается применение указанных соединений для лечения атеросклероза. В международной заявке WO9903854 раскрывается применение аминопроизводных пиридилпиримидина, в особенности Gleevec, соединения фирмы Novartis CGP57148 формулы IX, в качестве ингибиторов тирозинкиназы при лечении рака. Сообщаемое для Gleevec значение IC50 равно 38 наномолей (нМ). В международной заявке WO0222597 от 11.09.2001, фирмы Novartis, раскрываются соединения формулы (X),-4 013328 где R1 обозначает пиразинил; 1-метил-1H- пирролил; амино- или аминонизший алкилзамещенный фенил, где в каждом случае аминогруппа является свободной, алкилированной или ацилированной; 1Hиндолил или 1H-имидазолил, связанный по углеродному атому пятичленного цикла; или незамещенный,или замещенный низшим алкилом пиридил, связанный по циклическому углеродному атому и незамещенный или замещенный по атому азота кислородом, R2 и R3, каждый независимо, обозначает водород или низший алкил, один из радикалов R4, R5, R6, R7 и R8 обозначает радикал формулы 11-N(R9)-C(=X)(Y)n-R10, гдеR9 обозначает водород или низший алкил,X обозначает оксо, тио, имино, N-низший алкилимино, гидроксимино или О-низший алкилгидроксимино,Y обозначает кислород или группу NH, n обозначает 0 или 1 иR10 обозначает фенил, который а) замещен радикалом, выбранным из группы, состоящей из аминогруппы; моно- или динизшего алкиламина; низшего алканоиламино; формила; низшего алкоксикарбонила; и низшего алкила, содержащего в качестве заместителя аминогруппу, моно- или динизший алкиламин или низший алканоиламино, или б) замещен незамещенным или замещенным радикалом, выбранным из группы, состоящей из бензиламино; бензоиламино; пирролидинила; пиперидинила; пиперазинила; пиперазинил-карбонила; морфолинила; и низшего алкила, замещенного группами: бензиламино; бензоиламино; пирролидинил; пиперидинил; пиперазинил или морфолинил, причем заместители в указанном радикале выбирают из группы, состоящей из циано; низшего алкила; гидрокси- или аминозамещенного низшего алкила; грифторметила; гидрокси; низшего алкокси; низшего алканоилокси; амино; моноили динизшего алкиламина; низшего алканоиламино; бензоиламино; карбокси; низшего алкоксикарбонила и галогена, и в) необязательно дополнительно замещен одним или более радикалов, выбранных из группы, состоящей из циано; низшего алкила; гидрокси- или аминозамещенного низшего алкила; трифторметила; гидрокси; низшего алкокси; низшего алканоилокси; амино; моно- или динизшего алкиламина; низшего алканоиламино; бензоиламино; карбокси; низшего алкоксикарбонила и галогена, при условии, что R10 не обозначает (4-метилпиперазинил)метилфенил, а остальные радикалы R4, R5, R6, R7 иR8, каждый независимо, обозначают галоген; низший алкил, незамещенный или имеющий в качестве заместителя свободную или алкилированную аминогруппу, пиперазинил, пиперидил, пирролидинил или морфолинил; низший алканоил; трифторметил; свободную или этерифицированную с образованием простого или сложного эфира гидроксильную группу; свободную, алкилированную или ацилированную аминогруппу; или свободную или этерифицированную карбоксигруппу, или соль такого соединения,имеющего по меньшей мере одну солеобразующую группу. Хорошо известно, что фениламинопиридопиримидины, подпадающие под вышеуказанные категории, в высшей степени применимы для лечения Bcr-abl-позитивного рака и опухолевых заболеваний,таких как лейкозы [в особенности хронического миелоидного лейкоза (ХМЛ, CML) и острого лимфобластного лейкоза, когда, как обнаружено, реализуются, в частности, апоптотические механизмы действия]. Соответственно, интерес и внимание привлекает получение новых молекул, подпадающих под вышеуказанные категории соединений. Таким образом, основной целью настоящего изобретения является получение новых фениламинопиридопиримидинов общей формулы (I), определенной выше и их фармацевтически приемлемых солей. Другой целью настоящего изобретения является получение новых фениламинопиридопиримидинов общей формулы (I) по определению выше и их фармацевтически приемлемых солей с величиной IC50 в интервале 0.1-10.0 нМ. Еще одной целью настоящего изобретения является получение новых фениламинопиридопиримидинов общей формулы (I) и их фармацевтически приемлемых солей, применимых для лечения ХМЛ(CML). Еще одной целью настоящего изобретения является создание способа получения новых фениламинопиридопиримидинов общей формулы (I) по определению выше и их фармацевтически приемлемых солей. Другой целью настоящего изобретения является приготовление фармацевтической композиции, содержащей новые фениламинопиридопиримидины общей формулы (I) и их фармацевтически приемлемые соли, применимые для лечения ХМЛ (CML). Другой целью настоящего изобретения является создание способа приготовления фармацевтической композиции, содержащей новые фениламинопиридопиримидины общей формулы (I) по определению выше и их фармацевтически приемлемые соли. Еще одной целью настоящего изобретения является получение новых промежуточных, применимых для получения новых соединений формулы (I) по определению выше. Еще одной целью настоящего изобретения является создание способов получения новых промежуточных, применимых для получения новых соединений формулы (I) по определению выше. Соответственно, настоящее изобретение включает фениламинопиридопиримидины формулы (I) где символы имеют следующие значения: и их фармацевтически приемлемые соли. Трифторметильная группа в вышеприведенных соединениях, предпочтительно, связана с фенилом/пиридинилом в положении 3 (когда n = 1), а когда присутствуют две таких группы, они, предпочтительно, находятся в положениях 3, 5 (когда n = 2). Особое предпочтение отдается соединениям общей формулы (I), в которых R представляет собой метильную группу, а трифторметильная группа находится в положении 3 фенильного/пиридинильного цикла (n=1, серия- А, серия- В). Наиболее предпочтительно(ы) соединение(я) общей формулы (I), где в R присутствует метильная группа, а трифторметильная группа находится в положениях 3,5 фенильного цикла (n=1 и 2, серия- А). Вышеуказанные соединения являются новыми и о них не сообщалось в литературе. Соединения формулы (I) образуют фармацевтически приемлемые соли. Например, соли образуются с неорганическими кислотами, такими как хлористоводородная кислота, серная кислота, фосфорная кислота, (или) с подходящими органическими карбоновыми (или) сульфоновыми кислотами, например,алифатическими моно- (или) дикарбоновыми кислотами, такими как трифторуксусная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, гидроксималеиновая кислота, яблочная кислота, винная кислота (или) щавелевая кислота, (или) аминокислотами, такими как аргинин (или) лизин, ароматическими карбоновыми кислотами, такими как бензойная кислота, 2-феноксибензойная кислота, 2-ацетоксибензойная кислота, салициловая кислота,ароматическими-алифатическими карбоновыми кислотами, такими как никотиновая кислота, алифатическими сульфоновыми кислотами, такими как метансульфоновая кислота, и ароматическими сульфоновыми кислотами, такими, например, как бензолсульфоновая или 4-толуолсульфоновая кислота. Однако для терапевтических целей фармацевтически приемлемыми являются нетоксические соли, и эти соли являются предпочтительными. Изобретение охватывает способ получения фениламинопиридопиримидинов формулы I где символы имеют значения, представленные ниже, и их фармацевтически приемлемые соли, который включает: где R обозначает водород или метил, с трифторметилароилхлоридами формулы (XII)n обозначает 1 или 2, а X обозначает N или Н,в присутствии хлоруглеводорода в качестве растворителя и основания при температуре 30-40 С, с образованием новых промежуточных нитротрифторметил-ароиламидов формулы (XIII) где R и n имеют указанные выше значения;(ii) восстановление полученных новых соединений формулы (XIII) с применением восстановителя металл-кислота при температуре около 0-5 С с образованием новых промежуточных аминотрифторметилароиламидов формулы (XIV) где R и n имеют значения по определению выше;(iii) конденсацию соединений формулы (XIV) с цианамидом (CNNH2) при температуре 60-95 С в полярном растворителе и в присутствии неорганической кислоты с образованием новых промежуточных солей гуанидино-трифторметилароиламидов формулы (XV) где R и n имеют значения по определению выше, и(iv) конденсацию новых соединений формулы (XV) с соединением формулы (XVI) в присутствии основания при температуре 30-40 С с образованием новых соединений формулы (I), где R, n, X имеют значение по определению выше, и при желании, превращение новых соединений формулы I в фармацевтически приемлемые соли обычными методами. Описанный выше способ показан на приведенной ниже схеме I. Схема I Стадия i-7 013328 Также охватывается способ получения нитротрифторметилароиламидов формулы (XIII) применимых в качестве промежуточных для получения соединения формулы I, включающий конденсацию 4-метил-3-нитроанилина формулы (XI) где R обозначает водород или метил, с трифторметилароилхлоридами формулы (XII) где n обозначает 1 или 2, а X обозначает N или Н, в присутствии хлоруглеводорода в качестве растворителя и основания при температуре 30-40 С с образованием промежуточных нитротрифторметилароиламидов формулы (XIII) Согласно другому варианту изобретения охватывается способ получения аминотрифторметилароиламидов формулы (XIV) где R и n имеют значение по определению выше, применимых для получения соединений формулыI, который включает восстановление соединений формулы (XIII) при использовании в качестве восстановителя системы металл-кислота при температуре 0-5 С с образованием соединений формулы (XIV). Согласно другому варианту изобретения охватывается способ получения солей гуанидинотрифторметилароиламидов формулы (XV) где R и n имеют значение по определению выше, применимых в качестве промежуточных для получения соединений формулы (I), который включает конденсацию соединений формулы (XIV) с цианамидом (CNNH2) при температуре 60-95 С в полярном растворителе и в присутствии неорганической кислоты с образованием соединения формулы (XV). В предпочтительном варианте изобретения хлоруглеводородный растворитель, применяемый на стадии (i), можно выбирать из хлороформа, хлористого метилена или хлористого этилена, предпочтительным является хлороформ. Используемое основание можно выбирать из триэтиламина, дипропиламина или диизопропиламина, причем предпочтительным является триэтиламин. Предпочтительной температурой является температура 30-40 С. В другом варианте изобретения восстановитель металл-кислота, применяемый на стадии (ii) для восстановления нового соединения формулы (XII), можно выбирать из систем: хлорид олова/конц. HCl,железо/конц. HCl, цинк/конц. HCl, причем предпочтительной является система хлорид олова/конц. HCl. Полярный растворитель на стадии (iii) можно выбирать из н-пропанола, изопропанола, этанола, нбутанола или их смесей, причем предпочтительным является н-бутанол. Основанием, которое, предпочтительно, можно использовать на стадии (iv), является гидроксид калия или гидроксид натрия, а температура составляет 90-95 С. Согласно еще одному варианту настоящее изобретение охватывает альтернативый способ получения соединений общей формулы (I), который включает:(ii) конденсацию N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина формулы (XVII) с трифторметилароилхлоридами формулы (XII) с образованием новых соединений общей формулы (I), гдеn, X имеют значение по определению выше. Соединения формулы (I) по определению выше, ингибируют Bcr-Abl-киназу и, следовательно, как объясняется выше, пригодны для лечения Bcr-Abl-позитивных раковых и опухолевых заболеваний, таких как лейкоз (в особенности, хронический миелоидный лейкоз (ХМЛ, CML) и острый лимфобластный лейкоз, при которых, как обнаружено, реализуются, в частности, апоптотические механизмы действия). Данное изобретение также относится к фармацевтическим композициям, содержащим эффективное количество, в частности, количество, эффективное для предупреждения или лечения одного из вышеуказанных заболеваний, активного ингредиента вместе с фармацевтически приемлемыми носителями, пригодными для топического, энтерального, например орального или ректального, или парентерального введения, которые могут быть неорганическим или органическими, твердыми или жидкими. Кроме того,активный(е) ингредиент(ы), фармацевтические композиции по настоящему изобретению могут содержать один или более эксципиентов или адъювантов. Специалист в области рецептур (фармацевт) может легко выбрать эксципиенты и применяемые количества на основании опыта и изучения стандартных методик и справочников по данной области техники. Разбавители увеличивают объем твердой фармацевтической композиции и облегчают пациенту прием фармацевтической лекарственной формы и упрощают обращение с лекарством тому, кто его дает. Разбавители твердых композиций включают, например, микрокристаллическую целлюлозу (например,авицель), микрочастицы целлюлозы, лактозу, крахмал, прежелатинизированный крахмал, карбонат кальция, сульфат кальция, сахар, декстраты, декстрин, декстрозу, дигидрат гидроортофосфата (двухосновного фосфата) кальция, ортофосфат (трехосновный фосфат) кальция, каолин, карбонат магния, оксид магния, мальтодекстрин, маннит, полиметакрилаты (например, эудрагит), хлорид калия, порошковую целлюлозу, хлорид натрия, сорбит и тальк. Твердые фармацевтические композиции, которые прессуют (уплотняют) в лекарственную форму,такую как капсулы, могут включать эксципиенты, которые способствуют связыванию вместе активного ингредиента и других эксципиентов после прессования. Связующие для твердых фармацевтических композиций включают аравийскую камедь (гуммиарабик), альгиновую кислоту, карбомер (например, карбопол), натрийкарбоксиметилцеллюлозу, декстрин, этилцеллюлозу, желатин, смолу г(у)вара, гидрированное растительное масло, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу (например, клуцель (К,гидроксипропилметилцеллюлозу (например, метоцель), жидкую глюкозу, силикат магния и алюминия,мальтодекстрин, метилцеллюлозу, полиметакрилаты, повидон (например, коллидон, плаздон), прежелатинизированный крахмал, альгинат натрия и крахмал. Скорость растворения прессованной твердой фармацевтической композиции в желудке пациента можно повысить, добавляя в композицию дезинтегрант (вещество, способствующее измельчению). Дезинтегранты включают альгиновую кислоту, кальцийкарбоксиметилцеллюлозу, натрийкарбоксиметилцеллюлозу (например, Ac-Di-Sol, примеллозу, коллоидный диоксид кремния, кросповидон (например, коллидон (R), полиплаздон), смолу гвара, силикат магния и алюминия, метилцеллюлозу, микрокристаллическую целлюлозу, полакрин калия, порошковую целлюлозу, прежелатинизированный крахмал, альгинат натрия, "натрий крахмал гликолят" (например, Explotab) и крахмал. Для улучшения текучести непрессованной твердой композиции и повышения точности дозирования можно добавлять "глиданты" (вещества, способствующие уменьшению трения, улучшения скольжения). Эксципиенты, которые могут вести себя как "глиданты", включают коллоидный диоксид кремния, трисиликат магния, порошковую целлюлозу, крахмал, тальк и ортофосфат (трехосновный фосфат) кальция. Если лекарственную форму, такую как капсула, готовят прессованием порошковой композиции,давление на композицию осуществляют с помощью пуансона и красителя. Некоторые эксципиенты и активные ингредиенты имеют тенденцию прилипать к поверхностям пуансона и красителя, это может привести к тому, что в продукте наблюдается питтинг (точечное выкрашивание) и другие поверхностные неровности. Для уменьшения адгезии и для более легкого освобождения продукта от красителя в композицию можно добавлять смазку. Смазки включают стеарат магния, стеарат кальция, моностеарат глицерина, глицерилпальмитостеарат, гидрогенизованное касторовое масло, минеральное масло, полиэтиленгликоль, бензоат натрия, лаурилсульфат натрия, стеарилфумарат натрия, стеариновую кислоту, тальк и стеарат цинка. Ароматизаторы и корригенты (улучшители вкуса и запаха) делают лекарственную форму более-9 013328 приятной для пациента. Обычные ароматизаторы и корригенты для фармацевтических продуктов, которые можно включать в композицию по настоящему изобретению, включают мальтол, ванилин, этилванилин, ментол, лимонную кислоту, фумаровую кислоту, этилмальтол и винную кислоту. Твердые композиции можно также окрашивать с помощью любого фармацевтически приемлемого красителя для улучшения внешнего вида и/или для того, чтобы пациенту было легче их идентифицировать. Более подробно изобретение представлено в приведенных ниже примерах, которые даны только для иллюстрации изобретения и, следовательно, их не следует рассматривать как ограничивающие объем изобретения. Пример 1. Получение (3-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=1. Стадия I. Получение нового (3-трифторметил)-N-(4-метил-3-нитрофенил)бензамида формулы(XIII), где R обозначает метил, X обозначает СН и n=1. Прежде всего 3-трифторметилбензоилхлорид, который используют в качестве одного из исходных,получают следующим образом. Тионилхлорид (312.0 г, 2.63 моль) в течение 15 мин прибавляют к раствору 3-трифторметилбензойной кислоты (100.0 г, 0.53 моль) в хлороформе (1000 мл) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют совместной перегонкой с хлороформом в вакууме при 40 С. По окончании отгонки полученный трифторметилбензоилхлорид охлаждают до комнатной температуры и растворяют в 100 мл хлороформа. Раствор 4-метил-3-нитроанилина (49.0 г, 0.32 моль) в хлороформе (600 мл) охлаждают до -5 С и добавляют триэтиламин (161.0 г, 1.59 моль). Приготовленный как указано выше раствор трифторметилбензоилхлорида в хлороформе прибавляют по каплям при -5 С в течение 60-75 мин. Полученную суспензию перемешивают 1 ч при -5 С. Летучие отгоняют из суспензии в вакууме до остаточного объема 800 мл и отфильтровывают, промывают охлажденным хлороформом (250 мл) и сушат в вакууме, получают 85.0 г нового (3-трифторметил)-N-(4-метил-3-нитрофенил)бензамида формулы (IV), где R обозначает метил, X обозначает СН и n=1 (83%) в виде кристаллов бледно-желтого цвета (чистота, определенная методом ВЭЖХ, составляет 98.0%). Т.пл. 162-164 С. Стадия II. Получение нового (3-трифторметил)-N-(3-амино-4-метилфенил)бензамида формулы(XIV), где R обозначает метил, X обозначает СН и n=1. Суспензию (3-трифторметил)-N-(4-метил-3-нитрофенил)бензамида формулы (XIII) (85 г, 0.26 моль), полученного на стадии I, и хлорида олова (297.5 г, 1.3 моль) в абсолютном этаноле (490 мл) кипятят 30 мин. Полученную суспензию охлаждают до комнатной температуры и вливают в 4 л воды со льдом. рН реакционной смеси доводят до 8.0, добавляя 2.4 л 5% раствора гидроксида натрия, и экстрагируют 22 л этилацетата. Слой этилацетата последовательно промывают водой и рассолом и сушат сульфатом натрия. Этилацетат отгоняют полностью, к остатку добавляют 500 мл гексана и осадок отфильтровывают. Осадок на фильтре сушат в вакууме при 60 С, получают 60.0 г нового (3 трифторметил)-N-(3-амино-4-метилфенил)-бензамида формулы (XIV), где R обозначает метил, X обозначает СН и n=1 (80%), в виде желтых кристаллов (чистота, определенная методом ВЭЖХ, составляет 98.2%) Т.пл. 145-149 С. Стадия III. Получение (3-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамида формулы (XV),где R обозначает метил, X обозначает СН и n=1. К суспензии (3-трифторметил)-N-(3-амино-4-метилфенил)бензамида формулы (XIV), полученного на стадии (II), (60 г, 0.20 моль) в н-бутаноле (400 мл) прибавляют последовательно концентрированную азотную кислоту до рН 2.5 (13 г) и раствор цианамида (12.6 г, 0.3 моль) в воде (13 мл) в течение 30 мин. Полученную реакционную смесь перемешивают при кипении в течение 6 ч. Полученную реакционную смесь упаривают в вакууме досуха, а остаток охлаждают до комнатной температуры. К реакционной массе добавляют смесь 240 мл метанола и 240 мл IPE и перемешивают 1 ч при комнатной температуре. Продукт отфильтровывают под вакуумом, промывают смесью метанола и IPE (350 мл) и сушат в вакууме при 60 С, получают 43.2 г соли нитрата (3-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамида формулы (XV), где R обозначает метил, X обозначает СН и n=1, выход 53% от теоретического(чистота 99%, ВЭЖХ). Т.пл. 243-245 С. Стадия (IV). Получение (3-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино) фенил]бензамида (I), где R обозначает метил, X обозначает СН и n=1. К суспензии нитрата (3-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамида, полученного на стадии (IV) (43 г, 0.11 моль), в н-бутаноле (290 мл) в атмосфере азота последовательно прибавляют гранулы гидроксида натрия (6.9 г, 0,17 моль) и 3-диметиламино-1-пиридин-3-илпропенон (18.6 г, 0.11 моль). Полученную суспензию кипятят в течение 2 ч. Реакционная смесь становится гомогенным раствором глубокого оранжевого цвета, и диметиламин удаляют отгонкой н-бутанола. Реакционную массу охлаждают до RT, добавляют смесь воды и хлороформа (250 мл+250 мл) и хлороформный слой отделяют. Хлороформные вытяжки промывают водой и отгоняют до остаточного объема 40 мл. К реакционной- 10013328 массе прибавляют этилацетат (200 мл), осадок отфильтровывают в вакууме, промывают этилацетатом (250 мл) и водой (250 мл) и сушат в вакууме при 60 С. Выход: 29.0 г нового (3-трифторметил)-N-[4 метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил,X обозначает СН и n=1, в виде бледно-желтых кристаллов, выход 60% от теоретического (чистота, определяемая методом ВЭЖХ, составляет 99-89%). Т.пл. 211-213 С.-NH- С = О: при 1648 см-1. Пример 2. Альтернативный способ получения (3-трифторметил)-N-[4-метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=1. Прежде всего 3-трифторметилбензоилхлорид, который используют в качестве одного из исходных материалов, получают следующим образом. Тионилхлорид (2.65 кг, 3.72 моль) в течение 15 мин прибавляют к раствору 3 трифторметилбензойной кислоты (0.848 кг, 4.46 моль) и ДМФА (8.5 мл) в хлороформе (9 л) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют вместе с хлороформом в вакууме при 40 С. По окончании отгонки полученный 3-трифторметилбензоилхлорид охлаждают до комнатной температуры и растворяют в 600 мл хлороформа. Раствор N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина формулы (XVII) (1.03 кг, 3.72 моль) в хлороформе (9 л) охлаждают до -5 С и добавляют триэтиламин (1.35 кг, 13.37 моль). По каплям,при -5 С в течение 60-75 мин прибавляют приготовленный как описано выше раствор трифторметилбензоилхлорида в хлороформе. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию упаривают(отгонкой летучих) до остаточного объема 6 л, осадок отфильтровывают, промывают дистилированная водой и метанолом (2.5 л) и сушат в вакууме, получают 1 кг нового (3-трифторметил)-N-[4-метил-3-(4 пиридин-3-илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=1 (60%) в виде бледно-желтых кристаллов (чистота 95.0%, метод ВЭЖХ). Этот продукт дополнительно очищают кипячением с 3 объемами этилацетата и фильтрованием при 40 С [0.85 кг, 50.9%](чистота 98.5%, ВЭЖХ). Т.пл. 210-213 С. Пример 3. Получение [3,5-бис(трифторметил)]-N-[4-метил-3-(4-пиридин-3-илпиримидин-2 иламино)фенил]бензамида (I), где R обозначает метил, X обозначает СН и n=2. Стадия I. Получение нового [3,5-бис(трифторметил)]-N-(4-метил-3-нитрофенил)бензамида (XIII),где R обозначает метил, X обозначает СН и n=2. Прежде всего описанным ниже способом получают 3,5-бис(трифторметил)бензоилхлорид, который используют в качестве одного из исходных материалов. В течение 15 мин к раствору 3,5-бис(трифторметил)бензойной кислоты (Lancaster) (250.0 г, 0.97 моль) в хлороформе (2.5 л) при комнатной температуре прибавляют хлористый тионил (576.0 г, 4.8 моль). Реакционную смесь кипятят 1 ч. Избыток хлористого тионила удаляют совместной перегонкой с хлороформом в вакууме при 40 С. По окончании отгонки полученный 3,5-бис(трифторметил)бензоилхлорид охлаждают до комнатной температуры и растворяют в 400 мл хлороформа. Раствор 4-метил-3 нитроанилина (92.0 г, 0.60 моль) в хлороформе (1.2 л) охлаждают до -5 С и прибавляют триэтиламин(304.8 г, 3.0 моль). По каплям при -5 С в течение 60-75 мин прибавляют раствор 3,5-бис(трифторметил) бензоилхлорида в хлороформе. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию упаривают до остаточного объема 800 мл, фильтруют, осадок на фильтре промывают охлажденным хлороформом (200 мл) и сушат в вакууме, получают 160.0 г нового [3,5-бис(трифторметил)]-N-(4-метил-3 нитрофенил)бензамида (XIII), где R обозначает метил, X обозначает СН и n=2 (68%) в виде кристаллов кремового цвета (чистота 98.2%, ВЭЖХ) Т.пл. 123-130 С. Стадия (II). Получение [3,5-бис(трифторметил)]-N-(3-амино-4-метилфенил)бензамида (XIV), где R обозначает метил, X обозначает СН и n=2. Суспензию нового [3,5-бис(трифторметил)]-N-(4-метил-3-нитрофенил)бензамида (XIII) (160 г, 0.41 моль) и хлорида олова (460.8 г, 2.0 моль) в абсолютном этаноле (850 мл) кипятят 40 мин. Затем полученную суспензию охлаждают до комнатной температуры и выливают в 5 л воды со льдом. рН реакционной смеси доводят до 8.0, добавляя 4.3 л 5% раствора гидроксида натрия и экстрагируют этилацетатом (22 л). Слой этилацетата последовательно промывают водой, и рассолом и сушат сульфатом натрия. Этилацетат отгоняют полностью, к остатку добавляют 500 мл гексана и осадок отфильтровывают и сушат в вакууме при 60 С, получают 96.0 г нового [3,5-бис(трифторметил)]-N-(3-амино-4-метилфенил)бензамида(XIV), где R обозначает метил, X обозначает СН и n=2, формулы (V) (65%) в виде желтых кристаллов,(чистота 98.5%, ВЭЖХ) Т.пл. 153- 156 С. Стадия (III). Получение [3,5-бис(трифторметил)]-N-(3-гуанидино-4-метилфенил)бензамида (XV),- 11013328 где R обозначает метил, X обозначает СН и n=2. К суспензии [3,5-бис(трифторметил)]-N-(3-амино-4-метилфенил)бензамида (90 г, 0.20 моль) в нбутаноле (500 мл) последовательно прибавляют концентрированную азотную кислоту до рН 2.5 (15.9 г) и раствор цианамида (15.7 г, 0.37 моль) в воде (15 мл) за 30 мин. Полученную реакционную смесь перемешивают при кипении 6 ч, затем полностью упаривают летучие в вакууме и остаток оставляют охлаждаться до комнатной температуры. К реакционной смеси прибавляют смесь 180 мл метанола и 180 млIPE и перемешивают при комнатной температуре 1 ч. Продукт отфильтровывают под вакуумом, промывают смесью метанола и IPE (3 х 50 мл) и сушат в вакууме при 60 С, получают 72.0 г соли - нитрата нового [3,5-бис(трифторметил)]-N-(3-гуанидино-4-метилфенил)бензамида формулы (XV), где R обозначает метил, X обозначает СН и n=2, выход 62% от теоретического (чистота 99.2%, ВЭЖХ). Т.пл. 285- 287 С. Стадия (IV). Получение [3,5-бис(трифторметил)]-N-[4-метил-3-(4-пиридин-3-пиримидин-2-иламино)фенил]бензамида (I), где R обозначает метил, X обозначает СН и n=2. К суспензии нитрата [3,5-бис(трифторметил)]-N-(3-гуанидино-4-метилфенил)бензамида (70 г, 0.15 моль) в н-бутаноле (470 мл) в атмосфере азота последовательно добавляют гранулированный гидроксид натрия (7.0 г, 0.18 моль) и 3-диметиламино-1-пиридин-3-илпропенон (28.0 г, 0.16 моль). Полученную суспензию кипятят в течение 2 ч. Реакционная смесь становится гомогенным раствором глубокого оранжевого цвета, и диметиламин удаляют отгонкой н-бутанола. Реакционную массу охлаждают до RT, добавляют смесь воды и хлороформа (300 мл+300 мл) и хлороформный слой отделяют. Хлороформные вытяжки промывают водой и отгоняют до остаточного объема 70 мл. К реакционной массе прибавляют этилацетат (350 мл), осадок отфильтровывают в вакууме, промывают этилацетатом (250 мл) и водой (250 мл) и сушат в вакууме при 60 С. Выход: 48.0 г [3,5-бис(трифторметил)]-N-[4-метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=2,в виде бледно-желтых кристаллов, выход 62% от теоретического (чистота 99.9%, ВЭЖХ). Т.пл. 248- 250 С, IC50- 0.7 нМ (фиг. 2). 1-NH-ОО: при 1651.6 см-1. Пример 4. Альтернативный способ получения [3,5-бис(трифторметил)]-N-[4- метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]бензамида (I), где R обозначает метил, X обозначает СН и n=2. Прежде всего 3,5-бис(трифторметил)бензоилхлорид, который используют в качестве одного из исходных материалов, получают следующим образом. Тионилхлорид (2.04 кг, 17.2 моль) в течение 15 мин прибавляют к раствору 3,5-бис(трифторметил) бензойной кислоты (855.0 г, 3.3 моль) и ДМФА (9 мл) в хлороформе (9 л) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют вместе с хлороформом в вакууме при 40 С. По окончании отгонки полученный 3-бис(трифторметил)бензоилхлорид охлаждают до комнатной температуры и растворяют в 700 мл хлороформа. Раствор N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина формулы (XVII) (0.73 кг, 2.64 моль) в хлороформе (9 л) охлаждают до -5 С и добавляют триэтиламин (1.03 кг, 10.2 моль). По каплям,при -5 С в течение 60-75 мин прибавляют приготовленный как описано выше раствор 3,5 бис(трифторметил)бензоилхлорида в хлороформе. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию упаривают (отгонкой летучих) до остаточного объема 6 л, осадок отфильтровывают, промывают D.M. водой и метанолом и сушат в вакууме, получают 1.3 кг сырого титульного соединения, после перекристаллизации которого из метанола получают 0.82 кг (60%) [3,5-бис(трифторметил)]-N-[4-метил 3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида (I), где R обозначает метил, X обозначает СН и n=1 в виде кристаллов кремового цвета (чистота 99.9%, метод ВЭЖХ). Т.пл. 248- 250 С. Пример 5. Получение (2-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=1. Стадия I. Получение нового (2-трифторметил)-N-(4-метил-3-нитрофенил)бензамида формулы(XIII), где R обозначает метил, X обозначает СН и n=1. Прежде всего трифторметилбензоилхлорид, который используют в качестве одного из исходных,получают следующим образом. Тионилхлорид (62.4 г, 0.53 моль) в течение 15 мин прибавляют к раствору 2-трифторметилбензойной кислоты (Aldrich) (20.0 г, 0.106 моль) в хлороформе (200 мл) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют совместной перегонкой с хлороформом в вакууме при 40 С. По окончании отгонки полученный трифторметилбензоилхлорид охлаждают до комнатной температуры и растворяют в 100 мл хлороформа. Раствор 4-метил-3-нитроанилина (9.80 г,0.06 моль) в хлороформе (120 мл) охлаждают до -5 С и добавляют триэтиламин (32.2 г, 0.32 моль). Приготовленный как указано выше раствор трифторметилбензоилхлорида в хлороформе прибавляют по кап- 12013328 лям при -5 С в течение 30-45 мин. Полученную суспензию перемешивают 1 ч при -5 С. Летучие отгоняют из суспензии в вакууме до остаточного объема 150 мл и отфильтровывают, промывают охлажденным хлороформом и сушат в вакууме, получают 19.0 г нового (2-трифторметил)-N-(4-метил-3-нитрофенил) бензамида формулы (XIII), где R обозначает метил, X обозначает СН и n=1 (92%) в виде кристаллов бледно-желтого цвета (чистота, определенная методом ВЭЖХ, составляет 97.50%). Т.пл. 120- 130 С. Стадия II. Получение нового (2-трифторметил)-N-(3-амино-4-метилфенил)бензамида формулы(XIV), где R обозначает метил, X обозначает СН и n=1. Суспензию (2-трифторметил)-N-(4-метил-3-нитрофенил)бензамида формулы (XIII) (19 г, 0.058 моль), полученного на стадии I, и хлорида олова (59.5 г, 0.26 моль) в абсолютном этаноле (100 мл) кипятят 30 мин. Полученную суспензию охлаждают до комнатной температуры и вливают в 1 л воды со льдом. рН реакционной смеси доводят до 8.0, добавляя 0.5 л 5% раствора гидроксида натрия и экстрагируют 2 х 0.5 л этилацетата. Слой этилацетата последовательно промывают водой и рассолом и сушат сульфатом натрия. Этилацетат отгоняют полностью, к остатку добавляют 100 мл гексана и осадок отфильтровывают. Осадок на фильтре сушат в вакууме при 60 С, получают 14.0 г нового (2-трифторметил)-N-(3-амино 4-метилфенил)бензамида формулы (XIV), где R обозначает метил, X обозначает СН и n=1 (83%), в виде желтых кристаллов (чистота, определенная методом ВЭЖХ, составляет 98.4%). Т.пл. 128-135 С. Стадия III. Получение (2-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамида формулы (XV),где R обозначает метил, X обозначает СН и n=1. К суспензии (2-трифторметил)-N-(3-амино-4-метилфенил)бензамида формулы (XIV), полученного на стадии (II), (14 г, 0.047 моль) в н-бутаноле (100 мл) прибавляют последовательно концентрированную азотную кислоту до рН 2.5 (2.6 г) и раствор цианамида (2.5 г, 0.06 моль) в воде (3 мл) в течение 10 мин. Полученную реакционную смесь перемешивают при кипении в течение 4-6 ч. Реакционную смесь упаривают в вакууме досуха, а остаток охлаждают до комнатной температуры. К реакционной массе добавляют смесь 50 мл метанола и 50 мл IPE и перемешивают 1 ч при комнатной температуре. Продукт отфильтровывают под вакуумом, промывают смесью метанола и ГРЕ (320 мл) и сушат в вакууме при 60 С, получают 8.6 г соли - нитрата (2-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамида формулы (XV), где R обозначает метил, X обозначает СН и n=1, выход 52% от теоретического (чистота 99.1%,ВЭЖХ). Т.пл. 160-165 С. Стадия (TV). Получение (2-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино) фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=1. К суспензии нитрата (3-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамида, полученного на стадии (III) (8.6 г, 0.02 моль), в н-бутаноле (60 мл) в атмосфере азота последовательно прибавляют гранулы гидроксида натрия (1.4 г, 0.03 моль) и 3-диметиламино-1-пиридин-3-илпропенон (3.72 г, 0.02 моль). Полученную суспензию кипятят в течение 2 ч. Реакционная смесь становится гомогенным раствором глубокого оранжевого цвета, и диметиламин удаляют отгонкой н-бутанола. Реакционную массу охлаждают до RT, добавляют смесь воды и хлороформа (50+50 мл) и хлороформный слой отделяют. Хлороформные вытяжки промывают водой и отгоняют до остаточного объема 10 мл. К реакционной массе прибавляют этилацетат (40 мл), осадок отфильтровывают в вакууме, промывают этилацетатом (210 мл) и водой (210 мл) и сушат в вакууме при 60 С. Выход: 6.2 г нового (2-трифторметил)-N-[4-метил-3- (4 пиридин-3-илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=1, в виде кристаллов не чисто белого цвета, выход 64% от теоретического. Т.пл. 206- 207 С. 1-NH-C = O: при 3431.2 см-1,-NH- С = О: при 1655.9 см-1. Пример 6. Альтернативный способ получения (2-трифторметил)-N-[4-метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]бензамида формулы (I), где R обозначает метил, X обозначает СН и n=1. Прежде всего 2-трифторметилбензоилхлорид, который используют в качестве одного из исходных материалов, получают следующим образом. Тионилхлорид (156 г, 1.3 моль) в течение 15 мин прибавляют к раствору 2-трифторметилбензойной кислоты (50.0 г, 0.26 моль) в хлороформе (250 мл) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют вместе с хлороформом в вакууме при 40 С. По окончании отгонки полученный трифторметилбензоилхлорид охлаждают до комнатной температуры и растворяют в 100 мл хлороформа. Раствор N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина формулы (XVII) (55 г, 0.20 моль) в хлороформе (440 мл) охлаждают до -5 С и добавляют триэтиламин (79.6 г, 0.788 моль). По каплям, при -5 С в течение 30-45 мин прибавляют приготовленный как описано выше раствор трифторметилбензоилхлорида в хлороформе. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию фильтруют, промывают D.M. водой и метанолом и сушат в вакууме, получают 51.9 г (58%) нового 4-(2- 13013328 трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамида (I), где R обозначает метил, X обозначает СН и n=1 в виде бледно-желтых кристаллов (чистота 99.50%, метод ВЭЖХ). Пример 7. Получение (6-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида формулы (I), где R обозначает метил, X обозначает N и n=1. Стадия I. Получение нового (6-трифторметил)-N-(4-метил-3-нитрофенил)никотинамида формулы(XIII), где R обозначает метил, X обозначает N и n=1. Прежде всего 6-трифторметилникотиноилхлорид, который используют в качестве одного из исходных, получают следующим образом. Тионилхлорид (15.6 г, 0.13 моль) в течение 15 мин прибавляют к раствору 6-трифторметилникотиновой кислоты (GEORGANICS, консорциум, Словацкая Республика) (5.0 г, 0.026 моль) в хлороформе (100 мл) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют совместной перегонкой с хлороформом в вакууме при 40 С. По окончании отгонки полученный 6-трифторметилникотиноилхлорид охлаждают до комнатной температуры и растворяют в 10 мл хлороформа. Раствор 4-метил-3-нитроанилина (2.4 г, 0.016 моль) в хлороформе (50 мл) охлаждают до-5 С и добавляют триэтиламин (8.0 г, 0.08 моль). Приготовленный как указано выше раствор трифторметилникотиноилхлорида в хлороформе прибавляют по каплям при -5 С в течение 30 мин. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию отфильтровывают, промывают охлажденным хлороформом и сушат в вакууме, получают 3.6 г нового (6-трифторметил)-N-(4-метил-3-нитрофенил)никотинамида формулы (XIII), где R обозначает метил, X обозначает N и n=1 (70%) в виде кристаллов бледножелтого цвета (чистота, определенная методом ВЭЖХ, составляет 98.0%). Т.пл. 167- 171 С. Стадия II. Получение нового (6-трифторметил)-N-(3-амино-4-метилфенил)никотинамида формулы(XIV), где R обозначает метил, X обозначает N и n=1. Суспензию (6-трифторметил)-N-(4-метил-3-нитрофенил)никотинамида формулы (XIII) (3.6 г, 0.011 моль), полученного на стадии I, и хлорида олова (12.4 г, 0.055 моль) в абсолютном этаноле (25 мл) кипятят 30 мин. Полученную суспензию охлаждают до комнатной температуры и вливают в 0.28 л воды со льдом. рН реакционной смеси доводят до 8.0, добавляя 5% раствор гидроксида натрия, и экстрагируют 250 мл этилацетата. Слой этилацетата последовательно промывают водой и рассолом и сушат сульфатом натрия. Этилацетат отгоняют полностью, к остатку добавляют 10 мл гексана и осадок отфильтровывают. Осадок на фильтре сушат в вакууме при 60 С, получают 3.0 г нового (6-трифторметил)-N-(3 амино-4-метилфенил)никотинамида формулы (XIV), где R обозначает метил, X обозначает N и n=1(92%), в виде желтых кристаллов (чистота, определенная методом ВЭЖХ, составляет 98%). Т.пл. 174180.5 С. Стадия III. Получение (6-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамида формулы(XV), где R обозначает метил, X обозначает N и n=1. К суспензии (6-трифторметил)-N-(3-амино-4-метилфенил)никотинамида формулы (XIV), полученного на стадии (II), (3.0 г, 0.01 моль), в н-бутаноле (20 мл) прибавляют последовательно концентрированную азотную кислоту до рН 2.5 (0.65 г) и раствор цианамида (0.64 г, 0.015 моль) в воде (1 мл) в течение 5 мин. Полученную реакционную смесь перемешивают при кипении в течение 5 ч. Затем реакционную смесь упаривают в вакууме досуха, а остаток охлаждают до комнатной температуры. К реакционной массе добавляют смесь 12 мл метанола и 12 мл IPE и перемешивают 1 ч при комнатной температуре. Продукт отфильтровывают под вакуумом, промывают смесью метанола и IPE (310 мл) и сушат в вакууме при 60 С, получают 1.7 г соли - нитрата (6-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамида формулы (XV), где R обозначает метил, X обозначает N и n=1, выход 50% от теоретического(чистота 99.1%, ВЭЖХ). Т.пл. 287.6- 292.4 С. Стадия (IV). Получение (6-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида формулы (I), где R обозначает метил, X обозначает N и n=1. К суспензии нитрата (6-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамида, полученного на стадии (III) (1.7 г, 0.005 моль), в н-бутаноле (12 мл) в атмосфере азота последовательно прибавляют гранулы гидроксида натрия (0.22 г, 0.005 моль) и 3-диметиламино-1-пиридин-3-илпропенон (0.85 г, 0.005 моль). Полученную суспензию кипятят в течение 2 ч. Реакционная смесь становится гомогенным раствором глубокого оранжевого цвета, и диметиламин удаляют отгонкой н-бутанола. Реакционную массу охлаждают до RT, добавляют смесь воды и хлороформа (50+50 мл) и хлороформный слой отделяют. Хлороформные вытяжки промывают водой и отгоняют до остаточного объема 5 мл. К реакционной массе прибавляют этилацетат (25 мл), осадок отфильтровывают в вакууме, промывают этилацетатом и водой и сушат в вакууме при 60 С. Выход: 1.4 г нового (6-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида формулы (I), где R обозначает метил, X обозначает N и n=1, в виде кристаллов бледно-желтого цвета, выход 62% от теоретического (чистота 99.9%, ВЭЖХ). Т.пл. 243244 С. 1-NH-С = О: при 3444 см-1,-NH-С = О: при 1648 см-1. Пример 8. Альтернативный способ получения (6-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида формулы (I), где R обозначает метил, X обозначает N и n=1. Прежде всего 6-трифторметилникотиноилхлорид, который используют в качестве одного из исходных материалов, получают следующим образом. Тионилхлорид (15.6 г, 0.13 моль) в течение 15 мин прибавляют к раствору 6-трифторметилникотиновой кислоты (5.0 г, 0.026 моль) в хлороформе (100 мл) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют вместе с хлороформом в вакууме при 40 С. По окончании отгонки полученный 6-трифторметилникотиноилхлорид охлаждают до комнатной температуры и растворяют в 10 мл хлороформа. Раствор N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина формулы (XVII) (4.8 г, 0.016 моль) в хлороформе (50 мл) охлаждают до -5 С и добавляют триэтиламин (8.0 г, 0.08 моль). По каплям, при -5 С в течение 30 мин прибавляют приготовленный как описано выше раствор 6-трифторметилникотиноилхлорида в хлороформе. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию фильтруют, промывают D.M. водой и метанолом и сушат в вакууме, получают 4.3 г нового (6-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида (I), где R обозначает метил, X обозначает N и n=1 (60%) в виде бледно-желтых кристаллов (чистота 98.0%, метод ВЭЖХ). Т.пл. 242-244 С. Пример 9. Получение (5-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида (I), где R обозначает метил, X обозначает N и n=1: Стадия I. Получение нового (5-трифторметил)-N-(4-метил-3-нитрофенил)никотинамида формулы(XIII), где R обозначает метил, X обозначает N и n=1. Прежде всего 5-трифторметилникотиноилхлорид, который используют в качестве одного из исходных, получают следующим образом. Тионилхлорид (15.6 г, 0.13 моль) в течение 15 мин прибавляют к раствору 5-трифторметилникотиновой кислоты (GEORGANICS, консорциум, Словацкая Республика) (5.0 г, 0.026 моль) в хлороформе (100 мл) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют совместной перегонкой с хлороформом в вакууме при 40 С. По окончании отгонки полученный 6-трифторметилникотиноилхлорид охлаждают до комнатной температуры и растворяют в 10 мл хлороформа. Раствор 4-метил-3-нитроанилина (2.4 г, 0.016 моль) в хлороформе (50 мл) охлаждают до-5 С и добавляют триэтиламин (8.0 г, 0.08 моль). Приготовленный как указано выше раствор 5 трифторметилникотиноилхлорида в хлороформе прибавляют по каплям при -5 С в течение 30 мин. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию отфильтровывают, промывают охлажденным хлороформом и сушат в вакууме, получают 3.6 г нового (5-трифторметил)-N-(4-метил-3 нитрофенил)-никотинамида формулы (XIII), где R обозначает метил, X обозначает N и n=1 (70%) в виде кристаллов бледно-желтого цвета (чистота, определенная методом ВЭЖХ, составляет 98.0%). Т.пл. 167171 С. Стадия II. Получение нового (5-трифторметил)-N-(3-амино-4-метилфенил)никотинамида формулы(XIV), где R обозначает метил, X обозначает N и n=1. Суспензию (5-трифторметил)-N-(4-метил-3-нитрофенил)никотинамида формулы (XIII) (3.6 г, 0.011 моль), полученного на стадии I, и хлорида олова (12.4 г, 0.055 моль) в абсолютном этаноле (25 мл) кипятят 30 мин. Затем полученную суспензию охлаждают до комнатной температуры и вливают в 0.28 л воды со льдом. рН реакционной смеси доводят до 8.0, добавляя 5% раствор гидроксида натрия, и экстрагируют 250 мл этилацетата. Слой этилацетата последовательно промывают водой и рассолом и сушат сульфатом натрия. Этилацетат отгоняют полностью, к остатку добавляют 10 мл гексана и осадок отфильтровывают. Осадок на фильтре сушат в вакууме при 60 С, получают 3.0 г нового (5-трифторметил)-N-(3 амино-4-метилфенил)никотинамида формулы (XIV), где R обозначает метил, X обозначает N и n=1(92%), в виде желтых кристаллов (чистота, определенная методом ВЭЖХ, составляет 98%). Т.пл. 174180.5 С. Стадия III. Получение (5-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамида формулы(XV), где R обозначает метил, X обозначает N и n=1. К суспензии (5-трифторметил)-N-(3-амино-4-метилфенил)никотинамида формулы (XIV), полученного на стадии (П), (3.0 г, 0.01 моль) в н-бутаноле (20 мл) прибавляют последовательно концентрированную азотную кислоту до рН 2.5 (0.65 г) и раствор цианамида (0.64 г, 0.015 моль) в воде (1 мл) в течение 5 мин. Полученную реакционную смесь перемешивают при кипении в течение 5 ч. Затем реакционную смесь упаривают в вакууме досуха, а остаток охлаждают до комнатной температуры. К реакционной массе добавляют смесь 12 мл метанола и 12 мл IPE и перемешивают 1 ч при комнатной температуре. Продукт отфильтровывают под вакуумом, промывают смесью метанола и IРЕ (310 мл) и сушат в вакууме при 60 С, получают 1.70 г соли - нитрата (5-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамида формулы (XV), где R обозначает метил, X обозначает N и n=1, выход 50% от теоретического(чистота 99.1%, ВЭЖХ). Т.пл. 287.6-292.4 С. Стадия (IV). Получение (5-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино) фенил]никотинамида формулы (I), где R обозначает метил, X обозначает N и n=1. К суспензии нитрата (5-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамида, полученного на стадии (III) (1.7 г, 0.005 моль), в н-бутаноле (12 мл) в атмосфере азота последовательно прибавляют гранулы гидроксида натрия (0.22 г, 0.005 моль) и 3-диметиламино-1-пиридин-3-илпропенон (0.85 г, 0.005 моль). Полученную суспензию кипятят в течение 2 ч. Реакционная смесь становится гомогенным раствором глубокого оранжевого цвета, и диметиламин удаляют отгонкой с н-бутанолом. Реакционную массу охлаждают до RT, добавляют смесь воды и хлороформа (50 мл+50 мл) и хлороформный слой отделяют. Хлороформные вытяжки промывают водой и отгоняют до остаточного объема 5 мл. К реакционной массе прибавляют этилацетат (25 мл), осадок отфильтровывают в вакууме, промывают этилацетатом и водой и сушат в вакууме при 60 С. Выход: 1.4 г нового (5-трифторметил)-N-[4-метил-3-(4-пиридин-3 илпиримидин-2-иламино)фенил]никотинамида формулы (I), где R обозначает метил, X обозначает N и-NH-C = O: при 3444 см-1,-NH-С = O: при 1648 см-1. Пример 10. Альтернативный способ получения (5-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида (I), где R обозначает метил, X обозначает N и n=1. Прежде всего 5-трифторметилникотиноилхлорид, который используют в качестве одного из исходных материалов, получают следующим образом. Тионилхлорид (15.6 г, 0.13 моль) в течение 15 мин прибавляют к раствору 5-трифторметилникотиновой кислоты (5.0 г, 0.026 моль) в хлороформе (100 мл) при комнатной температуре. Реакционную смесь кипятят 1 ч. Избыток хлористого тионила отгоняют вместе с хлороформом в вакууме при 40 С. По окончании отгонки полученный 5-трифторметилникотиноилхлорид охлаждают до комнатной температуры и растворяют в 10 мл хлороформа. Раствор N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина формулы (XVII) (4.8 г, 0.016 моль) в хлороформе (50 мл) охлаждают до -5 С и добавляют триэтиламин (8.0 г, 0.08 моль). По каплям,при -5 С в течение 30 мин прибавляют приготовленный как описано выше раствор 5-трифторметилникотиноилхлорида в хлороформе. Полученную суспензию перемешивают 1 ч при -5 С. Суспензию фильтруют, промывают D.M. водой и метанолом и сушат в вакууме, получают 4.3 г нового (5-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамида (I), где R обозначает метил, X обозначает N и n=1 (60%) в виде кристаллов кремового цвета (чистота 98.0%, метод ВЭЖХ). Т.пл. 242-244 С. Пример 11. Капсулы, содержащие композиции приведенного ниже состава, включающие 25 мг и 50 мг соединений, полученных способом, описанным в примере 1 (3-трифторметил)-N-[4-метил-3-(4 пиридин-3-илпиримидин-2-иламино)фенил]бензамид и в примере 3 [3,5-бис(трифторметил)]-N-[4-метил 3-(4-пиридин-3-илпиримидин-2-иламино)фенил]бензамид, готовят обычным способом.- 16013328 Испытания in vitro Соединения формулы I, полученные способом, описанным в примере 1 и примере 3, растворяют в культуральной среде, содержащей ДМСО, с концентрацией 10 мМ для испытаний in vitro. Исходный раствор дополнительно разводят в той же самой культуральной среде и используют в экспериментах в концентрациях 0.1-10 мкМ. Для исследования, результаты которого раскрываются в данном описании, используют BCR-abl позитивную клеточную линию К 562 (непрерывная линия клеток, открытая Lozzio и Lozzio (1975) в плевральном выпоте 53-летней женщины, больной хроническим миелолейкозом, в терминальной стадии бластного криза) и клеточную линию D32p210 (клеточную линию, трансфецированную при использованииBCR-abl). Клетки К 562 и D32p210 выращивают в среде RPMI, дополненной 10% фетальной телячьей сывороткой, при 37 С и в атмосфере, содержащей 5% СО 2 и 95% воздуха. Клетки субкультивируют каждые 24 ч. Пролиферацию клеток определяют с помощью МТТ-теста следующим образом: клетки засевают в 96-луночный планшет при плотности 5103 клеток/лунка и в четверном повторе добавляют соединения формулы (I) в различной концентрации в пределах от 1 нМ до 100 мкМ. После инкубации клеток с соединениями в течение необходимого времени (24 ч) добавляют 20 мкл МТТ с концентрацией 5 мг/мл(конечная концентрация 100 мкг/мл) и инкубируют еще в течение 3 ч при 37 С и 5% СО 2. Через 3 ч кристаллы формазана растворяют в буфере для лизиса (10% SDS, 5% изобутанола, 12 ммоль/л HCl) в течение ночи при 37 С. Оптическую плотность определяют на ридере ELISA при двойной длине волны 570630 нм. С помощью МТТ анализа рассчитывают значения IC50 для соединений формулы (I). Экспериментальные значения равны 8 нМ и 0.7 нМ, соответственно, как показано на фиг. 1 и 2, прилагающихся к описанию. Анализ фрагментации ДНК проводят следующим образом. Клетки обрабатывают соединениями формулы (I) в течение 24 ч и фрагментированную ДНК выделяют с применением SDS/ПротеиназыK/RHK-азы. Этот метод экстракции позволяет выделять только фрагментированную ДНК без примеси геномной ДНК (Nucleic acids Res 22 5506-5507, 1994). Клетки отмывают фосфатно-солевым буферным раствором (PBS) и лизируют в буфере, содержащем 50 мМ Tris HCl (рН 8.0), 1 мМ EDTA, 0.2% тритон X-100, в течение 20 мин при 4 С. После центрифугирования при 14000 g в течение 15 мин супернатант обрабатывают протеиназой К (0.5 мг/мл) и 1% додецилсульфатом натрия (SDS) 1 ч при 50 С. ДНК дважды экстрагируют забуференным фенолом и осаждают, используя 140 мМ NaCl и 2 объема этанола при-20 С в течение носи. Осажденную ДНК дважды отмывают в 70% этаноле, растворяют в Tris-EDTA (ТЕ) и в течение 1 ч при 37 С обрабатывают РНКазой. Микролитры (мкл) ДНК, кодирующей белок, смешивают с 3 мкл буфера для образцов ДНК, содержащего 0.25% бромфенола синего, 0.25% ксиленцианола и 30% глицерина) и снова растворяют в 1% агарозном геле в ТВЕ (44.6 мМ Tris, 445 мМ борной кислоты и 1 мМ EDTA). Фрагментацию ДНК визуализируют окрашиванием геля этидия бромидом (0.5 мг/мл) и экспозицией с УФ-излучением. На наличие апоптоза указывает присутствие (лестницы) последовательных олигонуклеосомных фрагментов ДНК длиной около 180-200 п.о. ДНК фрагменты в геле четко показывают, что соединения формулы (I), определяемые выше, индуцируют апоптоз в Bcr-Abl позитивной клеточной линии К 562, как показано на фиг. 3.FACS анализ Анализ методом проточной цитометрии (FACS) проводят следующим образом. Для количественного определения апоптоза D32p210 клеток, обработанных соединениями формулы (I), полученных способом, описанным в примерах 1-3, проводят анализ методом проточной цитометрии с помощью пропидия иодида (PI). Клетки D32p210 обрабатывают соединениями формулы (I) в течение 24 ч. После обработки клетки дважды отмывают холодным PBS, постепенно фиксируют с применением 1 мл охлажденного льдом 70% этанола и выдерживают в течение ночи при 4 С. Клетки собирают центрифугированием при 500 Х g в течение 10 мин, дважды отмывают PBS и ресуспендируют в 1 мл раствора для окрашивания ДНК, содержащем 0.1% тритон Х-100, 0.1 мМ EDTA, РНКазу А (50 мкг/мл) и 50 мкг/мл пропидия иодида (PI), и инкубируют 1 ч в темноте при комнатной температуре. Красное флуоресцентное свечение индивидуальных клеток определяют с помощью клеточного сортера с возбуждением флуоресценции(FACS)/проточного питометра (Becton Dickinson, San Jose, CA, USA). Отбирают 10000 событий/образец. Относительное число молекул ДНК на клетку получают, измеряя флуоресценцию PI, который стехиометрически связывается с ДНК, как показано на фиг. 4. Величины константы ингибирования Ki (константы связывания ингибитора с ферментом) или IC50(ингибирующей концентрации, при которой рост или активность ингибируется на 50%), взятые из вышеприведенных анализов и испытаний in vitro, и ингибирующая способность соединений формулы (I) по определению выше показана на фиг. 5.In Vitro анализ киназной активности проводят следующим образом Ингибирование киназной активности bcr-abl тирозинкиназы соединениями формулы I (пример 1) количественно определяют Вестерн-блоттингом и денситометрическим анализом. Коротко говоря, 5106 клеток 32Dp210 в течение 30 мин обрабатывают соединениями формулы I (пример 1, стадия IV) с различной концентрацией. По окончании инкубации клетки осаждают центрифугированием ("пеллетиру- 17013328 ют"), отмывают в PBS и лизируют в 50 мкл буфера для лизиса, содержащего 10 мМ Tris-HCl (рН 8.0), 150 мМ NaCl, 1% Тритон Х-100, 1% Na-дезоксихолата, 0.1 мМ Na-ортованадата, 50 мМ -глицерофосфата,50 мМ NAF, 1 мМ PMSF, 10 мкг/мл леупептина и 10 мкг/мл пепстатина. В качестве контроля служат клетки, не обработанные лекарством. Равное количество белков разделяют на 6% SDS в геле и переносят на нитроцеллюлозную мембрану. После блокирования под действием 5% нежирного порошкового молока добавляют первичное антитело (антитело против фосфотирозина). Блот проявляют с помощью вторичного антитела, конъюгированного со щелочной фосфатазой. Интенсивность полосы bcr-abl киназы количественно определяют денситометрическим анализом. Апоптоз, вызываемый соединениями формулы I (пример 1, стадия IV), наблюдают методом фазовоконтрастной микроскопии. Апоптоз составляет 53.3%. Соединения формулы I, полученные методом,описанным в примере 1, ингибирует киназную активность bcr-abl киназы в клетках 32Dp210 в зависимости от дозы, а величина IC50, вычисленная с помощью денситометрического анализа, равна 4 нМ. Исследования Ex vivo проводят следующим образом. Лимфоциты выделяют из периферической крови ХМЛ (CML) больных и здоровых людей с применением Ficoll Histopaque. Кратко говоря, кровь разводят в отношении 1:1 с помощью 0.96% NaCl (физиологического раствора) и осторожно на Ficoll histopaque (в градиенте фиколла). Лейкоцитарную пленку экстрагируют центрифугированием при 1000 об/мин в течение 20 мин при комнатной температуре. Лимфоциты осторожно отбирают пастеровской пипеткой с поверхности раздела и один раз отмывают средойRPMI. Выделенные как указано выше лимфоциты культивируют в среде RPMI, содержащей 10% FBS, при 37 С и 5% СО 2. Клетки субкультивируют каждые 48 ч. После культивирования в течение 48 ч клетки (ХМЛ (CML) больных и здоровых людей) засевают в 96-луночный планшет при плотности 5103 клеток/лунка. Различные концентрации соединений формулы(I), полученных методом, описанным в примере 1 и в примере 3, добавляют к клеткам и инкубируют в течение 24 ч. После инкубационного периода к клеткам добавляют МТТ и инкубируют еще 3 ч. Образовавшиеся кристаллы формазана растворяют в буфере для лизиса и оптическую плотность считывают при двойной длине волны 570-630 нм. Рассчитывают процент ингибирования клеточной пролиферации относительно непрореагировавших клеток. Ингибирование клеточной пролиферации, полученное МТТ анализом, вводят в таблицу (фиг. 6). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фениламинопиридинилпиримидин общей формулы I где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН 3, или его фармацевтически приемлемые соли. 2. Соединение по п.1, где X представляет собой N, n=1 и R представляет собой Н или СН 3, или его фармацевтически приемлемые соли. 3. Соединение по п.1, где X представляет собой СН, n=1 или 2 и R представляет собой Н или СН 3,или его фармацевтически приемлемые соли. 4. Соединение по любому из пп.1-3, где, когда n=1, трифторметильная группа связана с ароматическим кольцом в положении 3; и когда n=2 и X представляет собой СН, трифторметильная группа связана с ароматическим кольцом в положении 3 и вторая трифторметильная группа связана с ароматическим кольцом в положении 5. 5. Соединение по любому из пп.1-4, у которого R представляет собой СН 3. 6. Соединения по любому из пп.1-5,где R представляет собой метил, X представляет собой СН и n=1; где R представляет собой метил, X представляет собой СН и n=2; где R представляет собой метил, X представляет собой N и n=1; где R представляет собой метил, X представляет собой N и n=2; или или их фармацевтически приемлемые соли. 7. Соединение по п.1, которое представляет собой(5-трифторметил)-N-[4-метил-3-(4-пиридин-3-илпиримидин-2-иламино)фенил]никотинамид или их фармацевтически приемлемые соли. 8. Соединение по п.7, которое представляет собой [3,5-бис(трифторметил)]-N-[4-метил-3-(4 пиридин-3-илпиримидин-2-иламино)фенил]бензамид или его фармацевтически приемлемые соли. 9. Соединение формулы XIII где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН 3, при условии, чтоX не является СН, когда n=1, и R представляет собой СН 3, или или его фармацевтически приемлемые соли. 10. Соединение по п.9,где R представляет собой метил, X представляет собой СН и n=2; где R представляет собой метил, X представляет собой СН и n=1 или где R представляет собой метил, X представляет собой N и n=1. 11. Соединение формулы XIV где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН 3, при условии, чтоX не является СН, когда n=1, и R представляет собой СН 3, или его фармацевтически приемлемые соли. 12. Соединение по п.11, где R представляет собой метил, X представляет собой СН и n=2; где R представляет собой метил, X представляет собой N и n=1. 13. Соединение формулы XV где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН 3, или его фармацевтически приемлемые соли. 14. Соединение по п.13,где R представляет собой метил, X представляет собой СН и n=1; где R представляет собой метил, X представляет собой СН и n=2; где R представляет собой метил, X представляет собой N и n=1; где R представляет собой метил, X представляет собой N и n=2. 15. Соединение по любому из пп.1-4, которое представляет собой [3,5-бис(трифторметил)]-N-(3 гуанидино-4-метилфенил)бензамид; (3-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамид; (2-трифторметил)-N-(3-гуанидино-4-метилфенил)бензамид; (6-трифторметил)-N-(3-гуанидино-4-метилфенил) никотинамид; (5-трифторметил)-N-(3-гуанидино-4-метилфенил)никотинамид или их фармацевтически приемлемые соли. 16. Соединение по любому пп.13-15, где соединение представляет собой [3,5-бис(трифторметил)]N-(3-гуанидино-4-метилфенил)бензамид, или его фармацевтически приемлемая соль. 17. Способ получения фениламинопиридинилпиримидинов формулы I где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН 3, или их фармацевтически приемлемых солей, включающий конденсацию 4-метил-3-нитроанилина формулы (XI) где R имеет указанные выше значения, с трифторметилароилхлоридами формулы (XII) где X и n имеют указанные выше значения, в присутствии хлоруглеводорода в качестве растворителя и основания при температуре 30-40 С с образованием промежуточных нитротрифторметилароиламидов формулы (XIII) где X, n, R имеют указанные выше значения,восстановление полученных соединений формулы (XIII) с применением восстановителя металлкислота при температуре 0-5 С с образованием промежуточных аминотрифторметилароиламидов формулы (XIV) где R и n имеют указанные выше значения; конденсацию соединений формулы (XIV) с цианамидом (CNNH2) при температуре 60-95 С в полярном растворителе и в присутствии неорганической кислоты с образованием промежуточных солей гуанидинотрифторметилароиламидов формулы (XV) где R, X и n имеют указанные выше значения, и конденсацию соединений формулы (XV) с соединением формулы (XVI) в присутствии основания при температуре 30-40 С с образованием соединений формулы (I) и, необязательно, получение фармацевтически приемлемых солей соединений формулы I. 18. Способ по п.17, где в качестве основания в процессе конденсации соединения формулы (XV) с соединением (XVI) используют гидроксид калия или гидроксид натрия. 19. Способ по п.17 или 18, где хлоруглеводородный растворитель представляет собой хлороформ,хлористый метилен или хлористый этилен; основание в процессе преобразования соединения формулыXII в соединение формулы (XIII) представляет собой триэтиламин, дипропиламин или диизопропиламин. 20. Способ по любому из пп.17-19, где хлоруглеводородный растворитель представляет собой хлороформ и основание в процессе преобразования соединения формулы XII в соединение формулы (XIII) представляет собой триэтиламин. 21. Способ по любому из пп.17-20, где восстановитель металл-кислота представляет собой хлорид олова/конц. HCl, железо/конц. HCl, цинк/конц. HCl. 22. Способ по любому из пп.17-21, где восстановитель металл-кислота представляет собой хлорид олова/конц. HCl. 23. Способ по пп.17-22, где полярный растворитель выбирают из н-пропанола, изопропанола, этанола, н-бутанола или их смесей, температура в процессе конденсации соединения формулы XIV с цианамидом составляет 90-95 С. 24. Способ по любому из пп.17-23, где полярный растворитель представляет собой н-бутанол. 25. Способ получения соединений формулы (XIII) где X представляет собой СН или N, n=1 или 2, R представляет собой Н или СН 3, включающий конденсацию 4-метил-3-нитроанилина формулы (XI) где R имеет указанные выше значения, с трифторметилароилхлоридами формулы (XII) где X и n имеют указанные выше значения, в присутствии хлоруглеводородного растворителя и основания при температуре 30-40 С с образованием промежуточных нитротрифторметилароиламидов формулы (XIII). 26. Способ получения соединений формулы (XIV) где X представляет собой СН или N, n=1 или 2, R представляет собой Н или СН 3; или их фармацевтически приемлемой соли, включающий восстановление соединения формулы (XIII) где X, n и R имеют указанные выше значения; с использованием восстановителя металл-кислота при температуре 0-5 С с образованием аминотрифторметилароиламида формулы (XIV). 27. Способ получения соли гуанидинотрифторметилароиламидов формулы (XV) где X представляет собой СН или N, n=1 или 2, R представляет собой Н или СН 3, включающий конденсацию соединения формулы (XIV) где X, n, R имеют указанные выше значения; с цианамидом (CNNH2) при температуре 60-95 С в полярном растворителе и в присутствии неорганической кислоты с образованием промежуточных солей гуанидинотрифторметилароиламидов формулы (XV). 28. Способ по п.27, где полярный растворитель выбирают из н-пропанола, изопропанола, этанола,н-бутанола или их смесей и температура в процессе конденсации соединения формулы XIV с цианамидом составляет 90-95 С. 29. Способ по п.27 или 28, где полярный растворитель представляет собой н-бутанол. 30. Способ получения фениламинопиридинилпиримидина формулы I где X представляет собой СН или N, n=1 или 2 и R представляет собой СН 3, или его фармацевтически приемлемых солей, включающий получение N-(5-амино-2-метилфенил)-4-(3-пиридил)-2 пиримидинамина формулы (XVII) где X имеет указные выше значения, с получением соединения формулы (I). 31. Фармацевтическая композиция для лечения хронической миелоидной лейкемии, содержащая соединение формулы (I) где X представляет собой СН или N, n=1 или 2 и R представляет собой Н или СН 3, или его фармацевтически приемлемые соли и фармацевтически приемлемый носитель. 32. Фармацевтическая композиция по п.31, где фармацевтически приемлемый носитель пригоден для топического, энтерального или парентерального применения или представляет собой неорганические или органические, твердые или жидкие носители. 33. Фармацевтическая композиция по п.31, которая дополнительно содержит эксципиент или адъювант, разбавитель, связующее, ароматизатор, корригент (улучшитель вкуса и запаха) или фармацевтически приемлемый краситель. 34. Фармацевтическая композиция по п.33, где разбавитель представляет собой микрокристаллическую целлюлозу, микрочастицы целлюлозы, лактозу, крахмал, прежелатинизированный крахмал, карбонат кальция, сульфат кальция, сахар, декстраты, декстрин, декстрозу, дигидрат гидроортофосфата (двухосновного фосфата) кальция, ортофосфат (трехосновный фосфат) кальция, каолин, карбонат магния, оксид магния, мальтодекстрин, маннит, полиметакрилаты, хлорид калия, порошковую целлюлозу, хлорид натрия, сорбит или тальк. 35. Фармацевтическая композиция по п.33, где связующее представляет собой аравийскую камедь(гуммиарабик), альгиновую кислоту, карбомер, натрийкарбоксиметилцеллюлозу, декстрин, этилцеллюлозу, желатин, смолу гувара, гидрированное растительное масло, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, жидкую глюкозу, силикат магния и алюминия, мальтодекстрин, метилцеллюлозу, полиметакрилаты, повидон (например, коллидон, плаздон), прежелатинизированный крахмал, альгинат натрия и крахмал. 36. Фармацевтическая композиция по п.33, где ароматизатор или корригент (улучшитель вкуса и запаха) представляет собой мальтол, ванилин, этилванилин, ментол, лимонную кислоту, фумаровую кислоту, этилмальтол и винную кислоту.
МПК / Метки
МПК: A61P 35/02, C07D 401/14, C07D 401/04, C07D 213/82, C07C 233/66, A61K 31/506, C07C 233/80
Метки: производные, ингибиторы, фениламинопиримидина, bcr-abl
Код ссылки
<a href="https://eas.patents.su/23-13328-proizvodnye-fenilaminopirimidina-kak-ingibitory-bcr-abl.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фениламинопиримидина как ингибиторы bcr-abl</a>
Предыдущий патент: Способ приготовления очищенных конъюгатов лекарственных средств
Следующий патент: Косметически приемлемая композиция и способ обработки субстрата
Случайный патент: Способ извлечения металлов












