Производные тиенопиридона как ингибиторы киназ
Номер патента: 10297
Опубликовано: 29.08.2008
Авторы: Брукингс Дэниел Кристофер, Лэнгхэм Бэрри Джон, Дэвис Джереми Мартин
Формула / Реферат
1. Соединение формулы (1)
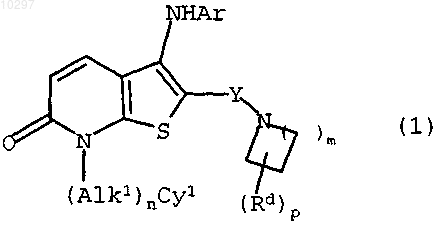
где Y представляет собой связывающую группу -С(О)- или -S(O)2-;
n является 0 или 1;
m является целым числом 1, 2, 3 или 4;
р является целым числом 1, 2, 3 или 4;
Rd представляет собой -ОН, -(Alk2)ОН (где Alk2 является прямой или разветвленной С1-4алкиленовой цепью), -OR1 (где R1 является прямой или разветвленной С1-6алкильной группой), -(Alk2)OR1, -NR2R3 (где R2 и R3 могут быть одинаковыми или различными и каждый независимо представляет собой атом водорода или прямую или разветвленную С1-6алкильную группу), -(Alk2)NR2R3 или прямую или разветвленную С1-6алкильную группу;
Alk1 представляет собой прямую или разветвленную С1-4алкиленовую цепь;
Су1 представляет собой необязательно замещенную С3-10циклоалкильную группу или С3-10циклоалкенильную группу, моноциклическую или бициклическую С6-12ароматическую группу или моноциклическую или бициклическую С1-9гетероароматическую группу, содержащую от 1 до 4 гетероатомов, выбранных из атомов кислорода, серы или азота, причем необязательные заместители Су1 циклоалкильных групп могут включать атомы галогена, особенно атомы фтора, хлора или брома или С1-6алкильные группы, в частности С1-3алкильные группы, самой предпочтительной является метильная группа, или галоС1-6алкильные группы, особенно фторС1-6алкильные группы, особенно предпочтительна -CF3 группа, или С1-6алкоксигруппы, особенно метокси, этокси, пропокси или изопропоксигруппа, или галоС1-6алкоксигруппы, особенно фторС1-6алкоксигруппа, самая предпочтительная -OCF3группа, или циано(-CN), этерифицированный карбоксил, нитро(-NO2), амино (-NH2),- NHCH3 или -N(CH3)2, -C(O)CH3, -NHCOCH3 группа, причем заместителями в Су1 ароматической или гетероароматической группах являются 1, 2 или 3 атома или группы, включающие атомы галогена, С1-6алкильные группы, галоС1-6алкильные группы, особенно фторС1-6алкильные группы, особенно предпочтительна -CF3 группа, или С1-6алкоксигруппы, особенно метокси, этокси, пропокси или изопропоксигруппа, или галоС1-6алкоксигруппы, особенно фторС1-6алкоксигруппы, самая предпочтительная -OCF3, или циано (-CN), карбоксил (-СО2Н), этерифицированный карбоксил -СО2СН3, или -СО2С(СН3)3, или -СО2С(СН3)3, нитро (-NO2), амино (-NH2), замещенный амино, особенно -NHCH3, или -N(CH3)2, -СОСН3, или -NHCOCH3 группа,
Ar представляет собой необязательно замещенную моноциклическую или бициклическую С6-12ароматическую группу или моноциклическую или бициклическую С1-9гетероароматическую группу, содержащую от 1 до 4 гетероатомов, выбранных из атомов кислорода, серы или азота, причем необязательные заместители в Ar ароматических или гетероароматических группах включают атомы или группы, включающие атомы галогена, в частности атомы фтора, хлора или брома, или С1-6алкильные группы, в частности С1-3алкильные группы, самой предпочтительной является метильная группа, или галоС1-6алкильные группы, особенно фторС1-6алкильные группы, особенно предпочтительна -CF3 группа, или С1-6алкоксигруппа, особенно метокси, этокси, пропокси или изопропоксигруппа, или галоС1-6алкоксигруппы, особенно фторС1-6алкоксигруппы, самая предпочтительная -OCF3 группа, или циано (-CN), этерифицированный карбоксил -СО2СН3 или -СО2С(СН3)3, нитро(-NO2), амино (-NH2), -NHCH3 или -N(CH3)2, -COCH3 или -NHCOCH3 группа,
а также его соли, сольваты, гидраты и N-оксиды.
2. Соединение по п.1, в котором Rd представляет собой -ОН, -(Alk2)OH, -(Alk2)OR1, -NR2R3 или -(Alk2)NR2R3, в которых Alk2, R1, R2 и R3 имеют значения, указанные в п.1.
3. Соединение по п.1 или 2, в котором Alk2 представляет собой -СН2- или -С(СН3)2-.
4. Соединение по любому из пп.1-3, где R1 является метилом.
5. Соединение по любому из пп.1-4, где R2 является водородом или метилом.
6. Соединение по любому из пп.1-5, где R3 является водородом или метилом.
7. Соединение по любому из пп.1-6, где Су1 представляет собой фенил, фторфенил, хлорфенил, метилфенил или циклопропил.
8. Соединение по любому из пп.1-7, где Ar представляет собой фенил, дифторфенил, (хлор)(фтор)фенил, (фтор)(метил)фенил, хлорфенил, цианофенил или метилфенил.
9. Соединение по п.1, выбранное из группы, включающей 3-[(2,4-дифторфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6-(7H)-он, 2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-3-[(3-метилфенил)амино]-7-фенилтиено[2,3-b]пиридин-6-(7H)-он, 3-[(3-хлорфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-(4-метилфенил)тиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-(4-метилфенил)тиено[2,3-b]пиридин-6(7H)-он, 2-{[(2R)-2(гидроксиметил)
пирролидин-1-ил]карбонил}-7-(4-метилфенил)-3-[(3-метилфенил)амино]тиено[2,3-b]пиридин-6-(7H)-он, 3-[(2,4-дифторфенил)амино]-7-(4-фторфенил)-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-7-(4-фторфенил)-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 7-(2-хлорфенил)-3-[(4-фтор-3-метилфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 7-(2-хлорфенил)-3-[(2,4-дифторфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 3-[(2-хлорфенил)амино]-2-{[(2R)-2(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено
[2,3-b]пиридин-6(7H)-он, 3-[(2-хлорфенил)амино]-2-{[(2S)-2-(гидроксиметил)пиролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-анилино-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-анилино-2-{[(2S)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридил-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(2S)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-анилино-2-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-анилино-2-{[(2R)-2-(метоксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 7-(4-хлорфенил)-3-[(4-фтор-3-метилфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(2S)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-(3-метилфенил)тиено[2,3-b]пиридин-6(7H)-он, 2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]-карбонил}-7-(3-метилфенил)-3-[(3-метилфенил)амино]тиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(2R)-2-(гидроксиметил)
пирролидин-1-ил]карбонил}-7-(3-метилфенил)тиено[2,3-b]пиридин-6(7H)-он, 3-[(3-хлор-4-фторфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-юэ, 3-[(3-хлор-4-фторфенил)амино]-2-{[(2S)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(2S)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3S,4S)-3,4-дигидроксипирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-[(3-гидроксиазетидин-1-ил)карбонил]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(2S)-2-(1-гидрокси-1-метилэтил)
пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(2R)-2-(1-гидрокси-1-метилэтил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2-цианофенил)амино]-2-{[(2S)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2-цианофенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]-пиридин-6(7H)-он, 3-анилино-7-(циклопропилметил)-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 3-[(3-цианофенил)амино]-2{[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(2R)-2-(гидроксиметил)пирролидин-1-ил]сульфонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-{[(3R)-3-аминопирролидин-1-ил]карбонил}-3-[(2,4-дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-{[2S)-2-(аминометил)пирролидин-1-ил]карбонил}-3-[(2,4-дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-{[(2R)-3-(аминометил)пирролидин-1-ил]карбонил}-3-[(2,4-дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3R)-3-(диметиламино)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-[(4-гидроксипиперидин-1-ил)-карбонил]-7-фенилтиено[2,3-b]пиридин-6-(7H)-он, rac-3-[(2,4-дифторфенил)амино]-2-[(3-гидроксипиперидин-1-ил)карбонил]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-{[(3R)-3-аминопирролидин-1-ил]карбонил}-3-[(4-фтор-3-метилфенил)амино]-7-фенилтиено[2,3-b]пиридин-6-(7H)-он, 2-{[(3R)-3-аминопирролидин-1-ил]карбонил}-3-[(4-фтор-3-метилфенил)амино]-7-фенилтиено[2,3-b]пиридин-6-(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(3R)-3-(диметиламино)пирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3R,4R)-3,4-дигидроксипиррорлидин-1-ил]карбонил}фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3R*,4S*)-3,4-дигидроксипирролидин-1-ил]
карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2-цианофенил)амино]-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2-цианофенил)амино]-2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, rac-2-{[3-аминопирролидин-1-ил]карбонил}-3-[(2,4-дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-{[(3S)-3-аминопирролидин-1-ил]карбонил}-3-[(2,4-дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-{[(3S)-3-аминопирролидин-1-ил]карбонил}-3-[(4-фтор-3-метилфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-7-(4-фторфенил)-2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-7-(4-фторфенил)-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-7-(4-фторфенил)-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 7-(2-хлорфенил)-3-[(4-фтор-3-метилфенил)
амино]-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он, 7-(2-хлорфенил)-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-3-[(3-метилфенил)амино]тиено[2,3-b]пиридин-6(7H)-он, 7-(2-хлорфенил)-3-[(2,4-дифторфенил)амино]-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}тиено[2,3-b]
пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-7-(4-метилфенил)тиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(3S)-3-гидроксипирролидин-1-ил]карбонил}-7-(4-метилфенил)тиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-7-(4-метилфенил)тиено[2,3-b]-пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-7-(4-метилфенил)тиено[2,3-b]пиридин-6(7H)-он, 3-[(4-фтор-3-метилфенил)амино]-2-[(3-гидроксиазетидин-1-ил)карбонил]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-[(4-аминопиперидин-1-ил)карбонил]-3-[(2,4-дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-[(3-аминоазетидин-1-ил)карбонил]-3-[(2,4-дифторфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[4-(диметиламино)пиперидин-1-ил]карбонил}-7-фенилтиено[2,3-b]
пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[3-(диметиламино)азетидин-1-ил]карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 3-[(2,4-дифторфенил)амино]-2-{[(3S)-3-(диметиламино)пирролидин-1-ил]
карбонил}-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 2-{[(3S)-3-(диметиламино)пирролидин-1-ил]карбонил}-3-[(4-фтор-3-метилфенил)амино]-7-фенилтиено[2,3-b]пиридин-6(7H)-он, 7-(2-хлорфенил)-3-[(2,4-дифторфенил)амино]-2-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}тиено[2,3-b]пиридин-6(7H)-он.
10. Фармацевтическая композиция, включающая соединение по п.1 или его фармацевтически приемлемые соль, сольват, гидрат или N-оксид в сочетании с фармацевтически пригодным носителем.
11. Применение соединения формулы (1) по в п.1 или его фармацевтически приемлемой соли, сольвата, гидрата или N-оксида для изготовления лекарственного средства для лечения и/или профилактики расстройства, при котором показан ингибитор р38 MAP киназы.
12. Способ лечения и/или профилактики расстройства, при котором показан ингибитор р38 MAP киназы, включающий введение пациенту, нуждающемуся в таком лечении, соединения формулы (1) по п.1 или его фармацевтически приемлемой соли, сольвата, гидрата или N-оксида.
Текст
010297 Данное изобретение относится к ряду производных тиенопиридона, содержащим их композициям,способам их получения и применению их в медицине. Иммуноспецифичные реакции и воспалительные процессы требуют участия целого ряда различных типов клеток при контроле и координации разного рода взаимодействий, проявляющихся как в виде непосредственных межклеточных контактов (например, взаимодействие интегринов с их рецепторами), так и за счет молекул, передающих сигналы от клетки к клетке. В этом случае задействовано множество различных передающих сигнал веществ, включая цитокины, лимфоциты, хемокины и факторы роста. Клетки реагируют на эти вещества, передающие сигналы клеткам, с помощью внутриклеточных механизмов передачи сигнала, например с помощью протеинкиназ, фосфатаз и фосфолипаз. Известны пять классов протеинкиназ, причем наиболее важным являются тирозинкиназы и серин/треонинкиназы(Hunter Т., Methods in Enzymology (Protein Kinase Classification), p.3, Hunter T. and Sefton B.M. eds., vol. 200,Academic Press, San Diego, 1991). Один подкласс серин/треонинкиназ представляет митоген-активирующие протеин (МАР)-киназы, который делится по крайней мере на три семейства с различными последовательностями и различной величиной активного центра (Adams J.L. et al., Progress in Medical Chemistry, pp. 1-60, King F.D. and Oxford A.W.eds., vol. 38, Elsevier Science, 2001: (i) внеклеточные регулируемые киназы (EPKs); (ii) с-Jun NH2-терминальные киназы или стресс-активируемые киназы (JNKs или SAP киназы); и (iii) р 38-киназы, которые имеют треонин-глицин-тирозиновый (TGY) активационный мотив. JNKs и р 38 МАР киназы первично активируются стрессовыми стимулами, но не только предшествующими воспалению цитокинами, например фактором некроза опухоли (TNF) и интерлейкином-1 (IL-1), ультрафиолетовым светом, эндотоксином и химическим или осмотическим шоком. Описаны четыре изоформы р 38 (р 38////). р 38 энзим человека вначале был идентифицирован как мишень цитокин-супрессивных противовоспалительных лекарств (CSAIDs), и два обнаруженных изоэнзима были первоначально названы CSAID связывающий протеин-1 (CSBP-1) и CSBP-2 (Lee J.C. etal., Nature (London), 1994, 372, 739-46). CSBP-2 в настоящее время принято называть р 38, и он отличается от CSBP-1 внутренней последовательностью из 25 аминокислот, являющейся результатом дифференциального сплайсинга двух экзонов, которые сохраняются и у мыши, и у человека (McDonnell P.C. etal., Genomics, 1995, 29, 301-2). CSBP-1 и р 38 экспрессируются повсеместно, и между этими двумя изоформами нет различий ни в отношении распределения в ткани, ни по профилю активности, субстратной специфичности или CSAID связыванию. Вторая изоформа - это р 38, которая на 70% идентична р 38. Вторая форма р 38, названная р 382, также известна, и полагают, что она является наиболее значимой формой из двух форм. р 38 и р 382 экспрессируются в самых различных тканях. Однако в моноцитах и макрофагах р 38 является доминирующей активной киназой (Lee J.C., ibid; Jing Y. et al., J. Biol. Chem.,1996, 271, 10531-34; Hale K.K. et al., J. Immunol., 1999, 162, 4246-52). p38 и р 38 (именуемые также SAPкиназа-3 и SAP-киназа-4 (соответственно) имеют 63% и 61% гомологии по сравнению с р 38, соответственно. р 38 в большей степени экспрессируется в скелетной мышце, тогда как р 38 обнаружена в яичках,поджелудочной железе, предстательной железе, тонкой кишке и в некоторых тканях эндокринной системы. Все гомологи и сплайс-варианты р 38 содержат активный центр из 12 аминокислот, который включает Thr-Gly-Tyr мотив. Двойное (совместное) фосфорилирование Thr-180 и Tyr-182 в TGY мотиве при двойственной специфичности в верхней части последовательности киназы необходимо для активирования р 38 и приводит к более чем 1000-кратному повышению специфической активности этих ферментов(Doza Y.N. et al., FEBS Letters, 1995, 364, 7095-8012). Это двойное фосфорилирование осуществляется с помощью MKK6 и при определенных условиях родственным энзимом MKK3 (Enslen H., et al., J. Biol.Chem., 1998, 273, 1741-48). MKK3 и MKK6 относятся к семейству энзимов, называемых MAPKK (киназа митоген-активирующей протеинкиназы), которые, в свою очередь, активируются MAPKKK (киназа киназы митоген-активирующей киназы), которые известны также как MAP3K. Некоторые MAP3K идентифицированы по их способности активироваться самыми различными стимулами, включая стресс окружающей среды, воспалительные цитокины и другие факторы.MEKK4/MTK1 (киназа MAP или ERK киназы/МАР три киназы-1), ASK1 (киназа, стимулируемая апоптозом) и TAK1 (TGFактивируемая киназа) представляют собой некоторые из энзимов, известных как активаторы в верхней части последовательности MAPKK. Считают, что MEKK4/MTK1 активируются несколькими GADD-45-подобными генами, которые индуцируются в ответ на раздражители внешней среды и которые, в конечном итоге, приводят к активации p38 (Takekawa M. and Saito H., Cell, 1998, 95,521-30). Показано, что TAK1 активирует MKK6 в ответ на трансформирование -фактора роста (TGF-). Полагают, что в TNF-стимулируемой активации р 38 задействованы TRAF2 (TNF-рецептор-ассоциируемый фактор) и Fas-адапторный протеин, Daxx, что приводит к активации ASK1 и затем р 38. Некоторые субстраты р 38 уже идентифицированы, в том числе и другие киназы (например, MAPKактивируемая протеинкиназа 2/3/5 (MAPKAP 2/3/5), р 38 регулируемая/активируемая протеинкиназа(PRAK), MAP киназа-взаимодействующая киназа 1/2 (MNK1/2), митоген- и стресс/активируемая протеинкиназа 1 (MSK1/RLPK) и рибосомальная S6 киназа-В (RSK-B; транскрипционные факторы (например, активирующий транскрипцию фактор 2/6 (ATF2/6), моноцит-энхансерный фактор 2 А/С (MEF2A/C),-1 010297 С/ЕВР гомологичный протеин (CHOP), Elk1 и Sap-1a1) и другие субстраты (например, cPLA2, p47phox).MAPKAP активируется р 38 в ответ на стимулы из внешней среды. Мыши, полученные способом,обусловившим утрату MAPKAP K2, не продуцируют TNF в ответ на стимуляцию липополисахаридом(LPS). Продуцирование некоторых других цитокинов, таких как IL-1, IL-6, IFN-g и IL-10, также частично ингибировано (Kotlyarov A., et al., Nature, Cell Biol., 1999, 1, 94-7). Кроме того, MAPKAP K2 из эмбриональных стволовых клеток лишенных р 38 мышей не активировалась в ответ на стресс, и эти клетки не продуцировали IL-6 в ответ на IL-1 (Allen M. et al., J. Exp. Med., 2000, 191, 859-69). Эти результаты показывают, что MAPKAP K2 не только существенна для продуцирования TNF и IL-1, но и для передачи сигнала, индуцированного цитокинами. Кроме того, MAPKAP K2/3 фосфорилирована и, следовательно,контролирует белки теплового шока HSP 25 и HSP 27, которые участвуют в цитоскелетной перестройке. Сообщалось о некоторых низкомолекулярных ингибиторах р 38, которые ингибируют синтез IL-1 иTNF в моноцитах человека при концентрациях низкого М уровня (Lee J.C. et al., Int. J. Immunopharm., 1988,10, 835) и проявляют активность на животных моделях, не восприимчивых к циклооксигеназным ингибиторам (Lee J.C. et al., Annals N.Y. Acad. Sci. 1993, 696, 149). Кроме того, известно, что эти низкомолекулярные ингибиторы снижают синтез большого числа протеинов, имеющих отношение к процессу воспаления, в том числе IL-6, IL-8, гранулоцит/макрофаг колониестимулирующий фактор (GM-CSF) и циклооксигеназа-2(СОХ-2). TNF-индуцируемое фосфорилирование и активирование цитозольной PLA2, TNF-индуцируемая экспрессия VCAM-1 в эндотелиальных клетках и IL-стимулируемый синтез коллагеназы и стромелизина также ингибируются низкомолекулярными ингибиторами р 38 (Cohen P., Trends Cell Biol., 1997, 7, 353-61). Ряд клеток, включая моноциты и макрофаги, продуцируют TNF и IL-1. Избыточное или нерегулируемое продуцирование TNF связано с целым рядом заболеваний, включая болезнь Крона, язвенный колит,лихорадку, ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артритные состояния, синдром токсического шока, эндотоксический шок, сепсис, септический шок, сепсис,вызванный грамотрицательными бактериями, заболевания, связанные с рассасыванием костей, реперфузионные раны, реакция "трансплантат против хозяина", отторжение аллотрансплантата, респираторный дистресс-синдром взрослых, хроническое легочное воспалительное заболевание, силикоз, саркоидоз легкого, церебральная малярия, образование тканевых рубцов (шрамов), образование келоидных рубцов,жар и миальгия вследствие инфекции, например гриппа, кахексия вследствие синдрома приобретенного иммунодефицита (AIDS), кахексия вследствие инфекции или злокачественной опухоли, СПИД (AIDS) или сопутствующий ему комплекс состояний или заболеваний. Чрезмерное или нерегулируемое продуцирование IL-1 связано с ревматоидным артритом, остеоартритом, травматическим артритом, артритом вследствие краснухи, острым синовитом, псориазным артритом, кахексией, синдромом Рейтера, эндотоксемией, синдромом токсического шока, туберкулезом, атеросклерозом, мышечной дистрофией и другими острыми или хроническими воспалительными заболеваниями, например воспалительной реакцией, вызванной эндотоксином, или воспалительным кишечным заболеванием. Кроме того, IL-1 связан с диабетом и деструкцией -клеток поджелудочной железы (Dinarello С.A., J. Clinical Immunology, 1985, 5, 287-97).IL-8 является хемотактическим фактором, продуцируемым различными типами клеток, включающими эндотелиальные клетки, мононуклеарные клетки, фибробласты и кератиноциты. IL-1, TNE и LPS индуцируют продуцирование IL-8 эндотелиальными клетками. In vitro показано, что IL-8 обладают рядом качеств, например хемоаттрактивным для нейтрофилов, Т-лимфоцитов и базофилов. Показано также, что IL-8 повышает поверхностную экспрессию Мас-1 (CD11b/CD18) нейтрофилами без de novo синтеза белков, которая может способствовать повышению адгезии нейтрофилов на васкулярные эндотелиальные клетки. Для многих заболеваний характерна сплошная инфильтрация нейтрофилов. Высвобождение гистамина из базофилов (и у атопических, и у нормальных индивидуумов) индуцируется IL-8, так же, как и выделение лизосомальных ферментов и дыхательный скачок нейтрофилов. Главная общая роль IL-1 и TNF по сравнению с другими полученными из лейкоцитов цитокинами как жизненно важных медиаторов воспаления хорошо описана. Показано или следует ожидать, что ингибирование этих цитокинов создает благоприятные возможности для контроля, облегчения или снижения интенсивности многих из перечисленных болезненных состояний. Главная роль, которую р 38 играет в каскаде передающих сигнал веществ, превращающих внеклеточный сигнал во внутриклеточный, и ее влияние не только на выработку IL-1, TNF и IL-8, но также и на синтез и/или действие других провоспалительных белков (например, IL-6, GM-CSF, СОХ-2, коллагеназу и стромелизин) делают ее привлекательной мишенью для ингибирования низкомолекулярными ингибиторами при ожидании, что такое ингибирование окажется высокоэффективным механизмом регулирования чрезмерного и деструктивного активирования иммунной системы. Такие ожидания подкреплены сообщениями, описывающими мощные и разнообразные противовоспалительные активности ингибиторов р 38 киназы (Adams, ibid; Badger et al., J. Pharm. Exp. Ther., 1996, 279, 1453-61; Griswold et al., Pharmacol.Comm., 1996, 7, 323-29). В настоящее время авторами обнаружена группа соединений, которые являются эффективными и селективными ингибиторами р 38 киназы (р 38, ,и ), а также их изоформ и сплайс-вариантов, в частности р 38, р 38 и р 382. Эти соединения предназначены для использования в медицине, например для-2 010297 профилактики или лечения иммунных или воспалительных заболеваний, которые описаны выше. Таким образом, согласно одному аспекту изобретения заявляется соединение формулы (1) где Y представляет собой связывающую группу -С(О)- или -S(O)2-;n является 0 или целым числом 1;m является целым числом 1, 2, 3 или 4; р является целым числом 1, 2, 3 или 4;Rd представляет собой -ОН, -(Alk2)ОН (где Alk2 является прямой или разветвленной С 1-4 алкиленовой цепью), -OR1 (где R1 является прямой или разветвленной С 1-6 алкильной группой), -(Alk2)OR1, -NR2R3(где R2 и R3 могут быть одинаковыми или различными и каждый независимо представляет собой атом водорода или прямую или разветвленную С 1-6 алкильную группу), -(Alk2)NR2R3 или прямую или разветвленную С 1-6 алкильную группу;Alk1 представляет собой прямую или разветвленную С 1-4 алкиленовую цепь; Су 1 представляет собой необязательно замещенную циклоалифатическую, ароматическую или гетероароматическую группу иAr представляет собой необязательно замещенную ароматическую или гетероароматическую группу,а также его соли, сольваты, гидраты и N-оксиды. Следует отметить, что соединения формулы (1) могут иметь один или несколько хиральных центров и существовать в виде энантиомеров или диастереомеров. Следует понимать, что изобретение распространяется на все такие энантиомеры, диастереомеры и их смеси в любой пропорции, включая рацематы. Формула (1) и нижеследующие формулы представляют все индивидуальные изомеры и их смеси, если не указано и не представлено иное. Кроме этого, соединения формулы (1) могут существовать в виде таутомеров, например кето (СН 2 С=О)-енол (СН=СНОН) таутомеров. Формула (1) и нижеследующие формулы предназначены для того, чтобы показать индивидуальные таутомеры и их смеси, если не оговорено иное. Следующие основные термины, которые используются здесь в отношении соединений данного изобретения, а также промежуточных соединений, имеют специально указанные нижеприведенные значения, если иное особо не оговорено. Таким образом, в используемом здесь смысле термин "алкил", независимо от того, присутствует ли он как группа или как часть группы, подразумевает С 1-6 алкильные группы с неразветвленной или разветвленной цепочкой, например С 1-4 алкильные группы, такие как метил, этил, н-пропил, изопропил, нбутил, вт.-бутил, изобутил или трет-бутил. Аналогично, подразумевается, что термин "алкенил" или "алкинил" означают С 2-6 алкенильные или С 2-6 алкинильные группы с неразветвленной или разветвленной цепью, такие как С 2-4 алкенильные или С 2-4 алкинильные группы. Необязательные заместители, которые могут содержаться в этих группах, включают 1, 2, 3 или более заместителей, причем каждый заместитель может быть одним и тем же или отличающимся и выбранным из атомов галогена, например фтора, хлора, брома или иода, или -ОН, -СО 2 Н, -CO2R4 (где R4 - необязательно замещенная С 1-6 алкильная группа с прямой или разветвленной цепью и представляет собой, в частности, прямую или разветвленную С 1-4 алкильную группу), например -СО 2 СН 3 или -СО 2 С(СН 3)3, -CONHR4, например -CONHCH3, -CON(R4)2, например -CON(CH3)2, -COR4, например -СОСН 3, С 1-6 алкокси, например метокси или этокси, галоС 1-6 алкокси, например трифторметокси или дифторметокси, тиол (-SH), -S(O)R4, например -S(O)CH3, -S(O)2R4,например -S(O)2CH3, С 1-6 алкилтио, например метилтио или этилтио, амино, -NHR4, например -NHCH3 или -N(R4)2, например -N(CH3)2. Если в любом из вышеуказанных заместителей присутствуют две R4 группы, они могут быть одинаковыми или различными. Помимо того, что две R4-алкильные группы присутствуют в любом из необязательных заместителей при описании, каким образом эти группы могут быть присоединены, они вместе с атомом N, с которым они соединены, могут образовывать гетероциклическое кольцо. Такие гетероциклические кольца могут необязательно включать и другой гетероатом или гетероатомсодержащую группу, выбранные из -О-, -S-,-N(R4)-, -C(O)- или -C(S)-групп. Конкретные примеры таких гетероциклических колец включают пиперидинил, пиразолидинил, морфолинил, тиоморфолинил, пирролединил, имидазолидинил и пиперазинил. Термин "галоген" включает атомы фтора, хлора, брома или иода. Термин "галоалкил" означает те же алкильные группы, указанные выше, замещенные 1, 2 или 3 атомами галогена, которые указаны выше. Конкретные примеры таких групп включают -CF3, -CCl3, -CHF2,-CHCl2, -CH2F и -CH2Cl. Термин "алкокси" в используемом здесь значении означает прямой или разветвленный С 1-6 алкокси,например С 1-4 алкокси, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, вт.-бутокси, изобутокси и трет-бутокси. "Галоалкокси" в используемом здесь смысле включает любую из этих алкокси-3 010297 групп, замещенную 1, 2 или 3 атомами галогена, как описано выше. Конкретные примеры включают-OCF3, -OCCl3, -OCHF2, -OCHCl2, -OCH2F и -OCH2Cl группы. В используемом здесь смысле термин "алкилтио" подразумевает прямой или разветвленный С 1-6 алкилтио, например С 1-4 алкилтио, такой как метилтио или этилтио. Термин "алкиламино" или "диалкиламино" означает здесь группы -NHRla и -N(Rla)(Rlb), где Rla и Rlb каждый независимо необязательно замещенная алкильная группа с прямой или разветвленной цепью или оба вместе с N атомом, с которым они связаны, образуют необязательно замещенную гетероциклоалкильную группу, которая может содержать другой гетероатом или гетероатомсодержащую группу, такие как -О- или -S- атом или -N(Rla)-группу. Конкретные примеры таких необязательно замещенных гетероциклоалкильных групп включают необязательно замещенные пирролидинил, пиперидинил, морфолинил,тиоморфолинил и N-С 1-6 алкилпиперазинильные группы. Необязательные заместители, которые могут присутствовать в таких гетероциклоалкильных группах, включают те необязательные заместители, что определены выше в отношении термина "алкил". Конкретные примеры алкиленовых цепей, обозначенные как Alk1 и/или Alk2, при присутствии каждого из них в заявленных соединениях, включают -СН 2-, -СН 2 СН 2-, -СН(СН 3)СН 2-, -(СН 2)2 СН 2-, -С(СН 3)2-,-(СН 2)3 СН 2-, -СН 2 СН(СН 3)СН 2-, -С(СН 3)2 СН 2- или -CH(CH3)CH2CH2-цепи. Необязательно замещенные циклоалифатические группы, обозначенные как группа Су 1 в соединениях по данному изобретению, включают необязательно замещенные С 3-10 циклоалифатические группы. Конкретные примеры включают необязательно замещенные С 3-10 циклоалкильную, например С 3-7 циклоалкильную, или С 3-10 циклоалкенильную, например С 3-7 циклоалкенильную, группы. Конкретные примеры циклоалифатических групп, обозначенных как Су 1 группа, включают необязательно замещенные циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, 2-циклобутен 1-ил, 2-циклопентен-1-ил и 3-циклопентен-1-ил, особенно циклопропил. Необязательные заместители, которые могут присутствовать в циклоалифатических группах, обозначенных как Су 1, включают 1, 2, 3 или более заместителей, выбранных из атомов галогена или С 1-6 алкила, например метил или этил, гало-С 1-6 алкила, например галометил или галоэтил, такой как дифторметил или трифторметил, необязательно замещенный гидроксилом, например -C(OH)(CF3)2, С 1-6 алкокси,например метокси или этокси, галоС 1-6 алкокси, например галометокси или галоэтокси, такой как дифторметокси или трифторметокси, тиол, C1-6 алкилтиол, например метилтиол или этилтиол, карбонил (=O),тиокарбонил (=S), имино (=NR4a) (где R4a является -ОН группой или С 1-6 алкильной группой) или -(Alk3)vR5 группы, в которых Alk3 представляет собой прямую или разветвленную С 1-3 алкиленовую цепь, v является 0 или 1, a R5 - циклоалкил, -ОН, -SH, -N(R6)(R7) (где R6 и R7 - каждый независимо выбран из атома водорода или необязательно замещенных алкила или С 3-8 циклоалкила), -OR6, -SR6, -CN, -NO2, -CO2R6, -SOR6, -SO2R6,-SO3R6, -OCO2R6, -C(O)R6, -OC(O)R6, -C(S)R6, -C(O)N(R6)(R7), -OC(O)N(R6)(R7), -N(R6)C(O)R7, -C(S)N(R6)(R7),-N(R6)C(S)R7, -SO2N(R6)(R7), -N(R6)SO2R7, -N(R6)C(O)N(R7)(R8) (где R8 имеет те же значения, что и R6),-N(R6)C(S)N(R7)(R8), -N(R6)SO2N(R7)(R8) или необязательно замещенные ароматическая или гетероароматическая группа. Конкретные примеры Alk3 цепей включают -СН 2-, -СН 2 СН 2-, -СН 2 СН 2 СН 2- и -СН(СН 3)СН 2-цепи. Когда R5, R6, R7 и/или R8 присутствуют как С 3-8 циклоалкильная группа, они могут представлять собой циклопропил, циклобутил, циклопентил или циклогексил. Необязательные заместители, которые могут присутствовать в таких группах, включают, например, 1, 2 или 3 заместителя, которые могут быть одинаковыми или разными и выбранными из атомов галогена, например фтора, хлора, брома или иода,или гидрокси или С 1-6 алкокси, например метокси, этокси или изопропоксигрупп. Когда группы R6 и R7 или R7 и R8, обе являются алкильными, эти группы могут при объединении сN атомами, к которому они присоединены, образовывать гетероциклическое кольцо. Такие гетероциклические кольца могут необязательно включать и другой гетероатом или гетероатомсодержащую группу,выбранную из -O-, -S-, -N(R7)-, -C(O)- или -C(S)-группы. Конкретные примеры таких гетероциклических колец включают пиперидинил, пиразолидинил, морфолинил, тиоморфолинил, пирролидинил, имидазолидинил и пиперазинил. Если R5 является необязательно замещенной ароматической или гетероароматической группой, она может быть такой же группой, что определены выше для Су 1. В общем, необязательно замещенные ароматические группы, соответствующие Су 1, включают, например, моноциклические или бициклические слитые в кольцо С 6-12 ароматические группы, такие как фенил, 1 или 2-нафтил, 1- или 2-тетрагидронафтил, инданильные или инденильные группы, предпочтительно фенил. Гетероароматические группы, соответствующие Су 1, включают, например, С 1-9 гетероароматические группы, содержащие, например, 1, 2, 3 или 4 гетероатома, выбранные из атомов кислорода, серы или азота. В общем, гетероароматические группы могут быть, например, слитыми в моноциклические или бициклические структуры группами. Моноциклические гетероароматические группы включают, например,5- или 6-членные гетероароматические группы, содержащие 1, 2, 3 или 4 гетероатома, выбранных из атомов кислорода, серы или азота. Бициклические гетероароматические группы включают например, 813-членные гетероароматические группы, образующие слитые кольца, содержащие 1, 2 или более гетероатомов, выбранных из атомов кислорода, серы или азота.-4 010297 Конкретные примеры гетероароматических групп этих типов включают пирролил, фурил, тиенил,имидазолил, N-С 1-6 алкилимидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3 триазолил, 1,2,4-триазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-тиадиазолил, пиридил, пиримидинил, пиридазинил, пиразинил, 1,3,5-триазинил, 1,2,4-триазинил, 1,2,3-триазинил,бензофурил, (2,3-дигидро)бензофурил, бензотиенил, (2,3-дигидро)бензотиенил, бензотриазолил, индолил, индолинил, индазолинил, бензимидазолил, имидазо(1,2-а)пиридил, бензотиазолил, бензоксазолил,бензизоксазолил, бензопиранил, (3,4-дигидро)бензопиранил, хиназолинил, хиноксалинил, нафтиридинил, имидазо(1,5-а)пиридинил, имидазо(1,5-а)пиразинил, имидазо(1,5-с)пиримидинил, пиридо(3,4-b)пиридил, пиридо(3,2-b)пиридил, пиридо(4,3-b)пиридил, хинолинил, изохинолинил, фталазинил, тетразолил,5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолинил, имидил, например сукцинимидил, фталимидил или нафталимидил, такой как 1,8-нафталимидил; пиразо(4,3-d)пиримидинил, фуро(3,2-d)пиримидинил, тиено(3,2-d)пиримидинил, пирроло(3,2-d)пиримидинил, пиразоло(3,2-b)пиридинил, фуро(3,2-b)пиридинил, тиено(3,2-b)пиридинил, пирроло(3,2-b)пиридинил, тиазоло(3,2-а)пиридинил, пиридо(1,2-а)пиримидинил, тетрагидроимидазо(1,2-а)пиримидинил и дигидроимидазо(1,2-а)пиримидинил. Необязательные заместители, которые могут присутствовать в ароматических или гетероароматических группах, обозначенных как Су 1, включают 1, 2, 3 или более заместителей, каждый из которых выбран из атома или группы R10, где R10 представляет собой R10a или -L6Alk5(R10a)r, где R10a - атом галогена или амино (-NH2), замещенная амино, нитро, циано, гидроксил (-ОН), замещенный гидроксил, формил, карбоксил (-СО 2 Н), этерифицированный карбоксил, тиол (-SH), замещенный тиол, -COR11 (где R11 представляет собой -L6Alk3(R10a)r, арил или гетероарил), -CSR11, -SO3H, -SOR11, -SO2R11, -SO3R11, -SO2NH2,-SO2NHR11, -SO2N(R11)2, -CONH2, -CSNH2, -CONHR11, -CSNHR11, -CON(R11)2, -CSN(R11)2, -N(R12)SO2R11(где R12 - атом водорода или алкил с прямой или разветвленной цепью), -N(SO2R11)2, -N(R12)SO2NH2,-N(R12)SO2NHR11, -N(R12)SO2N(R11)2, -N(R12)COR11, -N(R12)CONH2, -N(R12)CONHR11, -N(R12)CON(R11)2,-N(R12)CSNH2, -N(R12)CSNHR11, -N(R12)CSN(R11)2, -N(R12)CSR11, -N(R12)C(O)OR11, -C=NR12(NR12), -SO2NHet1(где -NHet1 - необязательно замещенная С 3-7 циклоаминогруппа, необязательно содержащая 1 или несколько -О- или -S- атомов или -N(R12)-, -С(О)-или -C(S)- группы), -CONHet1, -CSNHet1, -N(R12)SO2NHet1,-N(R12)CONHet1, -N(R12)CSNHet1, -SO2N(R12)Het (где -Het - необязательно замещенная моноциклическая С 3-7 карбоциклическая группа, необязательно замещенная 1 или несколькими -О- или -S- атомами или-N(R12)-, -C(O)-, -S(O)- или -S(O)2- группами), -Het, -CON(R12)Het, -CSN(R12)Het, -N(R12)CON(R12)Het,-N(R12)CSN(R12)Het, -N(R12)SO2N(R12)Het, арил или гетероарил; L6 представляет собой ковалентную связь или соединяющий атом или группу; Alk5 представляет собой необязательно замешенный прямой или разветвленный С 1-6 алкилен, С 2-6 алкенилен или С 2-6 алкинилен с необязательными вставками 1, 2 или 3 -О- или -S- атомов или -S(O)k- (где k - целое число 1 или 2) или -N(R12)-, например -N(СН 3)-группы; а r является 0 или целым числом 1, 2 или 3. Понятно, что, когда две R11 и R12 группы содержатся в одном из перечисленных заместителей, R11 и R12 группы могут быть одинаковыми или различными. Когда L6 в группе -L6Alk5(R10a)r является соединяющим атомом или группой, они могут быть любой двухвалентной соединяющей группой или двухвалентным атомом. Конкретные примеры включают -О- или -Sатом или -С(О)-, -С(О)О-, -ОС(О)-, -C(S)-, -S(O)-, -S(O)2-, -N(R3)- (где R3 является атомом водорода или алкилом с прямой или разветвленной цепью), -N(R3)O-, -N(R3)N-, -CON(R3)-, -OC(O)N(R3)-, -CSN(R3)-, -N(R3)CO-,-N(R3)C(O)O-, -N(R3)CS-, -S(O)2N(R3)-, N(R3)S(O)2-, -N(R3)CON(R3)-, -N(R3)CSN(R3)- или -N(R3)SO2N(R3)группы. Если L6 содержит две R3 группы, они могут быть одинаковыми или различными. Когда в группе -L6Alk5(R10a)r r является целым числом 1, 2 или 3, должно быть понятно, что заместитель или заместители R10a могут присутствовать при любом подходящем атоме углерода в -Alk5. Если заместителей R10a несколько, они могут быть одинаковыми и различными и могут содержаться у одного и того же или нескольких атомов в -Alk5. Понятно, что, если r равно 0 и заместителя R10a нет,алкиленовая, алкениленовая или алкиниленовая цепь, обозначенная как Alk5, превращается в алкильную,алкенильную или алкинильную группу. Если R10a представляет собой замещенную аминогруппу, она может быть, например, группой -NHR11(где R11 определена выше) или группой -N(R11)2, где каждая группа R11 является одной и той же группой или различными группами. Если R10a - атом галогена, она может быть атомом фтора, хлора, брома или иода. Если R10a является замещенной гидроксильной или замещенной тиольной группой, она может быть, например, группой - OR11 или -SR12, соответственно. Этерифицированные карбоксильные группы, обозначенные как R10a, включают группы формулы-CO2Alk6, где Alk6 представляет собой необязательно замещенный С 1-8 алкил с прямой или разветвленной цепью, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, вт.-бутил или трет-бутил; С 6-12 арилС 1-8 алкил, например необязательно замещенный бензил, фенилэтил, фенилпропил, 1-нафтилметил или 2-нафтилметил; С 6-10 арильную группу, например необязательно замещенный фенил, 1-нафтил или 2 нафтил; С 6-12 арилоксиС 1-8 алкил, например необязательно замещенный фенилоксиметил, фенилоксиэтил,1-нафтилоксиметил или 2-нафтилоксиметил; необязательно замещенный С 1-8 алканоилоксиС 1-8 алкил, например пивалоилоксиметил, пропионилоксиэтил или пропионилоксипропил; или С 6-12 ароилоксиС 1-8 алкил, например необязательно замещенный бензоилоксиэтил или бензоилоксипропил. Необязательные-5 010297 заместители, присутствующие в Alk6 группе, включают R10a атомы и группы, указанные выше. Если Alk5 присутствует в заместителе или как заместитель, он может быть, например, -СН 2-, -СН(СН 3)-,-С(СН 3)2, -СН 2 СН 2-, -СН 2 СН 2 СН 2-, -СН(СН 3)СН 2)-, -СН 2 СН 2 СН 2 СН 2-, -СН 2 СН(СН 3)СН 2-, -СН(СН 3)СН 2 СН 2-,-С(СН 3)2 СН 2-, -СН=СН-, -СН=СНСН 2-, -СН 2 СН=СН-, -СН=СНСН 2 СН 2-, -СН 2 СН=СНСН 2-, -СН 2 СН 2 СН=СН-,-CС-, -CCCH2-, -СН 2 СС-, -СССН 2 СН 2-, -СН 2 СССН 2- или -СН 2-СН 2 СС- цепью, с необязательными вставками 1, 2 или 3 -О- или -S- атомов или -S(O)-, -S(O)2- или -N(R12)-, например -N(СН 3)- групп. Алифатические цепочки, обозначенные Alk5, могут быть необязательно замещены 1, 2 или 3 атомами галогена помимо любых R10 групп, которые могут присутствовать. Арильные или гетероарильные группы, обозначенные как R10a или R11, включают моно- или бициклические необязательно замещенные С 6-12 ароматические или С 1-9 гетероароматические группы, которые описаны выше для Cy1. Эти ароматические или гетероароматические группы могут быть присоединены к группе Cy1 в соединениях формулы (1) по атому углерода или гетероатому, например атому азота, в соответствии с необходимостью. Подразумевается, что, когда -NHet1 или -Het образует часть заместителя R10, гетероатомы или группы, содержащие гетероатомы, которые могут присутствовать в кольце -NHet1 или -Het, занимают место атомов углерода в исходном (родительском) карбоциклическом кольце. Таким образом, когда -NHet1 или -Het образует часть заместителя R10, каждый из них может быть,например, необязательно замещенным пирролидинилом, имидазолидинилом, пиразолидинилом, пиперазинилом, морфолинилом, тиоморфолинилом, пиперидинилом или тиазолидинилом. Кроме того, Het может представлять собой, например, необязательно замещенный циклопентил или циклогексил. Необязательные заместители, которые могут содержаться в -NHet1, включают описанные выше для случая, когдаCy1 является гетероциклоалифатической группой. В частности, в число приемлемых представителей атомов и групп, обозначаемых как R10, входят атомы фтора, хлора, брома и иода, С 1-6 алкил, например метил, этил, н-пропил, изопропил, н-бутил или трет-бутил, необязательно замещенные фенил, пиридил, пиримидинил, пирролил, фурил, тиазолил или тиенил, С 1-6 гидроксиалкил, например гидроксиметил или гидроксиэтил, карбоксиС 1-6 алкил, например карбоксиэтил, С 1-6 алкилтио, например метилтио или этилтио, карбоксиС 1-6 алкилтио, например карбоксиметилтио, 2-карбоксиэтилтио или 3-карбоксипропилтио, С 1-6 алкокси, например метокси или этокси, гидроксиС 1-6 алкокси, например 2-гидроксиэтокси, необязательно замещенные фенокси, пиридилокси, тиазолилокси, фенилтио или пиридилтио, С 3-7 циклоалкил, например циклобутил или циклопентил, С 5-7 циклоалкокси, например циклопентилокси, галоС 1-6 алкил, например трифторметил, галоС 1-6 алкокси, например трифторметокси, С 1-6 алкиламино, например метиламино или этиламино, -CH(CH3)NH2 или -C(CH3)2NH2,галоС 1-6 алкиламино, например фторС 1-6 алкиламино, -CH(CF3)NH2 или -C(CF3)2NH2, амино (-NH2), аминоС 1-6 алкил, например аминометил или аминоэтил, С 1-6 диалкиламино, например диметиламино или диэтиламино, С 1-6 алкиламиноС 1-6 алкил, например этиламиноэтил, С 1-6 диалкиламиноС 1-6 алкил, например диэтиламиноэтил, аминоС 1-6 алкокси, например аминоэтокси, С 1-6 алкиламиноС 1-6 алкокси, например метиламиноэтокси, С 1-6 диалкиламиноС 1-6 алкокси, например диметиламиноэтокси, диэтиламиноэтокси, диизопропиламиноэтокси или диметиламинопропокси, имидо, например фталимидо или нафталимидо, например 1,8-нафталимидо, нитро, циано, гидроксил (-ОН), формил (НС(О)-), карбоксил (-СО 2 Н), -CO2Alk6(где Alk6 имеет указанные выше значения), С 1-6 алканоил, например ацетил, необязательно замещенный бензоил, тиол (-SH), тиоС 1-6 алкил, например тиометил или тиоэтил, сульфонил (-SO3H), С 1-6 алкилсульфонил,например метилсульфонил, аминосульфонил (-SO2NH2), С 1-6 алкиламиносульфонил, например метиламиносульфонил или этиламиносульфонил, С 1-6 диалкиламиносульфонил, например диметиламиносульфонил или диэтиламиносульфонил, фениламиносульфонил, карбоксамидо (-CONH2), С 1-6 алкиламинокарбонил,например метиламинокарбонил или этиламинокарбонил, С 1-6 диалкиламинокарбонил, например диметиламинокарбонил или диэтиламинокарбонил, аминоС 1-6 алкиламинокарбонил, например аминоэтиламинокарбонил, С 1-6 диалкиламиноС 1-6 алкиламинокарбонил, например диэтиламиноэтиламинокарбонил, аминокарбониламино, С 1-6 алкиламинокарбониламино, например метиламинокарбониламино или этиламинокарбониламино, С 1-6 диалкиламинокарбониламино, например диметиламинокарбониламино или диэтиламинокарбониламино, С 1-6 алкиламинокарбонилС 1-6 алкиламино, например метиламинокарбонилметиламино, аминотиокарбониламино, С 1-6 алкиламинотиокарбониламино, например метиламинотиокарбониламино или этиламинотиокарбониламино, С 1-6 диалкиламинотиокарбониламино, например диметиламинотиокарбониламино или диэтиламинотиокарбониламино, С 1-6 алкиламинотиокарбонилС 1-6 алкиламино, например этиламинотиокарбонилметиламино, -CONHC(=NH)NH2, С 1-6 алкилсульфониламино, например метилсульфониламино или этилсульфониламино, С 1-6 диалкилсульфониламино, например диметилсульфониламино или диэтилсульфониламино, необязательно замещенные фенилсульфониламино, аминосульфониламино (-NHSO2NH2), С 1-6 алкиламиносульфониламино, например метиламиносульфониламино или этиламиносульфониламино, С 1-6 диалкиламиносульфониламино, например диметиламиносульфониламино или диэтиламиносульфониламино, необязательно замещенные морфолинсульфониламино или морфолинсульфонилС 1-6 алкиламино, необязательно замещенные фениламиносульфониламино, С 1-6 алканоиламино, например ацетиламино, аминоС 1-6 алканоиламино, например аминоацетиламино, С 1-6 диалкиламиноС 1-6 алканоиламино, например диметиламиноацетиламино, С 1-6 алканоиламиноС 1-6 алкил, например-6 010297 ацетиламинометил, С 1-6 алканоиламиноС 1-6 алкиламино, например ацетамидоэтиламино, С 1-6 алкоксикарбониламино, например метоксикарбониламино, этоксикарбониламино, или трет-бутоксикарбониламино,или необязательно замещенные бензилокси, пиридилметокси, тиазолилметокси, бензилоксикарбониламино, бензилоксикарбониламиноС 1-6 алкил, например бензилоксикарбониламиноэтил, бензотио, пиридилметилтио или тиазолилметилтио. Кроме того, в число особенно приемлемых заместителей, обозначенных R10, когда присутствуют ароматические или гетероароматические группы, входят заместители формулы -L6Alk5R10a, где L6 предпочтительно представляет собой ковалентную связь, или -О- или -S-атом, или -N(R3)-, -С(О)-, -С(О)О-, -О-С(О)-,-N(R3)CO-, -CON(R3)- или -N(R3)S(O)2-группы, Alk5 является необязательно замещенной алкильной группой,необязательно включающей 1 или 2 -О- или -S- атома или -N(R12)-, -C(O)-, -C(S)-, -CON(R12)- или -N(R12)COгруппы, и R10a представляет собой необязательно замещенную Het группу, которая описана здесь, или необязательно замещенную гетероароматическую группу, которая была определена выше для Су 1. Если это желательно, то 2 заместителя R10 могут быть объединены с образованием циклической группы,такой как циклический эфир, например С 1-6 алкилендиоксигруппа, такая как метилендиокси или этилендиокси. Подразумевается, что, если есть 2 или несколько заместителей R10, необязательно, чтобы они были одними и теми же атомами и/или группами. В общем, заместитель (заместители) могут присутствовать в любом доступном положении кольца ароматической или гетероароматической группы, обозначенной Су 1. Замещенная ароматическая или гетероароматическая группа, обозначенная Ar, в соединениях данного изобретения может быть любой ароматической или гетероароматической группой, которые были определены выше для Су 1. Необязательные заместители, которые могут содержаться, включают те R10 атомы и группы, которые вообще или конкретно указаны для Су 1 ароматических и гетероароматических групп. Присутствие определенных заместителей в соединениях формулы (1) может быть обусловлено образованием солей этих соединений. Подходящие соли включают фармацевтически приемлемые соли,например соли присоединения кислот, полученные с помощью неорганических и органических кислот, и соли, полученные с использованием неорганических и органических оснований. Соли присоединения кислот включают гидрохлориды, гидробромиды, гидроиодиды, алкилсульфонаты, например метансульфонаты, этансульфонаты или изотионаты, арилсульфонаты, например п-толуолсульфонаты, бесилаты или напсилаты, фосфаты, сульфаты, гидросульфаты, ацетаты, трифторацетаты,пропионаты, цитраты, малеаты, фумараты, малонаты, сукцинаты, лактаты, оксалаты, тартраты и бензоаты. Соли, полученные с использованием неорганических и органических оснований, включают соли щелочных металлов, такие как соли натрия и калия, соли щелочно-земельных металлов, такие как соли магния или кальция, и соли органических аминов, такие как соли морфолина, пиперидина, диметиламина или диэтиламина. Особенно предпочтительные соли соединений согласно изобретению включают фармацевтически приемлемые соли, особенно фармацевтически приемлемые соли присоединения кислот. В одном варианте Y является -С(О)-. В другом варианте Y является -S(O)2-. В одном классе соединений формулы (1) n представляет собой целое число 1. Когда в соединениях формулы (1) n является целым числом 1, Alk1 предпочтительно представляет собой цепочку -СН 2 СН 2- и более предпочтительно-СН 2-. В одном классе соединений формулы (1) n равно 0. Особенно предпочтительные необязательно замещенные циклоалифатические Су 1 группы включают необязательно замещенные С 3-7 алкильные группы, в частности циклопропил, циклобутил, циклопентил или циклогексил. В частности, Су 1 представляет собой циклопропил. Каждая из этих предпочтительных Су 1 циклоалкильных групп может быть незамещенной. Если заместители есть, они, в частности, могут включать атомы галогена, особенно атомы фтора, хлора или брома, или С 1-6 алкильные группы, в частности С 1-3 алкильные группы, самой предпочтительной является метильная группа, или галоС 1-6 алкильные группы, особенно фторС 1-6 алкильные группы, особенно предпочтительна -CF3 группа, или С 1-6 алкоксигруппы, особенно метокси, этокси, пропокси или изопропоксигруппа, или галоС 1-6 алкоксигруппы, особенно фторС 1-6 алкоксигруппа, самая предпочтительная -OCF3 группа, или циано (-CN), этерифицированный карбоксил, особенно -СО 2 СН 3 или -СО 2 С(СН 3)3, нитро (-NO2),амино (-NH2), замещенный амино, особенно -NHCH3 или -N(CH3)2, -C(O)R6, особенно -С(О)СН 3 или-N(R6)C(O)R7, особенно -NHCOCH3 группа. Особенно предпочтительные Су 1 ароматические группы включают необязательно замещенные фенильные группы. Особенно предпочтительные гетероароматические группы включают необязательно замещенные моноциклические гетероароматические группы, в частности необязательно замещенные 5- и 6-членные гетероароматические группы, содержащие 1, 2, 3 или 4 гетероатома, выбранных из атомов кислорода, серы или азота. Особенно предпочтительные необязательно замещенные моноциклические гетероароматические группы включают необязательно замещенные фурил, тиенил, пирролил, оксазолил,тиазолил, пиридил, пиримидинил и триазинил. Предпочтительным также является то, что гетероароматическая группа может быть 8-13-членным бициклом со слитыми кольцами, содержащим 1 или 2 атома кислорода, серы или азота. Предпочтительно используемые группы этого типа включают необязательно замещенные группы индолила. Особенно предпочтительными необязательными заместителями, которые могут присутствовать в Су 1 ароматической или гетероароматической группах, являются 1, 2 или 3 атома или группы -R10a или-L6Alk5(R10a)r, как указывалось выше. Особенно приемлемыми необязательными заместителями являются атомы галогена, в частности атомы фтора, хлора или брома, или С 1-6 алкильные группы, в частности С 1-3 алкильные группы, самой предпочтительной является метильная группа, или галоС 1-6 алкильные группы,особенно фторС 1-6 алкильные группы, особенно предпочтительна -CF3 группа, или С 1-6 алкоксигруппы,особенно метокси, этокси, пропокси или изопропоксигруппа, или галоС 1-6 алкоксигруппы, особенно фтор С 1-6 алкоксигруппы, самая предпочтительная -OCF3, или циано (-CN), карбоксил (-СО 2 Н), этерифицированный карбоксил (-CO2Alk6), особенно -СО 2 СН 3, -CO2CH2CH3 или -СО 2 С(СН 3)3, нитро (-NO2), амино (-NH2),замещенный амино, особенно -NHCH3 или -N(CH3)2, -COR11, особенно -СОСН 3, или -N(R12)COR11, особенно -NHCOCH3 группа. Другие предпочтительные необязательные заместители, которые могут присутствовать в Су 1 ароматических или гетероароматических группах, включают группы формулы -L6Alk5(R10a)r, где r является целым число 1 или 2, L6 представляет собой ковалентную связь, или -О- или -S-атом, или -N(R3)-, в частности -NH- или -N(CH3)-, -C(O)-, -C(S)-, -С(О)О-, -ОС(О)-, -N(R3)CO-, в частности -NHCO-, или -CON(R3)-,в частности -CONH-группу, Alk5 представляет собой С 1-6 алкиленовую группу, в частности -СН 2-, -СН 2 СН 2-,-СН 2 СН 2 СН 2- или -СН 2 СН 2 СН 2 СН 2-, a R10a является гидроксилом или замещенным гидроксилом, особенно -ОСН 3, -ОСН 2 СН 3 или -ОСН(СН 3)2, или -NH2 или замещенной аминогруппой, особенно -N(СН 3)2 или-N(CH2CH3)2 группой, или -Het группой, в частности необязательно замещенной моноциклической С 5-7 карбоциклической группой, содержащей 1, 2 или 3 -О-, -S-, -N(R12)-, в частности -NH-, или -N(CH3)-, или-С(О)- группы внутри кольца согласно описанному ранее, наиболее предпочтительны необязательно замещенные пирролидинил, имидазолидинил, пиперидинил, например N-метилпиперидинил, морфолинил,тиоморфолинил или пиперазинил, или R10a является необязательно замещенной гетероароматической группой, в частности 5- или 6-членной моноциклической гетероароматической группой, содержащей 1,2, 3 или 4 гетероатома, выбранных из атомов кислорода, серы или азота, например необязательно замещенным пирролилом, фурилом, тиенилом, имидазолилом, триазолилом, пиридилом, пиримидинилом,триазинилом, пиридазинилом или пиразинилом. Особенно предпочтительными необязательными заместителями только что описанных -Het групп являются гидроксильные (-ОН) и карбоксильные (-СО 2 Н) группы или же те предпочтительные обязательные заместители, которые только что описаны для группы Су 1, особенно когда Су 1 является циклоалкильной группой. В одной особенно предпочтительной группе соединений формулы (1) Су 1 представляет собой необязательно замещенную фенильную группу, в частности фенильную группу, необязательно замещенную 1, 2 или 3 заместителями, причем по меньшей мере 1 и предпочтительно 2 заместителя находятся в орто-положении по отношению к связи, присоединяющей Су 1 к остатку соединения формулы (1). Особенно предпочтительные ортозаместители включают атомы галогена, в частности атомы фтора и хлора,или С 1-3 алкильные группы, в частности метил, С 1-3 алкоксигруппы, в частности метокси, галоС 1-3 алкильные группы, в частности -CF3, галоС 1-3 алкоксигруппы, в частности -OCF3, или циано (-CN) группы. В этом классе соединений второй или третий необязательный заместитель, если он находится в положении,отличающемся от орто-положений кольца Су 1, может быть предпочтительно атомом или группой -R10a или -L6Alk5(R10a)r, как описано здесь в общем и в частности. В другом предпочтительном варианте Су 1 фенильная группа может иметь заместитель в пара-положении по отношению к связи, присоединяющей Су 1 к остатку соединения формулы (1). Конкретные паразаместители включают такие конкретные предпочтительные ортозаместители, которые описаны выше. При необходимости, паразаместитель может присутствовать наряду с другими орто- или метазаместителями, которые только что описаны. Примерами конкретных заместителей Су 1 являются галоген (особенно фтор или хлор) и С 1-4 алкил(особенно метил). Конкретные Су 1 группы включают фенил, фторфенил, хлорфенил, метилфенил и циклопропил. Особенно предпочтительные ароматические группы Ar в соединениях формулы (1) включают необязательно замещенные фенильные группы. Особенно предпочтительные гетероароматические группы включают необязательно замещенные моноциклические гетероароматические группы, в частности необязательно замещенные 5- или 6-членные гетероароматические группы, содержащие 1, 2, 3 или 4 гетероатома, выбранные из атомов кислорода, серы и азота. Особенно предпочтительные необязательно замещенные моноциклические гетероароматические группы включают необязательно замещенные фурил,тиенил, пирролил, оксазолил, тиазолил, пиридил, пиримидинил и триазинил. Особенно предпочтительные необязательные заместители, которые могут присутствовать в Ar ароматических или гетероароматических группах, включают атомы или группы -R10a или -L6Alk5(R10a)r, как указывалось выше. Особенно приемлемыми необязательными заместителями являются атомы галогена, в частности атомы фтора, хлора или брома, или С 1-6 алкильные группы, в частности С 1-3 алкильные группы,самой предпочтительной является метильная группа, или галоС 1-6 алкильные группы, особенно фторС 1-6 алкильные группы, особенно предпочтительна -CF3 группа, или С 1-6 алкоксигруппы, особенно метокси,этокси, пропокси или изопропоксигруппа, или галоС 1-6 алкоксигруппы, особенно фторС 1-6 алкоксигруппы,самая предпочтительная -OCF3 группа, или циано (-CN), этерифицированный карбоксил, особенно -СО 2 СН 3 или -СО 2 С(СН 3)3, нитро (-NO2), амино (-NH2), замещенный амино, особенно -NHCH3 или -N(CH3)2, -C(O)R11,особенно -СОСН 3 или -N(R12)COR11, особенно -NHCOCH3 группа.-8 010297 Конкретные приемлемые Ar группы в соединениях формулы (1) включают фенил и моно- и дизамещенные фенильные группы, в которых каждый заместитель представляет собой, в частности, -R10a или-L6Alk5(R10a)r атом или группу, как оговорено выше, и в частности атом галогена или С 1-6 алкильную, С 1-6 алкокси или -CN группу. Примеры конкретных заместителей в Ar включают галоген (в частности, фтор или хлор), циано и С 1-4 алкил (в частности, метил). Конкретные Ar группы включают фенил, дифторфенил, (хлор)(фтор)фенил, (фтор)(метил)фенил,хлорфенил, цианофенил и метилфенил. Конкретные примеры Alk2, когда он присутствует в соединениях данного изобретения, включаютAlk2 представляет собой -С(СН 3)2-. Предпочтительно R1 является метилом. Предпочтительно R2 представляет собой водород или метил. Предпочтительно R3 - водород или метил. В одном варианте R2 и R3, оба являются водородами. В другом варианте R2 и R3, оба являются метилами. В соединениях данного изобретения m может быть выбрано так, чтобы изменять размер кольца от кольца, имеющего помимо атома азота от минимально 3 атомов углерода до 6 атомов углерода. Особенно предпочтительными являются кольца, когда m - целое число 1 или 2. В предпочтительном варианте m - целое число 2. В другом варианте m - целое число 1. Еще в одном варианте m - целое число 3. В предпочтительном варианте р - целое число 1. В другом варианте р - целое число 2. Каждый заместитель Rd может содержаться у любого атома углерода кольца. В одном конкретном классе соединений изобретения присутствуют 1 или 2 заместителя Rd. Подходящими значениями Rd являются -ОН-, -(Alk2)OH, -(Alk2)OR1, -NR2R3 и -(Alk2)NR2R3. Конкретные значения Rd включают -ОН, -СН 2 ОН, -С(СН 3)2 ОН, -СН 2 ОСН 3, -NH2, -N(CH3)2 и -CH2NH2. Характерные значения Rd включают -ОН, -(Alk2)OH и -(Alk2)OR1. Иллюстративные значения Rd включают -ОН, -СН 2 ОН, -С(СН 3)2 ОН и -СН 2 ОСН 3. Предпочтительные Rd заместители включают -ОН, -СН 2 ОН, -СН(СН 3)ОН и -С(СН 3)2 ОН группы. Особенно полезные соединения изобретения включают каждое из соединений, описанных ниже в примерах, а также их соли, сольваты, гидраты и N-оксиды. Соединения согласно изобретению являются мощными и селективными ингибиторами р 38 киназ, в том числе всех их изоформ и сплайс-вариантов. Более конкретно, соединения по данному изобретению являются ингибиторами р 38, р 38 и р 382. Способность этих соединений действовать таким образом может быть просто определена с помощью тестов, описанных ниже в примерах. Соединения формулы (1) являются полезными при модулировании активности р 38 киназ, и в частности полезны при профилактике и лечении любых опосредованных р 38 киназой заболеваний и расстройств человека и других млекопитающих. Изобретение охватывает как вышеуказанное применение этих соединений, так и применение для производства лекарственного средства для лечения этих заболеваний и расстройств. Кроме этого, изобретение распространяется на введение человеку эффективного количества р 38 ингибитора для лечения любого указанного заболевания или расстройства. Данное изобретение также распространяется на профилактику и лечение любого заболевания или расстройства, в которых играет роль р 38 киназа, включая состояния, обусловленные чрезмерным и нерегулируемым продуцированием провоспалительных цитокинов, включая, например, чрезмерное и нерегулируемое продуцирование TNF, IL-1, IL-6 и IL-8 в организме человека или другого млекопитающего. Изобретение охватывает такое применение, а также применение для производства лекарственного средства для лечения таких цитокин-опосредованных заболеваний и расстройств. Кроме этого, изобретение распространяется на введение человеку эффективного количества р 38 ингибитора для лечения любого указанного заболевания или расстройства. Заболевания или расстройства, в которых задействована р 38 киназа прямо или косвенно, посредством провоспалительных цитокинов, в том числе TNF, IL-1, IL-6 и IL-8, включают (без ограничения) аутоиммунные заболевания, воспалительные заболевания, деструктивные заболевания костей, пролиферативные заболевания, нейродегенеративные заболевания, вирусные заболевания, аллергии, инфекционные заболевания, сердечные атаки, ангиогенические заболевания, реперфузию/ишемию при ударе, васкулярную гиперплазию, гипоксию органов, гипертрофию сердца, тромбин-индуцируемую агрегацию и состояния, связанные с простагландин-эндопероксидаза-синтетазой-2 (СОХ-2). Аутоиммунные заболевания, которые можно предотвратить или лечить, включают (но не только) ревматоидный артрит, воспалительное кишечное заболевание, язвенный колит, болезнь Крона, рассеянный склероз, диабет, гломерулонефрит, системную красную волчанку, склеродермию, хронический тиреоидит, болезнь Грейвса, гемолитическую анемию, аутоиммунный гастрит, аутоиммунную нейтропению, тромбоцитопению, хронический активный гепатит, миастеническое отягощение, атопический дерматит, реакцию "трансплантат против хозяина" и псориаз. Данное изобретение, кроме того, охватывает также профилактику и лечение конкретного аутоиммунного заболевания - ревматоидного артрита.-9 010297 Воспалительные заболевания, которые можно лечить и в отношении которых можно осуществлять профилактику, включают (но не только) астму, аллергию, синдром респираторного дистресса, а также острый и хронический панкреатит. Деструктивные заболевания костей, которые можно лечить и в отношении которых можно осуществлять профилактику, включают (но не только) остеопороз, остеоартрит и связанное с множественной миеломой заболевание костей. Пролиферативные заболевания, которые можно лечить и в отношении которых можно осуществлять профилактику, включают (но без ограничения) острую или хроническую миелогенную лейкомию,саркому Капоши, метастатическую меланому и множественную миелому. Нейродегенеративные заболевания, которые можно лечить и в отношении которых можно осуществлять профилактику, включают (но без ограничения) болезнь Паркинсона, болезнь Альцгеймера, церебральную ишемию и нейродегенеративное заболевание, вызванное травматическим повреждением. Вирусные заболевания, которые можно лечить и в отношении которых можно осуществлять профилактику, включают (но без ограничения) острые гепатитные инфекции (включая гепатит А, гепатит В и гепатит С), ВИЧ-инфекцию и CMV ретинит. Инфекционные заболевания, которые можно лечить и в отношении которых можно осуществлять профилактику, включают (но без ограничения) септический шок, сепсис и шигелозис. Кроме этого, р 38 ингибиторы по настоящему изобретению также осуществляют ингибирование экспрессии индуцибельных протеинов провоспаления, таких как простагландин-эндопероксидаза-синтетаза-2, известная также как циклооксигеназа-2 (СОХ-2), и потому они применяются с терапевтическими целями. Провоспалительные медиаторы циклооксигеназного пути метаболизма, получаемые из арахидоновой кислоты, продуцируются индуцибельным СОХ-2 ферментом. Регуляция СОХ-2 должна регулировать эти провоспалительные медиаторы, такие как простагландины, которые воздействуют на широкий круг клеток и представляют собой важные и значимые медиаторы воспаления в большой группе заболеваний и болезненных состояний. В частности, эти медиаторы воспаления причастны к болеобразованию,например участвуют в сенсибилизации болевых рецепторов, и образованию отека. Соответственно, другие р 38 - опосредованные состояния, которые можно лечить или предотвращать, включают отек, анальгезию, лихорадку и боль, например нервно-мышечную боль, головную боль, зубную боль, артритную боль и боль, вызванную раком. Как результат р 38-ингибиторной активности, соединения данного изобретения применимы для профилактики и лечения заболеваний, связанных с выработкой цитокинов, включая (но без ограничения) заболевания, связанные с выработкой TNF, IL-1, IL-6 и IL-8. Таким образом, TNF - опосредованные заболевания и состояния включают, например, ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артритные состояния,сепсис, синдром септического шока, респираторный дистресс-синдром взрослых, церебральную малярию,хроническое легочное воспалительное заболевание, силикоз, саркоидоз легкого, заболевание, связанное с рассасыванием костей, реперфузионные раны, реакцию "трансплантат против хозяина", отторжение аллотрансплантата, лихорадку и миалгию вследствие инфекции, кахексию вследствие инфекции, СПИД,ARD или опухоли, образование келоидных рубцов, образование тканевых рубцов (шрамов), болезнь Крона,язвенный колит, лихорадку, вирусные инфекции, такие как ВИЧ, цитомегаловирусные инфекции, грипп и герпес; а также ветеринарные вирусные инфекции, такие как лентивирусные инфекции, включая (без ограничения) вызванные вирусом инфекционной анемии лошадей, вирусом артрита коз, вызванные visna вирусом или maedi вирусом, или ретровирусные инфекции, включающие вызванные вирусом иммунодефицита кошек, вирусом иммунодефицита крупного рогатого скота и вирусом иммунодефицита собак. Соединения по настоящему изобретению могут также использоваться при лечении вирусных инфекций, если эти вирусы вызывают выработку TNF in vivo или чувствительны к влиянию (находятся под контролем) TNF. Такие вирусы включают те, что продуцируют TNF в результате заражения, и те, что чувствительны к ингибированию, показывая как результат, например, сниженную репликацию, в результате прямого или косвенного воздействия TNF-ингибирующих соединений данного изобретения. Такие вирусы включают (но без ограничения) ВИЧ-1, ВИЧ-2 и ВИЧ-3, цитомегаловирус (CMV), вирус гриппа,аденовирус и вирусы группы герпес, например Herpes Zoster и Herpes Simplex. Заболевания и состояния, связанные с IL-1, включают, к примеру, ревматоидный артрит, остеоартрит, псориазный артрит, травматический артрит, артрит вследствие краснухи, воспалительное кишечное заболевание, удар, синдром эндотоксемического и/или токсического шока, воспалительное заболевание,обусловленное эндотоксином, диабет, заболевание -клеток поджелудочной железы, болезнь Альцгеймера, туберкулез, атеросклероз, мышечную дистрофию и кахексию. Заболевания и состояния, связанные с IL-8, включают, к примеру, такие, которые характеризуются массивной инфильтрацией нейтрофилов, например псориаз, воспалительное кишечное заболевание, астму, реперфузионные повреждения сердца, мозга или почек, респираторный дистресс-синдром взрослых,тромбоз и гломерулонефрит. Повышенная выработка IL-8, связанная с каждым из этих заболеваний, ответственна за хемотаксис нейтрофилов в местах воспалений. Это происходит вследствие уникального свойства IL-8 (по сравнению с TNF, IL-1 и IL-6) промотировать хемотаксис нейтрофилов и их актива- 10010297 цию. Следовательно, ингибирование продуцирования IL-8 должно привести к непосредственному уменьшению инфильтрации нейтрофилов. Известно также, что и IL-6, и IL-8 продуцируются в процессе заражения риновирусами (HRV) и участвуют в патогенезе вызываемого насморком раздражающего удушья (затруднений дыхания), осуществленного риновирусным (HRV) заражением (Turner et al., Clin. Infect. Dis., 1997, 26, 840; Granberg et al.,Am. J. Crit. Care Med., 1997, 155, 1362; Zhu et al., J. Clin. Invest., 1996, 97, 421). Было также указано in vitro,что заражение эпителиальных клеток легких риновирусами (которые представляют собой первичные точки инфицирования риновирусами) приводит к продуцированию IL-6 и IL-8 (Sabauste et al., J. Clin.Invest. 1995, 96, 549). Следовательно, р 38 ингибиторы могут использоваться для лечения и профилактики острого респираторного вирусного заражения, вызываемого инфицированием риновирусами человека(HRV), другими энтеровирусами, коронавирусами, вирусом гриппа, вирусом парагриппа, респираторным синцитиальным вирусом или аденовирусами. Для профилактики и лечения заболевания, связанного или обусловленного р 38 или провоспалительными цитоксинами, соединения по настоящему изобретению можно вводить человеку или иному млекопитающему в виде фармацевтических композиций, и в соответствии с другим аспектом изобретения предусматривается фармацевтическая композиция, которая включает соединение формулы (1) вместе с одним или несколькими фармацевтическими приемлемыми носителями, наполнителями и разбавителями. Фармацевтические композиции согласно изобретению могут быть в форме для орального, буккального, парентерального, назального, местного, глазного или ректального введения или в форме, пригодной для введения ингаляцией или инсуффляцией. Для орального введения фармацевтические композиции могут быть, например, в форме таблеток,пилюль или капсул, изготовленных обычными известными методами с фармацевтически пригодными наполнителями, такими как связующие средства (например, предварительно желатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например,лактоза, микрокристаллическая целлюлоза или кислый фосфат кальция); любриканты (например, стеарат магния, тальк или диоксид кремния); разрыхляющие средства (например, картофельный крахмал или гликолят натрия) или увлажняющие агенты (например, лаурилсульфат натрия). Эти таблетки могут иметь покрытие, нанесенное с помощью известных в данной области методов. Жидкие препараты для орального применения могут быть, например, в форме растворов, сиропов или суспензий или могут присутствовать в качестве сухого продукта для восстановления водой или иным подходящим средством перед использованием. Такие жидкие препараты могут готовиться известными методами с использованием фармацевтически приемлемых добавок, таких как суспендирующие средства, эмульгаторы, неводные средства и презервирующие добавки. Эти препараты могут также содержать буферные соли, отдушки,красители и подсластители, в зависимости от потребности. Препараты для орального применения могут быть созданы таким подходящим образом, чтобы было возможным контролировать выделение активного компонента. Для буккального введения композиции могут иметь форму таблеток или лепешек, изготовленных известным путем. Соединения формулы (1) могут входить в составы для парентерального введения путем инъекций,например инъекции болюсов или инфузионно. Составы для инъекций могут быть в виде единичных дозировок, например в стеклянных ампулах, мультидозных контейнерах, например стеклянных флаконах. Эти композиции для инъекций могут быть в виде суспензий, растворов или эмульсий в масляных или водных основах и могут содержать формирующие состав средства, такие как суспендирующие, стабилизирующие, презервирующие и/или диспергирующие средства. Или же активный компонент может содержаться в виде порошка для последующего объединения с подходящим средством, например стерильной апирогенной водой, перед использованием. Помимо вышеописанных составов соединения формулы (1) могут входить в составы так называемых депо-препаратов. Такие долгодействующие составы могут вводиться имплантацией или внутримышечной инъекцией. Для назального введения или введения путем ингаляции соединения для применения согласно настоящему изобретению обычно выпускают в виде аэрозольных спреев в емкостях и флаконах под давлением с применением подходящего распылителя, например дихлордифторметана, трихлорфторметана,дихлортетрафторэтана, диоксида углерода или другого подходящего газа или смеси газов. При желании эти композиции могут быть объединены в упаковке или распределительном средстве,которое может содержать одну или несколько единичных дозировочных форм, содержащих активный компонент. Такая упаковка или распределяющее средство могут быть снабжены инструкцией по введению. Для местного введения соединения, применяемые согласно настоящему изобретению, могут входить в состав подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких фармацевтически приемлемых носителях. Конкретные носители включают, например, минеральное масло, жидкую нефть, пропиленгликоль, полиоксиэтилен, полиоксипропилен,эмульгирующий воск и воду. Альтернативно соединения, применяемые в соответствии с настоящим изобретением, могут входитьв состав подходящего лосьона, содержащего активный компонент, суспенди- 11010297 рованный или растворенный в одном или нескольких фармацевтически приемлемых носителях. Конкретные носители включают, например, минеральное масло, сорбитан-моностеарат, полисорбат 60, цетилэфирный воск, цетеарильный спирт, бензиловый спирт, 2-октилдодеканол и воду. Для офтальмологического введения соединения, применяемые согласно настоящему изобретению,могут быть известным способом введены в состав микроионизированных суспензий в изотоническом рН-регулируемом стерильном солевом растворе как в присутствии, так и без консервантов, таких как бактерицидное или фунгицидное средство, например фенилмеркуринитрат, бензилалконийхлорид или хлоргексидинацетат. Альтернативно для офтальмологического введения соединения могут быть в составе мази, такой как петролатум. Для ректального введения соединения, применяемые согласно настоящему изобретению, могут быть известным способом введены в суппозитории. Они могут быть изготовлены смешиванием активного компонента с подходящим нераздражающим наполнителем, который является твердым при комнатной температуре и жидким при ректальной температуре с тем, чтобы плавиться в прямой кишке с выделением активного компонента. Такие вещества включают, например, масло какао, пчелиный воск и полиэтиленгликоли. Количество соединения по настоящему изобретению, требуемое для профилактики или лечения конкретного состояния, будет зависеть от выбранного соединения и состояния пациента, которого лечат. В общем, тем не менее, суточные дозы могут колебаться от примерно 100 нг/кг до 100 мг/кг, например от около 0,01 до 40 мг/кг веса тела для орального или буккального введения, от около 10 нг/кг до 50 мг/кг веса тела при парентеральном введении и от около 0,05 до около 1000 мг, например от около 0,5 мг до около 1000 мг при назальном введении или введении с помощью ингаляции или инсуффляции. Соединения по данному изобретению могут быть получены различными способами, в общих чертах описанными ниже и более подробно - в примерах. В нижеследующем описании способа символы Ar,Су 1, Alk1, n, Rd, p, m и Y при использовании в формулах представляют те же группы, что и указанные выше в отношении формулы (1), если иное не оговорено. В описанных ниже реакциях может оказаться необходимым защитить реакционноспособные функциональные группы, например гидрокси, амино, тио или карбоксигруппы, когда они желательны в конечном продукте, но нужно избежать их нежелательного участия в реакциях. Широко известные защитные группы могут использоваться согласно стандартным практическим приемам (см., например, Greene T.W. в "Protective Groups in Organic Synthesis", John Wileyand Sons, 1999). В некоторых случаях снятие защиты может быть конечной стадией синтеза соединения формулы (1), и следует понимать, что описанные ниже способы согласно изобретению охватывают и это удаление защитных групп. Таким образом, согласно еще одному аспекту изобретения соединение формулы (1), где Y является-С(О) группой, может быть получено из карбоновой кислоты формулы (2) или эфира формулы (5) в соответствии с реакциями образования амидной связи, хорошо известными специалистам в данной области. Такие реакции описаны в таких обзорах как March's Advanced Organic Chemistry (John Wiley and Sons,1992), Larock's Comprehensive Organic Transformations (VCN Publishers Inc., 1992) и Comprehensive OrganicFunctional Group Transformations, ed. Katritzky et al., vol. 1-8, 1984, and vol. 1-11, 1994 (Pergamon). Примеры осуществления этих способов, которые могут использоваться для получения соединений формулы(1 а), приведены, но без ограничения реакциями схем 1 и 2, представленных ниже. Схема 1 Таким образом, амиды формулы (1 а) могут быть получены реакцией карбоксилатной соли формулы(2) (где М - противоион металла, например ион натрия или лития или альтернативно ион аммония или ион триалкиламмония) с амином формулы (3) в присутствии связывающего агента, такого как карбодиимид, например 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) или N,N'-дициклогексилкарбодиимид, необязательно в присутствии основания, такого как амин, например триэтиламин или N-метилморфолин. Эти реакции могут проводиться в растворителе, таком как амидный растворитель, например N,Nдиметилформамид (DMF) или простой эфир, например циклический эфир, такой как тетрагидрофуран- 12010297 или 1,4-диоксан, или галогенированный растворитель, такой как дихлорметан, при температуре от примерно комнатной до 60 С. По другому способу пентафторфенильный эфир формулы (4) может быть получен реакцией карбоновой кислоты формулы (2) с пентафторфенилом в присутствии связывающего реагента, например 1-(3-диметиламинопропил)-3-этилкарбодиимида в растворителе, например амидном,например DMF, при комнатной температуре. Амиды формулы (1 а) могут быть затем получены при взаимодействии пентафторфенильного эфира с аминами формулы (3) в органическом растворителе, таком как галогенированый углеводород, например дихлорметан, при примерно комнатной температуре и необязательно в присутствии третичного аминного основания, такого как триэтиламин или диизопропилэтиламин. Промежуточные кислоты формулы (2) могут быть получены гидролизом эфиров формулы (5) с помощью основания, например гидркосида щелочного металла, например гидроксида натрия или гидроксида лития, в воде и растворителе, таком как тетрагидрофуран или спирт, например этанол, при температуре от примерно комнатной до температуры дефлегмации. Амиды формулы (1 а) могут быть также получены непосредственно из эфиров формулы (5) путем нагревания амина формулы (3) до температуры дефлегмации амина необязательно в присутствии растворителя, такого как 2-этоксиэтанольный эфир, при атмосферном давлении или под давлением в запечатанной пробирке (схема 2). Схема 2 Промежуточные эфиры формулы (5) могут быть получены способами, показанными на схеме 3,представленной ниже. На этой схеме специально показано получение этилового эфира, но подразумевается, что и другие эфиры можно получить, варьируя исходные вещества и, соответственно, условия реакции. Схема 3 Таким образом, по схеме 3 соединение (5 а) или (5b) может быть получено взаимодействием соединения формулы (6) или (7) с амином ArNH2 в присутствии палладиевого катализатора. Эта реакция, как- 13010297 известно, может выполняться в растворителе, таком как толуол, при повышенной температуре, например температуре дефлегмации, и с использованием катализатора, такого как трис(дибензилиденацетон)дипалладий(0), фосфинового лиганда, такого как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, и основания,такого как карбонат цезия. При желании можно использовать альтернативные условия реакций, например, описанные в литературе (Luker et al., Tetrahedron Lett. 2001, 41, 7731; Buchwald S.L., J. Org. Chem.,2000, 65, 1144; Hartwig J.F. Angew. Chem. Int. Ed. Engl., 1998, 37, 2046). Промежуточные соединения формулы (7) могут быть получены взаимодействием соединения формулы (8) с алкилирующим агентом формулы Cy1(Alk1)nZ, где Z - остаточная группа, например атом галогена, например атом хлора, брома или иода, или сульфонилоксигруппа, например алкилсульфонилокси,например трифторметилсульфонилокси, или арилсульфонилокси, например фенилсульфонилоксигруппа. Реакция может осуществляться в присутствии растворителя, например замещенного амида, такого как N,N-диметилформамид, необязательно в присутствии основания, например неорганического основания, такого как гидрид натрия, или органического основания, такого как органический амин, например циклический амин, такой как 1,5-диазабицикло[4,3,0]нон-5-ен, или связанного со смолой органического амина, например связанного со смолой 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2 диазафосфорина (PS-BEMP), при повышенной температуре, например от 80 до 100 С. Промежуточные соединения формулы (6) могут быть получены взаимодействием соединения формулы (8) с бороновой (boronic) кислотой формулы Cy1B(OH)2, где Су 1 является арильной или гетероарильной группой. Реакцию можно проводить в органическом растворителе, например галогенированном углеводороде, например дихлорметане или дихлорэтане, в присутствии медьсодержащего реагента, например соли меди(I), такой как CuI, или, например, реагента, содержащего медь(II), такого как ацетат меди(II), необязательно в присутствии оксиданта, например 2,2,6,6-тетраметилпиперидин-1-оксида или пиридин-N-оксида, необязательно в присутствии основания, например органического амина, такого как алкиламин,например триэтиламин, или ароматического амина, например пиридина, при температуре от комнатной до температуры дефлегмации (см., например, Chan D.T. et al., Tetrahedron Letters, 1998, 2933; Lan P.Y.S.et al., Tetrahedron Letters, 2001, 3415). Промежуточные соединения формулы (6), где Су 1 является арильной или гетероарильной группой,могут также быть получены нуклеофильным ароматическим замещением подходящим образом активированного арил- или гетероарилгалогенида соединением формулы (8). Реакцию можно проводить в диалкиламидном растворителе, таком как DMF, в присутствии основания, такого как гидрид металла, например гидрид натрия, при температуре от примерно комнатной до 100 С. Подходящим образом активированными являются арил или гетероарилгалогениды, имеющие электрон-оттягивающий заместитель,например нитро, циано или эфирную группу, например хлор- или фторнитробензол или 2-хлор-5 нитропиридин. Или же азотсодержащий гетероарилгалогенид может быть активирован для нуклеофильного замещения N-оксидированием, например N-оксид 2-хлорпиридина. Подразумевается, что при желании только что описанные реакции могут осуществляться в обратном порядке, так что аминирование с использованием ArNH2 выполняют с помощью промежуточного соединения формулы (8) на первом этапе, а потом алкилирование/арилирование с получением соединения формулы (5). Это может быть необходимым для защиты функции азота в соединениях формулы (8) во время осуществления всего цикла реакций. Такая защита может быть достигнута О-алкилированием алкилгалидом, например циклопропилметилбромидом, или арилалкилбромидом, например бензилбромидом, как показано на схеме 4. Схема 4- 14010297 основания, такого как амин, например циклический амин, например 1,5-диазабицикло[4,3,0]нон-5-ен,при повышенной температуре, например от 80 до 100 С с получением соединения формулы (13). Взаимодействие защищенного соединения (13) с ArNH2 при катализе палладием может осуществляться так,как перед этим описано получение соединения формулы (14). Снятия защиты можно добиться обработкой раствора этого соединения в спирте, например МеОН, минеральной кислотой, например HCl, при повышенной температуре, например температуре дефлегмации, с получением соединения формулы (15). Или же, когда применяется защита бензила, тогда эта группа может быть удалена с помощью восстановления обработкой раствора соединения (14) в органическом растворителе, таком как EtOH, с использованием палладиевого или платинового катализатора, например палладия-на-угле или PtO2, при повышенном давлении водорода и температуре от примерно комнатной до 60 С. Соединения формулы (15) могут быть затем подвергнуты реакциям алкилирования/арилирования, как было описано для получения соединений формулы (5). Промежуточные пиридиноны формулы (8) могут быть получены из N-оксидов пиридина формулы(9) последовательным взаимодействием с ангидридом, например уксусным ангидридом, при повышенной температуре, например температуре дефлегмации, с последующей реакцией с неорганическим основанием, например карбонатом, таким как водный карбонат калия, в растворителе, таком как эфир, например циклический эфир, например тетрагидрофуран, при примерно комнатной температуре. Альтернативно реакцию можно проводить, используя трифторуксусный ангидрид в N,N-диметилформамиде в условиях от 0 С до комнатной температуре (см., например, Konno et al., Heterocycles, 1986, 24, 2169).N-Оксиды пиридина формулы (9) можно получать окислением пиридинов формулы (10) окисляющим агентом, таким как пероксид водорода, в присутствии кислоты, такой как уксусная кислота, при повышенной температуре, например от около 70 С, или альтернативно реакцией с перкислотой, такой как надуксусная кислота или m-хлорпероксибензойная кислота, в растворителе, таком как галогенированный углеводород, дихлорметан или спирт, например трет-бутанол, при температуре от комнатной температуры до температуры дефлегмации. Промежуточные пиридины формулы (10) на схеме 3 можно получить известными способами, например с помощью Sandmeyer реакции. Так, например, бромид формулы (10) можно получить обработкой ариламина формулы (11) алкилнитрилом, например трет-бутилнитрилом, и солью меди, например бромидом меди(II), в присутствии растворителя, например нитрила, например ацетонитрила, при температуре от около 0 до около 65 С. Амины формулы (11) могут быть получены из 2-галопиридин-3-карбонитрилов формулы (12) взаимодействием с реагентом, таким как этил-2-меркаптоацетат. Реакцию можно вести в присутствии растворителя, такого как замещенный амид, например N,N-диметилформамид, или эфир, например циклический эфир, такой как тетрагидрофуран, или спирт, такой как этанол, в присутствии основания, например неорганического основания, такого как карбонат натрия или гидрид, например гидрид натрия, или органического основания, такого как 1,5-диазабицикло[4,3,0]нон-5-ен или триалкиламин, например триэтиламин, при температуре между от около 0 до 100 С. Исходные карбонитрилы являются легкодоступными или могут быть получены из известных соединений с помощью известных методов. По другому способу промежуточные эфиры формулы (5 а) могут быть получены путем реакций,приведенных на схеме 5. На этой схеме, представленной ниже, R20 представляет собой эфир или нитрил,a LG представляет собой отщепляемую группу, такую как атом галогена, например хлора или брома, или сульфонилоксигруппу, такую как алкилсульфонилоксигруппу, например трифторметилсульфонилокси,или арилсульфонилоксигруппу, например п-толуолсульфонилокси. Схема 5- 15010297 Таким образом, на стадии (А) реакционной схемы соединение формулы (17) или (18), где Rx является необязательно замещенным алкилом, например метилом, a W - атом водорода, ион металла или соль амина, можно ввести во взаимодействие с тиоамидом формулы (19). Эту реакцию можно проводить в присутствии основания. Соответствующие основания могут включать (но без ограничения) основания лития, такие как н-бутил- или трет-бутиллитий или диизопропиламид лития (LDA), силазаны, например гексаметилдисилазан лития (LiHMDS) или гексаметилдисилазан натрия (NaHMDS), карбонаты, например карбонат калия, алкоксиды, например этоксид натрия, метоксид натрия или трет-бутоксид калия,гидроксиды, например NaOH, гидриды, например гидрид натрия, и органические амины, например триэтиламин или диизопропилэтиламин, или циклический амин, такой как N-метилморфолин или пиридин. Реакцию можно проводить в органическом растворителе, таком как амид, например замещенный амид,такой как N,N-диметилформамид, эфир, например циклический эфир, такой как тетрагидрофуран или 1,4-диоксан, спирт, например метанол, этанол или пропанол, или ацетонитрил, при температуре от комнатной до температуры дефлегмации. В одном конкретном варианте способа реакцию осуществляют,используя алкоксидное основание, в частности этоксид натрия или метоксид натрия, в растворителе, являющемся спиртом, например этанолом, при температуре дефлегмации. Промежуточные соединения формулы (17), которые не являются коммерчески доступными, могут быть получены с помощью стандартных методов (см., например, Mir Hedayatullan, J. Heterocyclic Chem.,1981, 18, 339). Аналогично промежуточные соединения формулы (18), которые не являются коммерчески доступными, могут быть получены с помощью стандартных методов. Например, они могут быть получены in situ взаимодействием ацетата, например этилацетата, с основанием, например метоксидом натрия, с последующим добавлением формиата, например метилформиата. Точно так же промежуточные соединения формулы (19), если они не являются коммерчески доступными, могут быть получены с помощью методов, известных специалистам в данной области (см.,например, Adhikari et al., Aust. J. Chem., 1999, 52, 63-67). Например, изотиоцианаты формулы Cy1NCS могут быть введены во взаимодействие с ацетонитрилом в присутствии основания, например NaHMDS, в подходящем растворителе, например тетрагидрофуране, возможно при низкой температуре, например около -78 С. В соответствии с сущностью группы Су 1 промежуточные соединения формулы (19) могут быть получены in situ, например, с помощью вышеописанных способов с последующим последовательным добавлением соединения формулы (17) или (18). В течение этого процесса может быть получено промежуточное соединение формулы (20). При желании это промежуточное соединение может быть выделено в конце стадии (А) и затем подвергнуто взаимодействию с промежуточным соединением (21) с получением желаемого амина (22). В некоторых случаях, однако, может быть полезным не выделять промежуточное соединение формулы (20), и реакция(В) может осуществляться непосредственно в реакционной смеси стадии (А). Если на второй стадии способа применяется другой растворитель, может быть необходимым выпаривание растворителя первой стадии способа в условиях вакуума до начала второй стадии. После выпаривания грубые твердые частицы со стадии (А) могут использоваться на следующей стадии или могут быть очищены, например, кристаллизацией с получением выделяемого промежуточного соединения,такого как соединение формулы (20). Во время стадии (В) процесса промежуточное соединение формулы (21) может быть затем добавлено в реакционную смесь, или к неочищенным твердым частицам продукта, или очищенному продукту со стадии (А) в подходящем растворителе. Подходящие растворители включают (без ограничения) амиды,например замещенный амид, такой как N,N-диметилформамид, спирты, например этанол, метанол или изопропиловый спирт, эфиры, например циклический эфир, такой как тетрагидрофуран или 1,4-диоксан и ацетонитрил. Реакция может осуществляться при температуре от комнатной до температуры дефлегмации. В процессе осуществления стадии (В) промежуточное соединение формулы (24) может быть обнаружено или даже выделено, в зависимости от группы R20. Промежуточное соединение формулы (24) может быть переведено в соединение формулы (22) с помощью описанных выше методов. В этой ситуации может оказаться необходимым добавление основания для того, чтобы реакцию довести до конца. Соответствующие основания включают карбонаты, например карбонат цезия или калия, алкоксиды, например трет-бутоксид калия, гидриды, например гидрид натрия, или органические амины, например триэтиламин или диизопропилэтиламин, или циклические амины, такие как N-метилморфолин или пиридин. Амины формулы (22) могут быть переведены в бромиды формулы (23) стандартными методами,такими как, например, Sandmayer реакция, которые были ранее описаны для соединений формулы (11).- 16010297 Соединения формулы (5 а) могут быть затем получены из этих бромидов с помощью уже описанных реакций палладий-катализируемого аминирования. Следует учитывать, что промежуточные соединения формулы (21), если они не являются коммерчески доступными, могут быть получены с помощью стандартных методов, известных специалистам в данной области. Например, спиртовые группы могут быть переведены в отщепляемые группы, такие как атомы галогена или сульфонилоксигруппы, с использованием условий, известных специалистам. Например, спирт может быть подвергнут взаимодействию с тионилхлоридом в галогенированном углеводороде,например дихлорметане, с получением соответствующего хлорида. Основание, такое как триэтиламин,также может быть использовано в реакции. Нитрилы формулы (23 а), которые могут быть получены по реакционной схеме, приведенной на схеме 5, при условии, что R20 является -CN, являются полезными промежуточными соединениями в синтезе промежуточных карбоновых кислот формулы (25 а). Эту реакцию можно осуществить, гидролизуя нитрил (23 а) основанием, таким как гидроксид щелочного металла, например 2 М раствором гидроксида натрия в спиртовом растворителе, например метаноле или этаноле, при дефлегмации. Понятно, что эти промежуточные соединения, например промежуточные (17), (18), (19) или (21),если они не являются коммерчески доступными, то могут быть получены с помощью известных специалистам способов, описанных в обзорах, например Rodd's Chemistry of Carbon Compounds, тома 1-15 иSons, 1992). Другим способом амиды формулы (1 а) могут быть получены с помощью реакций, показанных на схеме 6 ниже. Схема 6 Таким образом, кислоты формулы (25) или (26) могут быть переведены в амиды формулы (3) в присутствии связывающих реагентов тем же способом, который ранее был описан для превращения соединений (2) в амиды формулы (1). Альтернативно, карбоновые кислоты могут быть превращены в хлориды кислот формулы (26) реакцией с хлорирующим агентом, таким как оксалилхлорид, необязательно в присутствии каталитического количества DMF в растворителе, таком как галогенированный углеводород,например дихлорметан, или эфир, например циклический эфир, например тетрагидрофуран, при почти комнатной температуре; или с хлорирующим агентом, таким как тионилхлорид, обычно в растворителе,таком как толуол, при температуре дефлегмации. Полученные в результате хлориды кислот могут быть затем подвергнуты взаимодействию с аминами формулы (3) в растворителе, таком как галогенированный- 17010297 углеводород, например дихлорметан, в присутствии аминного основания, такого как триэтиламин, при почти комнатной температуре с получением амидов формулы (27). Амиды формулы (1 а) могут быть затем получены из амидов формулы (27) с использованием способа палладий-катализируемого арилирования, описанного ранее в схеме 1. В процессе осуществления реакций, описанных выше, может быть полезной или необходимой защита Rd-заместителей, которые могут присутствовать в соединениях. Могут применяться обычные защитные группы в соответствии с известными методами (см., например, GreeneT.W. в "Prorective Groups in Organic Synthesis", John Wiley and Sons, 1999). В некоторых случаях снятие защиты может быть заключительной стадией в синтезе соединения формулы (1 а), и понятно, что описываемые ниже способы настоящего изобретения включают также и такое удаление защитных групп. Согласно еще одному аспекту изобретения соединение формулы (1), в котором Y является -S(O)2 группой, может быть получено в результате цикла реакций, показанных на схеме 7. Схема 7 Таким образом, соединение формулы (29) может быть получено реакцией соединения формулы (28) с солью металла и амидного основания, например натрий-бис(триметилсилил)амидом, в растворителе,таком как эфир, например циклический эфир, такой как тетрагидрофуран, при температуре около 0 С с последующим добавлением ди-трет-бутилдикарбоната в растворителе, например тетрагидрофуране, и перемешиванием при комнатной температуре. Затем может быть получено соединение формулы (1) с помощью следующих реакций. Соединение формулы (29) обрабатывают основанием, таким как алкиллитий, например н-бутиллитий, в растворителе, таком как эфир, например циклический эфир, такой как тетрагидрофуран, при температуре около -78 С. Газообразный диоксид серы пропускается через реакционную смесь перед тем, как реакционная смесь нагреется до комнатной температуры. Под вакуумом удаляют растворитель, такой как галогенированный углеводород, например дихлорметан, и обрабатывают смесь хлорирующим реагентом, например N-хлорсукцинимидом, при температуре около комнатной. Амин формулы (3) можно затем добавлять к реакционной смеси и получать соединение формулы(30), где R=трет-бутоксикарбонил. Сульфонамид формулы (1) затем может быть получен при обработке соединения формулы (30) кислотой, например минеральной кислотой, такой как HCl, или органической кислотой, например трифторуксусной кислотой, в растворителе, таком как галогенированный углеводород, например дихлорметан. Промежуточные соединения формулы (28) могут быть получены декарбоксилированием соединений формулы (2) кислотой, например минеральной кислотой, например HCl, в растворителе, например в эфире, например циклическом эфире, например тетрагидрофуране или 1,4 диоксане, при температуре от 50 С до температуры дефлегмации. Когда в описанных выше способах общего характера промежуточные соединения, такие как алкилирующие агенты формулы Cy1(Alk1)nZ, реагенты формулы HSCH2CO2Et и любые другие промежуточные, необходимые для синтеза соединений данного изобретения, не являются коммерчески доступными или известными из литературных источников, они могут быть легко получены из более простых известных соединений одним или несколькими стандартными синтетическими методами, включая реакции замещения, окисления, восстановления или расщепления. Конкретные методики введения заместителей включают обычное алкилирование, арилирование, гетероарилирование, ацилирование, тиоацилирование,галогенирование, сульфонилирование, нитрование, формилирование и связывание соединений. Понятно,что эти методы могут использоваться для получения или модификации других промежуточных соединений формулы (1), если соответствующие функциональные группы присутствуют в этих соединениях. Конкретные примеры таких методов представлены ниже в примерах. Так, например, ароматические галогенсодержащие заместители в этих соединениях могут быть с помощью основания подвергнуты обмену галогена с металлом, например с помощью литиевого основания, такого как н-бутил- или трет-бутиллитий, необязательно при низкой температуре, например около-78 С, в растворителе, таком как тетрагидрофуран, с последующим гашением электрофильным агентом для введения желаемого заместителя. Таким образом, к примеру, может быть введена формильная группа с использованием N,N-диметилформамида в качестве электрофила, тиометильная группа может быть введена с использованием диметилсульфида в качестве электрофила, спиртовая группа может быть введена с помощью альдегида в качестве электрофила и кислота может быть введена с помощью диоксида углерода в качестве электрофила. Ароматические кислоты формулы ArCO2H могут быть также получены- 18010297 гашением реагентов Гриньяра формулы ArMgHal диоксидом углерода. Ароматические кислоты формулы ArCO2H, полученные этим методом, и кислотосодержащие соединения, в целом, могут быть переведены в активированные производные, например галогениды кислот, реакцией с галогенирующим агентом, например галогенидом тионила, например тионилхлоридом,тригалогенидом фосфора, например трихлоридом фосфора, или пентагалогенидом фосфора, например пентахлоридом фосфора, необязательно в инертном растворителе, таком как ароматический углеводород, например толуол, или хлорсодержащий углеводород, например дихлорметан, при температуре от около 0 С до температуры дефлегмации, или могут быть переведены в Weinreb амиды формулыArC(O)N(OMe)Me превращением только что описанного галогенида кислоты и последующей реакцией с амином формулы NH(OMe)Me или его солью необязательно в присутствии основания, такого как органический амин, напимер триэтиламин, в инертном растворителе, таком как ароматический углеводород,например толуол, или хлорированный углеводород, например дихлорметан, при температуре от около 0 С до комнатной температуры. Эфирные группы, такие как -CO2Alk6 и -CO2Alk4, в соединении формулы (1) и его промежуточных могут быть превращены в соответствующие кислотные группы [-СО 2 Н] катализируемым кислотой или основанием гидролизом в зависимости от природы группы Alk6 или R4. Катализируемый кислотой или основанием гидролиз можно осуществить путем обработки органической или неорганической кислотой,например трифторуксуской кислотой, в органическом растворителе, например дихлорметане, или минеральной кислотой, такой как соляная кислота, в растворителе, таком как 1,4-диоксан, или гидроксидом щелочного металла, например гидроксидом лития, в водном растворе спирта, например водном метаноле. В другом примере -OR6 (где R6 представляет собой алкильную группу, например метильную) в соединениях формулы (1) и ее промежуточных может быть расщеплена до соответствующей спиртовой группы -ОН реакцией с трибромидом бора в растворителе, например галогенированном углеводороде,например дихлорметане, при низкой температуре, например около -78 С. Спиртовые [-ОН] группы могут быть также получены гидрогенированием соответствующей-OCH2R31 группы (где R31 - арильная группа) с использованием металлического катализатора, например палладия на носителе, например на угле, в растворителе, таком как этанол, в присутствии формиата аммония, циклогексадиена или водорода при температуре от примерно комнатной до температуры дефлегмации. В другом примере -ОН группы могут быть получены из соответствующих эфирных (например,-CO2Alk6) или альдегидных [-СНО] восстановлением с использованием, например, комплексного гидрида металла, такого как литий-алюминиевый гидрид или боргидрид натрия, в растворителе, например метаноле. В другом примере спиртовые [-ОН] группы в соединениях могут быть переведены в соответствующие -OR6 группы путем связывания с реагентом R6OH в растворителе, таком как тетрагидрофуран, в присутствии фосфина, например трифенилфосфина, и активатора, такого как диэтил-, диизопропил- или диметилазодикарбоксилат. Аминосульфониламино [-NHSO2NH2] группы в соединениях могут быть получены в другом примере реакцией соответствующего амина [-NH2] с сульфамидом в присутствии органического основания,такого как пиридин, при повышенной температуре, например температуре дефлегмации. В другом примере соединения, содержащие -NHCSR7 или -CSNHR7 группу, могут быть получены обработкой соответствующего соединения, содержащего -NHCOR7 или -CONHR7-группу, тиатирующим реагентом, например Lawesson's реагентом или P2S5, в безводном растворителе, например циклическом эфире, таком как тетрагидрофуран, при повышенной температуре, такой как температура дефлегмации. В другом примере аминные [-NH2] группы могут быть алкилированы с помощью способа восстановительного алкилирования при использовании альдегида и восстанавливающего агента. Подходящими восстановителями являются боргидриды, например триацетоксиборгидрид натрия или цианоборгидрид натрия. Восстановление можно проводить в растворителе, таком как галогенированный углеводород,например дихлорметан, кетон, например ацетон, или спирт, например этанол, при необходимости в присутствии кислоты, такой как уксусная кислота, при примерно комнатной температуре. Альтернативно,амин и альдегид могут сначала прореагировать в растворителе, таком как ароматический углеводород,например толуол, а затем подвергаться гидрогенизации в присутствии металлического катализатора, например палладия на носителе, например на угле, в растворителе, таком как спирт, например этанол. В другом примере аминные [-NH2] группы в соединениях формулы (1) и их промежуточных могут быть получены гидролизом из соответствующего имида реакцией с гидразином в растворителе, таком как спирт, например этанол, при комнатной температуре. В другом примере нитро [-NO2] группа может быть восстановлена до амина [-NH2], например каталитическим гидрогенированием, например водородом в присутствии металлического катализатора, например палладия, на носителе, например на угле, в растворителе, например эфире, таком как тетрагидрофуран, или спирте, таком как метанол, или химическим восстановлением с помощью, например, металла, такого как олово или железо, в присутствии кислоты, такой как соляная кислота. Еще в одном примере аминные [-CH2NH2] группы в соединениях формулы (1) и их промежуточных- 19010297 могут быть получены восстановлением нитрилов [-CN], например каталитическим гидрогенированием,например водородом, в присутствии металлического катализатора, например палладия, на носителе, например на угле, или никеля Ренея (Raney) в растворителе, например эфире, таком как циклический эфир, например тетрагидрофуран, или спирте, например метаноле или этаноле, необязательно в присутствии раствора аммония при температуре от комнатной до температуры дефлегмации или химическим восстановлением с помощью, например, гидрида металла, например алюминий-гидрида натрия, в растворителе, таком как эфир, например циклический эфир, такой как тетрагидрофуран, при температуре от 0 С до температуры дефлегмации. В другом примере атомы серы в соединениях, например, если они присутствуют в группах L1 или 2L , могут быть окислены до соответствующего сульфоксида или сульфона с помощью окисляющего агента, такого как пероксикислота, например 3-хлорпероксибензойная кислота, в инертном растворителе,таком как галогенированный углеводород, например дихлорметан, при примерно комнатной температуре. В другом примере N-оксиды соединений формулы (1) могут быть, в общем, получены, например,окислением соответствующего азотсодержащего основания, как описано выше в отношении получения промежуточных соединений формулы (5). Соли соединений формулы (1) могут быть получены реакцией соединений формулы (1) с соответствующим основанием в подходящем растворителе или смеси растворителей, например органическом растворителе, таком как эфир, например диэтиловый спирт, или спирт, например этиловый спирт, согласно известным способам. При желании, чтобы получить конкретный энантиомер соединения формулы (1), это можно сделать, используя смесь энантиомеров с помощью известных методов перерастворения энантиомеров. Таким образом, диастереомерные производные, например соли, могут быть получены реакцией смеси энантиомеров формулы (1), например рацемата, и соответствующего хирального соединения, например хирального основания. Диастереомеры могут быть затем отделены с помощью известных средств, например кристаллизацией, а желаемый энантиомер выделен, например, в результате обработки кислотой в том случае, если диастереомер является солью. В другом способе растворения рацемат формулы (1) может быть выделен хиральной ВЭЖХ. Или же, при желании, конкретный энантиомер может быть получен при использовании соответствующего хирального промежуточного соединения в одном из способов, описанных выше. Альтернативно, конкретный энантиомер может быть получен осуществлением энантиомер-специфичной энзиматической биотрансформации, например эфирным гидролизом с помощью эстеразы и отделением только энантиомерно-чистой гидролизованной кислотной формы от непрореагировавшего эфирного антипода. Промежуточные или конечные продукты могут также быть подвергнуты хроматографии, рекристаллизации и другим известных процедурам разделения, если желательно получить конкретный пространственный изомер данного изобретения. Следующие примеры иллюстрируют изобретение. Все значения температуры указаны в С. Используются следующие аббревиатуры:m.р. - точка плавления, температура плавления. Все ЯМР были получены при 300 или 400 МГц. Соединениям были даны наименования с использованием средства Beilstein Autonom, поставляемого MDL Information Systems GmbH, Theodor-Heuss-Allee 108, D-60486 Frankfurt, Germany, или ACD LabsName (v.6.0), поставляемого Advanced Chemical Development, Toronto, Canada. Приводимые значения времени удерживания (RT) при LCMC были получены с помощью HewlettPackard 1100 LC/MC на основе следующего метода: Phenomenex Luna 3C18(2) 504,6 мм колонка; подвижная фаза А=0,1% муравьиной кислоты в воде; подвижная фаза В=0,1% муравьиной кислоты в MeCN; скорость течения 0,9 мл/мин, температура колонки 40 С. Градиент. При других установленных условиях LCMC (условия В): проводимые значения времени удерживания (RT) при LCMC были получены с помощью Hewlett Packard 110/ThermoFinnigan LCQ Duo LC/MC системы с использованием Electrospray Ionisation и следующего LC метода: Phenomenex Luna C18(2)5 100 мм 4,6 мм колонка; подвижная фаза А=0,08% муравьиной кислоты в виде; подвижная фаза В=0,08% муравьиной кислоты в MeCN; скорость протока 3,0 мл/мин, температура колонки 35 С. Градиент. Промежуточное соединение 1. Этил 3-аминотиено[2,3-b]пиридин-2-карбоксилат. Смесь 2-хлор-3-цианопиридина (330 г, 2,3 моль), этил-2-меркаптоацетата (361,2 г, 3,0 моль), карбоната натрия (265 г, 2,5 моль) и EtOH (1,2 л) нагревали до дефлегмации в течение 4,5 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли воду (15 л). Получившийся осадок перемешивали в течение 30 мин и затем отфильтровывали. Фильтровальную лепешку промывали двумя порциями воды (22,5 л) и сушили до постоянного веса под вакуумом при 45 С с получением вышеуказанного целевого соединения в виде твердого продукта коричневого цвета (493,1 г, 93,2%). Н (CDCl3) 8,68 (1 Н, dd,J 4,7, 1,2 Гц), 7,93 (1 Н, dd, J 8,5, 1,2 Гц), 7,29 (1H, dd, J 8,5, 4,7 Гц), 5,90 (2H, b), 4,38 (2H, q, J 7,0 Гц), 1,40(3H, t, J 7,0 Гц). LCMS RT 2,9 мин, 223 (M+H)+. Промежуточное соединение 2. Этил-3-бромтиено[2,3-b]пиридин-2-карбоксилат. Промежуточное соединение (1) (363,6 г) добавляли порциями в течение 2 ч к смеси бромида меди(II) (403,3 г), трет-бутилнитрита (220,6 г) и ацетонитрила (3,6 л) и перемешивали при температуре от- 21010297 20 до 25 С. Смесь перемешивали при 20 С прежде, чем ее медленно добавляли к 2 М HCl (вод.) (4,2 л). Реакционную смесь вместе с осадком профильтровали и плотный осадок промыли водой (500 мл). Объединенный фильтрат экстрагировали этилацетатом (8 л); этот этилацетатный раствор промыли 2 М HCl(вод.) (2,2 л). Осадок растворили в этилацетате (6 л); этот раствор промыли дважды 2 М HCl (вод.) (4,4 и 2,2 л). Два этилацетатных раствора были затем объединены и промыты 2 М HCl (вод.) (2,2 л) и дважды водой (22 л). Раствор этилацетата был затем высушен (MgSO4), отфильтрован и сконцентрирован в вакууме при 40 мбар и 60 С с получением твердого остатка. Его измельчали и доводили до постоянного веса под вакуумом при 45 С с получением вышеуказанного целевого соединения в виде твердого продукта коричневого цвета (458,5 г, 97,9%). Н (DMSO-d6) 8,89 (1 Н, d, J 4,7 Гц), 8,47 (1 Н, dd, J 8,6 Гц), 7,71(1H, dd, J 8,6, 4,7 Гц), 4,46 (2H, q, J 7,2 Гц), 1,40 (3H, t, J 7,2 Гц). LCMS RT 3,8 мин, 288 (M+H)+. Промежуточное соединение 3. N-оксид этил 3-бромтиено[2,3-b]пиридин-2-карбоксилата. К осадку промежуточного соединения 2 (214 г, 0,747 моль) в DCM (2140 мл) под азотом добавили 70% mCPBA (240 г, 0,97 моль), порциями, в течение 0,5 ч. Реакционную смесь затем перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь гасили водой (800 мл) и доводили рН до 8,5 10% вес./об. раствором карбоната натрия (1250 мл). Нижний водный слой удаляли, а органический слой промыли водой до достижения рН 7. Органический слой концентрировали под вакуумом и неочищенный целевой продукт выделили в виде твердого продукта рыже-коричневого цвета. Этот грубый продукт очищали, отстаивая его в МТВЕ (600 мл) в течение 1 ч при 0-5 С, с получением указанного целевого продукта (174 г, 77%). Н (CDCl3) 8,44 (1H, dd, J 6,2, 0,8 Гц), 7,87 (1 Н, dd, J 8,3, 0,8 Гц), 7,48 (1H, dd, J 8,3,6,2 Гц), 4,49 (2H, q, J 7,1 Гц), 1,48 (3H, t, J 7,1 Гц). LCMS (ES+) RT 2,61 мин, 302 (M+H)+. Промежуточное соединение 4. Этил-3-бром-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. К суспензии промежуточного соединения 3 (95 г, 0,32 моль) в DMF (950 мл), перемешиваемой при комнатной температуре, добавили трифторуксусный ангидрид (198 г, 131 мл, 0,94 моль) по каплям в течение 30 мин (наблюдалась слабая экзотермическая реакция). По завершении добавления реакционную смесь перемешивали еще 45 мин при комнатной температуре. Избыток трифторуксусного ангидрида удаляли под вакуумом и реакционную смесь концентрировали приблизительно до половины исходного объема. Полученный темноокрашенный раствор влили потом в смесь воды (1 л) и толуола (900 мл). Смесь оставили для отстаивания в течение примерно 10 мин, затем фильтрованием отделяли осадок. Этот осадок промыли толуолом (350 мл) и затем высушили в вакуумной печи при 50-60 С. Это привело к получению целевого продукта в виде твердого вещества бежевого цвета (68,5 г, 72,1%). Н (DMSO-d6) 12,20 (1 Н, brs), 7,75 (1 Н, d, J 9,0 Гц), 6,50 (1 Н, d, J 9,0 Гц), 4,15 (2H, q, J 7,1 Гц), 1,12 (3H, t, J 7,1 Гц).LCMS (ES+) RT 2,86 мин, 302 (M+H)+. Т.пл. 261,7-268,1 С. Промежуточное соединение 5. Этил 3-бром-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Метод А. В 3 л аппарат с рубашкой загрузили промежуточное соединение 4 (100 г, 0,332 моль), CuI (15,8 г,0,083 моль), фенилборную кислоту (80 г, 0,664 моль), пиридин (104 г, 1,32 моль) и ацетонитрил (2,0 л),смесь перемешивали при 40 С. Воздух под давлением непрерывно пропускали через реакционную смесь в течение 6 ч. Затем подача воздуха была отключена и реакционную смесь оставили при перемешивании и температуре 40 С на ночь. На следующий день весь процесс повторили. Спустя примерно 36 ч ВЭЖХ показала 97% конверсию исходного материала в продукт. Полученную темную реакционную смесь выливали в смесь воды (1,2 л) и концентрированной соляной кислоты (300 мл). Эту смесь экстрагировали дихлорметаном (21,5 л) и объединенный органический слой промывали 2 М HCl (вод.) (21,5 л). Органический слой отделили, пропустили через слой MgSO4 и сконцентрировали в вакууме. Грубый остаток перекристаллизовывали из толуола (600 мл) и получили целевое соединение в виде твердого продукта бежевого цвета (93,85 г, 75,0%). Н (CDCl3) 7,82 (1 Н, d, J 8,5 Гц), 7,70-7,62 (3 Н, m), 7,54-7,42 (2 Н, m),6,70 (1 Н, d, J 8,5 Гц), 4,15 (2H, q, J 7,1 Гц), 1,14 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,75 мин, 378 (M+H)+. Т.пл.=201,6-206,0C. Метод В (альтернативный способ). В двугорлую круглодонную колбу добавили последовательно промежуточное соединение 4 (302 мг,1,0 ммоль), ацетат меди(II) (278 мг, 1,50 ммоль), фенилборную кислоту (488 мг, 4,00 ммоль), DCM (5 мл) и пиридин (158 мг, 2,00 ммоль). Реакционую смесь перемешивали при комнатной температуре в течение 18 ч с недопущением влаги. Реакционную смесь потом разбавили DCM (50 мл), промыли 2 М HCl (вод.)(50 мл), воду реэкстрагировали DCM (50 мл). Объединенная органическая фаза была промыта водой (50 мл),высушена (MgSO4) и сконцентрирована в вакууме. Грубый продукт был очищен разбалтыванием в метаноле (12 мл) с получением целевого соединения в виде твердого продукта бежевого цвета (270 мг, 72%). Н (CDCl3) 7,82 (1 Н, d, J 8,5 Гц), 7,70-7,62 (3H, m), 7,54-7,42 (2 Н, m), 6,70 (1 Н, d, J 8,5 Гц), 4,15 (2H, q, J 7,1 Гц), 1,14 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,75 мин, 378 (M+H)+. Промежуточное соединение 6. Этил 3-бром-7-(4-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. В колбу загрузили промежуточное соединение 4 (15,1 г, 0,05 моль), ацетат меди(II) (13,62 г, 0,075 мл),- 22010297 4-толилборную кислоту (14,0 г, 0,1 моль), DCM (500 мл) и пиридин (25 мл, 0,3 моль) и смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь промыли 2 М HCl (2200 мл), 5%NaOH (вод.) (200 мл), рассолом (200 мл) и высушили (MgSO4). Растворитель удалили под вакуумом и полученный твердый продукт растерли в порошок с метанолом, получили целевое соединение в твердом виде (15,7 г). Н (CDCl3) 7,76 (1 Н, d, J 9,7 Гц), 7,33 (2 Н, d, J 8,3 Гц), 7,18 (2H, d, J 8,3 Гц), 6,64 (1H, d, J 9,7 Гц), 4,24 (2H, q, J 7,1 Гц), 2,39 (3H, s), 1,26 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,86 мин, 394 (M+H)+. Промежуточное соединение 7. Этил 3-бром-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Из промежуточного соединения 4 и 4-фторфенилборной кислоты способом для промежуточного соединения 6. Белый твердый продукт. Н (CDCl3) 7,84 (1 Н, d, J 9,7 Гц), 7,41-7,37 (2 Н, m), 7,32-7,25 (2 Н,m), 6,72 (1 Н, d, J 9,7 Гц), 4,33 (2H, q, J 7,1 Гц), 1,34 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,729 мин, 397,8(M+H)+. Промежуточное соединение 8. Этил 3-бром-7-(4-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Из промежуточного соединения 4 и 4-хлорфенилборной кислоты способом для промежуточного соединения 6. Н (CDCl3) 7,86 (1 Н, d, J 9,6 Гц), 7,60 (2 Н, d, J 8,5 Гц), 7,37 (2H, d, J 8,5 Гц), 6,74 (1H, d, J 9,6 Гц),4,35 (2H, q, J 7,1 Гц), 1,36 (3H, t, J 7,1 Гц). LCMS (ES+) RT 3,937 мин, 413 (M+H)+. Промежуточное соединение 9. Этил 3-бром-7-(3-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Из промежуточного соединения 4 и 3-метилфенилборной кислоты способом для промежуточного соединения 6. Н (CDCl3) 7,85 (1 Н, d, J 9,6 Гц), 7,51-7,48 (1 Н, m), 7,38-7,27 (1H, m), 7,29 (2H, br m), 6,75(M+H)+. Промежуточное соединение 11. Этил 3-бром-7-(циклопропилметил)-6-оксо-6,7-дигидротиено-[2,3b]пиридин-2-карбоксилат. Гидрид натрия (60% в минеральном масле) (3,27 г, 81,4 ммоль) добавляли порциями к раствору промежуточного соединения 4 (22,3 г, 74 ммоль) в DMF (300 мл) при 0 С. Смесь перемешивали при комнатной температуре в течение 30 мин, затем медленно добавили циклопропилметилбромид (10 г, 74 ммоль) и смесь прогревали при 60 С в течение ночи. DMF удалили в вакууме и остаток разделили между EtOAc и рассолом. Органическую фазу высушили (MgSO4) и сконцентрировали в вакууме. Очистка колоночной хроматографией (диоксид кремния, 0-10% EtOAc в DCM) привела к получению целевого соединения в виде твердого продукта желтого цвета (12,5 г, 47%). Н (CDCl3) 7,57 (1 Н, d, J 9,5 Гц), 6,47 (1 Н, d, J 9,5 Гц),4,22 (2H, q, J 7,0 Гц), 3,87 (2H, d, J 7,1 Гц), 1,26-1,19 (4H, m), 0,43-0,37 (4H, m). LCMS (ES+) RT 3,80 мин,357 (M+H)+. Промежуточное соединение 12. Этил 3-[(4-фтор-3-метилфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Промежуточное соединение 5 (1,00 г, 2,64 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,121 г,0,132 ммоль) и BINAP (0,164 г, 0,264 ммоль) перемешивали в толуоле (12 мл) в течение 5 мин. 4-Фтор-3 метиланилин (0,397 г, 3,172 ммоль) и карбонат цезия (1,205 г, 3,701 ммоль) добавили к реакционной смеси и нагревали ее при температуре дефлегмации под азотом в течение 24 ч. Эту смесь растворили в THF(100 мл) и промыли водой. Объединенную органическую фазу высушили (Na2SO4) и сконцентрировали в вакууме, остаток растерли в порошок в МеОН с получением целевого соединения в виде твердого продукта белого цвета (0,754 г). Н (DMSO-d6) 8,72 (1H, s), 7,67-7,60 (3 Н, m), 7,51-7,49 (2 Н, m), 7,18-7,10LCMS (ES+) 423 (M+H)+. Промежуточное соединение 13. Этил 3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин -2-карбоксилат. трис(Дибензилиденацетон)дипалладий(0) (1,21 г, 1,32 ммоль) добавили к смеси промежуточного соединения 5 (10 г, 26,4 ммоль), карбоната цезия (12,05 г, 37,0 ммоль), 2,4-дифторанилина (4,1 г, 3,23 мл,31,7 ммоль) и BINAP (1,65 г, 2,64 ммоль) в безводном толуоле (80 мл) и реакционную смесь нагревали до дефлегмации под азотом в течение 4 дней. Реакционную смесь охлаждали, разделяли между DCM и водой и органическую фазу высушивали (MgSO4) и выпаривали в вакууме. Грубый остаток растирали с метанолом и получали указанное целевое соединение в виде твердого продукта белого цвета (9,87 г). НRT 4,06 мин, 427 (M+H)+. Основная процедура получения промежуточных соединений этил 3-анилино-6-оксо-7-фенил-6,7 дигидротиено[2,3-b]пиридин-2-карбоксилата. Промежуточные эфиры 14-26 были получены способом, аналогичным тому, который описан для промежуточного соединения 13. Таким образом, в высушенный в печи реакционный сосуд помещали магнитную мешалку, соответствующим образом замещенный анилин (1,2 экв.), безводный толуол, про- 23010297 межуточное соединение 5 (1,0 экв.), карбонат цезия (1,4 экв.), трис(дибензилиденацетон)дипалладий(0)(5 мол.%) и BINAR (10 мол.%). Реакционную смесь кипятили с обратным холодильником в азоте и с перемешиванием магнитной мешалкой в течение 24-48 ч. Каждую реакционную смесь разбавляли затемDCM, промывали водой, высушивали (MgSO4) и концентрировали в вакууме. Неочищенные продукты очищали на диоксиде кремния с элюцией градиентом EtOAc в DCM или альтернативно растиранием с метанолом или этилацетатом для получения целевых соединений в твердом виде. Промежуточное соединение 14. Этил 3-анилино-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2 карбоксилат. Из промежуточного соединения 5 и анилина получают указанное целевое соединение в виде твердого продукта белого цвета. Н (CDCl3) 8,70 (1 Н, bs), 7,57-7,47 (3 Н, m), 7,33-7,25 (4 Н, m), 7,20-7,10 (4 Н,m), 6,27 (1 Н, d, J 9,7 Гц), 4,19 (2H, q, J, 7,1 Гц), 1,22 (3H, t, J 7,1 Гц). LCMS (ES+) RT 4,10 мин, 391[2,3-b]пиридин-2-карбоксилат. Из 2-хлоранилина и промежуточного соединения 5 получают указанное целевое соединение в твердом виде. Н (CDCl3) 8,60 (1 Н, bs), 7,56-7,48 (3 Н, m), 7,40-7,38 (1 Н, m), 7,36-7,32 (2 Н, m), 7,20-7,15 (2 Н,m), 7,14-7,05 (1 Н, m), 7,05-6,98 (1 Н, m), 6,35 (1H, d, J 9,8 Гц), 4,21 (2 Н, q, J 7,1 Гц), 1,23 (3 Н, t, J 7,1 Гц).LCMS (ES+) RT 4,36 мин, 425 (M+H)+. Промежуточное соединение 16. Этил 3-[(3-цианофенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Из 3-цианоанилина и промежуточного соединения 5 получают указанное целевое соединение в виде твердого продукта белого цвета. Н (CDCl3) 8,58 (1 Н, bs), 7,61-7,43 (3 Н, m), 7,40-7,20 (6 Н, m), 7,14[2,3-b]пиридин-2-карбоксилат. Из 2-цианоанилина и промежуточного соединения 5 получают указанное целевое соединение. Н(M+H)+. Промежуточное соединение 20. Этил 3-[(3-хлор-4-фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Из промежуточного соединения 5 и 3-хлор-4-фторанилина получают указанное соединение в твердом виде. Н (CDCl3) 8,70 (1 Н, bs), 7,67-7,59 (3 Н, m), 7,44-7,41 (2 Н, m), 7,24-7,02 (4 Н, m), 6,43 (1 Н, d, J 9,8 Гц), 4,28 (2 Н, q, J 7,1 Гц). LCMS (ES+) RT 3,245 мин, 443 (M+H)+. Промежуточное соединение 22. Этил 3-[(4-фтор-3-метилфенил)амино]-7-(4-хлорфенил)-6-оксо-6,7 дигидротиено[2,3-b]пиридин-2-карбоксилат. Из промежуточного соединения 8 и 4-фтор-3-метиланилина получают указанное соединение в твердом виде. Н (CDCl3) 8,72 (1 Н, br s), 7,58-7,38 (2 Н, m), 7,35-7,28 (2 Н, m), 6,99-6,98 (4 Н, m), 6,34 (1 Н, d, J 9,8 Гц), 4,28 (2 Н, q, J 7,1 Гц), 2,29 (3 Н, s), 1,32 (3 Н, t, J 7,1 Гц). LCMS (ES+) RT 4,57 мин, 4,57 (M+H)+. Промежуточное соединение 23. Этил 3-[(4-фтор-3-метилфенил)амино]-7-(3-метилфенил)-6-оксо 6,7-дигидротиено[2,3-b]пиридин -2-карбоксилат. Из промежуточного соединения 9 и 4-фтор-3-метиланилина получают целевое соединение в твердом виде. Н (CDCl3) 8,63 (1 Н, br s), 7,40-7,15 (1 Н, m), 7,30-7,27 (1 Н, m), 7,18-7,10 (2H, m), 7,04-6,90 (4H,m), 6,27 (1H, d, J 9,7 Гц), 4,18 (2H, q, J 7,1 Гц), 2,21 (3H, s), 2,20 (3H, s), 1,21 (3H, t, J 7,1 Гц). LCMS (ES+)RT 4,469 мин, 437 (M+H)+. Промежуточное соединение 24. Этил 3-[(3-метилфенил)амино]-7-(3-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Из промежуточного соединения 9 и 3-метиланилина получают целевое соединение в твердом виде. Н (CDCl3) 8,55 (1 Н, br s), 7,32-7,28 (1 Н, m), 7,27-7,17 (1H, m), 7,08-7,00 (4H, m), 7,88-7,75 (3 Н, m), 6,15[2,3-b]пиридин-2-карбоксилат. Из промежуточного соединения 11 и анилина получают целевое соединение - твердый продукт желтоватого цвета. Н (CDCl3) 8,71 (1 Н, br s), 7,29-7,22 (2 Н, m), 7,10-6,97 (4 Н, m), 6,18 (1 Н, d, J 9,7 Гц), 4,27[2,3-b]пиридин-2-карбоксилат лития. Промежуточное соединение 12 (0,494 г, 1,170 ммоль) растворяли в EtOH/THF/H2O (2:1:1) (20 мл),- 24010297 нагревали до 80 С и обрабатывали LiOHH2O (0,054 г, 1,287 ммоль). Реакцию проводили, пока не израсходовались исходные вещества (что проверяли с помощью TLC). Растворитель удаляли под вакуумом, а остаток азеотропно обрабатывали толуолом с получением указанного целевого соединения в виде продукта бежевого цвета (0,284 г). Н (DMSO-d6) 7,81-7,75 (3 Н, m), 7,64-7,62 (2 Н, m), 7,41-7,38 (1 Н, d, J 9,55 Гц),7,20-7,15 (1 Н, t, J 9,01 Гц), 7,04-7,03 (1H, br m), 6,93-6,90 (1H, br m), 6,48-6,46 (1H, d, J 9,54 Гц), 2,35 (3H,s). LCMS (ES+) 395 (M+H)+. Промежуточное соединение 28. 3-[2,4-Дифторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3b]пиридин-2-карбоксилат лития. Указанное соединение получали из промежуточного соединения 13 (6,34 г, 14,9 ммоль) и моногидрата гидроксида лития (686 мг, 16,4 ммоль) по способу для получения промежуточного соединения 27. Н (DMSO-d6) 10,04 (1 Н, bs), 7,81 (3 Н, m), 7,69 (2 Н, m), 7,50 (1 Н, m), 7,48 (1 Н, d, J 9,6 Гц), 7,16 (2H, m),7,56 (1H, d, J 9,6 Гц). Промежуточное соединение 29. 6-Оксо-3-(фениламино)-7-фенил-6,7-дигидротиено[2,3-b]пиридин 2-карбоксилат аммония. Раствор гидроксида натрия (339 мг, 8,5 ммоль, 1,1 экв.) в воде (20 мл) добавили к суспензии промежуточного соединения 14 (3,0 г , 7,7 ммоль, 1,0 экв.) в этаноле (50 мл) и смесь нагревали с обратным холодильником в течение 2 ч. Этанол удаляли под вакуумом, а остаток обрабатывали до насыщения раствором (вод.) хлорида аммония (30 мл). Полученный твердый осадок отфильтровали, промыли водой(220 мл), Et2O (220 мл) и высушили в вакууме при комнатной температуре, получив целевое соединение с количественным выходом в виде твердого продукта белого цвета. Н (DMSO-d6) 9,60 (1 Н, bs), 7,657,57 (3 Н, m), 7,49-7,46 (2 Н, m), 7,29-7,18 (3 Н, m), 6,97-6,91 (3 Н, m), 6,34 (1 Н, d, J 9,6 Гц). LCMS (ES+) RT 3,24 мин, 363 (M+H)+. Промежуточное соединение 30. 7-(4-Хлорфенил)-3-[(4-фтор-3-метилфенил)амино]-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат натрия. Указанное соединение получали из промежуточного соединения 22 (1,0 г, 2,1 ммоль) и гидроксида натрия (100 мг, 2,6 ммоль, 1,2 экв.) по способу, аналогичному тому, что использовался для промежуточного соединения 29. Вместо обработки насыщающим раствором хлорида аммония, летучие вещества удаляли в вакууме, а остаток растирали с EtOAc с получением целевого соединения в твердом виде (800 мг). Н (DMSO-d6) 9,74 (1 Н, bs), 7,67 (2 Н, dd, J 6,6, 2,1 Гц), 7,54 (2 Н, dd, 16,6, 2,1 Гц), 7,24 (1H, d, J 9,6 Гц),7,20-7,01 (1H, m), 6,90-6,80 (1H, m), 6,85-6,75 (1H, m), 6,31 (1H, d, J 9,5 Гц), 4,68 (3H, s). LCMS (ES+) RT 3,51 мин, 429 (M+H)+. Промежуточное соединение 31. 3-[(4-Фтор-3-метилфенил)амино]-7-(3-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат натрия. Указанное соединение получали из промежуточного соединения 23 (1,0 г, 2,2 ммоль) и гидроксида натрия (183 мг, 4,4 ммоль) по способу для промежуточного соединения 30 с получением целевого соединения в твердом виде (1,0 г). Н (DMSO-d6) 7,56 (1 Н, t, J 7,7 Гц), 7,44 (1 Н, d, J 7,7 Гц), 7,38-7,24 (3H, m),7,07 (1H, t, J 9,1 Гц), 6,96-6,91 (1H, m), 6,88-6,75 (1H, m), 6,37 (1H, d, J 9,6 Гц), 2,47 (3H, s), 2,25 (3H, s). Промежуточное соединение 32. 3-[(3-Метилфенил)амино]-7-(3-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат натрия. Указанное соединение получали из промежуточного соединения 24 (1,0 г, 2,3 ммоль) и гидроксида натрия (140 мг, 3,5 ммоль) по способу для промежуточного соединения 30 с получением целевого соединения в твердом виде (842 мг). Н (DMSO-d6) 9,81 (1 Н, bs), 7,55 (1 Н, t, J 7,6 Гц), 7,47 (1 Н, d, J 12 Гц),7,42-7,24 (3H, m), 7,18 (1H, t, J 7,7 Гц), 6,80-6,75 (3H, m), 6,37 (1H, d J 9,5 Гц), 2,46 (3H, s), 2,31 (3H, s). Промежуточное соединение 33. 3-[(3-Хлор-4-фторфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат натрия. Указанное соединение получали из промежуточного соединения 20 (1,0 г, 2,2 ммоль) и гидроксида натрия (100 мг, 2,69 ммоль) по способу для промежуточного соединения 30 с получением целевого соединения в твердом виде (680 мг). Н (DMSO-d6) 9,78 (1 Н, bs), 7,61-7,59 (3 Н, m), 7,55-7,46 (2 Н, m), 7,307,24 (2 Н, m), 7,09-7,06 (1 Н, m), 6,90-6,88 (1 Н, m), 6,34 (1 Н, t, J 9,4 Гц). LCMS (ES+) RT 3,41 мин, 414EDC (0,163 г, 0,852 ммоль) добавляли к раствору промежуточного соединения 27 (0,284 г, 0,710 ммоль) в DMF (10 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Пентафторфенол(0,196 г, 1,065 ммоль) добавляли к смеси и перемешивали эту смесь при комнатной температуре в течение 24 ч. Растворитель отгоняли в вакууме, а осадок растворили в DCM, затем его промыли водой, высушили (MgSO4) и сконцентрировали в вакууме. Очистка колоночной хроматографией (диоксид кремния 50% гексан/EtOAc) привела к получению целевого соединения в виде твердого продукта белого цвета(3 Н, s). LCMS (ES+) 561 (M+H)+. Промежуточное соединение 35. Пентафторфенил-3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил-6,7- 25010297 дигидротиено[2,3-b]пиридин-2-карбоксилат. Указанное соединение получали из промежуточного соединения 28 по способу для промежуточного соединения 34 в виде твердого продукта белого цвета. Н (CDCl3) 8,66 (1 Н, bs), 7,76 (3 Н, m), 7,58 (2 Н,m), 7,47 (3 Н, m), 6,54 (1 Н, d, J 9,9 Гц). LCMS (ES+) RT 4,57 мин, 565 (M+H)+. Промежуточное соединение 36. 3-Бром-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоновая кислота. Гидроксид натрия (1,83 г, 45,8 ммоль, 1,1 экв.) добавили к суспензии промежуточного соединения 5(15,75 г, 41,6 ммоль, 1,0 экв.) в этаноле (78 мл) и воде (78 мл) при комнатной температуре. Реакционную смесь затем нагревали с обратным холодильником. Когда дефлегмация была закончена, твердый остаток перенесли в раствор, а анализ ВЭЖХ показал, что произошла полная конверсия в кислоту. Реакционную смесь затем охладили до -70 С и добавили конц. HCl (46 мл) в течение 10 мин. Реакционной смеси дали остыть до комнатной температуры и полученный твердый остаток отфильтровали, промыли водой (325 мл) и высушили в вакууме с получением целевого соединения в виде твердого продукта бежевого цвета(13,81 г, 97%). Н (DMSO-d6) 8,13 (1 Н, d, 19,6 Гц), 7,92-7,80 (3 Н, m), 7,78-7,74 (2H, m), 6,92 (1 Н, d, J 9,6 Гц). Промежуточное соединение 37. 3-Бром-7-(4-метилфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин 2-карбоновая кислота. Указанное соединение получали из промежуточного соединения 6 (16,0 г, 40,3 ммоль) по способу для промежуточного соединения 36 с получением продукта в твердом виде (13,84 г). Н (DMSO-d6) 7,85(1 Н, d, J 9,6 Гц), 7,45-7,38 (4 Н, m), 6,65 (1 Н, d, 19,6 Гц), 2,42 (3H, s). Промежуточное соединение 38. 3-Бром-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2 карбоновая кислота. Раствор моногидрата гидроксида лития (0,87 г, 20,8 ммоль) в воде (30 мл) добавили к раствору промежуточного соединения 7 (5,5 г, 13,9 ммоль) в диоксане (100 мл) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Концентрированную соляную кислоту добавляли по каплям до тех пор, пока продукт не выпал в осадок. Полученный осадок собрали, отфильтровав его, промыли его водой (230 мл), диэтиловым эфиром (230 мл) и высушили в вакуум-печи с получением целевого соединения в твердом виде (4,65 г, 91%). Н (DMSO-d6) 7,66 (1 Н, d, J 9,6 Гц), 7,43-7,38 (2 Н, m), 7,30-7,24(2 Н, m), 6,46 (1 Н, d, 19,6 Гц). Промежуточное соединение 39. 3-Бром-2[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил-7 фенилтиено[2,3-b]пиридин-6-(7H)-он. К раствору промежуточного соединения 36 (10,0 г, 28,6 ммоль) и DMF (2 капли) в THF (150 мл) добавляли оксалилхлорид (3,26 мл, 37,4 ммоль) via syringe в течение 30 мин. Реакционную смесь перемешивали еще 30 мин при комнатной температуре перед тем, как удалить растворитель и избыток реагента в вакууме, чтобы получить промежуточный хлорид кислоты (в виде твердого продукта бежевого цвета). Этот хлорид растворяли в DCM (150 мл) и добавляли в течение 45 мин к смеси (R)-2-пирролидинметанола (2,88 г, 28,5 ммоль) и триэтиламина (4,36 мл, 31,3 ммоль) в 100 мл дихлорметана. После завершения добавления реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды. Реакционную смесь выливали в воду (200 мл) и DCM слой отделяли, а водный слой реэкстрагировали DCM(100 мл). Объединенные органические слои промыли водой (200 мл), высушили (MgSO4) и подвергли выпариванию с получением целевого соединения в виде твердого продукта светло-коричневого цвета(12,83 г). H (CDCl3) 7,70 (1 Н, d, J 9,6 Гц), 7,50-7,60 (3H, m), 7,35-7,45 (2H, m), 6,75 (1H, d, J 9,6 Гц), 4,254,35 (1H, m), 4,00 (1H, br s), 3,45-3,80 (4H, m), 1,52-2,55 (4H, m). LCMS (ES+) RT 2,52 мин, 433,1 (M+H)+. Промежуточное соединение 40. 3-Бром-2-[(2R)-2-(гидроксиметил)пирролидин-1-ил]карбонил-7(4-метилфенил)тиено[2,3-b]пиридин-6(7 Н)-он. К суспензии промежуточного соединения 37 (6,4 г, 17,5 ммоль) в DCM (80 мл) добавили EDC (5,04 г,26 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 1 ч. Добавили (R)2-пирролидинметанол (2,6 мл, 26 ммоль) и перемешивали реакционную смесь в течение 18 ч при комнатной температуре. Реакционную смесь затем разбавили DCM (10 мл), промыли рассолом, высушили(MgSO4) и сконцентрировали в условиях вакуума. Грубый неочищенный остаток очистили хроматографией (диоксид кремния, 30-50% EtOAc в DCM) с получением целевого соединения в виде твердого продукта белого цвета (3,44 г, 43%). Н (CDCl3) 7,65 (1 Н, d, J 9,6 Гц), 7,37 (2 Н, d, J 8,2 Гц), 7,20-7,19 (2H, m),6,66 (1H, d, J 9,6 Гц), 4,25-4,23 (1H, m), 3,80-3,40 (4H, m), 2,37 (3H, s), 2,13-2,04 (1H, m), 1,79-1,53 (3H, m).LCMS (ES+) RT 2,92 мин, 449 (M+H)+. Промежуточное соединение 41. 3-Бром-7-(4-фторфенил)-2-[(2R)-2-(гидроксиметил)-пирролидин-1 ил]карбонилтиено[2,3-b]пиридин-6(7 Н)-он. Указанное соединение получали из промежуточного соединения 38 и (R)-2-пирролидинметанола по способу, описанному для промежуточного соединения 40, с получением продукта в твердом виде. LCMS(ES+) RT 2,83 мин, 452 (М+Н)+. Промежуточное соединение 42. 3-Бром-7-фенил-2-[(2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил] пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6-(7 Н)-он. В 1-литровую круглодонную колбу внесли промежуточное соединение 39 (12,5 г, 28,8 ммоль), дигид- 26010297 ропиран (12,1 г, 144 8 ммоль), п-толуолсульфокислоту (55 мг, 0,29 ммоль) и дихлорметан (5000 мл). Затем реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Эту реакционную смесь вылили в смесь воды (200 мл), насыщенного рассола (100 мл) и раствора бикарбоната натрия (100 мл). Слои разделились, и водный слой реэкстрагировали дихлорметаном (100 мл). Объединенные органические слои были затем промыты вышеуказанной водной смесью, высушены (MgSO4) и выпарены до сухого состояния. Очистка колоночной хроматографией (270 г диоксида кремния) с элюцией этилацетатом дала целевое соединение в виде твердого (или пенообразного) продукта светло-коричневого цвета(1H, br s), 3,35-3,80 (6H, m), 1,30-2,00 (10H, m). LCMS (ES+) RT 3,65 мин, 519,1 (M+H)+. Промежуточное соединение 43. 3-Бром-7-(4-метилфенил)-2-[(2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил]тиено[2,3-b]пиридин-6(7 Н)-он. Указанное соединение получали из промежуточного соединения 40 (3,44 г, 7,6 ммоль) по способу,используемому для промежуточного соединения 42. Это привело к получению целевого соединения в виде твердого продукта светло-коричневого цвета (4,85 г). Н (CDCl3) 7,63 (1 Н, d, J 9,6 Гц) 7,28 (2 Н, d, J 7,8 Гц), 7,17 (2H, m) 6,63 (1H, d, J 9,6 Гц), 4,48-4,28 (2H, m), 3,85-3,30 (6H, m), 2,36 (3H, s), 2,15-1,70 (7H,m), 1,48-1,46 (3H, m). LCMS (ES+) RT 3,69 мин, 533 (M+H)+. Промежуточное соединение 44. 3-Бром-7-(4-фторфенил)-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. Указанное соединение получали из промежуточного соединения 41 (1,0 г, 2,21 ммоль) по способу,используемому для промежуточного соединения 42. Получали целевое соединение в виде светло-коричневого масла (0,95 г). Н (CDCl3) 7,90 (1 Н, d, J 9,6 Гц), 7,69 (2 Н, m), 7,56 (2 Н, t, J 8,7 Гц), 6,73 (1H, d, J 9,6 Гц),4,61-4,57 (1 Н, m), 3,97-3,37 (8H, m), 1,97-1,50 (9H, m). LCMS (ES+) RT 3,51 мин, 560 (M+Na)+. Промежуточное соединение 45. 3-[(2,4-Дифторфенил)амино]-7-фенил-2-2R)-2-[(тетрагидро-2Hпиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. В сухую 500-миллиметровую двугорлую круглодонную колбу, снабженную входным отверстием для подачи и выхода азота, загрузили Cs2CO3 (11,2 г, 31,7 ммоль), (+/-)-BINAP (1,53 г, 2,46 ммоль), промежуточное соединение 42 (12,73 г, 24,6 ммоль) и Pd2(dba)3 (1,12 г, 1,22 ммоль). К этой смеси добавили безводный толуол (200 мл), который предварительно был тщательно дегазирован, и затем 2,4-дифторанилин (3,49 г, 27,0 ммоль) и реакционную смесь нагревали с обратным холодильником под азотом в течение 48 ч. Эту реакционную смесь охладили до комнатной температуры и затем влили в 1,0 М HCl (вод.)(300 мл). Она была проэкстрагирована дихлорметаном (2100 мл), а объединенный органический слой промыли 1,0 М HCl (вод.) (2300 мл), высушили (MgSO4) и сконцентрировали в вакууме с получением масла коричневого цвета. Этот грубый продукт был затем очищен колоночной хроматографией (диоксид кремния, 3:2 этилацетат:гептан) с получением целевого соединения в виде твердого продукта светложелтого цвета (7,32 г). Н (DMSO-d6) 8,75 (1 Н, s), 7,75 (1 Н, d, J 8,3 Гц), 7,70-7,60 (3 Н, m), 7,55-7,43 (2 Н,m), 7,35-7,22 (1 Н, m), 7,05-6,88 (2H, m), 6,50 (1H, d, J 9,6 Гц), 4,62 (1H, bs), 4,45-4,30 (1H, m), 3,65-2,75(6H, m), 1,90-1,20 (10H, m). LCMS (ES+) RT 3,01 мин, 566 (M+H)+. Промежуточное соединение 46. 3-[(3-Метилфенил)амино]-7-фенил-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. Вышеуказанное соединение было получено из промежуточного соединения 42 (2,5 г, 4,84 ммоль) и м-толуидина (0,62 мл, 5,8 ммоль) по способу для промежуточного соединения 45. Целевой продукт получен в виде твердого продукта оранжевого цвета (2,27 г). Н (CDCl3) 7,76 (3 Н, m), 7,66 (3 Н, m), 7,30(1 Н, m), 7,00 (3 Н, m), 6,54 (1 Н, d, J 9,7 Гц), 4,68 (1 Н, m), 4,65 (1 Н, m), 3,90-3,50 (6 Н, m), 2,46 (3 Н, s), 2,101,50 (10 Н, m). LCMS (ES+) RT 3,99 мин, 544 (М+Н)+. Промежуточное соединение 47. 3-[(3-Хлорфенил)амино]-7-фенил-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. Вышеуказанное соединение было получено из промежуточного соединения 42 (1,7 г, 3,3 ммоль) и 3-хлоранилина (0,42 мл, 3,9 ммоль) по способу для промежуточного соединения 45 с получением продукта в твердом виде коричневого цвета (900 мг). H (CDCl3) 7,66 (3 Н, m), 7,35 (3 Н, m), 7,19 (1 Н, m), 6,94(2 Н, m), 6,93 (1 Н, m), 3,75-3,36 (6 Н, m), 2,00-1,4 (10 Н, m). LCMS (ES+) RT 3,90 мин, 564 (М+Н)+. Промежуточное соединение 48. 3-[(2,4-Дифторфенил)амино]-7-(4-метилфенил)-2-2R)-2-[(тетрагидро-2 Н-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. Вышеуказанное соединение получали из промежуточного соединения 43 (1,5 г, 2,8 ммоль) и 2,4-дифторанилина (0,35 мл, 3,3 ммоль)по способу для промежуточного соединения 45 с получением продукта в твердом виде (1,14 г, 69%). Н (CDCl3) 9,33 (1 Н, bs), 7,39-7,30 (2H, m), 7,19-7,14 (3 Н, m), 6,96 (1 Н, dd, J 14,6, 9,1 Гц), 6,84 (1H, t, J 2,6 Гц), 6,73 (1H, t, J 8,2 Гц), 6,35 (1H, d, J 9,8 Гц), 4,48-4,38 (2H, m), 3,75-3,30(6H, m), 2,39 (3H, s), 1,97-1,50 (4H, m), 1,49-1,25 (6H, m). Промежуточное соединение 49. 3-[(4-Фтор-3-метилфенил)амино]-7-(4-метилфенил)-2-2R)-2[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7 Н)-он. Вышеуказанное соединение получали из промежуточного соединения 43 (1,5 г, 2,8 ммоль) и 4 фтор-3-метиланилина (0,42 мл, 3,3 ммоль) по способу для промежуточного соединения 45 с получением(3 Н, m), 6,30 (1 Н, d, J 9,8 Гц), 4,46-4,36 (2 Н, m), 3,71-3,25 (6 Н, m), 2,37 (3 Н, s), 2,15 (3 Н, s), 1,96-1,54 (6 Н,m), 1,45-1,40 (3 Н, m). LCMS (ES+) RT 4,21 мин, 576 (М+Н)+. Промежуточное соединение 50. 7-(4-Метилфенил)-3-[(3-метилфенил)амино]-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7 Н)-он. Вышеуказанное соединение получали из промежуточного соединения 43 (1,5 г, 2,8 ммоль) и м-толуидина (0,37 мл, 3,3 ммоль) по способу для промежуточного соединения 45 с получением твердого целевого продукта (1,0 г, 63%). Н (CDCl3) 9,29 (1H, m),7,30-7,19 (5H, m), 7,09 (1H, t, J 8,3 Гц), 6,78-6,76(3H, m), 6,32 (1H, d, J 9,7 Гц), 4,48-4,36 (2H, m), 3,76-3,32 (6H, m), 2,39 (3H, s), 2,23 (3H, s), 1,97-1,58 (6H,m), 1,54-1,42 (4H, m). Промежуточное соединение 51. 3-[(2,4-Дифторфенил)амино]-7-(4-фторфенил)-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7 Н)-он. Вышеуказанное соединение получали из промежуточного соединения 44 (0,48 г, 0,896 ммоль) и 2,4 дифторанилина (0,11 мл, 1,08 ммоль) по способу для промежуточного соединения 45 с получением соединения в виде твердого продукта желтого цвета (206 мг, 39%). LCMS RT 3,87 мин, 606 (M+Na)+. Промежуточное соединение 52. 3-[(4-Фтор-3-метилфенил)амино]-7-(4-фторфенил)-2-2R)-2-[тетрагидро-2H-пиран-2-алкокси)метил]пирролидин-1-илкарбонилтиено[2,3-b]пиридин-6(7H)-он. Вышеуказанное соединение было получено из промежуточного соединения 44 (0,48 г, 0,896 ммоль) и 3-метил-4-фторанилина (0,135 г, 1,08 ммоль) по способу для промежуточного соединения 45 с получением целевого продукта в твердом виде (90 мг). H (CDCl3) LCMS RT 3,94 мин, 581 (М+Н)+. Промежуточное соединение 53. 3-Амино-7-(2-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин 2-карбонитрил. Ацетонитрил (10 мл) добавили к раствору бис(триметилсилил)амида натрия (100 мл, 1,0 М в THF,100 ммоль) в THF (50 мл) при -78 С и получили плотный белый осадок. Добавили 2-хлорфенил изотиоцианат (7,72 г, 45,45 ммоль), получили раствор коричневого цвета. Смеси дали нагреться до комнатной температуры в течение 1 ч, затем разбавили EtOH (50 мл). Добавили N,N-диметилурацил (6,4 г, 45 ммоль) и нагревали смесь с обратным холодильником в течение 24 ч. Летучие вещества отогнали в вакууме, а остаток растворили в ацетонитриле (100 мл). Добавили хлорацетонитрил (2,85 мл, 45 ммоль) и нагревали смесь при 50 С в течение 1 ч, а при добавлении второй порции хлорацетонитрила (2,85 мл, 45 ммоль) нагревание продолжали еще 1,5 ч. Какое-то количество ацетонитрила (50 мл) удалили под вакуумом и к осадку продукта добавили воду. Отфильтровали твердый продукт коричневого цвета, промыли его водой(50 мл) и Et2O (50 мл), высушили с получением целевого соединения в виде твердого осадка коричневого цвета (14,3 г, колич.). H (DMSO-d6) 8,10 (1H, d, J 9,7 Гц), 7,75-7,73 (1H, m), 7,65-7,54 (3H, m), 7,14 (2H,br s, NH2), 6,54 (1H, d, J 9,7 Гц). LCMS (ES+) RT 2,97 мин, 302 (M+H)+. Промежуточное соединение 54. 3-Бром-7-(2-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2 карбонитрил. Промежуточное соединение 53 (1,17 г, 3,88 ммоль) суспендирвали в ацетонитриле (20 мл). Добавили бромид меди(II) (953 мг, 4,27 ммоль), затем трет-бутилнитрит (0,64 мл, 5,43 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч, затем разделили между 2 М HCl (вод.) (100 мл) и EtOAc(100 мл). Органический слой промыли 2 М HCl (вод.) (50 мл), 2 М NaOH (вод.) (50 мл) и водой (25 мл),высушили (Na2SO4) и сконцентрировали в вакууме. Очисткой колоночной хроматографией (диоксид кремния, от 0 до 5% EtOAc в DCM) получили целевое соединение в виде твердого продукта светло-коричневого цвета (980 мг, 67%). Н (CDCl3) 7,70 (1 Н, d, J 9,7 Гц), 7,61 (1 Н, dd, J 1,7, 7,7 Гц), 7,52-7,44 (2H,m), 7,34 (1H, dd, J 1,7, 7,7 Гц), 6,70 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,56 мин, 365 (M+H)+. Промежуточное соединение 55. 3-Бром-7-(2-хлорфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2 карбоновая кислота. Смесь промежуточного соединения 54 (1,86 г, 5,0 ммоль) в метаноле (50 мл) и 2 М водный NaOH(30 мл) нагревали с обратным холодильником в течение 1,5 ч. Летучие вещества отгоняли в вакууме, а остаток обработали 2 М водной HCl (75 мл). Эту смесь перемешивали при комнатной температуре в течение ночи до получения мелкого осадка белого цвета. Твердый осадок отфильтровали и высушили с получением целевого соединения в виде твердого продукта белого цвета (1,80 г, 92%). Н (DMSO-d6) 13,53 (1 Н, br s), 7,75 (1 Н, d, J 9,7 Гц), 7,64-7,62 (1 Н, m), 7,56-7,54 (1H, m), 7,51-7,42 (2H, m), 6,52 (1H, d, J 9,7 Гц). LCMS (ES+) RT 3,13 мин, 384 (35Cl79Br) (M+H)+. Промежуточное соединение 56. 3-Бром-7-(2-хлорфенил)-2-[(2R)-2-(гидроксиметил)пирролидин-1 ил]карбонил)тиено[2,3-b]пиридин-6(7 Н)-он. Тионилхлорид (0,66 мл, 9,1 ммоль) добавили к суспензии промежуточного соединения 55 (1,75 г,4,55 ммоль) в хлороформе (50 мл). Эту смесь нагревали при 50 С в течение 1 ч. Вторую порцию тионилхлорида (0,66 мл, 9,1 ммоль) добавили к смеси и нагревали ее при 50 С еще 1 ч, а затем подвергли перемешиванию при комнатной температуре в течение ночи и, наконец, нагревали с обратным холодильником еще в течение 1 ч с получением раствора. Летучие вещества удаляли в вакууме и остаток растворили в DCM (30 мл). Триэтиламин (0,25 мл, 9,1 ммоль) и (R)-2-пирролидинметанол (0,540 мл, 5,46 ммоль) до- 28010297 бавили к раствору, перемешиваемому при комнатной температуре в течение 3 ч. DCM (50 мл) добавили,затем промыли смесь 2 М водным раствором HCl (100 мл) и 2 М водным раствором NaOH (100 мл). Органическую фазу высушили (Na2SO4) и сконцентрировали в вакууме с получением целевого соединения в виде пенообразного продукта светло-коричневого цвета (2,15 г, колич.). Н (CDCl3) 7,70 (1 Н, d, J 9,6 Гц),7,60-7,55 (1 Н, m), 7,48-7,32 (3 Н, m), 6,66 (1 Н, d, J 9,6 Гц), 4,28-4,16 (1H, br s), 3,70-3,48 (5H, m), 2,13-2,09(1H, m), 1,92-1,81 (1H, m), 1,79-1,59 (2H, m). LCMS (ES+) RT 2,91 мин, 467 (M+H)+. Промежуточное соединение 57. 3-Бром-7-(2-хлорфенил)-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. 3,4-Дигидро-2H-пиран (2,0 мл, 22,4 ммоль) и моногидрат п-толуолсульфокислоты (45 мг, 5 мол.%) добавили к раствору промежуточного соединения 56 (2,10 г, 4,48 ммоль) в DCM (25 мл). Смесь перемешивали при комнатной температуре в течение 48 ч, затем разбавили DCM (50 мл) и промыли смесью водного раствора Na2CO3 (50 мл) и рассола (50 мл). Органическую фазу высушили (Na2SO4) и сконцентрировали в вакууме. Очисткой с помощью колоночной хроматографии (диоксид кремния, 70% EtOAc в гексане) получили целевое соединение в виде твердого продукта желтого цвета (2,08 г, 84%). Н (CDCl3) 7,69 (1 Н, m), 7,60-7,55 (1 Н, m), 7,50-7,32 (3 Н, m), 6,65 (1 Н, m), 4,50 (1 Н, br m), 4,29 (1 Н, br m), 3,70-3,31(6 Н, m), 2,06-1,80 (4 Н, m), 1,69-1,40 (6 Н, m). LCMS (ES+) RT 3,61 мин, 551 (М+Н)+. Промежуточное соединение 58. 7-(2-Хлорфенил)-3-[(4-фтор-3-метилфенил)амино]-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. Из промежуточного соединения 57 и 4-фтор-3-метиланилина способом для промежуточного соединения 45 получили твердый продукт желтого цвета. Н (CDCl3) 9,57 (1 Н, br s), 7,67-7,63 (1 Н, m), 7,547,40 (3 Н, m), 7,25 (1 Н, dd, J 1,0, 9,8 Гц), 6,95-6,85 (3 Н, m), 6,37 (1 Н, dd, J 1,0, 9,8 Гц), 4,56-4,50 (1 Н, m),4,48-4,43 (1 Н, m), 3,84-3,40 (6 Н, m), 2,24 (3 Н, s), 2,02-1,45 (10 Н, m). LCMS (ES+) RT 4,05 мин, 596(М+Н)+. Промежуточное соединение 59. 7-(2-Хлорфенил)-3-[(2,4-дифторфенил)амино]-2-2R)-2-[(тетрагидро-2H-пиран-2-илокси)метил]пирролидин-1-илкарбонил)тиено[2,3-b]пиридин-6(7H)-он. Из промежуточного соединения 57 и 24-дифторанилина способом для промежуточного соединения 45. Белый твердый продукт. Н (CDCl3) 9,45-9,40 (1 Н, m), 7,64-7,61 (1 Н, m), 7,52-7,39 (3 Н, m), 7,26 (1 Н,d, J 9,8 Гц), 7,07-7,01 (1 Н, m), 6,92-6,87 (1H, m), 6,82-6,77 (1H, m), 6,40 (1H, d, J 9,8 Гц), 4,53-4,41 (2H, m),3,81-3,37 (6H, m), 2,00-1,85 (3H, m), 1,82-1,67 (1H, m), 1,65-1,32 (6H, m). LCMS (ES+) RT 4,017 мин, 622,1(M+Na)+. Промежуточное соединение 60. 3-[(2,4-Дифторфенил)амино)]-7-фенилтиено[2,3-b]пиридин-6(7H)-он. К раствору промежуточного соединения 28 (4,20 г) в 1,4-диоксане (10 мл) добавили 2 М водный раствор HCl (10 мл) и реакционную смесь нагревали при 70 С в течение 1 ч. Реакционную смесь затем разбавили водой (30 мл), проэкстрагировали EtOAc (330 мл), EtOAc экстракты высушили (MgSO4) и сконцентрировали в вакууме. Грубый остаток был очищен хроматографией с помощью диоксида кремния (0-5% EtOAc в DCM) с получением целевого соединения в виде твердого продукта светло-желтого цвета (2,13 г). Н (CDCl3) 7,94 (1 Н, d, J 9,4 Гц), 7,64-7,53 (3 Н, m), 7,46 (2 Н, m), 7,45 (1 Н, m), 7,20 (1 Н, m),6,99 (1 Н, m), 6,48 (1 Н, d, J 9,4 Гц), 5,74 (1 Н, s). LCMS (ES+) RT 3,54 мин, 354,9 (M+H)+. Промежуточное соединение 61. трет-Бутил (2,4-дифторфенил)(6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-3-ил)карбамат. Натрий-бис(триметилсилил)амид (6,0 мл, 1,0 М в THF, 6 ммоль) добавили к раствору промежуточного соединения 60 (2,0 г, 5,65 ммоль) в THF (50 мл) при 0 С. Спустя 30 мин добавили ди-трет-бутилдикарбонат (1,36 г, 6,22 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь затем разделяли между EtOAc и рассолом. Водную фазу экстрагировали EtOAc (3), объединенные органические экстракты промывали рассолом, высушивали (MgSO4) и концентрировали в вакууме. Проводили очистку колоночной хроматографией (диоксид кремния, 10% EtOAc в DCM) и получали целевое соединение (1,2 г, 47%). Н (CDCl3) 7,45 (1 Н, d, J 9,5 Гц), 7,43-7,30 (3 Н, m), 7,22-7,19 (2 Н,m), 7,08-7,03 (1 Н, m), 6,76-6,65 (2H, m), 6,49-6,45 (2H, m), 1,26 (9H, s). LCMS (ES+) RT 3,79 мин, 455(M+H)+. Промежуточное соединение 62. трет-Бутил (2,4-дифторфенил)(2-[(2R)-2(гидроксиметил)пирролидин-1-ил]сульфонил-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-3-ил)карбамат. н-Бутил лития (0,54 мл 2,5 М раствора в гексане, 1,35 ммоль) добавили к раствору промежуточного 61 (600 мг, 1,32 ммоль) в THF (30 мл) при -78 С. Спустя 20 мин газообразный диоксид серы пропускали через раствор в течение 5 мин. Реакционной массе дали нагреться до комнатной температуры и удалили растворители под вакуумом. Остаток растворили в DCM (40 мл) и добавили N-хлорсукцинимид (210 мг,1,45 ммоль). После 90-минутного выдерживания при комнатной температуре добавили раствор (R)-2 пирролидинметанола (146 мг, 1,45 ммоль) в DCM (5 мл) и смесь перемешивали еще 30 мин. Затем смесь разбавили DCM и промыли рассолом. Органическую фазу высушили (MgSO4) и сконцентрировали в вакууме. Очистка колоночной хроматографией (диоксид кремния, 5-15% EtOAc в DCM) привела к целевому соединению (340 мг, 42%). Н (CDCl3) 7,40-7,34 (4 Н, m), 7,18-7,10 (3 Н, m), 6,74-6,67 (1 Н, m), 6,65-6,58(ES+) RT 3,55 мин, 618 (M+H)+. Промежуточное соединение 63. 3-[(2-Хлорфенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b] пиридин-2-карбоксилат натрия. Вышеуказанное соединение получали из промежуточного соединения 15 (1,5 г, 3,52 ммоль) и гидроксида натрия (150 мг) по способу для промежуточного соединения 30 с получением целевого соединения в твердом виде (1,47 г). Н (DMSO-d6) 9,97 (1 Н, bs), 9,56 (1 Н, d, J 9,6 Гц), 7,23-7,01 (2 Н, m), 7,26 (1 Н,t, J 7,0 Гц), 7,34 (1H, d, J 9,5 Гц), 7,47-7,13 (3H, m), 7,72-7,64 (3H, m). LCMS (ES+) RT 3,42 мин, 399(M+H)+. Промежуточное соединение 64. rac-трет-Бутил [1-(3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил 6,7-дигидротиено[2,3-b]пиридин-2-илкарбонил)пирролидин-3-ил]карбамат. К раствору промежуточного соединения 35 (300 мг, 0,53 ммоль) в DCM (5 мл) добавили третбутилпирролидин-3-илкарбамат (300 мг, 1,6 лмоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали в вакууме и неочищенный грубый продукт очищали колоночной хроматографией (диоксид кремния, 60% этилацетата в изогексане) с получением целевого соедиения в виде желтого смолообразного продукта (277 мг). ЯМР Н (CDCl3) 7,53 (3 Н,m), 7,19 (2 Н, m), 7,17 (1 Н, d, J 9,5 Гц), 6,98 (1 Н, m), 6,85 (1 Н, m), 6,73 (1 Н, m), 6,38 (1 Н, d, J 9,7 Гц), 4,50(1 Н, bm), 3,76 (1 Н, m), 3,61 (2 Н, m), 3,58 (1 Н, m), 2,10 (1 Н, m), 1,80 (1 Н, m), 1,35 (9 Н, s). LCMS (ES+) RT 3,50 мин, 567 (M+H)+. Промежуточное соединение 65. трет-Бутил [(3S)-1-(3-[(2,4-дифторфенил)амино]-6-оксо-7-фенил 6,7-дигидротиено[2,3-b]пиридин-2-илкарбонил)пирролидин-3-ил]карбомат. К раствору промежуточного соединения 35 (1 г, 1,77 ммоль) в DCM (30 мл) добавили трет-бутил(S)-пирролидин-3-илкарбамат (363 мг, 1,95 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали в вакууме и неочищенный продукт очищали колоночной хроматографией (диоксид кремния, этилацетат) с получением целевого соединения в виде твердого продукта белого цвета (700 мг). LCMS (ES+) RT 3,56 мин, 567 (М+Н)+. Промежуточное соединение 66. трет-Бутил [(3S)-1-(3-[(4-фтор-3-метилфенил)амино]-6-оксо-7 фенил-6,7-дигидротиено[2,3-b]пиридин-2-ил)карбонил)пирролидин-3-ил]карбамат. К раствору промежуточного соединения 34 (1,0 г, 1,79 ммоль) в DCM (30 мл) добавили трет-бутил(S)-пирролидин-3-илкарбамат (372 мг, 2,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали в вакууме и грубый неочищенный продукт очищали колоночной хроматографией (диоксид кремния, 20% EtOAc в DCM) с получением целевого соединения в виде твердого продукта белого цвета (1,2 г). NMR H (CDCl3) 9,61 (1 Н, bs), 7,65-7,55(1H, m), 1,91-1,85 (1H, m), 1,44 (9H, s). LCMS (ES+) RT 3,64 мин, 563 (M+H)+. Промежуточное соединение 67. Пентафторфенил 3-[(2-цианофенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат. Раствор моногидрата LiOH (390 мг, 9,27 ммоль) в воде (50 мл) добавили к суспензии промежуточного соединения 17 (3,5 г, 8,42 ммоль) в THF (50 мл) и EtOH (100 мл) и смесь нагревали с обратным холодильником в течение 5 ч. Растворитель удаляли под вакуумом и остаток выпаривали с толуолом (3),что позволило получить промежуточное соединение 3-[(2-цианофенил)амино]-6-оксо-7-фенил-6,7-дигидротиено[2,3-b]пиридин-2-карбоксилат лития в виде твердого продукта коричневого цвета. Этот твердый продукт растворили в DMF (100 мл) и добавили EDC (2,41 г, 12,6 ммоль). Реакционную смесь перемешивали 20 мин при комнатной температуре, прежде чем добавить пентафторфенол (2,89 г, 15,7 ммоль),затем перемешивали еще 18 ч. DMF отгоняли в вакууме, а остаток разделяли между DCM и водой. Органический слой отделяли, сушили (MgSO4) и концентрировали в вакууме. Неочищенный грубый продукт очищали колоночной хроматографией (диоксид кремния, 30-100% EtOAc в изогексане) с получением целевого соединения в твердом виде (1,35 мг). LCMS (ES+) RT 4,06 мин, 554 (М+Н)+. Промежуточное соединение 68. 3-Бром-7-(4-фторфенил)-6-оксо-6,7-дигидротиено[2,3-b]пиридин-2 карбонилхлорид. Тионилхлорид (5,2 мл, 71 ммоль) добавляли по каплям к суспензии промежуточного соединения 37(5,2 г, 14 ммоль) в толуоле (150 мл). Реакционную смесь затем нагревали с обратным холодильником в течение 3 ч, затем дали ей возможность остыть до комнатной температуры. Растворитель и остаток тионилхлорида удаляли в вакууме и полученный в твердом виде остаток выпаривали вместе с толуолом (3). Это привело к получению вышеуказанного целевого соединения в виде твердого продукта оранжевого цвета (4,9 г), который использовали без дополнительной очистки. NMR H (CDCl3) 7,77 (1 Н, d, J 9,7 Гц),7,29 (4 Н, m), 6,68 (2 Н, d, J 9,7 Гц). Промежуточное соединение 69. 3-Бром-7-(4-фторфенил)-2-[(3R)-3-гидроксипирролидин-1-ил]карбонилтиено[2,3-b]пиридин-6(7 Н)-он. К раствору промежуточного соединения 68 (2,5 мг, 6,5 ммоль) и диизопропилэтиламина (1,7 мл,9,7 ммоль) в DCM (100 мл) добавили (R)-3-гидроксипирролидин (850 мг, 9,7 ммоль) и перемешивали
МПК / Метки
МПК: A61K 31/4365, A61P 29/00, C07D 495/04
Метки: тиенопиридона, ингибиторы, производные, киназ
Код ссылки
<a href="https://eas.patents.su/30-10297-proizvodnye-tienopiridona-kak-ingibitory-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиенопиридона как ингибиторы киназ</a>
Предыдущий патент: &delta – кристаллическая форма гидрохлорида ивабрадина, способ её получения и фармацевтические композиции, которые её содержат
Следующий патент: Новые производные бензофурана, используемые для профилактики или лечения нарушений, связанных с 5-ht6-рецептором
Случайный патент: Устройство для удаления кислотности печатного материала












