Ингибиторы дпп-4 для лечения неалкогольной жировой дистрофии печени
Номер патента: 23207
Опубликовано: 31.05.2016
Авторы: Томас Лео, Марк Михаэль, Ниссен Хайко, Клайн Томас
Формула / Реферат
1. Применение ингибитора ДПП-4 формулы (I)
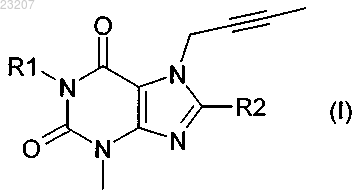
где R1 обозначает (4-метилхиназолин-2-ил)метил и R2 обозначает 3-(R)-аминопиперидин-1-ил, или его фармацевтически приемлемая соль;
для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП).
2. Применение ингибитора ДПП-4 по п.1 для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП), причем указанным ингибитором ДПП-4 является 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин.
3. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП), которая выбрана из группы, включающей гепатостеатоз, неалкогольный стеатогепатит (НАСГ) и фиброз печени.
4. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике гепатостеатоза.
5. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике неалкогольного стеатогепатита (НАСГ).
6. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике фиброза печени.
7. Применение фармацевтической композиции для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП), включающей гепатостеатоз, неалкогольный стеатогепатит (НАСГ) и/или фиброз печени, причем указанная фармацевтическая композиция включает ингибитор ДПП-4 по любому из пп.1-4, который представляет собой 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин.
8. Применение по п.7, где фармацевтическая композиция дополнительно включает метформин.
9. Применение по п.7, где фармацевтическая композиция дополнительно включает пиоглитазон.
10. Применение ингибитора ДПП-4 по любому из пп.1-4, который представляет собой 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин, для получения фармацевтической композиции, предназначенной для лечения и/или профилактики неалкогольной жировой дистрофии печени (прежде всего, диабетической НАЖДП), включающей гепатостеатоз, неалкогольный стеатогепатит (НАСГ) и/или фиброз печени.
11. Применение ингибитора ДПП-4 по п.10 для получения фармацевтической композиции, предназначенной для лечения и/или профилактики неалкогольной жировой дистрофии печени (НАЖДП)/неалкогольного стеатогепатита (НАСГ), прежде всего НАЖДП/НАСГ, связанных с диабетом.
12. Применение по п.10 или 11, где фармацевтическая композиция дополнительно включает одно или более других активных соединений, выбранных из группы, состоящей из метформина, тиазолидинонов, включая пиоглитазон, статинов, включая аторвастатин, и блокаторов рецептора ангиотензина II (ARB), включая телмисартан, такие как, например, средства для раздельного, последовательного, одновременного или поочередного введения активных ингредиентов.
13. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для лечения и/или профилактики неалкогольной жировой дистрофии печени (НАЖДП), включая гепатостеатоз, неалкогольный стеатогепатит (НАСГ) и/или фиброз печени, для использования в комбинации с одним или более активными соединениями, выбранными из группы, состоящей из метформина, тиазолидинонов, включая пиоглитазон, статинов, включая аторвастатин, и блокаторов рецептора ангиотензина II (ARB), включая телмисартан.
14. Применение по п.12 или 13, причем указанные активные соединения выбраны из группы, состоящей из метформина и пиоглитазона.
15. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике НАЖДП/НАСГ и/или заболеваний или нарушений, связанных с ними, у пациентов с диагнозом одного или более нарушений, выбранных из НАЖДП, метаболического синдрома, резистентности к инсулину, нарушенной толерантности к глюкозе, нарушенной толерантности к глюкозе натощак, избыточной массы тела, ожирения (прежде всего, висцерального и/или центрального ожирения), дислипидемии (включая гиперлипидемию, гипертриглицеридемию и/или гипоЛПВПемию), диабета (прежде всего, диабета типа 2), гипертензии, гипергликемии, гиперинсулинемии, гиперурикемии, тяжелого синдрома апноэ во сне, синдрома поликистоза яичников и хронического гепатита С.
16. Применение ингибитора ДПП-4 по п.2 для получения лекарственного средства для использования при снижении ожирения печени.
17. Применение ингибитора ДПП-4 по любому из предшествующих пунктов, где суточная пероральная доза 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина составляет 5 мг.
18. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике фиброза, выбранного из фиброза печени, легких, кожи, сердца или почек.
Текст
ИНГИБИТОРЫ ДПП-4 ДЛЯ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ ДИСТРОФИИ ПЕЧЕНИ В изобретении описано применение некоторых ингибиторов ДПП-4 для лечения и/или профилактики неалкогольной жировой дистрофии печени (НАЖДП).(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Настоящее изобретение относится к некоторым ингибиторам дипептидилпептидазы-4 (ДПП-4),предназначенным для лечения и/или профилактики неалкогольной жировой дистрофии печени(НАЖДП) и к использованию таких ингибиторов ДПП-4 для лечения и/или профилактики НАЖДП и/или связанных с ней заболеваний. Настоящее изобретение также относится к комбинациям некоторых ингибиторов ДПП-4 с другими активными соединениями для лечения и/или профилактики НАЖДП. Настоящее изобретение также относится к применению комбинаций таких ингибиторов ДПП-4 с другими активными соединениями для лечения и/или профилактики НАЖДП и к фармацевтическим композициям, предназначенным для лечения и/или профилактики неалкогольной НАЖДП, включающим ингибитор ДПП-4, как описано в настоящем контексте, необязательно в смеси с одним или более других активных соединений. Жировая дистрофия печени, связанная с метаболическими детерминантами и не связанная с воздействием алкоголя (НАЖДП), включает множество типов: от обычной жировой деградации печени до воспалительного неалкогольного стеатогепатита (НАСГ), фиброза и цирроза печени, а также в некоторых случаях до печеночно-клеточного рака. НАСГ является наиболее тяжелой формой НАЖДП, а последние данные свидетельствуют о том, что в США заболеваемость НАСГ и НАЖДП составляет от 17 до 33%. Таким образом, НАСГ и НАЖДП являются клинически важными типами хронических заболеваний печени в промышленно развитых странах (McCullough 2006). В настоящее время были предприняты попытки объяснить основные патофизиологические механизмы НАСГ и НАЖДП с помощью первой и второй теорий мишени. Первичное явление жирового стеатоза развивается в результате нарушений вне печени (например, повышение притока свободных жирных кислот, резистентность к инсулину, голодание,пониженный уровень адипонектина) или при нарушении внутри печени (например, сниженная способность к секреции ЛПОНП, сниженная скорость -окисления). Первое нарушение приводит к деградации жировой ткани печени и способствует и инициирует второе воспалительное явление. В связи с этим предполагают, что повышенный уровень реакционноспособного кислорода (РК) и повышенный уровень провоспалительных цитокинов, таких как ФНО-а, ускоряют воспалительный процесс. Значительное воздействие на развитие НАСГ и НАЖДП оказывает резистентность к инсулину у субъектов с ожирением и диабетом. Таким образом, современная терапия в основном направлена на снижение резистентности к инсулину с использованием таких сенсибилизаторов инсулина, как ТЗД (тиазолидиндион) и метформин. Получены некоторые обнадеживающие результаты в ходе предварительных клинических испытаний с использованием пиоглитазона (Promat 2004), розиглитазона (Neuschwander 2003), а также метформина(Zhou 2001). Однако терапия с использованием ТЗД связана со значительным увеличением массы тела пациента и перераспределением жира. Более того, ТЗД вызывает задержку жидкости и противопоказан пациентам с застойной сердечной недостаточностью. Длительное лечение ТЗД связано с повышенным риском переломов кости. Другие подходы к лечению НАСГ и НАЖДП уже в достаточной степени устарели и включают диету, физические упражнения и контроль массы тела. Более того, НАЖДП и, прежде всего НАСГ, связаны с повышенным риском развития дисфункции эндотелия и сердечно-сосудистых заболеваний, прежде всего через продолжительный период времени. Таким образом, существует острая необходимость в создании новых и эффективных лекарственных средств для лечения НАСГ и НАЖД. В статье Balaban и др., Annals of Hepatology, (2007) обсуждается роль экспрессии ДПП-4 у пациентов с НАСГ и интенсивность ДПП-4 при ее проявлении в ходе иммунологического анализа, которая коррелирует с гистопатологической степенью гепатостеатоза, что, таким образом, обеспечивает дополнительное доказательство для использования ингибиторов ДПП-4 в указанных целях. Фермент ДПП-4, также известный как CD26, является сериновой протеазой, расщепляющей дипептид в N-концевом фрагменте некоторых белков, содержащих в N-концевом фрагменте остаток пролина или аланина. Таким образом, ингибиторы ДПП-4 могут изменять уровень биоактивных белков в плазме,включая пептид GLP-1, и их можно рассматривать в качестве перспективных лекарственных средств для лечения сахарного диабета. Например, ингибиторы ДПП-4 и их применение описаны в заявках WO 2002/068420, WO 2004/018467, WO 2004/018468, WO 2004/018469, WO 2004/041820, WO 2004/046148, WO 2005/051950,WO 2005/082906, WO 2005/063750, WO 2005/085246, WO 2006/027204, WO 2006/029769 или WO 2007/014886, или в заявках WO 2004/050658, WO 2004/111051, WO 2005/058901 или WO 2005/097798,или в заявках WO 2006/068163, WO 2007/071738 или WO 2008/017670, или в заявках WO 2007/128721 или WO 2007/128761. Можно упомянуть следующие ингибиторы ДПП-4: Ситаглиптин (MK-0431), структурная формула А приведена ниже, (3R)-3-амино-1-[3(трифторметил)-5,6,7,8-тетрагидро-5 Н-[1,2,4]триазоло[4,3-а]пиразин-7-ил]-4-(2,4,5-трифторфенил)бутан 1-он, другое название (2R)-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)ил]-1-(2,4,5-трифторфенил)бутан-2-амин. В одном варианте ситаглиптин находится в форме дигидрофосфата, т.е. фосфата ситаглиптина. В другом варианте фосфат ситаглипина находится в безводной кристаллической форме или в форме моногидрата. В одном варианте предлагается моногидрат фосфата ситаглиптина. Ситаглиптин в форме свободного основания и его фармацевтически приемлемые соли описаны в заявке US6699871 и в заявкеWO 03/004498, пример 7. Кристаллический моногидрат фосфата ситаглиптина описан в заявках WO 2005/003135 и WO 2007/050485. Подробное описание способа получения, композиции, а также применение указанного соединения или его соли описаны в указанных документах. Таблетки, содержащие ситаглиптин, являются коммерческим продуктом с торговым названиемJanuvia. Таблетки, содержащие комбинацию ситаглиптин/метформин являются коммерческим продуктом с торговым названием Janumet. Вилдаглиптин (LAF-237), структурной формулы В, приведенной ниже, представляет собой (2S)[(3-гидроксиадамантан-1-ил)амино]ацетилпирролидин-2-карбонитрил, другое название (S)-1-[(3 гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин Вильдаглиптин подробно описан в патенте US6166063 и в заявке WO 00/34241, пример 1. Некоторые соли вильдаглиптина описаны в заявке WO 2007/019255. Кристаллическая форма вильдаглиптина,а также таблетки, содержащие вильдаглиптин, описаны в заявке WO 2006/078593. Композиции, включающие вильдаглиптин, также описаны в заявках WO 00/34241 или WO 2005/067976. Композиции, содержащие вильдаглиптин, с модифицированным высвобождением описаны в заявке WO 2006/135723. Подробное описание, например, способа получения, композиции или применения указанного соединения, описано в указанных документах. Таблетки, содержащие вильдаглиптин, являются коммерческим продуктом под торговым названиемGalvus. Таблетки, содержащие комбинацию вильдаглиптин/метформин, являются коммерческим продуктом под торговым названием Eucreas. Саксаглиптин (BMS-477118) структурной формулы С, приведенной ниже, представляет собой Саксаглиптин подробно описан в патенте US6395767 и в заявке WO 01/68603, пример 60. В одном варианте гидрохлорид или монобензоат саксаглиптина описан в заявке WO 2004/052850. В другом варианте саксаглиптин находится в форме свободного основания. В еще одном варианте моногидрат свободного основания саксаглиптина описан в заявке WO 2004/052850. Кристаллические формы гидрохлорида саксаглиптина и свободного основания саксаглиптина описаны в заявке WO 2008/131149. Способ получения саксаглиптина также описан в заявках WO 2005/106011 и WO 2005/115982. Получение таблеток саксаглиптина описано в заявке WO 2005/117841. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах. Алоглиптин (SYR-322) структурной формулы Е, приведенной ниже, представляет собой 2-(6[(3R)-3-аминопиперидин-1-ил]-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил)бензонитрил Алоглиптин описан в заявках US 2005/261271, ЕР 1586571 и WO 2005/095381. В одном варианте бензоат, гидрохлорид или тозилат алоглиптина описаны в заявке WO 2007/035629. В одном варианте настоящего изобретения предлагается бензоат алоглиптина. Полиморфные формы бензоата алоглиптина описаны в заявке WO 2007/035372. Способ получения алоглиптина описан в заявке WO 2007/112368 и, прежде всего, в заявке WO 2007/035629. Таблетки, содержащие алоглиптин (а именно его бензоат), получают и вводят, как описано в заявке WO 2007/033266. Композиции,содержащие алоглиптин в комбинации с метформином или пиоглитазоном, описаны в заявках WO 2008/093882 или WO 2009/011451 соответственно. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах.(2S)-1-[2-(5-Метил-2-фенилоксазол-4-ил)этиламино]ацетилпирролидин-2-карбонитрил или его фармацевтически приемлемая соль, предпочтительно мезилат, или (2S)-1-[1,1-диметил-3-(4-пиридин-3 илимидазол-1-ил)пропиламино]ацетилпирролидин-2-карбонитрил или его фармацевтически приемлемая соль. Указанные соединения и способы их получения описаны в заявке WO 03/037327. Мезилат указанного выше соединения, а также его кристаллические полиморфные формы описаны в заявке WO 2006/100181. Фумарат указанного соединения, а также его кристаллические полиморфные формы описаны в заявке WO 2007/071576. Получение фармацевтических композиций таких соединений описано в заявке WO 2007/017423. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах.(S)-1-2S,3S,11bS)-2-Амино-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2 Н-пиридо[2,1-а]изохинолин 3-ил)-4-фторметилпирролидин-2-он или его фармацевтически приемлемая соль Указанное соединение и способы его получения описаны в заявке WO 2005/000848. Способ получения указанного соединения (прежде всего, его дигидрохлорида) описан в заявках WO 2008/031749, WO 2008/031750 и WO 2008/055814. Получение фармацевтической композиции, содержащей указанное соединение, описано в заявке WO 2007/017423. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах.(3,3-Дифторпирролидин-1-ил)-2S,4S)-4-(4-(пиримидин-2-ил)пиперазин-1-ил)пирролидин-2 ил)метанон ил его фармацевтически приемлемая соль. Указанное соединение и способы его получения описаны в заявке WO 2005/116014 и патенте US 7291618. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах.(13S,4S)-4-Амино-1-(4-(3,3-дифторпирролидин-1-ил)-1,3,5-триазин-2-ил)пирролидин-3-ил)-5,5 дифторпиперидин-2-он или его фармацевтически приемлемая соль Указанное соединение и способы его получения описаны в заявках WO 2007/148185 и US 20070299076. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах. лидин-2-карбонитрил или его фармацевтически приемлемая соль: Указанное соединение и способы его получения описаны в заявках WO 2006/040625 и WO 2008/001195. Прежде всего, описанные соли включают метансульфонат и пара-толуолсульфонат. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах.(R)-2-[6-(3-Аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил]-4 фторбензонитрил или его фармацевтически приемлемая соль Указанное соединение, способы его получения и применения описаны в заявках WO 2005/095381,US 2007060530, WO 2007/033350, WO 2007/035629, WO 2007/074884, WO 2007/112368 и WO 2008/033851. Прежде всего, описанные соли включают сукцинат (WO 2008/067465), бензоат, бензолсульфонат, пара-толуолсульфонат, (R)-манделат и гидрохлорид. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах. бис-Диметиламид 5-(S)-2-[2-S)-2-цианопирролидин-1-ил)-2-оксоэтиламино]пропил-5-(1 Н-тетразол-5-ил)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен-2,8-дикарбоновой кислоты или его фармацевтически приемлемая соль Указанное соединение и способы его получения описаны в заявках WO 2006/116157 и US 2006/270701. Подробное описание, например, способа получения, композиции или применения указанного соединения или его соли, описано в указанных документах. Во избежание любых неопределенностей, содержание каждого из вышеупомянутых документов включено в данное описание в качестве ссылки. В настоящем изобретении неожиданно было установлено, что ингибиторы ДПП-4, как определено в данном контексте, обладают неожиданными свойствами, которые позволяют использовать их для лечения и/или профилактики (включая предотвращение, замедление, снижение интенсивности симптомов и/или обращение развития заболевания или снижение частоты или замедление развития заболевания) неалкогольной жировой дистрофии печени (НАЖДП), включая стеатоз печени, неалкогольный стеатогепатит (НАСГ) и/или фиброз печени и/или связанные с ними заболевания (такие как диабет, резистентность к инсулину, сверхпродуцирование глюкозы печенью и/или метаболический синдром) или связанные с ними заболевания (такие как, например, сердечно-сосудистые заболевания и/или атеросклероз или другие (кардио)метаболические заболевания) и, таким образом, для предотвращения цирроза печени (необратимого прогрессирующего рубцевания печени) и/или печеночно-клеточного рака. Таким образом, настоящее изобретение относится к ингибитору ДПП-4, как описано в данном контексте, и их применеию для лечения и/или профилактики НАЖДП. Кроме того, настоящее изобретение также относится к ингибитору ДПП-4, как определено в данном контексте, для применения при повышении чувствительности к инсулину. В настоящем изобретении также предлагается ингибитор ДПП-4, как определено в данном контексте, для применения при снижении продуцирования глюкозы в печени. В настоящем изобретении, кроме того, предлагается ингибитор ДПП-4, как определено в данном контексте, для лечения и/или профилактики резистентности к инсулину и/или синдрома резистентности к инсулину. В настоящем изобретении также предлагается ингибитор ДПП-4, как определено в данном контексте, для лечения и/или профилактики метаболического синдрома. В настоящем изобретении кроме того предлагается ингибитор ДПП-4, как определено в данном контексте, для лечения и/или профилактики одного или более заболеваний, связанных с метаболическим синдромом, таких как НАЖДП/НАСГ, (общее) ожирение, диабет, дислипидемия, гипертензия и/или атеросклероз, сердечно-сосудистые заболевания или нарушения. В настоящем изобретении также предлагается ингибитор ДПП-4, как определено в данном контексте, для профилактики и/или снижения риска отрицательных эффектов, наблюдаемых в ходе лечения НАЖДП/НАСГ (например, при использовании ТЗД и/или метформина). Кроме того, в настоящем изобретении предлагается ингибитор ДПП-4, как определено в данном контексте, для снижения риска дисфункции эндотелия и/или сердечно-сосудистых заболеваний или явлений, например при лечении НАЖДП/НАСГ. В настоящем изобретении также предлагается ингибитор ДПП-4, как определено в данном контексте, для снижения массы тела или профилактики роста массы тела, а также для ускорения снижения массы тела или для положительного влияния на распределение жира в организме. В настоящем изобретении также предлагается ингибитор ДПП-4, как определено в данном контексте, для лечения и/или профилактики ожирения, прежде всего, в тяжелой форме или крайне тяжелой степени (например, класс II или III), например, при ИМТ 35 или даже 40 кг/м 2 (или 30 кг/м 2 для пациентов японской национальности), прежде всего, центрального или висцерального ожирения. Настоящее изобретение, кроме того, относится к применению ингибитора ДПП-4, как определено в данном контексте, для лечения и/или профилактики (включая снижение риска развития или прогрессирования) НАЖДП/НАСГ и/или заболеваний или нарушений, связанных с ними, прежде всего, у пациентов с указанными заболеваниями или у пациентов, включенных в группу риска развития НАЖДП/НАСГ,например, у пациентов с диагнозом одного или более нарушений, выбранных из НАЖДП, метаболического синдрома, резистентности к инсулину, нарушенной толерантности к глюкозе, нарушенной толерантности к глюкозе натощак, избыточной массы тела, ожирения (например, ИМТ 25-30 кг/м 2, окружность талии 88 см (женщины) - 102 см (мужчины), и/или отношение окружности талии к окружности бедер 0,85 (женщины) - 0,9 (мужчины), прежде всего, из висцерального и/или центрального ожирения),дислипидемии (включая гиперлипидемию, прежде всего гипертриглицеридемию (например, уровень триглицеридов в крови 150 мг/дл) и/или гипоЛПВПемию (например, уровень холестерина ЛПВП в крови 40 (мужчины) - 50 мг/дл (женщины, диабета (прежде всего, диабета типа 2), гипертензии (например, 130/85 мм рт.ст.), гипергликемии, гиперинсулинемии, гиперурикемии, тяжелого синдрома апноэ во сне, синдрома поликистоза яичников и хронического гепатита С, прежде всего, у пациентов старше 45 лет. Настоящее изобретение также относится к ингибитору ДПП-4, как определено в данном контексте,для лечения и/или профилактики (включая снижение риска развития или прогрессирования) метаболических нарушений или заболеваний, прежде всего диабета (прежде всего, диабета типа 2), у пациентов,страдающих от НАЖДП/НАСГ. Более того, в другом объекте настоящего изобретения предлагается применение ингибитора ДПП-4,как определено в данном контексте, для получения лекарственного средства, одного или более следующих назначений: профилактика, замедление развития, снижение интенсивности симптомов или лечение метаболических нарушений или заболеваний, таких как сахарный диабет типа 1, сахарный диабет типа 2, нарушенная толерантность к глюкозе, нарушенная толерантность к глюкозе натощак, гипергликемия, гипергликемия после приема пищи, избыточная масса тела, ожирение, дислипидемия, гиперлипидемия, гиперхолестеринемия, гипертензия, атеросклероз, дисфункция эндотелия, остеопороз, хроническое системное воспаление, ретинопатия, невропатия, нефропатия и/или метаболический синдром, - улучшение гликемического контроля и/или снижение уровня глюкозы в плазме натощак, глюкозы в плазме после принятия пищи и/или гликозилированного гемоглобина HbA1c, - профилактика, замедление, снижение интенсивности симптомов или обращение прогрессирования нарушенной толерантности к глюкозе, нарушения толерантности к глюкозе натощак, резистентности к инсулину и/или от метаболического синдрома до сахарного диабета типа 2,профилактика, снижение риска развития, замедление прогрессирования, снижение интенсивности симптомов или лечения осложнений сахарного диабета, таких как микро- и макрососудистые заболевания, такие как нефропатия, ретинопатия, невропатия, сердечно- и церебрососудистые заболевания, тканевая ишемия, диабетическая стопа или язва, атеросклероз, инфаркт миокарда, острый коронарный синдром, нестабильная стенокардия, стабильная стенокардия, окклюзивное поражение периферических артерий, кардиомиопатия, сердечная недостаточность, нарушение сердечного ритма, сосудистый рестеноз и/или инсульт. снижение массы тела или предотвращение роста массы тела или ускорение снижения массы тела,профилактика, замедление, снижение интенсивности симптомов или лечение дегенерации -клеток поджелудочной железы и/или снижение функционирования -клеток поджелудочной железы и/или для улучшения и/или восстановления функционирования -клеток поджелудочной железы и/или стимуляции и/или восстановления функциональности секреции инсулина поджелудочной железой,снижение риска развития отрицательных побочных эффектов, связанных с обычным (пероральным) введением антигипергликемических лекарственных средств и/или поддержание и/или улучшение чувствительности к инсулину и/или лечение или профилактика гиперинсулинемии и/или резистентности к инсулину,прежде всего, у пациентов, страдающих от НАЖДП, необязательно в комбинации с одним или более активных соединений, таких как, например, любое из соединений, как описано в данном контексте. Более того, в настоящем изобретении предлагается ингибитор ДПП-4, как описано в данном контексте, для лечения и/или профилактики фиброза, например фиброза печени, легких, кожи, сердца или почек. Настоящее изобретение также относится к применению ингибитора ДПП-4, как описано в данном контексте, для получения фармацевтической композиции, предназначенной для лечения и/или профилактики описанных в данном контексте заболеваний, прежде всего, профилактики НАЖДП. Настоящее изобретение также относится к фиксированной или нефиксированной комбинации,включающей набор компонентов для лечения и/или профилактики указанных заболеваний, прежде всего для профилактики НАЖДП, причем указанная комбинация содержит ингибитор ДПП-4, как описано в данном контексте, и необязательно одно или более других активных соединений, например, любое из описанных в данном контексте, прежде всего, метформин или пиоглитазон или блокатор рецепторов ангиотензна (например, телмисартан). Настоящее изобретение также относится к применению ингибитора ДПП-4, как описано в данном контексте, в комбинации с одним или более другим активным соединением, например, с любым из упомянутых в данном контексте, прежде всего, с метформином или блокатором рецептора ангиотензина(например, телмисартаном), для получения фармацевтической композиции, предназначенной для лечения и/или профилактики описанных в данном контексте заболеваний, прежде всего, НАЖДП. Настоящее изобретение также относится к фармацевтической композиции для лечения и/или профилактики описанных в данном контексте заболеваний, прежде всего, НАЖДП (прежде всего, диабетической НАЖДП), причем указанная фармацевтическая композиция содержит ингибитор ДПП-4, как описано в данном контексте, и необязательно один или более других активных соединений, например, любое из описанных в данном контексте, прежде всего, метформин или пиоглитазон или блокатор рецептора ангиотензина (например, телмисартан), например, для раздельного, последовательного, одновременного или поочередного введения активных ингредиентов. Настоящее изобретение кроме того относится к фармацевтической композиции, предназначенной для лечения и/или профилактики указанных в данном контексте заболеваний, прежде всего, НАЖДП,причем указанная композиция включает ингибитор ДПП-4, как описано в данном контексте, в качестве единственного активного ингредиента, необязательно в комбинации с одним или более другими активными соединениями, например, описанными в данном контексте, прежде всего, метформином или пиоглитазоном, или блокатором рецептора ангиотензина (таким как телмисартан) и необязательно один или более фармацевтически приемлемых носителей и/или разбавителей. Настоящее изобретение кроме того относится к способу лечения и/или профилактики указанных в данном контексте заболеваний, прежде всего, НАЖДП, причем указанный способ заключается во введении субъекту, нуждающемуся в таком лечении, (прежде всего, человеку) эффективного количества ингибитора ДПП-4, как описано в данном контексте, необязательно отдельно или в комбинации, например,раздельно, последовательно, одновременно или поочередно, вместе с эффективным количеством одного,двух или более активных соединений, таких как, например, любого из описанных в данном контексте,прежде всего, метформина или пиоглитазона или блокатора рецептора ангиотензина (например, телмисартан). В другом варианте настоящего изобретения НАЖДП включает, но не ограничиваясь только ими,гепастеатоз, неалкогольный стеатогепатит (НАСГ) и/или фиброз печени. В одном варианте осуществления настоящего изобретения НАЖДП включает неалкогольный стеатогепатит (НАСГ). В другом варианте настоящего изобретения лечение по настоящему изобретению обеспечивает улучшение одного или более гистопатологических показателей у пациента, таких как, например, портальное воспаление, гепатостеатоз, баллонирующая дегенерация и/или дольковое воспаление. Ингибитор ДПП-4 по настоящему изобретению включает, но не ограничиваясь только ими, любой ингибитор ДПП-4, описанный в данном контексте, предпочтительно перорально активные ингибиторы ДПП-4. В первом варианте осуществления настоящего изобретения (вариант А), ингибитор ДПП-4 обозначает ингибитор ДПП-4 формулы (I) где R1 обозначает ([1,5]нафтиридин-2-ил)метил, (хиназолин-2-ил)метил, (хиноксалин-6-ил)метил,(4-метилхиназолин-2-ил)метил, 2-цианобензил, (3-цианохинолин-2-ил)метил, (3-цианопиридин-2 ил)метил, (4-метилпиримидин-2-ил)метил или (4,6-диметилпиримидин-2-ил)метил, a R2 обозначает 3(R)-аминопиперидин-1-ил, (2-амино-2-метилпропил)метиламино или (2-(S)-аминопропил)метиламино или их фармацевтически приемлемая соль. Во втором варианте (вариант Б) ингибитор ДПП-4 выбран из группы, включающей ситаглиптин,вилдаглиптин, саксаглиптин, алоглиптин,(2S)-1-[2-(5-метил-2-фенилоксазол-4-ил)этиламино]ацетилпирролидин-2-карбонитрил,(2S)-1-[1,1-диметил-3-(4-пиридин-3-илимидазол-1-ил)пропиламино]ацетилпирролидин-2-карбонитрил,(S)-1-2S,3S,11bS)-2-амино-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2 Н-пиридо[2,1-а]изохинолин 3-ил)-4-фторметилпирролидин-2-он,(3,3-дифторпирролидин-1-ил)-2S,4S)-4-(4-(пиримидин-2-ил)пиперазин-1-ил)пирролидин-2-ил)метанон,(13S,4S)-4-амино-1-(4-(3,3-дифторпирролидин-1-ил)-1,3,5-триазин-2-ил)пирролидин-3-ил)-5,5 дифторпиперидин-2-он,(2S,4S)-1-2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил-4-фторпирролидин-2-карбонитрил,(R)-2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил]-4 фторбензонитрил и бис-диметиламид 5-(S)-2-[2-S)-2-цианопирролидин-1-ил)-2-оксоэтиламино]пропил-5-(1 Нтетразол-5-ил)-10,11-дигидро-5 Н-дибензо[а,d]циклогептен-2,8-дикарбоновой кислоты или их фармацевтически приемлемую соль. Согласно первому варианту (вариант А) предпочтительные ингибиторы ДПП-4 включают любые или все следующие соединения и их фармацевтически приемлемые соли: 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин (см. WO 2004/018468, пример 2(142: Указанные ингибиторы ДПП-4 отличаются от структурно родственных ингибиторов ДПП-4 тем,что они характеризуются исключительной эффективностью, продолжительным действием и благоприятными фармакологическими свойствами, селективностью к рецептору и благоприятным профилем побочных эффектов, или они обеспечивает неожиданную терапевтическую эффективность или улучшение действия в комбинации с другими фармацевтически активными соединениями. Получение таких соединений описано в цитируемых документах. Более предпочтительным ингибитором ДПП-4 из вышеупомянутых ингибиторов ДПП-4 в варианте А по настоящему изобретению является 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8(3-(R)-аминопиперидин-1-ил)ксантин, прежде всего, в форме свободного основания (другое название BI 1356). Во втором варианте (вариант В) предпочтительные ингибиторы ДПП-4 выбраны из группы, включащей саксаглиптин и алоглиптин и их фармацевтически приемлемые соли. Если не указано иное, следует понимать, что определения активных соединений (включая ингибиторы ДПП-4), упомянутых в настоящем контексте, также включают их фармацевтически приемлемые соли, а также гидраты, сольваты и полиморфные формы. Предпочтительными солями, гидратами и полиморфными формами являются упомянутые в данном контексте. Согласно варианту А используют известные способы получения ингибиторов ДПП-4. Прежде всего, ингибиторы ДПП-4 согласно варианту А по настоящему изобретению получают с использованием известных способов, описанных в литературе. Так, например, производные пурина формулы (I) можно получать, как описано в заявках WO 2002/068420, WO 2004/018468, WO 2005/085246, WO 2006/029769 или WO 2006/048427, содержание которых в полном объеме включено в настоящее описание. Производные пурина формулы (II) получают, как описано, например, в заявках WO 2004/050658 или WO 2005/110999, содержание которых в полном объеме включено в настоящее описание. Производные пурина формулы (III) и (IV) получают, как описано, например, в заявках WO 2006/068163, WO 2007/071738 или WO 2008/017670, содержание которых в полном объеме включено в настоящее описание. Получение ингибиторов ДПП-4, подробно описанных в настоящем контексте, описано в цитируемых документах. Полиморфные кристаллические модификации и композиции, содержащие отдельные ингибиторы ДПП-4, описаны в заявках WO 2007/128721 и WO 2007/128724, соответственно, содержание которых в полном объеме включено в настоящее описание. Составы, содержащие отдельные ингибиторы ДПП-4 и метформин или другие компоненты комбинации, описаны в патенте РСТ/ЕР 2009053978, содержание которого включено в настоящий контекст в полном объеме. Типичные дозы двойной комбинации BI 1356/метформин составляют 2,5/500, 2,5/850 и 2,5/1000 мг, причем каждую дозу вводят перорально один или два раза в сутки, прежде всего, два раза в сутки. Согласно варианту В используют известные способы получения ингибиторов ДПП-4, описанные в научной литературе и/или в опубликованных патентных документах, прежде всего, цитированных в данном контексте. В фармацевтике для введения теплокровным позвоночным, прежде всего человеку, соединения по настоящему изобретению обычно используют в дозах от 0,001 до 100 мг/кг массы тела, предпочтительно 0,1-15 мг/кг, в каждом случае от 1 до 4 раз в сутки. С этой целью соединения, необязательно в комбинации с другими активными соединениями, можно включать в смеси с одним или более инертных стандартных носителей и/или разбавителей, например, такими как кукурузный крахмал, лактоза, глюкоза,микрокристаллическая целлюлоза, стеарат магния, поливинилпирролидон, лимонная кислота, винная кислота, вода, вода/этанол, вода/глицерин, вода/сорбит, вода/полиэтиленгликоль, пропиленгликоль, цетилстеариловый спирт, карбоксиметилцеллюлоза или жирные соединения, такие как твердый жир или их пригодные смеси, в соответствующие галеновые препараты, такие как таблетки или таблетки с покрытием, капсулы, порошки, суспензии или суппозитории. Фармацевтические композиции по настоящему изобретению, включающие ингибиторы ДПП-4,описанные в данном контексте, получают известными специалистам в данной области техники способами с использованием фармацевтически приемлемых эксципиентов, как описано в уровне техники. Примеры таких эксципиентов включают, но не ограничиваясь только ими, разбавители, связующие, носители, наполнители, смазывающие вещества, улучшители текучести, замедлители кристаллизации, дезинтегрирующие агенты, солюбилизирующие агенты, красители, регулирующие рН агенты, ПАВ и эмульгаторы. Примеры пригодных разбавителей для соединений по настоящему изобретению в варианте А включают порошкообразную целлюлозу, гидрофосфат кальция, эритрит, гидроксипропилцеллюлозу с низкой степенью замещения, маннит, предварительно желатинизированный крахмал или ксилит. Примеры пригодных смазывающих веществ для соединений по настоящему изобретению в варианте А включают тальк, полиэтиленгликоль, бегенат кальция, стеарат кальция, гидрированное касторовое масло или стеарат магния. Примеры пригодных связующих для соединений по настоящему изобретению согласно варианту А включают коповидон (сополимер винилпирролидона и других винилпроизводных), гидроксипропилметилцеллюлозу (ГПМЦ), гидропропилцеллюлозу (ГПЦ), поливинилпирролидон (повидон), предварительно желатинизированный крахмал или гидроксипропилцеллюлозу с низкой степенью замещения (НГПЦ). Примеры пригодных дезинтегрирующих агентов для соединений по настоящему изобретению согласно варианту А включают кукурузный крахмал или кросповидон. Пригодные способы получения фармацевтических композиций, содержащих ингибиторы ДПП-4 по настоящему изобретению согласно варианту А включают прямое таблетирование из порошкообразной смеси активного соединения и пригодных эксципиентов для таблетирования,грануляцию с пригодными эксципиентами, смешивание с пригодными эксципиентами с последующим таблетированием, а также нанесением пленочного покрытия оболочкой или упаковку порошкообразных смесей или гранул в капсулы. Пригодные способы грануляции включают влажную грануляцию в смесителе с интенсивным перемешиванием с последующей сушкой в псевдоожиженном слое, грануляцию в одном реакторе, грануляцию в кипящем слое или сухую грануляцию(например, с использованием ротационного уплотнения) с пригодными эксципиентами и последующие таблетирование или упаковку в капсулы. Подробное описание лекарственных форм, композиций и введения ингибиторов ДПП-4 по настоящему изобретению приведено в научной литературе и/или опубликованных патентах, прежде всего,включенных в настоящее описание в качестве ссылок. В первом варианте настоящего изобретения (вариант А) стандартная доза ингибитора ДПП-4, описанного в данном контексте в варианте А, при внутривенном введении обычно составляет от 0,1 до 10 мг, предпочтительно от 0,25 до 5 мг, при пероральном введении от 0,5 до 100 мг, предпочтительно от 2,5 до 50 мг или от 0,5 до 10 мг, наиболее предпочтительно от 2,5 до 10 мг или от 1 до 5 мг, в каждом случае от 1 до 4 раз в сутки. Таким образом, доза 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8(3-(R)-аминопиперидин-1-ил)ксантина при пероральном введении составляет от 5 до 50 мг, от 20 до 50 мг, от 0,5 до 10 мг или от 2,5 до 10 мг или от 1 до 5 мг одному пациенту в сутки. Лекарственная форма, полученная из фармацевтической композиции, включающей ингибитор ДПП-4, описанный в данном контексте в варианте А, содержит активный ингредиент в дозе от 0,1 до 100 мг. Таким образом, например, доза 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)аминопиперидин-1-ил)ксантина составляет 0,5, 1, 2,5, 5 и 10 мг. Следует учитывать, что количество соединения по настоящему изобретению при применении для лечения и/или профилактики заболеваний может изменяться, например, в зависимости от природы или стадии заболевания или состояния, подлежащего лечению и/или профилактике. Согласно второму варианту осуществления настоящего изобретения (вариант Б) доза ингибитора ДПП-4, описанного в данном контексте в варианте В, для введения млекопитающим, например человеку,например, с массой тела приблизительно 70 кг, в общем случае составляет от приблизительно 0,5 до приблизительно 350 мг, например, от приблизительно 10 до приблизительно 250 мг, предпочтительно 20-200 мг, более предпочтительно 20-100 мг активного агента одному субъекту в сутки, или от приблизительно 0,5 до приблизительно 20 мг, предпочтительно 2,5-10 мг одному субъекту в сутки, причем дозу предпочтительно делят на 1-4 однократные отдельные дозы, например, равные дозы. Однократные дозы содержат, например, 10, 25, 40, 50, 75, 100, 150 и 200 мг активного агента, ингибитора ДПП-4. Доза ингибитора ДПП-4, ситаглиптина, обычно составляет от 25 до 200 мг активного агента. Рекомендуемая доза ситаглиптина составляет 100 мг в расчете на активный агент (свободное безводное осно- 10023207 вание) один раз в сутки. Доза безводного свободного основания ситаглиптина (активный агент в лекарственной форме) составляет 25, 50, 75, 100, 150 и 200 мг. Предпочтительная доза ситаглиптина (например, в одной таблетке) составляет 25, 50 и 100 мг. Эквивалентное количество моногидрата фосфата ситаглиптина в расчете на безводное свободное основание ситаглиптина, используемое в фармацевтических композициях, составляет 32,13, 64,25, 96,38, 128,5, 192,75 и 257 мг соответственно. Оптимизированные дозы ситаглиптина для пациентов с почечной недостаточностью составляют 25 и 50 мг. Типичные дозы двойной комбинации ситаглиптин/метформин составляют 50/500 и 50/1000 мг, каждую из которых можно вводить перорально один или два раза в сутки, прежде всего, дважды в сутки. Интервал доз ингибитора ДПП-4, вилдаглиптина, обычно составляет от 10 до 150 мг в сутки, прежде всего, от 25 до 150 мг, от 25 до 100 мг или от 25 до 50 мг или от 50 до 100 мг в сутки. Типичные примеры суточных пероральных доз составляют 25, 30, 35, 45, 50, 55, 60, 80, 100 или 150 мг. В более предпочтительном объекте суточная доза вилтаглиптина составляет от 25 до 150 мг или от 50 до 100 мг. В другом более предпочтительном объекте суточная доза вилтаглиптина составляет от 50 до 100 мг. Введение активного ингредиента можно проводить до трех раз в сутки, предпочтительно один или два раза в сутки. Предпочтительная доза составляет 50 или 100 мг вилдаглиптина. Типичная доза двойной комбинации вилдаглиптин/матформин составляет 50/850 и 50/1000 мг, каждую из которых можно вводить перорально один или два раза в сутки, прежде всего, два раза в сутки. Алоглиптин можно вводить пациенту в суточной дозе от 5 до 250 мг/сут, необязательно от 10 до 200 мг, необязательно от 10 до 150 мг и необязательно от 10 до 100 мг алоглиптина (в каждом случае в расчете на молекулярную массу алоглиптина в форме свободного основания). Таким образом, дозы, которые можно вводить, включают, но не ограничиваясь только ими, 10, 12,5, 20, 25, 50, 75 и 100 мг алоглиптина в сутки. Алоглиптин можно вводить в форме свободного основания или в виде фармацевтически приемлемой соли. Саксаглиптин можно вводить пациенту в суточной дозе от 2,5 до 100 мг/сут, необязательно от 2,5 до 50 мг. Дозы, которые можно вводить, включают, но не ограничиваясь только ими, 2,5, 5, 10, 15, 20, 30,40, 50 и 100 мг саксаглиптина в сутки. Типичная доза двойной комбинации саксоглиптин/метформин составляет 2,5/500 и 2,5/1000 мг, каждую из которых вводят перорально один или два раза в сутки, предпочтительно дважды в сутки. Отдельный вариант ингибиторов ДПП-4 по настоящему изобретению относится к перорально вводимым ингибиторам ДПП-4, проявляющим терапевтическую эффективность при введении низких доз,например, пероральная доза составляет 100 мг или 70 мг для пациента в сутки, предпочтительно 50 мг, более предпочтительно 30 или 20 мг, еще более предпочтительно от 1 до 10 мг, прежде всего от 1 до 5 мг (более предпочтительно 5 мг) для пациента в сутки (при необходимости дозу делят на 4 однократные дозы, прежде всего, на 1-2 однократные дозы, необязательно равного размера, и водят предпочтительно перорально один или два раза в сутки (более предпочтительно один раз в сутки), предпочтительно в любое время суток, во время приема пищи или в периоды между приемами пищи. Так, например, суточную пероральную дозу 5 мг BI 1356 можно вводить один раз в сутки (т.е. 5 мг BI 1356 один раз в сутки) или дважды в сутки (т.е. 2,5 мг BI 1356 дважды в сутки), в любое время суток, во время приема пищи или в периоды между приемами пищи. Прежде всего, предпочтительным ингибитором ДПП-4 по настоящему изобретению является 1-[(4 метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин (другое название BI 1356). BI 1356 характеризуется высокой эффективностью, продолжительностью действия в течение 24 ч и широким спектром терапевтического действия. При введении пациентам с диабетом типа 2 BI 1356 проявляет сопоставимую с плацебо безопасность и переносимость. В низких дозах приблизительно 5 мг BI 1356 можно использовать в качестве надежного, вводимого один раз в сутки перорального лекарственного средства, которое обеспечивает ингибирование ДПП-4 в течение всего периода 24 ч. При введении терапевтических пероральных доз BI 1356 в основном выводится через печень и лишь небольшое количество (приблизительно 7% введенной перорально дозы) выводится через почки. BI 1356 в основном выводится в неизменном виде с желчью. Доля BI 1356, выводимая через почки, лишь незначительно повышается в течение времени и при увеличении дозы, таким образом, не существует необходимости в оптимизации дозы BI 1356 в зависимости от функции почек пациента. Выведение BI 1356 не через почки в комбинации с его низкой степенью накопления и широким интервалом безопасности являются существенным преимуществом для пациентов с диабетом, которые предрасположены к почечной недостаточности и диабетической нефропатии. Так как у одного пациента часто наблюдаются различные функциональные метаболические нарушения, в большинстве случаев требуется комбинировать друг с другом различные активные агенты. Так,например, в зависимости от диагностируемого функционального нарушения, для повышения эффективности лечения можно комбинировать ингибиторы ДПП-4 с активными соединениями, которые обычно используются для лечения соответствующих нарушений, такими как, например, одно или более активных соединений, выбранных из других антидиабетических средств, прежде всего, активных соединений,снижающих уровень сахара в крови или уровень липидов в крови, повышающих уровень ЛПВП в крови,- 11023207 снижающих кровяное давление или предназначенных для лечения атеросклероза или ожирения. Более того, согласно настоящему изобретению, необязательно ингибитор ДПП-4 можно комбинировать с одним или более антиоксидантами и/или противовоспалительными агентами. Более того, согласно настоящему изобретению, необязательно ингибитор ДПП-4 можно комбинировать с одним или более агентами для защиты сосудистого эндотелия. Ингибиторы ДПП-4, описанные выше, кроме их применения в режиме монотерапии, также можно использовать в комбинации с другими активными соединениями, и в результате улучшить результаты лечения. Указанную комбинированную терапию можно проводить с использованием свободной комбинации соединений или фиксированной комбинации, например, в форме таблетки или капсулы. Фармацевтические композиции необходимых компонентов комбинации являются коммерческими фармацевтическими композициями или их можно получать известными методами. Активные соединения в виде коммерческих фармацевтических композиций описаны в многочисленных публикациях в уровне техники, например, в перечне лекарственных средств, ежегодно публикуемом в справочнике "Rote Liste" федеральной ассоциации фармацевтической промышленности или в ежегодно обновляемом справочнике лекарственных средств "Physicians' Desk Reference", в котором представлена информация фирмпроизводителей по назначению лекарственных средств. Примеры противодиабетических компонентов комбинации включают метформин, сульфонилмочевины, такие как глибенкламид, толбутамид, глимепирид, глипизид, гликвидон, глиборнурид и гликлазид,натеглинид, репаглинид, тиазолидиндионы, такие как рзиглитазон и пиоглитазон, модуляторы -PPAR,такие как метаглидазы, антагонисты -PPAR, такие как GI 262570, антагонисты -PPAR, модуляторы /PPAR, такие как тезаглитазар, мураглитазар и KRP297, модуляторы //-PPAR, активаторы АМРК, такие как AICAR, ингибиторы ацетил-КоА-карбоксилазы (АСС 1 и АСС 2), ингибиторы диацилглицеринацетилтрансферазы (DGAT), агонисты бета клеток поджелудочной железы GCRP, такие как агонисты рецепторов SMT3 и GPR119, ингибиторы 11-HSD, агонисты или аналоги FGF19, блокаторы альфаглюкозидазы, такие как акарбоз, воглибоз и миглитол, антагонисты альфа-2, инсулин и аналоги инсулина,такие как инсулин человека, инсулин лиспро, инсулин глузилин, аспартат р-ДНК-инсулин, инсулин NPH,инулин детемир, цинковая суспензия инсулина и инсулин гларгин, глюкозависимый инсулинотропный пептид (GIP), прамлинтид, амилин или GLP-1 и аналоги GLP-1, например, такие как эксендин-4, например, эксенатид, эксенатид LAR, лираглютид, таспоглютид или албиглютид, ингибиторы SGLT2, такие как KGT-1251, ингибиторы протеинтирозинфосфатазы, ингибиторы глюкоза-6-фосфатазы, модуляторы фруктоза-1,6-бисфосфатазы, модуляторы гликогенфосфорилазы, антагонисты глюкагоновых рецепторов,ингибиторы фосфоенолпируваткарбоксилкиназы (РЕРСК), ингибиторы пируватдегидрогенакиназы, ингибиторы тирозинкиназы (от 50 до 600 мг), такие как PDGF-рецепторная киназа (см. ЕР-А-564409, WO 98/35958, US 5093330, WO 2004/005281 и WO 2006/041976), модуляторы глюкокиназы/регуляторного белка, включая активаторы глюкокиназы, ингибиторы гликоген синтазакиназы, ингибиторы инозит-5 фосфатазы типа 2 (SHIP2), содержащие SH2-домен IKK, такие как салицилаты в высокой дозе, ингибиторы JNK1, ингибиторы С-тета-протеинкиназы, агонисты бета 3, такие как ритобегрон, YM 178, солабегрон, талибегрон, N-5984, GRC-1087, рафабегрон, FMP825, ингибиторы альдозаредуктазы, такие как AS 3201, зенарестат, фидарестат, эпалрестат, ранирестат, NZ-314, СР-744809 и СТ-112, ингибиторы SGLT-1 или SGLT-2, ингибиторы каналов KV 1,3, модуляторы GPR40, ингибиторы SCD-1, антагонисты CCR-2,агонисты рецептора допамина (бромокриптина мезилат/циклосет) и другие ингибиторы ДПП-4. Предпочтительный пример противодиабетического компонента комбинации включает метформин,который обычно вводят в количестве от приблизительно 250 до 3000 мг, прежде всего от 500 до 2000 мг и до 2500 мг в сутки, используя различный курс лечения, например, обычно в дозе от приблизительно 100 до 500 мг или от 200 до 850 мг (1-3 раза в сутки), или приблизительно от 300 до 1000 мг один или два раза в сутки или метформин с замедленным высвобождением в дозе от приблизительно 100 до 1000 мг или предпочтительно от 500 до 1000 мг один или два раза в сутки. Доза может составлять 250, 500, 625,750, 850 и 1000 мг гидрохлорида метформина. Другой предпочтительный пример включает пиоглитазон, обычно в дозе от приблизительно 1 до 10 мг, 15 мг, 30 мг или 45 мг один раз в сутки. Розиглитазон обычно вводят в дозе от 4 до 8 мг, один раз (или в разделенных дозах дважды) в сутки(типичная доза составляет 2, 4 и 8 мг). Глибенкламид (глибурид) обычно вводят в количестве от 2,5-5 до 20 мг, один раз (или в разделенных дозах дважды) в сутки (типичная доза составляет 1,25, 2,5 и 5 мг), или микронизированный глибенкламид в дозе от 0,75-3 до 12 мг один раз (или в разделенных дозах дважды) в сутки (типичная доза составляет 1,5, 3, 4,5 и 6 мг). Глипизид обычно вводят в дозе от 2,5 до 10-20 мг один раз (или до 40 мг в виде двух доз два раза) в сутки (типичная доза составляет 5 и 10 мг) или глипизид с замедленным высвобождением в дозе от 5 до 10 мг (до 20 мг один раз в сутки (типичная доза составляет 2,5, 5 и 10 мг). Глимепирид обычно вводят в количестве от 1-2 до 4 мг (до 8 мг) один раз в сутки (типичная доза составляет 1, 2 и 4 мг). Двойную комбинацию глибенкламид/метформин обычно вводят в дозе от 1,25/250 один раз в сутки до 10/1000 мг дважды в сутки (типичная доза составляет 1,25/250, 2,5/500 и 5/500 мг). Двойную комбинацию глипизид/метформин обычно вводят в дозе от 2,5/250 до 10/1000 мг дважды в сутки (типичная доза составляет 2,5/250, 2,5/500 и 5/500 мг). Двойную комбинацию глимепирид/метформин обычно вводят в дозе от 1/250 до 4/1000 мг дважды в сутки. Двойную комбинацию розиглитазон/глимепирид обычно вводят в дозе от 4/1 мг один или два раза в сутки до 4/2 мг дважды в сутки (типичная доза составляет 4/1, 4/2, 4/4, 8/2 и 8/4 мг). Двойную комбинацию пиоглитазон/глимепирид обычно вводят в дозе от 30/2 до 30/4 мг один раз в сутки (типичная доза составляет 30/4 и 45/4 мг). Двойную комбинацию розиглитазон/метформин обычно вводят в дозе от 1/500 до 4/1000 мг дважды в сутки (типичнаяо доза составляет 1/500, 2/500, 4/500, 2/1000 и 4/1000 мг). Двойную комбинацию пиоглитазон/метформин обычно вводят в дозе от 15/500 мг один раз в сутки до 15/850 мг три раза в сутки (типичная доза составляет 15/500 мг и 15/850 мг). Натеглинид (в отличие от лекарственных средств типа сульфанилмочевины), повышающий секрецию инсулина, обычно вводят в дозе от 60 до 120 мг во время приема пищи (до 360 мг/сут, типичная доза составляет 60 и 120 мг), репаглинид обычно вводят в дозе от 0,5 до 4 мг во время приема пищи (до 16 мг/сут, типичная доза составляет 0,5, 1 и 2 мг). Двойную комбинацию репаглинид/метформин вводят в дозе 1/500 и 2/850 мг. Акарбозу обычно вводят в дозе от 25 до 100 мг во время приема пищи (до 300 мг/сут, типичная доза составляет 25, 50 и 100 мг). Миглитол обычно вводят в дозе от 25 до 100 мг во время приема пищи (до 300 мг/сут, типичная доза составляет 25, 50 и 100 мг). Примеры компонентов комбинации, снижающих уровень липидов в крови, включают ингибиторы-PPAR, ингибиторы ацил-коэнзима А/холестеринацилтрансферазы (АСАТ, ЕС 2.3.1.26), такие как авазимиб, ингибиторы всасывания холестерина, такие как эзетимиб, вещества, связывающиеся с желчными кислотами, такие как холестирамин, колестипол и колесевелам, ингибиторы транспорта желчных кислот,активные соединения, модулирующие ЛПВП, такие как D4F, обратный D4F, активные соединения, модулирующие печеночный Х-рецептор (LXR) и активные соединения, модулирующие фарнезоидный рецептор X (FXR), ингибиторы белка переноса холестеринового эфира (iETP), такие как торцетрапиб, JTT705/далцетрапиб, анацетрапиб или соединение 12, описанное в заявке WO 2007/005572, модуляторы рецептора ЛПНП и антисмысловая РНК АроВ 100. Доза аторвастина в качестве компонента комбинации обычно составляет от 1 до 40 мг или от 10 до 80 мг один раз в сутки. Примеры компонентов комбинации, снижающих кровяное давление, включают бета-блокаторы, такие как атенолол, бисопролол, целипролол, метопролол и карведилол, диуретики, такие как гидрохлортиазид, хлорталидон, ксипамид, фуроземид, пиретанид, тораземид, спиронолактон, эплеренон, амилорид и триамтерен, блокаторы кальциевых каналов, такие как амлодипин, нифедипин, нитрендипин, низолдипин, никардипин, фелодипин, лацидипин, лерканипидин, манидипин, израдипин, нилвадипин, верапамил, галлопамил и дилтиазем, ингибиторы ангиотензинконвертирующего фермента, такие как рамиприл,лизиноприл, цилазаприл, квинаприл, каптоприл, эналаприл, беназеприл, периндоприл, фозиноприл и трандолаприл, а также блокаторы рецептора ангиотензина II (ARB), такие как телмисартан, кандесартан,валсартан, лосартан, ирбесартан, олмесартан и эпргосартан. Доза телмисартана в качестве компонента композиции обычно составляет от 20 до 320 мг или от 40 до 160 мг в сутки. Примеры компонентов комбинации, повышающих уровень ЛПВП в крови, включают ингибиторы белка-переносчика холестеринового эфира, ингибиторы липазы эндотелия, регуляторы АВС 1, антагонисты -LXR, агонисты -LXR, агонисты -PPAR-дельта, регуляторы /-LXR и соединения, повышающие экспрессию и/или концентрацию в плазме аполипопротеина A-I. Примеры компонентов комбинации для лечения ожирения включают сибутрамин, тетрагидролипстатин (орлистат), ализим, дексфенфлурамин, аксокин, антагонисты каннабиноидного рецептора 1, такие как антагонист СВ 1, римонобант, антагонисты рецептора МСН-1, агонисты рецептора МС 4, антагонисты(SCD1), ингибиторы синтазы жирных кислот (FAS), агонисты рецептора CCK, модуляторы рецептора грелина, Руу 3-36, антагонисты рецептора орексина и тезофензин. Примеры компонентов комбинации для лечения атеросклероза включают ингибиторы фосфолипазы А 2, ингибиторы тирозинкиназ (от 50 до 600 мг), такие как PDGF-рецепторная киназа (см. ЕР-А-564409,WO 98/35958, US 5093330, WO 2004/005281 и WO 2006/041976), антитела oxLDL и вакцины ОХ LDL,- 13023207 ингибиторы ароА-1 Milano, ASA и VCAM-1. Примеры компонентов комбинации в качестве антиоксидантов включают селен, бетаин, витамин С,витамин Е и бета-каротин. Пример противовоспалительного компонента комбинации включают пентоксифиллин, другой пример противовоспалительного компонента комбинации включает ингибитор фосфодиэстеразы-4 (ФДЭ-4),такой как тетомиласт, рофлумиласт или 3-[7-этил-2-(метоксиметил)-4-(5-метил-3-пиридинил)пирроло[1,2-b]пиридазин-3-ил]пропановую кислоту (или другие соединения, описанные в US 7153854, WO 2004/063197, US 7459451 и/или WO 2006/004188). Другой пример противовоспалительного компонента комбинации включает ингибитор каспазы, например,(3S)-5-фтор-3-([(5R)-5-изопропил-3-(1-изохинолинил)-4,5-дигидро-5-изоксазолил]карбониламино-4-оксопентановую кислоту (или другие соединения, описанные в WO 2005/021516 и/или WO 2006/090997). Пример защищающего сосудистый эндотелий агента включает ингибитор ФДЭ-5, такой как, например, силденафил, варденафил или тадалафил, другой пример защищающего сосудистый эндотелий агента включает донор оксида азота. Более того, в объем настоящего изобретения, необязательно дополнительно включен ингибитор ДПП-4 в комбинации с одним или более агонистов CCK-2 или гастрина, таких как, например, ингибиторы протонового насоса (включая обратимые, а также необратимые ингибиторы желудочной Н+/K+АТФазы), например, омепразол, эзомепразол, пантопразол, рабепразол или ланзопразол. Прежде всего, предпочтительным ингибитором ДПП-4 по настоящему изобретению является 1-[(4 метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин в форме свободного основания (другое название BI 1356). Объем настоящего изобретения не ограничивается отдельными вариантами, описанными в данном контексте. Различные модификации настоящего изобретения, кроме описанных в данном контексте,представляются очевидными для специалистов в данной области техники после ознакомления с настоящим описанием изобретения. Такие модификации включены в объем формулы изобретения. Все заявки, цитированные в настоящем описании, в полном объеме включены в данное описание в качестве ссылок. Другие варианты осуществления, признаки и преимущества настоящего изобретения представляются очевидными после ознакомления с приведенными ниже примерами. Примеры представлены только для иллюстрации основных принципов настоящего изобретения и/или сущности настоящего изобретения, но не ограничивают его объем. Примеры Экспериментальные модели жировой дистрофии печени у грызунов Животные и специальная диета а) Самкам мышей db/db (C57BLKS/Bom-db/db, Charles-River, Германия), в возрасте 6-7 недель в течение 8 недель вводили ингибитор ДПП-4. Животных содержали в группах по 5-6 мышей в клетках Makrolon со свободным доступом к корму и воде в следующих условиях: световой режим (свет с 6 утра до 6 вечера), комнатная температура 222 С, относительная влажность 5010%. Ингибитор ДПП-4 суспендировали в 0,5 мас.% натрозола. Однократная суточная доза при пероральном введении через зонд составляла 3 мг/кг/сут ингибитора ДПП-4 в дозе 5 мл/кг. Контрольным животным вводили 0,5 мас.% натрозол также в дозе 5 мл/кг. После завершения указанного периода (8 недель после начала лечения) у животных отбирали образцы биопсии печени. б) Самцам крыс ZDF (ZDF/Crl-leprfa) в возрасте 8-10 недель вводили ингибитор ДПП-4 один раз в сутки в течение 35 сут в дозе 3 мг/кг/сут. Вводимая доза составляла 3 мл/кг натрозола. Животных содержали в индивидуальных клетках (n=8-10) в следующих условиях: световой режим (свет с 6 ч утра до 6 ч вечера), комнатная температура 222 С, относительная влажность 5010%. в) Жировая дистрофия, индуцированная диетой. Самцов мышей C57BL/6 (C57BL/6NC, Charles River, Германия) кормили кормом с высоким содержанием жира (D12492, 60% ккал жира, 5,24 ккал/г, корм Research diets, New Brunswick, США) в возрасте 9 недель. Животные получали корм и воду в свободном доступе. Животных содержали в контролируемых условиях: световой режим (свет с 6 ч утра до 6 ч вечера). Животные получали корм с высоким содержанием жира в течение 7 недель до начала лечения. Затем животным вводили ингибитор ДПП-4 (0,110 мг/кг/сут перорально, суспендированный в 0,5% натрозоле, или носитель в течение 6 недель один раз в сутки). После голодания в течение ночи животных умерщвляли и удаляли печень для дальнейшего анализа. г) Жировая дистрофия печени, индуцированная кормом с дефицитом метионина и холина. Самцы мышей C57BL/6 (C57BL/6NC, Charles River, Германия) в ходе испытаний получали нормальный корм или корм с дефицитом метионина и холина (корм Research Diets, New Brunswick, США) и водопроводную воду в свободном доступе. Сначала все мыши в течение 1 недели карантина и акклиматизации получали нормальный корм. Затем, в возрасте 9 недель мышей без отклонений от нормы в конце срока ка- 14023207 рантина и акклиматизации рандомизировали в группы (по 8-10 мышей в группе) и лечили в течение 5 недель следующим образом: группа 1 (нормальная) получала обычный корм + носитель (0,5 мас.% натрозола), группа 2 (контрольная, диета с дефицитом метионина и холина) получала корм с дефицитом метионина и холина + носитель, группа 3 получала корм с дефицитом метионина и холина + ингибитор ДПП-4 (3 мг/кг/сут). После завершения периода испытаний у животных отбирали образцы крови из хвостовой вены и образцы печени. Гистологический анализ на воспаление и фиброз проводили аналогично тому, как описано в разделе Аутопсия и гистология. Определение содержания триглицеридов в печени Образцы для измерения уровня триглицеридов в печени получали при гомогенизации доли печени в буферном растворе для лизиса (0,5% тридециловый эфир полиоксиэтилена 10 (Sigma, Р 2393), 0,01 МNaPi, 1 мМ ЭДТУ, рН 7,4). Ткань печени предварительно нагревали в указанном буферном растворе в течение 10 мин при 95 С. После предварительной гомогенизации образцы затем обрабатывали в приборе МР Biotech (FastPrep-24), оранжевые крышки (245 с). Затем образцы центрифугировали в течение 2 мин при 3000 об/мин. Супернатант отбирали для анализа. Содержание триглицеридов определяли с использованием набора Sigma serum triglyceride (Sigma, TR 0100). Аутопсия и гистология Аутопсию проводили на животных, получавших корм в свободном доступе. Животных анастезировали препаратом 3% изофлуран/кислород (Isoba, серия J10417, Essex Pharma GmbH, 81737, Германия). Печень удаляли и фиксировали в 4% растворе параформальдегида для последующего микроскопического исследования. Липидоз печени оценивали слепым и полуколичественным методом с использованием оптического микроскопа. Срезы исследовали на кодированных предметных стеклах и все параметры (например, жировой дистрофии и воспаления) оценивали полуколичественно (степень тяжести заболевания) по следующей схеме в пятибальной системе: Оценка 1 = изменения отсутствуют Оценка 2 = минимальные изменения (поражено 5% ткани печени) Оценка 3 = средняя степень изменений (поражено 5-15% ткани печени) Оценка 4 = умеренная степень изменений (пораженно 15-25% ткани печени) Оценка 5 = тяжелая степень изменений (поражено 25% ткани печени). Оценка жировой дистрофии лечения методом ЯМР-спектроскопии Для измерения содержания липидов в печени in vivo методом ЯМР-спектроскопии, мышей C57BL/6 с индуцированной кормом жировой дистрофией печени анастезировали ингаляцией газообразной смеси 2% изофлурана в N2O/O2, (70:30, об./об.). ЯМР-спектры снимали на сканере Bruker BioSpec 47/40 (BrukerBioSpin, Ettlingen, Германия), снабженном системой градиентных катушек BGA12. Объемную катушку использовали для возбуждения, поверхностную катушку использовали для приема сигнала. Для анатомического ориентирования проводили предварительное сканирование, включающее горизонтальное и осевое ядерномагнитное изображение, с использованием последовательности импульсов градиент-эхо со следующими параметрами: передача-прием (TR) 135 мс, эхо-время (ТЕ) 3,5 мс, зона визуализации 4545 мм 2, матрица 1282, толщина среза 1,75 мм. Согласно предварительному сканированию искомый элемент изображения (VOI: 333 мм 3) расположен в левом вентральном отделе печени. Уровень липидов в искомом элементе измеряли методом ЯМР спектроскопии с использованием последовательности PRESS(спектроскопия точечного разрешения) со следующими параметрами: TR 1050 мс, ТЕ 20 мс, число усреднений 32, цифровое разрешение 1024 экспериментальные точки. Данные анализировали с использованием коммерческого программного обеспечения LCModel, S. W. Provencher. Для описанной выше модели животных в) (мыши с индуцированным кормом ожирением) получены следующие результаты для BI 1356. Мыши с индуцированным кормом ожирением в течение 2 месяцев получали корм с высоким содержанием жиров (содержание жира в печени через 29 дней в группах лечения/контроля), фиг. 1. Мыши с индуцированным кормом ожирением в течение 4 месяцев получали корм с высоким содержанием жиров (содержание жира в печени через 21 день в группах лечения/контроля), фиг. 2. Влияние на жировую дистрофию печени ингибиторов ДПП-4 по настоящему изобретению можно испытывать с использование описанных в данном контексте моделей и/или оценивать и детектировать с использованием способов, описанных в данном контексте. Влияние на различные формы фиброза можно оценивать с помощью следующих методов. Методы оценки фиброза Количественное определение специфических мРНК методом ОТ-ПЦР После разрушения и гомогенизации в буферном растворе для лизиса приблизительно 50 мг быстрозамороженной ткани, выделяли общую РНК с использованием набора RNeasy Mini-kit (Qiagen, Германия). Транскрипты коллагена типаI, TGF-1, проколлагена 1(I), TIMP-1 (тканевый ингибитор матричных металлопротеиназ 1, 2, 3, 8, 9, 13(ММР-1, ММР-2, ММР-3, ММР-8, ММР-9, ММР-13), рецептора PDGF- и -актина из клеток гладкой мускулатуры анализировали с помощью ТК-ПЦР и нормализовали по GAPDH мРНК. Проявление колла- 15023207 гена с использованием красителя Сириус красный Получали срезы ткани толщиной 5 мкм, фиксированной в формалине и залитой в парафин, и проявляли с использованием красителя Сириус красный (насыщенная пикриновая кислота в дистиллированной воде, содержащая 0,1 об./мас.% красителя Сириус красный F3B (BDH Chemicals, Англия) для визуализации фиброза печени. Все образцы из серии экспериментов контрастировали одновременно и анализировали слепым способом. Аутопсия и гистология Аутопсию проводили на животных, получавших корм в свободном доступе. Животных анастезировали препаратом 3% изофлуран/кислород (Isoba, серия J10417, Essex Pharma GmbH, 81737, Германия). Органы (печень, почки, легкие и т.п.) удаляли и фиксировали в 4% параформальдегида для последующего микроскопического анализа. Фиброз оценивали слепым и полуколичественным методом с использованием оптического микроскопа. Срезы исследовали на кодированных предметных стеклах и все параметры оценивали полуколичественно (степень тяжести заболевания) по следующей схеме в пятибальной системе: Оценка 0 = фиброз отсутствует Оценка 1 = некоторые воротные вены расширены Оценка 2 = большинство воротных вен расширено Оценка 3 = воротные вены расширены, +/- слева Оценка 4 = значительное просветление(Р-Р иР-С слева) Оценка 5 = значительное просветление, наличие узелков, неполный цирроз) Оценка 6 = цирроз, возможный или определенный 1) Ishak и др., J Hepatol 22: 696 (1995). Оценка фиброза методом магнитной резонансной эластографии Фиброз связан с повышенной жесткостью и вязкостью ткани. Вязкоэластические свойства живой ткани можно оценить методом магнитной резонансной эластографии при измерении распространения волн низкочастотного механического сдвига через ткань. Распространение волн сдвига визуализировали методом бесконтактной магнитно-резонансной томографии, по данным которой можно рассчитать параметры механических свойств ткани. В ходе доклинических испытаний было установлено, что методом магнитно-резонансной эластографии можно различать известные стадии фиброза и что полученные результаты соответствуют результатам, полученным с использованием биопсии с золотым стандартом 2. 2) Salameh и др., J. Magn. Reson. Imaging 26:956 (2007). Влияние на массу тела, фиг. 3 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ингибитора ДПП-4 формулы (I) где R1 обозначает (4-метилхиназолин-2-ил)метил и R2 обозначает 3-(R)-аминопиперидин-1-ил, или его фармацевтически приемлемая соль; для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП). 2. Применение ингибитора ДПП-4 по п.1 для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП), причем указанным ингибитором ДПП-4 является 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3(R)-аминопиперидин-1-ил)ксантин. 3. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП),которая выбрана из группы, включающей гепатостеатоз, неалкогольный стеатогепатит (НАСГ) и фиброз печени. 4. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике гепатостеатоза. 5. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике неалкогольного стеатогепатита (НАСГ). 6. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике фиброза печени. 7. Применение фармацевтической композиции для получения лекарственного средства для использования при лечении и/или профилактике неалкогольной жировой дистрофии печени (НАЖДП), включающей гепатостеатоз, неалкогольный стеатогепатит (НАСГ) и/или фиброз печени, причем указанная фармацевтическая композиция включает ингибитор ДПП-4 по любому из пп.1-4, который представляет собой 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин. 8. Применение по п.7, где фармацевтическая композиция дополнительно включает метформин. 9. Применение по п.7, где фармацевтическая композиция дополнительно включает пиоглитазон. 10. Применение ингибитора ДПП-4 по любому из пп.1-4, который представляет собой 1-[(4 метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин, для получения фармацевтической композиции, предназначенной для лечения и/или профилактики неалкогольной жировой дистрофии печени (прежде всего, диабетической НАЖДП), включающей гепатостеатоз,неалкогольный стеатогепатит (НАСГ) и/или фиброз печени. 11. Применение ингибитора ДПП-4 по п.10 для получения фармацевтической композиции, предназначенной для лечения и/или профилактики неалкогольной жировой дистрофии печени(НАЖДП)/неалкогольного стеатогепатита (НАСГ), прежде всего НАЖДП/НАСГ, связанных с диабетом. 12. Применение по п.10 или 11, где фармацевтическая композиция дополнительно включает одно или более других активных соединений, выбранных из группы, состоящей из метформина, тиазолидинонов, включая пиоглитазон, статинов, включая аторвастатин, и блокаторов рецептора ангиотензина II(ARB), включая телмисартан, такие как, например, средства для раздельного, последовательного, одновременного или поочередного введения активных ингредиентов. 13. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для лечения и/или профилактики неалкогольной жировой дистрофии печени (НАЖДП), включая гепатостеатоз, неалкогольный стеатогепатит (НАСГ) и/или фиброз печени, для использования в комбинации с одним или более активными соединениями, выбранными из группы, состоящей из метформина, тиазолидинонов, включая пиоглитазон, статинов, включая аторвастатин, и блокаторов рецептора ангиотензина II(ARB), включая телмисартан. 14. Применение по п.12 или 13, причем указанные активные соединения выбраны из группы, состоящей из метформина и пиоглитазона. 15. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике НАЖДП/НАСГ и/или заболеваний или нарушений,связанных с ними, у пациентов с диагнозом одного или более нарушений, выбранных из НАЖДП, метаболического синдрома, резистентности к инсулину, нарушенной толерантности к глюкозе, нарушенной толерантности к глюкозе натощак, избыточной массы тела, ожирения (прежде всего, висцерального и/или центрального ожирения), дислипидемии (включая гиперлипидемию, гипертриглицеридемию и/или гипоЛПВПемию), диабета (прежде всего, диабета типа 2), гипертензии, гипергликемии, гиперинсулинемии, гиперурикемии, тяжелого синдрома апноэ во сне, синдрома поликистоза яичников и хронического гепатита С. 16. Применение ингибитора ДПП-4 по п.2 для получения лекарственного средства для использования при снижении ожирения печени. 17. Применение ингибитора ДПП-4 по любому из предшествующих пунктов, где суточная пероральная доза 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1 ил)ксантина составляет 5 мг. 18. Применение ингибитора ДПП-4 по любому из пп.1, 2 для получения лекарственного средства для использования при лечении и/или профилактике фиброза, выбранного из фиброза печени, легких,кожи, сердца или почек.
МПК / Метки
МПК: A61P 21/00, A61K 31/4985, A61K 31/4439, A61K 31/5025, A61K 31/4375, A61K 31/4025, A61K 31/403, A61K 31/522, A61P 1/16, A61K 31/40, A61K 31/506, A61K 31/513
Метки: печени, неалкогольной, дпп-4, ингибиторы, дистрофии, жировой, лечения
Код ссылки
<a href="https://eas.patents.su/20-23207-ingibitory-dpp-4-dlya-lecheniya-nealkogolnojj-zhirovojj-distrofii-pecheni.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы дпп-4 для лечения неалкогольной жировой дистрофии печени</a>
Предыдущий патент: Способ и фракционирующая емкость для отделения метана от смеси природного газа
Следующий патент: Фармацевтические композиции, которые содержат имидазохинолин(амины) и их производные, пригодные для местного введения
Случайный патент: Кристаллическая форма [3-(4,5-дигидро-3-изоксазолил)-2-метил-4-(метилсульфонил)фенил]-(5-гидрокси-1-метил-1h-пиразол-4-ил)метанона












