Фармацевтические композиции, которые содержат имидазохинолин(амины) и их производные, пригодные для местного введения
Номер патента: 23208
Опубликовано: 31.05.2016
Авторы: Леони Лоренцо, Веккио Карло, Паттарино Франко, Май Роберто
Формула / Реферат
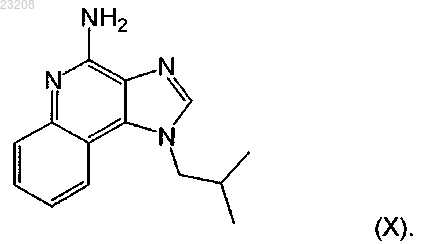
1. Применение фармацевтической композиции, которая содержит имидазохинолин(амин) и молочную кислоту, при лечении заболеваний мочевого пузыря, где имидазохинолин(амин) представляет собой имихимод, имеющий специфическую формулу 1-изобутил-1H-имидазо[4,5-с]хинолин-4-амин, выбранный из следующей формулы (X):
2. Применение фармацевтической композиции в соответствии с п.1, где фармацевтическая композиция дополнительно содержит по меньшей мере один термочувствительный агент, где по меньшей мере один термочувствительный агент выбирают из хитозана или из поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид) сополимера (также обозначается РЕО-РРО-РЕО или Poloxamer).
3. Применение фармацевтической композиции в соответствии с любым из пп.1-2, где фармацевтическая композиция содержит молочную кислоту в концентрации от 0,025 до 0,200 М, предпочтительно в концентрации от 0,025 до 0,100 М, или в концентрации от 0,100 до 0,200 М, или в концентрации от 0,075 до 0,125 М.
4. Применение фармацевтической композиции в соответствии с любым из пп.1-3, где фармацевтическая композиция содержит имидазохинолин(амин) в количестве от 0,005 до 5% (мас./об.), включая количество от 0,01 до 5% (мас./об.), количество от 0,1 до 4% (мас./об.), количество от 0,1 до 3% (мас./об.), количество от 0,2 до 2% (мас./об.), количество от 0,2 до 1% (мас./об.), количество от 0,5 до 1% (мас./об.) или количество от 0,1 до 1% (мас./об.).
5. Применение фармацевтической композиции в соответствии с любым из пп.1-4:
i) где фармацевтическая композиция дополнительно содержит один или несколько циклодекстрин(ов), выбранных из α-циклодекстринов, β-циклодекстринов, γ-циклодекстринов, δ-циклодекстринов и e-циклодекстринов, предпочтительно из β-циклодекстринов, включая гидроксипропил-β-циклодекстрин (HP-β-CD), предпочтительно содержит циклодекстрин(ы) в количестве от 0,1 до 30% (мас./об.), предпочтительно в количестве от 1 до 20% (мас./об.), предпочтительно в количестве от 2 до 20% (мас./об.), более предпочтительно в количестве от 5 до 20% (мас./об.), еще более предпочтительно в количестве от 5 до 15% (мас./об.) и наиболее предпочтительно в количестве от 10 до 15% (мас./об.) или в количестве от 2 до 6% (мас./об.), и/или
ii) где фармацевтическая композиция содержит по меньшей мере один термочувствительный агент, где по меньшей мере один термочувствительный агент выбирают из хитозана или из поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид) сополимера (также обозначается РЕО-РРО-РЕО или Poloxamer) и где по меньшей мере один термочувствительный агент проявляет специфическую "низкую критическую температуру растворения" (LCST), измеренную при атмосферном давлении в диапазоне от 15 до 35°С, более предпочтительно в диапазоне от 15 до 30°С, еще более предпочтительно в диапазоне от 15 или 20 или 25 до 30°С, наиболее предпочтительно в диапазоне от 15 или 20 до 25°С.
6. Применение фармацевтической композиции в соответствии с любым из пп.2-5, где фармацевтическая композиция содержит по меньшей мере один термочувствительный агент в количестве от 0,1 до 40% (мас./об.), предпочтительно в количестве от 2 до 30% (мас./об.), предпочтительно в количестве от 5 до 30% (мас./об.), более предпочтительно в количестве от 10 до 30% (мас./об.) и наиболее предпочтительно в количестве от 10 до 25% (мас./об.) или в количестве от 10 до 20% (мас./об.), предпочтительно, где любые два из термочувствительных агентов содержатся в фармацевтической композиции в виде смеси в соотношении от 1:20 до 20:1, включая соотношение от 1:20, 2:20, 3:30, 4:20, 5:20, 6:20, 7:20, 8:20, 9:20, 10:20, 11:20, 12:20, 13:20, 14:20, 15:20, 16:20, 17:20, 18:20, 19:20, 20:20 (= 1:1), или в соотношении от 20:20, 19:20, 18:20, 17:20, 16:20, 15:20, 14:20, 13:20, 12:20, 11:20, 10:20, 9:20, 8:20, 7:20, 6:20, 5:20, 4:20, 3:20, 2:20 или 1:20, или диапазоне, образованном любыми двумя значениями диапазона, как определено выше.
7. Применение фармацевтической композиции в соответствии с любым из пп.2-6, где по меньшей мере один термочувствительный агент представляет собой Poloxamer 407 и/или Poloxamer 188 или смесь Poloxamer 407 и Poloxamer 188.
8. Применение фармацевтической композиции в соответствии с п.7:
i) где по меньшей мере один термочувствительный агент представляет собой Poloxamer 407 в количестве от 10 до 25% (мас./об.) или в количестве от 12 до 25% (мас./об.), предпочтительно, где по меньшей мере один термочувствительный агент представляет собой Poloxamer 407 в (общем) количестве от 17,5 до 22,5% (мас./об.)/(мас./мас), предпочтительно в (общем) общем количестве от 17,5% (мас./об.)/(мас./мас.), от 18,0% (мас./об.)/(мас./мас.), от 18,5% (мас./об.)/(мас./мас), от 19,0% (мас./об.)/(мас./мас.), от 19,5% (мас./об.)/(мас./мас.), от 20,0% (мас./об.)/(мас./мас.), от 20,5% (мас./об.)/(мас./мас.), от 21,0% (мас./об.)/(мас./мас.), от 21,5% (мас./об.)/(мас./мас.), от 22,0% (мас./об.)/(мас./мас.) или от 22,5% (мас./об.)/(мас./мас.), или любой диапазон, образованный любыми двумя этими значениями, или
ii) где по меньшей мере один термочувствительный агент представляет собой смесь Poloxamer 407 и Poloxamer 188 в (общем) количестве от 22,5 до 27,5% (мас./об.)/(мас./мас.), более предпочтительно в общем количестве от 25% (мас./об.)/(мас./мас.), и в соотношении Poloxamer 407:Poloxamer 188 от 15:5, 16:4, 17:3, 18:2, 19:1 или 20:1, или диапазон, образованный любыми двумя этими значениями соотношений, более предпочтительно в соотношении от 9,5:0,5, от 9:1, от 8,5:1,5 или от 8:2, или диапазон, образованный любыми двумя этими значениями соотношений.
9. Применение фармацевтической композиции в соответствии с любым из пп.1-8, где фармацевтическая композиция содержит молочную кислоту в концентрации от 0,025 до 0,2 М, предпочтительно в концентрации от 0,075 до 0,125 М, имидазохинолин(амин) в количестве от 0,1 до 1% (мас./об.), циклодекстрин(ы) в количестве от 2 до 6% (мас./об.) и Poloxamer 407 в количестве от 10 до 25% (мас./об.), предпочтительно в количестве от 12 до 25% (мас./об.).
10. Применение фармацевтической композиции в соответствии с любым из пп.1-9, где заболевания мочевого пузыря выбирают из рака мочевого пузыря и цистита.
11. Применение фармацевтической композиции в соответствии с любым из пп.1-10 для внутрипузырного лечения заболеваний мочевого пузыря, предпочтительно где заболевания мочевого пузыря представляют собой цистит и рак мочевого пузыря.
12. Применение фармацевтической композиции в соответствии с любым из пп.1-11 для производства лекарственного средства для лечения заболеваний мочевого пузыря, включая рак мочевого пузыря и цистит, которое включает введение фармацевтической композиции, как определено в любом из пп.1-11, пациенту, который в этом нуждается.
13. Применение в соответствии с п.12, где фармацевтическую композицию вводят внутрипузырно и/или где заболевания мочевого пузыря представляют собой цистит и рак мочевого пузыря.
Текст
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, КОТОРЫЕ СОДЕРЖАТ ИМИДАЗОХИНОЛИН(АМИНЫ) И ИХ ПРОИЗВОДНЫЕ, ПРИГОДНЫЕ ДЛЯ МЕСТНОГО ВВЕДЕНИЯ Настоящее изобретение относится, в целом, к области модуляторов природной иммунной системы, в особенности к применению фармацевтической композиции, которая содержит имидазохинолин(амин) и молочную кислоту, при лечении заболеваний мочевого пузыря, где имидазохинолин(амин) представляет собой имихимод, имеющий специфическую формулу 1 изобутил-1H-имидазо[4,5-с]хинолин-4-амин, выбранный из следующей формулы (X): Настоящее изобретение, в целом, относится к области модуляторов природной иммунной системы,в особенности к фармацевтическим композициям, которые содержат имидазохинолин(амин) и их производные, предпочтительно пригодным для местного введения, такого как внутрипузырное введение. Дополнительно, настоящее изобретение охватывает применение имидазохинолин(аминов) и их производных для внутрипузырного лечения заболеваний мочевого пузыря, таких как, например, рак мочевого пузыря и цистит. Настоящее изобретение также охватывает способы лечения этих заболеваний, а также способы введения фармацевтических композиций согласно изобретению. Индукция и/или усиление иммунных ответных реакций природной иммунной системы и, зависимость от типа триггера, адаптивная иммунная система играет важную роль в современной медицине для лечения и предотвращения различных заболеваний. Для этой цели в данной области широко используются иммуномодуляторные композиции, которые нацелены на небольшое количество рецепторов, называемые рецепторами распознавания образов. Эти рецепторы распознавания образов обычно распознают консервативные молекулярные структуры, которые отличают чужеродные организмы, такие как вирусы,бактерии, грибы и паразиты, от клеток их хозяев. Как известно в настоящее время, рецепторы распознавания образов включают, в частности, так называемые представители семейства Toll-подобного рецептора (TLR), первого семейства рецепторов распознавания образов, изученных подробно.TLR представляют собой трансмембранные белки, которые распознают лиганды внеклеточной среды или полости ядрышек. После связывания с лигандом они преобразуют сигнал посредством цитоплазматических адапторных белков, которые приводят к запуску ответных защитных реакций хозяев и вызывают продукцию антимикробных белков, провоспалительных хемокинов и цитокинов, антивирусных цитокинов и т.д. К настоящему времени было идентифицировано по меньшей мере 10 представителей(TLR) у людей включают TLR1-TLR2, которые распознают триациллипопептиды; Toll-подобные рецепторы TLR1-TLR6, которые распознают диациллипопептил; Toll-подобный рецептор TLR2, который распознает пептидогликаны; Toll-подобный рецептор TLR3, который, как известно, распознает дмРНК, вирусный продукт; Toll-подобный рецептор TLR4, который имеет LPS (липополисахарид) грамотрицательных бактерий в качестве известного лиганда; Toll-подобный рецептор TLR5, который распознает бактериальный(е) флагеллин(ы); Toll-подобные рецепторы TLR7/8, известные лиганды которых содержат имидазохинолины, гуанозиновые аналоги и ссРНК; Toll-подобный рецептор TLR9, который распознает неметилированные CpG мотивы, которые часто обнаруживаются в геноме бактерий, вирусов и простейших, но не у позвоночных; TLR9 также распознает малярийный пигмент гемозоин, продукт расщепления гемоглобина. В завершение, было показано, что Toll-подобный рецептор TLR10 непосредственно связывается с MyD88, общим адаптером домена рецептора Toll IL-1 (см., например, Hasan и др.,The Journal of Immunology, 2005, 174: 2942-2950). После распознавания микробных патогенов эти TLR обычно запускают внутриклеточные пути передачи сигналов, которые приводят к индукции воспалительных цитокинов (например, TNF-альфа, IL-6, IL-1-бета и IL-12), интерферона I типа (IFN-бета и составного IFN-альфа) и хемокинов (Kawai Т. и S. Akira (2006). "TLR signalling". Cell Death Differ 13(5): 816-25). Из вышеописанных TLR наиболее важными являются TLR3, TLR7 и TLR9. TLR7 распознает небольшие синтетические иммунные модификаторы, включая имихимод, R-848, локсорибин и бропиримин, все они уже применяются или являются перспективными для клинического применения по отношению к вирусным инфекциям и злокачественным новообразованиям. Дополнительно, плазмоцитоидные дендритные клетки экспрессируют TLR7 и TLR9 и отвечают на TLR7 и TLR9 лиганды путем продукции большого количества интерферона (IFN-альфа). Эти результаты указывают на то, что TLR3, TLR7 иTLR9 могут играть важную роль в обнаружении и уничтожении вирусных инфекций. Конкретным примером иммунных модификаторов, как описано выше, является имихимод (который в дальнейшем описании также обозначается как R-837, ТМХ, ТМХ-101), который относится к классу имидазохинолин(аминовых) иммунных модификаторов. Было показано, что иммуномодуляторная молекула имихимода (1-изобутил-1H-имидазо[4,5-с]хинолин-4-амин) обладает клинической эффективностью при онкологических, вирусных и воспалительных заболеваниях. Полагают, что механизм иммуностимулирующей активности имихимода обусловлен существенным образом усилением ответной иммунной реакции посредством индукции различных важных цитокинов (например, интерферонов, интерлейкинов,фактора некроза опухоли и др.). Даже если точный механизм действия имихимода до настоящего времени не изучен, но связывание имихимода с Toll-подобным рецептором 7 (TLR7) рассматривают как одну из существенных стадий активации иммунной системы. Клетки, стимулированные имихимодом посредством TLR-7, секретируют цитокины (главным образом, интерферон- (IFN-), интерлейкин-6 (IL-6) и фактор некроза опухоли- (TNF-), которые содействуют антивирусным, противоопухолевым и противовоспалительным свойствам агента. Было показано, что имихимод является эффективным иммунным модулятором, который в настоящее время используется в качестве местной терапии первой линии для остроконечных бородавок и поверхностных базально-клеточных раков (Purdon C.H., Azzi C.G., Zhang J., Smith E.W., Maibach H.I. Pene-1 023208the management of anogenital warts, actinic keratoses, basal cell carcinoma and other skin lesions. Drugs. 2007; 67: 2187-210). Дополнительно, имихимод используют для лечения злокачественных поражений кожи,включая меланому и базально-клеточный рак (Wagstaff A.J., Perry C.M. Topical imiquimod: a review of itsuse in the management of anogenital warts, actinic keratoses, basal cell carcinoma and other skin lesions. Drugs. 2007; 67: 2187-210). Имихимод индуцирует провоспалительные цитокины и хемокины в условиях in vitro и in vivo (Chan M., Hayashi T., Kuy C.S. и др. Synthesis and Immunological Characterization of Toll-Like Receptor 7 Agonistic Conjugates. Bioconjugate chemistry. 2009), которые привлекают иммунные клетки в локальный сайт введения (Barnetson R.S., Satchell A., Zhuang L., Slade H.B., Halliday G.M. Imiquimod induced regression of clinically diagnosed superficial basal cell carcinoma is associated with early infiltration byCD4 T cells and dendritic cells. Clinical and experimental dermatology, 2004; 29: 639-43). Кроме того, было показано, что имидазохинолины направляют цитотоксические эффекты на клетки рака мочевого пузыря и индуцируют их секретировать провоспалительные цитокины (Smith Е.В.,Schwartz M., Kawamoto H. и др. Antitumor effects of imidazoquinolines in urothelial cell carcinoma of thebladder. The Journal of urology. 2007; 177: 2347-51). Также было описано, что имидазохинолины обладают противоопухолевыми действиями на мышиных моделях ортотопического рака мочевого пузыря (Smith Е.В., Schwartz M., Kawamoto H. и др. Antitumor effects of imidazoquinolines in urothelial cell carcinoma ofthe bladder. The Journal of urology. 2007; 177: 2347-51). Кроме того, было показано, что TLR-7 также экспрессируется в клеточных линиях рака мочевого пузыря мышей и человека и имидазохинолины обладают эффективными прямыми биологическими действиями на клетки уротелиально-клеточного рака путем снижения жизнеспособности клеток и инуцирования апоптоза и продукции цитокинов (Smith Е.В., Schwartz M., Kawamoto H. и др. Antitumour effects ofImidazoquinolines in urothelial cell carcinoma of the bladder. J Urol 2007; 177: 2347). Полагают, что прямые эффекты обусловлены понижающей регуляцией по отношению к с-Мус и могут синергизировать с иммуномодулирующим действием имидазохинолинов (Liu H., Schwartz M.J., Hwang D.H., Scherr O.S. Tumour growth inhibition by an imidazoquinoline is associated with c-Myc down-regulation in urothelial cell carcinoma. BJU Int 2008; 101: 894-901). Дополнительно, первоначальные результаты в иммуно-компетентной, ортотопической мышиной модели предполагают противоопухолевые эффекты в условиях inBJU Int 2008; 101: 894-901). Следовательно, имидазохинолины обладают терапевтическим потенциалом в качестве внутрипузырного средства при раке мочевого пузыря. Несмотря на то что некоторые благоприятные влияния иммунных модификаторов, таких как имихимод, известны, способность обеспечивать терапевтическую пользу посредством локального введения этих иммунных модификаторов для лечения конкретного состояния в конкретной локализации может быть затруднена вследствие различных факторов. Эти факторы включают нерастворимость и/или разложение этих иммунных модификаторов в препарате перед, на протяжении или даже после введения, но также физическую нестабильность препарата, включая такие факторы, как разделение компонентов, загустение, осаждение/агломерация активных компонентов, и другие, а также плохое проникновение иммунного(ых) модификатора(ов) в окружающую ткань или клетки при введении. Специфически, растворимость иммунного модификатора имихимода является решающей, и его применение в фармацевтических композициях, в частности в жидких или полужидких композициях, ограничивается вследствие его гидрофобных свойств. Несмотря на то что имихимод растворим в низких концентрациях в полярных органических растворителях, таких как ДМСО, диметилформамид и N-метил-2-пирролидон, такие растворители не предоставляют возможности введения имихимода на или в организм человека вследствие их различных токсических эффектов. Тем не менее, нетоксичные растворители, такие как вода или этанол,солибилизируют представителя имидазохинолин(амин)ов, такого как имихимод, только незначительно и только предоставляют возможность введения имихимода на или в организм человека в низких (субтерапевтических) концентрациях. Следовательно, в соответствии с первым аспектом настоящего изобретения существует потребность обеспечить фармацевтическую композицию предпочтительно в виде жидкого или полужидкого препарата, которая предоставляет возможность солюбилизировать имидазохинолин(амин)ы, такие как имихимод, значительным образом и, следовательно, предоставляет возможность более высоких эффективных концентраций иммунных модификаторов, таких как имихимод, при введении субъекту, который в этом нуждается. Предпочтительно в данной области существует потребность обеспечить такой жидкий или полужидкий препарат для местных способов введения, который не проявляет токсических действий,но проявляет улучшенную растворимость и предпочтительно уменьшает физическую нестабильность препарата. Тем не менее, применение иммунных модификаторов, в особенности представителей класса имида-2 023208 зохинолин(амин)ов, таких как имихимод, для лечения онкологических и вирусных заболеваний также ограничено его различными побочными действиями. Например, описано, что имихимод вызывает, например, ажитацию, анемию, ангионевротический отек, аритмии, синдром просачивания капилляров, сердечную недостаточность, кардиомиопатию, расстройство мозгового кровообращения, депрессию, одышку, многоформную эритему, эксфолиативный дерматит, болезнь Шенлейна-Геноха, идиопатическую тромбицитопеническую пурпуру, бессонницу, ишемию, лейкопению, аномальное функционирование печени, лимфому, ухудшенный рассеянный склероз, парез, протеинурию, отек легких, судороги, обморок, тромбоцитопению и тиреоидит. Для уменьшения риска таких тяжелых побочных действий - которые в некоторых случаях могут быть опасными для жизни - в настоящее время он, главным образом, вводится местно вместо системного введения. В этом контексте пути для системного введения, в целом, включают, например, трансдермальный, оральный или парентеральный пути, включая подкожные, внутривенные, внутримышечные, внутриартериальные, внутрикожные и внутрибрюшинные инъекции и/или интраназальные пути введения. Такое системное введение обычно приводит к общему распределению иммунных модификаторов в организме человека и, следовательно, существенно увеличивает риск побочных действий. В отличие от этого пути для местного введения, в целом, включают, например, пути местного введения, а также внутрикожные, трансдермальные, подкожные или внутримышечные инъекции или инъекции в очаг поражения,внутричерепные, внутрилегочные, внутрисердечные и подъязычные инъекции, где такие введения обычно происходят в участке болезни и предоставляют возможность прямого действия лекарственного средства, в то время как системные побочные эффекты существенно уменьшаются, которые наступают при системном введении. В контексте иммунных модификаторов, как определено выше, в частности имидазохинолин(амин)ов, таких как имихимод или его производные, специфическая потребность местного введения вследствие указанных выше физико-химических свойств этих соединений и побочные действия при системном введении ограничивают их терапевтическое применение и количество заболеваний, которые можно лечить с их помощью. В настоящее время большинство заболеваний, которые можно лечить с помощью имихимода или его производных, представляют собой специфические заболевания кожи,включая раковые новообразования кожи, такие как базально-клеточный рак, болезнь Бовена, поверхностный плоскоклеточный рак, а также остроконечные бородавки (остроконечные кондиломы). Дальнейшим важным заболеванием, которое можно лечить с помощью иммунных модификаторов, в частности имидазохинолин(амин)ов, таких как имихимод, является заболевание мочевого пузыря, в частности рак мочевого пузыря и цистит. В этом контексте рак мочевого пузыря относится к любым некоторым типам (злокачественным или незлокачественным) неопластических заболеваний мочевого пузыря. Он представляет собой одно из наиболее быстро увеличивающихся злокачественных новообразований во всем мире в связи с быстрым старением популяций в большинстве стран. Каждый код в США рак мочевого пузыря впервые диагностируется в более чем 60 тыс. человек, где 80% этих больных имеют неинвазивный рак мочевого пузыря. Поскольку коэффициент смертности от рака мочевого пузыря является относительно низким, то общее количество пациентов в США и в Европе составляет свыше 400 тыс. человек. Таким образом, рак мочевого пузыря является пятым наиболее распространенным злокачественным новообразованием среди населения Западной Европы. Большинство случаев рака мочевого пузыря диагностируют в виде неинвазивных, поверхностных опухолей, которые потенциально поддаются лечению с помощью хирургической и иммунологической терапии (Schenk-Braat E.A., Bangma C.H. Immunotherapy for superficial bladder cancer. Cancer Immunol Immunother. 2005; 54: 414-23). До настоящего времени большинство пациентов с неинвазивным (поверхностным) раком мочевого пузыря лечат с помощью так называемых "растворов бациллы Кальметта-Герена (BCG)", которые вводят с помощью внутрипузырного пути. Тем не менее, такие растворы BCG являются нехарактерными продуктами, состоящими из ослабленной формы бактерии Mycobacterium tuberculosis, и, следовательно,проявляют плохой профиль безопасности. Дополнительно, поверхностно растущие опухоли можно удалять путем трансуретральной резекции,но частота рецидивов является высокой. Для пролонгирования интервалов без опухоли после хирургической резекции в настоящее время используют внутрипузырное лечение с помощью Mycobacterium bovis бациллы Кальметта-Герена (BCG), вакцинного штамма против заражения туберкулезом, в качестве адъювантной опции лечения (Alexandroff A.B., Jackson A.M., O'Donnell M.A., James K. BCG immunotherapyimmunotherapy of prostate and bladder cancer. BJU international. 2005; 96: 728-35). Тем не менее, лечение с помощью М. bovis BCG индуцирует неспецифическое местное воспаление в мочевом пузыре, которое сопровождается различными цитокинами (IL-2, IL-6, IL-8 и TNF) (De Boer 2003; 170: 2004) и хемокинами, которые, в свою очередь, инициируют инфильтрацию иммунных клеток в уротелий мочевого пузыря (Suttmann H., Riemensberger J., Bentien G. и др. Neutrophil granulocytes areBCG immunotherapy for bladder cancer. Urologic oncology. 2008; 26: 341-5). BCG инстилляции вызывают неспецифическую стимуляцию иммунной системы, которая индуцирует локальную инфильтрацию стенки мочевого пузыря активированными Т-клетками, имеющими происхождение из клеточно-опосредованного иммунитета (Bohle A., Brandau S. Immune mechanisms in bacillus Calmette-Guerin immunotherapy for superficial bladder cancer. The Journal of urology. 2003; 170: 964-9). Коэффициент заболеваемости немышечным инвазивным раком уротелиальных клеток мочевого пузыря (NMIBC) является высоким (Babjuk M., Oosterlinck W., Sylvester R., Kaasinen E., Bohle A., PalouRedorta J.; European Association of Urology (EAU). EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol 2008; 54: 303-14) и распространение его еще более высокое вследствие высокой частоты рецидивов после первичной транс-уретральной резекции. У пациентов с высоким риском рецидива опухоли и/или прогрессирования в мышечно-инвазивное заболевание, показана внутрипузырная BCG иммунотерапия по меньшей мере в течение одного года (Babjuk M., Oosterlinck W., Sylvester R.,Kaasinen E., Bhle A., Palou-Redorta J.; European Association of Urology (EAU). EAU guidelines on nonmuscle-invasive urothelial carcinoma of the bladder. Eur Urol 2008; 54: 303-14). Тем не менее, BCG только частично эффективна и могут развиваться тяжелые местные и системные побочные эффекты (Witjes J.A.,Palou J., Soloway M., Lamm O., Brausi M., Spermon J.R., Persad R., Buckley R., Akaza H., Colombel M., Bhle A. Clinical Practice recommendations for the prevention and management of intravesical therapy-associatedadverse events. Eur. Urol Suppl 2008; 7: 667-74). Следовательно, остается важным развитие новых опций внутрипузырного лечения для снижения частоты рецидивов опухолей и прогрессирования NMIBC. В качестве дальнейшего заболевания мочевого пузыря цистит обычно включает воспаление мочевого пузыря и происходит, когда нормально стерильный нижний мочеполовой тракт (уретра и мочевой пузырь) инфицируется бактериями и становится раздраженным и воспаленным. В связи с риском распространения инфекции в почки и вследствие высокой степени осложнений у пожилых людей и у диабетиков быстрое лечение почти всегда рекомендуется. Для борьбы с бактериальной инфекцией цистит обычно лечат с помощью антибиотиков. Обычно используемые антибиотики для лечения включают, например, нитрофурантоин, триметоприм-сульфаметоксазол, амоксициллин, цефалоспорины, ципрофлоксацин или левофлоксацин и доксициклин. Тем не менее, такая терапия антибиотиками часто нарушает нормальный баланс флоры кишечника, вызывая диарею. Дополнительно, также может происходить индицируемое антибиотиками разрушение популяции бактерий, обычно присутствующих в качестве составных компонентов нормальной флоры влагалища, и это может приводить к чрезмерному росту видов дрожжей рода Candida в вульво-вагинальной области. Для таких заболеваний, в особенности для лечения заболеваний мочевого пузыря, таких как неивазивный рак и/или цистит, будет являться желательным обеспечение альтернативного средства, которое действует посредством активации иммунной системы. Тем не менее, даже если иммунные модификаторы, как определено выше, в частности имихимод или его производные, могут применяться для лечения этих заболеваний, введение может затрудняться тяжелыми побочными действиями при системном введении, как объяснено выше. Кроме того, при локальном введении такие иммунные модификаторы, в частности имихимод или его производные, обычно не представлены в терапевтически эффективном количестве in vivo вследствие их (фармацевтически трудных) физико-химических свойств. Такие фармацевтические композиции еще не были описаны в уровне техники, указывая на нерешенные трудности в данной области. Как известно специалисту в данной области техники, для обеспечения такой специфической фармацевтической композиции следует принимать во внимание различные фармацевтические аспекты,такие как доза, совместимость наполнителей, растворимость, стабильность, стерильное приготовление,осуществимость в промышленном масштабе, возможность доставки с катетером, стоимость и соответствие для пациента, а также фармакологические аспекты, такие как биологическая активность, проницаемость через мембрану, продолжительность действия, низкая системная циркуляция (для избежания системных побочных действий) и профиль токсичности. Как и для многих других активных средств, обеспечение фармацевтических композиций, которые содержат желательное активное средство и высвобождающие средство таким образом, чтобы обеспечивалась локальная доставка лекарственного средства,является одной из основных трудностей для каждого фармацевта. Дополнительно, следует учитывать(решающие) физико-химические свойства, например имидазохинолин(аминов), в частности профиль гидрофобности этого класса соединений, которые (с учетом подходов, описанных в уровне техники) обычно приводят к недостаточной концентрации in vivo введенного соединения - иммунного модификатора, действующего в качестве TLR-7 лиганда. Таким образом, в соответствии с другим аспектом существует настоятельная потребность в обеспечении фармацевтической композиции, пригодной для специфической местной доставки иммунных модификаторов, как определено выше, в частности имихимода или его производных, например, для лечения заболевания мочевого пузыря, например, посредством внутрипузырного введения. Таким образом, как изложено выше, имихимод является активным средством, эффективным для лечения онкологических, вирусных и воспалительных заболеваний. Тем не менее, применение имидазохинолин(амин)ов, таких как имихимод и его производные, для приготовления лекарственного средства сильно ограничено его характеристиками растворимости. Дополнительно, при системном введении различные побочные действия вызываются имидазохинолин(амин)ами, такими как имихимод. Следовательно, введение этого средства в препарате, который предоставляет возможность средству специфически доставляться в орган-мишень путем использования соответствующей фармацевтической композиции,является чрезвычайно важным. Таким образом, будет очень желательным обеспечить специфические фармацевтические композиции, которые содержат имидазохинолин(амин)ы, такие как имихимод, в достаточно солюбилизированных количествах для обеспечения эффективного лечения заболеваний, указанных в настоящей заявке. Дополнительно, будет являться предпочтительным, если имидазохинолин(амин)ы, такие как имихимод и его производные, приготавливают в виде подходящего препарата для локального введения, в частности внутрипузырно, для лечения заболевания мочевого пузыря, таким образом существенно уменьшая риск тяжелых системных побочных действий. Таком образом, задачей настоящего изобретения является обеспечение фармацевтической композиции, подходящей для содержания иммунных модификаторов, в частности имидазохинолин(амин)ов, таких как имихимод, в терапевтически эффективных количествах. Дополнительно, дальнейшей задачей настоящего изобретения является обеспечение фармацевтических композиций, подходящих для применения для приготовления лекарственного средства для внутрипузырного лечения заболеваний мочевого пузыря, в частности неинвазивного рака мочевого пузыря и цистита, посредством внутрипузырного введения. Задача(и) настоящего изобретения решается(ются) с помощью пунктов приложенной формулы изобретения. В частности, задача(и) настоящего изобретения решается(ются) с помощью фармацевтической композиции, которая содержит (а) имидазохинолин(амин) или его производное, например имихимод или его производное, и (b) по меньшей мере одну органическую кислоту, выбранную из уксусной кислоты и/или молочной кислоты или их смесь. Таким образом, в соответствии с одним предпочтительным вариантом осуществления настоящего изобретения фармацевтическая композиция содержит имидазохинолин(амин) и по меньшей мере одну органическую кислоту, выбранную из уксусной кислоты и/или молочной кислоты. Для некоторых вариантов осуществления применяются одно или несколько следующих условий: фармацевтические композиции для местного введения исключены,фармацевтические композиции, которые содержат масло, исключены,фармацевтические композиции, приготовленные в виде в/м (вода в масле) или м/в (масло в воде) препарата, исключены,фармацевтические композиции, приготовленные в виде крема, который содержит 4 мас.% по весу имихимод (1-изобутил-1H-имидазо[4,5-с]хинолин-4-амин) в масляной фазе и 1 мас.% по весу молочной кислоты (85%) в водной фазе, исключены,фармацевтические композиции для парентерального введения исключены,фармацевтические композиции, которые содержат глицерин и/или сорбит, исключены,фармацевтические композиции для парентерального введения, которые содержат 1 мас.% по весу 1 изобутил-1H-имидазо[4,5-с]хинолин-4-амина и/или 1 мас.% по весу 1-(2-гидрокси-2-метилпропил)-1Hимидазо[4,5-с]хинолин-4-амина или N-[4-(4-амино-2-этил-1 Н-имидазо[4,5-с]хинолин-1-ил)бутил]метансульфонамида и 1 или 2 мас.% по весу молочной кислоты (85%) или 0,6 мас.% по весу уксусной кислоты, исключены,фармацевтические композиции, которые содержат уксусную кислоту и сорбитан моноолеат 20 миристат или изопропил миристат, исключены, и/или фармацевтические композиции, которые содержат наночастицы имихимод хитозан, полученные путем смешивания раствора хитозан уксусной кислоты с имихимодом, исключены. В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения фармацевтическая композиция дополнительно содержит по меньшей мере один термочувствительный агент, где по меньшей мере один термочувствительный агент предпочтительно выбирают из хитозана или его производных, или из поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид) сополимера(также обозначается РЕО-РРО-РЕО или Poloxamer). В соответствии с дальнейшим предпочтительным вариантом осуществления настоящего изобретения по меньшей мере один термочувствительный агент выбирают из хитозана или его производных или из поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид) сополимера (также обозначается РЕОРРО-РЕО или Poloxamer), включая Pluronic F 108 Cast Solid Surfacta; Pluronic F 108 Pastille; Pluronic F 108Pluronic P 105; Pluronic P 123 Surfactant; Pluronic P 65; Pluronic P 84; Pluronic P 85 и Poloxamer 403, или выбирают из смеси, образованной двумя или больше вышеуказанными термочувствительными агентами. В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения по меньшей мере один термочувствительный агент выбирают из поли(этиленоксид)-поли(пропиленоксид)поли(этиленоксид) сополимера (также обозначается РЕО-РРО-РЕО или Poloxamer), включая Pluronic F 108 Cast Solid Surfacta; Pluronic F 108 Pastille; Pluronic F 108 Prill; Pluronic F 108NF Prill (Poloxamer 338);(Poloxamer 124); Pluronic N 3; Pluronic P 103; Pluronic P 104; Pluronic P 105; Pluronic P 123 Surfactant; Pluronic P 65; Pluronic P 84; Pluronic P 85 и Poloxamer 403, или выбирают из смеси, образованной двумя или больше вышеуказанными термочувствительными агентами. В контексте настоящего изобретения фармацевтическая композиция в соответствии с изобретением содержит в качестве первого компонента по меньшей мере одну органическую кислоту, выбранную из уксусной кислоты и/или молочной кислоты или их смесь. Хотя органические кислоты "уксусная кислота" и "молочная кислота" уже известны специалисту в данной области техники для приготовления фармацевтических композиций в целом, изобретатели настоящего изобретения неожиданно обнаружили, что конкретно эти карбоновые кислоты с короткой цепью пригодны для эффективной солюбилизации имидазохинолин(амина) или его производных, открытие, которое до настоящего времени не было опубликовано или не обсуждалось в уровне техники. Дополнительно, было обнаружено, что уксусная кислота и молочная кислота проявляют свойства солюбилизации, которые значительно выше по сравнению с любой другой (карбоновой) кислотой. Более специфически и еще более неожиданно, уксусная кислота(СН 3 СООН) и/или молочная кислота (2-гидроксипропионовая кислота), солюбилизируют имидазохинолин(амин) в 3-100 раз лучше, чем другие (карбоновые) кислоты с короткой цепью, а именно фосфорная кислота, янтарная кислота и лимонная кислота. Эти неожиданные эффекты, без ограничения любой теорией, в частности, обуславливаются специфической структурой имидазохинолин(аминов) или их производных, как используется в настоящей заявке, например, имихимод, и специфическим взаимодействием конкретно уксусной кислоты и молочной кислоты с имидазохинолин(аминовым) соединением, что приводит к неожиданной структуре присоединения. Термин "имидазохинолин(амин)ы" относится как к общему классу имидазохинолинов и, более специфически в предпочтительном варианте осуществления, также к подклассу имидазохинолинаминов. Поскольку имидазохинолин(амины) или их производные, как используется в настоящей заявке,имеют щелочную функциональную группу, в частности аминовый компонент, в документах из уровня техники предполагается, что имидазохинолин(амины) могут быть солюбилизированы в любом кислотном растворе при значениях рН ниже pKa соединений этого класса, например, в случае имихимода, то есть приблизительно 4. Тем не менее, изобретателями настоящего изобретения было показано, что растворимость имидазохинолин(аминов) или их производных, как используется в настоящей заявке, не только зависит от рН. Не желая ограничиваться любой теорией, полагают, что эти превосходящие свойства реализуются путем взаимодействия, которое происходит между имидазохинолин(аминами) или их производными, как используется в настоящей заявке, и (органической) кислотой, специфически выбранной из уксусной кислоты и/или молочной кислоты, таким образом образуя специфические аддукты между обоими компонентами. Очевидно, таких взаимодействий не происходит между имидазохинолин(аминами) или их производными, как используется в настоящей заявке, и любой другой (органической) кислотой. Следовательно, полагают, что неожиданные результаты настоящего изобретения, в особенности специфические улучшенные характеристики солюбилизации имидазохинолин(аминов) или их производных, как используется в настоящей заявке, в органических кислотах уксусной кислоте и/или молочной кислоте, зависят от специфических структурных свойств, которые исключительно реализуются с помощью молочной и уксусной кислоты, но не любой другой (органической) кислоты. Таким образом, молочная и/или уксусная кислота образуют анион в структуре присоединения и имидазохинолин(амин)ы предоставляют положительно заряженные катионы. В соответствии с предпочтительным вариантом осуществления настоящего изобретения фармацевтическая композиция в соответствии с изобретением, как определено выше, содержит органическую кислоту, выбранную из уксусной кислоты и/или молочной кислоты или их смесь в концентрации от приблизительно 0,025 М до приблизительно 0,200 М, предпочтительно в концентрации от приблизительно 0,025 М до приблизительно 0,100 М или в концентрации от приблизительно 0,100 М до приблизительно 0,200 М, или в концентрации от приблизительно 0,075 М до приблизительно 0,125 М, например, в концентрации от приблизительно 0,025 М до приблизительно 0,200 М, от приблизительно 0,030 М до приблизительно 0,200 М, от приблизительно 0,035 М до приблизительно 0,200 М, от приблизительно 0,040 М до приблизительно 0,200 М, от приблизительно 0,045 М до приблизительно 0,200 М, от приблизительно 0,050 М до приблизительно 0,200 М, от приблизительно 0,055 М до приблизительно 0,200 М, от приблизительно 0,060 М до приблизительно 0,200 М, от приблизительно 0,065 М до приблизительно 0,200 М, от приблизительно 0,070 М до приблизительно 0,200 М, от приблизительно 0,075 М до приблизительно 0,200 М, от приблизительно 0,080 М до приблизительно 0,200 М, от приблизительно 0,085 до 0 приблизительно 200 М, от приблизительно 0,090 М до приблизительно 0,200 М, от приблизительно 0,095 М до приблизительно 0,200 М, от приблизительно 0,095 М до приблизительно 0,200 М, от приблизительно 0,100 М до приблизительно 0,200 М, от приблизительно 0,125 М до приблизительно 0,200 М, от приблизительно 0,130 М до приблизительно 0,200 М, от приблизительно 0,135 М до приблизительно 0,200 М, от приблизительно 0,140 М до приблизительно 0,200 М, от приблизительно 0,145 М до приблизительно 0,200 М, от приблизительно 0,0150 М до приблизительно 0,200 М, от приблизительно 0,155 М до приблизительно 0,200 М, от приблизительно 0,160 М до приблизительно 0,200 М, от приблизительно 0,165 М до приблизительно 0,200 М, от приблизительно 0,170 М до приблизительно 0,200 М, от приблизительно 0,175 М до приблизительно 0,200 М, от приблизительно 0,180 М до приблизительно 0,200 М, от приблизительно 0,185 М до приблизительно 0,200 М, от приблизительно 0,190 М до приблизительно 0,200 М, или приблизительно 0,195 М до приблизительно 0,200 М, или предпочтительно в концентрации от приблизительно 0,050 М до приблизительно 0,100 М, например, в концентрации от приблизительно 0,055 М до приблизительно 0,100 М, от приблизительно 0,060 М до приблизительно 0,100 М, от приблизительно 0,065 М до приблизительно 0,100 М, от приблизительно 0,070 М до приблизительно 0,100 М, от приблизительно 0,075 М до приблизительно 0,100 М, от приблизительно 0,080 М до приблизительно 0,100 М, от приблизительно 0,085 М до приблизительно 0,100 М, от приблизительно 0,090 М до приблизительно 0,100 М, или от приблизительно 0,095 М до приблизительно 0,100 М, или в концентрации от приблизительно 0,025 М до приблизительно 0,100 М, например, в концентрации от приблизительно 0,025 М до приблизительно 0,100 М, от приблизительно 0,030 М до приблизительно 0,100 М, от приблизительно 0,035 М до приблизительно 0,100 М, от приблизительно 0,040 М до приблизительно 0,100 М, от приблизительно 0,045 М до приблизительно 0,100 М, от приблизительно 0,050 М до приблизительно 0,100 М, от приблизительно 0,055 М до приблизительно 0,100 М, от приблизительно 0,060 М до приблизительно 0,100 М, от приблизительно 0,065 М до приблизительно 0,100 М, от приблизительно 0,070 М до приблизительно 0,100 М, от приблизительно 0,075 М до приблизительно 0,100 М, от приблизительно 0,080 М до приблизительно 0,100 М, от приблизительно 0,085 до 0 приблизительно 200 М, от приблизительно 0,090 М до приблизительно 0,100 М, от приблизительно 0,095 М до приблизительно 0,100 М, от приблизительно 0,095 М до приблизительно 0,100 М, или в концентрации от приблизительно 0,100 М до приблизительно 0,200 М, например, в концентрации от приблизительно 0,100 М до приблизительно 0,200 М, от приблизительно 0,125 М до приблизительно 0,200 М, от приблизительно 0,130 М до приблизительно 0,200 М, от приблизительно 0,135 М до приблизительно 0,200 М, от приблизительно 0,140 М до приблизительно 0,200 М, от приблизительно 0,145 М до приблизительно 0,200 М, от приблизительно 0,0150 М до приблизительно 0,200 М, от приблизительно 0,155 М до приблизительно 0,200 М, от приблизительно 0,160 М до приблизительно 0,200 М, от приблизительно 0,165 М до приблизительно 0,200 М, от приблизительно 0,170 М до приблизительно 0,200 М, от приблизительно 0,175 М до приблизительно 0,200 М, от приблизительно 0,180 М до приблизительно 0,200 М, от приблизительно 0,185 М до приблизительно 0,200 М, от приблизительно 0,190 М до приблизительно 0,200 М, или приблизительно 0,195 М до приблизительно 0,200 М, или в концентрации от приблизительно 0,075 М до приблизительно 0,125 М, например, от приблизительно 0,08 М до приблизительно 0,125 М, от приблизительно 0,085 М до приблизительно 0,125 М, от приблизительно 0,09 М до приблизительно 0,125 М, от приблизительно 0,095 М до приблизительно 0,125 М, от приблизительно 0,1 М до приблизительно 0,125 М, или от приблизительно 0,075 М до приблизительно 0,120 М, от приблизительно 0,075 М до приблизительно 0,115 М, от приблизительно 0,075 М до приблизительно 0,110 М, от приблизительно 0,075 М до приблизительно 0,105 М, от приблизительно 0,075 М до приблизительно 0,105 М или от приблизительно 0,08 М до приблизительно 0,120 М, например, от приблизительно 0,085 М до приблизительно 0,115 М, от приблизительно 0,09 М до приблизительно 0,110 М, от приблизительно 0,095 М до приблизительно 0,105 М,или от приблизительно 0,1 М. В этом контексте было показано, что количество солюбилизированных имидазохинолин(аминов) или их производных, как используется в настоящей заявке, в растворе непосредственно связано с концентрацией кислоты, то есть концентрацией уксусной кислоты и молочной кислоты. Таким образом, более высокие концентрации уксусной кислоты и/или молочной кислоты или смесь обеих кислот может быть предпочтительной для солюбилизации предпочтительно в пределах вышеуказанных диапазонов. В соответствии с одним специфическим вариантом осуществления настоящего изобретения фармацевтическая композиция в соответствии с изобретением, как определено выше, содержит смесь (двух органических кислот, выбранных из) уксусной кислоты и молочной кислоты, обе совместно предпочти-7 023208 тельно проявляют "общую концентрацию" органических кислот, как определено выше, для фармацевтической композиции в соответствии с изобретением, в целом, от приблизительно 0,025 М до приблизительно 0,200 М или от приблизительно 0,075 М до приблизительно 0,125 М любой другой концентрации,как определено выше. В этом контексте термин "общая концентрация органических кислот" обозначает,что молярности обеих органических кислот уксусной кислоты и молочной кислоты, используемых для такой смеси, приводят к концентрации, как определено выше. Еще более предпочтительно оба компонента смеси (две органические кислоты, выбранные из) уксусной кислоты и молочной кислоты, как определено выше, содержат соотношение уксусной кислоты:молочной кислоты от приблизительно 1:30 до приблизительно 30:1, например, от приблизительно 2:30, от приблизительно 3:30, от приблизительно 4:30, от приблизительно 5:30, от приблизительно 6:30, от приблизительно 7:30, от приблизительно 8:30,от приблизительно 9:30, от приблизительно 10:30, от приблизительно 11:30, от приблизительно 12:30, от приблизительно 13:30, от приблизительно 14:30, от приблизительно 15:30, от приблизительно 16:30, от приблизительно 17:30, от приблизительно 18:30, от приблизительно 19:30, от приблизительно 20:30, от приблизительно 21:30, от приблизительно 22:30, от приблизительно 23:30, от приблизительно 24:30, от приблизительно 25:30, от приблизительно 26:30, от приблизительно 27:30, от приблизительно 28:30, от приблизительно 29:30, от приблизительно 30:29, от приблизительно 30:28, от приблизительно 30:27, от приблизительно 30:26, от приблизительно 30:25, от приблизительно 30:24, от приблизительно 30:23, от приблизительно 30:22, от приблизительно 30:21, от приблизительно 30:20, от приблизительно 30:19, от приблизительно 30:18, от приблизительно 30:17, от приблизительно 30:16, от приблизительно 30:15, от приблизительно 30:14, от приблизительно 30:13, от приблизительно 30:12, от приблизительно 30:11, от приблизительно 30:10, от приблизительно 30:9, от приблизительно 30:8, от приблизительно 30:7, от приблизительно 30:6, от приблизительно 30:5, от приблизительно 30:4, от приблизительно 30:3, от приблизительно 30:2 или от приблизительно 30:1. Диапазоны уксусной кислоты:молочной кислоты описаны в настоящей заявке, которые могут образовываться на основании любых вышеописанных значений, например, 1:30 к 30:24, 1:30 к 23:30, 30:12 к 30:1, 30:8 к 30:1 и др. В соответствии с одним дополнительным специфическим вариантом осуществления настоящего изобретения фармацевтическая композиция в соответствии с изобретением, как определено выше, содержит исключительно либо уксусную кислоту или молочную кислоту в качестве кислотных компонентов. В любом случае, специфические варианты осуществления относятся к композициям по изобретению, как описано выше, которые не содержат любой другой кислоты, которая является органической или неорганической кислотой, за исключением уксусной кислоты и/или молочной кислоты. В другом специфическом варианте осуществления фармацевтическая композиция содержит исключительно уксусную кислоту (и не содержит молочную кислоту) в качестве (органического) кислотного компонента и более предпочтительно кроме уксусной кислоты не содержит никакой другой кислоты, ни органической или неорганической. Взамен, фармацевтическая композиция может (в другом специфическом варианте осуществления) содержать исключительно молочную кислоту (и не содержать уксусную кислоту) в качестве(органической) кислоты и более предпочтительно кроме молочной кислоты не содержать никакой другой кислоты, ни органической или неорганической. В еще другом предпочтительном варианте осуществления фармацевтическая композиция может содержать только уксусную и или молочную кислоту в качестве органических кислотных компонентов, тем не менее, может включаться по меньшей мере одна дополнительная неорганическая кислота в фармацевтическую композицию согласно изобретению, например фосфорная кислота, HCl и др. В соответствии с другим специфическим вариантом осуществления настоящего изобретения фармацевтическая композиция в соответствии с изобретением, как определено в настоящей заявке, содержит исключительно молочную кислоту в качестве кислотного компонента, предпочтительно проявляя концентрацию молочной кислоты, как определено выше для фармацевтической композиции в соответствии с изобретением, в целом, от приблизительно 0,025 М до приблизительно 0,200 М или от приблизительно 0,075 М до приблизительно 0,125 М или любую другую концентрацию, как определено выше. В этом специфическом варианте осуществления еще более предпочтительно, что фармацевтическая композиция в соответствии с изобретением, как определено выше, не охватывает любую другую кислоту, кроме молочной кислоты, ни органической или неорганической кислоты. В этом контексте изобретатели настоящего изобретения неожиданно обнаружили, что молочная кислота еще более эффективна для солюбилизации имидазохинолин(аминов) или их производных, как используется в настоящей заявке, чем уксусная кислота. Неожиданно, молочная кислота является в два раза более эффективной для солюбилизации имидазохинолин(аминов) или их производных, как используется в настоящей заявке, относительно уксусной кислоты. Также было обнаружено, что растворимость имидазохинолин(аминов) или их производных, как используется в настоящей заявке, в молочной кислоте не увеличивается при добавлении поверхностно-активных веществ, таких как Tween или Pluronic, которые обычно действуют в качестве усилителей растворимости в фармацевтических композициях. Эти данные свидетельствуют о том, что имидазохинолин(амины) или их производные, как используется в настоящей заявке, не захватываются в мицеллы, образуемые поверхностно-активными вещества, и, следовательно, подтверждают предположение,что эти имидазохинолин(амины) взаимодействуют с молочной кислотой путем образования специфиче-8 023208 ски структурированных аддуктов. В соответствии с другим специфическим вариантом осуществления настоящего изобретения фармацевтическая композиция в соответствии с изобретением, как определено в настоящей заявке, содержит молочную кислоту в концентрации от приблизительно 0,075 М до приблизительно 0,125 М, например, от приблизительно 0,08 М до приблизительно 0,125 М, от приблизительно 0,085 М до приблизительно 0,125 М, от приблизительно 0,09 М до приблизительно 0,125 М, от приблизительно 0,095 М до приблизительно 0,125 М, от приблизительно 0,1 М до приблизительно 0,125 М, или от приблизительно 0,075 М до приблизительно 0,120 М, от приблизительно 0,075 М до приблизительно 0,115 М, от приблизительно 0,075 М до приблизительно 0,110 М, от приблизительно 0,075 М до приблизительно 0,105 М, от приблизительно 0,075 М до приблизительно 0,105 М или от приблизительно 0,08 М до приблизительно 0,120 М,например, от приблизительно 0,085 М до приблизительно 0,115 М, от приблизительно 0,09 М до приблизительно 0,110 М, от приблизительно 0,095 М до приблизительно 0,105 М или от приблизительно 0,1 М. В соответствии с дальнейшим специфическим вариантом осуществления настоящего изобретения фармацевтическая композиция в соответствии с изобретением, как определено в настоящей заявке,обычно имеет значение рН от приблизительно 3 до приблизительно 8, предпочтительно от приблизительно 3 до приблизительно 7, более предпочтительно от приблизительно 3 до приблизительно 6, еще более предпочтительно от приблизительно 3 до приблизительно 5, и наиболее предпочтительно значение рН от приблизительно 3,5 до приблизительно 4, включая значение рН в диапазоне от приблизительно 3,5 до приблизительно 4,9, от приблизительно 3,5 до приблизительно 4,8, от приблизительно 3,6 до приблизительно 4,7, от приблизительно 3,6 до приблизительно 4,6, от приблизительно 3,7 до приблизительно 4,5, от приблизительно 3,7 до приблизительно 4,4, от приблизительно 3,8 до приблизительно 4,3, от приблизительно 3,8 до приблизительно 4,2, или от приблизительно 3,9 до приблизительно 4,1. Фармацевтическая композиция в соответствии с изобретением может приготавливатьсяи вводиться при значении рН, как определено выше. При необходимости, значение рН может дополнительно регулироваться для специфических требований лечения и введения, например, до более нейтрального значения рН приблизительно 5, 6 или 7 (рН 5-7), например, используя буферы и вспомогательные вещества, как описано в настоящей заявке. В контексте настоящего изобретения фармацевтическая композиция в соответствии с изобретением содержит в качестве дополнительного компонента имидазохинолин(амин) соединение, такое как имихимод или его производное, в качестве биологически (терапевтически) активного средства. В контексте настоящего изобретения термин "имидазохинолин(амины) или их производные, как используется в настоящей заявке", предпочтительно относится к имидазохинолин(аминам), как определено ниже. В соответствии с одним предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит имидазохинолин(амины), выбранные из следующей формулы (I):R1, R2 и R3 каждый независимо выбирают из водорода; циклического алкила из трех, четырех или пяти атомов углерода; неразветвленного или разветвленного алкила, содержащего от одного до приблизительно десяти атомов углерода, и замещенного неразветвленного или разветвленного алкила, содержащего от одного до приблизительно десяти атомов углерода, где заместитель выбирают из группы,включающей циклоалкил, содержащий от трех до приблизительно шести атомов углерода, и циклоалкил,содержащий от трех до приблизительно шести атомов углерода, замещенный неразветвленным или разветвленным алкилом, содержащим от одного до приблизительно четырех атомов углерода; фтор- или хлоралкила, содержащего от одного до приблизительно десяти атомов углерода, и один или несколько атомов фтора или хлора; неразветвленного или разветвленного алкенила, содержащего от двух до приблизительно десяти атомов углерода, и замещенного неразветвленного или разветвленного алкенила,содержащего от двух до приблизительно десяти атомов углерода, где заместитель выбирают из группы,включающей циклоалкил, содержащий от трех до приблизительно шести атомов углерода, и циклоалкил,содержащий от трех до приблизительно шести атомов углерода, замещенный неразветвленным или разветвленным алкилом, содержащим от одного до приблизительно четырех атомов углерода; гидроксиалкил из одного приблизительно шести атомов углерода; алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно шести атомов углерода; ацилоксиалкил, где ацилоксикомпонент представляет собой алканоилокси из двух до приблизительно четырех атомов углерода, или бензоилокси, и алкильный компонент содержит от одного до приблизительно шести атомов углерода, при условии, что любая такая алкильная, замещенная алкильная, алкенильная, замещенная алкенильная, гидроксиалкильная, алкоксиалкильная или ацилоксиалкильная группа не имеет полностью углеродный замещенный атом углерода,связанный непосредственно с атомом азота; бензила; (фенил)этила и фенила; указанный бензильный,(фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце одним или двумя компонентами, независимо выбранными из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген, при условии, что если указанное бензольное кольцо замещено двумя указанными компонентами, то компоненты вместе содержат не больше шести атомов углерода;-CHRxRy, где Ry представляет собой водород или углерод-углеродную связь, при условии, что еслиRy представляет собой водород, то Rx представляет собой алкокси из одного до приблизительно четырех атомов углерода, гидроксиалкокси из одного до приблизительно четырех атомов углерода, 1-алкинил из двух до приблизительно десяти атомов углерода, тетрагидропиранил, алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно четырех атомов углерода, 2-, 3- или 4-пиридил, и при дальнейшем условии,что если Ry представляет собой углерод-углеродную связь, то Ry и Rx вместе образуют тетрагидрофуранильную группу, необязательно замещенную одним или несколькими заместителями, независимо выбранными из группы, включающей гидрокси или гидроксиалкил из одного до приблизительно четырех атомов углерода; неразветвленный или разветвленный алкил, содержащий от одного до приблизительно восьми атомов углерода, неразветвленный или разветвленный гидроксиалкил, содержащий от одного до приблизительно шести атомов углерода, морфолинометил, бензил, (фенил)этил и фенил, бензильный, (фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце компонентом,выбранным из группы, включающей метил, метокси или галоген;-C(RS)(RT)(X), где RS и RT независимо выбирают из группы, включающей водород, алкил из одного до приблизительно четырех атомов углерода, фенил и замещенный фенил, где заместитель выбирают из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген;X представляет собой алкокси, содержащий от одного до приблизительно четырех атомов углерода,алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно четырех атомов углерода, галоалкил из одного до приблизительно четырех атомов углерода, алкиламидо, где алкильная группа содержит от одного до приблизительно четырех атомов углерода, амино, замещенный амино, где заместитель представляет собой алкил или гидроксиалкил из одного до приблизительно четырех атомов углерода, азидо, алкилтио из одного до приблизительно четырех атомов углерода, или морфолиноалкил, где алкильный компонент содержит от одного до приблизительно четырех атомов углерода;Ra и Rb каждый независимо представляет собой водород, (C1-C6)алкил, гидрокси(C1-C6)алкил, амино(C1-C6)алкил, аминосульфонил, (С 1-С 6)алканоил, арил или бензил, все из них необязательно замещены одной или несколькими аминогруппами; или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пирролидино, пиперидино или морфолиногруппу; пунктирные линии в пятичленном кольце формулы (I) выше представляют собой необязательную связь, которая связывает азот пятичленного кольца с углеродом, который находится между двумя азотами пятичленного кольца, и если связь присутствует, либо R1 или R3 отсутствует; при условии, что Ra и Rb вместе позволяют образовываться иону четвертичного аммония либо на азоте центрального структурного элемента N(Ra)(Rb) или посредством любого иона четвертичного аммония, обеспечиваемого Ra и/или Rb; или его фармацевтически приемлемая соль. Фармацевтически приемлемая соль в контексте настоящего изобретения обычно относится к соли уксусной или молочной кислоты. В соответствии с одним дальнейшим предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит имидазохинолин или его производное имидазохинолинамин, такое как 1H-имидазо[4,5-с]хинолин-4-амины, обычно выбирают из одной из следующих формул (II)-(VI): например, такие соединения могут быть выбраны из формулы (II)R11 выбирают из группы, включающей алкил от одного до приблизительно десяти атомов углерода, гидроксиалкил из одного приблизительно шести атомов углерода, ацилоксиалкил, где ацилоксикомпонент представляет собой алканоилокси из двух до приблизительно четырех атомов углерода, или бензоилокси, и алкильный компонент содержит от одного до приблизительно шести атомов углерода, бензил, (фенил)этил и фенил, указанный бензильный, (фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце одним или двумя компонентами, независимо выбранными из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген, при условии, что если указанное бензольное кольцо замещено двумя из указанных компонентов, то указанные компоненты вместе содержат не более шести атомов углерода;R21 выбирают из группы, включающей водород, алкил из одного до приблизительно восьми атомов углерода, бензил, (фенил)этил и фенил, бензильный, (фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце одним или двумя компонентами, независимо выбранными из группы,включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген, при условии, что если бензольное кольцо замещено двумя из указанных компонентов, то компоненты вместе содержат не больше шести атомов углерода; и каждыйR1 независимо выбирают из группы, включающей алкокси из одного до приблизительно четырех атомов углерода, галоген и алкил из одного до приблизительно четырех атомов углерода, иn представляет собой целое число от 0 до 2, при условии, что если n равен 2, то указанные R1 группы вместе содержат не больше шести атомов углерода; или фармацевтически приемлемая соль любого из вышеуказанных; или могут быть выбраны из формулы (III)R12 выбирают из группы, включающей неразветвленный или разветвленный алкенил, содержащий от двух до приблизительно десяти атомов углерода, и замещенный неразветвленный или разветвленный алкенил, содержащий от двух до приблизительно десяти атомов углерода, где заместитель выбирают из группы, включающей неразветвленный или разветвленный алкил, содержащий от одного до приблизительно четырех атомов углерода, и циклоалкил, содержащий от трех до приблизительно шести атомов углерода; и циклоалкил, содержащий от трех до приблизительно шести атомов углерода, замещенный неразветвленным или разветвленным алкилом, содержащим от одного до приблизительно четырех атомов углерода; иR22 выбирают из группы, включающей водород, неразветвленный или разветвленный алкил, содержащий от одного до приблизительно восьми атомов углерода, бензил, (фенил)этил и фенил, бензильный,(фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце одним или двумя компонентами, независимо выбранными из группы, включающей неразветвленный или разветвленный алкил, содержащий от одного до приблизительно четырех атомов углерода, неразветвленный или разветвленный алкокси, содержащий от одного до приблизительно четырех атомов углерода, и галоген,при условии, что если бензольное кольцо замещено двумя такими компонентами, то компоненты вместе содержат не больше шести атомов углерода; и каждыйR2 независимо выбирают из группы, включающей неразветвленный или разветвленный алкокси,содержащий от одного до приблизительно четырех атомов углерода, галоген и неразветвленный или разветвленный алкил, содержащий от одного до приблизительно четырех атомов углерода, иn представляет собой целое число от нуля до 2, при условии, что если n равен 2, то указанные R2 группы вместе содержат не больше шести атомов углерода; или фармацевтически приемлемая соль любого из вышеуказанных; или могут быть выбраны из формулы (IV)R23 выбирают из группы, включающей водород, неразветвленный или разветвленный алкил из одного до приблизительно восьми атомов углерода, бензил, (фенил)этил и фенил, бензильный, (фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце одним или двумя компонентами, независимо выбранными из группы, включающей неразветвленный или разветвленный алкил из одного до приблизительно четырех атомов углерода, неразветвленный или разветвленный алкокси из одного до приблизительно четырех атомов углерода, и галоген, при условии, что если бензольное кольцо замещено двумя такими компонентами, то компоненты вместе содержат не больше шести атомов углерода; и каждыйR3 независимо выбирают из группы, включающей неразветвленный или разветвленный алкокси из одного до приблизительно четырех атомов углерода, галоген и неразветвленный или разветвленный алкил из одного до приблизительно четырех атомов углерода, иn представляет собой целое число от нуля до 2, при условии, что если n равен 2, то указанные R3 группы вместе содержат не больше шести атомов углерода; или фармацевтически приемлемая соль любого из вышеуказанных; или могут быть выбраны из формулы (V)R14 представляет собой -CHRxRy, где Ry представляет собой водород или углерод-углеродную связь,при условии, что если Ry представляет собой водород, то Rx представляет собой алкокси из одного до приблизительно четырех атомов углерода, гидроксиалкокси из одного до приблизительно четырех атомов углерода, 1-алкинил из двух до приблизительно десяти атомов углерода, тетрагидропиранил, алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно четырех атомов углерода, 2-, 3- или 4 пиридил, и при дальнейшем условии, что если Ry представляет собой углерод-углеродную связь, то Ry иRx вместе образуют тетрагидрофуранильную группу, необязательно замещенную одним или несколькими заместителями, независимо выбранными из группы, включающей гидрокси и гидроксиалкил из одного до приблизительно четырех атомов углерода;R24 выбирают из группы, включающей водород, алкил из одного до приблизительно четырех атомов углерода, фенил и замещенный фенил, где заместитель выбирают из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген; и выбирают из группы, включающей водород, неразветвленный или разветвленный алкокси, содержащий от одного до приблизительно четырех атомов углерода, галоген, и неразветвленный или разветвленный алкил, содержащий от одного до приблизительно четырех атомов углерода; или фармацевтически приемлемая соль любого из вышеуказанных; или могут быть выбраны из формулы (VI)R15 выбирают из группы, включающей водород; неразветвленный или разветвленный алкил, содержащий от одного до приблизительно десяти атомов углерода, и замещенный неразветвленный или разветвленный алкил, содержащий от одного до приблизительно десяти атомов углерода, где заместитель выбирают из группы, включающей циклоалкил, содержащий от трех до приблизительно шести атомов углерода, и циклоалкил, содержащий от трех до приблизительно шести атомов углерода, замещенный неразветвленным или разветвленным алкилом, содержащим от одного до приблизительно четырех атомов углерода; неразветвленный или разветвленный алкенил, содержащий от двух до приблизительно десяти атомов углерода, и замещенный неразветвленный или разветвленный алкенил, содержащий от двух до приблизительно десяти атомов углерода, где заместитель выбирают из группы, включающей циклоалкил, содержащий от трех до приблизительно шести атомов углерода, и циклоалкил, содержащий от трех до приблизительно шести атомов углерода, замещенный неразветвленным или разветвленным алкилом, содержащим от одного до приблизительно четырех атомов углерода; гидроксиалкил из одного приблизительно шести атомов углерода; алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно шести атомов углерода; ацилоксиалкил, где ацилоксикомпонент представляет собой алканоилокси из двух до приблизительно четырех атомов углерода, или бензоилокси, и алкильный компонент содержит от одного до приблизительно шести атомов углерода; бензил; (фенил)этил и фенил; указанный бензил, (фенил)этил или фенил, заместитель необязательно замещен на бензольном кольце одним или двумя компонентами, независимо выбранными из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген, при условии, что если указанное бензольное кольцо замещено двумя указанными компонентами, то компоненты вместе содержат не больше шести атомов углерода;RS и RT независимо выбирают из группы, включающей водород, алкил из одного до приблизительно четырех атомов углерода, фенил и замещенный фенил, где заместитель выбирают из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген;X выбирают из группы, включающей алкокси, содержащий от одного до приблизительно четырех атомов углерода, алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно четырех атомов углерода, гидроксиалкил из одного до приблизительно четырех атомов углерода, галоалкил из одного до приблизительно четырех атомов углерода, алкиламидо, где алкильная группа содержит от одного до приблизительно четырех атомов углерода, амино, замещенный амино, где заместитель представляет собой алкил или гидроксиалкил из одного до приблизительно четырех атомов углерода, азидо, хлор, гидрокси, 1-морфолино, 1-пирролидино, алкилтио из одного до приблизительно четырех атомов углерода; иR5 выбирают из группы, включающей водород, неразветвленный или разветвленный алкокси, содержащий от одного до приблизительно четырех атомов углерода, галоген и неразветвленный или разветвленный алкил, содержащий от одного до приблизительно четырех атомов углерода; или фармацевтически приемлемая соль любого из вышеуказанных. В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит имидазохинолин или его производные имидазохинолин(амины) из следующей формулы (VII):R16 выбирают из группы, включающей водород; циклический алкил из трех, четырех или пяти атомов углерода; неразветвленный или разветвленный алкил, содержащий от одного до приблизительно десяти атомов углерода, и замещенный неразветвленный или разветвленный алкил, содержащий от одного до приблизительно десяти атомов углерода, где заместитель выбирают из группы, включающей циклоалкил, содержащий от трех до приблизительно шести атомов углерода, и циклоалкил, содержащий от трех до приблизительно шести атомов углерода, замещенный неразветвленным или разветвленным алкилом, содержащим от одного до приблизительно четырех атомов углерода; фтор- или хлоралкил, содержащий от одного до приблизительно десяти атомов углерода, и один или несколько атомов фтора или хлора; неразветвленный или разветвленный алкенил, содержащий от двух до приблизительно десяти атомов углерода, и замещенный неразветвленный или разветвленный алкенил, содержащий от двух до приблизительно десяти атомов углерода, где заместитель выбирают из группы, включающей циклоал- 13023208 кил, содержащий от трех до приблизительно шести атомов углерода, и циклоалкил, содержащий от трех до приблизительно шести атомов углерода, замещенный неразветвленным или разветвленным алкилом,содержащим от одного до приблизительно четырех атомов углерода; гидроксиалкил из одного приблизительно шести атомов углерода; алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно шести атомов углерода; ацилоксиалкил, где ацилоксикомпонент представляет собой алканоилокси из двух до приблизительно четырех атомов углерода, или бензоилокси, и алкильный компонент содержит от одного до приблизительно шести атомов углерода, при условии, что любая такая алкильная, замещенная алкильная, алкенильная, замещенная алкенильная, гидроксиалкильная, алкоксиалкильная, или ацилоксиалкильная группа не имеет полностью углеродный замещенный атом углерода, связанный непосредственно с атомом азота; бензил; (фенил)этил и фенил; указанный бензильный, (фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце одним или двумя компонентами, независимо выбранными из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода, и галоген, при условии, что если указанное бензольное кольцо замещено двумя указанными компонентами, то компоненты вместе содержат не больше шести атомов углерода; и-CHRxRy, где Ry представляет собой водород или углерод-углеродную связь, при условии, что еслиRy представляет собой водород, то Rx представляет собой алкокси из одного до приблизительно четырех атомов углерода, гидроксиалкокси из одного до приблизительно четырех атомов углерода, 1-алкинил из двух до приблизительно десяти атомов углерода, тетрагидропиранил, алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент, содержащий от одного до приблизительно четырех атомов углерода, 2-, 3- или 4-пиридил, и при дальнейшем условии, что если Ry представляет собой углерод-углеродную связь, то Ry и Rx вместе образуют тетрагидрофуранильную группу, необязательно замещенную одним или несколькими заместителями, независимо выбранными из группы, включающей гидрокси и гидроксиалкил из одного до приблизительно четырех атомов углерода,R26 выбирают из группы, включающей водород, неразветвленный или разветвленный алкил, содержащий от одного до приблизительно восьми атомов углерода, неразветвленный или разветвленный гидроксиалкил, содержащий от одного до приблизительно шести атомов углерода, морфолинометил, бензил, (фенил)этил и фенил, бензильный, (фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце компонентом, выбранным из группы, включающей метил, метокси, и галоген; иRS и RT независимо выбирают из группы, включающей водород, алкил из одного до приблизительно четырех атомов углерода, фенил и замещенный фенил, где заместитель выбирают из группы, включающей алкил из одного до приблизительно четырех атомов углерода, алкокси из одного до приблизительно четырех атомов углерода и галоген;X выбирают из группы, включающей алкокси, содержащий от одного до приблизительно четырех атомов углерода, алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно четырех атомов углерода, галоалкил из одного до приблизительно четырех атомов углерода, алкиламидо, где алкильная группа содержит от одного до приблизительно четырех атомов углерода, амино, замещенный амино, где заместитель представляет собой алкил или гидроксиалкил из одного до приблизительно четырех атомов углерода, азидо, алкилтио из одного до приблизительно четырех атомов углерода и морфолиноалкил, где алкильный компонент содержит от одного до приблизительно четырех атомов углерода, иR6 выбирают из группы, включающей водород, фтор, хлор, неразветвленный или разветвленный алкил, содержащий от одного до приблизительно четырех атомов углерода, и неразветвленный или разветвленный фтор- или хлоралкил, содержащий от одного до приблизительно четырех атомов углерода, и по меньшей мере один атом фтора или хлора; и их фармацевтически приемлемые соли. В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит имидазохинолин или его производные имидазохинолин(амины) из следующей формулы (VIII): неразветвленный, разветвленный или циклический алкил, содержащий от одного до приблизительно десяти атомов углерода, неразветвленный или разветвленный алкенил, содержащий от двух до приблизительно десяти атомов углерода, неразветвленный или разветвленный гидроксиалкил, содержащий от одного до приблизительно шести атомов углерода, алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно шести атомов углерода, и фенилэтил; и -CH=CRZRZ, где каждый RZ представляет собой независимо неразветвленный, разветвленный или циклический алкил из одного приблизительно шести атомов углерода;R27 выбирают из группы, включающей водород, неразветвленный или разветвленный алкил, содержащий от одного до приблизительно восьми атомов углерода, неразветвленный или разветвленный гидроксиалкил, содержащий от одного до приблизительно шести атомов углерода, алкоксиалкил, где алкоксикомпонент содержит от одного до приблизительно четырех атомов углерода, и алкильный компонент содержит от одного до приблизительно шести атомов углерода, бензил, (фенил)этил и фенил, бензильный, (фенил)этильный или фенильный заместитель необязательно замещен на бензольном кольце компонентом, выбранным из группы, включающей метил, метокси и галоген; и морфолиноалкил, где алкильный компонент содержит от одного до приблизительно четырех атомов углерода;R67 и R77 независимо выбирают из группы, включающей водород и алкил из одного до приблизительно пяти атомов углерода, при условии, что R67 и R77 вместе содержат не больше шести атомов углерода, и при дальнейшем условии, что если R77 представляет собой водород, то R67 отличается от водорода и R27 отличается от водорода или морфолиноалкила, и при дальнейшем условии, что если R67 представляет собой водород, то R77 и R27 отличаются от водорода; и их фармацевтически приемлемые соли. В соответствии с дополнительным предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит имидазохинолин или его производные имидазохинолин(амины) из следующей формулы (IX):-(CH2)a-C(RDRE)(CH2)b-, где а и b представляют собой целые числа и а+b представляет собой 0-3, RD представляет собой водород или алкил из одного до четырех атомов углерода, и RE выбирают из группы,включающей алкил из одного до четырех атомов углерода, гидрокси, -ORF, где RF представляет собой алкил из одного до четырех атомов углерода, и -NRGR'G, где RG и R'G независимо представляют собой водород или алкил из одного до четырех атомов углерода; и-(СН 2)a-(Y)-(СН 2)b-, где а и b представляют собой целые числа и а+b представляет собой 0-3, и Y представляет собой О, S или -NRJ-, где RJ представляет собой водород или алкил из одного до четырех атомов углерода; и гдеR8 выбирают из группы, включающей алкил из одного до четырех атомов углерода, алкокси из одного до четырех атомов углерода и галоген,и их фармацевтически приемлемые соли. В соответствии с еще одним предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит имидазохинолин(амин) специфическое соединение имихимод, предпочтительно имеющий специфическую формулу 1-изобутил-1H-имидазо[4,5-с]хинолин 4-амин, еще более предпочтительно которая содержит следующую специфическую структуру: В соответствии с еще одним предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит имидазохинолин(амин) специфическое соединение резихимод, предпочтительно который содержит следующую специфическую структуру: Фармацевтическая композиция в соответствии с изобретением также может содержать смесь больше чем один имидазохинолин(амин), как определено выше, обычно 2-4 имидазохинолин(амины), которые могут быть выбраны, например, из любого из вышеописанных соединений в соответствии с формулами (I)-(XI). Предпочтительно по меньшей мере один из фармацевтически активных компонентов в такой фармацевтически активной композиции, которая содержит больше чем один имидазохинолин(амин),соответствует формула (XI):имихимод. В контексте имидазохинолин(аминов) или их производных, как определено выше, предпочтительно могут применяться следующие дальнейшие определения. В формулах, содержащих целое число n и где n может представлять собой ноль, один или два, n предпочтительно представляет собой ноль или один. Заместители R11-R17 выше обычно обозначаются "1-заместители" в настоящем изобретении. В одном варианте осуществления 1-заместители предпочтительно представляют собой алкил, содержащий от одного до шести атомов углерода, и гидроксиалкил, содержащий от одного до шести атомов углерода,например, 1-заместитель представляет собой 2-метилпропил или 2-гидрокси-2-метилпропил. Заместители R21-R27 выше обычно обозначаются "2-заместители" в настоящей заявке. В одном варианте осуществления 2-заместители предпочтительно представляют собой водород, алкил от одного до шести атомов углерода, алкоксиалкил, где алкоксикомпонент содержит от одного до четырех атомов углерода, и алкильный компонент содержит от одного до четырех атомов углерода, и гидроксиалкил из одного до четырех атомов углерода, например, 2-заместитель представляет собой водород, метил, бутил,гидроксиметил, этоксиметил или метоксиэтил. Термин "алкил" предпочтительно включает неразветвленные или разветвленные С 1-10 алкильные группы, например, метил, этил, пропил, бутил, пентил, изопропил, изобутил, 1-метилпропил, 3 метилбутил, гексил и другие. Термин "низший алкил" предпочтительно включает неразветвленный или разветвленный C1-6 алкильные группы, например метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1 диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил и другие. Термин "алкилен" предпочтительно относится к двухвалентной неразветвленной или разветвленной углеводородной цепи (например, этилен -СН 2-СН 2-). Термин "С 3-7 циклоалкил" предпочтительно включает такие группы, как циклопропил, циклопентил,циклогексил, циклогептил и другие, и алкилзамещенную С 3-7 циклоалкильную группу, предпочтительно неразветвленную или разветвленную C1-6 алкильную группу, такую как метил, этил, пропил, бутил или пентил, и С 5-7 циклоалкильную группу, такую как циклопентил или циклогексил и другие. Термин "низший алкокси" предпочтительно включает C1-6 алкоксигруппы, такие как метокси, этокси или пропокси и другие. Термин "низший алканоил" предпочтительно включает C1-6 алканоильные группы, такие как формил, ацетил, пропаноил, бутаноил, пентаноил или гексаноил и другие. Термин "С 7-11 ароил" включает такие группы, как бензоил или нафтоил. Термин "низший алкоксикарбонил" предпочтительно включает С 2-7 алкоксикарбонильные группы,такие как метоксикарбонил, этоксикарбонил или пропоксикарбонил и другие. Термин "низшая алкиламиногруппа" предпочтительно обозначает аминогруппу, замещеннуюC1-6 алкильной группой, такую как метиламино, этиламино, пропиламино, бутиламино и другие. Термин "ди(низший алкил)аминогруппа" предпочтительно обозначает аминогруппу, замещенную одинаковой или разной и C1-6 алкильной группой (например, диметиламино, диэтиламино, этилметиламино). Термин "низшая алкилкарбамоильная группа" предпочтительно обозначает карбамоильную группу,замещенную C1-6 алкильной группой (например, метилкарбамоил, этилкарбамоил, пропилкарбамоил, бутилкарбамоил). Термин "ди(низший алкил)карбамоильная группа" предпочтительно обозначает карбамоильную группу, замещенную одинаковой или разной и C1-6 алкильной группой (например, диметилкарбамоил,диэтилкарбамоил, этилметилкарбамоил). Термин "атом галогена", как определено в настоящей заявке, предпочтительно обозначает атом галогена, такой как атом фтора, атом хлора, атом брома или атом йода. Термин "арил", как определено в настоящей заявке, предпочтительно относится к С 6-10 моноциклической или сопряженной циклической арильной группе, такой как фенил, инденил или нафтил и другие. Термин "гетероциклический", как определено в настоящей заявке, предпочтительно относится к моноциклическим насыщенным гетероциклическим группам, или ненасыщенной моноциклической или сопряженной гетероциклической группе, содержащей по меньшей мере один гетероатом, например, 0-3 атома азота, 0-1 атом кислорода (-О-) и 0-1 атом серы (-S-). В этом контексте неограничивающими примерами насыщенной моноциклической гетероциклической группы являются 5- или 6-членная насыщенная гетероциклическая группа, такая как тетрагидрофуранил, пирролидинил, морфолинил, пиперидил,пиперазинил или пиразолидинил. Неограничивающими примерами ненасыщенной моноциклической гетероциклической группы являются 5- или 6-членная ненасыщенная гетероциклическая группа, такая как фурил, пирролил, пиразолил, имидазолил, тиазолил, тиенил, пиридил или пиримидинил. Неограничивающими примерами ненасыщенных сопряженных гетероциклических групп являются ненасыщенная бициклическая гетероциклическая группа, такая как индолил, изоиндолил, хинолил, бензотизолил, хроманил, бензофуранил и другие. Дополнительно, алкильные, арильные и гетероциклические группы, как определено в настоящей заявке, могут быть необязательно замещены одним или несколькими заместителями, где заместители являются одинаковыми или разными, и включают низший алкил; C1-6 алкокси, такой как метокси, этокси или пропокси; карбоксил; С 2-7 алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил или пропоксикарбонил) и галоген; циклоалкил и включают C3-6 циклоалкил; гидроксил; C1-6 алкокси; амино; циано; арил; замещенный арил, такой как 4-гидроксифенил, 4-метоксифенил, 4-хлорфенил или 3,4-дихлорфенил; нитро и галоген, гидроксил; гидрокси C1-6 алкилен, такой как гидроксиметил, 2-гидроксиэтил или 3-гидроксипропил; низший алкокси; C1-6 алкокси C1-6 алкил, такой как 2-метоксиэтил, 2-этоксиэтил или 3 метоксипропил; амино; алкиламино; диалкиламино; циано; нитро; ацил; карбоксил; низший алкоксикарбонил; галоген; меркапто; C1-6 алкилтио, такой как, метилтио, этилтио, пропилтио или бутилтио; замещенный C1-6 алкилтио, такой как метоксиэтилтио, метилтиоэтилтио, гидроксиэтилтио или хлорэтилтио; арил; замещенный С 6-10 моноциклический или сопряженно-циклический арил, такой как 4-гидроксифенил, 4-метоксифенил, 4-фторфенил, 4-хлорфенил или 3,4-дихлорфенил; 5-6-членный ненасыщенный гетероциклил, такой как фурил, пирролил, пиразолил, имидазолил, тиазолил, тиенил, пиридил или пиримидинил; и бициклический ненасыщенный гетероциклил, такой как индолил, изоиндолил, хинолил, бензотиазолил, хроманил, бензофуранил или фталимино. Кроме того, гетероциклическое кольцо, как определено в настоящей заявке, необязательно может быть замещено одним или несколькими заместителями,где заместители являются одинаковыми или разными и включают C1-6 алкил; гидрокси C1-6 алкилен;C1-6 алкокси C1-6 алкилен; гидроксил; C1-6 алкокси и циано. В завершение, специалист в данной области техники примет во внимание, что имидазохинолин(амины), как определено выше в контексте настоящего изобретения, также могут иметь хиральный центр и могут быть выделены в оптически активных и рацемических формах. Некоторые соединения могут проявлять полиморфизм. Подразумевается, что настоящее изобретение охватывает любую рацемическую, оптически-активную, полиморфную или стереоизомерную форму, или их смеси, имидазохинолин(аминов) или их производных, как определено выше, которые обладают полезными свойствами,описанными в настоящей заявке, в данной области техники известно, как получить оптически активные формы (например, путем разделения рацемической формы с помощью методик перекристаллизации, путем синтеза с оптически-активных исходных веществ, путем хирального синтеза или путем хроматографического разделения, используя хиральную неподвижную фазу) и как определить никотиновую агонистическую активность, используя стандартные тесты, описанные в настоящей заявке, или используя другие сходные тесты, которые хорошо известны в данной области техники. В соответствии с одним вариантом фармацевтическая композиция в соответствии с настоящим изобретением обычно содержит имидазохинолин(амин) или его производное, как определено в настоящей заявке, предпочтительно имихимод или его производное, в количестве от приблизительно 0,005%(мас./об.) до приблизительно 5% (мас./об.), предпочтительно в количестве от приблизительно 0,01%(мас./об.) до приблизительно 5% (мас./об.), более предпочтительно в количестве от приблизительно 0,1%(мас./об.) до приблизительно 4% (мас./об.), еще более предпочтительно в количестве от приблизительно 0,1% (мас./об.) до приблизительно 3% (мас./об.), еще более предпочтительно в количестве от приблизительно 0,2% (мас./об.) до приблизительно 2% (мас./об.) и наиболее предпочтительно в количестве от приблизительно 0,2% (мас./об.) до приблизительно 1% (мас./об.) или еще в количестве от приблизительно 0,5% (мас./об.) до приблизительно 1% (мас./об.), где количества, как определено в % (мас./об.), могут быть определены либо на основе веса имидазохинолин(амина) или его производного, как определено в настоящей заявке, предпочтительно имихимода или его производного, по отношению к общему объему фармацевтической композиции в соответствии с изобретением, если, например, обеспечивается в виде жидкого или полужидкого препарата. Альтернативно, вышеуказанные количества могут быть определены в % (мас./мас.), где количества, как определено в% (мас./мас), могут быть определены либо на основе веса имидазохинолин(амина) или его производного, как определено выше, предпочтительно имихимода или его производного, по отношению к общему весу фармацевтической композиции в соответствии с изобретением. В соответствии с одним особо предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с настоящим изобретением обычно содержит имидазохинолин(амин) или его производное, как определено в настоящей заявке, предпочтительно имихимод или его производное, в количестве от приблизительно 0,005% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,01% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,1% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,2% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,3% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,4%(мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,5% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,6% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,7% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,8% (мас./об.) до приблизительно 1,2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 0,9% (мас./об.) до приблизительно 1, 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,0% (мас./об.) до приблизительно 2, 3, 4 или 5%(мас./об.), в количестве от приблизительно 1,1% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,2% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,3% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,4% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,5% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,6%(мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,7% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,8% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 1,9% (мас./об.) до приблизительно 2, 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,0% (мас./об.) до приблизительно 3, 4 или 5%(мас./об.), в количестве от приблизительно 2,1% (мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,2% (мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,3% (мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,4% (мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,5%(мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,6% (мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,7% (мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 2,8% (мас./об.) до приблизительно 3, 4 или 5%(мас./об.), в количестве от приблизительно 2,9% (мас./об.) до приблизительно 3, 4 или 5% (мас./об.), в количестве от приблизительно 3,0% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,1% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,2% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,3% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,4% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,5% (мас./об.) до приблизительно 4 или 5%(мас./об.), в количестве от приблизительно 3,6% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,7% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,8% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 3,9% (мас./об.) до приблизительно 4 или 5% (мас./об.), в количестве от приблизительно 4,0% (мас./об.) до приблизительно 5% (мас./об.), в количестве от приблизительно 4,1% (мас./об.) до приблизительно 5%(мас./об.), в количестве от приблизительно 4,2% (мас./об.) до приблизительно 5% (мас./об.), в количестве от приблизительно 4,3% (мас./об.) до приблизительно 5% (мас./об.), в количестве от приблизительно 4,4% (мас./об.) до приблизительно 5% (мас./об.), в количестве от приблизительно 4,5% (мас./об.) до приблизительно 5% (мас./об.), в количестве от приблизительно 4,6% (мас./об.) до приблизительно 5%(мас./об.), в количестве от приблизительно 4,7% (мас./об.) до приблизительно 5% (мас./об.), в количестве от приблизительно 4,8% (мас./об.) до приблизительно 5% (мас./об.), или в количестве от приблизительно 4,9% (мас./об.) до приблизительно 5% (мас./об.). Вышеуказанные значения также могут быть определены в % (мас./мас.). Оба термина "% (мас./об.)" и "% (мас./мас.)" предпочтительно имеют значения, как определено выше. В соответствии с другим особо предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с настоящим изобретением обычно содержит имидазохинолин(амин) или его производное, как определено в настоящей заявке, предпочтительно имихимод или его производное, в количестве от приблизительно 0,1% (мас./об.) до приблизительно 1% (мас./об.). В соответствии с одним дальнейшим особо предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с настоящим изобретением обычно содержит имидазохинолин(амин) или его производное, как определено в настоящей заявке, предпочтительно имихимод или его производное, в количестве от приблизительно 0,005% (мас./об.) до приблизительно 0,5% (мас./об.), в количестве от приблизительно 0,01% (мас./об.) до приблизительно 0,5% (мас./об.), в количестве от приблизительно 0,1% (мас./об.) до приблизительно 0,6% (мас./об.), в количестве от приблизительно 0,2%(мас./об.) до приблизительно 0,7% (мас./об.), в количестве от приблизительно 0,3% (мас./об.) до приблизительно 0,8% (мас./об.), в количестве от приблизительно 0,4% (мас./об.) до приблизительно 0,9%(мас./об.), в количестве от приблизительно 0,5% (мас./об.) до приблизительно 1,0% (мас./об.), в количестве от приблизительно 0,6% (мас./об.) до приблизительно 1,1% (мас./об.), в количестве от приблизительно 0,7% (мас./об.) до приблизительно 1,2% (мас./об.), в количестве от приблизительно 0,8% (мас./об.) до приблизительно 1,3% (мас./об.), в количестве от приблизительно 0,9% (мас./об.) до приблизительно 1,4% (мас./об.), в количестве от приблизительно 1,1% (мас./об.) до приблизительно 1,5% (мас./об.), в количестве от приблизительно 1,2% (мас./об.) до приблизительно 1,6% (мас./об.), в количестве от приблизительно 1,3% (мас./об.) до приблизительно 1,7% (мас./об.), в количестве от приблизительно 1,4%(мас./об.) до приблизительно 1,8% (мас./об.), в количестве от приблизительно 1,5% (мас./об.) до приблизительно 1,9% (мас./об.), в количестве от приблизительно 1,6% (мас./об.) до приблизительно 2,0%(мас./об.), в количестве от приблизительно 1,7% (мас./об.) до приблизительно 2,1% (мас./об.), в количестве от приблизительно 1,8% (мас./об.) до приблизительно 2,2% (мас./об.), в количестве от приблизительно 1,9% (мас./об.) до приблизительно 2,3% (мас./об.), в количестве от приблизительно 2,0% (мас./об.) до приблизительно 2,5% (мас./об.), в количестве от приблизительно 2,1% (мас./об.) до приблизительно 2,6% (мас./об.), в количестве от приблизительно 2,2% (мас./об.) до приблизительно 2,7% (мас./об.), в количестве от приблизительно 2,3% (мас./об.) до приблизительно 2,8% (мас./об.), в количестве от приблизительно 2,4% (мас./об.) до приблизительно 2,9% (мас./об.), в количестве от приблизительно 2,5%(мас./об.) до приблизительно 3,0% (мас./об.), в количестве от приблизительно 2,6% (мас./об.) до приблизительно 3,1% (мас./об.), в количестве от приблизительно 2,7% (мас./об.) до приблизительно 3,2%(мас./об.), в количестве от приблизительно 2,8% (мас./об.) до приблизительно 3,3% (мас./об.), в количестве от приблизительно 2,9% (мас./об.) до приблизительно 3,4% (мас./об.), в количестве от приблизительно 3,0% (мас./об.) до приблизительно 3,5% (мас./об.), в количестве от приблизительно 3,1% (мас./об.) до приблизительно 3,6% (мас./об.), в количестве от приблизительно 3,2% (мас./об.) до приблизительно 3,7% (мас./об.), в количестве от приблизительно 3,3% (мас./об.) до приблизительно 3,8% (мас./об.), в количестве от приблизительно 3,4% (мас./об.) до приблизительно 3,9% (мас./об.), в количестве от приблизительно 3,5% (мас./об.) до приблизительно 4,0% (мас./об.), в количестве от приблизительно 3,6%(мас./об.) до приблизительно 4,1% (мас./об.), в количестве от приблизительно 3,7% (мас./об.) до приблизительно 4,2% (мас./об.), в количестве от приблизительно 3,8% (мас./об.) до приблизительно 4,3%(мас./об.), в количестве от приблизительно 3,9% (мас./об.) до приблизительно 4,4% (мас./об.), в количестве от приблизительно 4,0% (мас./об.) до приблизительно 4,5% (мас./об.), в количестве от приблизительно 4,1% (мас./об.) до приблизительно 4,6% (мас./об.), в количестве от приблизительно 4,2% (мас./об.) до приблизительно 4,7% (мас./об.), в количестве от приблизительно 4,3% (мас./об.) до приблизительно 4,8% (мас./об.), в количестве от приблизительно 4,4% (мас./об.) до приблизительно 4,9% (мас./об.), или в количестве от приблизительно 4,5% (мас./об.) до приблизительно 5,0% (мас./об.). Вышеуказанные значения также могут быть определены в % (мас./мас). Оба термина "% (мас./об.)" и "% (мас./мас)" предпочтительно имеют значения, как определено выше. Для приготовления фармацевтической композиции в соответствии с изобретением, например, если приготавливают (маточный) раствор при приготовлении фармацевтической композиции в соответствии с изобретением, тем не менее, имидазохинолин(амин) или его производное, как определено в настоящей заявке, может быть растворен в таком (маточном) водном растворе, содержащем либо молочную кислоту или уксусную кислоту или смесь обеих кислот, как определено выше обычно, более высокой концентрации, как указано выше для конечной фармацевтической композиции в соответствии с изобретением. Для таких целей (маточный) раствор может содержать количество от приблизительно 0,005% (мас./об.) или 0,01% (мас./об.) до приблизительно 30% (мас./об.), предпочтительно количество от приблизительно 1%(мас./об.) до приблизительно 25% (мас./об.), более предпочтительно количество от приблизительно 5%(мас./об.) до приблизительно 25% (мас./об.), еще более предпочтительно количество от приблизительно 10% (мас./об.) до приблизительно 25% (мас./об.) и наиболее предпочтительно количество от приблизительно 15% (мас./об.) до приблизительно 20 или 25% (мас./об.) имидазохинолин(амина) или его производного, как определено в настоящей заявке. Вышеуказанные значения альтернативно могут пониматься как % (мас./мас.). Эти проценты "% (мас./об.)" и "% (мас./мас.)" предпочтительно имеют значения, как определено выше. В соответствии с другим вариантом осуществления фармацевтическая композиция в соответствии с изобретением также может содержать добавки или дополнительные компоненты. Благоприятно, такие добавки или дополнительные компоненты усиливают растворимость и/или проникновение через мембрану имидазохинолин(амина) или его производного, как определено в настоящей заявке, в фармацевтической композиции в соответствии с изобретением. Альтернативно или дополнительно, такие добавки или дополнительные компоненты предоставляют возможность обеспечить более подходящий препарат для специфического заболевания, которое подвергают лечению, придают лучшую переносимость фармацевтической композиции в соответствии с изобретением и т.д. В соответствии с предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением может содержать циклодекстрины, которые также обозначаются циклоамило- 19023208 зы. Как неожиданно было обнаружено изобретателями настоящего изобретения, циклодекстрины могут использоваться для усиления растворимости и, благоприятно, проникновения через мембрану имидазохинолин(амина) или его производного, как определено в настоящей заявке, в фармацевтической композиции в соответствии с изобретением, даже если имидазохинолин(амин) или его производное может не быть достаточно растворимым с помощью только циклодекстринов. В этом контексте растворимость имидазохинолин(амина) или его производного, как определено в настоящей заявке, не только усиливается в конечной фармацевтической композиции в соответствии с изобретением и использованием циклодекстринов, но также и в промежуточном (маточном) растворе, образованном с помощью имидазохинолин(амина) или его производного, как определено в настоящей заявке, и органической кислоты, как определено выше, например молочной кислоты, уксусной кислоты или их смесь. В особенности, это является неожиданным открытием с учетом знаний из известного уровня техники, согласно которым циклодекстрин в комбинации с молочной кислотой и/или уксусной кислотой приводит к небольшому, но существенному возрастанию растворимости имидазохинолин(амина) или его производного, предпочтительно имихимода, по меньшей мере на 10%, более предпочтительно по меньшей мере на 15% или по меньшей мере приблизительно на 18% по сравнению с растворимостью этого терапевтически активного средства в комбинации с молочной кислотой отдельно. Соответственно, циклодекстрины могут использоваться на любой стадии приготовления фармацевтической композиции для усиления растворимости имидазохинолин(амина) или его производного, как определено в настоящей заявке. В контексте настоящего изобретения циклодекстрины предпочтительно подразумеваются как представители семейства циклических олигосахаридов, состоящих из 5 или более -D-глюкопиранозидных единиц, связанных между положениями 1 и 4, как известно для амилозы, фрагмента крахмала. В контексте настоящего изобретения циклодекстрины предпочтительно включают -циклодекстрины, которые образуют шестичленные сахарные кольцевые молекулы, -циклодекстрины, которые образуют семичленные сахарные кольцевые молекулы, -циклодекстрины, которые образуют восьмичленные сахарные кольцевые молекулы, -циклодекстрины и -циклодекстрины. Более предпочтительно фармацевтическая композиция в соответствии с изобретением содержит -циклодекстрины, -циклодекстрины и/или -циклодекстрины,еще более предпочтительно -циклодекстрины, такие как гидроксипропилциклодекстрин (HPCD). Неожиданно, включение HPCD в фармацевтический препарат согласно изобретению улучшает физическую стабильность, обеспечивая прозрачный гомогенный раствор. В соответствии с особым предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением, как определено выше, может содержать циклодекстрины, как определено выше в количестве от приблизительно 0,1% (мас./об.) до приблизительно 30% (мас./об.), обычно в количестве от приблизительно 1% (мас./об.) до приблизительно 20% (мас./об.), предпочтительно в количестве от приблизительно 2% (мас./об.) до приблизительно 20% (мас./об.), более предпочтительно в количестве от приблизительно 5% (мас./об.) до приблизительно 20% (мас./об.), еще более предпочтительно в количестве от приблизительно 5% (мас./об.) до приблизительно 15% (мас./об.) и наиболее предпочтительно в количестве от приблизительно 10% (мас./об.) до приблизительно 15% (мас./об.) или в количестве от приблизительно 0,1% (мас./об.) до приблизительно 4% (мас./об.), от 0,1 до 2%, более предпочтительно в количестве от 0,5 до 2% или, альтернативно, в количестве от приблизительно 2% (мас./об.) до приблизительно 6% (мас./об.), в количестве от приблизительно 4% (мас./об.) до приблизительно 8%(мас./об.), в количестве от приблизительно 6% (мас./об.) до приблизительно 10% (мас./об.), в количестве от приблизительно 8% (мас./об.) до приблизительно 12% (мас./об.), в количестве от приблизительно 10%(мас./об.) до приблизительно 14% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 16% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 18% (мас./об.),в количестве от приблизительно 16% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 18% (мас./об.) до приблизительно 22% (мас./об.), в количестве от приблизительно 20%(мас./об.) до приблизительно 24% (мас./об.), в количестве от приблизительно 22% (мас./об.) до приблизительно 26% (мас./об.), в количестве от приблизительно 24% (мас./об.) до приблизительно 28% (мас./об.) или в количестве от приблизительно 26% (мас./об.) до приблизительно 30% (мас./об.), где количества,как определено в% (мас./об.), могут либо пониматься как исходя из веса циклодекстрина по отношению к общему объему фармацевтической композиции в соответствии с изобретением или промежуточного маточного раствора, если, например, обеспечивается в виде жидкого или полужидкого препарата. Альтернативно, вышеуказанные количества могут быть определены в % (мас./мас.), где количества, как определено в % (мас./мас.), могут либо определяться на основании веса циклодекстрина по отношению к общему весу фармацевтической композиции в соответствии с изобретением или на основании промежуточного маточного раствора. В соответствии с другим особо предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением, как определено выше, может содержать циклодекстрины,как определено выше в количестве от приблизительно 2% (мас./об.) до приблизительно 6% (мас./об.),например, от приблизительно 2,5% (мас./об.) до приблизительно 6% (мас./об.), от приблизительно 3%(мас./об.) до приблизительно 6% (мас./об.) или от приблизительно 2,5% (мас./об.) до приблизительно 5,5% (мас./об.), приблизительно 3% (мас./об.) до приблизительно 5,5% (мас./об.), от приблизительно 3,5% (мас./об.) до приблизительно 5,5% (мас./об.), от приблизительно 4% (мас./об.) до приблизительно 5,5% (мас./об.), от приблизительно 4,5% (мас./об.) до приблизительно 5,5% (мас./об.) или от приблизительно 5% (мас./об.). В соответствии с другим особо предпочтительным вариантом осуществления, в особенности для определенных форм введения и применений, фармацевтическая композиция в соответствии с настоящим изобретением дополнительно содержит по меньшей мере один термочувствительный агент. В контексте настоящего изобретения термин "термочувствительный агент" обычно относится к соединению, предпочтительно полимеру, которое способно изменять его состояние агрегации или его вязкости в реперной точке перехода (кооперативный переход) из жидкого или полужидкого состояния в твердое или полутвердое состояние, предпочтительно в твердое состояние. Более предпочтительно термин "термочувствительный агент" обычно относится к соединению, предпочтительно (органическому) полимеру, который способен изменять его состояние агрегации из жидкого или полужидкого состояния в твердое или полутвердое состояние (например, из жидкого в гелеобразное состояние или в твердое состояние) в специфической точке перехода (так называемая "низкая критическая температура растворения" (LCST) или"температура гелевого перехода"), где специфическая точка перехода предпочтительно определяется путем специфической температуры перехода в диапазоне от приблизительно 15 С до приблизительно 35 С, более предпочтительно в диапазоне от приблизительно 15 С до приблизительно 30 С, еще более предпочтительно в диапазоне от приблизительно 15 или 20 С до приблизительно 30 С, наиболее предпочтительно в диапазоне от приблизительно 15 или 20 С до приблизительно 25 С. "Низкая критическая температура растворения" в соответствии с настоящим изобретением измеряется при атмосферном давлении и зависит от молярно-массового распределения, если термочувствительный агент. Предпочтительно такой термочувствительный агент, как определено выше, предоставляет возможность образования геля in situ термочувствительного агента и любого соединения или композиции, приготовленной из них,например фармацевтической композиции в соответствии с изобретением при температуре тела, тогда как фармацевтическая композиция обычно будет проявлять (полу)жидкие свойства. В этом контексте образование геля in situ термочувствительного агента и любого соединения или композиции, приготовленной из них, обычно происходит сразу при или сразу после введения фармацевтической композиции в соответствии с изобретением в участок болезни пациента, подвергаемого лечению, то есть не перед введением фармацевтической композиции в соответствии с изобретением. Такое образование геля in situ чрезвычайно благоприятно для специфических применений, которые предназначены для высвобождения имидазохинолин(амина) или его производного из фармацевтической композиции в соответствии с изобретением, как определено в настоящей заявке, в течение удлиненного периода времени. Такие применения обычно направлены на помещение препарата в полость организма, например ткань или орган, такой как мочевой пузырь, и, следовательно, могут быть чрезвычайно пригодны, например, для пузырного введения при лечении заболеваний мочевого пузыря. Одним предпочтительным преимуществом фармацевтической композиции согласно настоящему изобретению, которая содержит термочувствительные агенты, является простота ее введения вследствие выбора точки перехода в температурном интервале, как определено выше. Более специфически, выбор точки перехода в температурном интервале, как определено выше, предоставляет возможность не только приготовления или хранения фармацевтической композиции в соответствии с изобретением в жидком или полужидком агрегированном состоянии. Он также предоставляет возможность введения (предпочтительно жидкой) фармацевтической композиции в соответствии с изобретением, например, путем инъекции, поскольку фармацевтическая композиция в соответствии с изобретением сразу затвердевает или подвергается желатинированию после введения вследствие повышенной температуры окружающей ткани или органа, которая предпочтительно является более высокой, чем температура точки перехода. Следовательно, образование геля индуцируется в пределах ткани или органа. Поэтому введение можно осуществлять, используя неинвазивные методы (без хирургии), такие как инъекционная игла, имеющая канюлю подходящего диаметра, инъекционную трубку, эндоскопические методы и др. Кроме того, такое образование геля приводит к повышению биоадгезивных свойств фармацевтической композиции в соответствии с изобретением настоящего изобретения, что обеспечивает пролонгированную экспозицию имидазохинолин(амина) или его производного фармацевтической композиции в соответствии с изобретением в клетки, экспрессирующие TLR7, и меньшее системное проникновение лекарственного средства. Как было указано выше, экспозиция имидазохинолин(амина) или его производного в клетки, экспрессирующие TLR7, индуцирует иммунологический ответ, вызывающий желательный терапевтический эффект. Дополнительно, фармацевтические композиции согласно настоящему изобретению, которые содержат термочувствительные агенты, благоприятно избегают или, по меньшей мере, существенно уменьшают системные побочные действия имидазохинолин(амина) или его производного вследствие локального введения в сайт болезни, повышения вязкости in vivo фармацевтической композиции в соот- 21023208 ветствии с изобретением, уменьшения диффузии биологически активного средства в окружающую ткань и, дополнительно, в некоторых случаях также благодаря повышению биоадгезивных свойств. В завершение, фармацевтические композиции согласно настоящему изобретению, которые содержат термочувствительные агенты, благоприятно предоставляют возможность так называемого "продолженного высвобождения" (или иногда обозначает "длительное высвобождение") имидазохинолин(амина) или его производного, которые они содержат. В особенности, образование геля фармацевтической композиции в соответствии с изобретением приводит к удлиненному высвобождению лекарственного средства имидазохинолин(амина) или его производного в кинетике нулевого порядка, что повышает продолжительность терапевтического эффекта. Такой пролонгированный терапевтический эффект имидазохинолин(амина) или его производного, содержащегося в фармацевтической композиции в соответствии с изобретением, также избегает повторного введения фармацевтической композиции в соответствии с изобретением, предпочтительно в более короткие временные интервалы, которых обычно не удается избегать при использовании фармацевтических композиций без проявления длительного высвобождения лекарственного средства. Депо-эффект фармацевтической композиции согласно изобретению обычно продолжается по меньшей мере 24 ч, более предпочтительно 48 ч, более предпочтительно по меньшей мере 7 дней, обычно высвобождение активного компонента в прибл. постоянных количествах со временем(например, сопоставимые высвобождаемые количества в течение 24 ч в течение, например, дня 2 и дня 8 после введения). В соответствии со специфическим предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением, как определено выше, содержит термочувствительный агент,как определено в настоящей заявке, в количестве от приблизительно 0,1% (мас./об.) до приблизительно 40% (мас./об.), предпочтительно между 0,1 и 5% (более предпочтительно 0,1 и 2%) или, альтернативно,обычно в количестве от приблизительно 2% (мас./об.) до приблизительно 30% (мас./об.), предпочтительно в количестве от приблизительно 5% (мас./об.) до приблизительно 30% (мас./об.), более предпочтительно в количестве от приблизительно 10% (мас./об.) до приблизительно 30% (мас./об.), и наиболее предпочтительно в количестве от приблизительно 10% (мас./об.) до приблизительно 25% (мас./об.), например, в количестве от приблизительно 0,1% (мас./об.) до приблизительно 10% (мас./об.), в количестве от приблизительно 5% (мас./об.) до приблизительно 15% (мас./об.), в количестве от приблизительно 10%(мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 11% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 20% (мас./об.),в количестве от приблизительно 13% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 15%(мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 16% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 10% (мас./об.) до приблизительно 19% (мас./об.),в количестве от приблизительно 10% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 10% (мас./об.) до приблизительно 17% (мас./об.), в количестве от приблизительно 10%(мас./об.) до приблизительно 16% (мас./об.), в количестве от приблизительно 11% (мас./об.) до приблизительно 19% (мас./об.), в количестве от приблизительно 11% (мас./об.) до приблизительно 18% (мас./об.),в количестве от приблизительно 11% (мас./об.) до приблизительно 17% (мас./об.), в количестве от приблизительно 11% (мас./об.) до приблизительно 16% (мас./об.), в количестве от приблизительно 12%(мас./об.) до приблизительно 19% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 17% (мас./об.),в количестве от приблизительно 12% (мас./об.) до приблизительно 16% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 19% (мас./об.), в количестве от приблизительно 13%(мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 17% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 16% (мас./об.),в количестве от приблизительно 14% (мас./об.) до приблизительно 19% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 14%(мас./об.) до приблизительно 17% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 16% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 19% (мас./об.),в количестве от приблизительно 15% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 17% (мас./об.), в количестве от приблизительно 15%(мас./об.) до приблизительно 16% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 20% (мас./об.) до приблизительно 30% (мас./об.),в количестве от приблизительно 25% (мас./об.) до приблизительно 35% (мас./об.), или в количестве от приблизительно 30% (мас./об.) до приблизительно 40% (мас./об.), где количества, как определено в %(мас./об.), могут подразумеваться как-либо выражены на основе веса термочувствительного агента, как определено в настоящей заявке, по отношению к общему объему фармацевтической композиции в соответствии с изобретением или в промежуточном маточном растворе, если, например, обеспечивается в виде жидкого или полужидкого препарата. Альтернативно, вышеуказанные количества могут быть определены в % (мас./мас), где количества, как определено в % (мас./мас.), могут подразумеваться как-либо выражены на основе веса термочувствительного агента, как определено в настоящей заявке, по отноше- 22023208 нию к общему весу фармацевтической композиции в соответствии с изобретением. В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения фармацевтическая композиция содержит имидазохинолин(амин), по меньшей мере одну органическую кислоту, выбранную из уксусной кислоты и/или молочной кислоты, и по меньшей мере один термочувствительный агент, где по меньшей мере один термочувствительный агент предпочтительно выбирают из хитозана или его производных, или из поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид) сополимера (также обозначается РЕО-РРО-РЕО или Poloxamer). В соответствии с одним предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением, как определено выше, содержит в качестве термочувствительного агента хитозан или его производное. В контексте настоящего изобретения такой хитозан предпочтительно понимают как линейный полисахарид, состоящий из случайно распределенного -(1-4)-связанного Dглюкозамина (деацетилированная единица) и N-ацетил-D-глюкозамина (ацетилированная единица). Хитозан обычно получают коммерчески путем деацетилирования хитина, который является структурным элементом экзоскелета ракообразных, таких как крабы, креветки и др. Степень деацетилирования (%DA) обычно определяют путем ЯМР спектроскопии, где %DA в коммерческих хитозанах обычно находится в интервале 60-100%. Хитозаны в контексте настоящего изобретения дополнительно включают их производные, такие как триметилхитозан, где аминогруппа хитозана триметилирована, или олигомерные производные (3-6 кДа) хитозанов. В соответствии с одним дальнейшим более предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением, как определено выше, содержит в качестве термочувствительного агента Poloxamer. Poloxamers, солюбилизированные в относительно высоких концентрациях ( 17,5%), способны продуцировать системы, которые являются жидкими при низкой температуре (ниже комнатной температуры) и которые образуют желеобразные, полутвердые или твердые структуры или гели при повышенных температурах. Poloxamers являются коммерчески доступными под торговыми марками Pluronic и Lutrol (BASF AG, Ludwigshafen, Germany). Poloxamers представлены во многих продаваемых фармацевтических продуктах, таких как солюбилизаторы, поверхностно-активные вещества, вяжущие и желеобразующие средства. В этом контексте фармацевтическая композиция в соответствии с изобретением предпочтительно не содержит любых дополнительных компонентов, проявляющих поверхностно-активные свойства, за исключением таких термочувствительных компонентов,например, Poloxamers, которые дополнительно проявляют поверхностно-активные свойства. Фармацевтические композиции в соответствии с настоящим изобретением, которые содержат термочувствительный агент, являются особенно благоприятными, например, внутрипузырное введение фармацевтической композиций в соответствии с настоящим изобретением, которые содержат термочувствительный агент, такой как, например, Poloxamer, позволяет избегать системной абсорбции и, дополнительно, обеспечивает повышенный локальный контакт имидазохинолин(амина) с уротелием. Таким образом, добавление термочувствительного агента уменьшает системную абсорбцию имидазохинолин(амина) из уротелия мочевого пузыря с длительной локальной инфильтрацией иммунных клеток.Poloxamers в контексте настоящего изобретения обычно понимают как поли(этиленоксид)поли(пропиленоксид)-поли(этиленоксид) сополимер, также сокращенно обозначается как "РЕО-РРОРЕО". Такие Poloxamers, следовательно, представляют собой неионные триблок-сополимеры, состоящие из центральной гидрофобной цепи полиоксипропилена (поли(пропиленоксид, фланкированной двумя гидрофильными цепями полиоксиэтилена (поли(этиленоксид. Молекулярный вес таких Poloxamers обычно специально не указывают и он может изменяться для каждой специфической цели. Поскольку длины полимерных блоков можно модифицировать в соответствии с требованиями заказчика, то можно получать множество Poloxamers, имеющих незначительно отличающиеся свойства. Для общего термина"Poloxamer" эти сополимеры обычно обозначаются буквой "Р" (для Poloxamer) с последующими тремя цифрами, первые две цифры 100 представляют среднюю молекулярную массу полиоксипропиленового ядра, и последняя цифра 10 предоставляет процент содержания полиоксиэтилена (например, Р 407 =Poloxamer с молекулярным весом полиоксипропилена 4,000 г/моль и 70% содержанием полиоксиэтилена). Для торговой марки Pluronic/Lutrol кодирование этих сополимеров начинается с буквы для обозначения его физической формы при комнатной температуре (L = жидкий, Р = паста, F = хлопья (твердый с последующими двумя или тремя цифрами. Первая цифра (две цифры в трехзначном номере) в цифровом обозначении, умноженные на 300, указывают средний молекулярный вес гидрофоба; и последняя цифра 10 предоставляет процент содержание полиоксиэтилена (например, L61 = Pluronic с молекулярной массой полиоксипропилена 1,800 г/моль и 10% содержанием полиоксиэтилена). В данном примереPoloxamers, пригодные для фармацевтической композиции в соответствии с изобретением в качестве термочувствительного агента, предпочтительно содержат любой поли(этиленоксид)-поли(проиленоксид)-поли(этиленоксид) сополимер или смесь таких сополимеров, пригодных для целей изобретения, то есть любой РЕО-РРО-РЕО полимер или смесь таких сополимеров, проявляющая термочувтсвительные свойства, как определено выше, также РЕО-РРО-РЕО полимеры включают также ком- 23023208Pluronic P 85 и Poloxamer 403. Такие РЕО-РРО-РЕО полимеры также включают смеси, образованные любыми двумя или более (3, 4, 5, 6 и т.д.) этих РЕО-РРО-РЕО полимеров. Более предпочтительно Poloxamers, пригодные для фармацевтической композиции в соответствии с изобретением в качестве термочувствительного агента, включают Poloxamers или их смеси, Poloxamers,выбранные из Poloxamer 124, Poloxamer 188, Poloxamer 237, Poloxamer 338, Poloxamer 403 и Poloxamer 407. Таким образом, используя Poloxamer ярлыки кодирования BASF, подходящие Poloxamers выбирают из Pluronic/Lutrol F 44 (Poloxamer 124), Pluronic/Lutrol F 68 (Poloxamer 188), Pluronic/Lutrol F 87 (Poloxamer 237), Pluronic/Lutrol F 108 (Poloxamer 338), Pluronic/Lutrol F 123 (Poloxamer 403), Pluronic/Lutrol F 127 (Poloxamer 407). Еще более предпочтительно Poloxamers, пригодные для фармацевтической композиции в соответствии с изобретением в качестве термочувствительного агента, включают Poloxamers или их смеси,Poloxamers, выбранные из Poloxamer 188, Poloxamer 403 и Poloxamer 407. Из различных РЕО-РРО-РЕО полимеров, пригодных для фармацевтической композиции в соответствии с изобретением в качестве термочувствительного агента, наиболее предпочтительно выбираютPoloxamer 407 и он представляет собой полимер первого выбора для получения термореактивных гелей в контексте настоящего изобретения. Poloxamer 407 в качестве термочувствительного агента можно использовать самостоятельно или в вмеси с другими Poloxamers, как описано выше, предпочтительно сPoloxamer 188, для получения смеси термочувствительных агентов, которые "застудневают" при выбранной температуре, предпочтительно немного выше комнатной температуры ( 20 С), но ниже температуры тела ( 37 С). В соответствии с одним особенно предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением содержит в качестве термочувствительного агента Poloxamer 407 в количестве, как определено выше, в общем для термочувствительных агентов, более предпочтительно в количестве от приблизительно 0,1, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10% (мас./об.) до приблизительно 30% (мас./об.), еще более предпочтительно в количестве от приблизительно 5% (мас./об.) до приблизительно 25% (мас./об.) и наиболее предпочтительно в количестве от приблизительно 10% (мас./об.) до приблизительно 25% (мас./об.), например, в количестве от приблизительно 0,1, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 10,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 11% (мас./об.) до приблизительно 25%(мас./об.), в количестве от приблизительно 11,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 12,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 13,5% (мас./об.) до приблизительно 25%(мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 14,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 15,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 16% (мас./об.) до приблизительно 25%(мас./об.), в количестве от приблизительно 16,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 17% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 17,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 18% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 18,5% (мас./об.) до приблизительно 25%(мас./об.), в количестве от приблизительно 19% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 19,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 20% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 20,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 21% (мас./об.) до приблизительно 25%(мас./об.), в количестве от приблизительно 21,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 22% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 22,5% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 23% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 23,5% (мас./об.) до приблизительно 25%(мас./об.), в количестве от приблизительно 24% (мас./об.) до приблизительно 25% (мас./об.), или в количестве от приблизительно 24,5% (мас./об.) до приблизительно 25% (мас./об.), или более предпочтительно в количестве от приблизительно 12% (мас./об.) до приблизительно 25% (мас./об.), в количестве от при- 24023208 близительно 13% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 14%(мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 16% (мас./об.) до приблизительно 25% (мас./об.),в количестве от приблизительно 17% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 18% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 19%(мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 20% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 21% (мас./об.) до приблизительно 25% (мас./об.),в количестве от приблизительно 22% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 23% (мас./об.) до приблизительно 25% (мас./об.), в количестве от приблизительно 24%(мас./об.) до приблизительно 25% (мас./об.), или более предпочтительно в количестве от приблизительно 12% (мас./об.) до приблизительно 24% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 23% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 22%(мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 21% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 19% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 17%(мас./об.), в количестве от приблизительно 12% (мас./об.) до приблизительно 16% (мас./об.), или более предпочтительно в количестве от приблизительно 13% (мас./об.) до приблизительно 24% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 23% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 22% (мас./об.), в количестве от приблизительно 13%(мас./об.) до приблизительно 21% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 19% (мас./об.),в количестве от приблизительно 13% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 13% (мас./об.) до приблизительно 17% (мас./об.), в количестве от приблизительно 13%(мас./об.) до приблизительно 16% (мас./об.), или более предпочтительно в количестве от приблизительно 14% (мас./об.) до приблизительно 24% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 23% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 22%(мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 21% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 19% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 17%(мас./об.), в количестве от приблизительно 14% (мас./об.) до приблизительно 16% (мас./об.), или более предпочтительно в количестве от приблизительно 15% (мас./об.) до приблизительно 24% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 23% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 22% (мас./об.), в количестве от приблизительно 15%(мас./об.) до приблизительно 21% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 20% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 19% (мас./об.),в количестве от приблизительно 15% (мас./об.) до приблизительно 18% (мас./об.), в количестве от приблизительно 15% (мас./об.) до приблизительно 17% (мас./об.), в количестве от приблизительно 15%(мас./об.) до приблизительно 16% (мас./об.) или более предпочтительно в количестве от приблизительно 24% (мас./об.) до приблизительно 25% (мас./об.), где количества, как определено в % (мас./об.), могут подразумеваться как-либо выражены на основе веса термочувствительного агента, как определено в настоящей заявке, по отношению к общему объему фармацевтической композиции в соответствии с изобретением или в промежуточном маточном растворе, если, например, обеспечивается в виде жидкого или полужидкого препарата. Альтернативно, вышеуказанные количества могут быть определены в %(мас./мас.), где количества, как определено в % (мас./мас.), могут подразумеваться как-либо выражены на основе веса термочувствительного агента, как определено в настоящей заявке, по отношению к общему весу фармацевтической композиции в соответствии с изобретением. В соответствии с дальнейшим предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением может содержать в качестве термочувствительного агента любой из Poloxamers, как определено выше, предпочтительно любой из Poloxamers, выбранных из Poloxamer 124, Poloxamer 188, Poloxamer 237, Poloxamer 338 и Poloxamer 403. Такие Poloxamers предпочтительно присутствуют в фармацевтической композиции в соответствии с изобретением в качестве термочувствительного агента в количествах, как определено выше, для термочувствительных агентов в целом или более предпочтительно, как определено выше, для Poloxamer 407. В соответствии с особым предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением также может содержать в качестве термочувствительного агента смесь любых из термочувствительных агентов, как определено выше. Такая смесь термочувствительных агентов предпочтительно содержит общее количество термочувствительного агента в такой смеси сходное с, как определено выше, в общем для термочувствительных агентов или более специфически, как определено выше, для Poloxamer 407. Кроме того, такая смесь термочувствительных агентов предпочтительно содержит соотношение различных Poloxamers, что приводит к смеси термочувствительных аген- 25023208 тов, которая "застудневает" при желательной температуре, предпочтительно в температурном интервале,как определено выше. В этом контексте, на соотношение и/или количество различных Poloxamers в смеси может влияния "низкая критическая температура растворения" (LCST) и, таким образом, температура гелевого перехода. Например, было обнаружено, что снижение процента Poloxamer 407 в смеси с Poloxamer 188 приводит к повышению LCST. Кроме того, количество и/или соотношение различных Poloxamers в смеси предпочтительно выбирают в отношении растворимости лекарственного средства. Предпочтительно любые два из термочувствительных агентов, как определено выше, в особенности, если обеспечиваются в количестве, как определено выше, могут содержаться в фармацевтической композиции в соответствии с изобретением в виде смеси в соотношении от приблизительно 1: 20 до приблизительно 20:1,предпочтительно в соотношении от приблизительно 1:20, 2:20, 3:30, 4:20, 5:20, 6:20, 7:20, 8:20, 9:20,10:20, 11:20, 12:20, 13:20, 14:20, 15:20, 16:20, 17:20, 18:20, 19:20, 20:20 (= 1:1), или в соотношении от приблизительно 20:20, 19:20, 18:20, 17:20, 16:20, 15:20, 14:20, 13:20, 12:20, 11:20, 10:20, 9:20, 8:20, 7:20,6:20, 5:20, 4:20, 3:20, 2:20, или приблизительно 1:20, или в соотношении от приблизительно 1:20, 1:19,2:18:, 3:17, 4:16, 5:15, 6:14, 7:13, 8:12, 9:11, 10:10 (1:1), 11:9, 12:8, 13:7, 14:6, 15:5, 16:4, 17:3, 18:2, 19:1 или 20:1, или в диапазоне, образованном любыми двумя из этих значений соотношений, как определено выше. Еще более предпочтительно, любые два из термочувствительных агентов, как определено выше, в особенности, если обеспечиваются в количестве, как определено выше, могут содержаться в фармацевтической композиции в соответствии с изобретением в виде смеси в диапазоне от приблизительно 1:10 до приблизительно 10:1, например, в соотношении от приблизительно 1:10, 2:10, 3:10, 4:10, 5:10, 6:10,7:10, 8:10, 9:10 или 10:10 (то есть 1:1), или в соотношении от приблизительно 10:9, 10:8, 10:7, 10:6, 10:5,10:4, 10:3, 10:2 или 10:1, или в диапазоне, образованном любыми двумя из этих значений соотношений,как определено выше. Еще более предпочтительно фармацевтическая композиция в соответствии с изобретением может содержать в качестве термочувствительного агента смесь Poloxamer 407 и любого из вышеописанныхPoloxamers, еще более предпочтительно выбранных из Poloxamer 124, Poloxamer 188, Poloxamer 237,Poloxamer 338 и Poloxamer 403. Аналогично, такая смесь термочувствительных агентов предпочтительно содержит суммарное количество термочувствительных агентов смеси подобно, как определено выше, в общем для термочувствительных агентов или более специфически, как определено выше, для Poloxamer 407. В соответствии с особым предпочтительным вариантом осуществления фармацевтическая композиция в соответствии с изобретением может содержать в качестве термочувствительного агента смесьPoloxamer 407 и Poloxamer 188. Предпочтительно такая смесь Poloxamer 407 и Poloxamer 188 содержится в фармацевтической композиции в соответствии с изобретением в общем количестве, как определено выше, в общем для термочувствительных агентов или более специфически, как определено выше, дляPoloxamer 407. Предпочтительно такая смесь Poloxamer 407 и Poloxamer 188 также содержится в фармацевтической композиции в соответствии с изобретением в соотношении, как определено выше, в целом для смесей Polyoxamers, используемых в качестве термочувствительного агента в фармацевтической композиции в соответствии с изобретением. Еще более предпочтительно такое соотношение выбирают из соотношения Poloxamer 407:Poloxamer 188 от приблизительно 1:20, 1:19, 2:18, 3:17, 4:16, 5:15, 6:14,7:13, 8:12, 9:11, 10:10 (1:1), 11:9, 12:8, 13:7, 14:6, 15:5, 16:4, 17:3, 18:2, 19:1 или 20:1, или соотношение,образованное любыми двумя значениями, как определено выше. Наиболее предпочтительно такое соотношение выбирают из соотношения Poloxamer 407:Poloxamer 188 от приблизительно 7:3, 7,5:2,5, 8:2,8,5:1,5, 9:1 или 9,5:0,5, или соотношение, образованное любым двумя из этих значений. Таким образом,абсолютное содержание Poloxamer 188 и Poloxamer 407 в фармацевтической композиции в соответствии с изобретением может быть определено на основании общего количества и специфического соотношения обоих Poloxamers в фармацевтической композиции в соответствии с изобретением. В соответствии со специфическим вариантом осуществления фармацевтическая композиция в соответствии с изобретением может содержать в качестве термочувствительного агента Poloxamer 407 в (общем) количестве от приблизительно 17,5% (мас./об.)/(мас./мас.) до приблизительно 22,5%(мас./об.)/(мас./мас.), более предпочтительно в общем количестве от приблизительно 17,5%(мас./об.)/(мас./мас.), от приблизительно 22,0% (мас./об.)/(мас./мас.) или от приблизительно 22,5%(мас./об.)/(мас./мас.), или в (общем) количестве от приблизительно 10% (мас./об.)/(мас./мас.) до приблизительно 22,5% (мас./об.)/(мас./мас.), более предпочтительно в общем количестве от приблизительно 11% (мас./об.)/(мас./мас.) до приблизительно 22,5% (мас./об.)/(мас./мас.), от приблизительно 12,0%(мас./об.)/(мас./мас.) до приблизительно 22,5% (мас./об.)/(мас./мас.), или от приблизительно 11%(мас./об.)/(мас./мас.) до приблизительно 20,0% (мас./об.)/(мас./мас.), или от приблизительно 11%(мас./об.)/(мас./мас.) до приблизительно 19,0% (мас./об.)/(мас./мас.), или от приблизительно 11%(мас./об.)/(мас./мас.) до приблизительно 18,0% (мас./об.)/(мас./мас.), или от приблизительно 11%(мас./об.)/(мас./мас.) до приблизительно 17,0% (мас./об.)/(мас./мас.), или от приблизительно 11%(мас./об.)/(мас./мас.) до приблизительно 16,5% (мас./об.)/(мас./мас.). Термин (мас./об.)/(мас./мас.) обозначает либо (мас./об.) или (мас./мас.) или любой диапазон, образованный любыми двумя этими значениями, как определено выше. В соответствии с дальнейшим специфическим вариантом осуществления фармацевтическая композиция в соответствии с изобретением может содержать в качестве термочувствительного агента смесьPoloxamer 407 и Poloxamer 188 в общем количестве от приблизительно 22,5% (мас./об.)/(мас./мас.) до приблизительно 27,5% (мас./об.)/(мас./мас.), более предпочтительно в общем количестве от приблизительно 25% (мас./об.)/(мас./мас.) и предпочтительно в соотношении Poloxamer 407:Poloxamer 188 от приблизительно 15:5, 16:4, 17:3, 18:2, 19:1 или 20:1, или соотношение, образованное любыми двумя из этих значений, более предпочтительно в соотношении от приблизительно 9,5:0,5, от приблизительно 9:1, от приблизительно 8,5:1,5 или от приблизительно 8:2, или соотношение, образованное любыми двумя из этих значений. Таким образом, если фармацевтическая композиция в соответствии с изобретением содержит смесь Poloxamer 407 и Poloxamer 188, то Poloxamer 407 может присутствовать в фармацевтической композиции в соответствии с изобретением в количестве от приблизительно 15,5%(мас./об.)/(мас./мас.) до приблизительно 26,5% (мас./об.)/(мас./мас.), предпочтительно в количестве от приблизительно 17,5% (мас./об.)/(мас./мас.) до приблизительно 22,5% (мас./об.)/(мас./мас.), тогда какPoloxamer 188 может присутствовать в фармацевтической композиции в количестве от приблизительно 1,0% (мас./об.)/(мас./мас.) до приблизительно 6,0% (мас./об.)/(мас./мас.), предпочтительно в количестве от приблизительно 2,5% (мас./об.)/(мас./мас.) до приблизительно 4,5% (мас./об.)/(мас./мас.). Термин(мас./об.)/(мас./мас.) обозначает либо (мас./об.) или (мас./мас.). Фармацевтическая композиция в соответствии с изобретением дополнительно может содержать добавки или дополнительные компоненты, такие как, например, циклодекстрин, как определено выше. В этом контексте содержание добавок, предпочтительно циклодекстрина, может оказывать влияние на вышеопределенную так называемую "низкую критическую температуру растворения" (LCST) или "температуру гелевого перехода". В качестве предпочтительного примера повышенный пример циклодекстрина приводит к повышению LCST Poloxamer 407 или смеси Poloxamer 407 и Poloxamer 188, как определено выше. Это может подходяще применяться для других Poloxamers, как определено выше и для других термочувствительных агентов, как определено в настоящей заявке. Аналогичным образом, на LCST фармацевтических композиций согласно настоящему изобретению оказывает различное влияние уксусная кислота и молочная кислота. Обе кислоты, в целом, повышаютLCST композиций. Тем не менее, тогда как, например, имихимод не оказывает никакого влияния на температуру гелевого перехода фармацевтических композиций в соответствии с изобретением, которые содержат только уксусную кислоту, то LCST композиций, которые содержат молочной кислоты, увеличена. Таким образом, конечный процент термочувствительных агентов, как определено в настоящей заявке,может зависеть от используемой кислоты и того, присутствует циклодекстрин или нет. В соответствии с дальнейшим вариантом осуществления фармацевтическая композиция в соответствии с изобретением дополнительно может содержать приемлемый носитель и/или наполнитель. В контексте настоящего изобретения фармацевтически приемлемый носитель обычно включает жидкое основание фармацевтической композиции в соответствии с изобретением, например апирогенную воду; безводный раствор можно комбинировать в любом подходящем соотношении с водорастворимым, фармацевтически приемлемым органическим растворителем, например спиртом (например, этанол или изипропанол); следующие растворы также могут применяться: изотонические солевые или буферные (водные) растворы, например фосфатный, цитратный и т.д. буферные растворы, водный буферный раствор,содержащий, например, натриевую соль, предпочтительно по меньшей мере 50 мМ натриевой соли,кальциевую соль, предпочтительно по меньшей мере 0,01 мМ кальциевой соли, и/или калиевую соль,предпочтительно по меньшей мере 3 мМ калиевой соли. В соответствии с предпочтительным вариантом осуществления натриевая, кальциевая и/или калиевая соли могут быть представлены в форме их галогенидов, например хлоридов, йодидов или бромидов, в форме их гидроксидов, карбонатов, гидрокарбонатов или сульфатов и др. Не ограничиваясь только ими, примеры натриевых солей включают, например,NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4, примеры необязательных калиевых солей включают, например, KCl, KI, KBr, K2CO3, KHCO3, K2SO4, и примеры кальциевых солей включают, например, CaCl2, CaI2,CaBr2, CaCO3, CaSO4, Ca(OH)2. Кроме того, органические анионы вышеуказанных катионов могут содержаться в композиции согласно изобретению. В соответствии с более предпочтительным вариантом осуществления композиция согласно изобретению, пригодная для инъекции, как определено выше, может содержать соли, выбранные из хлорида натрия (NaCl), хлорида кальция (CaCl2) и необязательно хлорида калия (KCl), где другие анионы могут присутствовать дополнительно к хлоридам. CaCl2 также может быть заменен на другую соль, такую как KCl. Композиция согласно изобретению может быть гипертонической, изотонической или гипотонической в отношении специфической сравнительной среды, то есть композиция согласно изобретению может иметь более высокое, идентичное или низшее содержание соли в отношении специфической сравнительной среды, где предпочтительно такие концентрации вышеуказанных солей могут использоваться, которые не приводят к повреждению клеток вследствие осмоса или других концентрационных воздействий. Сравнительные среды представляют собой, например,жидкости, которые встречаются в методах "in vivo", такие как кровь, лимфа, цитозольные жидкости, или другие жидкости организма, или, например, жидкости, которые могут использоваться в качестве сравнительной среды в методах "in vitro", такие как общепринятые буферы или жидкости. Такие общепринятые буферы или жидкости известны специалисту в данной области техники. Тем не менее, также для фармацевтических композиций в соответствии с изобретением могут использоваться один или несколько совместимых твердых или жидких наполнителей или разбавителей или инкапсулирующих соединений, которые пригодны для введения пациенту, подвергаемого лечению. Термин "совместимый", как используется в настоящей заявке, обозначает, что эти компоненты фармацевтической композиции в соответствии с изобретением способны смешиваться с имидазохинолин(аминами) или их производными, как определено в соответствии с настоящим изобретением, таким образом, что не будет происходить взаимодействий, которые будут существенно уменьшать фармацевтическую эффективность фармацевтической композиции в соответствии с изобретением в типичных условиях применения. Фармацевтически приемлемые носители, наполнители и разбавители должны, несомненно, иметь достаточно эффективную высокую чистоту и достаточно низкую токсичность, чтобы быть пригодными для введения особи, подвергающейся лечению. Некоторые примеры соединений, которые могут использоваться в качестве фармацевтически приемлемых носителей, наполнителей или их компонентов, включают сахара, такие как, например, лактоза, глюкоза и сахароза; крахмалы, такие как, например, кукурузный крахмал или картофельный крахмал; целлюлоза и ее производные, такие как, например, натрий карбоксиметилцеллюлоза, этилцеллюлоза, целлюлоза ацетат; порошкообразный трагакант; солод; желатин; жир; твердые глиданты, такие как, например, стеариновая кислота, стеарат магния; сульфат кальция; растительные масла, такие как, например, арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и какао-масло; многоатомные спирты, такие как, например, полипропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота. Другими добавками, которые можно включать в фармацевтическую композицию в соответствии с изобретением, являются эмильсификаторы, такие как, например, Tween; смачивающие вещества, такие как, например, натрий лаурил сульфат; красители; агенты, придающие вкус, фармацевтические носители; таблеткообразующие вещества; стабилизаторы; антиоксиданты; консерванты. В соответствии с другим вариантом осуществления фармацевтическая композиция в соответствии с изобретением может содержать адъювант. В этом контексте адъювант может подразумеваться как любое соединение, которое пригодно для инициации или повышения иммунной ответной реакции природной иммунной системы, то есть неспецифической ответной иммунной реакции. Другими словами, при введении фармацевтическая композиция в соответствии с изобретением обычно вызывает врожденную иммунную реакцию в ответ на адъювант, который необязательно в ней содержится. Такой адъювант можно выбирать из любого адъюванта, известного специалисту в данной области техники и пригодного в настоящем случае, то есть поддерживающего индукцию врожденной иммунной ответной реакции у млекопитающего. Предпочтительно адъювант выбирают из группы, включающей, не ограничиваясь только ими, любые из следующих соединений, включая хитозан, TDM, MDP, мурамил дипептид, Pluronics, раствор квасцов, гидроксид алюминия, ADJUMER (полифосфазен); алюминий фосфатный гель; гликаны из водорослей; гамма-иммулин; гель алюминий гидроксид (квасцы); гель алюминий гидроксид, интенсивно адсорбирующий протеин; гель гидроксида алюминия низкой вязкости; AF или SPT (эмульсия сквалана (5%), Tween 80 (0,2%), Pluronic L121 (1,25%), фосфатно-солевой буферный раствор, рН 7,4);AVRIDINE (пропандиамин); BAY R1005 N-(2-дезокси-2-L-лейциламино-b-D-глюкопиранозил)-Nоктадецилдодеканоиламид гидроацетат); CALCITRIOL (1-альфа,25-дигидрокси-витамин D3); гель фосфата кальция; САРТМ (наночастицы фосфата кальция); холерный голотоксин, слитый белок холерный токсин-А 1-протеин-А-D-фрагмент, субъединица В холерного токсина; CRL 1005 (блок-сополимер Р 1205); цитокинсодержащие липосомы; DDA (диметилдиоктадециламмоний бромид); DHEA (дегидроэпиандростерон); DMPC (димиристоилфосфатидилхолин); DMPG (димиристоилфосфатидилглицерол); комплекс DOC/квасцы (натриевая соль дезоксихолевой кислоты); полный адъювант Фрейнда; неполный адъювант Фрейнда; гамма-инулин; адъювант Гербу, смесь: i) N-ацетилглюкозаминил-(Р 1-4)-N-ацетилмурамил-L-аланил-D-глутамин (GMDP), ii) диметилдиотадециламмоний хлорид (DDA), iii) комплекс цинк-L-пролиновая соль (ZnPro-8); GM-CSF); GMDP (N-ацетилглюкозаминил-(b1-4)-N-ацетилмурамилL-аланил-D-изоглутамин); ImmTher (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-isoGlu-L-Alaглицерин дипальмитат); DRVs (иммунолипосомы, приготовленные из дегидратированныхрегидратированных пузырьков); интерферон-гамма; интерлейкин-1 бета; интерлейкин-2; интерлейкин-7; интерлейкин-12; ISCOMS; ISCOPREP 7.0.3.; липосомы; LOXORIBINE (7-аллил-8-оксогуанозин);LT пероральный адъювант (E.coli лабильный энтеротоксин-протоксин); микросферы и микрочастицы любого состава; MF59; (эмульсия сквален-вода); MONTANIDE ISA 51 (очищенный неполный адъювант Фрейнда); MONTANIDE ISA 720 (преобразующийся в ходе обмена маслянистый адъювант);MPL (3-Q-дезацил-4'-монофосфорил липид А); МТР-РЕ и МТР-РЕ липосомы N-ацетил-L-аланил-Dизоглутаминил-L-аланин-2-(1,2-дипальмитоил-sn-глицеро-3-(гидроксифосфорилоксиэтиламид, мононатриевая соль); MURAMETIDE (Nac-Mur-L-Ala-D-Gln-OCH3); MURAPALMITINE и DMURAPALMITINE (Nac-Mur-L-Thr-D-isoGln-sn-глицеролдипальмитоил); NAGO (нейраминидазагалактоза оксидаза); наносферы или наночастицы любого состава; NISVs (неионные поверхностноактивные пузырьки); PLEURAN (-глюкан); PLGA, PGA и PLA (гомо- и сополимеры молочной кислоты и гликолевой кислоты; микросферы/наносферы); PLURONIC L121; РММА (полиметилметакрилат);(эмульсия Marcol 52, Span 85 и Tween 85); сквален или Robane (2,6,10,15,19,23-гексаметилтетракозан и 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тертакозагексан); стеарилтирозин (октадецилтирозин гидрохлорид); Theramid (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-isoGlu-L-Ala-дипальмитоксипропиламид); Theronyl-MDP (Termurtide или [thr 1]-MDP; N-ацетилмурамил-L-треонил-D-изоглутамин); Ту частицы (Ty-VLPs или вирусоподобные частицы); Walter-Reed липосомы (липосомы, содержащие липид А, адсорбированный на гидроксиде алюминия), и липопептиды, включая Pam3Cys, в частности,соли алюминия, такие как Adju-phos, Alhydrogel, Rehydragel; эмульсии, включая CFA, SAF, IFA, MF59,Provax, TiterMax, Montanide, Vaxfectin; сополимеры, включая Optivax (CRL1005), L121 и др.; липосомы,включая Stealth, кохлеаты, включая BIORAL; адъюванты, производные растений, включая QS21, Quil A,Iscomatrix, ISCOM; адъюванты, подходящие для совместной стимуляции, включая Tomatine, биополимеры, включая PLG, РММ, инулин; адъюванты, имеющие происхождение из микроорганизмов, включаяRomurtide, DETOX, MPL, CWS, Mannose, CpG нуклеиновокислотные последовательности, CpG7909, лиганды TLR 1-10 человека, лиганды TLR 1-13 мыши, ISS-1018, IC31, Ampligen, Ribi529, IMOxine, IRIVs,VLPs, холерный токсин, токсин, неустойчивый при нагревании, Pam3Cys, флагеллин, GPI якорь,LNFPIII/Lewis X, антимикробные пептиды, UC-1V150, RSV слитый белок, cdiGMP; и адъюванты, пригодные в качестве антагонистов, включая CGRP нейропептид. Фармацевтическая композиция в соответствии с изобретением дополнительно может содержать од- 29
МПК / Метки
МПК: A61P 13/10, A61K 9/00, A61K 31/4745, A61K 47/12, A61P 35/00
Метки: фармацевтические, содержат, композиции, местного, имидазохинолин(амины, пригодные, введения, которые, производные
Код ссылки
<a href="https://eas.patents.su/30-23208-farmacevticheskie-kompozicii-kotorye-soderzhat-imidazohinolinaminy-i-ih-proizvodnye-prigodnye-dlya-mestnogo-vvedeniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, которые содержат имидазохинолин(амины) и их производные, пригодные для местного введения</a>
Предыдущий патент: Ингибиторы дпп-4 для лечения неалкогольной жировой дистрофии печени
Следующий патент: Способ и устройство для тонкой регулировки вводимой через кожу клапанной структуры
Случайный патент: Устройство и способ для очистки воздуха от загрязнений












