Применение неиммуносупрессивного производного циклоспорина a [d-mealaa]3-[etval]4-csa для изготовления лекарства для лечения поясноконечностной мышечной дистрофии и способ предупреждения или уменьшения мышечной дегенерации у субъекта, страдающего поясноконечностной мышечной дистрофией
Формула / Реферат
1. Применение циклического ундекапептида следующей формулы:
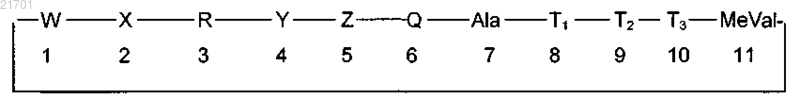
где W представляет собой MeBmt;
X представляет собой αAbu;
R представляет собой (D)-MeAla;
Y представляет собой N-этил-Val (EtVal);
Z представляет собой Val;
Q представляет собой MeLeu;
Т1 представляет собой (D)Ala;
Т2 представляет собой MeLeu и
Т3 представляет собой MeLeu;
для изготовления лекарства для лечения поясноконечностной мышечной дистрофии.
2. Способ предупреждения или уменьшения мышечной дегенерации у субъекта, страдающего поясноконечностной мышечной дистрофией, включающий введение пациенту эффективного количества циклического ундекапептида следующей формулы:
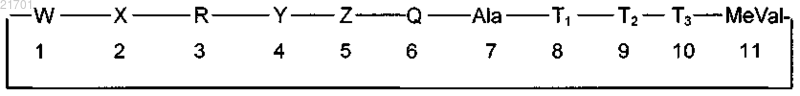
где W представляет собой MeBmt;
X представляет собой αAbu;
R представляет собой (D)-MeAla;
Y представляет собой N-этил-Val (EtVal);
Z представляет собой Val;
Q представляет собой MeLeu;
T1 представляет собой (D)Ala;
Т2 представляет собой MeLeu и
Т3 представляет собой MeLeu.
Текст
A [D-MeAla]3-[EtVal]4-CsA ДЛЯ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВА ДЛЯ ЛЕЧЕНИЯ ПОЯСНОКОНЕЧНОСТНОЙ МЫШЕЧНОЙ ДИСТРОФИИ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ ИЛИ УМЕНЬШЕНИЯ МЫШЕЧНОЙ ДЕГЕНЕРАЦИИ У СУБЪЕКТА, СТРАДАЮЩЕГО ПОЯСНОКОНЕЧНОСТНОЙ МЫШЕЧНОЙ ДИСТРОФИЕЙ Настоящее изобретение относится к применению неиммуносупрессивного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA для изготовления лекарства для лечения поясноконечностной мышечной дистрофии и способу предупреждения или уменьшения мышечной дегенерации у субъекта, страдающего поясноконечностной мышечной дистрофией.(71)(73) Заявитель и патентовладелец: ДЕБИОФАРМ ИНТЕРНЕЙШНЭЛ СА (CH) Настоящее изобретение относится к применению неиммуносупрессивного производного циклоспорина А для снижения индукции некроза мышечных волокон и дегенерации мышечных волокон у субъекта, у которого диагностирована поясноконечностная мышечная дистрофия (ПКМД), в частности саркогликанопатия. Мышечные дистрофии (МД) включают разнотипную группу наследственных расстройств, которые обширно поражают поперечнополосатую мышечную ткань, приводя в результате к прогрессирующей мышечной слабости, истощению и во многих случаях к преждевременной смерти. Многие охарактеризованные мутации, которые причинно связаны с МД у людей, обусловлены изменениями в структурных связывающих белках, которые прикрепляют нижележащие сократительные белки к базальной пластинке,обеспечивая ригидность клеточной мембраны скелетных мышц (сарколеммы), или в белках, которые непосредственно стабилизируют или репарируют клеточную мембрану, таких как, например, саркогликан или дистрофин. Наследуемые мутации генов саркогликана (генов альфа-, бета-, гамма- и дельта-саркогликана) вызывают скелетно-мышечное заболевание с гетерогенными синдромами, ПКМД и его подгруппу, саркогликанопатии. Синдромы или фенотипы саркогликанопатий зависят от того, какой ген саркогликана мутирован, и от типа генетических мутаций (аллельного варианта), и проявляют четыре формы конкретных расстройств: ПКМД типов 2 С, 2D, 2 Е и 2F (мутации генов гамма-, альфа-, бета- и дельта-саркогликана соответственно), которые представляют 25% всех диагностированных случаев ПКМД. В частности, различные мутации, специфично обнаруживаемые в гене дельта-саркогликана, приводят в результате к тяжелому расстройству ПКМД типа 2F или ПКМД 2F (Online Mendelian Inheritance in Man [OMIM] 601287, genetic mutations: [OMIM] 601411. Emery et al., The Lancet, 2002, 359:687-695). Различные типы ПКМД характеризуются прогрессирующим истощением и слабостью с атрофией,преимущественно вовлекающей мышцы рук и ног, проксимальные к плечу и бедру соответственно. Фенотипы заболевания напоминают синдромы тяжелой мышечной дистрофии типа Дюшенна или Беккера. Однако в последние заболевания вовлечены другие молекулярные механизмы и генетические расстройства. До того, как стали доступны молекулярные диагностики ПКМД, пациентов с ПКМД часто диагностировали как страдающих мышечной дистрофией Дюшенна. Начало заболевания варьирует от раннего детства до взрослого состояния с клиническими формами от легких до тяжелых. Вплоть до 25% пациентов проявляют тяжелые формы заболевания, и у них развивается тяжелый поясничный лордоз,контрактуры пяточных сухожилий, мышечная гипертрофия, кардиомиопатия и нарушения сердечной проводимости. Гипертрофия икроножных мышц или языка, избирательность вовлеченности мышц и сердечные осложнения поздней стадии более или менее специфично связаны с каждой из различных форм (Daniele et al., Int J. Biochem Cell Biol., 2007; 39:1608-1624). Прогрессирующая слабость приводит к рестриктивному легочному процессу и гиповентиляции, требующей вспомогательной вентиляции. В целом заболеваемость и смертность варьируют. При раннем начале прогрессирование заболевания до смерти типично является очень быстрым. Смерть часто наступает вследствие респираторных осложнений. К настоящему времени недоступно специфическое лечение для пациентов, страдающих любым из синдромов ПКМД. Интенсивная поддерживающая терапия, например ортопедия, хирургия и физиотерапевтическое лечение для сохранения мышечной функции, максимально увеличивает функциональную способность и продлевает ожидаемую продолжительность жизни. Однако эти меры не могут предотвратить дегенерацию мышечных волокон и возникновения, в конечном счете, респираторных осложнений. Благодаря разработке моделей на животных, у которых отсутствуют специфичные гены, вовлеченные в мышечную дистрофию, приблизились к лучшему пониманию молекулярных механизмов, лежащих в основе саркогликанопатий. Недавно было показано, что мышечные клетки мышей, у которых отсутствует дельта-саркогликан (мышей scgd-/-) вследствие направленной инактивации гена дельтасаркогликана (scgd), обладают предрасположенностью к повышенному клеточному притоку кальция. Предполагают, что потеря компонентов комплекса дистрофин-гликопротеин (ДГК), такого как комплекс дистрофина или саркогликана, приводит в результате к фундаментальному изменению физических свойств клеточной мембраны мышц и к повышенной проницаемости и протеканию сарколеммы. Активация нерегулируемых каналов притока кальция, вызванная нестабильностью и ломкостью мембраны,может инициировать дистрофическое заболевание в скелетной мышце, приводящее к дегенерации мышечных волокон и индукции некроза мышечных волокон. Авторами Parsons et al. (J. Biol. Chem., 2007, 282:10068-10078) показано, что ингибирование активируемой кальцием/кальмодулином активности сериновой/треониновой протеинфосфатазы кальцинеурина(calcineurin) в результате генетической делеции уменьшало дегенерацию и воспаление скелетной мышцы и мышечных волокон у мышей scgd-/-, а также было цитопротекторным. Аналогичные улучшения заболевания вследствие ингибирования активности кальцинеурина не наблюдали у мышей, у которых отсутствует ген mdx (мутация гена дистрофина), используемых в качестве модели мышечной дистрофии Дюшенна, даже, несмотря на то, что в обеих моделях мышечной дистрофии наблюдали повышенный приток кальция. Действительно, активированный трансген для кальцинеурина защищал мышей mdx (Chakkalakal et al., Hum. Mol. Genet., 2004, 13: 379-399; Stupka et al. Acta Neuropathol., 2004, 107: 299-310, но см. De Luca et al., Am. J. Pathol., 2005, 166: 477-489). Авторами Parsons et al. идентифицирован кальцинеурин как потенциальная мишень для терапевтических агентов ПКМД. На основании этих наблюденийParsons et al. предположили, что ингибирование активности кальцинеурина может обеспечить некоторую пользу при избранных типах мышечных заболеваний, таких как поясноконечностная мышечная дистрофия, и что, следовательно, циклоспорин А (CsA) мог бы обладать потенциальной пользой. Эффекторные механизмы, которые вызывают прогрессирующую дегенерацию мышечных волокон,индуцированную измененной проницаемостью мембраны при ПКМД, плохо поняты и являются предметом активных исследований, которые могут обеспечить основу для конечной разработки основанных на механизме новых стратегий лечения для пациентов, страдающих этим расстройством. В данное время,однако, отсутствует эффективный способ, доступный для лечения пациентов, страдающих ПКМД. Поэтому существует необходимость в новых терапевтических подходах, таких как описано в данной заявке. Цель настоящего изобретения состоит в обеспечении врачей терапией для лечения как индукции,так и прогрессирования некроза мышечных волокон и дегенерации мышцы у пациента, страдающего ПКМД, и, в частности, саркогликанопатией, и более конкретно ПКМД типа 2F. Эта терапия должна защищать против некроза дистрофических скелетных мышц, а также сердечной и диафрагмальной мышцы и должна замедлить прогрессирование заболевания. Авторы настоящего изобретения неожиданно обнаружили, что введение неиммуносупрессивного производного циклоспорина A (CsA), которое не ингибирует кальцинеурин, субъекту, страдающему расстройствами, диагностированными как ПКМД, и, в частности, саркогликанопатией, и более конкретно ПКМД типа 2F, является эффективной терапией. Они наблюдали, что введение неиммуносупрессивного производного CsA [D-MeAla]3-[EtVal]4-CsA уменьшает мышечную патологию субъекта, у которого диагностирован некроз мышечных волокон, в частности, с ПКМД, и более конкретно с ПКМД типа 2F, а также дегенерацию и прогрессирование заболевания, а также нормализует распределение площади мышечных волокон путем снижения чувствительности митохондрий к латентной перегрузке кальция. Субъект может представлять собой человека или млекопитающее, такое как, например, мышь, которые проявляют фенотип мышечной дистрофии в результате делеции гена или отсутствия экспрессии гена, ответственного за фенотип заболевания. Таким образом, настоящее изобретение относится к применению неиммуносупрессивного производного CsA [D-MeAla]3-[EtVal]4-CsA формулы I, для получения лекарственного препарата для предупреждения или уменьшения мышечной дегенерации у субъекта, страдающего ПКМД, и, в частности,саркогликанопатией, и более конкретно ПКМД типа 2F. Неиммуносупрессивные производные CsA, пригодные для применения настоящим изобретением, были также описаны в международной заявке на патент WO 2005/021028 Novartis AG, на страницах 3-6. [D-MeAla]3-[EtVal]4-CsA был раскрыт авторамиWenger et al. в международной заявке на патент WO 00/01715. [D-MeAla]3-[EtVal]4-CsA формулы I приписан регистрационный номер CAS 254435-95-5. Формула I.Q представляет собой MeLeu; Т 1 представляет собой (D)Ala; Т 2 представляет собой MeLeu и Т 3 представляет собой MeLeu,и где MeBmt представляет собой N-метил-(4R)-4-бут-2 Е-ен-1-ил-4-метил-(L)треонин, Abu представляет собой Lаминомасляную кислоту, D-MeAla представляет собой N-метил-О-аланин, EtVal представляет собой N-этил-L-валин, Val представляет собой L-valine, MeLeu представляет собой Nметил-L-лейцин, Ala представляет собой L-аланин, (D)Ala представляет собой D-аланин, и MeVal представляет собой N-метил-L-валин. Общепринятая нумерация положений аминокислот, обычно используемая в ссылке на циклоспорин А, показана в приведенной ниже формуле. Составные названия используют для производных CsA, где эти составные названия включают первую часть, указывающую идентичность остатков, которые отличаются от остатков в циклоспорине А, и дающую их положение, и вторую часть, обозначенную "CsA", указывающую, что все другие остатки идентичны остаткам в циклоспорине А. Например, [Melle]4-CsA представляет собой циклоспорин, который идентичен циклоспорину А, за исключением того, что MeLeu в положении 4 заменен Melle (N-метил-Lизолейцином). форме осуществления изобретение относится к способу предупреждения или уменьшения В другой мышечной дегенерации у субъекта, страдающего ПКМД, и, в частности, саркогликанопатией, и более конкретно ПКМД типа 2F, включающему введение субъекту эффективного количества неиммуносупрессивного производного CsA [D-MeAla]3-[EtVal]4-CsA формулы I. Эффективное количество неиммуносупрессивного производного циклоспорина А понимают как количество, которое при повторном введении в ходе терапевтической схемы субъекту, страдающему ПКМД, и, в частности, саркогликанопатией, и более конкретно ПКМД типа 2F приводит в результате к объективному клиническому ответу, такому как улучшение, стабилизация или замедление прогрессирования заболевания. При введении перорально эффективное количество для суточного введения или введения три раза в неделю должно составлять от примерно 1 мг/кг (массы тела) до примерно 100 мг/кг, предпочтительно от примерно 1 до примерно 20 мг/кг. Внутривенным путем показанная соответствующая дозировка может составлять от примерно 1 до примерно 50 мг/кг, предпочтительно от примерно 1 до примерно 25 мг/кг. Настоящее изобретение будет дополнительно объяснено ниже с помощью приведенных ниже графических материалов. На фиг. 1(а) представлено набухание базового уровня, измеренное как поглощение при 540 нм, митохондрий из скелетной мышцы 6-недельных мышей дикого типа (Wt) (белый столбик) и мышей scgd-/(черный столбик). Митохондрии из группы подошвенных мышц, четырехглавой и передней большеберцовой мышц объединяли. Как показывает более низкое измерение поглощения, митохондрии из мышц мышей scgd-/- были в большей степени набухшими при базовом уровне, чем митохондрии от мышей Wt. На фиг. 1(б) представлены изменения в набухании митохондрий через 10 мин после обработки кальцием (Са 2+) или ПЭГ-3350 (ПЭГ), измеренные как разности поглощения при 540 нм между необработанными и обработанными митохондриями от 6-недельных мышей дикого типа (Wt) (белый столбик) и мышей scgd-/- (черный столбик). Митохондрии из группы подошвенных мышц, четырехглавой и передней большеберцовой мышц объединяли. На фиг. 2(а) представлено уменьшение мышечной патологии после введения D-[MeAla]3-[EtVal]4CsA у мышей scgd-/-. Отношения массы мышц (MW) к длине большеберцовой кости (TL) (MW/TL) измеряли в икроножной (Gastroc), четырехглавой (Quad.), передней большеберцовой (ТА) и сердечной мышце от мышей дикого типа (Wt), обработанных либо носителем (белый столбик), либо D-[MeAla]3[EtVal]4-CsA (черный столбик), или от мышей scgd-/-, обработанных либо носителем (серый столбик или второй от конца в группе), либо D-[MeAla]3-[EtVal]4-CsA (столбик с точечной заливкой или последний столбик в группе). D-[MeAla]3-[EtVal]4-CsA предотвращает увеличение массы мышцы у мышей Scgd-/-,которое обусловлено заболеванием. На фиг. 2(б) представлено уменьшение мышечной патологии после введения D-[MeAla]3-[EtVal]4CsA у мышей Scgd-/-, наблюдаемое в репрезентативных срезах, окрашенных гематоксилином и эозином,четырехглавой мышцы от мышей дикого типа (Wt) и мышей scgd-/-, обработанных D-[MeAla]3-[EtVal]4CsA. Также показаны соответствующие контроли носителя. На фиг. 2(в) представлено уменьшение мышечной патологии после введения D-[MeAla]3-[EtVal]4CsA у мышей scgd-/-, оцениваемое путем количественного определения площадей волокон в срезах, окрашенных трихромом, из диафрагмы (Diaph.), передней большеберцовой мышцы (ТА), икроножной мышцы (Gastroc), четырехглавой мышцы (Quad). Оценивали срезы от мышей дикого типа (Wt), обработанных либо носителем (белый столбик), либо D-[MeAla]3-[EtVal]4-CsA (черный столбик), и от мышейscgd-/-, обработанных либо носителем (серый столбик или второй столбик от конца в группе), либо D[MeAla]3-[EtVal]4-CsA (столбик с точечной заливкой или последний столбик группы). D-[MeAla]3[EtVal]4-CsA уменьшал фиброз у мышей scgd-/-. На фиг. 3(а) представлено уменьшение гетерогенности площади мышечных волокон в мышце от мышей scgd-/- после введения D-[MeAla]3-[EtVal]4-CsA, которую оценивали путем количественного определения распределения площадей волокон в передней большеберцовой (мышце). Исследование включало мышей дикого типа (Wt), обработанных либо носителем (белый столбик), либо D-[MeAla]3-[EtVal]4CsA (черный столбик), и у мышей scgd-/-, обработанных либо носителем (серый столбик или второй столбик от конца в группе), либо D-[MeAla]3-[EtVal]4-CsA (столбик с точечной заливкой или последний столбик группы). ( обозначает "ниже", обозначает "выше"). Обработка D-[MeAla]3-[EtVal]4-CsA нормализовала гетерогенность площади волокон у мышей scgd-/-. На фиг. 3(б) представлено уменьшение гетерогенности площади мышечных волокон в мышце от мышей scgd-/- после введения D-[MeAla]3-[EtVal]4-CsA, которую оценивали путем количественного определения распределения площадей волокон в икроножной (мышце). Исследование включало мышей дикого типа (Wt), обработанных либо носителем (белый столбик), либо D-[MeAla]3-[EtVal]4-CsA (черный столбик), и у мышей scgd-/-, обработанных либо носителем (серый столбик или второй столбик от конца в группе), либо D-[MeAla]3-[EtVal]4-CsA (столбик с точечной заливкой или последний столбик группы).( обозначает "ниже", обозначает "выше"). Обработка D-[MeAla]3-[EtVal]4-CsA нормализовала гетерогенность площади волокон у мышей scgd-/-. На фиг. 3(в) представлено уменьшение гетерогенности площади мышечных волокон в мышце от мышей scgd-/- после введения D-[MeAla]3-[EtVal]4-CsA, которую оценивали путем количественного оп-3 021701 ределения распределения площадей волокон в четырехглавой мышце. Исследование включало мышей дикого типа (Wt), обработанных либо носителем (белый столбик), либо D-[MeAla]3-[EtVal]4-CsA (черный столбик), и у мышей scgd-/-, обработанных либо носителем (серый столбик или второй столбик от конца в группе), либо D-[MeAla]3-[EtVal]4-CsA (столбик с точечной заливкой или последний столбик группы).( обозначает "ниже", обозначает "выше"). Обработка D-[MeAla]3-[EtVal]4-CsA нормализовала гетерогенность площади волокон у мышей scgd-/-. Если повышенная концентрация кальция служит в качестве инициатора ПКМД посредством некроза мышечных волокон, ряд нижележащих кальций-зависимых эффекторов можно потенциально считать причинными факторами. Например, повышенный кальций может привести к некрозу мышечных трубочек посредством активации активируемой кальцием протеазы калпаина, сигнального белка, критически вовлеченного в регенерацию скелетных мышц после повреждения и в дифференциацию скелетномышечных клеток. Авторы Parsons et al. (2007) показали в мышиной модели ПКМД, что ингибирование активности активируемой кальцием/кальмодулином сериновой/треониновой протеинфосфатазы кальцинеурина (calcineurin) в результате генетической делеции уменьшало дегенерацию и воспаление скелетной мышцы и мышечных волокон, то есть улучшало патологию скелетной мышцы. Этого не было в случае мышиной модели дистрофии Дюшенна, где ингибирование кальцинеурина CsA было вредным для мышечной патологии (Stupka et al., Acta Neuropathol, 2004, 107: 299-310). Это расхождение в последствиях ингибирования активности кальцинеурина при различных дистрофиях, характеризующихся повышенными концентрациями кальция в мышечных клетках, преимущественно является следствием их соответствующих различных генетических делеций, вовлекающих и действующих на различные изменения мембраны мышечных клеток и различные пути передачи сигнала. Другим основным механизмом, ведущим к клеточному некрозу, является перегрузка митохондриального кальция, которая вторично усиливает образование активных форм кислорода (АФК) и дополнительно способствует МРТ (изменению мембранной проницаемости митохондрий). Повышенный субсарколеммальный кальций также способствует локальному повышению активных форм кислорода (АФК),приводящему к более значительным дефектам в клеточной мембране и дополнительному поступлению кальция, дополнительно способствующему клеточному некрозу и/или апоптозу. Были проведены эксперименты по экспериментальной проверке существования причинной связи между отсутствием гена scgd, прогрессирующей дегенерацией мышечных волокон и клеточным некрозом и/или апоптозом, индуцированным митохондриальной дисфункцией. Чтобы оценить, может ли индуцированная кальцием митохондриальная дисфункция инициировать и направлять прогрессирующую дегенерацию мышечных волокон, обусловленную ПКМД, авторы настоящего изобретения сравнивали митохондрии, выделенные из дистрофической скелетной мышцы мышей scgd -/- и мышей дикого типа. Митохондрии, выделенные путем гомогенизации в буфере, содержащем сахарозу (250 мМ сахароза, 10 мМ Трис (рН 7,4), 1 мМ ЭДТА), из группы подошвенных мышц, четырехглавой и передней большеберцовой мышц, суспендировали после промывок и центрифугирования в изотоническом буфере (120 мМ KCl, 10 мМ Трис (рН 7,4), 5 мМ KH2PO4) и тестировали в анализе набухания. Этот анализ состоял в инкубации выделенных митохондрий с 200 мкМ CaCl2 (набухание) или 5% (мас./об) ПЭГ-3350 (сморщивание). Набухание дает уменьшение, а сморщивание увеличение поглощения при 540 нм. Результаты представлены в виде средних значенийСОС (стандартной ошибки средних) (фиг. 1(а) и фиг. 1(б. Использовали двухвыборочный t-критерий Стьюдента и значения считали значимыми только при р 0,05. Митохондрии, выделенные из скелетной мышцы мышей scgd-/-, набухали при базовом уровне по сравнению с митохондриями мышей дикого типа. Они были также рефракторными к дополнительному набуханию экзогенно наносимым кальцием и не проявляли реверсии в набухании базового уровня (фиг. 1(а) и фиг. 1(б. Эта нечувствительность митохондрий мышей scgd -/- к дополнительному кальцию указывала на то, что они были набухшими и патологическими, что соответствует нижележащим патологическим эффектам, таким как ответ псевдогипертрофии в икроножной мышце и четырехглавой мышце в возрасте 6 недель, где эта гипертрофия обусловлена воспалением ткани, выраженное снижение мышечных масс с возрастом по сравнению с мышами дикого типа, характерное увеличение центральной нуклеации мышечных волокон, указывающей на регенерацию вследствие продолжающейся дегенерации и многочисленные циклы дегенерации/регенерации, и дестабилизация мышечной мембраны, поврежденной избытком кальция. Вышеуказанные открытия являются сильным свидетельством в пользу предположения, что кальций-зависимый процесс МРТ лежит в основе прогрессирующей дегенерации мышечных волокон, обусловленной ПКМД, даже, несмотря на то, что латентная митохондриальная аномалия может не являться предсказывающей тяжесть клинического синдрома. В принципе, патогенная цепь событий вслед за генетическим повреждением может быть прервана соответствующим лекарством. Например, потеря активности миостатина может ослаблять ПКМД у мышей scgd-/- посредством уменьшения фиброза и индуцировать регенерацию мышцы. Ингибирование активности кальцинеурина, как сообщали, производит анало-4 021701 гичные эффекты. В соответствии с обсужденными выше новыми открытиями и теми, которые представлены в примерах 1 и 2, модулирование циклов дегенерации/регенерации и уменьшение дегенерации скелетной мышцы в мышиной модели ПКМД может быть достигнуто посредством нормализации митохондриальной функции. Эти открытия авторов изобретения дают возможность нового фармакологического лечения пациентов, пораженных ПКМД, которое направлено на функцию митохондрий, но не на активность кальцинеурина, и не вызывает иммуносупрессию. Соответственно, настоящее изобретение относится к применению неиммуносупрессивного производного CsA, наиболее предпочтительно D-[MeAla]3-[EtVal]4-CsA, для предупреждения или уменьшения мышечной дегенерации у субъекта, страдающего ПКМД. Неиммуносупрессивное производное CsA можно также применять для нормализации митохондриальной функции в митохондриях, препарированных из мышечных биопсий субъекта, страдающего ПКМД. Обнаружение толерантности к перегрузке кальция в таких митохондриях должно служить в качестве индикатора того, что лечение пациента неиммуносупрессивным производным CsA будет эффективно при уменьшении тяжести заболевания. Активное соединение, то есть неиммуносупрессивное производное циклоспорина А, применяемое для лечения пациентов, страдающих ПКМД, можно вводить любым общепринятым путем. Его можно вводить парентерально, например, в форме инъекционных растворов или суспензий, или в форме инъекционных депо-препаратов. Предпочтительно его следует вводить перорально в форме растворов или суспензий для приема внутрь, таблеток или капсул. Фармацевтические композиции для перорального введения, содержащие неиммуносупрессивное производное циклоспорина A [D-MeAla]3-[EtVal]4-CsA,описаны в примерах. Такие фармацевтические композиции типично содержат выбранное неиммуносупрессивное производное циклоспорина А и одно или более чем одно вещество, являющееся фармацевтически приемлемым носителем. Подходящие фармацевтические носители описаны, например, в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA (1990), который является стандартным справочником в данной области. Типично эти композиции являются концентрированными,и их необходимо комбинировать с соответствующим разбавителем, например с водой, перед введением. Фармацевтические композиции для парентерального введения типично также включают один или более чем один эксципиент. Возможные, но не обязательные эксципиенты включают изотонический агент, буфер или другой агент, регулирующий рН, и консервант. Эти эксципиенты можно добавлять для поддержания композиции и для достижения предпочтительных диапазонов рН (примерно 6,5-7,5) и осмолярности (примерно 300 мосм/л). Дополнительные примеры препаратов циклоспорина для перорального введения можно найти в патентах США 5525590 и 5639724 и в заявке на патент США 2003/0104992. Посредством перорального пути показанная дозировка неиммуносупрессивного производного циклоспорина А для введения от ежесуточного до трех раз в неделю может составлять от примерно 1 мг/кг (массы тела) до примерно 100 мг/кг, предпочтительно от примерно 1 до примерно 20 мг/кг. Посредством внутривенного пути соответствующая показанная дозировка может составлять от примерно 1 до примерно 50 мг/кг, предпочтительно от примерно 1 до примерно 25 мг/кг. Эффективное количество неиммуносупрессивного производного циклоспорина А понимают как количество, при повторном введении в ходе терапевтической схемы пациенту с ПКМД приводит в результате к объективному клиническому ответу, такому как улучшение,стабилизация или замедление прогрессирования заболевания. Такой клинический ответ можно оценить,например, с помощью тестирования количественного изометрического напряжения (QIS). QIS дает возможность объективно оценить напряжение мышцы с помощью преобразующего давление и регистрирующего оборудования. Альтернативно нормализацию скоростей апоптоза можно оценить в биопсиях мышцы биохимическими и иммуногистохимическими методами, известными специалистам в данной области техники. Наконец, можно использовать электромиографию, которая показывает мышечную диаграмму вместо нейрогенной, которую можно определить количественно. При определении испытуемых доз для тестирования эффективности фармацевтической композиции по изобретению, содержащей неиммуносупрессивное производное циклоспорина А, наиболее предпочтительно [D-MeAla]3-[EtVal]4-CsA, врач должен учитывать многочисленные факторы. Главными среди них являются токсичность и время полужизни неиммуносупрессивного производного циклоспорина А. Дополнительные факторы включают размер пациента, возраст пациента, общее состояние пациента(включая механическую вентиляцию, клиническую стадию заболевания, тяжесть симптомов), наличие других лекарств у пациента и тому подобное. Курс лечения потребует повторного введения фармацевтической композиции по изобретению. Типично адекватную дозу лекарства будут вводить один раз в сутки. В связи с генетической природой заболевания может быть необходимость продолжать лечение в течение пролонгированного периода времени, возможно в течение жизни пациента. В настоящее время неизвестно эффективное фармакологическое лечение ПКМД. Пациентов поддерживают вакцинацией против гриппа и пневмококковой инфекции, и любую инфекцию интенсивно лечат антибиотиками. Поэтому фармацевтические композиции по настоящему изобретению могут содержать один или более чем один другой активный ингредиент в дополнение к неиммуносупрессивному производному циклоспорина А, такой как, например, один или более чем один антибиотик. Неиммуносупрессивное производное циклоспорина А и такой другой активный ингредиент можно вводить вместе как часть одной и той же фармацевтической композиции, или можно вводить по отдельности как часть соответствующего режима дозировки, предназначенного для получения пользы всех активных ингредиентов. Соответствующий режим дозировки, количество каждой вводимой дозы и специфичные интервалы между дозами каждого активного агента будут зависеть от конкретной применяемой комбинации активных агентов, от состояния пациента, подлежащего лечению, и от других факторов, обсужденных в предыдущем разделе. Такие дополнительные активные ингредиенты, как правило, вводят в количествах,равных тем, для которых они известны как эффективные в качестве отдельных терапевтических агентов. Одобренные FDA дозировки для таких активных агентов, которые получили одобрение FDA для введения людям, опубликованы. Все патенты, заявки на патенты и публикации, цитируемые в данной заявке, следует считать включенными посредством ссылки в их полном объеме. Изобретение дополнительно разработано посредством нижеследующих примеров. Примеры приведены в целях иллюстрации для специалистов в данной области техники и не предназначены для ограничения объема изобретения, как описано в формуле изобретения. Таким образом, изобретение не следует истолковывать как ограниченное приведенными примерами, но следует истолковывать как охватывающее любые и все вариации, которые становятся очевидными как результат приведенных здесь положений. Примеры Пример 1. Стабилизации индуцированного кальцием повреждения в мышечной мембране и уменьшение прогрессирования и патологии мышечной дистрофии Для стабилизации индуцированного кальцием повреждения и уменьшения прогрессирования заболевания, вызванного многочисленными циклами дегенерации/регенерации, мышей scgd-/- обрабатывалиD-[MeAla]3-[EtVal]4-CsA. Мышей scgd-/- обрабатывали подкожным введением либо D-[MeAla]3-[EtVal]4-CsA в дозе 50 мг/кг/сутки, либо носителя (препарата, который не содержит активный ингредиент D-[MeAla]3-[EtVal]4CsA), начиная с 4-недельного возраста и заканчивая в возрасте 10 недель. Различные препарированные мышцы, то есть икроножную, четырехглавую, переднюю большеберцовую и сердечную мышцы, взвешивали и определяли отношения массы мышцы (MW) к длине большеберцовой кости (TL) (MW/TL). Результаты на фиг. 2(а) и 2(в) представлены в виде среднихСОС (стандартной шибки средних). Односторонний критерий ANOVA использовали для сравнения средних среди 3 или большего числа независимых групп. Апостериорный критерий Ньюмана-Кейлса применяли всегда, когда проводили множественные сравнения, используя InStat 3.0 (программное обеспечение GraphPad от Science Inc.). Значения считали значимыми при р 0,05. В ответ на многочисленные циклы дегенерации/регенерации у мышей scgd-/- исходно представлены гипертрофические скелетные мышцы, как видно у субъектов, страдающих ПКМД. Введение D-[MeAla]3[EtVal]4-CsA у мышей scgd-/-приводило в результате к уменьшению мышечной патологии, наблюдаемому как снижение псевдогипертрофических ответов в скелетных мышцах обработанных мышей scgd-/(фиг. 2(а. Снижение скелетной мышечной гипертрофии было примерно 1,3-кратным в икроножной(Gastroc.), четырехглавой (Quad.) и передней большеберцовой (ТА) и примерно 1,2-кратным в сердечной мышце (Heart) D-[MeAla]3-[EtVal]4-CsA-обработанных мышей scgd-/- по сравнению с животными, обработанными носителями. Сниженную патологию у мышей scgd-/-, обработанных D-[MeAla]3-[EtVal]4-CsA, также наблюдали в гистологических препаратах четырехглавой мышцы (фиг. 2 (б. Улучшение организации мышечных волокон и нормализация распределений площади мышечных волокон были отмечены в гистологических препаратах, обработанных D-[MeAla]3-[EtVal]4-CsA, мышей scgd-/-по сравнению с мышами дикого типа и мышами scgd-/-, обработанными носителем. Процент фиброза оценивали с помощью биохимического анализа, который количественно определяет содержание гидроксипролина (Parsons et al., Am. J. Pathol., 2006, 168:1975-1985) в диафрагмальной(Diaph.), передней большеберцовой (ТА), икроножной (Gastroc.) и четырехглавой (Quad) мышцах от мышей дикого типа и мышей scgd-/-, обработанных или не обработанных D-[MeAla]3-[EtVal]4-CsA. Обработка мышей scgd-/- D-[MeAla]3-[EtVal]4-CsA уменьшала фиброз в различных мышцах примерно на 1,5-3,5% (фиг. 2(в. Пример 2. Нормализация распределения малых и больших волокон и снижение циклов дегенерации/регенерации в скелетных мышцах мышей scad-/-после обработки D-[MeAla]3-[EtVal]4-CsA Обработка D-[MeAla]3-[EtVal]4-CsA мышей scgd-/- частично нормализовала распределения площади волокон в передней большеберцовой (фиг. 3(а, икроножной (фиг. 3(б и четырехглавой мышцах(фиг. 3(в, указывая на снижение циклов дегенерации/регенерации. Мышам scgd-/- вводили подкожно либо D-[MeAla]3-[EtVal]4-CsA в дозе 50 мг/кг/сутки, либо носитель в течение 6 недель. Гистологический анализ волокон трех скелетных мышц от мышей scgd-/- показал значительные увеличения численности волокон малых диаметров (менее 200 мкм 2) относительно мышей дикого типа, что указывает на возросшее число регенерирующих волокон, прохождение циклов дегенерации/регенерации и прогрессирование-6 021701 заболевания. Введение неиммуносупрессивного D-[MeAla]3-[EtVal]4-CsA мышам scgd-/- снижало скорость регенерации волокон и частично нормализовало распределение малых и больших волокон. Меньшее количество малых волокон наблюдали у мышей scgd-/-, обработанных неиммуносупрессивным D[MeAla]3-[EtVal]4-CsA, по сравнению с мышами scgd-/-, которые получали только носитель. Пример 3. Пероральные препараты [D-MeAla]3-[EtVal]4-CsA. Количества выражены в виде % мас./мас. Пример А. Индивидуальные компоненты препаратов A-Г и способы их получения см. британскую заявку на патент 2222770. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение циклического ундекапептида следующей формулы:Q представляет собой MeLeu; Т 1 представляет собой (D)Ala; Т 2 представляет собой MeLeu и Т 3 представляет собой MeLeu; для изготовления лекарства для лечения поясноконечностной мышечной дистрофии. 2. Способ предупреждения или уменьшения мышечной дегенерации у субъекта, страдающего поясноконечностной мышечной дистрофией, включающий введение пациенту эффективного количества циклического ундекапептида следующей формулы:
МПК / Метки
МПК: A61K 38/13, A61P 21/00
Метки: лечения, субъекта, циклоспорина, d-mealaa]3-[etval]4-csa, поясноконечностной, лекарства, изготовления, дистрофией, предупреждения, неиммуносупрессивного, дистрофии, уменьшения, страдающего, производного, мышечной, способ, дегенерации, применение
Код ссылки
<a href="https://eas.patents.su/11-21701-primenenie-neimmunosupressivnogo-proizvodnogo-ciklosporina-a-d-mealaa3-etval4-csa-dlya-izgotovleniya-lekarstva-dlya-lecheniya-poyasnokonechnostnojj-myshechnojj-distrofii-i-sposob-p.html" rel="bookmark" title="База патентов Евразийского Союза">Применение неиммуносупрессивного производного циклоспорина a [d-mealaa]3-[etval]4-csa для изготовления лекарства для лечения поясноконечностной мышечной дистрофии и способ предупреждения или уменьшения мышечной дегенерации у субъекта, страдающего поясноконечностной мышечной дистрофией</a>
Следующий патент: Система связи в режиме ведущий-ведомый
Случайный патент: Гетероциклилзамещенные фенилсульфамоилкарбоксамиды












