Тиопроизводные лактамов в качестве высокоактивных ингибиторов hdac и их применение в качестве лекарственных средств
Номер патента: 23171
Опубликовано: 29.04.2016
Авторы: Фанто' Никола, Веши Лоредана, Пизано Клаудио, Джаннини Джузеппе, Виньола Давиде, Баттистуцци Джанфранко, Кабри Вальтер
Формула / Реферат
1. Соединение, имеющее общую формулу I
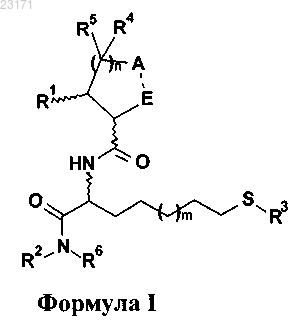
где R1 представляет собой Н, (С1-С6)-алкил или (С6-С14)-арил, или альтернативно
R1 и один R4, каждый из которых связан с двумя соседними атомами углерода, в случае если n равен 2 или 3, объединены с образованием циклопропанового кольца;
R2 представляет собой фенил, возможно замещенный галогеном, бензилокси, (C1-С3)-алкилом или CF3; (С3-С6)-циклоалкил; (С6-С14)-арил-(С1-С6)-алкил, где (С6-С14)-арил возможно замещен бензилокси, (С1-С3)-алкилом или CF3;
R3 представляет собой Н или группу формулы (II)
(CO)-R7
Формула II
R7 представляет собой (С1-С7)-алкил или (С1-С6)-алкокси;
R4 и R5 в каждом случае представляют собой Н;
R6 представляет собой Н,
R2 и R6 объединены с образованием шестичленного гетероцикла, который конденсирован с С6-арильным фрагментом;
-А-Е- представляет собой -(CO)-(NR9-) или -(NR9)-(CO)-;
R9 представляет собой Н или (С1-С3)-алкил;
m представляет собой целое число от 0 до 3;
n представляет собой целое число от 0 до 2;
символ![]() означает, что атом углерода, который отмечен указанным символом, может иметь R- или S-конфигурацию;
означает, что атом углерода, который отмечен указанным символом, может иметь R- или S-конфигурацию;
его таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и рацемические формы, а также их фармацевтически приемлемые соли.
2. Соединение по п.1, отличающееся тем, что n равен 1 или 2.
3. Соединение по п.1, отличающееся тем, что m равен 1.
4. Соединение по пп.1 и 2, выбранное из группы, состоящей из
S-{(S)-6-[((S)-4-оксоазетидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, S-[(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-(4-трифторметилбензилкарбамоил)гексилового] эфира тиоуксусной кислоты, S-{(S)-6-(3-бензилоксибензилкарбамоил)-6-[((S)-6-оксопиперидин-2-карбонил)амино]гексилового} эфира тиоуксусной кислоты, S-{(S)-7-(3,4-дигидро-1Н-изохинолин-2-ил)-7-оксо-6-[((S)-6-оксопиперидин-2-карбонил)амино]гептилового} эфира тиоуксусной кислоты, S-[(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-(2-м-толуилэтилкарбамоил)гексилового] эфира тиоуксусной кислоты, S-{(S)-6-[((R)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-п-толуилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-м-толуилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-циклопентилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((3R*,4S*)-2-оксо-4-фенилпирролидин-3-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((3R*,4R*)-2-оксо-4-фенилпирролидин-3-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((R)-5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[(R*)-(2-оксопиперидин-3-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты, ((S)-1-циклопентилкарбамоил-6-меркаптогексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты, [(S)-1-(3-бензилоксибензилкарбамоил)-6-меркаптогексил]амида (S)-6-оксопиперидин-2-карбоновой кислоты, [(S)-6-меркапто-1-(4-трифторметилбензилкарбамоил)гексил]амида (S)-6-оксопиперидин-2-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-4-оксоазетидин-2-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (3S,4S)-2-оксо-4-фенилпирролидин-3-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (3R,4R)-2-оксо-4-фенилпирролидин-3-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (3R,4S)-2-оксо-4-фенилпирролидин-3-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (3S,4R)-2-оксо-4-фенилпирролидин-3-карбоновой кислоты, [(S)-1-(3,4-дигидро-1Н-изохинолин-2-карбонил)-6-меркаптогексил]амида (S)-6-оксопиперидин-2-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (R)-5-оксопирролидин-2-карбоновой кислоты, [(S)-6-меркапто-1-(2-м-толуилэтилкарбамоил)гексил]амида (S)-6-оксопиперидин-2-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (R)-2-оксопиперидин-3-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-2-оксопиперидин-3-карбоновой кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (R)-6-оксопиперидин-2-карбоновой кислоты, смешанного {(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} этилового эфира тиокарбоновой кислоты, S-{(S)-6-[((S)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоизомасляной кислоты, S-{(S)-6-[((S)-5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((S)-5-оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((R)-1-метил-5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, смешанного {(S)-6-[((R)-5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексилового}этилового эфира тиокарбоновой кислоты, S-{(S)-6-[((R)-5-оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексилового} эфира тиоуксусной кислоты, S-{(S)-6-[((R)-1-метил-5-оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексилового} эфира тиоуксусной кислоты, S-[(S)-6-[((R)-5-оксопирролидин-2-карбонил)амино]-6-(3-трифторметилфенилкарбамоил)гексилового] эфира тиоуксусной кислоты, S-{(S)-6-[((S)-1-метил-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты, ((S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-1-метил-6-оксопиперидин-2-карбоновой кислоты, ((S)-6-меркапто-1-м-толуилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты, ((S)-6-меркапто-1-п-толуилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты и S-{(S)-6-[((S)-6-оксо-1,2,3,6-тетрагидропиридин-2-карбонил)амино]-6-фенилкарбамоилгексилового} эфира тиоуксусной кислоты.
5. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по пп.1-4 в качестве активного ингредиента в смеси по меньшей мере с одним фармацевтически приемлемым носителем и/или наполнителем.
6. Применение соединения по любому из пп.1-4 в качестве лекарственного средства.
7. Применение по п.6 для лечения патологического состояния, при котором модуляция активности HDAC приводит к улучшению состояния здоровья пациента.
8. Применение по п.7, отличающееся тем, что патологическое состояние представляет собой раковое заболевание, нейродегенеративное заболевание, воспалительное заболевание, инсульт, ишемию или инфекции Plasmodium.
9. Применение по п.8, отличающееся тем, что раковое заболевание представляет собой рак груди, поджелудочной железы, легких, толстой кишки, плевры, брюшной полости, лица и шеи, почки, мочевого пузыря, мозга, простаты, яичников или глаз.
10. Применение по п.9, отличающееся тем, что раковое заболевание представляет собой метастатическую форму рака.
11. Применение по п.8, отличающееся тем, что воспалительное заболевание представляет собой ревматоидный артрит.
12. Применение по п.8, отличающееся тем, что нейродегенеративное заболевание представляет собой болезнь Хантингтона, болезнь Паркинсона, амиотрофический латеральный склероз.
13. Способ лечения пациента, пораженного раковым заболеванием, включающий введение соединения по пп.1-4.
14. Способ синтеза соединений по п.1 путем взаимодействия соединений формулы III
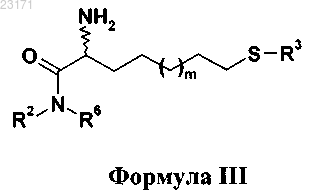
где R2, R3 и R6 и m такие, как описано в п.1,
с соединениями формулы IV в форме соли или несолевой форме.
Текст
ТИОПРОИЗВОДНЫЕ ЛАКТАМОВ В КАЧЕСТВЕ ВЫСОКОАКТИВНЫХ ИНГИБИТОРОВ HDAC И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ Изобретение относится к новым амидным соединениям формулы (I) и к их применению в качестве противоопухолевых и проапоптотических агентов. Изобретение включает применение указанных соединений в медицине в отношении раковых заболеваний, а также других заболеваний,чувствительных к ингибированию HDAC, и фармацевтическую композицию, содержащую указанные соединения.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. Область техники Настоящее изобретение относится к новым тиосоединениям и их применению в качестве лекарственных средств. Изобретение включает применение указанных соединений и фармацевтической композиции, содержащей указанные соединения, в медицине для лечения раковых заболеваний, воспалительных заболеваний, нейрональных заболеваний, паразитарных инфекций (например, инфекции Plasmodium), а также других заболеваний, чувствительных к ингибированию HDAC. Уровень техники Гистондеацетилазы (HDAC) являются семейством ферментов, содержащихся в ряде организмов,включая бактерии, грибки, растения и животных. Указанные ферменты катализируют удаление ацетильных групп из остатков -N-ацетилированного лизина, входящих в состав различных белковых субстратов, включая гистоны, факторы транскрипции, -тубулин и импортеры белковых веществ в ядро. К настоящему времени охарактеризованы восемнадцать изоформ HDAC. Они разделены на четыре различных семейства по сходству последовательностей их ДНК и их биологической роли в клетках.HDAC1, HDAC2, HDAC8 и HDAC3 являются представителями класса I. Первые три изоформы,главным образом, представлены в ядре, тогда как HDAC3 также присутствует в цитоплазме или связана с мембраной.HDAC4, HDAC5, HDAC6, HDAC7, HDAC9 и HDAC10 образуют класс II. Этот класс дополнительно разделен на два подкласса - класс IIa (HDAC4, 5, 7 и 9) и класс IIb (HDAC6 и 10). Ферменты класса II экспрессируются в ограниченном количестве типов клеток и либо перемещаются между ядром и цитоплазмой (т.е. класс IIa), либо присутствуют, главным образом, в цитоплазме (т.е. класс IIb) (Yang X.J., etal., Mol. Cell. Biol, 2005, 25, 2873). Класс IV состоит только из одного члена (HDAC11), при этом класс III состоит из НАД (никотинамидадениндинуклеотидфосфат)+-зависимых ферментов, также называемых сиртуинами. Общим отличительным признаком ферментов классов I, II и IV является их чувствительность к цинку. Было показано,что ингибиторы HDAC (HDACi) являются высокоактивными стимуляторами блокировки роста, дифференцировки и апоптотической гибели трансформированных клеток in vitro и in vivo. Также на моделях аутоиммунных и воспалительных заболеваний было показано, что ингибирование HDAC приводит к снижению воспаления (Leoni F., et al. , Proc. Natl. Acad. Sci., 2002, 99, 2995). Одним из первых соединений, которое было подтверждено как HDACi, являлась хорошо известная вальпроевая кислота, используемая против эпилепсии, которая ингибирует все изоформы классов I, II иIV. После выявления важной роли этого семейства ферментов в развитии рака рядом научных групп, а также фармацевтических компаний предпринимались попытки, направленные на поиск высокоактивныхHDACi. Вориностат, первоначально известный как SAHA (субероиланилид гидроксамовой кислоты), являлся лучшим HDACi в классе небольших производных гидроксаматов, одобренным FDA в 2006 году для лечения редкого ракового заболевания - кожной Т-клеточной лимфомы - у пациентов, которым ранее проводили по меньшей мере одну системную терапию (Grant S., et al., Nature Rev. Drug Discov., 2007, 6,21). SAHA является высокоактивным HDACi, ингибирующим классы I и II, при этом в настоящее время подавляющее большинство HDACi находится на стадии клинических исследований (Paris М., et al., J.Med. Chem., 2008, 51, 1505). Фактически, в зависимости от структуры различные семейства ингибиторов можно разделить на четыре основные группы:a) короткоцепочечные жирные кислоты (например, бутират натрия, фенилбутират, Pivanex (пивалоилоксиметилбутират, AN-9) и вальпроевая кислота);d) бензамид (например, энтиностат (MS-275), моцетиностат (MGCD-0103) и ацетилдиналин (CI994. Для определения эффективности комбинации широкого спектра HDACi и стандартных химиотерапевтических агентов (например, доцетаксела и вориностата) у пациентов с распространенным и рецидивирующим раком легких, мочевого пузыря или простаты проводили ряд клинических исследований с применением комбинированной терапии (клиническое исследование NCT00565227). Еще примерно тринадцать лет назад предположили, что HDAC является потенциальной мишенью для лечения паразитарных инфекций (например, инфекции Plasmodium). С учетом того, что в научном сообществе большинство попыток направлено на выявление селективных HDACi, в медицине сохраняется большая потребность в универсальных ингибиторах, поскольку показано, что в различных раковых заболеваниях задействованы различные изоформы HDAC. Кроме того, в научном сообществе также выделились группы,пытающиеся соотнести конкретные изоформы HDAC и конкретные раковые заболевания (Giannini G., etal., Future Medicinal Chemistry, 2012, 4, 11, 1439-1460). Действительно, содержание HDAC1 повышено при раке простаты (Halkidou К., et al., Prostate, 2004, 59, 177) и раке кишечника (Choi J.H., et al., Jpn. J.Cancer Res., 2001, 92, 1300), HDAC2 - при раке кишечника (Song J., et al., APMIS, 2005, 113, 264), HDAC3- при раке легких (Bartling В., et al., Lung Cancer, 2005, 49, 145), а при плоскоклеточной карциноме полости рта наблюдается повышенная экспрессия HDAC6 (Sakuma Т., et al., J. Oncol, 2006, 29, 117). Также отмечено участие HDAC в других заболеваниях, таких как нейродегенеративные заболевания (Chuang D.M., et al., Trends in Neuroscience, 2009, 32, 11, 591; Sleiman S.F., et al., Expert Opin. Investig.Drugs, 2009, 18, 5, 573), гипертрофия сердца (Hamamori Y., et al., J. Clin. Invest., 2003, 112, 6, 824). В недавнем обзоре подробно рассмотрены заболевания, новым подходом к лечению которых является ингибирование HDAC (Dinarello С.A., et al., Mol. Med, 2011, 77, 333). Известно, что бидентатный фрагмент гидроксамовой кислоты является одной из лучших групп, связывающих цинк, и было разработано множество ингибиторов HDAC, содержащих указанный фрагмент(Sampath-Kumar A., et al., Bioorg. Med. Chem. Lett., 2005, 15, 8, 1969). Тем не менее, применение указанной функциональной группы связывают с ухудшением фармакокинетических свойств (Colletti S., et al.,Bioorg. Med. Chem. Lett., 2001, 11, 107), а также с продолжительной токсичностью (Suzuki Т., Cur. Med.Chem., 2005, 12, 24, 2867). Соответственно предпринималось множество попыток выявления новыхHDACi, которые могут иметь высокую аффинность связывания с биологической мишенью, а также высокую активность в клетке. В недавно опубликованном обзоре (Bertrand P., Eur. J. Med. Chem., 2010, 45, 2095), в котором определяли аффинность связывания и биологические свойства, среди негидроксаматных производных были описаны тиоаддукты, что позволяет предположить, что последние могут иметь ориентацию в активном участке белка, совершенно отличную от ориентации гидроксаматных аналогов. Несмотря на то что проводились исследования HDACi, содержащих линейную тиосвязывающую группу, тем не менее, до настоящего времени не было клинических испытаний ни одного из указанных производных. П. Бертранд (Bertrand P.) также предположил, что биологическая активность FK228 была вызвана восстановлением дисульфидной связи, что приводило к получению тиоаддукта 1, и активным веществом являлся последний, что изображено ниже на схеме 1. Схема 1 Тем не менее, этот механизм действия FK228 может быть оспорен на основании заявки на патент США 12/845658, в которой в качестве активного соединения предложен другой метаболит. К сожалению, так как биологическая активность различных метаболитов, предложенных в теории, не показана,прямых выводов на основании этой работы сделать нельзя. Был синтезирован линейный тиоаналог SAHA (схема 2) (Suzuki Т., et al., Bioorg. Med. Chem. Lett,2004, 14, 3313), и оба соединения имели схожую аффинность к HDAC. Схема 2 Т. Сузуки с соавторами (Suzuki Т., et al.) дополнительно предложили более активные HDACi с тиосодержащими группами, связывающими металлы (MBG), содержащие более стерически затрудненный амидный фрагмент, такой как бифенил, бензофуран, индол или хинолин вместо фенильной группы SAHA (Suzuki Т., et al., J. Med. Chem., 2005. 48, 1019). Предпочтительным вариантом реализации настоящего изобретения являются соединения формулы(I), описанные ранее, где R3 представляет собой группу формулы (II), описанную выше. Согласно другому варианту реализации настоящего изобретения раковым заболеванием, подвергающимся лечению, является первичная опухоль, выбранная из группы, включающей саркому, карциному, меланому, опухоль кости, нейроэндокринную опухоль, лимфоидную лейкемию, миелоидную лейкемию, моноцитарную лейкемию, мегакариоцитарную лейкемию, острую промиелоцитарную лейкемию или болезнь Ходжкина. Вышеуказанные саркома и карцинома состоят из группы, включающей рак груди, рак легких,включая немелкоклеточный рак легких (НМРЛ) и мелкоклеточный рак легких (МРЛ); рак желудочнокишечного тракта, включая рак пищевода, желудка, тонкого кишечника, толстого кишечника, прямой кишки и толстой кишки; глиому, включая глиобластому; рак яичников; рак шейки матки; рак эндометрия; мезотелиому; рак почек; рак простаты; рак брюшной полости; рак плевры; рак области лица и шеи; рак мочевого пузыря; рак мозга и рак кожи или глаз. Новообразования также могут относиться к педиатрическому раку. Педиатрические раковые забо-2 023171 левания, которые можно лечить или прогрессирование которых можно отсрочивать согласно настоящему изобретению, например, выбраны из группы, состоящей из острой лимфобластной лейкемии, острой миелоидной лейкемии, адренокортикальной карциномы, астроцитом, рака мочевого пузыря, глиомы ствола головного мозга, атипичного тератоидного/рабдоидного рака центральной нервной системы, рака мозга,эмбрионального рака центральной нервной системы, рака мозга, астроцитом, краниофарингиом, эпендимобластомы, эпендимомы, детской медуллобластомы, медуллоэпителиомы, рака паренхимы шишковидной железы с промежуточной дифференцировкой, супратенториального примитивного нейроэктодермального рака и пинеобластомы, рака груди, бронхиального рака, карциноидного рака, рака шейки матки, хордомы, колоректального рака, рака пищевода, экстракраниального рака зародышевых клеток, рака желудка, глиомы, печеночно-клеточного рака (рака печени), лимфомы Ходжкина, рака почки, рака гортани, лейкемии, острой лимфобластной/миелоидной лейкемии, рака печени, нехождкинской лимфомы,медуллобластомы, мезотелиомы, синдрома множественной эндокринной неоплазии, рака носоглотки,рака полости рта, рака яичников, рака поджелудочной железы, папилломатоза, почечно-клеточного рака,рабдомиосаркомы, рака слюнных желез, саркомы, рака кожи, тимомы и тимусной саркомы, рака щитовидной железы и рака влагалища. Другой вариант реализации настоящего изобретения включает соединения, выбранные из группы,состоящей из S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты, S)-1-циклопентилкарбамоил-6-меркаптогексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты,[(S)-1-(3-бензилоксибензилкарбамоил)-6-меркаптогексил]амида (S)-6-оксопиперидин-2-карбоновой кислоты,[(S)-6-меркапто-1-(4-трифторметилбензилкарбамоил)гексил]амида(S)-6-оксопиперидин-2 карбоновой кислоты, S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-1-метил-6-оксопиперидин-2 карбоновой кислоты, S)-6-меркапто-1-м-толуилкарбамоилгексил)амида (S)-6-оксопиперидин-2 карбоновой кислоты и S)-6-меркапто-1-п-толуилкарбамоилгексил)амида (S)-6-оксопиперидин-2 карбоновой кислоты и соответствующих пролекарств, где R3 такой, как описан для соединений формулы(I), но не является Н. Другой вариант реализации настоящего изобретения включает соединения, выбранные из группы,состоящей из S-(S)-6-[S)-4-оксоазетидин-2-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S-[(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-(4-трифторметилбензилкарбамоил)гексильного] эфира тиоуксусной кислоты, S-(S)-6-(3-бензилоксибензилкарбамоил)-6-[S)-6 оксопиперидин-2-карбонил)-амино]гексильного эфира тиоуксусной кислоты, S-(S)-7-(3,4-дигидро-1 Низохинолин-2-ил)-7-оксо-6-[S)-6-оксопиперидин-2-карбонил)амино]гептильного эфира тиоуксусной кислоты, S-[(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-(2-м-толуилэтилкарбамоил)-гексильного] эфира тиоуксусной кислоты, S-(S)-6-[R)-6-оксопиперидин-2-карбонил)-амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]6-п-толуилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-м-толуилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-циклопентилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)6-[3R,4S)-2-оксо-4-фенилпирролидин-3-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[3R,4R)-2-оксо-4-фенилпирролидин-3-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[R)-5-оксопирролидин-2-карбонил)амино]-6 фенилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[(R)-(2-оксопиперидин-3-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S)-6-меркапто-1-фенил-3 023171(R)-6 оксопиперидин-2-карбоновой кислоты, смешанного (S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6 фенилкарбамоилгексилового-этилового эфира тиокарбоновой кислоты, S-(S)-6-[S)-6-оксопиперидин 2-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоизомасляной кислоты, S-(S)-6-[S)-5 оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S(S)-6-[S)-5-оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексильного эфира тиоуксусной кислоты, S-(S)-6-[R)-1-метил-5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, смешанного (S)-6-[R)-5-оксопирролидин-2-карбонил)амино]-6 фенилкарбамоилгексиловогоэтилового эфира тиокарбоновой кислоты,S-(S)-6-[R)-5 оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексильного эфира тиоуксусной кислоты, S(S)-6-[R)-1-метил-5-оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексильного эфира тиоуксусной кислоты, S-[(S)-6-[R)-5-оксопирролидин-2-карбонил)амино]-6-(3-трифторметилфенилкарбамоил)гексильного] эфира тиоуксусной кислоты, S-(S)-6-[S)-1-метил-6-оксопиперидин-2 карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты, S)-6-меркапто-1 фенилкарбамоилгексил)амида (S)-1-метил-6-оксопиперидин-2-карбоновой кислоты, S)-6-меркапто-1-мтолуилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты, S)-6-меркапто-1-птолуилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты и S-(S)-6-[S)-6-оксо 1,2,3,6-тетрагидропиридин-2-карбонил)амино]-6-фенилкарбамоилгексильного эфира тиоуксусной кислоты. Описание чертежа Фиг. 1 - вестерн-блот анализ экстрактов цитоплазмы и ядер клеток NCI-H460 после введения соединения согласно примеру 14. В проиллюстрированных ниже примерах приведен не исчерпывающий перечень объектов, находящихся под защитой настоящего изобретения. Примеры Сокращения.Et2O - диэтиловый эфир ВЭЖХ - высокоэффективная жидкостная хроматографияIPA - изопропиловый спирт МеОН - метанолSac - тиоацетил ТФУ - трифторуксусная кислота ТСХ - тонкослойная хроматография Общие положения. Все реакции в безводной среде проводили в высушенной пламенем стеклянной посуде при положительном давлении аргона без доступа влаги к реагентам и стеклянной посуде при помощи традиционных способов обращения с чувствительными к воздуху соединениями. Безводный ТГФ, толуол, Et2O и ДХМ получали путем фильтрования через колонки с осушителем (Solvent Delivery System); другие растворители перед применением перегоняли при положительном давлении сухого аргона и сушили при помощи традиционных способов. Реагенты, получаемые из коммерческих источников, использовали без дополнительной очистки. Флэш-хроматографию проводили на силикагеле 230-400 меш с использованием указанных систем растворителей. Тонкослойную хроматографию проводили на пластинах с предварительно нанесенным силикагелем и фольгированной обратной стороной (Merck 60F254). Визуализацию проводили в коротковолновом ультрафиолете и/или путем погружения пластин в раствор сульфата церия/молибдата аммония в водной H2SO4, перманганата калия или раствор анисальдегида в этаноле и последующего обугливания с использованием фена. В качестве альтернативы окрашивание пластин ТСХ можно проводить путем воздействия паров йода в проявляющей камере с йодом. Массовый анализ с низким и высоким разрешением проводили на масс-спектрометрах AEI-MS 902 или MS-50 с использованием техники электронного распыления (ИЭР). Спектры ядерного магнитного резонанса получали на спектрометрахGemini (Varian) при 300 или 500 МГц. Массовый анализ проводили на спектрометре Waters ZQ2000 с использованием техники электронного распыления (ИЭР). Анализ ЖХМС проводили на устройстве LCWaters (HPLC Waters Alliance 2695, ZQ2000 MS, детектор PDA-УФ 2996). Пример 1. S-(S)-6-[S)-4-Оксоазетидин-2-карбонил)амино]-6-фенилкарбамоилгексиловый сложный эфир тиоуксусной кислоты. Схема 1 Стадия А. трет-Бутиловый эфир S)-1-фенилкарбамоилгекс-5-енил)карбаминовой кислоты. Раствор (S)-2-трет-бутоксикарбониламиногепт-6-еновой кислоты (5,24 ммоль), DIPEA (15,7 ммоль) и анилина (5,76 ммоль) перемешивали при КТ в ДХМ (70 мл) в течение 20 мин, после чего добавляли РуВОР (5,24 ммоль) и безводный ДМФ (5 мл). Реакционную смесь перемешивали в течение 2 ч при КТ. Растворитель удаляли при пониженном давлении и неочищенную реакционную смесь разбавляли AcOEt,промывали 5% Na2CO3, водой, а затем 5% водной лимонной кислотой и, наконец, солевым раствором. После удаления растворителя при пониженном давлении и очистки на силикагеле (н-гексан/AcOEt: 9/1) получали целевой аддукт. Выход: 85%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,13 (m, 2 Н), 1,14 (s, 9 Н), 1,60 (m, 2 Н), 2,01 (m, 2 Н), 4,05 (m, 1H),4,94 (m, 2 Н), 5,77 (m, 1 Н), 7,02 (m, 2 Н), 7,29 (t, 2H), 7,59 (d, 2H), 9,92 (s, 1H). ИЭР-МС m/z 341,2 (M+Na)+. Стадия В. S-S)-6-трет-Бутоксикарбониламино-6-фенилкарбамоилгексиловый) эфир тиоуксусной кислоты. В перемешиваемый раствор трет-бутилового эфира S)-1-фенилкарбамоилгекс-5-енил)карбаминовой кислоты (250 мг, 0,78 ммоль), тиоуксусной кислоты (564 мкл, 7,8 ммоль) в дегазированном диоксане при 75 С добавляли AIBN (129 мг, 0,78 ммоль). Реакционную смесь перемешивали в течение 1 ч. Реакционную смесь охлаждали до 0 С и при перемешивании добавляли избыток циклогексена, перемешивали в течение 20 мин. Реакционную смесь концентрировали при пониженном давлении, а полученный неочищенный продукт промывали несколько раз гексаном с получением целевого аддукта. Выход: 81%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,30 (m, 4H), 1,36 (s, 9H), 1,47 (m, 2H), 1,56 (m, 2H), 2,29 (s, 3 Н),2,79 (t, 2 Н), 4,02 (m, 1H), 6,96 (d, 1H), 7,02 (t, 1H), 7,28 (t, 2H), 7,57 (d, 2H), 9,89 (s, 1H). ИЭР-МС m/z 417,2 (M+Na)+. Стадия С. S-S)-6-Амино-6-фенилкарбамоилгексиловый) эфир тиоуксусной кислоты. В перемешиваемый раствор S-S)-6-трет-бутоксикарбониламино-6-фенилкарбамоилгексилового) эфира тиоуксусной кислоты в ДХМ при 0 С медленно добавляли ТФУ. Реакционную смесь затем оставляли нагреваться до КТ и перемешивали в течение ночи. Растворитель удаляли при пониженном давлении с получением целевого аддукта в виде трифторацетатной соли, который использовали без какойлибо очистки на следующей стадии. Стадия D. S-(S)-6-[S)-4-Оксоазетидин-2-карбонил)амино]-6-фенилкарбамоилгексиловый эфир тиоуксусной кислоты. В раствор трифторацетатной соли, полученной на стадии С (305 мг, 0,75 ммоль), в ДХМ (10 мл) добавляли NEt3 (312 мкл, 2,24 ммоль), (S)-4-оксоазетидин-2-карбоновую кислоту (90 мг, 0,79 ммоль), РуВОР (408 мг, 0,79 ммоль) и ДМФ (1,7 мл). Реакционную смесь перемешивали в течение ночи, а затем разбавляли AcOEt, промывали водой, 5% водн. Na2CO3, солевым раствором, 5% раствором лимонной кислоты и снова солевым раствором. Неочищенное вещество очищали путем хроматографии на силикагеле с использованием AcOEt в качестве элюента с получением целевого аддукта в виде белого твердого вещества. Выход: 42%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,31 (m, 4 Н), 1,48 (m, 2 Н), 1,64 (m, 2 Н), 2,29 (s, 3H), 2,67 (dt, 1H),2,79 (t, 2H), 3,09 (dd, 1H), 4,06 (dd, 1H), 4,42 (m, 1H), 7,03 (t, 1H), 7,28 (t, 2H), 7,57 (d, 2H), 8,12 (s, 1H),8,38 (d, 1H), 10,07 (s, 1H). ИЭР-МС m/z 392,0 (М+Н)+; ИЭР-МС m/z 504,2 (M+CF3COO)-. Соединения согласно примерам 2-12 синтезировали согласно способу, изображенному на схеме 1, с использованием соответствующего амина на стадии А и подходящей кислоты на стадии D. Пример 2. S-[(S)-6-[S)-6-Оксопиперидин-2-карбонил)амино]-6-(4-трифторметилбензилкарбамоил)гексиловый] эфир тиоуксусной кислоты. Выход: 51%. 1 Н ЯМР (500 МГц, CD2Cl2) : 1,39 (m, 4H), 1,56 (m, 2H), 1,64-1,94 (m, 5H), 2,05 (m, 1H), 2,24 (m, 2H),2,32 (s, 3 Н), 2,84 (t, 2H), 4,00 (m, 1H), 4,46 (m, 3H), 7,21 (m, 1H), 7,32-7,47 (m, 4H), 7,60 (m, 2H). ИЭР-МС m/z 502,09 (M+H)+. Пример 3. S-(S)-6-(3-Бензилоксибензилкарбамоил)-6-[S)-6-оксопиперидин-2-карбонил)амино] гексиловый эфир тиоуксусной кислоты. Выход: 44%. 1 Н ЯМР (500 МГц, CD2Cl2) : 1,25-1,48 (m, 4H), 1,56 (m, 2H), 1,62-1,97 (m, 5H), 2,01 (m, 1H), 2,23 (m,2H), 2,30 (s, 3 Н), 2,83 (t, 2H), 3,98 (m, 1H), 4,36 (m, 2H), 4,46 (m, 1H), 5,06 (m, 2H), 6,82-6,92 (m, 3H), 7,02(d, 1H), 7,40 (s, 1H), 8,47 (d, 1H), 9,99 (s, 1H). ИЭР-МС m/z 433,4 (М+Н)+; 546,5 (M+CF3COO)-. Пример 7. S-(S)-6-[S)-5-Оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексиловый эфир тиоуксусной кислоты Выход: 53%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,33 (m, 4 Н), 1,50 (m, 2 Н), 1,65 (m, 2 Н), 1,88 (m, 1 Н), 2,11 (m, 2 Н),2,25 (m, 1 Н), 2,27 (s, 3 Н), 2,31 (s, 3 Н), 2,81 (t, 2 Н), 4,10 (m, 1 Н), 4,38 (m, 1H), 6,87 (d, 1H), 7,18 (t, 1 Н), 7,37(d, 2H), 8,35 (d, 1H), 10,07 (s, 1H). ИЭР-МС m/z 433,9 (М+Н)+. Пример 13. S-(S)-6-[R)-6-Оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексиловый] эфир тиоуксусной кислоты Схема 2 Стадия А. трет-Бутиловый эфир S)-1-фенилкарбамоилгекс-5-енил)карбаминовой кислоты. Соединение получали согласно стадии А, описанной в примере 1. Стадия В. Фениламид (S)-2-аминогепт-6-еновой кислоты. В перемешиваемый раствор трет-бутилового эфира S)-1-фенилкарбамоилгекс-5-енил)карбаминовой кислоты (т.е. соединения, полученного на стадии А в примере 1) при 0 С медленно добавляли ТФУ. Реакционную смесь затем оставляли нагреваться до КТ и перемешивали в течение 2 ч. Растворитель удаляли при пониженном давлении с получением целевого аддукта в виде трифторацетатной соли с количественным выходом, который использовали без какой-либо очистки на следующей стадии. Стадия С. S)-1-Фенилкарбамоилгекс-5-енил)амид (R)-6-оксопиперидин-2-карбоновой кислоты. Трифторацетатную соль, полученную на стадии А, растворенную в ДХМ/ДМФ (10 мл, 10/2), подвергали взаимодействию с (R)-6-оксопиперидин-2-карбоновой кислотой (0,79 ммоль) и РуВОР (0,79 ммоль) в присутствии NEt3 (2,25 ммоль) в течение 2 ч. Реакционную смесь разбавляли ДХМ и промывали 5% Na2CO3, солевым раствором, 5% лимонной кислотой и солевым раствором. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенную реакционную смесь очищали путем хроматографии на силикагеле с использованием смеси AcOEt/MeOH (9/1) в качестве элюента с получением целевого аддукта в виде белого твердого вещества. Выход: 85%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,38 (m, 2 Н), 1,65 (m, 5 Н), 1,86 (m, 1H), 2,03 (m, 2 Н), 2,11 (t, 2 Н),3,96 (m, 1 Н), 4,44 (m, 1 Н), 4,96 (m, 2 Н), 5,77 (m, 1 Н), 7,04 (t, 1H), 7,29 (t, 2H), 7,47 (d, 1H), 7,57 (d, 2H),8,13 (d, 1H), 10,03 (s, 1H). ИЭР-МС m/z 366,3 (M+Na)+; 342,2 (М-Н)-. Стадия D. S-(S)-6-[R)-6-Оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексиловый эфир тиоуксусной кислоты. В перемешиваемый раствор S)-1-фенилкарбамоилгекс-5-енил)амида (R)-6-оксопиперидин-2 карбоновой кислоты (220 мг, 0,64 ммоль), тиоуксусной кислоты (460 мкл, 6,4 ммоль) в дегазированном диоксане (7 мл) при 75 С добавляли AIBN (105 мг, 0,64 ммоль). Реакционную смесь перемешивали до полной конверсии исходного вещества, которую отслеживали при помощи анализа ТСХ. Реакционную смесь охлаждали до 0 С и реакцию гасили избытком циклогексена при перемешивании в течение 20 мин. Концентрирование при пониженном давлении и очистка путем хроматографии на силикагеле с использованием смеси гексан/ДХМ/IPA: 50/40/10 в качестве элюента приводили к получению целевого аддукта. Выход: 53%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,30 (m, 4 Н), 1,47 (m, 2 Н), 1,64 (m, 5 Н), 1,86 (m, 1H), 2,11 (t, 2 Н),2,29 (s, 3 Н), 2,79 (t, 2 Н), 3,95 (m, 1 Н), 4,41 (m, 1H), 7,03 (t, 1H), 7,29 (t, 2H), 7,48 (d, 1H), 7,57 (d, 2 Н), 8,14(d, 1H), 10,05 (s, 1H). ИЭР-МС m/z 420,1 (М+Н)+; 532,2 (M+CF3COO)+. Соединения согласно примерам 14-18 синтезировали согласно способу, изображенному на схеме 2,с использованием соответствующего амина на стадии А и подходящей кислоты на стадии С. Пример 14. S-(S)-6-[S')-6-Оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексиловый эфир тиоуксусной кислоты. Выход: 87%. 1 Н ЯМР (200 МГц, CDCl3) : 1,31 (m, 4H), 1,47 (m, 2H), 1,64 (m, 5H), 1,84 (m, 1H), 2,09 (t, 2H), 2,29EDCI (2,10 г, 11,1 ммоль) и анилин (0,68 мл, 7,5 ммоль) добавляли в раствор 7,4 ммоль (S)-7-бром 2-трет-бутоксикарбониламиногептановой кислоты (Gupta P.K., et al., Bioorg. Med. Chem. Lett., 2010, 20,23, 7067) в ТГФ (70 мл) и реакционную смесь перемешивали в течение ночи при КТ. Растворитель уда-8 023171 ляли при пониженном давлении и неочищенную реакционную смесь разбавляли AcOEt, промывали водой, а затем 10% водной лимонной кислотой и, наконец, насыщенным NaHCO3. После удаления растворителя при пониженном давлении и очистки на силикагеле (н-гексан/AcOEt 1/9) получали целевой аддукт. Выход: 91%. 1 Н ЯМР (500 МГц, CDCl3) : 1,38-1,48 (m, 14H), 1,75-2,00 (m, 3 Н), 3,48 (t, 2H), 4,30 (m, 1H), 5,40 (m,1 Н), 6,50 (m, 1H), 7,12 (t, 1H), 7,33 (t, 2H), 7,60 (d, 2H). ИЭР-МС m/z 421,21 (M+Na)+; 423,21 (M+Na)+. Стадия В. S-S)-6-трет-Бутоксикарбониламино-6-фенилкарбамоилгексиловый) эфир тиоуксусной кислоты. Тиоацетат калия (9,7 ммоль) добавляли в раствор трет-бутилового эфира S)-6-бром-lфенилкарбамоилгексил)карбаминовой кислоты (6,5 ммоль) в EtOH (40 мл). Реакционную смесь перемешивали при КТ в течение ночи. Растворитель удаляли при пониженном давлении и полученный осадок выливали в воду и дважды экстрагировали AcOEt. Органический слой промывали солевым раствором и сушили над Na2SO4, после чего выпаривали с получением целевого аддукта. Выход: 97%. 1 Н ЯМР (300 МГц, CDCl3) : 1,45-1,50 (m, 13 Н) 1,65-1,55 (m, 3 Н), 2,10 (t, 3 Н), 2,74 (m, 1H), 2,84 (t,2H), 4,17 (s, 1H), 5,04 (s, 1H), 7,10 (t, 1H), 7,30 (t, 1H), 7,52 (d, 2H). ИЭР-МС m/z 417,41 (M+Na)+. Стадия С. Трифторацетат S-S)-6-амино-6-фенилкарбамоилгексилового) эфира тиоуксусной кислоты. Трифторуксусную кислоту (61 ммоль) добавляли в раствор S-S)-6-трет-бутоксикарбониламино-6 фенилкарбамоилгексилового) эфира тиоуксусной кислоты (6,10 ммоль) в ДХМ (30 мл). Реакционную смесь перемешивали при КТ в течение 5 ч, после чего концентрировали при пониженном давлении. Полученную неочищенную реакционную смесь дважды обрабатывали Et2O для полного удаления избытка трифторуксусной кислоты. Целевой аддукт получали в виде красноватой маслянистой жидкости. Выход количественный. 1 Н ЯМР (500 МГц, ДМСО-d6) : 1,20-2,00 (m, 8 Н), 2,31 (s, 3 Н), 2,80 (t, 2 Н), 4,05 (m, 1 Н), 7,05 (t, 1H),7,30 (t, 2H), 7,40 (m, 3 Н), 7,58 (d, 2H), 9,85 (s,1H). Стадия D. S-(S)-6-[(2-оксо-4-Фенилпирролидин-3-карбонил)амино]-6-фенилкарбамоилгексиловый эфир тиоуксусной кислоты. Трифторацетат S-S)-6-амино-6-фенилкарбамоилгексилового) эфира тиоуксусной кислоты (1,03 ммоль), DIPEA (3,08 ммоль) и РуВОР (1,03 ммоль) добавляли в раствор (3R,4S)-2-оксо-4 фенилпирролидин-3-карбоновой кислоты в ДХМ/ДМФ 5/9. Полученную реакционную смесь перемешивали при КТ в течение ночи. После удаления растворителя при пониженном давлении полученное твердое вещество высыпали в воду и дважды экстрагировали AcOEt. Органический слой затем промывалиNaHCO3, водой и солевым раствором, после чего сушили над Na2SO4 и концентрировали при пониженном давлении с получением маслянистой жидкости, которую частично очищали путем хроматографии на силикагеле, а затем подвергали очистке ВЭЖХ. Выход: 12%. 1 Н ЯМР (500 МГц, ацетон-d6) : 1,30-1,80 (m, 8 Н), 2,28 (s, 3 Н), 2,81 (t, 2 Н), 3,51 (t, 1H), 3,75 (d, 1H),3,87 (m, 1 Н), 4,31 (m, 1H), 4,54 (m, 1 Н), 7,00-7,40 (m, 8 Н), 7,53 (bs, 1H), 7,84 (m, 2 Н), 7,89 (d, 1H), 9,80 (bs,1H). ИЭР-МС m/z 482,06 (М+Н)+. Соединения согласно примерам 20-22 синтезировали согласно способу, изображенному на схеме 3,с использованием соответствующего амина на стадии А и подходящей кислоты на стадии D. Пример 20. S-(S)-6-[3R,4R)-2-оксо-4-Фенилпирролидин-3-карбонил)амино]-6-фенилкарбамоилгексиловый) эфир тиоуксусной кислоты. Кислота, которую использовали в реакции на стадии D, представляла собой цис-рацемическую (т.е. 2 н. раствор NaOH (7,0 ммоль) добавляли в раствор S-(S)-6-[S)-6-оксопиперидин-2 карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты (0,95 ммоль) в EtOH (13 мл). Реакционную смесь перемешивали при КТ в течение ночи, а затем выливали в воду и экстрагировали AcOEt, промывали водой, солевым раствором и, наконец, сушили над Na2SO4. Удаление растворителя при пониженном давлении приводило к получению целевого аддукта, который очищали путем ВЭЖХ. Выход: 20%. 1 Н ЯМР (500 МГц, CD3OD) : 1,50 (m, 4H), 1,68 (m, 2H), 1,80 (m, 2H), 1,95 (m, 3H), 2,10 (m, 1H),2,38 (m, 2H), 2,55 (t, 2H), 4,15 (t, 1H), 4,53 (m, 1H), 7,12 (t, 1H), 7,33 (t, 2H), 7,60 (d, 2H). ИЭР-МС m/z 400,40 (M+Na)+; 376,34 (M-H)-. Соединения согласно примерам 24-40 синтезировали согласно способу, изображенному на схеме 4,с использованием соответствующего исходного вещества. Пример 24. S)-1-Циклопентилкарбамоил-6-меркаптогексил)амид (S)-6-оксопиперидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 17. Выход: 44%. 1 Н ЯМР (500 МГц, ДМСО-d6) : 1,05-1,90 (m, 20 Н), 2,12 (t, 2 Н), 2,21 (t, 1 Н), 2,45 (m, 2 Н), 3,92 (m,1H), 3,97 (m, 1 Н), 4,21 (m, 1 Н), 7,55 (d, 1H), 7,80 (s, 1H), 7,82 (s,1H). ИЭР-МС m/z 392,2 (M+Na)+; 368,1 (М-Н)-. Пример 25. [(S)-1-(3-Бензилоксибензилкарбамоил)-6-меркаптогексил]амид (S)-6-оксопиперидин-2 карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 3. Выход: 32%. 1 Н ЯМР (500 МГц, CD2Cl2) : 1,20-1,48 (m, 4H), 1,48-2,02 (m, 8H), 2,21 (m, 2H), 2,49 (m, 2 Н), 3,203,42 (m, 2 Н), 4,51 (m, 1H), 5,04 (s, 2H), 6,80-6,95 (m, 3 Н), 7,23 (t, 1H), 7,28-7,50 (m, 5H), 7,64 (s, 1H), 7,75(d, 1H). ИЭР-МС m/z 498,35 (M+H)+. Пример 26. [(S)-6-Меркапто-1-(4-трифторметилбензилкарбамоил)гексил]амид (S)-6-оксопиперидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 2. Выход: 33%. 1 Н ЯМР (500 МГц, CD2Cl2) : 1,38 (m, 4H), 1,52-2,12 (m, 9H), 2,23 (m, 2H), 2,50 (m, 2H), 3,98 (m, 1H),4,45 (m, 3 Н), 7,20 (m, 1H), 7,28-7,72 (m, 6H). ИЭР-МС m/z 460,14 (М+Н)+. Пример 27. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (S)-4-оксоазетидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 1. Выход: 56%. 1 Н ЯМР (300 МГц, ДМСО-d6) :1,34 (m, 4 Н), 1,57 (m, 4 Н), 2,22 (t, 1H), 2,47 (q, 1H), 2,66 (m, 2 Н), 3,10(dd, 1 Н), 4,07 (m, 1H), 4,43 (m, 1 Н), 7,04 (t, 1H), 7,29 (t, 2H), 7,58 (d, 2H), 8,15 (s, 1 Н), 8,43 (d,1H), 10,11 (s,1H). ИЭР-МС m/z 372,2 (M+Na)+; 348,2 (M-H)-. Пример 28. S)-6-Меркапто-1-фенилкар 6 амоилгексил)амид (3S,4S)-2-оксо-4-фенилпирролидин-3 карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 20. После гидролиза диастереомерную смесь двух тиолатных производных очищали путем флэш-хроматографии на силикагеле, что обеспечивало выделение чистых изомеров. Выход: 44%. Н ЯМР (500 МГц, ацетон-d6) : 1,35-2,00 (m, 8H), 2,42 (t, 2H), 3,40 (t, 1H), 3,59 (d, 1H), 3,78 (m, 1 Н),4,13 (m, 1 Н), 4,48 (m, 1H), 7,00-7,40 (m, 9 Н), 7,63 (m, 2 Н), 7,89 (d, 1H), 9,25 (bs, 1H). ИЭР-МС m/z 462,27 (M+Na)+. Пример 29. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (3R,4R)-2-оксо-4-фенилпирролидин-3 карбоновой кислоты. Соединение согласно примеру 29 получали после очистки согласно способу, приведенному в примере 28. Выход: 37%. 1 Н ЯМР (500 МГц, ацетон-d6) : 1,35-2,00 (m, 8H), 2,42 (t, 2H), 3,51 (t, 1H), 3,75 (d, 1H), 3,87 (m, 1 Н),4,31 (m, 1H), 4,54 (m, 1H), 7,00-7,40 (m, 9 Н), 7,63 (m, 2 Н), 7,89 (d, 1H), 9,25 (bs, 1H). ИЭР-МС m/z 462,27 (M+Na)+. Пример 30. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (3R,4S)-2-оксо-4-фенилпирролидин-3 карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 19. После гидролиза диастереомерную смесь двух тиолатных производных очищали путем флэш-хроматографии на силикагеле, что обеспечивало выделение чистого изомера. Выход: 40%. 1 Н ЯМР (500 МГц, ацетон-d6) : 1,30-1,80 (m, 8 Н), 2,42 (t, 2 Н), 3,51 (t, 1H), 3,75 (d, 1H), 3,87 (m, 1 Н),4,31 (m, 1 Н), 4,54 (m, 1 Н), 7,00-7,40 (m, 8 Н), 7,53 (bs, 1 Н), 7,84 (m, 2 Н), 7,89 (d, 1H), 9,80 (bs, 1H). ИЭР-МС m/z 462,81 (M+Na)+. Пример 31. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (3S,4R)-2-оксо-4-фенилпирролидин-3 карбоновой кислоты. Соединение согласно примеру 31 получали после очистки согласно способу, приведенному в примере 30. Выход: 37%. 1 Н ЯМР (500 МГц, CD3OD) : 1,35-2,40 (m, 8 Н), 2,43 (m, 2 Н), 3,48 (t, 1H), 3,80 (m, 2H), 4,22 (m, 1H),4,53 (m, 1H), 7,09 (m, 2H), 7,30 (m, 4H), 7,36 (m, 4H), 7,68 (m, 2H). ИЭР-МС m/z 462,27 (M+Na)+. Пример 32. [(S)-1-(3,4-Дигидро-1 Н-изохинолин-2-карбонил)-6-меркаптогексил]амид (S)-6-оксопиперидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 4. Выход: 37%. 1 Н ЯМР (500 МГц, ДМСО-d6) : 1,10-1,90 (m, 13 Н), 2,05-2,23 (m, 2 Н), 2,35-3,00 (m, 4 Н), 3,60-4,10(m, 3 Н), 4,48-4,86 (m, 3 Н), 7,17 (s, 4 Н), 7,49 (m, 1H), 8,10 (m, 4 Н). ИЭР-МС m/z 418,05 (М+Н)+. Пример 33. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (R)-5-оксопирролидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 21. Выход: 42%. 1 Н ЯМР (500 МГц, ДМСО-d6) : 1,20-2,00 (m, 10 Н), 2,18 (m, 2 Н), 2,21 (t, 1 Н), 2,45 (m, 1 Н), 4,05 (m,1H), 4,40 (m, 1 Н), 7,04 (t, 1H), 7,29 (t, 2 Н), 7,55 (d, 1H), 7,58 (d, 2 Н), 8,08 (d, 1H), 9,98(s, 1H). ИЭР-МС m/z 364,28 (М+Н)+. Пример 34. [(S)-6-Меркапто-1-(2-м-толуилэтилкарбамоил)гексил]амид (S)-6-оксопиперидин-2 карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 5. Выход: 41%. 1 Н ЯМР (500 МГц, ДМСО-d6) : 1,10-1,34 (m, 4 Н), 1,42-1,76 (m, 7 Н), 1,83 (m, 1H), 2,11 (t, 2 Н), 2,21(t, 1 Н), 2,27 (s, 3 Н), 2,44 (m, 2 Н), 2,66 (t, 2 Н), 3,23 (m, 2 Н), 3,91 (m, 1H), 4,19 (m, 1 Н), 6,90-7,08 (m, 2 Н),7,16 (t, 1H), 7,51 (bs, 1H), 7,89 (d, 1H), 7,95 (t, 1H). ИЭР-МС m/z 420,09 (М+Н)+. Пример 35. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (R)-2-оксопиперидин-3-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 22. После гидролиза диастереомерную смесь двух тиолатных производных очищали путем флэш-хроматографии на силикагеле, что обеспечивало выделение чистого изомера. Выход: 39%. 1 Н ЯМР (500 МГц, CD3OD) : 1,42-1,19 (m, 12H), 2,55 (t, 2H), 3,35 (m, 2H), 3,40 (m, 2H), 4,53 (m,2 Н), 7,12 (t, 1H), 7,33 (t, 2H), 7,60 (d, 2H). ИЭР-МС m/z 400,40 (M+Na)+. Пример 36. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (S)-2-оксопиперидин-3-карбоновой кислоты. Соединение согласно примеру 36 получали после очистки согласно способу, приведенному в примере 35. Выход: 20%. 1 Н ЯМР (500 МГц, CD3OD) : 1,40-2,22 (m, 12H), 2,55 (t, 2H), 3,35 (m, 2H), 3,42 (m, 2H), 4,53 (m,2 Н), 7,09 (t, 1 Н), 7,29 (t, 2H), 7,68 (d, 2H). ИЭР-МС m/z 400,40 (M+Na)+. Пример 37. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (R)-6-оксопиперидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 13. Выход: 82%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,34 (m, 4 Н), 1,51 (m, 2 Н), 1,64 (m, 5 Н), 1,87 (m, 1H), 2,11 (t, 2 Н),2,22 (t, 1 Н), 2,44 (m, 2 Н), 3,96 (m, 1H), 4,43 (m, 1H), 7,04 (t, 1H), 7,29 (t, 2H), 7,49 (d, 1H), 7,57 (d, 2H), 8,13(d, 1H), 10,04 (s, 1H). ИЭР-МС m/z 400,2 (M+Na)+; 376,2 (М-Н)-. Пример 38. S)-6-Меркапто-1-м-толуилкарбамоилгексил)амид (S)-6-оксопиперидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 16. Выход: 25%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,34 (m, 4 Н), 1,51 (m, 2 Н), 1,64 (m, 5 Н), 1,85 (m, 1H), 2,10 (t, 2 Н),2,20 (t, 1 Н) 2,25 (s. 3 Н), 2,44 (m, 2 Н), 3,95 (m, 1H), 4,38 (m, 1H), 6,85 (d, 1H), 7,16 (t, 1H), 7,36 (d, 1 Н), 7,41(s, 1H), 7,48 (d, 1H), 8,06 (d, 1H), 9,89 (s, 1H). ИЭР-МС m/z 414,3 (M+Na)+; 390,4 (М-Н)-. Пример 39. S)-6-Меркапто-1-п-толуилкарбамоилгексил)амид (S)-6-оксопиперидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 15. Выход: 53%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,33 (m, 4 Н), 1,51 (m, 2 Н), 1,60 (m, 5 Н), 1,83 (m, 1H), 2,10 (t, 2 Н),2,21 (t, 1 Н), 2,23 (s, 3 Н), 2,43 (m, 2 Н), 3,95 (m, 1H), 4,37 (m, 1H), 7,09 (d, 2H), 7,45 (d, 2 Н), 7,48 (d, 1 Н),8,08 (d, 1H), 9,89 (s, 1H). ИЭР-МС m/z 414,4 (M+Na)+; 390,3 (М-Н)-. Пример 40. S)-6-Меркапто-1-фенилкарбамоилгексил)амид (S)-1-метил-6-оксопиперидин-2-карбоновой кислоты. Исходным веществом являлось соединение согласно примеру 12. Выход: 28%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,34 (m, 4H), 1,49 (m, 2H), 1,57 (m, 3 Н), 1,66 (m, 2H), 1,88 (m, 2 Н),2,17 (m, 2 Н), 2,67 (s, 3 Н), 2,80 (t, 2 Н), 4,08 (m, 1 Н), 4,42 (m, 1H), 7,02 (t, 1H), 7,26 (t, 2H), 7,56 (d, 2H), 8,33(d, 1H), 10,05 (s, 1H). ИЭР-МС m/z 392,0 (M+H)+. Пример 41. Смешанный (S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексиловыйэтиловый эфир тиокарбоновой кислоты. В раствор S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты (0,21 ммоль) в ДХМ (20 мл) добавляли NEt3 (0,23 ммоль) и этилхлорформиат (0,23 ммоль). Реакционную смесь перемешивали при КТ в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и неочищенный продукт очищали путем хроматографии на силикагеле с использованием смеси AcOEt/MeOH 80/20 в качестве элюента. Выход: 74%. 1 Н ЯМР (500 МГц, ДМСО-d6) : 1,20 (t, 3 Н), 1,25-1,45 (m, 4 Н), 1,52-1,80 (m, 7 Н), 1,87 (m, 1H), 2,11(t, 2 Н), 2,82 (t, 2 Н), 3,97 (m, 1H), 4,21 (m, 4 Н), 3,47 (q, 2 Н), 4,41 (m, 1H), 7,05 (t, 1H), 7,30 (t, 2 Н), 7,48 (bs,1 Н), 7,58 (d, 2 Н), 8,10 (d, 1 Н), 9,99 (s, 1H). ИЭР-МС m/z 450,15 (М+Н)+. Соединение согласно примеру 42 синтезировали согласно способу, приведенному в примере 41, с использованием S)-6-меркапто-1-фенилкарбамоилгексил)амида (R)-5-оксопирролидин-2-карбоновой кислоты вместо S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты. Пример 42. Смешанный (S)-6-[R)-5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексиловыйэтиловый эфир тиокарбоновой кислоты. Выход: 82%. 1 Н ЯМР (300 МГц, ДМСО-d6) : 1,18 (t, 3 Н), 1,33 (m, 4 Н), 1,6 (m, 4 Н), 1,85 (m, 1H), 2,10 (m, 2 Н), 2,25 Пример 43. S-(S)-6-[S)-6-Оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексиловый] эфир тиоизомасляной кислоты. Данное соединение синтезировали согласно способу, описанному в примере 30, но с использованием изобутирилхлорида вместо этилхлорформиата. Выход: 42%. 1 Н ЯМР (500 МГц, ДМСО-d6) : 1,04 (t, 6 Н), 1,22-1,44 (m, 4 Н), 1,46-1,77 (m, 6 Н), 1,93 (m, 1 Н), 2,06(t, 2H), 7,57 (d, 2H), 8,33 (d, 1H), 9,99 (s, 1H). ИЭР-МС m/z 448,24 (М+Н)+. Соединение А. S-(6-Фенилкарбамоилгексиловый) эфир тиоуксусной кислоты. Данное коммерчески доступное производное, которое не содержит фрагмент лактамкарбониламиногруппы в боковой цепи при остове, исследовали в качестве соединения сравнения в эксперименте in vivo, в котором тестировали соединение согласно примеру 14 (табл.8). Биология. Пример 44. Ферментное исследование HDAC. Определение профиля HDAC проводили в отношении одиннадцати выделенных изоформ HDAC человека в присутствии фторогенного тетрапептидного субстрата RHKKAc (от р 53 остатки 379-382) (10 мкМ). Выделенные HDAC человека получали путем стандартной очистки, за исключением HDAC3, которая является рекомбинантным белком человека, т.е. комплексом полноразмерной HDAC3 человека с С-терминальным His-тэгом и аминокислот 395-489 NCOR2 человека с N-терминальным GST-тэгом, которые совместно экспрессировали в системе экспрессирования бакуловируса. Каждое соединение растворяли в ДМСО, и последовательно разбавленные растворы использовали для исследования. TSA иSAHA использовали в качестве соединений сравнения. После деацетилирования высвобождался фторофор, который являлся источником флуоресцентного излучения, его детектировали на флуориметре, значения IC50 соединений определяли путем анализа кривых зависимости доза-ингибирующий эффект. TSA и SAHA использовали в качестве соединений сравнения. Таблица 1 Результаты. Подтверждено, что соединения согласно настоящему изобретению имеют высокую активность в отношении всех изоформ HDAC, при этом ингибирующая активность проявляется в диапазоне низких наномолей (табл. 1). Указанное открытие было неожиданным с учетом биологического поведения производного, которое использовали в качестве соединения сравнения (т.е. трет-бутиловото эфира S)-1 циклопентилкарбамоил-6-меркаптогексил)карбаминовой кислоты, о котором сообщается в Itoh Y., et al.,J. Med. Chem., 2007, 50, 5425). Фактически, как отмечалось ранее, мы проверили и подтвердили профиль его селективности в отношении HDAC6, определив к тому же, что оно обладало значительно меньшей активностью в отношении HDAC6 по сравнению с большинством соединений, описанных в настоящей заявке. При сравнении профиля ингибирования в отношении HDAC некоторых из приведенных выше производных с соответствующими гидроксаматными аналогами мы неожиданно обнаружили, что исходные тиопроизводные имели, по меньшей мере, равную активность, а иногда даже более высокую активность по сравнению с аналогами, содержащими гидроксаматную группу, связывающую цинк (табл. 2). Пример 45. Цитотоксичность. Цитотоксическое действие некоторых соединений согласно настоящему изобретению на клетки немелкоклеточной карциномы легких NCI-H460 и клетки рака толстой кишки НСТ 116 оценивали согласно способу, описанному Скеханом с соавторами (Skehan P., et al., J Natl Cancer Inst, 1990, 82, 13, 1107) с использованием SAHA (вориностат) в качестве соединения сравнения. Клетки опухолей выращивали в среде RPMI 1640, содержащей 10% инактивированную нагреванием эмбриональную бычью сыворотку и 50 мкг/мл сульфата гентамицина, и высевали в 96-луночные планшеты для тканевых культур с примерно 10% конфлюентностью. Клетки оставляли для фиксации и восстановления по меньшей мере на 24 ч. Затем для определения значения IC50 (т.е. концентрации, которая подавляла выживание клеток на 50%) в каждую лунку добавляли соединения согласно настоящему изобретению в различных концентрациях. Планшеты инкубировали в течение 24 ч при 37 С, после чего их 3 раза промывали путем удаления надосадочной жидкости и добавления PBS. Затем планшеты дополнительно инкубировали в течение 48 ч при 37 С. Добавляли 200 мкл PBS и 50 мкл холодной 80% ТХУ и планшеты инкубировали во льду в течение по меньшей мере 1 ч. Удаляли ТХУ и планшеты 3 раза промывали путем погружения в дистиллированную воду. Затем планшеты сушили на бумаге при 40 С в течение 5 мин. Добавляли 200 мкл 0,4% сульфородамина В в 1% уксусной кислоте. Планшеты дополнительно инкубировали при комнатной температуре в течение 30 мин. Удаляли сульфородамин В и планшеты 3 раза промывали путем погружения в 1% уксусную кислоту и сушили на бумаге при 40 С в течение 5 мин. Затем добавляли 200 мкл 10 мМTris. Планшеты выдерживали при перемешивании с использованием магнитной мешалки в течение 20 мин. Выживание клеток определяли по оптической плотности при 540 нм на спектрофлуориметре Multiskan. Количество уничтоженных клеток рассчитывали как снижение в процентах связывания сульфородамина В по сравнению с контрольными культурами. Значения IC50 (приведены в табл. 3 для клеточной линии Н 460 и в табл. 4 для клеточной линии НСТ 116) рассчитывали с использованием программного обеспечения "ALLFIT". Результаты. Соединения согласно настоящему изобретению имели очень хороший профиль ингибирования,очень часто даже лучше, чем профиль соединения сравнения SAHA. Таблица 3 Пример 46. Соединение согласно примеру 21 дополнительно исследовали на расширенной панели клеточных линий для определения цитотоксичности по сравнению с SAHA, который использовали в качестве соединения сравнения. Клетки опухоли (А 2780, SKOV-3, MDA-MD436, MCF-7, HSC3) выращивали в слипшемся виде в среде RPMI 1640, содержащей 10% инактивированную нагреванием эмбриональную бычью сыворотку и 50 мкг/мл сульфата гентамицина, тогда как в случае клеточной линии MDA-MB231 использовалиDMEM. Клетки высевали в 96-луночные планшеты для тканевых культур с примерно 10% конфлюентностью. Клетки оставляли для фиксации и восстановления по меньшей мере на 24 ч. Затем для определенияIC50, обеспечивающей подавление выживания клеток, в каждую лунку добавляли соединения согласно настоящему изобретению в различных концентрациях. Планшеты инкубировали в течение 72 ч при 37 С,после чего их 3 раза промывали путем удаления надосадочной жидкости. Добавляли 200 мкл PBS и 50 мкл холодной 80% ТХУ и планшеты инкубировали во льду в течение по меньшей мере 1 ч. Удаляли ТХУ и планшеты 3 раза промывали путем погружения в дистиллированную воду. Затем их сушили на бумаге при 40 С в течение 5 мин. Добавляли 200 мкл 0,4% сульфородамина В в 1%-ной уксусной кислоте. Планшеты дополнительно инкубировали при комнатной температуре в течение 30 мин. Удаляли сульфородамин В и планшеты 3 раза промывали путем погружения в 1% уксусную кислоту и сушили на бумаге при 40 С в течение 5 мин. Затем добавляли 200 мкл 10 мМ Tris. Планшеты выдерживали при перемешивании с использованием магнитной мешалки в течение 20 мин. Выживание клеток определяли по оптической плотности при 540 нм на спектрофлуориметре Multiskan. Количество уничтоженных клеток рассчитывали как снижение в процентах связывания сульфородамина В по сравнению с контрольными культурами. Значения IC50 (приведены в табл. 5) рассчитывали с использованием программного обеспечения "ALLFIT". Клетки U937, HUT78 и K562 выращивали в виде суспензии в среде RPMI 1640, содержащей 10% инактивированную нагреванием эмбриональную бычью сыворотку и 50 мкг/мл сульфата гентамицина,тогда как клетки MV4-11 выращивали в среде Дульбекко, модифицированной Исковым. Процедура эксперимента соответствовала описанной выше с тем исключением, что удаление надосадочной жидкости проводили путем центрифугирования планшетов при 1600g в течение 10 мин (операцию проводили два раза). Результаты приведены в табл.5. Таблица 5 Результаты, приведенные в табл.5, явно указывают на то, что соединение согласно примеру 14 обладает более выраженными свойствами в отношении широкого диапазона раковых клеточных линий,при этом соединение сравнения SAHA, в целом, имело значительно более низкую биологическую активность. Пример 47. Ацетилирование тубулина и гистона. Вестерн-блот анализ экстрактов цитоплазмы и ядер клеток NCI-H460, которые предварительно инкубировали с соединением согласно примеру 14 или с SAHA, проводили для измерения ацетилирования-тубулина и гистона с использованием различных антител, приведенных ниже: мышиное моноклональное антитело против ацетилтубулина (Sigma; кат. Т 6793); мышиное моноклональное антитело против -актина (Sigma; кат. А 5316); кроличье поликлональное антитело против ацетилгистона Н 4 (Upstate; кат. 06-598); мышиное моноклональное антитело против гистона Н 4 (Upstate; кат. 07-108). Эксперименты проводили с использованием реагентов ECL Plus для вестерн-блот анализа (производства American Biosciences), интенсивность полос анализировали с использованием компьютерной фосфоранализирующей системы (Phospholmager; Molecular Dynamics, Sunnyvale, CA, USA). Результаты. Соединение согласно примеру 14 вызывало значительно более высокое ацетилирование цитоплазматического -тубулина по сравнению с соединением сравнения SAHA. Кроме того, соединение согласно примеру 14 также вызывало гиперацетилирование Н 4 в концентрациях не более 100 нМ, тогда какSAHA был в 6 раз менее эффективным при инициировании ацетилирования гистона Н 4 (см. фиг. 1 и табл.6). Таблица 6 Пример 48. Противоопухолевая активность. Клетки рака толстой кишки НСТ 116 или НМРЛ NCI-H460 или клетки множественной миеломыH929, суспендированные в 0,1 мл среды 199, инокулировали подкожно (п.к.) в правый бок бестимусных мышей CDI (т.е. в количестве 5106 в случае НСТ 116, 3106 в случае NCI-H460 и 20106 в случае Н 929). Лечение (способы приведены в табл.6) начинали через 3 дня после инъекции опухоли согласно схемеqd5 р./нед.3 нед., за исключением цисплатина, который вводили q4d/нед.3 нед. Исследуемые производные вводили в виде суспензии в PBS/DMCO/Cremophor EL (Sigma): 85/10/5 об.%. Противоопухолевую активность определяли путем измерения диаметра опухоли с использованием штангенциркуля с нониусом по формуле где d и D представляют собой самый небольшой и самый крупный диаметр соответственно. Когда объем опухоли достигал примерно 1000 мм 3, мышей умерщвляли путем смещения шейных позвонков. Эффективность лекарственного средства определяли по подавлению роста объема опухоли согласно формуле: Определение массы тела проводили для оценки снижения массы тела согласно уравнению: где BW деньх соответствует средней массе в день х эксперимента, a BW день 1 соответствует средней массе тела в первый день эксперимента. Результаты. Соединение согласно примеру 14 оказывало сравнимое или даже более выраженное подавление роста опухоли даже при введении в три раза более низкой дозы по сравнению с SAHA в трех экспериментах. Эффективность лечения хорошо подтверждалась на всех животных (табл.7). Таблица 7 Пример 49. Противоопухолевая активность. Эксперимент, описанный в примере 48, повторяли с другим соединением на модели развития рака толстой кишки НСТ 116 у мышей, описанной выше, или рака яичников А 2780, лекарственные средства вводили перорально в виде раствора в ПЭГ 200/ДМСО/Cremophor EL (Sigma): 85/10/5 об.%. Результаты приведены в табл.8. Таблица 8 Соединение согласно примеру 21 имело высокую биологическую активность в противоположность своему аналогу, соединению А, которое не содержало боковую цепь, что, таким образом, подтверждает важность введения фрагмента лактам-карбониламиногруппы в остов молекулы. Более того, соединение согласно примеру 21 также имело высокую биологическую активность в животной модели рака яичников, при этом значение индекса TVI превышало значение, достигаемое после применения SAHA. Важно отметить также, что высокая биологическая активность сохранялась даже после перорального введения,что позволяет предположить высокую стабильность к метаболизму первого прохождения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее общую формулу IR1 и один R4, каждый из которых связан с двумя соседними атомами углерода, в случае если n равен 2 или 3, объединены с образованием циклопропанового кольца;R3 представляет собой Н или группу формулы IIR4 и R5 в каждом случае представляют собой Н;m представляет собой целое число от 0 до 3;n представляет собой целое число от 0 до 2; символ означает, что атом углерода, который отмечен указанным символом, может иметь R- илиS-конфигурацию; его таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и рацемические формы, а также их фармацевтически приемлемые соли. 2. Соединение по п.1, отличающееся тем, что n равен 1 или 2. 3. Соединение по п.1, отличающееся тем, что m равен 1. 4. Соединение по пп.1 и 2, выбранное из группы, состоящей изS-(S)-6-[S)-4-оксоазетидин-2-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты,S-[(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-(4-трифторметилбензилкарбамоил)гексилового] эфира тиоуксусной кислоты, S-(S)-6-(3-бензилоксибензилкарбамоил)-6-[S)-6 оксопиперидин-2-карбонил)амино]гексилового эфира тиоуксусной кислоты, S-(S)-7-(3,4-дигидро-1 Низохинолин-2-ил)-7-оксо-6-[S)-6-оксопиперидин-2-карбонил)амино]гептилового эфира тиоуксусной кислоты, S-[(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-(2-м-толуилэтилкарбамоил)гексилового] эфира тиоуксусной кислоты, S-(S)-6-[R)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6 фенилкарбамоилгексилового эфира тиоуксусной кислоты,S-(S)-6-[S)-6-оксопиперидин-2 карбонил)амино]-6-п-толуилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[S)-6 оксопиперидин-2-карбонил)амино]-6-м-толуилкарбамоилгексилового эфира тиоуксусной кислоты, S(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-циклопентилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[3R,4S)-2-оксо-4-фенилпирролидин-3-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[3R,4R)-2-оксо-4-фенилпирролидин-3 карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[R)-5 оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, S(S)-6-[(R)-(2-оксопиперидин-3-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, S)-6-меркапто-1-фенилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты,S)-1-циклопентилкарбамоил-6-меркаптогексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты, [(S)1-(3-бензилоксибензилкарбамоил)-6-меркаптогексил]амида (S)-6-оксопиперидин-2-карбоновой кислоты,[(S)-6-меркапто-1-(4-трифторметилбензилкарбамоил)гексил]амида(S)-2-оксопиперидин-3-карбоновой кислоты,S)-6-меркапто-1 фенилкарбамоилгексил)амида (R)-6-оксопиперидин-2-карбоновой кислоты, смешанного (S)-6-[S)-6 оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового этилового эфира тиокарбоновой кислоты, S-(S)-6-[S)-6-оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоизомасляной кислоты,S-(S)-6-[S)-5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[S)-5-оксопирролидин-2-карбонил)амино]-6-мтолуилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[R)-1-метил-5-оксопирролидин-2 карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, смешанного (S)-6-[R)5-оксопирролидин-2-карбонил)амино]-6-фенилкарбамоилгексиловогоэтилового эфира тиокарбоновой кислоты, S-(S)-6-[R)-5-оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексилового эфира тиоуксусной кислоты, S-(S)-6-[R)-1-метил-5-оксопирролидин-2-карбонил)амино]-6-м-толуилкарбамоилгексилового эфира тиоуксусной кислоты, S-[(S)-6-[R)-5-оксопирролидин-2-карбонил)амино]-6-(3 трифторметилфенилкарбамоил)гексилового] эфира тиоуксусной кислоты, S-(S)-6-[S)-1-метил-6 оксопиперидин-2-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты, S)-6 меркапто-1-фенилкарбамоилгексил)амида (S)-1-метил-6-оксопиперидин-2-карбоновой кислоты, S)-6 меркапто-1-м-толуилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты, S)-6 меркапто-1-п-толуилкарбамоилгексил)амида (S)-6-оксопиперидин-2-карбоновой кислоты и S-(S)-6[S)-6-оксо-1,2,3,6-тетрагидропиридин-2-карбонил)амино]-6-фенилкарбамоилгексилового эфира тиоуксусной кислоты. 5. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по пп.1-4 в качестве активного ингредиента в смеси по меньшей мере с одним фармацевтически приемлемым носителем и/или наполнителем. 6. Применение соединения по любому из пп.1-4 в качестве лекарственного средства. 7. Применение по п.6 для лечения патологического состояния, при котором модуляция активностиHDAC приводит к улучшению состояния здоровья пациента. 8. Применение по п.7, отличающееся тем, что патологическое состояние представляет собой раковое заболевание, нейродегенеративное заболевание, воспалительное заболевание, инсульт, ишемию или инфекции Plasmodium. 9. Применение по п.8, отличающееся тем, что раковое заболевание представляет собой рак груди,поджелудочной железы, легких, толстой кишки, плевры, брюшной полости, лица и шеи, почки, мочевого пузыря, мозга, простаты, яичников или глаз. 10. Применение по п.9, отличающееся тем, что раковое заболевание представляет собой метастатическую форму рака. 11. Применение по п.8, отличающееся тем, что воспалительное заболевание представляет собой ревматоидный артрит. 12. Применение по п.8, отличающееся тем, что нейродегенеративное заболевание представляет собой болезнь Хантингтона, болезнь Паркинсона, амиотрофический латеральный склероз. 13. Способ лечения пациента, пораженного раковым заболеванием, включающий введение соединения по пп.1-4. 14. Способ синтеза соединений по п.1 путем взаимодействия соединений формулы III где R2, R3 и R6 и m такие, как описано в п.1,с соединениями формулы IV в форме соли или несолевой форме.
МПК / Метки
МПК: C07D 401/04, A61P 29/00, C07D 205/08, A61K 31/397, A61K 31/45, A61K 31/4015, C07D 207/277, C07D 211/78, A61P 33/00, A61K 31/4709, A61P 25/00, C07D 207/28, A61P 35/00
Метки: тиопроизводные, применение, средств, ингибиторов, лактамов, высокоактивных, качестве, лекарственных
Код ссылки
<a href="https://eas.patents.su/20-23171-tioproizvodnye-laktamov-v-kachestve-vysokoaktivnyh-ingibitorov-hdac-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Тиопроизводные лактамов в качестве высокоактивных ингибиторов hdac и их применение в качестве лекарственных средств</a>
Предыдущий патент: Замещенные производные фенил(окси/тио)алканолов
Следующий патент: Способ интерпретации данных электромагнитной разведки
Случайный патент: Соединения, регулирующие рост растений












