Дизамещенные бициклические гетероциклы, их получение и применение в качестве лекарственных средств
Номер патента: 3697
Опубликовано: 28.08.2003
Авторы: Рис Уве, Винен Вольфганг, Хауэль Норберт, Штассен Йеан, Приепке Хеннинг
Формула / Реферат
1. Дизамещенные бициклические гетероциклы общей формулы (I)
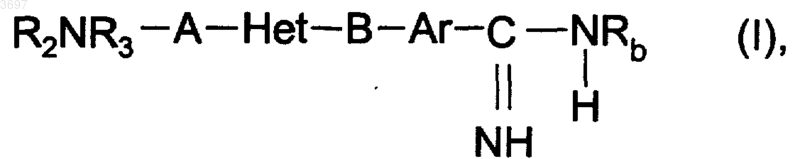
в которой A означает карбонильную или сульфонильную группу, связанную с бензо-, пиридо- или тиеновой частью остатка Het,
B означает этиленовую группу, в которой метиленовая группа, связанная с остатком Ar, может быть замещена атомом кислорода или серы или -NR1-группой, при этом
R1 представляет собой атом водорода или алкильную группу с 1-4 атомами углерода,
Rb представляет собой атом водорода, гидроксильную, алкоксикарбонильную, где алкокси с 1-9 атомами углерода, циклогексилоксикарбонильную, фенилалкоксикарбонильную, где алкокси с 1-3 атомами углерода, бензоильную, п-алкилбензоильную, где алкил с 1-3 атомами углерода, или пиридиноильную группу, при этом этоксильная часть во 2-ом положении упомянутой выше алкоксикарбонильной группы, где алкокси с 1-9 атомами углерода, дополнительно может быть замещена алкилсульфонильной группой, где алкил с 1-3 атомами углерода, или 2-алкоксиэтильной группой, где алкокси с 1-3 атомами углерода,
Ar означает 1,4-фениленовую или 2,5-тиениленовую группу, при необходимости замещенную атомом хлора, метильной, этильной или метоксигруппой,
Het означает 1-(C1-3-алкил)-2,5-бензимидазолиленовую, 1-циклопропил-2,5-бензимидазолиленовую, 2,5-бензтиазолиленовую, 1-(C1-3-алкил)-2,5-индолиленовую, 1-(C1-3-алкил)-2,5-имидазо[4,5-b]пиридиниленовую, 3-(C1-3-алкил)-2,7-имидазо[1,2-a]пиридиниленовую или 1-(C1-3-алкил)-2,5-тиено[2,3-d]имидазолиленовую группу и
R2 представляет собой алкильную группу с 1-4 атомами углерода, которая может быть замещена карбоксильной, алкилоксикарбонильной, где алкил с 1-6 атомами углерода, бензилоксикарбонильной, алкилсульфониламинокарбонильной, где алкил с 1-3 атомами углерода, или 1H-тетразол-5-ильной группой,
алкильную группу с 2-4 атомами углерода, которая замещена гидрокси, бензилокси, карбоксиалкиламино, где алкил с 1-3 атомами углерода, алкоксикарбонилалкиламино, где алкокси и алкил с 1-3 атомами углерода, N-алкилкарбоксиалкиламино, где оба алкила с 1-3 атомами углерода, или N-алкилалкоксикарбонилалкиламиногруппой, где алкокси и оба алкила с 1-3 атомами углерода, при этом в вышеупомянутых группах a-углеродный атом, стоящий рядом с атомом азота, не может быть замещен,
R3 представляет собой циклоалкильную группу с 3-7 атомами углерода, пропаргиловую группу, при этом ненасыщенная часть не может быть непосредственно связана с атомом азота R2NR3-группы, фенильную группу, при необходимости замещенную атомом фтора или хлора, метильной или метоксигруппой, пиразолильную, пиридинильную, пиридазолильную группу, при необходимости замещенную метильной группой, или
R2 и R3 вместе с находящимся между ними атомом азота представляют собой 5-7 членную циклоалкилениминогруппу, при необходимости замещенную карбоксигруппой или алкоксикарбонильной группой, где алкокси с 1-4 атомами углерода, и к которой дополнительно может быть приконденсировано фенильное кольцо,
их таутомеры, их стереоизомеры и их соли.
2. Дизамещенные бициклические гетероциклы общей формулы I no п.1, в которой
A означает карбонильную или сульфонильную группу, связанную с бензо-, пиридо- или тиеновой частью остатка Het,
B означает этиленовую группу, в которой метиленовая группа, связанная с остатком Ar, может быть замещена атомом кислорода или серы или -NR1-группой, при этом
R1 представляет собой атом водорода или метильную группу,
Rb представляет собой атом водорода, гидроксильную, алкоксикарбонильную, где алкокси с 1-9 атомами углерода, циклогексилоксикарбонильную, бензилоксикарбонильную, бензоильную, п-алкилбензоильную, где алкил с 1-3 атомами углерода, или никотиноильную группу, при этом этоксильная часть во 2-ом положении упомянутой выше алкоксикарбонильной группы, где алкокси с 1-9 атомами углерода, дополнительно может быть замещена алкилсульфонильной группой, где алкил с 1-3 атомами углерода, или 2-алкоксиэтильной группой, где алкокси с 1-3 атомами углерода,
Ar означает 1,4-фениленовую или 2,5-тиениленовую группу, при необходимости замещенную атомом хлора, метильной, этильной или метоксигруппой,
Het означает 1-метил-2,5-бензимидазолиленовую, 1-циклопропил-2,5-бензимидазолиленовую, 2,5-бензтиазолиленовую, 1-метил-2,5-индолиленовую, 1-метил-2,5-имидазо[4,5-b]пиридиниленовую, 3-метил-2,7-имидазо[1,2-а]пиридиниленовую или 1-метил-2,5-тиено[2,3-d]имидазолиленовую группу и
R2 представляет собой алкильную группу с 1-3 атомами углерода, которая может быть замещена карбоксильной, алкилоксикарбонильной, где алкил с 1-6 атомами углерода, бензилоксикарбонильной, метилсульфониламинокарбонильной или 1H-тетразол-5-ильной группой,
алкильную группу с 2-3 атомами углерода, которая замещена гидрокси, бензилокси, карбоксиалкиламино, где алкил с 1-3 атомами углерода, алкоксикарбонилалкиламино, где алкокси и алкил с 1-3 атомами углерода, N-алкилкарбоксиалкиламино, где оба алкила с 1-3 атомами углерода, или N-алкилалкоксикарбонилалкиламиногруппой, где алкокси и оба алкила с 1-3 атомами углерода, при этом в вышеупомянутых группах a-углеродный атом, стоящий рядом с атомом азота, не может быть замещен, и
R3 представляет собой пропаргиловую группу, при этом ненасыщенная часть не может быть непосредственно связана с атомом азота R2NR3-группы, фенильную группу, при необходимости замещенную атомом фтора или хлора, метильной или метоксигруппой, пиридинильную группу,
их таутомеры, их стереоизомеры и их соли.
3. Дизамещенные бициклические гетероциклы общей формулы I по п.1, в которой
A означает карбонильную группу, связанную с бензо- или тиеновой частью остатка Het,
B означает этиленовую группу, в которой метиленовая группа, связанная с остатком Ar, может быть замещена атомом кислорода или серы или -NR1-группой, при этом
R1 представляет собой атом водорода или метильную группу,
Rb представляет собой атом водорода, гидроксильную, алкоксикарбонильную, где алкокси с 1-9 атомами углерода, циклогексилоксикарбонильную, бензилоксикарбонильную, бензоильную, п-алкилбензоильную, где алкил с 1-3 атомами углерода, или никотиноильную группу, при этом этоксильная часть во 2-ом положении упомянутой выше алкоксикарбонильной группы, где алкокси с 1-9 атомами углерода, дополнительно может быть замещена метилсульфонильной группой или 2-этоксиэтильной группой,
Ar означает 1,4-фениленовую или 2,5-тиениленовую группу, при необходимости замещенную метоксигруппой,
Het означает 1-метил-2,5-бензимидазолиленовую, 2,5-бензтиазолиленовую, 1-метил-2,5-индолиленовую или 1-метил-2,5-тиено[2,3-d]-имидазолиленовую группу и
R2 представляет собой алкильную группу с 1-3 атомами углерода, которая может быть замещена карбоксильной, алкилоксикарбонильной, где алкил с 1-6 атомами углерода, бензилоксикарбонильной, метилсульфониламинокарбонильной или 1H-тетразол-5-ильной группой,
алкильную группу с 2-3 атомами углерода, которая замещена гидрокси-, бензилокси, карбоксиалкиламино, где алкил с 1-3 атомами углерода, алкоксикарбонилалкиламино, где алкокси и алкил с 1-3 атомами углерода, N-алкилкарбоксиалкиламино, где оба алкила с 1-3 атомами углерода, или N-алкилалкоксикарбонилалкиламиногруппу,
где алкокси и оба алкила с 1-3 атомами углерода, при этом в вышеупомянутых группах a-углеродный атом, стоящий рядом с атомом азота, не может быть замещен, или
R3 представляет собой фенильную группу, при необходимости замещенную атомом фтора, 2-пиридинильную группу,
их таутомеры, их стереоизомеры и их соли.
4. Следующие соединения общей формулы I:
(a) N-фенил-N-(2-карбоксиэтил)амид 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты,
(b) N-фенил-N-(2-гидроксикарбонилэтил)амид 2-[N-(4-амидинофенил)-N-метиламинометил]бензтиазол-5-ил-карбоновой кислоты,
(c) N-фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(d) N-фенил-N-(3-гидроксикарбонилпропил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(e) N-(2-пиридил)-N-(гидроксикарбонилметил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(f) N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[2-(2-амидинотиофен-5-ил)этил]бензимидазол-5-ил-карбоновой кислоты,
(g) N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(h) N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-ил-карбоновой кислоты,
(i) N-фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-ил-карбоновой кислоты,
(j) N-фенил-N-[2-(1H-тетразол-5-ил)этил]амид 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-ил-карбоновой кислоты,
(k) N-фенил-N-[2-(1H-тетразол-5-ил)этил]амид 1-мeтил-2-[N-(4-aмидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(l) N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5-ил-карбоновой кислоты,
(m) N-(3-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5-ил-карбоновой кислоты,
(n) N-фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5-ил-карбоновой кислоты,
(o) N-фенил-N-[(N-гидроксикарбонилэтил-N-метил)-2-аминоэтил]амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(p) N-(3-трифторфенил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(q) N-(4-фторфенил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(r) N-фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидино-2-метоксифенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(s) N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидино-2-метоксифенил)аминометил]бензимидазол-5-ил-карбоновой кислоты,
(t) N-фенил-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]индол-5-ил-карбоновой кислоты,
(u) N-фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]тиено[2,3-d]имидазол-5-ил-карбоновой кислоты,
их таутомеры, стереоизомеры и их соли.
5. N-фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты и его соли.
6. N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-карбоновой кислоты и его соли.
7. N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидино-2-метоксифенил)аминометил]бензимидазол-5-ил-карбоновой кислоты и его соли.
8. N-(2-пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гексилоксикарбониламидино)фенил)аминометил]бензимидазол-5-ил-карбоновой кислоты и его соли.
9. Соединения по пп.1-8 в виде физиологически приемлемых солей.
10. Лекарственное средство, содержащее соединение, по меньшей мере, по одному из пп.1-8 или его соль по п.9, при необходимости, наряду с одним или несколькими инертными носителями и/или разбавителями.
11. Применение соединения, по меньшей мере, по одному из пп.1-8 или его соли по п.9 для получения лекарственного средства, пролонгирующего действие тромбина, обладающего тромбиноингибирующим действием и оказывающего тормозящее действие на используемые серин-протеазы.
12. Способ получения лекарственного средства по п.10, отличающийся тем, что нехимическим путем соединение, по меньшей мере, по одному из пп.1-8 или его соль по п.9 вносят в один или несколько инертных носителей и/или разбавителей.
13. Способ получения дизамещенных бициклических гетероциклов по пп. 1-9, у которых Rb представляет собой атом водорода или гидроксил, отличающийся тем, что образующееся, при необходимости, в реакционной смеси соединение общей формулы II
R2NR3-A-Het-B-Ar-C(=NH)-Z1 (II),
в которой A, B, Ar, Het, R2 и R3 определены как в пп.1-8 и
Z1 представляет собой алкокси-, аралкокси-, алкилтио- или аралкилтиогруппу,
подвергают взаимодействию с амином общей формулы III
H2N-Rb' (III),
в которой Rb' представляет собой атом водорода, гидроксигруппу или алкильную группу с 1-3 атомами углерода,
с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности физиологически приемлемых солей.
14. Способ получения дизамещенных бициклических гетероциклов по пп. 1-9, у которых R2NR3-A-группа имеет указанное в пп.1-9 значение, при условии, что она содержит карбоксильную группу, или R2NR3-A-группа имеет указанное в пп.1-9 значение и Rb означает атом водорода, или R2NR3-A-группа содержит карбоксильную группу и Rb означает атом водорода, отличающийся тем, что соединение общей формулы IV
R2'NR3'-A-Het-B-Ar-E' (IV),
в которой A, B, Ar и Het определены как в пп.1-9 и R2'NR3'-A-группа имеет значения, упомянутые в пп.1-9 для R2NR3-A-группы, и E' означает остаток -C(=NH)-NH2 или группу, превращаемую в указанный остаток, при условии, что R2'NR3'-A-группа содержит группу, превращаемую в карбоксильную группу с помощью гидролиза, обработки кислотой или основанием, термолиза или гидрогенолиза, и E' означает вышеуказанный остаток или E' представляет собой группу, превращаемую в -C(=NH)-NH2-группу с помощью гидролиза, обработки кислотой или основанием, термолиза или гидрогенолиза, a R2'NR3'-A-группа имеет значения, упомянутые в пп.1-9 для R2NR3-A-группы, или R2'NR3'-A-группа содержит группу, превращаемую в карбоксильную группу с помощью гидролиза, обработки кислотой или основанием, термолиза или гидрогенолиза, а E' представляет собой группу, превращаемую с помощью гидролиза, обработки кислотой или основанием, термолиза или гидрогенолиза в -C(=NH)-NH2-группу,
превращают в соединение общей формулы I, в которой R2NR3-A-группа содержит карбоксильную группу или имеет другие значения, указанные в пп.1-9, a Rb означает атом водорода, с помощью гидролиза, обработки кислотой или основанием, термолиза или гидрогенолиза с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности физиологически приемлемых солей.
15. Способ получения дизамещенных бициклических гетероциклов по пп.1-9, у которых R2NR3-A-группа содержит одну из эфирных групп, упомянутых при определении значения данного фрагмента в пп.1-9, отличающийся тем, что соединение общей формулы V
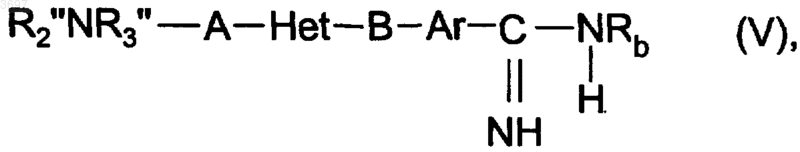
в которой B, Rb, Ar и Het определены в пп.1-9 и
R2"NR3"-A-группа имеет значения, упомянутые в пп.1-9 для R2NR3-A-группы, при условии, что R2"NR3"-A-группа содержит карбоксильную группу или группу, превращаемую с помощью спирта в соответствующую эфирную группу,
подвергают взаимодействию со спиртом общей формулы VI
HO-R7 (VI),
в которой R7 представляет собой алкильную часть одного из упомянутых в пп.1-9 остатков, отщепляемых in vivo, за исключением R6-CO-O-(R5CR6)-группы для карбоксильной группы, или с его формамидинацеталями, или с соединением общей формулы VII
Z2-R8 (VII),
в которой R8 представляет собой алкильную часть одного из упомянутых в пп.1-9 остатков, отщепляемых in vivo, за исключением R6-CO-O-(R5CR6)-группы для карбоксильной группы, и Z2 представляет собой отщепляемую группу, с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности физиологически приемлемых солей.
16. Способ получения дизамещенных бициклических гетероциклов по пп.1-9, у которых Rb представляет отщепляемый in vivo остаток, отличающийся тем, что соединение общей формулы VIII
R2NR3-A-Het-B-Ar-C (=NH)-NH2 (VIII),
в которой R2, R3, A, Het, B и Ar определены в пп.1-9,
подвергают взаимодействию с соединением общей формулы IX
Z2-R5 (IX),
в которой R5 означает отщепляемый in vivo остаток и
Z2 означает нуклеофильную отщепляемую группу,
с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности физиологически приемлемых солей.
Текст
1 Настоящее изобретение относится к новым дизамещенным бициклическим гетероциклам общей формулы I их таутомерам, их стереоизомерам и их солям,особенно к их физиологически приемлемым солям с неорганическими или органическими кислотами или основаниями, которые могут быть использованы для получения лекарственного средства, пролонгирующего действие тромбина, обладающего тромбино-ингибирующим действием и оказывающего тормозящее действие на используемые серин-протеазы. Соединения вышеприведенной общей формулы I, а также их таутомеры и их стереоизомеры, проявляют ценные фармакологические свойства, в частности, обладают тромбинингибирующим действиeм и увеличивают время действия тромбина. Объектом настоящего изобретения являются новые соединения вышеприведенной общей формулы I, а также их получение и их применение, лекарственное средство, содержащие фармакологически активные соединения общей формулы I, и способ его получения. В вышеприведенной общей формуле I А означает карбонильную или сульфонильную группу, связанную с бензо-, пиридоили тиеновой частью остатка Het,В означает этиленовую группу, в которой метиленовая группа, связанная с остатком Аr,может быть замещена атомом кислорода или серы или -NR1-группой, при этомR1 представляет собой атом водорода или алкильную группу с 1-4 атомами углерода,Rb представляет собой атом водорода, гидроксильную, алкоксикарбонильную, где алкокси с 1-9 атомами углерода, циклогексилоксикарбонильную, фенилалкоксикарбонильную, где алкокси с 1-3 атомами углерода, бензоильную, палкилбензоильную, где алкил с 1-3 атомами углерода, или пиридиноильную группу, при этом этоксильная часть во 2-положении упомянутой выше алкоксикарбонильной группы, где алкокси с 1-9 атомами углерода, дополнительно может быть замещена алкилсульфонильной группой, где алкил 1-3 атомами углерода, или 2 алкоксиэтильной группой, где алкокси с 1-3 атомами углерода,Аr означает 1,4-фениленовую или 2,5 тиениленовую группу, при необходимости, замещенную атомом хлора, метильной, этильной или метоксигруппой,Het означает 1-(С 1-3-алкил)-2,5-бензимидазолиленовую,1-циклопропил-2,5-бензимидазолиленовую, 2,5-бензтиазолиленовую, 1(С 1-3-алкил)-2,5-индолиленовую, 1-(С 1-3-алкил)2,5-имидазо[4,5-b]пиридиниленовую,3-(С 1-3 алкил)-2,7-имидазо[1,2-а]пиридиниленовую илиR2 представляет собой алкильную группу с 1-4 атомами углерода, которая может быть замещена карбоксильной, алкилоксикарбонильной, где алкил с 1-6 атомами углерода, бензилоксикарбонильной, алкилсульфониламинокарбонильной, где алкил с 1-3 атомами углерода,или 1 Н-тетразол-5-ильной группой,алкильную группу с 2-4 атомами углерода,которая замещена гидрокси, бензилокси, карбоксиалкиламино, где алкил с 1-3 атомами углерода, алкоксикарбонилалкиламино, где алкокси и алкил с 1-3 атомами углерода, Nалкилкарбоксиалкиламино, где оба алкила с 1-3 атомами углерода, или N-алкилалкоксикарбонилалкиламиногруппой, где алкокси и оба алкила с 1-3 атомами углерода, при этом в вышеупомянутых группах -углеродный атом,стоящий рядом с атомом азота, не может быть замещен,R3 представляет собой циклоалкильную группу с 3-7 атомами углерода, пропаргиловую группу, при этом ненасыщенная часть не может быть непосредственно связана с атомом азотаR2NR3-группы, фенильную группу, при необходимости, замещенную атомом фтора или хлора,метильной или метоксигруппой, пиразолильную, пиридинильную, пиридазолильную группу, при необходимости, замещенную метильной группой, илиR2 и R3 вместе с находящимся между ними атомом азота представляют собой 5-7 членную циклоалкилениминогруппу, при необходимости,замещенную карбоксигруппой или алкоксикарбонильной группой, где алкокси с 1-4 атомами углерода, и к которой дополнительно может быть приконденсировано фенильное кольцо. Предпочтительными соединениями вышеприведенной общей формулы I являются такие,в которых А означает карбонильную или сульфонильную группу, связанную с бензо-, пиридоили тиеновой частью остатка Het,В означает этиленовую группу, в которой метиленовая группа, связанная с остатком Аr,может быть замещена атомом кислорода или серы или -NR1-группой, при этомR1 представляет собой атом водорода или метильную группу,Rb представляет собой атом водорода, гидроксильную, алкоксикарбонильную, где алкокси с 1-9 атомами углерода, циклогексилоксикарбонильную, бензилоксикарбонильную, бензоильную, п-алкилбензоильную, где алкил с 1-3 атомами углерода, или никотиноильную группу,при этом этоксильная часть во 2-положении упомянутой выше алкоксикарбонильной группы, где алкокси с 1-9 атомами углерода, дополнительно может быть замещена алкилсульфонильной группой, где алкил 1-3 атомами углерода, или 2-алкоксиэтильной группой, где алкокси с 1-3 атомами углерода, 3 Аr означает 1,4-фениленовую или 2,5 тиениленовую группу, при необходимости, замещенную атомом хлора, метильной, этильной или метоксигруппой,Het означает 1-метил-2,5-бензимидазолиленовую, 1-циклопропил-2,5-бензимидазолиленовую, 2,5-бензтиазолиленовую, 1-метил-2,5 индолиленовую,1-метил-2,5-имидазо[4,5-b] пиридиниленовую, 3-метил-2,7-имидазо[1,2-а] пиридиниленовую или 1-метил-2,5-тиено[2,3-d] имидазолиленовую группу, иR2 представляет собой алкильную группу с 1-3 атомами углерода, которая может быть замещена карбоксильной, алкилоксикарбонильной, где алкил с 1-6 атомами углерода, бензилоксикарбонильной, метилсульфониламинокарбонильной или 1 Н-тетразол-5-ильной группой,алкильную группу с 2-3 атомами углерода,которая замещена гидрокси, бензилокси, карбоксиалкиламино, где алкил с 1-3 атомами углерода, алкоксикарбонилалкиламино, где алкокси и алкил с 1-3 атомами углерода, Nалкилкарбоксиалкиламино, где оба алкила с 1-3 атомами углерода, или N-алкилалкоксикарбонилалкиламиногруппой, где алкокси и оба алкила с 1-3 атомами углерода, при этом в вышеупомянутых группах -углеродный атом,стоящий рядом с атомом азота, не может быть замещен, иR3 представляет собой пропаргиловую группу, при этом ненасыщенная часть не может быть непосредственно связана с атомом азотаR2NR3-группы, фенильную группу, при необходимости, замещенную атомом фтора или хлора,метилльной или метоксигруппой, пиридинильную группу,их таутомеры, их стереоизомеры и их соли. Особенно предпочтительными соединениями вышеприведенной общей формулы I являются такие, в которых А означает карбонильную группу, связанную с бензо- или тиеновой частью остатка Het,В означает этиленовую группу, в которой метиленовая группа, связанная с остатком Аr,может быть замещена атомом кислорода или серы или -NR1-группой, при этомR1 представляет собой атом водорода или метильную группу,Rb представляет собой атом водорода, гидроксильную, алкоксикарбонильную, где алкокси с 1-9 атомами углерода, циклогексилоксикарбонильную, бензилоксикарбонильную, бензоильную, п-алкилбензоильную, где алкил с 1-3 атомами углерода, или никотиноильную группу,при этом этоксильная часть во 2-положении упомянутой выше алкоксикарбонильной группы, где алкокси с 1-9 атомами углерода, дополнительно может быть замещена метилсульфонильной группой или 2-этоксиэтильной группой, 003697R2 представляет собой алкильную группу с 1-3 атомами углерода, которая может быть замещена карбоксильной, алкилоксикарбонильной, где алкил с 1-6 атомами углерода, бензилоксикарбонильной, метилсульфониламинокарбонильной или 1 Н-тетразол-5-ильной группой,алкильную группу с 2-3 атомами углерода,которая замещена гидрокси-, бензилокси, карбоксиалкиламино, где алкил с 1-3 атомами углерода, алкоксикарбонилалкиламино, где алкокси и алкил с 1-3 атомами углерода, Nалкилкарбоксиалкиламино, где оба алкила с 1-3 атомами углерода, или N-алкилалкоксикарбонилалкиламиногруппу, где алкокси и оба алкила с 1-3 атомами углерода, при этом в вышеупомянутых группах -углеродный атом, стоящий рядом с атомом азота, не может быть замещен, илиR3 представляет собой фенильную группу,при необходимости, замещенную атомом фтора,2-пиридинильную группу,их таутомеры, их стереоизомеры и их соли. В качестве примера особо предпочтительных соединений следует упомянуть следующие:N-фенил-N-(2-метоксикарбонилэтил) амид 1-метил-2-[N-(4-амидинофенил)аминометил]индол-5-илкарбоновой кислоты,(u) N-фенил-N-(2-гидроксикарбонилэтил) амид 1-мeтил-2-[N-(4-aмидинофенил)аминометил]тиено[2,3-d]имидазол-5-илкарбоновой кислоты,их таутомеры, стереоизомеры и их соли. Новые соединения могут быть получены известными способами, например, следующими способами. а) Для получения соединения общей формулы I, у которых Rb представляет собой атом водорода или гидроксил: образующееся, при необходимости, в реакционной смеси соединение общей формулы IIZ1 представляет собой алкокси-, аралкокси-, алкилтио- или аралкилтиогруппу,подвергают взаимодействию с амином общей формулы IIIRb' представляет собой атом водорода,гидроксигруппу или алкильную группу с 1-3 атомами углерода, с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности физиологически приемлемых солей. Взаимодействие соединения общей формулы II с соединением общей формулы III или с соответствующей солью кислоты, такой как карбонат аммония, проводят, в основном, в растворителе, таком как метанол, этанол, нпропанол, вода, смесь метанол/вода, тетрагидрофуран или диоксан, при температурах между 0 и 150 С, предпочтительно при температурах между 20 и 120 С. Соединение общей формулы II получают,например, взаимодействием соединения общей формулы II'(II'),в которой А, В, Аr, Het, R2 и R3 определены выше, с соответствующим спиртом, таким как метанол, этанол, н-пропанол, изопропанол или бензиловый спирт, в присутствии кислоты, такой как соляная кислота, или взаимодействием соответствующего амида с триалкилоксониевой солью, такой как, триэтилоксонийтетрафторборат, в растворителе, таком как хлористый метилен, тетрагидрофуран или диоксан, при температурах между 0 и 50 С, предпочтительно при 20 С, или взаимодействием соответствующего нитрила с сероводородом, в основном, в растворителе, как например, в пиридине или диметилформамиде, в присутствии основания, такого как триэтиламин, и последующим алкилированием образующегося тиоамида соответствующим алкил- или арилгалогенидом.b) Для получения соединения общей формулы I, у которых R2NR3-A-группа имеет указанные выше значения, при условии, что она содержит карбоксильную группу, или R2NR3-Агруппа имеет указанные выше значения, и Rb означает атом водорода, или R2NR3-А-группа содержит карбоксильную группу и Rb означает атом водорода: соединение общей формулы IVR2'NR3'-A-группа имеет значения, упомянутые выше для R2NR3-А-группы и Е' означает остаток -C(=NH)-NH2 или группу, превращаемую в указанный остаток, при условии, чтоR2'NR3'-A-группа содержит группу, превращаемую в карбоксильную группу с помощью гидролиза, обработки кислотой или основанием,термолиза или гидрогенолиза, и Е' означает вышеуказанный остаток, или Е' представляет собой группу, превращаемую в -C(=NH)-NH2 группу, с помощью гидролиза, обработки кислотой или основанием, термолиза или гидрогенолиза, a R2'NR3'-A-группа имеет значения,упомянутые выше для R2NR3-А-группы, илиR2'NR3'-A-группа содержит группу, превращаемую в карбоксильную группу с помощью гидролиза, обработки кислотой или основанием,термолиза или гидрогенолиза, а Е' представляет собой группу, превращаемую с помощью гидролиза, обработки кислотой или основанием,термолиза или гидрогенолиза в -C(=NH)-NH2 группу, превращают в соединение общей формулы I, в которой R2NR3-А-группа содержит карбоксильную группу или имеет другие значения, указанные выше, a Rb означает атом водорода, с помощью гидролиза, обработки кислотой или основанием, термолиза или гидрогенолиза, с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности, физиологически приемлемых солей. В качестве группы, превращаемой в карбоксильную, рассматривается, например, карбоксильная группа, блокированная защитным остатком, а именно, ее функциональные производные, например ее незамещенные и замещенные амиды, эфиры, тиоэфиры, триметилсилильные эфиры, ортоэфиры или иминоэфиры, которые превращают, в основном, c помощью гидролиза в карбоксильную группу; ее эфиры с третичными спиртами,например,третбутиловый эфир, который в основном, с помощью обработки кислотой или термолизом превращают в карбоксильную группу; и ее эфиры с аралканолами, например бензиловый эфир, в основном, с помощью гидрогенолиза переводится в карбоксильную группу. Гидролиз, в основном, проводится или в присутствии кислоты, такой как соляная кислота, серная кислота, фосфорная кислота, уксусная кислот, трихлоруксусная кислота, трифторуксусная кислота или их смеси, или в присутствии основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в подходящем растворителе, к примеру, в воде, смеси вода/метанол, вода/этанол, вода/изопропанол, в метаноле, этаноле, смеси вода/тетрагидрофуран или вода/диоксан, при температурах между -10 и 120 С, например при температурах между комнатной и температурой кипения реакционной смеси. Если R2'NR3'-A-группа и/или Е' в соединении формулы IV содержит, например, третбутильную или трет-бутилоксикарбонильную группу, то они могут быть отщеплены с помощью обработки кислотой, такой как трифторуксусная кислота, муравьиная кислота, птолуолсульфокислота, серная кислота, соляная кислота, фосфорная кислота или полифосфорная кислота, при необходимости, в инертном растворителе, таком как метиленхлорид, хлороформ, бензол, толуол, диэтиловый эфир, тетрагидрофуран или диоксан, в основном, при температурах между -10 и 120 С, например при температурах между 0 и 60 С, или также термически, при необходимости в инертном растворителе, таком как метиленхлорид, хлороформ, 003697 8 бензол, толуол, тетрагидрофуран или диоксан, и предпочтительно в присутствии каталитических количеств кислоты, такой как п-толуолсульфокислота, фосфорная кислота или полифосфорная кислота, предпочтительно при температуре кипения используемого растворителя, например, при температурах между 40 и 120 С. Если R2'NR3'-A-группа и/или Е' в соединении формулы IV содержит, например, бензилокси- или бензилоксикарбонильную группу, то они могут быть отщеплены также гидрогенолитически (с помощью гидрогенолиза) в присутствии катализатора гидрирования, такого как палладий на угле, в подходящем растворителе, таком как метанол, этанол, этанол/вода, ледяная уксусная кислота, этиловый эфир уксусной кислоты, диоксан или диметилформамид, предпочтительно при температурах между 0 и 50 С,например при комнатной температуре, и давлении водорода от 1 до 5 бар. с) Для получения соединения общей формулы I, у которых R2NR3-А-группа содержит одну из эфирных групп, вышеупомянутых при определении значения данного фрагмента: соединение общей формулы V в которой В, Rb, Аr и Het определены выше, иR2"NR3"-А-группа имеет значения, упомянутые выше для R2NR3-A-группы, при условии,что R2"NR3"-A-группа содержит карбоксильную группу, или группу, превращаемую с помощью спирта в соответствующую эфирную группу,подвергают взаимодействию со спиртом общей формулы VI НО-R7(VI),в которой R7 представляет собой алкильную часть одного из упомянутых выше остатков,отщепляемых in vivo, за исключением R6-CO-O(R5CR6)-группы для карбоксильной группы, или с его формамидинацеталями, или с соединением общей формулы VII(VII),в которой R8 представляет собой алкильную часть одного из упомянутых выше остатков,отщепляемых in vivo, за исключением R6-CO-O(R5CR6)-группы для карбоксильной группы, и Z2 представляет собой отщепляемую группу, с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности,физиологически приемлемых солей. Реакция со спиртом общей формулы VI проводится, в основном, в растворителе или смеси растворителей, таком как метиленхлорид,бензол, толуол, хлорбензол, тетрагидрофуран,бензол/тетрагидрофуран или диоксан, предпочтительным образом все-таки в спирте общей формулы VI, при необходимости, в присутствии кислоты, такой как соляная кислота, или в присутствии водоотнимающего средства, например,в присутствии изобутилового эфира хлормуравьиной кислоты, тионилхлорида, триметил 9 хлорсилана, соляной кислоты, серной кислоты,метансульфокислоты, п-толуолсульфокислоты,треххлористого фосфора, пятиокиси фосфора,N,N'-дициклогексилкарбодиимида, смеси N,N'дициклогексилкарбодиимид/N-гидроксисукцинимид, N,N'-карбонилдиимидазола или N,N'тионилдиимидазола, смеси трифенилфосфин/ четыреххлористый углерод или трифенилфосфин/(диэтиловый эфир азодикарбоновой кислоты), при необходимости, в присутствии основания, такого как карбонат калия, N-этилдиизопропиламин или N,N-диметиламинопиридин, в основном, при температурах между 0 и 150 С, предпочтительно при температурах между 0 и 80 С. С соединением общей формулы VII реакция проводится, в основном, в растворителе,таком как метиленхлорид, тетрагидрофуран,диоксан, диметилсульфоксид, диметилформамид или ацетон, при необходимости, в присутствии ускорителей реакции, таких как йодид натрия или калия, или предпочтительно в присутствии основания, такого как карбонат натрия или карбонат калия, или в присутствии третичного органического основания, такого как Nэтилдиизопропиламин или N-метилморфолин,которые одновременно могут служить в качестве растворителей, или при необходимости в присутствии карбоната серебра или оксида серебра, при температурах между -30 и 100 С,предпочтительно при температурах между -10 и 80 С.d) Для получения соединения общей формулы I, у которых Rb представляет отщепляемый in vivo остаток: соединение общей формулы VIIIR2NR3-А-Het-В-Аr-С(=NH)-NH2 (VIII),в которой R2, R3, А, Het, В и Аr определены выше,подвергают взаимодействию с соединением общей формулы IXZ2 означает нуклеофильную отщепляемую группу,с последующим выделением целевого продукта в виде стереоизомеров или солей, в частности физиологически приемлемых солей. Реакция проводится предпочтительно в растворителе, таком как метанол, этанол, метиленхлорид, тетрагидрофуран, толуол, диоксан,диметилсульфоксид или диметилформамид, при необходимости, в присутствии неорганического или органического основания, предпочтительно при температурах между 20 С и температурой кипения используемого растворителя. С соединением общей формулы IX, в которой Z2 представляет собой нуклеофильную отщепляемую группу, реакция проводится предпочтительно в растворителе, таком как ме 003697 10 тиленхлорид, ацетонитрил, тетрагидрофуран,толуол, диметилформамид или диметилсульфоксид, при необходимости, в присутствии основания, такого как гидрид натрия, карбонат калия, трет-бутилат калия или N-этилдиизопропиламин, при температурах между 0 и 60 С. При описанных выше реакциях имеющиеся в наличии реакционноспособные группы,такие как гидрокси-, карбокси, амино-, алкиламино или иминогруппы, при необходимости во время реакции могут быть защищены с помощью обычных защитных групп, которые после реакции снова отщепляются. Например, в качестве защитного остатка для гидроксигруппы рассматривается триметилсилильная, ацетильная, бензоильная, третбутильная, тритильная, бензильная или тетрагидропиранильная группа, в качестве защитного остатка для карбоксигруппы рассматривается триметилсилильная, метильная, этильная, третбутильная, бензильная или тетрагидропиранильная группа, и в качестве защитного остатка для амино-, алкиламино- или иминогруппы рассматривается ацетильная, трифторацетильная,бензоильная,этоксикарбонильная,тpeтбутоксикарбонильная, бензилоксикарбонильная,бензильная, метоксибензильная или 2,4 диметоксибензильная группа, и для аминогруппы дополнительно фталильная группа. Следующее за этим, при необходимости,отщепление используемого защитного остатка происходит, к примеру, гидролитически в водном растворителе, например, в воде, смеси изопропанол/вода, тетрагидрофуаран/вода или диоксан/вода, в присутствии кислоты, такой как трифторуксуная кислота, соляная кислота или серная кислота, или в присутствии щелочного основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, или посредством эфирного расщепления, например, в присутствии йодтриметилсилана, при температурах между 0 и 100 С, предпочтительно при температурах между 10 и 50 С. Отщепление бензильного, метоксибензильного и бензилоксикарбонильного остатка происходит, к примеру, гидрогенолитически,например, водородом в присутствии катализатора, такого как палладий на угле, в растворителе, таком как метанол, этанол, уксусноэтиловый эфир, диметилформамид, диметилформамид/ацетон или ледяная уксусная кислота, при необходимости при добавлении кислоты, такой как соляная кислота, при температурах между 0 и 50 С, предпочтительно при комнатной температуре, и при давлении водорода от 1 до 7 бар, предпочтительно от 3 до 5 бар. Отщепление метоксибензильной группы может происходить также в присутствии окислителя, такого как Се (IV) - аммонийнитрат, в растворителе, таком как метиленхлорид, ацетонитрил или смеси ацетонитрил/вода, при темпе 11 ратурах между 0 и 50 С, предпочтительно при комнатной температуре. Отщепление 2,4-диметоксибензильного остатка происходит, в основном, в трифторуксусной кислоте в присутствии анизола. Отщепление трет-бутильного или третбутилоксикарбонильного остатка происходит предпочтительно посредством обработки кислотой, такой как трифторуксусная кислота или соляная кислота, в некоторых случаях при использовании растворителя, такого как метиленхлорид, диоксан или эфир. Отщепление фталильного остатка происходит, в основном, в присутствии гидразина или первичного амина, такого как метиламин, этиламин или н-бутиламин, в растворителе, таком как метанол, этанол, изопропанол, толуол/вода или диоксан, при температурах между 20 и 50 С. Отщепление аллиоксикарбонильного остатка происходит посредством обработки каталитическим количеством тетракис(трифенилфосфин)палладия(0), предпочтительно в растворителе, таком как тетрагидрофуран, и предпочтительно, в присутствии избытка основания,такого как морфолин или 1,3-димедон, при температурах между 0 и 100 С, предпочтительно при комнатной температуре и в инертном газе,или посредством обработки каталитическим количеством трис-(трифенилфосфин) родий (I)хлорида в растворителе, таком как водный этанол, и в некоторых случаях, в присутствии основания,такого как 1,4-диазабицикло[2,2,2]октан, при температурах между 20 и 70 С. Используемые в качестве исходных веществ соединения общих формул II-IX, которые частично известны в литературе, получают по известным в литературе методам, кроме того, их получение описано в примерах. Так, получают, например, соединение общей формулы II посредством реакции соответствующего нитрила с соответствующим меркаптаном (тиолом) или спиртом в присутствии хлористого или бромистого водорода. Используемые в качестве исходных веществ соединения общих формул IV, V, VIII получают целесообразно согласно способу настоящего изобретения. Используемые в качестве исходных веществ соединения общих формул III, VI, VII, IX получают тривиальными способами, например,восстановлением ароматического эфира, который в о-положении замещен аминогруппой, в некоторых случаях замещенной, и нитрогруппой, и, при необходимости, последующего замыкания кольца полученного таким образом одиаминосоединения с соответствующей карбоновой кислотой. Далее полученные соединения общей формулы I могут быть разделены на их энантиомеры и/или диастереомеры. 12 Так, например, полученные соединения общей формулы I, которые находятся в виде рацематов, могут быть разделены по известным методам (смотри Allinger N.L. und Eliel E.L.вTopics in Stereochemistry, Vol. 6, Wiley Interscience, 1971) на их оптические антиподы, а соединения общей формулы I, по меньшей мере, с 2 асимметрическими атомами углерода на основе их различия в физико-химических свойствах могут быть разделены по известным методам,например хроматографией и/или фракционированной кристаллизацией, на их диастереомеры,которые, если они выпадают в рацемической форме, затем, как упомянуто выше, могут быть разделены на энантиомеры. Разделение энантиомеров происходит предпочтительно с помощью разделения на колонках на хиральных фазах или перекристаллизацией из оптически активного растворителя,или посредством взаимодействия с оптически активным веществом, образующим с рацемическим соединением соли или производные, такие как эфиры или амиды, особенно с кислотами и их активированными производными или спиртами, и разделения полученной таким способом диастереомерной смеси солей или производных,например, на основе различных растворимостей, при этом из чистых диастереомерных солей или производных могут быть выделены свободные антиподы посредством действия подходящих реагентов. Особенно употребительны оптически активные кислоты, например,D- и L-формы винной кислоты или дибензоилвинной кислоты, диотолилвинной кислоты, яблочной кислоты, миндальной кислоты, камфаросульфокислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. В качестве оптически активного спирта рассматривается спирт, к примеру, (+)- или (-)метанол, а в качестве оптически активного ацильного остатка в амидах рассматривается,например, (+)- или (-)-ментилоксикарбонильный остаток. Кроме того, полученные соединения общей формулы I могут быть переведены в их соли, в особенности для фармацевтического применения в их физиологически приемлемые соли с неорганическими и органическими кислотами. В качестве кислот рассматриваются для этого,например,соляная кислота,бромистоводородная кислота, серная кислота, фосфорная кислота, фумаровая кислота, янтарная кислота,молочная кислота, лимонная кислота, винная кислота или малеиновая кислота. Кроме того, полученные таким образом новые соединения общей формулы I, если они содержат карбоксильную группу, при желании затем могут быть превращены в их соли с неорганическими или органическими основаниями,особенно для фармацевтического применения в их физиологически приемлемые соли. В качестве оснований рассматриваются при этом, на 13 пример, гидроксид натрия, гидроксид калия,циклогексиламин, этаноламин, диэтаноламин и триэтаноламин. Как уже упомянуто выше, новые соединения общей формулы I и их соли проявляют ценные (полезные) свойства. Так, соединения общей формулы II' являются ценными промежуточными продуктами для получения других соединений общей формулы I, а соединения общей формулы I, а также их таутомеры, их стереоизомеры, их физиологически приемлемые соли, проявляют ценные фармакологические свойства, в частности, обладают тромбиноингибирующим действим, способностью увеличивать время действия тромбина и оказывают тормозящее действие на родственные серинпротеазы, такие как трипсин, урокиназа факторXII, при этом также некоторые соединения, как например соединение примера 16, одновременно также проявляют способность незначительно тормозить агрегацию тромбоцитов. В качестве примера были исследованы соединения А = N-фенил-N-(2-карбоксиэтил)амид 2[N-(4-амидинофенил)аминометил]бензтиазол-5 илкарбоновой кислоты,В = N-фенил-N-(3-гидроксикарбонилпропил)амид 1-метил-2-[2-(4-амидинофенил)этил] бензтиазол-5-илкарбоновой кислоты,С = N-фенил-N-(гидроксикарбонилметил) амид 1-метил-2-[(4-амидино-фенил)оксиметил] бензтиазол-5-илкарбоновой кислоты,D = N-фенил-N-(2-гидроксикарбонилэтил) амид 1-метил-2-[N-(4-амидинофенил)аминометил] бензтиазол-5-илкарбоновой кислоты,Е = N-(2-пиридил)-N-(гидроксикарбонилметил)амид 1-метил-2-[N-(4-амидинофенил) аминометил]бензтиазол-5-илкарбоновой кислоты,F = N-фенил-N-[2-(1 Н-тетразол-5-ил)этил] амид 1-метил-2-[2-(4-амидинофенил)этил]бензтиазол-5-илкарбоновой кислоты иG = N-(2-пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил) аминометил]бензтиазол-5-илкарбоновой кислоты в отношении их влияния на время действия тромбина. Результаты приведены ниже. Материалы: плазма из человеческой крови, полученная с использованием цитрата; тест-тромбин (бычий), 30 U/мл, BehrigBiomatic В 10 Коагулометр, Sarstedt. Проведение эксперимента: Определение времени действия тромбина проводят на коагулометре Biomatic В 10 фирмы 14 Тестируемое вещество с 0,1 мл человеческой цитратной плазмы и 0,1 мл диэтилбарбитурат-ацетата (ДБА-буфера) помещают в специальный сосуд для испытаний, разработанный изготовителем. Образец инкубируют в течение одной минуты при 37 С. После добавления 0,3U тест-тромбина и 0,1 мл ДБА-буфера начиналась реакция свертывания крови. В соответствии с инструкцией к прибору при добавлении тромбина проводят измерение времени свертывания образца. В качестве контроля служат образцы, содержащие только 0,1 мл ДБА-буфера. Согласно определению на основании кривой действия доз получают эффективную концентрацию вещества, при которой время действия тромбина удваивается. Полученные значения приведены в следующей таблице. Вещество Время действия тромбина (ED20 в М) А 0,04 В 0,06 С 0,15G 0,03 К примеру, в экспериментах на крысах при использовании соединений A, D, Е и G до дозы 1 мг/кг in vivo не наблюдается никаких серьезных токсичных побочных действий. Соответственно этому, указанные соединения являются хорошо совместимыми. На основе их фармакологических свойств новые соединения и их физиологически приемлемые соли пригодны для профилактики и лечения венозных и артериальных тромботических заболеваний, например, для лечения глубоких внутривенных тромбозов, предотвращения реокклюзии после операций шунтирования или операции на сосудах (РТ(С)А), а также окклюзии при периферийных артериальных заболеваниях, а именно, легочной эмболии, распространенного внутрисосудистого свертывания крови, профилактики коронарного тромбоза,профилактики снижения сердечного ритма и предотвращения окклюзии шунтов и стеноза(сужений сосудов). Кроме того, заявляемые соединения пригодны для антитромботической поддержки при тромболитическом лечении, как например, с rt-PA или стрептокиназой, для предотвращения метастаз и роста коагуляционнозависимых опухолей и фибринозависимых воспалительных процессах. Дозировки, требуемые для получения соответствующего эффекта, составляют в основном, при внутривенном введении от 0,1 до 30 мг/кг, предпочтительно от 0,3 до 10 мг/кг, а при оральном введении от 0,1 до 50 мг/кг, предпочтительные от 0,3 до 30 мг/кг, в каждом случае от 15 1 до 4 раз ежедневно. К тому же, соединения формулы I, полученные согласно настоящему изобретению, при необходимости, могут использоваться в составе с другими активными веществами, вместе с одним или несколькими обычными инертными носителями и/или разбавителями, например, с кукурузным крахмалом,молочным сахаром, тростниковым сахаром,микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, смесью вода/этанол, вода/глицерин, вода/сорбит, вода/полиэтиленгликоль, пропиленгликолем, цетил-стеариловым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, а именно с твердым жиром, или с их подходящими смесями, в обычных галеновых составах,таких как таблетки, драже, капсулы, порошки,суспензии или язычки. Следующие примеры должны раскрыть изобретение полнее. Предварительные пояcнения При измерении значений Rf, если не оговорено иное, всегда используются Polygram пластинки силикагеля фирмы E.Merck, Darmstadt. ЕКА-масс-спектры (масс-спектры катионов, полученных методом электрораспыления) описаны, например, в Chemie unserer Zeit 6, 308316 (1991). Пример 1. N-Фенил-N-(2-этоксикарбонилэтил)амид 3-метил-2-[2-(4-амидинофенил)этил] имидазо[4,5-b]пиридин-6-карбоновой кислоты.al. в J. Chem. Soc. 1951, 2590) в 20 мл 40%-ного водного раствора метиламина перемешивают 30 мин при комнатной температуре. Затем реакционную смесь разбавляют ледяной водой, выпавший желтый осадок отфильтровывают и сушат. Выход: 1,2 г ( 80% от теории). Значение Rf: 0,66 (силикагель; этилацетат/этанол/уксусная кислота=90:5:5).b) Метиловый эфир 5-амино-6-метиламиноникотиновой кислоты. К раствору 3,1 г (15 мМоль) метилового эфира 6-метиламино-5-нитроникотиновой кислоты в 100 мл смеси этанол/дихлорметан (3:1) добавляют 1 г палладия на угле (10%-ный), и полученную суспензию гидрируют при давлении водорода 5 бар 1,5 ч при комнатной температуре. Затем катализатор отфильтровывают, и растворитель отгоняют в вакууме. Полученный маслообразный сырой продукт непосредственно подвергают дальнейшему превращению. Выход: 2,4 г ( 92% от теории). Значение Rf: 0,44 (силикагель; этилацетат/этанол/аммиак=90:10:1).c) Метиловый эфир 5-[2-(4-цианофенил) этилкарбониламино]-6-метиламиноникотиновой кислоты. К раствору 2,6 г (15 мМоль) 3-(4 цианофенил)пропионовой кислоты в 25 мл абсолютного тетрагидрофурана добавляют 2,4 г(15 мМоль) N,N'-карбонилдиимидазола и перемешивают 20 мин при комнатной температуре. Затем к (полученному) имидазолиду прибавляют раствор 2,3 г (13 мМоль) метилового эфира 5-амино-6-метиламиноникотиновой кислоты в 25 мл диметилформамида и нагревают 3 ч при 100 С. После удаления растворителя в вакууме полученный сырой продукт обрабатывают этилацетатом, органический слой промывают водой,и после сушки над сульфатом натрия вновь упаривают растворитель. Полученный остаток очищают с помощью колоночной хроматографии (силикагель; элюент: от чистого дихлорметана до смеси дихлорметан/этанол=19:1). Выход: 2,1 г слабоокрашенного твердого веществаd) Метиловый эфир 3-метил-2-[2-(4 цианофенил)этил]имидазо[4,5-b]пиридин-6 карбоновой кислоты. Раствор 2,0 г (5,9 мМоль) метилового эфира 5-[2-(4-цианофенил)этилкарбониламино]-6 метиламиноникотиновой кислоты в 50 мл этилацетата нагревают 1 ч при 100 С. После удаления растворителя остаток растворяют в дихлорметане, полученный раствор промывают раствором бикарбоната натрия, сушат сульфатом натрия, и вновь отгоняют растворитель. Выход: 1,7 г коричневого твердого вещества (89% от теории). Значение Rf: 0,50 ( силикагель; этилацетат/этанол/аммиак=90:10:1). е) 3-Метил-2-[2-(4-цианофенил)этил]имидазо[4,5-b]пиридин-6-карбоновая кислота. Раствор 3,2 г (10 мМоль) метилового эфира 3-метил-2-[2-(4-цианофенил)этил]имидазо[4,5-b]пиридин-6-карбоновой кислоты в 150 мл метанола смешивают с раствором 1,5 г гидроксида лития в 20 мл воды и перемешивают 24 ч при комнатной температуре. Затем разбавляют 50 мл воды, спирт отгоняют, и водный слой промывают этилацетатом. После подкисления разбавленной соляной кислотой (раствор) несколько раз экстрагируют смесью дихлорметан/метанол (9:1), органические слои сушат сульфатом натрия, и растворитель отгоняют. Выход: 2,1 г слабоокрашенного веществаf) N-Фенил-N-(2-этоксикарбонилэтил)амид 3-метил-2-[2-(4-цианофенил)этил]имидазо[4,5b]пиридин-6-карбоновой кислоты. К раствору 2 г (6,5 мМоль) 3-метил-2-[2(4-цианофенил)этил]имидазо[4,5-b]пиридин-6 17 карбоновой кислоты в 100 мл дихлорметана добавляют 20 мл тионилхлорида и кипятят 2 ч с обратным холодильником. После отгонки жидких компонент сырой продукт экстрагируют еще 2 раза дихлорметаном и каждый раз отгоняют растворитель. Полученный таким образом сырой хлорангидрид (2 г) суспендируют в 100 мл тетрагидрофурана и смешивают с 1,2 г (6,5 мМоль) N-(2-этоксикарбонилэтил)анилина. Затем прикалывают 0,73 г (7,2 мМоль) триэтиламина в течение 5 мин. После 1-часового перемешивания растворитель отгоняют в вакууме,остаток обрабатывают этилацетатом, органический слой промывают водой и сушат сульфатом натрия. После отгонки растворителя и колоночной хроматографии (силикагель; элюент: от чистого дихлорметана до смеси дихлорметан/этанол=49:1) желаемое соединение выделяют в виде коричневатого масла. Выход: 1,9 г (65% от теории). Значение Rf: 0,44 (силикагель; этилацетат/этанол/аммиак=90:10:1)N-Фенил-N-(2-этоксикарбонилэтил) амид 3-метил-2-[2-(4-амидинофенил)этил]имидазо[4,5-b]пиридин-6-карбоновой кислоты. 1,8 г (3,7 мМоль) N-фенил-N-(2-этоксикарбонилэтил)амида 3-метил-2-[2-(4-цианофенил)этил]имидазо[4,5-b]пиридин-6-карбоновой кислоты в 100 мл насыщенного хлористым водородом этанола перемешивают сначала 16 ч при 0 С, а затем при комнатной температуре до тех пор, пока методом тонкослойной хроматографии не перестанет обнаруживаться исходное вещество. Затем растворитель отгоняют, маслянистый остаток обрабатывают 50 мл абсолютного этанола, и добавляют 3,6 г (37 мМоль) карбоната аммония. Через 4 ч растворитель отгоняют в вакууме, полученный сырой продукт очищают с помощью колоночной хроматографии (силикагель; элюент:смесь дихлорметан/этанол в отношении от 19:1 до 4:1), и вновь упаривают (растворитель). Выход: 1,6 г слабоокрашенного твердого вещества (80% от теории). Значение Rf: 0,30 (силикагель; этилацетат/этанол/аммиак=90:5:5). Пример 2. N-Фенил-N-(2-гидроксикарбонилэтил)амид 3-метил-2-[2-(4-амидинофенил) этил]имидазо[4,5-b]пиридин-6-карбоновой кислоты. Раствор 535 мг (1,0 мМоль) N-фенил-N-(2 этоксикарбонилэтил)амида 3-метил-2-[2-(4 амидинофенил)этил]имидазо[4,5-b]пиридин-6 карбоновой кислоты в 10 мл этанола смешивают с 5 мл 2 N натровой щелочи и перемешивают 2 ч при комнатной температуре. Затем разбавляют 10 мл воды, спирт отгоняют, водный слой промывают 20 мл этилацетата и подкисляют концентрированной соляной кислотой, при этом целевое соединение выпадает в виде белых кристаллов. Выход: 375 мг (74% от теории). 18 Значение Rf: 0,23 (силикагель; этилацетат/этанол/аммиак=90:5:5). С 26 Н 26N6 О 3 (470,54). Масс-спектр: (М+Н)+=471. Пример 3. Гидрохлорид N-(2-пиридил)-N(2-метоксикарбонилэтил)амида 3-метил-2-[2-(4 амидинофенил)этил]имидазо[4,5-b]пиридин-6 карбоновой кислоты. Получают аналогично примеру 1 из N-(2 пиридил)-N-(2-метоксикарбонилэтил)амида 3 метил-2-[2-(4-цианофенил)этил]имидазо[4,5-b] пиридин-6-карбоновой кислоты, метанольного раствора соляной кислоты, метанола и карбоната аммония. Выход: 75% от теории. С 26 Н 27N7 О 3 (485,55). Значение Rf: 0,31 (силикагель; этилацетат/этанол/аммиак=50:45:5). ЕКА - масс-спектр: (М+Н)+=486. Пример 4. Гидрохлорид N-фенил-N-этоксикарбонилметиламида 3-метил-2-[2-(4-амидинофенил)этил]имидазо[4,5-b]пиридин-6-карбоновой кислоты. Получают аналогично примеру 1 из Nфенил-N-этоксикарбонилметиламида 3-метил-2[2-(4-цианофенил)этил]имидазо[4,5-b]пиридин 6-карбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 84% от теории. С 27 Н 28N6 О 3 (484,56). Значение Rf: 0,44 (силикагель; этилацетат/этанол/аммиак=50:45:5). ЕКА - масс-спектр: (М+Н)+=485. Пример 5. Гидрохлорид N-фенил-Nгидоксикарбонилметиламида 3-метил-2-[2-(4 амидинофенил)этил]имидазо[4,5-b]пиридин-6 карбоновой кислоты. Получают аналогично примеру 2 из гидрохлорида N-фенил-N-этоксикарбонилметиламида 3-метил-2-[2-(4-амидинофенил)этил]имидазоC25H24N6O3 (456,51). Значение Rf: 0,19 (силикагель; этилацетат/этанол/аммиак=50:45:5). ЕКА - масс-спектр: (М+Н)+=457. Пример 6. Гидрохлорид 2-[2-(4-амидинофенил)этил]-3-метил-6-(2-метоксикарбонил-2,3 дигидроиндол-1-илкарбонил)имидазо[4,5-b] пиридина. Получают аналогично примеру 1 из 2-[2(4-цианофенил)этил]-3-метил-6-(2-метоксикарбонил-2,3-дигидроиндол-1-илкарбонил)имидазо[4,5-b]пиридина, метанольного раствора соляной кислоты, метанола и карбоната аммония. Выход: 20% от теории. С 27 Н 26N6 О 3 (482,54). Значение Rf: 0,30 (силикагель; этилацетат/этанол/аммиак=50:45:5). ЕКА - масс-спектр: (М+Н)+=483. 19 Пример 7. Гидрохлорид 2-[2-(4-амидинофенил)этил]-3-метил-6-(2-карбокси-2,3-дигидроиндол-1-илкарбонил)имидазо[4,5-b]пиридина. Получают аналогично примеру 2 из гидрохлорида 2-[2-(4-амидинофенил)этил]-3-метил-6(2-метоксикарбонил-2,3-дигидроиндол-1-илкарбонил)имидазо[4,5-b]пиридина и натровой щелочи. Выход: 90% от теории. С 26 Н 24N6 О 3 (468,52). Значение Rf: 0,24 (силикагель; этилацетат/этанол/аммиак=50:45:5). ЕКА - масс-спектр: (М+Н)+=469.(с) 1,5 г никеля Рэнея 3,5 ч при комнатной температуре. Затем катализатор отфильтровывают,и фильтрат упаривают. После кристаллизации полученного остатка из петролейного эфира получают 5,75 г (84% от теории) целевого продукта в виде оливково-зеленых кристаллов. С 7H11N3 (137,20). Точка плавления: 112-113 С.b) 1,5-Диметил-2-[(4-цианофенил)оксиметил]имидазо[4,5-b]пиридин. 11,4 г (63 мМоль) 4-цианофеноксиуксусной кислоты растворяют в 200 мл абсолютного тетрагидрофурана и при комнатной температуре добавляют 10,2 г (63 мМоль) N,N'карбонилдиимидазола. Через 15 мин при 60 С прибавляют 5,70 г (41,5 мМоль) 2-амино-3 метиламино-6-метилпиридина. Через 2 ч при 60 С отгоняют растворитель, кристаллический остаток обрабатывают водой, промывают водой и сушат. После кристаллизации из этанола получают 9,95 г (91% от теории) целевого продукта в виде белых кристаллов.c) 1,5-Диметил-2-[(4-цианофенил)оксиметил]имидазо[4,5-b]пиридин-4-N-оксид. 2,62 г (10 мМоль) 1,5-диметил-2-[(4 цианофенил)оксиметил]имидазо[4,5-b]пиридина суспендируют в 125 мл дихлорметана и добавляют 2,62 г (12,7 ммоль) м-хлорпербензойной кислоты, при этом образуется прозрачный раствор. Через 2 ч отгоняют растворитель при комнатной температуре и полученный остаток обрабатывают раствором бикарбоната натрия. Через 30 мин полученный белый кристаллический продукт отсасывают, промывают водой и сушат при 40 С. Выход: 2,45 г (83% от теории). С 16 Н 14N4O2 (294,30).d) 1-Метил-2-[(4-цианофенил)оксиметил]5-гидроксиметилимидазо[4,5-b]пиридин. 2,40 г (8,2 мМоль) 1,5-диметил-2-[(4-цианофенил)оксиметил]имидазо[4,5-b]пиридин-4N-оксида суспендируют в 75 мл дихлорметана и добавляют 2,4 мл ангидрида трифторуксусной кислоты (16,9 мМоль), при этом образуется прозрачный раствор. Через 16 ч при комнатной температуре отгоняют растворитель, полученный вязкий остаток обрабатывают 50 мл дихлорметана и добавляют 50 мл 2 М раствора бикарбоната натрия. После сильного 3-часового перемешивания образовавшийся осадок отсасывают, промывают водой и сушат при 40 С. Выход: 1,85 г белого порошка (78% от теории). С 16 Н 14N4O2 (294,30). Точка плавления: 172 С. е) 1-Метил-2-[(4-цианофенил)оксиметил] имидазо[4,5-b]пиридин-5-карбальдегид. 3,65 г (12,5 мМоль) 1-метил-2-[(4 цианофенил)оксиметил]-5-гидроксиметилимидазо[4,5-b]пиридина растворяют в 500 мл дихлорметана, и добавляют 15,0 г двуокиси марганца. Через 96 ч при комнатной температуре смесь фильтруют через специальный сорбент кизельгур, и растворитель отгоняют. Полученный фильтрат упаривают, кристаллический осадок растирают с эфиром, отсасывают и сушат. Выход: 3,05 г белого порошка (84% от теории). С 16 Н 12N4O2 (292,30). Точка плавления: 231-234 С.f) 1-Метил-2-[(4-цианофенил)оксиметил]5-карбоксиимидазо[4,5-b]пиридин. 1,25 г (4,3 мМоль) 1-метил-2-[(4-цианофенил)оксиметил]имидазо[4,5-b]пиридин-5-карбальдегида растворяют в 10 мл муравьиной кислоты, и при 0 С добавляют 1,0 мл пероксид водорода (33%-ной). Через 12 ч при 4 С образовавшийся белый осадок отсасывают, промывают водой и сушат при 40 С. Выход: 0,81 г (61% от теории). С 16 Н 12N4O3 (308,7).g) N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[(4-цианофенил)оксиметил]имидазо[4,5-b]пиридин-5-илкарбоновой кислоты. 308 мг (1,0 мМоль) 1-метил-2-[(4-цианофенил)оксиметил]-5-карбоксиимидазо[4,5-b]пиридина суспендируют в 5 мл диметилформамида и добавляют 303 мг (3,0 мМоль) N-метилморфолина и 321 мг (1,0 мМоль) O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторбората. Через 10 мин при комнатной температуре прибавляют раствор 215 мг (1,2 мМоль) метилового эфира N-(2-пиридил)-3 аминопропионовой кислоты в 2 мл диметилформамида, при этом образуется прозрачный раствор. Через 12 ч при комнатной температуре реакционный раствор выливают при перемеши 21 вании в ледяную воду. После трехкратной экстракции этилацетатом объединенные органические вытяжки промывают раствором поваренной соли, сушат над сульфатом натрия и упаривают. Полученный остаток хроматографируют на силикагеле с элюентом дихлорметан/этанол(в отношении от 90:1 до 25:1). Выход: 165 мг белого порошка (35% от теории).N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[2-(4-амидинофенил)оксиметил]имидазо[4,5-b]пиридин-5-илкарбоновой кислоты. Получают с помощью реакции 140 мг (0,3 мМоль) N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[(4-цианофенил)оксиметил]имидазо[4,5-b]пиридин-5-илкарбоновой кислоты с насыщенным хлористым водородом этанолом и смесью (карбонат аммония)/этанол аналогично примеру 1g. Полученный продукт очищают с помощью хроматографии на силикагеле с элюентом дихлорметан/этанол (в соотношении от 19:1 до 4:1). Выход: 48 мг белого порошка (36% от теории).Dodds в J. Amer. Chem. Soc. 65, 2305 (1943 и 1,56 мл (1,85 г=17,0 мМоль) метоксиацетилхлорида в 50 мл хлорбензола перемешивают 1 ч при 50 С и затем 15 мин при кипении с обратным холодильником. Затем растворитель отгоняют в вакууме, и полученный сырой продукт очищают с помощью колоночной хроматографии (силикагель; дихлорметан/этанол=100:1). Желаемое соединение выпадает сначала в виде масла, которое затвердевает в течение нескольких дней. Выход: 3,8 г (98% от теории). Значение Rf: 0,38 (силикагель; дихлорметан/этанол=19:1).(5,2 мМоль) реагента Лоуссона нагревают 6 ч в 90 мл толуола при кипении с обратным холодильником, вновь добавляют 1,0 г реагента Лоуссона и нагревают еще 6 ч при 120 С. После замены растворителя на ксилол нагревают еще 8 ч в автоклаве при 180 С. Затем растворитель отгоняют в вакууме, полученный сырой продукт очищают с помощью колоночной хроматофа 003697c) 2-Метоксиметилбензтиазол-5-карбоновая кислота. Смесь 2,1 г (8,36 мМоль) этилового эфира 2-метоксиметилбензтиазол-5-карбоновой кислоты и 16 мл 2 N натровой щелочи в 60 мл этанола перемешивают 1 ч при комнатной температуре. Затем спирт отгоняют, сырой продукт растворяют в 20 мл воды, промывают 50 мл диэтилового эфира и водный слой подкисляют концентрированной соляной кислотой при охлаждении льдом. Выпавшее из раствора соединение розовато-бежевого цвета отсасывают, промывают водой и сушат. Выход: 1,6 г (86% от теории),Значение Rf: 0,12 (силикагель; дихлорметан/этанол=29:1)N-Фенил-N-(2-этоксикарбонилэтил) амид 2-метоксиметилбензтиазол-5-карбоновой кислоты. К суспензии 1,6 г (7,2 мМоль) 2 метоксиметилбензтиазол-5-карбоновой кислоты в 60 мл дихлорметана добавляют 1,6 мл (22 мМоль) тионилхлорида и кипятят 1 ч с обратным холодильником. При этом твердое вещество растворяется через 30 мин. После отгонки жидких компонент сырой продукт обрабатывают еще 2 раза дихлорметаном и каждый раз отгоняют растворитель. Полученный таким образом сырой хлорангидрид растворяют в 50 мл тетрагидрофурана, прикалывают к смеси 1,4 г(7,2 мМоль) N-(2-этоксикарбонилэтил)анилина и 3,0 мл (21 мМоль) триэтиламина в 50 мл тетрагидрофурана и перемешивают до следующего дня при комнатной температуре. Затем растворитель отгоняют в вакууме, остаток растворяют в 30 мл дихлорметана, полученный раствор промывают водой и сушат сульфатом натрия. После отгонки растворителя и колоночной хроматографии (силикагель; элюент: дихлорметан/этанол в соотношении от 98,5:1,5 до 80:20) выделяют желаемое соединение в виде коричневатого масла. Выход: 2,05 г (72% от теории),Значение Rf: 0,40 (силикагель; этилацетат/ петролейный эфир=1:1)N-Фенил-N-(2-этоксикарбонилэтил) амид 2-[N-(4-цианофенил)аминометил]бензтиазол-5-карбоновой кислоты. Смесь 2,05 г (5,14 мМоль) N-фенил-N-(2 этоксикарбонилэтил)амида 2-метоксиметилбензтиазол-5-карбоновой кислоты и 5,7 мл (5,7 мМоль) 1 М раствора трехбромистого бора в дихлорметане растворяют еще в 60 мл дихлорметана и перемешивают 16 ч при комнатной температуре. Затем реакционную смесь промывают 40 мл насыщенного раствора бикарбоната 23 натрия, органический слой сушат сульфатом натрия, и растворитель отгоняют. Полученный таким образом сыройN-фенил-N-(2 этоксикарбонилэтил)амид 2-бромметилбензтиазол-5-карбоновой кислоты (2,4 г) растворяют в 5,0 мл N'N-диизипропилэтиламина и добавляют 0,64 г (5,4 мМоль) 4-аминобензонитрила. После 1-часового нагревания при 130 С растворитель отгоняют в вакууме и полученный сырой продукт очищают с помощью колоночной хроматографии (силикагель; элюент: этилацетат/ петролейный эфир в соотношении от 1:3 до 1:1),при этом при упаривании элюата образуется оранжево-окрашенная пена. Выход: 1,1 г (44% от теории). Значение Rf: 0,35 (силикагель; этилацетат/петролейный эфир=7:3).f) N-Фенил-N-(2-этоксикарбонилэтил)амид 2-[N-(4-амидинофенил)аминометил]бензтиазол 5-карбоновой кислоты. 1,1 г (2,27 мМоль) N-фенил-N-(2-этоксикарбонилэтил)амида 2-[N-(4-цианофенил)аминометил]бензтиазол-5-карбоновой кислоты в 100 мл насыщенного хлористым водородом этанола перемешивают сначала 5 ч при 0 С, а затем при комнатной температуре до тех пор, пока методом тонкослойной хроматографии не будет обнаруживаться больше исходное вещество. Затем отгоняют растворитель при максимальной температуре в бане 30 С, маслообразный остаток растворяют в 100 мл абсолютного этанола, и добавляют 1,6 г (22 мМоль) карбоната аммония. После 18-часового перемешивания при комнатной температуре растворитель отгоняют в вакууме и сырой продукт очищают с помощью колоночной хроматографии(силикагель; элюент: вода/метанол в соотношении от 19:1 до 4:1). При упаривании элюата получают желаемое вещество в виде белой пены. Выход: 0,77 г (63% от теории). Значение Rf: 0,19 (силикагель; дихлорметан/этанол=3:7). С 27 Н 27N5O3S (501,6). Масс-спектр: (М+Н)+=502. Пример 10. N-Фенил-N-(2-карбоксилэтил) амид 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты. 0,45 г (0,84 мМоль) N-фенил-N-(2-этоксикарбонилэтил)амида 2-[N-(4-амидинофенил) аминометил]бензтиазол-5-карбоновой кислоты растворяют в 15 мл этанола, добавляют 2 мл 2 N натровой щелочи и перемешивают 4 ч при комнатной температуре. Затем смесь подкисляют 3 мл 2 N соляной кислоты и растворитель отгоняют. Полученный сырой продукт растворяют в 5 мл смеси дихлорметан/этанол (2:1) и отфильтровывают не растворившийся хлорид натрия. После отгонки растворителя получают желаемое вещество в виде желтой пены. Выход: 0,26 г (67% от теории). Значение Rf: 0,47 [силикагель; метанол/(5%-ный водный хлорид натрия)=6:4].C25H23N5O3S (473,55). Масс-спектр: (М+Н)+=474. Пример 11. Дигидрохлорид N-(2-пиридил)N-(2-метоксикарбонилэтил)амида 2-[N-(4-амидинофенил)аминометил]-бензтиазол-5-илкарбоновой кислоты. Получают аналогично примеру 9 из N-(2 пиридил)-N-(2-метоксикарбонилэтил)амида 2[N-(4-цианофенил)аминометил]бензтиазол-5 карбоновой кислоты, метанольного раствора соляной кислоты, метанола и карбоната аммония. Выход: 63% от теории. С 25 Н 24N6 О 3S (488,57). Значение Rf: 0,13 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=489. Пример 12. Дигидрохлорид N-(2-пиридил)N-(этоксикарбонилметил)амида 2-[2-(4-амидинофенил)этил]бензтиазол-5-илкарбоновой кислоты. Получают аналогично примеру 9 из N-(2 пиридил)-N-(этоксикарбонилметил)амида 2-[2(4-цианофенил)этил]бензтиазол-5-карбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 95% от теории. С 26 Н 25N5 О 3S (487,58). Значение Rf: 0,20 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=488. Пример 13. Дигидрохлорид N-(2-пиридил)N-(этоксикарбонилметил)амида 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 9 из N-(2 пиридил)-N-(этоксикарбонилметил)амида 2-[N(4-цианофенил)аминометил]бензтиазол-5 карбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 68 % от теории.C25H24N6O3S (488,57). Значение Rf: 0,14 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=489. Пример 14. Дигидрохлорид N-(2-пиридил)N-(гидроксикарбонилметил)амида 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 10 из дигидрохлорида N-(2-пиридил)-N-(этоксикарбонилметил)амида 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты и натриевой щелочи. Выход: 90% от теории.N-Фенил-N-(2-этоксикарбонилэтил) амид 2-[N-(4-цианофенил)-N-метиламинометил] бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 9 е из 4 циано-N-метиланилина и N-фенил-N-(2-этоксикарбонилэтил)амида 2-метоксиметилбензтиазол-5-карбоновой кислоты. Выход: 57% от теории. Значение Rf: 0,46 (силикагель; дихлорметан/этанол=19:1).b) Гидрохлорид N-фенил-N-(2-этоксикарбонилэтил)амида 2-[N-(4-амидинофенил)-Nметил-аминометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 9 из Nфенил-N-(2-этоксикарбонилэтил)амида 2-[N-(4 цианофенил)-N-метиламинометил]бензтиазол-5 карбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 73% от теории. С 28 Н 29N5 О 3S (515,64). Значение Rf: 0,29 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=516. Пример 16. Гидрохлорид N-фенил-N-(2 гидроксикарбонилэтил)амида 2-[N-(4-амидинофенил)-N-метиламинометил]бензтиазол-5 карбоновой кислоты. Получают аналогично примеру 10 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 2-[N-(4-амидинофенил)-N-метиламинометил]бензтиазол-5-карбоновой кислоты и натриевой щелочи. Выход: 96% от теории. С 26 Н 25N5 О 3S (487,58). Значение Rf: 0,48 [Merck RP-8 ; метанол/(5%-ный водный хлорид натрия)=6:4].(M+2Na)=266,5. Пример 17. Гидрохлорид N-фенил-N-(2 этоксикарбонилэтил)амида 2-[(4-амидинофенил)тиометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 9 из Nфенил-N-(2-этоксикарбонилэтил)амида 2-[N-(4 цианофенил)тиометил]бензтиазол-5-карбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 61% от теории. С 27 Н 26N4 О 3S2 (518,66). Значение Rf: 0,27 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=519. Пример 18. Гидрохлорид N-фенил-N-(2 гидроксикарбонилэтил)амида 2-[(4-амидинофе 003697 26 нил)тиометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 10 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 2-[(4-амидинофенил)тиометил]бензтиазол-5-карбоновой кислоты и натриевой щелочи. Выход: 95% от теории. С 25 Н 22N4 О 3S2 (490,61). Значение Rf: 0,25 [Merck RP-8; метанол/(5%-ный водный хлорид натрия)=6:4]. ЕКА - масс-спектр: (М+Н)+=491, (М+Na)+= 513. Пример 19. Гидрохлорид N-фенил-N(этоксикарбонилметил)амида 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-илкарбоновой кислоты. Получают аналогично примеру 9 из Nфенил-N-(этоксикарбонилметил)амида 2-[N-(4 цианофенил)аминометил]бензтиазол-5-карбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 82% от теории. С 26 Н 25N5 О 3S (487,58). Значение Rf: 0,21 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=488. Пример 20. Гидрохлорид N-фенил-N(гидроксикарбонилметил)амида 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 10 из гидрохлорида N-фенил-N-(этоксикарбонилметил) амида 2-[N-(4-амидинофенил)аминометил] бензтиазол-5-карбоновой кислоты и натриевой щелочи. Выход: 75% от теории.(М+Na) =482. Пример 21. Гидрохлорид N-фенил-N-(2-этоксикарбонилэтил)амида 2-[2-(4-амидинофенил)этил]бензтиазол-5-илкарбоновой кислоты. Получают аналогично примеру 9 из Nфенил-N-(2-этоксикарбонилэтил)амида 2-[2-(4 цианофенил)этил]бензтиазол-5-илкарбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 80% от теории. С 28 Н 28N4O3S (500,62). Значение Rf: 0,30 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=501. Пример 22. Гидрохлорид N-фенил-N-(2 гидроксикарбонилэтил)амида 2-[2-(4-амидинофенил)этил]бензтиазол-5-карбоновой кислоты. 27 Получают аналогично примеру 10 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 2-[2-(4-амидинофенил)этил]бензтиазол-5 карбоновой кислоты и натриевой щелочи. Выход: 77% от теории. С 26 Н 24N4 О 3S (472,57). Значение Rf: 0,18 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=473, (М+Na)+= 495, (M+H+Na)=259. Пример 23. Гидрохлорид N-(н-пропил)-N(2-этоксикарбонилэтил)амида 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 9 из N-(нпропил)-N-(2-этоксикарбонилэтил)амида 2-[N(4-цианофенил)аминометил]бензтиазол-5 карбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 83% от теории. С 24 Н 29N5 О 3S (467,59). Значение Rf: 0,31 (силикагель; дихлорметан/этанол=4:1+несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=468, (2 М+Н)+= 935. Пример 24. Гидрохлорид N-(н-пропил)-N(2-гидроксикарбонилэтил)амида 2-[N-(4-амидинофенил)аминометил]бензтиазол-5-карбоновой кислоты. Получают аналогично примеру 10 из гидрохлорида N-(н-пропил)-N-(2-этоксикарбонилэтил)амида 2-[N-(4-амидинофенил)аминометил] бензтиазол-5-карбоновой кислоты и натриевой щелочи. Выход: 75% от теории.Na) =231,6. Пример 25. Гидрохлорид N-фенил-N-(2 этоксикарбонилэтил)амида 1-метил-2-[N-(4 амидинофенил)аминометил]-бензимидазол-5 карбоновой кислоты. а) N-Фенил-N-(2-этоксикарбоксиэтил)амид 4-метиламино-3-нитробензойной кислоты. К раствору 24,7 г (0,115 моль) хлорангидрида 4-метиламино-3-нитробензойной кислоты и 22,3 г (0,115 моль) N-(2-этоксикарбонил) анилина в 300 мл тетрагидрофурана при перемешивании прикалывают 13,1 г (0,13 моль) триэтиламина в течение 15 мин при комнатной температуре. После 2-часового перемешивания растворитель отгоняют на водоструйном насосе, и к остатку при перемешивании прибавляют 700 мл воды. Смесь экстрагируют 3 раза дихлорметаном, каждый раз по 200 мл, органический экстракт промывают 200 мл 2N соляной кислоты и 2 раза водой, каждый раз по 300 мл, и сушат над 28 сульфатом натрия. Затем растворитель отгоняют, и полученный таким образом сырой маслянистый продукт очищают с помощью колоночной хроматографии (1 кг силикагеля; элюент: петролейный эфир/этилацетат=2:1). Выход: 35,0 г ( 82% от теории). Значение Rf: 0,28 (силикагель; дихлорметан/этанол=50:1).N-Фенил-N-(2-этоксикарбонилэтил) амид 3-амино-4-метиламинобензойной кислоты. 12,1 г (0,0326 моль) N-фенил-N-(2-этоксикарбонилэтил)амида 4-метиламино-3-нитробензойной кислоты в 300 мл этанола и 150 мл дихлорметана после добавления примерно 4 г палладия на угле (10%) гидрируют при комнатной температуре и давлении водорода 5 бар. Затем катализатор отфильтровывают, и фильтрат упаривают. Полученный таким образом сырой продукт подвергают дальнейшему превращению без дополнительной очистки. Выход: 10,6 г (95% от теории). Значение Rf: 0,19 (силикагель; дихлорметан/этанол=50:1).c) N-фенил-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-карбоновой кислоты. 6,17 г (0,035 моль) N-(4-цианофенил) глицина и 5,68 г (0,035 моль) N,N'-карбонилдиимидазола в 300 мл тетрагидрофурана нагревают в течение 30 мин до кипения, затем добавляют 10,6 г (0,032 моль) N-фенил-N-(2 этоксикарбонилэтил)амида 3-амино-4-метиламинобензойной кислоты и нагревают еще 5 ч при кипении с обратным холодильником. Затем растворитель отгоняют в вакууме, остаток растворяют в 150 мл ледяной уксусной кислоты и нагревают 1 ч при кипении с обратным холодильником. Затем уксусную кислоту удаляют в вакууме, остаток растворяют примерно в 300 мл дихлорметана, раствор дважды промывают водой, каждый раз по 150 мл, и затем сушат над сульфатом натрия. После упаривания растворителя полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (800 г силикагеля; элюент: дихлорметан с добавкой 1-2% этанола). Выход: 8,5 г ( 57% от теории). Значение Rf: 0,51 (силикагель; дихлорметан/этанол=19:1).d) Гидрохлорид N-фенил-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. 1,2 г (2,49 мМоль) N-фенил-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-цианофенил)аминометил]бензимидаазол-5-карбоновой кислоты в 100 мл насыщенного этанольного раствора соляной кислоты перемешивают 6 ч при комнатной температуре. Затем упаривают в вакууме досуха, остаток растворяют в 100 мл этанола, добавляют 2,5 г (26 мМоль) карбоната аммония и перемешивают до следующего дня 29 при комнатной температуре. После отгонки растворителя полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (100 г силикагеля; элюент: дихлорметан/этанол=4:1). При упаривании элюата получают целевой продукт в виде белого аморфного вещества. Выход: 1,10 г (83 % от теории). Значение Rf: 0,18 (силикагель; дихлорметан/этанол=4:1). С 28 Н 30N6 О 3HCl (498,6). ЕКА - масс-спектр: (М+Н)+=499, (М+ 2 Н)=250, (M+H+Na)=261. Пример 26. N-фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты. Смесь 300 мг (0,56 мМоль) гидрохлоридаN-фенил-N-(2-этоксикарбонилэтил)амида 1 метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-карбоновой кислоты, 15 мл этанола, 4 мл воды и 120 мг (3,0 мМоль) гидроксида натрия перемешивают 2 ч при комнатной температуре. Затем разбавляют примерно 20 мл воды, и с помощью ледяной уксусной кислоты устанавливают слабокислую среду. Выкристаллизовывающийся при этом продукт отсасывают,промывают водой и сушат в вакууме при 60 С. Выход: 250 мг (95% от теории). С 26 Н 26N6 О 3 (470,5). ЕКА масс-спектр:a) N-(н-пропил)-N-(2-этоксикарбонилэтил) амид 4-метиламино-3-хлорацетамидобензойной кислоты. Раствор 1,8 г (5,9 мМоль) N-(н-пропил)-N(2-этоксикарбонилэтил)амида 3-амино-4-метиламинобензойной кислоты [получение происходит аналогично N-фенил-N-(2-этоксикарбонилэтил)амиду 3-амино-4-этиламинобензойной кислоты], 1,1 г (6,8 мМоль) N,N'карбонилдиимидазола и 0,65 г (6,9 мМоль) в 75 мл тетрагидрофурана перемешивают 1 ч при комнатной температуре. Затем растворитель отгоняют в вакууме, и сырой продукт очищают с помощью колоночной хроматографии (силикагель; дихлорметан/ этанол=49:1). Выход: 1,7 г (77% от теории) желтого масла. Значение Rf: 0,58 (силикагель; этилацетат/этанол/аммиак=90:10:1). 30 сусной кислоты нагревают 30 мин при 100 С. Затем растворитель отгоняют, сырой продукт растворяют в 40 мл смеси метиленхлорид/этанол (9:1) и промывают 20 мл насыщенного раствора бикарбоната натрия. Органический слой сушат над сульфатом натрия и упаривают. Выход: 1,5 г (100% от теории) коричневого масла. Значение Rf: 0,63 (силикагель; этилацетат/этанол/аммиак=90:10:1). с) N-(н-пропил)-N-(2-этоксикарбонилэтил) амид 1-метил-2-[(4-цианофенил)тиометил]бензимидазол-5-карбоновой кислоты. Смесь 1,5 г (4,1 мМоль) N-(н-пропил)-N(2-этоксикарбонилэтил)амида 2-хлорметил-1 метил-бензимидазол-5-ил-карбоновой кислоты и 0,65 г (4,8 мМоль) п-цианотиофенола в 10 мл диметилформамида и 10 мл диизопропилэтиламина нагревают 1 ч при 100 С. Растворитель отгоняют в вакууме, сырой продукт растворяют в 30 мл этилацетата, промывают 30 мл воды и после концентрирования очищают с помощью колоночной хроматографии (силикагель; дихлорметан/этанол в соотношении от 49:1 до 19:1). Выход: 1,5 г (79% от теории) коричневого масла. Значение Rf: 0,65 (силикагель; этилацетат/этанол/аммиак=90:10:1).N-(н-пропил)-N-(2 этоксикарбонилэтил)амида 1-метил-2-[(4-амидинофенил)тиометил]бензимидазол-5-карбоновой кислоты. 1,4 г (3,01 мМоль) N-(н-пропил)-N-(2 этоксикарбонилэтил)амида 1-метил-2-[(4-цианофенил)тиометил]бензимидазол-5-илкарбоновой кислоты в 50 мл насыщенного хлористым водородом этанола перемешивают 5 ч при 0 С, а затем при комнатной температуре до тех пор,пока методом тонкослойной хроматографии не перестанет обнаруживаться исходное вещество. Затем растворитель отгоняют при максимальной температуре в бане 30 С, маслообразный остаток обрабатывают 40 мл абсолютного этанола и добавляют 2,8 карбоната аммония. Через 18 ч растворитель отгоняют в вакууме, и сырой продукт очищают с помощью колоночной хроматофафии (силикагель; дихлорметан/этанол в соотношении от 19:1 до 4:1). Выход: 1,3 г (83% от теории) в виде светло-бежевого вещества. Значение Rf: 0,29 (силикагель; этилацетат/ этанол/аммиак=50:45:5). С 25 Н 31N6 О 3S (481,62). ЕКА - масс-спектр: (М+Н)+=482. Пример 28. Гидрохлорид N-(н-пропил)-N(2-гидроксикарбонилэтил)амида 1-метил-2-[(4 амидинофенил)тиометил]бензимидазол-5 карбоновой кислоты. 0,52 г (1,0 мМоль) гидрохлорида N-(нпропил)-N-(2-этоксикарбонилэтил)амида 1 31 метил-2-[(4-амидинофенил)тиометил]бензимидазол-5-карбоновой кислоты растворяют в 15 мл этанола, добавляют 5 мл 2N натриевой щелочи и перемешивают 2 ч при комнатной температуре. Затем добавляют 5 мл воды, спирт отгоняют и подкисляют концентрированной соляной кислотой. Воду отгоняют в вакууме, сырой продукт обрабатывают 5 мл этанола и отфильтровывают не растворившийся хлорид натрия. После отгонки растворителя остается вышеназванное соединение в виде белого вещества. Выход: 0,43 г (88% от теории). Значение Rf: 0,19 (силикагель; этилацетат/этанол/аммиак=50:45:5). С 23 Н 27N5 О 3S (453,57). ЕКА - масс-спектр: (М+Н)+=454, (M+Na)+= 476. Пример 29. Гидрохлорид N-(2-метилпропил)-N-(2-этоксикарбонилэтил)амида 1-метил-2[(4-амидинофенил)тиометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 27 из N-(2 метилпропил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[(4-цианофенил)тиометил]бензимидазол-5-илкарбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 83% от теории. C25H31N6O3S(495,65). Значение Rf: 0,30 (силикагель; этилацетат/этанол/аммиак=50:45:5). ЕКА - масс-спектр: (М+Н)+=496. Пример 30. Гидрохлорид N-фенил-N-(2 этоксикарбонилэтил)амида 1-метил-2-[(4-амидинофенил)тиометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 27 из Nфенил-N-(2-этоксикарбонилэтил)амида 1-метил 2-[(4-цианофенил)тиометил]бензимидазол-5 илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 90% от теории. С 28 Н 29N5 О 3S (515,64). Значение Rf: 0,24 (силикагель; этилацетат/ этанол/аммиак=50:45:5). ЕКА - масс-спектр: (М+Н)+=516, (M+H+Na) =269,7. Пример 31. Гидрохлорид N-фенил-N-(2 гидроксикарбонилэтил)амида 1-метил-2-[(4 амидинофенил)тиометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 28 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 1-метил-2-[(4-амидинофенил)тиометил] бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 76% от теории.N-(1-Метилпиперидинин-4-ил)-Nметиламид 4-хлор-3-нитробензолсульфокислоты. К раствору 2,2 мл (15 мМоль) 1-метил-4 метиламинопиперидина в 60 мл пиридина при охлаждении льдом порциями добавляют 3,8 г(15 мМоль) 4-хлор-3-нитробензолсульфохлорида. Затем перемешивают еще два часа при охлаждении, после этого упаривают досуха,остаток обрабатывают 50 мл воды, и при сильном перемешивании добавляют концентрированный аммиак до щелочной реакции. Выпавший сырой продукт отсасывают и очищают с помощью колоночной хроматографии (250 г силикагеля, элюент: дихлорметан с добавкой 1,5% этанола). Выход: 1,6 г (31% от теории). С 13 Н 18 СlN3O4S (347,8). Значение Rf: 0,19 (силикагель; дихлорметан/этанол=19:1).N-Метил-N-(1-метилпиперидин-4-ил) амид 4-метиламино-3-нитробензолсульфокислоты. 1,6 г (4,6 мМоль) N-мeтил-N-(1 мeтилпипepидинин-4-ил)aмидa 4-хлор-3-нитробензолсульфокислоты и 30 мл 40%-ного раствора метиламина перемешивают в закрытой колбе 4 ч при комнатной температуре. Затем разбавляют примерно 40 мл воды, выпавший продукт отсасывают, промывают водой и сушат. Выход: 1,5 г (95% от теории).N-(1-Метилпиперидинин-4-ил)-Nметиламид 3-амино-4-метиламинобензолсульфокислоты. 1,5 г (4,4 мМоль) N-метил-N-(1-метилпиперидинин-4-ил)амида 4-метиламино-3-нитробензолсульфокислоты растворяют в 100 мл метанола, и гидрируют каталитически (10% палладий на угле) при комнатной температуре и давлении 5 бар. Затем катализатор отфильтровывают и фильтрат упаривают. Полученный таким образом маслянистый продукт без очистки подвергают дальнейшему превращению. Выход: 1,4 г (100% от теории).N-(1-метилпиперидинин-4-ил)-N-метиламида 3-амино-4-метиламинобензолсульфокислоты и кипятят еще 8 ч. Затем упаривают и полученное таким образом маслянистый остаток нагревают с 30 мл ледяной уксусной кислоты с обратным холодильником при кипении. Уксусную кислоту (полученный раствор) фильтруют, остаток обрабатывают примерно 30 мл воды, подщелачивают концентрированным аммиаком, и раствор экстрагируют 3 раза дихлорметаном, каждый раз по 20 мл. Органические вытяжки сушат и упаривают. Полученный таким образом продукт без очистки подвергают дальнейшему превращению. Выход: 400 мг (39% от теории). С 23 Н 27N5O3S (4533,6). Значение Rf: 0,37 (силикагель; дихлорметан/этанол=4:1). е) Гидрохлорид N-метил-N-(1-метилпиперидинин-4-ил)амида 1-метил-2-[(4-амидинофенил)оксиметил]бензимидазол-5-илсульфоновой кислоты. Получают аналогично примеру 25d из Nметил-N-(1-метилпиперидинин-4-ил)амида 1 метил-2-[(4-цианофенил)оксиметил]бензимидазол-5-илсульфоновой кислоты с этанольным раствором соляной кислоты и карбонатом аммония. Выход: 370 мг ( 83% от теории). С 23 Н 30N6 О 3S (470,6). ЕКА - масс-спектр: (М+Н)+=471, (M+ 2H)=236. Пример 33. Гидрохлорид N-метил-Nфениламида 1-метил-2-[(4-амидинофенил)оксиметил]бензимидазол-5-илсульфоновой кислоты. Получают аналогично примеру 32 из Nметил-N-фениламида 1-метил-2-[(4-цианофенил)оксиметил]бензимидазол-5-илсульфоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 46% от теории.(М+Н+метанол) =482, (М+2 Н) =223. Пример 34. Гидрохлорид N-(3-этоксикарбонил-н-пропил)-N-фениламида 1-метил-2-[(4 амидинофенил)оксиметил]бензимидазол-5 илсульфоновой кислоты. Получают аналогично примеру 32 из N-(3 этоксикарбонил-н-пропил)-N-фениламида 1 метил-2-[(4-цианофенил)оксиметил]бензимидазол-5-илсульфоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 57% от теории. С 28 Н 31N5 О 3S (549,7). ЕКА - масс-спектр: (М+Н)+=550. Пример 35. Гидрохлорид пирролидида 1 метил-2-[(3-амидинофенил)оксиметил]бензимидазол-5-илсульфоновой кислоты. Получают аналогично примеру 32 из пирролидида 1-метил-2-[(3-цианофенил)оксиметил] 34 бензимидазол-5-илсульфоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 71% от теории.C20N23N5O3S (413,5). ЕКА - масс-спектр: (М+Н)+=414. Пример 36. Дигидрохлорид N-(3-метоксикарбонилпропил)-N-фениламида 1-метил-2-[2(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(3-трет-бутилоксикарбонилпропил)-N-фениламида 1-метил-2-[2-(4-цианофенил)этил]бензимидазол-5-илкарбоновой кислоты, метанольного раствора соляной кислоты, метанола и карбоната аммония. Выход: 83,5% от теории. Значение Rf: 0,17 (силикагель; дихлорметан/этанол=4:1).C29H31N5O3 (497,6). ЕКА - масс-спектр: (М+Н)+=498,(M+H+Na)=260,7. Пример 37. Гидрохлорид N-(3-гидроксикарбонилпропил)-N-фениламида 1-метил-2-[2(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из дигидрохлорида N-(3-метоксикарбонилпропил)-Nфениламида 1-метил-2-[(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 92% от теории. Значение Rf: 0,09 (силикагель; дихлорметан/этанол=4:1).C28H29N5O3 (483,6). ЕКА - масс-спектр: (М+Н)+=484, (M+Na)+= 506, (M+H+Na)=253,7. Пример 38. Дигидрохлорид N-фенил-N-(3 этоксикарбонилпропил)амида 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. а) N-Фенил-N-(3-трет-бутилоксикарбонилпропил)амид 1-метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25 с из N(4-цианофенил)глицина и N-фенил-N-(3-третбутилоксикарбонилпропил)амида 3-амино-4 метиламинобензойной кислоты. Выход: 65% от теории. Значение Rf: 0,17 (силикагель; дихлорметан/метанол=19:1).b) Дигидрохлорид N-фенил-N-(3-этоксикарбонилпропил)амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-(3-трет-бутилоксикарбонилпропил) амида 1-метил-2-[(4-цианофенил)аминометил] бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония.Na) =268. Пример 39. Гидрохлорид N-фенил-N-(3 гидроксикарбонилпропил)амида 1-метил-2-[N(4-амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 26 из дигидродрохлорида 2H) =243, (M+H+Na)=254. Пример 40. Гидрохлорид N-фенил-N(этоксикарбонилметил)амида 1-метил-2-[2-(4 амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(4-цианофенил)глицина и N-фенил-N-(этилоксикарбонилметил)амида 1-метил-2-[2-(4-цианофенил)этил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты,этанола и карбоната аммония. Выход: 73% от теории. Значение Rf: 0,15 (силикагель; дихлорметан/этанол=4:1). С 28H29N5 О 3 (483,6). ЕКА - масс-спектр: (М+Н)+=484, (M+H+Na) =253,7. Пример 41. Гидрохлорид N-фенил-N(гидроксикарбонилметил)амида 1-метил-2-[2-(4 амидинофенил)этил]-бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-фенил-N-(этоксикарбонилметил) амида 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 97% от теории. С 26 Н 25N5O3 (455,5). ЕКА - масс-спектр: (М+Н)+=456, (M+Na)+= 478, (M+2Na)=250,6. Пример 42. Гидрохлорид N-фенил-N(этоксикарбонилметил)амида 1-метил-2-[(4-амидинофенил)оксиметил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-(этоксикарбонилметил)амида 1-метил 2-[(4-цианофенил)оксиметил]бензимидазол-5 ил-карбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 76% от теории. Значение Rf: 0,17 (силикагель; дихлорметан/этанол=4:1).Na) =254,7. Пример 43. Гидрохлорид N-фенил-N(гидроксикарбонилметил)амида 1-метил-2-[(4 амидинофенил)оксиметил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-фенил-N-(этоксикарбонилметил) амида 1-метил-2-[(4-амидинофенил)оксиметил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 58% от теории,С 25 Н 23N5O4 (457,5). ЕКА - масс-спектр: (М+Н)+=458, (M+Na)+= 480, (M+2Na)=251,6. Пример 44. Гидрохлорид N-фенил-N(этоксикарбонилметил)амида 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-(этоксикарбонилметил)амида 1-метил 2-[N-(4-цианофенил)аминометил]бензимидазол 5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 74% от теории. Значение Rf: 0,12 (силикагель; дихлорметан/этанол=4:1). С 27 Н 28N6 О 3 (484,6). ЕКА - масс-спектр: (М+Н)+=485, (M+H+Na) =254. Пример 45. Гидрохлорид N-фенил-N(гидроксикарбонилметил)амида 1-метил-2-[N(4-амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-фенил-N(этоксикарбонилметил)амида 1-метил-2-[(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 84% от теории. С 25 Н 24N6 О 3 (456,5). ЕКА - масс-спектр: (М+Н)+=457, (M+Na)+= 479, (M+2Na)=251. Пример 46. Гидрохлорид N-(4-пиримидил)-N-(2-этоксикарбонилэтил)амида 1-метил-2[(4-амидинофенил)оксиметил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 25d из N(4-пиримидил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[(4-цианофенил)оксиметил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 14% от теории. С 26 Н 27N7O4 (501,6). ЕКА - масс-спектр: (М+Н)+=502. Пример 47. Дигидрохлорид N-(2-пиридил)N-(этоксикарбонилметил)амида 1-метил-2-[(4 амидинофенил)оксиметил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(этоксикарбонилметил)амида 1 37 метил-2-[(4-цианофенил)оксиметил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 44% от теории. Значение Rf: 0,12 (силикагель; дихлорметан/этанол=4:1).(M+2H) =244, (M+H+Na) =255. Пример 48. Гидрохлорид N-(2-пиридил)-N(гидроксикарбонилметил)амида 1-метил-2-[(4 амидинофенил)оксиметил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из дигидрохлорида N-(2-пиридил)-N-(этоксикарбонилметил)амида 1-метил-2-[(4-амидинофенил) оксиметил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 85% от теории.a) N-(2-Пиридил)-N-(этоксикарбонилметил)амид 1-метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25 с из N(4-цианофенил)глицина и N-(2-пиридил)-Nэтоксикарбонилметиламида 3-амино-4-метиламинобензойной кислоты. Выход: 24% от теории. Значение Rf: 0,56 (силикагель; дихлорметан/метанол=4:1).N-(2-пиpидил)-N(этoкcикapбoнилмeтил)aмидa 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5-ил карбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(этоксикарбонилметил)амида 1 метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 70% от теории. Значение Rf: 0,16 (силикагель; дихлорметан/этанол=4:1). С 26 Н 27N7O3 (485,6). ЕКА - масс-спектр: (M+H)+=486, (М+2H)=243,7, (M+H+Na)=254,6. Пример 50. Гидрохлорид N-(2-пиридил)-N(гидроксикарбонилметил)амида 1-метил-2-[N(4-амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 26 из дигидрохлорида N-(2-пиридил)-N-(этоксикарбонилметил)амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. 38 Выход: 91% от теории. С 24 Н 23N7 О 3 (457,5). ЕКА - масс-спектр: (М+Н)+=458, (M+Na)+= 480, (M+2Na)=251,7. Пример 51. Дигидрохлорид N-(2-пиридил)N-(этоксикарбонилметил)амида 1-метил-2-[2-(4 амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(этоксикарбонилметил)амида 1 метил-2-[2-(4-цианофенил)этил]бензимидазол 5-илкарбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 90% от теории. Значение Rf: 0,17 (силикагель; дихлорметан/этанол=4:1). С 27 Н 28N6O3 (484,6). ЕКА масс-спектр:(M+2H) =243, (M+H+Na) =254. Пример 52. Гидрохлорид N-(2-пиридил)-N(2-гидроксикарбонилметил)амида 1-метил-2-[2(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из дигидрохлорида N-(2-пиридил)-N-(этоксикарбонилметил)амида 1-метил-2-[2-(4-амидинофенил) этил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 89% от теории. С 25 Н 24N6 О 3 (456,5). ЕКА масс-спектр:(M+Na) =479. Пример 53. Гидрохлорид N-фенил-N-(2 метоксикарбонилэтил)амида 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-(2-этоксикарбонилэтил)амида 1-метил 2-[N-(4-цианофенил)аминометил]бензимидазол 5-илкарбоновой кислоты и метанольного раствора соляной кислоты, метанола и карбоната аммония. Выход: 87% от теории. Значение Rf: 0,11 (силикагель; дихлорметан/этанол=4:1). С 27 Н 28N6 О 3 (484,6). ЕКА - масс-спектр: (М+Н)+=485, (М+ 2H) =243, (M+H+Na)=254. Пример 54. Гидрохлорид N-фенил-N-(2 этоксикарбонилэтил)амида 1-метил-2-[(4-амидинофенил)оксиметил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-(2-этоксикарбонилэтил)амида 1-метил 2-[(4-цианофенил)оксиметил]бензимидазол-5 илкарбоновой кислоты этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 79,5% от теории. С 28 Н 29N5O4 (499,6). Значение Rf: 0,15 (силикагель; дихлорметан/этанол=4:1).(M+H+Na) =261,7. Пример 55. Гидрохлорид N-фенил-N-(2 гидроксикарбонилэтил)амида 1-метил-2-[(4 амидинофенил)оксиметил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 1-метил-2-[(4-амидинофенил)оксиметил] бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 82% от теории. Значение Rf: 0,11 (силикагель; дихлорметан/этанол=4:1).N-(2-пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[2-(2-цианотиофен-5-ил) этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25 с из 3-(2 цианотиофен-5-ил)пропионовой кислоты и N(2-пиридил)-N-(2-этоксикарбонилэтил)амида 3 амино-4-метиламинобензойной кислоты. Выход: 18% от теории. Значение Rf: 0,66 (силикагель; дихлорметан/метанол=9:1).N-(2-пиpидил)-N-(2 этoкcикapбoнилэтил)aмидa 1-метил-2-[2-(2-амидинотиофен-5-ил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из гидрохлорида N-(2-пиpидил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[2-(2-цианотиофен-5-ил) этил] бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 53% от теории. С 26 Н 28N6 О 3S (504,6). Значение Rf: 0,22 (силикагель; дихлорметан/метанол=5:1). ЕКА - масс-спектр: (М+Н)+=505, (M+H+Na) =264. Пример 57. N-(2-Пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[2-(2-амидинотиофен-5-ил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[2-(2-амидинотиофен-5 ил)этил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 98% от теории. С 24 Н 24N6 О 3S (476,6). ЕКА масс-спектр:N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-цианофенил) аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25 с из N(4-цианофенил)глицина и N-(2-пиридил)-N-(2 этоксикарбонилэтил)амида 3-амино-4-метиламинобензойной кислоты. Выход: 61% от теории. Значение Rf: 0,62 (силикагель; дихлорметан/метанол=19:1).N-(2-пиридил)-N-(2 этоксикарбонилэтил)амида 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1 метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 71% от теории. С 27H29N7 О 3 (499,6). Значение Rf: 0,28 (силикагель; дихлорметан/этанол=5:1). ЕКА - масс-спектр: (М+Н)+=500, (M+H+Na) =261,8, (M+2H)=250,8. Пример 59. N-(2-Пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 91% от теории. С 25 Н 25N7 О 3 (471,5). ЕКА - масс-спектр: (М+Н)+=472, (M+H+N-(2-пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[2-(4-цианофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 149 а из 3(4-цианофенил)пропионовой кислоты и N-(2 пиридил)-N-(2-этоксикарбонилэтил)амида 3 амино-4-метиламинобензойной кислоты. Выход: 22% от теории. Значение Rf: 0,68 (силикагель; дихлорметан/метанол=19:1).N-(2-пиридил)-N-(2 этоксикарбонилэтил)амида 1-метил-2-[2-(4 амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1 метил-2-[2-(4-цианофенил)этил]бензимидазол 41 5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 85% от теории. С 28 Н 30N6 О 3 (498,6). Значение Rf: 0,30 (силикагель; дихлорметан/метанол=5:1). ЕКА масс-спектр:(M+H+Na) =261. Пример 61. N-(2-Пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[2-(4-амидинофенил)этил] бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 97% от теории. С 26 Н 26N6 О 3 (470,5). ЕКА - масс-спектр: (М+Н)+=472, (M+H+Na) =247, (М+Na)+=493. Пример 62. Гидрохлорид N-фенил-N-(2 этоксикарбонилэтил)амида 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-(2-этоксикарбонилэтил)амида 1-метил 2-[2-(4-цианофенил)этил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 86% от теории. С 29 Н 31N5 О 3 (497,6). Значение Rf: 0,11 (силикагель; дихлорметан/этанол=4:1). ЕКА масс-спектр:(М+2H) =249,8. Пример 63. Гидрохлорид N-фенил-N-(2 гидроксикарбонилэтил)амида 1-метил-2-[2-(4 амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлоридаNa) =246,6, (М+Na)+=492, (М+2 Н)=235,6. Пример 64. Дигидрохлорид N-(2-пиридил)N-(метоксикарбонилметил)амид 1-метил-2-[N(4-амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(метоксикарбонилметил)амида 1 метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и метанольного раствора соляной кислоты, метанола и карбоната аммония. Выход: 73% от теории. С 25 Н 25N7 О 3 (471,5).Na) =247,8. Пример 65. Гидрохлорид N-(2-пиридил)-N(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(метоксикарбонилэтил)амида 1 метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и метанольного раствора соляной кислоты, метанола и карбоната аммония. Выход: 78% от теории. С 26 Н 27N7 О 3 (485,6). Значение Rf: 0,31 (силикагель; дихлорметан/метанол=5:1). ЕКА - масс-спектр: (М+Н)+=486, (M+H+Na) =254,8. Пример 66. Гидрохлорид N-фенил-N-[2(1 Н-тетразол-5-ил)этил]амида 1-метил-2-[2-(4 амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. а) N-фенил-N-[2-(1 Н-тетразол-5-ил)этил] амид 1-метил-2-[2-(4-цианофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25 с из 3-(4 цианофенил)пропионовой кислоты и N-фенилN-[2-(1 Н-тетразол-5-ил)этил]амида 3-амино-4 метиламинобензойной кислоты. Выход: 67% от теории. ИК - масс-спектры (КВr): характеристические полосы при 3439,5 см-1 (N-Н); 2235,5 см-1b) Гидрохлорид N-фенил-N-[2-(1 Н-тетразол-5-ил)этил]амида 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-[2-(1 Н-тетразол-5-ил)этил]амида 1 метил-2-[2-(4-цианофенил)этил]бензимидазол 5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 92% от теории. С 27 Н 27N9 О 3 (493,6). ЕКА - масс-спектр: (М+Н)+=494, (M+Na)+= 516, (М+2 Н)=258,7. Пример 67. Гидрохлорид N-фенил-N-[2(1 Н-тетразол-5-ил)этил]амида 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-[2-(1 Н-тетразол-5-ил)этил]амида 1 метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 29% от теории. С 36 Н 26N10 О (494,6). ЕКА - масс-спектр: (М+Н)+=495. 43 Пример 68. Гидрохлорид N-(2-пиридил)-N(2-н-гексилоксикарбонилэтил)амида 1-метил-2[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Примерно в 30 мл м-гексанола, насыщенного хлористым водородом, добавляют гидрохлорид N-(2-пиридил)-N-(2-этоксилоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и перемешивают 19 ч при комнатной температуре. Затем гексанол отгоняют в вакууме, к остатку при перемешивании добавляют примерно 5 мл 1N раствора аммиака и вновь упаривают. Полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (силикагель, дихлорметан/метанолN-(2-Пиридил)-N-(2-этоксилоксикарбонилэтил)амид 1-метил-2-[N-(4-цианофенил)N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25 с из N(4-цианофенил)-N-метилглицина и N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 3-амино 4-метиламинобензойной кислоты. Выход: 71% от теории. Значение Rf: 0,66 (силикагель; дихлорметан/метанол=19:1).b) Гидрохлорид N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил] бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1 метил-2-[N-(4-цианофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 77% от теории. С 28 Н 31N7 О 3 (513,6). Значение Rf: 0,12 (силикагель; дихлорметан/этанол=4:1). ЕКА масс-спектр:(M+H+Na) =268,7. Пример 70. N-(2-Пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-(2-пиридил)-N(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4 амидинофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. 44 Выход: 66% от теории. С 26 Н 27N7 О 3 (485,6). Значение Rf: 0,12 (силикагель; дихлорметан/этанол=4:1). ЕКА - масс-спектр: (М+Н)+=486, (M+Na)+= 508, (M+2Na)=265,6. Пример 71. Гидрохлорид N-циклопентилN-(2-этоксикарбонилэтил)амида 1-метил-2-[2(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nциклопентил-N-(2-этоксилоксикарбонилэтил) амида 1-метил-2-[2-(4-цианофенил)этил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 65% от теории. С 28 Н 35N5 О 3 (489,6). Значение Rf: 0,12 (силикагель; дихлорметан/этанол=4:1). ЕКА - масс-спектр: (М+Н)+=490. Пример 72. N-Циклопентил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[2-(4-амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналгично примеру 26 из гидрохлорида N-циклопентил-N-(2-этоксикарбонилэтил)амида 1-метил-2-[2-(4-амидинофенил)этил] бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 89% от теории. С 26 Н 31N5 О 3 (461,6). ЕКА - масс-спектр: (М+Н)+=462, (M+H+Na) =242,6, (M+Na)+=484, (М+2 Н)=231,6. Пример 73. Гидрохлорид N-циклопентилN-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из Nциклопентил-N-(2-этоксикарбонилэтил)амида 1 метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 60% от теории. С 27 Н 34N6 О 3 (490,6). ЕКА - масс-спектр: (М+Н)+=491. Пример 74. N-Циклопентил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналгично примеру 26 из гидрохлорида N-циклопентил-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 45% от теории. С 25 Н 30N3O4 (462,6). ЕКА - масс-спектр: (М+Н)+=463, (M+H+Na) =243, (M+Na)+=485, (M+2Na)=254. Пример 75. Гидрохлорид N-(2-пиридил)-N(этоксикарбонилметил)амида 1-метил-2-[N-(4 45 амидинофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(этоксикарбонилметил)амида 1 метил-2-[N-(4-цианофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 54% от теории. С 27H29N7O3 (499,6). ЕКА - масс-спектр: (М+Н)+=500, (М+ 2H) =250,7. Пример 76. N-(2-Пиридил)-N-(гидроксикарбонилметил)амид 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5 илкарбоновой кислоты. Получают аналгично примеру 26 из гидрохлорида N-(2-пиридил)-N-(этоксикарбонилметил)амида 1-метил-2-[N-(4-амидинофенил)-Nметиламинометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 68% от теории. С 25 Н 25N7O3 (471,5). ЕКА - масс-спектр: (М+Н)+=472, (M+Na)+= 494, (M+2Na)=258,6. Пример 77. Гидрохлорид N-(3-пиридил)-N(2-этоксикарбонилэтил)амид 1-метил-2-[2-(4 амидинофенил)этил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(3-пиридил)-N-(2-этоксикарбонилэтил)амида 1 метил-2-[2-(4-цианофенил)этил]бензимидазол 5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 91% от теории. С 28 Н 30N6 О 3 (498,6). Значение Rf: 0,19 (силикагель; дихлорметан/этанол=4:1). ЕКА - масс-спектр: (М+Н)+=499. Пример 78. Дигидрохлорид N-(3-пиридил)N-(2-этоксикарбонилэтил)амида 1-метил-2-[N(4-амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 25d из N(3-пиридил)-N-(2-этоксикарбонилэтил)амида 1 метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 86% от теории. С 27 Н 29N7O3 (499,6). Значение Rf: 0,09 (силикагель; дихлорметан/этанол=4:1). ЕКА - масс-спектр: (М+Н)+=500. Пример 79. N-(3-Пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из дигидрохлорида 2 Н) =236,6, (M+2Na)=258,6. Пример 80. Гидрохлорид N-(3-пиридил)-N(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4 амидинофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(3-пиридил)-N-(2-этоксикарбонилэтил)амида 1 метил-2-[N-(4-цианофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты и этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 64% от теории. С 28 Н 31N7O3 (513,6). ЕКА - масс-спектр: (М+Н)+=514. Пример 81. N-(3-Пиридил)-N-(2-гидроксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-(3-пиридил)-N-(2-этоксикарбонилэтил)амида 1-мeтил-2-[N-(4-aмидинoфeнил)-Nмeтилaминoметил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 70% от теории. С 26 Н 27N7O3 (485,6). ЕКА - масс-спектр: (М+Н)+=486, (M+Na)+= 508, (M+2Na)=265,6. Пример 82. Гидрохлорид N-фенил-N-(2 этоксикарбонилэтил)амида 1-метил-2-[N-(4 амидинофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты.b) Гидрохлорид N-фенил-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 25d из Nфенил-N-(2-этоксикарбонилэтил)амида 1-метил 2-[N-(4-цианофенил)-N-метиламинометил] бензимидазол-5-илкарбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 74% от теории. С 29 Н 32N6 О 3 (512,6). ЕКА - масс-спектр: (М+Н)+=513, (M+H+Na) =268, (М+2H)=257. Пример 83. N-Фенил-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофе 47 нил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты и натриевой щелочи. Выход: 80% от теории. С 27H28N6 О 3 (484,6). ЕКА - масс-спектр: (М+Н)+=485, (M+H+Na) =254, (M+Na)+=507, (M+2Na)=265. Пример 84. Гидрохлорид N-(2-пиридил)-N(2-этоксикарбонилэтил)амида 1-этил-2-[N-(4 амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1 этил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 85% от теории. С 28 Н 31N7 О 3 (513,6).Na) =268,6, (М+2 Н)=257,7. Пример 85. N-(2-Пиридил)-N-(2-гидроксикарбонилэтил)амид 1-этил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-этил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и 2N натриевой щелочи. Выход: 49% от теории. С 26 Н 27N7 О 3 (485,6). ЕКА - масс-спектр: (М+Н)+=486, (M+H+Na) =254,6, (М+2 Н)=243,6, (M+2Na)=265,7. Пример 86. Гидрохлорид N-(2-фторфенил)-N-(2-этоксикарбонилэтил)амида 1-метил-2[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(2-фторфенил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 88% от теории.Na) =270, (М+2 Н )+=259. Пример 87. N-(2-Фторфенил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида(M+H+Na) =267, (М+2 Н) =256. Пример 88. Гидрохлорид N-(3-метилфенил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 25d из N(3-метилфенил)-N-(2-этоксикарбонилэтил) амида 1-метил-2-[N-(4-цианофенил)аминометил] бензимидазол-5-илкарбоновой кислоты, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 79% от теории. С 29 Н 32N6 О 3 (512,6).Na) =268. Пример 89. N-(3-Метилфенил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 26 из гидрохлорида N-(3-метилфенил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и натровой щелочи. Выход: 62% от теории.Na) =254, (M+Na)+=507, (M+2Na)=265. Пример 90. N-Фенил-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гексилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. 1,1 г (2,06 мМоль) гидрохлорида N-фенилN-(2-этоксикарбонилэтил)амида 1-метил-2-[N(4-амидинофенил)аминометил]бензимидазол-5 илкарбоновой кислоты растворяют в смеси 40 мл тетрагидрофурана и 10 мл воды, затем добавляют 570 мг (4,12 мМоль) карбоната калия и 362 мг (2,2 мМоль) н-гексилового эфира хлормуравьиной кислоты и перемешивают 2 ч при комнатной температуре. Растворитель отгоняют, к остатку добавляют примерно 50 мл насыщенного раствора поваренной соли, и полученный таким образом раствор экстрагируют 3 раза дихлорметаном, каждый раз по 20 мл. Экстракты сушат над сульфатом натрия и упаривают. Полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (100 г силикагеля; дихлорметан+5% этанола). Выход: 78% от теории. С 35 Н 42N6 О 5 (626,8).Na) =325, (М+2 Н)=314. Пример 91. N-Фенил-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-метоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и метилового эфира хлормуравьиной кислоты. Выход: 41% от теории. С 30 Н 32N6O5 (556,6).Na) =290, (М+Na)+=579. Пример 92. N-Фенил-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-этоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-метоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и этилового эфира хлормуравьиной кислоты. Выход: 62% от теории. С 30 Н 32N6O5 (556,6).(М+Н+Na) =290, (М+2 Н) =279. Пример 93. N-Фенил-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-циклогексилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-метоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и циклогексилового эфира хлормуравьиной кислоты. Выход: 25% от теории. С 34 Н 38N6 О 5 (610,7).(М+2 Н) =306. Пример 94. N-Фенил-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-[4-[N-[2-(метилсульфонил)этилоксикарбонил]амидино]фенил] аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-этоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и 2(метилсульфонил)этилового эфира хлормуравьиной кислоты. Выход: 66% от теории.Na) =336, (M+2H)=325. Пример 95. N-Фенил-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-октилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-метоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и ноктилового эфира хлормуравьиной кислоты. Выход: 41% от теории. С 36 Н 44N6O5 (640,8). 0,43Rf: этанол=19:1). ЕКА - масс-спектр: (М+Н)+=641, (М+Na)+= 663. Пример 96. N-Фенил-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-гидроксиамидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. 1,44 г (3,0 мМоль) N-фенил-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-илкарбоновой кислоты, 0,625 г (9,0 мМоль) гидрохлорида гидроксиламина и 0,425 г (4,0 мМоль) карбоната натрия растворяют в 80 мл этанола и нагревают 7 ч с обратным холодильником. Затем добавляют еще 210 мг гидрохлорида гидроксиламина и 170 мг карбоната натрия, кипятят еще 5 ч и затем упаривают в вакууме. Остаток растворяют примерно в 30 мл дихлорметана, полученный раствор промывают 20 мл воды, органические слои сушат и упаривают. Полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (200 г силикагеля; дихлорметан+4% этанола). Выход: 39% от теории. С 28 Н 30N6O4 (514,6).(M+Na) =537, (2M+H) =1029, (2M+Na)+=1051. Пример 97. N-Фенил-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гептилоксикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-метоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и нгептилового эфира хлормуравьиной кислоты. Выход: 43% от теории. С 35 Н 42N6 О 5 (626,8). 51 Пример 98. N-Фенил-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-бензоиламидино)фенил)аминометил] бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-метоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и хлористого бензоила. Выход: 88% от теории. С 34 Н 32N6O4 (588,7).(д, 2 Н), 7,05-7,55 (м, 12 Н), 8,03 (д, 2 Н), 8,25 (дд,2 Н), 8,98 (с, 1 Н), 10,48 (с, 1 Н). Пример 99. N-Фенил-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гексилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-метоксикарбонилэтил) амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и н-гексилового эфира хлормуравьиной кислоты. Выход: 54% от теории. С 34 Н 40N6O5 (612,7).(силикагель; дихлорметан/ этанол=19:1). ЕКА - масс-спектр: (М+Н)+=613. Пример 100. N-Фенил-N-(2-н-пропилоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гексилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-фенил-N-(2-н-пропилоксикарбонилэтил)амида 1-метил-2-[M-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-гексилового эфира хлормуравьиной кислоты. Выход: 31% от теории. С 36 Н 44N6O5 (640,8).(M+H+Na) =332, (М+Na) =663. Пример 101. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-этоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и этилового эфира хлормуравьиной кислоты. Выход: 72% от теории.Na) =290,8, (М+Na)+=580. Пример 102. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-ноктилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-октилового эфира хлормуравьиной кислоты. Выход: 57% от теории. С 35 Н 43N7 О 5 (641,8).Na) =332,8, (М+Na)+=664. Пример 103. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-метоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и метилового эфира хлормуравьиной кислоты. Выход: 48% от теории. С 29 Н 31N7O5 (557,6).Na) =290,7, (M+Na)+=580. Пример 104. N-(2-Пиридил)-N-(2-гидроксикарбонилэтил)амид 1-метил-2-[N-(4-(N-ноктилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. 0,7 г (1,1 мМоль) N-(2-пиридил)-N-(2 метоксикарбонилэтил)амида 1-метил-2-[N-(4(N-н-октилоксикарбониламидино)фенил) аминометил]бензимидазол-5-илкарбоновой кислоты в смеси 0,12 г (3,0 мМоль) гидроксида натрия, 5 мл воды и 10 мл метанола перемешивают 1 ч при комнатной температуре. Затем разбавляют 20 мл воды, и с помощью ледяной уксусной кислоты устанавливают рН, равный 6. Затем добавляют примерно 5 мл диэтилового эфира и энергично перемешивают в течение 1 ч. Выпавший при этом продукт отсасывают, промывают небольшим количеством воды, затем диэтиловым эфиром и сушат. Выход: 80% от теории. С 34H41N7 О 5 (627,8). ЕКА - масс-спектр: (М+Н)+=628, (М+Н+ 53 Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и 2-(метилсульфонил)этилового эфира хлормуравьиной кислоты. Выход: 65% от теории. С 31 Н 35N7O7S (649,7).Na) =336,6, (M+Na)+=672, (M+2Na)=347,6. Пример 106. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-нбутилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-бутилового эфира хлормуравьиной кислоты. Выход: 30% от теории. С 31 Н 35N7 О 5 (585,7).Na) =304,7, (М+2 Н)=293,7. Пример 107. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-нгексилоксикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-гексилового эфира хлормуравьиной кислоты. Выход: 51% от теории. С 33 Н 39N7 О 5 (613,7).Na) =318,7, (М+2 Н)=307,6. Пример 108. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гептилоксикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-гептилового эфира хлормуравьиной кислоты. Выход: 21% от теории. С 34 Н 41N7 О 5 (627,8). 54 пентилоксикарбониламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-пентилового эфира хлормуравьиной кислоты. Выход: 66% от теории. С 32 Н 37N7 О 5 (599,7). 0,58Na) =311,7, (M+Na)+=622. Пример 110. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-нонилоксикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлоридаNa) =339,8, (M+Na)+=678. Пример 111. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-бензоиламидино)фенил)аминометил]бензимидазол-5 илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида(силикагель; дихлорметан/ метанол=9:1). ЕКА - масс-спектр: (М+Н)+=590, (M+Na)+= 612. Пример 112. N-(2-Пиридил)-N-(2-метоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-никотиноиламидино)фенил)аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-метоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и хлорангидрида никотиновой кислоты. Выход: 40% от теории. С 32 Н 30N8O4 (590,7).Na) =307, (M+Na)+=613. Пример 113. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гекси 55 локсикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-гексилового эфира хлормуравьиной кислоты. Выход: 51% от теории. С 34 Н 41N7O5 (627,8). 0,53Na) =325,7, (М+2 Н)=314,7. Пример 114. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-октилоксикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-октилового эфира хлормуравьиной кислоты. Выход: 57% от теории. С 36 Н 45N7 О 5 (655,8).Na) =339,7, (М+2 Н)=328,7. Пример 115. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-[4-(N-(2-метилсульфонилэтилоксикарбонил)амидино)фенил]аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и 2-(метилсульфонил)этилового эфира хлормуравьиной кислоты. Выход: 72% от теории. С 30 Н 33N7 О 7S (635,7).Na) =329,8. Пример 116. N-(2-Пиридил)-N-метоксикарбонилметиламид 1-метил-2-[N-(4-(N-циклогесилоксикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-метоксикарбонилметиламида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и циклогексилового эфира хлормуравьиной кислоты. Выход: 40% от теории. С 32 Н 35N7 О 5 (597,7).=620. Пример 117. N-(2-Пиридил)-N-этоксикарбонилметиламид 1-метил-2-[N-[4-(N-метоксикарбониламидино)фенил]аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-этоксикарбонилметиламида 1-метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-илкарбоновой кислоты и метилового эфира хлормуравьиной кислоты. Выход: 62% от теории.Na) =283,8, (M+Na)+=566. Пример 118. N-(2-Пиридил)-N-метоксикарбонилметиламид 1-метил-2-[N-[4-(N-этоксикарбониламидино)фенил]аминометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлоридаN-(2-пиридил)-N-метоксикарбонилметиламида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и этилового эфира хлормуравьиной кислоты. Выход: 42% от теории. С 28 Н 29N7 О 5 (543,6).Rf: 0,20 (силикагель; дихлорметан/ этанол= 19:1). ЕКА - масс-спектр: (М+Н)+=544. Пример 119. N-(3-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-ноктилоксикарбониламидино)фенил)аминометил] бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(3-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил) аминометил]бензимидазол-5-илкарбоновой кислоты и н-октилового эфира хлормуравьиной кислоты. Выход: 35% от теории. 2H) =328,7. Пример 120. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-гексилоксикарбониламидино)фенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)-Nметиламинометил]бензимидазол-5-илкарбоновой кислоты и н-гексилового эфира хлормуравьиной кислоты. Выход: 58% от теории. С 35 Н 43N7 О 5 (641,2).Na) =332,7. Пример 121. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-октилоксикарбониламидино)фенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)-Nметиламинометил]бензимидазол-5-илкарбоновой кислоты и н-октилового эфира хлормуравьиной кислоты. Выход: 36% от теории. С 37H47N7 О 5 (669,8).Na) =346,8, (М+2 Н)=335,6. Пример 122. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-н-бутилоксикарбониламидино)фенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)-Nметиламинометил]бензимидазол-5-илкарбоновой кислоты и н-бутилового эфира хлормуравьиной кислоты. Выход: 34% от теории. С 33 Н 39N7 О 5 (613,7). ЕКА - масс-спектр: (М+Н)+=614, (M+H+Na) = 318,7, (M+Na )+=636. Пример 123. N-(2-Пиридил)-N-(2-этоксикарбонилэтил)амид 1-метил-2-[N-(4-(N-бензоиламидино)фенил)-N-метиламинометил]бензимидазол-5-илкарбоновой кислоты. Получают аналогично примеру 90 из гидрохлорида N-(2-пиридил)-N-(2-этоксикарбонилэтил)амида 1-метил-2-[N-(4-амидинофенил)-Nметиламинометил]бензимидазол-5-илкарбоновой кислоты и хлористого бензоила. Выход: 63% от теории. С 35 Н 35N7 О 4 (617,7). ЕКА - масс-спектр: (М+Н)+=618, (M+H+Na) =320,7, (М+Na)+=640. Пример 124. 1-Метил-2-[(4-амидинофенил) оксиметил]бензимидазол-5-ил-(1-этоксикарбонилметилциклогекс-1-ил)кетонгидрохлорид. а) 4-Хлорфенил-(1-гидроксикарбонилметилциклогекс-1-ил)кетон. 8,4 г (40 мМоль) 3-(4-хлорбензоил)пропионовой кислоты растворяют в 300 мл тетрагидрофурана и добавляют порциями 5,8 г (120 мМоль) гидрида натрия (50-60%-ная суспензия в парафиновом масле). Затем нагревают (кипятят) 1,5 ч при перемешивании с обратным холодильником, после чего прикапывают 8,9 мл (60 мМоль) 1,5-дийодпентана и кипятят еще 3 ч. После охлаждения полученный раствор вливают при перемешивании в 200 мл ледяной воды,затем тетрагидрофуран отгоняют в вакууме и полученный таким образом водный раствор 58 подкисляют 2N соляной кислотой и экстрагируют 3 раза дихлорметаном, каждый раз по 150 мл. Органические слои сушат и упаривают, полученный таким образом сырой продукт очищают с помощью колоночной хроматографииb) 4-Хлор-3-нитрофенил-(1-гидроксикарбонилметилциклогекс-1-ил)кетон. 7,0 г (25 мМоль) 4-хлорфенил-(1-гидроксикарбонилметилциклогекс-1-ил)кетона вносят порциями при перемешивании при -5 - -10 С в 80 мл кипящей азотной кислоты. Затем перемешивают еще 10 мин и полученный раствор вливают при перемешивании в 200 мл ледяной воды, выпавший продукт промывают водой и сушат. Выход: 7,8 г (96% от теории).c) 4-Метиламино-3-нитрофенил-(1-гидроксикарбонилметилциклогекс-1-ил)кетон. 7,8 г (23,9 мМоль) 4-хлор-3-нитрофенил(1-гидроксикарбонилметилциклогекс-1-ил) кетона в 100 мл 40%-ного водного раствора метиламина перемешивают 14 ч при комнатной температуре, затем разбавляют примерно 150 мл воды, и подкисляют ледяной уксусной кислотой до слабо кислой среды. Выпавший продукт отсасывают, промывают водой и сушат. Выход: 7,1 г (93% от теории).d) 4-Метиламино-3-нитрофенил-(1-метоксикарбонилметилциклогекс-1-ил)кетон. 4,9 г (15 мМоль) 4-метиламино-3-нитрофенил-(1-гидроксикарбонилметилциклогекс-1-ил) кетона растворяют в 100 мл тетрагидрофурана,добавляют 2,4 г (15 мМоль) 1,1'-карбонилдиимидазола и нагревают 15 мин с обратным холодильником. Затем растворитель упаривают, добавляют 30 мл метанола и кипятят при перемешивании 3 ч. После отгонки метанола полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (250 г силикагеля; элюент: дихлорметан с добавлением от 1 до 5% этанола). Выход: 2,4 г (48% от теории).Rf: 0,76 (силикагель; дихлорметан/этанол= 19:1). е) 3-Амино-4-метиламинофенил-(1-метоксикарбонилметилциклогекс-1-ил)кетон. 2,4 г (7,2 мМоль) 4-метиламино-3 нитрофенил-(1-метоксикарбонилметилцикло 59 гекс-1-ил)кетона в 100 мл метанола гидрируют каталитически (10% палладия на угле) при комнатной температуре и давлении водорода 5 бар. Полученный таким образом сырой продукт без очистки подвергают дальнейшему превращению. Выход: 2,1 г (96% от теории).f) 3-(4-Цианофенилоксиацетиламино)-4 метиламинофенил-(1-метоксикарбонилметилциклогекс-1-ил)кетон. 620 мг (3,5 мМоль) 4-цианофенилоксиуксусной кислоты и 570 мг (3,5 мМоль) 1,1'карбонилдиимидазола в 50 мл тетрагидрофурана нагревают 15 мин с обратным холодильником. Затем добавляют 1,0 г (3,28 мМоль) 3 амино-4-метиламино-(1-метоксикарбонилметилциклогекс-1-ил)кетона и кипятят еще 4 ч. Затем растворитель упаривают, и полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (150 г силикагеля; элюент: дихлорметан с добавлением от 0 до 2% этанола). Выход: 1,4 г (93% от теории). С 26 Н 29N3 О 5 (463,5).g) 1-Метил-2-[(4-цианофенил)оксиметил] бензимидазол-5-ил-(1-метоксикарбонилметилциклогекс-1-ил)кетон. 1,4 г (3,02 мМоль) 3-(4-цианофенилоксиацетиламино)-4-метиламинофенил-(1-метоксикарбонилметилциклогекс-1-ил)кетона в 50 мл ледяной уксусной кислоты нагревают 1 ч с обратным холодильником. Затем уксусную кислоту отгоняют, остаток обрабатывают 20 мл воды,и добавляют концентрированный аммиак до щелочной реакции. Полученный раствор экстрагируют 3 раза дихлорметаном, каждый раз по 20 мл, органические экстракты сушат и упаривают. Полученный таким образом сырой продукт очищают с помощью колоночной хроматографии (100 г силикагеля; элюент: дихлорметан с добавлением от 0 до 2% этанола). Выход: 700 мг (52% от теории). С 26 Н 27N3O4 (445,5).h) 1-Метил-2-[(4-амидинофенил)оксиметил]бензимидазол-5-ил-(1-метоксикарбонилметилциклогекс-1-ил)кетонгидрохлорид. Получают аналогично примеру 25d из 700 мг (1,57 мМоль) 1-метил-2-[(4-цианофенил) оксиметил]бензимидазол-5-ил-(1-метоксикарбонилметилциклогекс-1-ил)кетона с этанольным раствором соляной кислоты и карбонатом аммония. Выход: 390 мг (50% от теории).(кв, 2 Н); 5,60 (с, 2 Н); 7,25-7,40 (м, 3 Н); 7,567,75 (м, 2 Н); 7,90 (д, 2 Н); 9,20 (уш.с, 4 Н) м.д. Пример 125. 1-Метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-трет-бутилкетонгидрохлорид. Получают аналогично примеру 25d из гидрохлорида 1-метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-ил-трет-бутилкетона,этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 59% от теории.C21 Н 25N5 О (363,5). ЕКА - масс-спектр: (М+Н)+=364. Пример 126. 1-Метил-2-[N-(4-амидинофенил)аминометил]бензимидазол-5-ил-(1-метилциклопент-1-ил)кетонгидрохлорид. Получают аналогично примеру 25d из гидрохлорида 1-метил-2-[N-(4-цианофенил)аминометил]бензимидазол-5-ил-(1-метилциклопент-1 ил)кетона, этанольного раствора соляной кислоты, этанола и карбоната аммония. Выход: 63,5% от теории.C23H27N5O (389,5). ЕКА - масс-спектр: (М+Н)+=390. Пример 127. Гидрохлорид N-фенил-N-(2 этоксикарбонилэтил)амида 2-[(4-амидинофенил)сульфинилметил]бензтиазол-5-илкарбоновой кислоты. К раствору 0,15 г (0,27 мМоль) гидрохлорида N-фенил-N-(2-этоксикарбонилэтил)амида 2-[(4-амидинофенил)тиометил]бензтиазол-5-илкарбоновой кислоты в 10 мл уксусной кислоты добавляют 0,09 мл (примерно 0,81 мМоль) 30%ного раствора перекиси водорода и перемешивают при комнатной температуре. Спустя 4 дня добавляют еще 0,18 мл раствора перекиси водород, и перемешивают еще 2 дня. После удаления растворителя в вакууме полученный сырой продукт очищают с помощью колоночной хроматографии (силикагель; метиленхлорид/этанол в соотношении от 10:1 до 4:1). С 27 Н 26N4O4S2 (534,66).Rf: 0,24 (силикагель; метиленхлорид/ этанол=4:1 + несколько капель уксусной кислоты). ЕКА - масс-спектр: (М+Н)+=535. Пример 128. Гидрохлорид N-(н-пропил)-N(2-этоксикарбонилэтил)амида 1-метил-2-[(4 амидинофенил)сульфонилметил]бензимидазол 5-илкарбоновой кислоты. К раствору 0,40 г (0,70 мМоль) гидрохлоридаN-(н-пропил)-N-(2-этоксикарбонилэтил) амида 1-метил-2-[(4-амидинофенил)тиометил] бензимидазол-5-илкарбоновой кислоты в 10 мл муравьиной кислоты добавляют 2 мл 30%-ного раствора перекиси водорода и перемешивают 16 ч при комнатной температуре. Затем растворитель отгоняют в вакууме, при этом получают целевое соединение в виде слегка окрашенного твердого вещества (с незначительной примесью гидрохлорида
МПК / Метки
МПК: C07D 277/64, A61K 31/428, A61P 7/02
Метки: качестве, применение, получение, средств, дизамещенные, гетероциклы, бициклические, лекарственных
Код ссылки
<a href="https://eas.patents.su/30-3697-dizameshhennye-biciklicheskie-geterocikly-ih-poluchenie-i-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Дизамещенные бициклические гетероциклы, их получение и применение в качестве лекарственных средств</a>
Предыдущий патент: Селективный в отношении цог-2 карпрофен для лечения боли и воспаления у собак
Следующий патент: Галогензамещенные тетрациклические производные тетрагидрофурана
Случайный патент: Элемент для проращивания и семенная лента, содержащая множество таких расположенных последовательно элементов для проращивания












