Кальциевые соли соединения в качестве противовоспалительных, иммуномодулирующих и антипролиферативных агентов
Номер патента: 22462
Опубликовано: 29.01.2016
Авторы: Аммендола Альдо, Фитт Даниель, Дидерикс Юлия, Лебан Иоганн
Формула / Реферат
1. Кальциевая соль соединения общей формулы (I)
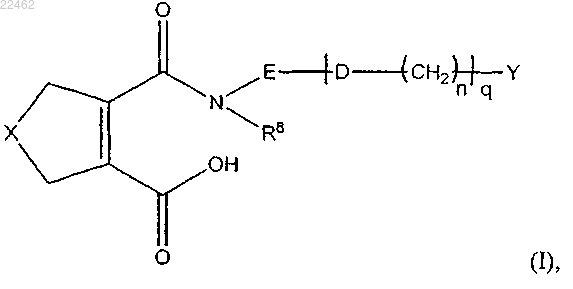
где X выбран из группы, состоящей из СН2, S или О;
D представляет собой О или S;
R8 представляет собой водород;
Е представляет собой фениленовую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, нитро, C1-С6алкила или С1-С6алкокси;
Y представляет собой фенильную, пиридиновую или бензотиофеновую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, C1-С6алкила, С1-С6алкокси, галоген-С1-С6алкокси, галоген-С1-С6алкила или CN;
n равен 0 или 1 и
q равен 0 или 1;
при условии, что кальциевые соли соединений, где X представляет собой СН2, q равен 0, Y представляет собой незамещенный фенил и Е представляет собой незамещенный фенилен, исключены;
или ее гидрат.
2. Кальциевая соль или ее гидрат по п.1, где Y представляет собой замещенный или незамещенный фенил.
3. Кальциевая соль или ее гидрат по п.1 или 2, где q равен 0.
4. Кальциевая соль или ее гидрат по любому из пп.1-3, где Е представляет собой незамещенную фениленовую группу или фениленовую группу, которая замещена одной или более группами, независимо выбранными из галогена, нитро или С1-С6алкокси.
5. Кальциевая соль или ее гидрат по любому из пп.1-4, где Y представляет собой фенильную группу, которая замещена одной или более группами, независимо выбранными из метокси или трифторметокси.
6. Кальциевая соль или ее гидрат по любому из пп.1-5, где соединение формулы (I) представляет собой 2-(3-фтор-3'-метоксибифенил-4-илкарбамоил)циклопент-1-енкарбоновую кислоту.
7. Фармацевтическая композиция, обладающая активностью ингибиторов дигидрооротатдегидрогеназы (DHODH), содержащая соль или ее гидрат по любому из пп.1-6 вместе с фармацевтически приемлемыми разбавителями или носителями.
8. Применение кальциевой соли или ее гидрата по любому из пп.1-6 в качестве лекарственного средства, обладающего активностью ингибиторов дигидрооротатдегидрогеназы (DHODH).
9. Применение кальциевой соли или ее гидрата по любому из пп.1-6 в изготовлении лекарственного средства для использования в лечении заболевания или терапевтического показания, выбранного из группы, содержащей ревматизм, острые иммунологические расстройства, аутоиммунные болезни, болезни, вызванные пролиферацией раковых клеток, воспалительные заболевания, заболевания человека и животных, вызванные инвазиями простейших, заболевания, вызванные вирусными инфекциями и Pneumocystis carinii, фиброз, увеит, ринит, астму или артропатию.
10. Применение по п.9, где заболевание или терапевтическое показание выбрано из группы, содержащей реакции "трансплантат против хозяина" и "хозяин против трансплантата", ревматоидный артрит, рассеянный склероз, красную волчанку, воспалительное заболевание кишечника и псориаз.
11. Способ получения кальциевой соли или ее гидрата по любому из пп.1-6, включающий стадии:
а) добавление суспензии гидроксида кальция в органическом растворителе к раствору свободной кислоты соединения формулы (I), как оно определено в любом из пп.1-6,
б) перемешивание суспензии, полученной на стадии а),
в) по меньшей мере частичное выпаривание указанного органического растворителя с получением суспензии кальциевой соли указанного соединения формулы (I),
г) извлечение кальциевой соли указанного соединения формулы (I) из смеси, полученной на стадии в), и
д) промывку кальциевой соли указанного соединения формулы (i), полученной на стадии г), указанным органическим растворителем.
Текст
КАЛЬЦИЕВЫЕ СОЛИ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ,ИММУНОМОДУЛИРУЮЩИХ И АНТИПРОЛИФЕРАТИВНЫХ АГЕНТОВ Изобретение относится к кальциевой соли соединения общей формулы (I) где X выбран из группы, состоящей из СН 2, S или О; D представляет собой О или S; R8 представляет собой водород; Е представляет собой фениленовую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, нитро, C1-С 6 алкила или C1-С 6 алкокси; Y представляет собой фенильную, пиридиновую или бензотиофеновую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, C1-С 6 алкила, C1 С 6 алкокси, галоген-С 1-С 6 алкокси, галоген-С 1-С 6 алкила или CN; n равен 0 или 1, и q равен 0 или 1; при условии, что кальциевые соли соединений, где X представляет собой СН 2, q равен О,Y представляет собой незамещенный фенил, и Е представляет собой незамещенный фенилен,исключены; или ее гидрату; к содержащей их фармацевтической композиции, обладающей активностью ингибиторов дигидрооротат-дегидрогеназы (DHODH), к их применениям, а также к способу их получения. Изобретение относится к кальциевым солям соединений, которые можно применять в качестве противовоспалительных, иммуномодулирующих и антипролиферативных агентов. В частности, это изобретение относится к кальциевым солям соединений, которые ингибируют дигидрооротатдегидрогеназу(DHODH), способу их изготовления, содержащим их фармацевтическим композициям и их применению для лечения и предупреждения заболеваний, в частности, их применению в отношении таких заболеваний, когда выгодно ингибирование дигидрооротатдегидрогеназы (DHODH). Ревматоидный артрит (РА) представляет собой довольно распространенное заболевание, особенно среди пожилых людей. Его лечение с помощью обычных лекарственных средств, например нестероидных противовоспалительных агентов, не является удовлетворительным. Принимая во внимание усиливающееся старение населения, особенно в развитых западных странах или в Японии, необходима срочная разработка новых лекарственных средств для лечения РА. В WO 2003/006425 описаны некоторые конкретные соединения, которые, как сообщается, полезны для лечения и предупреждения заболеваний, когда выгодно ингибирование дигидрооротатдегидрогеназы(DHODH). Однако конкретные соли по настоящему изобретению не раскрыты. В WO 99/38846 и ЕР 0646578 раскрыты соединения, которые, как сообщается, полезны для лечения РА. Компанией Aventis недавно выпущено на рынок лекарственное средство от ревматоидного артрита с новым механизмом действия (лефлуномид) под торговой маркой ARAVA (ЕР 780128, WO 97/34600). Лефлуномид обладает иммуномодулирующим, а также противовоспалительным свойствами (ЕР 217206,DE 2524929). Механизм его действия основан на ингибировании дигидрооротатдегидрогеназы(DHODH), фермента биосинтеза пиримидинов. В De Julian-Ortiz (J. Med. Chem., 1999, 42, 3308-3314) описаны некоторые потенциальные противогерпесные соединения с группировками циклопентеновой кислоты. В DE 3346814 А 1 описаны некоторые производные амида угольной кислоты для лечения, предупреждения и уменьшения интенсивности заболеваний, связанных с церебральной дисфункцией, и вызванных ею симптомов. В организме DHODH катализирует синтез пиримидинов, которые необходимы для клеточного роста. Ингибирование DHODH ингибирует рост (патологически) быстро пролиферирующих клеток, тогда как клетки, растущие с нормальной скоростью, могут получить необходимые им пиримидиновые основания из обычного метаболического цикла. Типы клеток, которые наиболее важны для иммунного ответа, лимфоциты, используют для своего роста только лишь синтез пиримидинов и особенно чувствительно реагируют на ингибирование DHODH. Вещества, которые ингибируют рост лимфоцитов, являются важными лекарственными средствами для лечения аутоиммунных болезней. Ингибитор DHODH, лефлуномид (ARAVA), представляет собой первое лекарственное средство этого класса соединений (лефлуномидов) для лечения ревматоидного артрита. Дополнительной ссылкой,в которой раскрыты соединения, действующие в качестве ингибиторов DHODH, является WO 99/45926. В JP-A-50-121428 раскрыты N-замещенные моноамиды циклопентен-1,2-дикарбоновой кислоты в качестве гербицидов и их синтез. Например, N-(4-хлорфенил)-1-циклопентен-1,2-дикарбоновой кислоты моноамид получают путем взаимодействия ангидрида 1-циклопентен-1,2-дикарбоновой кислоты с 4 хлоранилином. В указанном выше Journal of Med. Chemistry (1999, vol. 42, pp. 3308-3314) описаны возможные комбинаторные синтезы и компьютерный скрининг новых потенциальных противогерпесных соединений. В табл. 3 на стр. 3313 представлены результаты экспериментов, относящиеся к IC50 и цитотоксичности 2(2,3-дифторфенилкарбамоил)-1-циклопентен-1-карбоновой кислоты, 2-(2,6-дифторфенилкарбамоил)-1 циклопентен-1-карбоновой кислоты и 2-(2,3,4-трифторфенилкарбамоил)-1-циклопентен-1-карбоновой кислоты. В DE 3346814 и US 4661630 раскрыты амиды карбоновых кислот. Эти соединения полезны для заболеваний, сопровождающихся церебральной дисфункцией, и также обладают противоязвенной, противоастматической, противовоспалительной и гипохолестериновой активностями. В ЕР 0097056, JP 55157547, DE 2851379 и DE 2921002 описаны производные полуамида тетрагидрофталевой кислоты. Целью настоящего изобретения является предоставление эффективных альтернативных агентов в форме кальциевых солей, которые можно применять для лечения заболеваний, когда требуется ингибирование DHODH. Более подробно, ранее было обнаружено, что соединения общей формулы (I), изображенной в данном описании ниже, такие как 2-(3-фтор-3'-метоксибифенил-4-илкарбамоил)циклопент-1-енкарбоновая кислота (международное непатентованное название (МНН): Видофлудимус), демонстрируют хорошую противовоспалительную активность, и было обращено внимание на их применимость в пероральной терапии для лечения аутоиммунных болезней, таких как, например, ревматоидный артрит или воспалительных заболеваний кишечника. Однако, растворимость вышеупомянутых соединений в водных средах при нейтральном значении рН меньше 1 мг/мл. Растворимость соединения является важной характеристикой при поиске новых лекарственных средств, поскольку служит отправной точкой для разработки препарата. Кроме того, резорбция лекарственного средства из кишечника в кровоток после перорального введения, по меньшей мере, частично зависит от его растворимости. Только лишь растворенные вещества могут подвергаться резорбции, так что можно ожидать, что увеличение растворимости приведет к лучшему поглощению соединения в желудочно-кишечном тракте, то есть к лучшей пероральной биодоступности и, следовательно, улучшенным фармакокинетическим свойствам. Является желательным предоставление соединений, обладающих повышенной биодоступностью, с целью улучшения их применения в качестве фармацевтического соединения для перорального использования. Поэтому авторы настоящего изобретения предприняли попытки улучшить растворимость соединений в водных средах и, следовательно, их биодоступность. С этой мотивацией было проведено исследование, заключающееся в разработке новой солевой формы соединений, которое в результате привело к солям, неожиданно демонстрирующим значительно улучшенные физико-химические свойства. Обнаружено, что кальциевые соли соединений формулы (I), описанные ниже, такие как кальциевая соль 2-(3-фтор-3'-метоксибифенил-4-илкарбамоил)циклопент-1-енкарбоновой кислоты, демонстрируют благоприятные физико-химические свойства, такие как улучшенная растворимость в воде с сохранением хорошей долгосрочной стабильности. Более того, обнаружено, что не все соли соединения обычно увеличивают растворимость в воде до одной и той же величины; в действительности, хотя растворимости всех протестированных солей выше, чем растворимость свободной кислоты, они значительно отличаются друг от друга. Более важным является то, что кальциевая соль неожиданно демонстрирует заметно увеличенную биодоступность по сравнению с другими солями или свободной кислотой. Соответственно, обнаружен новый класс кальциевых солей соединений с ингибирующим действием в отношении DHODH, в частности в отношении DHODH человека. Следовательно, настоящее изобретение относится к кальциевой соли соединения общей формулы где X выбран из группы, состоящей из СН 2, S или О;R8 представляет собой водород; Е представляет собой фениленовую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, нитро, C1-С 6 алкила или C1-С 6 алкокси;Y представляет собой фенильную, пиридиновую или бензотиофеновую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, С 1-С 6 алкила, C1-С 6 алкокси,галоген-С 1-С 6 алкокси, галоген-С 1-С 6 алкила или CN;q равен 0 или 1, предпочтительно равен 0; при условии, что кальциевые соли соединений, где X представляет собой СН 2, q равен 0, Y представляет собой незамещенный фенил и Е представляет собой незамещенный фенилен, исключены; или ее гидрату. Предпочтительно Е представляет собой незамещенную фениленовую группу или фениленовую группу, которая замещена одной или более группами, независимо выбранными из галогена, нитро или С 1-С 6 алкокси; более предпочтительно Е представляет собой фениленовую группу, которая замещена одним атомом фтора или хлора, одной группой метокси или четырьмя атомами фтора. Еще более предпочтительно Е представляет собой фениленовую группу, которая замещена одним или четырьмя атомами фтора, еще более предпочтительно - одним атомом фтора. Предпочтительно Y представляет собой возможно замещенную фенильную, пиридиновую или бензотиофеновую группу. Более предпочтительно Y представляет собой незамещенную фенильную группу или фенильную группу, которая замещена одной или более группами, независимо выбранными из галогена, С 1-С 6 алкила, С 1-С 6 алкокси, галоген-С 1-С 6 алкокси, галоген-С 1-С 6 алкила или CN. Еще более предпочтительно Е представляет собой фенильную группу, которая замещена одной или более группами, независимо выбранными из фтора, хлора, CN, метокси, этокси, трифторметила или трифторметокси. Еще более предпочтительно Е представляет собой фенильную группу, которая замещена одной или более группами, независимо выбранными из метокси или трифторметокси, еще более предпочтительно метокси. Предпочтительно настоящее изобретение относится к кальциевой соли соединения формулы (I) или ее гидрату, описанным выше, где соединение формулы (I) представляет собой 2-(3-фтор-3'-метоксибифенил-4-илкарбамоил)циклопент-1-енкарбоновую кислоту. Алкильная группа, если не оговорено особо, предпочтительно представляет собой насыщенную ли-2 022462 нейную или разветвленную цепь из 1-6 атомов углерода, предпочтительно метильную, этильную, пропильную, изопропильную, бутильную, трет-бутильную, изобутильную, пентильную или гексильную группу, причем метильная, этильная, изопропильная или трет-бутильная группа является более предпочтительной; метильная или этильная группа является еще более предпочтительной; и метильная группа является еще более предпочтительной. Группа алкокси означает группу О-алкил, где алкильная группа является такой, как определено выше. Галогеналкильная группа означает алкильную группу, которая замещена одним или более атомами галогена, где алкильная группа является такой, как определено выше; причем трифторметил является предпочтительным. Группа галогеналкилокси означает группу алкокси, которая замещена одним или более атомами галогена, где группа алкокси является такой, как определено выше; причем OCF3 является предпочтительной. Предпочтительно, галоген представляет собой хлор, бром, фтор или йод, причем предпочтительными являются фтор, хлор или бром; более предпочтительным является фтор. В изобретении также предложена фармацевтическая композиция, обладающая активностью ингибиторов дигидроортат-дегидрогеназы (DHODH), содержащая кальциевую соль соединения формулы (I) или ее гидрат, описанные выше, вместе с фармацевтически приемлемым разбавителем или носителем. Изобретение также относится к применению кальциевой соли соединения формулы (I) или ее гидрата, описанным выше, в качестве лекарственного средства, обладающего активностью ингибиторов дигидроортат-дегидрогеназы (DHODH). Изобретение также относится к применению кальциевой соли соединения формулы (I) или ее гидрата, описанным выше, в изготовлении лекарственного средства для использования в лечении заболевания или терапевтического показания, выбранного из группы, содержащей ревматизм, острые иммунологические расстройства, аутоиммунные болезни, болезни, вызванные пролиферацией раковых клеток,воспалительные заболевания, заболевания человека и животных, вызванные инвазиями простейших, заболевания, вызванные вирусными инфекциями и Pneumocystis carinii, фиброз, увеит, ринит, астму или артропатию; предпочтительно заболевания или терапевтического показания, выбранного из группы, содержащей реакции "трансплантат против хозяина" и "хозяин против трансплантата", ревматоидный артрит, рассеянный склероз, красную волчанку, воспалительное заболевание кишечника и псориаз. Кроме того, изобретение относится к способу получения кальциевой соли соединения формулы (I) или ее гидрата, описанным выше, включающему стадии: а) добавление суспензии гидроксида кальция в органическом растворителе к раствору свободной кислоты соединения формулы (I), как оно определено выше,б) перемешивание суспензии, полученной на стадии а),в) по меньшей мере частичное выпаривание указанного органического растворителя с получением суспензии кальциевой соли указанного соединения формулы (I),г) извлечение кальциевой соли указанного соединения формулы (I) из смеси, полученной на стадии в), и д) промывку кальциевой соли указанного соединения формулы (I), полученной на стадии г), указанным органическим растворителем. Настоящее изобретение также охватывает гидраты солей по настоящему изобретению, что указывает на то, что кристаллы, получаемые из указанных солей, содержат воду в конкретных стехиометрических или суб-стехиометрических количествах, например 0,5, 1 или 2 молекулы воды на молекулу соединения формулы (I), раскрытого в данном описании. В настоящем изобретении раскрыты способы получения целевых амидов формулы (I), а также их кальциевых солей, описанных выше. Первый способ синтеза амидов формулы (I) включает стадию взаимодействия ангидрида кислоты формулы (II) с амином формулы (III). Второй способ по изобретению получения соединений формулы (I) включает стадию взаимодействия амина формулы (IV) с арилбороновой кислотой общей формулы (V) (HO)2B-E-[D-(CHR3)n]q-Y [M. P. Третий способ по изобретению получения соединений формулы (I) включает стадию взаимодействия галогенпроизводного формулы (VI) с арилбороновой кислотой общей формулы (VII) [N. E. Leadbeater, S. M. Resouly, Tetrahedron, 55, 1999, 11889-11894]. Q представляет собой галогеновую группу, такую как группа хлора, брома, фтора или йода, причем группа брома является предпочтительной. В приведенных в данном описании структурах формул II-VII остатки X, Е, D, Y, R8, а также переменные n и q имеют значения, которые определены в данном описании для формулы I. Предпочтительно соли по настоящему изобретению представляют собой кальциевые соли, полученные из соединения, выбранного из группы, содержащей соединения 1-76, перечисленные ниже: 1. 2-4-(бензилокси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 13. 2-2'-фтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 14. 2-2'-хлор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 15. 2-2'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 16. 2-4-2,6-дифторбензил)окси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 17. 2-2'-этокси-3-фтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 18. 2-2-хлор-3'-циано-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 19. 2-2-хлор-4'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 22. 2-3-хлор-4-(6-метоксипиридин-3-ил)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 23. 2-4'-метокси-2-метил-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 24. 2-3,5-дибром-4-2,5-дифторбензил)окси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 25. 2-3,5-дибром-4-3,4-дифторбензил)окси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 26. 2-3-фтор-3'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 27. 2-3,3'-дифтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 29. 4-4-(бензилокси)-3,5-дибромфенил)карбамоил)-2,5-дигидротиофен-3-карбоновая кислота; 30. 2-3,4',5-трифтор-3'-метил-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 31. 2-3,5-дифтор-2'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 32. 2-2'-метокси-3-нитро-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 33. 2-3-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота 34. 2-2'-хлор-3-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота 35. 2-3-метокси-3'-(трифторметокси)-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 36. 2-2'-фтор-3-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 37. 2-2',3,4'-триметокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 38. 2-3'-этокси-3-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 39. 2-3,3'-диметокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 40. 2-3,5-дибром-4-2-хлор-6-фторбензил)окси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 41. 4-2'-хлор-[1,1'-бифенил]-4-ил)карбамоил)-2,5-дигидротиофен-3-карбоновая кислота; 42. 2-4-(м-толилтио)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 43. 2-3'-(трифторметокси)-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 44. 2-4-(бензо[b]тиофен-2-ил)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 45. 2-4-(бензо[b]тиофен-2-ил)-2-фторфенил)карбамоил)циклопент-1-енкарбоновая кислота; 46. 2-3'-этокси-3-фтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 47. 4-3,5-дифтор-2'-метокси-[1,1'-бифенил]-4-ил)карбамоил)-2,5-дигидрофуран-3-карбоновая кислота; 50. 2-4-феноксифенил)карбамоил)циклопент-1-енкарбоновая кислота; 52. 4-3,5-дибром-4-2-хлор-6-фторбензил)окси)фенил)карбамоил)-2,5-дигидротиофен-3-карбоновая кислота; 53. 2-3-хлор-2'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 54. 2-2-хлор-2'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 56. 2-2,3,5,6-тетрафтор-2'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 57. 2-2'-метокси-3-метил-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 58. 2-3,5-дихлор-2'-метокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 62. 2-2'-этокси-3,5-дифтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 63. 2-3'-этокси-3,5-дифтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 64. 2-3,5-дифтор-3'-(трифторметокси)-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 65. 2-2'-хлор-3,5-дифтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 66. 2-2',3,5-трифтор-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 67. 2-3,5-дифтор-2',4'-диметокси-[1,1'-бифенил]-4-ил)карбамоил)циклопент-1-енкарбоновая кислота; 68. 2-3-хлор-4-2-(трифторметил)бензил)окси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 69. 2-3-хлор-4-2-хлор-6-фторбензил)окси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 72. 2-4-(бензилокси)-3-хлорфенил)карбамоил)циклопент-1-енкарбоновая кислота; 74. 2-3-хлор-4-2-фторбензил)окси)фенил)карбамоил)циклопент-1-енкарбоновая кислота; 76. 2-3-фтор-2'-метокси-[1,1'-бифенил]-4-ил)окси)карбамоил)циклопен-1-енкарбоновая кислота. Предпочтительно, кальциевые соли по настоящему изобретению представляют собой вышеупомянутые кальциевые соли, где соединение формулы (I) выбрано из группы, содержащей соединения, изображенные в табл. 1 ниже. Таблица 1mC - мультиплетный центр; активность в отношении ингибирования определена следующим образом: А: 0-800 нМ, В: 800-1500 нМ, С: больше 1500 нМ. Соединения формулы (I) могут быть получены различными способами, в том числе способом, описанным в JP-A-50-121428. В предпочтительных воплощениях способов по изобретению используют следующие два способа синтеза. Способ 1. На первой стадии циклоалкен-1,2-дикарбоновые кислоты можно получить из соответствующих ,'-дибромалкандикарбоновых кислот, как описано R.N. Me Donald и R.R. Reitz в J. Org. Chem. 37, (1972) 2418-2422. Циклопентен-1,2-дикарбоновую кислоту также можно получить в больших количествах из пимелиновой кислоты [D.C. Owsley und J.J. Bloomfield, Org. Prep. Proc. Int. 3, (1971) 61-70; R.Willsttter, J. Chem. Soc. (1926), 655-663]. Дикарбоновые кислоты, замещенные в или по кольцевой системе, обычно можно синтезировать посредством циангидринового синтеза [Shwu-Jian Lee et.al., Bull. Inst. Chem. Academia Sinica Number 40,(1993), 1-10 или В. R. Baker at al., J. Org. Chem. 13, 1948, 123-133; и В. R. Baker at al., J. Org. Chem. 12,1947, 328-332; L. A. Paquette et. al., J. Am. Chem. Soc. 97, (1975), 6124-6134]. Затем дикарбоновые кислоты можно превратить в соответствующие ангидриды кислот путем их взаимодействия с ангидридом уксусной кислоты [P. Singh and S.M. Weinreb, Tetrahedron 32, (1976), 23792380]. Другие способы получения разных ангидридов кислот формулы (II) описаны в V. A. Montero at al.,J. Org. Chem. 54, (1989), 3664-3667; P. ten Haken, J. Heterocycl. Chem. 7, (1970), 1211-1213; K. Alder, H.Chem. 543, (1940), 56-78; и W. Flaig, J. Lieb. Annalen d. Chem. 568, (1950), 1-33. Затем эти ангидриды можно подвергнуть взаимодействию с соответствующими аминами до целевых амидов формулы (I). Эту реакцию можно проводить либо в реакционных условиях, описанных в J.V.de Julian Ortiz et al., J. Med. Chem. 42, (1999), 3308 (в примере 1 путь обозначен как путь А), либо путем использования 4-диметиламинопиридина (в примере 1 путь обозначен как путь В). Способ 2. Амиды формулы (I) также можно синтезировать путем взаимодействия амина формулы(IV) с арилбороновой кислотой общей формулы (V) [М. P. Winters, Tetrahedron Lett., 39, (1998), 29332936]. Биариланилин обычно можно синтезировать посредством палладиевого сочетания [G. W. Kabalka etCommun. 22, (1999), 2259-2260]. Способ 3. Амиды формулы (I) также можно синтезировать путем взаимодействия галогенпроизводного формулы (VI) с арилбороновой кислотой общей формулы (VII) [N. Е. Leadbeater, S. M. Resouly, Tetrahedron, 55, 1999, 11889-11894]. Кальциевые соли по настоящему изобретению можно применять в отношении множества заболеваний человека и животных, предпочтительно заболеваний человека, когда полезно ингибирование метаболизма пиримидина. Такие заболевания представляют собой фиброз, увеит, ринит, астму или артропатию, в частности артроз; все формы ревматизма; острые иммунологические события и расстройства, такие как сепсис, септический шок, эндотоксический шок, грамотрицательный сепсис, синдром токсического шока, острый респираторный дистресссиндром, удар, реперфузионное повреждение, повреждение центральной нервной системы (ЦНС), тяжелые формы аллергии, реакции "трансплантат против хозяина" и "хозяин против трансплантата", болезнь Альцгеймера или лихорадка, повторный стеноз, хроническое воспалительное заболевание легких, силикоз, патологическое разрастание мягких тканей легкого, резорбция кости. Эти иммунологические события также включают желательную модуляцию и супрессию функций иммунной системы; все типы аутоиммунных болезней, в частности ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит, рассеянный склероз, инсулинзависимый сахарный диабет и инсулиннезависимый диабет, красную волчанку, неспецифический язвенный колит, болезнь Крона, воспалительное заболевание кишечника, а также другие хронические воспаления, хроническую диарею; дерматологические расстройства, такие как псориаз; прогрессирующую атрофию сетчатки; все виды инфекций, включая условно-патогенные инфекции. Кальциевые соли по изобретению и изготовленные из них лекарственные средства обычно полезны для лечения нарушений клеточной пролиферации, для лечения или профилактики иммунологических заболеваний и состояний (например, воспалительных заболеваний, нейроиммунологических заболеваний, аутоиммунных болезней или других заболеваний). Кальциевые соли по настоящему изобретению также полезны для разработки иммуномодулирующих и противовоспалительных лекарственных средств или, более широко, для лечения заболеваний, когда полезно ингибирование биосинтеза пиримидинов. Кальциевые соли по настоящему изобретению также полезны для лечения заболеваний, которые вызваны пролиферацией раковых клеток, таких как все формы гематологического и солидного рака. Таким образом, соединения по изобретению и изготовленные из них лекарственные средства в общем полезны для регуляции активации клеток, пролиферации клеток, жизнеспособности клеток, дифференцировки клеток, клеточного цикла, созревания клеток и гибели клеток или для индуцирования системных изменений метаболизма, таких как изменения метаболизма сахаров, липидов или белков. Их также можно применять для поддержания процесса генерации клеток, в том числе роста и генерации клеток крови(прогемопоэтический эффект) после истощения популяции клеток или деструкции клеток, вызванного,например, токсическими агентами, радиацией, иммунотерапией, дефектами роста, нарушением питания,нарушением всасывания, иммунной дисрегуляцией, анемией и тому подобными, или для обеспечения терапевтического контроля за генерацией и деградацией тканей и терапевтической модификации клеток и сохранения тканей и гомеостаза клеток крови. Эти заболевания и состояния включают рак, как гематологический (например, лейкемию, лимфому,миелому), так и солидные опухоли (например, молочной железы, предстательной железы, печени, мочевого пузыря, легкого, пищевода, желудка, толстой кишки, мочеполовой системы, желудочно-кишечного тракта, кожи, поджелудочной железы, головного мозга, матки, ободочной кишки, головы, шеи и яичника,меланому, астроцитому, мелкоклеточный рак легкого, глиому, базально-клеточную и плоскоклеточную карциному, карциномы, такие как саркому Капоши и остеосаркому), лечение расстройств, в которые вовлечены Т-клетки, таких как гипопластическая анемия и синдром Ди Георга, болезнь Грейвса, но не ограничиваются ими. Лефлуномид, как было обнаружено ранее, ингибирует репликацию HCMV клеточной культуре. Глазной герпес представляет собой наиболее общую причину (couse) инфекционной слепоты в промышленно развитых странах. Только лишь в США за год происходит примерно 50000 случаев, из которых 90% являются рецидивами начальных инфекций. Рецидивы лечат противовирусными средствами и кортикостероидами. Цитомегаловирус (другой вирус герпеса) представляет собой общую причину повреждения сетчатки и слепоты у пациентов с синдромом приобретенного иммунодефицита (СПИДом). Для лечения таких заболеваний соединения по настоящему изобретению можно применять сами по себе или в комбинации с другими противовирусными соединениями, такими как Ганцикловир и Фоскарнет. Кроме того, кальциевые соли по настоящему изобретению можно применять в отношении заболеваний человека и животных, вызванных инвазиями простейших. Такими патогенными простейшими для животных и человека предпочтительно являются внутриклеточные активные паразиты типа апикомплексов или саркомастигофор, особенно трипаносомы, плазмодии, лейшмании, бабезии и тейлерии, криптоспоридии, саркоцистиды, амебы, кокцидии и трихомонады. Эти активные вещества или соответствующие лекарственные средства особенно подходят для лечения тропической малярии, вызываемой Plasmodiumfalciparum, трехдневной малярии, вызываемой Plasmodium vivax или Plasmodium ovale, и для лечения четырехдневной малярии, вызываемой Plasmodium malariae. Они также являются подходящими для лечения токсоплазмоза, вызываемого Toxoplasma gondii, кокцидиоза, вызываемого, например, IsosporaTrypanosoma cruzi, сонной болезни, вызываемой Trypanosoma brucei rhodesiense или gambiense, кожной,висцеральной, а также других форм лейшманиоза. Они также подходят для лечения животных, инфицированных патогенными простейшими для животных, подобными Theileria parva, патогеном, вызывающим восточно-береговую лихорадку коров, Trypanosoma congolense congolense или Trypanosoma vivaxvivax, Trypanosoma brucei brucei, патогенами, вызывающими болезнь Нагана крупного рогатого скота в Африке, Trypanosoma brucei evansi, вызывающим трипаносомоз, Babesia bigemina, патогеном, вызывающим техасскую лихорадку у крупного рогатого скота и буйволов, Babesia bovis, патогеном, вызывающим европейский бабезиоз у коров, а также бабезиоз у собак, кошек и овец, Sarcocystis ovicanis и ovifelis, патогенами, вызывающими саркоцистиоз у овец, крупного рогатого скота и свиней, Cryptosporidia, патогенами, вызывающими криптоспоридиоз у крупного рогатого скота и птиц, родами Eimeria и Isospora, патогенами, вызывающими кокцидиоз у кроликов, крупного рогатого скота, овец, коз, свиней и птиц, особенно у кур и индеек. Применение соединений по настоящему изобретению является предпочтительным,в частности, для лечения кокцидиоза или малярийных инфекций либо для изготовления лекарственного средства или корма для лечения этих заболеваний. Это лечение может быть профилактическим или куративным. При лечении малярии соединения по настоящему изобретению можно объединять с другими противомалярийными агентами. Кроме того, кальциевые соли по настоящему изобретению можно применять в отношении вирусных инфекций или других инфекций, вызванных, например, Pneumocystis carinii. Предпочтительно, заболевания или медицинские состояния, которые следует лечить или предупреждать с помощью кальциевых солей по настоящему изобретению, выбраны из группы, содержащей реакции "трансплантат против хозяина" и "хозяин против трансплантата", ревматоидный артрит, рассеянный склероз, красную волчанку, воспалительное заболевание кишечника и псориаз. Животным, предпочтительно млекопитающим, и в частности человеку, собакам и курам, кальциевые соли соединений формулы (I) в виде лекарственных средств можно вводить как таковые, в виде смесей друг с другим или в форме фармацевтических препаратов, которые делают возможным энтеральное или парентеральное применение, и которые в дополнение к обычным фармацевтически безвредным эксципиентам и добавкам содержат эффективную дозу по меньшей мере одной из вышеупомянутых кальциевых солей соединений формулы (I) в качестве активного компонента. Лекарственные средства можно вводить перорально, например в форме пилюль, таблеток, таблеток,покрытых оболочкой, таблеток, покрытых сахарной оболочкой, твердых и мягких желатиновых капсул,растворов, сиропов, эмульсий или суспензий либо в виде аэрозольных смесей. Однако введение также можно осуществлять ректально, например в форме суппозиториев, или парентерально, например в форме инъекций или инфузий, или чрескожно, например в форме мазей, кремов или настоек. Кроме вышеупомянутых солей активных соединений формулы (I), фармацевтическая композиция может содержать дополнительные обычные, как правило инертные, материалы-носители или эксципиенты. Таким образом, фармацевтические препараты также могут содержать добавки, такие как, например,наполнители, разбавители, разрыхлители, связующие вещества, вещества, способствующие скольжению,смачивающие вещества, стабилизаторы, эмульгаторы, консерванты, подсластители, красители, корригенты или ароматизаторы, буферные вещества, и, кроме того, растворители или солюбилизаторы либо вещества для достижения депо-эффекта, а также соли для изменения осмотического давления, вещества оболочки или антиоксиданты. Кроме того, они могут содержать вышеупомянутые соли двух или более соединений формулы (I), а также другие терапевтически активные вещества. Таким образом, соли по настоящему изобретению применять сами по себе или в комбинации с другими активными соединениями, например с уже известными лекарственными средствами для лечения вышеупомянутых заболеваний, причем в последнем случае отмечают благоприятный аддитивный, увеличивающий эффект. Подходящие количества для введения человеку находятся в диапазоне от 5 до 500 мг. Для приготовления фармацевтических препаратов можно использовать фармацевтически инертные неорганические или органические эксципиенты. Для приготовления пилюль, таблеток, таблеток, покрытых оболочкой, и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и так далее. Эксципиенты для мягких желатиновых капсул и суппозиториев представляют собой, например, жиры, воски, полутвердые и жидкие высокомолекулярные спирты, природные или отвержденные масла и так далее. Подходящие эксципиенты для приготовления растворов и сиропов представляют собой, например, воду, сахарозу,инвертный сахар, глюкозу, высокомолекулярные спирты и так далее. Подходящие эксципиенты для приготовления растворов для инъекций представляют собой, например, воду, спирты, глицерин, высокомолекулярные спирты или растительные масла. Доза может изменяться в широких пределах и должна быть подходящей для индивидуального состояния в каждом отдельном случае. Подходящая дозировка для вышеуказанных применений будет изменяться в зависимости от способа введения, конкретного состояния, которое следует лечить, и желаемого эффекта. Однако в общем удовлетворительных результатов достигают при дозировках от примерно 1 до 100 мг/кг массы тела животного, предпочтительно от 1 до 50 мг/кг. Подходящие дозировки для более крупных млекопитающих, например человека, имеют порядок от примерно 10 мг до 3 г/сутки и удобны при введении один раз, в разделенных дозах от 2 до 4 раз в сутки, или в форме замедленного высвобождения. В общем суточная доза для человека, составляющая от приблизительно 10 мг до 5000 мг, предпочтительно от 50 до 500 мг, является подходящей в случае перорального введения, которое представляет собой предпочтительную форму введения по изобретению. В случае других форм введения суточная доза также находится в подобных пределах. Краткое описание графических материалов Фиг. 1 - снижение пролиферации Т-клеток человека, вызванное 2-(бифенил-4-илкарбамоил)циклопент-1-енкарбоновой кислотой, использованной в концентрации 100 мкМ; фиг. 2 - сравнение уровней видофлудимуса в виде свободной кислоты (закрашенные точки) и его кальциевой соли (незакрашенные точки) в плазме крыс после однократной пероральной дозы, составляющей 10 мг/кг массы тела; фиг. 3 - спектр комбинационного рассеяния для кальциевой соли (верхняя линия) и свободной кислоты (нижняя линия); фиг. 4 - оптическая микроскопия с кросс-поляризациями кальциевой соли видофлудимуса; фиг. 5 - PXRD (порошковая дифрактограмма) кальциевой соли видофлудимуса; фиг. 6 - PXRD видофлудимуса в виде свободной кислоты. Примеры Далее изобретение проиллюстрировано следующими неограничивающими примерами. Данные,представленные для конкретных соединений, описанных в табл. 1 выше, также относятся к конкретным примерам по настоящему изобретению. Экспериментальная часть / Параметры настройки 1 Н-ЯМР: 1 Н-ЯМР-спектры регистрировали с использованием спектрометра Bruker DPX300 с частотой протона 300,13 МГц; 30 импульс возбуждения, задержка повторного цикла 1 с. Накапливали 16 сканирований; в качестве растворителя использовали D2O, MeOD или d6-DMSO.DSC: дифференциальную сканирующую калориметрию осуществляли на приборе Perkin ElmerDSC-7 instrument (закрытый золотой тигель в атмосфере N2). Образец нагревают вплоть до точки плавления со скоростью 10 К/мин, затем охлаждают (скорость охлаждения 200 К/мин), после чего снова нагревают со скоростью 10 К/мин.DVS (динамическая сорбция паров) (SMS): анализатор сорбции паров воды DVS-1 Surface Measurement Systems Ltd. Образец помещают в платиновый тигель и оставляют уравновешиваться при заданной относительной влажности (о.в.), обычно 50%-ной о.в. Затем запускали предварительно определенную программу влажности со скоростью развертки 5% о.в. за час. Первая стадия: от 50%-ной о.в. до 0% о.в. (в случае возможного гидрата в качестве исходного вещества от 50 до 95%-ной о.в.), вторая стадия: от 0 до 95%-ной о.в. (в случае возможного гидрата в качестве исходного вещества от 95%-ной о.в. до 0%). Спектроскопия комбинационного рассеяния с преобразованием Фурье: спектры комбинационного рассеяния с преобразованием Фурье регистрировали на системе Bruker RFS 100 FT-Raman system с ближним инфракрасным Nd:YAG лазером, работающим при 1064 нм, и германиевым детектором, охлаждаемым жидким азотом. Для каждого образца накапливали минимум 64 сканирования с разрешением 2 см-1. Использовали лазер с номинальной мощностью 300 мВт. Данные, касающиеся спектров комбинационного рассеяния с преобразованием Фурье, показаны в области между 3500 и 100 см-1. Ниже 100 см-1 данные являются ненадежными вследствие Рэлеевской отсечки фильтра. Оптическая микроскопия: микроскоп Leitz Orthoplan 110680, снабженный камерой Leica DFC280 и программным обеспечением с захватом изображения IM50 v.5. Изображения регистрировали со скрещенными поляризаторами и без них и с увеличением 4, 10 или 25. Дифракция рентгеновских лучей на порошке: Bruker D8; Медное Ka излучение, 40 кВ/40 мА; детектор LynxEye, длина шага 0.02 2, продолжительность шага 37 с. Приготовление образца: образцы обычно подвергают измерению без какой-либо специальной обработки, отличной от обработки небольшим давлением с получением плоской поверхности. Использовали держатели образцов из монокристалла кремния (глубиной 0,1, 0,5 или 1 мм). Во время измерения образцы поворачивали. Микроскопия комбинационного рассеяния: Система Renishaw inVia Reflex Raman System. Стабилизированный диодный лазер с длиной волны возбуждения 785 нм и NIR усовершенствованной CCD камерой (камерой на приборе с зарядовой связью), охлаждаемой устройством на эффекте Пельтье, в качестве детектора. Измерения проводили с длиннофокусным объективом 20 х. Диапазон волновых чисел 2000100 см-1, время детектирования 10 с, три накопления на спектр. Растворители: во всех экспериментах использовали растворители Fluka, Merck или ABCR аналитической категории.TG-FT1R: термогравиметрические измерения проводили с термомикровесами Netzsch ThermoMicrobalance TG 209, связанными с спектрометром Braker FTIR Spectrometer Vector 22 или IFS 28 (чашки для образцов с отверстием малого диаметра, атмосфера N2, скорость нагрева 10 С/мин, диапазон от 25 С до 350 С). ВЭЖХ: ВЭЖХ осуществляли на жидкостном хроматографе Dionex UltiMate 3000, включающем растворитель Rack, вакуумный дегазатор, бинарный насос (микро), неподвижный миксер (500 мкл), автоматический пробоотборник, петлю для образца объемом 25 мкл, шприц объемом 100 мкл, термостат колонок и детектор с диодной матрицей (DAD) (полумикроизмерительный модуль), который был настроен на УФ анализ. Результаты анализа получали с помощью Chromeleon 6.80 SP3. Соединения разделяли при 30 С на колонке Phenomenex Onyx Monolithic C18, 502 мм. Инъецируемый объем составлял 2 мкл, длина волны детектирования составляла 305 нм. В качестве подвижной фазы использовали градиент смеси 0,1% муравьиной кислоты в воде категории для ВЭЖХ / ацетонитрил, начиная с концентрации ацетонитрила 5%. Исходную концентрацию выдерживали в течение 1 мин, затем градиент изменяли по линейному закону до 95% ацетонитрила в течение 2 мин, выдерживали при 95% ацетонитрила в течение 0,7 мин, после чего возвращали до 5% ацетонитрила в пределах 0,1 мин и удерживали постоянным в течение 0,7 мин для повторного уравновешивания колонки. Скорость потока подвижной фазы составляла 1,5 мл/мин. Пример 1. Синтез соединений формулы (I). Синтез соединений формулы (I) подробно описан в документе WO 2003/0006425, который включен в данное описание путем ссылки. Пример 2. Анализ ингибирования активности DHODH. Стандартная смесь для анализа содержала 50 мкМ дециклоубихинона, 100 мкМ дигидрооротата, 60 мкМ 2,6-дихлориндофенола, а также 20 мЕ DHODH. Удельная объемная активность используемого рекомбинантного фермента составляла 30 Е/мл. Измерения проводили в 50 мМ трис-HCl (150 мМ KCl,0,1% тритона Х-100, рН 8,0) при 30 С в конечном объеме 1 мл. Компоненты смешивали и, добавляя дигидрооротат, начинали реакцию. За протеканием реакции следили путем спектрофотометрического измерения уменьшения поглощения при 600 нм в течение 2 мин. Исследования ингибирования проводили в соответствии со стандартным анализом с дополнительными переменными количествами ингибитора. Для определения значений IC50 (концентрации ингибитора, которая требуется для 50%-ного ингибирования) использовали по меньшей мере пять разных концентраций ингибитора. Эти исследования проводили с рекомбинантной DHODH человека и рекомбинантной DHODH мышей, которые были предоставлены проф. М. Lftier, Marburg, Germany [M. Lffler, Chem. Biol. Interact. 124, (2000), 61-76]. В качестве стандарта использовали активный метаболит лефлуномида А 77-1726 (соединение 12) [J.Jckel et. al. Biochemical Pharmacology 56 (1998), 1053-1060]. Результаты анализа ингибирования представлены в табл. 1 выше. Из сравнения значений IC50 понятно, что соединения, используемые для получения солей по настоящему изобретению, обладают не только соизмеримой или даже лучшей ингибирующей активностью в отношении фермента человека, чем активный метаболит лефлуномида, но и более высокой специфичностью в отношении фермента человека. Пример 3. Анализ пролиферации Т-клеток человека. Мононуклеарные клетки периферической крови человека (РВМС) получали от клинически здоровых добровольцев и переносили в среду для культур клеток RPMI1640, содержащую 10% диализированной фетальной телячьей сыворотки. В 96-луночный планшет с помощью пипетки переносили 80000 клеток на лунку и добавляли фитогемагглютинин (РНА) в фосфатно-солевом буферном растворе до конечной концентрации 20 мкг/мл для стимуляции пролиферации Т-клеток. Добавляли видофлудимус в диметилсульфоксиде (DMSO, конечная концентрация: 0,1 об.%) до конечных концентраций в диапазоне от 20 нМ до 50 мкМ. Клеточную пролиферацию после инкубирования в течение 48 ч подсчитывали, используя иммуноферментный твердофазный анализ (ELISA) с 5-бром-2'-дезоксиуридином в отношении пролиферации клеток ("cell proliferation ELISA BrdU") (Roche) в соответствии с инструкциями производителя. Половину максимального ингибирования (IC50) рассчитывали с использованием 4-параметрической аппроксимации сигмоидальной кривой. Видофлудимус ингибировал пролиферацию Т-клеток со значениемIC50 4,1 мкМ (см. фиг. 1). Пример 4. Получение кальциевых солей. 300,4 мг видофлудимуса в виде свободной кислоты растворяли в 18 мл DCM (дихлорметан) / МеОН(3:1) и обрабатывали ультразвуком в течение 8 мин. 31,5 мг гидроксида кальция суспендировали в 3 млDCM/MeOH (3:1) и медленно добавляли к раствору Видофлудимуса в виде свободной кислоты. Тонкую суспензию перемешивали в течение ночи при 25 С. Растворитель частично выпаривали в токе азота при 25 С. Наблюдали густую светло-желтую суспензию. Твердое вещество извлекали фильтрованием и промывали DCM/MeOH (3:1). Вещество сушили под вакуумом при 25 С в течение 15 мин. С помощью способов, описанных ниже, было показано, что вещество является кристаллическим. С помощью элементного анализа рассчитывали отношение фтора к кальцию. Элементный состав,по существу, соответствовал составу геми-кальциевой соли. Спектр комбинационного рассеяния вновь образованного соединения продемонстрировал отличия от спектра свободной кислоты (см. оба спектра на фиг. 3). Следует отметить, что спектр комбинационного рассеяния, который не является простым наложением свободной кислоты, солеобразующего вещества и используемого для спектра растворителя, например спектр комбинационного рассеяния, где наблюдаются новые пики или сдвинутые пики, может соответствовать соли. Однако только лишь из спектра комбинационного рассеяния невозможно установить, произошло ли образование кристаллической соли. Сдвиги пиков также могут быть обусловлены, в принципе, образованием комплекса из свободной кислоты и солеобразующего вещества в виде аморфного продукта; полиморфами либо свободной кислоты,либо солеобразующего вещества; примесями или разрушением продуктов. Поэтому, целостность молекулярной структуры была подтверждена 1 Н-ЯМР. Кроме того, на порошковой дифрактограмме, изображенной на фиг. 5, показано, что получено кристаллическое вещество, однако его картина отличается от картины свободной кислоты (см. фиг. 6). Обнаружены светлые микроскопические кристаллы (фиг. 4). Анализ методом ДСК (дифференциальная сканирующая калориметрия) показал точку плавления примерно 155 С (указывающую на плавление сольвата и несольватированной формы). Анализ методом ТГ-ИСПФ (термогравиметрический анализ соединенный с инфракрасной спектроскопией с преобразованием Фурье) показал, что вероятно были образованы метанольный сольват и гидрат, а с помощью динамической сорбции паров была выявлена десольватация с последующим 0,3%-ным поглощением воды при примерно 85% о.в. и 0,4%-ным поглощением воды при 95% о.в. Пример 5. Исследование растворимости соединений. Изучали растворимости видофлудимуса в виде свободной кислоты (2-(3-фтор-3'-метоксибифенил-4 илкарбамоил)циклопент-1-енкарбоновой кислоты), его калиевой соли и его кальциевой соли в воде. Способ в принципе основан на руководстве Организации экономического сотрудничества и развития, касающемся тестирования химических веществ (OECD Guideline for testing of chemicals, 105 "Water Solubility"). В пробирки Эппендорфа объемом 1,5 мл отвешивали 2 мг используемых в экспериментах соединений. Потом добавляли воду до достижения концентрации 5 мг/мл. После приготовления образцов для исследования растворимости их инкубировали в течение 24 ч при 23 С при постоянном встряхивании. Затем образцы центрифугировали для отделения осадка от растворенного соединения. Надосадочные жидкости переносили в меченые флаконы для ВЭЖХ для количественного определения посредством ВЭЖХ-УФ. Окончательно эти ВЭЖХ-образцы анализировали на системе ВЭЖХ-УФ и содержимое образцов вычисляли по калибровочным кривым. Концентрация соединения в надосадочной жидкости равна его растворимости в воде. Были обнаружены следующие значения растворимости в воде для Видофлудимуса в виде свободной кислоты и его калиевой и кальциевой солей. Таблица 2. Растворимость кальциевой соли видофлудимуса по сравнению с калиевой солью и свободной кислотой Пример 6. Определение биодоступности. Пероральные биодоступности кальциевой соли и свободной кислоты видофлудимуса сравнивали на крысах-самцах Wistar. Желатиновые капсулы наполняли свободной кислотой или кальциевой солью и животных подвергали однократному введению при уровне дозы примерно 10 мг эквивалентов свободной кислоты на килограмм массы тела. Четырех крыс-самцов Wistar (диапазон массы тела: 250-275 г) на группу обрабатывали либо видофлудимусом в виде свободной кислоты, либо в виде его кальциевой соли. Капсулы вводили в пищевод животных с использованием устройства для внесения. Образцы венозной крови животных отбирали при анестезии изофлураном в следующие моменты времени после введения: 30 мин; 1 ч; 2 ч; 4 ч; 6 ч; 8 ч; 24 ч; 28 ч; 32 ч и 48 ч. Коагуляцию ингибировали, используя Na-гепарин; плазму генерировали путем центрифугирования образцов крови. Образцы плазмы анализировали в отношении видофлудимуса посредством ЖХ-МС (жидкостная хроматография - масс-спектрометрия) / МС, и рассчитывали фармакокинетические параметры в соответствии с комбинированным линейно-логарифмическим методом трапеций. Для изучения калиевой соли шесть крыс-самок Lewis (масса тела примерно 200 г) обрабатывали либо видофлудимусом в виде свободной кислоты, либо в виде его калиевой соли при уровне дозы 30 мг/кг (эквиваленты свободной кислоты). Соединения приготавливали в 0,5% метилцеллюлозы в фосфатно-солевом буферном растворе, и животных обрабатывали путем перорального кормления через желудочный зонд. Образцы венозной крови животных отбирали при анестезии изофлураном в следующие моменты времени после введения: 30 мин; 1 ч; 2 ч; 4 ч; 8 ч; 26 ч; 33 ч; 48 ч и 72 ч. Коагуляцию ингибировали, используя Na-гепарин; плазму генерировали путем центрифугирования образцов крови. Образцы плазмы анализировали в отношении Видофлудимуса посредством ЖХ-МС/МС, и рассчитывали фармакокинетические параметры (AUC) в соответствии с линейным методом трапеций. Пероральные биодоступности солей оценивали путем сравнения площадей под кривыми "концентрация в плазме - время" (AUC) и максимально достигнутых концентраций в плазме (значений Cmax) для Видофлудимуса после введения соли со значениями, наблюдаемыми после введения свободной кислоты. ЭТИ соотношения показаны в табл. 3 и на фиг. 2. Таблица 3. Сравнение фармакокинетических (РК) параметров после перорального применения Видофлудимуса на крысах Пример 7. Определение долгосрочной стабильности. Соединения хранили в течение 18 месяцев при условиях окружающей среды (20-25 С, относительная влажность 30-60%), а затем анализировали посредством ВЭЖХ в отношении чистоты.LOD (предел обнаружения) для продукта гидролиза: 0,1 мкг/мл ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кальциевая соль соединения общей формулы (I) где X выбран из группы, состоящей из СН 2, S или О;R8 представляет собой водород; Е представляет собой фениленовую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, нитро, C1-С 6 алкила или С 1-С 6 алкокси;Y представляет собой фенильную, пиридиновую или бензотиофеновую группу, которая возможно замещена одной или более группами, независимо выбранными из галогена, C1-С 6 алкила, С 1-С 6 алкокси,галоген-С 1-С 6 алкокси, галоген-С 1-С 6 алкила или CN;q равен 0 или 1; при условии, что кальциевые соли соединений, где X представляет собой СН 2, q равен 0, Y представляет собой незамещенный фенил и Е представляет собой незамещенный фенилен, исключены; или ее гидрат. 2. Кальциевая соль или ее гидрат по п.1, где Y представляет собой замещенный или незамещенный фенил. 3. Кальциевая соль или ее гидрат по п.1 или 2, где q равен 0. 4. Кальциевая соль или ее гидрат по любому из пп.1-3, где Е представляет собой незамещенную фениленовую группу или фениленовую группу, которая замещена одной или более группами, независимо выбранными из галогена, нитро или С 1-С 6 алкокси. 5. Кальциевая соль или ее гидрат по любому из пп.1-4, где Y представляет собой фенильную группу, которая замещена одной или более группами, независимо выбранными из метокси или трифторметокси. 6. Кальциевая соль или ее гидрат по любому из пп.1-5, где соединение формулы (I) представляет собой 2-(3-фтор-3'-метоксибифенил-4-илкарбамоил)циклопент-1-енкарбоновую кислоту. 7. Фармацевтическая композиция, обладающая активностью ингибиторов дигидрооротатдегидрогеназы (DHODH), содержащая соль или ее гидрат по любому из пп.1-6 вместе с фармацевтически приемлемыми разбавителями или носителями. 8. Применение кальциевой соли или ее гидрата по любому из пп.1-6 в качестве лекарственного средства, обладающего активностью ингибиторов дигидрооротатдегидрогеназы (DHODH). 9. Применение кальциевой соли или ее гидрата по любому из пп.1-6 в изготовлении лекарственного средства для использования в лечении заболевания или терапевтического показания, выбранного из группы, содержащей ревматизм, острые иммунологические расстройства, аутоиммунные болезни, болезни, вызванные пролиферацией раковых клеток, воспалительные заболевания, заболевания человека и животных, вызванные инвазиями простейших, заболевания, вызванные вирусными инфекциями и Pneumocystis carinii, фиброз, увеит, ринит, астму или артропатию. 10. Применение по п.9, где заболевание или терапевтическое показание выбрано из группы, содержащей реакции "трансплантат против хозяина" и "хозяин против трансплантата", ревматоидный артрит,рассеянный склероз, красную волчанку, воспалительное заболевание кишечника и псориаз. 11. Способ получения кальциевой соли или ее гидрата по любому из пп.1-6, включающий стадии: а) добавление суспензии гидроксида кальция в органическом растворителе к раствору свободной кислоты соединения формулы (I), как оно определено в любом из пп.1-6,б) перемешивание суспензии, полученной на стадии а),в) по меньшей мере частичное выпаривание указанного органического растворителя с получением суспензии кальциевой соли указанного соединения формулы (I),г) извлечение кальциевой соли указанного соединения формулы (I) из смеси, полученной на стадии в), и д) промывку кальциевой соли указанного соединения формулы (i), полученной на стадии г), указанным органическим растворителем.
МПК / Метки
МПК: C07D 333/58, C07D 333/38, A61K 31/167, C07C 233/59, C07C 233/58, C07D 307/30, C07C 233/60
Метки: антипролиферативных, соли, иммуномодулирующих, агентов, кальциевые, противовоспалительных, соединения, качестве
Код ссылки
<a href="https://eas.patents.su/19-22462-kalcievye-soli-soedineniya-v-kachestve-protivovospalitelnyh-immunomoduliruyushhih-i-antiproliferativnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Кальциевые соли соединения в качестве противовоспалительных, иммуномодулирующих и антипролиферативных агентов</a>
Предыдущий патент: Гетероциклические производные алканола в качестве фунгицидов
Следующий патент: Способ получения листового неорганического неметаллического материала с использованием расплавленного шлака
Случайный патент: Слитый белок против злокачественных новообразований












