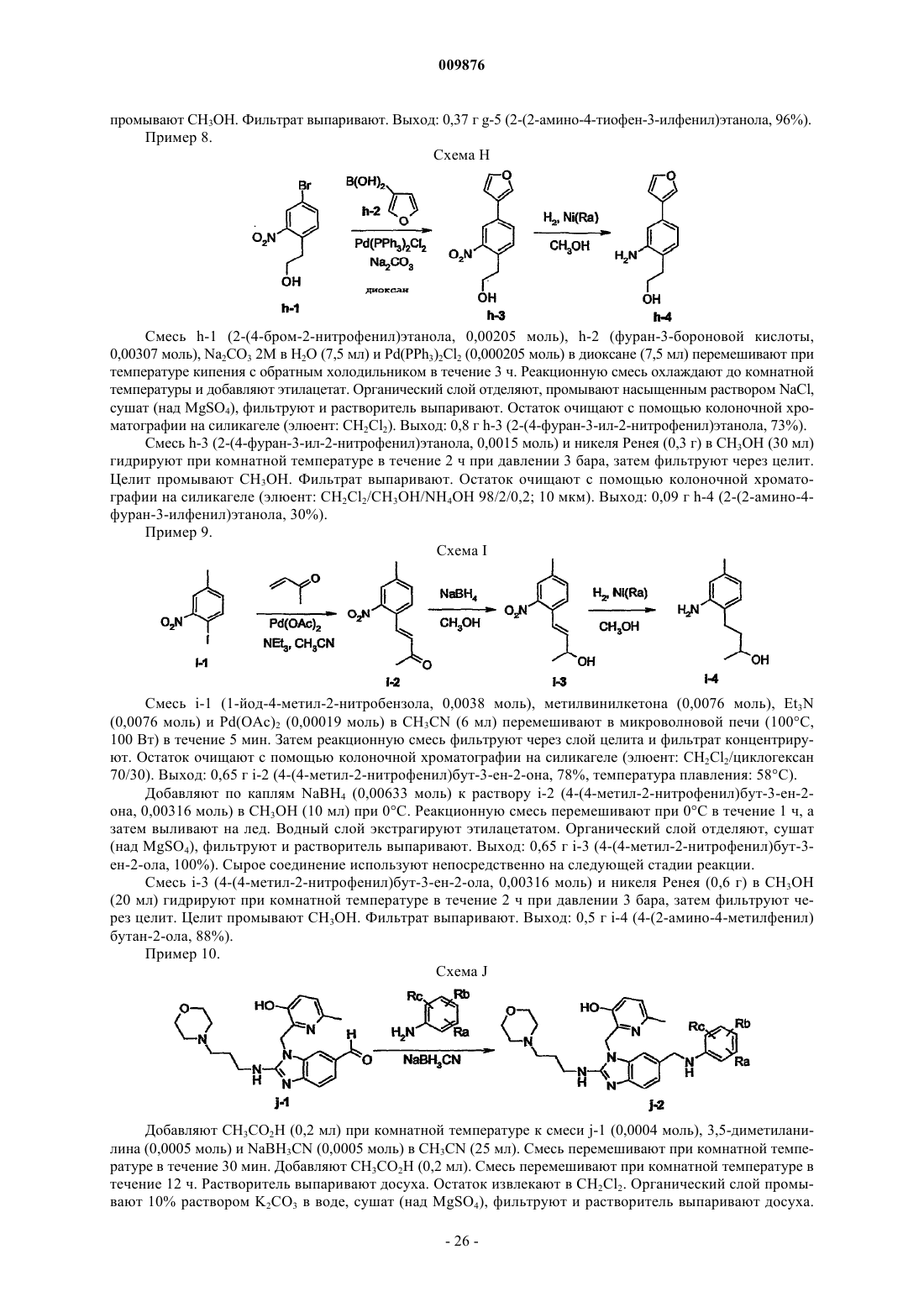
Морфолинилсодержащие бензимидазолы в качестве ингибиторов репликации респираторно-синцитиального вируса
Номер патента: 9876
Опубликовано: 28.04.2008
Авторы: Мейер Кристоф, Фортэн Жером Мишель Клод, Жевер Том Валериус Жозефа, Дубле Фредерик Марк Морис, Бонфанти Жан-Франсуа, Тиммерман Филип Мария Марта Берн, Андрис Кунрад Йозеф Лодевейк, Виллебрордс Руди Эдмонд, Мюллер Филипп
Формула / Реферат
1. Соединение, имеющее формулу
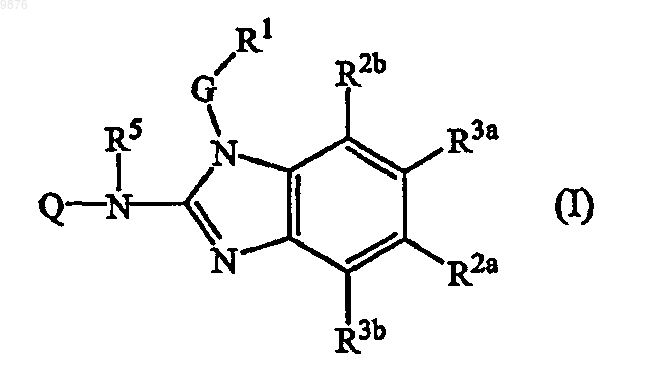
его N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы, где
G представляет собой прямую связь или C1-10алкандиил, необязательно замещенный одним или несколькими заместителями, индивидуально выбранными из группы заместителей, состоящей из гидрокси, C1-6алкилокси, Ar1C1-6алкилокси, C1-6алкилтио, Ar1C1-6алкилтио, НО(-CH2-CH2-O)n-, C1-6алкилокси(-CH2-CH2-O)n- или Ar1алкилокси(-CH2-CH2-O)n-;
R1 представляет собой Ar1 или моноциклический или бициклический гетероцикл, выбранный из пиперидинила, пиперазинила, пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тетрагидрофуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, хинолинила, хиноксалинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензтиазолила, пиридопиридила, нафтиридинила, 1Н-имидазо[4,5-b]пиридинила, 3Н-имидазо[4,5-b]
пиридинила, имидазо[1,2-а]пиридинила, 2,3-дигидро-1,4-диоксино[2,3-b]пиридила или радикала формулы

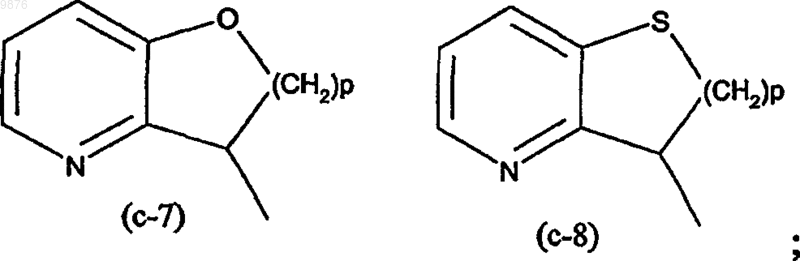
где каждый из указанных моноциклических или бициклических гетероциклов может необязательно быть замещен 1 или, где возможно, несколькими, например 2, 3, 4 или 5, заместителями, индивидуально выбранными из группы заместителей, состоящей из галогена, гидрокси, амино, циано, карбоксила, C1-6алкила, C1-6алкилокси, C1-6
алкилтио, C1-6алкилоксиC1-6алкила, Ar1, Ar1C1-6алкила, Ar1C1-6алкилокси, гидроксиC1-6алкила, моно- или ди(С1-6
алкил)амино, моно- или ди(C1-6алкил)аминоС1-6алкила, полигалогенС1-6алкила, С1-6алкилкарбониламино, C1-6алкил-SO2-NR5c-, Ar1-SO2-NR5c-, C1-6алкилоксикарбонила, -С(=O)-NR5cR5d, НО(-CH2-CH2-O)n-, галоген(-CH2-CH2-O)n-, С1-6алкилокси(-CH2-CH2-O)n-, Ar1C1-6алкилокси(-CH2-CH2-O)n- и моно- или ди(C1-6алкил)амино(-CH2-CH2-O)n-;
каждый n независимо равен 1, 2, 3 или 4;
каждый m независимо равен 1 или 2;
каждый р независимо равен 1 или 2;
каждый t независимо равен 0, 1 или 2;
Q представляет собой R7, пирролидинил, замещенный R7, пиперидинил, замещенный R7, или гомопиперидинил, замещенный R7, где
R7 представляет собой C1-6алкил, замещенный гетероциклом, или R7 представляет собой C1-6алкил, замещенный как радикалом -OR8, так и гетероциклом, где указанный гетероцикл выбирается из группы, состоящей из оксазолидина, тиазолидина, 1-оксотиазолидина, 1,1-диоксотиазолидина, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, гексагидрооксазепина, гексагидротиазепина, 1-оксогексагидротиазепина, 1,1-диоксогексагидротиазепина; где каждый из указанных гетероциклов может необязательно быть замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-6алкила, гидроксиC1-6алкила, аминокарбонилС1-6алкила, гидрокси, карбоксила, С1-4алкилоксикарбонила, аминокарбонила, моно- или ди(С1-4алкил)аминокарбонила, C1-4алкилкарбониламино, аминосульфонила и моно- или ди(С1-4алкил)аминосульфонила;
R8 представляет собой водород, C1-6алкил или Ar1C1-6алкил;
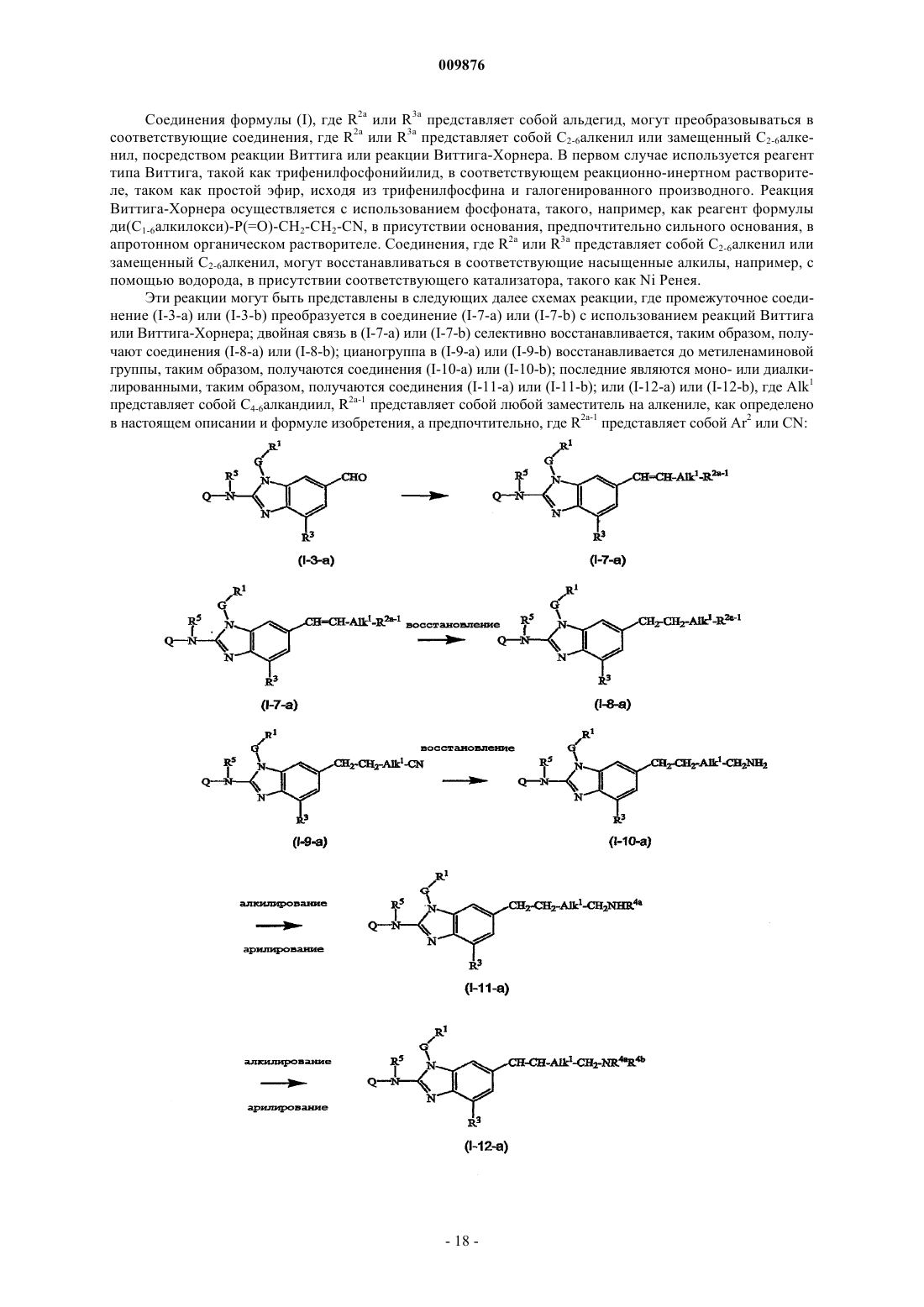
один из R2a и R3a выбирается из галогена, необязательно моно- или полизамещенного C1-6алкила, необязательно моно- или полизамещенного С2-6алкенила, нитро, гидрокси, Ar2, N(R4aR4b), N(R4aR4b)сульфонила, N(R4aR4b)карбонила, С1-6алкилокси, Ar2окси, Ar2C1-6алкилокси, карбоксила, C1-6алкилоксикарбонила, или -C(=Z)Ar2; и другой из R2a и R3a представляет собой водород; где
=Z представляет собой =O, =СН-С(=O)-NR5aR5b, =CH2, =CH-C1-6алкил, =N-OH или =N-O-C1-6алкил; и
необязательные заместители на C1-6алкиле и С2-6алкениле могут быть одинаковыми или различными относительно друг друга и являются, каждый независимо, выбранными из группы заместителей, состоящей из гидрокси, циано, галогена, нитро, N(R4aR4b), N(R4aR4b)сульфонила, Het, Ar2, С1-6алкилокси, C1-6алкил-S(=O)t, Ar2окси, Ar2-S(=O)t, Ar2С1-6алкилокси, Ar2С1-6алкил-S(=O)t, Het-окси, Het-S(=O)t, HetC1-6алкилокси, HetC1-6алкил-S(=O)t, карбоксила, C1-6алкилоксикарбонила и -C(= Z)Ar2;
в случае, когда R2a является отличным от водорода, тогда R2b представляет собой водород, C1-6алкил или галоген и R3b представляет собой водород;
в случае, когда R3a является отличным от водорода, тогда R3b представляет собой водород, C1-6алкил или галоген и R2b представляет собой водород;
R4a и R4b могут быть одинаковыми или различными относительно друг друга и являются, каждый независимо, выбранными из группы заместителей, состоящей из водорода, C1-6алкила, Ar2C1-6алкила, (Ar2)(гидрокси)C1-6алкила, Het-C1-6алкила, гидроксиC1-6алкила, моно- и ди(C1-6алкилокси)C1-6алкила, (гидроксиC1-6алкил)оксиС1-6алкила, Ar1C1-6алкилокси-C1-6алкила, дигидроксиC1-6алкила, (C1-6алкилокси)(гидрокси)C1-6алкила, (Ar1C1-6алкилокси)(гидрокси)C1-6алкила, Ar1окси-C1-6алкила, (Ar1окси)(гидрокси)-C1-6алкила, аминоC1-6алкила, моно- и ди(С1-6алкил)аминоС1-6алкила, карбоксилС1-6алкила, C1-6алкилоксикарбонилC1-6алкила, аминокарбонилC1-6алкила, моно- и ди(C1-6алкил)аминокарбонилC1-6алкила, C1-6алкилкарбонилC1-6алкила, (С1-4алкилокси)2Р(=O)-C1-6алкила, (С1-4алкилокси)2Р(=O)-O-C1-6алкила, аминосульфонил-C1-6алкила, моно- и ди(С1-6алкил)
аминосульфонилC1-6алкила, C1-6алкилкарбонила, Ar2карбонила, Het-карбонила, Ar2C1-6алкилкарбонила, Het-C1-6алкилкарбонила, C1-6алкилсульфонила, аминосульфонила, моно- и ди(С1-6алкил)аминосульфонила, Ar2сульфонила, Ar2C1-6алкилсульфонила, Ar2, Het, Het-сульфонила, Het-C1-6алкилсульфонила;
R5 представляет собой водород или C1-6алкил;
R5a и R5b могут быть одинаковыми или различными относительно друг друга и каждый независимо представляет собой водород или C1-6алкил; или
R5a и R5b, взятые вместе, могут образовыврть двухвалентный радикал формулы -(CH2)s-, где s равен 4 или 5;
R5c и R5d могут быть одинаковыми или различными относительно друг друга и каждый независимо представляет собой водород или C1-6алкил; или
R5c и R5d, взятые вместе, могут образовывать двухвалентный радикал формулы -(CH2)s-, где s равен 4 или 5;
Ar1 представляет собой фенил или фенил, замещенный 1 или несколькими, например 2, 3 или 4, заместителями, выбранными из галогена, гидрокси, C1-6алкила, гидроксиC1-6алкила, полигалогенС1-6алкила и C1-6алкилокси;
Ar2 представляет собой фенил, фенил, аннелированный с C5-7циклоалкилом, или фенил, замещенный 1 или несколькими, например 2, 3, 4 или 5, заместителями, выбранными из галогена, циано, C1-6алкила, Het-C1-6алкила, Ar1C1-6алкила, цианоC1-6алкила, С2-6алкенила, цианоС2-6алкенила, R6b-O-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-O-С3-6алкинила, Ar1, Het, R6b-O-, R6b-S-, R6c-SO-, R6c-SO2-, R6b-O-C1-6алкил-SO2-, -N(R6aR6b), полигалоген-C1-6алкила, полигалогенС1-6алкилокси, полигалогенC1-6алкилтио, R6c-С(=O)-, R6b-O-C(=O)-, N(R6aR6b)-C(=O)-, R6b-O-C1-10алкила, R6b-S-C1-6алкила, R6c-S(=O)2-C1-6алкила, N(R6aR6b)-C1-6алкила, R6c-C(=O)-C1-6алкила, R6b-O-C(=O)-C1-6алкила, N(R6aR6b)-C(=O)-С1-6алкила, R6c-C(=O)-NR6b-, R6c-C(=O)-O-, R6c-С(=O)-NR6b-C1-6алкила, R6c-C(=O)-O-C1-6алкила, N(R6aR6b)-S(=O)2-, H2N-C(=NH)-;
R6a представляет собой водород, C1-6алкил, Ar1, Ar1C1-6алкил, C1-6алкилкарбонил, Ar1карбонил, Ar1C1-6алкилкарбонил, C1-6алкилсульфонил, Ar1сульфонил, Ar1C1-6алкилсульфонил, C1-6алкилоксиC1-6алкил, аминоC1-6алкил, моно- или ди(С1-6алкил)аминоC1-6алкил, гидроксиC1-6алкил, (карбоксил)-C1-6алкил, (C1-6алкилоксикарбонил)-C1-6алкил, аминокарбонилC1-6алкил, моно- и ди(C1-6алкил)аминокарбонилC1-6алкил, аминосульфонилC1-6алкил, моно- и ди(C1-6алкил)аминосульфонил-C1-6алкил, Het, Het-C1-6алкил, Het-карбонил, Het-сульфонил, Het-C1-6алкилкарбонил;
R6b представляет собой водород, C1-6алкил, Ar1 или Ar1C1-6алкил;
R6c представляет собой C1-6алкил, Ar1 или Ar1C1-6алкил;
Het представляет собой гетероцикл, выбранный из тетрагидрофуранила, тетрагидротиенила, пирролидинила, пирролидинонила, фуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, тиадиазолила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, пиридила, пиразинила, пиридазинила, пиримидинила, тетрагидрохинолинила, хинолинила, изохинолинила, бензодиоксанила, бензодиоксолила, индолинила, индолила, каждый из указанных гетероциклов может необязательно быть замещен оксо, амино, Ar1, С1-4алкилом, аминоС1-4алкилом, Ar1C1-4алкилом, моно- или ди(C1-6алкил)аминоС1-6алкилом, моно- или ди(C1-6алкил)амино, (гидроксиC1-6алкил)амино и, необязательно, дополнительно одним или двумя С1-4алкильными радикалами.
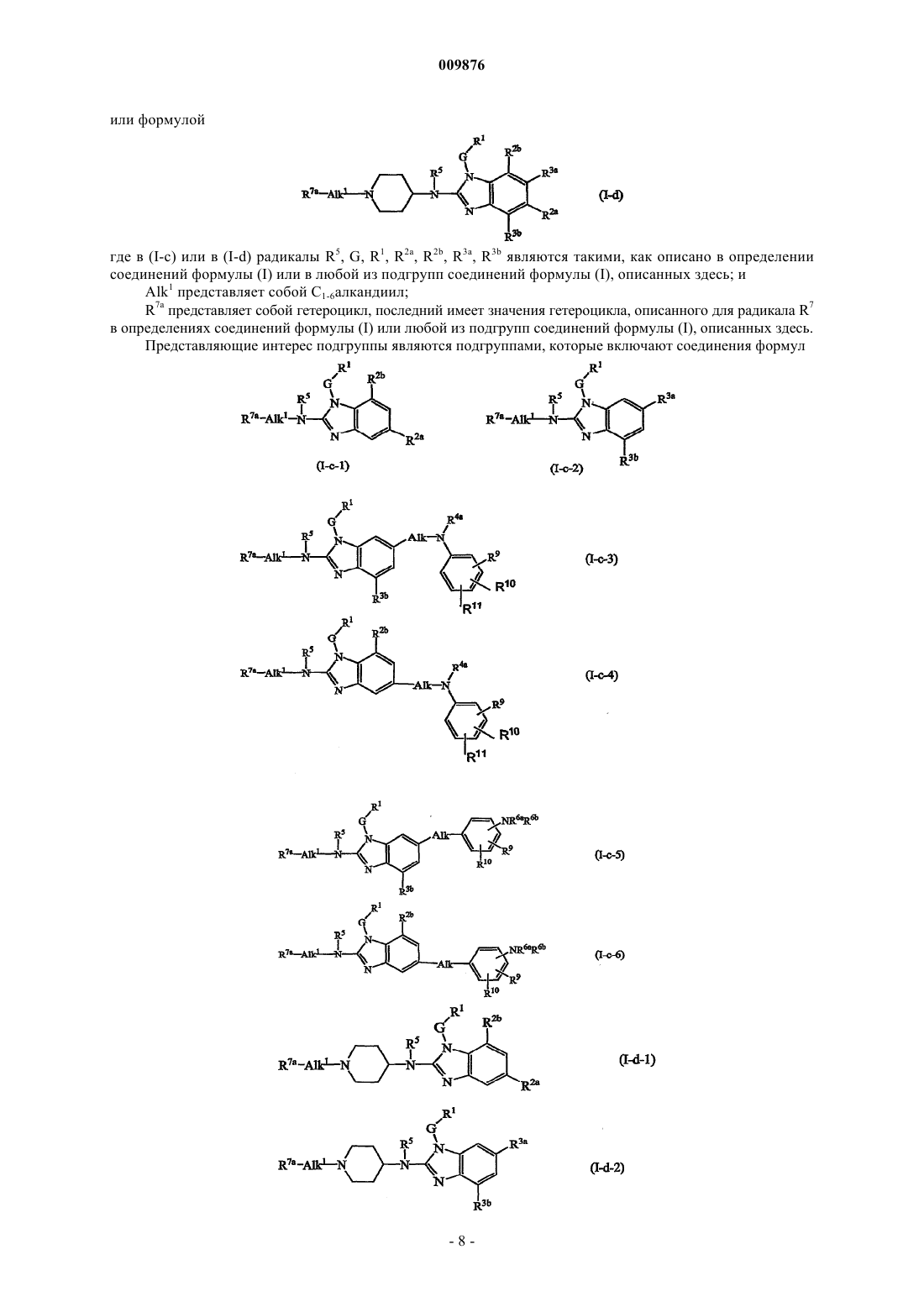
2. Соединение по п.1, где соединение имеет формулу
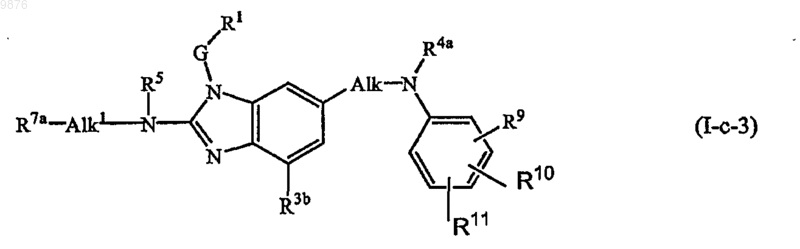
где R5, G, R1, R3b, R4a являются такими, как в п.1, Alk1 представляет собой C1-6алкандиил; R7a представляет собой гетероцикл, который выбирается из группы, состоящей из оксазолидина, тиазолидина, 1-оксотиазолидина, 1,1-диоксотиазолидина, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, гексагидрооксазепина, гексагидротиазепина, 1-оксогексагидротиазепина и 1,1-диоксогексагидротиазепина; где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-6алкила, гидрокси, карбоксила, C1-4алкилоксикарбонила, аминокарбонила, моно- или ди(С1-4алкил)аминокарбонила, С1-4алкилкарбониламино, аминосульфонила и моно- или ди(С1-4алкил)аминосульфонила; и
R9, R10, R11, каждый независимо, выбираются из галогена, циано, C1-6алкила, Het-C1-6алкила, Ar1C1-6алкила, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, R6b-O-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-O-С3-6алкинила, Ar1, Het, R6b-O-, R6b-S-, R6c-SO-, R6c-SO2-, R6b-O-C1-6алкил-SO2-, -N(R6aR6b), полигалогенС1-6алкила, полигалогенС1-6алкилокси, полигалогенС1-6алкилтио, R6c-С(=O)-, R6b-O-C(=O)-, N(R6aR6b)-C(=O)-, R6b-O-C1-6алкила, R6b-S-C1-6алкила, R6c-S(=O)2-C1-6алкила, N(R6aR6b)-C1-6алкила, R6c-C(=O)-C1-6алкила, R6b-O-C(=O)-C1-6алкила, N(R6aR6b)-C(=O)-C1-6алкила, R6c-C(=O)-NR6b-, R6c-C(=O)-O-, R6c-C(=O)-NR6b-C1-6алкила, R6c-C(=O)-O-C1-6алкила, N(R6aR6b)-S (=O)2-, H2N-C(=NH)-; и
Alk представляет собой C1-6алкандиил.
3. Соединение по п.2, где R7a представляет собой гетероцикл, где указанный гетероцикл представляет собой оксазолидин, тиазолидин, морфолинил или тиоморфолинил, где каждый из указанных гетероциклов может необязательно быть замещен одним или двумя заместителями, выбранными из группы, состоящей из C1-6алкила, гидроксиC1-6алкила, аминокарбонилС1-6алкила.
4. Соединение по п.2, где R7a представляет собой морфолинил.
5. Соединение по п.2, где Alk представляет собой метилен.
6. Соединение по п.2, где Alk1 представляет собой C1-4алкандиил.
7. Соединение по п.2, где R9, R10, R11 выбираются из C1-6алкила, Het-C1-6алкила, Ar1C1-6алкила, цианоC1-6алкила, C2-6алкенила, цианоС2-6алкенила, R6b-O-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-O-С3-6алкинила, R6b-O-C1-6алкила, R6b-S-C1-6алкила, R6c-S(=O)2-C1-6алкила, N(R6aR6b)-C1-6алкила, R6b-O-C(=O)-C1-6алкила и N(R6aR6b)-C(=O)-C1-6алкила.
8. Соединение по п.2, где R9, R10, R11 выбираются из C1-6алкила, Het-C1-6алкиыр, Ar1-C1-6алкила, цианоC1-6алкила, C2-6алкенила, циано-С2-6алкенил, С2-6алкинила, цианоС2-6алкинил, R6b-O-C1-6алкила, амино-S(=O)2-C1-6алкила, R6b-O-C(=O)-C1-6алкила, амино-С(=O)-C1-6алкила, моно- и диамино-С(=O)-C1-6алкила.
9. Соединение по п.2, где R9, R10, R11 представляют собой C1-6алкил или R6b-O-C1-6алкил и R10 и/или R11 могут также представлять собой водород.
10. Соединение по любому из пп.1-9, где G представляет собой C1-10алкандиил.
11. Соединение по любому из пп.1-9, где G представляет собой метилен.
12. Соединение по любому из пп.1-11, где R1 представляет собой фенил, необязательно замещенный одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидрокси, C1-6алкила, C1-6алкилокси; хинолинила; радикал (с-4), где m равен 2, необязательно замещенный самое большее двумя радикалами, выбранными из C1-6алкила; бензимидазолил, необязательно замещенный C1-6алкилом; пиридил, необязательно замещенный одним или двумя радикалами, выбранными из гидрокси, галогена, C1-6алкила, бензилокси и C1-6алкилокси; пиразинил, необязательно замещенный самое большее тремя радикалами, выбранными из C1-6алкила; или пиридил, замещенный или необязательно замещенный одним или двумя радикалами, выбранными из группы, состоящей из галогена, гидрокси, C1-6алкила, C1-6алкилокси, Ar1C1-6алкилокси, (C1-6алкилокси)C1-6алкилокси.
13. Соединение по любому из пп.1-11, где R1 представляет собой пиридил, необязательно замещенный одним или двумя радикалами, выбранными из гидрокси, галогена, C1-6алкила, бензилокси и C1-6алкилокси.
14. Соединение по любому из пп.1-11, где R1 представляет собой пиридил, необязательно замещенный одним или двумя радикалами, выбранными из гидрокси и C1-6алкила, C1-6алкилокси.
15. Соединение по любому из пп.1-14, в котором, когда это применимо, один из R2a и R3a выбирается из (R4aR4b)N-CO-; C1-6алкила, необязательно замещенного гидрокси, Ar2, Het или -N(R4aR4b); и С2-6алкенила, замещенного Ar1; и другой из R2d и R3a представляет собой водород; или
в случае, когда R2a является отличным от водорода, тогда R2b представляет собой водород или C1-6алкил и R3b представляет собой водород;
в случае, когда R3a является отличным от водорода, тогда R3b представляет собой водород или C1-6алкил и R2b представляет собой водород;
Ar1, Ar2, Het, R4a и R4b являются такими, как в определениях соединений формулы (I) или как в любой подгруппе, описанной здесь.
16. Соединение по п.15, в котором, когда это применимо, как R2b, так и R3b представляют собой водород.
17. Соединение по п.1, где соединение представляет собой 2-[6-{[2-(3-гидроксипропил)-5-метилфениламино]метил}-2-(3-морфолин-4-илпропиламино)бензимидазол-1-илметил]-6-метилпиридин-3-ол.
18. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения, как описано по любому из пп.1-17.
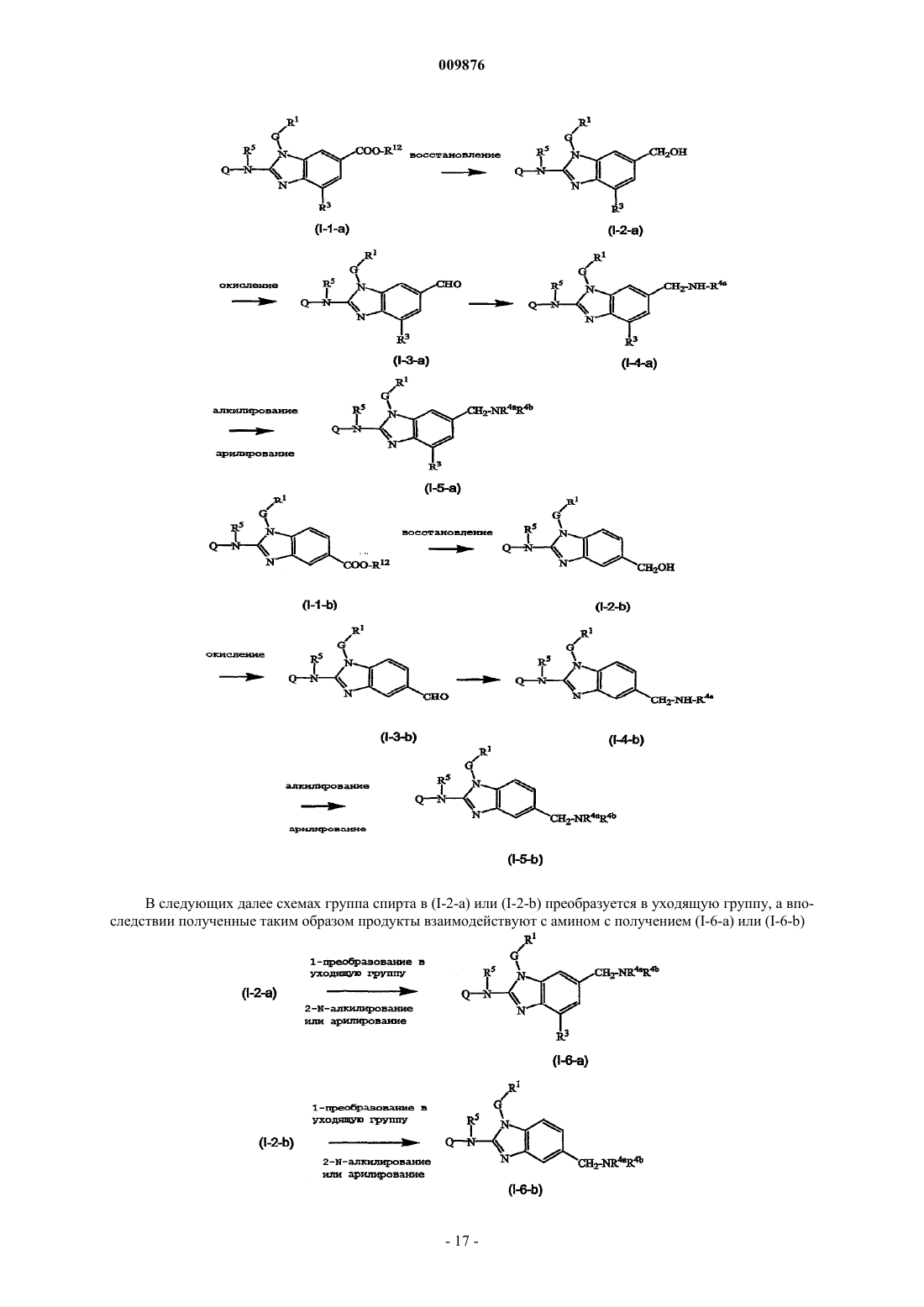
19. Способ получения соединения по любому из пп.1-17, где указанный способ включает восстановление соединения (I-1-a) или (I-1-b) с получением соединения (I-2-a) или (I-2-b) с последующим окислением группы спирта в (I-2-a) или (I-2-b) с помощью мягкого окислителя с получением промежуточного соединения (I-3-а) или (I-3-b) с последующим алкилированием (I-3-a) или (I-3-b) с получением (I-4-a) или (I-4-b), который дополнительно алкилируется с получением (I-5-a) или (I-5-b), как в следующих далее схемах реакций, где R12 представляет собой C1-6алкил, где R4a и R4b являются такими, как определено в пп.1-17, но являются иными, чем водород:
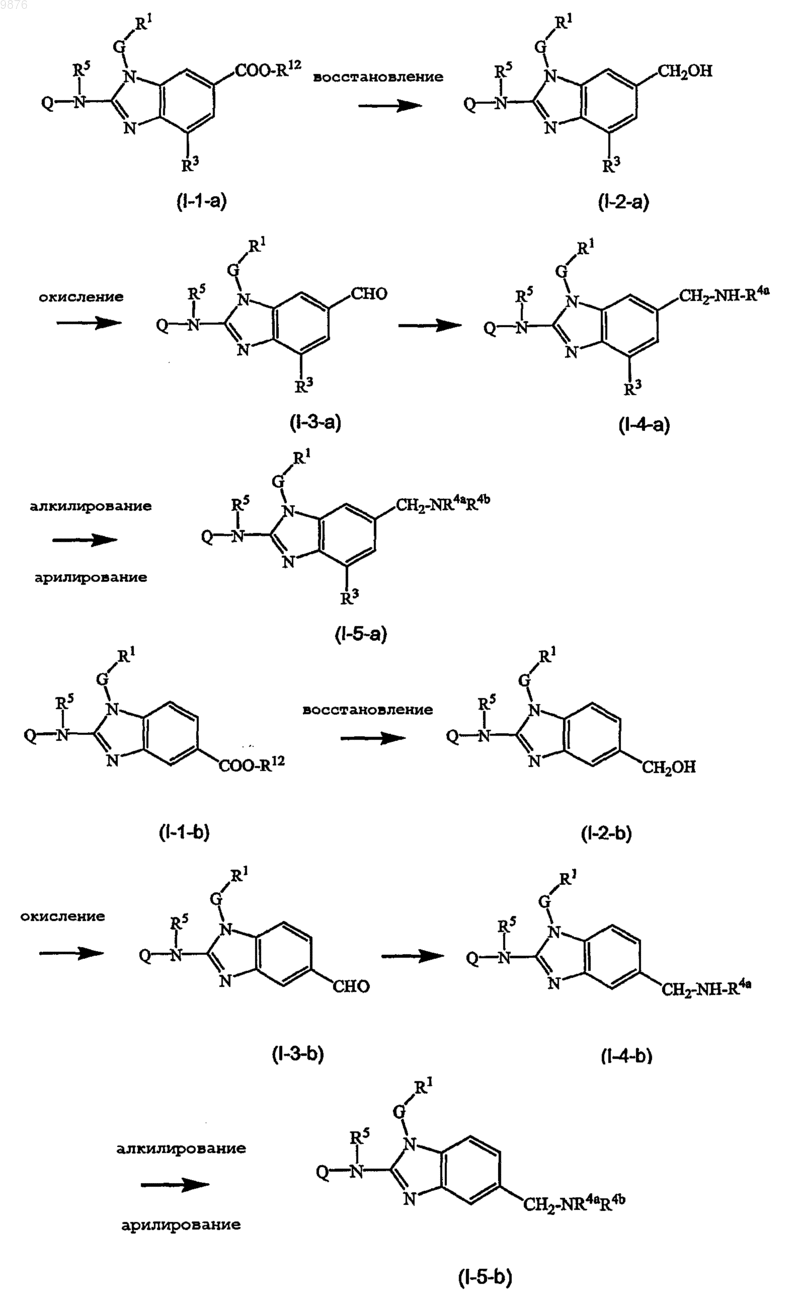
и необязательное преобразование полученных таким образом соединений формулы (I) в их фармацевтически приемлемую форму основно-аддитивной соли или кислотно-аддитивной соли посредством обработки с помощью соответствующего основания или кислоты, и наоборот, обработки формы основно-аддитивной или кислотно-аддитивной соли кислотой или основанием с получением свободной формы соединения формулы (I).
20. Способ получения соединения по любому из пп.1-17, где указанный способ включает
преобразование группы спирта в (I-2-a) или (I-2-b) в уходящую группу и последующее взаимодействие полученных таким образом продуктов с амином с получением (I-6-а) или (I-6-b):

и необязательное преобразование полученных таким образом соединений формулы (I) в их фармацевтически приемлемую форму основно-аддитивной соли или кислотно-аддитивной соли посредством обработки с помощью соответствующего основания или кислоты, и наоборот, обработки формы основно-аддитивной или кислотно-аддитивной соли кислотой или основанием с получением свободной формы соединения формулы (I).
Текст
009876 Настоящее изобретение относится к морфолинилсодержащим бензимидазолам, имеющим противовирусную активность, в частности имеющим ингибирующую активность в отношении репликации респираторно-синцитиального вируса (RSV). Кроме того, оно относится к их получению и к композициям,содержащим эти соединения.RSV, или респираторно-синцитиальный вирус человека, представляет собой большой РНК-вирус,член семейства Paramyxoviridae, подсемейства pneumoviridae вместе с бычьим вирусом RSV. RSV человека является ответственным за некоторый набор заболеваний дыхательных путей у людей всех возрастов по всему миру. Он представляет собой главную причину заболеваний нижнего отдела дыхательных путей у младенцев и детей. Более половины всех младенцев встречается с RSV в первый год их жизни, и почти все - в свои первые 2 года. Инфекция у маленьких детей может вызвать повреждения легких, которые могут продолжаться в течение нескольких лет, и может вносить вклад в хроническое заболевание легких в последующей жизни (хроническое свистящее дыхание, астма). Дети более старшего возраста и взрослые часто страдают от сильной обычной простуды при инфекции RSV. В старшем возрасте восприимчивость опять увеличивается, и RSV участвует в ряде случаев пневмонии у пожилых людей, которые приводят к значительной смертности. Инфекция вирусом из данной подгруппы не защищает против последующей инфекции изолятомRSV из той же подгруппы в следующем зимнем сезоне. Повторное инфицирование RSV является, таким образом, распространенным, несмотря на существование только двух подтипов, А и В. В настоящее время только три лекарственных средства являются одобренными для использования против инфекции RSV. Первое представляет собой рибавирин, аналог нуклеозида, он обеспечивает аэрозольное лечение серьезной инфекции RSV у госпитализированных детей. Аэрозольный способ введения,токсичность (риск тератогенности), стоимость и большой разброс по эффективности ограничивают его использование. Два других лекарственных средства, RespiGam и паливизумаб, иммуностимуляторы поликлональных и моноклональных антител, предназначаются для использования превентивным образом. Все другие попытки до настоящего времени разработать безопасную и эффективную вакцину RSV оказались неудачными. Инактивированные вакцины не могут защитить против заболевания и, на самом деле, в некоторых случаях, усиливают заболевание во время последующей инфекции. Живые ослабленные вакцины пытались применять с ограниченным успехом. Очевидно, имеется необходимость в эффективном, нетоксичном и простом при введении лекарственном средстве против репликации RSV. Ранее бензимидазолы и имидазопиридины в качестве ингибиторов репликации RSV описывались вWO 01/00611, WO 01/00612 и WO 01/00615. Несколько серий бензимидазолил- и имидазопиридинил-пиперидинов описаны в патентах, в заявках на патенты и публикациях Janssen Pharmaceutica N.V. в качестве соединений, обладающих антигистаминными свойствами. См., например, европейские патенты ЕР-А-5318, ЕР-А-99139, ЕР-А-145037, WO92/01687, Janssens F. et al., в Journal of Medicinal Chemistry, Am. Chem. Soc., Vol. 28, no. 12, pp. 1934-1943(1985). Настоящее изобретение относится к ингибиторам репликации RSV, которые могут быть представлены формулой (I) их пролекарствам, N-оксидам, аддитивным солям, четвертичным аминам, комплексам с металлами и их стереохимически изомерным формам, гдеG представляет собой прямую связь или C1-10 алкандиил, необязательно замещенный 1 или несколькими заместителями, индивидуально выбранными из группы заместителей, состоящей из гидрокси, C1-6 алкилокси, Ar1C1-6 алкилокси, C1-6 алкилтио, Ar1C1-6 алкилтио, НО(-СН 2-CH2-О)n-, C1-6 алкилокси(-СН 2-CH2O)n- или Ar1C1-6 алкилокси(-СН 2-CH2-О)n-;R1 представляет собой Ar1 или моноциклический или бициклический гетероцикл, выбранный из пиперидинила, пиперазинила, пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тетрагидрофуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, хинолинила, хиноксалинила, бензофуранила, бензотиенила, бензимидазолила,бензоксазолила, бензтиазолила, пиридопиридила, нафтиридинила, 1 Н-имидазо[4,5-b]пиридинила, 3 Нимидазо[4,5-b]пиридинила, имидазо[1,2-а]пиридинила, 2,3-дигидро-1,4-диоксино[2,3-b]пиридила или радикала формулы где каждый из указанных моноциклических или бициклических гетероциклов может необязательно быть замещен 1 или, где это возможно, несколькими, например 2, 3, 4 или 5, заместителями, индивидуально выбранными из группы заместителей, состоящей из галогена, гидрокси, амино, циано, карбоксила, C1-6 алкила, C1-6 алкилокси, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкила, Ar1, Ar1C1-6 алкила, Ar1C1-6 алкилокси, гидроксиC1-6 алкила, моно- или ди(C1-6 алкил)амино, моно- или ди(C1-6 алкил)аминоC1-6 алкила, полигалогенС 1-6 алкила, C1-6 алкилкарбониламино, C1-6 алкил-SO2-NR5c-, Ar1-SO2-NR5c-, C1-6 алкилоксикарбонила, -С(=O)-NR5cR5d,НО(-CH2-CH2-O)n-, галоген(-CH2-CH2-O)n-, C1-6 алкилокси(-CH2-CH2-O)n-, Ar1C1-6 алкилокси(-CH2-CH2-O)n- и моно- или ди(C1-6 алкил)амино(-CH2-CH2-O)n-; каждый n независимо равен 1, 2, 3 или 4; каждый m независимо равен 1 или 2; каждый р независимо равен 1 или 2; каждый t независимо равен 0, 1 или 2;R7 представляет собой C1-6 алкил, замещенный гетероциклом, или R7 представляет собой C1-6 алкил,замещенный как радикалом -OR8, так и гетероциклом, где указанный гетероцикл выбирается из группы,состоящей из оксазолидина, тиазолидина, 1-оксотиазолидина, 1,1-диоксотиазолидина, морфолинила,тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, гексагидрооксазепина, гексагидротиазепина, 1-оксогексагидротиазепина, 1,1-диоксогексагидротиазепина; где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила, аминокарбонилС 1-6 алкила, гидрокси, карбоксила, С 1-4 алкилоксикарбонила, аминокарбонила, моно- или ди(С 1-4 алкил)аминокарбонила, C1-4 алкилкарбониламино, аминосульфонила и моно- или ди(С 1-4 алкил)аминосульфонила;=Z представляет собой =O, =СН-С(=O)-NR5aR5b, =CH2, =CH-C1-6 алкил, =N-OH или =N-O-C1-6 алкил; и необязательные заместители на C1-6 алкиле и С 2-6 алкениле могут быть одинаковыми или различными относительно друг друга и являются, каждый, независимо выбранными из группы заместителей, состоящей из гидрокси, циано, галогена, нитро, N(R4aR4b), N(R4aR4b)сульфонила, Het, Ar2, C1-6 алкилокси, C1-6 алкилS(=O)t, Ar2 окси, Ar2-S(=O)t, Ar2C1-6 алкилокси, Ar2C1-6 алкил-S(=O)t, Het-окси, Het-S(=O)t, Het-C1-6 алкилокси, HetC1-6 алкил-S(=O)t, карбоксила, C1-6 алкилоксикарбонила и -C(=Z)Ar2; в случае, когда R2a является отличным от водорода, тогда R2b представляет собой водород, C1-6 алкил или галоген и R3b представляет собой водород; в случае, когда R3a является отличным от водорода, тогда R3b представляет собой водород, C1-6 алкил или галоген и R2b представляет собой водород;R4a и R4b могут быть одинаковыми или различными относительно друг друга и являются, каждый,независимо выбранными из группы заместителей, состоящей из водорода, C1-6 алкила, Ar2C1-6 алкила,(Ar2)(гидрокси)C1-6 алкила, Het-C1-6 алкила, гидроксиC1-6 алкила, моно- и ди(C1-6 алкилокси)C1-6 алкила,(гидроксиC1-6 алкил)оксиC1-6 алкила, Ar1C1-6 алкилоксиC1-6 алкила, дигидроксиC1-6 алкила, (C1-6 алкилокси)R5a представляет собой водород или C1-6 алкил;R5a и R5b могут быть одинаковыми или различными относительно друг друга и, каждый, независимо представляют собой водород или C1-6 алкил; илиR5a и R5b, взятые вместе, могут образовывать двухвалентный радикал формулы -(CH2)s-, где s равен 4 или 5;R5c и R5d могут быть одинаковыми или различными относительно друг друга и, каждый, независимо представляют собой водород или C1-6 алкил; илиR5c и R5d, взятые вместе, могут образовывать двухвалентный радикал формулы -(CH2)s-, где s равен 4 или 5;Ar1 представляет собой фенил или фенил, замещенный 1 или несколькими, например 2, 3 или 4, заместителями, выбранными из галогена, гидрокси, C1-6 алкила, гидроксиC1-6 алкила, полигалогенС 1-6 алкила и C1-6 алкилокси;Het представляет собой гетероцикл, выбранный из тетрагидрофуранила, тетрагидротиенила, пирролидинила, пирролидинонила, фуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, тиадиазолила, пиперидинила, гомопиперидинила,пиперазинила, морфолинила, пиридила, пиразинила, пиридазинила, пиримидинила, тетрагидрохинолинила, хинолинила, изохинолинила, бензодиоксанила, бензодиоксолила, индолинила, индолила, каждый из указанных гетероциклов может необязательно быть замещен оксо, амино, Ar1, C1-4 алкилом, аминоС 1-4 алкилом, Ar1C1-4 алкилом, моно- или ди(C1-6 алкил)аминоС 1-6 алкилом, моно- или ди(C1-6 алкил)амино,(гидроксиC1-6 алкил)амино и, необязательно, кроме того, 1 или 2 C1-6 алкильными радикалами. Настоящее изобретение относится к применению соединений формулы (I) или его пролекарства, Nоксида, аддитивной соли, четвертичного амина, комплекса с металлом и стереохимически изомерной формы для производства лекарственного средства для ингибирования репликации RSV. Или настоящее изобретение относится к способу ингибирования репликации RSV у теплокровного животного, где указанный способ включает введение эффективного количества соединения формулы (I) или его пролекарства, N-оксида, аддитивной соли, четвертичного амина, комплекса с металлом и стереохимически изомерной формы. В дополнительном аспекте настоящее изобретение относится к новым соединениям формулы (I), а также к способам получения этих соединений. Термин "пролекарство", как используется в настоящем тексте, обозначает фармакологически приемлемые производные, например сложные эфиры и амиды, так что получаемый продукт биологического преобразования производного представляет собой активное лекарственное средство, как определяется в соединениях формулы (I). Ссылка Goodman и Gilman (The Pharmacological Basis of Therapeutics, 8th ed.,McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15), описывающая пролекарства в общей форме, тем самым, включается сюда. Пролекарства отличаются хорошей растворимостью в воде и биодоступностью и легко метаболизируются в активные ингибиторы in vivo. Термины "полизамещенный C1-6 алкил" и "полизамещенный С 2-6 алкенил", такие, как используются при определении R2 а и R3 а, включают C1-6 алкильные радикалы, имеющие 2 или более заместителей, например 2, 3, 4, 5 или 6 заместителей, конкретно 2 или 3 заместителя, более конкретно 2 заместителя. Верхний предел количества заместителей определяется количеством атомов водорода, которые могут замещаться, а также общими свойствами заместителей, такими как их объемность, эти свойства дают возможность специалисту в данной области для определения указанного верхнего предела. Термин "C1-10 алкандиил, необязательно замещенный 1 или несколькими заместителями", как используется в определении G, как подразумевается, включает C1-10 алкандиильные радикалы, не имеющие,имеющие 1, 2 или более заместителей, например без заместителей, 1, 2, 3, 4, 5 или 6 заместителей, конкрет-3 009876 но без заместителей, 1, 2 или 3 заместителя, более конкретно без заместителей, 1 или 2 заместителя. Здесь также верхний предел количества заместителей определяется посредством факторов, рассмотренных выше. Как используется выше и ниже, "полигалогенС 1-6 алкил" в качестве группы или части группы, например полигалогенС 1-6 алкилокси, определяется как моно- или полигалогензамещенный C1-6 алкил, конкретно C1-6 алкил, замещенный, самое большее, 1, 2, 3, 4, 5, 6 или более атомами галогена, например метил или этил с 1 или несколькими атомами фтора, например дифторметил, трифторметил, трифторэтил. Также включенными являются перфторС 1-6 алкильные группы, которые представляют собой C1-6 алкильные группы, в которых все атомы водорода заменяются атомами фтора, например пентафторэтил. В том случае, если более 1 атома галогена присоединяется к алкильной группе в пределах определения полигалогенС 1-6 алкил, атомы галогена могут быть одинаковыми или различными. Каждый из моноциклических или бициклических гетероциклов в определении R1 может необязательно быть замещен 1 или, где это возможно, большим количеством заместителей, например 2, 3, 4 или 5 заместителями. Конкретно, указанные гетероциклы могут необязательно быть замещены, самое большее, 4, самое большее, 3, самое большее, 2 заместителями или, самое большее, 1 заместителем. Каждый Ar1 или Ar2 может представлять собой незамещенный фенил или фенил, замещенный 1 или несколькими заместителями, например 5 или 4 заместителями, или, что является предпочтительным, самое большее, 3 заместителями, или, самое большее, 2 заместителями, или 1 заместителем. Радикал R6b-O-С 3-6 алкенил или R6b-O-С 3-6 С 3-6 алкинил, такой как рассматривается среди заместителей Ar2, конкретно, имеет группу R6b-O- на насыщенном атоме углерода. ГидроксиС 1-6 алкильная группа, когда она является заместителем на атоме кислорода или атоме азота, предпочтительно представляет собой гидроксиС 2-6 алкильную группу, где гидроксигруппа и кислород или азот отделены друг от друга по меньшей мере 2 атомами углерода. ДигидроксиС 1-6 алкильная группа, как рассмотрено, например, в определении R4a и R4b, представляет собой C1-6 алкильную группу, имеющую 2 гидроксизаместителя, которые конкретно являются заместителями на различных атомах углерода. Термины (C1-6 алкилокси)(гидрокси)C1-6 алкил, ди(C1-6 алкилокси)C1-6 алкил, (Ar1C1-6 алкилокси(гидрокси)C1-6 алкил относятся к C1-6 алкильному радикалу, замещенному, так же,как и C1-6 алкилокси и гидроксигруппами, двумя C1-6 алкилоксигруппами и Ar1C1-6 алкилокси и гидроксигруппой, соответственно. Предпочтительно в этих радикалах заместители на C1-6 алкильной группе находятся на атоме углерода, ином, чем углерод, связанный с атомом азота, с которым соединены R4a и/или R4b. Как здесь используется, C1-3 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 3 атомов углерода, такие как метил, этил, пропил, 1-метилэтил и т.п.; С 1-4 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как группа, определенная для C1-3 алкила, и бутил, и т.п.; С 2-4 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие от 2 до 4 атомов углерода, такие как этил, пропил, 1-метилэтил, бутил и т.п.; C1-6 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как группы, определенные для C1-4 алкила, и пентил, гексил, 2-метилбутил и т.п.; C1-9 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 9 атомов углерода,такие как группы, определенные для C1-6 алкила, и гептил, октил, нонил, 2-метилгексил, 2-метилгептил и т.п.; C1-10 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 10 атомов углерода, такие как группы, определенные для C1-9 алкила, и децил, 2-метилнонил и т.п. Термин "С 3-6 алкенил", используемый здесь, в качестве группы или части группы, как подразумевается, включает ненасыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие по меньшей мере одну двойную связь или предпочтительно имеющие одну двойную связь и от 3 до 6 атомов углерода, такие как пропенил, бутен-1-ил, бутен-2-ил, пентен-1-ил, пентен-2-ил, гексен-1-ил, гексен-2-ил, гексен-3-ил, 2-метилбутен-1-ил и т.п. Термин "С 2-6 алкенил", используемый здесь, в качестве группы или части группы, как подразумевается, включает С 3-6 алкенильные группы и этилен. Термин "С 3-6 алкинил" определяет ненасыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие одну тройную связь и от 3 до 6 атомов углерода, такие как пропенил, бутин-1-ил, бутин-2-ил,пентин-1-ил, пентин-2-ил, гексин-1-ил, гексин-2-ил, гексин-3-ил, 2-метилбутин-1-ил и т.п. Термин "С 2-6 алкинил", используемый здесь, в качестве группы или части группы, как подразумевается, включает С 3-6 алкинильные группы и этинил. С 3-7 Циклоалкил представляет собой общее обозначение для циклопропила, циклобутила, циклопентила, циклогексила и циклогептила. С 2-5 Алкандиил определяет двухвалентные насыщенные углеводородные радикалы с прямой и разветвленной цепью, имеющие от 2 до 5 атомов углерода, такие, например, как 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил, 1,5-пентандиил и т.п.; С 1-4 алкандиил определяет двухвалентные насыщенные углеводородные радикалы с прямой и разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие, например, как метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил и т.п.; C1-6-4 009876 алкандиил, как подразумевается, включает C1-4 алкандиил и его высшие гомологи, имеющие от 5 до 6 атомов углерода, такие, например, как 1,5-пентандиил, 1,6-гександиил и т.п.; C1-10 алкандиил, как подразумевается, включает C1-6 алкандиил и его высшие гомологи, имеющие от 7 до 10 атомов углерода, такие, например, как 1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10-декандиил и т.п. Как здесь используется, термин "R7 представляет собой C1-6 алкил, замещенный как радикалом -OR8,так и гетероциклом" относится к C1-6 алкильному радикалу, несущему 2 заместителя, то есть группу -OR8 и гетероцикл, и присоединенному к остальной части молекулы через атом углерода C1-6 алкильного остатка. Предпочтительно группа -OR8 присоединяется к атому углерода C1-6 алкильного остатка, который не находится рядом (не в -положении) с гетероатомом (таким как атом азота). Более предпочтительно радикал "R7, будучи C1-6 алкилом, замещенным как радикалом -OR8, так и гетероциклом", представляет собой радикал, который может быть представлен формулой -CH2-CH(OR8)-CH2-. Гетероцикл в R7 предпочтительно соединен с группой C1-6 алкила через атом азота. Радикалы гексагидрооксазепин, гексагидротиазепин, 1-оксогексагидротиазепин и 1,1-диоксогексагидротиазепин предпочтительно представляют собой 1,4-гексагидрооксазепин, 1,4-гесагидротиазепин, 1-оксо-1,4-гексагидротиазепин и 1,1-диоксо-1,4-гексагидротиазепин. Как здесь использовалось до этого, термин (=O) образует карбонильный остаток, когда присоединяется к атому углерода, сульфоксидный остаток, когда присоединяется к атому серы, и сульфонильный остаток, когда два указанных =O присоединены к атому серы. Группа (=N-OH) образует гидроксииминовый остаток, когда присоединяется к атому углерода. Термин "галоген" представляет собой общее обозначение для фтора, хлора, брома и йода. Как используется выше и ниже, полигалогенC1-6 алкил в качестве группы или части группы определяется как моно- или полигалогензамещенный C1-6 алкил, конкретно метил с 1 или несколькими атомами фтора, например дифторметил или трифторметил. В случае, когда более 1 атома галогена присоединяются к алкильной группе в пределах определения полигалогенC1-4 алкил, атомы галогена могут быть одинаковыми или различными. Необходимо отметить, что положение радикалов на любом молекулярном остатке, используемом в определениях, может находиться на таком остатке где угодно, пока он является химически стабильным. Радикалы, используемые в определениях переменных, включают все возможные изомеры, если не указано иного. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3-пентил. Когда любая переменная встречается более 1 раза в любом компоненте, каждое определение является независимым. При каждом последующем использовании термин "соединения формулы (I)", или "настоящие соединения", или сходный термин, как подразумевается, включает соединения общей формулы (I), их пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы. Представляющая интерес подгруппа соединений формулы (I) или любой их подгруппы представляет собой N-оксиды, соли и все стереоизомерные формы соединений формулы (I). Будет понятно, что некоторые соединения формулы (I) могут содержать один или несколько центров хиральности и существовать как стереохимически изомерные формы. Термин "стереохимически изомерные формы", как используется выше, определяет все возможные соединения, состоящие из одних и тех же атомов, соединенных посредством одной и той же последовательности связей, но имеющие различные трехмерные структуры, которые не являются взаимозаменяемыми, которыми могут обладать соединения формулы (I). Если не рассмотрено или не указано иного, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которыми может обладать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений по настоящему изобретению как в чистой форме, так и в смеси друг с другом, как предполагается, охватываются рамками настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных соединений, как указано здесь, определяются как изомеры, по существу, не содержащие других энантиомерных или диастереомерных форм одной и той же основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере от 90% (т.е., минимум, 90% одного изомера и, максимум, 10% остальных возможных изомеров) до стереоизомерного избытка 100%(т.е. 100% одного изомера и нет других), более конкретно к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток от 90 до 100%, еще более конкретно имеющим стереоизомерный избыток от 94 до 100% и наиболее конкретно имеющим стереоизомерный избыток от 97 до 100%. Термины "энантиомерно чистый" и "диастеромерно чистый" должны пониматься подобным же образом, но тогда принимается во внимание энантиомерный избыток, диастереомерный избыток рассматриваемой смеси, соответственно. Чистые стереоизомерные формы соединений и промежуточных соединений по настоящему изобретению могут быть получены посредством применения процедур, известных из литературы. Например,-5 009876 энантиомеры могут отделяться друг от друга посредством селективной кристаллизации их диастереомерных солей с помощью оптически активных кислот или оснований. Их примеры представляют собой винную кислоту, дибензоилвинную кислоту, дитолуоилвинную кислоту и камфорсульфоновую кислоту. Альтернативно, энантиомеры могут разделяться с помощью хроматографических методик с использованием хиральных стационарных фаз. Эти чистые стереохимически изомерные формы могут также быть получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, при условии, что реакция осуществляется стереоспецифически. Предпочтительно,если желаемым является конкретный стереоизомер, указанное соединение будет синтезироваться посредством стереоспецифических способов получения. Эти способы будут преимущественно использовать энантиомерно чистые исходные материалы. Диастереомерные рацематы формулы (I) могут получаться отдельно с помощью обычных способов. Соответствующие способы физического разделения, которые могут использоваться преимущественно, представляют собой, например, селективную кристаллизацию и хроматографию, например колоночную хроматографию. Для некоторых соединений формулы (I), их пролекарств, N-оксидов, солей, сольватов, четвертичных аминов или комплексов с металлами и промежуточных соединений, используемых при их получении, абсолютная стереохимическая конфигурация не является определенной экспериментально. Специалист в данной области способен определить абсолютную конфигурацию таких соединений с использованием способов, известных из литературы, таких, например, как рентгеноструктурный анализ. Настоящее изобретение также, как предполагается, включает все изотопы атомов, имеющихся в настоящих соединениях. Изотопы включают атомы, которые имеют одинаковый атомный номер, но различные массовые числа. В качестве общего примера и без ограничения изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. Для терапевтического использования соли соединений формулы (I) представляют собой соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, либо фармацевтически приемлемые, либо нет, включаются в рамки настоящего изобретения. Фармацевтически приемлемые кислотно-аддитивные и основно-аддитивные соли, как рассмотрено выше, как подразумевается, включают терапевтически активные формы кислотно-аддитивных и основно-аддитивных солей, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли удобно получать посредством обработки формы основания такой соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты,такие как галогенводородные кислоты, например хлористо-водородную или бромисто-водородную кислоту, серную, азотную, фосфорную и т.п. кислоты; или органические кислоты, такие, например, как уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксибутандиовая кислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, п-аминосалициловая, памовая и им подобные кислоты. Наоборот, указанные солевые формы могут преобразовываться посредством обработки соответствующим основанием в форму свободного основания. Соединения формулы (I), содержащие кислые протоны, также могут преобразовываться в их нетоксичные формы солей металлов или аддитивных солей аминов посредством обработки соответствующими органическими и неорганическими основаниями. Соответствующие формы основных солей включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например бензатиновые, N-метил-D-глюкаминовые, гидрабаминовые соли, и соли с аминокислотами, такими, например, как аргинин, лизин и т.п. Термин "аддитивная соль", как используется выше, также включает сольваты, которые способны образовывать соединения формулы (I), а также и его соли. Такие сольваты представляют собой, например, гидраты, алкоголяты и т.п. Термин "четвертичный амин", как используется выше, определяет соли четвертичного аммония, которые способны образовывать соединения формулы (I) посредством взаимодействия между основным азотом соединения формулы (I) и соответствующим кватернизующим агентом, таким, например, как необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например метилйодид или бензилйодид. Также могут использоваться и другие реагенты с подходящими уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, йод,трифторацетат и ацетат. Выбранный противоион может вводиться с использованием ионообменных смол.(I), в которых 1 или несколько атомов азота окисляются до так называемого N-оксида. Будет ясно, что соединения формулы (I) могут иметь свойства связывания, хелатирования, комплексообразования с металлом и по этой причине могут существовать как комплексы с металлами или хелаты металлов. Такие металлированные производные соединений формулы (I), как предполагается,-6 009876 должны включаться в рамки настоящего изобретения. Некоторые из соединений формулы (I) могут существовать также в их таутомерной форме. Такие формы, хотя и не указываются явно в приведенной выше формуле, как предполагается, включаются в рамки настоящего изобретения. Один из вариантов осуществления настоящего изобретения относится к соединениям формулы (I-а) где Q, R5, G, R1, R2a, R2b являются такими, как описано в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных здесь. Другой вариант осуществления настоящего изобретения относится к соединениям формулы (I-b) где Q, R5, G, R1, R3a, R3b являются такими, как описано в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных здесь. Один из конкретных вариантов осуществления настоящего изобретения относится к соединениям формулы (I-а-1) где Q, R5, G, R1, R4a и R2b являются такими, как описано в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных здесь; иR9, R10, R11 независимо друг от друга имеют такие же значения, как заместители на Ar2, как указано в определениях соединений формулы (I) или любой из их подгрупп; и R10 и/или R11 могут также представлять собой водород. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы (I-b-1) где Q, R5, G, R1, R4a и R3b являются такими, как описано в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных здесь; иR9, R10, R11 независимо друг от друга имеют такие же значения, как заместители на Ar2, как указано в определениях соединений формулы (I) или любой из их подгрупп; и R10 и/или R11 могут также представлять собой водород. Другие варианты осуществления настоящего изобретения представляют собой группы соединений,которые могут быть представлены формулой где в (I-c) или в (I-d) радикалы R5, G, R1, R2a, R2b, R3a, R3b являются такими, как описано в определении соединений формулы (I) или в любой из подгрупп соединений формулы (I), описанных здесь; иR7a представляет собой гетероцикл, последний имеет значения гетероцикла, описанного для радикала R7 в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных здесь. Представляющие интерес подгруппы являются подгруппами, которые включают соединения формул-8 009876 где в (I-c-1), (I-c-2), (I-c-3), (I-c-4), (I-c-5), (I-c-6), (I-d-1) или (I-d-2) радикалы R5, G, R1, R2a, R2b, R3a, R3b являются такими, как описано в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных здесь; и радикалы Alk, Alk1, R7a, R9, R10, R11 являются такими, как описано выше или в любой из подгрупп соединений формулы (I), описанных здесь; и в (I-c-5) и (I-c-6) R6a и R6b являются такими, как описано в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных здесь. Предпочтительные подгруппы представляют собой такие подгруппы соединений формулы (I), гдеR7a представляет собой гетероцикл, выбранный из группы, состоящей из оксазолидина, тиазолидина,морфолинила, тиоморфолинила, гексагидрооксазепина, гексагидротиазепина; где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила, аминокарбонилС 1-6 алкила, гидрокси, карбоксила, C1-4 алкилоксикарбонила, аминокарбонила, моно- или ди(C1-4 алкил)аминокарбонила, C1-4 алкилкарбониламино, аминосульфонила и моно- или ди(С 1-4 алкил)аминосульфонила; или, предпочтительно, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы,состоящей из C1-6 алкила, гидроксиC1-6 алкила, аминокарбонилС 1-6 алкила, карбоксила, C1-4 алкилоксикарбонила, аминокарбонила, моно- или ди(С 1-4 алкил)аминокарбонила; или, более предпочтительно, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила, аминокарбонилС 1-6 алкила. Более предпочтительные подгруппы представляют собой такие подгруппы соединений формулы (I),где R7a представляет собой гетероцикл, где указанный гетероцикл представляет собой оксазолидин, тиазолидин, морфолинил, или тиоморфолинил, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила, аминокарбонилС 1-6 алкила. Дополнительные предпочтительные подгруппы представляют собой такие подгруппы соединений формулы (I), где R7a представляет собой гетероцикл, где указанный гетероцикл представляет собой морфолинил или тиоморфолинил, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиC1-6 алкила и аминокарбонилC1-6 алкила. Дополнительные предпочтительные подгруппы представляют собой такие подгруппы соединений формулы (I), где R7a представляет собой гетероцикл, где указанный гетероцикл представляет собой морфолинил, который может необязательно быть замещен 1 или 2 заместителями, выбранными из группы,состоящей из C1-6 алкила, гидроксиC1-6 алкила, аминокарбонилС 1-6 алкила. Наиболее предпочтительные подгруппы представляют собой такие подгруппы соединений формулы (I), где R7a представляет собой морфолинил. Дополнительные предпочтительные подгруппы представляют собой такие, где Alk представляет собой этилен или метилен, более предпочтительно, где Alk представляет собой метилен. Дополнительные предпочтительные подгруппы представляют собой такие, где Alk1 представляет собой C1-4 алкандиил, более предпочтительно, где Alk1 представляет собой С 2-3 алкандиил. В (I-a-1), (I-b-1), (I-c-3) или (I-c-4) R4a предпочтительно представляет собой водород, гидроксиC1-6 алкил, аминокарбонилС 1-6 алкил. В (I-a-1), (I-b-1), (I-е) (I-d), (I-c-1), (I-c-2), (I-c-3), (I-c-4), (I-c-5), (I-c-6), (I-d-1) или (I-d-2) радикалыR9, R10, R11 предпочтительно и независимо друг от друга представляют собой C1-6 алкил или R6b-OC1-6 алкил; иR10 и/или R11 могут также представлять собой водород; илиR9, R10 более предпочтительно и независимо друг от друга представляют собой C1-6 алкил или R6b-OC1-6 алкил; иR9, R10 еще более предпочтительно представляют собой C1-6 алкил и R11 представляет собой водород; илиR9 представляет собой C1-6 алкил, R10 представляет собой R6b-O-C1-6 алкил и R11 представляет собой водород. Необходимо понять, что определенные выше подгруппы соединений формул (I-a), (I-b) и т.п., а также любая другая подгруппа, определенная здесь, как подразумевается, также включает любые пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы таких соединений. Конкретные подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где G представляет собой C1-10 алкандиил, более конкретно такие, где G представляет собой метилен. Другие конкретные подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где:(b) R1 представляет собой Ar1 или моноциклический гетероцикл, который является таким, как ука-9 009876 зано в определениях соединений формулы (I) или любой из их подгрупп. Дополнительные конкретные подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где:(c) R1 представляет собой пиридил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, гидрокси, амино, циано, карбоксила, C1-6 алкила, C1-6 алкилокси, C1-6 алкилтио, C1-6 алкилоксиС 1-6 алкила, Ar1, Ar1C1-6 алкила, Ar1C1-6 алкилокси, гидроксиС 1-6 алкила,моно- или ди(C1-6 алкил)амино, моно- или ди(С 1-6 алкил)аминоС 1-6 алкила, полигалогенС 1-6 алкила, C1-6 алкилкарбониламино, C1-6 алкил-SO2-NR4a-, Ar1-SO2-NR4a-, C1-6 алкилоксикарбонила, -С(=O)-NR4aR4b, НО(-CH2CH2-O)n-, галоген (-CH2-CH2-O)n-, C1-6 алкилокси(-CH2-CH2-O)n-, Ar1C1-6 алкилокси(-CH2-CH2-O)n- и моноили ди(C1-6 алкил)амино(-CH2-CH2-O)n-; или более конкретно(d) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, C1-6 алкила, галогена, C1-6 алкилокси, Ar1C1-6 алкилокси и (C1-6 алкилокси)C1-6 алкилокси; предпочтительно, где:(e) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, C1-6 алкила, галогена и C1-6 алкилокси; или где:(f) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси и C1-6 алкила; более предпочтительно, где:(i) R1 представляет собой 3-гидрокси-6-метилпирид-2-ил. Дополнительные варианты осуществления включают такие соединения формулы (I) или любой из подгрупп соединений формулы (I), где:(k) R1 представляет собой Ar1, хинолинил, бензимидазолил или радикал формулы (с-4), где m равен 2, пиразинил или пиридил; где каждый из радикалов в (j) и (k) может необязательно быть замещен заместителями, описанными в определении соединений формулы (I) и конкретно пиридил может быть замещен, как указано выше в (a)-(i). Дополнительные варианты осуществления включают такие соединения формулы (I) или любой из подгрупп соединений формулы (I), где:(l) R1 представляет собой Ar1, хинолинил, бензимидазолил или радикал формулы (с-4), где m равен 2, пиразинил, или пиридил, где каждый из этих радикалов может необязательно быть замещен 1, 2 или 3 радикалами, выбранными из группы, состоящей из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, Ar1C1-6 алкилокси, (C1-6 алкилокси)C1-6 алкилокси; или, более конкретно, где:(m) R1 представляет собой Ar1, хинолинил, бензимидазолил или радикал формулы (с-4), где m равен 2, пиразинил, или пиридил, где каждый из этих радикалов может необязательно быть замещен 1, 2 или 3 радикалами, выбранными из группы, состоящей из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, бензилокси; или, более конкретно, где:(n) R1 представляет собой фенил, необязательно замещенный 1, 2 или 3 радикалами, выбранными из группы, состоящей из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси; хинолинил; радикал (с-4), где m равен 2, необязательно замещенный, самое большее, 2 радикалами, выбранными из C1-6 алкила; бензимидазолил, необязательно замещенный C1-6 алкилом; пиридил, необязательно замещенный 1 или 2 радикалами, выбранными из гидрокси, галогена, C1-6 алкила, бензилокси и C1-6 алкилокси; пиразинил, необязательно замещенный, самое большее, 3 радикалами, выбранными из C1-6 алкила; или пиридил, замещенный или необязательно замещенный, как указано выше в (а)-(i); или где:(q) R1 представляет собой радикал (с-4), где m равен 2, необязательно замещенный, самое большее,2 радикалами, выбранными из C1-6 алкила;(r) R1 представляет собой бензимидазолил, необязательно замещенный C1-6 алкилом; пиридил, необязательно замещенный 1 или 2 радикалами, выбранными из гидрокси, галогена, C1-6 алкила, бензилокси и C1-6 алкилокси,(s) R1 представляет собой пиразинил, необязательно замещенный, самое большее, 3 радикалами,выбранными из C1-6 алкила. Предпочтительные подгруппы соединений формулы (I) или любой из подгрупп соединений форму- 10009876 лы (I) представляют собой подгруппы, где G представляет собой прямую связь или метилен и R1 является таким, как указано выше в (a)-(s). Более предпочтительными являются соединения формулы (I) или любой из подгрупп, описанных здесь, где G представляет собой прямую связь и R1 представляет собой радикал (с-4), конкретно, где m равен 2, необязательно замещенные, самое большее, 2 радикалами, выбранными из C1-6 алкила. Более предпочтительными являются соединения формулы (I) или любой из подгрупп, описанных здесь, где G представляет собой метилен и R1 является таким, как указано выше в (a)(s), но является иным, чем радикал (с-4). Дополнительные конкретные подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где R5 представляет собой водород. Другие конкретные подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где Q представляет собой R7. Представляющие интерес соединения представляют собой такие соединения формулы (I) или любой из подгрупп, описанных здесь, где Q представляет собой R7 и последний представляет собой C1-6 алкил, замещенный гетероциклом, или R7 представляет собой C1-6 алкил, замещенный как радикалом -OR8,так и гетероциклом, где указанный гетероцикл выбирается из группы, состоящей из оксазолидина, тиазолидина, морфолинила, тиоморфолинила, гексагидрооксазепина, гексагидротиазепина; где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиC1-6 алкила, аминокарбонилC1-6 алкила, гидрокси, карбоксила,C1-4 алкилоксикарбонила, аминокарбонила, моно- или ди(С 1-4 алкил)аминокарбонила, С 1-4 алкилкарбониламино, аминосульфонила и моно- или ди(С 1-4 алкил)аминосульфонила; или, предпочтительно, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила, аминокарбонилC1-6 алкила, карбоксила, C1-4 алкилоксикарбонила, аминокарбонил, моно- или ди(C1-4 алкил)аминокарбонила; или, более предпочтительно,где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиC1-6 алкила, аминокарбонилC1-6 алкила. Представляющая интерес подгруппа соединений представляет собой такие соединения формулы (I) или любой из подгрупп, описанных здесь, где Q представляет собой R7 и последний представляет собой-OR8, так и гетероциклом, где указанный гетероцикл представляет собой оксазолидин, тиазолидин, морфолинил или тиоморфолинил, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила, аминокарбонилС 1-6 алкила. Дополнительная представляющая интерес подгруппа соединений представляет собой такие соединения формулы (I) или любой из подгрупп, описанных здесь, где Q представляет собой R7 и последний представляет собой C1-6 алкил, замещенный гетероциклом, или R7 представляет собой C1-6 алкил, замещенный как радикалом -OR8, так и гетероциклом, где указанный гетероцикл представляет собой морфолинил или тиоморфолинил, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиC1-6 алкила и аминокарбонилC1-6 алкила. Еще одна дополнительная представляющая интерес подгруппа соединений представляет собой такие соединения формулы (I) или любой из подгрупп, описанных здесь, где Q представляет собой R7 и последний представляет собой C1-6 алкил, замещенный морфолинилом, который может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила, аминокарбонил-C1-6 алкила, или, предпочтительно, где Q представляет собой R7 и последний представляет собой C1-6 алкил, замещенный морфолинилом. Другие конкретные подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где Q представляет собой пирролидинил, замещенный R7, пиперидинил, замещенный R7, или гомопиперидинил, замещенный R7; конкретно, где Q представляет собой пиперидинил, замещенный R7. Еще другие конкретные подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где Q представляет собой пирролидинил, замещенный R7, пиперидинил, замещенный R7, или гомопиперидинил, замещенный R7; конкретно, где Q представляет собой пиперидинил, замещенный R7; где:C1-6 алкил, замещенный как радикалом -OR8, так и гетероциклом, где указанный гетероцикл представляет собой оксазолидин, тиазолидин, морфолинил, тиоморфолинил, гексагидрооксазепин или гексагидротиазепин; где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксилС 1-6 алкила, аминокарбонилС 1-6 алкила,гидрокси, карбоксила, C1-4 алкилоксикарбонила, аминокарбонила, моно- и ди(С 1-4 алкил)аминокарбонила,C1-4 алкилкарбониламино, аминосульфонила и моно- или ди(С 1-4 алкил)аминосульфонила; или, предпочтительно, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксилС 1-6 алкила, аминокарбонилС 1-6 алкила,- 11009876 карбоксила, С 1-4 алкилоксикарбонила, аминокарбонила, моно и ди(С 1-4 алкил)аминокарбонила; или, более предпочтительно, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила; или(b) где каждый R7 представляет собой C1-6 алкил, замещенный гетероциклом, или R7 представляет собой C1-6 алкил, замещенный как радикалом -OR8, так и гетероциклом, где указанный гетероцикл представляет собой оксазолидин, тиазолидин, морфолинил или тиоморфолинил, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила и аминокарбонилС 1-6 алкила; или(c) где каждый R7 представляет собой C1-6 алкил, замещенный гетероциклом, или R7 представляет собой C1-6 алкил, замещенный как радикалом -OR8 , так и гетероциклом, где указанный гетероцикл представляет собой морфолинил или тиоморфолинил, где каждый из указанных гетероциклов может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила, гидроксиС 1-6 алкила и аминокарбонилС 1-6 алкила; или(d) где каждый R7 представляет собой C1-6 алкил, замещенный морфолинилом, который может необязательно быть замещен 1 или 2 заместителями, выбранными из группы, состоящей из C1-6 алкила,гидроксиC1-6 алкила, аминокарбонилC1-6 алкила; или предпочтительно(е) где Q представляет собой R7 и последний представляет собой C1-6 алкил, замещенный морфолинилом. Особенный интерес представляют соединения формулы (I) или любой из подгрупп, описанных здесь, где R8 представляет собой водород. Другие подгруппы соединений формулы (I) представляют собой соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где:(a) R4a и R4b являются, каждый, независимо выбранными из водорода, C1-6 алкила, Ar2C1-6 алкила,2(b) R4a и R4b являются, каждый, независимо выбранными из водорода, C1-6 алкила, Ar2C1-6 алкила,2(c) R4a и R4b являются, каждый, независимо выбранными из водорода, C1-6 алкила, Ar2C1-6 алкила,2(d) R4a и R4b являются, каждый, независимо выбранными из водорода, C1-6 алкила, (Ar2)(гидрокси)C1-6 алкила, Het-C1-6 алкила, гидроксиC1-6 алкила, (C1-6 алкилокси)C1-6 алкила, (гидроксиС 1-6 алкил)оксиC1-6 алкила, Ar1C1-6 алкилоксиC1-6 алкила, Ar1 оксиC1-6 алкила, (Ar1 окси)(гидрокси)C1-6 алкила, аминоC1-6 алкила, моно- и ди(C1-6 алкил)аминоC1-6 алкила, карбоксилC1-6 алкила, аминокарбонилС 1-6 алкила, моно- и ди(C1-6 алкил)аминокарбонилC1-6 алкила, (C1-4 алкилокси)2 Р(=O)C1-6 алкила, (С 1-4 алкилокси)2 Р(=O)-O-C1-6 алкила,аминосульфонилC1-6 алкила, моно- и ди(C1-6 алкил)аминосульфонилС 1-6 алкила и Ar1. Представляющие интерес подгруппы соединений формулы (I) представляют такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где:(e) R4a и R4b являются, каждый, независимо выбранными из водорода, морфолинилC1-6 алкила,гидроксиC1-6 алкила, (C1-6 алкилокси)C1-6 алкила, аминоC1-6 алкила, моно- и ди(С 1-6 алкил)аминоC1-6 алкила,карбоксилC1-6 алкила, аминокарбонилС 1-6 алкила, моно- и ди(C1-6 алкил)аминокарбонилC1-6 алкила, аминосульфонилC1-6 алкила, моно- и ди(C1-6 алкил)аминосульфонилC1-6 алкила и Ar1; или где:(f) R4 а и R4b являются, каждый, независимо выбранными из водорода, гидроксиC1-6 алкила, (C1-6 алкилокси)C1-6 алкила, аминоС 1-6 алкил, моно- и ди(C1-6 алкил)аминоС 1-6 алкила, карбоксилC1-6 алкила, аминокарбонилС 1-6 алкила, моно- и ди(C1-6 алкил)аминокарбонилC1-6 алкила; или где:(g) R4a и R4b являются, каждый, независимо выбранными из водорода, гидроксиС 1-6 алкила, аминокарбонилС 1-6 алкила, моно- и ди(C1-6 алкил)аминокарбонилC1-6 алкила; или где:(h) R4a и R4b являются, каждый, независимо выбранными из водорода, гидроксиC1-6 алкила и аминокарбонилС 1-6 алкила. Другие представляющие интерес подгруппы соединений формулы (I) представляют такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где R4a представляет собой водород и R4b является таким, как указано выше в определениях, ограниченных (a)-(h). Другие подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где:(e) Ar2 представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями или 1 или 2 заместителями, выбранными из C1-6 алкила, Het-C1-6 алкила, Ar1-C1-6 алкила, цианоC1-6 алкила, C2-6 алкенила,цианоС 2-6 алкенила, гидроксиС 3-6 алкенила, С 2-6 алкинила, цианоС 2-6 алкинила, гидроксиС 3-6 алкинила, R6bO-C1-6 алкила, амино-S(=O)2-C1-6 алкила, N(R6aR6b)-C1-6 алкила, R6b-O-C(=O)-C1-6 алкила, амино-С(=O)-C1-6 алкила, моно- и диC1-6 алкиламино-С(=O)-C1-6 алкила;(g) Ar2 представляет собой фенил, или фенил, замещенный 1, 2 или 3 заместителями или 1 или 2 заместителями, выбранными из C1-6 алкила, R6b-O-C1-6 алкила и амино-С(=O)-C1-6 алкила или выбранными изC1-6 алкила, гидрокси-C1-6 алкила и амино-С(=O)-C1-6 алкила. Ограничения при замещениях на Ar2, как указано в (а)-(g), выше, предпочтительно применяются к любому Ar2, являющемуся частью радикала R2a или R3a, представляющему собой C1-6 алкил, замещенный радикалом -NR4aR4b, где R4a и/или R4b является или являются радикалом Ar2. Другие подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где:(h) Ar2 представляет собой фенил, замещенный C1-6 алкилом, Het-C1-6 алкилом, Ar1-C1-6 алкилом,цианоC1-6 алкило, С 2-6 алкенилом, цианоС 2-6 алкенилом, С 2-6 алкинилом, цианоС 2-6 алкинилом, R6b-O-C1-6 алкилом, амино-S(=O)2-C1-6 алкилом, R6b-O-C(=O)-C1-6 алкилом, амино-С(=O)-C1-6 алкилом, моно- и ди-C1-6 алкиламино-С(=O)-C1-6 алкилом; и необязательно дополнительно замещенный 1 или 2 из заместителей(i) Ar2 представляет собой фенил, замещенный R6b-O-C1-6 алкилом, амино-С(=O)-C1-6 алкилом; или фенил, замещенный гидрокси-C1-6 алкилом, амино-С(=O)-C1-6 алкилом; и дополнительно необязательно замещенный 1 или 2 заместителями на Ar2, рассмотренными выше в ограничениях (а)-(g). Ограничения при замещениях на Ar2, как указано в (h)-(i), выше, предпочтительно применяются к любому Ar2, являющемуся частью радикала R28 или R3a, представляющему собой C1-6 алкил, замещенный радикалом Ar2. Дополнительные подгруппы представляют собой соединения формулы (I) или любой из подгрупп(b) R6a более конкретно представляет собой водород, C1-6 алкил, Ar1, Ar1C1-6 алкил, C1-6 алкилоксиC1-6 алкил, аминоC1-6 алкил, моно- или ди(C1-6 алкил)аминоC1-6 алкил, гидроксиС 1-6 алкил, (карбоксил)C1-6 алкил,(C1-6 алкилоксикарбонил)C1-6 алкил, аминокарбонилС 1-6 алкил, моно- и ди(C1-6 алкил)аминокарбонилС 1-6 алкил, аминосульфонилС 1-6 алкил, моно- и ди(C1-6 алкил)аминосульфонилC1-6 алкил, Het, Het-C1-6 алкил;(c) R6a более конкретно представляет собой водород, C1-6 алкил, Ar1C1-6 алкил, C1-6 алкилоксиC1-6 алкил, аминоC1-6 алкил, моно-или ди(C1-6 алкил)аминоC1-6 алкил, гидроксиC1-6 алкил, (карбоксил)C1-6 алкил,(C1-6 алкилоксикарбонил)C1-6 алкил, аминокарбонилC1-6 алкил, моно- и ди(C1-6 алкил)аминокарбонилC1-6 алкил, аминосульфонилС 1-6 алкил, моно- и ди(C1-6 алкил)аминосульфонилC1-6 алкил, Het-C1-6 алкил;(d) R6a более конкретно представляет собой водород, C1-6 алкил, Ar1C1-6 алкил, аминоC1-6 алкил, гидрокси(е) R6a более конкретно представляет собой водород, гидроксиC1-6 алкил, аминокарбонилС 1-6 алкил,аминосульфонилC1-6 алкил; или где:(e) R6a представляет собой водород, C1-6 алкил, Ar1 или Ar1C1-6 алкил; или R6a представляет собой водород или C1-6 алкил; или R6a представляет собой водород. Дополнительные подгруппы представляют собой соединения формулы (I) или любой из подгрупп соединений формулы (I), где:(f) R6b предпочтительно представляет собой водород или C1-6 алкил или более предпочтительно представляет собой водород;(g) R6c предпочтительно представляет собой C1-6 алкил. В группе соединений формулы (I) или в любой из подгрупп соединений формулы (I):(a) Ar1 предпочтительно представляет собой фенил или фенил, замещенный, самое большее, 3 заместителями, или, самое большее, 2 заместителями, или 1 заместителем, выбранным из галогена, гидрокси, C1-6 алкила, гидроксиC1-6 алкила, трифторметила и C1-6 алкилокси;(b) Ar1 более предпочтительно представляет собой фенил или фенил, замещенный, самое большее, 3 заместителями, или, самое большее, 2 заместителями, или 1 заместителем, выбранным из галогена, гидрокси, C1-6 алкила и C1-6 алкилокси;(c) Ar1 более предпочтительно представляет собой фенил или фенил, замещенный, самое большее, 3 заместителями, или, самое большее, 2 заместителями, или 1 заместителем, выбранным из галогена и C1-6 алкила. Другие подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или любой подгруппы соединений формулы (I), описанных здесь, где:(a) Het представляет собой тетрагидрофуранил, фуранил, тиенил, тиазолил, оксазолил, имидазолил,изотиазолил, пиразолил, изоксазолил, пиперидинил, гомопиперидинил, пиперазинил, морфолинил, пиридил, пиразинил, пиримидинил, тетрагидрохинолинил, хинолинил, изохинолинил, бензодиоксанил, бензодиоксолил, индолинил, индолил, который может необязательно быть замещен оксо, амино, Ar1, C1-4 алкилом, аминоC1-4 алкилом, Ar1C1-4 алкилом, моно- или ди(C1-6 алкил)аминоC1-6 алкилом, моно- или ди(С 1-6 алкил)амино, (гидроксиC1-6 алкил)амино и, необязательно, дополнительно 1 или 2 C1-4 алкильными радикалами; или(b) Het представляет собой тетрагидрофуранил, фуранил, тиенил, тиазолил, оксазолил, имидазолил,пиразолил, изоксазолил, пиперидинил, гомопиперидинил, пиперазинил, морфолинил, пиридил, пиразинил, пиримидинил, тетрагидрохинолинил, хинолинил, изохинолинил, бензодиоксанил, бензодиоксолил,индолинил, индолил, который может необязательно быть замещен оксо, амино, Ar1, C1-4 алкилом, амино(c) Het представляет собой фуранил, тиенил, пиразолил, изоксазолил, морфолинил, пиримидинил,хинолинил, индолинил, который может необязательно быть замещен 1 или 2 C1-4 алкильными радикалами;(d) Het представляет собой морфолинил, который может необязательно быть замещен 1 или 2 C1-4 алкильными радикалами; или(d) Het представляет собой морфолинил. Конкретный вариант осуществления настоящего изобретения относится к соединениям формулы(I), где Q, G, R1 и R5 являются такими, как описано выше, в определении формулы (I), или как в любой из подгрупп соединений формулы (I), описанных здесь; и где:(a) один из R2a и R3a выбирается из -N(R4aR4b), (R4aR4b)N-CO-, C1-6 алкила, замещенного 1 или 2 заместителями, выбранными из гидрокси, циано, Ar2, Het или -N(R4aR4b) и С 2-6 алкенила, замещенного циано или Ar2; а другой из R2d и R3a представляет собой водород; или(c) один из R2a и R3a выбирается из (R4aR4b)N-CO-; C1-6 алкила, необязательно замещенного гидрокси,Ar , Het или -N(R4aR4b); и С 2-6 алкенила, замещенного Ar2; а другой из R2a и R3a представляет собой водород; и в случае, когда R2a является отличным от водорода, тогда R2b представляет собой водород, C1-6 алкил или галоген и R3b представляет собой водород; в случае, когда R3a является отличным от водорода, тогда R3b представляет собой водород, C1-6 алкил или галоген и R2b представляет собой водород;Ar2, Het, R4a и R4b являются такими, как в определениях соединений формулы (I) или как в любой подгруппе, описанной здесь. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы (I), где Q, G, R1 и R5 являются такими, как описано выше в определении формулы (I) или как в любой из подгрупп соединений формулы (I), описанных здесь; и(j) один из R2a и R3a представляет собой C1-6 алкил, необязательно замещенный -N(R4a)Ar2; а другой 2a из R и R3a представляет собой водород; в случае, когда R2a является отличным от водорода, тогда R2b представляет собой водород или C1-6 алкил и R3b представляет собой водород; в случае, когда R3a является отличным от водорода, тогда R3b представляет собой водород или C1-6 алкил и R2b представляет собой водород;Ar2, Het, R4 а и R4b являются такими, как в определениях соединений формулы (I) или как в любой подгруппе, описанной здесь. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы (I), где Q, G, R1 и R5 являются такими, как описано выше в определении формулы (I) или как в любой из подгрупп соединений формулы (I), описанных здесь; где R2a и R3a являются такими, как определено в (a)-(j), выше, и как R2b, так и R3b представляют собой водород. Другой вариант осуществления настоящего изобретения относится к соединениям формулы (I), гдеQ, G, R1 и R5 являются такими, как описано выше в определении формулы (I) или как в любой из подгрупп соединений формулы (I), описанных здесь; где:(k) один из R2a и R3a представляет собой C1-6 алкил; а другой из R2a и R3a представляет собой водород; в случае, когда R2a является отличным от водорода, тогда R2b представляет собой C1-6 алкил и R3b представляет собой водород; в случае, когда R3a является отличным от водорода, тогда R3b представляет собой C1-6 алкил и R2b представляет собой водород. Еще один вариант осуществления настоящего изобретения относится к соединениям формулы (I),где Q, G, R1 и R5 являются такими, как описано выше в определении формулы (I) или как в любой из подгрупп соединений формулы (I), описанных здесь; где один из R2a и R3a выбирается из C1-6 алкила, замещенного -N(R4aR4b), где R4b представляет собой водород; а другой из R2a и R3a представляет собой водород; и в случае, когда R2a является отличным от водорода, тогда R2b представляет собой водород и R3b представляет собой водород; в случае, когда R3a является отличным от водорода, тогда R3b представляет собой водород и R2b представляет собой водород. Еще один вариант осуществления настоящего изобретения относится к соединениям формулы (I),где Q, G, R1 и R5 являются такими, как описано выше или как в любой из подгрупп соединений, описанных здесь; и один из R2a и R3a выбирается из C1-6 алкила, замещенного -N(R4aR4b); а другой из R2a и R3a представляет собой водород; и в случае, когда R2a является отличным от водорода, тогда R2b представляет собой водород и R3b представляет собой водород; в случае, когда R3a является отличным от водорода, тогда R3b представляет собой водород и R2b 2- 15009876 представляет собой водород; и кроме того, когда R4a представляет собой Ar2 и R4b представляет собой C1-6 алкил, Ar2C1-6 алкил, C1-6 алкилоксиС 1-6 алкил, гидроксиC1-6 алкилоксиC1-6 алкил, Ar1C1-6 алкилоксиC1-6 алкил, (C1-6 алкилокси)(гидрокси)C1-6 алкил, (Ar1C1-6 алкилокси)(гидрокси)C1-6 алкил, аминоC1-6 алкил, моно- и ди(С 1-6 алкил)аминоC1-6 алкил, гидроксиC1-6 алкил, аминокарбонилC1-6 алкил, моно- и ди(C1-6 алкил)аминокарбонилC1-6 алкил, C1-4 алкилоксикарбонилC1-6 алкил, гидроксикарбонилC1-6 алкил, Het или Het-C1-6 алкил. Предпочтительные соединения представляют собой такие соединения, которые перечислены в табл. 1-13, более конкретно соединения с номерами 1-128, 131-153, 161-164; 171-182, 185 и 192-293. Наиболее предпочтительными являются соединение 3 в табл. 1, приведенное в примере 11, название которого представляет собой 2-[6-[2(3-гидроксипропил)-5-метилфениламино]метил-2-(3-морфолин-4-илпропиламино)бензимидазол-1-илметил]-6-метилпиридин-3-ол,соединение 58 в табл. 2, приведенное в примере 14, название которого представляет собой 2-[6[(3,5-диметилфенил)-(2-гидроксиэтил)амино]метил-2-(3-морфолин-4-илпропиламино)бензимидазол-1 илметил]-6-метилпиридин-3-ол,соединение 59 в табл. 2, название которого представляет собой 2,2-[6-[(3,5-диметилфенил)-(3-аминокарбонилпропил)амино]метил-2-(3-морфолин-4-илпропиламино)бензимидазол-1-илметил]-6-метилпиридин-3-ол,а также их пролекарства, N-оксиды, аддитивные соли, четвертичные амины и комплексы с металлами, конкретно указанные три соединения и их кислотно-аддитивные соли. Соединения формулы (I) или из любой их подгрупп могут быть получены, как представлено в следующих далее схемах реакций. В этой схеме Q, G, R1, R2a, R2b, R3a, R3b, R5 имеют значения, определенные выше для соединений формулы (I) или любой из их подгрупп. W представляет собой соответствующую уходящую группу,предпочтительно она представляет собой хлор или бром. Реакция по этой схеме, как правило, осуществляется в пригодном для использования растворителе, таком как простой эфир, например THF (тетрагидрофуран), галогенированный углеводород, например дихлорметан, CHCl3, толуол, полярный апротонный растворитель, такой как DMF (диметилформамид), ДМСО, DMA (диметиламин) и т.п. Основание может добавляться для связывания кислоты, которая освобождается во время реакции. Если это желательно,могут добавляться определенные катализаторы, такие как йодидные соли (например, KI). Соединения формулы (I) могут преобразовываться друг в друга, следуя известным из литературы реакциям преобразования функциональных групп, включая те, которые описаны ниже. Соединения формулы (I), где R2a или R3a представляет собой C1-6 алкоксикарбонил или C1-6 алкил,замещенный C1-6 алкоксикарбонилом, может восстанавливаться, например, с помощью LiAlH4 до соответствующих соединений, где R2a или R3a представляет собой гидроксиC1-6 алкил. Последняя группа может окисляться до альдегидной группы, например, с помощью MnO2, которая может затем превращаться в производные с помощью аминов, например с помощью способа восстановительного аминирования, до соответствующих C1-6 алкиламинов или модифицированых аминов. Альтернативно, соединения формулы(I), где R2a или R3a представляют собой гидроксиC1-6 алкил, могут преобразовываться в соответствующие галогенC1-6 алкильные соединения, например, посредством обработки соответствующим галогенирующим агентом, таким как SOCl2 или POCl3, эти соединения впоследствии взаимодействуют с амином или производным амина. Эти реакции могут быть представлены в следующих далее схемах реакций, где соединение (I-1-a) или (I-1-b) восстанавливается, с получением соединения (I-2-a) или (I-2-b), а впоследствии группа спирта в (I-2-a) или (I-2-b) окисляется с помощью мягкого окислителя с получением промежуточного соединения (I-3-a) или (I-3-b), и впоследствии (I-3-a) или (I-3-b) алкилируются с получением (I-4-a) или (I-4-b),которые дополнительно алкилируются с получением (I-5-a) или (I-5-b), где R12 представляет собой C1-6 алкил, где R4a и R4b являются такими, как определено в настоящем описании и формуле изобретения, но являются иными, чем водород. В следующих далее схемах группа спирта в (I-2-а) или (I-2-b) преобразуется в уходящую группу, а впоследствии полученные таким образом продукты взаимодействуют с амином с получением (I-6-a) или (I-6-b)- 17009876 Соединения формулы (I), где R2a или R3a представляет собой альдегид, могут преобразовываться в соответствующие соединения, где R2a или R3a представляет собой С 2-6 алкенил или замещенный С 2-6 алкенил, посредством реакции Виттига или реакции Виттига-Хорнера. В первом случае используется реагент типа Виттига, такой как трифенилфосфонийилид, в соответствующем реакционно-инертном растворителе, таком как простой эфир, исходя из трифенилфосфина и галогенированного производного. Реакция Виттига-Хорнера осуществляется с использованием фосфоната, такого, например, как реагент формулы ди(C1-6 алкилокси)-P(=O)-CH2-CH2-CN, в присутствии основания, предпочтительно сильного основания, в апротонном органическом растворителе. Соединения, где R2 а или R3 а представляет собой С 2-6 алкенил или замещенный С 2-6 алкенил, могут восстанавливаться в соответствующие насыщенные алкилы, например, с помощью водорода, в присутствии соответствующего катализатора, такого как Ni Ренея. Эти реакции могут быть представлены в следующих далее схемах реакции, где промежуточное соединение (I-3-a) или (I-3-b) преобразуется в соединение (I-7-a) или (I-7-b) с использованием реакций Виттига или Виттига-Хорнера; двойная связь в (I-7-a) или (I-7-b) селективно восстанавливается, таким образом, получают соединения (I-8-a) или (I-8-b); цианогруппа в (I-9-a) или (I-9-b) восстанавливается до метиленаминовой группы, таким образом, получаются соединения (I-10-a) или (I-10-b); последние являются моно- или диалкилированными, таким образом, получаются соединения (I-11-а) или (I-11-b); или (I-12-а) или (I-12-b), где Alk1 представляет собой С 4-6 алкандиил, R2a-1 представляет собой любой заместитель на алкениле, как определено в настоящем описании и формуле изобретения, а предпочтительно, где R2a-1 представляет собой Ar2 или CN: Соединения формулы (I), где R2a или R3a представляет собой альдегид, могут также превращаться в производные с помощью реакции типа Гриньяра для введения арильных или алкильных групп. Нитрогруппы могут восстанавливаться до аминогрупп, которые впоследствии могут алкилироваться до моно- или диалкиламиногрупп или ацилироваться до арилкарбониламино- или алкилкарбониламино- и подобных им групп. Цианогруппы могут восстанавливаться до аминометиленовых групп, которые могут превращаться в производные подобным же образом. Ряд промежуточных соединений, используемых для получения соединений формулы (I), являются известными соединениями или представляют собой аналоги известных соединений, которые можно получить, следуя модификациям технологий, известных из литературы, легко доступным для специалиста в данной области. Ряд получений промежуточных соединений приводится далее несколько более подробно. На первой стадии диаминобензол (IV) подвергают циклизации с помощью мочевины в соответствующем растворителе, например в ксилоле, с получением бензимидазолона (V). Последнее соединение преобразуют в производное бензимидазола (V), где W представляет собой уходящую группу, как указано выше, конкретно, посредством взаимодействия (V) с соответствующим галогенирующим агентом, на- 19009876 пример POCl3, и полученное промежуточное соединение (VI) взаимодействует с производным амина(VII) с получением промежуточного соединения (II). Соединения формулы (I) могут преобразовываться в соответствующие N-оксидные формы, если следовать процедурам, известным из литературы, для преобразования трехвалентного азота в его N-оксидную форму. Указанная реакция N-окисления может, как правило, осуществляться посредством взаимодействия исходного материала формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода,пероксиды щелочного металла или щелочно-земельного металла, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать в себя пероксикислоты, такие как, например, пероксобензойная кислота или галогензамещенная пероксобензойная кислота, например 3-хлорпероксобензойная кислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Соответствующие растворители представляют собой,например, воду, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены посредством применения процедур, известных из литературы. Диастереомеры могут разделяться посредством физических способов, таких как селективная кристаллизация, и хроматографических методик, например противоточного распределения, жидкостной хроматографии и т.п. Соединения формулы (I), как получены в описанных выше способах, представляют собой, как правило,рацемические смеси энантиомеров, которые могут отделяться друг от друга, если следовать процедурам разделения, известным из литературы. Рацемические соединения формулы (I), которые являются достаточно основными или кислотными, могут преобразовываться в формы соответствующей диастереомерной соли посредством взаимодействия с соответствующей хиральной кислотой, хиральным основанием, соответственно. Впоследствии указанные формы диастереомерной соли разделяются, например, посредством селективной или фракционированной кристаллизации, и энантиомеры высвобождаются из них посредством щелочи или кислоты. Альтернативный способ выделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут также быть получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, при условии,что реакция осуществляется стереоспецифически. Предпочтительно, если желаемым является конкретный стереоизомер, указанное соединение будет синтезироваться посредством стереоспецифических способов получения. Эти способы будут преимущественно использовать энантиомерно чистые исходные материалы. В дальнейшем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), как описано здесь, или соединения из любой из подгрупп соединений формулы (I), как описано здесь, и фармацевтически приемлемый носитель. Терапевтически эффективное количество в этом контексте представляет собой количество,достаточное для профилактического действия против вирусной инфекции, для стабилизации или уменьшения вирусной инфекции, а конкретно инфекции вируса RSV, у инфицированных субъектов или субъектов с риском инфицирования. Еще в одном аспекте настоящее изобретение относится к способу получения фармацевтической композиции, как здесь описано, который включает тщательное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы(I), как здесь описано, или соединения любой из подгрупп соединений формулы (I), как здесь описано. Следовательно, соединения по настоящему изобретению или любая их подгруппа могут приготавливаться для целей введения в различных фармацевтических формах. В качестве соответствующих композиций могут быть перечислены все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения необязательно в форме аддитивной соли или комплекса с металлами в качестве активного ингредиента объединяется в смеси с фармацевтически приемлемым носителем, этот носитель может принимать разнообразные формы, в зависимости от формы препарата, желаемой для введения. Эти фармацевтические композиции являются желательными в единичной дозированной форме, пригодной, в частности, для перорального, ректального, подкожного введения или введения посредством парентеральной инъекции. Например, при получении композиций в пероральной дозированной форме может использоваться любая из обычных фармацевтических сред, такая, например, как вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензия, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие вещества, дезинтегрирующие агенты и т.п., в случае порошков, пилюль, капсул и таблеток. Из-за простоты их введениятаблетки и капсулы представляют собой наиболее преимущественные пероральные дозированные единичные формы, в этом случае, разумеется, используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать стерильную воду, по меньшей мере, как большую часть, хотя могут включаться и другие ингредиенты, например для увеличения растворимости. Могут приготавливаться растворы для инъекций, например такие, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и рас- 20009876 твора глюкозы. Могут также приготавливаться суспензии для инъекций, в этом случае могут использоваться соответствующие жидкие носители, суспендирующие агенты и т.п. Также сюда включаются препараты в виде твердых форм, которые предназначаются для преобразования, вскоре после использования, в препараты в виде жидких форм. В композициях, пригодных для подкожного введения, носитель необязательно содержит агент для усиления проникновения и/или соответствующий смачивающий агент, необязательно объединенный с соответствующими добавками любой природы в малых пропорциях, эти добавки не оказывают значительного вредного воздействия на кожу. Соединения по настоящему изобретению могут также вводиться посредством пероральной ингаляции или инсуффляции, с помощью способов и композиций, используемых в данной области для введения таким путем. Таким образом, как правило, соединения по настоящему изобретению могут вводиться в легкие в форме раствора, суспензии или сухого порошка, при этом раствор является предпочтительным. Любая система, разработанная для доставки растворов, суспензий или сухих порошков посредством пероральной ингаляции или инсуффляции, является пригодной для введения настоящих соединений. Таким образом, настоящее изобретение также предусматривает фармацевтическую композицию, адаптированную для введения посредством ингаляции или инсуффляции через рот, содержащую соединение формулы (I) и фармацевтически приемлемый носитель. Предпочтительно соединения по настоящему изобретению вводятся посредством ингаляции раствора в дозах, содержащих распыленные мелкодисперсные частицы или аэрозоль. Является особенно преимущественным приготовление указанных выше фармацевтических композиций в единичной дозированной форме для простоты введения и однородности дозировки. Единичная дозированная форма, как здесь используется, относится к физически дискретным единицам, пригодным в качестве единичных доз, каждая единица содержит заданное количество активного ингредиента, рассчитанное для оказания желаемого терапевтического воздействия, в ассоциации с требуемым фармацевтическим носителем. Примеры таких единичных дозированных форм представляют собой таблетки (включая таблетки с насечкой или таблетки с покрытием), капсулы, пилюли, суппозитории, пакетики с порошком,пластинки, растворы или суспензии для инъекций и т.п. и их разделенные комплекты. Соединения формулы (I) демонстрируют противовирусные свойства. Вирусные инфекции, которые могут лечиться с использованием соединений и способов по настоящему изобретению, включают инфекции, вносимые посредством орто- и парамиксовирусов, и конкретно посредством респираторносинцитиального вируса (RSV) человека и быка. Ряд соединений по настоящему изобретению, кроме того,являются активными против мутировавших штаммов RSV. В дополнение к этому, многие соединения по настоящему изобретению демонстрируют благоприятный фармакокинетический профиль и имеют привлекательные свойства с точки зрения биодоступности, включая приемлемый период полувыведения,AUCC (площадь под кривой), и пиковые значения, и отсутствие неблагоприятных явлений, таких как недостаточно быстрое поступление и удерживание в тканях. Противовирусная активность настоящих соединений in vitro против RSV исследуется в анализе, как описано в экспериментальной части описания, и может также быть продемонстрирована в анализе с уменьшением выхода вируса. Противовирусная активность in vivo против RSV настоящих соединений может быть продемонстрирована на опытной модели с использованием хлопковых хомяков, как описаноWyde et al. (Antiviral Research (1998), 38, 31-42). Благодаря их противовирусным свойствам, конкретно их свойствам против RSV, соединения формулы (I) или любой их подгруппы, их пролекарства, N-оксиды, аддитивные соли, четвертичные амины,комплексы с металлами и стереохимически изомерные формы являются пригодными при лечении индивидуумов, испытывающих вирусную инфекцию, конкретно инфекцию RSV, и для профилактики этих инфекций. Как правило, соединения по настоящему изобретению могут быть пригодными при лечении теплокровных животных, инфицированных вирусами, конкретно респираторно-синцитиальным вирусом. Соединения по настоящему изобретению или любая их подгруппа могут, следовательно, применяться в качестве лекарственных средств. Указанное применение в качестве лекарственного средства или способ лечения включает системное введение субъектам, инфицированным вирусом, или субъектам,восприимчивым к вирусным инфекциям, количества, эффективного для борьбы с состояниями, связанными с вирусными инфекциями, в частности с инфекцией RSV. Настоящее изобретение также относится к применению настоящих соединений или любой их подгруппы при производстве лекарственного средства для лечения или профилактики вирусных инфекций, в частности инфекции RSV. Настоящее изобретение, кроме того, относится к способам лечения теплокровного животного, инфицированного вирусом или имеющего риск инфицирования вирусом, в частности RSV, указанный способ включает введение противовирусно эффективного количества соединения формулы (I), как здесь описано, или соединения из любой из подгрупп соединений формулы (I), как здесь описано. Как правило, предполагается, что противовирусно эффективное ежедневное количество должно составлять от 0,01 до 500 мг/кг массы тела, более предпочтительно от 0,1 до 50 мг/кг массы тела. Может быть удобным введение требуемой дозы в виде 2, 3, 4 или более поддоз через соответствующие интервалы времени в течение дня. Указанные поддозы могут приготавливаться в виде единичных дозированных форм, например, содержащих от 1 до 1000 мг, а конкретно от 5 до 200 мг, активного ингредиента на единичную дозированную форму.- 21009876 Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), конкретного состояния, которое лечится, тяжести состояния, которое лечится, возраста, массы, пола,степени расстройства и общего физического состояния конкретного пациента, а также другого лекарственного средства, которое может принимать индивидуум, как хорошо известно специалистам в данной области. Кроме того, очевидно, что указанное эффективное ежедневное количество может уменьшаться или увеличиваться в зависимости от реакции субъекта, который лечится, и/или в зависимости от оценки врача, предписывающего соединения по настоящему изобретению. По этой причине пределы эффективного ежедневного количества, рассмотренные выше, представляют собой только примерные показатели. Также в качестве лекарственного средства может использоваться комбинация другого противовирусного агента и соединения формулы (I). Таким образом, настоящее изобретение также относится к продукту,содержащему (а) соединение формулы (I) и (b) другое противовирусное соединение в качестве объединенного препарата для одновременного, раздельного или последовательного применения при противовирусном лечении. Различные лекарственные средства могут объединяться в одном препарате вместе с фармацевтически приемлемыми носителями. Например, соединения по настоящему изобретению могут объединяться с интерфероном-бета или фактором-альфа некроза опухоли для лечения или профилактики инфекции RSV. Примеры Следующие далее примеры предназначены для иллюстрации настоящего изобретения, а не для его ограничения с их помощью. Термины "соединение 58", "соединение 143" и т.п., используемые в этих примерах, относятся к этим соединениям в таблицах. Соединения анализируют с помощью ЖХ/МС с использованием следующего оборудования.LCT: электрораспылительная ионизация в положительном режиме, режим сканирования от 100 до 900 а.е.м; Xterra MS C18 (Waters, Milford, MA) 5 мкм, 3,9x150 мм; скорость потока 1 мл/мин. Две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетата аммония + 15% ацетонитрила; подвижная фаза В: 20% 6,5 мМ ацетата аммония + 80% ацетонитрила) используют для создания градиента от 100% А в течение 3 мин до 100% В через 5 мин, от 100% В в течение 6 мин до 100% А через 3 мин и с последующим повторным уравновешиванием при 100% А в течение 3 мин.ZQ: электрораспылительная ионизация как в положительном, так и в отрицательном (импульсном) режиме сканирования от 100 до 1000 а.е.м; Xterra RP С 18 (Waters, Milford, MA), 5 мкм, 3,9x150 мм; скорость потока 1 мл/мин. Две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетата аммония + 15% ацетонитрила; подвижная фаза В: 20% 6,5 мМ ацетата аммония + 80% ацетонитрила) используют для создания условий градиента от 100% А в течение 3 мин до 100% В через 5 мин, от 100% В в течение 6 мин до 100% А через 3 мин и с последующим повторным уравновешиванием при 100% А в течение 3 мин. Пример 1. Схема А- 22009876 Смесь сложного этилового эфира 3,4-диаминобензойной кислоты (0,166 моль) и мочевины (0,199 моль) в ксилоле (300 мл) перемешивают при температуре кипения с обратным холодильником в течение 12 ч. Реакционную смесь охлаждают до комнатной температуры. Осадок отфильтровывают, промывают ксилолом и простым диизопропиловым эфиром, а затем сушат с получением 32 г промежуточного соединения а-1 (93%, температура плавления: 260 С). Смесь а-1 (0,073 моль) в POCl3 (150 мл) перемешивают при 100 С. Концентрированную HCl (приблизительно 1,5 мл) добавляют по каплям, очень осторожно, до тех пор, пока не растворится а-1. Смесь перемешивают при 120 С в течение 6 ч. Растворитель выпаривают досуха. Остаток извлекают в Н 2 О/лед,подщелачивают K2CO3 (порошок) и экстрагируют этилацетатом + 10% метанола. Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха с получением 13,5 г промежуточного соединения а-2 (83%, температура плавления: 178 С). Смесь а-2 (0,0356 моль) и N-пропиламиноморфолина (0,0427 моль) перемешивают при 120 С в течение 4 ч, а затем извлекают в CH2Cl2/CH3OH. Органический слой промывают 10% раствором K2CO3 в воде, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток (11,9 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 94/6/0,2; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают с получением 6 г промежуточного соединения а-3(47%). Смесь а-3 (0,018 моль), а-4 (0,027 моль) и K2CO3 (0,054 моль) в CH3CN (100 мл) и диметилформамида (10 мл) перемешивают при 80 С в течение 12 ч. Растворитель выпаривают досуха. Остаток извлекают в CH2Cl2/H2O. Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток кристаллизуют из 2-пропанона. Осадок фильтруют, промывают H2O и сушат с получением 2,8 г промежуточного соединения а-6 (34%, температура плавления: 176 С). Маточный слой выпаривают досуха и очищают с помощью хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 93/7/0,7; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из CH3CN/диизопропиловый эфир с получением 1,6 г промежуточного соединения а-5 (20%, температура плавления: 184C). Смесь а-5 (0,0035 моль) в тетрагидрофуране (60 мл) охлаждают до 5C в потоке N2. LiAlH4 (0,0105 моль) добавляют по частям. Смесь перемешивают при 5 С в течение 1 ч, а затем перемешивают при комнатной температуре в течение 2 ч. Добавляют минимум H2O. Добавляют CH2Cl2. Органический слой отделяют,сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток кристаллизуют из 2-пропанона/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 1,2 г промежуточного соединения а-7 (83%). Часть этой фракции (0,1 г) кристаллизуют из 2-пропанона/CH3CN/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 0,074 г (температура плавления: 192 С). Промежуточное соединение а-8 (температура плавления: 134 С) получают аналогичным образом. Смесь а-7 (0,0024 моль) и MnO2 (2 г) в CH2Cl2 (50 мл) перемешивают при комнатной температуре в течение 12 ч и затем фильтруют через целит. Целит промывают H2O. Растворитель из фильтрата выпаривают досуха с получением 0,9 г промежуточного соединения а-9 (90%, температура плавления: 206C). Промежуточное соединение а-10 получают аналогичным образом. Пример 2. Схема ВLiAlH4 (0,146 моль) добавляют по частям к раствору в тетрагидрофуране (200 мл) при 5 С в потокеN2. Затем добавляют по каплям раствор b-1 (0,073 моль) в тетрагидрофуране (200 мл). Смесь перемешивают при 5 С в течение 3 ч. Затем добавляют минимум H2O, а затем раствор CH2Cl2/CH3OH (90/10). Полученную смесь сушат (над MgSO4), фильтруют и растворитель выпаривают досуха с получением 12,6 г промежуточного соединения b-2 (95%, температура плавления: 179 С). Смесь b-2 (0,069 моль) и N-пропиламиноморфолина (0,207 моль) перемешивают при 125 С в течение 4 ч, а затем извлекают в CH2Cl2/CH3OH. Органический слой промывают 10% раствором K2CO3 в воде, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток (37 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 90/10/0,5; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают с получением 16,5 г промежуточного соединенияb-3 (82%). Смесь b-3 (0,0396 моль), b-4 (0,0475 моль) и K2CO3 (0,1188 моль) в диметилформамиде (110 мл) перемешивают при комнатной температуре в течение 12 ч. Реакционную смесь выливают в лед/воду. Водный слой насыщают K2CO3 (порошок) и экстрагируют раствором CH2Cl2/CH3OH (95/5). Остаток очищают с помощью хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 90/10/1; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают с получением 5,4 г промежуточного соединения b-5(33%, температура плавления: 192 С) и 5 г промежуточного соединения b-6 (31%, температура плавления: 134 С). Добавляют по каплям SOCl2 (0,81 мл) к смеси b-5 (0,0006 моль) в CH2Cl2 (10 мл) при 5 С. Смесь перемешивают при 5C в течение 2 ч, затем доводят до комнатной температуры и перемешивают в течение 12 ч. Растворитель выпаривают досуха с получением 0,42 г промежуточного соединения b-7 (100%). Пример 3. Схема С Добавляют по каплям TiCl3 (15% в H2O) (0,026 моль) при 0 С к раствору с-1 (3-(4-метил-2-нитрофенил)проп-2-ен-1-ола 0,0026 моль) в тетрагидрофуране (30 мл). Смесь перемешивают при 0 С в течение 30 мин, затем при комнатной температуре в течение 12 ч, выливают в H2O и медленно подщелачивают при 0 С K2CO3, добавляют EtOAc. Смесь фильтруют через целит. Целит промывают EtOAc. Фильтрат декантируют. Органический слой промывают H2O, сушат (над MgSO4), фильтруют и растворитель выпаривают. Остаток (0,4 г) очищают с помощью колоночной хроматографии на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 97/3/0,1). Чистые фракции собирают и растворитель выпаривают. Выход: 0,1 г промежуточного соединения с-2 (3-(2-амино-4-метилфенил)проп-2-ен-1-ола, 24%). Пример 4. Схема D Смесь d-1 (4-метил-2-нитрофенола, 0,00653 моль), 2-бромэтанола (0,00653 моль) и K2CO3 (0,0131 моль) в CH3CN (15 мл) перемешивают при температуре кипения с обратным холодильником в течение 6 ч, а затем охлаждают до комнатной температуры. Раствор концентрируют. Остаток извлекают в CH2Cl2 и промывают H2O. Органический слой отделяют, сушат (над MgSO4), фильтруют и концентрируют. Выход: 1,3 г промежуточного соединения d-2 (2-(4-метил-2-нитрофенокси)этанола, 100%). Соединение используют непосредственно на следующей стадии реакции. Смесь d-2 (2-(4-метил-2-нитрофенокси)этанола, 0,0066 моль) и никеля Ренея (1,3 г) в СН 3 ОН (30 мл) гидрируют при давлении 3 бара, при комнатной температуре, в течение 2 ч. Раствор фильтруют через пад из целита. Пад промывают СН 3 ОН и фильтрат концентрируют. Остаток извлекают в CH2Cl2. Осадок отфильтровывают и сушат. Выход: 0,41 г промежуточного соединения d-3 (2-(2-амино-4-метилфенокси) этанол, 37%, температура плавления: 135C). Смесь е-1 (сложного этилового эфира 3-(4-метил-2-нитрофенил)акриловой кислоты, 0,0063 моль) в растворе NH3/CH3OH, 7 н. (20 мл) перемешивают при 80 С в течение 24 ч, затем охлаждают до комнатной температуры и выпаривают. Остаток извлекают в CH2Cl2. Осадок отфильтровывают и сушат. Выход: 0,78 г е-2 (3-(4-метил-2-нитрофенил)акриламида, 60%, температура плавления: 208 С). Смесь е-2 (3-(4-метил-2-нитрофенил)акриламида, 0,0037 моль) и никеля Ренея (0,7 г) в СН 3 ОН (30 мл) гидрируют при комнатной температуре в течение 2 ч и затем фильтруют через целит. Целит промывают СН 3 ОН. Фильтрат выпаривают. Выход: 0,7 г е-3 (3-(2-амино-4-метилфенил)пропионамида, 100%). Пример 6. Схема F Смесь f-1 (2-(4-бром-2-нитрофенил)этанола, 0,002 моль) и никеля Ренея (0,002 моль) в СН 3 ОН (20 мл) и тиофена (0,5 мл) гидрируют при комнатной температуре в течение 1 ч при давлении 3 бара, затем фильтруют через целит. Целит промывают СН 3 ОН. Фильтрат выпаривают. Выход: 0,4 г f-2 (2-(2-амино 4-бромфенил)этанола, 91%). Трибутилвинилстаннан (0,0092 моль) добавляют по каплям при комнатной температуре к смеси f-2 (2(2-амино-4-бромфенил)этанола, 0,0046 моль) и Pd(PPh3)4 (0,0004 моль) в диоксане (20 мл) в потоке N2. Смесь перемешивают при 80 С в течение 12 ч, выливают в H2O и экстрагируют этилацетатом. Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают. Остаток (3,4 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 0,21 г f-3 (2-(2-амино-4-винилфенил)этанола, 28%). Пример 7. Схема G Смесь g-1 (4-бром-1-метил-2-нитробензола, 0,0104 моль), g-2 (3-тиофенбороновой кислоты, 0,0156 моль),Na2CO3 2 М в H2O (30 мл) и Pd(PPh3)2Cl2 (0,00104 моль) в диоксане (30 мл) перемешивают при температуре кипения с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют этилацетат. Органический слой отделяют, промывают насыщенным растворомNaCl, сушат (над MgSO4), фильтруют и растворитель выпаривают. Выход: 3,7 г g-3 (3-(4-метил-3-нитрофенил)тиофена, 100%). Сырое соединение используют непосредственно на следующей стадии реакции. Смесь g-3 (3-(4-метил-3-нитрофенил)тиофена, 0,00502 моль), параформальдегида (0,002 моль) и 40% тритона В в H2O (0,11 мл) в ДМСО (1,1 мл) перемешивают при 90 С в течение 3 ч. Сырой раствор очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2). Выход: 0,44 г g-4 (2(2-нитро-4-тиофен-3-илфенил)этанола, 35%). Смесь g-4 (2-(2-нитро-4-тиофен-3-илфенил)этанола, 0,00176 моль) и никеля Ренея (0,4 г) в СН 3 ОН (40 мл) гидрируют при комнатной температуре в течение 2 ч при давлении 3 бара, затем фильтруют через целит. Целит Смесь h-1 (2-(4-бром-2-нитрофенил)этанола, 0,00205 моль), h-2 (фуран-3-бороновой кислоты,0,00307 моль), Na2CO3 2 М в H2O (7,5 мл) и Pd(PPh3)2Cl2 (0,000205 моль) в диоксане (7,5 мл) перемешивают при температуре кипения с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют этилацетат. Органический слой отделяют, промывают насыщенным раствором NaCl,сушат (над MgSO4), фильтруют и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2). Выход: 0,8 г h-3 (2-(4-фуран-3-ил-2-нитрофенил)этанола, 73%). Смесь h-3 (2-(4-фуран-3-ил-2-нитрофенил)этанола, 0,0015 моль) и никеля Ренея (0,3 г) в СН 3 ОН (30 мл) гидрируют при комнатной температуре в течение 2 ч при давлении 3 бара, затем фильтруют через целит. Целит промывают СН 3 ОН. Фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,2; 10 мкм). Выход: 0,09 г h-4 (2-(2-амино-4 фуран-3-илфенил)этанола, 30%). Пример 9. Схема I(0,0076 моль) и Pd(OAc)2 (0,00019 моль) в CH3CN (6 мл) перемешивают в микроволновой печи (100 С,100 Вт) в течение 5 мин. Затем реакционную смесь фильтруют через слой целита и фильтрат концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/циклогексан 70/30). Выход: 0,65 г i-2 (4-(4-метил-2-нитрофенил)бут-3-ен-2-она, 78%, температура плавления: 58 С). Добавляют по каплям NaBH4 (0,00633 моль) к раствору i-2 (4-(4-метил-2-нитрофенил)бут-3-ен-2 она, 0,00316 моль) в СН 3 ОН (10 мл) при 0 С. Реакционную смесь перемешивают при 0 С в течение 1 ч, а затем выливают на лед. Водный слой экстрагируют этилацетатом. Органический слой отделяют, сушат(над MgSO4), фильтруют и растворитель выпаривают. Выход: 0,65 г i-3 (4-(4-метил-2-нитрофенил)бут-3 ен-2-ола, 100%). Сырое соединение используют непосредственно на следующей стадии реакции. Смесь i-3 (4-(4-метил-2-нитрофенил)бут-3-ен-2-ола, 0,00316 моль) и никеля Ренея (0,6 г) в СН 3 ОН(20 мл) гидрируют при комнатной температуре в течение 2 ч при давлении 3 бара, затем фильтруют через целит. Целит промывают СН 3 ОН. Фильтрат выпаривают. Выход: 0,5 г i-4 (4-(2-амино-4-метилфенил) бутан-2-ола, 88%). Пример 10. Схема J Добавляют СН 3 СО 2 Н (0,2 мл) при комнатной температуре к смеси j-1 (0,0004 моль), 3,5-диметиланилина (0,0005 моль) и NaBH3CN (0,0005 моль) в CH3CN (25 мл). Смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют СН 3 СО 2 Н (0,2 мл). Смесь перемешивают при комнатной температуре в течение 12 ч. Растворитель выпаривают досуха. Остаток извлекают в CH2Cl2. Органический слой промывают 10% раствором K2CO3 в воде, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха.- 26009876 Остаток (0,24 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 90/10/0,2; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,15 г, 60%) кристаллизуют из 2-пропанона/CH3CN/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 0,121 г 2-[6-[(3,5-диметилфениламино)метил]-2-(3-морфолин-4-илпропиламино)бензимидазол 1-илметил]-6-метилпиридин-3-ола (пример j-2, соединение 23, 48%, температура плавления: 199C). Пример 11 Схема K Добавляют СН 3 СО 2 Н (0,2 мл) при комнатной температуре к смеси k-1 (0,0004 моль), 3-(2-амино-4-метилфенил)пропан-1-ола (0,0005 моль) и BH3CN- на твердом носителе (0,0007 моль) в СН 3 ОН (20 мл). Смесь перемешивают при комнатной температуре в течение 12 ч. Твердый носитель отфильтровывают, промывают СН 3 ОН и фильтрат концентрируют. Остаток извлекают в 10% растворе K2CO3 в воде и экстрагируютCH2Cl2/CH3OH (95/5). Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент CH2Cl2/CH3OH/NH4OH 92/8/1; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из 2-пропанона/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 0,223 г 2-[6-[2-(3-гидроксипропил)-5-метилфениламино]метил-2-(3-морфолин-4-илпропиламино)бензимидазол-1-илметил]-6-метилпиридин-3-ола (пример k-2, соединение 3, 82%, температура плавления: 208 С). Пример 12. Схема L(0,0005 моль) в Et3N (15 мл) в потоке N2. Смесь перемешивают при комнатной температуре в течение 4 ч,выливают в H2O и экстрагируют EtOAc. Органический слой промывают H2O, сушат (над MgSO4), фильтруют и растворитель выпаривают. Остаток (2,1 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/циклогексан 70/30). Чистые фракции собирают и растворитель выпаривают. Выход: 1 г промежуточного соединения i-3 (79%). Добавляют СН 3 СО 2 Н (5 капель), а затем BH3CN- на твердом носителе (0,0009 моль) при комнатной температуре к смеси l-4 (0,0004 моль) и l-3 (0,0007 моль) в CH3OH (3 мл). Смесь перемешивают при комнатной температуре в течение 48 ч, затем фильтруют и промывают CH2Cl2/CH3OH. Фильтрат выпаривают. Выход: 0,4 г промежуточного соединения 1-5 (100%). Этот продукт используют непосредственно на следующей стадии реакции. Смесь l-5 (0,0004 моль) и пиридиний п-толуолсульфоната (0,00004 моль) в EtOH (15 мл) перемешивают при 60 С в течение 12 ч. Добавляют HCl 3 н. (5 капель). Смесь перемешивают при 60 С в течение 3 ч,затем охлаждают до комнатной температуры и выпаривают. Остаток извлекают в CH2Cl2/CH3OH. Орга- 27009876 нический слой промывают 10% K2CO3, сушат (над MgSO4), фильтруют и растворитель выпаривают. Остаток (0,33 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 94/6/0,5). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из простого диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,016 г 2-[6-[2-(3-гидроксипроп-1-инил)-5-метилфениламино]метил-2-(3-морфолин-4-илпропиламино)бензимидазол-1-илметил]-6 метилпиридин-3-ола (l-6, соединение 34, 6%, температура плавления: 225 С). Пример 13. Схема M Смесь m-1 (0,000347 моль), m-2 (0,00041 моль) и K2CO3 (0,00173 моль) в диметилформамиде (10 мл) перемешивают при 80 С в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и выливают в 10% раствор K2CO3 в воде. Раствор насыщают K2CO3 (порошок) и экстрагируют CH2Cl2/CH3OH(95/5). Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток (0,15 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,5; 10 мкм). Чистые фракции собирают и растворитель выпаривают с получением 0,03 г промежуточного соединения m-3 (15%, смесь E/Z (89/11. Смесь m-3 (0,000106 моль) и Pd/C 10% (0,020 г) в CH3OH (15 мл) и тетрагидрофуране (15 мл) гидрируют при комнатной температуре в течение 6 ч при давлении 3 бара. Реакционную смесь фильтруют через целит. Целит промывают и фильтрат выпаривают досуха. Остаток (0,06 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 93/7/0,5; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,028 г) кристаллизуют из 2-пропанона/диизопропилового эфира с получением 0,021 г 3-(4-[3-(3-гидрокси-6-метилпиридин-2-илметил)-2-(3-морфолин-4-илпропиламино)-3 Н-бензимидазол-5-илметил]амино-3,5-диметилфенил)пропионитрила (m-4, соединение 49, 35%, температура плавления: 114 С). Изомеры, замещенные в положении 5 на бензимидазольном остатке, синтезируют аналогично процедурам, описанным в схемах J и K, начиная от промежуточного соединения а-10. Пример 14. Схема N Смесь 3-броманилина (0,037 моль), 2-бромэтанола (0,074 моль) и триэтиламина (0,0555 моль) в толуоле (35 мл) перемешивают при температуре кипения с обратным холодильником в течение 12 ч. Реакционную смесь охлаждают до комнатной температуры и осадок отфильтровывают. Растворитель фильтрата выпаривают досуха. Остаток (22 г) очищают с помощью колоночной хроматографии на силикагеле(элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают с получением 4,8 г 2-(3-бромфениламино)этанола (60%). Сложный этиловый эфир 5-(3,5-диметилфениламино)пентановой кислоты, и сложный этиловый эфир 3-(3-бромфениламино)пропионовой кислоты, и амид 4-м-толиламинобутан-1-сульфоновой кислоты, и сложный диэтиловый эфир сложного 2-(3,5-диметилфениламино)этилового эфира фосфорной кислоты, и сложный диэтиловый эфир [2-(3,5-диметилфениламино)этил]фосфоновой кислоты, и метиламид 4-м-толиламинобутан-1-сульфоновой кислоты получают аналогично.(50 мл) перемешивают при 80 С в течение 12 ч. Реакционную смесь охлаждают до комнатной температуры и растворитель выпаривают. Остаток извлекают в CH2Cl2/CH3OH (95/5) и промывают насыщенным раствором K2CO3 в воде. Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 98/2/0,1; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают с получением 1,9 г 2-(3,5-диметилфениламино)этанола (29%). Сложный этиловый эфир 3-(3,5-диметилфениламино)пропионовой кислоты, и сложный этиловый эфир 4-(3,5-диметилфениламино)масляной кислоты, и (3,5-диметилфенил)-(2-морфолин-4-илэтил)амин, и третбутиловый сложный эфир [2-(3,5-диметилфениламино)этил]карбаминовой кислоты получают аналогично. Сложный этиловый эфир 3-(3,5-диметилфениламино)пропионовой кислоты (0,0026 моль) в 7 н. растворе NH3 в СН 3 ОН перемешивают при 80 С в герметичной емкости. Реакционную смесь охлаждают до комнатной температуры и растворитель выпаривают досуха с получением 0,5 г 3-(3,5-диметилфениламино)пропионамида (100%). 4-(3,5-Диметилфениламинобутирамид, и 4-м-толиламинобутирамид, и 3-м-толиламинопропионамид,и 3-(3-бромфениламино)пропионамид получают аналогично. Сложный этиловый эфир 3-(3,5-диметилфениламино)пропионовой кислоты (0,00226 моль) в тетрагидрофуране (5 мл) добавляют по каплям к суспензии LiAlH4 (0,0034 моль) в тетрагидрофуране (10 мл) при 5C в потоке N2. Смесь перемешивают при 5 С в течение 1 ч. Добавляют минимум воды иCH2Cl2/CH3OH (95/5). Раствор сушат (над MgSO4), фильтруют и растворитель выпаривают досуха с получением 0,35 г 3-(3,5-диметилфениламинопропан-1-ола (86%). 5-(3,5-Диметилфениламино)пентан-1-ол получают аналогично.(0,0433 моль) в толуоле (80 мл) перемешивают при 120 С в течение 24 ч. Осадок фильтруют. Фильтрат выпаривают досуха. Остаток (6,3 г) очищают с помощью колоночной хроматографии на силикагеле (цик- 29009876 логексан/AcOEt 95/5; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 0,789 г 1-(3,5-диметилфениламино)-3-метилбутан-2-она (13%). Добавляют по частям NaBH4 (0,0046 моль) при 5 С к раствору 1-(3,5-диметилфениламино)-3-метилбутан-2-она (0,0038 моль) в тетрагидрофуране (10 мл) и СН 3 ОН (10 мл). Смесь перемешивают при комнатной температуре в течение 6 ч, выливают в 10% K2CO3 и экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,1; 20 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 0,25 г 1-(3,5-диметилфениламино)-3-метилбутан 2-ола (52%, температура плавления: 65 С). Смесь 3,5-диметилфениламина (0,0422 моль) и 2-феноксиметилоксирана (0,0422 моль) в EtOH (50 мл) перемешивают при 80 С в течение 12 ч, а затем охлаждают до комнатной температуры. Осадок фильтруют, промывают H2O и сушат. Маточный слой выпаривают досуха. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2; 10 мкм). Две фракции собирают и растворитель выпаривают. Выход: 0,4 г промежуточного соединения 1-(3,5-диметилфениламино)-3-феноксипропан-2 ола (4%, температура плавления: 65 С).(b) Синтез конечных соединений n-4 и n-5.MgSO4), фильтруют и растворитель выпаривают. Остаток (0,5 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 93/7/0,5; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают с получением 0,120 г фракции 1 (31%) и 0,045 г фракции 2 (12%). Фракцию 1 кристаллизуют из CH3CN/диизопропилового эфира. Осадок фильтруют, промывают простым диизопролиловым эфиром и сушат с получением 0,1 г 2-[6-[(3,5-диметилфенил)-(2-гидроксиэтил)амино]метил-2-(3-морфолин-4-ил-пропиламино)бензимидазол-1-илметил]-6-метилпиридин-3-ола (соединение 58, пример соединения n-4; 26%, температура плавления: 180 С). Фракцию 2 кристаллизуют из 2 пропанона/диизопропилового эфира. Осадок фильтруют, промывают простым диизопропиловым эфиром и сушат с получением 0,016 г 2-[6-[4-(2-гидроксиэтиламино)-2,6-диметилбензил]-2-(3-морфолин-4 илпропиламино)бензимидазол-1-илметил]-6-метилпиридин-3-ола (соединение 143, пример соединения n5, 4%, температура плавления: 162 С). Смесь сложного этилового эфира 4-(3,5-диметилфенил)-[3-(3-гидрокси-6-метилпиридин-2-илметил)-2-(3-морфолин-4-илпропиламино)-3 Н-бензимидазол-5-илметил]аминомасляной кислоты (соединение 71), полученного, как описано для соединения n-4 (0,000175 моль), и LiOH/H2O (0,00035 моль) в тетрагидрофуране (8 мл) и H2O (8 мл) перемешивают при комнатной температуре в течение 12 ч. Тетрагидрофуран выпаривают и добавляют 1 н. раствор NaOH в воде. Раствор экстрагируют CH2Cl2/CH3OH (95/5). Органический слой отделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают. Остаток из- 30
МПК / Метки
МПК: A61K 31/4184, C07D 401/06, C07D 413/14
Метки: морфолинилсодержащие, ингибиторов, качестве, респираторно-синцитиального, бензимидазолы, репликации, вируса
Код ссылки
<a href="https://eas.patents.su/30-9876-morfolinilsoderzhashhie-benzimidazoly-v-kachestve-ingibitorov-replikacii-respiratorno-sincitialnogo-virusa.html" rel="bookmark" title="База патентов Евразийского Союза">Морфолинилсодержащие бензимидазолы в качестве ингибиторов репликации респираторно-синцитиального вируса</a>