Производные пиперидинил- и пиперазинил- алкилкарбаматов, способы их получения и применение их в терапии
Номер патента: 9468
Опубликовано: 28.12.2007
Авторы: Хорнар Кристиан, Бюрнье Филипп, Женесс Жан, Пюэш Фредерик, Абуабделла Ахмед
Формула / Реферат
1. Производные пиперидинил- и пеперазинилалкилкарбаматов, соответствующие формуле (I)

где А представляет собой атом азота или группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную, циано, трифторметильную, C1-6алкильную или C1-6алкоксигруппу;
n представляет собой целое число, равное 2 или 3, и m представляет собой целое число, равное 2, когда А представляет собой атом азота;
n представляет собой целое число, равное 1, 2 или 3, и m представляет собой целое число, равное 1 или 2, когда А представляет собой группу CR2;
В представляет собой ковалентную связь или С1-8алкиленовую группу;
R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, оксазолила, изоксазолила, тиазолила, изотиазолила, имидазолила, оксадиазолила, тиадиазолила, триазолила, нафтила, хинолила, тетрагидрохинолила, изохинолила, тетрагидроизохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, циннолила, имидазопиримидинила, тиенопиримидинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, индазолила, пирролопиридила, фуропиридила, дигидрофуропиридила, тиенопиридила, дигидротиенопиридила, имидазопиридила, пиразолопиридила, оксазолопиридила, изоксазолопиридила и тиазолопиридила;
причем группа R1 возможно замещена одной или более группами R' и/или R";
R' представляет собой атом галогена или группу циано, нитро, гидроксил, С1-6алкил, C1-6алкокси, C1-6тиоалкил, C1-6фторалкил, C1-6фторалкокси, С1-6фтортиоалкил, С3-7циклоалкил, С3-7циклоалкил-С1-6алкилен, азетидинил, пиперидил, пирролидинил, морфолинил, пиперазинил, азепинил, NH2, NHR6, NR6R7, NR6COR7, NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 или -О-(С1-6алкилен)-О-;
R" представляет собой фенил, имидазолил, пиридил или пиримидинил;
причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или С1-6алкильную группу, и
R5 представляет собой атом водорода или группу С1-6алкил, С3-7циклоалкил либо С3-7циклоалкилС1-6-алкилен;
R6 и R7 независимо друг от друга представляют собой С1-6алкильную группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
2. Соединение формулы (I) по п.1, отличающееся тем, что
А представляет собой атом азота;
n представляет собой целое число, равное 2 или 3, и
m представляет собой целое число, равное 2;
В представляет собой C1-8алкиленовую группу;
R1 представляет собой группу, выбранную из фенила, пиридила, пиримидинила, тиадиазолила и нафтила;
причем группа R1 возможно замещена одной или более группами R' и/или R";
R' представляет собой атом галогена или группу нитро либо C1-6фторалкил;
R" представляет собой фенил, возможно замещенный одной или более группами, которые могут быть одинаковыми или отличными друг от друга, выбранными из атома галогена или группы циано, C1-6алкокси либо C1-6фторалкокси;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой
R4 представляет собой атом водорода, и
R5 представляет собой атом водорода или группу С1-6алкил, С3-7циклоалкил либо С3-7циклоалкил-С1-6алкилен;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
3. Соединение формулы (I) по п.1, отличающееся тем, что
А представляет собой группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную группу;
m представляет собой целое число, равное 1 или 2, и
n представляет собой целое число, равное 1 или 2;
В представляет собой ковалентную связь или С1-4алкиленовую группу;
R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, тиазолила, хинолила, изохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, фуропиридила, тиенопиримидинила, имидазопиримидинила, бензотиазолила, бензимидазолила и бензоксазолила;
причем группа R1 возможно замещена одной или более группами R' и/или R";
R' представляет собой атом галогена, или группу циано или C1-6алкил, C1-6алкокси, С1-6фторалкил, C1-6фторалкокси, С3-7циклоалкил, пирролидинил, NH2, NR6R7 или COR6;
R" представляет собой фенил, имидазолил или пиридил;
причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга, более конкретно одним или более чем одним атомом хлора или фтора;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой
R4 представляет собой атом водорода или С1-6алкильную группу, и
R5 представляет собой атом водорода или группу C1-6алкил, С3-7циклоалкил или С3-7циклоалкил-С1-6алкилен;
R6 и R7 независимо друг от друга представляют собой C1-6алкильную группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
4. Соединение формулы (I) по п.1 или 3, отличающееся тем, что
А представляет собой группу CR2, в которой R2 представляет собой атом водорода;
m равно 2, и n равно 2;
В представляет собой этильную группу;
R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, тиазолила, хинолила, изохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, фуропиридила, тиенопиримидинила, имидазопиримидинила, бензотиазолила, бензимидазолила и бензоксазолила;
причем группа R1 возможно замещена одной или более группами R' и/или R";
R' представляет собой атом галогена или группу циано либо С1-6алкил, C1-6алкокси, C1-6фторалкил, С1-6фторалкокси, С3-7циклоалкил, пирролидинил, NH2, NR6R7 или COR6;
R" представляет собой фенил, имидазолил или пиридил;
причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга, более конкретно одним или более чем одним атомом хлора или фтора;
R3 представляет собой группу общей формулы CHR4CONHR5, в которой
R4 представляет собой атом водорода, и
R5 представляет собой атом водорода или С1-6алкильную группу;
R6 и R7 независимо друг от друга представляют собой С1-6алкильную группу;
в форме основания, соли присоединения кислоты, гидрата или сольвата.
5. Способ получения соединения формулы (I) по любому из пп.1-4, включающий стадию, состоящую в превращении карбамата общей формулы (Ia)
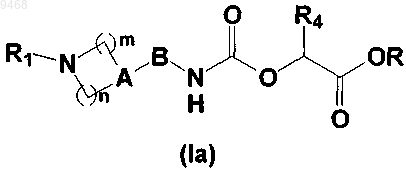
где n, m, А, В, R1 и R4 такие, как они определены в общей формуле (I) согласно п.1, и R представляет собой метильную или этильную групяу, посредством аминолиза с использованием амина общей формулы R5NH2, где R5 такой, как он определен в общей формуле (I) согласно п.1.
6. Способ получения соединения формулы (I) по любому из пп.1-4, включающий стадию, состоящую в превращении оксазолидиндионового производного общей формулы (V),
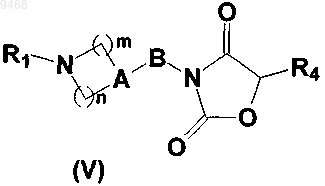
где n, m, А, В, R1 и R4 такие, как они определены в общей формуле (I) согласно п.1, посредством аминолиза с использованием амина общей формулы R5NH2, где R5 такой, как он определен в общей формуле (I) согласно п.1.
7. Производные пиперидинил- и пеперазинилалкилкарбаматов, соответствующие общей формуле (Ia),
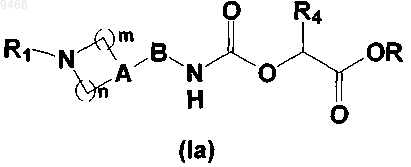
где А представляет собой атом азота или группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную, циано, трифторметильную, C1-6алкильную или C1-6алкоксигруппу;
n представляет собой целое число, равное 2 или 3, и m представляет собой целое число, равное 2, когда А представляет собой атом азота;
n представляет собой целое число, равное 1, 2 или 3, и m представляет собой целое число, равное 1 или 2, когда А представляет собой группу CR2;
В представляет собой ковалентную связь или С1-8алкиленовую группу;
R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, оксазолила, изоксазолила, тиазолила, изотиазолила, имидазолила, оксадиазолила, тиадиазолила, триазолила, нафтила, хинолила, тетрагидрохинолила, изохинолила, тетрагидроизохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, циннолила, имидазопиримидинила, тиенопиримидинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, индазолила, пирролопиридила, фуропиридила, дигидрофуропиридила, тиенопиридила, дигидротиенопиридила, имидазопиридила, пиразолопиридила, оксазолопиридила, изоксазолопиридила и тиазолопиридила;
причем группа R1 возможно замещена одной или более группами R' и/или R";
R' представляет собой атом галогена или группу циано, нитро, гидроксил, C1-6алкил, C1-6алкокси, C1-6тиоалкил, C1-6фторалкил, С1-6фторалкокси, С1-6фтортиоалкил, С3-7циклоалкил, С3-7циклоалкил-С1-6алкилен, азетидинил, пиперидил, пирролидинил, морфолинил, пиперазинил, азепинил, NH2, NHR6, NR6R7, NR6COR7, NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 или -О-(С1-6-алкилен)-О-;
R" представляет собой фенил, имидазолил, пиридил, пиразинил, пиридазинил или пиримидинил;
причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга;
R4 представляет собой атом водорода или С1-6алкильную группу;
R6 и R7 независимо друг от друга представляют собой C1-6алкильную группу;
R представляет собой метильную или этильную группу.
8. Производные пиперидинил- и пеперазинилоксазолидиндиона, соответствующие общей формуле (V)
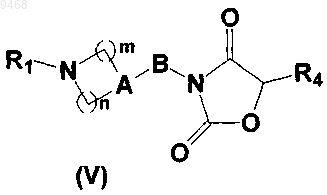
где
А представляет собой атом азота или группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную, циано, трифторметильную, C1-6алкильную или С1-6алкоксигруппу;
n представляет собой целое число, равное 2 или 3, и m представляет собой целое число, равное 2, когда А представляет собой атом азота;
n представляет собой целое число, равное 1, 2 или 3, и m представляет собой целое число, равное 1 или 2, когда А представляет собой группу CR2;
В представляет собой ковалентную связь или С1-8алкиленовую группу;
R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, оксазолила, изоксазолила, тиазолила, изотиазолила, имидазолила, оксадиазолила, тиадиазолила, триазолила, нафтила, хинолила, тетрагидрохинолила, изохинолила, тетрагидроизохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, циннолила, имидазопиримидинила, тиенопиримидинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, индазолила, пирролопиридила, фуропиридила, дигидрофуропиридила, тиенопиридила, дигидротиенопиридила, имидазопиридила, пиразолопиридила, оксазолопиридила, изоксазолопиридила и тиазолопиридила;
причем группа R1 возможно замещена одной или более чем одной группой R' и/или R";
R' представляет собой атом галогена или группу циано, нитро, гидроксил, C1-6алкил, C1-6алкокси, C1-6тиоалкил, С1-6фторалкил, С1-6фторалкокси, C1-6фтортиоалкил, С3-7циклоалкил, С3-7циклоалкил-С3-7алкилен, азетидинил, пиперидил, пирролидинил, морфолинил, пиперазинил, азепинил, NH2, NHR6, NR6R7, NR6COR7, NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 или -О-(С1-6алкилен)-О-;
R" представляет собой фенил, имидазолил, пиридил, пиразинил, пиридазинил или пиримидинил;
причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга;
R4 представляет собой атом водорода или С1-6алкильную группу;
R6 и R7 независимо друг от друга представляют собой C1-6алкильную группу;
за исключением следующих соединений:
3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-2,4-оксазолидиндион;
3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-метил-2,4-оксазолидиндион;
3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-этил-2,4-оксазолидиндион;
3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-пропил-2,4-оксазолидиндион;
3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-(1-метилэтил)-2,4-оксазолидиндион.
9. Лекарство для предупреждения или лечения патологии, в которую вовлечены эндогенные каннабиноиды и/или любой другой субстрат, метаболизируемый ферментом FAAH (гидролаза амидов жирных кислот), содержащее соединение формулы (I) по любому из пп.1-4 в форме основания или соли присоединения фармацевтически приемлемой кислоты, гидрата либо сольвата.
10. Фармацевтическая композиция для предупреждения или лечения патологии, в которую вовлечены эндогенные каннабиноиды и/или любой другой субстрат, метаболизируемый ферментом FAAH (гидролаза амидов жирных кислот), содержащая по меньшей мере одно соединение формулы (I) по любому из пп.1-4 в форме основания или соли присоединения фармацевтически приемлемой кислоты, гидрата либо сольвата и возможно один или более чем один фармацевтически приемлемый эксципиент.
11. Применение соединения формулы (I) по любому из пп.1-4 в форме основания или соли присоединения фармацевтически приемлемой кислоты, гидрата либо сольвата для изготовления лекарства для предупреждения или лечения патологии, в которую вовлечены эндогенные каннабиноиды и/или любой другой субстрат, метаболизируемый ферментом FAAH (гидролаза амидов жирных кислот).
12. Применение соединения формулы (I) по любому из пп.1-4 в форме основания или соли присоединения фармацевтически приемлемой кислоты, гидрата либо сольвата для изготовления лекарства для предупреждения или лечения острой или хронической боли, головокружеэшя, рвоты, тошноты, нарушений пищевого поведения, неврологических и психиатрических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, расстройств сна, сердечно-сосудистых заболеваний, почечной ишемии, рака, расстройств иммунной системы, аллергических заболеваний, паразитарных, вирусных или бактериальных инфекционных заболеваний, воспалительных заболеваний, остеопороза, глазных болезней, легочных болезней, желудочно-кишечных заболеваний или недержания мочи.
Текст
009468 Изобретение относится к производным пиперидинил- и пиперазинил-алкилкарбаматов и к их получению и терапевтическому применению. Соединения по изобретению соответствуют общей формуле (I): где А представляет собой атом азота или группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную, циано, трифторметильную, С 1-6 алкильную или С 1-6 алкоксигруппу;n представляет собой целое число, равное 2 или 3, и m представляет собой целое число, равное 2,когда А представляет собой атом азота;n представляет собой целое число, равное 1, 2 или 3, и m представляет собой целое число, равное 1 или 2, когда А представляет собой группу CR2; В представляет собой ковалентную связь или С 1-8 алкиленовую группу;R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, оксазолила, изоксазолила, тиазолила, изотиазолила, имидазолила, оксадиазолила,тиадиазолила, триазолила, нафтила, хинолила, тетрагидрохинолила, изохинолила, тетрагидроизохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, циннолила, имидазопиримидинила,тиенопиримидинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, индазолила, пирролопиридила, фуропиридила, дигидрофуропиридила, тиенопиридила, дигидротиенопиридила, имидазопиридила, пиразолопиридила, оксазолопиридила,изоксазолопиридила и тиазолопиридила; причем группа R1 возможно замещена одной или более группами R' и/или R";R' представляет собой атом галогена или группу циано, нитро, гидроксил, С 1-6 алкил, C1-6 алкокси, С 1-6 тиоалкил, C1-6 фторалкил, С 1-6 фторалкокси, C1-6 фтортиоалкил, С 3-7 циклоалкил, С 3-7 циклоалкил-С 1-6 алкилен, азетидинил, пиперидил, пирролидинил, морфолинил, пиперазинил, азепинил, NH2, NHR6, NR6R7, NR6COR7,NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 или -О-(С 1-балкилен)-О-;R" представляет собой фенил, имидазолил, пиридил, пиридазинил, пиразинил или пиримидинил; причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга;R3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода или С 1-6 алкильную группу, иR5 представляет собой атом водорода или группу С 1-6 алкил, С 3-7 циклоалкил или С 3-7 циклоалкил-С 1-6 алкилен;R6 и R7 независимо друг от друга представляют собой C1-6 алкильную группу. Среди соединений общей формулы (I) первая подгруппа соединений состоит из соединений, для которых А представляет собой атом азота; и/илиn представляет собой целое число, равное 2 или 3, и m представляет собой целое число, равное 2; и/или В представляет собой С 1-8 алкиленовую группу, более конкретно этил или пропил; и/илиR1 представляет собой группу, выбранную из фенила, пиридила, пиримидинила, тиадиазолила и нафтила; причем группа R1 возможно замещена одной или более чем одной группой R' и/или R"; и/илиR' представляет собой атом галогена, более конкретно хлора, или нитро либо C1-6 фтортиоалкильную группу, более конкретно трифторметил; и/илиR" представляет собой фенил, возможно замещенный одной или более группами, которые могут быть одинаковыми или отличными друг от друга, выбранными из атома галогена, более конкретно хлора, и группы циано, C1-6 алкокси, более конкретно метокси, или C1-6 фторалкокси, более конкретно трифторметокси; и/илиR3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода, иR5 представляет собой атом водорода или С 1-6 алкильную группу, более конкретно метил или этил,С 3-7 циклоалкильную группу, более конкретно циклопропил, или группу С 3-7 циклоалкил-С 1-6 алкилен, более конкретно цилопропилметилен. Вторая подгруппа соединений из числа соединений общей формулы (I) состоит из соединений, для которых А представляет собой группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную группу; и/илиm представляет собой целое число, равное 1 или 2, и n представляет собой целое число, равное 1 или 2; и/или В представляет собой ковалентную связь или С 1-4 алкиленовую группу, более конкретно метил, этил или н-пропил; и/илиR1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, тиазолила, хинолила, изохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, фуропиридила, тиенопиримидинила, имидазопиримидинила, бензотиазолила, бензимидазолила и бензоксазолила; причем группа R1 возможно замещена одной или более чем одной группой R' и/или R"; и/илиR' представляет собой атом галогена, более конкретно фтора, хлора или брома, или цианогруппу,С 1-6 алкил, более конкретно метил, этил, н-пропил или изобутил, С 1-6 алкокси, более конкретно метокси,С 1-6 фторалкил, более конкретно трифторметил, С 1-6 фторалкокси, более конкретно трифторметокси, С 3-7 циклоалкил, более конкретно циклопропил или циклопентил, пирролидинил, NH2, NR6R7 или COR6; и/илиR" представляет собой фенил, имидазолил или пиридил; причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга,более конкретно одним или более чем одним атомом хлора или фтора; и/илиR3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода или С 1-6 алкильную группу, более конкретно метил, иR5 представляет собой атом водорода или С 1-6 алкильную группу, более конкретно метил или этил,С 3-7 циклоалкил, более конкретно циклопропил, С 3-7 циклоалкил-С 1-6 алкилен, более конкретно циклопропил-метилен; и/илиR6 и R7 представляют собой независимо друг от друга С 1-6 алкильную группу, более конкретно метил. Третья подгруппа соединений из числа соединений общей формулы (I) состоит из соединений, для которых А представляет собой группу CR2, в которой R2 представляет собой атом водорода; и/илиm равно 2, и n равно 2; и/или В представляет собой этильную группу; и/илиR1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, тиазолила, хинолила, изохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, фуропиридила, тиенопиримидинила, имидазопиримидинила, бензотиазолила, бензимидазолила и бензоксазолила; причем группа R1 возможно замещена одной или более чем одной группой R' и/или R"; и/илиR' представляет собой атом галогена, более конкретно фтора, хлора или брома, или цианогруппу,С 1-6 алкил, более конкретно метил, этил, н-пропил или изобутил, C1-6 алкокси, более конкретно метокси,C1-6 фторалкил, более конкретно трифторметил, С 1-6 фторалкокси, более конкретно трифторметокси, С 3-7 циклоалкил, более конкретно циклопропил или циклопентил, пирролидинил, NH2, NR6R7 или COR6; и/илиR" представляет собой фенил, имидазолил или пиридил; причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга, более конкретно одним или более чем одним атомом хлора или фтора; и/илиR3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода, иR5 представляет собой атом водорода или С 1-6 алкильную группу, более конкретно метил или этил; и/илиR6 и R7 независимо друг от друга представляют собой С 1-6 алкильную группу, более конкретно метил. Из числа соединений общей формулы (I) объектом изобретения также являются соединения, соответствующие общей формуле (I') где А представляет собой атом азота или группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную, циано, трифторметильную, С 1-5 алкильную или С 1-5 алкоксигруппу;n представляет собой целое число, равное 2 или 3, и m представляет собой целое число, равное 2,-2 009468 когда А представляет собой атом азота;n представляет собой целое число, равное 1, 2 или 3, и m представляет собой целое число, равное 1 или 2, когда А представляет собой группу CR2; В представляет собой ковалентную связь или С 1-8 алкиленовую группу;R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, тиазолила, имидазолила, оксадиазолила, тиадиазолила, триазолила, нафтила, хинолила, тетрагидрохинолила, изохинолила, тетрагидроизохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, циннолила, имидазопиримидинила, тиенопиримидинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, индазолила, пирролопиридила, фуропиридила, дигидрофуропиридила, тиенопиридила, дигидротиенопиридила, имидазопиридила, пиразолопиридила, оксазолопиридила, изоксазолопиридила и тиазолопиридила; возможно замещенную одним или более чем одним заместителем, выбранным из атома галогена и группы циано, нитро, С 1-5 алкил, C1-3 алкокси, С 1-5 тиоалкил, С 1-5 фторалкил, C1-5 фторалкокси, C1-3 фтортиоалкил,С 3-5 циклоалкил, С 3-5 циклоалкил-С 1-3 алкилен, пиперидил, пирролидинил, морфолинил, NH2, NHR6, NR6R7,NHCOR6, COR6, CO2R6, SO2R6, -O-(C1-3 алкилен)-О-, фенил, пиридил или пиримидинил; причем фенильные, пиридильные и пиримидинильные группы возможно замещены одним или более чем одним заместителем, выбранным из атома галогена и группы циано, нитро, гидроксил, С 1-5 алкил,С 1-3 алкокси, С 1-5 тиоалкил, С 1-5 фторалкил, C1-3 фторалкокси, C1-3 фтортиоалкил, С 3-5 циклоалкил, С 3-5 циклоалкил-С 1-3 алкилен, пиперидил, пирролидинил, морфолинил, NH2, NHR6, NR6R7, NHCOR6, COR6,CO2R6, SO2R6 или -О-(С 1-3 алкилен)-О-;R3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода или C1-3 алкильную группу, иR5 представляет собой атом водорода или группу С 1-3 алкил, С 3-5 циклоалкил или С 3-5 циклоалкил-С 1-3 алкилен;R6 и R7 независимо друг от друга представляют собой C1-3 алкильную группу. Соединения общей формулы (I) могут содержать один или более чем один асимметрический атом углерода. Они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры и также их смеси, в том числе рацемические смеси, составляют часть данного изобретения. Соединения общей формулы (I) могут существовать в форме оснований или солей присоединения кислоты. Такие соли присоединения кислоты составляют часть данного изобретения. Эти соли преимущественно получают с помощью фармацевтически приемлемых кислот, но соли других кислот, которые полезны, например, для очистки или выделения соединений формулы (I), также составляют часть данного изобретения. Соединения общей формулы (I) могут быть в форме гидратов или сольватов, то есть в форме ассоциатов или комбинаций с одной или более чем одной молекулой воды или растворителя. Такие гидраты и сольваты также составляют часть данного изобретения. В контексте данного изобретения применяются следующие определения:Ct-z, где t и z могут иметь значения от 1 до 8, углеродная цепь, возможно содержащая от t до z атомов углерода, например С 1-3 углеродная цепь, которая может содержать от 1 до 3 атомов углерода; алкил, насыщенная, линейная или разветвленная алифатическая группа, например С 1-3 алкильная группа представляет собой линейную или разветвленную углеродную цепь из 1-3 атомов углерода, более конкретно метил, этил, пропил или 1-метилэтил; алкилен, насыщенная, линейная или разветвленная двухвалентная алкильная группа, например С 1-3 алкиленовая группа представляет собой линейную или разветвленную двухвалентную углеродную цепь из 1-3 атомов углерода, более конкретно метилен, этилен, 1-метилэтилен или пропилен; циклоалкил, циклическая алкильная группа, например С 3-5 циклоалкильная группа представляет собой циклическую углеродную группу из 3-5 атомов углерода, более конкретно циклопропил, циклобутил или циклопентил; алкокси, группа -О-алкил, содержащая насыщенную линейную или разветвленную алифатическую цепь; тиоалкил, группа -S-алкил, содержащая насыщенную линейную или разветвленную алифатическую цепь; фторалкил, алкильная группа, в которой один или более чем один атом водорода заменен атомом фтора; фторалкокси, алкоксигруппа, в которой один или более чем один атом водорода заменен атомом фтора; фтортиоалкил, тиоалкильная группа, в которой один или более чем один атом водорода заменен атомом фтора; атом галогена, фтор, хлор, бром или иод. Соединения по изобретению могут быть получены согласно различным способам, проиллюстрированным на представленных ниже схемах.-3 009468 Так, первый способ (схема 1) заключается во взаимодействии амина общей формулы (II), где А, В,R1, n и m такие, как они определены выше, с карбонатом общей формулы (IIIa), где Z представляет собой атом водорода или нитрогруппу, R4 такой, как он определен выше, и R представляет собой метильную или этильную группу. Карбамат общей формулы (la), полученный таким образом, затем превращают в соединение общей формулы (I) посредством аминолиза, используя амин общей формулы R5NH2, где R5 такой, как он определен выше. Реакция аминолиза может быть проведена в растворителе, таком как метанол, или смеси растворителей, таких как метанол и тетрагидрофуран или метанол и диоксан. Один из вариантов получения соединений общей формулы (I) (схема 1) заключается во взаимодействии амина общей формулы (II), как определено выше, с карбонатом общей формулы (IIIb), где Z представляет собой атом водорода или нитрогруппу, a R4 и R5 такие, как они определены выше, в растворителе, таком как толуол или дихлорэтан, при температуре между 0 и 80 С. Карбонаты общей формулы (IIIa) и (IIIb) могут быть получены любым способом, описанным в литературе, например путем взаимодействия спирта общей формулы HOCHR4COOR, где R представляет собой метильную или этильную группу, или HOCHR4CONHR5, где R4 и R5 такие, как они определены выше, с фенилхлорформиатом или 4-нитрофенилхлорформиатом в присутствии основания, такого как триэтиламин или диизопропилэтиламин. Схема 1 Второй способ получения соединений общей формулы (I) (схема 2) заключается во взаимодействии производного общей формулы (IIa), где Y представляет собой гидроксильную, мезилатную или тозилатную группу либо атом хлора, брома или иода, и А, В, R1, n и m такие, как они определены выше, с оксазолидиндионом общей формулы (IV), где R4 такой, как он определен выше, с получением оксазолидиндионового производного общей формулы (V). В случае, когда Y представляет собой гидроксильную группу, реакция может быть проведена в соответствии с условиями Мицунобу (Synthesis, 1981, 1-28),например посредством действия диэтил- или диизопропилазодикарбоксилата в присутствии трифенилфосфина. В случае, когда Y представляет собой атом хлора, брома или иода либо мезилатную или тозилатную группу, реация может быть проведена в присутствии основания, такого как 1,1,3,3 тетраметилгуанидин, гидрид натрия или трет-бутоксид натрия, в растворителе, таком как тетрагидрофуран, ацетонитрил или диметилформамид, при температуре между 0 С и температурой флегмы растворителя. Оксазолидиндионовое производное общей формулы (V), полученное таким образом, затем превращают в соединение общей формулы (I) посредством аминолиза, используя амин общей формулы R5NH2,где R5 такой, как он определен выше. Схема 2-4 009468 Кроме того, соединения общих формул (I), (Ia), (II), (IIа) и (V), где R1 замещен группой R", могут быть получены путем взаимодействия соответствующих соединений общих формул (I), (Ia), (II), (IIа) и(V), у которых R1 замещен атомом хлора, брома или иода либо трифлатной группой по положению, в которое следует ввести группу R", с производным арил- или гетероарил-бороновой кислоты в соответствии с условиями реакции Сузуки (Chem. Rev. 1995, 95, 2457-2483) или с производным арил- или гетероарил-триалкилстаннана в соответствии с условиями реакции Штилле (Angew. Chem. Int. Ed. 1986, 25, 504524). Соединения общих формул (II), (IIа) и (IV), если способ их получения не описан, имеются в продаже или они описаны в литературе либо, альтернативно, могут быть получены согласно способам, изложенным в данном описании или известным специалистам в данной области техники. Амины общей формулы R5NH2 имеются в продаже. Согласно следующему из своих аспектов объектом изобретения также являются соединения формулы (Ia), где n, m, А, В, R1 и R4 такие, как они определены выше, и R представляет собой метильную или этильную группу. Соединения формулы (Ia) полезны в качестве синтетических промежуточных соединений для получения соединений формулы (I). Согласно следующему из своих аспектов объектом изобретения также являются соединения формулы (V), где n, m, А, В, R1 и R4 такие, как они определены выше, за исключением следующих соединений: 3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-2,4-оксазолидиндион; 3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-метил-2,4-оксазолидиндион; 3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-этил-2,4-оксазолидиндион; 3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-пропил-2,4-оксазолидиндион; 3-[1-(4-амино-6,7-диметокси-2-хиназолинил)-4-пиперидил]-5-(1-метилэтил)-2,4-оксазолидиндион. Соединения формулы (V) полезны в качестве синтетических промежуточных соединений для получения соединений формулы (I). Следующие далее примеры иллюстрируют получение ряда соединений по изобретению. Эти примеры не являются ограничивающими и даны главным образом для иллюстрации изобретения. Микроанализы и спектры ИК, ЯМР и/или ЖХ/МС (жидкостная хроматография в сочетании с массспектроскопией) подтверждают структуры и чистоту полученных соединений. Т.пл. (С) представляет собой точку плавления в градусах Цельсия. Числа, указанные в круглых скобках в заголовках примеров, соответствуют таковым в первой колонке таблицы, представленной в данном описании ниже. Для наименования соединений в представленных ниже примерах использована номенклатура IUPAK (Международный союз по теоретической и прикладной химии). Пример 1 (соединение 38). 2-(Метиламино)-2-оксоэтил-2-[4-(1-нафтил)-1-пиперазинил]этилкарбамат гидрохлорид 1.1. 2-2-[4-(1-Нафтил)-1-пиперазинил]этил-1 Н-изоиндол-1,3(2 Н)-дион Суспензию 1,17 г (5,52 ммоль) 1-(1-нафтил)пиперазина (Tetrahedron Letters, 1998, 39(15), 22192222), 0,99 г (7,15 моль) карбоната калия и 1,68 г (6,62 ммоль) 2-(2-бромэтил)-1H-изоиндол-1,3(2H)диона в 15 мл N,N-диметилформамида нагревают при 90 С в течение 2 ч. Смесь оставляют охлаждаться до комнатной температуры и концентрируют при пониженном давлении. Остаток переводят в этилацетат и воду, водную фазу отделяют и три раза экстрагируют этилацетатом, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле с элюированием смесью этилацетата и циклогексана (40/60). Таким образом получают 1,14 г чистого продукта в виде масла. 1.2. 2-[4-(1-Нафтил)-1-пиперазинил]этанамин 0,17 мл (3,55 ммоль) гидразина моногидрата медленно добавляют при комнатной температуре к раствору 1,14 г (2,96 ммоль) 2-2-[4-(1-нафтил)-1-пиперазинил]этил-1H-изоиндол-1,3(2H)-диона, полученного на стадии 1.1, в 15 мл этанола. Реакционную смесь затем кипятят с обратным холодильником в течение 1 ч. Смесь оставляют охлаждаться до комнатной температуры, нерастворившийся материал отделяют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток переводят в 20 мл диэтилового эфира и перемешивают при комнатной температуре в течение 20 мин. Нерастворившийся материал еще раз отделяют и фильтрат концентрируют при пониженном давлении. Полученный остаток-5 009468 очищают хроматографией на силикагеле, элюируя смесью дихлорметана, метанола и 28%-ного водного аммиака (90/10/1). Таким образом получают 0,45 г амина в виде бесцветного масла. 1.3. Этил-[(фенилоксикарбонил)окси]ацетат 32 мл (256 ммоль) фенилхлорформиата медленно добавляют при комнатной температуре к раствору 25 г (240 ммоль) этилгликолята и 55 мл (315 ммоль) диизопропилэтиламина в 500 мл толуола. Перемешивание при комнатной температуре продолжают в течение 2 ч. Образовавшуюся соль отделяют и фильтрат концентрируют при пониженном давлении. Получают 53,7 г маслянистого продукта и его используют на следующей стадии без дальнейшей очистки. 1.4. Этил-[([2,4-(1-нафтил)-1-пиперазинил]этиламино)карбонил]оксиацетат Раствор 0,45 г (1,76 ммоль) 2-[4-(1-нафтил)-1-пиперазинил]этанамина, полученного на стадии 1.2, и 0,48 г (2,16 ммоль) этил-[(фенилоксикарбонил)окси]ацетата, полученного на стадии 1.3, в 15 мл толуола нагревают при 50 С в течение 6 ч. Смесь оставляют охлаждаться до комнатной температуры, нерастворившийся материал отделяют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток переводят в дихлорметан и воду, водную фазу отделяют и три раза экстрагируют дихлорметаном, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола в отношении 97/3 и затем 93/7. Таким образом получают 0,49 г чистого продукта в виде масла. 1.5. 2-(Метиламино)-2-оксоэтил-2-[4-(1-нафтил)-1-пиперазинил]этилкарбамат 1,9 мл (3,75 ммоль) раствора (2 М) метиламина в тетрагидрофуране добавляют к раствору 0,48 г(1,25 ммоль) этил-[([2,4-(1-нафтил)-1-пиперазинил]этиламино)карбонил]оксиацетата, полученного на стадии 1.4, в 5 мл метанола. Перемешивание при комнатной температуре продолжают в течение 1 ч. После концентрирования при пониженном давлении полученный остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола (97/3). Получают маслянистый остаток, который переводят в раствор соляной кислоты (5 н) в изопропаноле. Смесь концентрируют досуха и полученную соль затем повторно кристаллизуют из смеси ацетона и диизопропилового эфира (1/1). Таким образом получают 0,23 г чистого продукта (моногидрохлорида) в виде твердого вещества белого цвета. ЖХ-МС:М+Н = 371. Т.пл. (С): 166 С. 1 Н ЯМР (DMSO)(млн-1): 2,55 (d, 3H); 3,20-3,75 (неразрешенный пик, 12 Н); 4,40 (s, 2 Н); 7,10 (d,1 Н); 7,35-7,70 (неразрешенный пик, 4 Н); 7,80-8,05 (неразрешенный пик, 2 Н); 8,15 (dd, 1H); 10,90 (уширенный s, 1H). Пример 2 (соединение 157). 2-(Метиламино)-2-оксоэтил-3-[1-(1-изохинолил)-4-пиперидил]пропилкарбамат гидрохлорид 2.1. 2-[1-(1-Изохинолил)-4-пиперидил]этанол 4,17 г (25,50 ммоль) 1-хлоризохинолина, 3,62 г (28 ммоль) 2-(4-пиперидил)этанола, 5,90 г (61,20 ммоль) трет-бутоксида натрия и 0,476 г (0,765 ммоль) BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил),суспендированные в 50 мл толуола, переводят в атмосферу инертного газа. Добавляют 0,233 г (0,255 ммоль) трис(дибензилиденацетон)дипалладия. Затем реакционную смесь кипятят с обратным холодильником в течение 12 ч. Соли отделяют фильтрованием через целит и фильтрат далее концентрируют при пониженном давлении. Остаток переводят в этилацетат и воду, водную фазу отделяют и дважды экстрагируют этилацетатом, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола (97/3). Получают 3,34 г продукта в виде серой пасты. 2.2. 1-[4-(2-хлорэтил)-1-пиперидил]изохинолин 2,20 мл (30,10 ммоль) тионилхлорида по каплям добавляют к раствору 3,09 г (12,10 ммоль) 2-[1-(1 изохинолил)-4-пиперидил]этанола, полученного на стадии 2.1, в 30 мл дихлорметана. Реакционную смесь затем кипятят с обратным холодильником в течение 5 ч. Смесь концентрируют досуха при пониженном давлении. Остаток переводят в 40 мл дихлорметана и 30 мл водного раствора гидроксида натрия (1 М). Водную фазу отделяют и дважды экстрагируют дихлорметаном, объединенные органические фазы промывают насыщенным водным раствором хлорида-6 009468 натрия, сушат над сульфатом натрия и фильтрат концентриуют при пониженном давлении. Получают 2,70 г продукта в виде коричневой пасты, которую используют без дальнейшей очистки на следующей стадии. 2.3. 3-[1-(1-Изохинолил)-4-пиперидил]пропаннитрил 0,63 г (9,57 ммоль) цианида калия порциями добавляют к суспензии 2,63 г (9,57 ммоль) 1-[4-(2 хлорэтил)-1-пиперидил]изохинолина, полученного на стадии 2.2, и 0,048 г (0,29 ммоль) иодида калия в 30 мл диметилсульфоксида. Реакционную смесь выдерживают при приблизительно 120 С в течение 16 ч. Смесь оставляют охлаждаться до комнатной температуры и затем добавляют 90 мл воды и этилацетата. Водную фазу отделяют и три раза экстрагируют этилацетатом, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (30/70). Получают 0,77 г продукта в виде твердого вещества желтого цвета. Т.пл. (С): 141-143 С. 2.4. 3-[1-(1-Изохинолил)-4-пиперидил]пропанамин Раствор 0,77 г (2,90 ммоль) 3-[1-(1-изохинолил)-4-пиперидил]пропаннитрила, полученного на стадии 2.3, в 16 мл тетрагидрофурана по каплям добавляют к суспензии 0,22 г (5,80 ммоль) алюмогидрида лития в 8 мл тетрагидрофурана. Реакционную смесь далее кипятят с обратным холодильником в течение 5 ч. Реакционную среду охлаждают до приблизительно 0 С и затем медленно добавляют 15 мл водного раствора гидроксида натрия (1 М). Смесь перемешивают при комнатной температуре в течение 30 мин с последующим добавлением порциями влажного сульфата натрия. Соли отделяют фильтрованием через бумагу и фазам далее дают возможность разделиться путем отстаивания. Водную фазу три раза экстрагируют этилацетатом, объединенные органические фазы сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана, метанола и 28%-ного водного аммиака в отношении 93/7/0,7. Получают 0,329 г продукта в виде желтого масла, которое кристаллизуется при комнатной температуре. 2.5. Этил-[(3-[1-(1-изохинолил)-4-пиперидил]пропиламино)карбонил]оксиацетат Процесс проводят как и в примере 1 (стадия 1.4). Исходя из 0,350 г (1,30 ммоль) 3-[1-(1 изохинолил)-4-пиперидил]пропанамина, полученного на стадии 2.4, и 0,32 г (1,43 ммоль) этил[(фенилоксикарбонил)окси]ацетата, полученного на стадии 1.3 примера 1, и после хроматографии на силикагеле с элюированием смесью этилацетата и циклогексана (20/80 и затем 30/70) получают 0,383 г продукта в виде желтой пасты. 2.6. 2-(Метиламино)-2-оксоэтил-3-[1-(1-изохинолил)-4-пиперидил]пропилкарбамат Процесс проводят, как описано в примере 1 (стадия 1.5). Исходя из 0,380 г (0,95 ммоль) этил-[(3[1-(1-изохинолил)-4-пиперидил]пропиламино)карбонил]оксиацетата, полученного на стадии 2.5, и 4,8 мл (9,51 ммоль) раствора (2 М) метиламина в тетрагидрофуране, и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (98/2 и затем 95/5) получают 0,277 г продукта в виде масла. Этот маслянистый остаток затем переводят в раствор соляной кислоты (5 н) в изопропаноле, образовавшуюся соль отфильтровывают и затем промывают этилацетатом. После высушивания под вакуумом при приблизительно 40 С получают 0,204 г гидрохлорида в виде аморфного твердого вещества белого цвета. ЖХ-МС: М+Н = 385. 1 Н ЯМР (DMSO+D2O)(млн-1): 1,30 (m, 2H); 1,40-1,80 (неразрешенный пик, 5 Н), 1,90 (уширенный 3.1. 2-1-[3-(Трифторметил)фенил]-4-пиперидилэтанол Процесс проводят, как описано в примере 2 (стадия 2.1). Исходя из 25,6 г (113,90 ммоль) 1-бром-3(трифторметил)бензола, 17,66 г (136,60 ммоль) 2-(4-пиперидил)этанола, 26,24 г (273 ммоль) третбутоксида натрия, 2,12 г (3,41 ммоль) BINAP и 1,04 г (1,14 ммоль) трис(дибензилиденацетон)дипалладия и после хроматографии на силикагеле с элюированием смесью этилацетата и циклогексана (25/75) полу-7 009468 чают 17,90 г маслянистого остатка оранжевой окраски. Этот остаток переводят в 100 мл метанола, затем добавляют раствор 4,24 г гидроксида калия в 15 мл метанола и перемешивание продолжают при комнатной температуре в течение 1 ч. Смесь концентрируют при пониженном давлении и остаток затем переводят в хлороформ и водный раствор соляной кислоты (1 н). Органическую фазу отделяют и сушат над сульфатом натрия, а фильтрат концентрируют при пониженном давлении. Получают 14 г продукта в виде темного желтого масла, которое используют без дальнейшей очистки на следующей стадии. 3.2. 2-1-[3-(Трифторметил)фенил]-4-пиперидилэтилметансульфонат Раствор 1 г (8,78 ммоль) мезилхлорида в 5 мл дихлорметана в атмосфере инертного газа по каплям добавляют к раствору 2 г (7,32 ммоль) 2-1-[3-(трифторметил)фенил]-4-пиперидилэтанола, полученного на стадии 3.1, и 1,53 мл (10,98 ммоль) триэтиламина в 40 мл дихлорметана, охлажденному до приблизительно 0 С. Перемешивание продолжают при 0 С в течение 1 ч и затем при комнатной температуре в течение 2 ч. К реакционной среде добавляют воду, водную фазу отделяют и три раза экстрагируют дихлорметаном, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом получают 2,5 г продукта в виде масла, которое используют без дальнейшей очистки на следующей стадии. 3.3. 3-(2-1-[3-(Трифторметил)фенил]-4-пиперидилэтил)-1,3-оксазолидин-2,4-дион Раствор 2,3 г (6,545 ммоль) 2-1-[3-(трифторметил)фенил]-4-пиперидилэтилметансульфоната, полученного на стадии 3.2, 0,694 г (6,87 ммоль) 1,3-оксазолидин-2,4-диона (J. Med. Chem., 1991, 34, 15381544) и 1,5 г (13,09 ммоль) 1,1,3,3-тетраметилгуанидина в 30 мл тетрагидрофурана кипятят с обратным холодильником в течение 12 ч в атмосфере инертного газа. Смесь концентрируют при пониженном давлении. Остаток переводят в дихлорметан и воду, водную фазу отделяют, дважды экстрагируют дихлорметаном, а объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана в отношении 20/80 и затем 40/60. Получают 1,61 г чистого продукта в виде масла. 3.4. 2-Амино-2-оксоэтил-2-1-[3-(трифторметил)фенил]-4-пиперидилэтилкарбамат 9,3 мл (64,82 ммоль) раствора водного аммиака (7 н) в метаноле добавляют к раствору 0,77 г (2,16 ммоль) 3-(2-1-[3-(трифторметил)фенил]-4-пиперидил-этил)-1,3-оксазолидин-2,4-диона, полученного на стадии 3.3, в 10 мл смеси метанола и тетрагидрофурана (1/1). Перемешивание при комнатной температуре продолжают в течение 24 ч. После концентрирования при пониженном давлении полученный остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана и метанола в отношении 97/3 и затем 95/5, с последующей перекристаллизацией из смеси этилацетата и диизопропилового эфира. Получают 0,370 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 374. Т.пл. (С): 140-142 С. 1 Н ЯМР (CDCl3)(млн-1): 1,30-1,55 (неразрешенный пик, 5 Н); 1,90 (уширенный d, 2H); 2,80 (t, 2H); 3,35 (q, 2H); 3,80 (уширенный d, 2H); 4,60 (s, 2H); 4,90 (уширенный s, 1H); 5,55 (уширенный s, 1H); 6,05 4.1. 2-[1-(6-Метил-2-пиридил)-4-пиперидил]этанол 1 г (7,74 ммоль) 2-(4-пиперидил)этанола и 0,987 г (7,74 ммоль) 2-хлор-6-метилпиридина помещают в автоклав. Смесь затем нагревают при 130 С в течение 17 ч. Реакционную смесь оставляют охлаждаться до комнатной температуры и затем переводят в хлороформ и насыщенный водный раствор гидрокарбоната натрия. Водную фазу отделяют и дважды экстрагируют хлороформом, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом получают 1,21 г продукта в виде жидкости оранжевой окраски, которую используют без дальнейшей очистки на следующей стадии.-8 009468 4.2. 2-[1-(6-Метил-2-пиридил)-4-пиперидил]этилметансульфонат Процесс проводят как и в примере 3 (стадия 3.2). Исходя из 0,661 г (3 ммоль) 2-[1-(6-метил-2 пиридил)-4-пиперидил]этанола, полученного на стадии 4.1, 0,378 г (3,30 ммоль) мезилхлорида и 0,63 мл(4,50 ммоль) триэтиламина получают 0,779 г продукта в виде масла оранжевой окраски, которое используют без дальнейшей очистки на следующей стадии. 4.3. 3-2-[1-(6-Метил-2-пиридил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии со способом, описанным в примере 3 (стадия 3.3). Исходя из 0,776 г (2,60 ммоль) 2-[1-(6-метил-2-пиридил)-4-пиперидил]этилметансульфоната, полученного на стадии 4.2, 0,315 г (3,12 ммоль) 1,3-оксазолидин-2,4-диона и 0,65 мл (5,20 ммоль) 1,1,3,3 тетраметилгуанидина и после хроматографии на силикагеле с элюированием смесью этилацетата и циклогексана (30/70) получают 0,76 г чистого продукта в виде желтого масла. 4.4. 2-(Метиламино)-2-оксоэтил-2-[1-(6-метил-2-пиридил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 1 (стадия 1.5). Исходя из 0,841 г (2,77 ммоль) 3-2-[1-(6-метил-2-пиридил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 4.3, и 6,9 мл (13,86 ммоль) раствора (2 М) метиламина в тетрагидрофуране, получают 0,598 г чистого продукта в виде масла после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (95/5). Этот маслянистый остаток переводят в раствор соляной кислоты (5 н) в изопропаноле, образовавшуюся соль отфильтровывают и далее последовательно промывают ацетоном и затем диэтиловым эфиром. После высушивания под вакуумом при приблизительно 80 С получают 0,492 г гидрохлорида в виде порошка белого цвета. ЖХ-МС: М+Н = 335. Т.пл. (С):95-100 С. 1 Н ЯМР (DMSO+D2O)(млн-1): 0,95-1,45 (неразрешенный пик, 4 Н); 1,60 (m, 1H); 1,80 (уширенный 5.1. [1-(1-Изохинолил)-4-пиперидил]метанол Процесс проводят, как описано в примере 2 (стадия 2.1). Исходя из 2,50 г (15,28 ммоль) 1 хлоризохинолина, 1,94 г (136,6 ммоль) 4-пиперидилметанола, 3,53 г (36,67 ммоль) трет-бутоксида натрия, 0,285 г (0,46 ммоль) BINAP и 0,140 г (0,15 ммоль) трис(дибензилиденацетон)дипалладия и после хроматографии на силикагеле с элюированием смесью дихлорметана, метанола и 28%-ного водного аммиака в отношении 98/2/0,2 и затем 95/5/0,5 получают 2,40 г чистого продукта в виде вязкого оранжевого масла. 5.2. 3-[1-(1-Изохинолил)-4-пиперидил]метил-1,3-оксазолидин-2,4-дион Раствор 2,01 г (9,95 ммоль) диизопропилазодикарбоксилата (DIAD) в 5 мл тетрагидрофурана по каплям в атмосфере инертного газа добавляют к раствору 2,4 г (9,95 ммоль) [1-(1-изохинолил)-4 пиперидил]метанола, полученного на стадии 5.1, 2,87 г (10,94 ммоль) трифенилфосфина и 1,21 г (11,93 ммоль) 1,3-оксазолидин-2,4-диона в 40 мл тетрагидрофурана, охлажденному до приблизительно -10 С,подддерживая все время температуру реакционной среды между -10 и 0 С. Перемешивание далее продолжают при 0 С в течение 1 ч и затем при 25 С в течение 18 ч. Смесь концентрируют при пониженном давлении и остаток переводят в дихлорметан и 10 мл водного 5%-ного раствора гидроксида натрия. Водную фазу отделяют и далее дважды экстрагируют дихлорметаном. Органические фазы объединяют и последовательно промывают водным раствором соляной кислоты (1 н), затем насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на силикагеле, элюируя смесью дихлорметана, метанола и 28%-ного водного аммиака в отношении 99/1/0,1 и затем 98/2/0,2. Таким образом получают 3,57 г оксазолидиндиона в виде оранжевой пасты. 5.3. 2-(Метиламино)-2-оксоэтил-[1-(1-изохинолил)-4-пиперидил]метилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 1 (стадия 1.5). Исходя из 3,57 г(10,97 ммоль) 3-[1-(1-изохинолил)-4-пиперидил]метил-1,3-оксазолидин-2,4-диона, полученного на стадии 5.2, и 27 мл (54,86 ммоль) раствора (2 М) метиламина в тетрагидрофуране и после хроматографии на-9 009468 силикагеле с элюированием смесью дихлорметана, метанола и 28%-ного водного аммиака (95/5/0,5) получают 0,90 г чистого продукта в виде желтой пасты. Этот остаток переводят в раствор соляной кислоты(5 н) в изопропаноле, образовавшуюся соль отфильтровывают и далее промывают ацетоном. После высушивания под вакуумом при приблизительно 80 С получают 0,728 г гидрохлорида в виде твердого вещества бледно-желтой окраски. ЖХ-МС: М+Н = 357. Т.пл. (С): 208-212 С (разложение). 1 Н ЯМР (D2O)(млн-1): 1,55 (m, 2H); 1,95 (m, 3H); 2,70 (s, 3H); 3,20 (уширенный d, 2H); 3,45 (t, 2H); 4,10 (уширенный d, 2H); 4,50 (s, 2H); 7,35 (d, 1H); 7,55 (d, 1 Н); 7,70 (m, 1 Н); 7,90 (d, 2H); 8,20 (d, 1H). Пример 6 (соединение 158). 2-Амино-2-оксоэтил-2-[1-(6-фтор-1-изохинолил)-4-пиперидил]этилкарбамат 6.1. 2-[1-(6-Фтор-1-изохинолил)-4-пиперидил]этанол Процесс проводят, как описано в примере 4 (стадия 4.1). Исходя из 1,52 г (8,39 ммоль) 1-хлор-6 фторизохинолина и 1,20 г (9,23 ммоль) 2-(4-пиперидил)этанола и после хроматографии на силикагеле с элюированием смесью дихлорметана, метанола и 28%-ного водного аммиака (95/5/0,5) получают 0,90 г чистого продукта в виде желтой пасты. 6.2. 2-[1-(6-Фтор-1-изохинолил)-4-пиперидил]этил-метансульфонат Процесс проводят, как описано в примере 3 (стадия 3.2). Исходя из 1,47 г (5,36 ммоль) 2-[1-(6-фтор 1-изохинолил)-4-пиперидил]этанола, полученного на стадии 6.1, 0,675 г (5,89 ммоль) мезилхлорида и 1,13 мл (8,04 ммоль) триэтиламина получают 1,80 г продукта в виде масла, которое используют без дальнейшей очистки на следующей стадии. 6.3. 3-2-[1-(6-Фтор-1-изохинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии со способом, описанным в примере 3 (стадия 3.3). Исходя из 1,8 г(5,10 ммоль) 2-[1-(6-фтор-1-изохинолил)-4-пиперидил]этилметансульфоната, полученного на стадии 6.2,0,62 г (6,13 ммоль) 1,3-оксазолидин-2,4-диона и 1,30 мл (10,21 ммоль) 1,1,3,3-тетраметилгуанидина и после хроматографии на силикагеле с элюированием смесью этилацетата и циклогексана (40/60) получают 1,34 г чистого продукта в виде аморфного твердого вещества белого цвета. 6.4. 2-Амино-2-оксоэтил-2-[1-(6-фтор-1-изохинолил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 3 (стадия 3.4). Исходя из 0,597 г (1,67 ммоль) 3-2-[1-(6-фтор-1-изохинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 6.3, и 14,30 мл (100,20 ммоль) раствора (7 М) водного аммиака в метаноле и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (95/5) с последующей перекристаллизацией из диизопропилового эфира получают 0,168 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 375. Т.пл. (С): 135-139 С. 1 Н ЯМР (DMSO)(млн-1): 1,20-1,70 (неразрешенный пик, 5 Н); 1,80 (уширенный d, 2H); 2,85 (t, 2H),3,10 (уширенный d, 2H); 3,70 (уширенный d, 2H); 4,30 (s, 2H); 6,95-7,20 (неразрешенный пик, 3 Н); 7,30 (d,1H); 7,45 (td, 1H); 7,60 (dd, 1H);8,10 (m, 2H). Пример 7 (соединение 172). 2-(Метиламино)-2-оксоэтил-2-[1-(4-изохинолил)-4-пиперидил]этилкарбамат гидрохлорид 7.1. 2-[1-(4-Изохинолил)-4-пиперидил]этанол Процесс проводят согласно протоколу, описанному в примере 2 (стадия 2.1). Исходя из 1 г (4,81 ммоль) 4-бромизохинолина, 0,683 г (5,29 ммоль) 2-(4-пиперидил)этанола, 1,11 г (11,50 ммоль) третбутоксида натрия,0,090 г(0,048 ммоль) трис(дибензилиденацетон)дипалладия и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола в отношении 97/3 и затем 95/5 получают 0,810 г продукта в виде вязкой зеленой жидкости.- 10009468 7.2. 3-2-[1-(4-Изохинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Используют методику, описанную в примере 5 (стадия 5.2). Исходя из 0,801 г (3,12 ммоль) 2-[1-(4 изохинолил)-4-пиперидил]этанола, полученного на стадии 7.1, 0,902 г (3,44 ммоль) трифенилфосфина,0,379 г (3,75 ммоль) 1,3-оксазолидин-2,4-диона и 0,632 г (3,12 ммоль) диизопропилазодикарбоксилата(DIAD) и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (98/2) получают 1 г продукта в виде зеленой пасты. 7.3. 2-(Метиламино)-2-оксоэтил-2-[1-(4-изохинолил)-4-пиперидил]этилкарбамат Используют методику, описанную в примере 1 (стадия 1.5). Исходя из 1 г (2,95 ммоль) 3-2-[1-(4 изохинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 7.2, и 7,40 мл (14,73 ммоль) раствора (2 М) метиламина в тетрагидрофуране и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (95/5) получают 0,410 г чистого продукта в виде аморфного вещества белого цвета. Этот маслянистый остаток затем переводят в раствор соляной кислоты (5 н) в изопропаноле, образовавшуюся соль отфильтровывают и далее промывают последовательно ацетоном и затем диизопропиловым эфиром. После высушивания под вакуумом при приблизительно 90 С получают 0,359 г гидрохлорида в виде твердого вещества желтого цвета. ЖХ-Мс: М+Н = 371. Т.пл. (С): 205-210 С. 1 Н ЯМР (DMSO)(млн-1): 1,30-1,70 (неразрешенный пик, 5 Н); 1,90 (уширенный d, 2H); 2,60 (d, 3H); 2,90 (t, 2H), 3,15 (m, 2H); 3,50 (уширенный d, 2 Н); 4,35 (s, 2H); 7,25 (уширенный t, 1H); 7,80 (уширенный 8.1. 2-[1-(2-Хинолил)-4-пиперидил]этанол Процесс проводят, как описано в примере 4 (стадия 4.1). Исходя из 2 г (12,20 ммоль) 2 хлорхинолина и 1,58 г (12,20 ммоль) 2-(4-пиперидил)этанола и после хроматографии на силикагеле с элюированием смесью дихлорметана, метанола и 28%-ного водного аммиака в отношении 98/2/0,2 и затем 95/5/0,5 получают 2,36 г чистого продукта в виде бледно-желтого масла, которое кристаллизуется при комнатной температуре. 8.2. 3-2-[1-(2-Хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии с методикой, описанной в примере 5 (стадия 5.2). Исходя из 2,22 г(8,65 ммоль) 2-[1-(2-хинолил)-4-пиперидил]этанола, полученного на стадии 8.1, 2,50 г (9,52 ммоль) трифенилфосфина, 1,05 г (10,38 ммоль) 1,3-оксазолидин-2,4-диона и 1,75 г (8,65 ммоль) диизопропилазодикарбоксилата (DIAD) и после хроматографии на силикагеле с элюированием смесью этилацетата и циклогексана в отношении 30/70 и затем 40/60 получают 2,63 г продукта в виде аморфного твердого вещества белого цвета. 8.3. 2-(Метиламино)-2-оксоэтил-2-[1-(2-хинолил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 1 (стадия 1.5). Исходя из 1,5 г(4,42 ммоль) 3-2-[1-(2-хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 8.2, и 11 мл (22,10 ммоль) раствора (2 М) метиламина в тетрагидрофуране и после хроматографии на силикагеле с элюированием смесью дихлорметана, метанола и 28%-ного водного аммиака в отношении 98/2/0,2 и затем 95/5/0,5 с последующей кристаллизацией из этилацетата получают 0,405 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС:М+Н = 371. Т.пл. (С): 125-128 С. 1 Н ЯМР (CDCl3)(млн-1): 1,20-1,60 (неразрешенный пик, 5 Н); 1,85 (уширенный d, 2H); 2,85 (d, 3H); 3,0 (уширенный t, 2H), 3,30 (уширенный q, 2 Н); 4,55 (уширенный d, 2H); 4,60 (s, 2H); 4,85 (уширенный s,1H); 6,10 (уширенный s, 1 Н); 7,0 (d, 1H); 7,20 (t, 1H); 7,55 (m, 2H); 7,70 (d, 1H); 7,90 (d, 1H). Пример 9 (соединение 127). 2-Амино-2-оксоэтил-2-[1-(2-хинолил)-4-пиперидил]этилкарбамат(стадия 8.2), и 9,60 мл (67,20 ммоль) раствора (7 М) водного аммиака в метаноле и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (95/5) с последующей перекристаллизацией из этилацетата получают 0,360 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 357. Т.пл. (С): 135-137C. 1 Н ЯМР (CDCl3)(млн-1): 1,15-1,70 (неразрешенный пик, 5 Н); 1,85 (уширенный d, 2H); 2.95 (t, 2H); 3,35 (q, 2H); 4,55 (уширенный d, 2H); 4,60 (s, 2H); 4,85 (уширенный s, 1H); 5,55 (уширенный s, 1H); 6,05 10.1. 2-[1-(6-Хлор-2-хинолил)-4-пиперидил]этанол Процесс проводят, как описано в примере 4 (стадия 4.1). Исходя из 2 г (10,10 ммоль) 2,6 дихлорхинолина и 1,44 г (11,10 ммоль) 2-(4-пиперидил)этанола и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (98/2) получают 2,54 г чистого продукта в виде твердого вещества белого цвета. 10.2. 2-[1-(6-Хлор-2-хинолил)-4-пиперидил]этилметансульфонат Процесс проводят, как описано в примере 3 (стадия 3.2). Исходя из 2,49 г (8,56 ммоль) 2-[1-(6-хлор 2-хинолил)-4-пиперидил]этанола, полученного на стадии 10.1, 1,08 г (9,42 ммоль) мезилхлорида и 1,81 мл (12,84 ммоль) триэтиламина получают 3,10 г продукта в виде масла, которое используют без дальнейшей очистки на следующей стадии. 10.3. 3-2-[1-(6-Хлор-2-хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии со способом, описанным в примере 3 (стадия 3.3). Исходя из 3 г(8,13 ммоль) 2-[1-(6-хлор-2-хинолил)-4-пиперидил]этилметансульфоната, полученного на стадии 10.2,1,09 г (10,8 ммоль) 1,3-оксазолидин-2,4-диона и 2,30 мл (18 ммоль) 1,1,3,3-тетраметилгуанидина и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (98/2) получают 2,57 г продукта. 10.4. 2-Амино-2-оксоэтил-2-[1-(6-хлор-2-хинолил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 3 (стадия 3.4). Исходя из 1,28 г(3,42 ммоль) 3-2-[1-(6-хлор-2-хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 10.3, и 22,10 мл (154,08 ммоль) раствора (7 М) водного аммиака в метаноле и после кристаллизации из этанола получают 0,64 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 391. Т.пл. (С): 189-191 С. 1 Н ЯМР (DMSO)(млн-1): 1,10 (m, 2 Н); 1,40 (m, 2 Н); 1,60 (m, 1 Н); 1,80 (уширенный d, 2 Н); 2,90 11.1. 2-[1-(3-Изохинолил)-4-пиперидил]этанол Процесс проводят, как описано в примере 4 (стадия 4.1). Исходя из 1 г (6,11 ммоль) 3- 12009468 хлоризохинолина и 0,869 г (6,72 ммоль) 2-(4-пиперидил)этанола и после хроматографии на силикагеле с элюированием смесью дихлсрметана и метанола (98/2) получают 0,34 г чистого продукта в виде масла. 11.2. 2-[1-(3-Изохинолил)-4-пиперидил]этилметансульфонат Процесс проводят, как описано в примере 3 (стадия 3.2). Исходя из 0,34 г (1,33 ммоль) 2-[1-(3 изохинолил)-4-пиперидил]этанола, полученного на стадии 11.1, 0,18 г (1,59 ммоль) мезилхлорида и 0,30 мл (1,99 ммоль) триотиламина получают 0,44 г продукта в виде масла, которое используют без дальнейшей очистки на следующей стадии. 11.3. 3-2-[1-(3-Изохинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии со способом, описанным в примере 3 (стадия 3.3). Исходя из 0,44 г (1,32 ммоль) 2-[1-(3-изохинолил)-4-пиперидил]этил-метансульфоната, полученного на стадии 11.2, 0,16 г (1,58 ммоль) 1,3-оксазолидин-2,4-диона и 0,30 г (2,63 ммоль) 1,1,3,3-тетраметилгуанидина и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (98/2) получают 0,25 г продукта. 11.4. 2-(Метиламино)-2-оксоэтил-2-[1-(3-изохинолил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 1 (стадия 1.5). Исходя из 0,24 г(0,71 ммоль) 3-2-[1-(3-изохинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 11.3, и 1,8 мл (3,53 ммоль) раствора (2 М) метиламина в тетрагидрофуране и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола в отношении 98/2 и затем 96/4 с последующей кристаллизацией из диизопропилового эфира получают 0,16 г чистого продукта в виде твердого вещества белого цвета. ЖХ-MC:M+Н = 371. Т.пл. (С): 156-158 С. 1 Н ЯМР (CDCl3)(млн-1): 1,20-1,70 (неразрешенный пик, 5 Н); 1,85 (d, 2H); 2,90 (m, 5H); 3,30 (q,2H); 4,40 (d, 2H); 4,60 (s, 2H); 4,85 (уширенный s, 1H); 6,10 (уширенный s, 1 Н); 6,80 (s, 1H); 7,30 (т, 1 Н); 7,60 (т, 2 Н); 7,80 (d, 1 Н); 8,95 (s, 1 Н). Пример 12 (соединение 128). 2-(Метиламино)-2-оксоэтил-2-[4-фтор-1-(2-хинолил)-4-пиперидил]этилкарбамат(108,50 ммоль) трет-бутил-4-(2-этокси-2-оксоэтил)-4-гидрокси-1 пиперидинкарбоксилата (WO 02/16352) в 150 мл тетрагидрофурана по каплям добавляют к суспензии 4,12 г (108,50 ммоль) алюмогидрида лития в 150 мл тетрагидрофурана. Смесь перемешивают при комнатной температуре в течение 2 ч и затем обрабатывают, как описано в примере 2 (стадия 2.4). Получают 26 г продукта в виде желтого масла, которое используют без дальнейшей очистки на следующей стадии. 12.2. трет-Бутил-4-(2-[трет-бутилдифенилсилил]оксиэтил)-4-гидрокси-1-пиперидинкарбоксилат Раствор 21,50 мл (82,50 ммоль) трет-бутилдифенилсилилхлорида в 15 мл дихлорметана по каплям добавляют в атмосфере инертного газа к раствору 18,4 г (75 ммоль) трет-бутил-4-гидрокси-4-(2 гидроксиэтил)-1-пиперидинкарбоксилата, полученного на стадии 12.1, и 11,60 мл (82,50 ммоль) триэтиламина в 100 мл дихлорметана, охлажденному до приблизительно 0 С. Смесь оставляют нагреваться до комнатной температуры и затем продолжают перемешивание в течение 12 ч. В реакционную среду добавляют насыщенный водный раствор хлорида аммония. Водную фазу отделяют и дважды экстрагируют дихлорметаном, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана в отношении 10/90 и затем 20/80. Таким образом получают 33,48 г продукта в виде желтого масла 12.3. трет-Бутил-4-(2-[трет-бутил(дифенил)силил]оксиэтил)-4-фтор-1-пиперидинкарбоксилат Раствор 1,70 мл (13,40 ммоль) 1,1'-[(трифтор-4-сульфанил)имино]диэтана (DAST) в 10 мл дихлорметана по каплям добавляют в атмосфере инертного газа к раствору 5 г (10,34 ммоль) трет-бутил-4-(2[трет-бутил(дифенил)силил]оксиэтил)-4-гидрокси-1-пиперидинкарбоксилата, полученного на стадии 12.2, в 100 мл дихлорметана, охлажденному до приблизительно 0 С. Смесь оставляют нагреваться до комнатной температуры и затем продолжают перемешивание в течение 12 ч. В реакционную среду добавляют насыщенный водный раствор гидрокарбоната натрия. Водную фазу отделяют и экстрагируют три раза дихлорметаном, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Фильтрат концентрируют при пониженном давлении и- 13009468 полученный таким образом остаток далее очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (10/90). Таким образом получают 4,65 г продукта в виде масла оранжевой окраски. 0,60 мл раствора тетроксида осмия (2,5%-ного) в трет-бутаноле добавляют при комнатной температуре к раствору 4,50 г этого маслянистого остатка и 1,25 г (10,7 ммоль) оксида N-метилморфолина(NMO) в смеси 8 мл ацетона и 6 мл воды. Перемешивание продолжают в течение 21 ч. Остаток переводят в этилацетат и воду, водную фазу отделяют и дважды экстрагируют этилацетатом, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле,элюируя смесью этилацетата и циклогексана (6/94). Таким образом получают 3,40 г продукта в виде бледно-желтого масла. 12.4. 4-(2-[трет-Бутил(дифенил)силил]оксиэтил)-4-фторпиперидин 2,80 мл (37,06 ммоль) трифторуксусной кислоты медленно добавляют к раствору 3 г (6,17 ммоль) трет-бутил-4-(2-[трет-бутил(дифенил)силил]оксиэтил)-4-фтор-1-пиперидинкарбоксилата, полученного на стадии 12.3, в 20 мл дихлорметана. Перемешивание продолжают при комнатной температуре в течение 5 ч. Реакционную смесь выливают в смесь воды со льдом и 28%-ного водного аммиака. Фазы разделяют путем отстаивания, водную фазу дважды экстрагируют дихлорметаном, объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Таким образом получают 2,30 г продукта в виде желтого масла, которое используют без дальнейшей очистки на следующей стадии. 12.5. 2-[4-(2-[трет-Бутилдифенилсилил]оксиэтил)-4-фтор-1-пиперидил]хинолин Процесс проводят, как описано в примере 2 (стадия 2.1). Исходя из 1,18 г (5,68 ммоль) 2 бромхинолина (Eur. J. Org. Chem. 2002, 4181-4184), 2,30 г (5,98 ммоль) 4-(2-[третбутил(дифенил)силил]оксиэтил)-4-фторпиперидина, полученного на стадии 12.4, 0,66 г (6,81 ммоль) трет-бутоксида натрия, 0,149 г (0,239 ммоль) BINAP и 0,074 г (0,081 ммоль) трис(дибензилиденацетон)дипалладия и после хроматографии на силикагеле с элюированием смесью этилацетата и циклогексэна (10/90) получают 2,15 г чистого продукта в виде масла оранжевой окраски. 12.6. 2-[4-Фтор-1-(2-хинолил)-4-пиперидил]этанол 0,40 г (1,26 ммоль) н-тетрабутиламмония фторида тригидрата добавляют к раствору 2,15 г (4,19 ммоль) 2-[4-(2-[трет-бутилдифенилсилил]оксиэтил)-4-фтор-1-пиперидил]хинолина, полученного на стадии 12.5, в 20 мл тетрагидрофурана. Перемешивание продолжают при комнатной температуре в течение 4 ч. Смесь концентрируют досуха и полученный остаток далее очищают хроматографией на силикагеле, элюируя смесью этилацетата и цилогексана в отношении 35/65 и затем 40/60. Получают 0,61 г продукта в виде масла оранжевой окраски. 12.7. 2-[4-Фтор-1-(2-хинолил)-4-пиперидил]этилметансульфонат Процесс проводят, как описано в примере 3 (стадия 3.2). Исходя из 0,61 г (2,22 ммоль) 2-[4-фтор-1(2-хинолил)-4-пиперидил]этанола, полученного на стадии 12.6, 0,280 г (2,45 ммоль) мезилхлорида и 0,35 мл (2,45 ммоль) триэтиламина, получают 0,80 г продукта в виде масла оранжевой окраски, которое используют без дальнейшей очистки на следующей стадии. 12.8. 3-2-[4-Фтор-1-(2-хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии со способом, описанным в примере 3 (стадия 3.3). Исходя из 0,780 г (2,22 ммоль) 2-[4-фтор-1-(2-хинолил)-4-пиперидил]этилметансульфоната, полученного на стадии 12.7, 0,27 г (2,66 ммоль) 1,3-оксазолидин-2,4-диона и 0,51 г (4,43 ммоль) 1,1,3,3-тетраметилгуанидина и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (99/1) получают 0,520 г чистого продукта в виде твердого вещества бежевой окраски. 12.9. 2-(Метиламино)-2-оксоэтил-2-[4-фтор-1-(2-хинолил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 1 (стадия 1.5). Исходя из 0,52 г(1,46 ммоль) 3-2-[4-фтор-1-(2-хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 12.8, и 3,6 мл (7,28 ммоль) раствора (2 М) метиламина в тетрагидрофуране и после хроматографии на силикагеле с элюированием смесью этилацетата и метанола (99/1) с последующей кристаллизацией из диэтилового эфира, получают 0,390 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 389. Т.пл. (С): 147-149 С. 1 Н ЯМР (CDCl3)(млн-1): 1,70-2,10 (неразрешенный пик, 6 Н); 2,90 (d, 3 Н); 3,40 (уширенный t, 2H); 3,50 (q, 2H); 4,40 (уширенный d, 2H); 4,60 (s, 2H); 5,15 (уширенный s, 1H); 6,15 (уширенный s, 1H); 7,05 13.1. 2-[1-(6-Бром-2-пиридил)-4-пиперидил]этанол Процесс проводят, как описано в примере 4 (стадия 4.1). Исходя из 30,20 г (127 ммоль) 2,6 дибромпиридина и 16,45 г (127 ммоль) 2-(4-пиперидил)этанола и после хроматографии на силикагеле с элюированием смесью этилацетата и циклогексана (30/70) получают 7 г чистого продукта в виде масла. 13.2. 2-[1-(6-Бром-2-пиридил)-4-пиперидил]этилметансульфонат Процесс проводят, как описано в примере 3 (стадия 3.2). Исходя из 7 г (24,50 ммоль) 2-[1-(6-бром-2 пиридил)-4-пиперидил]этанола, полученного на стадии 13.1, 2,50 мл (26,90 ммоль) мезилхлорида и 3,80 мл (26,90 ммоль) триэтиламина, получают 8,68 г продукта в виде масла, которое используют без дальнейшей очистки на следующей стадии. 13.3. 3-2-[1-(6-Бром-2-пиридил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии со способом, описанным в примере 3 (стадия 3.3). Исходя из 8,68 г (23,80 ммоль) 2-[1-(6-бром-2-пиридил)-4-пиперидил]этилметансульфоната, полученного на стадии 13.2,2,90 г (28,60 ммоль) 1,3-оксазолидин-2,4-диона и 6 мл (47,60 ммоль) 1,1,3,3-тетраметилгуанидина и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (97/3) получают 4,52 г продукта в виде масла. 13.4. 3-2-[1-(6-Изобутил-2-пиридил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион 2 г (5,43 ммоль) 3-2-[1-(6-бром-2-пиридил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 13.3, и 0,20 г (0,271 ммоль) дихлорбис(трифенилфосфин)палладия (Pd(PPh3)2Cl2), суспендированного в 10 мл тетрагидрофурана, вводят в атмосферу инертного газа. Затем добавляют 22 мл(10,80 ммоль) раствора (0,5 М) бром(изобутил)цинка в тетрагидрофуране. Перемешивание продолжают при комнатной температуре в течение 17 ч. Реационную смесь выливают в воду и этилацетат. Фазы разделяют путем отстаивания, водную фазу дважды экстрагируют этилацетатом, объединенные органические фазы сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (20/80). Получают 1,41 г продукта в виде твердого вещества белого цвета. Т.пл. (С): 94-96 С. 13.5. 2-(Метиламино)-2-оксоэтил-2-[1-(6-изобутил-2-пиридил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 1 (стадия 1.5). Исходя из 0,72 г(2,08 ммоль) 3-2-[1-(6-изобутил-2-пиридил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 13.4, и 5,20 мл (10,40 ммоль) раствора (2 М) метиламина в тетрагидрофуране и после хроматографии на силикагеле с элюированием смесью дихлорметана, метанола и 28%-ного водного аммиака(95/5/0,5) с последующей кристаллизацией из диизопропилового эфира, получают 0,540 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 377. Т.пл. (С): 97-99C. 1 Н ЯМР (DMSO)(млн-1): 0,85 (d, 6H); 1,05 (m, 2H); 1,20-1,60 (неразрешенный пик, 3 Н); 1,70 (уширенный d, 2 Н); 2,0 (m, 1 Н); 2,40 (d, 2H); 2,55 (d, 3 Н); 2,70 (уширенный t, 2H); 3,05 (уширенный q, 2H); 4,20 (уширенный d, 2H); 4,30 (s, 2H); 6,35 (d, 1H); 6,55 (d, 1H); 7,15 (уширенный t, 1H); 7,40 (dd, 1H); 7,75 14.1. 3-2-[1-(6-Фенил-2-пиридил)-4-пиперидил]метил-1,3-оксазолидин-2,4-дион 0,20 г (0,56 ммоль) 3-2-[1-(6-бром-2-пиридил)-4-пиперидил]метил-1,3-оксазолидин-2,4-диона, полученного в соответствии с методикой, описанной в примере 13 (стадии 13.1, 13.2 и 13.3), 0,089 г (0,73 ммоль) фенилбороновой кислоты и 0,480 г (2,25 ммоль) гидратированного фосфата калия, суспендированного в 3 мл 1,2-диметоксиэтана, вводят в атмосферу инертного газа. Затем добавляют 0,040 г (0,0346 ммоль) тетракис-(трифенилфосфин)палладия. Реакционную смесь далее поддерживают при приблизительно 85 С в течение 16 ч. Полученную смесь концентрируют при пониженном давлении. Остаток пе- 15009468 реводят в этилацетат и воду, водную фазу отделяют и дважды экстрагируют этилацетатом, объединенные органические фазы сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (40/60). Получают 0,175 г продукта. 14.2. 2-Амино-2-оксоэтил 2-[1-(6-фенил-2-пиридил)-4-пиперидил]метилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 3 (стадия 3.4). Исходя из 0,175 г (0,499 ммоль) 3-2-[1-(6-фенил-2-пиридил)-4-пиперидил]метил-1,3-оксазолидин-2,4-диона, полученного на стадии 14.1, и 2,5 мл (17,45 ммоль) раствора (7 М) нашатырного спирта в метаноле после кристаллизации из этилацетата получают 0,070 г чистого продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 369. Т.пл. (С): 131-132 С. 1 Н ЯМР (CDCl3)(млн-1): 1,20-1,90 (неразрешенный пик, 5 Н); 2,90 (уширенный t, 2H); 3,20 (t, 2H); 4,50 (уширенный d, 2H); 4,60 (s, 2H); 5,0 (уширенный s, 1H); 5,55 (уширенный s, 1H); 6,15 (уширенный s,1H); 6,65 (d, 1H); 7,10 (d, 1H); 7,35-7,60 (m, 4H); 8,15 (dd, 2H). Пример 15 (соединение 130). 2-(Метиламино)-2-оксоэтил-2-[1-(5-хлор-2-хинолил)-4-пиперидил]этилкарбамат 15.1. 2-[1-(5-Хлор-2-хинолил)-4-пиперидил]этанол Процесс проводят, как описано в примере 4 (стадия 4.1). Исходя из 4,78 г (24,14 ммоль) 2-хлор-5 хлорхинолина (J. Med. Chem., 2002, 45, 3130-3137), и 3,43 г (26,55 ммоль) 2-(4-пиперидил)этанола получают 7 г продукта в виде масла, которое используют без дальнейшей очистки на следующей стадии. 15.2. 2-[1-(5-Хлор-2-хинолил)-4-пиперидил]этил-метансульфонат Процесс проводят, как описано в примере 3 (стадия 3.2). Исходя из 7 г (24,07 ммоль) 2-[1-(5-хлор-2 хинолил)-4-пиперидил]этанола, полученного на стадии 15.1, 3,31 г (28,89 ммоль) мезилхлорида и 5,10 мл(36,11 ммоль) триэтиламина получают 8,70 г продукта в виде масла, которое используют без дальнейшей очистки на следующей стадии. 15.3. 3-2-[1-(5-Хлор-2-хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-дион Процесс проводят в соответствии со способом, описанным в примере 3 (стадия 3.3). Исходя из 8,7 г(23,58 ммоль) 2-[1-(5-хлор-2-хинолил)-4-пиперидил]этилметансульфоната, полученного на стадии 15.2,2,86 г (28,30 ммоль) 1,3-оксазолидин-2,4-диона и 5,43 г (47,17 ммоль) 1,1,3,3-тетраметилгуанидина и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола (99,5/0,5), получают 6,40 г продукта в виде твердого вещества белого цвета. Т.пл. (С): 136 С. 15.4. 2-(Метиламино)-2-оксоэтил-2-[1-(5-хлор-2-хинолил)-4-пиперидил]этилкарбамат Процесс проводят в соответствии с методикой, описанной в примере 1 (стадия 1.5). Исходя из 6,40 г(17,12 ммоль) 3-2-[1-(5-хлор-2-хинолил)-4-пиперидил]этил-1,3-оксазолидин-2,4-диона, полученного на стадии 15.3, и 60 мл (119,84 ммоль) раствора (2 М) метиламина в тетрагидрофуране и после хроматографии на силикагеле с элюированием смесью дихлорметана и метанола в отношении 98/2 и затем 96/4 с последующей кристаллизацией из диизопропилового эфира получают 5,14 г продукта в виде твердого вещества белого цвета. ЖХ-МС: М+Н = 405. Т.пл. (С): 158-162 С. 1 Н ЯМР (CDCl3)(млн-1): 1,10-1,80 (неразрешенный пик, 5 Н); 1,9 (уширенный d, 2 Н); 2,90 (d, 3 Н); 3,0 (m, 2 Н); 3,30 (q, 2 Н); 4,60 (m, 4 Н); 4,85 (уширенный s, 1H); 6,10 (уширенный s, 1H); 7,05 (d, 1H); 7,25(d, 1H); 7,40 (dd, 1H);7,60 (d, 1H);8,30 (s, 1H). В представленной ниже табл. 1 проиллюстрированы химические структуры и физические свойства ряда соединений согласно изобретению. В этой таблице в колонке основание или соль основание означает соединение в форме свободного основания, в то время как HCl означает соединение в форме гидрохлорида; ОМе означает метоксигруппу. М+Н (ЖХ-МС) разл. = разложение продукта Соединения по изобретению подвергали фармакологическим испытаниям с целью определения их ингибирующего действия в отношении фермента FAAH (fatty acid amide hydrolase; гидролаза амидов жирных кислот) Ингибиторная активность была продемонстрирована в радиоферментном тесте, основанном на измерении продукта гидролиза (этаноламин [1-3 Н]) анандамида [этаноламин 1-3 Н] посредством FAAH (LifeSciences (1995), 56, 1999-2005 и Journal of Pharmacology and Experimented Therapeutics (1997), 283, 729734). Так, у мышей извлекали головной мозг (минус мозжечок) и хранили при -80 С. Мембранные гомогенаты для немедленного использования получали гомогенизацией тканей с использованием гомогенизатора Polytron в 10 мМ трис-HCl буфере (рН 8,0), содержащем 150 мМ NaCl и 1 мМ EDTA (этилендиаминтетрауксусная кислота). Ферментативную реакцию далее осуществляли в 70 мкл буфера, содержащего свободный от жирных кислот бычий сывороточный альбумин (1 мг/мл). К тестируемым соединениям в различных концентрациях последовательно добавляли анандамид [этаноламин 1-3 Н] (удельная активность 15-20 Ки/ммоль), разбавленный до 10 мкМ нерадиоактивным анандамидом, и мембранный препарат (400 мкг замороженной ткани на тест). Через 15 мин при 25 С ферментативную реакцию гасили путем добавления 140 мкл смеси хлороформ/метанол (2:1). Смесь перемешивали в течение 10 мин и затем центрифугировали в течение 15 мин при 3500 g. Аликвоту (30 мкл) водной фазы, содержащей этаноламин [1-3 Н], подсчитывали на жидкостном сцинтилляционном счетчике. В этих условиях наиболее активные соединения по изобретению имеют величины IC50 (концентрация, при которой ингибируется 50% контрольной ферментативной активности FAAH) между 0,001 и 1 мкМ. В представленной ниже табл. 2 показаны величины IC50 для некоторых соединений согласно изобретению. Таблица 2 Таким образом показано, что соединения согласно изобретению обладают ингибиторной активностью в отношении фермента FAAH. Активность соединений по изобретению in vivo оценивали в тесте на аналгезию. Так, внутрибрюшинное (в.б.) введение PBQ (фенилбензохинон, 2 мг/кг в 0,9%-ном растворе хлорида натрия, содержащем 5% этанола) самцам OF1 мышей массой 25-30 г вызывает абдоминальные тракции, в среднем 30 скручиваний или сокращений в продолжение периода от 5 до 15 мин после инъекции. Тестируемые соединения вводят перорально или внутрибрюшинно в виде 0,5%-ной суспензии в Твин 80 за 60 или 120 мин перед введением PBQ. В этих условиях наиболее сильнодействующие соединения по- 27009468 изобретению дают снижение на 35-70% числа тракций, индуцированных действием PBQ, в дозовом интервале между 1 и 30 мг/кг. В представленной ниже табл. 3 показаны результаты теста на аналгезию для некоторых соединений согласно изобретению. Таблица 3(б) 3 мг/кг п.о. за 1 ч. Фермент FAAH (Chemistry and Physics of Lipids, (2000), 103, 107-121) катализирует гидролиз эндогенных амидных и сложноэфирных производных разнообразных жирных кислот, таких как Nарахидоноилэтаноламин (анандамид), N-пальмитоилэтаноламин, N-олеоилэтаноламин, олеамид или 2 арахидоноилглицерин. Эти производные проявляют различные фармакологические активности путем взаимодействия, inter alia, с каннабиноидными и ванилоидными рецепторами. Соединения по изобретению блокируют данный путь деградации и увеличивают тканевое содержание этих эндогенных веществ. Они могут быть использованы в этом отношении в предупреждении и лечении патологий, в которые вовлечены эндогенные канабиноиды и/или любые другие субстраты, метаболизируемые под действием фермента FAAH. Примеры, которые могут быть упомянуты, влючают следующие заболевания и недомогания: боль, в особенности, острая или хроническая боль нейрогенного типа: мигрень, невропатическую боль, в том числе формы, ассоциированные с вирусом герпеса и диабетом, острая или хроническая боль,ассоциированная с воспалительными заболеваниями: артритом, ревматоидным артритом, остеоартритом,спондилитом, подагрой, васкулитом, болезнью Крона, синдромом раздраженного кишечника,острая или хроническая периферическая боль,головокружение, рвота, тошнота, в частности тошнота после химиотерапии,нарушения пищевого поведения, в частности анорексия и кахексия различной природы,неврологические и психиатрические патологии: тремор, дискинезия, дистония, мышечная спастичность, компульсивное и обсессивное поведение, синдром Туретта, все формы депрессии и тревоги любой природы или происхождения, расстройства настроения, психозы,острые и хронические нейродегенеративные заболевания: болезнь Паркинсона, болезнь Альцгеймера, сенильная деменция, хорея Гентингтона, поражения, ассоциированные с церебральной ишемией и черепной и мозговой травмой, эпилепсия,расстройства сна, в том числе апноэ во сне,сердечно-сосудистые заболевания, в частности гипертензия, сердечная аритмия, артериосклероз,сердечный приступ, сердечная ишемия,почечная ишемия,рак: доброкачественные опухоли кожи, папилломы, опухоли предстательной железы, церебральные опухоли (глиобластомы, медуллоэпителиомы, медуллобластомы, нейробластомы, опухоли эмбрионального происхождения, астроцитомы, астробластомы, эпендимомы, олигодендроглиомы, опухоль сплетения, нейроэпителиомы, опухоли шишковидного тела, эпендимобластомы, злокачественные менингиомы,саркоматоз, злокачественные меланомы, шванномы),расстройства иммунной системы, в особенности аутоиммунные заболевания: псориаз, красная волчанка, заболевания соединительной ткани, синдром Шегрена, анкилозирующий спондилоартрит, недифференцируемый спондилит, болезнь Бехчета, гемолитические аутоиммунные анемии, рассеянный склероз, амиотрофический боковой склероз, амилоз, отторжение трансплантатов, заболевания, воздействующие на линию плазмоцитов,аллергические заболевания: аллергическая реакция немедленного или замедленного типа, аллергический ринит или аллергический конъюнктивит, контактный дерматит,паразитарные, вирусные или бактериальные инфекционные заболевания: СПИД, менингит, воспалительные заболевания, в особенности суставные заболевания: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулит, болезнь Крона, синдром раздраженного кишечника,остеопороз,глазные болезни: глазная гипертензия, глаукома,легочные болезни: заболевания дыхательных путей, бронхоспазмы, кашель, астма, хронический бронхит, хроническая обструкция дыхательных путей, эмфизема,- 28009468 желудочно-кишечные заболевания: синдром раздраженного кишечника, воспалительные расстройства кишечника, язвы, диаррея,недержание мочи и воспаление мочевого пузыря. Применение соединений согласно изобретению в форме основания или соли присоединения фармацевтически приемлемой кислоты, гидрата либо сольвата для изготовления лекарства для лечения упомянутых выше патологий составляет неотъемлемую часть данного изобретения. Объектом изобретения также являются лекарства, содержащие соединение формулы (I) или его соль присоединения кислоты либо, альтернативно, фармацевтически приемлемый гидрат или сольват соединения формулы (1). Эти лекарства находят свое терапевтическое применение в особенности в лечении упомянутых выше патологий. Согласно следующему из своих аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим В качестве активного начала по меньшей мере одно соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу соединения согласно изобретению или соли присоединения фармацевтически приемлемой кислоты, гидрата либо сольвата указанного соединения и возможно один или более чем один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают в соответствии с фармацевтической формой и желаемым способом введения из общепринятых эксципиентов, известных специалистам в данной области техники. В фармацевтических композициях по настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, местного, локального, интратекального, интраназального, трансдермального, легочного, глазного или ректального введения активное начало формулы(I), приведенной выше, или его возможная соль присоединения кислоты, сольват или гидрат могут быть введены в единичных формах введения в виде смеси со стандартными фармацевтическими эксципиентами человеку или животным для профилактики или лечения упомянутых выше расстройств или заболеваний. Подходящие единичные формы введения включают пероральные формы, такие как таблетки, мягкие или твердые гелевые капсулы, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные, трансбуккальные, интратрахельные, внутриглазные и интаназальные формы введения, формы для введения посредствои ингаляции, подкожно, внутримышечно или внутривенно вводимые формы и ректально или вагинально вводимые формы. Для местного введения соединения согласно изобретению могут быть использованы в кремах, мазях или лосьонах. В качестве примера единичная форма введения соединения согласно изобретению в форме таблетки может содержать следующие компоненты: Соединение согласно изобретению 50,0 мг Маннит 223,75 мг Кроскармелозы натриевая соль 6,0 мг Крахмал кукурузный 15,0 мг Гидроксипропилметилцеллюлоза 2,25 мг Магния стеарат 3,0 мг Указанные единичные формы вводят для обеспечения суточного введения от 0,01 до 20 мг активного начала на кг массы тела в зависимости от формы представления. Могут иметь место конкретные случаи, в которых необходимыми оказываются более высокие или более низкие дозы, и такие дозы также составляют часть данного изобретения. Согласно общепринятой практике доза, подходящая для каждого пациента, определяется врачом в соответствии со способом введения и массой и реакцией указанного пациента. Согласно следующему из своих аспектов изобретение также относится к способу лечения упомянутых выше патологий, который включает введение эффективной дозы соединения согласно изобретению,его соли присоединения фармацевтически приемлемой кислоты или сольвата либо гидрата указанного соединения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные пиперидинил- и пеперазинилалкилкарбаматов, соответствующие формуле (I) где А представляет собой атом азота или группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную, циано, трифторметильную, C1-6 алкильную или C1-6 алкоксигруппу;n представляет собой целое число, равное 2 или 3, и m представляет собой целое число, равное 2,- 29009468 когда А представляет собой атом азота;n представляет собой целое число, равное 1, 2 или 3, и m представляет собой целое число, равное 1 или 2, когда А представляет собой группу CR2; В представляет собой ковалентную связь или С 1-8 алкиленовую группу;R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, оксазолила, изоксазолила, тиазолила, изотиазолила, имидазолила, оксадиазолила,тиадиазолила, триазолила, нафтила, хинолила, тетрагидрохинолила, изохинолила, тетрагидроизохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, циннолила, имидазопиримидинила,тиенопиримидинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, индазолила, пирролопиридила, фуропиридила, дигидрофуропиридила, тиенопиридила, дигидротиенопиридила, имидазопиридила, пиразолопиридила, оксазолопиридила,изоксазолопиридила и тиазолопиридила; причем группа R1 возможно замещена одной или более группами R' и/или R";R' представляет собой атом галогена или группу циано, нитро, гидроксил, С 1-6 алкил, C1-6 алкокси, C1-6 тиоалкил, C1-6 фторалкил, C1-6 фторалкокси, С 1-6 фтортиоалкил, С 3-7 циклоалкил, С 3-7 циклоалкил-С 1-6 алкилен,азетидинил, пиперидил, пирролидинил, морфолинил, пиперазинил, азепинил, NH2, NHR6, NR6R7, NR6COR7,NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 или -О-(С 1-6 алкилен)-О-;R" представляет собой фенил, имидазолил, пиридил или пиримидинил; причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга;R3 представляет собой группу общей формулы CHR4CONHR5, в которой R4 представляет собой атом водорода или С 1-6 алкильную группу, иR5 представляет собой атом водорода или группу С 1-6 алкил, С 3-7 циклоалкил либо С 3-7 циклоалкилС 1-6 алкилен;R6 и R7 независимо друг от друга представляют собой С 1-6 алкильную группу; в форме основания, соли присоединения кислоты, гидрата или сольвата. 2. Соединение формулы (I) по п.1, отличающееся тем, что А представляет собой атом азота;n представляет собой целое число, равное 2 или 3, иm представляет собой целое число, равное 2; В представляет собой C1-8 алкиленовую группу;R1 представляет собой группу, выбранную из фенила, пиридила, пиримидинила, тиадиазолила и нафтила; причем группа R1 возможно замещена одной или более группами R' и/или R";R' представляет собой атом галогена или группу нитро либо C1-6 фторалкил;R" представляет собой фенил, возможно замещенный одной или более группами, которые могут быть одинаковыми или отличными друг от друга, выбранными из атома галогена или группы циано, C1-6 алкокси либо C1-6 фторалкокси;R3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода, иR5 представляет собой атом водорода или группу С 1-6 алкил, С 3-7 циклоалкил либо С 3-7 циклоалкил-С 1-6 алкилен; в форме основания, соли присоединения кислоты, гидрата или сольвата. 3. Соединение формулы (I) по п.1, отличающееся тем, что А представляет собой группу CR2, в которой R2 представляет собой атом водорода или фтора либо гидроксильную группу;m представляет собой целое число, равное 1 или 2, иn представляет собой целое число, равное 1 или 2; В представляет собой ковалентную связь или С 1-4 алкиленовую группу;R1 представляет собой группу, выбранную из фенила, пиридила, пиридазинила, пиримидинила, пиразинила, тиазолила, хинолила, изохинолила, фталазинила, хиназолинила, хиноксалинила, нафтиридинила, фуропиридила, тиенопиримидинила, имидазопиримидинила, бензотиазолила, бензимидазолила и бензоксазолила; причем группа R1 возможно замещена одной или более группами R' и/или R";R' представляет собой атом галогена, или группу циано или C1-6 алкил, C1-6 алкокси, С 1-6 фторалкил,C1-6 фторалкокси, С 3-7 циклоалкил, пирролидинил, NH2, NR6R7 или COR6;R" представляет собой фенил, имидазолил или пиридил; причем группа(ы) R" возможно замещена(ы) одной или более группами R', которые могут быть одинаковыми или отличными друг от друга, более конкретно одним или более чем одним атомом хлора или фтора;R3 представляет собой группу общей формулы CHR4CONHR5, в которойR4 представляет собой атом водорода или С 1-6 алкильную группу, и
МПК / Метки
МПК: A61K 31/436, C07D 295/12, A61K 31/495, C07D 471/04, A61K 31/506, C07D 401/04, C07D 491/04, A61K 31/44, C07D 401/14, C07D 495/04, A61K 31/435
Метки: пиперидинил, пиперазинил, алкилкарбаматов, терапии, применение, получения, способы, производные
Код ссылки
<a href="https://eas.patents.su/30-9468-proizvodnye-piperidinil-i-piperazinil-alkilkarbamatov-sposoby-ih-polucheniya-i-primenenie-ih-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперидинил- и пиперазинил- алкилкарбаматов, способы их получения и применение их в терапии</a>
Предыдущий патент: Композиция для получения геля повышенной прочности
Следующий патент: Производные фталазинона
Случайный патент: Способ и устройство для изготовления труб из стали












