Производные 4-(3-трифторметилпиридин-5-ил)пиперазина, фармацевтическая композиция, способы их получения и применение.
Формула / Реферат
1. Соединение формулы (I)

где R1 выбран из Н, C1-4-алкила, 2-гидроксиэтила, 2-цианоэтила, тетрагидропиран-2-ила и азотозащитной группы;
R2 и R3 каждый независимо представляет Н или СН3;
R4 выбран из O-R5, NH-R5 или S-R5, где
R5 выбран из арила, арил-С1-6-алкила, арилокси-С2-6-алкила, гетероарила, гетероарил-С1-6-алкила, гетероарилокси-С2-6-алкила, С3-6-циклоалкила, С3-6-циклоалкил-С1-4-алкила, C1-6-алкила, 2-тетрагидрофурила, 3-тетрагидрофурила, 2-тетрагидрофурфурила, 3-тетрагидрофурфурила, пиперидин-4-ила, тетрагидропиран-4-ила, С3-6-алкинила, С3-6-алкенила или фтор-С2-4-алкила;
и где любой арильный или гетероарильный остаток, сам по себе или как часть другой группы, может быть незамещен или замещен одним или более C1-4-алкилом, C1-4-алкокси, C1-4-алкилтио, С2-4-ацилом, C1-4-алкилсульфонилом, циано, нитро, гидрокси, С2-6-алкенилом, С2-6-алкинилом, фторметилом, трифторметилом, трифторметокси, галогеном, -N(R6)(R7), арилом, арилокси, арилтио, арил-С1-4-алкилом, арил-С2-4-алкенилом, арил-С2-4-алкинилом, гетероарилом, гетероарилокси, гетероарилтио, гетероарил-С1-4-алкилом, арил-С1-4-алкокси, арилокси-С1-4-алкилом или диметиламино-С2-4-алкокси, где
R6 и R7 независимо друг от друга представляют собой водород, метил или этил; или вместе с атомом азота, с которым они соединены, образуют пирролидиновый, пиперазиновый, морфолиновый, тиоморфолиновый или пиперидиновый цикл;
и где любой арильный или гетероарильный остаток в качестве заместителей арильных или гетероарильных остатков, в свою очередь, сам по себе или как часть другой группы, может быть замещен в одном или более положениях, предпочтительно одном, независимо друг от друга C1-4-алкилом, C1-4-алкокси, галогеном, трифторметилом, циано, гидрокси или диметиламино;
и его фармацевтически приемлемые соли, гидраты, сольваты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы.
2. Соединение по п.1, где R1 представляет собой водород.
3. Соединение по любому из пп.1, 2, где R4 выбран из O-R5 и S-R5.
4. Соединение по любому из пп.1-3, где R5 выбран из арил-С1-6-алкила, арилокси-С2-6-алкила, гетероарил-С1-6-алкила, гетероарилокси-С2-6-алкила, С3-6-циклоалкила, С3-6-циклоалкил-С1-4-алкила, C1-6-алкила, 2-тетрагидрофурфурила, и где любой арильный или гетероарильный остаток, сам по себе или как часть другой группы, может быть незамещен или замещен одним или более С1-4-алкилом, C1-4-алкокси, циано, галогеном или арилокси-С1-4-алкилом.
5. Соединение по любому из пп.1-4, где R5 выбран из бензила, 2-хлорбензила, 3-цианобензила, 2-циклогексилэтила, циклопентила, 2-циклопентилэтила, 2,3-дифторбензила, 2,6-дифторбензила, 2-(2,6-дифторфенокси)этила, 2,3-дигидробензо[1,4]диоксин-6-илметила, этила, 5-фтор-2-метоксибензила, фуран-2-илметила, метила, a -метилбензила, 3-метилбензила, 2-(нафталин-2-илокси)этила, 2-феноксиэтила, 2-феноксиметилбензила, н-пропила, 3-(пиридин-3-ил)-н-пропила, 2-(8-хинолинилокси)этила, тетрагидрофуран-2-илметила или 3-тиенилметила.
6. Соединение по любому из пп.1-5, где R1, R2 и R3 представляют собой водород.
7. Соединение по любому из пп.1-6, где атом углерода, с которым соединен R2, имеет (S)-конфигурацию, если R2 представляет собой метил, и оба R1 и R3 представляют собой водород.
8. Соединение по любому из пп.1-6, где атом углерода, с которым соединен R3, имеет (R)-конфигурацию, если R3 представляет собой метил, и оба R1 и R2 представляют собой водород.
9. Соединение по любому из пп.1-6, где соединение выбрано из
ацетата 1-[6-(2-феноксиэтокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-[6-(2,3-дигидробензо[1,4]диоксин-6-илметокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-[6-(тиофен-3-илметокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 3-(6-пиперазин-1-ил-3-трифторметилпиридин-2-илоксиметил)бензонитрила;
ацетата 1-[6-(3-метилбензилсульфанил)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-[6-(2,3-дифторбензилокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)пиперазина;
ацетата 1-(6-пропокси-5-трифторметилпиридин-2-ил)пиперазина;
ацетата 1-(6-циклопентилокси-5-трифторметилпиридин-2-ил)пиперазина;
ацетата 1-[6-(1-фенилэтокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 8-[2-(6-пиперазин-1-ил-3-трифторметилпиридин-2-илокси)этокси]хинолина;
ацетата 1-[6-(2,6-дифторбензилокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-[6-(3-{пиридин-3-ил}пропокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-(6-бензилокси-5-трифторметилпиридин-2-ил)пиперазина;
ацетата 1-[6-(фуран-2-илметокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-{6-[2-(2,6-дифторфенокси)этокси]-5-трифторметилпиридин-2-ил}пиперазина;
ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-2-(R)-метилпиперазина;
ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазина;
ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазина;
ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазина;
ацетата 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазина;
ацетата 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазина;
1-(6-бензилокси-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазина;
1-(6-бензилокси-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазина;
ацетата 1-(6-метокси-5-трифторметилпиридин-2-ил)пиперазина;
ацетата 1-[6-(5-фтор-2-метоксибензилокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-{6-[2-(нафталин-2-илокси)этокси]-5-трифторметилпиридин-2-ил}пиперазина;
ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-3-(S)-метилпиперазина;
ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-2-(S)-метилпиперазина;
ацетата 1-[6-(2-феноксиметилбензилокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-[6-(тетрагидрофуран-2-илметокси)-5-трифторметилпиридин-2-ил]пиперазина;
ацетата 1-[6-(2-циклопентилэтокси)-5-трифторметилпиридин-2-ил]пиперазина; или
ацетата 1-[6-(2-циклогексилэтокси)-5-трифторметилпиридин-2-ил]пиперазина.
10. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-9 и фармацевтически приемлемый носитель.
11. Способ профилактики или лечения серотонинсвязанного расстройства или состояния субъекта, нуждающегося в такой профилактике или лечении, включающий введение субъекту эффективного количества соединения по любому из пп.1-9.
12. Способ по п.11, где серотонинсвязанное расстройство или состояние представляет собой расстройство или состояние, связанное с 5-НТ2c-рецептором.
13. Способ по п.12, где расстройство или состояние, связанное с 5-НТ2с-рецептором, выбрано из расстройств памяти; болезни Альцгеймера; шизофрении; расстройств настроения; расстройств, связанных с тревожными состояниями; боли; злоупотребления веществами; половой дисфункции; эпилепсии; глаукомы; недержания мочи; менопаузальных и постменопаузальных приливют; диабета II типа; пищевых расстройств; пищевых расстройств, связанных с потреблением спиртного в большом количестве; нервной анорексии; булимии; или прибавления в весе, связанного с введением антипсихотропного лекарственного средства.
14. Способ по п.12, где расстройство или состояние, связанное с 5-НТ2с-рецептором представляет собой ожирение.
15. Способ по любому из пп.11-14, где субъект является человеком.
16. Способ по любому из пп.11-14, где субъект является животным.
17. Способ модулирования активности 5-НТ2с-рецептора у субъекта, нуждающегося в таком модулировании, включающий введение субъекту эффективного количества соединения по любому из пп.1-9.
18. Способ по п.17, где субъект является человеком.
19. Способ по п.17, где субъект является животным.
20. Применение соединения по любому из пп.1-9 для получения лекарственного средства для профилактики или лечения серотонинсвязанного расстройства или состояния.
21. Применение по п.20, где серотонинсвязанное расстройство или состояние связано с 5-НТ2с-рецептором.
22. Применение по п.21, где расстройство или состояние, связанное с 5-НТ2с-рецептором, выбрано из расстройств памяти; болезни Альцгеймера; шизофрении; расстройств настроения; расстройств, связанных с тревожными состояниями; боли; злоупотребления веществами; половой дисфункции; эпилепсии; глаукомы; недержания мочи; менопаузальных и постменопаузальных приливов; диабета II типа; пищевых расстройств; пищевых расстройств, связанных с потреблением спиртного в большом количестве; нервной анорексии; булимии; или прибавления в весе, связанного с введением антипсихотропного лекарственного средства.
23. Применение по п.21, где расстройство или состояние, связанное с 5-НТ2c-рецептором, представляет собой ожирение.
24. Способ получения фармацевтической композиции, включающий смешение соединения по любому из пп.1-9 с фармацевтически приемлемым носителем.
25. Способ получения соединения по любому из пп.1-9 путем взаимодействия соединения формулы (II)
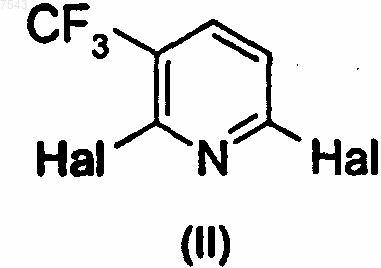
где Hal представляет собой галоген;
с соответствующим производным пиперазина формулы (III)
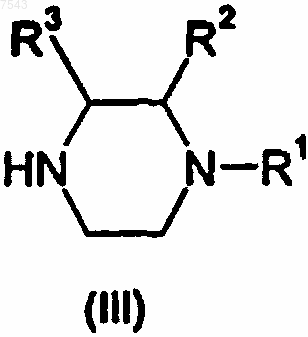
где R1 представляет собой Н или C1-4-алкил, 2-гидроксиэтил, 2-цианоэтил, тетрагидропиран-2-ил или азотозащитную группу; и
R2 и R3 каждый независимо представляет собой Н или СН3; с получением соединения формулы (IV)
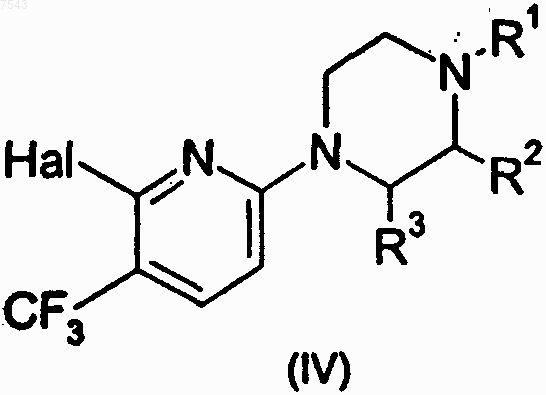
где
R1, R2 и R3 имеют значения, указанные в формуле (III); и
Hal представляет собой галоген,
и соединение формулы (IV) подвергается взаимодействию с соответствующим спиртом, амином или тиолом, обозначаемым как O-R5, NH-R5 или S-R5.
Текст
007543 Данная заявка имеет приоритет заявки Швеции 0201544-4, поданной 17 мая 2002 г., и заявки на патент США 60/410038, поданной 12 сентября 2002 г., содержание которых включено в данное описание путем ссылок. Настоящее изобретение относится к новым соединениям, фармацевтическим композициям, содержащих такие соединения, к способам их получения, а также к применению соединений для получения лекарственного средства, которое, в частности, действует на центральную нервную систему. Многочисленные расстройства и состояния центральной нервной системы находятся под влиянием адренергической, допаминергической и серотонинергической нейротрансмиттерных систем. Например,серотонин (5-НТ; 5-гидрокситриптамин) участвует в ряде расстройств и состояний центральной нервной системы. В ряде фармакологических и генетических экспериментов с участием рецепторов серотонина,показано, что в регуляции всасывания пищи активно участвует подтип 5-НТ 2c-рецептора, см., например,публикации Obes.Res. 1995, 3, Suppl.4, 449S-462S и Drugs Future 2001, 26, 383-393. Подтип 5-НТ 2 срецептора транскрибируется и экспрессируется в гипоталамических структурах, связанных с регуляцией аппетита. Было показано, что м-хлорфенилпиперазин (mCPP), агонист 5-НТ 2c-рецептора, который имеет некоторое преимущество в отношении связывания 5-НТ 2c-рецептора, понижает всасывание пищи у мышей, которые экспрессируют нормальный 5-НТ 2c-рецептор, тогда как указанное соединение проявляет недостаточную активность у мышей, экспрессирующих мутированную неактивную форму 5-НТ 2cрецептора (Nature 1995, 374, 542-546). В недавнем клиническом исследовании после 2-недельного лечения субъекта, страдающего ожирением, соединением mCPP (Psychopharmacology 1997, 133, 309-312) было получено небольшое, но постоянное снижение веса тела. В настоящее время ряд производных пирроло[3,2,1-ij]хинолина был идентифицирован в качестве агонистов 5-НТ 2 с-рецептора, имеющих большую селективность по сравнению с селективностью в отношении 5-НТ 2 а-рецептора (Isaac М. и др.,Bioorg.Med.Chem.Lett. 2000, 10, 919-921). Указанные соединения предлагаются для нового подхода к лечению ожирения и эпилепсии. Снижение веса также наблюдали при клинических исследованиях других серотонинергических средств (см., например, IDrugs 1998, 1, 456-470). Например, ингибитор обратного захвата 5-НТ флуоксетин и средство, способствующее высвобождению 5-НТ/ингибитор обратного захвата дексфенфлурамин,ингибировали снижение веса в контрольных экспериментах. Однако существующие в настоящее время лекарственные средства, которые усиливают серотонинергическую трансмиссию, имеют, по-видимому,только умеренное и в некоторых случаях преходящее влияние на вес тела. Также предполагается, что подтип 5-НТ 2 с-рецептора участвует в расстройствах ЦНС, таких как депрессия и тревожные состояния (Exp.Opin.Invest. Drugs 1998, 7, 1587- 1599; IDrugs, 1999, 2, 109-120). Кроме того, предполагается, что подтип 5-НТ 2 с-рецептора участвует в расстройствах мочеиспускания, таких как недержание мочи (IDrugs 1999, 2, 109-120). Следовательно, соединения, которые действуют на 5-НТ 2 с-рецептор, могут находить терапевтическое применение при лечении расстройств, подобных вышеупомянутым. Описание литературных данных В заявке US-A-3253989 описано применение mСРР в качестве анорексигенного средства. В заявке ЕР-А 1-863136 описаны производные азетидина и пирролидина, которые являются селективными агонистами 5-НТ 2 с-рецептора, обладающими антидепрессантной активностью, и которые можно применять для лечения или профилактики серотонин-связанных заболеваний, включая пищевые расстройства и тревожные состояния. В заявке ЕР-А-657426 описаны трициклические производные пиррола, проявляющие активность в отношении 5-НТ 2 с-рецептора, которые, в числе прочего, могут применяться для лечения пищевых расстройств. В заявке ЕР-А-655440 описаны 1-аминоэтилиндолы, проявляющие активность в отношении 5-НТ 2 срецептора, которые могут применяться для лечения пищевых расстройств. В заявке ЕР-А-572863 описаны пиразиноиндолы, проявляющие активность в отношении 5-НТ 2cрецептора, которые могут применяться для лечения пищевых расстройств. В публикациях J.Med.Chem. 1978, 21, 536-542 и US-A-4081542 описан ряд пиперазинилпиразинов,обладающих центральной серотониноподобной активностью. В патенте США 4078063 описан ряд пиперазинилпиридинов, обладающих анорексигенным действием. В публикации J.Med.Chem. 1981, 24, 93-101 описан ряд пиперазинилхиноксалинов с центральной серотониноподобной активностью. В публикации ES 514549 описано производное пиперазина с анорексигенным действием. В патенте ЕР 370560 описаны 1-[моно- или бис(трифторметил)-2-пиридинил]пиперазины в качестве средств для центральной нервной системы. В заявке WO 98/33504 описано новое медицинское применение 1-[6-хлор-5-(трифторметил)-2 пиридинил]пиперазина, в частности, для нового способа лечения недержания мочи. В заявке WO 02/30902 описаны кристаллические формы хлоргидрата 1-[6-хлор-5-(трифторметил)-2 пиридинил]пиперазина. В патенте ЕР 1213017 описано применение агониста 5-НТ 2 с-рецептора, например 1-[6-хлор-5-1 007543(трифторметил)-2-пиридинил]пиперазина, для лечения приливов. В публикации J.Med.Chem. 1987, 30, 1210-1214 в качестве противосудорожных средств описаныN,N-дизамещенные-6-алкокси-2-пиридинамины, включая 1-(6-метокси-2-пиридинил)пиперазин, 1-(6 этокси-2-пиридинил)пиперазин,1-(6-изопропокси-2-пиридинил)пиперазин,1-(6-изобутокси-2 пиридинил)пиперазин, 1-(6-циклопропилметокси-2-пиридинил)пиперазин, 1-(6-циклогексилметокси-2 пиридинил)пиперазин и 1-(6-циклогексилокси-2-пиридинил)пиперазин. В публикации J.Med.Chem. 1989, 32, 1237-1242 в качестве противосудорожных средств описаны 6 алкил-N,N-дизамещенные-2-пиридинамины, включая 1-(6-бутилтио-2-пиридинил)пиперазин, 1-(6 циклогексилметил-2-пиридинил)пиперазин и 1-[6-(2-фенилэтил)-2-пиридинил]пиперазин. В патенте JP 07300474 описаны лекарственные средства для лечения заболеваний, связанных с серотонинергическим нервом, включая 1-(6-фенокси-2-пиридинил)пиперазин и 1-[6-(замещенные)фенокси-2-пиридинил]пиперазины, 1-(6-бензилокси-2-пиридинил)пиперазин, 1-(6-циклобутилокси 2-пиридинил)пиперазин и 1-(6-циклопентилокси-2-пиридинил)пиперазин. В патенте ЕР 580465 в качестве агонистов 5-НТ 3 описаны гетероциклические пиперазины, включая 6-хлор-2-(3-метилпиперазинил)пиридин и 6-хлор-2-(4-метилпиперазинил)пиридин. В заявке WO 00/12475 в качестве лигандов 5-НТ 2b- и/или 5-НТ 2 с-рецептора описаны производные индолина, главным образом для лечения ожирения. В заявке WO 00/12510 в качестве агонистов 5-НТ 2 с-рецептора описаны пирролоиндолы, пиридоиндолы и азепиноиндолы, в частности, для лечения ожирения. В заявке WO 00/12482 в качестве селективных лигандов 5-НТ 2 с-рецептора прямого действия, предпочтительно агонистов 5-НТ 2 с-рецептора, описаны производные индазола, в частности, для применения в качестве средств против ожирения. В заявке WO 00/12502 описаны пирролохинолины в качестве агонистов 5-НТ 2 с-рецептора, в частности, для применения в качестве средств против ожирения. В заявке WO 00/35922 в качестве агонистов 5 НТ 2 с описаны 2,3,4,4 а-тетрагидро-1H-пиразино[1,2 а]хиноксалин-5(6H)оны, которые можно применять для лечения ожирения. В заявке WO 00/44737 в качестве агонистов 5-НТ 2c описаны аминоалкилбензофураны, которые можно применять для лечения ожирения. Кроме того, сообщалось, что соединения, являющиеся агонистами 5 НТ 2 с-рецептора, представляют собой, например, индазолилпропиламины описанного в заявке WO 00/12481 типа; индазолы описанного в заявке WO 00/17170 типа; пиперазинилпиразины описанного в заявках WO 00/76984; WO 02/40456 иWO 02/40457 типа; -карболины с конденсированными гетероциклами описанного в заявках WO 00/77001, WO 00/77002 и WO 00/77010 типа; бензофурилпиперазины описанного в заявках WO 01/09111 и WO 01/09123 типа; бензофураны описанного в заявке WO 01/09122 типа; бензотиофены описанного в заявке WO 01/09126 типа; аминоалкилиндазолы описанного в заявке WO 98/30548 типа; индолы описанного в заявке WO 01/12603 типа; индолины описанного в заявках WO 01/12602 и WO 02/44152 типа; пиразино(аза)индолы описанного в заявке WO 00/44753 типа; диазациклопента[а]индены описанного в патенте ЕР 1132389 типа; производные пиперазина описанного в заявках WO 02/10169; WO 02/72584 и WO 02/48124 типа; хиноксалиноны описанного в патенте США 6372745 типа и трициклические пирролы или пиразолы описанного в заявке WO 98/56768 типа. В заявке WO 95/01976 описаны производные индолина с активностью в качестве антагонистов 5 НТ 2 с и возможностью применения для лечения расстройств ЦНС. В заявке WO 99/58490 описаны арилгидронафталиналканамины, которые могут частично или полностью блокировать серотонинергические 5-НТ 2 с-рецепторы в организме. В заявке WO 03/00666 описаны [1,2']бипиразинильные лиганды 5-НТ 2-рецептора, в частности лиганды 5-НТ 2 с-рецептора, для лечения половой дисфункции. В заявке WO 03/00663 описаны пиперазинилпиримидины в качестве лигандов 5-НТ 2-рецептора, в частности лигандов 5-НТ 2 с-рецептора, для лечения половых расстройств. В заявке WO 02/51844 описаны циклоалкильные конденсированные производные индола и их применение в качестве лигандов 5-НТ 2b- и 5-НТ 2c-рецепторов. В заявке WO 02/42304 в качестве селективных агонистов 5-НТ 2 с-рецептора описаны циклопента[b][1,4]диазепино[6,7-hi]индолы. В заявке WO 02/36596 в качестве агонистов серотонина 5-НТ 2 с описаны диазепинокарбазолы и родственные соединения. Краткое описание изобретения Новые соединения согласно изобретению описываются формулой (I):R1 выбран из Н, C1-4-алкила, 2-гидроксиэтила, 2-цианоэтила, тетрагидропиран-2-ила и азотозащитной группы; каждый из R2 и R3 независимо представляет собой Н или СН 3;R5 выбран из арила, арил-С 1-6-алкила, арилокси-С 2-6-алкила, гетероарила, гетероарил-С 1-6-алкила,гетероарилокси-С 2-6-алкила, С 3-6-циклоалкила, С 3-6-циклоалкил-С 1-4-алкила, С 1-6-алкила, 2-тетрагидрофурила, 3-тетрагидрофурила, 2-тетрагидрофурфурила, 3-тетрагидрофурфурила, пиперидин-4-ила,тетрагидропиран-4-ила, С 3-6-алкинила, С 3-6-алкенила или фтор-С 2-4-алкила; и где любой арильный или гетероарильный остаток, сам по себе или как часть другой группы, может быть незамещен или замещен одним или более C1-4-алкилом, C1-4-алкокси, C1-4-алкилтио, С 2-4-ацилом, C1-4 алкилсульфонилом, циано, нитро, гидрокси, С 2-6-алкенилом, С 2-6-алкинилом, фторметилом, трифторметилом,трифторметокси, галогеном, -N(R6)(R7), арилом, арилокси, арилтио, арил-С 1-4-алкилом, арил-С 2-4-алкенилом,арил-С 2-4-алкинилом, гетероарилом, гетероарилокси, гетероарилтио, гетероарил-С 1-4-алкилом, арил-С 1-4 алкокси, арилокси-С 1-4-алкилом или диметиламино-С 2-4-алкокси, гдеR6 и R7 независимо друг от друга представляют собой водород, метил или этил; или вместе с атомом азота, к которому они присоединены, образуют пирролидиновый, пиперазиновый, морфолиновый,тиоморфолиновый или пиперидиновый цикл; и где любой арильный или гетероарильный остаток в качестве заместителей арильных или гетероарильных групп, сам по себе или как часть другой группы, в свою очередь может быть замещен в одном или более положениях, предпочтительно в одном, независимо друг от друга C1-4-алкилом, C1-4-алкокси,галогеном, трифторметилом, циано, гидрокси или диметиламино; и их фармацевтически приемлемые соли, гидраты, сольваты, геометрические изомеры, таутомеры,оптические изомеры, N-оксиды и пролекарственные формы, при условии, что, когда R4 представляет собой галоген по меньшей мере один из R1, R2 или R3 не является водородом. Если R4 представляет собой галоген, предпочтительным является любой из двух вариантов:(ii) R1 выбран из Н, C1-4-алкила, 2-гидроксиэтила, 2-цианоэтила, тетрагидропиран-2-ила и азотозащитной группы; и по меньшей мере один из R2 и R3 представляет собой СН 3; В случае если соединения формулы (I) существуют в форме оптических изомеров, изобретение включает рацемическую смесь, а также индивидуальные энантиомеры, как таковые. В случае если соединения формулы (I) содержат группы, которые могут находиться в таутомерных формах, изобретение включает таутомерные формы соединений, а также их смеси. В случае если соединения формулы (I) существуют в форме геометрических изомеров, изобретение включает геометрические изомеры, а также их смеси. Согласно другому аспекту изобретение относится к применению соединений приведенной выше формулы (I) для терапевтических целей. Кроме того, изобретение относится к фармацевтической композиции, содержащей соединение приведенной выше формулы (I) в качестве активного ингредиента, предпочтительно вместе с фармацевтически приемлемым носителем и, если требуется, другими фармакологически активными средствами. Согласно еще одному аспекту изобретение относится к способу профилактики или лечения серотонинсвязанного расстройства или состояния у субъекта, который нуждается в такой профилактике или лечении, к способу, включающему введение субъекту эффективного количества соединения формулы (I). Предпочтительно серотонин-связанное расстройство или состояние представляет собой расстройство или состояние, связанное с 5-НТ 2 с-рецептором, главным образом, расстройство памяти; болезнь Альцгеймера; шизофрению; расстройства настроения; расстройства, связанные с тревожными состояниями; боль; злоупотребление веществами; половую дисфункцию; эпилепсию; глаукому; недержание мочи; менопаузальные и постменопаузальные приливы; диабет II типа; пищевые расстройства; пищевые расстройства, связанные с потреблением спиртного в большом количестве; нервную анорексию; булимию или прибавление в весе, связанное с введением антипсихотропного лекарственного средства; и наиболее предпочтительно представляет собой ожирение. Субъект предпочтительно является человеком или животным. Способ включает введение эффективного количества соединения формулы (I) или композиции, содержащей соединение формулы (I).-3 007543 Другой аспект изобретения относится к применению соединений формулы (I) для получения лекарственного средства для профилактики или лечения серотонин-связанного расстройства или состояния. Предпочтительно серотонин-связанное расстройство или состояние представляет собой расстройство или состояние, связанное с 5-НТ 2 с-рецептором, главным образом, расстройства памяти; болезнь Альцгеймера; шизофрению; расстройства настроения; расстройства, связанные с тревожными состояниями; боль; злоупотребление веществами; половую дисфункцию; эпилепсию; глаукому; недержание мочи; менопаузальные и постменопаузальные приливы; диабет II типа; пищевые расстройства; пищевые расстройства, связанные с потреблением спиртного в большом количестве; нервную анорексию; булимию или прибавление в весе, связанное с введением антипсихотропного лекарственного средства; и наиболее предпочтительно представляет собой ожирение. В конечном итоге аспектом изобретения является способ модулирования функции 5 НТ 2 с-рецептора. Описанные способы могут также включать стадию идентифицирования нуждается ли субъект в лечении серотонинсвязанного расстройства или состояния субъекта, в частности, связанного с 5-НТ 2 срецептором. Подробное описание изобретения Согласно изобретению обнаружен класс новых соединений, которые соединяются с 5-НТ 2 срецептором. Соединения могут действовать в качестве агонистов рецептора или антагонистов 5-НТ 2 срецептора и, следовательно, могут применяться для лечения серотонин-связанных расстройств или состояний, в частности, связанных с 5-НТ 2 с-рецептором. Следует пояснить различные термины, используемые в приведенном выше описании соединений общей формулы (I), как по отдельности, так и в сочетаниях. Выражение C1-6-алкил относится к алкильным группам с прямой и разветвленной цепью, содержащим от 1 до б атомов углерода. В частности, C1-6-алкильные группы представляют собой метил, этил,н-пропил, изопропил, трет-бутил, н-пентил, изопентил, н-гексил и изогексил. Производные понятия, такие как C1-4-алкокси и C1-4-алкилтио имеют соответствующую структуру. Используемое выражение С 2-6-алкенил относится к алкенильным группам с прямой и разветвленной цепью, содержащим от 2 до 6 атомов углерода. Типичные примеры включают винильную, аллильную, 3,3-диметилаллильную, 1-бутенильную и 2-бутенильную группы. Используемое выражение С 2-6-алкинил относится к алкинильным группам с прямой и разветвленной цепью, содержащим от 2 до 6 атомов углерода. Типичные примеры включают этинильные и пропаргильные группы. Под гетероатомом подразумеваются атомы азота, кислорода, серы в гетероциклических кольцах(включая гетероароматические, а также насыщенные и частично насыщенные гетероциклические кольца), а также атом селена. Термин арил относится к ароматическим циклам (моноциклическим или бициклическим) , содержащим от 6 до 10 атомов углерода в цикле, таким как фенил, 1-нафтил, 2-нафтил, 1,2,3,4 тетрагидронафтил и инданил. Арильная группа может быть химическим путем связана с остальной частью молекулы через атом углерода в любом цикле. Термин гетероарил означает моно- или бициклическую ароматическую кольцевую систему, в которой ароматическим может быть только одно кольцо, и которая может быть химическим путем связана с остальной частью молекулы через атом углерода или азота в любом кольце, и которая содержит от 5 до 10 кольцевых атомов (моно- или бициклическая), в которой один или более кольцевых атомов представляют собой гетероатомы, такие как атомы азота, серы, кислорода и селена, а остальная часть атомов представляет собой атомы углерода. Примерами таких гетероарильных циклов являются пиррол, имидазол, тиофен, фуран, тиазол, изотиазол, тиадиазол, оксазол, изоксазол, оксадиазол, пиридин, пиразин, пиримидин, пиридазин, пиразол, триазол, тетразол, хроман, изохроман, кумарин, хинолин, хиноксалин,изохинолин, фталазин, циннолин, хиназолин, индол, изоиндол, индолин, изоиндолин, бензотиофен, бензофуран, 2,3-дигидробензофуран, изобензофуран, бензоксазол, 2,1,3-бензоксадиазол, бензотиазол, 2,1,3 бензотиадиазол, 2,1,3-бензоселенадиазол, бензимидазол, индазол, 2,3-дигидро-1,4-бензодиоксин, 1,3-бензодиоксол, 1,2,3,4-тетрагидрохинолин, 3,4-дигидро-2H-1,4-бензоксазин, 1,5-нафтиридин, 1,8-нафтиридин,3,4-дигидро-2H-пиридо[3,2-b]-1,4-оксазин и 2,3-дигидро-1,4-бензоксатиин. Если бициклическое арильное или гетероарильное кольцо замещено, то замещение может происходить в любом кольце. Например, арил-С 1-6-алкил, в котором алкильная часть группы может представлять собой алкил с прямой или разветвленной цепью, включает бензил, 2-нафтилметил, 2-фенилэтил, 3-фенил-1-пропил, 1 фенилэтил, 1-фенил-2-пропил, 2-фенил-1-пропил и т.п. Например, арилокси-С 2-6-алкил, в котором алкильная часть группы может представлять собой алкил с прямой или разветвленной цепью, включает 2-феноксиэтил, 2-(1-нафтилокси)этил, 3-(2-нафтилокси)-1 пропил, 3-фенокси-1-пропил, 4-фенокси-1-бутил, 5-фенокси-1-пентил, 1-фенокси-2-пропил и т.п. Например, С 3-6-циклоалкил-С 1-4-алкил, в котором алкильная часть группы может представлять собой алкил с прямой или разветвленной цепью, включает циклопропилметил, циклопентилметил, 2 циклогексилэтил, 1-циклогексилэтил, 1-циклопропилэтил, 1-циклобутилэтил и т.п. Например, гетероарилокси-С 2-6-алкил включает 2-(8-хинолинилокси)этил, 2-(3-пиридинилокси)-4 007543 этил, 3-(8-хинолинилокси)пропил и т.п. Галоген включает фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром. Когда выше утверждается, что арильные или гетероарильные остатки могут быть замещены (в одном или более положениях) , сказанное относится к арилу и гетероарилу как таковым, а также к любым комбинированным группам, содержащим арильные или гетероарильные остатки, таким как гетероарилокси-С 2-6-алкил, арил-С 1-6-алкил и т.д. Термин N-оксиды означает, что один или более атомов азота, присутствующих в соединении, находятся в форме N-оксида (NО). Термин пролекарственные формы означает фармакологически приемлемое производное, такое как карбамат или амид, которое в организме биологически преобразуется в активную лекарственную форму. Можно сослаться на публикацию Goodman и Gilman, The Pharmacological basis of Therapeutics, 8thed., McGraw-Hill, Int.Ed., 1992, Biotransformation of Drugs, стр.13-15. Фармацевтически приемлемая означает применимость для получения фармацевтической композиции, которая обязательно безопасна, нетоксична и приемлема как биологическим, так и иным образом,и включает применение для ветеринарии, а также фармакологическое применение для человека. Фармацевтически приемлемые соли означает соли, которые фармацевтически приемлемы, как указано выше, и которые обладают требуемой фармакологической активностью. Такие соли включают кислотно-аддитивные соли, образуемые с органическими и неорганическими кислотами, такими как хлористый водород, бромистый водород, йодистый водород, серная кислота, фосфорная кислота, уксусная кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, яблочная кислота, щавелевая кислота, толуолсульфокислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота, аскорбиновая кислота и т.п. Выражение содержащая означает включающая, но этим не ограничивающаяся. Следовательно,могут присутствовать и другие неупомянутые вещества, добавки или носители. Азотозащитная группа (а именно, в значении для R1) относится к группе, ковалентно соединенной с атомом азота, или с любой группой, применяемой для защиты (дериватизации) атома азота (например, атома азота в аминогруппе). Группу можно вводить или отщеплять традиционными способами,такими как способы, описанные в Protective Groups in Organic Synthesis, John WileySons, 1991. Примеры азотозащитных групп включают тритильную или т-бутоксикарбонильную группы и группы, описанные в Protective Groups in Organic Synthesis, John WileySons, 1991 и последующих ее изданиях. Предпочтительно R1 представляет собой водород. Также предпочтительно R4 выбран из хлора, O-R5 и S-R5. Также предпочтительно R5 выбран из арил-С 1-6-алкила, арилокси-С 2-6-алкила, гетероарил-С 1-6 алкила, гетероарилокси-С 2-6-алкила, С 3-6-циклоалкила, С 3-6-циклоалкил-С 1-4-алкила, С 1-6-алкила, 2 тетрагидрофурфурила, где любой арильный или гетероарильный остаток, сам по себе или как часть другой группы, может быть незамещен или замещен одним или более C1-4-алкилом, C1-4-алкокси, циано, галогеном или арилокси-С 1-4-алкилом. Более предпочтительно R5 выбран из бензила, 2-хлорбензила, 3-цианобензила, 2-циклогексилэтила,циклопентила, 2-циклопентилэтила, 2,3-дифторбензила, 2,6-дифторбензила, 2-(2,6-дифторфенокси)этила,2,3-дигидробензо[1,4]диоксин-6-илметила, этила, 5-фтор-2-метоксибензила, фуран-2-илметила, метила,-метилбензила, 3-метилбензила, 2-(нафталин-2-илокси)этила, 2-феноксиэтила, 2-феноксиметилбензила,н-пропила, 3-(пиридин-3-ил)-н-пропила, 2-(8-хинолинилокси)этила, тетрагидрофуран-2-илметила или 3 тиенилметила. Также предпочтительно, чтобы атом углерода, к которому присоединяется R2, имел (S)конфигурацию, если R2 представляет собой метил, а оба R1 и R3 представляют собой водород. Также предпочтительно, чтобы атом углерода, к которому присоединяется R3, имел (R)конфигурацию, если R3 представляет собой метил, а оба R1 и R2 представляют собой водород. Предпочтительными соединениями общей формулы (I), описанной выше, являются следующие соединения (соответствующие примерам 6-43, приведенным ниже): 1-(6-хлор-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазин 1-(6-хлор-5-трифторметилпиридин-2-ил)-3-R)-метилпиперазин 1-(6-хлор-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазин хлоргидрат 1-(6-хлор-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазина ацетат 1-[6-(2-феноксиэтокси)-5-трифторметилпиридин-2-ил]-пиперазина ацетат 1-[6-(2,3-дигидробензо[1,4]диоксин-6-илметокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-[6-(тиофен-3-илметокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 3-(6-пиперазин-1-ил-3-трифторметилпиридин-2-илоксиметил)бензонитрила ацетат 1-[6-(3-метилбензилсульфанил)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-[6-(2,3-дифторбензилокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)пиперазина-5 007543 ацетат 1-(6-пропокси-5-трифторметилпиридин-2-ил)пиперазина ацетат 1-(6-циклопентилокси-5-трифторметилпиридин-2-ил)пиперазина ацетат 1-[6-(1-фенилэтокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 8-[2-(6-пиперазин-1-ил-3-трифторметилпиридин-2-илокси)этокси]хинолина ацетат 1-[6-(2,6-дифторбензилокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-[6-(3-пиридин-3-илпропокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-(6-бензилокси-5-трифторметилпиридин-2-ил)пиперазина ацетат 1-[6-(фуран-2-илметокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-6-[2-(2,6-дифторфенокси)этокси]-5-трифторметилпиридин-2-илпиперазина ацетат 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-2-(R)-метилпиперазина ацетат 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазина ацетат 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазина ацетат 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазина ацетат 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазина ацетат 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазина ацетат 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазина ацетат 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазина ацетат 1-(6-метокси-5-трифторметилпиридин-2-ил)пиперазина ацетат 1-[6-(5-фтор-2-метоксибензилокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-6-[2-(нафталин-2-илокси)этокси]-5-трифторметилпиридин-2-илпиперазина; ацетат 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-3-(S)-метилпиперазина ацетат 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-2-(S)-метилпиперазина ацетат 1-[6-(2-феноксиметилбензилокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-[6-(тетрагидрофуран-2-илметокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-[6-(2-циклопентилэтокси)-5-трифторметилпиридин-2-ил]пиперазина ацетат 1-[6-(2-циклогексилэтокси)-5-трифторметилпиридин-2-ил]пиперазина и их фармакологически приемлемые соли и сольваты. Еще более предпочтительными являются соединения, соответствующие примерам 6, 8, 10-38 и 41-43. Как упоминалось выше, соединения согласно настоящему изобретению применимы для лечения,включая профилактическое лечение, серотонин-связанных расстройств и состояний, главным образом,связанных с 5-НТ 2 с-рецептором, у человека или у животного, включая, например, домашних животных,таких как расстройства памяти; болезнь Альцгеймера; шизофрения; расстройства настроения, включая,но этим не ограничиваясь, большую депрессию и биполярную депрессию, включая как легкое, так и маниакальное биполярное расстройство, сезонное эмоциональное нарушение (SAD); расстройства, связанные с тревожными состояниями, включая ситуационное тревожное состояние, генерализованное тревожное расстройство, первичные тревожные расстройства (расстройства панического типа, фобии, обсессивно-компульсивные расстройства и посттравматические стрессы), и вторичные тревожные расстройства(например, тревожное состояние, связанное со злоупотреблением веществами); боль; злоупотребление веществами; половая дисфункция; эпилепсия; глаукома; недержание мочи; менопаузальные и постменопаузальные приливы; диабет II типа; пищевые расстройства; пищевые расстройства, связанные с потреблением спиртного в большом количестве; нервная анорексия; булимия; или прибавление в весе, связанное с введением антипсихотропного лекарственного средства; и, в частности, ожирение. Соединения согласно настоящему изобретению в меченой радиоактивными изотопами форме можно применять в качестве диагностического средства. Способы получения Настоящее изобретение также относится к способу получения фармацевтической композиции, к способу, включающему объединение соединения формулы (I) с фармацевтически приемлемым носителем. Настоящее изобретение также относится к способам получения соединений любых приведенных в описании формул, включающим взаимодействие любого, одного или более соединений описанных формул, включая любые описанные способы. Согласно одному из аспектов изобретение относится к способу получения описанного соединения формулы (I). Соединения описанной выше общей формулы (I) можно получить тем или иным способом,аналогично традиционным способам, и главным образом, согласно или аналогично следующему способу. Соединения формулы (I), описанной выше, в которых R4 представляет собой галоген, О-R5, NH-R5 или S-R5, получают путем взаимодействия соединения структурной формулы (II): где Hal представляет собой галоген; с 1-10 молярными эквивалентами соответствующего производного пиперазина формулы (III): где значения R1, R2 и R3 указаны выше; в растворителе, таком как диметилсульфоксид (ДМСО),ацетонитрил, диоксан, тетрагидрофуран (ТТФ), н-бутанол, N,N-диметилформамид (DMF), или в смеси растворителей, такой как DMF/диоксан, необязательно в присутствии основания, такого как К 2 СО 3,Na2CO3, Cs2CO3, NaOH, триэтиламин, пиридин или т.п., при 0-200 С в течение 1-24 ч с получением соединения формулы (IV): где значения R1, R2 и R3 указаны выше и Hal представляет собой галоген. Соединение формулы (IV) подвергают взаимодействию с соответствующим спиртом, амином или тиолом, которые указаны выше как O-R5, NH-R5 или S-R5, или соответствующими им анионами с получением соединения описанной выше формулы (I). Соответствующий спирт, амин или тиол можно преобразовать полностью или частично до соответствующего ему аниона при обработке основаниями, такими как триэтиламин, 1,8 диазабицикло[5,4,0]ундец-7-ен, К 2 СО 3, NaOH, NaH, КО-т-Bu, диизопропиламид лития или т.п. Реакцию проводят в растворителе, таком как ДМСО, диоксан, ТГФ, трет-бутанол или DMF, при 0-200 С в течение 1-24 ч. Полученное соединение описанной выше формулы (I) можно преобразовать в другое соединение формулы (I) с помощью хорошо известных способов. Химические вещества, применяемые в описанных выше синтезах, могут включать, например, растворители, реагенты, катализаторы, реагенты для защиты группы и удаления защитной группы. Описанные выше способы могут также дополнительно включать стадии добавления или удаления подходящей защитной группы, либо до конкретно описанной стадии, либо после нее, для того, чтобы целенаправленно осуществить синтез соединений формулы (I). Если R1 представляет собой азотозащитную группу, как указано выше, последующее снятие защиты атома N проводят традиционными способами. Кроме того,чтобы выделить требуемые соединения, различные стадии синтеза можно проводить в альтернативной последовательности или порядке. Методики преобразований, известные в синтетической химии, и методики применения защитных групп (защита и снятие защиты), применяемые для синтеза подходящих соединений, известны в данной области и включают, например, методики, описанные в публикацияхReagents for Organic Synthesis, John Wiley и Sons (1994); и L.Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley и Sons (1995); и последующие ее издания. Описанный выше способ можно осуществить с выделением соединения согласно изобретению в форме свободного основания или в форме кислотно-аддитивной соли. Фармацевтически приемлемую кислотно-аддитивную соль можно получить путем растворения свободного основания в подходящем органическом растворителе и обработки раствора кислотой в соответствии с традиционными методиками получения кислотно-аддитивной соли из основных соединений. Примерами кислот, образующих аддитивные соли, является малеиновая кислота, фумаровая кислота, янтарная кислота, метансульфоновая кислота, уксусная кислота, яблочная кислота, щавелевая кислота, бензойная кислота, хлористоводородная кислота, серная кислота, фосфорная кислота и т.п. В соединениях формулы (I) может присутствовать один или более хиральных атомов углерода и,следовательно, соединения можно получить в форме оптических изомеров, например в виде чистого энантиомера, или в виде смеси энантиомеров (рацемическая смесь) или в виде смеси, содержащей диастереомеры. Разделение смесей оптических изомеров для получения чистых энантиомеров хорошо известно в данной области и может быть, например, достигнуто с помощью дробной кристаллизации соли с оптически активными (хиральными) кислотами или с помощью хроматографического разделения на колонках с хиральным наполнителем. Необходимые исходные материалы для получения соединений формулы (I) либо известны, либо могут быть получены аналогично получению известных соединений. Согласно изобретению соединения формулы (I) в форме свободных оснований или солей с физиологически приемлемыми кислотами можно перевести в подходящие галеновые препараты, такие как композиции для орального применения, для инъекций, для назального введения в виде спрея или т.п., в-7 007543 соответствии с общепринятыми фармацевтическими методиками. Такие фармацевтические композиции согласно изобретению содержат эффективное количество соединений формулы (I) в комбинации с совместимыми, фармацевтически приемлемыми носителями или разбавителями, хорошо известными в данной области. Носители могут представлять собой любой инертный материал, органический или неорганический, подходящий для энтерального введения, введения через кожу, подкожного или парентерального введения, такой как: вода, желатин, гуммиарабик, лактоза, микрокристаллическая целлюлоза, крахмал, крахмалгликолят натрия, гидрофосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и т.п. Такие композиции могут также содержать другие фармакологически активные средства и традиционные вспомогательные вещества, такие как стабилизаторы, увлажнители, эмульгаторы, корригенты, буферы и т.п. Композиции согласно изобретению можно, например, получать в твердой или жидкой форме для орального введения, такой как таблетки, пилюли, капсулы, порошки, сиропы, элексиры, гранулы для приготовления дисперсий, крахмальные облатки, суппозитории и т.п., в форме стерильных растворов,суспензий или эмульсий для парентерального введения, спреев, например, назального спрея, трансдермальных препаратов, например, пластырей и т.п. Как упомянуто выше, соединения согласно изобретению можно применять для лечения серотонинсвязанных, главным образом, связанных с 5-НТ 2 с-рецептором расстройств и состояний человека или животного, таких как расстройства памяти, включая болезнь Альцгеймера; шизофрения; расстройства настроения; расстройства, связанные с тревожными состояниями; боль; злоупотребление веществами; половая дисфункция; эпилепсия; глаукома; недержание мочи; менопаузальные и постменопаузальные приливы; диабет II типа; пищевые расстройства, такие как пищевые расстройства, связанные с потреблением спиртного в большом количестве, нервная анорексия и булимия; прибавление в весе, связанное с введением антипсихотропного лекарственного средства; и, в частности, ожирение. Также в объем настоящего изобретения включен способ модулирования (например, ингибирование или стимулирование) активности 5-НТ 2 с-рецептора. Способ включает введение субъекту, который нуждается в лечении, эффективного количества соединения формулы (I). Описанные здесь способы могут также включать стадию идентификации субъекта, нуждающегося в лечении серотонин-связанного, главным образом, связанного с 5-НТ 2 с-рецептором расстройства и состояния субъекта (например, животного, человека, лошади, собаки или кошки). Эффективное количество относится к количеству соединения, которое оказывает терапевтический эффект на субъект, подвергаемый лечению. Терапевтический эффект может быть объективным (то есть измеренным с помощью какого-то теста или маркера) или субъективным (то есть субъект высказывает признаки эффекта или ощущает эффект). При клиническом применении соединения согласно изобретению входят в состав фармацевтических композиций для орального, ректального, парентерального или других способов введения. Обычно количество активных соединений составляет в препарате 0,1-95 мас.%, предпочтительно 0,2-20 мас.% в препаратах для парентерального применения и предпочтительно 1-50 мас.% в препаратах для орального введения. Уровень дозировки и частота приема конкретного соединения будут различаться в зависимости от ряда факторов, включая потенциальные возможности конкретного применяемого соединения, метаболическую стабильность и продолжительность действия данного соединения, возраст пациента, вес тела,общее состояние здоровья, пол, питание, способ и время введения, скорость выведения из организма,сочетание лекарственных средств, серьезность состояния, которое должно подвергаться лечению, и переносимость терапии пациентом. Ежедневная дозировка может составлять, например, приблизительно от 0,001 до 100 мг на килограмм веса тела, при введении в однократных или в кратных дозах, например,приблизительно от 0,01 до 25 мг в каждой. Обычно такую дозу принимают орально, однако можно также выбрать парентеральное введение. Все процитированные в описании ссылки, находятся ли они в печатной или электронной форме,доступны ли для чтения на компьютерных носителях информации или в другой форме, прямо и полностью включены в описание путем ссылки, включая, однако, не ограничиваясь перечисленным, рефераты,статьи, журналы, публикации, тексты, монографии, веб-сайты в интернете, базы данных, патенты и публикации патентов. Далее изобретение иллюстририруется следующими примерами, которые, однако, предназначены для иллюстративных целей и не ограничивают объем изобретения. Примеры Экспериментальные методы 1 Н- и 13 С ЯМР-спектры получали на спектрометре Bruker DPX 400. Данные экспериментов поDPFGSE-NOE (ядерному эффекту Оверхаузера) получали на установке Varian INOVA 400. Время перемешивания составляло 0,8 с. Препаративную ЖХ проводили на хроматографе для препаративной жидкостной хроматографии LC-MS Gilson-Finnigan с колонкой 120 А, 50x20 мм S 5 мкм. Скорость потока составляла 30 мл/мин, применяли различные градиенты 0,1% уксусной кислоты в воде и ацетонитриле. Точные массы определяли на масс-спектрометре Micromass LCT с электрораспылительной ионизацией. Элементный анализ проводили на установке Vario EL. Для измерения температур плавления, которые не-8 007543 корректировались, применяли стенд Кофлера (Koefler bench). Примеры 1-5. Получение промежуточных соединений. Общие методики осуществления примеров 1-2 К суспензии LiAlH4 (1,2 г, 32 ммоль) в безводном ТГФ (5 мл) добавляют альдегид или карбоновую кислоту (10 ммоль) и перемешивают смеси при комнатной температуре в течение 2 ч. Смеси с альдегидами в качестве исходных материалов оставляют в резерве, а кислоты нагревают при 60 С в течение ночи. К каждой смеси добавляют последовательно воду (1,2 мл), 2 М водный раствор NaOH (1,2 мл) и воду(3,6 мл). Осадок отфильтровывают и растворитель удаляют при пониженном давлении, получая при этом целевые продукты в виде маслянистых веществ. Пример 1. (5-Фтор-2-метоксифенил)метанол. Целевое соединение получают, исходя из 5-фтор-2-метоксибензальдегида, в виде светло-красного маслянистого вещества (выход 94%). Фрагментирующий МС-анализ подтверждает установленную структуру. Степень чистоты 97% (ГХ). 1H ЯМР (CDC13)3,28 (с, 3 Н), 4,64 (с, 2 Н), 6,78 (м, 1 Н), 6,93 (м, 1 Н), 7,02 (м, 1 Н). 13 С ЯМР (CDCl3)55,73, 61,34, 110,83 (д, J=8,5 Гц), 114,22 (д, J=22,6 Гц), 115,26 (д, J=23,3 Гц),138,68 (д, J=6,4 Гц), 153,18 (д, J=2,1 Гц), 156,95 (д, J=238,8 Гц). Пример 2. (2-Феноксиметилфенил)метанол. Целевое соединение получают, исходя из 2-(феноксиметил)бензойной кислоты, в виде светложелтого маслянистого вещества (выход 96%). Фрагментирующий МС-анализ подтверждает установленную структуру. Степень чистоты 94% (ГХ). Ранее соединение описано в публикации J.Chem.Soc., 1954,2819-2826. Пример 3. 3-(S)-Метил-1-тритилпиперазин. К раствору 2-(S)-метилпиперазина (3,79 г, 37,9 ммоль) в СНСl3 (100 мл) добавляют тритилхлорид(10,56 г, 37,9 ммоль) в виде одной порции. Экзотермическую реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч, органическую фазу трижды промывают водой, сушат(MgSO4) и выпаривают растворитель при пониженном давлении, получая при этом 12,5 г (96%) бесцветной пены, которая отверждается до хрупкого состояния в течение ночи. 1 Н ЯМР (CDCl3)1,06 (д, J=5,5 Гц, 3 Н), 1,35 (м, 1 Н), 1,61 (м, 1 Н), 3,01 (м, 3 Н), 3,14 (м, 1 Н), 3,31 (м,1 Н), 7,08 (м, 3 Н), 7,16 (м, 6 Н), 7,35 (м, 6 Н). 13 С ЯМР (CDCl3)18,17, 44,46, 46,68, 51,59, 54,03, 126,26, 127,13, 127,68, 129,07. О рацемической смеси целевого соединения сообщалось в публикации Bioorg.Med.Chem.Lett. 2000,10, 2643-2646. Пример 4. 3-(R)-Метил-1-тритилпиперазин. Целевое соединение получают, как описано в заявке WO 00/76984, исходя из 2-(R)-метилпиперазина (5,51 г, 55,1 ммоль). При этом получают 18,8 г (99%) белого хрупкого вещества. Для C24H26N2 (M)+ вычислено HRMS m/z 342,2096, найдено 342,2110. Пример 5. 1-(6-Хлор-5-трифторметилпиридин-2-ил)пиперазин. Стадия 1. Сложный трет-бутиловый эфир 4-(6-хлор-5-трифторметилпиридин-2-ил)пиперазин-1-карбоновой кислоты. К суспензии трет-бутил-1-пиперазинкарбоксилата (27,0 г, 145 ммоль) и К 2 СО 3 (40,0 г, 290 ммоль) в ДМСО (200 мл) добавляют 2,6-дихлор-3-трифторметилпиридин (29,1 г, 135 ммоль) и толуол (50 мл). Сгущенный осадок перемешивают при 80 С в течение 2 ч с последующим добавлением толуола (0,5 л) и воды (1 л). Фазы разделяют и органическую фазу дважды промывают водой. Растворитель после сушки(MgSO4) органической фазы выпаривают при пониженном давлении. Твердый остаток перекристаллизовывают из смеси EtOAc/гептан, получая при этом белые кристаллы (37 г). Фильтрат после перекристаллизации концентрируют и остаток хроматографируют на колонке с силикагелем смесью гексан/EtOAc(90:10), получая при этом дополнительно 6,0 г продукта (общий выход 85%). Степень чистоты 99%(ВЭЖХ) ; т.пл. 125 С, Анализ C,H,N (C15H19ClF3N3O2). Стадия 2. 1-(6-Хлор-5-трифторметилпиридин-2-ил)пиперазин (ранее соединение описано в патенте ЕР 370560). Целевое соединение получают из продукта, полученного выше на стадии 1, применяя методику снятия защиты атома N, приведенную в примере 6, стадия 2. При этом получают 29,7 г (100%) светложелтого маслянистого вещества, которое кристаллизуется со временем (при выдерживании). Между метиленовыми протонами при атоме С-2 в пиперазиновом цикле и водородом при атоме С-3 в пиридиновом цикле наблюдался N0E (ядерный эффект Оверхаузера). Степень чистоты 99% (ВЭЖХ); т.пл.56 С. Фрагментирующий МС-анализ подтверждает установленную структуру. Для C10H11ClF3N3 (М)+ вычислено HRMS m/z 265,0594, найдено 265,0597. Пример 6. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазин. Стадия 1. Сложный трет-бутиловый эфир 4-(6-хлор-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазин-1-карбоновой кислоты. К суспензии 2-(S)-метилпиперазина (2,65 г, 26,5 ммоль) и К 2 СO3 (4,0 г, 2 9 ммоль) в безводном-9 007543 ДМСО (50 мл) медленно добавляют 2,6-дихлор-3-трифторметилпиридин (5,70 г, 26,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, фильтруют, разбавляют водой(примерно 1 л) и дважды экстрагируют EtOAc (100 мл). Из объединенных высушенных (MgSO4) органических фаз выпаривают при пониженном давлении растворитель, получая при этом желтое маслянистое вещество (7,4 г). Полученный материал растворяют в МеОН (100 мл), добавляют в виде одной порции ВОС-ангидрид (6,0 г, 27,5 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение 2 ч. Избыток ВОС-ангидрида гасят пиридином (3 мл) и выдерживают смесь при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении и полученное в результате маслянистое вещество хроматографируют на колонке с силикагелем (60x110 мм) смесью гексан/EtOAc(95:5, 1 л, затем последовательно 90:10, 1 л и 80:20). При упаривании очищенных фракций при пониженном давлении получают бесцветное маслянистое вещество (8,05 г, 80%), которое отверждается до белого твердого вещества в течение ночи. Степень чистоты 97% (ВЭЖХ); т.пл.86 С. Фрагментирующий МСанализ подтверждает установленную структуру. Для C16H21ClF3N3O2 (М)+ вычислено HRMS m/z 379,1274, найдено 379,1286. Стадия 2. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазин. Раствор сложного трет-бутилового эфира 4-(6-хлор-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазин-1-карбоновой кислоты (7,80 г, 26,4 ммоль) растворяют в смеси CH2Cl2/TFA (50:50; 30 мл) и перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении и полученное в результате маслянистое вещество распределяют между щелочной водой (NaOH) и СНСl3. Водную фазу экстрагируют один раз СНСl3, объединенные органические фазы сушат (MgSO4) и выпаривают растворитель при пониженном давлении, получая при этом 5,79 г (78%) светло-желтого,маслянистого вещества. Между метиленовыми протонами при атоме С-2 в пиперазиновом цикле и водородом при атоме С-3 в пиридиновом цикле наблюдался NOE. Степень чистоты 100% (ВЭЖХ). Фрагментирующий МС-анализ подтверждает установленную структуру. Для C11H13ClF3N3 (M)+ вычислено HRMSm/z 279,0750, найдено 279,0751. Пример 7. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазин. Стадия 1. Сложный трет-бутиловый эфир 4-(6-хлор-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазин-1-карбоновой кислоты. Указанное в заголовке соединение получают, исходя из 2-(R)-метилпиперазина, согласно методике,приведенной в примере 6, стадия 1, для (S)-изомера, полученное соединение представляет собой белое кристаллическое твердое вещество. Выход 7,4 г (70%). Степень чистоты 99% (ВЭЖХ); т.пл.86 С. Фрагментирующий МС-анализ подтверждает установленную структуру. Для C16H21ClF3N3O2 (М)+ вычисленоHRMS m/z 379,1274, найдено 379,1269. Стадия 2. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазин. Целевое соединение получают, исходя из продукта, полученного выше на стадии 1, применяя методику снятия защиты атома N, приведенную в примере 6, стадия 2, и полученное соединение представляет собой светло-желтое маслянистое вещество. Выход 4,76 г (90%). Степень чистоты 99% (ВЭЖХ). Фрагментирующий МС-анализ подтверждает установленную структуру. Для C11H13ClF3N3 (M)+ вычисленоHRMS m/z 279,0750, найдено 279,0742. Пример 8. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазин. Стадия 1. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-2-(R)-метил-4-тритилпиперазин. Суспензию 3-(R)-метил-1-тритилпиперазина (по примеру 4; 7,80 г, 22,9 ммоль), 2,6-дихлор-3 трифторметилпиридина (4,50 г, 20,8 ммоль) и К 2 СO3 (4,0 г, 29 ммоль) в ДМСО (100 мл) перемешивают при 80 С в течение ночи. К отфильтрованному раствору добавляют смесь EtOAc/толуол (50:50; 500 мл) и трижды промывают смесь водой (1 л). Высушенную (MgSO4) органическую фазу концентрируют при пониженном давлении, полученное в результате коричневое маслянистое вещество растворяют в смеси гептан/EtOAc (90:10) и фильтруют через пробку (60x60 мм) из силикагеля. Медленное выпаривание приблизительно двух третей растворителя при пониженном давлении приводит к образованию светложелтых кристаллов (6,11 г, 56%). Степень чистоты 100% (ВЭЖХ); т.пл. 209 С. Фрагментирующий МСанализ подтверждает установленную структуру. Анализ C,H,N (C30H27ClF3N3). Стадия 2. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазин. Суспензию 1-(6-хлор-5-трифторметилпиридин-2-ил)-2-(R)-метил-4-тритилпиперазина (полученную выше на стадии 1; 5,70 г, 10,9 ммоль) в EtOH (70 мл) нагревают до 80 С. Добавляют водный раствор НСl(4 М; 6 мл) и нагревают смесь в открытом сосуде в течение часа. К прозрачному раствору добавляют воду(100 мл) и осадок отфильтровывают. Растворитель выпаривают из фильтрата, понижая объем приблизительно до 10 мл, кристаллы отфильтровывают и продолжают выпаривание, понижая объем до 3 мл, и отфильтровывают другую порцию слегка розоватых кристаллов. Объединенные кристаллические фракции распределяют между щелочной водой (NaOH)/CHCl3. Водную фазу дважду промывают СНСl3 и объединяют, сушат (MgSO4), органические фазы упаривают при пониженном давлении, получая при этом светло-желтое маслянистое вещество (1,75 г, 69%). Между метиленовыми протонами при атоме С-2 в пиперазиновом цикле и водородом при атоме С-3 в пиридиновом цикле наблюдался NOE. Степень чистоты 99% (ВЭЖХ). Фрагментирующий МС-анализ подтверждает установленную структуру. ДляC11H13ClF3N3 (М) + вычислено HRMS m/z 279,0750, найдено 279,0744. Пример 9. Хлоргидрат 1-(6-хлор-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазина. Стадия 1. 1-(6-Хлор-5-трифторметилпиридин-2-ил)-2-(S)-метил-4-тритилпиперазин. Указанное в заголовке соединение получают, исходя из 3-(S)-метил-1-тритилпиперазина (полученного в примере 3), применяя методику, приведенную в примере 8 для получения (R)-изомера. Светложелтые кристаллы; выход 5,1 г (43%). Степень чистоты 96% (ВЭЖХ); т.пл. 210 С. Фрагментирующий МС-анализ подтверждает установленную структуру. Анализ C,H,N (C30H27ClF3N3). Стадия 2. Хлоргидрат 1-(6-хлор-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазина. Целевое соединение получают, исходя из продукта, полученного выше на стадии 1, применяя методику N-детритилирования, приведенную в примере 8, стадия 2, для (R)-изомера. Полученный продукт 2,06 г (68%) в виде свободного основания указанного в заголовке соединения представляет собой маслянистое вещество розоватого цвета. Свободное основание преобразуют в его хлоргидратную соль. Степень чистоты 99% (ВЭЖХ). Фрагментирующий МС-анализ подтверждает установленную структуру. ДляC11H13ClF3N3 (M)+ вычислено HRMS m/z 279,0750, найдено 279,0738. Примеры 10-43. Общая методика. Объемы выражены в виде общих (суммарных) объемов. В 16 мм пробирку добавляют: 0,5 ммоль соответствущего спирта или тиола 0,4 ммоль соответствующего 6-хлор-5-трифторметил-2-пиперазинилпиридина в ДМСО (0,5 мл) 0,65 ммоль К-т-BuO в ДМСО (1,0 мл) Реакционные смеси перемешивали при комнатной температуре в течение 2 ч с последующим добавлением НОАс (1,25 ммоль, 75 мкл). Растворитель выпаривали при пониженном давлении в течение ночи (быстрое разрежение). Остающиеся твердые вещества растворяли в смеси вода/ацетонитрил/НОАс,фильтровали и очищали продукты препаративной ВЭЖХ. Масс-спектр (детектирование) получали на масс-спектрометре Micro Mass LCP с электрораспылительной ионизацией. Аналитические ВЭЖХ-хроматограммы получали на хроматографе Hewlett Packard 1100 с колонкой 50x4,6 мм Grom-SIL 100 ODS 0 АВ, 3 мкм и с колонкой 50x4,6 мм YMC-AQ, 5 мкм. Применяли различные градиенты 0,1% TFA в воде и ацетонитриле и детектировали пики при 254 нм. Степень чистоты описывали по площади (%) самого большого пика. Схема 1 Исходные 6-хлорпиридины, применяемые в примерах 10-43(М+Н)+. Для C21H21F3N4O2 (M)+ вычислено HRMS m/z 418,1617, найдено 418,1625. Исходный материал 12 получали как описано в заявке WO 00/76984. Пример 22. Ацетат 1-[6-(2,6-дифторбензилокси)-5-трифторметилпиридин-2-ил]пиперазина. Исходный материал А и 13, см. схему 1. Степень чистоты 96% (ВЭЖХ). MC m/z 374 (М+Н)+. ДляC18H18F5N3O2 (М)+ вычислено HRMS m/z 403,1319, найдено 403,1326. Исходный материал 17 получали из 2,6-дифторфенола и этиленкарбоната согласно общей методике, описанной в заявке WO 00/76984 (пример 91). МС-анализ подтвердил установленную структуру. ДляC18H26F3N3O (М)+ вычислено HRMS m/z 357,2028, найдено 357,2040. Получение фармацевтической композиции Пример. Получение таблеток. Ингредиенты мг/таблетка 1. Активное соединение формулы (I) 10,0 2. Целлюлоза, микрокристаллическая 57,0 3. Гидрофосфат кальция 15,0 4. Крахмалгликолят натрия 5,0 5. Диоксид кремния, коллоидный 0,25 6. Стеарат магния 0,75 Активный ингредиент 1 смешивают с ингредиентами 2, 3, 4 и 5 в течение приблизительно 10 мин. Затем добавляют стеарат магния и полученную смесь перемешивают в течение приблизительно 5 мин и прессуют в форме таблеток с пленочным покрытием или без него. Фармакологические методики Способность соединения согласно изобретению соединяться с конкретными подтипами 5-НТрецептора или действовать на них можно определить in vitro и in vivo с помощью анализов, известных в данной области. Биологическую активность соединений, полученных в примерах, проверяли с помощью различных тестов.- 13007543 Анализ аффинного связывания. Аффинное связывание полученных в примерах соединений с 5-НТ 2 с-рецептором определяли в экспериментах по конкурентному связыванию, где способность каждого соединения при серийном разведении замещать 3 Н-меченный 5-НТ, связанный с мембранами, полученными из линии трансфицированных НЕК 2 93-клеток, стабильно экспрессирующих человеческий 5-НТ 2 с-рецепторный протеин, отслеживали с помощью SPA-технологии (Scintillation Proximity Assay). Неспецифическое связывание определяли с помощью 5 мкМ миансерина. Результаты, полученные для типичных соединений изобретения, проиллюстрированы ниже в таблице. Показатели аффинности связывания с 5-НТ 2c-рецептором, выраженные в процентах ингибирования связывания радиоактивного лиганда при 50 нМ тестируемого соединения, находятся в диапазоне 10-95%. Значения Ki для соединений в отношении 5-НТ 2 с-рецептора находятся в диапазоне 0,5-5000 нМ. Таблица. Аффинное связывание с 5-НТ 2 с-рецептором Соединение Кi, нМ Пример 15 1 Пример 17 15 Пример 21 246 Пример 25 14 Пример 30 24 Пример 36 5 Пример 38 6 Анализ активности. Агонистическую активность полученных в примерах соединений в отношении 5-НТ 2 с-рецептора определяли по способности каждого соединения мобилизовать внутриклеточный кальций в трансфицированных НЕК 293-клетках, стабильно экспрессирующих человеческий 5-НТ 2 с-рецепторный протеин, с помощью комплекса кальций-хелатообразующий флуоресцирующий краситель FLUO-3 (Sigma, St.Louis,МО, USA). Максимальные ответы полученных в примерах соединений находились в диапазоне 0-102% по отношению к максимальному ответу 5-НТ (серотонина) при концентрации 1 мкМ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)R2 и R3 каждый независимо представляет Н или СН 3;R5 выбран из арила, арил-С 1-6-алкила, арилокси-С 2-6-алкила, гетероарила, гетероарил-С 1-6-алкила,С 3-6-циклоалкила,С 3-6-циклоалкил-С 1-4-алкила,C1-6-алкила,2 гетероарилокси-С 2-6-алкила,тетрагидрофурила, 3-тетрагидрофурила, 2-тетрагидрофурфурила, 3-тетрагидрофурфурила, пиперидин-4 ила, тетрагидропиран-4-ила, С 3-6-алкинила, С 3-6-алкенила или фтор-С 2-4-алкила; и где любой арильный или гетероарильный остаток, сам по себе или как часть другой группы, может быть незамещен или замещен одним или более C1-4-алкилом, C1-4-алкокси, C1-4-алкилтио, С 2-4-ацилом, C1-4 алкилсульфонилом, циано, нитро, гидрокси, С 2-6-алкенилом, С 2-6-алкинилом, фторметилом, трифторметилом,трифторметокси, галогеном, -N(R6)(R7), арилом, арилокси, арилтио, арил-С 1-4-алкилом, арил-С 2-4-алкенилом,арил-С 2-4-алкинилом, гетероарилом, гетероарилокси, гетероарилтио, гетероарил-С 1-4-алкилом, арил-С 1-4 алкокси, арилокси-С 1-4-алкилом или диметиламино-С 2-4-алкокси, гдеR6 и R7 независимо друг от друга представляют собой водород, метил или этил; или вместе с атомом азота, с которым они соединены, образуют пирролидиновый, пиперазиновый, морфолиновый, тиоморфолиновый или пиперидиновый цикл; и где любой арильный или гетероарильный остаток в качестве заместителей арильных или гетероарильных остатков, в свою очередь, сам по себе или как часть другой группы, может быть замещен в одном или более положениях, предпочтительно одном, независимо друг от друга C1-4-алкилом, C1-4 алкокси, галогеном, трифторметилом, циано, гидрокси или диметиламино; и его фармацевтически приемлемые соли, гидраты, сольваты, геометрические изомеры, таутомеры,оптические изомеры, N-оксиды и пролекарственные формы.- 14007543 2. Соединение по п.1, где R1 представляет собой водород. 3. Соединение по любому из пп.1, 2, где R4 выбран из O-R5 и S-R5. 4. Соединение по любому из пп.1-3, где R5 выбран из арил-С 1-6-алкила, арилокси-С 2-6-алкила, гетероарил-С 1-6-алкила, гетероарилокси-С 2-6-алкила, С 3-6-циклоалкила, С 3-6-циклоалкил-С 1-4-алкила, C1-6 алкила, 2-тетрагидрофурфурила, и где любой арильный или гетероарильный остаток, сам по себе или как часть другой группы, может быть незамещен или замещен одним или более С 1-4-алкилом, C1-4-алкокси,циано, галогеном или арилокси-С 1-4-алкилом. 5. Соединение по любому из пп.1-4, где R5 выбран из бензила, 2-хлорбензила, 3-цианобензила, 2 циклогексилэтила, циклопентила, 2-циклопентилэтила, 2,3-дифторбензила, 2,6-дифторбензила, 2-(2,6 дифторфенокси)этила, 2,3-дигидробензо[1,4]диоксин-6-илметила, этила, 5-фтор-2-метоксибензила, фуран-2-илметила, метила, -метилбензила, 3-метилбензила, 2-(нафталин-2-илокси)этила, 2-феноксиэтила,2-феноксиметилбензила, н-пропила, 3-(пиридин-3-ил)-н-пропила, 2-(8-хинолинилокси)этила, тетрагидрофуран-2-илметила или 3-тиенилметила. 6. Соединение по любому из пп.1-5, где R1, R2 и R3 представляют собой водород. 7. Соединение по любому из пп.1-6, где атом углерода, с которым соединен R2, имеет (S)конфигурацию, если R2 представляет собой метил, и оба R1 и R3 представляют собой водород. 8. Соединение по любому из пп.1-6, где атом углерода, с которым соединен R3, имеет (R)конфигурацию, если R3 представляет собой метил, и оба R1 и R2 представляют собой водород. 9. Соединение по любому из пп.1-6, где соединение выбрано из ацетата 1-[6-(2-феноксиэтокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-[6-(2,3-дигидробензо[1,4]диоксин-6-илметокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-[6-(тиофен-3-илметокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 3-(6-пиперазин-1-ил-3-трифторметилпиридин-2-илоксиметил)бензонитрила; ацетата 1-[6-(3-метилбензилсульфанил)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-[6-(2,3-дифторбензилокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)пиперазина; ацетата 1-(6-пропокси-5-трифторметилпиридин-2-ил)пиперазина; ацетата 1-(6-циклопентилокси-5-трифторметилпиридин-2-ил)пиперазина; ацетата 1-[6-(1-фенилэтокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 8-[2-(6-пиперазин-1-ил-3-трифторметилпиридин-2-илокси)этокси]хинолина; ацетата 1-[6-(2,6-дифторбензилокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-[6-(3-пиридин-3-илпропокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-(6-бензилокси-5-трифторметилпиридин-2-ил)пиперазина; ацетата 1-[6-(фуран-2-илметокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-6-[2-(2,6-дифторфенокси)этокси]-5-трифторметилпиридин-2-илпиперазина; ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-2-(R)-метилпиперазина; ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазина; ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазина; ацетата 1-(6-этилсульфанил-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазина; ацетата 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-3-(S)-метилпиперазина; ацетата 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-3-(R)-метилпиперазина; 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-2-(R)-метилпиперазина; 1-(6-бензилокси-5-трифторметилпиридин-2-ил)-2-(S)-метилпиперазина; ацетата 1-(6-метокси-5-трифторметилпиридин-2-ил)пиперазина; ацетата 1-[6-(5-фтор-2-метоксибензилокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-6-[2-(нафталин-2-илокси)этокси]-5-трифторметилпиридин-2-илпиперазина; ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-3-(S)-метилпиперазина; ацетата 1-[6-(2-хлорбензилсульфанил)-5-трифторметилпиридин-2-ил]-2-(S)-метилпиперазина; ацетата 1-[6-(2-феноксиметилбензилокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-[6-(тетрагидрофуран-2-илметокси)-5-трифторметилпиридин-2-ил]пиперазина; ацетата 1-[6-(2-циклопентилэтокси)-5-трифторметилпиридин-2-ил]пиперазина; или ацетата 1-[6-(2-циклогексилэтокси)-5-трифторметилпиридин-2-ил]пиперазина. 10. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-9 и фармацевтически приемлемый носитель. 11. Способ профилактики или лечения серотонинсвязанного расстройства или состояния субъекта,нуждающегося в такой профилактике или лечении, включающий введение субъекту эффективного количества соединения по любому из пп.1-9. 12. Способ по п.11, где серотонинсвязанное расстройство или состояние представляет собой расстройство или состояние, связанное с 5-НТ 2c-рецептором. 13. Способ по п.12, где расстройство или состояние, связанное с 5-НТ 2 с-рецептором, выбрано из расстройств памяти; болезни Альцгеймера; шизофрении; расстройств настроения; расстройств, связан- 15007543 ных с тревожными состояниями; боли; злоупотребления веществами; половой дисфункции; эпилепсии; глаукомы; недержания мочи; менопаузальных и постменопаузальных приливов; диабета II типа; пищевых расстройств; пищевых расстройств, связанных с потреблением спиртного в большом количестве; нервной анорексии; булимии; или прибавления в весе, связанного с введением антипсихотропного лекарственного средства. 14. Способ по п.12, где расстройство или состояние, связанное с 5-НТ 2 с-рецептором представляет собой ожирение. 15. Способ по любому из пп.11-14, где субъект является человеком. 16. Способ по любому из пп.11-14, где субъект является животным. 17. Способ модулирования активности 5-НТ 2 с-рецептора у субъекта, нуждающегося в таком модулировании, включающий введение субъекту эффективного количества соединения по любому из пп.1-9. 18. Способ по п.17, где субъект является человеком. 19. Способ по п.17, где субъект является животным. 20. Применение соединения по любому из пп.1-9 для получения лекарственного средства для профилактики или лечения серотонинсвязанного расстройства или состояния. 21. Применение по п.20, где серотонинсвязанное расстройство или состояние связано с 5-НТ 2 срецептором. 22. Применение по п.21, где расстройство или состояние, связанное с 5-НТ 2 с-рецептором, выбрано из расстройств памяти; болезни Альцгеймера; шизофрении; расстройств настроения; расстройств, связанных с тревожными состояниями; боли; злоупотребления веществами; половой дисфункции; эпилепсии; глаукомы; недержания мочи; менопаузальных и постменопаузальных приливов; диабета II типа; пищевых расстройств; пищевых расстройств, связанных с потреблением спиртного в большом количестве; нервной анорексии; булимии; или прибавления в весе, связанного с введением антипсихотропного лекарственного средства. 23. Применение по п.21, где расстройство или состояние, связанное с 5-НТ 2c-рецептором, представляет собой ожирение. 24. Способ получения фармацевтической композиции, включающий смешение соединения по любому из пп.1-9 с фармацевтически приемлемым носителем. 25. Способ получения соединения по любому из пп.1-9 путем взаимодействия соединения формулы где Hal представляет собой галоген; с соответствующим производным пиперазина формулы (III)R2 и R3 каждый независимо представляет собой Н или СН 3; с получением соединения формулы (IV)
МПК / Метки
МПК: A61P 3/04, C07D 401/14, C07D 401/04, A61K 31/496, A61P 13/02, A61P 15/12, A61K 31/444, C07D 213/72, A61P 25/00
Метки: применение, производные, композиция, способы, 4-(3-трифторметилпиридин-5-ил)пиперазина, получения, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/17-7543-proizvodnye-4-3-triftormetilpiridin-5-ilpiperazina-farmacevticheskaya-kompoziciya-sposoby-ih-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-(3-трифторметилпиридин-5-ил)пиперазина, фармацевтическая композиция, способы их получения и применение.</a>
Предыдущий патент: Новые блок-сополимеры и способ их получения
Следующий патент: Композиция противовоспалительного, регенерационного и антимикробного действия
Случайный патент: Новый холиновый сокристалл эпалрестата












