Замещенные производные 1-пиперидин-3-ил-4-пиперидин-4-илпиперазина и их применение в качестве антагонистов нейрокинина
Номер патента: 8774
Опубликовано: 31.08.2007
Авторы: Янссенс Франс Эдуард, Соммен Франсуа Мария, Де Бук Бенуа Кристиан Альберт Гилейн, Ленартс Йозеф Элизабет
Формула / Реферат
1. Соединение общей формулы (I)
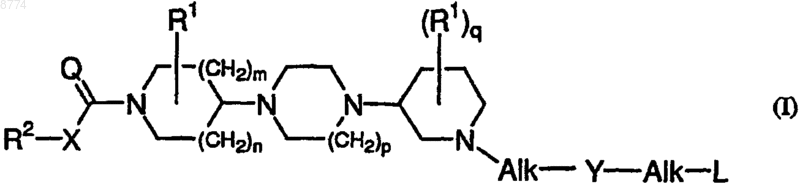
и его фармацевтически приемлемые соли с кислотами или основаниями, его стереохимически изомерные формы, его N-оксидная форма и его пролекарства, где
n и m, каждый равен 1;
р представляет собой целое число, равное 1 или 2;
q представляет собой целое число, равное 0 или 1;
Q представляет собой О или NR3;
X представляет собой ковалентную связь;
каждый R3 независимо друг от друга представляет собой водород или алкил;
каждый R1 независимо друг от друга выбран из группы, включающей Ar1, Ar1-алкил и ди(Ar1)алкил;
R2 представляет собой Ar2, Ar2-алкил, ди(Ar2)алкил;
Y представляет собой ковалентную связь или бивалентный радикал формулы -С(=O)-, -SO2-, >C=CH-R или >C=N-R, где R представляет собой CN или нитро;
каждый Alk представляет собой независимо друг от друга ковалентную связь; бивалентный неразветвленный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный или ненасыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; причем каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из фенила, галогена, циано, гидрокси, формила и амино;
L выбран из группы, состоящей из водорода, алкила, алкилокси, Ar3-окси, алкилоксикарбонила, алкилкарбонилокси, моно- и ди(алкил)амино, моно- и ди(Ar3)амино, Ar3, Ar3-карбонила, Het2 и Het2-карбонила;
Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, включающей галоген, алкил, циано, аминокарбонил и алкилокси;
Ar2 представляет собой нафталинил или фенил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо друг от друга выбран из группы, включающей галоген, нитро, амино, моно- и ди(алкил)амино, циано, алкил, гидрокси, алкилокси, карбоксил, алкилоксикарбонил, аминокарбонил и моно- и ди(алкил)аминокарбонил;
Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями, причем каждый независимо друг от друга выбран из группы, включающей алкилокси, алкил, галоген, гидрокси, Ar1-карбонилоксикарбонил, пиридинил, морфолинил, пирролидинил, имидазо[1,2-а]пиридинил, морфолинилкарбонил, пирролидинилкарбонил, амино и циано;
Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, включающей тетрагидрофуранил, пирролидинил, диоксолил, имидазолидинил, пирразолидинил, пиперидинил, морфолинил, дитианил, тиоморфолинил, пиперазинил, имидазолидинил, тетрагидрофуранил, 2Н-пирролил, пирролинил, имидазолинил, пирразолинил, пирролил, имидазолил, пиразолил, триазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил, пиридазинил и триазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей бензопиперидинил, хинолинил, хиноксалинил, индолил, изоиндолил, хроменил, бензимидазолил, имидазо[1,2-а]пиридинил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, бензо[2,1,3]оксадиазолил, имидазо[2,1-b]тиазолил, 2,3-дигидробензо[1,4]диоксил и октагидробензо[1,4]диоксил;
каждый радикал может быть необязательно замещен одним или несколькими радикалами, выбранными из группы, включающей Ar1, Ar1-алкил, Ar1-алкилоксиалкил, галоген, гидрокси, алкил, алкилкарбонил, алкилокси, алкилоксиалкил, алкилоксикарбонил, пиперидинил, пиридинил, пирролил, тиенил, оксо и оксазолил; и
алкил представляет собой неразветвленный или разветвленный, насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклические насыщенные углеводородные радикалы, имеющие от 3 до 6 атомов углерода, необязательно замещенные на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из группы, включающей фенил, галоген, циано, оксо, гидрокси, формил и амино.
2. Соединение по п.1, отличающееся тем, что
n равно 1;
m равно 1;
р равно 1;
q равно 0;
Q представляет собой О;
X представляет собой ковалентную связь;
каждый R1 представляет собой Ar1 или Ar1-алкил;
R2 представляет собой Ar2;
Y представляет собой ковалентную связь или бивалентный радикал формулы -С(=O)-, -SO2-, или >C=CH-R, или >C=N-R, где R представляет собой CN или нитро;
каждый Alk представляет собой независимо друг от друга ковалентную связь; бивалентный неразветвленный или разветвленный, насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; причем каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими гидроксирадикалами;
L выбран из группы, включающей водород, алкил, алкилокси, алкилкарбонилокси, моно- и ди(алкил)амино, моно- и ди(Ar3)амино, Ar3, Het2 и Неt2-карбонил;
Ar1 представляет собой фенил;
Ar2 представляет собой фенил, необязательно замещенный 1, 2 или 3 алкильными радикалами;
Ar3 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, причем каждый независимо друг от друга выбран из группы, включающей алкилокси, алкил, галоген, гидрокси, Ar1-карбонилоксикарбонил и циано;
Het2 представляет собой гетероциклический радикал, выбранный из группы, включающей тетрагидрофуранил, пирролидинил, имидазолил, пиразолил, фуранил, тиенил, изоксазолил, тиазолил, тиадиазолил, пиридинил, пиразинил, бензо[2,1,3]оксадиазолил и имидазо[2,1-b]тиазолил;
каждый радикал необязательно замещен одним или несколькими радикалами, выбранными из Ar1-алкилоксиалкила, галогена, алкила, алкилкарбонила, пиридинила или оксазолила; и
алкил представляет собой неразветвленный углеводородный радикал, имеющий от 1 до 6 атомов углерода, необязательно замещенный одним или несколькими радикалами, выбранными из группы, включающей галоген и гидрокси.
3. Соединение по любому из пп.1 и 2, отличающееся тем, что R1 представляет собой Ar1-метил и присоединен в 2-положении или R1 представляет собой Ar1 и присоединен в 3-положении.
4. Соединение по любому из пп.1-3, отличающееся тем, что часть R2-X-C(=Q)- представляет собой 3,5-ди(трифторметил)фенилкарбонил.
5. Соединение по любому из пп.1-4, отличающееся тем, что р равно 1.
6. Соединение по любому из пп.1-5, отличающееся тем, что Y представляет собой -С(=O)-.
7. Соединение по любому из пп.1-6, отличающееся тем, что Alk представляет собой ковалентную связь.
8. Соединение по любому из пп.1-3, отличающееся тем, что L представляет собой Het2.
9. Соединение, выбранное из следующей группы:
[2R-транс]-(2-бензил-4-{4-[1-(тиофен-2-сульфонил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
[2R-[2a,4b(S*)]]-(2-бензил-4-{4-[1-(тиофен-2-сульфонил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-1-(3-{4-[2-бензил-1-(3,5-бис-трифторметилбензоил)пиперидин-4-ил]пиперазин-1-ил}пиперидин-1-ил)-2-фенилпропан-1-он;
[2R-транс]-(2-бензил-4-{4-[1-(1-фуран-3-ил-2-гидроксиэтил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-(2-бензил-4-{4-[1-(3,5-диметилизоксазол-4-сульфонил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-{2-бензил-4-[4-(1-циклопропанкарбонилпиперидин-3-ил)пиперазин-1-ил]пиперидин-1-ил}-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-{2-бензил-4-[4-(1-циклопентакарбонилпиперидин-3-ил)пиперазин-1-ил]пиперидин-1-ил}-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-(2-бензил-4-{4-[1-(2,1-дихлорбензоил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-(2-бензил-4-{4-[1-(3-бензилоксиметилтиофен-2-карбонил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-(2-бензил-4-{4-[1-(2-трифторметилбензолсульфонил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
[2R-транс]-(2-бензил-4-{4-[1-(3,5-диметилбензоил)пиперидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон;
10. Применение соединения по любому из пп.1-9 при получении лекарственного средства для лечения опосредованных тахикинином состояний.
11. Применение соединения по п.10 при получении лекарственного средства для лечения шизофрении, рвоты, тревожности, депрессии, синдрома раздраженной толстой кишки (IBS), нарушений циркадного ритма, боли, нейрогенного воспаления, астмы, нарушений мочеиспускания, таких как недержание мочи, и ноцицепции.
12. Фармацевтический препарат, содержащий фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-9.
13. Способ получения фармацевтического препарата по п.12, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-9.
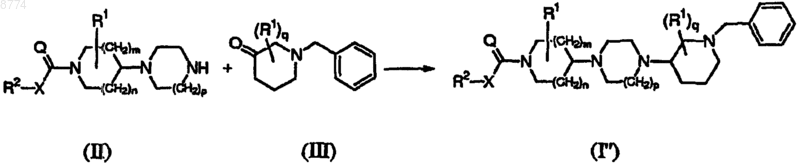
14. Способ получения соединения формулы (I"), где промежуточное соединение формулы (II) подвергают взаимодействию с промежуточным соединением формулы (III), где радикалы R2, X, Q, R1, m, n, p и q имеют значения, указанные в п.1,
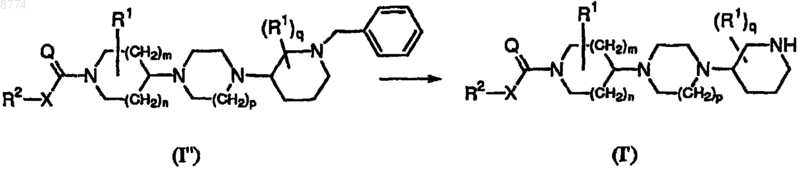
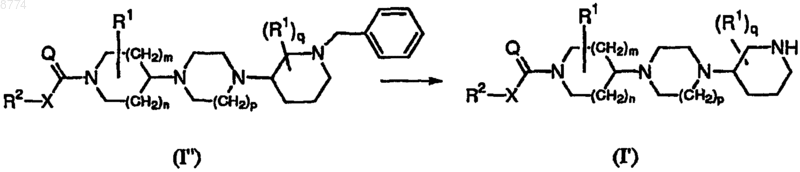
15. Способ получения соединения формулы (I'), где конечное соединение формулы (I") подвергают восстановительному гидрированию, где радикалы R2, X, Q, R1, m, n, p и q имеют значения, указанные в п.1.
16. Способ получения соединения формулы (I'), включающий последовательные стадии:
1) взаимодействия промежуточного соединения формулы (II) с промежуточным соединением формулы (III) с получением соединения формулы (I"), где радикалы R2, X, Q, R1, m, n, p и q имеют значения, указанные в п.1,
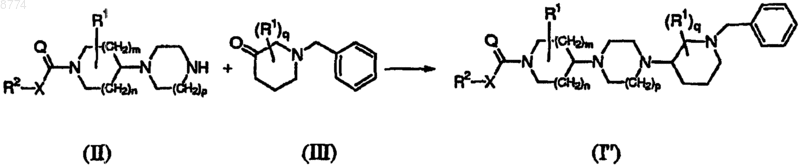
2) восстановительного гидрирования соединения формулы (I") с получением соединения формулы (I'), где радикалы R2, X, Q, R1, m, n, р и q имеют значения, указанные в п.1,
Текст
008774 Область изобретения, к которой относится изобретение Данное изобретение относится к замещенным производным 1-пиперидин-3-ил-4-пиперидин-4 илпиперазина, обладающим антагонистической активностью против нейрокинина, в частности NK1 антагонистической активностью, комбинированной NK1/NK3-антагонистической активностью и комбинированной NK1/NK2/NK3-антагонистической активностью, их получению, содержащим их композициям и их применению в качестве лекарственного средства, в частности для лечения шизофрении, рвоты, тревоги и депрессии, синдрома раздраженной толстой кишки (IBS), расстройств циркадного ритма, висцеральной боли, нейрогенного воспаления, астмы, нарушений мочеиспускания, таких как недержание мочи, и ноцицепции. Уровень техники изобретения Тахикинины принадлежат к семейству коротких пептидов, которые широко представлены в центральной и периферической нервных системах млекопитающих (Bertrand and Geppetti, Trends Pharmacol.Sci. 17: 255-259 (1996); Lundberg, Can. J. Physiol. Pharmacol. 73: 908-914 (1995); Maggi, Gen. Pharmacol. 26: 911-944 (1995); Regoli et al., Pharmacol. Rev. 46 (1994. Они имеют общую С-концевую последовательность Phe-Xaa-Gly-Leu-Met-NH2. Считается, что тахикинины, высвобождаемые из периферических чувствительных нервных окончаний, принимают участие в нейрогенном воспалении. В спинном мозге/центральной нервной системе тахикинины могут играть роль в передаче/восприятии боли и в некоторых автономных рефлексах и поведениях. Тремя основными тахикининами являются вещество Р (SP),нейрокинин А (NKА) и нейрокинин В (NKВ) с предпочтительной аффинностью для трех различных подтипов рецепторов, обозначенных NK1, NK2 и NK3, соответственно. Однако функциональные исследования на клонированных рецепторах позволяют предположить сильное перекрестное функциональное взаимодействие между 3 тахикининами и их соответствующими рецепторами (Maggi and Schwartz,Trends Pharmacol. Sci. 18: 351-355 (1997. Видовые различия в структуре NK1-рецепторов являются ответственными за относящиеся к видовым различиям активности NK1-антагонистов (Maggi, Gen. Pharmacol. 26: 911-944 (1995); Regoli et al.,Pharmacol. Rev. 46(4): 551-599 (1994. NK1-рецептор человека является очень сходным с NK1-рецептором морских свинок и песчанок, но заметно отличается от NK1-рецептора грызунов. Разработка антагонистов нейрокининов привела к настоящему времени к получению ряда пептидных соединений, которые, как можно ожидать, являются метаболически слишком лабильными, чтобы их можно было использовать в качестве фармацевтически активных веществ (Longmore J. et al., DNP 8(1): 5-23 (1995. Тахикинины принимают участие в механизмах шизофрении, депрессии, (относящихся к стрессу) тревожных состояниях, рвоте, воспалительных реакциях, сокращении гладких мышц и восприятии боли. В разработке находятся антагонисты нейрокининов для таких показаний, как рвота, тревога и депрессия,синдром раздраженной толстой кишки (IBS), расстройства циркадного ритма, висцеральная боль, нейрогенное воспаление, астма, нарушения мочеиспускания и ноцицепция. В частности, антагонисты NK1 имеют огромное терапевтическое значение для лечения астмы. NK3-антагонисты, по-видимому, играют роль при лечении боли/воспаления (Giardina, G. et al., Exp. Opin. Ther. Patents, 10(6): 939-960 (2000 и шизофрении. Шизофрения Недавно было показано, что NK3-антагонист SR 142801 (Sanofi) обладает антипсихотической активностью у шизофренических пациентов без проявления отрицательных симптомов (Arvantis, L. ACNPMeeting, December 2001). Активация NK1-рецепторов вызывает тревожность, случаи максимального стресса вызывают повышенные уровни вещества Р (SP) в плазме, и указывается, что NK1-антагонисты являются анксиолитическими на нескольких моделях животных. NK1-антагонист от Merck, MK-869, проявляет антидепрессантные действия при большой депрессии, но данные не были убедительными вследствие высокой степени реакции плацебо. Кроме того, было показано, что NK1-антагонист от GlaxoWelcome (S)-GR205171 усиливает высвобождение допамина в лобной части коры головного мозга, но не в полосатом теле (Lejeune et al., Soc. Neurosci., November 2001). Поэтому высказывается гипотеза, чтоNK3-антагонизм в комбинации с NK1-антагонизмом может быть полезным как против положительных,так и отрицательных симптомов шизофрении. Тревожность и депрессия Депрессия является одним из наиболее обычных аффективных нарушений здоровья современного общества с высоким и все же увеличивающимся преобладанием, особенно у молодых членов общества. Процент наличия глубокой депрессии (MDD, DSM-IV) в течение жизни в настоящее время оценивается как 10-25% у женщин и 5-12% у мужчин, при этом приблизительно 25% пациентов в течение всей жизни являются рецидивирующими без полного промежуточного выздоровления с наложением на дистимическое нарушение. Депрессия значительно распространена вместе с другими психическими нарушениями,и, в частности, среди более молодой части общества, что в значительной степени связано со злоупотреблением лекарственными средствами и алкоголем. Ввиду того факта, что депрессия поражает людей в возрасте 18-44 лет, то есть наиболее продуктивную часть общества, очевидно, что она является большой проблемой для индивидуума, семьи и всего общества. Среди всех терапевтических возможностей терапия антидепрессантами является, бесспорно, наибо-1 008774 лее эффективной. Большое число антидепрессантов разработано и продвинуто на рынок в течение последних 40 лет. Тем не менее, ни один из современных антидепрессантов не удовлетворяет полностью всем критериям идеального лекарственного средства (высокая терапевтическая и профилактическая эффективность, быстрое начало действия, полностью удовлетворительная кратковременная и долговременная безопасность, простая и благоприятная фармакокинетика) или проявляет побочные действия, которые тем или иным образом ограничивают их применение во всех группах и подгруппах пациентов, страдающих депрессией. Поскольку в настоящее время не существует лечения причины депрессии, не вырабатывается иммунитет и никакой антидепрессант не является эффективным более чем для 60-70% пациентов, оправданной является разработка нового антидепрессанта, который может преодолеть любые из недостатков доступных лекарственных средств. Несколько открытий указывают на участие SP в относящихся к стрессу состояниях беспокойства. Центральная инъекция SP индуцирует сердечно-сосудистую реакцию, напоминающую классическую реакцию "сражение или отступление", характеризующуюся физиологически васкулярной дилатацией в скелетных мышцах и снижением мезентериального и почечного кровотока. Эта сердечно-сосудистая реакция сопровождается поведенческой реакцией, наблюдаемой у грызунов после ядовитого стимула или стресса (Culman and Unger, Can. J. Physiol. Pharmacol. 73: 885-891 (1995. У мышей центрально введенные агонисты и антагонисты NK1 являются анксиогенными и анксиолитическими, соответственно(Teixeira et al., Eur. J. Pharmacol. 311: 7-14 (1996. Способность антагонистов NK1 ингибировать частое постукивание лапами, индуцированное SP (или электрическим шоком; Ballard et al., Trends Pharmacol.Sci. 17: 255-259 (2001, может соответствовать этой антидепрессантной/анксиолитической активности,так как частое постукивание лапок у песчанок играет роль настораживающего или предупреждающего сигнала для особей, принадлежащих к одному и тому же виду. Рецептор NK1 широко распространен на всем протяжении лимбической системы и тревожностьпроцессирующих путей головного мозга, в том числе миндалин, гиппокампа, перегородок, гипоталамуса и периканального серого вещества. Кроме того, вещество Р высвобождается в центральной нервной системе в ответ на травматический или ядовитый стимул, и ассоциированная с веществом Р нейротрансмиссия может содействовать или принимать участие в состоянии тревоги, страха и эмоциональных расстройств, которые сопровождают аффективные расстройства, такие как депрессия и тревожность. Эту точку зрения подтверждает факт, что изменения в содержании вещества Р в дискретных областях головного мозга могут наблюдаться в ответ на стресс-стимулы (Brodin et al., Neuropeptides 26: 253-260 (1994. Центральная инъекция миметиков (агонистов) вещества Р индуцирует диапазон защитных поведенческих и сердечно-сосудистых изменений, включающих чувство неприязни к месту (Elliott, Exp. Brain.Res. 73: 354-356 (1988, усиленную реакцию на акустический сигнал (Krase et al., Behav. Brain. Res. 63: 81-88 (1994, дистресс-вокализацию, поведение избегания (Kramer et al., Science, 281: 1640-1645 (1998 и тревожность на каскадном крестообразном лабиринте (Aguiar and Brandao, Physiol. Behav. 60: 11831186 (1996. Эти соединения не модифицировали моторную функцию и координацию на аппарате с вращающимся стержнем или способность передвигаться в клетке для определения активности. Негативная регуляция биосинтеза вещества Р имеет место в ответ на введение известных анксиолитических и антидепрессантных лекарственных средств (Brodin et al., Neuropeptides 26: 253-260 (1994); Shirayama etal., Brain. Res. 739: 70-78 (1996. Аналогичным образом, индуцированная центрально введенным NK1 агонистом голосовая реакция у морских свинок может быть антагонизирована антидепрессантами, такими как имипрамин и флуоксетин, а также L-733060 и NK1-антагонист. Эти исследования дали доказательства, позволяющие предположить, что блокада центральных NK1-рецепторов может ингибировать психологический стресс способом, сходным с действием антидепрессантов и анксиолитиков (Rupniakand Kramer, Trends Pharmacol. Sci. 20: 1-12 (1999, но без побочных действий настоящих лекарственных средств. Рвоты Тошнота и рвота находятся среди наиболее дистрессовых побочных эффектов химиотерапии рака. Они снижают качество жизни и могут вызвать у пациента желание задержки или отказа от приема потенциально целебных лекарственных средств. (Kris et al., J. Clin. Oncol., 3: 1379-1384 (1985. Частота таких явлений, интенсивность и картина рвоты определяются различными факторами, такими как химиотерапевтический агент, доза и путь введения. Обычно ранняя или острая рвота начинается в течение первых 4 ч после введения химиотерапевтического средства, достигая пика между 4 и 10 ч, и снижается к 12-24 ч. Отложенную рвоту (развивающуюся спустя 24 ч и продолжающуюся до 3-5 дней после химиотерапии) наблюдали у большинства "высокорвотных" химиотерапевтических лекарственных средств(уровень 4 и 5 в соответствии с Hesketh et al., J. Clin. Oncol. 15: 103 (1997. У людей эти "высокорвотные" противораковые лечения, в том числе цисплатин, индуцируют острую рвоту у 98% и отложенную рвоту у 60-90% раковых пациентов. Животные модели рвоты химиотерапии, такие как индуцированная цисплатином рвота у африканских хорьков (Rudd and Naylor, Neuropharmacology 33: 1607-1608 (1994); Naylor and Rudd, Cancer. Surv. 21: 117-135 (1996, успешно предсказали клиническую эффективность антагонистов 5-НТ 3-рецептора.-2 008774 Хотя это открытие привело к эффективной терапии для лечения индуцированной химиотерапией и радиацией тошноты у раковых пациентов, 5-НТ 3-антагонисты, такие как ондансетрон и гранисетрон (либо не в сочетании, либо в сочетании с дексаметазоном), являются эффективными в подавлении острой рвотной фазы (первые 24 ч), но могут только уменьшить развитие задержанной рвоты (24 ч) с низкой эффективностью (De Mulder et al., Annuals of Internal Medicine 113: 834-840 (1990); Roila, Oncology 50: 163-167 (1993. Несмотря на наиболее эффективные в настоящее время лечения для профилактики как острой, так и задержанной рвоты, все же 50% пациентов страдают от задержанной рвоты и/или тошноты(Antiemetic Subcommittee, Annals Oncol. 9: 811-819 (1998. В настоящее время обнаружено, что, в противоположность 5-НТ 3-антагонистам, NK1-антагонисты,такие как СР-99994 (Piedimonte et al., L. Pharmacol. Exp. Ther. 266: 270-273 (1993 и апрепитант (известный также как МК-869 или L-754030; Kramer et al., Science 281: 1640-1645 (1998); Rupniak and Kramer,Trends Pharmacol. Sci. 20: 1-12 (1999, ингибируют не только острую, но также задержанную фазу индуцированной цисплатином рвоты у животных (Rudd et al., Br. J. Pharmacol. 119: 931-936 (1996); Tattersall etal., Neuropharmacology 39: 652-663 (2000. Было показано также, что NK1-антагонисты уменьшают "задержанную" рвоту у человека в отсутствие сопутствующей терапии (Cocquyt et al., Eur. J. Cancer 37: 835842 (2001); Navari et al., N. Engl. L. Med. 340: 190-195 (1999. Кроме того, обнаружено, что при введении вместе с дексаметазоном и 5-НТ 3-антагонистами NK1-антагонисты (такие, как МК-869 и СJ-11974, известный также как эзлопитант) продуцируют дополнительные действия при предупреждении острой рвоты (Campos et al., J. Clin. Oncol. 19: 1759-1767 (2001); Hesketh et al., Clin. Oncol. 17: 338-343 (1999. Центральные рецепторы нейрокинина NK1 играют основную роль в подавлении рвоты. NK1-антагонисты являются активными против большого числа рвотных стимулов (Watson et al., Br. J. Pharmacol. 115: 84-94 (1995); Tattersall et al., Neuropharmacol. 35: 1121-1129 (1996); Megens et al., J. Pharmacol. Exp.Ther. 302: 696-709 (2002. Предполагается, что такие соединения действуют блокированием центральных NK1-рецепторов ядра одиночного пути. Помимо антагонизма NK1 проникновение в ЦНС является поэтому предварительным требованием для противорвотной активности этих соединений. Индуцированная лоперамидом рвота у африканских хорьков может быть использована в качестве быстрой и надежной модели скрининга противорвотной активности антагонистов NK1. Дальнейшая оценка их терапевтической ценности при лечении как острой, так и задержанной фаз вызванной цисплатином рвоты была продемонстрирована на установленной модели африканского хорька (Rudd et al., Br. J. Pharmacol. 119: 931936 (1994. Эта модель исследует как "острую", так и "задержанную" рвоту после цисплатина, она была подтверждена на примере ее чувствительности к антагонистам 5-НТ 3-рецептора, глюкокортикоидам(Sam et al., Eur. J. Pharmacol. 417: 231-237 (2001 и другим фармакологическим стимулам. Маловероятно,что любое будущее противорвотное средство найдет клиническое одобрение, если только оно не будет успешным при лечении как "острой", так и "задержанной" фаз рвоты. Синдром раздраженной толстой кишки (IBS) Пациенты с синдромом раздраженной толстой кишки (IBS) имеют ухудшенное качество жизни и экстенсивно используют ресурсы медико-санитарной помощи, так как они ищут лучшие "решения" (в том числе ненужные повторяющиеся исследования или даже хирургические операции). Хотя эти пациенты страдают "доброкачественным" нарушением (другими словами, они никогда не умрут от такого синдрома или у них не произойдет развития значительных осложнений), тем не менее, они создают значительные экономические затраты из-за экстенсивного использования ресурсов медико-санитарной помощи и отсутствия трудовой деятельности. Опубликовано достаточное число предварительных клинических публикаций по роли NK1-рецепторов в висцеральной боли. При применении NK1-рецептора из мышей с нокаутом и антагонистов NK1 на моделях-животных различные группы демонстрировали важную роль, играемую NK1-рецептором при гипералгезии и висцеральной боли. Распределение NK1-рецепторов и вещества Р способствует основной роли в висцеральной, а не в соматической боли. Действительно, более чем 80% висцерального основного афферента содержит вещество Р по сравнению с 25% афферентов кожи. NK1-рецепторы принимают участие также в желудочно-кишечной сократительной способности (Tonini et al., Gastroenterol. 120: 938-945(2001); Okano et al., J. Pharmacol. Exp. Ther. 298: 559-564 (2001. Вследствие такой двойной роли как в желудочно-кишечной сократительной способности, так и в ноцицепции, считают, что антагонисты NK1 обладают потенциалом для ослабления симптомов у пациентов с IBS. Уровень техники Соединения, содержащие 1-пиперидин-4-илпиперазинильную часть, опубликованы в WO 97/16440A1, опубликованной 9 мая 1997 Janssen Pharmaceutica N.V., для использования в качестве антагонистов вещества Р, в WO 02/32867, опубликованной 25 апреля 2002 Glaxo Group Ltd., по причине их особых преимуществ в качестве антагонистов нейрокининов (более конкретно, описаны производные амидов 4 пиперазин-1-илпиперидин-1-карбоновой кислоты), в WO 01/30348-A1, опубликованной 03 мая 2001Janssen Pharmaceutica N.V., для применения в качестве антагонистов вещества Р для влияния на систему циркадного хронометрирования и в WO 02/062784-А 1, опубликованной 15 августа 2002 Hoffmann-LaRoche AG, для применения в качестве антагонистов нейрокинина-1. Соединения настоящего изобретения отличаются от соединений известного уровня техники в заме-3 008774 щении пиперазинильной части, являющейся замещенной пиперидинильной частью, а также их повышенной способностью в качестве сильнодействующих, перорально и центрально активных антагонистов нейрокининов с терапевтической ценностью, особенно для лечения шизофрении, рвоты, тревоги и депрессии,синдрома раздраженной толстой кишки (IBS), нарушений циркадного ритма, висцеральной боли, нейрогенного воспаления, астмы, нарушений мочеиспускания, таких как недержание мочи, и ноцицепции. Описание изобретения Настоящее изобретение относится к новым замещенным производным 1-пиперидин-3-ил-4-пиперидин-4-илпиперазина общей формулы (I) и их фармацевтически приемлемым солям с кислотами или основаниями, их стереохимически изомерным формам, их N-оксидным формам и их пролекарствам, гдеn представляет собой целое число, равное 0, 1 или 2;m представляет собой целое число, равное 1 или 2, при условии, что если m равно 2, тогда n равно 1; р представляет собой целое число, равное 1 или 2;q представляет собой целое число, равное 0 или 1;X представляет собой ковалентную связь или бивалентный радикал формулы -O-, -S- или -NR3-; каждый R3 независимо друг от друга представляет собой водород или алкил; каждый R1 независимо друг от друга выбран из группы, включающей Аr1, Аr1-алкил и ди(Аr1)алкил;Y представляет собой ковалентную связь или бивалентный радикал формулы -С(=O)-, -SO2-,C=CH-R или C=N-R, где R представляет собой CN или нитро; каждый Alk представляет собой независимо друг от друга ковалентную связь; бивалентный неразветвленный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный или ненасыщенный углеводородный радикал,имеющий от 3 до 6 атомов углерода; причем каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из фенила, галогена, циано,гидрокси, формила и амино;Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, включающей галоген, алкил, циано, аминокарбонил и алкилокси;Ar2 представляет собой нафталинил или фенил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, причем каждый независимо друг от друга выбран из группы, включающей галоген,нитро, амино, моно- и ди(алкил)амино, циано, алкил, гидрокси, алкилокси, карбоксил, алкилоксикарбонил, аминокарбонил и моно- и ди(алкил)аминокарбонил;Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями, причем каждый независимо друг от друга выбран из группы, включающей алкилокси, алкил, галоген,гидрокси, Ar1-карбонилоксикарбонил, пиридинил, морфолинил, пирролидинил, имидазо[1,2-а]пиридинил, морфолинилкарбонил, пирролидинилкарбонил, амино и циано;Het1 представляет собой моноциклический гетероциклический радикал, выбранный из группы,включающей пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил,изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил,бензоксазолил, бензизоксазолил, бензотиазолил, бензоизотиазолил, бензофуранил, бензотиенил и 4 а,8 адигидро-2 Н-хроменил; причем каждый гетероциклический радикал может быть, необязательно, замещен у любого атома одним или несколькими радикалами, выбранными из группы, включающей галоген, оксо и алкил;Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы,включающей тетрагидрофуранил, пирролидинил, диоксолил, имидазолидинил, пирразолидинил, пиперидинил, морфолинил, дитианил, тиоморфолинил, пиперазинил, имидазолидинил, тетрагидрофуранил, 2 Нпирролил, пирролинил, имидазолинил, пирразолинил, пирролил, имидазолил, пиразолил, триазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил,пиразинил, пиридазинил и триазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей бензопиперидинил, хинолинил, хиноксалинил, индолил, изоиндолил, хроменил,бензимидазолил, имидазо[1,2-а]пиридинил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, бензо[2,1,3]оксадиазолил, имидазо[2,1-b]тиазолил, 2,3-дигидробензо[1,4]диоксил и октагидробензо[1,4]диоксил; каждый радикал может быть необязательно замещен одним или несколькими радикалами, выбранными из группы, включающей Ar1, Ar1-алкил, Ar1-алкилоксиалкил,галоген, гидрокси, алкил, алкилкарбонил, алкилокси, алкилоксиалкил, алкилоксикарбонил, пиперидинил,пиридинил, пирролил, тиенил, оксо и оксазолил; и алкил представляет собой неразветвленный или разветвленный, насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклические насыщенные углеводородные радикалы,имеющие от 3 до 6 атомов углерода, необязательно замещенные на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из группы, включающей фенил, галоген, циано,оксо, гидрокси, формил и амино. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его Nоксидным формам и его пролекарствам, гдеX представляет собой ковалентную связь; каждый R1 представляет собой Ar1 или Ar1-алкил;Y представляет собой ковалентную связь или бивалентный радикал формулы -С(=O)-, -SO2-, илиC=CH-R, или C=N-R, где R представляет собой CN или нитро; каждый Alk представляет собой независимо друг от друга ковалентную связь; бивалентный неразветвленный или разветвленный, насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; причем каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими гидроксирадикалами;Ar3 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, причем каждый независимо друг от друга выбран из группы, включающей алкилокси, алкил, галоген, гидрокси, Ar1 карбонилоксикарбонил и циано;Het2 представляет собой гетероциклический радикал, выбранный из группы, включающей тетрагидрофуранил, пирролидинил, имидазолил, пиразолил, фуранил, тиенил, изоксазолил, тиазолил, тиадиазолил, пиридинил, пиразинил, бензо[2,1,3]оксадиазолил и имидазо[2,1-b]тиазолил; каждый радикал необязательно замещен одним или несколькими радикалами, выбранными из Ar1 алкилоксиалкила, галогена, алкила, алкилкарбонила, пиридинила или оксазолила; и алкил представляет собой неразветвленный углеводородный радикал, имеющий от 1 до 6 атомов углерода, необязательно замещенный одним или несколькими радикалами, выбранными из группы,включающей галоген и гидрокси. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам, где R1 представляет собой Ar1-метил и присоединен в 2-положении или R1 представляет собой Ar1 и присоединен в 3-положении; примерами соединений формулы (I),где m и n равны 1 и Ar представляет собой незамещенный фенил, являются соединения нижеследующих формул. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам, где остаток R2-X-C(=Q)-представляет собой 3,5-ди(трифторметил)-5 008774 фенилкарбонил. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам, где р равно 1. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам, где Y представляет собой -С(=O)-. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам, где Alk представляет собой ковалентную связь. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам, где L представляет собой Het2. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам, где соединение представляет собой соединение, выбранное из группы соединений с номером соединения 25, 48, 79, 39, 15, 41, 64, 88, 50, 59 и 3, как указано в любой одной из приведенных далее табл. 1-2 данной заявки. В рамках данной заявки алкил определен как моновалентный неразветвленный или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, например метил, этил, пропил, бутил, 1-метилпропил, 1,1-диметилэтил, пентил, гексил; алкил далее определяет одновалентный циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, например циклопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. Определение алкила включает в себя также алкильный радикал, который необязательно замещен на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из фенила, галогена, циано, оксо, гидрокси, формила и амино, например гидроксиалкил, в частности гидроксиметил и гидроксиэтил, и полигалогеналкил, в частности дифторметил и трифторметил. В рамках данной заявки галоген является родовым названием фтора, хлора, брома и йода. В рамках данной заявки выражение "соединения по изобретению" означает соединение общей формулы (I), его фармацевтически приемлемые соли с кислотами или основаниями, его стереохимически изомерные формы, его N-оксидные формы и его пролекарства. В рамках данной заявки, особенно в остатке -Alka-Y-Alkb в формуле (I), когда два или более последовательных элементов указанного остатка означают ковалентную связь, то он означает одну ковалентную связь. Например, когда Alk2 и Y обозначают оба ковалентную связь и Alkb представляет собой СН 2,тогда остаток Alka-Y-Alkb означает -СН 2-. Аналогично этому, если Alka, Y и А 1kb, каждый, означают ковалентную связь и L представляет собой Н, тогда остаток Alka-Y-Alkb означает -Н. Фармацевтически приемлемые соли определяют как включающие в себя формы терапевтически активных нетоксичных кислотно-аддитивных солей, которые способны образовывать соединения формулы(I). Указанные соли могут быть получены обработкой формы основания соединений формулы (I) подходящими кислотами, например неорганическими кислотами, например галогеноводородной кислотой, в частности хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламиновой кислотой, салициловой кислотой, п-аминосалициловой кислотой и памоевой кислотой. Соединения формулы (I), содержащие кислотные протоны, могут быть также преобразованы в их формы терапевтически активных нетоксичных солей металлов или аддитивных солей аминов обработкой подходящими органическими или неорганическими основаниями. Формы подходящих солей с основаниями включают в себя, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности соли лития, натрия, калия, магния и кальция, соли с органическими основаниями, например соли бензатина, N-метил-D-глюкозамина, гибрамина, и соли с аминокислотами, например аргинином и лизином. Наоборот, указанные формы солей могут быть преобразованы в свободные формы обработкой подходящим основанием или кислотой. Термин "аддитивная соль", используемый в рамках данного изобретения, включает также сольваты,которые могут образовывать соединения формулы (I), а также их соли. Такими сольватами являются,например, гидраты и алкоголяты. Имеется в виду, что N-оксидные формы соединений формулы (I) включают в себя те соединения формулы (I), у которых один или несколько атомов азота окислены в так называемый N-оксид, особенно те N-оксиды, у которых один или несколько третичных атомов азота (например, радикала пиперазинила-6 008774 или пиперидинила) N-окислены. Такие N-оксиды могут быть легко получены специалистом в данной области без любых изобретательских квалификаций, они являются явными альтернативами для соединений формулы (I), так как эти соединения являются метаболитами, которые образуются путем окисления в теле человека при поглощении. Как, в общем, известно, окисление обычно является первой стадией,включенной в метаболизм лекарственного средства (Textbook of Organic Medicinal and PharmaceuticalChemistry, 1977, pages 70-75). Как, в общем, также известно, человеку вместо соединения per se может быть также введена метаболитная форма соединения со значительно более сильными, но такими же действиями. Соединения по изобретению имеют по меньшей мере 2 окисляемых атома азота (остатки третичных аминов). Следовательно, весьма возможно, что N-оксиды будут образовываться при метаболизме в теле человека. Соединения формулы (I) могут быть преобразованы в соответствующие N-оксидные формы известными в данной области методами превращения трехвалентного атома азота в его N-оксидную форму. Указанную реакцию N-окисления обычно проводят взаимодействием исходного соединения формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают в себя, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать в себя пероксикислоты, такие как, например, бензолкарбопероксоновая кислота или галогензамещенная бензолкарбопероксоновая кислота, например 3-хлорбензолкарбопероксоновая кислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Термин "стереохимически изомерные формы", используемый здесь ранее, означает все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не оговорено или не указано особо, химическое определение соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стерические центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо транс-конфигурацию. Соединения, обладающие двойными связями, могут иметь Е- или Z-стереохимию у указанной двойной связи. Конечно, подразумевается, что стереохимически изомерные формы соединений формулы (I) включены в объем данного изобретения. По номенклатурным конвенциям CAS, когда два стерических центра известной абсолютной конфигурации присутствуют в молекуле, обозначение R или S приписывается (на основании правила КанаИнгольда-Прелога) хиральному центру с самой низкой нумерацией, ссылочному центру. R и S, каждый, обозначает оптически чистые стерические центры с неопределенной абсолютной конфигурацией. Если используют обозначения и , положение заместителя с самым высоким приоритетом на асимметричном атоме углерода в циклической системе, имеющем самый низшее число в кольце, является всегда условно в -положении средней плоскости, определяемой циклической системой. Положение заместителя с наиболее высоким приоритетом на другом асимметричном атоме углерода в циклической системе (атом водорода в соединениях формулы (I относительно положения заместителя с самым высоким приоритетом на ссылочном атоме обозначают , если он находится на той же стороне средней плоскости, определяемой циклической системой, или , если он находится на другой стороне средней плоскости, определяемой циклической системой. Соединения формулы (I) и некоторые промежуточные соединения имеют по меньшей мере два стерических центра в своей структуре, обозначенных звездочкой в табл. 1 и 2. Изобретение включает в себя также соединения-производные (обычно называемые "пролекарствами") фармацевтически активных соединений по изобретению, которые расщепляются in vivo с образованием соединений по изобретению. Пролекарства обычно (но не всегда) обладают более низкой активностью у рецептора цели, чем соединения, в которые они расщепляются. Пролекарства являются особенно ценными, когда требуемое соединение имеет химические или физические свойства, которые делают его введение трудным или неэффективным. Например, требуемое соединение может быть только слабо растворимым, оно может быть слабо переносимым через слизистый эпителий или оно может иметь нежелательно короткий полупериод существования в плазме. Дальнейшее обсуждение пролекарств можно найти вStella, V.J. et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112-176, and Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармацевтически активных соединений по изобретению обычно являются соединениями формулы (I), их фармацевтически приемлемыми аддитивными солями с кислотами или основаниями, их стереохимически изомерными формами и их N-оксидной формой, имеющими кислотную группу, которая является этерифицированной или амидированной. Такие этерифицированные кислотные группы включают группы формулы -COORx, где Rx представляет собой C1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают в себя группы формулы CONRyRz, где Ry представляет собой Н, C1-6 алкил, фенил или бензил и Rz представляет собой -ОН, Н, C1-6 алкил, фенил или бензил. Соединения по изобретению, имеющие аминогруппу, могут быть преобразованы в производные кетоном или альдегидом, таким как формальдегид, с образованием основания Манниха. Это основание может гидролизовать с кинетиками первого порядка в водном растворе. Соединения формулы (I), полученные способами, описанными ниже, могут быть синтезированы в виде рацемических смесей энантиомеров, которые могут быть отделены друг от друга следующими известными в данной области методами разделения. Рацемические соединения формулы (I) могут быть преобразованы в формы соответствующих диастереомерных солей реакцией с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, селективной или фракционной кристаллизацией и энантиомеры выделяют из них с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает в себя жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут также быть получены из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ, при условии, что реакция протекает стереоспецифическим образом. Если нужным является определенный стереоизомер, указанное соединение предпочтительно может быть синтезировано стереоспецифическими способами получения. Такие способы будут преимущественно использовать энантиомерно чистые исходные вещества. Фармакология Вещество Р и другие нейрокинины принимают участие в различных биологических действиях, таких как передача боли (ноцицепция), нейрогенное воспаление, сокращение гладких мышц, транссудация белка плазмы, вазодилатация, секреция, грануляция тучных клеток, а также в активации иммунной системы. Считается, что ряд заболеваний вызывается активацией рецепторов нейрокинина, в частности рецептора NK1, избыточным высвобождением вещества Р и других нейрокининов в определенных клетках,таких как клетки в нейронном сплетении желудочно-кишечного тракта, немиелированные первичные сенсорные афферентные нейроны, симпатические и парасимпатические нейроны и типы ненейронных клеток (DNP 8(1): 5-23 (1995) и Longmore J. et al., "Neurokinin Receptors" Pharmacological Reviews 46(4): 551-599 (1994. Соединения настоящего изобретения являются сильнодействующими ингибиторами нейрокининопосредованных действий, в частности действий, опосредованных через рецептор NK1, NK2 и NK3, и могут быть, следовательно, описаны как антагонисты нейрокинина, особенно антагонисты вещества Р, так как могут проявлять in vitro антагонизм индуцированной веществом Р релаксации коронарных артерий свиней. Аффинность связывания настоящих соединений для рецепторов нейрокинина человека, морских свинок и песчанок может быть также определена in vitro в испытании на связывание рецептора с использованием вещества 3 Н-Р в качестве радиолиганда. Рассматриваемые соединения проявляют также антагонистическую активность для вещества Р in vivo, что может быть доказано, например, антагонизмом индуцированной веществом Р экстравазации плазмы у морских свинок или антагонизмом индуцированной лекарственным средством рвоты у африканских хорьков (Watson et al., Br. J. Pharmacol. 115: 84-94(1995. По причине их способности антагонизировать действиям нейрокининов блокированием рецепторов нейрокининов, в частности блокированием рецептора NK1, NK2 и NK3, соединения по изобретению могут быть использованы в качестве лекарственного средства, в частности, при профилактике и терапевтическом лечении тахикинин-опосредованных состояний. Более конкретно, было обнаружено, что некоторые соединения проявляют антагонистическую активность для NK1, комбинированную антагонистическую активность против NK1/NK3 и комбинированную антагонистическую активность против NK1/NK2/NK3, что может быть видно из табл. 8 в экспериментальном разделе. Изобретение далее относится к соединению общей формулы (I), его фармацевтически приемлемым солям с кислотами или основаниями, его стереохимически изомерным формам, его N-оксидным формам и его пролекарствам для использования в качестве лекарственного средства. Изобретение относится также к применению соединения по изобретению при получении лекарственного средства для лечения либо профилактическим, либо терапевтическим образом или тем, и другим состояний, опосредованных тахикинином. Соединения по изобретению могут быть использованы при лечении нарушений ЦНС, в частности шизоаффективных нарушений, депрессии, нарушений типа тревожности, нарушений, относящихся к стрессу, нарушений сна, нарушений познавательной способности, изменения личности, нарушения аппетита, нейродегенеративных нарушений, нарушений типа аддикции, нарушений настроения, половой дисфункции, боли и других относящихся к ЦНС состояний; воспаления; аллергических нарушений; рво-8 008774 ты; желудочно-кишечных нарушений, в частности синдрома раздраженной толстой кишки (IBS); кожных нарушений; вазоспастических нарушений; фиброзных и коллагеновых заболеваний; нарушений, относящихся к иммунному усилению или иммунной супрессии и ревматическим заболеваниям; и регулирования массы тела. В частности, соединения по изобретению могут быть использованы при лечении или профилактике шизоаффективных нарушений, являющихся результатом различных причин, в том числе шизоаффективных нарушений маниакального типа, депрессивного типа, смешанного типа; параноидной, дезорганизованной, кататонической, недифференцированной и остаточной шизофрении; нарушения типа шизофрении; бредового нарушения; краткого психотического нарушения; раздельного психотического нарушения; индуцированного веществом психотического нарушения и иного, не указанного психотического нарушения. В частности, соединения по изобретению могут быть использованы при лечении или профилактике депрессии, включающей в себя, но не ограничивающейся перечисленным, большие депрессивные нарушения, включающие в себя биполярную депрессию; униполярную депрессию; одинарные или повторяющиеся большие депрессивные эпизоды с психотическими признаками или без них; кататонические признаки, меланхолические признаки, атипические признаки или постнатальную атаку и, в случае повторяющихся эпизодов, с сезонной картиной или без нее. Другие нарушения настроения, включенные в термин "большое депрессивное нарушение", включают дистимическое нарушение с ранним или поздним началом и с атипическими признаками или без них, биполярное нарушение I, биполярное нарушение II,циклотимическое нарушение, повторяющееся основное депрессивное нарушение, смешанное аффективное нарушение, невропатическую депрессию, послетравматическое стрессовое нарушение и социальную фобию; деменцию типа Альцгеймера с ранним или поздним началом, с подавлением настроения; васкулярную деменцию с подавленным настроением; индуцированные веществом нарушения настроения, такие как нарушения настроения, индуцированные алкоголем, амфетаминами, кокаином, галлюциногенами, лекарственными формами для ингаляции, опиоидами, фенциклидином, седативными средствами,снотворными средствами, анксиолитиками и другими веществами; шизоаффективное нарушение депрессивного типа и регулируемое расстройство с депрессивным настроением. Большие депрессивные нарушения могут быть также результатом общего медицинского состояния, включающего в себя, но не ограничивающегося перечисленным, инфаркт миокарда, диабеты, выкидыш, аборт и т.д. В частности, соединения по изобретению могут быть использованы при лечении или профилактике нарушений типа состояния тревоги, включающих в себя, но не ограничивающихся перечисленным, панический приступ; агорафобию; паническое нарушение без агорафобии; агорафобию без истории панического нарушения; специфическую фобию; социальную фобию; навязчивое компульсивное нарушение; послетравматическое стрессовое нарушение; острое стрессовое нарушение; нарушение типа генерализованного состояния тревоги; нарушение типа тревожности, обусловленной общим медицинским состоянием; индуцированное веществом нарушение типа тревожности и иное, не указанное нарушение типа состояния тревоги. В частности, соединения по изобретению могут быть использованы при лечении или профилактике относящихся к стрессу нарушений, ассоциированных с депрессией и/или тревожностью, включающих в себя, но не ограничивающихся перечисленным, острую стрессовую реакцию; нерегулируемые расстройства, такие как краткая депрессивная реакция, пролонгированная депрессивная реакция, смешанная реакция тревожности и депрессии, нерегулируемое расстройство с доминирующим нарушением других эмоций, регулируемое расстройство с доминирующим нарушением поведения, регулируемое расстройство со смешанным нарушением эмоций и поведения и регулируемые расстройства с другими специфическими доминирующими симптомами и другие реакции на сильный стресс. В частности, соединения по изобретению могут быть использованы при лечении или профилактике нарушений сна, включающих, но не ограничивающихся перечисленным, дисомнию и/или парасомнии,как первичные нарушения сна; инсомнию; приступы апное во сне; нарколепсию; нарушения циркадного ритма; нарушения сна, относящиеся к другому ментальному нарушению; нарушение сна, обусловленное общим медицинским состоянием, и индуцированное веществом нарушение сна. В частности, соединения по изобретению могут быть использованы при лечении или профилактике познавательных нарушений, включающих в себя, но не ограничивающихся перечисленным, деменцию; амнестические нарушения и познавательные нарушения, не указанные иначе, особенно деменцию, вызванную дегенеративными нарушениями, повреждениями, травмой, инфекциями, васкулярными нарушениями, токсинами, аноксией, дефицитом витаминов или эндокринными нарушениями; деменцию типа Альцгеймера с ранним и поздним началом, с подавленным настроением; СПИД-ассоциированную деменцию или амнестические нарушения, вызванные алкоголем или другими причинами дефицита тиамина, повреждение билатеральной височной доли вследствие простого герпеса, энцефалита и другого лимбического энцефалита, нейронной потери, вторичной к аноксии/гипогликемии/сильных судорог и хирургии, дегенеративных нарушений, васкулярных нарушений или патологии вокруг желудочка III. Кроме того, соединения по изобретению могут быть также использованы в качестве средств, улучшающих память и/или познавательную способность у здоровых людей без когнитивного дефицита и/или дефицита-9 008774 памяти. В частности, соединения по изобретению могут быть использованы при лечении или профилактике изменений личности, включающих в себя, но не ограничивающихся перечисленным, параноидное изменение личности; шизоидное изменение личности, шизотипичное изменение личности, антисоциальное изменение личности; пограничное изменение личности; мимическое изменение личности; нарциссизмовое изменение личности; изменение личности типа избегания; зависимое изменение личности; навязчивое компульсивное изменение личности и иное, не указанное изменение личности. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике нарушений аппетита, включающих в себя нервную анорексию; атипичную нервную анорексию; нервную булимию; атипичную нервную булимию; переедание, ассоциированное с другими физиологическими расстройствами; рвоту, связанную с другими физиологическими расстройствами, и неспецифические нарушения аппетита. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике нейродегенеративных заболеваний, включающих в себя, но не ограничивающихся перечисленным, болезнь Альцгеймера; хорею Хантингтона; болезнь Крейтцфельда-Якоба; болезнь Пика, демиелирующие нарушений, такие как рассеянный склероз и ALS; другие невропатии и невралгию; рассеянный склероз; боковой амиотрофический склероз; удар и травму головы. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике нарушений типа аддикции, включающих в себя, но не огранивающихся перечисленным, зависимость от вещества или злоупотребление веществом с физиологической зависимостью или без нее, особенно, когда веществом является алкоголь, амфетамины, подобные амфетаминам вещества, кофеин, кокаин, галлюциногены, лекарственные формы для ингаляции, никотин, опиоиды (такие, как каннабис,героин и морфин), фенциклидин, подобные фенциклидину соединения, седативные-снотворные средства, бензодиазепины и/или другие вещества, особенно применимые для лечения абстиненции от вышеуказанных соединений и абстиненции алкогольного делирия. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике нарушений настроения, вызванных особенно алкоголем, амфетаминами, кофеином, каннабисом,кокаином, галлюциногенами, лекарственными формами для ингаляции, никотином, опиоидами, фенциклидином, седативными средствами, снотворными средствами, анксиолитиками и другими веществами. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике половой дисфункции, включающей в себя, но не ограничивающейся перечисленным, расстройство полового влечения; половые возбуждающие нарушения; оргастические нарушения; половые болезненные нарушения; половую дисфункцию, обусловленную общим медицинским состоянием; вызванную веществом половую дисфункцию и иную, не указанную половую дисфункцию. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике боли, включающей в себя, но не ограничивающейся перечисленным, травматическую боль, такую как послеоперационная боль; травматическую авульсионную боль, такую как боль бронхиального сплетения; хроническую боль, такую как артритная боль, такая как имеющая место при остеоревматоидном или псориатическом артрите; невропатическую боль, такую как послегерпетическая невралгия,тройничная невралгия, сегментальная или межреберная невралгия, фибромиалгия, каузалгия, периферическая невропатия, диабетическая невропатия, индуцированная химиотерапией невропатия, относящаяся к СПИДУ невропатия, затылочная невралгия, коленчатая невралгия, глоссофарингеальная невралгия,рефлекторная симпатическая дистрофия и фантомная боль конечностей; различные формы головной боли, такие как мигрень, острое или хроническое напряжение головной боли, височно-нижнечелюстная боль, боль верхнечелюстной пазухи и мигрень; зубную боль; раковую боль; висцеральную боль; желудочно-кишечную боль; боль ущемления нерва; боль при спортивном повреждении; дисменорею; менструальную боль; менингит; арахноидит; мышечно-скелетную боль; боль нижней части спины, такую как спинальный стеноз; выпавший диск, ишиалгию, ангину, анкилозирующий спондилоартрит; подагру; ожоги; рубцовую боль; чесотку и таламическую боль, такую как таламическая боль после удара. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике других состояний, относящихся к ЦНС: акинезии, акинетических-ригидных синдромов, дискинезии и индуцированного лекарственным лечением паркинсонизма, синдрома Жилль де ла Туретта и его симптомов, тремора, хореи, миоклонуса, тиков и дистонии, нарушения типа дефицита внимания/повышенной активности (ADHD), болезни Паркинсона, индуцированного лекарственным средством паркинсонизма, послеэнцефалитического паркинсонизма, прогрессирующего надъядерного паралича, атрофии множественной системы, кортикобазальной дегенерации, комплекса паркинсонизм-деменция ALS и кальцификации базальных ганглий, поведенческих расстройств и поведенческих нарушений при деменции и умственно замедленного, включающего в себя беспокойство и возбуждение нарушения экстрапирамидальных движений, синдрома Дауна и акатизии. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике воспаления, включающего в себя, но не ограничивающегося перечисленным, воспалительные состояния при астме, гриппе, хроническом бронхите и ревматоидном артрите; воспалительные состояния- 10008774 в желудочно-кишечном тракте, такие как, но не ограничивающиеся перечисленным, болезнь Крона, неспецифический язвенный колит, воспалительное заболевание толстой кишки и повреждение, вызванное нестероидными противовоспалительными лекарственными средствами; воспалительные состояния кожи,такие как герпес и экзема; воспалительные состояния мочевого пузыря, такие как цистит и недержание мочи, и глазное и зубное воспаление. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике аллергических нарушений, включающих в себя, но не ограничивающихся перечисленным, аллергические нарушения кожи, такие как крапивница, но не ограничивающиеся таким заболеванием, и аллергические нарушения дыхательных путей, такие как ринит, но не ограничивающиеся таким заболеванием. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике рвоты, т.е. тошноты, позывов на рвоту и самой рвоты, включающей, но не ограничивающейся перечисленным, острую рвоту, задержанную рвоту и преждевременную рвоту; рвоту, вызванную лекарственными средствами, такими как химиотерапевтические агенты при лечении рака, такие как алкилирующие агенты, например циклофосфамид, кармустин, ломустин и хлорамбуцил, цитотоксичные антибиотики, например дактиномицин, доксорубицин, митомицин С и блеомицин; антиметаболиты, например цитарабин, метотрексат и 5-фторурацил; винка-алкалоиды, например этопозид, винбластин и винкристин, и другие лекарственные средства, такие как цисплатин, дакабазин, прокабазин и гидроксимочевина и их комбинации; лучевой болезнью; радиационной терапией, такой как при лечении рака; ядами; токсинами, такими как токсины, вызванные метаболическими нарушениями или инфекцией, такой как гастрит, или токсинами, высвобождаемыми во время бактериальной или вирусной желудочно-кишечной инфекции; беременностью; вестибулярными нарушениями, такими как морская болезнь, головокружение и болезнь Миньера; послеоперационной тошнотой; желудочно-кишечной обструкцией; пониженной желудочно-кишечной сократительной способностью; висцеральной болью, такой как инфаркт миокарда или перитонит; мигренью; повышенным внутричерепным давлением; пониженным внутричерепным давлением (таким как высотная болезнь); опиодными аналгетиками, такими как морфин; нарушением типа гастроэзофагеального рефлюкса; изжогой; сверхпотаканиями слабостям к пищевым продуктам и питью; кислотной реакцией желудка, желудочной отрыжкой; водной изжогой/регургитацией; изжогой,такой как эпизодическая изжога, ночная изжога и вызванная пищей изжога; и диспепсией. В частности, соединения по изобретению могут быть также использованы при лечении или профилактике желудочно-кишечных нарушений, включающих в себя, но не ограничивающихся перечисленным, синдром раздраженной толстой кишки (IBS); кожных нарушений, таких как псориаз, зуд и солнечный ожог; вазоспастических заболеваний, таких как ангина, васкулярная головная боль и болезнь Рейно,церебральная ишемия, такая как церебральный вазоспазм после субарахноидального кровоизлияния; фиброзных и коллагеновых заболеваний, таких как склеродермия и эозинофильный фасциолез; нарушений, относящихся к иммунному усилению и подавлению, такому как системная красная волчанка; и ревматических заболеваний, таких как фиброзит; кашля и регулирования массы тела, в том числе лечении ожирения. Наиболее конкретно, соединения по изобретению могут быть использованы для изготовления лекарственного средства для лечения шизофрении, рвоты, тревожности, депрессии, синдрома раздраженной толстой кишки (IBS), нарушений циркадного ритма, боли, нейрогенного воспаления, астмы, нарушений мочеиспускания, таких как недержание мочи и ноцицепция. Настоящее изобретение относится также к способу лечения и/или профилактики опосредованных тахикинином заболеваний, в частности для лечения и/или профилактики шизофрении, рвоты, тревожности,депрессии, синдрома раздраженной толстой кишки (IBS), нарушений циркадного ритма, боли, нейрогенного воспаления, астмы, нарушений мочеиспускания, таких как недержание мочи и ноцицепция, включающему в себя введение человеку, нуждающемуся в таком введении, эффективного количества соединения по изобретению, особенно формулы (I), его фармацевтически приемлемых солей с кислотами или основаниями, его стереохимически изомерных форм, его N-оксидной формы, а также его пролекарств. Изобретение относится также к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по изобретению, в частности соединение формулы (I), его фармацевтически приемлемых солей с кислотами или основаниями, его стереохимически изомерных форм, его N-оксидной формы и его пролекарства. Соединения по изобретению, в частности соединения формулы (I), их фармацевтически приемлемые соли с кислотами или основаниями, их стереохимически изомерные формы, их N-оксидную форму и их пролекарства или любую подгруппу или комбинацию их можно изготовить в различных фармацевтических формах для целей введения. Когда подходящие композиции цитируются здесь, все композиции обычно используют для системного введения лекарственных средств. Для получения фармацевтических композиций данного изобретения эффективное количество определенного соединения необязательно в форме аддитивной соли в качестве активного ингредиента комбинируют с образованием тесной смеси с фармацевтически приемлемым носителем, который может быть в виде большого числа форм в зависимости от формы препарата, требуемого для введения. Эти фармацевтические композиции являются жела- 11008774 тельными в единичной лекарственной форме, подходящей, в частности, для введения перорально, ректально, подкожно, парентеральной инъекцией или ингаляцией. Например, при получении композиций в пероральной лекарственной форме может применяться любая из обычных фармацевтических сред, такая как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара,каолин, разбавители, смазывающие вещества, связывающие вещества, дезинтегрирующие агенты и т.п., в случае порошков, пилюль, капсул и таблеток. Вследствие их легкости введения таблетки и капсулы представляют собой наиболее подходящие пероральные унифицированные лекарственные формы, в этом случае, как очевидно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно представляет собой стерильную воду, по меньшей мере, в большей части, хотя могут быть включены другие ингредиенты, например, для содействия растворимости. Например, могут быть получены инъецируемые растворы, в которых носитель представляет собой солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Могут быть также получены инъецируемые суспензии, в этом случае могут применяться подходящие жидкие носители, суспендирующие агенты и т.п. Включены также препараты в твердой форме, которые предназначены для превращения, незадолго до применения, в препараты жидких форм. В композициях, подходящих для подкожного введения, носитель необязательно содержит агент, усиливающий проникновение, и/или подходящий смачивающий агент, необязательно комбинированный с подходящими добавками любой природы в небольшой пропорции, такие добавки не должны оказывать значительное ухудшающее действие на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными для получения требуемых композиций. Эти композиции могут быть введены различными путями, например в виде чрескожного пластыря, для нанесения в виде пятен или в виде мази. Особенно удобным является изготовление вышеуказанных фармацевтических композиций в унифицированной лекарственной форме для легкости их введения и однородности дозы. Унифицированная лекарственная форма, используемая здесь, относится к физически дискретным единицам, подходящим в качестве доз на один прием, причем каждая единица содержит заданное количество активного ингредиента, вычисленное для индуцирования требуемого терапевтического действия,в сочетании с требуемым фармацевтическим носителем. Примерами таких унифицированных лекарственных форм являются таблетки (в том числе таблетки с насечками или с покрытиями), капсулы, пилюли, пакетики порошков, суппозитории, инъецируемые растворы или суспензии и т.п. и их сегрегированные многократные дозы. Поскольку соединения по изобретению являются сильнодействующими, перорально вводимымиNK1, NK1/NK3 и NK1/NK2/NK3-антагонистами, фармацевтические композиции, содержащие указанные соединения, являются особенно подходящими для перорального введения. Синтез Соединения по изобретению обычно получают последовательностью стадий, каждая из которых известна специалисту в данной области. Конечные соединения формулы (I) подходящим образом получают при восстановительном N-алкилировании промежуточного соединения формулы (II) промежуточным соединением формулы (III). Указанное восстановительное N-алкилирование может быть проведено в инертном для реакции растворителе, таком как, например, дихлорметан, этанол или толуол или их смеси, и в присутствии подходящего восстанавливающего агента, такого как, например, боргидрид, например боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид. В случае, когда боргидрид применяют в качестве восстанавливающего агента, может быть удобно применять образующий комплекс агент, такой как, например,изопропилат титана(IV), как описано в J. Org. Chem. 1990, 55, 2552-2554. Использование указанного образующего комплекс агента может также привести к образованию смеси цис/транс-изомеров с преобладанием транс-изомера. Может быть также удобно использовать водород в качестве восстанавливающего агента в комбинации с подходящим катализатором, таким как, например, палладий на угле или платина на угле. В случае применения водорода в качестве восстанавливающего агента может быть выгодным добавление к реакционной смеси дегидратирующего агента, такого как, например, трет-бутоксид алюминия. Для предотвращения нежелательного дополнительного гидрирования некоторых функциональных групп в реагентах и продуктах реакции может быть также выгодно добавлять к реакционной смеси подходящий яд для катализатора, например тиофен или комплекс хинолин-сера. Перемешивание и необязательно повышенные температуры и/или давления могут повысить скорость реакции. В данном и следующих получениях продукты реакции могут быть выделены из реакционной среды и, если необходимо, далее очищены по методологиям, обычно известным в данной области, таким как- 12008774 экстракция, кристаллизация, растирание и хроматография. Особенно подходящим является получение конечного соединения формулы (I) в соответствии с предварительно указанной схемой реакции, в которой часть Alk-Y-Alk-L представляет собой бензил, что,таким образом, позволяет получить соединение формулы (I), в которой часть Alk-Y-Alk-L представляет собой бензил. Указанное конечное соединение является фармакологически активным и может быть преобразовано в конечное соединение по изобретению, в котором часть Alk-Y-Alk-L представляет собой водород, восстановительным гидрированием с использованием, например, водорода в качестве восстановительного агента в комбинации с подходящим катализатором, таким как, например, палладий на угле или платина на угле. Образовавшееся конечное соединение по изобретению может быть преобразовано в другие соединения формулы (I) известными в данной области преобразованиями, например ацилированием и алкилированием. В частности, конечные соединения формулы (Iа) могут быть получены взаимодействием конечного соединения формулы (I') с промежуточным соединением формулы (V), в которой W1 представляет собой подходящую удаляемую группу, такую как, например, галоген, например хлор или бром, или удаляемую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси. Реакцию можно проводить в инертном для реакции растворителе, таком как, например, хлорированный углеводород, например дихлорметан, или кетон, например метилизобутилкетон, и в присутствии подходящего основания,такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повысить скорость реакции. Реакцию можно подходящим образом проводить при температуре, находящейся между комнатной температурой и температурой флегмы. В альтернативном варианте конечное соединение формулы (Iа) может быть также получено взаимодействием конечного соединения формулы (I') с карбоновой кислотой формулы (VI). Реакцию проводят в инертном для реакции растворителе, таком как, например, хлорированный углеводород, например дихлорметан, в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин, и в присутствии активатора, такого как, например, DCC (дициклогексилкарбодиимид), CDI (карбонилдиимидазол) и EDCI (1-(3-диметиламинопропил)-3-этилкарбодиимидНСl). Перемешивание может повысить скорость реакции. Реакция может быть подходящим образом проведена при температуре, находящейся между комнатной температурой и температурой флегмы. В частности, конечные соединения формулы (Ib) могут быть получены взаимодействием конечного соединения формулы (I') с соединением формулы (VII), в которой W2 представляет собой подходящую удаляемую группу, такую как, например, галоген, например хлор или бром, или удаляемую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси. Реакцию можно проводить в инертном для реакции растворителе, таком как, например, хлорированный углеводород, например дихлорметан, спирт, например этанол, или кетон, например метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повысить скорость реакции. Реакцию можно подходящим образом проводить при температуре, находящейся между комнатной температурой и температурой флегмы.- 13008774 Конечные соединения формулы (Ic) и формулы (Id) могут быть получены либо при восстановительном аминировании или алкилировании конечного соединения формулы (I'), либо соединением формулы(VIII) либо (IX), где W3 в формуле (VIII) представляет собой подходящую удаляемую группу, такую как,например, галоген, например, хлор или бром, или удаляемую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси, и где -СН 2-Аlk в формуле (Id) представляет собой Alk. Реакцию можно проводить в инертном для реакции растворителе, таком как, например, хлорированный углеводород, например дихлорметан, спирте, например этаноле, или кетоне, например метилизобутилкетоне,и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повысить скорость реакции. Реакцию можно подходящим образом проводить при температуре, находящейся между комнатной температурой и температурой флегмы. Исходные соединения и некоторые промежуточные соединения являются известными соединениями и коммерчески доступны или могут быть получены общепринятыми процедурами реакции, обычно известными в данной области. Например, промежуточные соединения формулы (II) могут быть получены при восстановительном N-алкилировании промежуточного соединения формулы (XI) промежуточным соединением формулы (XII), в которой W4 представляет собой бензильный радикал, после чего образовавшееся соединение затем восстанавливают, получая при этом промежуточное соединение формулы (II). Указанное восстановительное N-алкилирование может быть проведено в инертном для реакции растворителе, таком как, например, дихлорметан, этанол, толуол или их смесь, и в присутствии подходящего восстанавливающего агента, такого как, например, боргидрид, например боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид. В случае, когда используют боргидрид в качестве восстанавливающего агента, можно удобно использовать образующий комплекс агент, такой как, например,изопропилат титана(IV), как описано в J. Org. Chem., 1990, 55, 2552-2554. С использованием указанного,образующего комплекс агента можно также получить смесь цис/транс-изомеров с преобладанием трансизомера. Может быть также удобно использовать водород в качестве восстанавливающего агента в комбинации с подходящим катализатором, таким как, например, палладий на угле или платина на угле. В случае, когда водород используют в качестве восстанавливающего агента, может быть подходящим добавление к реакционной смеси дегидратирующего агента, такого как, например, трет-бутоксид алюминия. Для предотвращения нежелательного дополнительного гидрирования некоторых функциональных групп в реагентах и продуктах реакции может быть также выгодным добавление к реакционной смеси подходящего яда для катализатора, например тиофена или комплекса хинолин-сера. Перемешивание и необязательно повышенные температуры и/или давления могут повысить скорость реакции. Получение промежуточных соединений (XI) и (XII) и других промежуточных соединений описано вWO 97/16440-A1, опубликованной 9 мая 1997 Janssen Pharmaceutica N.V., которая включена здесь в качестве ссылки, а также в других публикациях, указанных в WO 97/16440-A1, такой как, например, ЕР 0532456-А. Следующие примеры предназначены для иллюстрации, но не ограничивают объем настоящего изобретения. Экспериментальная часть В дальнейшем "RT" означает комнатную температуру, "ТГФ" означает тетрагидрофуран, "DIPE" означает диизопропиловый эфир, "DCM" означает дихлорметан, "ДМФА" означает N,N-диметилформамид,- 14008774"НОВТ" означает 1-гидрокси-1 Н-бензотриазол. А. Получение промежуточных соединений. Пример А 1. а. Получение промежуточного соединения 1.Et3N (0,55 моль) добавляют к перемешиваемой смеси 7-(фенилметил)-1,4-диокса-8-азаспиро[4,5]декана (0,5 мл) в толуоле (1500 мл). 3,5-бис(Трифторметил)бензоилхлорид (0,5 моль) добавляют в течение 1 ч (экзотермическая реакция). Смесь перемешивают при комнатной температуре в течение 2 ч, затем выдерживают 2,5 дня и промывают 3 раза водой (500 мл, 2x250 мл). Органический слой отделяют, сушат,фильтруют и растворитель выпаривают. Выход: 245 г (100%). Часть этой фракции кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 1,06 г промежуточного соединения 1.b1. Получение промежуточного соединения 2. Х.ч. НСl (300 мл) добавляют к смеси промежуточного соединения 1 (0,5 моль) в этаноле (300 мл) и Н 2O (300 мл). Реакционную смесь перемешивают при 60 С в течение 20 ч. Осадок отфильтровывают,измельчают, перемешивают в Н 2 О, отфильтровывают, промывают петролейным эфиром и сушат. Выход: 192 г промежуточного соединения 2 +/-)-1-[3,5-бис(трифторметил)бензоил]-2-(фенилметил)-4-пиперидинона) (89,4%) (смесь R- и S-энантиомеров).b2. Получение промежуточного соединения 9 и промежуточного соединения 10. Промежуточное соединение 2 разделяют на оптические изомеры с помощью хиральной колоночной хроматографии на хиралпаке (CHIRALPAK AS 1000 , 20 мм (DAICEL); элюент: гексан/2-пропанол,70/30). Две фракции продукта собирают и растворитель каждой выпаривают. Выход фракции 1: 32,6 г промежуточного соединения 9 (R), и фракции 2: 30,4 г промежуточного соединения 10 (S). с. Получение промежуточного продукта 3. Смесь промежуточного соединения 2 (0,046 моль), 1-(фенилметил)пиперазина (0,051 моль) и тетраизопропилоксида Ti (0,056 моль) перемешивают в течение 2 ч при 40 С. Реакционную смесь охлаждают- 15008774 до комнатной температуры. Добавляют этанол первого сорта (350 мл). Добавляют NaBH4 (0,138 моль). Образовавшуюся реакционную смесь перемешивают в течение 1 ч при комнатной температуре, затем в течение 1 ч при 50 С. Добавляют еще NaBH4 (5,2 г) и реакционную смесь перемешивают в течение 2 ч при 50 С. Снова добавляют NaBH4 и реакционную смесь перемешивают в течение ночи при комнатной температуре, затем в течение 2 ч при 50 С. Добавляют воду (10 мл). Смесь перемешивают в течение 15 мин. Добавляют CH2Cl2 (200 мл) и смесь перемешивают в течение 15 мин. Органическую фазу отделяют, сушат (MgSO4), добавляют декалит, смесь фильтруют через декалит и фильтрат упаривают. Эту фракцию разделяют на (цис)- и (транс)-изомер с помощью колоночной хроматографии на силикагеле. Требуемую(транс)-фракцию собирают и растворитель выпаривают, получая при этом 14,8 г остатка 1), 1,06%(цис и 4,9 г остатка II), 6% (цис. Разделение и очистку этих (транс)-фракций (всего 20 г) проводят хроматографией на стационарной фазе хиралцел OD (1900Gr) в Prochrom LC110, 35 бар (элюент: гексан/этанол, 90/10). Требуемые фракции собирают и растворитель выпаривают. Выход: 9,5 г промежуточного соединения 3, (2R-транс)-1-[3,5-бис(трифторметил)бензоил]-2-(фенилметил)-4-[4-(фенилметил)-1 пиперазинил]пиперидина.d. Получение промежуточного соединения 4. Раствор промежуточного соединения 3 (0,288 моль) в метаноле (700 мл) гидрируют при 40 С с использованием 10% Pd/C (5 г) в качестве катализатора. После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Выход: 141,2 г промежуточного соединения, 4-(+)-(2R-транс)-1[3,5-бис(трифторметил)бензоил]-2-(фенилметил)-4-(1-пиперазинил)пиперидина. Пример А 2. а. Получение промежуточного соединения 5.NaH (0,086 моль) добавляют порциями к раствору 3-тиофенэтанола (0,078 моль) в ТГФ при 5 С в потоке N2. Смесь перемешивают в течение 1 ч при 5 С. Добавляют Bu4NI (0,001 ммоль) и (бромметил)бензол (0,080 моль). Смесь перемешивают при комнатной температуре в течение 3 ч, переносят в Н 2O и экстрагируют AcOEt. Органический слой отделяют, сушат (MgSO4) и растворитель выпаривают. Концентрат 1 (18 г) очищают колоночной хроматографией на силикагеле (градиентный элюент: циклогексан/AcOEt, от 100/0 до 80/20). Чистые фракции собирают и растворитель выпаривают. Выход: 9,9 г промежуточного соединения 5 (58%).b. Получение промежуточного соединения 6. К раствору промежуточного соединения 16 (0,023 моль) в ТГФ (50 мл) при -50 С порциями в потоке N2 добавляют BuLi [1,6 М] (0,025 моль). Температуру медленно повышают до 0 С. Смесь перемешивают при 0 С в течение 1 ч и охлаждают до -40 С. При -40 С добавляют раствор SO2Cl2 (0,046 моль) в пентане (50 мл). Смесь перемешивают при -40 С в течение 1 ч. Концентрат гидролизуют, экстрагируютAcOEt, промывают насыщенным раствором NaCl, сушат над MgSO4 и концентрируют, получая при этом 9 г. Концентрат очищают колоночной хроматографией на силикагеле (градиентный элюент: циклогексан/AcOEt, от 100/0 до 80/20). Выход: 1,2 г промежуточного соединения 6 (16%). Пример A3. а. Получение промежуточного соединения 7.NaH (60% в масле) (0,086 моль, 3,4 г) добавляют порциями к раствору 2-(2-тиенил)этанола (0,078 моль,10 г) в ТГФ (150 мл) при 5 С в потоке N2. Смесь перемешивают в течение 1 ч при 5 С. Добавляют йодид тетрабутиламмония (0,001 ммоль, 0,3 г) и затем к раствору добавляют (бромметил)бензол (0,080 моль,9,5 мл). Смесь перемешивают при комнатной температуре в течение 3 ч, выливают в воду, экстрагируют- 16008774 этилацетатом, сушат над MgSO4 и концентрируют. Сырой продукт (18 г) очищают колоночной хроматографией на силикагеле (градиентный элюент: СН 2 Сl2/циклогексан, от 0/100 до 20/80) и фракции продукта концентрируют. Выход: 11,4 г промежуточного соединения 7 (66%).b. Получение промежуточного соединения 8. н-BuLi (1,6 М) (0,015 моль, 9,45 мл) медленно добавляют к раствору промежуточного соединения 7(0,014 моль, 3 г) в ТГФ (30 мл) в потоке N2 при -40 С. Реакционной смеси дают возможность медленно нагреться до 0 С и охлаждают до -70 С. Добавляют сухой лед (2 г). Температуре дают возможность медленно повыситься до комнатной температуры. Добавляют NaOH (1 моль на литр, 30 мл), смесь промывают диэтиловым эфиром. Водный слой подкисляют НСl (1 н.) и экстрагируют СН 2 Сl2. Органический слой сушат над MgSO4 и концентрируют. Выход: 2,6 г промежуточного соединения 8 (71%). В. Получение конечных соединений. Пример В 1. а. Получение конечного соединения 1. Смесь промежуточного соединения 4 (0,005 моль), 1-(фенилметил)-3-пиперидинона (0,005 моль) и ацетата калия в метаноле (150 мл) гидрируют при 50 С с использованием 10% Pd/C (1 г) в качестве катализатора в присутствии раствора тиофена (1 мл). После поглощения Н 2 (1 экв.) катализатор отфильтровывают и фильтрат концентрируют. Остаток очищают колоночной флэш-хроматографией на силикагеле(элюент: CH2Cl2/(МеОН/NН 3), 95/5). Фракции продукта собирают и растворитель выпаривают. Выход: 2,5 г конечного соединения 1 (74%).b. Получение конечного соединения 2. Раствор конечного соединения 1 (получено по способу B1.a) (0,09 моль) в метаноле (500 мл) гидрируют при 50 С с использованием 10% Pd/C (5 г) в качестве катализатора. После поглощения Н 2 (1 экв.) катализатор отфильтровывают и фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(MeOH/NH3), 85/15). Фракции продукта собирают и растворитель выпаривают. Выход: 41,3 г конечного соединения 2 (78,7%).c. Получение конечных соединений 105 и 71.- 17008774 Эфир бис-(1,1-диметилэтил)диугольной кислоты (0,008 моль) добавляют к раствору конечного соединения 2 (получено по способу B1.b) (0,007 моль) в СН 2 Сl2 первого сорта (100 мл) и реакционную смесь перемешивают в течение 6 ч при комнатной температуре. Растворитель выпаривают и сухой остаток фильтруют через силикагель (элюент: СН 2 Сl2/СН 3 ОН, 95/5). Фракции продукта собирают и растворитель выпаривают. Полученный остаток разделяют хиральным разделением на колонке AD (элюент: гексан/EtOH, 95/5). Собирают две фракции продукта и их растворитель выпаривают. Каждый остаток очищают на стеклянном фильтре (градиентное элюирование: СН 2 Сl2/СН 3 ОН, 100/0-90/10), затем собирают требуемые продукты и их растворитель выпаривают. Выход фракции 1: 1,2 г конечного соединения 105, ([2R-[2,4(R. Выход фракции 2: 0,75 г конечного соединения 71, ([2R-[2,4(S.d. Получение конечного соединения 108. НСl/2-пропанол (5 мл) добавляют к раствору конечного соединения 105 (получено по способу B1.c)(0,00175 моль) в 2-пропаноле (50 мл). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 90 мин. Растворитель выпаривают и остаток суспендируют в DIPE. Образовавшийся осадок отфильтровывают и переносят в Н 2O. Смесь подщелачивают раствором NaOH и экстрагируютCH2Cl2. Органический слой промывают водой, сушат (MgSO4), фильтруют и растворитель выпаривают. Наконец, требуемый продукт сушат. Выход: 0,550 г конечного соединения 108 (54%) (2R-[2,4(R)]). Пример В 2. Получение конечного соединения 26. Конечное соединение 2 (получено по способу B1.b) (0,007 моль) растворяют в MIK (50 мл). Добавляют хлорпиразин (0,11 г) и Nа 2 СО 3 (0,5 г). Смесь перемешивают и кипятят с обратным холодильником в течение 44 ч, затем промывают водой, сушат и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/МеОН, 90/10). Фракции продукта собирают и растворитель выпаривают. Выход: 54 мг конечного соединения 26. Пример В 3. Получение конечного соединения 49. Конечное соединение 2 (получено по способу B1.b) (0,0007 моль) растворяют в СН 2 Сl2 (20 мл). Добавляют бензолметансульфонилхлорид (0,0008 моль). Реакционную смесь перемешивают. Затем добавляют Na2CO3 (0,5 г) и смесь перемешивают в течение 3 ч. Реакционную смесь очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/МеОН, 95/5). Требуемые фракции собирают и растворитель выпаривают. Остаток сушат. Выход: 0,237 г конечного соединения 49. Пример В 4. Получение конечного соединения 41.- 18008774 Циклопентанкарбонилхлорид (0,0008 моль) добавляют к раствору конечного соединения 2 (получено по способу B1.b) (0,0007 моль) в CH2Cl2 (20 мл) и смесь перемешивают, затем добавляют Na2CO3(0,005 моль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Смесь очищают колоночной хроматографией на силикагеле (градиентный элюент: СН 2 Сl2/СН 3 ОН, 100/0-90/10). Фракции продукта собирают, растворитель выпаривают и остаток сушат. Выход: 0,296 г конечного соединения 41. Пример В 5. Получение конечного соединения 17.(0,0025 моль) в СН 2 Сl2 (50 мл) и смесь перемешивают в течение 2 ч при комнатной температуре. Добавляют конечное соединение 2 (получено по способу B1.b) (0,002 моль) и реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Смесь промывают разбавленным раствором NaOH и водой, сушат и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле(градиентный элюент: CH2Cl2/CH3OH, 98/2-90/10). Фракции продукта собирают, растворитель выпаривают и остаток сушат. Выход: 0,915 г конечного соединения 17. Пример В 6. Получение конечных соединений 24 и 21. Смесь -оксо-2-фурануксусной кислоты (0,001 моль) и 1,1'-карбонил-бис-1 Н-имидазола (0,0011 моль) в CH2Cl2 (50 мл) перемешивают в течение 4 ч при комнатной температуре, затем добавляют конечное соединение 2 (получено по способу B1.b) (0,001 моль) и реакционную смесь перемешивают в течение ночи. Смесь промывают в течение 30 мин разбавленным раствором NaOH и водой, сушат и растворитель выпаривают. Остаток очищают колоночной хроматографией (градиентный элюент: CH2Cl2/CH3OH, 98/290/10). Собирают две фракции продукта, их растворитель выпаривают и каждый остаток сушат. Выход фракции 1: 0,120 г соединения 24, и выход фракции 2: 0,147 г соединения 21. Пример В 7. Получение конечного соединения 54.Et3N (0,0051 моль) добавляют к смеси эфира (2S)-1-(1,1-диметилэтил)-1,2-пирролидиндикарбоновой кислоты (0,0028 моль), N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина (0,0038 моль) и конечного соединения 2 (получено по способу B1.b) (0,0025 моль) в СН 2 Сl2 первого сорта (50 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч и выдерживают в течение ночи.- 19008774 Раствор промывают NaOH (0,3 н.); органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентный элюент:CH2Cl2/CH3OH, от 100/0 до 90/10). Фракции продукта собирают, растворитель выпаривают и остаток сушат (вакуум) при 50 С в течение 2 дней. Выход: 1,01 г конечного соединения 54 (52%). Пример В 8. Получение конечного соединения 67.B1.b) (0,001 моль) 4-гидроксибензойной кислоты (0,001 моль), НОВТ (0,001 моль) и Et3N (0,001 моль) в СН 2 Сl2 (5 мл). Смесь перемешивают при комнатной температуре в течение 8 ч, затем промывают Н 2O. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (0,5 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 96/4/0,1). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,14 г конечного соединения 67 (23%). Пример В 9. Получение конечного соединения 66. 2-Изоцианатопропан (0,0007 моль) добавляют при комнатной температуре к смеси конечного соединения 2 (получено по способу B1.b) (0,0006 моль) в ТГФ (5 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют Н 2O. Смесь экстрагируют CH2Cl2. Органический слой отделяют,сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (0,4 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH, 95/5/0,1). Чистые фракции собирают и растворитель выпаривают. Выход: 0,2 г соединения 66 (43%). Пример В 10. а. Получение конечного соединения 77. Смесь конечного соединения 2 (получено по способу B1.b) (0,001 моль), 2-тиенилбороновой кислоты (0,001 моль) и 1,4-диоксан-2,5-диола (0,001 моль) в этаноле (5 мл) перемешивают при комнатной температуре в течение 18 ч. Растворитель выпаривают досуха. Остаток растворяют в СН 2 Сl2. Органический слой промывают 10% K2 СO3, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (0,6 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 97/3/0,5). Чистые фракции собирают и растворитель выпаривают. Выход: 0,13 г конечного соединения 77 (21%).b. Получение конечного соединения 124.- 20008774 Уксусный ангидрид (0,003 мл, 0,301 ммоль) добавляют к смеси конечного соединения 89 (получено по способу В 10.а) (0,185 г, 0,251 ммоль) и диметиламинопиридина (0,05 г, 0,376 ммоль) в СН 2 Сl2 (2 мл) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 1 ч, выливают в 10% K2 СО 3, экстрагируют СН 2 Сl2, сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH/NH4OH, 97/3/0,3). Чистые фракции собирают и растворитель выпаривают. Выход: 0,147 г конечного соединения 124 (75%). Пример В 11. Получение конечного соединения 91. Смесь диметил-N-цианодитиоиминокарбоната (1 г; 6,8 ммоль) и изопропиламина (0,6 мл; 6,8 ммоль) в 10 мл ацетонитрила нагревают при кипении с обратным холодильником в течение 5 ч. После охлаждения раствора до -10 С последовательно добавляют конечное соединение 2 (получено по способу B1.b) (3,87 г; 6,8 ммоль) и 3 н. раствор NaOH (2,3 мл; 6,8 ммоль). Смесь перемешивают в течение 5 мин и по каплям добавляют нитрат серебра (1,16 г; 6,8 ммоль) в ацетонитриле (5 мл). Реакционную смесь перемешивают при 0 С в течение 2 ч, затем при комнатной температуре в течение 2 ч. Реакционную смесь фильтруют и остаток промывают ацетонитрилом. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH/NH4OH, 95/5/0,5). Чистые фракции собирают и растворитель выпаривают. Выход: 0,96 г конечного соединения 91 (21%). Пример В 12. Получение конечного соединения 103. Смесь 1,1-бис(метилтио)-2-нитроэтилена (0,30 г; 1,8 ммоль) и изопропиламина (0,16 мл; 1,8 ммоль) в ацетонитриле (5 мл) нагревают при кипении с обратным холодильником в течение ночи. После охлаждения раствора до -10 С последовательно добавляют конечное соединение 2 (получено по способу B1.b)(0,529 г; 0,9 ммоль) и 3 н. раствор гидроксида натрия (0,9 мл; 0,9 ммоль). Смесь перемешивают в течение 5 мин и по каплям добавляют раствор нитрата серебра (0,16 г; 0,9 ммоль) в ацетонитриле (5 мл). Реакционную смесь перемешивают при 0 С в течение 2 ч, затем в течение ночи при комнатной температуре. Раствор фильтруют и остаток промывают ацетонитрилом. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (кромасил, 10 мкм, элюент: СН 2 Сl2/МеОН/NH4 ОН, 96/4/0,1). Чистые фракции собирают и упаривают. Выход: 0,217 г конечного соединения 103 (34%). Пример В 13. а. Получение конечного соединения 83. Промежуточное соединение 6 (получено по способу А 2.b) (0,002 моль, 0,55 г) добавляют порциями к раствору конечного соединения 2 (получено по способу B1.b) (0,002 моль, 1,0 г) в дихлорметане при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 18 ч, промывают 10% K2 СО 3, сушат над MgSO4 и концентрируют. Сырой продукт (1,6 г) очищают колоночной хроматографией на силикагеле (кромасил, 10 мкм, элюент: CH2Cl2/MeOH/NH4OH, 99/1/0,2). Чистые фракции собирают и выпаривают. Выход: 1,19 г конечного соединения 83 (77%).b. Получение конечного соединения 96. Трибромид бора (1M в СН 2 Сl2) (0,009 моль, 5,2 мл) медленно добавляют к раствору конечного соединения 83 (получено по способу В 13.а) (0,001 моль, 0,9 г) в дихлорметане (10 мл) при -70 С в потокеN2. Температуре реакции дают возможность медленно повышаться до -50 С и смесь перемешивают при-50 С в течение 1 ч. Смесь гидролизуют 10% K2 СО 3, экстрагируют дихлорметаном, сушат над MgSO4 и концентрируют. Сырой продукт (0,65 г) очищают колоночной хроматографией на силикагеле (кромасил,10 мкм, градиентный элюент: CH2Cl2/MeOH/NH4OH, от 96/4/0,1 до 92/8/0,5). Чистые фракции собирают и упаривают. Выход: 0,11 г конечного соединения 96 (14%). Пример В 14. а. Получение конечного соединения 93. Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,002 моль, 0,32 г) добавляют порциями к раствору конечного соединения 2 (получено по способу B1.b) (0,002 моль, 1 г), промежуточного соединения 8 (получено по способу А 3.b) (0,002 моль, 0,54 г), 1-гидроксибензотриазола (0,002 моль, 0,28 г) и триэтиламина (0,003 моль, 0,36 мл) в дихлорметане (10 мл) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 18 ч, затем промывают 10% K2 СO3, сушат над MgSO4 и концентрируют. Сырой продукт очищают колоночной хроматографией на силикагеле (кромасил, 10 мкм,элюент: СН 2 Сl2/МеОН/NH4 ОН, 97/3/0,1). Чистые фракции собирают и упаривают. Выход: 1,07 г конечного соединения 93 (65%).b. Получение конечного продукта 98. Применяют такую же процедуру, как описано в примере В 13.b, но вместо конечного соединения 83(получено по способу В 13.а) используют конечное соединение 93 (получено по способу В 14.а). Пример В 15. Получение конечного соединения 3. 3,5-Диметилбензоилхлорид (0,00309 моль) добавляют к раствору конечного соединения 2 (получено по способу B1.b) (0,00257 моль), Et3N первого сорта (0,0035 моль) и N,N-диметил-4-пиридинамина(0,01 г) в СН 2 Сl2 первого сорта (10 мл) при комнатной температуре и смесь перемешивают в течение ночи. Реакционную смесь распределяют между Н 2O и СН 2 Сl2. Отделенный органический слой промывают Н 2O, сушат и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/МеОН, 95/5). Фракции продукта собирают и растворитель выпаривают. Эту фракцию (светложелтое масло) очищают снова колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/МеОН, 98/2).- 22008774 Фракции продукта собирают и растворитель выпаривают. Выход: 1,75 г. Данную фракцию промывают раствором NaOH и Н 2O, затем сушат и растворитель выпаривают. Выход: 1,3 г конечного соединения 3. Пример В 16. Получение конечного соединения 78. ВВr3 (0,005 моль) медленно добавляют при -70 С к раствору конечного соединения 72 (получено по способу В 3) (0,001 моль) в СН 2 Сl2 (10 мл). Реакционную смесь медленно охлаждают до комнатной температуры, затем перемешивают в течение 18 ч. Добавляют воду. Смесь подщелачивают NH4OH и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (0,8 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 97/3/0,1). Чистые фракции собирают и растворитель выпаривают. Выход: 0,497 г конечного соединения 78 (63%). Соединения, примеры которых приведены в следующих табл. 1 и 2, получали способом, аналогичным способам вышеуказанных примеров. Таблица 1
МПК / Метки
МПК: C07D 409/14, C07D 211/58, C07D 401/14, A61P 29/00, C07D 211/96, C07D 513/04, C07D 413/14, C07D 405/14, A61P 25/00, A61K 31/496
Метки: нейрокинина-2, применение, антагонистов, производные, замещенные, качестве, 1-пиперидин-3-ил-4-пиперидин-4-илпиперазина
Код ссылки
<a href="https://eas.patents.su/30-8774-zameshhennye-proizvodnye-1-piperidin-3-il-4-piperidin-4-ilpiperazina-i-ih-primenenie-v-kachestve-antagonistov-nejjrokinina.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 1-пиперидин-3-ил-4-пиперидин-4-илпиперазина и их применение в качестве антагонистов нейрокинина</a>
Предыдущий патент: Способ обнаружения дефектов в листовом стекле
Следующий патент: Ингибиторы протеазы вич для лечения инфекции вич и фармацевтическая композиция
Случайный патент: Новый поверхностный белок haemophilus influenzae (белок e; pe)












