Соединения 1-арил-2-ациламиноэтана и их применение в качестве антагонистов нейрокинина, в частности нейрокинина 1.
Номер патента: 2348
Опубликовано: 25.04.2002
Авторы: Веенстра Сим Якоб, Оберсон Ив, Шиллинг Вальтер, Офнер Сильвио, Фон Шпрехер Андреас, Бетшарт Клаудиа, Гершпахер Марк, Рогго Сильвио, Ма Роберт
Формула / Реферат
1. Соединение формулы I
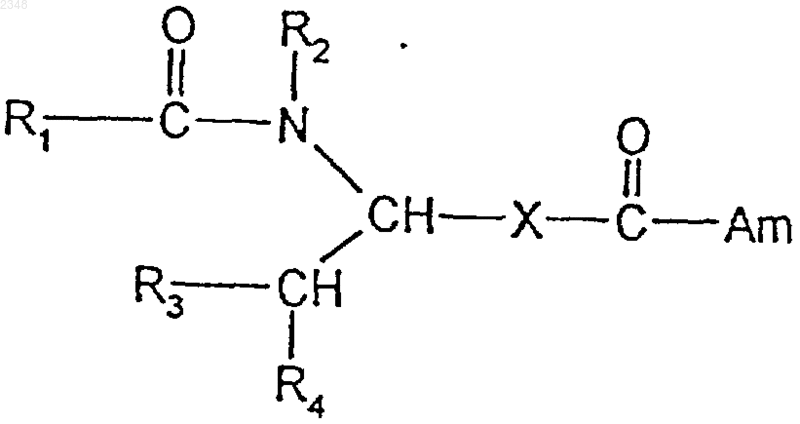
где R1 представляет собой арил или гетероарил;
R2 представляет собой водород, С1-С7алкил или арил-С1-С7алкил;
R3 представляет собой водород, С1-С7алкил, арил или гетероарил;
R4 представляет собой арил или гетероарил;
Х представляет собой С1-С7алкилен, С2-С7алкенилен или С4-С7алкандиенилен; и
Am представляет собой незамещенную или одно- либо двузамещенную аминогруппу, причем подразумевается, что двузамещенная аминогруппа включает в себя также аминогруппу, аминный азот которой входит в состав кольца;
или его соль.
2. Соединение формулы I по п.1, отличающееся тем, что Am представляет собой аминогруппу -NR5R6, в которой R5 представляет собой водород, незамещенный или замещенный С1-С7алкил, незамещенный или замещенный С1-С7алкенил, незамещенный или замещенный С1-С7алкинил, незамещенный или замещенный циклоалкил, незамещенный или замещенный (аза, окса или тиа)-циклоалкил, незамещенный или замещенный бензо-(аза, окса или тиа)-циклоалкил, арил, частично гидратированный гетероарил, гетероарил или (незамещенный или замещенный С1-С7алкил, незамещенный или замещенный С1-С7алкенил, арил или гетероарил)-сульфонил; a R6 представляет собой водород, незамещенный или замещенный С1-С7алкил, незамещенный или замещенный С1-С7алкенил, незамещенный или замещенный С1-С7алкинил, арил, гетероарил или ацил; или
когда радикалы R5 и R6 вместе с аминным азотом образуют кольцо, Am также может представлять собой присоединенный через кольцевой атом азота радикал аза-(циклоалкил, циклоалкенил, циклоалкинил, частично гидратированный гетероарил или гетероарил), который в дополнение к аминному азоту может дополнительно содержать гетероатомы, выбранные из атомов азота, кислорода и серы, и который является незамещенным или замещенным.
3. Соединение формулы I по п.1, отличающееся тем, что
R1 представляет собой фенил или пиридил, каждый из которых не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси, С1-С7алкокси и нитро;
R2 представляет собой водород, С1-С7алкил или фенил-С1-С7алкил, причем фенильная группа не замещена или замещена одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R3 представляет собой водород, С1-С7алкил, фенил, нафтил или индолил, причем каждый из фенила, нафтила и индолила не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R4 представляет собой фенил, нафтил или индолил, причем каждый из этих радикалов не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
Х представляет собой С1-С7алкилен, С2-С7алкенилен или С4-С7алкандиенилен; и
Am представляет собой аминогруппу -NR5R6, в которой
R5 представляет собой арильный радикал, выбранный из группы, содержащей фенил и нафтил, причем арильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из С1-С7алкила, галоген-С1-С7алкила, циклоалкила, галогена, гидрокси, С1-С7алкокси, амино, С1-С7-алкиламино, ди-С1-С7алкиламино, пиперидино, морфолино, тиоморфолино, нитрогруппы, С1-С7алканоила, галоген-С1-С7алканоила, карбокси, алкоксикарбонила, карбамоила, С1-С7алкилкарбамоила, ди-С1-С7-алкилкарбамоила, циано, N-С1-С7алкил-N-фенил-С1-С7алкилкарбамоила и (фенил или пиридил)-С1-С7алкилкарбамоила, где фенильная или пиридильная группа не замещена или замещена С1-С7алкилом, трифторметилом, гидрокси, С1-С7алкокси или галогеном;
арил-С1-С7алкил, арильная группа которого определена таким же образом, как и для арильного радикала R5, и который не замещен или замещен гидрокси в группировке С1-С7алкила;
гетероарильный радикал, выбранный из группы, содержащей пирролил, пиразолил, имидазолил, триазолил, тетразолил, фуранил, тиенил, изоксазолил, оксазолил, оксадиазолил, изотиазолил, тиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил, изоиндолил, бензимидазолил, бензотриазолил, бензофуранил, бензотиенил, бензоксазолил, бензотиазолил, бензопиранил, хинолинил и изохинолинил, причем данный гетероарильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из С1-С7алкила, галоген-С1-С7алкила, галогена, гидрокси, С1-С7алкокси, амино, С1-С7алкиламино, ди-С1-С7алкиламино, нитро, С1-С7-алканоила, галоген-С1-С7алканоила, карбокси, С1-С7алкоксикарбонила, карбамоила, С1-С7алкилкарбамоила, ди-С1-С7алкилкарбамоила, циано, фенила, (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенила и оксо;
гетероарил-С1-С7алкил, гетероарильная группа которого определена таким же образом, как и для гетероарильного радикала R5;
частично гидратированный гетероарильный радикал, выбранный из группы, содержащей дигидропирролил, дигидропиразолил, дигидроимидазолил, дигидрофуранил, дигидротиенил, дигидрооксазолил, дигидротиазолил, дигидропиридил и дигидропиримидинил, причем данный частично гидратированный гетероарильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из С1-С7алкила, галоген-С1-С7алкила, галогена, гидрокси, С1-С7алкокси, амино, С1-С7алкиламино, да-С1-С7-алкиламино, нитро, С1-С7алканоила, галоген-С1-С7алканоила, карбокси, С1-С7-алкоксикарбонила, карбамоила, С1-С7алкилкарбамоила, ди-С1-С7-алкилкарбамоила, циано, фенила, (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенила и оксо;
частично гидратированный гетероарил-С1-С7алкил, частично гидратированная гетероарильная группа которого определена таким же образом, как и для частично гидратированного гетероарильного радикала R5;
С1-С7алкил, который не замещен или замещен радикалами в количестве от 1 до 3, выбранными из карбокси, С1-С7алкоксикарбонила, карбамоила, С1-С7-алкилкарбамоила, ди-С1-С7алкилкарбамоила, циано, амино, С1-С7алкиламино, ди-С1-С7алкиламино, пиперидино, морфолино, тиоморфолино, гидрокси, С1-С7алкокси, галогена, С1-С7алканоила и бензоила;
С3-С7алкенил, который не замещен или замещен карбокси или С1-С7-алкоксикарбонилом;
С3-С7алкинил, который не замещен или замещен карбокси или С1-С7-алкоксикарбонилом;
циклоалкил, который не замещен или замещен С1-С7алкилом, гидрокси, карбокси или С1-С7алкоксикарбонилом;
циклоалкил-С1-С7алкил, циклоалкильная группа которого определена таким же образом, как и для циклоалкила R5;
(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо, С1-С7алкилом, фенил-С1-С7алкилом, (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенил-С1-С7алкилом, карбокси или С1-С7-алкоксикарбонилом;
бензо-(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо по циклоалифатическому кольцу и не замещен или замещен С1-С7 алкилом, трифторметилом, галогеном, гидрокси или С1-С7алкокси по бензольному кольцу;
С1-С7алкилсульфонил;
арилсульфонил, арильная группа которого определена таким же образом, как и для арильного радикала R5;
арил-С1-С7алкилсульфонил, арильная группа которого определена таким же образом, как и для арильного радикала R5;
С1-С7алкенилсульфонил;
арил-С1-С7алкенилсульфонил, арильная группа которого определена таким же образом, как и для арильного радикала R5;
пиридилсульфонил, который не замещен или замещен С1-С7алкилом, трифторметилом, галогеном, гидрокси, С1-С7алкокси, фенил-С1-С7алкокси, (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенил-С1-С7алкокси, фенилокси или (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенилокси;
R6 представляет собой водород, С1-С7алкил, гидрокси-С1-С7алкил, (карбокси, С1-С7алкоксикарбонил, карбамоил, С1-С7алкилкарбамоил, ди-С1-С7алкилкарбамоил или циано)-С1-С7алкил, С3-С7алкенил, С3-С7алкинил, С1-С7алканоил, галоген-С1-С7алканоил, фенил-С1-С7алканоил, который не замещен или замещен С1-С7алкилом, трифторметилом, галогеном, гидрокси или С1-С7алкокси по фенильному кольцу, или бензоил, который не замещен или замещен С1-С7алкилом, трифторметилом, галогеном, гидрокси или С1-С7-алкокси;
или где -NR5R6 представляет собой циклическую аминогруппу, выбранную из
азациклоалкан-1-ила, который не замещен или замещен одним или двумя заместителями, выбранными из С1-С7алкила, гидрокси-С1-С7алкила, циано-С1-С7алкила, С1-С7алкил-(сульфинил или сульфонил)-С1-С7алкила, фенил-С1-С7алкил-(сульфинил или сульфонил)-С1-С7алкила, (С1-С7 алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенил-С1-С7алкил-(сульфинил или сульфонил)-С1-С7алкила, фенил-(сульфинил или сульфонил)-С1-С7алкила, (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7 алкокси)-фенил-(сульфинил или сульфонил)-С1-С7алкила, ди-С1-С7-алкиламино, С1-С7алканоиламино, гидрокси, С1-С7алкокси, карбокси, С1-С7-алкоксикарбонила, карбамоила, С1-С7алкилкарбамоила, ди-С1-С7 алкилкарбамоила, циано, фенила, (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенила и спироиндолона, который не замещен или замещен С1-С7алкилом;
диазациклоалкан-1-ила, который не замещен или замещен фенилом, (С1-С7алкил, трифторметил, галоген, гидрокси или С1-С7алкокси)-фенилом, пиримидинилом, (фенил, С1-С7алкилфенил, трифторметилфенил, галогенфенил, гидроксифенил или С1-С7алкоксифенил)-С1-С7алкилом, (карбокси, С1-С7-алкоксикарбонил, карбамоил, С1-С7алкилкарбамоил, ди-С1-С7алкилкарбамоил или циано)-С1-С7алкилом или (азациклоалкан-1-ил)-карбонил-С1-С7-алкилом;
морфолино;
тиоморфолино; и
азагетероарил-1-ила, выбранного из группы, содержащей пиррол-1-ил, пиразол-1-ил, имидазол-1-ил, триазол-1-ил, тетразол-1-ил, индол-1-ил, бензимидазол-1-ил и бензотриазол-1-ил, причем азагетероарил-1-ильный радикал не замещен или замещен С1-С7алкилом, ди-С1-С7алкиламино-С1-С7-алкилом, циано-С1-С7алкилом, гидрокси, С1-С7алкокси, фенил-С1-С7алкокси, С1-С7алкилтио, С1-С7алканоилом или галогеном;
или его соль.
4. Соединение формулы I по п.1, отличающееся тем, что
R1 представляет собой фенил, который не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R2 представляет собой водород, С1-С7алкил или фенил-С1-С7алкил, фенильная группа которого не замещена или замещена одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R3 представляет собой водород, С1-С7алкил, фенил, нафтил или индолил, причем каждый из фенила, нафтила и индолила не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R4 представляет собой фенил, нафтил или индолил, причем каждый из этих радикалов не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
Х представляет собой С1-С7алкилен или С2-С7алкенилен; и
Аm представляет собой аминогруппу -NR5R6, в которой R5 представляет собой арильный радикал, выбранный из группы, содержащей фенил и нафтил, причем данный арильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из С1-С7алкила, галоген-С1-С7алкила, галогена, гидрокси, С1-С7алкокси, амино, С1-С7 алкиламино, ди-С1-С7алкиламино, пиперидино, морфолино, тиоморфолино, нитро, С1-С7алканоила, галоген -С1-С7алканоила, карбокси, С1-С7алкоксикарбонила, карбамоила, С1-С7алкилкарбамоила, ди-С1-С7алкилкарбамоила и циано;
арил-С1-С7алкил, арильная группа которого определена таким же образом, как и для арильного радикала R5, и который не замещен шыш замещен гидрокси в группировке С1-С7алкила;
гетероарильный радикал, выбранный из группы, содержащей пирролил, пиразолил, имидазолил, триазолил, тетразолил, фуранил, тиенил, изоксазолил, оксазолил, оксадиазолил, изотиазолил, тиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил, изоиндолил, бензимидазолил, бензотриазолил, бензофуранил, бензотиенил, бензоксазолил, бензотиазолил, хинолинил и изохинолинил, причем данный гетероарильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из С1-С7-алкила, галоген- С1-С7-алкила, галогена, гидрокси, С1-С7-алкокси, амино, С1-С7алкиламино, ди-С1-С7алкиламино, нитро, С1-С7-алканоила, галоген-С1-С7алканоила, карбокси, С1-С7алкоксикарбонила, карбамоила, низшего алкилкарбамоила, ди-С1-С7алкилкарбамоила и циано;
гетероарил низший алкил, гетероарильная группа которого определена таким же образом, как и для гетероарильного радикала R5;
С1-С7алкил, который не замещен или замещен радикалами в количестве от 1 до 3, выбранными из карбокси, С1-С7алкоксикарбонила, карбамоила, C1-С7-алкилкарбамоила, ди-С1-С7алкилкарбамоила, циано, амино, С1-С7алкиламино, ди-С1-С7алкиламино, пиперидино, морфолино, тиоморфолино, гидрокси, С1-С7-алкокси, галогена, С1-С7алканоила и бензоила;
С3-С7алкенил, который не замещен или замещен карбокси или C1-С7-алкоксикарбонилом;
С3-С7алкинил, который не замещен или замещен карбокси или С1-С7-алкоксикарбонилом;
циклоалкил, который не замещен или замещен С1-С7алкилом, гидрокси, карбокси или С1-С7алкоксикарбонилом;
циклоалкил-С1-С7алкил, циклоалкильная группа которого определена таким же образом, как и для циклоалкила R5;
(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо; или
арилсульфонил, арильная группа которого определена таким же образом, как и для арильного радикала R5;
R6 представляет собой водород, С1-С7алкил, гидрокси-С1-С7алкил, (карбокси, С1-С7алкоксикарбонил, карбамоил, С1-С7алкилкарбамоил, ди-С1-С7алкилкарбамоил или циано)-С1-С7алкил, С3-С7алкенил или С3-С7алкинил;
или где -NR5R6 представляет собой циклическую аминогруппу, выбранную из
азациклоалкан-1-ила, который не замещен или замещен одним или двумя заместителями, выбранными из С1-С7алкила, гидрокси-С1-С7алкила, циано-С1-С7алкила, ди-С1-С7алкиламино, С1-С7алканоиламино, гидрокси, С1-С7алкокси, фенила и (С1-С7алкил, трифторметил, галоген, гидрокси или C1-С7-алкокси)-фенила;
диазациклоалкан-1-ила, который не замещен или замещен фенилом, (С1-С7алкил, трифторметил, галоген, гидрокси или C1-С7алкокси)-фенилом, (фенил, С1-С7алкилфенил, трифторметилфенил, галогенфенил, гидроксифенил или С1-С7алкоксифенил)-С1-С7алкилом, (карбокси, С1-С7алкоксикарбонил, карбамоил, С1-С7алкилкарбамоил, ди-С1-С7алкилкарбамоил или циано)-С1-С7-алкилом или (азациклоалкан-1-ил)-карбонил-С1-С7алкилом;
морфолино;
тиоморфолино; и
азагетероарил-1-ила, выбранного из группы, содержащей пиррол-1-ил, пиразол-1-ил, имидазол-1-ил, триазол-1-ил, тетразол-1-ил, индол-1-ил, бензимидазол-1-ил и бензотриазол-1-ил, причем азагетероарил-1-ильный радикал не замещен или замещен С1-С7алкилом, ди-С1-С7алкиламино-С1-С7-алкилом, циано-С1-С7алкилом, гидрокси, С1-С7алкокси, фенил-С1-С7-алкокси, С1-С7алкилтио, С1-С7алканоилом или галогеном;
или его соль.
5. Соединение формулы I по п.1, отличающееся тем, что R1 представляет собой фенил, который не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси, С1-С7алкокси и нитро, или R1 представляет собой пиридил;
R2 представляет собой водород или С1-С7алкил;
R3 представляет собой водород, C1-С7алкил, фенил или нафтил, причем каждый из фенила и нафтила не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R4 представляет собой фенил, нафтил или индолил, причем каждый из этих радикалов не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
Х представляет собой С1-С4алкилен или С2-С4алкенилен; и
Am представляет собой аминогруппу -NR5R6, в которой R5 представляет собой арильный радикал, выбранный из группы, содержащей фенил и нафтил, причем данный арильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из С1-С7алкила, циклоалкила, галогена, гидрокси, С1-С7алкокси, ди-С1-С7алкиламино, морфолино, нитро и С1-С7алкоксикарбонила;
арил-С1-С7алкил, в котором арил выбран из группы, содержащей фенил, нафтил и индолил, и который не замещен или замещен в арильной группировке одним или двумя радикалами, выбранными из гидрокси, С1-С7алкокси, галогена и амино, и не замещен или замещен гидрокси в группировке С1-С7алкила;
гетероарильный радикал, выбранный из группы, содержащей пиридил, хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил, причем данный гетероарильный радикал не замещен или замещен одним или двумя радикалами, выбранными из С1-С7алкила, галогена и галоген-С1-С7-алканоила;
дигидропиразолил, который замещен оксо и который дополнительно не замещен или замещен одним, двумя или тремя заместителями, выбранными из C1-С7алкила и фенила;
гетероарил-С1-С7алкил, в котором гетероарил выбран из группы, содержащей пиридил, хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил;
бензопиранон-С1-С7алкил;
С1-С7алкил, который не замещен или замещен С1-С7алкоксикарбонилом, карбамоилом, С1-С7алкилкарбамоилом, циано, ди-С1-С7алкиламино, пиперидино, морфолино, гидрокси или бензоилом;
С3-С7алкенил;
С3-С7алкинил;
циклоалкил, который не замещен или замещен гидрокси;
циклоалкил-С1-С7алкил, который не замещен или замещен С1-С7-алкоксикарбонилом в циклоалкильной группировке;
(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо, С1-С7алкиыюь, фенил-С1-С7алкилом или С1-С7алкоксикарбонилом;
бензо-(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо;
С1-С7алкилсульфонил;
фенил-С1-С7алкилсульфонил, фенильное кольцо которого не замещено или замещено С1-С7алкоксикарбонилом;
С1-С7алкенилсульфонил, который не замещен или замещен фенилом или галогенфенилом;
фенилсульфонил, который не замещен или замещен С1-С7алкилом, C1-С7алкокси, С1-С7алкоксикарбонилом, карбамоилом, С1-С7алкилкарбамоилом, ди-С1-С7алкилкарбамоилом, N-C1-С7алкил-N-фенил-С1-С7алкилкарбамоилом, (фенил или С1-С7алкоксифенил)-С1-С7алкилкарбамоилом или пиридил-С1-С7алкилкарбамоилом; или
пиридилсульфонил, который не замещен или замещен фенилокси;
R6 представляет собой водород, С1-С7алкил, гидрокси-С1-С7алкил, циано-С1-С7алкил или С1-С7алкенил;
или где -NR5R6 представляет собой циклическую аминогруппу, выбранную из
пиперидино, который не замещен или замещен одним или двумя заместителями, выбранными из С1-С7алканоиламино, фенила, С1-С7алкила, гидрокси-С1-С7алкила, ди-С1-С7алкиламино, гидрокси, С1-С7алкокси, карбамоила, фенилсульфинил-С1-С7алкила или спироиндолона, который не замещен или замещен С1-С7алкилом;
азокано;
азиридино, который не замещен или замещен С1-С7алкилом;
пиперазино, который не замещен или замещен фенилом, С1-С7алкоксифенилом, пиримидинилом, галогенфенил-С1-С7алкилом или (азациклоалкан-1-ил)-карбонил-С1-С7алкилом;
морфолино;
индол-1-ила, который не замещен или замещен С1-С7алкилом, С1-С7-алканоилом, ди-С1-С7алкиламино-С1-С7алкилом или фенил-С1-С7алкокси;
бензимидазол-1-ила, который не замещен или замещен C1-С7алкилтио или циано -С1-С7алкилом;
имидазол-1-ила, который не замещен или замещен C1-С7алкилом;
1,2,4-триазол-1-ила; и
бензотриазол-1-ила;
или его фармацевтически приемлемая соль.
6. Соединение формулы I по п.1, отличающееся тем, что
R1 представляет собой фенил, который не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R2 представляет собой водород или С1-С7алкил;
R3 представляет собой водород, С1-С7алкил, фенил или нафтил, причем каждый из фенила и нафтила не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
R4 представляет собой фенил, нафтил или индолил, причем каждый из этих радикалов не замещен или замещен одним или двумя заместителями, выбранными из группы, содержащей С1-С7алкил, трифторметил, галоген, гидрокси и С1-С7алкокси;
Х представляет собой С1-С4алкилен или С2-С4алкенилен; и
Am представляет собой аминогруппу -NR5R6, в которой
R5 представляет собой арильный радикал, выбранный из группы, содержащей фенил и нафтил, причем данный арильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из С1-С7алкила, галогена, гидроксила, С1-С7алкокси, ди-С1-С7алкиламино, морфолино, нитро и C1-С7алкоксикарбонила;
арил-С1-С7алкил, в котором арил выбран из группы, содержащей фенил, нафтил и индолил, и который не замещен или замещен в арильной группировке одним или двумя радикалами, выбранными из гидрокси, С1-С7алкокси и галогена, и не замещен или замещен гидрокси в группировке С1-С7алкила;
гетероарильный радикал, выбранный из группы, содержащей пиридил, хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил, причем данный гетероарильный радикал не замещен или замещен одним или двумя радикалами, выбранными из алкила, галогена и галоген-С1-С7алканоила;
гетероарил-С1-С7алкил, в котором гетероарил выбран из группы, содержащей пиридил, хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил;
С1-С7алкил, который не замещен или замещен С1-С7алкоксикарбонилом, карбамоилом, циано, ди-С1-С7алкиламино, пиперидино, морфолино, гидрокси или бензоилом;
С3-С7алкенил;
С3-С7алкинил;
циклоалкил, который не замещен или замещен гидрокси;
циклоалкил-С1-С7алкил, который не замещен или замещен С1-С7-алкоксикарбонилом в циклоалкильной группировке;
(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо;
или
(фенил или С1-С7алкилфенил)-сульфонил;
R6 представляет собой водород, С1-С7алкил, гидрокси-С1-С7алкил, циано-С1-С7алкил или С3-С7алкенил;
или где -NR5R6 представляет собой циклическую аминогруппу, выбранную из
пиперидино, который не замещен или замещен одним или двумя заместителями, выбранными из С1-С7алканоиламино, фенила, С1-С7алкила, гидрокси-С1-С7алкила, ди-С1-С7алкиламино и гидрокси;
азокано;
азиридино, который не замещен или замещен С1-С7алкилом;
пиперазино, который не замещен или замещен фенилом, C1-С7алкоксифенилом, галогенфенил-С1-С7алкилом или (азациклоалкан-1-ил)-карбонил-С1-С7алкилом;
морфолино;
индол-1-ила, который не замещен или замещен С1-С7алкилом, C1-С7-алканоилом, ди-С1-С7алкиламино-С1-С7алкилом или фенил-С1-С7алкокси;
бензимидазол-1-ила, который не замещен или замещен С1-С7алкилтио или циано-С1-С7алкилом;
имидазол-1-ила, который не замещен или замещен С1-С7алкилом;
1,2,4-триазол-1-ила; и
бензотриазол-1-ила;
или его фармацевтически приемлемая соль.
7. Соединение формулы I по п.1, отличающееся тем, что R1 представляет собой 3,5-бистрифторметилфенил; R2 представляет собой метил, группа -СНR3R4 представляет собой бензил, 4-хлорбензил, 2-нафтилметил, дифенилметил, 1H-индол-3-илметил или 1-метилиндол-3-илметил; Х представляет собой 1,2-этилен или 1,2-этенилен, a Am представляет собой аминогруппу -NR5R6, в которой R5 представляет собой пиридил-С1-С4алкил, С1-С7алкил, незамещенный или замещенный гидрокси; циклоалкил, имеющий от 5 до 7 кольцевых углеродных атомов; (аза, окса или тиа)-циклоалкил, имеющий от 5 до 7 кольцевых атомов, включая гетероатом(ы), и незамещенный или замещенэыщ оксо; бензо(аза, окса или тиа)-циклоалкил, имеющий от 5 до 7 кольцевых атомов, включая гетероатом(ы), в гетероциклическом кольце, и незамещенный или замещенный оксо; a R6 представляет собой водород или С1-С7алкил;
или его фармацевтически приемлемая соль.
8. N-(3-Метоксибензил)амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пент-2-еновой кислоты по п.1 или его фармацевтически приемлемая соль.
9. N-Циклогексил-N-изопропиламид 3-[N'-(3,5-бистрифторметилбензоил)-N'-метиламинo]-4-(1Н-индол-3-ил)бутановой кислоты по п.1 или его фармацевтически приемлемая соль.
10. N-[2-(2-Пиридил)этил]амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пент-2-еновой кислоты по п.1 или его фармацевтически приемлемая соль.
11. N-(1-Нафтилметил)амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(1-метилиндол-3-ил)пентановой кислоты по п.1 или его фармацевтически приемлемая соль.
12. N-(D,L-Эпсилон-капролактам-3-ил)амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пент-2-еновой кислоты по п.1 или его фармацевтически приемлемая соль.
13. N-Циклогексиламид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)-амино]-5-(4-хлорфенил)-2-метилпент-2-еновой кислоты по п.1 или его фармацевтически приемлемая соль.
14. N-Циклогексиламид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)-амино]-5-(нафт-2-ил)пент-2-еновой кислоты по п.1 или его фармацевтически приемлемая соль.
15. Фармацевтический состав, содержащий соединение по любому из пп.1-14 и, по меньшей мере, один фармацевтически приемлемый носитель.
16. Применение соединения формулы I в качестве антагониста нейрокинина для лечения заболеваний, зависимых от влияния антагонистов на NK1-рецепторы.
17. Применение по п.16, в котором заболевание представляет собой заболевание дыхательных путей или желудочно-кишечного тракта.
18. Применение по п.17, в котором заболеванием является астма или хронические бронхиты.
19. Способ получения соединения формулы I по п.1, заключающийся в том, что соединение формулы II
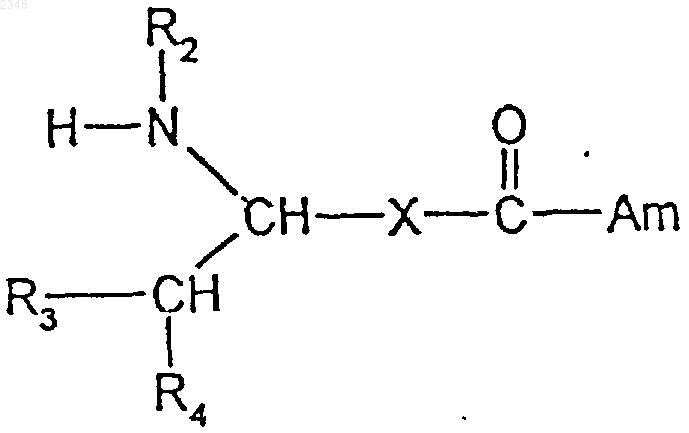
подвергают N-ацилированию карбоновой кислотой формулы R1-C(=О)-OH или ее реакционноспособным производным с последующим, в случае необходимости, превращением свободного соединения в его соль, или обратно в свободное соединение, или в другую соль и/или разделением полученной смеси стереоизомеров, диастереоизомеров или энантиомеров на индивидуальные стереоизомеры, диастереоизомеры или энантиомеры.
20. Способ получения соединений формулы I по п.1, заключающийся в том, что карбоновую кислоту формулы III или ее реакционноспособное производное подвергают конденсации с аммиаком либо с одно- или двузамещенным амином с последующим, в случае необходимости, превращением свободного соединения в его соль, или обратно в свободное соединение, или в другую соль и/или разделением полученной смеси стереоизомеров, диастереоизомеров или энантиомеров на индивидуальные стереоизомеры, диастереоизомеры или энантиомеры.
21. Способ получения соединений формулы I по п.1, где Х представляет собой С2-С7алкенилен или С4-С7алкандиенилен, заключающийся в удалении аминозащитной группы Рr в соединении формулы (Va)

где R2, R3 и R4 имеют значения, указанные в п.1, с последующим N-ацилированием полученного соединения карбоновой кислотой R1-COOH или ее реакционноспособным производным и обработкой полученного N-ацилированного продукта в условиях реакции Виттига или ее варианта, с последующим в случае необходимости превращением свободного соединения в его соль, или обратно в свободное соединение, или в другую соль и/или разделением полученной смеси стереоизомеров, диастереоизомеров или энантиомеров на индивидуальные стереоизомеры, диастереоизомеры или энантиомеры.
Евразийский патент действует на территории всех Договаривающихся государств, кроме AM и MD.
Текст
1 Данное изобретение относится к соединениям формулы I где R1 представляет собой арил или гетероарил;R2 представляет собой водород, низший алкил или арил-низший алкил;R4 представляет собой арил или гетероарил; Х представляет собой С 1-С 7 алкилен, С 2 С 7 алкенилен или С 4-С 7 алкандиенилен; иAm представляет собой незамещенную или одно- либо двузамещенную аминогруппу, причем под двузамещенной аминогруппой также понимается аминогруппа, аминный азот которой входит в состав кольца; и их солям, к способам получения этих соединений, фармацевтическим составам, содержащим эти соединения, и к применению этих соединений для терапевтического лечения человека и животного или при производстве фармацевтических составов. Основные термины, использованные здесь ранее и далее, в пределах объема данной заявки предпочтительно имеют следующие значения. Как уже отмечалось, под двузамещенной аминогруппой Am следует также понимать и аминогруппу, аминный азот которой входит в состав кольца. Данное кольцо может быть, например, насыщенным, частично ненасыщенным или ароматическим кольцом. Подобное кольцо содержит (включая аминный азот) предпочтительно от 3 до 8 членов. Помимо аминного азота кольцо может содержать также и гетероатомы,например атомы азота, кислорода и/или серы, и быть незамещенным или замещенным. Аm главным образом представляет собой аминогруппу -NR5R6, в которой R5 является водородом, незамещенным или замещенным низшим алкилом, незамещенным или замещенным низшим алкенилом, незамещенным или замещенным низшим алкинилом, незамещенным или замещенным циклоалкилом, незамещенным или замещенным (аза, окса или тиа-)циклоалкилом, незамещенным или замещенным бензо-(аза, окса или тиа)-циклоалкилом, арилом,частично гидратированным гетероарилом, гетероарилом или (незамещенный или замещенный низший алкил, незамещенный или замещенный низший алкенил, арил или гетероарил)сульфонилом; a R6 представляет собой водород,незамещенный или замещенный низший алкил,незамещенный или замещенный низший алкенил, незамещенный или замещенный низший алкинил, арил, гетероарил или ацил; или, 002348 2 когда радикалы R5 и R6 вместе с аминным азотом образуют кольцо, Am также может представлять собой присоединенный через кольцевой атом азота радикал аза-(циклоалкил, циклоалкенил, циклоалкинил, частично гидратированный гетероарил или гетероарил), который помимо аминного азота может также содержать гетероатомы, выбранные из атомов азота, кислорода и серы, и быть незамещенным или замещенным. Термин "низший" относится к радикалу,имеющему до 7 включительно, и в особенности до 4 включительно атомов углерода. Низший алкил представляет собой, например, н-пропил, изопропил, н-бутил, изобутил,втор-бутил, трет-бутил, н-пентил, неопентил, нгексил или н-гептил, предпочтительно этил или метил. Замещенный низший алкил следует понимать как низший алкил, который замещен один или несколько раз, главным образом от 1 до 3 раз, необходимым заместителем(ями). Заместители, которые могут быть упомянуты в качестве примера, представляют собой: арил, частично гидратированный гетероарил, гетероарил, циклоалкил, (аза, окса или тиа)-циклоалкил, бензо(аза, окса или тиа)-циклоалкил, карбокси, низший алкоксикарбонил, карбамоил, низший алкилкарбамоил, динизший алкилкарбамоил, циано, амино, низший алкиламино, динизший алкиламино, пиперидино, морфолино, тиоморфолино, гидрокси, низший алкокси, галоген, низший алканоил или бензоил. Замещенный низший алкенил следует понимать как низший алкенил, который замещен один или несколько раз, главным образом один раз, необходимым заместителем(ями). Заместители, которые можно упомянуть в качестве примера, представляют собой: арил, гетероарил,карбоксил и низший алкоксикарбонил. Замещенный низший алкинил следует понимать как низший алкинил, который замещен один или несколько раз, главным образом один раз, необходимым заместителем(ями). Заместители, которые можно упомянуть в качестве примера, представляют собой: арил, гетероарил,карбоксил и низший алкоксикарбонил. Галоген представляет собой, например,хлор, бром или фтор, но может также быть и иодом. Ацил представляет собой, например, низший алканоил, замещенный низший алканоил, в частности галогено-низший алканоил, арилкарбонил, арилнизший алканоил, гетероарилкарбонил или гетероарил(низший алканоил), а главным образом, ацил представляет собой низший алканоил. Низшим алканоилом, например, является ацетил, пропионил или пивалоил, но может быть также, в частности, и формил. Карбамоил представляет собой -CONH2. Оксогруппа представляет собой группу =O. 3 Арил представляет собой, к примеру, фенил или нафтил, каждый из которых не замещен или замещен, как указано ниже, в частности, для фенила. Предпочтительно арил представляет собой фенил, незамещенный или замещенный одним или несколькими (в особенности от 1 до 3) заместителями из группы, содержащей галоген, низший алкил, галоген-низший алкил, (гидрокси или низший алканоилокси)-низший алкил, низший алкокси-низший алкил, (амино или низший алканоиламино)-низший алкил, низший алкиламино-низший алкил, динизший алкиламино-низший алкил,(пиперидинил,пиперазинил, морфолинил или тиоморфолинил)низший алкил, (имидазолил или пиридил)низший алкил, меркапто-низший алкил, низший алкил-(тио, сульфинил или сульфонил)-низший алкил, карбокси-низший алкил, низший алкоксикарбонил-низший алкил, карбамоил-низший алкил, низший алкилкарбамоил-низший алкил,динизший алкилкарбамоил-низший алкил, низший алкенил, низший алкинил, циклоалкил,(гидрокси или низший алкил)-циклоалкил, циклоалкил-низший алкил, фенил, гидрокси, низший алкокси, фенил-низший алкокси, низший алканоилоксил, С 1-С 3 алкилендиоксил, фенилнизший алкокси, карбокси-низший алкокси,низший алкоксикарбонил-низший алкокси, карбамоил-низший алкокси, низший алкилкарбамоил-низший алкокси, динизший алкилкарбаноил-низший алкокси, низший алкенилокси,амино, низший алкиламино, динизший алкиламино, низший алканоиламино, пиперидинил,пиперазинил, морфолинил, тиоморфолинил,меркапто, низший алкил-(тио, сульфинил или сульфонил), карбокси-низший алкилтио, низший алкоксикарбонил-низший алкилтио, фенилтио, фенил-низший алкилтио, карбокси,низший алкоксикарбонил, карбамоил, низший алкилкарбамоил, динизший алкилкарбамоил,циано, нитро, низший алканоил, галогенонизший алканоил и бензоил. Фенильные и бензоильные группы, содержащиеся в вышеприведенном списке фенильных заместителей, предпочтительно являются незамещенными, но могут быть также и замещенными, например, 1 или 2 заместителями, выбранными из группы,содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси. Пиперазинильные группы, содержащиеся в вышеприведенном списке фенильных заместителей, предпочтительно являются незамещенными, но могут быть также и замещенными, например, по атому азота, низшим алкилом, фенил-низшим алкилом, фенилом или низшим алканоилом. В частности, арил представляет собой фенил, незамещенный или замещенный 1 или 2 заместителями, выбранными из низшего алкила, трифторметила, галогена, гидрокси и низшего алкокси. Гетероарил представляет собой, например,5- или 6-членный моноциклический ароматиче 002348 4 ский гетероцикл или бицикл, составленный из 5- или 6-членного моноциклического ароматического гетероцикла и конденсированного бензольного кольца, и является, например, пирролилом, пиразолилом, имидазолилом, триазолилом, тетразолилом, фуранилом, тиенилом, изоксазолилом, оксазолилом, оксадиазолилом, изотиазолилом, тиазолилом, тиадиазолилом, пиридилом, пиридазинилом, пиримидинилом, пиразинилом, триазинилом, индолилом, изоиндолилом, бензимидазолилом, бензотриазолилом,бензофуранилом, бензотиенилом, бензоксазолилом, бензотиазолилом, хинолинилом или изохинолинилом. Гетероарильные радикалы являются незамещенными или замещенными, например одним или несколькими (в особенности от 1 до 3) заместителями, выбранными из группы, содержащей низший алкил, галоген-низший алкил, галоген, гидрокси, низший алкокси, амино,низший алкиламино, динизший алкиламино,нитро, низший алканоил, галоген-низший алканоил, карбокси, низший алкоксикарбонил, карбамоил, низший алкил-карбамоил, динизший алкилкарбамоил и циано. Частично гидратированный гетероарил представляет собой, например, определенный выше гетероарильный радикал, содержащий, по меньшей мере, одну гидратированную двойную связь. Это, например, дигидропирролил, дигидропиразолил,дигидроимидазолил,дигидрофуранил, дигидротиенил, дигидрооксазолил, дигидротиазолил, дигидропиридил или дигидропиримидинил. Частично гидратированный гетероарильный радикал может являться незамещенным или замещенным, например от 1 до 5, в особенности от 1 до 3, радикалами, выбранными, в частности, из низшего алкила, галогеннизшего алкила, галогена, гидрокси, низшего алкокси, амино, низшего алкиламино, динизшего алкиламино, нитро, низшего алканоила, галоген-низшего алканоила, карбокси, низшего алкокси-карбонила, карбамоила, низшего алкилкарбамоила, динизшего алкилкарбамоила, циано, фенила, низшего алкила, трифторметила,галогена, гидрокси или низшего алкоксифенила и оксо. С 1-С 7 алкилен представляет собой, в частности, неразветвленный С 1-С 7 алкилен, например, 1,2-этилен, 1,3-пропилен или 1,4-бутилен,но может быть также и разветвленным, например, 1,1-этилен, 1,2-пропилен или 1,2- либо 1,3 бутилен. Главным образом, С 1-С 7 алкилен представляет собой 1,2-этилен, 1,3-пропилен или 1,2-пропилен. С 2-С 7 алкенилен представляет собой, в частности, неразветвленный С 2-С 7 алкенилен, например 1,2-этенилен, 1,3-пропенилен или 1,4 бутенилен, но может быть также и разветвленным, например 1,2-пропенилен или 1,3 бутенилен. Главным образом, С 2-С 7-алкенилен представляет собой 1,2-этенилен или 1,2 пропенилен и в особенности 1,2-этенилен. 5 С 4-С 7 алкандиенилен предпочтительно представляет собой неразветвленный С 4 С 7 алкандиенилен, например 1,4-бутадиенилен или 1,5-пентадиенилен, но может быть также и разветвленным, например 1,4-пентадиенилен. Главным образом, С 4-С 7 алкандиенилен представляет собой 1,4-бутадиенилен. Галоген-низший алкил представляет собой,например, галогенметил, в частности хлорметил или трифторметил. Главным образом галогеннизший алкил представляет собой трифторметил. Галоген-низший алканоил представляет собой, например, трифторацетил. Низший алкенил представляет собой, например, этенил (=винил), аллил, 1-пропенил,изопропенил, 2- или 3-метилаллил либо 3 бутенил. Низший алкинил представляет собой, например, этинил, пропаргил или 2-бутинил. Каждый из С 3-С 7 алкенила и С 3 С 7 алкинила, обозначенных как R5 и R6, предпочтительно связан с амидным азотом через sp3 углерод и представляет собой в таком случае,например аллил, 2-метилаллил или пропаргил,соответственно. Циклоалкил содержит, например от 3 до 8,предпочтительно от 3 до 7 атомов углерода и представляет собой, в частности, циклопропил,циклобутил, циклопентил, циклогексил или циклогептил."С 5-С 7 циклоалкил","С 3 С 8 циклоалкил" и т.д. обозначают циклоалкильный радикал, имеющий указанное число атомов углерода в кольце. Циклоалкил предпочтительно является незамещенным, но может быть также и замещенным, например заместителями,приведенными выше для низшего алкила, или в особом варианте, одним или двумя заместителями, выбранными из низшего алкила, трифторметила, галогена, гидрокси и низшего алкокси.(Аза, окса или тиа)циклоалкил может содержать, например, один или два, в особенности один, гетероатом(а). Он содержит, например, от 3 до 8, предпочтительно от 5 до 7, атомов в кольце, включая гетероатом(ы). Примерами незамещенного или замещенного (аза, окса или тиа)циклоалкила являются пирролидин-(2 или 3)-ил, тетрагидрофуран-(2 или 3)-ил, тетрагидротиен-(2 или 3)-ил, пиперидин-(2,3 или 4)-ил,1-фенил(низший алкил)-4-(низший алкокси) карбонил-пиперидин-4-ил, морфолин-(2 или 3)ил, тиоморфолин-(2 или 3)-ил, пиперазин-2- -ил,азациклогептан-2-он-3-ил, тетрагидрофуран-2 он-3-ил или тетрагидротиен-2-он-3-ил (=тиолан 2-он-3-ил). В частности, (аза, окса или тиа)циклоалкил представляет собой азациклогептан 2-он-3-ил (=гексагидроазепин-2-он-3-ил). Бензо(аза, окса или тиа)-циклоалкил представляет собой, к примеру (аза, окса или тиа)циклоалкильный радикал, определенный выше,который помимо этого содержит, например од 002348 6 но или два, предпочтительно одно, конденсированное бензольное кольцо(а), которое, в свою очередь, может быть незамещенным или замещенным, как в частности приведено выше для арильных радикалов. В частности бензо-(аза,окса или тиа)-циклоалкил представляет собой 1,3,4,5-тетрагидробензоазепин-2-он-3-ил. Азациклоалкан-1-ил представляет собой,например, азиридино, пирролидино, пиперидино, гексагидро-1 Н-азепино-(7-членное кольцо) или азокано(8-членное кольцо). Азациклоалкан-1-ил, замещенный спироиндолоном, который незамещен или замещен низшим алкилом, представляет собой, в частности, 1-метил-спиро(индол-2-он-3,4'-пиперидино). Аза(циклоалкильный, циклоалкенильный или циклоалкинильный) радикал, связанный через атом азота в кольце, представляет собой главным образом азациклоалкан-1-ил (см. выше) или азациклоалкен-1-ил, например 2,5 дигидро-1 Н-пиррол-1-ил, но может также быть азациклоалкин-1-илом. Диазациклоалкан-1-ил представляет собой,например, пиперазино. Азагетероарил-1-ил представляет собой,например, пиррол-1-ил, пиразол-1-ил, имидазол 1-ил, триазол-1-ил, тетразол-1-ил, индол-1-ил,бензимидазол-1-ил или бензотриазол-1-ил. Соли соединений формулы I главный образом представляют собой фармацевтически приемлемые соли. Соединения формулы I,имеющие основную группу, в частности аминогруппу, могут, например, образовывать соли,полученные присоединением минеральных кислот, таких как галоидоводородные кислоты,серная кислота и фосфорная кислота, например гидрохлориды, гидробромиды, сульфаты, гидросульфаты или фосфаты; соли с соответствующими алифатическими или ароматическими сульфоновыми кислотами или N-замещенными сульфаминовыми кислотами, например метансульфонаты, бензолсульфонаты, п-толуолсульфонаты или N-циклогексилсульфаматы (цикламаты); или соли сильных органических карбоновых кислот, а именно низший алканкарбоновыми кислотами или насыщенными, либо ненасыщенными, либо гидроксилированными алифатическими дикарбоновыми кислотами, например ацетаты, оксалаты, малонаты, малеинаты, фумараты, малеаты, тартраты или цитраты. В тех случаях, когда соединения формулыI содержат кислотную группу, возможно образование соответствующих солей с основаниями,в частности солей соответствующих щелочных металлов или щелочно-земельных металлов,например солей натрия, калия или магния; фармацевтически приемлемых солей переходных металлов, типа солей цинка или меди; или солей аммония либо органических аминов, типа циклических аминов, типа моно-, ди- или три 7 низший алкиламинов, таких как гидроксинизший алкиламинов, например моно-, ди- или тригидрокси-низший алкиламинов, гидроксинизший алкил-низший алкиламинов или полигидрокси-низший алкиламинов. Примерами циклических аминов являются морфолин, тиоморфолин, пиперидин или пирролидин. В качестве мононизший алкиламинов понимаются,например, этиламин и трет-бутиламин; в качестве динизший алкиламинов, например диэтиламин и диизопропиламин; и в качестве тринизший алкиламинов - например триметиламин и триэтиламин. Примерами соответствующих гидрокси-низший алкиламинов являются, например, моно-, ди- и триэтаноламины; а примерами гидрокси-низший алкил-низший алкиламинов являются, например N,N-диметиламинои N,N-диэтиламиноэтанол. Соединения формулы I, имеющие кислотную группу, в частности карбоксино, и основную группу, в частности амино, могут существовать также, например, в форме внутренних солей, в так называемой форме цвиттер-иона, или одна часть молекулы может быть в форме внутренней соли, а другая часть - в форме обычной соли. Непредназначенные для фармацевтического применения соли также включаются, поскольку их можно использовать, например при выделении и очистке свободного соединения I и его фармацевтически приемлемых солей. Соединения формулы I, включая их фармацевтически приемлемые соли, которые также включены ниже, обладают полезными фармакологическими свойствами. В частности, они действуют как антагонисты нейрокинина-1 (NK1 антагонисты) и поэтому способны предупреждать симптомы заболевания, вызываемого inter(=NKA). В дыхательных путях располагаются чувствительные нервы, которые содержат ряд нейропептидов, в частности тахикининов и CGRP(=пептид, связанный с геном кальцитонина). Активация чувствительных нервов приводит к локальному высвобождению нейропептидов внутри легких. В особенности секретируются субстанция Р и нейрокинин А, которые запускают острую воспалительную реакцию, называемую нейрогенным воспалением. Такая воспалительная реакция осуществляется в основном через активацию NK1-peцептора и включает главным образом вазодилатацию, капиллярное истечение, рекруитмент воспалительных лейкоцитов и избыточное выделение слизи, а также бронхостеноз [главным образом через активацию рецептора нейрокинина 2 (NK2 рецептора)]. Такое воздействие тахикинина является характерной особенностью астмы. Фармакологическое действие соединений формулы I основывается главным образом на антагонизации NK1-рецептора и, в случае некоторых соединений формулы I, дополнительно на 8 антагонизации также и NK2-рецептора. Следовательно, соединения формулы I способны к ингибированию нейрогенных воспалений и индуцированного тахикинином бронхостеноза. Преимущественное действие соединений формулы I может быть продемонстрировано с помощью различных тест-методов in vivo или invitro. Например in vitro они ингибируют выброс Са 2+-ионов, индуцированный [бета-Аla8]NKA(410), в яичниковых клетках подвергшихся трансфекции китайских хомячков, которые экспрессируют рецепторы рекомбинантного человеческого нейрокинина 2, со значениями ИК 50, приблизительно равными 1 мкМ. Вдобавок они оказываются эффективны, например in vivo в тесте на NK-1 бронхоспазм у морских свинок со значениями ЭД 50, составляющими приблизительно 0,05-1 мг/кг п.о., причем тестируемые соединения даются за 2, 4 и 24 ч до внутривенного введения 3,0 мкг/кг [Sar9,Met(02)11]-субстанции Р[=SarSP]. Введение SarSP индуцирует повышение внутритрахеального давления у морских свинок. Кроме того, некоторые из соединений формулы I также эффективны in vivo в тесте наNK-2 бронхоспазм у морских свинок со значениями ЭД 50, составляющими приблизительно 1 мг/кг п.о. В этом случае повышение внутритрахеального давления индуцируют путем введения 0,8 мкг/кг [бета-Аlа 8]NКА(4-10), причем тестируемые соединения даются, например за 2 ч до указанного введения. Соединения формулы I в особенности эффективны в качестве антагонистов NK1 рецепторов. Воздействие их на данный класс рецепторов, воздействие их на родственные рецепторные системы, например NK2, и другие виды воздействий, не связанных с NK-peцепторами, делают соединения формулы I терапевтически полезными для предупреждения,лечения или диагностирования ряда заболеваний, например заболеваний верхних и нижних дыхательных путей, в частности бронхиальной астмы, аллергической астмы, астмы неаллергической природы, состояний аллергической гиперчувствительности и гиперсекреции, а именно, хронического бронхита, муковисцидоза; фиброза легких различной этиологии; заболеваний легочного и бронхиального кровообращения, а именно, повышенного легочного кровяного давления, ангиогенеза, метастазов; заболеваний желудочно-кишечного тракта, а именно,болезни Крона (Crohn's), болезни Гиршспрунга(Hirschprung's), диареи, состояний малабсорбции, воспалительных состояний; при аффективных, травматических или воспалительных расстройствах центральной и периферической нервной системы, а именно депрессии, состояний тревоги, мигрени и других форм краниальной боли, припадков, рвоты; заболеваний кровеносных сосудов, а именно краниальных сосудов; заболеваний, имеющих отношение к микрокровообращению в различных тканях, а 9 именно кожи и глаз; заболеваний иммунной системы и ретикулогистиоцитарной системы,как например в ткани селезенки и лимфатической ткани; боли и других расстройств, в патогенез, патологию и этиологию которых вовлечено действие нейрокининов, тахикининов и других родственных веществ. Как уже было упомянуто, соединения формулы I также действуют и как антагонисты субстанции Р. Субстанция Р играет важную роль при различных расстройствах, например при состояниях боли, при мигрени и некоторых расстройствах центральной нервной системы типа состояний тревоги, рвоты, шизофрении и депрессии, при некоторых двигательных расстройствах типа болезни Паркинсона (Parkinson's), а также при воспалительных заболеваниях типа ревматоидного артрита, ирита и конъюктивита, при заболеваниях органов дыхания типа астмы и хронического бронхита, при расстройствах желудочно-кишечного тракта типа язвенного колита и болезни Крона (Crohn's) и при гипертензии. Антагонистическое действие по отношению к субстанции Р можно продемонстрировать на следующем примере: в частности, связывание 3 Н-субстанции Р с сетчаткой быка в радиорецепторном анализе in vitro согласно (Н. Bittiger, Ciba Foundation Symposium 91 (1982) 196199), ингибируется при значениях ИК 50 от приблизительно 1 нM. Внутриполостное введение метилового эфира субстанции Р вызывает изменение поведения песчанки. Данный эффект может быть подавлен после перорального введения in vivo соединений формулы I. Примененный здесь тест-метод представляет собой известную (A.Molecular Physiology") процедуру. Для данной процедуры получены значения ЭД 50, составляющие приблизительно 1-5 мг/кг п.о., что указывает на возможность применения соединений формулы I при лечении заболеваний центральной нервной системы. Данное изобретение относится главным образом к соединениям формулы I, гдеR1 представляет собой фенил или пиридил,каждый из которых не замещен или замещен 1 или 2 заместителями, выбранными из группы,содержащей низший алкил, трифторметил, галоген, гидрокси, низший алкокси и нитро;R3 представляет собой водород, низший алкил или фенил-низший алкил, причем фенильная группа не замещена или замещена 1 или 2 заместителями, выбранными из группы,содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси;R3 представляет собой водород, низший алкил, фенил, нафтил или индолил, причем каждый из фенила, нафтила и индолила не замещен или замещен 1 или 2 заместителями, вы 002348R4 представляет собой фенил, нафтил или индолил, причем каждый из этих радикалов не замещен или замещен 1 или 2 заместителями,выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси; Х представляет собой С 1-С 7 алкилен, С 2 С 7 алкенилен или С 4-С 7 алкандиенилен; иR5 представляет собой арильный радикал,выбранный из группы, содержащей фенил и нафтил, причем арильный радикал не замещен или замещен радикалами, в количестве от 1 до 3, выбранными из низшего алкила, галогеннизшего алкила, циклоалкила, галогена, гидрокси, низшего алкокси, амино, низшего алкиламино, динизшего алкиламино, пиперидино,морфолино, тиоморфолино, нитрогруппы, низшего алканоила, галоген-низшего алканоила,карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила, динизшего алкилкарбамоила, циано, N-низшего алкил-Nфенил-низшего алкилкарбамоила; и (фенил или пиридил)-низшего алкилкарбамоила, где фенильная или пиридильная группа не замещена или замещена низшим алкилом, трифторметилом, гидрокси, низшим алкоксим или галогеном; арил-низший алкил, арильная группа которого определена таким же образом, как и для арильного радикала R5, и который не замещен или замещен гидрокси в группировке низшего алкила; гетероарильный радикал, выбранный из группы, содержащей пирролил, пиразолил,имидазолил, триазолил, тетразолил, фуранил,тиенил, изоксазолил, оксазолил, оксадиазолил,изотиазолил, тиазолил, тиадиазолил, пиридил,пиридазинил, пиримидинил, пиразинил, триазинил, индолил, изоиндолил, бензимидазолил,бензотриазолил, бензофуранил, бензотиенил,бензоксазолил, бензотиазолил, бензопиранил,хинолинил и изохинолинил, причем данный гетероарильный радикал не замещен или замещен радикалами, в количестве от 1 до 3, выбранными из низшего алкила, галоген-низшего алкила, галогена, гидрокси, низшего алкокси,амино, низшего алкиламино, динизшего алкиламино, нитро, низшего алканоила, галогеннизшего алканоила, карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила, динизшего алкилкарбамоила, циано, фенила, (низший алкил, трифторметил, галоген,гидрокси или низший алкокси)-фенила и оксо; гетероарил-низший алкил, гетероарильная группа которого определена таким же образом,как и для гетероарильного радикала R5; 11 частично гидратированный гетероарильный радикал, выбранный из группы, содержащей дигидропирролил, дигидропиразолил, дигидроимидазолил, дигидрофуранил, дигидротиенил, дигидрооксазолил, дигидротиазолил,дигидропиридил и дигидропиримидинил, причем данный частично гидратированный гетероарильный радикал не замещен или замещен радикалами, в количестве от 1 до 3, выбранными из низшего алкила, галоген-низшего алкила,галогена, гидрокси, низшего алкокси, амино,низшего алкиламино, динизшего алкиламино,нитро, низшего алканоила, галоген-низшего алканоила, карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила, динизшего алкилкарбамоила, циано, фенила,(низший алкил, трифторметил, галоген, гидрокси или низший алкокси)-фенила и оксо; частично гидратированный гетероарилнизший алкил, частично гидратированная гетероарильная группа которого определена таким же образом, как и для частично гидратированного гетероарильного радикала R5; низший алкил, который не замещен или замещен радикалами, в количестве от 1 до 3,выбранными из карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила,динизшего алкилкарбамоила, циано, амино,низшего алкиламино, динизшего алкиламино,пиперидино, морфолино, тиоморфолино, гидрокси, низшего алкосила, галогена, низшего алканоила и бензоила; С 3-С 7 алкенил, который не замещен или замещен карбокси или низшим алкоксикарбонилом; С 3-С 7 алкинил, который не замещен или замещен карбокси или низшим алкоксикарбонилом; циклоалкил, который не замещен или замещен низшим алкилом, гидрокси, карбокси или низшим алкоксикарбонилом; циклоалкил-низший алкил, циклоалкильная группа которого определена таким же образом, как и для циклоалкила R5;(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо, низшим алкилом,фенил-низшим алкилом, (низший алкил, трифторметил, галоген, гидрокси или низший алкокси)-фенил-низшим алкилом, карбокси или низшим алкоксикарбонилом; бензо-(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо по циклоалифатическому кольцу и не замещен или замещен низшим алкилом, трифторметилом, галогеном, гидрокси или низшим алкокси по бензольному кольцу; низший алкилсульфонил; арилсульфонил, арильная группа которого определена таким же образом, как и для арильного радикала R5; 12 арил-низший алкилсульфонил, арильная группа которого определена таким же образом,как и для арильного радикала R5; низший алкенилсульфонил; арилнизший алкенилсульфонил, арильная группа которого определена таким же образом,как и для арильного радикала R5; пиридилсульфонил, который не замещен или замещен низшим алкилом, трифторметилом, галогеном, гидрокси, низшим алкокси, фенил-низшим алкокси, (низший алкил, трифторметил, галоген, гидрокси или низший алкоксифенил-низшим алкокси, фенилокси или (низший алкил, трифторметил, галоген, гидрокси или низший алкокси)-фенилокси;R6 представляет собой водород, низший алкил, гидрокси-низший алкил, (карбокси, низший алкоксикарбонил, карбамоил, низший алкилкарбамоил, динизший алкилкарбамоил или циано)-низший алкил, С 3-С 7 алкенил, С 3 С 7 алкинил, низший алканоил, галоген-низший алканоил, фенил-низший алканоил, который не замещен или замещен низшим алкилом, трифторметилом, галогеном, гидрокси или низшим алкокси по фенильному кольцу, или бензоил,который не замещен или замещен низшим алкилом, трифторметилом, галогеном, гидрокси или низшим алкокси; или где -NR5R6 представляет собой циклическую аминогруппу, выбранную из азациклоалкан-1-ила, который не замещен или замещен 1 или 2 заместителями, выбранными из низшего алкила, гидрокси-низшего алкила, циано-низшего алкила, низшего алкил(сульфинил или сульфонил)-низшего алкила,фенил-низшего алкил-(сульфинил или сульфонил)-низшего алкила, (низший алкил, трифторметил, галоген, гидрокси или низший алкокси)фенил-низшего алкил-(сульфинил или сульфонил)-низшего алкила, фенил-(сульфинил или сульфонил)-низшего алкила, (низший алкил,трифторметил, галоген, гидрокси или низший алкокси)-фенил-(сульфинил или сульфонил)низшего алкила, динизшего алкиламино, низшего алканоиламино, гидрокси, низшего алкокси,карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила, динизшего алкилкарбамоила, циано, фенила, (низший алкил, трифторметил, галоген, гидрокси или низший алкокси)-фенила и спироиндолона, который не замещен или замещен низшим алкилом; диазациклоалкан-1-ила, который не замещен или замещен фенилом, (низший алкил,трифторметил, галоген, гидрокси или низший алкокси)-фенилом, пиримидинилом, (фенил,низший алкил-фенил, трифторметил-фенил, галоген-фенил, гидрокси-фенил или низший алкокси-фенил)-низшим алкилом, (карбокси, низший алкоксикарбонил, карбамоил, низший алкилкарбамоил, динизший алкилкарбамоил или циано)-низшим алкилом или (азациклоалкан-1 ил)-карбонил-низшим алкилом; 13 морфолино; тиоморфолино; и азагетероарил-1-ила, выбранного из группы, содержащей пиррол-1-ил, пиразол-1-ил,имидазол-1-ил, триазол-1-ил, тетразол-1-ил,индол-1-ил, бензимидазол-1-ил и бензотриазол 1-ил, причем азагетероарил-1-ильный радикал не замещен или замещен низшим алкилом, динизший алкиламино-низшим алкилом, цианонизшим алкилом, гидрокси, низшим алкокси,фенил-низшим алкокси, низшим алкилтио, низшим алканоилом или галогеном; и их солям. Изобретение относится в частности к соединениям формулы I, гдеR1 представляет собой фенил, который не замещен или замещен 1 или 2 заместителями,выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси;R2 представляет собой водород, низший алкил или фенил-низший алкил, фенильная группа которого не замещена или замещена 1 или 2 заместителями, выбранными из группы,содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси;R3 представляет собой водород, низший алкил, фенил, нафтил или индолил, причем каждый из фенила, нафтила и индолила не замещен или замещен 1 или 2 заместителями, выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси;R4 представляет собой фенил, нафтил или индолил, причем каждый из этих радикалов не замещен или замещен 1 или 2 заместителями,выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси; Х представляет собой С 1-С 7 алкилен или С 2-С 7 алкенилен; и Am представляет собой аминогруппу -NR5R6, в которой R5 представляет собой арильный радикал, выбранный из группы,содержащей фенил и нафтил, причем данный арильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из низшего алкила, галоген-низшего алкила,галогена, гидрокси, низшего алкокси, амино,низшего алкиламино, динизшего алкиламино,пиперидино, морфолино, тиоморфолино, нитро,низшего алканоила, галоген-низшего алканоила,карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила, динизшего алкилкарбамоила и циано; арил-низший алкил, арильная группа которого определена таким же образом, как и для арильного радикала R5, и который не замещен или замещен гидрокси в группировке низшего алкила; гетероарильный радикал, выбранный из группы, содержащей пирролил, пиразолил,имидазолил, триазолил, тетразолил, фуранил, 002348 14 тиенил, изоксазолил, оксазолил, оксадиазолил,изотиазолил, тиазолил, тиадиазолил, пиридил,пиридазинил, пиримидинил, пиразинил, триазинил, индолил, изоиндолил, бензимидазолил,бензотриазолил, бензофуранил, бензотиенил,бензоксазолил, бензотиазолил, хинолинил и изохинолинил, причем данный гетероарильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из низшего алкила, галоген-низшего алкила, галогена, гидрокси, низшего алкокси, амино, низшего алкиламино, динизшего алкиламино, нитро, низшего алканоила, галоген-низшего алканоила, карбокси, низшего алкоксикарбонила, карбамоила,низшего алкилкарбамоила, динизшего алкилкарбамоила и циано; гетероарил-низший алкил, гетероарильная группа которого определена таким же образом,как и для гетероарильного радикала R5; низший алкил, который не замещен или замещен радикалами в количестве от 1 до 3,выбранными из карбокси, низшего алкоксикарбонила, карбамоила, низшего алкилкарбамоила,динизшего алкилкарбамоила, циано, амино,низшего алкиламино, динизшего алкиламино,пиперидино, морфолино, тиоморфолино, гидрокси, низшего алкокси, галогена, низшего алканоила и бензоила; С 3-С 7 алкенил, который не замещен или замещен карбокси или низшим алкоксикарбонилом; С 3-С 7 алкинил, который не замещен или замещен карбокси или низшим алкоксикарбонилом; циклоалкил, который не замещен или замещен низшим алкилом, гидрокси, карбокси или низшим алкоксикарбонилом; циклоалкил-низший алкил, циклоалкильная группа которого определена таким же образом, как и для циклоалкила R5;(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо; или арилсульфонил, арильная группа которого определена таким же образом, как и для арильного радикала R5;R6 представляет собой водород, низший алкил, гидрокси-низший алкил, (карбокси, низший алкоксикарбонил, карбамоил, низший алкилкарбамоил, динизший алкилкарбамоил или циано)-низший алкил, С 3-С 7 алкенил или С 3 С 7 алкинил; или в которой -NR5R6 представляет собой циклическую аминогруппу, выбранную из азациклоалкан-1-ила, который не замещен или замещен 1 или 2 заместителями, выбранными из низшего алкила, гидрокси-низшего алкила, циано-низшего алкила, динизшего алкиламино, низший алканоиламино, гидрокси, низшего алкокси, фенила и (низший алкил, трифторметил, галоген, гидрокси или низший алкокси)фенила; 15 диазациклоалкан-1-ила, который не замещен или замещен фенилом, (низший алкил,трифторметил, галоген, гидрокси или низший алкокси)-фенилом, (фенил, низший алкилфенил, трифторметил-фенил, галоген-фенил,гидрокси-фенил или низший алкокси-фенил)низшим алкилом, (карбокси, низший алкоксикарбонил, карбамоил, низший алкилкарбамоил,динизший алкилкарбамоил или циано)-низшим алкилом или (азациклоалкан-1-ил)-карбонилнизшим алкилом; морфолино; тиоморфолино; и азагетероарил-1-ила, выбранного из группы, содержащей пиррол-1-ил, пиразол-1-ил,имидазол-1-ил, триазол-1-ил, тетразол-1-ил,индол-1-ил, бензимидазол-1-ил и бензотриазол 1-ил, причем азагетероарил-1-ильный радикал не замещен или замещен низшим алкилом, динизшим алкиламино-низшим алкилом, цианонизшим алкилом, гидрокси, низшим алкокси,фенил-низшим алкокси, низшим алкилтио, низшим алканоилом или галогеном; и их солям. Изобретение особенно относится к соединениям формулы I, в которойR1 представляет собой фенил, который не замещен или замещен 1 или 2 заместителями,выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси, низший алкокси и нитро, или R1 представляет собой пиридил;R2 представляет собой водород или низший алкил;R3 представляет собой водород, низший алкил, фенил или нафтил, причем каждый из фенила и нафтила не замещен или замещен 1 или 2 заместителями, выбранными из группы,содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси;R4 представляет собой фенил, нафтил или индолил, причем каждый их этих радикалов не замещен или замещен 1 или 2 заместителями,выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси; Х представляет собой С 1-С 4aлкилен или С 2-С 4 алкенилен; и Am представляет собой аминогруппу -NR5R6, в которой R5 представляет собой арильный радикал, выбранный из группы,содержащей фенил и нафтил, причем данный арильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из низшего алкила, циклоалкила, галогена, гидрокси, низшего алкокси, динизшего алкиламино, морфолино, нитро и низшего алкоксикарбонила; арил-низший алкил, в котором арил выбран из группы, содержащей фенил, нафтил и индолил, и который не замещен или замещен в арильной группировке 1 или 2 радикалами, выбранными из гидрокси, низшего алкокси, гало 002348 16 гена и амино, и не замещен или замещен гидрокси в группировке низшего алкила; гетероарильный радикал, выбранный из группы, содержащей пиридил, хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил, причем данный гетероарильный радикал не замещен или замещен 1 или 2 радикалами, выбранными из низшего алкила, галогена и галоген-низшего алканоила; дигидропиразолил, который замещен оксо и который дополнительно не замещен или замещен 1, 2 или 3 заместителями, выбранными из низшего алкила и фенила; гетероарил-низший алкил, в котором гетероарил выбран из группы, содержащей пиридил,хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил; бензопиранон-низший алкил; низший алкил, который не замещен или замещен низшим алкоксикарбонилом, карбамоилом, низшим алкилкарбамоилом, циано, динизшим алкиламино, пиперидино, морфолино,гидрокси или бензоилом; С 3-С 7 алкенил; С 3-С 7 алкинил; циклоалкил, который не замещен или замещен гидрокси; циклоалкил-низший алкил, который не замещен или замещен низшим алкоксикарбонилом в циклоалкильной группировке;(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо, низшим алкилом,фенил-низшим алкилом или низшим алкоксикарбонилом; бензо-(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо; низший алкилсульфонил; фенил-низший алкилсульфонил, фенильное кольцо которого не замещено или замещено низшим алкоксикарбонилом; низший алкенилсульфонил, который не замещен или замещен фенилом или галогенфенилом; фенилсульфонил, который не замещен или замещен низшим алкилом, низшим алкокси,низшим алкоксикарбонилом, карбамоилом,низшим алкилкарбамоилом, динизшим алкилкарбамоилом,(N-низший алкил)-N-фенилнизшим алкилкарбамоилом, (фенил или низший алкоксифенил)-низшим алкилкарбамоилом, или пиридил-низшим алкилкарбамоилом; или пиридилсульфонил, который не замещен или замещен фенилокси;R6 представляет собой водород, низший алкил, гидрокси-низший алкил, циано-низший алкил или С 3-С 7 алкенил; или в которой -NR5R6 представляет собой циклическую аминогруппу, выбранную из пиперидино, который не замещен или замещен 1 или 2 заместителями, выбранными из низшего алканоиламино, фенила, низшего алкила, гидрокси-низшего алкила, динизшего алки 17 ланино, гидрокси, низшего алкокси, карбамоила, фенилсульфинил-низшего алкила или спироиндолона, который не замещен или замещен низшим алкилом; азокано; азиридино, который не замещен или замещен низшим алкилом; пиперазино, который не замещен или замещен фенилом, низшим алкокси-фенилом, пиримидинилом, галогенфенил-низшим алкилом или(азациклоалкан-1-ил)-карбонил-низшим алкилом; морфолино; индол-1-ила, который не замещен или замещен низшим алкилом, низшим алканоилом,динизшим алкиламино-низшим алкилом или фенил-низшим алкокси; бензимидазол-1-ила, который не замещен или замещен низшим алкилтио или цианонизшим алкилом; имидазол-1-ила, который не замещен или замещен низшим алкилом; 1,2,4-триазол-1-ила; и бензотриазол-1-ила; и их фармацевтически приемлемым солям. Наиболее специально изобретение относится к соединениям формулы I, гдеR1 представляет собой фенил, который не замещен или замещен 1 или 2 заместителями,выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси;R2 представляет собой водород или низший алкил;R3 представляет собой водород, низший алкил, фенил или нафтил, причем каждый из фенила и нафтила не замещен или замещен 1 или 2 заместителями, выбранными из группы,содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси;R4 представляет собой фенил, нафтил или индолил, причем каждый из этих радикалов не замещен или замещен 1 или 2 заместителями,выбранными из группы, содержащей низший алкил, трифторметил, галоген, гидрокси и низший алкокси; Х представляет собой С 1-С 4 алкилен или С 2-С 4 алкенилен, и Am представляет собой аминогруппу -NR5R6, в которой R5 представляет собой арильный радикал, выбранный из группы,содержащей фенил и нафтил, причем данный арильный радикал не замещен или замещен радикалами в количестве от 1 до 3, выбранными из низшего алкила, галогена, гидроксила, низшего алкокси, динизшего алкиламино, морфолино, нитро и низшего алкоксикарбонила; арил-низший алкил, в котором арил выбран из группы, содержащей фенил, нафтил и индолил, и который не замещен или замещен в арильной группировке 1 или 2 радикалами, выбранными из гидрокси, низшего алкокси и гало 002348 18 гена, и не замещен или замещен в группировке низшего алкила гидрокси; гетероарильный радикал, выбранный из группы, содержащей пиридил, хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил, причем данный гетероарильный радикал не замещен или замещен 1 или 2 радикалами, выбранными из низшего алкила, галогена и галоген-низшего алканоила; гетероарил-низший алкил, в котором гетероарил выбран из группы, содержащей пиридил,хинолинил, пиримидинил, тиазолил, тиадиазолил, изотиазолил и индолил; низший алкил, который не замещен или замещен низшим алкокси-карбонилом, карбамоилом, циано, динизшим алкиламино, пиперидино, морфолино, гидрокси или бензоилом; С 3-С 7 алкенил; С 3-С 7 алкинил; циклоалкил, который не замещен или замещен гидрокси; циклоалкил-низший алкил, который не замещен или замещен низшим алкоксикарбонилом в циклоалкильной группировке;(аза, окса или тиа)-циклоалкил, который не замещен или замещен оксо; илиR6 представляет собой водород, низший алкил, гидрокси-низший алкил, циано-низший алкил или С 3-С 7 алкенил; или где -NR5R6 представляет собой циклическую аминогруппу, выбранную из пиперидино, который не замещен или замещен 1 или 2 заместителями, выбранными из низшего алканоиламино, фенила, низшего алкила, гидрокси-низшего алкила, динизшего алкиламино и гидрокси; азокано; азиридино, который не замещен или замещен низшим алкилом; пиперазино, который не замещен или замещен фенилом, низший алкокси-фенилом, галогенфенил-низшим алкилом или (азациклоалкан-1-ил)-карбонил-низшим алкилом; морфолино; индол-1-ила, который не замещен или замещен низшим алкилом, низшим алканоилом,динизший алкиламино-низшим алкилом или фенил-низшим алкокси; бензимидазол-1-ила, который не замещен или замещен низшим алкилтио или цианонизшим алкилом; имидазол-1-ила, который не замещен или замещен низшим алкилом; 1,2,4-триазол-1-ила; и бензотриазол-1-ила; и их фармацевтически приемлемым солям. Особое значение имеют соединения формулы I, где R1 представляет собой 3,5 бистрифторметилфенил, R2 представляет собой метил, группа -СНR3R4 представляет собой бен 19 зил, 4-хлорбензил, 2-нафтилметил, дифенилметил, 1H-индол-3-илметил или 1-метил-индол-3 илметил, Х представляет собой 1,2-этилен или 1,2-этенилен, a Am представляет собой аминогруппу -NR5R6, в которой R5 представляет собой пиридил-С 1-С 4 алкил; С 1-С 7 алкил, незамещенный или замещенный гидрокси; циклоалкил,имеющий от 5 до 7 кольцевых углеродных атомов; (аза, окса или тиа)-циклоалкил, имеющий от 5 до 7 кольцевых атомов, включая гетероатом(ы), и незамещенный или замещенный оксо; бензо(аза, окса или тиа)-циклоалкил, имеющий от 5 до 7 кольцевых атомов, включая гетероатом(ы) в гетероциклическом кольце, и незамещенный или замещенный оксо; а R6 представляет собой водород или С 1-С 7 алкил; и их фармацевтически приемлемые соли. Следует специально упомянуть о каждой из подгрупп группы соединений формулы I:R1 представляет собой 3,5 бистрифторметилфенил, 3,5-диметилфенил или 3,5-дигалогенфенил; (в) соединения формулы I,в которых R1 представляет собой 3,5 бистрифторметилфенил; (г) соединения формулы I, в которых R2 представляет собой низший алкил; (д) соединения формулы I, в которых R2 представляет собой метил; (е) соединения формулы I, в которых группа -СНR3R4 представляет собой бензил, 4-хлорбензил, 2-нафтилметил,дифенилметил, 1H-индол-3-илметил или 1 метилиндол-3-илметил; (ж) соединения формулы I, в которых Х представляет собой -СН=СН-,-СН 2-, -(CH2)2- или -(СН 2)3-; (з) соединения формулы I, в которых Х представляет собой-NR5R6, где R5 является пиридил-низшим алкилом, С 5-С 7 циклоалкилом, азациклогептан-2-он 3-илом (=гексагидроазепин-2-он-3-илом), 1 гидроксиметил-2-метилпропилом или 1-гидроксиметил-3-метилбутилом, a R6 аналогичен таковым, определенным для данной группы соединений формулы I; (к) соединения формулы I,в которых Аm представляет собой аминогруппу-NR5R6, где R5 является азациклогептан-2-он-3 илом (=гексагидроазепин-2-он-3-илом) или циклогексилом, a R6 является водородом; (л) соединения формулы I, в которых Х представляет собой С 1-С 4 алкилен или С 2-С 4 алкенилен; (м) соединения формулы I, в которых Am представляет собой нециклическую аминогруппу-NR5R6, где R5 отличен от водорода, a R6 аналогичен таковым, определенным для данной группы соединений формулы I. 20 Данное изобретение особенно относится к специфическим соединениям, описанным в примерах, и их солям. Соединения формулы I могут быть получены известным per se способом, например: карбоновой кислотой R1-C(=O)-OH или ее реакционноспособным производным, либо(Б) конденсированием карбоновой кислоты формулы III или ее реакционноспособного производного с аммиаком либо одно- или двузaмещенным амином, либо(В) в случае получения соединения формулы I, в котором Х представляет собой С 2 С 7 алкенилен или С 4-С 7 алкандиенилен, образованием на последней стадии двойной связи или одной из двойных связей посредством реакции Виттига (Wittig) или ее варианта, например Виттига-Хорнера (Wittig-Horner); и, при необходимости, превращением соединения формулы I в другое соединение формулы I и/или, при необходимости, превращением полученной соли в свободное соединение или в другую соль, и/или, при необходимости,превращением полученного свободного соединения формулы I, обладающего свойствами образовывать соли, в соль, и/или, при необходимости, разделением полученной смеси стереоизомеров, диастереоизомеров или энантиомеров на индивидуальные стереоизомеры, диастереоизомеры или энантиомеры. В следующем более подробном описании способов, если не указано особо, символы от R1 до R4, Х и Am аналогичны определенным для формулы I. Способ (А). Реакция по способу (А) соответствует известному per se N-ацилированию первичных и вторичных аминов, другими словами, образованию амидов (гетеро)арилкарбоновых кислот из соответствующих карбоновых кислот (или их производных) и первичных и вторичных аминов. Одним из многочисленных возможных способов, который может быть упомянут, является ацилирование соединения формулы II хлоридом карбоновой кислоты R1-COCl, например, в присутствии триэтиламина и 4-диметиламинопиридина (DMAP). Соединение формулы II, где Х представляет собой С 2-С 7 алкилен, получают, например, 21 следующим образом. В качестве исходного материала используют соединение формулы IV где ВОС представляет собой аминозащитную группу трет-бутилоксикарбонил (-СОО-третбутил), alk' является прямой связью или С 1 С 5 алкиленом, а Alk представляет собой С 1 С 7 алкил. Сначала гидрируют двойную связь,затем гидролизуют алкиловый эфир до образования карбоновой кислоты и далее вводят радикал -N(-R6)-R5 посредством реакции с амином НNR5R6 [образованием -С(=O)-N(-R6)-R5] и в концe удаляют защитную группу -ВОС. Соединение формулы IV может быть получено, например, посредством использования в качестве исходного материала производного альфа-аминокислоты формулы V(например R3=Н, R4=фенил:фенилаланин), защиты свободной аминогруппы защитной группой "Pr" [например ВОС с помощью реакции с(ВОС)2 О], возможного введения группы R2, например, N-алкилированием, и этерификации радикала карбоновой кислоты (предпочтительно до образования эфира низшего алкила, в особенности метилового эфира). При необходимости введение группы R2 и этерификация радикала карбоновой кислоты могут быть проведены в один этап, например, реакцией с метилиодидом и Аg2 О в DMF. Эфир карбоновой кислоты восстанавливают до соответствующего альдегида(например, реакцией с гидридом диизобутилалюминия в толуоле при -78 С) и в конце концов соединение формулы IV получают в реакции Виттига-Хорнера. Это может быть проведено,например, посредством реакции с триалкиловым эфиром фосфоноалкановой кислоты формулы (AlkO)2P(=O)-alk'-COOAlk. Соединение формулы II, в котором Х представляет собой С 1 алкилен (= -СН 2-), получают, например, следующим образом: используя в качестве исходного материала соединение формулы VI (см. ниже), гидролизуют алкиловый эфир до образования карбоновой кислоты, а радикал -N(-R6)-R5 вводят с помощью реакции с 22 амином HNR5R6 [с образованием -С(=О)-N(-R6)R5]. Соединение формулы II, в котором Х представляет собой С 2-С 7 алкенилен, получают,например, следующим образом: используя в качестве исходного материала соединение формулы IV, гидролизуют алкиловый эфир до образования карбоновой кислоты, а радикал -N(-R6)R5 вводят с помощью реакции с амином HNR5R6[с образованием -С(=O)-N(-R6)-R5] и наконец удаляют защитную группу -ВОС. Способ (Б). Реакция по способу (Б) соответствует известному per se образованию амидов карбоновых кислот из соответствующих карбоновых кислот (или их производных) и аммиака или первичных и вторичных аминов. Из большого числа возможных способов можно упомянуть следующие: (1) взаимодействие карбоновой кислоты формулы III с аммиаком или первичным либо вторичным амином HNR5R6,например, в присутствии гидрохлорида N-этилN'-(3-диметиламинопропил)карбодиимида(EDC) и 4-диметиламинопиридина (DMAP); (2) взаимодействие карбоновой кислоты формулыIII сначала с N-гидроксисукцинимидом и гидрохлоридом N-этил-N'-(3-диметиламинопропил) карбодиимида в присутствии DMAP с образованием соответствующего эфира N-гидроксисукцинимида и затем с соответствующим амином НNR5R6; (3) взаимодействие карбоновой кислоты формулы III с амином НNR5R6, в особенности с анилином, в присутствии ангидрида 1-пропанфосфоновой кислоты. Соединение формулы III, в котором Х представляет собой С 2-С 7 алкилен, получают,например, следующим образом: используя соединение формулы IV в качестве исходного материала, удаляют аминозащитную группу (в случае ВОС, например, реакцией с трифторуксусной кислотой), проводят ацилирование этой аминогруппы карбоновой кислотой R1COOH или ее реакционноспособным производным [аналогично способу (А)], двойную связь восстанавливают, например, в присутствии Н 2/палладия-на-угле в THF и 1,2-дихлорбензоле, и наконец гидролизуют остаток алкилового эфира, например, реакцией с LiOH в метаноле и THF. Другой способ получения соединения формулы III, X которого представляет собой С 2 С 7 алкилен, включает взаимодействие альдегида формулы Va с галидом 1,3-диоксан-2-илалкилтрифенилфосфония, например, бромидом 2-(1,3-диоксан-2-ил)этилтрифенилфосфония, в реакции Виттига, гидрирование полученной двойной связи, например, в присутствии никеля Ренея, окисление концевой 1,3-диоксан-2 ильной группы до 3-гидроксипропилового эфира соответствующей карбоновой кислоты, например озоном, удаление аминозащитной группы, ацилирование этой аминогруппы карбоновой кислотой R1-COOH или ее реакционноспо 23 собным производным [аналогично способу (А)] и наконец гидролиз 3-гидроксипропилового эфира до образования карбоновой кислоты. Соединения формулы III, в которых Х представляет собой С 2-С 7 алкенилен, получают аналогично таковым, Х которых представляет собой С 2-С 7 алкилен, иначе говоря, таким же образом из соединений формулы IV; единственное отличие заключается в том, что двойную связь не восстанавливают. Соединение формулы III, в котором Х представляет собой С 1 алкилен (= -СН 2-), получают, например, следующим образом: используя в качестве исходного материала соединение формулы VI в котором Alk представляет собой низший алкил, проводят ацилирование аминогруппы карбоновой кислотой R1-COOH или ее реакционноспособным производным [аналогично способу(А)] и эфирную группу гидролизуют до образования карбоновой кислоты III. Соединение формулы VI в свою очередь получают, например, следующим образом: в качестве исходного материала используют карбоновую кислоту формулы R3R4CH-COOH, которую приводят во взаимодействие с производным малоновой кислоты, в частности магниевой солью бис(моноэтилового эфира малоновой кислоты), например, в присутствии карбонилдиимидазола. Получающийся кетоэфир формулыR3R4CH-C(=O)-CH2-COO-Alk переводят, например, в результате реакции с амином R2NH2 и далее с цианборгидридом натрия в желаемое соединение формулы VI. Для получения соединения формулы VI можно также, например, использовать следующую процедуру: в качестве исходного материала применяют соединение формулы V, аминогруппу защищают аминозащитной группой, в частности ВОС, карбоксильную группу этерифицируют до метилового эфира, метиловый эфир восстанавливают до гидроксиметила (например с помощью LiBH4), гидроксиметильную группу мезилируют и в результате взаимодействия с цианидом тетраэтиламмония получают соответствующее цианометильное соединение. Последнее может быть гидролизовано с образованием карбоновой кислоты и превращено путем этерификации в соединение формулы VI. Соединение формулы III, в котором Х представляет собой С 3 алкилен [-(СН 2)3-], получают, например, следующим образом: используя в качестве исходного материала соединение формулы IVa восстанавливают двойную связь, например с помощью Н 2/палладия-на-угле, удаляют аминозащитную группу (в случае ВОС, например, в результате реакции с трифторуксусной кислотой), ацилируют эту аминогруппу карбоновой кислотой R1-COOH или ее реакционноспособным производным [аналогично способу (А)] и наконец гидролизуют алкилэфирную группу,например, в присутствии КОН. Соединение формулы IVa в свою очередь получают, например, используя в качестве исходного материала соединение формулы VI,следующим образом: низший алкиламиногруппу защищают, вводя защитную группу, в частности, в результате реакции с бензиловым эфиром хлормуравьиной кислоты, низший алкилэфир восстанавливают, например, с помощью гидрида диизобутилалюминия, до альдегида и последний приводят во взаимодействие, например, в реакции Виттига-Хорнера, с триэтиловым эфиром фосфоноуксусной кислоты с образованием соединения формулы IVa. Способ (В). Возможным исходным соединением в реакции Виттига-Хорнера является,например, альдегид формулы Va, в котором аминозащитную группу удаляют и который затем N-ацилируют карбоновой кислотой R1COOH или ее реакционноспособным производным [аналогично способу (А)]. Такого рода альдегид может, например, реагировать с амидом диалкилового эфира фосфоноалкановой кислоты формулы (AlkO)2P(=O)-alk'-CO-Am в реакции Виттига-Хорнера с образованием соединения формулы I. Соединения формулы I также могут быть превращены известным per se способом в другие соединения формулы I. Например, соединение формулы I, в котором R2 представляет собой низший алкил или арил-низший алкил, может быть получено путем N-алкилирования соединения формулы I, в котором R2 представляет собой водород, соединением Y3-R2, в котором Y3 представляет собой гидроксильную или реакционноспособную этерифицированную гидроксильную группу. Другой возможный способ заключается во взаимодействии соединения формулы I, в котором R2 представляет собой водород, с соединением Y4R2', где Y4 представляет собой формил, a R2' укороченный на -СН 2- группу радикал R2 (R2 =-CH2-R2') в условиях восстановления (восстановительное аминирование). Также возможным, например, для соединений формулы I, в которых Х представляет собой С 2-С 7 алкенилен, оказывается превращение последнего посредством гидрирования (вос 25 становления) в соответствующие соединения формулы I, Х которых представляет собой С 2 С 7 алкилен. Соединения формулы I, имеющие R6 = Н,можно превратить в соединения формулы I, R6 которых представляет собой ацил, например низший алканоил, с помощью стандартных методов ацилирования, предпочтительно в присутствии сильного основания, например гидрида натрия. В сучае, если какие-либо промежуточные производные будут содержать взаимовлияющие реакционноспособные группы, например карбоксильные, гидроксильные, меркапто- или аминогруппы, такие группы можно на какое-то время защитить легко удаляемыми защитными группами. Выбор подходящих защитных групп и способ их введения и удаления известны per seChemistry, Plenum Press, London, New York 1973). Соли соединений I могут быть получены известным per se способом. Например, соли соединений I, образованные в результате присоединения кислоты, получают обработкой соответствующей кислотой или соответствующим ионообменным реагентом, а соли, образованные в результате присоединения основания, получают обработкой соответствующим основанием или соответствующим ионообменным реагентом. Соли соединений формулы I могут быть превращены в свободные соединения I обычным способом: соли, образованные в результате присоединения кислоты, например, обработкой соответствующим основным агентом или соответствующим ионообменным реагентом, а соли,образованные в результате присоединения основания, например, обработкой соответствующей кислотой или соответствующим ионообменным реагентом. Соли соединений I могут быть превращены в другие соли соединений I известным per se образом: например, соли, образованные в результате присоединения кислоты, можно превратить в другие соли, образованные в результате присоединения кислоты, в частности, обработкой соли неорганической кислоты, типа гидрохлорида, соответствующей кислой солью металла, такой как соли натрия, бария или серебра,к примеру ацетатом серебра, в соответствующем растворителе, в котором образующаяся неорганическая соль, например хлорид серебра,оказывается нерастворимой и следовательно осаждается в реакционной смеси. В зависимости от способа и условий реакции соединения I, обладающие свойством образовывать соли, могут быть получены в свободной форме или в форме солей. В результате близкого родства между соединениями I в свободной форме и в форме их солей любое приведенное здесь выше и ниже упоминание о свободном соединении I или его 26 соли следует понимать, как включающее также и соответствующие соли или свободное соединение I, соответственно, как подходящие и целесообразные. Соединения I, включая соли солеобразующих соединений, могут также быть получены в форме их гидратов и/или могут включать другие растворители, например растворители, которые могут быть использованы для кристаллизации соединения в твердой форме. В зависимости от природы заместителей и соответствующего ряда центров асимметрии, а также от исходного материала и выбранных способов, соединения формулы I и их соли могут быть получены в форме смесей стереоизомеров, например смесей диастереомеров или смесей энантиомеров, типа рацематов, или возможно также в виде чистых стереоизомеров. Смеси диастереомеров, получаемые согласно данному способу или какому-либо другому методу, можно разделить обычным путем на смеси энантиомеров, в частности рацематов, или на индивидуальные диастереомеры, например на основе различий в физико-химических свойствах между составляющими известным способом фракционной кристаллизации, дистилляции и/или хроматографии. Преимущественно выделяют более активный изомер. Смесь энантиомеров, особенно рацематов,получаемая согласно данному способу или какому-либо другому методу, можно разделить на индивидуальные энантиомеры известными perse способами, например перекристаллизацией из оптически активного растворителя, с помощью микроорганизмов, хроматографией и/или в результате реакции с оптически активным вспомогательным соединением, например основанием, кислотой или спиртом, с целью образования смесей солей диастереомеров или функциональных производных, типа эфиров, разделения их и высвобождения желаемого энантиомера. Преимущественно выделяют более активный изомер. Данное изобретение также относится к тем вариантам способа, согласно которым соединение, получаемое в качестве промежуточного продукта на какой-либо стадии этого способа,используют как исходный материал и выполняют оставшиеся этапы или исходный материал используют в форме производного, либо соли,либо, в особенности, получают в условиях реакции. В способе по настоящему изобретению предпочтительно использовать эти исходные материалы или промежуточные продукты, в каждом случае в свободном виде или в форме соли, в результате чего образуются соединенияI, или их соли, описанные вначале как особенно важные. Данное изобретение относится также к новым исходным материалам и промежуточный продуктам, в каждом случае в свободном виде или в форме соли, для получения соединений I 27 или их солей, к их применению и к способам их получения, причем переменная R для соединений I определена. Данное изобретение относится также к применению соединений I и их фармацевтически приемлемых солей при лечении аллергических состояний и заболеваний, преимущественно в форме фармацевтически приемлемых составов, особенно в способе терапевтического воздействия на тело животного и человека, и к подобному способу воздействия. Данное изобретение относится также к фармацевтическим составам, содержащим соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, и к способу его производства. Такие фармацевтические составы представляют собой составы для энтерального, например перорального и также ректального введения, для парентерального введения, для местного применения и особенно для применения в виде ингаляции теплокровным животным, в особенности людям, причем данные составы содержат либо один фармакологически активный ингредиент, либо вместе с обычными фармацевтическими эксципиентами. Фармацевтические составы содержат (в мас.%),например, от приблизительно 0,001 до 100%,предпочтительно от приблизительно 0,1 до приблизительно 50%, активного ингредиента. Фармацевтические составы для энтерального и парентерального введения представляют собой, например, составы в виде стандартной дозы в форме драже, таблеток, капсул или суппозиториев, а также ампул. Их готовят известным per se способом, например посредством традиционных методов смешивания, гранулирования, приготовления сиропов, растворения и лиофилизации. Например, фармацевтический состав для перорального введения можно приготовить путем смешивания активного ингредиента с твердым носителем, возможного гранулирования полученной смеси и обработки смеси или гранул, при желании или необходимости после добавления соответствующих эксципиентов, с целью формирования таблеток или сердцевин драже. Подходящими носителями являются в основном наполнители типа сахаров, например лактоза, сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например фосфат кальция или гидрофосфат кальция, а также связующие, а именно крахмальные пасты на основе, например, крахмала из кукурузы,пшеницы, риса или картофеля, желатин, трагакант, метилцеллюлоза и/или поливинилпирролидон и, при необходимости, разрыхлители типа вышеупомянутых крахмалов, а также карбоксиметилкрахмал, перекрестно-сшитый поливинилпирролидон, агар или альгиновая кислота либо ее соль типа альгината натрия. Эксципиенты в основном определяют текучесть и являются смазывающими веществами, например, 002348 28 кремниевая кислота, тальк, стеариновая кислота или ее соли, типа стеарата магния или кальция,и/или полиэтиленгликоль. Сердцевины драже обеспечиваются подходящим, возможно энтеросолюбильным, покрытием, при этом используются inter alia концентрированные растворы сахара, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, или растворы для покрытия в соответствующих органических растворителях либо в смесях растворителей, или для получения покрытия энтеросолюбильной оболочкой, растворы соответствующих целлюлозных препаратов типа фталата ацетилцеллюлозы или фталата гидроксипропилметилцеллюлозы. Красители или пигменты могут быть добавлены в таблетки или покрывающие драже оболочки, например в целях идентификации или для указания различных доз активного ингредиента. Другими вводимыми перорально фармацевтическими составами являются твердые желатиновые капсулы и также мягкие, герметизированные капсулы, состоящие из желатина и пластификатора, типа глицерина или сорбита. Твердые желатиновые капсулы могут содержать активный ингредиент в виде гранул, например в смеси с наполнителями типа лактозы, связующими типа крахмала, и/или скользящими веществами типа талька либо стеарата магния, и, при необходимости, стабилизаторами. Активный ингредиент в мягких капсулах предпочтительно растворен или суспендирован в соответствующих жидкостях типа жирных масел, парафинового масла или жидких полиэтиленгликолей,при этом также возможно добавление стабилизаторов. Соответствующими вводимыми ректально фармацевтическими составами являются, например суппозитории, которые содержат смесь активного ингредиента с материалом основы суппозитория. Соответствующие материалы основы суппозитория представляют собой, например, природные и синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие спирты. Также возможно применение желатиновых ректальных капсул, которые включают смесь активного ингредиента с материалом основы. Соответствующими материалами основы являются, например,жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды. Для парентерального введения особенно приемлемыми являются водные растворы активного ингредиента в водорастворимой форме,например в виде водорастворимой соли, а также суспензии активного ингредиента, а именно соответствующие масляные суспензии для инъекций (при этом используют соответствующие липофильные растворители или наполнители типа жирных масел, например масло из кунжута, или синтетические эфиры жирных кислот, 29 например этилолеат либо триглицериды) или суспензии с водой для инъекций, которые содержат вещества, повышающие вязкость, например натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран, и также возможно стабилизаторы. Фармацевтическими составами для местного применения, в частности для местной обработки кожи, являются лосьоны, кремы и мази,так называемые жидкие или полутвердые эмульсии масла-в-воде или воды-в-масле; жирные мази, не содержащие воды; пасты, так называемые кремы и мази, содержащие в своем составе порошкообразные составляющие, обладающие способностью к выделению-абсорбции; водянистые гели с низким содержанием воды или не содержащие воды и состоящие из материалов, способных к набуханию и гелеобразованию; пены, так называемые жидкие эмульсии масла-в-воде в форме аэрозоли, которые вводят распылением из находящихся под давлением контейнеров; и настойки на водно-спиртовой основе; каждый из этих составов может содержать дополнительные традиционные фармацевтические эксципиенты, как например консерванты. Фармацевтические составы для местного применения производят известным per se способом путем смешивания активного ингредиента с фармацевтическими эксципиентами, например растворением или суспендированием активного ингредиента во всем материале или, если необходимо, в части его. Для получения эмульсий,активный ингредиент которых растворяется в одной из жидких фаз, его обычно растворяют в этой фазе перед эмульгированием; для получения суспензий, активный ингредиент которых суспендируется в эмульсии, его смешивают с частью материала основы после эмульгирования, а затем добавляют к оставшейся части по рецептуре. Доза активного ингредиента может зависеть от различных факторов, таких как активность и продолжительность действия активного ингредиента, тяжесть подлежащего лечению заболевания и его симптомы, способ применения, вид, пол, возраст и вес теплокровного животного и/или состояние индивидуума. Установлено, что в типичном случае ежедневная вводимая доза, например для перорального введения теплокровному животному, весящему приблизительно 75 кг, составляет от приблизительно 1 до приблизительно 1000 мг, в особенности от приблизительно 5 до приблизительно 200 мг. Данную дозу можно вводить в виде единичной дозы или в виде нескольких частичных доз, содержащих, например, от 10 до 100 мг. Описанное выше изобретение иллюстрируется следующими примерами. Значения температур даются в градусах Цельсия; "пиколил"= пиридилметил; "карбамоил" = -СОNН 2; "гексан" означает смесь изомеров гексана (например поставляемых фирмой Fluka); "ТСХ" - тонкос 002348 30 лойная хроматография; "RT" - комнатная температура. Относительно номенклатуры, используемой для обозначения соединений в разделе примеры: для большей ясности конечные продукты всегда называются как "амиды карбоновых кислот", даже когда амидный азот входит в состав кольца (например алифатически или ароматически). Те случаи, когда амидный азот является одно- или двузамещенным (но не входящим в состав кольца), обозначаются как "NN-", например "N-(1-метил-индол-5-ил)амид пентановой кислоты" или "N-бензил-Nметил-амид пентановой кислоты". Если же амидный азот является частью кольца, в обозначениях для заместителей опускают "N-N-" и"ил", а название кольца помещают в скобках вместе с термином "амид", например "(3 ацетил-индол-1-амид) пентановой кислоты" или"(4-фенил-4-ацетиламинопиперидинамид) пентановой кислоты." Пример 1. N-(2-метоксибензил)-амид 4[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-[4-хлорфенил)-пент-2-еновой кислоты. Раствор, содержащий 1,25 г N-(2-метоксибензил)-амида 4-(N'-метил)-амино-5-(4-хлорфенил)-пент-2-еновой кислоты, 1,06 г 3,5 бистрифторметилбензоилхлорида, 1,41 г триэтиламина и 50 мг 4-N,N-диметиламинопиридина в 80 мл метиленхлорида, перемешивают в атмосфере аргона при 0 С в течение 18 ч. После этого реакционную смесь разбавляют с помощью 300 мл этилацетата. Смесь промывают в делительной воронке 0,1 н. раствором гидроксида натрия, водой, 0,1 н. соляной кислотой и насыщенным раствором NaCl, высушивают(сульфат магния) и концентрируют упариванием. Перекристаллизация остатка из смеси нпентан/этилацетат дает поименованное в заголовке соединение в виде кристаллов белого цвета с точкой плавления 163-168 С. 1(s, 3 Н), 3,06 (m, 2 Н), 2,82 (s, 3 Н). Исходные материалы могут быть получены следующим образом: а) N-(2-метоксибензил)-амид 4-(N'-метил)амино-5-(4-хлорфенил)-пент-2-еновой кислоты. Раствор, содержащий 1,8 г N-(2-метоксибензил)-амида 4-(N'-метил-N'-трет-бутилоксикарбонил)-амино-5-(4-хлорфенил)-пент-2 еновой кислоты и 10 мл трифторуксусной кислоты в 30 мл метиленхлорида, перемешивают в атмосфере аргона при комнатной температуре в течение 5 ч. Реакционную смесь концентрируют упариванием и остаток растворяют в 200 мл этилацетата. Этилацетатный раствор промывают 0,05 н. раствором гидроксида натрия и насыщенным раствором NaCl, высушивают (сульфат натрия), концентрируют упариванием, получая 31 масло светло-желтой окраски, которое немедленно используют для последующих реакций. б) N-(2-метоксибензил)-амид 4-(N'-метилN'-трет-бутилоксикарбонил)-амино-5-(4-хлорфенил)-пент-2-еновой кислоты. Смесь, содержащую 2,1 г 4-(N'-метил-N'трет-бутилоксикарбонил)-амино-5-(4-хлорфенил)-пент-2-еновой кислоты, 0,85 г 2 метоксибензиламина, 1,31 г гидрохлорида Nэтил-N'-(3-диметиламинопропил)-карбодиимида, 0,83 г 4-диметиламинопиридина и 80 мл метиленхлорида, перемешивают в атмосфере аргона при комнатной температуре в течение 16 ч и затем концентрируют упариванием. Остаток хроматографируют(силикагель,гексан/ этилацетат в отношении 1:1). Этим способом поименованное в заголовке соединение получают в виде бесцветного аморфного твердого вещества. 1(d, 1H), 5,0 (b, 1H), 4,5 (d, 2 Н), 3,85 (s, 3 Н), 2,92,6 (m, 5 Н), 1,3 (bs, 9H). в) 4-(N'-Meтил-N'-тpeт-бyтилoкcикapбoнил)-aминo-5-(4-хлорфенил)-пент-2-еновая кислота. Раствор, содержащий 4,0 г этилового эфира 4-(N'-метил-N'-трет-бутилоксикарбонил)амино-5-(4-хлорфенил)-пент-2-еновой кислоты и 2,3 г гидроксида лития в смеси тетрагидрофуран/метанол/вода в отношении 2/2/1, перемешивают при комнатной температуре в течение 18 ч и затем концентрируют упариванием. Остаток растворяют в 50 мл воды, подкисляют до значения рН 2 с помощью 0,1 н. соляной кислоты и дважды экстрагируют этилацетатом. Объединенные органические фазы промывают водой и насыщенным раствором NaCl, высушивают(ppm): 7,30 (d, 2H), 7,20 (d, 2H), 6,80 (dd, 1H),5,81 (d, 1H), 4,85 (m, 1H), 2,75 (d, 2H), 2,63 (s,3 Н), 1,35 (s, 9H). г) Этиловый эфир 4-(N'-метил-N'-третбутилоксикарбонил)-амино-5-(4-хлорфенил)пент-2-еновой кислоты. К раствору, содержащему 6,72 г триэтилового эфира фосфоноуксусной кислоты в 120 мл абсолютного тетрагидрофурана, добавляют порциями при 0 С 1,44 г гидрида натрия (приблизительно 55% в масле) и смесь перемешивают при этой температуре в течение 30 мин. Затем к смеси по каплям добавляют раствор, содержащий 5,0 г N'-метил-N'-трет-бутилоксикарбонил-(4-хлорфенил)-аланиналя (в 20 мл THF). В течение следующего часа по окончании добавления смесь перемешивают при температуре 0 С. Вслед за этим реакционную смесь выливают в воду и дважды экстрагируют, используя по 150 мл этилацетата каждый раз. Объединенные органические фазы промывают три раза водой и 32 один раз насыщенным раствором NaCl, высушивают (сульфат магния) и концентрируют упариванием. Остаток очищают хроматографией (силикагель/этилацетат в отношении 3:1). Этим способом поименованное в заголовке соединение получают в виде бесцветного масла. 1 Н-ЯМР, 200 МГц, СDСl3, дельта (ррm): 7,35-7,05 (m, 4 Н), 6,90 (dd, 1H), 5,85 (d, 1H), 5,15(m, 0,5H), 4,90 (m, 0,5H), 4,17 (q, 2 Н), 2,90 (m,2 Н), 2,68 (s, 3 Н), 1,30 (m, 12 Н). д) N'-Метил-N'-трет-бутилоксикарбонил(4-хлорфенил)-аланиналь. Раствор, содержащий 10 г метилового эфира N'-метил-N'-трет-бутилоксикарбонил-(4 хлорфенил)-аланина в 25 мл толуола, охлаждают до -78C в атмосфере аргона. При этой температуре к нему медленно по каплям добавляют 7 мл 1 М раствора гидрида диизобутилалюминия в толуоле. По окончании добавления смесь перемешивают при указанной выше температуре в течение 2 ч. Далее к реакционной смеси добавляют 1 мл метанола и 22 мл (6 г) раствора калий-натрий тартрата. Смесь интенсивно перемешивают при температуре 0 С в течение 2 ч. Фазы разделяют и водную фазу еще раз экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают водой и насыщенным раствором NaCl, высушивают(сульфат натрия) и концентрируют упариванием. Остаток используют в последующих реакциях без дополнительной очистки. 1 Н-ЯМР, 200 МГЦ, СDСl3, дельта (ррm): 7,30-7,05 (m, 4 Н), 4,16 (m, 0,5 Н), 3,93 (m, 0,5 Н),3,25 (dd, 2H), 2,90 (m, 1H), 2,70 и 2,62 (2s, 3H),1,40 (2s, 9H). е) Метиловый эфир N'-метил-N'-третбутилоксикарбонил-(4-хлорфенил)-аланина. 80 г оксида серебра(I) добавляют при перемешивании к раствору, содержащему 20 г трет-бутилоксикарбонил-(4-хлорфенил)-аланина в 300 мл N,N-диметилформамида. Вслед за этим к смеси по каплям приливают 10,2 мл метилиодида. Реакционную смесь перемешивают при 45 С в течение 2 ч и при комнатной температуре в течение 3 дней, после чего разбавляют 600 мл этилацетата, фильтруют и концентрируют упариванием. Остаток очищают хроматографией (силикагель, гексан/этилацетат в отношении 5:1). Этим способом поименованное в заголовке соединение получают в виде бесцветного масла. 1H-ЯМР, 200 МГц, СDСl3, дельта (ррm): 7,25 (d, 2H), 7,11 (d, 2H), 4,90 (bs, 0,5H), 4,47 (bs,0,5H), 3,72 (s, 3H), 3,25 (m, 1 Н), 3,00 (dd, 1H),2,70 (s, 3H), 1,35 (s, 9H). Таким же образом, описанным в примере 1 а)-е), используя на стадии 1 б) соответствующие амины, также можно получить следующие соединения. Пример 1/1. N,N-Диметиламид 4-[N'метил-N'-(3,5-бистрифторметилбензоил)-амино]-5-(4-хлорфенил)-пент-2-еновой кислоты. 33 Кристаллы белого цвета с точкой плавления 152-153 С. Пример 1/2. N-[2-(2-пиридил)-этил]-амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2-еновой кислоты. Раствор, содержащий 1,20 г N-[2-(2 пиридил)-этил]-амида 4-(N'-метил)-амино-4-(5 хлорфенил)-пент-2-еновой кислоты, 1,06 г 3,5 бистрифторметилбензоилхлорида, 1,41 г триэтиламина и 50 мг 4-N,N-диметиламинопиридина в 80 мл метиленхлорида, перемешивают при 0 С в атмосфере аргона в течение 18 ч. Реакционную смесь разбавляют 300 мл этилацетата. Смесь промывают в делительной воронке 0,1 н. раствором гидроксида натрия, водой и насыщенным раствором NaCl, высушивают (сульфат магния) и концентрируют упариванием. Остаток хроматографируют (силикагель, метанол/этилацетат в отношении 1:10). Этим способом поименованное в заголовке соединение получают в виде аморфного твердого вещества белого цвета. Значение Rf = 0,17 (этилацетат). 1(dd, 1H), 6,11 (d, 1H), 4,9 (b, 1H), 3,56 (m, 2 Н),3,06 (m, 2 Н), 2,92 (t, 2H), 2,81 (s, 3 Н). Исходный материал может быть получен следующим образом. а)N-[2-(2-пиридил)-этил]-амид 4-(N'метил)-амино-4-(5-хлорфенил)-пент-2-еновой кислоты. Раствор, содержащий 1,8 г N-[2-(2 пиридил)-этил]-амида 4-(N'-метил-N'-третбутилоксикарбонил)-амино-4-(5-хлорфенил)пент-2-еновой кислоты и 10 мл трифторуксусной кислоты в 30 мл метиленхлорида перемешивают при комнатной температуре в атмосфере аргона в течение 5 ч. Затем реакционную смесь концентрируют упариванием и остаток растворяют в 200 мл этилацетата. Раствор этилацетата промывают 0,05 н. раствором гидроксида натрия и насыщенным раствором NaCl, высушивают (сульфат натрия), концентрируют упариванием, получая масло светло-желтой окраски, которое немедленно используют в дальнейших реакциях. б)N-этил-N'-(3-диметиламинопропил)карбодиимида, 0,83 г 4-диметиламинопиридина и 80 мл метиленхлорида, нагревают при комнатной температуре в течение 16 ч и после этого концентрируют упариванием. Остаток хроматографируют (силикагель, этилацетат). Этим способом поименованное в заголовке соединение= 0,2 (этилацетат). Пример 1/3. N-(1-метил-3-трифторацетилиндол-5-ил)-амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)-амино]-5-(4-хлорфенил)пент-2-еновой кислоты. Кристаллы белого цвета с точкой плавления 138-140. Пример 2. N-(2-метоксибензил)-амид 4[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2-еновой кислоты. Это соединение из примера 1. Оно может быть получено также в результате следующего синтеза: смесь, состоящую из 0,493 г 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2-еновой кислоты,0,137 г 2-метоксибензиламина, 0,21 г гидрохлорида N-этил-N'-(3-диметиламинопропил)-карбодиимида, 0,134 г 4-диметиламинопиридина и 10 мл метиленхлорида, перемешивают при комнатной температуре в атмосфере аргона в течение 16 ч и затем концентрируют упариванием. Остаток хроматографируют (силикагель, гексан/этилацетат в отношении 1:1). Этим способом поименованное в заголовке соединение получают в виде бесцветного аморфного твердого вещества. 1(d, 1 Н), 5,0 (b, 1H), 4,5 (d, 2H), 3,85 (s, 3H), 2,92,6 (m, 5 Н), 1,3 (bs, 9H). Исходные материалы могут быть получены следующим образом. а) 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)-амино]-5-(4-хлорфенил)-пент-2-еновая кислота. Раствор, содержащий 20 г этилового эфира 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2-еновой кислоты и 15 г гидроксида лития моногидрата в 100 мл смеси THF/метанол/вода в отношении 3:3:1,перемешивают при комнатной температуре в течение 4 ч, после чего к нему добавляют 200 мл воды и 1 н. соляной кислоты (значение рН приблизительно 2). Смесь дважды экстрагируют этилацетатом. Объединенные органические фазы промывают водой и насыщенным растворомNaCl, высушивают (сульфат магния) и концентрируют упариванием. Поименованное в заголовке соединение получают в виде бесцветного масла, которое может быть использовано далее без дополнительной очистки. б) Этиловый эфир 4-[N'-метил-N'-(3,5 бистрифторметилбензоил)-амино]-5-(4-хлорфенил)-пент-2-еновой кислоты. 22 г 3,5-бистрифторметилбензоилхлорида,16 г триэтиламина и 1 г 4-диметиламинопиридина добавляют при 0 С в атмосфере азота к раствору, содержащему 30 г трифторацетата этилового эфира 4-(N'-метил)-амино-5-(4 хлорфенил)-пент-2-еновой кислоты в 250 мл метиленхлорида. Реакционную смесь переме 35 шивают при 0 С в течение 18 ч и после этого выливают в воду. Отделяют органическую фазу,а водную фазу дважды экстрагируют метиленхлоридом. Объединенные органические фазы промывают 0,01 н. соляной кислотой, водой и насыщенным раствором NaCl, высушивают(сульфат магния) и концентрируют упариванием. Остаток хроматографируют (силикагель,гексан/этилацетат в отношении 1:1). Этим способом поименованное в заголовке соединение получают в виде бесцветного масла. 1(m, 2H), 1,25 (t, 3H). в) Трифторацетат этилового эфира 4-(N'метил)-амино-5-(4-хлорфенил)-пент-2-еновой кислоты. 60 мл трифторуксусной кислоты добавляют по каплям к раствору, содержащему 50 г этилового эфира 4-(N'-метил-N'-трет-бутилоксикарбонил)-амино-5-(4-хлорфенил)-пент-2 еновой кислоты в 200 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, после чего концентрируют упариванием. Остаток растворяют в 300 мл толуола и еще раз концентрируют упариванием. Данный этап повторяют дважды. Полученный таким образом неочищенный продукт может быть далее использован без дополнительной очистки. Аналогично примеру 2, используя соответствующие амины(вместо 2-метоксибензиламина), также можно получить следующие соединения. Пример 2/1. N-(1-метилиндол-5-ил)-амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2-еновой кислоты. Кристаллы белого цвета с точкой плавления 232-234. Пример 2/2. N-(2-пиридилметил)-амид 4[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2-еновой кислоты. Аморфное твердое вещество белого цвета. 1(dd, 1H), 6,23 (dd, 1H), 4,9 (bs, 1H), 4,49 (d, 2H),3,08 (m, 2H), 2,85 (s, 3H). Пример 2/3. N-[2-этоксикарбонил-2-этилбутил]амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2 еновой кислоты. Аморфное твердое вещество белого цвета. Пример 2/4. N-(3-метоксибензил)амид 4[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)-пент-2-еновой кислоты. Аморфное твердое вещество белого цвета. Значение Rf = 0,25 (гексан/этилацетат в отношении 1:1). 36 Пример 3. N-(2-метоксибензил)амид 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]5-(4-хлорфенил)пентановой кислоты. Поименованное в заголовке соединение получают, используя методологию, описанную в примере 1, начиная с N-(2-метоксибензил)амида 4-(N'-метил)амино-5-(4-хлорфенил)пентановой кислоты. Соединение получают в виде бесцветного аморфного твердого вещества. 1(ppm): 7,95 (s, 1 Н), 7,50 (s, 2H), 7,43 (s, 1H), 7,37,1 (m, 6H), 6,95 (d, 1H), 4,23 (d, 2H), 3,80 (s,3 Н), 2,9-2,7 (m, 5 Н), 2,25 (m, 2H), 1,92 (m, 2H). Исходные материалы могут быть получены следующим образом. а) N-(2-метоксибензил)амид 4-(N'-метил)амино-5-(4-хлорфенил)пентановой кислоты. Поименованное в заголовке соединение получают так же, как описано в примере 1 а) изN-(2-метоксибензил)амида 4-(N'-метил-N'-третбутилоксикарбонил)амино-5-(4-хлорфенил)пентановой кислоты. б) N-(2-метоксибензил)амид 4-(N'-метилN'-трет-бутилоксикарбонил)амино-5-(4-хлорфенил)пентановой кислоты. Поименованное в заголовке соединение получают так же, как описано в примере 1 б) из 4-(N'-метил-N'-трет-бутилоксикарбонил)амино 5-(4-хлорфенил)пентановой кислоты. 1H-ЯМР, 200 МГц, CDCl3, дельта (ррm): 7,25 (m, 4 Н), 7,05 (m, 2H), 6,87 (m, 2H), 4,40 (m,2H), 3,82 (s, 3 Н), 2,68 и 2,55 (2s, 3 Н), 2,65 (m,2H), 2,2-1,7 (m, 4 Н), 1,35 и 1,22 (2s, 9H). в) 4-(N'-метил-N'-трет-бутилоксикарбонил)амино-5-(4-хлорфенил)пентановая кислота. Поименованное в заголовке соединение получают так же, как описано в примере 1 в) из этилового эфира 4-(N'-метил-N'-трет-бутилоксикарбонил)амино-5-(4-хлорфенил)пентановой кислоты. 1(ppm): 7,25 (d, 2H), 7,15 (d, 2H), 4,19 (m, 1H),2,70 (2s, 2H), 2,58 (s, 3H), 2,11 (t, 2H), 1,72 (m,2H), 1,28 (s, 9H). г) Этиловый эфир 4-(N'-метил-N'-третбутилоксикарбонил)амино-5-(4-хлорфенил)пентановой кислоты. Раствор, содержащий 1,0 г этилового эфир 4-(N'-метил-N'-трет-бутилоксикарбонил)амино 5-(4-хлорфенил)пент-2-еновой кислоты (см. пример 1 г) в 30 мл тетрагидрофурана, гидрируют в течение 0,5 ч в присутствии 0,1 г палладияна-активированном угле и 0,2 г 1,2-дихлорбензола. Реакционную смесь фильтруют и концентрируют упариванием. Данный способом поименованное в заголовке соединение получают в чистом виде. 1 Н-ЯМР, 200 МГц, CDCl3, дельта (ppm): 7,25 (d, 2H), 7,12 (d, 2H), 4,12 (q, 2H), 2,72 (14,2H), 2,68 и 2,60 (2s, 3H), 2,26 (d, 2H), 1,82 (m,2H), 1,35 (m, 12H). 37 Таким же образом, описанным в примере 3, используя соответствующие амины на стадии 3 б), можно также получить следующие соединения [в случае примера 3/3 на стадии 3/3 б) вместо амина используют 2-метилбензолсульфонамид]. Пример 3/1. (4-Фенил-4-ацетиламинопиперидинамид) 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. 1 Н-ЯМР, 400 МГц, DMSO, 150, дельта(s, 3H), 2,65 (m, 2H), 2,10 (m, 2H). Пример 3/5. N-(4-этоксикарбонилфенил)амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. Кристаллы белого цвета с точкой плавления 159-160. Пример 4. N-(2-метоксибензил)амид 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]5-(4-хлорфенил)пентановой кислоты. Данное соединение описано в примере 3. Оно также может быть получено в результате следующего метода синтеза: смесь, состоящую из 0,495 г 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты, 0,137 г 2-метоксибензиламина, 0,21 г гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида, 0,134 г 4-диметиламинопиридина и 10 мл метиленхлорида, перемешивают при комнатной температуре в течение 16 ч, после чего концентрируют упариванием. Остаток очищают хроматографией (силикагель,гексан/этилацетат в отношении 1:1). Данным способом поименованное в заголовке соедине 002348 38 ние получают в виде бесцветного аморфного твердого вещества. 1 Н-ЯМР, 400 МГц, DMSO, 150, дельта(ppm): 7,95 (s, 1 Н), 7,50 (s, 2H), 7,43 (s, 1 Н), 7,37,1 (m, 6H), 6,95 (d, 1 Н), 4,23 (d, 2H), 3,80 (s,3 Н), 2,9-2,7 (m, 5 Н), 2,25 (m, 2H), 1,92 (m, 2H). Исходные материалы могут быть получены следующим образом. а) 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановая кислота. Раствор, содержащий 25 г этилового эфира 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты и 18 г гидроксида лития моногидрата в 120 мл смеси ТНF/метанол/вода в отношении 3:3:1,перемешивают при комнатной температуре в течение 4 ч, после чего к нему добавляют 200 мл воды и 1 н. соляной кислоты (значение рН приблизительно 2). Смесь дважды экстрагируют этилацетатом. Объединенные органические фазы промывают водой и насыщенным растворомNaCl, высушивают (сульфат магния) и концентрируют упариванием. Остаток перекристаллизовывают из смеси диэтилового и петролейного эфиров. Данным способом поименованное в заголовке соединение получают в виде кристаллов белого цвета (т.пл. 125-127 С). б) Этиловый эфир 4-[N'-метил-N'-(3,5 бистрифторметилбензоил)амино 1-5-(4-хлорфенил)пентановой кислоты. Раствор, содержащий 29 г этилового эфира 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пент-2-еновой кислоты[см. пример 2b)] в 300 мл тетрагидрофурана,гидрируют в течение 0,5 ч в присутствии 3 г палладия-на-активированном угле (10%) и 6 г 1,2-дихлорбензола. Затем реакционную смесь фильтруют и концентрируют упариванием. Остаток очищают хроматографией (силикагель,гексан/этилацетат в отношении 3:1). Данным способом поименованное в заголовке соединение получают в виде бесцветного масла. 1 Н-ЯМР, 500 МГц, DMSO, 140, дельта(m, 4H), 2,35 (m, 2H), 2,02 (m, 1H), 1,90 (m, 1H),1,19 (t, 3H). Аналогично примеру 4, при использовании соответствующих аминов (вместо 2-метоксибензиламина), можно также получить следующее соединение. Пример 4/1. N-(1-метилиндол-5-ил)-амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. Аморфное твердое вещество белого цвета. 1 Н-ЯМР, 500 МГц, DMSO, 140, дельта 39 Пример 5. N-изопропиламид 4-[N'-метилN'-(3,5-бистрифторметилбензоил)амино]-5-(4 хлорфенил)пентановой кислоты. 13,2 мг триэтиламина добавляют к раствору, содержащему 50 мг гидроксисукцинимидного эфира 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты и 5,6 мг изопропиламина в 1,5 мл метиленхлорида. Реакционную смесь оставляют при комнатной температуре в течение 18 ч. После этого к ней добавляют 0,5 мл 1 н. раствора карбоната калия и интенсивно встряхивают. После разделения фаз органическую фазу отбирают и концентрируют упариванием. Данным способом поименованное в заголовке соединение получают в виде пены белого цвета. Значение Rf=0,36 (этилацетат). а) Гидроксисукцинимидный эфир 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]5-(4-хлорфенил)пентановой кислоты. Раствор, содержащий 5 г 4-[N'-метил-N'(3,5-бистрифторметилбензоил)амино]-5-(4 хлорфенил)пентановой кислоты, 1,255 г Nгидроксисукцинимида и 2,335 г N,N'-дициклогексилкарбодиимида в 250 мл тетрагидрофурана, перемешивают при комнатной температуре в течение 18 ч. Затем реакционный раствор фильтруют, переводят в эфир, еще раз фильтруют и концентрируют упариванием. Данным способом поименованное в заголовке соединение получают в виде бесцветной (белой) пены. Способом, аналогичным описанному в примере 5, можно также получить следующие соединения. Пример 5/1. N,N-Дипропиламид 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]5-(4-хлорфенил)пентановой кислоты. Значение Rf=0,29 (гексан:этилацетат 1:1). Пример 5/2. N-Аллиламид 4-[N'-метил-N'(3,5-бистрифторметилбензоил)амино]-5-(4 хлорфенил)пентановой кислоты. Значение Rf=0,15 (гексан:этилацетат 1:1). Пример 5/3. N-(2-N",N"-Диэтиламиноэтил)амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf=0,1 (гексан:этилацетат 1:1). Пример 5/4. N-(2-Гидроксиэтил)амид 4[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf=0,11 (метиленхлорид:метанол 95:5). Пример 5/5. (Пиперидинамид) 4-[N'-метилN'-(3,5-бистрифторметилбензоил)амино]-5-(4 хлорфенил)пентановой кислоты. Значение Rf=0,27 (метиленхлорид:метанол 95:5). Пример 5/6. N-Метил-N-(3-хлорбензил) амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. 41 Пример 5/18. N-Метил-N-(2-гидроксиэтил) амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf = 0,4 (этилацетат:метанол 5:1). Пример 5/19. N-(2-Гидроксиэтил)-N-(1 метил-2-гидроксиэтил)амид 4-[N'-метил-N'-(3,5 бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf = 0,35 (этилацетат:метанол 5:1). Пример 5/20. N-[2-(3,4-Дигидроксифенил)этил]амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)-амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf = 0,25 (этилацетат). Пример 5/21. 4-[2-(4-Хлорфенил)этил]пиперазин-1-амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил)амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf = 0,3 (метиленхлорид:метанол 95:5). Пример 5/22. N-[2-(2-Пиридил)этил]амид 4-[N'-метил-N'-(3,5-бистрифторметилбензоил) амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf = 0,21 (этилацетат:метанол 95:5). Пример 5/23. N-(3-Метоксибензил)амид 4[N'-метил-N'-(3,5-бистрифторметилбензоил) амино]-5-(4-хлорфенил)пентановой кислоты. Значение Rf = 0,25 (гексан:этилацетат 1:1). Взаимодействие анилинов с 4-[N'-метилN'-(3,5-бистрифторметилбензоил)амино]-5-(4 хлорфенил)пентановой кислотой с целью образования соответствующих амидов проводят,например, в присутствии ангидрида пропанфосфоновой кислоты. Пример 6. N-(4-Изопропилфенил)амид 4[N'-метил-N'-(3,5-бистрифторметилбензоил) амино]-5-(4-хлорфенил)пентановой кислоты. Смесь, состоящую из 41,6 мг 4-[N'-метилN'-(3,5-бистрифторметилбензоил)амино]-5-(4 хлорфенил)пентановой кислоты, 12,8 мг 4 изопропиланилина, 36,65 мг ангидрида пропанфосфоновой кислоты, 37 мг триэтиламина и 1,5 мл метиленхлорида, оставляют при комнатной температуре на 18 ч. Затем к смеси добавляют 0,5 мл 1 н. раствора карбоната калия и интенсивно встряхивают. После разделения фаз органическую фазу отделяют и концентрируют упариванием. Данным способом поименованное в заголовке соединение получают в виде пены белого цвета. Значение Rf = 0,26 (этилацетат). Способом, аналогичным описанному в примере 6, можно также получить следующие соединения. Пример 6/1. N-Этил-N-фениламид 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]5-(4-хлорфенил)пентановойкислоты. Значение Rf = 0,66 (метиленхлорид:метанол 95:5).N-Циклогексилизопропиламин (10,4 мг; 1,2 экв.) и триэтиламин (10,4 мкл; 1,2 экв.) растворяют в дихлорметане (1 мл) и к раствору добавляют гидроксисукцинимидный эфир из примера 7(в) (35 мг; 0,06 ммоль). Раствор оставляют при комнатной температуре в течение 2 дней. Далее его промывают 1 н. раствором карбоната калия (0,5 мл) и растворитель концентрируют упариванием. Rf = 0,68 (этилацетат:метанол 1:1). Взаимодействие (1 Н-индол-3-ил)уксусной кислоты с образованием этилового эфира 4-(1 Ниндол-3-ил)-3-метиламинобутановой кислоты описано в примере 14(а) и (б). а) Этиловый эфир 3-[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-4-(1Hиндол-3-ил)бутановой кислоты. Этиловый эфир 4-(1 Н-индол-3-ил)-3 метиламинобутановой кислоты (24,2 г; 92 ммоль) помещают в дихлорметане в ледяную баню и к нему добавляют 3,5-бистрифторметилбензоилхлорид (16,7 мл; 1,0 экв.). Смесь перемешивают при комнатной температуре в течение 2 ч, после чего к ней добавляет 1 н. соляную кислоту; смесь экстрагируют дихлорметаном,высушивают над сульфатом магния и концентрируют упариванием. Кристаллизация остатка из гексана дает поименованное в заголовке соединение в виде кристаллов светло-бежевой окраски, Rf = 0,56 (этилацетат/гексан 1/2). б) 3-[N'-(3,5-Бистрифторметилбензоил)-N'метиламино]-4-(1 Н-индол-3-ил)бутановая кислота. 43 Эфир из примера 7(а) (48,2 г; 96 ммоль) помещают в тетрагидрофуран (600 мл) и воду(440 мл) и добавляют 3 М раствор гидроксида лития (160 мл; 5 экв.). Смесь перемешивают при комнатной температуре в течение 17 ч. Затем к смеси добавляют 1 н. соляную кислоту и проводят экстракцию этилацетатом. Высушивание над сульфатом магния и концентрирование с помощью упаривания дают поименованное в заголовке соединение в виде твердой пены светло-коричневой окраски. Rf = 0,64 (этилацетат). в) N-Гидроксисукцинимидный эфир 3-[N'(3,5-бистрифторметилбензоил)-N'-метиламино]4-(1 Н-индол-3-ил)бутановой кислоты. Кислоту из примера 7(б) (45 г, 95 ммоль),N,N-диметиламинопиридин (2,33 г; 0,2 экв.) и гидрохлоридN-гидроксисукцинимид (11,9 г; 1,05 экв.). Смесь перемешивают при комнатной температуре в течение ночи и выливают в 5%-ную лимонную кислоту во льду. Экстракция дихлорметаном, высушивание над сульфатом магния и концентрирование упариванием дает масло желтого цвета, которое хроматографируют на силикагеле в системе растворителей гексан/этилацетат в отношении 1/9. Поименованное в заголовке соединение получают в виде твердой пены, Rf = 0,54 (этилацетат). Следующие соединения получают аналогично примеру 7. Пример 7/1. [2-(2-Гидроксиэтил)пиперидинамид] 3-[N'-(3,5-бистрифторметилбензоил)N'-метиламино]-4-(1 Н-индол-3-ил)бутановой кислоты.Rf = 0,86 (этилацетат/метанол 1:1). Пример 8. N-Фениламид 3-[N'-(3,5 бистрифторметилбензоил)-N'-метиламино]-4(1H-индол-3-ил)бутановой кислоты. Анилин (8,3 мг; 1,2 экв.) помещают в дихлорметан (0,5 мл) и к нему добавляют триэтиламин (52 мкл; 5 экв.) и 3-[N'-(3,5 бистрифторметилбензоил)-N'-метиламино]-4(1H-индол-3-ил)бутановую кислоту [пример 7(б)] (35 мг; 0,07 мл). К смеси добавляют ангидрид пропанфосфоновой кислоты (31,6 мг; 4 экв. в 0,5 мл смеси этилацетат/дихлорметан), после чего смесь оставляют при комнатной температуре на 24 ч. Далее ее промывают 1 н. раствором карбоната калия (0,5 мл) и растворитель концентрируют упариванием. Полученное поименованное в заголовке соединение имеет значение Rf = 0,69 (этилацетат). Следующие соединения получают аналогично примеру 8. Пример 8/1. N-Этил-N-фениламид 3-[N'(3,5-бистрифторметилбензоил)-N'-метиламино]4-(1H-индол-3-ил)бутановой кислоты.N-Циклогексилизопропиламин (10,5 мг; 1,2 экв.) и триэтиламин (10,4 мкл; 1,2 экв.) растворяют в дихлорметане (1 мл) и к раствору добавляют гидроксисукцинимидный эфир из примера 9(г) (35 мг; 0,06 ммоль). Раствор оставляют при комнатной температуре на 2 дня. Далее смесь промывают 1 н. раствором карбоната калия (0,5 мл) и растворитель концентрируют упариванием. Rf = 0,64 (этилацетат/метанол 1:1). а) Этиловый эфир 4-(4-хлорфенил)-3-оксобутановой кислоты. 4-Хлорфенилуксусную кислоту (34,1 г; 0,2 моль) растворяют в тетрагидрофуране (260 мл). В условиях охлаждения в ледяной бане к раствору добавляют сначала карбонилдиимидазол(38,8 г; 1,1 экв.), а затем дополнительные 100 мл тетрагидрофурана. Суспензию белого цвета перемешивают при температуре 0 С в течение 2 ч. Смеси позволяют нагреться до комнатной температуры, после чего к ней добавляют магниевую соль бис-(моноэтилового эфира малоновой кислоты) (68,6 г; 1,15 экв.). Смесь перемешивают при комнатной температуре в течение ночи,далее часть растворителя концентрируют упариванием и к смеси добавляют 6 н. соляную кислоту и диэтиловый эфир. Органическую фазу промывают раствором бикарбоната и солевым 45 раствором, высушивают над сульфатом магния и концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла желтого цвета, Rf = 0,83 (дихлорметан/метанол 19:1). б) Этиловый эфир 4-(4-хлорфенил)-3 метиламинобутановой кислоты. Кетоэфир из примера 9(а) помещают в дихлорметан (345 мл) и к нему добавляют метиламин (27% в этаноле; 71 мл; 5 экв.), безводный сульфат магния (121 г; 8 экв.) и ледяную уксусную кислоту (1,5 мл). Реакционную смесь перемешивают при температуре 40 С в течение 3 дней, затем фильтруют, промывают остаток дихлорметаном и объединенные фильтраты концентрируют упариванием. Остаток растворяют в метаноле (150 мл) и к нему добавляют буферный раствор, приготовленный из ацетата натрия и ледяной уксусной кислоты (100 мл; 1 М в метаноле). Далее добавляют цианборгидрид натрия (85%; 10,2 г; 1,1 экв.) и смесь перемешивают при комнатной температуре в течение 2 ч. После добавления 1 н. соляной кислоты (450 мл) реакционную смесь концентрируют и к ней добавляют диэтиловый эфир. Экстракцию смеси осуществляют с помощью 1 н. соляной кислоты. Кислотную водную фазу подщелачивают гидроксидом калия и экстрагируют этилацетатом. Поименованное в заголовке соединение получают в виде масла желтого цвета, Rf = 0,1 (этилацетат). в) Этиловый эфир 3-[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-4-(4-хлорфенил)бутановой кислоты. Амин из примера 9(б) (23,8 г; 93 ммоль) в дихлорметане помещают в ледяную баню и к нему добавляют бис-трифторбензоилхлорид(16,8 мл; 1,0 экв.). Смесь перемешивают при комнатной температуре в течение 2 ч, после чего к ней добавляют 1 н. соляную кислоту. Смесь экстрагируют дихлорметаном, высушивают над сульфатом магния и концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла желтого цвета,которое в неочищенном виде используют в последующих реакциях. Rf = 0,59 (этилацетат/гексан 1/2). г) 3-[N'-(3,5-Бистрифторметилбензоил)-N'метиламино]-4-(4-хлорфенил)бутановая кислота. Эфир из примера 9(с) (52,2 г; 0,1 моль) помещают в тетрагидрофуран (600 мл) и воду (430 мл) и добавляют 3 М раствор гидроксида лития(176 мл; 5 экв.). Смесь перемешивают при комнатной температуре в течение ночи. Далее к ней добавляют 1 н. соляную кислоту и осуществляют экстракцию с помощью этилацетата. Высушивание над сульфатом магния и концентрирование упариванием дает поименованное в заголовке соединение в виде твердой пены светложелтой окраски, Rf = 0,18 (этилацетат). 46 д) (N-Гидроксисукцинимидный) эфир 3[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-4-(4-хлорфенил)бутановой кислоты. Кислоту из примера 9(г) (49 г; 105 ммоль),N,N-диметиламинопиридин (2,56 г, 0,2 экв.) и гидрохлоридN-(3-диметиламинопропил)-N'этилкарбодиимида (22,8 г; 1,1 экв.) помещают в дихлорметан и к этой смеси в ледяной бане добавляют N-гидроксисукцинимид (13,1 г; 1,05 экв.). Смесь перемешивают при комнатной температуре в течение ночи. Далее содержимое реакционной смеси выливают в 5%-ную лимонную кислоту во льду. Экстракция дихлорметаном, высушивание над сульфатом магния и концентрирование упариванием дает масло желтого цвета, которое хроматографируют на силикагеле в системе растворителей гексан:этилацетат в отношении 1:9. Поименованное в заголовке соединение получают в виде твердой пены, Rf = 0,62 (этилацетат). Следующие соединения получают аналогично примеру 9. Пример 9/1. [2-(2-Гидроксиэтил)пиперидинамид] 3-[N'-(3,5-бистрифторметилбензоил)N'-метиламино]-4-(4-хлорфенил)бутановой кислоты.(52 мкл; 5 экв.) и кислоту из примера 9(г) (35 мг; 0,07 ммоль). Далее добавляют ангидрид пропанфосфоновой кислоты (31,6 мг; 4 экв. в 0,5 мл смеси этилацетат/дихлорметан) и смесь оставляют при комнатной температуре на 24 ч. Смесь промывают 1 н. раствором карбоната калия (0,5 мл) и концентрируют упариванием. Rf = 0,52 47 Следующие соединения получают аналогично примеру 10. Пример 10/1. N-Этил-N-фениламид 3-[N'(3,5-бистрифторметилбензоил)-N'-метиламино]4-(4-хлорфенил)бутановой кислоты.(0,0724 ммоль) бензилметиламина и смесь оставляют при комнатной температуре на 16 ч. Далее реакционную смесь промывают 0,5 мл 1 н. водного раствора карбоната калия. Водную фазу экстрагируют 1,1 мл метиленхлорида. Объединенные органические фазы концентрируют упариванием в вакуумной центрифуге. Поименованное в заголовке соединение получают в виде пены белого цвета. ТСХ:метиленхлорид/ацетон(7:3) Rf = 0,48. Исходные соединения получают следующим образом. а) Этиловый эфир 3-оксо-4-(2-нафтил)бутановой кислоты. К раствору, содержащему 17,5 г (94 ммоль) нафтилуксусной кислоты в 180 мл тетрагидрофурана, при температуре 0 С добавляют 16,8 г (103 ммоль) карбонилдиимидазола в виде одной порции. Вместе со вспениванием образуется густая суспензия белого цвета. Через 2 ч реакционную смесь нагревают до комнатной температуры и к ней добавляют 32,2 г (108 ммоль) магниевой соли бис-(моноэтилового эфира малоновой кислоты) (D.W. Brooks, L.D.L. LuS. Masamune; Angew. Chem. 91, 76(1979). По окончании перемешивания в течение 18 ч при комнатной температуре к смеси добавляют 150 мл охлажденной во льду 6 н. соляной кислоты; далее добавляют эфир и производят отделение органической фазы, которую промывают насыщенным водным раствором бикарбоната натрия и солевым раствором. Поименованное в заголовке соединение получают в виде масла светло-желтой окраски. б) Этиловый эфир 3-метиламино-4-(2 нафтил)бут-2-еновой кислоты. 52 мл (462 ммоль) 27,3%-ного раствора метиламина в этаноле, 100 г сульфата магния и 1 мл уксусной кислоты добавляют к раствору,содержащему 23,7 г (92,5 ммоль) этилового эфира 3-оксо-4-нафтилбутановой кислоты в 250 мл метиленхлорида, и полученную смесь пере 002348 48 мешивают при температуре 40 С в течение 18 ч. Далее смесь фильтруют и отфильтрованный остаток промывают с помощью 1,5 л смеси метиленхлорид/этанол (95:5). Поименованное в заголовке соединение получают в виде неочищенного продукта. 1H-ЯМP, 200 МГц, СDСl3, (E/Z или Z/E смесь 1:3), дельта (ppm): 8,6 (b, 1H), 7,9-7,3 (m,7H), 4,53, 4,42 (2s, 1H), 4,17, 4,11 (2q, 2H), 3,7 (s,2H), 2,83, 2,68 (2d, 3 Н), 1,27 (t, 3 Н). в) Этиловый эфир 3-метиламино-4-(2 нафтил)бутановой кислоты. 2 мл (17,6 ммоль) 27,3%-ного раствора метиламина в этаноле и 5,5 мл уксусной кислоты добавляют к раствору, содержащему 24,9 г (92,5 ммоль) этилового эфира 3-метиламино-4-(2 нафтил)бут-2-еновой кислоты в 250 мл этанола,и полученную смесь охлаждают до температуры 0 С. Далее к суспензии добавляют 6,4 г (87 ммоль) 85% цианборгидрида натрия и дополнительные 5,5 мл уксусной кислоты. Реакционную смесь оставляют при перемешивании на 2 ч для нагревания до комнатной температуры. К прозрачному раствору добавляют дополнительные 0,64 г (8,7 ммоль) цианборгидрида натрия и перемешивание при комнатной температуре продолжают в течение еще 2 ч. Далее к смеси добавляют 400 мл 1 н. соляной кислоты, реакционную смесь перемешивают в течение 1 ч, после чего этанол упаривают на роторном испарителе. Водную фазу дважды промывают эфиром и эфирные фазы экстрагируют 1 н. соляной кислотой. К объединенным водным фазам добавляют этилацетат и смесь подщелачивают с помощью твердого карбоната калия; органическую фазу отделяют и промывают солевым раствором. Поименованное в заголовке соединение получают в виде масла светло-коричневой окраски. ИК: 1725 см-1; 1 Н-ЯМР, 200 МГц, СDСl3,дельта (ppm): 7,86-7,32 (m, 7 Н), 4,12 (q, 2H), 3,26(ABxd, 2H), 2,44 (s, 3H), 1,25 (t, 3H). г) 3-[N'-(3,5-Бистрифторметилбензоил)-N'метиламино]-4-(2-нафтил)бутановая кислота. К раствору, содержащему 22,5 г (83,1 ммоль) этилового эфира 3-метиламино-4-(2 нафтил)бутановой кислоты в 500 мл третбутилметилового эфира, в течение 5 мин по каплям последовательно добавляют 25,3 г (91,4 ммоль) 3,5-бистрифторметилбензоилхлорида и 13,3 мл (95,6 ммоль) триэтиламина. По окончании выдерживания смеси в течение 12 ч при комнатной температуре к ней в течение 10 мин добавляют 16,6 г (415 ммоль) гидроксида натрия, растворенного в 150 мл метанола, и смесь перемешивают в течение 5 ч. Далее при температуре 0 С добавляют 275 мл 2 н. соляной кислоты и смесь промывают 300 мл этилацетата. После концентрирования на роторном испарителе поименованное в заголовке соединение кристаллизуется из смеси трет-бутилметиловый эфир/гексан в виде игольчатых кристаллов бе 49 лого цвета. Т.пл.: 128-130 С; ИК: 3400-2500 (b),1710, 1635 см-1; 1 Н-ЯМР, 200 МГц, СDСl3, дельта (ppm): 7,9-6,93 (m, 10 Н), 5,01, 4,30 (2m, rotamer, 1H), 3,9-2,6 (m, 4H), 3,18, 2,68 (2s,rotamer, 3H). д) N-Гидроксисукцинимидный эфир 3-[N'(3,5-бистрифторметилбензоил)-N'-метиламино]4-(2-нафтил)бутановой кислоты. К раствору, содержащему 15 г (31 ммоль) 3-[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-4-(2-нафтил)бутановой кислоты в 100 мл метиленхлорида, добавляют 3,75 г (32,6 ммоль)N-гидроксисукцинимида и 0,76 г (6,2 ммоль) 4 диметиламинопиридина и смесь охлаждают до 0 С. Затем к смеси добавляют 6,54 г (34,1 ммоль) гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида,реакционную смесь перемешивают при 0 С в течение 10 мин и далее при комнатной температуре в течение 3,5 ч. Смесь промывают 5%-ной лимонной кислотой, высушивают над сульфатом натрия и концентрируют упариванием в роторном испарителе. Поименованное в заголовке соединение кристаллизуется из диэтилового эфира в виде кристаллов белого цвета. Т.пл.: 131 С; ДП-МС: М+=580; 1 Н-ЯМР, 200 МГц, СDСl3, дельта(ррm): 7,9-6,95 (m, 10 Н), 4,89, 4,36 (2m, rotamer,1H), 3,6-2,7 (m, 8 Н), 2,84, 2,69 (2s, rotamer, 3H). Пример 12. N-(4-Хлор-2-метилфенил)амид 3-[N'-(3,5-бистрифторметилбензоил)-N'метиламино 1-4-(2-нафтил)бутановой кислоты. Раствор, содержащий 0,055 мл (0,393 ммоль) триэтиламина и 38 мг (0,0786 ммоль) 3[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-4-(2-нафтил)бутановой кислоты в 0,5 мл метиленхлорида, и раствор, содержащий 33,3 мг ангидрида 1-пропанфосфоновой кислоты в 0,4 мл метиленхлорида, последовательно добавляют к 10,3 мг (0,0943 ммоль) 4-хлор-2 метиланилина и смесь оставляют на ночь (16 ч) при комнатной температуре. Далее реакционную смесь промывают 0,5 мл 1 н. водного раствора карбоната калия. Водную фазу экстрагируют дополнительными 0,8 мл метиленхлорида. Объединенные органические фазы концентрируют упариванием на вакуумной центрифуге. Поименованное в заголовке соединение получают в виде пены белого цвета. ТСХ: метиленхлорид/ацетон (7:3), Rf = 0,48. Пример 13. Способом, аналогичным примерам 11 и 12, получают следующие соединения. Пример 13/1. (Азокан-1-амид) 3-[N'-(3,5 бистрифторметилбензоил)-N'-метиламино]-4-(2 нафтил)бутановой кислоты. ТСХ: этилацетат/гексан (1:1), Rf = 0,37. Пример 13/2. (4,4-Дигидроксипиперидинамид) 3-[N'-(3,5-бистрифторметилбензоил)-N'метиламино]-4-(2-нафтил)бутановой кислоты. ТСХ: этилацетат/гексан (1:1), Rf = 0,06.N-(4-Диметиламинофенил)амид 3-[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-4-(2-нафтил)бутановой кислоты. ТСХ: этилацетат/гексан (1:1), Rf = 0,16. Пример 14. [4-(4-Метоксифенил)пиперазинамид] 5-[N'-(3,5-бистрифторметилбензоил)N'-метиламино]-6-(1H-индол-3-ил)гексановой кислоты. 80 мг (0,134 ммоль) N-Гидроксисукцинимидилового эфира 5-[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-6-(1 Н-индол-3-ил)гексановой кислоты растворяют в 5 мл метиленхлорида и к раствору последовательно добавляют 68 мл (0,48 ммоль) триэтиламина и 42,5 мг (0,16 ммоль) дигидрохлорида 1-(4 метоксифенил)пиперазина. Реакционную смесь перемешивают при комнатной температуре в течение 20 ч, затем дважды промывают водным раствором карбоната калия. Водную фазу дважды экстрагируют метиленхлоридом, органические фазы объединяют, высушивают над сульфатом магния и концентрируют упариванием. Остаток хроматографируют на силикагеле, используя в качестве подвижной фазы этилацетат. Поименованное в заголовке соединение получают в виде пены белого цвета. МС (ЭИ): 674(М+), 544, 403, 241, 213, 130. ТСХ: этилацетат,Rf = 0,25. а) Этиловый эфир 4-(1 Н-индол-3-ил)-3 оксобутановой кислоты. К раствору, содержащему 24,5 г (140 ммоль) 3-индолуксусной кислоты в 250 мл тетрагидрофурана, при температуре 0 С добавляют 24,95 г (154 ммоль) карбонилдиимидазола и смесь перемешивают при 0 С в течение 30 мин. Далее добавляют 46 г (161 ммоль) магниевой соли бис-(моноэтилового эфира малоновой ки 002348 52 слоты) и смесь перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь концентрируют упариванием и к ней добавляют охлажденную во льду 6 н. соляную кислоту; добавляют диэтиловый эфир и отделяют органическую фазу, которую промывают 10% водным раствором бикарбоната натрия и солевым раствором, высушивают над сульфатом магния и концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла оранжевого цвета. 1 Н-ЯМР (200 МГц): 8,22 (br.s,1H), 7,53 (d, 1H), 7,37 (d, 1H), 7,28-7,10 (m, 3 Н),4,23 (q, 2H), 3,93 (s, 2H), 3,46 (s, 2H), 1,22 (t, 3 Н). б) Этиловый эфир 4-(1 Н-индол-3-ил)-3 метиламинобутановой кислоты. К раствору, содержащему 33,4 г (136 ммоль) этилового эфира 4-(1 Н-индол-3-ил)-3 оксобутановой кислоты в 350 мл метиленхлорида, добавляют 75 мл (680 ммоль) приблизительно 30% раствора метиламина в этаноле, 132 г (1,1 ммоль) сульфата магния моногидрата и 1,5 мл уксусной кислоты. Смесь перемешивают при комнатной температуре в течение 66 ч. Далее смесь фильтруют и отфильтрованный остаток промывают 1,1 л метиленхлорида. Фильтрат концентрируют упариванием. К остатку (масло коричневого цвета) добавляют 250 мл метанола,22,33 г (272 ммоль) ацетата натрия, 7,8 мл (136 ммоль) уксусной кислоты и 12,8 г (163 ммоль,85% в масле) цианборгидрида натрия и смесь перемешивают при комнатной температуре в течение 16 ч. Смесь концентрируют упариванием, добавляют 1 н. соляную кислоту, после чего дважды промывают диэтиловым эфиром. Фазы диэтилового эфира три раза экстрагируют 1 н. соляной кислотой. Объединенные водные фазы охлаждают и подщелачивают с помощью 50%ного раствора гидроксида натрия. Далее добавляют этилацетат, отделяют органическую фазу,которую промывают солевым раствором, высушивают над сульфатом магния и концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла коричневого цвета. 1 Н-ЯМР (200 МГц): 8,21 (br. s, 1H), 7,64 (d,1H), 7,37 (d, 1H), 7,28-7,04 (m, 3H), 4,12 (q, 2H),3,28 (m, 1H), 2,95 (d, 2H), 2,48 (m, 5H), 1,27 (t,3H). в) Этиловый эфир 3-(N-бензилоксикарбонил-N-метил)амино-4-(1H-индол-3-ил)бутановой кислоты. К раствору, содержащему 5 г (19,2 имоль) этилового эфира 4-(1 Н-индол-3-ил)-3-метиламинобутановой кислоты в 100 мл тетрагидрофурана, при температуре 0 С добавляют 6,7 мл (48 ммоль) триэтиламина и 235 мг (1,92 имоль) 4-диметиламинопиридина. Через 10 мин к смеси в течение 20 мин по каплям добавляют 96 мл (42,3 ммоль) бензилового эфира хлормуравьиной кислоты и полученную смесь перемешивают при комнатной температуре в течение 18 ч. Смесь фильтруют и фильтрат концентри 53 руют упариванием. К остатку добавляют диэтиловый эфир и смесь фильтруют через силикагель. Фильтрат концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла коричневого цвета. МС(ЭИ): 394 (M+.), 229, 220, 130, 91. ТСХ: этилацетат/петролейный эфир (1:1), Rf = 0,41. г) 3-(N-Бензилоксикарбонил-N-метил)амино-4-(1H-индол-3-ил)бутаналь. К раствору, содержащему 8,8 г (19,2 ммоль) этилового эфира 3-(N-бензилоксикарбонил-N-метил)амино-4-(1H-индол-3-ил)-3-метиламинобутановой кислоты в 100 мл толуола, при температуре -70 С в течение одного часа по каплям добавляют 34,8 мл (41,6 ммоль) 20%-ного раствора гидрида диизобутилалюминия в толуоле. После перемешивания в течение 2 ч при-70 С к смеси медленно по каплям добавляют 6 мл метанола. Далее при температуре 0 С в течение одного часа по каплям добавляют раствор,содержащий 51 г калий-натрий тартрата в 200 мл воды. Смесь перемешивают при 0 С в течение 18 ч и затем разбавляют диэтиловым эфиром. Органическую фазу отделяют, промывают водой и солевым раствором, высушивают над сульфатом магния и концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла коричневого цвета. МС (ЭИ): 350 (М+.), 185, 176, 130, 91. ТСХ: этилацетат/петролейный эфир (1:1), Rf = 0,32. д) Этиловый эфир 5-(N-бензилоксикарбонил-N-метил)амино-6-(1 Н-индол-3-ил)-гекс-2 еновой кислоты. К раствору, содержащему 3,76 мл (18,8 ммоль) триэтилового эфира фосфоноуксусной кислоты в 50 мл тетрагидрофурана, добавляют при 0 С в четыре приема 684 мг (15,7 ммоль) 55%-ного гидрида натрия в масле. По истечении 30 мин к смеси при 0 С в течение одного часа по каплям добавляют 7,6 г (19,21 ммоль) 3-(Nбензилоксикарбонил-N-метил)амино-4-(1Hиндол-3-ил)бутаналя в 50 мл тетрагидрофурана. Через 1 ч смесь выливают в лед и экстрагируют этилацетатом. Органическую фазу промывают ледяной водой и солевым раствором, после чего концентрируют упариванием. Остаток хроматографируют на силикагеле в системе растворителей этилацетат/петролейный эфир (1:2, затем 1:1). Поименованное в заголовке соединение получают в виде масла желтоватой окраски. МС(ЭИ): 420 (М+.), 290, 246, 130, 91. ТСХ: этилацетат/петролейный эфир (1:1), Rf = 0,67. е) Соль трифторуксусной кислоты этилового эфира 6-(1 Н-индол-3-ил)-5-метиламиногексановой кислоты. Раствор, содержащий 1,0 г (2,38 ммоль) этилового эфира 5-(N-бензилоксикарбонил-Nметил)амино-6-(1H-индол-3-ил)-гекс-2-еновой кислоты в 20 мл этанола и 0,38 мл (5 ммоль) трифторуксусной кислоты, гидрируют под давлением водорода 1 атм в присутствии 200 мг 5% палладия-на-угле при температуре 22 С. По ис 002348 54 течении 3 ч суспензию фильтруют через Hyflo,промывают этанолом и фильтрат концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла желтого цвета. МС (ЭИ): 243 (M+. -EtO), 173, 158, 130, 112,70. ТСХ: этилацетат, Rf = 0,11. ж) Этиловый эфир 5-[N-(3,5-бистрифторметилбензоил)-N-метиламино]-6-(1H-индол-3 ил)гексановой кислоты. К раствору, содержащему 0,49 мл (2,61 ммоль) 97% 3,5-бистрифторметилбензоилхлорида в 10 мл тетрагидрофурана, при 0 С добавляют в течение 30 мин по каплям сначала 1,16 мл (8,32 ммоль) триэтиламина, а затем раствор, содержащий 947 мг (2,38 ммоль) соли трифторуксусной кислоты этилового эфира 6(1 Н-индол-3-ил)-5-метиламиногексановой кислоты в 10 мл тетрагидрофурана. Смесь перемешивают при комнатной температуре в течение 18 ч, фильтруют и промывают 10 мл тетрагидрофурана. Фильтрат концентрируют упариванием и добавляют к нему диэтиловый эфир. Далее смесь фильтруют через силикагель и фильтрат концентрируют упариванием. Поименованное в заголовке соединение получают в виде масла коричневого цвета. МС (ЭИ): 528(М+.), 483, 398, 257, 241, 130. ТСХ: этилацетат,Rf = 0,66. з) 5-[N-(3,5-Бистрифторметилбензоил)-Nметиламино]-6-(1H-индол-3-ил)гексановая кислота. К раствору, содержащему 970 мг (1,84 ммоль) этилового эфира 5-[(3,5-бистрифторметилбензоил)-N-метиламино]-6-(1H-индол-3 ил)гексановой кислоты в 10 мл тетрагидрофурана, добавляют при комнатной температуре раствор, содержащий 108 мг (1,93 ммоль) гидроксида натрия в 1 мл воды. Смесь перемешивают при комнатной температуре в течение 18 ч, после чего к ней добавляют 10 мл воды и 20 мл диэтилового эфира. Водную фазу отделяют и подкисляют с помощью 6 н. соляной кислоты. Далее добавляют этилацетат и производят экстракцию продукта. Объединенные органические фазы промывают солевым раствором, высушивают над сульфатом магния и концентрируют упариванием. Поименованное в заголовке соединение кристаллизуется из смеси диэтиловый эфир/гексан в виде кристаллов белого цвета. Т.пл.: 152-157 С. МС (ЭИ): 500 (М+.), 370, 241,229, 130. ТСХ: (этилацетат/уксусная кислота 99:1), Rf = 0,49. и) N-Гидроксисукцинимидиловый эфир 5[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-6-(1H-индол-3-ил)-гексановой кислоты. К 380 мг (0,759 ммоль) 5-[N-(3,5 бистрифторметилбензоил)-N-метиламино]-6(1 Н-индол-3-ил)гексановой кислоты в 5 мл метиленхлорида добавляют 19 мг (0,15 ммоль) 4 диметиламинопиридина и 92 мг (0,798 ммоль)N-гидроксисукцинимида. Смесь охлаждают до 0 С и к ней добавляют 160 мг (0,835 ммоль) 55 гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида. Реакционную смесь перемешивают в течение 15 мин при 0 С, а затем в течение 20 ч при комнатной температуре. Смесь промывают 10% лимонной кислотой и солевым раствором. Органическую фазу высушивают над сульфатом магния и концентрируют упариванием. Поименованное в заголовке соединение кристаллизуется из смеси диэтиловый эфир/гексан в виде кристаллов белого цвета. Т.пл.: 159-160 С; МС (ЭИ): 597 (М+.), 483, 467,326, 241, 130, 44. ТСХ: этилацетат, Rf = 0,57. Следующие соединения получают аналогично примеру 14. Пример 14/1. N-Бутил-N-(2-гидроксиэтил)амид 5-[N'-(3,5-бистрифторметилбензоил)-N'метиламино]-6-(1 Н-индол-3-ил)гексановой кислоты. Пример 14/2. N,N-бис(2-Цианоэтил)амид 5-[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-6-(1H-индол-3-ил)гексановой кислоты. Пример 14/3. (4-Морфолинамид) 5-[N'(3,5-бистрифторметилбензоил)-N'-метиламино]6-(1 Н-индол-3-ил)гексановой кислоты. Пример 14/4. (1,2,4-Триазол-1-амид) 5-[N'(3,5-бистрифторметилбензоил)-N'-метиламино]6-(1H-индол-3-ил)гексановой кислоты. Пример 14/5. N-Метиламид 5-[N'-(3,5 бистрифторметилбензоил)-N'-метиламино]-6(1 Н-индол-3-ил)гексановой кислоты. Пример 15. N-(2-Хлор-4-метилфенил) амид 5-[N'-(3,5-бистрифторметилбензоил)-N'метиламино]-6-(1H-индол-3-ил)гексановой кислоты. 160 мг(0,268 ммоль) 5-[N-(3,5 бистрифторметилбензоил)-N-метиламино]-6(1H-индол-3-ил)гексановой кислоты растворяют в 10 мл метиленхлорида и к раствору добавляют 222 мл (1,34 ммоль) триэтиламина, 48 мл (0,382 ммоль) 2-хлор-4-метиланилина и 271 мл 50%ного раствора ангидрида пропилфосфоновой кислоты в этилацетате. Реакционную смесь перемешивают при комнатной температуре в течение 20 ч, после чего дважды промывают водным раствором карбоната калия. Водную фазу дважды экстрагируют метиленхлоридом, органические фазы объединяют, высушивают над сульфатом магния и концентрируют упариванием. Остаток хроматографируют на силикагеле в системе растворителей этилацетат/петролейный эфир (первоначально в отношении 1:2, затем 3:1). Поименованное в заголовке соединение получают в виде кристаллов белого цвета. МС (ЭИ): 352, 241, 222, 213, 130. ТСХ: этилацетат, Rf = 0,59. Следующие соединения получают аналогично примеру 15. Пример 15/1. N-(2,5-Дихлорфенил)амид 5[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-6-(1H-индол-3-ил)гексановой кислоты. 56 Пример 15/2. (3-Ацетилиндол-1-амид) 5[N'-(3,5-бистрифторметилбензоил)-N'-метиламино]-6-(1H-индол-3-ил)гексановой кислоты. Пример 15/3. N-(пиразин-2-ил)амид 5-[N'(3,5-бистрифторметилбензоил)-N'-метиламино]6-(1H-индол-3-ил)гексановой кислоты. Пример 16. N-Пропиламид 5-(N-(3,5)бистрифторметилбензоил-N-метил)амино-6-(4 хлорфенил)гексановой кислоты. Раствор, содержащий 0,51 г (1,03 ммоль) 5(N-(3,5)-бистрифторметилбензоил-N-метил)амино-6-(4-хлорфенил)гексановой кислоты, 0,08 ил (0,98 ммоль) пропиламина и 0,592 г (3,09 ммоль) гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида в 15 мл диметилформамида, перемешивают при комнатной температуре в атмосфере аргона в течение 24 ч. Реакционную смесь переводят в этилацетат, промывают 1 н. соляной кислотой, солевым раствором,насыщенным раствором бикарбоната и еще раз солевым раствором, высушивают над сульфатом натрия и концентрируют на роторном испарителе. Неочищенный продукт может быть очищен с помощью хроматографии на 50 г силикагеля(этилацетат/метанол 1:0-1:1). Поименованное в заголовке соединение получают в виде прозрачного масла. ТСХ: этилацетат, Rf = 0,51. а)N-трет-Бутилоксикарбонил-4-хлорфенилаланин. Раствор, содержащий 54,6 г (250 ммоль) ди-трет-бутилдикарбоната в 250 мл н-бутанола,добавляют к раствору, содержащему 50 г (250 ммоль) (R,S)-4-хлорфенилаланина в 750 мл 0,65 н. раствора гидроксида натрия, и полученную смесь перемешивают при комнатной температуре в течение 19 ч. Далее раствор дважды промывают эфиром, рН раствора доводят до 2 с помощью 2 н. соляной кислоты, после чего его дважды экстрагируют этилацетатом. Органические фазы промывают водой и солевым раствором, высушивают над сульфатом натрия и концентрируют упариванием. Неочищенный продукт кристаллизуется из гексана. Т.пл.: 145146 С. б) Метиловый эфир N-трет-бутилоксикарбонил-N-метил-4-хлорфенилаланина. РастворN-трет-Бутилоксикарбонил-4 хлорфенилаланина в 150 мл диметилформамида добавляют по каплям в атмосфере аргона в течение 30 мин при температуре 0-5 С к суспензии 6,9 г (273 ммоль) гидрида натрия (95%) в 100 мл толуола. Добавление сопровождается легким вспениванием. Раствор перемешивают в течение 15 мин при 0 С и в течение 30 мин при комнатной температуре, после чего к нему по каплям при 0 С добавляют 22,8 мл (365 ммоль) метилиодида, растворенного в 50 мл диметилформамида. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч; суспензию фильтруют, используя отсасывание,промывают этилацетатом и органические фазы концентрируют на роторном испарителе. Оста 57 ток переводят в этилацетат, содержащий небольшое количество метанола, промывают водой и солевым раствором и органическую фазу концентрируют на роторном испарителе. Неочищенный продукт фильтруют через силикагель (гексан/этилацетат 9:1). Поименованное в заголовке соединение получают в виде прозрачного масла. ТСХ: гексан/этилацетат 4:1, Rf = 0,42. в) 2-(N-трет-Бутилоксикарбонил-N-метил)амино-3-(4-хлорфенил)пропиональдегид. К раствору, содержащему 11,0 г (33,5 ммоль) метилового эфира N-трет-бутилоксикарбонил-N-метил-4-хлорфенилаланина в 220 мл толуола, в течение 45 мин при температуре-70 С по каплям добавляют 56 мл (67 ммоль) гидрида диизобутилалюминия (1,2 М в толуоле) и смесь перемешивают в течение 40 мин. По завершении реакции к смеси медленно по каплям добавляют 7 мл метанола и раствор нагревают до 0 С. Затем при интенсивном перемешивании добавляют раствор, содержащий 55 г тартрата калия в 200 мл воды. Суспензию переводят в этилацетат, промывают водой и 5 раз солевым раствором. Органические фазы высушивают над сульфатом натрия и концентрируют на роторном испарителе. В результате флэшхроматографии (гексан/этилацетат 9:1) поименованное в заголовке соединение получают в виде прозрачного масла. ТСХ: гексан/ этилацетат 4:1, Rf = 0,40. г) 2-[4-(N-тpeт-Бутилоксикарбонил-Nметил)-амино-5-(4-хлорфенил)пент-2-енил]-1,3 диоксан. К суспензии, содержащей 49,8 г (108,9 ммоль) бромида 2-(1,3-диоксан-2-ил)этилтрифенилфосфония в 330 мл THF, добавляют при -25 С 69,7 мл (108,9 ммоль) 1,6 М бутиллития. Раствор перемешивают при -25 С в течение 30 мин, затем охлаждают до -75 С и к нему по каплям добавляют раствор, содержащий 16,6 г(55,7 ммоль) 2-(N-трет-бутилоксикарбонил-Nметил)амино-3-(4-хлорфенил)пропиональдегида в 165 мл THF. Реакцию проводят при -75 С в течение 30 мин, после чего смесь в течение периода времени приблизительно в 1 ч нагревают до комнатной температуры и перемешивают при этой температуре последующие 2,5 ч. К раствору оранжевой окраски добавляют 200 мл воды и смесь переводят в этилацетат. Органическую фазу промывают водой и солевым раствором, высушивают над сульфатом натрия и концентрируют на роторном испарителе. Неочищенный продукт фильтруют через 600 г силикагеля в системе растворителей гексан/этилацетат(1 л 95:5, 1 л 4:1). Поименованное в заголовке соединение получают в виде прозрачного масла. ТСХ: гексан/этилацетат 4:1, Rf = 0,32. д) 2-[4-(N-трет-Бутилоксикарбонил-Nметил)амино-5-(4-хлорфенил)пентил]-1,3 диоксан. 58 Раствор, содержащий 11,0 г (27,8 ммоль) 2[4-(N-трет-бутилоксикарбонил-N-метил)амино 5-(4-хлорфенил)пент-2-енил]-1,3-диоксана в 250 мл этилацетата, гидрируют в присутствии 3 г никеля Ренея при комнатной температуре и нормальном давлении водорода. По истечении 2 ч суспензию фильтруют и фильтрат концентрируют. Продукт получают в виде прозрачного масла. ТСХ: гексан/этилацетат 4:1, Rf = 0,29. е) 3-Гидроксипропиловый эфир 5-(N-третбутилоксикарбонил-N-метил)амино-6-(4 хлорфенил)гексановой кислоты. В раствор, содержащий 17,2 г (43,2 ммоль) 2-[4-(N-тpeтбyтилоксикарбонил-N-метил)амино-5-(4-хлорфенил)пентил]-1,3-диоксана в 320 мл этилацета, при температуре -75 С в течение 7,5 ч вводят озон. По окончании реакции остаток озона может быть вытеснен аргоном. Раствор нагревают до комнатной температуры, переводят в этилацетат, экстрагируют насыщенным бикарбонатным раствором и промывают водой и солевым раствором. Органические фазы высушивают над сульфатом натрия и концентрируют на роторном испарителе. Неочищенный продукт может быть хроматографически очищен на силикагеле (гексан/этилацетат 7:3). Поименованное в заголовке соединение получают в виде прозрачного масла. ТСХ: гексан/этилацетат 1:1, Rf = 0,30. ж) 3-Гидроксипропиловый эфир 5 метиламино-6-(4-хлорфенил)гексановой кислоты. 11,2 г (27,1 ммоль) 3-гидроксипропилового эфира 5-(Nтрет-бутилоксикарбонил-N-метил) амино-6-(4-хлорфенил)гексановой кислоты растворяют в 60 мл метиленхлорида и к раствору добавляют 60 мл трифторуксусной кислоты. Реакционный раствор перемешивают при комнатной температуре в течение 30 мин и концентрируют на роторном испарителе. После трехкратного перерастворения в толуоле и концентрирования на роторном испарителе неочищенный продукт получают в виде прозрачного масла, которое используют без дальнейшей очистки. з) 3-Гидроксипропиловый эфир 5-(N-(3,5)бистрифторметилбензоил-N-метил)амино-6-(4 хлорфенил)гексановой кислоты. К раствору, содержащему 16,15 г (51,5 ммоль) 3-гидроксипропилового эфира 5 метиламино-6-(4-хлорфенил)гексановой кислоты в 290 мл метиленхлорида, добавляют при комнатной температуре в атмосфере аргона 28,9 мл (208,5 ммоль) триэтиламина и 0,618 г (5,1 ммоль) 4-диметиламинопиридина и смесь охлаждают до 0 С. После добавления по каплям 17,54 г (63,4 ммоль) (3,5)-бистрифторметилбензоилхлорида в 23 мл метиленхлорида реакционную смесь перемешивают при 0 С в течение 16 ч, добавляют этилацетат и смесь промывают водой и солевым раствором. Органические фазы высушивают над сульфатом натрия и кон 59 центрируют на роторном испарителе. Неочищенный продукт может быть хроматографически очищен на силикагеле (гексан/этилацетат 7:3). Поименованное в заголовке соединение получают в виде прозрачного масла. ТСХ: гексан/этилацетат 3:7, Rf = 0,45. и) 5-(N-(3,5)-Бистрифторметилбензоил-Nметил)амино-6-(4-хлорфенил)гексановая кислота. К раствору, содержащему 7,2 г (13,0 ммоль) 3-гидроксипропилового эфира 5-(N(3,5)-бистрифторметилбензоил-N-метил)амино 6-(4-хлорфенил)гексановой кислоты в 26,5 мл этанола, добавляют раствор, содержащий 3,08 г гидроксида калия в 6,25 мл воды, и реакционную смесь кипятят с обратным холодильником в течение 45 мин. Далее к смеси при 0 С добавляют 31,2 мл 2 н. соляной кислоты и раствор экстрагируют этилацетатом. Органические фазы промывают солевым раствором, высушивают над сульфатом натрия и концентрируют на роторном испарителе. Поименованное в заголовке соединение получают в виде пены желтоватой окраски. ТСХ: этилацетат, Rf = 0,49. Следующие соединения получают аналогично примеру 16. Пример 16/1. N-(Циклогексилметил)амид 5-(N-(3,5)бистрифторметилбензоил-N-метил)амино-6-(4-хлорфенил)гексановой кислоты. ТСХ: гексан/этилацетат 3:7, Rf = 0,39. Пример 16/2. N-[2-(2-Пиридил)этил]амид 5-(N-(3,5)-бистрифторметилбензоил-N-метил)амино-6-(4-хлорфенил)гексановой кислоты. ТСХ: этилацетат/метанол 9:1, Rf = 0,47. Пример 16/3. N-(2-Метоксибензил)амид 5(N-(3,5)-бистрифторметилбензоил-N-метил)амино-6-(4-хлорфенил)гексановой кислоты. ТСХ: гексан/этилацетат 3:7, Rf = 0,34. Пример 16/4. N-(2-Пиридилметил)амид 5(N-(3,5)-бистрифторметилбензоил-N-метил)амино-6-(4-хлорфенил)гексановой кислоты. ТСХ: этилацетат/метанол 9:1, Rf = 0,50. Пример 16/5. (Пиперидинамид) 5-(N-(3,5)бистрифторметилбензоил-N-метил)амино-6-(4 хлорфенил)гексановая кислота. ТСХ: гексан/этилацетат 3:7, Rf = 0,23. Пример 17. N,N-Диаллиламид 5-(N-(3,5)бистрифторметилбензоил-N-метил)амино-6-(4 хлорфенил)гексановой кислоты. Раствор, содержащий 12,6 мл (0,18 ммоль) триэтиламина в 0,4 мл метиленхлорида, и раствор, содержащий 45 мг (0,076 ммоль) Nгидроксисукцинимидного эфира 5-(N-(3,5)бистрифторметилбензоил-N-метил)амино-6-(4 хлорфенил)гексановой кислоты, последовательно добавляют при комнатной температуре к 8,85 мг (0,091 ммоль) диаллиламина и смесь оставляют при этой температуре на ночь (16 ч). Затем к смеси добавляют 0,5 мл 1 н. раствора карбоната калия, встряхивают и быстро центрифугируют для разделения фаз. Органическую фазу концентрируют. Поименованное в заголовке 60 соединение получают в виде прозрачного масла. ТСХ: метиленхлорид/метанол 95:5, Rf = 0,70. а) N-Гидроксисукцинимидный эфир 5-(N(3,5)-бистрифторметилбензоил-N-метил)амино 6-(4-хлорфенил)гексановой кислоты. Раствор, содержащий 10,41 г (21 ммоль) 5(N-(3,5)-бистрифторметилбензоил-N-метил)амино-6-(4-хлорфенил)гексановой кислоты, 2,53 г (22 ммоль) N-гидроксисукцинимида, 4,72 г (23 ммоль) N,N'-дициклогексилкарбодиимида и 500 мл тетрагидрофурана, перемешивают при комнатной температуре в атмосфере азота в течение 16 ч. Реакционный раствор фильтруют и концентрируют на роторном испарителе. Остаток дважды собирают эфиром, фильтруют и концентрируют на роторном испарителе. Неочищенный продукт высушивают под высоким вакуумом. Поименованное в заголовке соединение получают в виде пены желтоватой окраски. ТСХ: гексан/этилацетат 2:3, Rf = 0,54. Аналогично примеру 17 получают следующие соединения. Пример 17/1. N-Циклогексиламид 5-(N(3,5)-бистрифторметилбензоил-N-метил)амино 6-(4-хлорфенил)гексановой кислоты. ТСХ: метиленхлорид/метанол 95:5, Rf = 0,70. Пример 17/2. N-(2-Цианоэтил)-N-метиламид 5-(N-(3,5)-бистрифторметилбензоил-Nметил)амино-6-(4-хлорфенил)гексановой кислоты. ТСХ: этилацетат, Rf = 0,70. Пример 18. N-(3-Хлорбензил)амид 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]5-(1-метилиндол-3-ил)пентановой кислоты. К раствору, содержащему 108,5 мг гидроксисукцинимидного эфира 4-[N'-метил-N'-(3,5 бистрифторметилбензоил)амино]-5-(1-метилиндол-3-ил)пентановой кислоты и 27 мг 3 хлорбензиламина в 1 мл метиленхлорида, добавляют 26,4 мкл триэтиламина. Реакционную смесь оставляют при комнатной температуре на 18 ч. Далее ее концентрируют упариванием,остаток переводят в этилацетат и последовательно промывают 2 н. раствором карбоната калия, водой, 0,1 н. соляной кислотой и солевым раствором, после чего высушивают над сульфатом натрия и еще раз концентрируют упариванием. Данным способом поименованное в заголовке соединение получают в виде бесцветной пены. Значение Rf = 0,40 (этилацетат). Исходные материалы можно получить следующим образом. а) Гидроксисукцинимидный эфир 4-[N'метил-N'-(3,5-бистрифторметилбензоил)амино]5-(1-метилиндол-3-ил)пентановой кислоты. Раствор, содержащий 13,49 г 4-[N'-метилN'-(3,5-бистрифторметилбензоил)амино]-5-(1 метилиндол-3-ил)пентановой кислоты, 3,23 г Nгидроксисукцинимида и 6,05 г N,N'-дициклогексилкарбодиимида в 500 мл тетрагидрофурана,перемешивают при комнатной температуре в
МПК / Метки
МПК: C07D 213/40, C07C 237/22, A61K 31/16, A61P 1/08
Метки: 1-арил-2-ациламиноэтана, применение, нейрокинина-2, частности, качестве, антагонистов, соединения
Код ссылки
<a href="https://eas.patents.su/30-2348-soedineniya-1-aril-2-acilaminoetana-i-ih-primenenie-v-kachestve-antagonistov-nejjrokinina-v-chastnosti-nejjrokinina-1.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения 1-арил-2-ациламиноэтана и их применение в качестве антагонистов нейрокинина, в частности нейрокинина 1.</a>
Предыдущий патент: Замещенные трициклические соединения.
Следующий патент: Очистка нейротрофинов
Случайный патент: Бумажный стакан и способ его изготовления












