2-(1н-индазол-6-иламино)бензамидные соединения как ингибиторы протеинкиназ, полезные для лечения офтальмологических заболеваний
Номер патента: 8501
Опубликовано: 29.06.2007
Авторы: Палмер Синтия Луиз, Борчардт Аллен Джон, Кэйниа Роберт Стивен
Формула / Реферат
1. Соединение 2-{3-[(Е)-2-(4,6-диметилпиридин-2-ил)винил]-1H-индазол-6-иламино}-N-(4-гидрокси-бут-2-инил)бензамид, представленное формулой
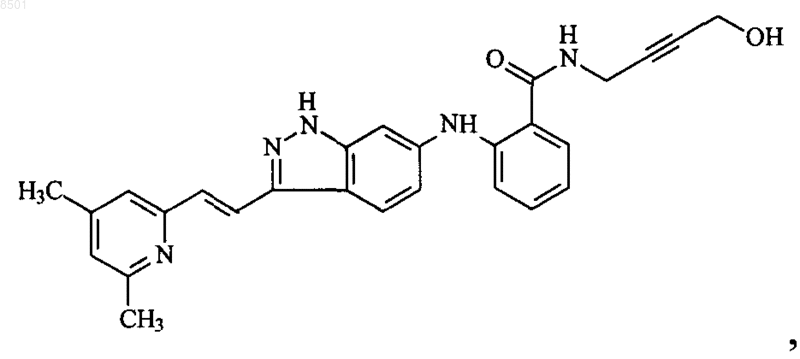
или его фармацевтически приемлемая соль.
2. Способ лечения возрастной дегенерации желтого пятна у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.1.
3. Способ лечения хориоидальной неоваскуляризации у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.1.
4. Способ лечения ретинопатии у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.1.
5. Способ по п.4, где ретинопатия включает диабетическую ретинопатию, витреоретинопатию или ретролетальную фиброплазию.
6. Способ лечения ретинита у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.1.
7. Способ по п.6, где ретинит включает цитомегаловирусный ретинит.
8. Способ лечения отека желтого пятна у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.1.
9. Способ лечения офтальмологического заболевания у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.1.
10. Фармацевтическая композиция, обладающая ингибиторной активностью в отношении протеинкиназ, содержащая
(а) терапевтически эффективное количество соединения или его фармацевтически приемлемой соли по п.1; и
(б) фармацевтически приемлемый носитель, разбавитель или наполнитель.
11. Способ лечения болезненного состояния млекопитающих, опосредованного протеинкиназной активностью, включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.1.
12. Способ по п.11, где болезненное состояние млекопитающих ассоциировано с опухолевым ростом, клеточной пролиферацией или ангиогенезом.
13. Способ модуляции активности протеинкиназного рецептора, включающий приведение киназного рецептора в контакт с эффективным количеством соединения или его фармацевтически приемлемой соли по п.1.
14. Способ по п.13, где протеинкиназный рецептор представляет собой VEGF-рецептор (рецептор сосудистого эндотелиального фактора роста).
Текст
008501 Ссылки на родственные заявки Данная заявка имеет притязания на приоритет предварительной заявки на патент США 60/434902, поданной 19 декабря 2002 г., включенной в данное описание ссылкой во всей своей полноте для всех назначений. Область изобретения Данное изобретение относится к соединениям индазола, а именно к 2-3-[(Е)-2-(4,6-диметилпиридин-2-ил)винил]-1 Н-индазол-6-иламино-N-(4-гидрокси-бут-2-инил)бензамиду, которое опосредует и/или ингибирует офтальмологические заболевания и активность некоторых протеинкиназ, и к фармацевтической композиции, содержащей это соединение. Изобретение также относится к терапевтическому или профилактическому применению этого соединения и композиции и к способам лечения офтальмологических заболеваний и рака, а также других болезненных состояний, связанных с нежелательными ангиогенезом и/или клеточной пролиферацией, путем введения эффективных количеств этого соединения. Предшествующий уровень техники Некоторые заболевания и состояния заднего сегмента глаза угрожают зрению. Возрастная дегенерация желтого пятна (ARMD или AMD), хориоидальная неоваскуляризация (CNV), ретинопатии (например диабетическая ретинопатия, витреоретинопатия, ретролетальная фиброплазия), ретинит (например,цитомегаловирусный (CMV) ретинит), увеит, отек желтого пятна и глаукома представляют собой несколько примеров. Возрастная дегенерация желтого пятна (ARMD или AMD) является ведущей причиной слепоты в пожилом возрасте. ARMD воздействует на центр зрения и затуманивает его, делая чтение, вождение и другие детализированные занятия трудными или невозможными. Только в Соединенных Штатах Америки каждый год возникает приблизительно 200000 новых случаев ARMD. Согласно недавно проведенным оценкам обнаружено, что приблизительно 40% населения старше 75 лет и приблизительно 20% населения старше 60 лет испытывают страдания от дегенерации желтого пятна разной степени. ВлажнаяARMD представляет собой тип ARMD, наиболее часто приводящий к слепоте. При влажной ARMD вновь образованные хориоидальные кровеносные сосуды (хориоидальная неоваскуляризация (CNV пропускают жидкость, что приводит к прогрессирующему повреждению сетчатки. Для конкретного случая CNV при ARMD в настоящее время разрабатываются два способа лечения: (а) фотокоагуляция и (б) применение ингибиторов ангиогенеза. Однако фотокоагуляция может оказаться губительной для сетчатки и неосуществимой, когда CNV соразмерна ямке (сетчатки). К тому же, со временем фотокоагуляция зачастую приводит к рецидивнойCNV. Кроме того, на предмет системного лечения ARMD испытывали пероральное введение противоангиогенных соединений. Однако вследствие специфических в отношении лекарственных средств метаболических ограничений системным введением обычно доставляются в глаз субтерапевтические уровни лекарственных средств. Следовательно, для достижения эффективных внутриглазных концентраций лекарственных средств требуются либо неприемлемо высокая доза, либо повторяющиеся традиционные дозировки. Для доставки противоангиогенных соединений местно в глаз также были разработаны разнообразные имплантаты. Примеры таких имплантатов раскрыты в патенте США 5824072 (Wong), патенте США 5476511 (Gwon и др.) и патенте США 5773019 (Ashton и др.); все они включены в данное описание ссылкой во всей своей полноте для всех назначений. Неоваскулярные заболевания глаза Как упомянуто выше, согласно настоящему изобретению также предложены способы лечения неоваскулярных заболеваний глаза, в том числе, например неоваскуляризация роговицы, неоваскулярная глаукома, пролиферативная диабетическая ретинопатия, ретролетальная фиброплазия и дегенерация желтого пятна. Кратко, неоваскуляризация роговицы, как результат поражения артериального сегмента, является важной причиной понижения остроты зрения и слепоты и главным фактором риска для отторжения аллотрансплантатов роговицы. Как описано Бургером (Burger) и др. (Lab. Invest. 48: 169-180, 1983; включено в данное описание ссылкой во всей своей полноте для всех назначений), корнеальный ангиогенез включает три фазы: предваскулярный латентный период, активную неоваскуляризацию и созревание и регрессию сосудов. Своеобразие и механизм действия различных ангиогенных факторов, включая такие звенья воспалительного ответа, как лейкоциты, тромбоциты, цитокины и эйкозаноиды или неидентифицированные составляющие плазмы, все еще требуют выявления. В настоящее время не существует никакой удовлетворительной клинической терапии для подавления неоваскуляризации роговицы или регрессии существующих новых корнеальных сосудов. Местные кортикостероиды обнаруживают некоторую клиническую применимость, предположительно путем ограничения воспаления стромы. Таким образом, в одном аспекте настоящего изобретения предложены способы для лечения неоваскулярных заболеваний глаза, таких как неоваскуляризация роговицы (в том числе неоваскуляризация трансплантата роговицы), включающие стадию введения пациенту терапевтически эффективного количества противоангиогенной композиции (описанной выше) в роговицу, тем самым образование кровеносных сосудов подавляется. Кратко, роговица представляет собой ткань, в которой в обычном состоя-1 008501 нии отсутствуют кровеносные сосуды. Однако при некоторых патологических состояниях капилляры могут распространяться внутрь роговицы из перикорнеального сосудистого сплетения лимба. Когда роговица васкуляризуется, она, кроме того, делается мутной, что вызывает понижение остроты зрения у пациента. Потеря зрения может стать полной, если роговица становится полностью непрозрачной. Кровеносные сосуды могут проникать в роговицу в виде различных структур и на разную глубину в зависимости от процесса, провоцирующего неоваскуляризацию. Эти структуры традиционно определялись офтальмологами как следующие типы: трахоматозный паннус, лепрозный паннус, фликтенулезный паннус, дегенеративный паннус и глаукоматозный паннус. Кроме того, в строму роговицы могут внедряться ответвления передней цилиарной артерии (именуется интерстициальная васкуляризация), что вызывает выраженные клинические повреждения: периодически повторяющиеся петли, щеткообразную структуру, форму зонтика, форму сетки, интерстициальные аркады (из эписклеральных сосудов) и аберрантные имеющие неправильную форму сосуды. Большое разнообразие расстройств может приводить к неоваскуляризации роговицы, в том числе,например инфекции роговицы (например, трахома, герпетический кератит, лейшманиоз и онхоцеркоз),иммунологические процессы (например, отторжение трансплантата и синдром Стивенса-Джонсона),ожоги щелочью, травма, воспаление (любого происхождения), токсические состояния и дефицит питательных веществ и как осложнение от ношения контактных линз. Несмотря на то, что причина неоваскуляризации роговицы может варьировать, реакция роговицы на повреждение и следующее за этим прорастание сосудов внутрь оказывается похожей независимо от причины. Кратко, локализация повреждения оказывается важной, только когда эти поражения, расположенные в пределах критического расстояния от лимба, будут провоцировать ангиогенный ответ. Это,вероятно, обусловлено тем фактом, что ангиогенные факторы, ответственные за выявление сосудистой инвазии, образуются в месте поражения и должны диффундировать к местонахождению ближайших кровеносных сосудов (лимб) для того, чтобы оказывать свое действие. Дальше определенного расстояния от лимба это становится невозможным, и лимбический эндотелий не оказывается вовлеченным в прорастание внутрь роговицы. В этот процесс вероятно вовлечены несколько ангиогенных факторов,многие из которых являются продуктами воспалительной реакции. В самом деле, кажется, что неоваскуляризация роговицы имеет место только в ассоциации с воспалительным клеточным инфильтратом и степень ангиогенеза пропорциональна распространению воспалительной реакции. Отек роговицы также способствует прорастанию кровеносных сосудов путем разрыхления структуры стромы роговицы и создания пути наименьшего сопротивления, посредством которого могут расти капилляры. Вслед за первоначальной воспалительной реакцией начинается прорастание капилляров внутрь роговицы аналогично тому, как оно имеет место в других тканях. В норме находящиеся в покое эндотелиальные клетки лимбических капилляров и венул стимулируются к делению и миграции. Эндотелиальные клетки выходят далеко из своих сосудов, от которых происходят, разрушают окружающую базальную мембрану и ткань, через которую они перемещаются, и мигрируют по направлению к источнику ангиогенного раздражения. Непроходимые с одного конца отростки приобретают просвет и затем срастаются вместе с образованием капиллярных петель. Конечным результатом является образование сосудистого сплетения внутри стромы роговицы. Противоангиогенные факторы и композиции по настоящему изобретению полезны вследствие блокировки стимуляторных эффектов промоторов ангиогенеза, ослабления эндотелиального клеточного деления, уменьшения эндотелиальной клеточной миграции и понижения активности протеолитических ферментов, секретируемых эндотелием. В особенно предпочтительных воплощениях данного изобретения противоангиогенный фактор может быть приготовлен для местного введения в физиологическом растворе (скомбинированный с любыми из консервантов и антимикробных агентов, обычно используемыми в глазных препаратах) и введен в форме глазных капель. Раствор или суспензия противоангиогенного фактора могут быть приготовлены в своей чистой форме и введены несколько раз ежесуточно. Альтернативно, противоангиогенные композиции, приготовленные, как описано выше, кроме того, могут быть введены непосредственно в роговицу. В предпочтительных воплощениях противоангиогенную композицию готовят с мукоадгезивным полимером, который связывается с роговицей. В следующих воплощениях противоангиогенные факторы или противоангиогенные композиции могут быть использованы в качестве дополнения к традиционной терапии стероидами. Кроме того, местная терапия может быть полезной профилактически при поражениях роговицы,которые, как известно, имеют большую вероятность к индуцированию ангиогенной реакции (как например, химические ожоги). В этих случаях лечение, вероятно в комбинации со стероидами, может быть начато сразу же с целью предупреждения последующих осложнений. В других воплощениях противоангиогенные композиции, описанные выше, могут быть инъецированы непосредственно в строму роговицы офтальмологом с использованием микроскопа. Предпочтительное место инъекции может варьировать в соответствии с морфологией индивидуального повреждения, но задачей данного введения будет размещение композиции на прогрессирующей передней стороне сосудистой сети (т.е. россыпями между кровеносными сосудами и нормальной роговицей). В большин-2 008501 стве случаев это будет касаться перилимбической корнеальной инъекции с целью защиты роговицы от прогрессирующих кровеносных сосудов. Кроме того, этот способ может быть применен вскоре после кровоизлияния в роговице с целью профилактического предупреждения неоваскуляризации роговицы. В этой ситуации материал следует инъецировать в перилимбическую роговицу россыпями между областью поражения роговицы и областью нежелательного возможного лимбического кровоснабжения. Такие способы также могут быть использованы похожим образом для предупреждения капиллярной инвазии трансплантированных роговиц. Инъекции в форме непрерывного высвобождения могут потребоваться всего лишь 2-3 раза в год. Кроме того, для ослабления воспаления от самой инъекции в инъекционный раствор можно добавить стероид. В другом аспекте настоящего изобретения предложены способы лечения неоваскулярной глаукомы,включающие стадию введения пациенту терапевтически эффективного количества противоангиогенной композиции в глаз, благодаря чему подавляется образование кровеносных сосудов. Кратко, неоваскулярная глаукома является патологическим состоянием, при котором в радужной оболочке глаза развиваются новые капилляры. Обычно ангиогенез берет начало от сосудов, расположенных на краю зрачка, и продвигается сквозь корень радужной оболочки в трабекулярную сеть. С капиллярным ростом связаны фибробласты и другие элементы соединительной ткани, и развивается фибрососудистая пленка, которая распространяется по всей передней поверхности радужной оболочки. Со временем эта ткань достигает угла передней камеры, где она образует спайки. Эти спайки, в свою очередь,срастаются, покрываются рубцами и сокращаются, в конечном счете перекрывая угол передней камеры. Образование рубцов мешает адекватному дренажу внутриглазной жидкости через угол и в трабекулярную сеть, вызывая в результате увеличение внутриглазного давления, что может привести к слепоте. В общем случае неоваскулярная глаукома возникает как осложнение заболеваний, при которых преобладает ретинальная ишемия. В частности, приблизительно одна треть пациентов с этим расстройством имеет диабетическую ретинопатию и 28% имеют центральную ретинальную венозную окклюзию. Другие причины включают хроническую отслойку сетчатки, конечную стадию глаукомы, обструктивное заболевание сонной артерии, ретролетальную фиброплазию, серповидноклеточную анемию, внутриглазные опухоли и каротидно-кавернозные свищи. На ранних стадиях неоваскулярная глаукома может быть диагностирована посредством биомикроскопии высокого увеличения с использованием щелевой лампы,где она обнаруживается в виде небольших, расширенных, дезорганизованных капилляров (которые пропускают флуоресцеин) на поверхности радужной оболочки. Позже гониоскопия демонстрирует прогрессирующую облитерацию угла передней камеры по фиброваскулярным связкам. До тех пор, пока угол передней камеры еще открыт, консервативное лечение может оказать помощь. Однако как только угол закрывается, требуется хирургическое вмешательство для ослабления давления. Следовательно, в одном воплощении изобретения противоангиогенные факторы (либо как таковые,либо в противоангиогенной композиции, как описано выше) могут быть введены местно в глаз с целью лечения ранних форм неоваскулярной глаукомы. В других воплощениях изобретения противоангиогенные композиции могут быть имплантированы посредством инъекции композиции в область угла передней камеры. Это обеспечивает постоянное локализованное увеличение концентрации противоангиогенного фактора и предупреждает разрастание кровеносных сосудов по поверхности. Имплантированные или инъецированные противоангиогенные композиции, которые располагаются между прогрессирующими капиллярами радужной оболочки и углом передней камеры, могут защищать открытый угол от неоваскуляризации. Поскольку капилляры не будут расти в пределах значительного радиуса действия противоангиогенной композиции, раскрытое состояние угла может быть обеспечено. В других воплощениях противоангиогенная композиция может быть размещена, кроме того, в любом таком месте, чтобы противоангиогенный фактор постоянно высвобождался во внутриглазную жидкость. Это увеличит концентрацию противоангиогенного фактора в жидкости, которая, в свою очередь, обмывает поверхность радужной оболочки и аномальные капилляры в ней, тем самым обуславливая другой механизм, посредством которого осуществляется доставка лекарственного средства. Эти терапевтические модальности также могут быть полезны профилактически и в комбинации с существующими видами лечения. В другом аспекте настоящего изобретения предложены способы лечения пролиферирующей диабетической ретинопатии, включающие стадию введения пациенту терапевтически эффективного количества противоангиогенной композиции в глаз, благодаря чему подавляется образование кровеносных сосудов. Кратко, полагают, что патология диабетической ретинопатии схожа с описанной выше для неоваскулярной глаукомы. В частности, полагают, что предшествующая диабетическая ретинопатия превращается в пролиферирующую диабетическую ретинопатию под влиянием ретинальной гипоксии. В общем случае неоваскулярная ткань разрастается от зрительного нерва (обычно в пределах 10 мм от границы) и от поверхности сетчатки в области, где тканевая перфузия ослаблена. Сначала капилляры вырастают между внутренней ограничивающей мембраной сетчатки и задней поверхностью стекловидного тела. Со временем сосуды прорастают в стекловидное тело и через внутреннюю ограничивающую мембрану. По мере того, как стекловидное тело сокращается, сосуды растяги-3 008501 ваются, что зачастую приводит к разрыву сосудов и помутнению стекловидного тела вследствие кровоизлияния. Фиброзное вытяжение от рубцевания в сетчатке также может служить причиной отслоения сетчатки. Традиционно предпочтительной терапией является панретинальная фотокоагуляция с целью сокращения ретинальной ткани и тем самым уменьшения потребности сетчатки в кислороде. Несмотря на первоначальную эффективность, есть высокая скорость рецидива в отношении новых повреждений, образующихся в других частях сетчатки. Осложнения этой терапии включают уменьшение периферического зрения у вплоть до 50% пациентов, механические повреждения роговицы, индуцированное лазером образование катаракты, острую глаукому и стимулирование расположенного под сетчаткой неоваскулярного роста (который может приводить к потере зрения). В результате эту процедуру проводят только в том случае, когда наличествует несколько факторов риска и отношение риск/польза очевидно в пользу вмешательства. Следовательно, в особенно предпочтительных воплощениях изобретения пролиферативная диабетическая ретинопатия может быть подвергнута лечению путем инъекции противоангиогенного фактора(ов) (или противоангиогенной композиции) во внутриглазную жидкость или стекловидное тело с целью увеличения локальной концентрации противоангиогенного фактора в сетчатке. Предпочтительно это лечение следует начинать до обнаружения серьезного заболевания, нуждающегося в фотокоагуляции. В других воплощениях изобретения артерии, которые питают неоваскулярные повреждения, могут быть эмболизованы (с использованием противоангиогенных композиций, которые описаны выше). В другом аспекте настоящего изобретения предложены способы лечения ретролетальной фиброплазии, включающие стадию введения пациенту терапевтически эффективного количества противоангиогенного фактора (или противоангиогенной композиции) в глаз, благодаря чему подавляется образование кровеносных сосудов. Кратко, ретролетальная фиброплазия представляет собой состояние, встречающееся у недоношенных младенцев, которые получают оксигенотерапию. Периферическая ретинальная сосудистая сеть, в особенности на височной стороне, не полностью образуется до окончания эмбрионального периода. Полагают, что избыточный кислород (даже уровни,которые следует считать физиологическими в определенный период) и образование свободных кислородных радикалов являются существенными вследствие того, что они вызывают повреждение кровеносных сосудов в недоразвившейся сетчатке. Эти сосуды сужаются и затем структурно облитерируются,подвергаясь воздействию кислорода. В результате в периферической сетчатке не образуются кровеносные сосуды, и обеспечена ретинальная ишемия. В ответ на ишемию индуцируется неоваскуляризация в месте соединения нормальной и подвергнутой ишемии сетчатки. В 75% случаев эти сосуды спонтанно регрессируют. Тем не менее в оставшихся 25% наблюдается продолжающийся капиллярный рост, сокращение фиброваскулярного компонента и вытяжение как сосудов, так и сетчатки. Это вызывает кровоизлияние в стекловидном теле и/или отслоение сетчатки, что может привести к слепоте. Неоваскулярная закрытоугольная глаукома также является осложнением этого состояния. Поскольку зачастую невозможно определить, в каких случаях будет наблюдаться спонтанное рассасывание и какие будут прогрессировать до серьезного состояния, в общем случае к традиционному лечению (т.е. хирургическому вмешательству) приступают только в отношении пациентов с установленным заболеванием и четко развитой патологией. Этот подход выжидать и наблюдать исключает раннее вмешательство и дает возможность развиться заболеванию у этих 25%, что сопровождается осложненным течением (заболевания). Следовательно, в одном воплощении изобретения местное введение противоангиогенных факторов (или противоангиогенных композиций, которые описаны выше) может быть осуществлено для младенцев, представляющих собой группу высокого риска развития этого состояния, в попытке сократить сферу действия развития ретролетальной фиброплазии. В других воплощениях могут быть использованы инъекции внутрь стекловидного тела и/или внутриглазные имплантаты противоангиогенной композиции. Такие способы особенно предпочтительны в случаях установленного заболевания с целью снижения необходимости в хирургическом вмешательстве. Протеинкиназы Протеинкиназы представляют собой семейство ферментов, катализирующих фосфорилирование гидроксильной группы определенных тирозиновых, сериновых или треониновых остатков в белках. Обычно такое фосфорилирование разительно изменяет функционирование данного белка, и, таким образом, протеинкиназы являются главнейшими в регулировании большого разнообразия клеточных процессов, включая метаболизм, клеточную пролиферацию, клеточную дифференцировку и клеточную выживаемость. Среди многих различных клеточных функций, для которых, как известно, требуется активность протеинкиназ, некоторые процессы представляются привлекательными мишенями для терапевтического вмешательства при некоторых болезненных состояниях. Два примера представляют собой ангиогенез и регулирование клеточного цикла, в которых протеинкиназы играют главнейшую роль; эти процессы существенны для роста солидных опухолей, а также для других заболеваний. Ангиогенез представляет собой механизм, посредством которого из существующих сосудов обра-4 008501 зуются новые капилляры. При необходимости сосудистая система может образовывать новые капиллярные сети с целью поддержания правильного функционирования тканей и органов. Однако у взрослых ангиогенез довольно ограничен, и имеет место только в процессах ранозаживления и неоваскуляризации эндометрия при менструации. Смотри статью Merenmies et al., Cell GrowthDifferentiation, 8, 3-10(1997), включенную в данное описание ссылкой во всей своей полноте для всех назначений. С другой стороны, нежелательный ангиогенез является признаком некоторых заболеваний, таких как ретинопатии,псориаз, ревматоидный артрит, возрастная дегенерация желтого пятна (AMD) и рак (солидные опухоли). Смотри статью Folkman, Nature Med., 1, 27-31 (1995), включенную в данное описание ссылкой во всей своей полноте для всех назначений. Протеинкиназы, которые, как было показано, вовлечены в ангиогенный процесс, включают в себя три члена тирозинкиназного семейства рецепторов факторов роста:VEGF-R2 (рецептор-2 сосудистого эндотелиального фактора роста, также известный как KDR (киназный домен-содержащий рецептор) и как FLK-1 (фетальная печеночная киназа); FGF-R (рецептор фактора роста фибробластов); и ТЕК (тирозиновую эпителиальную киназу, также известную как Tie-2).VEGF-R2, который экспрессируется только на эндотелиальных клетках, связывается с сильнодействующим ангиогенным фактором роста VEGF и опосредует последующую сигнальную трансдукцию через активацию внутриклеточной киназной активности. Таким образом, ожидается, что прямое ингибирование киназной активности VEGF-R2 будет приводить к ослаблению ангиогенеза даже в присутствии экзогенного VEGF (смотри Strawn et al., Cancer Research, 56, 3540-3545 (1996, как было показано на мутантах по VEGF-R2, которые не опосредуют сигнальную трансдукцию. Millauer et al., Cancer Research,56, 1615-1620 (1996). Кроме того, по-видимому, VEGF-R2 не выполняет никакой другой функции у взрослого человека кроме опосредования ангиогенной активности VEGF. Поэтому следует ожидать, что селективный ингибитор киназной активности VEGF-R2 будет проявлять незначительную токсичность. Аналогично FGF-R связывается с ангиогенными факторами роста aFGF и bFGF и опосредует последующую внутриклеточную сигнальную трансдукцию. Недавно было высказано предположение, что такие факторы роста, как bFGF, могут играть критическую роль в индуцировании ангиогенеза в солидных опухолях, достигших определенного размера. Yoshiji et al., Cancer Research, 57, 3924-3928 (1997). Однако в отличие от VEGF-R2, FGF-R экспрессируется в ряде разных типов клеток по всему организму и может играть или может не играть важной роли в других обычных физиологических процессах у взрослого человека. Несмотря на это, сообщалось, что системное введение низкомолекулярного ингибитора киназной активности FGF-R блокирует bFGF-индуцированный ангиогенез у мышей без явной токсичности. Mohammad et al., EMBO Journal, 17, 5996-5904 (1998). ТЕК (также известная как Tie-2) представляет собой другую рецепторную тирозинкиназу, экспрессируемую только на эндотелиальных клетках, которая, как было показано, играет роль в ангиогенезе. Связывание фактора ангиопоэтина-1 приводит к аутофосфорилированию киназного домена ТЕК и вызывает процесс сигнальной трансдукции, который, по-видимому, опосредует взаимодействие эндотелиальных клеток с периэндотелиальными поддерживающими клетками, тем самым способствуя созреванию вновь образованных кровеносных сосудов. С другой стороны, фактор ангиопоэтин-2, по-видимому, является антагонистом действию ангиопоэтина-1 на ТЕК и нарушает ангиогенез. Maisonpierre et al.,Science, 277, 55-60 (1997). В результате вышеописанных разработок было предложено лечить ангиогенез, используя соединения, ингибирующие киназную активность VEGF-R2, FGF-R и/или ТЕК. Например, в международной публикации WIPO (Всемирной организации по защите интеллектуальной собственности)WO 97/34876 описываются некоторые циннолиновые производные, являющиеся ингибиторами VEGF-R2,которые могут быть использованы для лечения болезненных состояний, связанных с аномальным ангиогенезом и/или повышенной проницаемостью сосудов, таких как рак, диабет, псориаз, ревматоидный артрит, саркома Капоши, гемангиома, острые и хронические нефропатии, атерома, артериальный рестеноз,аутоиммунные заболевания, острое воспаление и глазные заболевания с пролиферацией ретинальных сосудов. Киназа фосфорилазы активирует гликогенфосфорилазу, тем самым увеличивая расщепление гликогена и высвобождение глюкозы печенью. Продуцирование глюкозы печенью разрегулировано при диабете 2 типа и является основной причиной гипергликемии натощак, что приводит к многочисленным вторичным осложнениям, поражающим таких пациентов. Таким образом, уменьшение высвобождения глюкозы из печени будет снижать повышенные уровни глюкозы в плазме. Следовательно, ингибиторы киназы фосфорилазы будут уменьшать фосфорилазную активность и гликогенолиза, таким образом снижая гипергликемию у пациентов. Другим физиологическим ответом на VEGF является повышенная проницаемость сосудов, которая,как предполагается, играет роль на ранних стадиях ангиогенеза. В ишемических тканях, таких как ткани,встречающиеся в головном мозге жертв удара, гипоксия инициирует экспрессию VEGF, приводя к увеличению проницаемости сосудов и, в конечном счете, к отеку в окружающих тканях. На крысиных моделях удара van Bruggen et al., J. Clinical Invest., 104, 1613-20 (1999) показали, что введение моноклонального антитела к VEGF уменьшает размер инфаркта. Таким образом, ожидается, что ингибиторыVEGFR будут полезны для лечения удара.-5 008501 В дополнение к своей роли в ангиогенезе протеинкиназы также играют ключевую роль в регулировании клеточного цикла. Неконтролируемая клеточная пролиферация является характерной особенностью рака. Клеточная пролиферация в ответ на различные раздражители проявляется в дерегуляции цикла клеточного деления, процесса, посредством которого клетки размножаются и делятся. Опухолевые клетки обычно имеют повреждение в генах, которые прямо или косвенно регулируют прохождение цикла клеточного деления. Циклинзависимые киназы (CDK) представляют собой серин-треониновые протеинкиназы, играющие критическую роль в регулировании переходов между различными фазами клеточного цикла. См.,например, статьи, объединенные в Science, 274, 1643-1677 (1996). CDK-комплексы образуются при ассоциации регуляторной циклиновой субъединицы (например циклина A, Bl, В 2, Dl, D2, D3 и Е) и каталитической киназной субъединицы (например cdc2 (CDK1), CDK2, CDK4, CDK5 и CDK6). Как вытекает из названии, CDK проявляют абсолютную зависимость от циклиновой субъединицы при фосфорилировании своих целевых субстратов, и различные пары киназа/циклин функционируют с целью регулирования прохождения через конкретные фазы клеточного цикла.CDK4, образующая комплекс с D-циклинами, которая играет критическую роль в инициировании цикла клеточного деления от стадии покоя или интерфазы к стадии, на которой клетки вовлекаются в клеточное деление. Такая последовательность событий зависит от ряда регуляторных механизмов роста,как негативных, так и позитивных. Отклонения в такой системе регулирования, в частности влияющие на функцию CDK4, вовлечены в развитие клеток до высоко пролиферативного состояния, характерного для злокачественности, в частности наследственных меланом, карциномы пищевода и видам рака поджелудочной железы. См., например, Kamb, Trends in Genetics, 11, 136-140 (1995); Kamb et al., Science,264, 436-440 (1994). В бесчисленных публикациях описано множество химических соединений, полезных в отношении множества терапевтических мишеней. Например, в международных публикациях WIPOWO 99/23077 и WO 99/23076 описаны индазол-содержащие соединения, обладающие ингибиторной активностью против фосфодиэстеразы IV типа, созданные путем биоизостерической замены катехина на индазол. В патенте США 5760028 раскрыты гетероциклы, включая 3-[1-[3-(имидазолин-2-иламино)пропил] индазол-5-илкарбониламино]-2-(бензилоксикарбониламино)пропионовую кислоту, которые полезны в качестве антагонистов v3 интегрина и родственных поверхностных белковых рецепторов клеточной адгезии. В международной публикации WIPOWO 98/09961 раскрыты некоторые производные индазола и их применение в качестве ингибиторов фосфодиэстеразы (PDE) IV типа или продуцирования фактора некроза опухоли (TNF) у млекопитающего. Последние дополнения виртуальной библиотеки известных соединений включают соединения, описанные как антипролиферативные терапевтические агенты,ингибирующие CDK. Например, в патенте США 5621082 (Xiong et al.) раскрыта нуклеиновая кислота,кодирующая ингибитор CDK6, и в публикации европейского патента 0666270 А 2 описаны пептиды и пептидные миметики, действующие как ингибиторы CDK1 и CDK2. В международной публикацииWIPOWO 97/16447 раскрыты некоторые аналоги хромонов, которые являются ингибиторами циклинзависимых киназ, в частности комплексы CDK/циклин, такие как CDK4/циклин-D1, которые могут быть использованы для ингибирования избыточной или аномальной клеточной пролиферации и, следовательно, для лечения рака. В международной публикации на патент WIPOWO 99/21845 раскрыты 4 аминотиазольные производные, полезные в качестве ингибиторов CDK. Все вышеприведенные патенты и/или заявки включены в данное описание ссылкой во всей своей полноте для всех назначений. Однако все еще имеется необходимость в низкомолекулярных соединениях, которые можно легко синтезировать и которые эффективны в ингибировании одной или более CDK, либо одного или более комплекса CDK/циклин. Поскольку CDK4 может служить в качестве основного активатора клеточного деления в большинстве клеток и комплексы CDK4 и циклинов D-типа регулируют раннюю G1-фазу клеточного цикла, существует необходимость в эффективных ингибиторах CDK4 и ее комплексах с циклином D-типа для лечения одного или более типов опухолей. Кроме того, ключевые роли комплексов циклин E/CDK2 и циклин B/CDK1 киназ в G1/S-фазе и G2/М-переходах, соответственно, выдвигают дополнительные мишени для терапевтического вмешательства в подавлении дерегулируемой последовательности клеточного цикла при раке. Другая протеинкиназа СНK1 (киназа сверочной точки 1) играет важную роль в качестве сверочной точки прохождения клеточного цикла. Сверочные точки представляют собой регулирующие системы,которые координируют прохождение клеточного цикла путем влияния на образование, активацию и последующую инактивацию циклинзависимых киназ. Сверочные точки предотвращают прохождение клеточного цикла в неподходящие моменты времени, поддерживают метаболический баланс клеток, пока клетки приостановлены, и в некоторых случаях могут индуцировать апоптоз (запрограммированную клеточную смерть), если требования сверочной точки не были удовлетворены. См., например, O'Connor,Cancer Surveys, 29, 151-182 (1997); Nurse, Cell, 91, 865-867 (1997); Hartwell et al., Science, 266, 1821-1828(1994); Hartwell et al., Science, 246, 629-634 (1989). Одна группа сверочных точек контролирует целостность генома, и при обнаружении повреждения ДНК эти сверочные точки повреждения ДНК блокируют прохождение клеточного цикла в G1- и G2-6 008501 фазах и замедляют прохождение через S-фазу. O'Connor, Cancer Surveys, 29, 151-182 (1997); Hartwell etal., Science, 266, 1821-1828 (1994). Такое действие запускает процессы репарации ДНК с завершением задач до того, как произойдет репликация генома и последующее разделение данного генетического материала на новые дочерние клетки. Важно, что наиболее часто мутированный ген при раке человека, генсупрессор опухолей р 53, продуцирует белок сверочной точки повреждения ДНК, который блокирует прохождение клеточного цикла в G1-фазе и/или индуцирует апоптоз (запрограммированную клеточную смерть) после повреждения ДНК. Hartwell et al., Science, 266, 1821-1828 (1994). Также было показано, что супрессор опухолей р 53 усиливает действие сверочной точки повреждения ДНК в G2-фазе клеточного цикла. См., например Bunz et al., Science, 28, 1497-1501 (1998); Winters et al., Oncogene, 17, 673-684(1998); Thompson, Oncogene, 15, 3025-3035(1997). С учетом ключевого характера пути через супрессора опухолей р 53 при раке человека, активно предпринимались попытки терапевтических вмешательств, при которых использовалась уязвимые места при раке, дефектном по р 53. Одно обнаруженное уязвимое место лежит в деятельности G2-сверочной точкой в дефектных по р 53 раковых клетках. Раковые клетки, поскольку у них отсутствует G1-сверочная точка, особенно уязвимая к аннулированию последнего оставшегося барьера, защищающего их от подавляющих рак воздействий ДНК-повреждающих агентов: G2-сверочной точки. G2-сверочная точка регулируется системой регулирования, которая сохраняется от дрожжей до людей. Существенной в этой консервативной системе является киназа СНK1, которая передает сигналы от чувствительного к повреждению ДНК комплекса для ингибирования активации комплекса циклин В/Cdc2-киназа, который стимулирует вхождение в митоз. См., например, Peng et al., Science, 277, 1501-1505 (1997); Sanchez et al., Science, 277, 1497-1501 (1997). Было показано, что инактивация CHK1 аннулирует задержку на G2, индуцированную повреждением ДНК, наносимую либо противораковыми агентами, либо за счет эндогенного повреждения ДНК, а также приводит к предпочтительному уничтожению полученныхз дефектных по сверочной точке клеток. См., например Nurse, Cell, 91, 865-867 (1997); Weinert, Science, 277, 1450-1451(1994). Избирательное манипулирование контролем сверочной точкой в раковых клетках могло бы найти широкое применение в схемах химиотерапевтического лечения и лучевой терапии рака и может, кроме того, предложить вниманию использование общеупотребительного критерия геномной нестабильности при раке человека, в качестве избирательной основы для деструкции раковых клеток. Ряд факторов позволяют отнести CHK1 к основной мишени в контроле сверочной точкой повреждения ДНК. Выяснение ингибиторов этой и функционально родственных киназ, таких как Cdsl/CHK2, киназ, которые как недавно обнаружено, взаимодействуют с CHK1 в регулировании прохождения S-фазы (см. Zeng et al.,Nature, 395, 507-510 (1998); Matsuoka, Science, 282, 1893-1897 (1998, может явиться полезным новым терапевтическим подходом для лечения рака. Интегриновый рецептор, связывающийся с ЕСМ, инициирует внутриклеточные сигналы, опосредованные FAK (киназой фокальной адгезии), которые вовлечены в клеточную подвижность, клеточную пролиферацию и выживаемость. При раке человека сверхэкспрессия FAK вовлечена в онкогенез и в потенциал метастазирования вследствие ее роли в интегрин-опосредованных сигнальных путях. Тирозинкиназы могут быть рецепторного типа (имеющие внеклеточный, трансмембранный и внутриклеточный домены) и нерецепторного типа (являющиеся полностью внутриклеточными). Предполагается, что по меньшей мере одна из нерецепторных тирозиновых протеинкиназ, а именно LCK (лимфоцит-специфичная киназа), опосредует передачу в Т-клетки сигнала от взаимодействия белка клеточной поверхности (Cd4) с перекрестно сшитым анти-Cd4 антителом. Более подробное описание нерецепторных тирозинкиназ приведено в Bolen, Oncogene, 8, 2025-2031 (1993), включенной в данное описание ссылкой во всей своей полноте для всех назначений. В дополнение к определенным выше протеинкиназам в качестве терапевтических мишеней были рассмотрены многие другие протеинкиназы, и в многочисленных публикациях раскрыты ингибиторы киназной активности, рассмотренные в следующих публикациях: патент США 6534524, опубликованный 18 марта 2003 г., патент США 6531491, опубликованный 11 марта 2003 г., публикация РСТ международной заявки на патентWO 00/38665 (опубликована 6 июля 2001 г.), публикация РСТ международный заявки на патентWO 97/49688 (опубликована 31 декабря 1997 г.), публикация РСТ международной заявки на патентWO 98/23613 (опубликована 4 июня 1998 г.), патент США 6071935, опубликованный 6 июня 2000 г., публикация РСТ международной заявки на патентWO 96/30347 (опубликована 3 октября 1996 г.), публикация РСТ международной заявки на патентWO 96/40142 (опубликована 19 декабря 1996 г.), публикация РСТ международной заявки на патентWO 97/13771 (опубликована 17 апреля 1997 г.), публикация РСТ международной заявки на патентWO 95/23141 (опубликована 31 августа 1995 г.), публикация РСТ международной заявки на патентWO 03/006059 (опубликована 23 января 2003 г.), публикация РСТ международной заявки на патентWO 03/035047 (опубликована 1 мая 2003 г.), публикация РСТ международной заявки на патентWO 02/064170 (опубликована 22 августа 2002 г.), публикация РСТ международной заявки на патентWO 02/41882 (опубликована 30 мая 2002 г.), публикация РСТ международной заявки на патентWO 02/30453 (опубликована 18 апреля 2002 г.),-7 008501 публикация РСТ международной заявки на патентWO 01/85796 (опубликована 15 ноября 2001 г.),публикация РСТ международной заявки на патентWO 01/74360 (опубликована 11 октября 2001 г.),публикация РСТ международной заявки на патентWO 01/74296 (опубликована 11 октября 2001 г.),публикация РСТ международной заявки на патентWO 01/70268 (опубликована 27 сентября 2001 г.),публикация заявки на европейский патентЕР 1086705 (опубликована 28 марта 2001 г.) и публикация РСТ международной заявки на патентWO 98/51344 (опубликована 19 ноября 1998 г.). Все указанные выше патенты и заявки включены в данное описание ссылкой во всей своей полноте для всех назначений. Тем не менее, все еще имеется необходимость в эффективных ингибиторах протеинкиназ. Более того, как очевидно специалистам в данной области техники, желательно, чтобы ингибиторы киназ обладали как высокой аффинностью в отношении целевой киназы или целевых киназ, так и высокой селективностью по отношению к другим протеинкиназам. Таким образом, задачей данного изобретения является обнаружение сильнодействующих агентов для лечения офтальмологических заболеваний, таких как возрастная дегенерация желтого пятна(ARMD), хориоидальная неоваскуляризация (CNV), ретинопатии (например, диабетическая ретинопатия,витреоретинопатия, ретролетальная фиброплазия), ретинит (например, цитомегаловирусный (CMV) ретинит), увеит, отек желтого пятна и глаукома. В задачу настоящего изобретения также входило обнаружение сильнодействующих ингибиторов протеинкиназ. Другой задачей изобретения является обнаружение эффективных ингибиторов киназ, обладающих сильной и селективой аффинностью в отношении одной или более конкретных киназ. Эти и другие задачи изобретения, которые станут понятны из следующего ниже описания, были решены путем обнаружения индазольного соединения, а именно, 2-3-[(Е)-2-(4,6-диметил-пиридин-2-ил) винил]-1H-индазол-6-иламино-N-(4-гидрокси-бут-2-инил)бензамида, и его фармацевтически приемлемых солей (это соединение и соли совместно упоминаются как агенты), описанных ниже, которые модулируют и/или ингибируют активность протеинкиназ. Фармацевтические композиции, содержащие такие агенты, полезны в лечении заболеваний, опосредованных киназной активностью, таких как рак, а также других болезненных состояний, связанных с нежелательным ангиогенезом и/или клеточной пролиферацией, таких как диабетическая ретинопатия, неоваскулярная глаукома, ревматоидный артрит и псориаз. Кроме того, данные агенты имеют полезные свойства в отношении модуляции и/или ингибирования киназной активности, связанной с VEGF-R, FGF-R, CDK комплексами, CHK1, LCK, ТЕК, FAK и/или киназой фосфорилазы. Краткое изложение сущности изобретения Согласно настоящему изобретению предложено соединение 2-3-[(Е)-2-(4,6-диметил-пиридин-2 ил)винил]-1 Н-индазол-6-иламино-N-(4-гидрокси-бут-2-инил)бензамид, представленное формулой или его фармацевтически приемлемая соль. В изобретении также предложен способ лечения возрастной дегенерации желтого пятна у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Далее согласно изобретению предложен способ лечения хориоидальной неоваскуляризации у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Также предложен способ лечения ретинопатии у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Предпочтительно ретинопатия включает диабетическую ретинопатию, витреоретинопатию или ретролетальную фиброплазию. Далее в изобретении предложен способ лечения ретинита у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Предпочтительно ретинит включает цитомегаловирусный ретинит. Кроме того, предложен способ лечения отека желтого пятна у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Также предложен способ лечения офтальмологического заболевания у млекопитающего, включаю-8 008501 щий введение указанному млекопитающему терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Согласно изобретению предложена также фармацевтическая композиция, обладающая ингибиторной активностью в отношении протеинкиназ, содержащая(а) терапевтически эффективное количество соединения по изобретению или его фармацевтически приемлемой соли и(б) фармацевтически приемлемый носитель, разбавитель или наполнитель. Далее согласно изобретению предложен способ лечения болезненного состояния млекопитающих,опосредованного протеинкиназной активностью, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Предпочтительно в указанном способе болезненное состояние млекопитающих ассоциировано с опухолевым ростом, клеточной пролиферацией или ангиогенезом. Кроме того, предложен способ модуляции активности протеинкиназного рецептора, включающий приведение киназного рецептора в контакт с эффективным количеством соединения по изобретению или его фармацевтически приемлемой соли. Предпочтительно указанный протеинкиназный рецептор представляет собой VEGF-рецептор (рецептор сосудистого эндотелиального фактора роста). Соединение по изобретению можно с пользой использовать в комбинации с другими известными терапевтическими агентами. Например, оно может быть введено совместно с цитотоксическими химиотерапевтическими агентами, такими как таксол, таксотер, винбластин, цис-платин, доксорубицин, адриамицин и подобные, с целью создания усиленного противоопухолевого эффекта. Аддитивное или синергетическое усиление терапевтического эффекта также может быть получено путем совместного введения соединения по изобретению, обладающего противоангиогенной активностью, с другими противоангиогенными агентами, такими как комбретастатин А-4, эндостатин, приномастат, целекоксиб, рофококсиб, EMD121974, IM862, анти-VEGF моноклональные антитела и анти-KDR моноклональные антитела. Дополнительные комбинации приведены в виде примеров в WO 0038716, WO 00387171, WO 0038715, WO 0038730, WO 0038718, WO 0038665, WO 0037107, WO 0038786, WO 0038719; все одновременно поданы 22 декабря 1999 г.; и все включены в данное описание ссылкой во всей своей полноте для всех назначений. Термины содержащий и включающий использованы в расширенном, не ограничивающем смысле. В описании для целей сравнения приведены также примеры получения и соответствующие данные по биологической активности для ряда структурно родственных соединений. Очевидно, что несмотря на то, что раскрытые соединения могут проявлять явление таутомерии, на рисунках формул в данном описании нарочито изображена только одна из возможных таутомерных форм. Поэтому следует понимать, что формулы, данные в пределах изобретения, предназначены для представления любой таутомерной формы изображенного графически соединения, и их не следует ограничивать единственно конкретной таутомерной формой, изображенной рисунками формул. Некоторые из раскрытых соединений могут существовать в виде единичных стереоизомеров (т.е. существенно свободными от других стереоизомеров), рацематов и/или смесей энантиомеров и/или диастереомеров. Подразумевается, что все такие единичные стереоизомеры, рацематы и их смеси находятся в пределах объема настоящего изобретения. Предпочтительно, когда раскрытые соединения, являющиеся оптически активными, используются в оптически чистой форме. Как в целом понимается специалистами в данной области техники, оптически чистое соединение,имеющее один хиральный центр, представляет собой соединение, которое состоит, по существу, из одного из двух возможных энантиомеров (т.е. является энантиомерно чистым), и оптически чистое соединение, имеющее более чем один хиральный центр, представляет собой соединение, которое является как диастереомерно чистым, так и энантиомерно чистым. Предпочтительно, когда соединения используют в форме, являющейся по меньшей мере на 90% оптически чистой, то есть в форме, которая содержит по меньшей мере 90% единичного изомера (80% энантиомерный избыток (е.е.) или диастереомерный избыток (d.e., более предпочтительно по меньшей мере 95% (90% е.е. или d.e.), еще более предпочтительно по меньшей мере 97,5% (95% е.е. или d.e.) и наиболее предпочтительно по меньшей мере 99%(98% е.е. или d.e.). Кроме того, подразумевается, что формулы охватывают сольватированные, а также несольватированные формы идентифицированных структур, например как гидратированные, так и негидратированные формы. Другие примеры сольватов включают структуры в комбинации с изопропанолом, этанолом,метанолом, DMSO, этилацетатом, уксусной кислотой или этаноламином. Данное изобретение включает фармацевтически приемлемые соли заявленного соединения. Фармацевтически приемлемая соль предназначена для обозначения соли, которая сохраняет биологическую эффективность свободных кислот и оснований конкретного соединения и которая не является биологически или каким-либо иным образом нежелательной. Раскрытые соединения могут иметь дос-9 008501 таточно кислотные, достаточно основные или обе функциональные группы и согласно этому взаимодействовать с любым из ряда неорганических или органических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Примеры фармацевтически приемлемых солей включают таковые соли, полученные путем взаимодействия соединений по настоящему изобретению с минеральной или органической кислотой либо неорганическим основанием, как например соли, включая сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, гидрофосфаты,дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты,сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты,нафталин-2-сульфонаты и манделаты. Если раскрытые соединения представляют собой основание, нужная фармацевтически приемлемая соль может быть получена любым подходящим способом, доступным в данной области техники, например обработкой свободного основания неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные, или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота,салициловая кислота, пиранозидиловая кислота, как например глюкуроновая кислота или галактуроновая кислота, альфа-оксикислота, как например лимонная кислота или винная кислота, аминокислота, как например аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, как например бензойная кислота или коричная кислота, сульфоновая кислота, как например паратолуолсульфоновая кислота или этансульфоновая кислота, и подобные. Если раскрытые соединения представляют собой кислоту, нужная фармацевтически приемлемая соль может быть получена любым подходящим способом, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный),гидроксид щелочных металлов или гидроксид щелочноземельных металлов и подобные. Иллюстративные примеры подходящих солей включают органические соли, являющиеся производными аминокислот,таких как глицин и аргинин, аммиака, первичных, вторичных или третичных аминов и циклических аминов, как например пиперидин, морфолин и пиперазин, и неорганические соли, являющиеся производными натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. В случае агентов, которые являются твердыми веществами, специалистам в данной области техники очевидно, что соединения и соли по изобретению могут существовать в различных кристаллических или полиморфных формах; подразумевается, что все они находятся в пределах объема настоящего изобретения и конкретных формул. Терапевтически эффективные количества агентов по изобретению могут быть использованы для лечения заболеваний, опосредованных путем модуляции или регулирования протеинкиназ. Эффективное количество предназначено для обозначения того количества агента, которое при введении нуждающемуся в таком лечении млекопитающему достаточно для эффективного лечения заболевания, опосредованного активностью одной или более чем одной протеинкиназы, такой как тирозинкиназа. Так,например, терапевтически эффективное количество соединения по изобретению или его соли является количеством, достаточным для модуляции, регулирования или ингибирования активности одной или более чем одной протеинкиназы, так что болезненное состояние, которое опосредовано этой активностью, ослабляется или облегчается. Количество заданного агента, которое будет соответствовать такому количеству, будет варьировать в зависимости от таких факторов, как конкретное соединение, болезненное состояние и его серьезность,отличительная черта (например, масса) нуждающегося в лечении млекопитающего, но тем не менее может быть запросто определено специалистом в данной области техники. Лечение предназначено для обозначения по меньшей мере облегчения болезненного состояния у млекопитающего, например человека, которое подвергается, по меньшей мере частично, воздействию активности одной или более чем одной протеинкиназы, такой как тирозинкиназа, и включает: предупреждение возникновения болезненного состояния у млекопитающего, в особенности когда обнаруживается, что данное млекопитающее предрасположено к данному болезненному состоянию, но еще не поставлен диагноз, что оно его имеет; модуляцию и/или ингибирование болезненного состояния; и/или облегчение болезненного состояния. Соединение по изобретению может быть получено с использованием схемы синтеза, как она описана ниже, с применением методик, доступных в данной области техники, используя легко доступные исходные материалы. Условия на стадиях от а) до и) следующие: а) NaNO2, Br 2, HBr, 0 С- -5 С; 48% выход; б) Pd(OAc)2, Pd(орто-толил)3, диизопропилэтиламин (DIEA), DMF (диметилформамид), H2O, дегазация, микроволновое облучение, 110 С, 1 ч; 68% выход; в) порошок железа, насыщенный водный NH4OH, EtOH, 45C; 72% выход; г) метил-2-бромбензоат, R-BINAP, Pd2(dbа)3, Cs2CO3, толуол, дегазация, 110 С в течение ночи; 74% выход; д) KOH, MeOH:THF:H2O (3:1:1), 70 С, 2-3 ч; количественно; е) защищенный амин, HATU (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат), NEt3, DMF, комнатная температура в течение 2 ч; 80%-ный выход; ж) TsOH (12% TsOH в НОАс), EtOH (10% водный); 44% выход; з) трибутилвинилолово, Pd(PPh3)4, 2,6-ди-трет-бутил-4-метилфенол, толуол, дегазация, 105 С; 31% выход; и) Pd(OAc)2, Pd(ортотолил)з, DIEA, DMF, дегазация, 100 С; приблизительно 70% выход. Средство соединения по изобретению к рецептору может быть усилено путем обеспечения многочисленных копий лиганда на близком расстоянии, предпочтительно применяя подвешивание, обеспечиваемое группировкой носителя. Было показано, что предоставление таких мультивалентных соединений с оптимальным расстоянием между группировками заметно улучшает связывание с рецептором. См.,например Lee et al., Biochem., 23, 4255 (1984). Мультивалентность и расстояние можно регулировать выбором подходящей групировки носителя или линкерных единиц. Такие группировки включают молекулярные подложки, содержащие множество функциональных групп, которые могут взаимодействовать с функциональными группами ассоциированными с соединениями по изобретению. Несомненно, может быть использовано множество носителей, включая белки, например BSA (бычий сывороточный альбу- 11008501 мин) или HAS, множество пептидов, включая, например, пентапептиды, декапептиды, пентадекапептиды, и подобные. Пептиды или белки могут содержать нужное количество аминокислотных остатков,имеющих свободные аминогруппы на боковых цепях; однако и другие функциональные группы, такие как сульфгидрильные группы или гидроксильные группы, также могут быть использованы для получения стабильных связей. Активность соединения по изобретению как модулятора протеинкиназной активности, например активности киназ, может быть измерена любым способом, имеющимся в распоряжении специалистов в данной области техники, включая in vivo и/или in vitro анализы. Примеры подходящих анализов для измерения активности включают описанные в Parast С. et al., BioChemistry, 37, 16788-16801 (1998); Jeffreyet al., Nature, 376, 313-320 (1995); в международной публикации WIPOWO 97/34876; и международной публикации WIPOWO 96/14843. Эти свойства могут быть оценены, например, посредством использования одной или более методик биологического тестирования, приведенных ниже в примерах. Активные агенты по изобретению могут входить в состав фармацевтических композиций, как описано ниже. Фармацевтические композиции по данному изобретению содержат эффективное модулирующее, регулирующее или ингибирующее количество соединения по изобретению и инертный, фармацевтически приемлемый носитель или разбавитель. В одном воплощении фармацевтических композиций предложены эффективные уровни агентов по изобретению, такие чтобы обеспечить терапевтические преимущества, включающие модуляция протеинкиназ. Под эффективными уровнями подразумеваются уровни, при которых действия протеинкиназ, как минимум, регулируются. Такие композиции готовят в стандартной лекарственной форме, соответствующей способу введения, например парентеральному или пероральному введению. Агент по изобретению вводят в традиционной лекарственной форме, приготовленной путем объединения терапевтически эффективного количества агента в качестве активного ингредиента с соответствующими фармацевтическими носителями или разбавителями в соответствии с традиционными методиками. Эти методики могут включать смешивание, гранулирование и прессование или растворение ингредиентов, как это целесообразно, до нужного препарата. Используемый фармацевтический носитель может быть либо твердым, либо жидким. Примерами твердых носителей являются лактоза, сахароза, тальк, желатин, агар, пектин, аравийская камедь, стеарат магния, стеариновая кислота и подобные. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, вода и подобные. Аналогично, носитель или разбавитель может включать в себя вещество с задержкой во времени или высвобождением во времени, известный в данной области техники, например глицерилмоностеарат или глицерилдистеарат, сам по себе или с воском, этилцеллюлозу,гидроксипропилметилцеллюлозу, метилметакрилат и подобные. Может быть использовано множество фармацевтических форм. Так, если используется твердый носитель, препарат может быть таблетирован, помещен в твердую желатиновую капсулу в порошковой форме или форме гранул, либо находиться в форме пилюли или лепешки. Количество твердого носителя может варьироваться, но в общем случае будет составлять от приблизительно 25 мг до приблизительно 1 г. Если используется жидкий носитель, препарат будет находиться в форме сиропа, эмульсии, капли,мягкой желатиновой капсулы, стерильного инъекционного раствора или суспензии, в ампуле или флаконе, либо неводной жидкой суспензии. Для получения стабильной водорастворимой лекарственной формы фармацевтически приемлемую соль агента по изобретению растворяют в водном растворе органической или неорганической кислоты,таком как 0,3 М раствор янтарной кислоты или лимонной кислоты. Если растворимой солевой формы нет в наличии, агент может быть растворен в подходящем сорастворителе или комбинациях сорастворителей. Примеры подходящих сорастворителей включают спирт, пропиленгликоль, полиэтиленгликоль 300, полисорбат 80, глицерин и подобные, в концентрациях в интервале 0-60% от суммарного объема, но ими не ограничиваются. В приводимом в качестве примера воплощении соединение по изобретению растворяют в DMSO и разбавляют водой. Композиция также может находиться в форме раствора солевой формы активного ингредиента в подходящем водном наполнителе, таком как вода или изотонический физиологический раствор, либо раствор декстрозы. Очевидно, что фактические дозировки агентов, используемых в композициях по этому изобретению, будут варьироваться в соответствии с конкретной используемой системой, конкретной приготавливаемой композицией, способом введения и конкретным местом, хозяином и заболеванием, подвергаемым лечению. Оптимальные дозировки для заданного набора условий могут быть установлены специалистами в данной области техники с использованием традиционных тестов по определению дозировок, с учетом экспериментальных данных для агента. Для перорального введения примерная суточная доза, используемая в общем случае, составляет от приблизительно 0,001 до приблизительно 1000 мг/кг массы тела, более предпочтительно от приблизительно 0,001 до приблизительно 50 мг/кг массы тела с курсами лечения, повторяемыми через определенные интервалы. Введение пролекарств обычно дозируется по уровням массы, которые химически эквивалентны уровням массы полностью активной формы. Композиции по изобретению могут быть изготовлены способами, общеизвестными в изготовлении фармацевтических композиций, например, используя традиционные методики, такие как смешивание,- 12008501 растворение, гранулирование, изготовление драже, отмучивание, эмульгирование, инкапсулирование,включение в вещества или лиофилизация. Фармацевтические композиции могут быть приготовлены традиционным образом с использованием одного или более физиологически приемлемых носителей, которые могут быть выбраны из эксципиентов и вспомогательных веществ, облегчающих переработку активных соединений в препараты, которые могут быть использованы фармацевтически. Подходящий препарат зависит от выбранного способа введения. Для инъекции агенты по изобретению могут быть приготовлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера или буферный физиологический раствор. Для введения через слизистые в препарате используют проникающие вещества, подходящие для прохождения барьера. Такие проникающие вещества в целом известны в данной области техники. Для перорального введения соединения могут быть легко приготовлены в виде препарата путем объединения активных соединений с фармацевтически приемлемыми носителями, известными в данной области техники. Такие носители позволяют изготовить препараты соединений по изобретению в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и подобного для перорального приема внутрь пациентом, подвергаемым лечению. Фармацевтические препараты для перорального применения можно получить, используя твердый эксципиент в смеси с активным ингредиентом(агентом), возможно с измельчением полученной смеси и обработкой смеси гранул после добавления подходящих вспомогательных веществ, если желательно, с целью получения таблеток или ядер драже. Подходящие эксципиенты включают: наполнители, такие как сахара, в том числе лактозу, сахарозу, маннит или сорбит; и препараты целлюлозы, например кукурузный крахмал, зерновой крахмал, рисовый крахмал, картофельный крахмал, желатин, камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу,натриевую соль карбоксиметилцеллюлозы или поливинилпирролидон (PVP). При желании могут быть добавлены разрыхлители, такие как перекрестносшитый поливинилпирролидон, агар или альгиновая кислота либо ее соль, например альгинат натрия. Ядра драже обеспечиваются подходящими оболочками. Для этой цели могут быть использованы концентрированные растворы сахаров, которые возможно могут содержать гуммиарабик, поливинилпирролидон, гель Карбопол, полиэтиленгликоль и/или двуокись титана, растворы лаков и подходящие органические растворители или смеси растворителей. К таблеткам или оболочкам драже могут быть добавлены красители или пигменты для распознавания различных комбинаций активных агентов. Фармацевтические препараты, которые могут быть использованы перорально, включают заполненные капсулы, изготовленные из желатина, а также мягкие герметичные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Заполненные капсулы могут содержать активные ингредиенты в смеси с наполнителями, такими как лактоза, связующими, такими как крахмалы,и/или смазывающими веществами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В мягких капсулах активные агенты могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все препараты для перорального введения должны иметь дозировки, подходящие для такого введения. Для трансбуккального введения композиции могут принимать форму таблеток или лепешек, изготовленных традиционным способом. Для интраназального введения или введения посредством ингаляции соединения для применения согласно настоящему изобретению удобным образом доставляются в форме подачи аэрозольного спрея из находящихся под давлением упаковок или небулайзера, с использованием подходящего пропеллента,например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, двуокиси углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля стандартная дозировка может определяться при помощи клапана, выпускающего отмеренное количество. Капсулы и картриджи из желатина для использования в ингаляторе или инсуффляторе и тому подобном могут быть изготовлены содержащими порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал. Соединения могут быть изготовлены в виде препаратов для парентерального введения путем инъекции, например путем болюсной инъекции или непрерывной инъекции. Препараты для инъекции могут быть представлены в стандартной лекарственной форме, например в ампулах или в мультидозовых контейнерах, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать препаратообразующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические препараты для парентерального введения включают водные растворы активных соединений в водорастворимой форме. Кроме того, суспензии активных агентов могут быть приготовлены в виде подходящих масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные инъекционные суспензии могут содержать вещества, увеличивающие вязкость суспензии,такие как натрийкарбоксиметилцеллюлозу, сорбит или декстран. Возможно, суспензии также могут содержать подходящие стабилизаторы или агенты, увеличивающие растворимость соединений с целью приготовления- 13008501 сильноконцентрированных растворов. Для введения в глаз соединение по изобретению доставляют в фармацевтически приемлемом офтальмологическом носителе, так чтобы поддерживать контакт соединения с поверхностью глаза в течение периода времени, достаточного для того, чтобы соединение проникло в роговицу и/или склеру и внутренние области глаза, включая, например, переднюю камеру, заднюю камеру, стекловидное тело,внутриглазную жидкость, жидкость стекловидного тела, роговицу, радужную оболочку/реснички, хрусталик, сосудистую оболочку глаза/сетчатку и склеру. Фармацевтически приемлемым офтальмологическим носителем может быть мазь, растительное масло или инкапсулирующее вещество. Соединение по изобретению также можно инъецировать непосредственно в жидкость стекловидного тела или во внутриглазную жидкость. Кроме того, соединение также может быть введено хорошо известными приемлемыми способами,такими как инъекции под теноновую капсулу или под конъюнктиву. Как хорошо известно в офтальмологии, пятно состоит главным образом из колбочек и представляет собой область максимальной остроты зрения на сетчатке. Теноновая капсула или теноновая оболочка расположена на склере. Конъюнктива 36 покрывает небольшую область глазного яблока за лимбом (конъюнктива глазного яблока) и переходящий вверх (верхний свод) или вниз (нижний свод), чтобы закрыть внутренние области верхнего века и нижнего века соответственно. Конъюнктива расположена сверху теноновой капсулы. Склера и теноновая капсула определяют наружную поверхность глазного яблока. Для леченияARMD, CNV, ретинопатии, ретинита, увеита, кистоидного отека желтого пятна (СМЕ), глаукомы и других заболеваний или состояний заднего сегмента глаза предпочтительно расположить депо, содержащее конкретное количество офтальмологически приемлемого фармацевтически активного агента, непосредственно на внешней поверхности склеры и ниже теноновой капсулы. Кроме того, в случаях ARMD и СМЕ, наиболее предпочтительно разместить депо непосредственно на внешней поверхности склеры,ниже теноновой капсулы и, как правило, выше желтого пятна. В исследовании с использованием новозеландских белых кроликов лекарственное депо 4,9(11)-прегнадиен-17.альфа.,21-диол-3,20-дион-21 ацетата, ангиостатического стероида, имеющегося у Steraloids, Inc. (Wilton, New Hampshire), размещали непосредственно на внешней поверхности склеры, ниже теноновой капсулы и немного позади экватора глаз кролика. Такое лекарственное депо приводило к концентрации ангиостатического стероида, усредненной по всей сетчатке и измеренной на следующие сутки после инъекции, приблизительно в десять раз большей, чем аналогичная концентрация, доставляемая посредством депо, помещенным ниже конъюнктивы, но выше теноновой капсулы глаз кролика. Принимая во внимание тот факт, что теноновая капсула новозеландского белого кролика очень тонка, эти полезные результаты оказались весьма неожиданными. Важно отметить, что теноновая капсула человеческого глаза тоже очень тонка. 4,9(11)-Прегнадиен 17.альфа.,21-диол-3,20-дион-21-ацетат и родственное соединение 4,9(11)-прегнадиен-17.альфа.,21-диол 3,20-дион более полно описаны в патентах США 5770592 и 5679666, которые включены в данное описание ссылкой во всей своей полноте. Альтернативно, активный ингредиент может находиться в порошковой форме для разведения в подходящем носителе, например стерильной апирогенной воде, перед использованием. Соединения также могут быть приготовлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например содержащие традиционные основы для суппозиториев, такие как масло какао или другие глицериды. В дополнение к описанным выше препаратам соединения также могут быть приготовлены в виде депо-препаратов. Такие препараты пролонгированного действия могут быть введены путем имплантации(например, подкожно или внутримышечно), внутримышечной инъекции или путем упомянутой выше инъекции под теноновую капсулу или внутрь стекловидного тела. В особенно предпочтительных воплощениях изобретения соединения могут быть приготовлены для местного введения в физиологическом растворе (объединенными с любыми консервантами и антимикробными агентами, обычно используемыми в глазных препаратах) и введены в форме глазных капель. Раствор или суспензия противоангиогенного фактора могут быть приготовлены в чистой форме и введены несколько раз ежесуточно. Альтернативно, противоангиогенные композиции, приготовленные как описано выше, также могут быть введены непосредственно в роговицу. В предпочтительных воплощениях композицию готовят с мукоадгезивным полимером, который связывается с роговицей. Так, например, соединения могут быть приготовлены в виде препарата с подходящими полимерными или гидрофобными веществами (например в виде эмульсии в подходящем масле) или ионообменными смолами, либо в виде умеренно растворимых производных, например в виде умеренно растворимых солей. В других воплощениях противоангиогенные факторы или противоангиогенные композиции могут быть использованы в качестве дополнения к традиционной стероидной терапии. Фармацевтическим носителем для гидрофобных соединений является система сорастворителей, содержащая бензиловый спирт, неполярное поверхностно-активное вещество, смешиваемый с водой органический полимер и водную фазу. Система сорастворителей может представлять собой VPD-систему сорастворителей. VPD представляет собой раствор в абсолютном этаноле 3 мас.% бензилового спирта,8 мас.% неполярного поверхностно-активного вещества полисорбата 80 и 65 мас.% полиэтиленгликоля- 14008501 300, доведенных до нужного объема. VPD-система сорастворителей (VPD:5W) содержит VPD, разбавленный 1:1 5% декстрозой в водном растворе. Такая система сорастворителей хорошо растворяет гидрофобные соединения, и сама проявляет низкую токсичность при системном введении. Конечно, пропорции системы растворителей могут значительно варьироваться без нарушения ее характеристик растворимости и токсичности. Кроме того, могут меняться конкретные компоненты сорастворителей: например вместо полисорбата 80 могут быть использованы другие низкотоксичные неполярные поверхностноактивные вещества; может меняться размер фракции полиэтиленгликоля; полиэтиленгликоль может быть заменен другими биосовместимыми полимерами, например поливинилпирролидоном; а декстроза может быть заменена другими сахарами или полисахаридами. Альтернативно, могут быть использованы другие системы доставки гидрофобных фармацевтических соединений. Липосомы и эмульсии являются известными примерами наполнителей или носителей для доставки гидрофобных лекарственных средств. Также могут быть использованы некоторые органические растворители, такие как диметилсульфоксид, хотя ценой более высокой токсичности. Кроме того,соединения могут быть доставлены с использованием системы замедленного высвобождения, такой как полупроницаемые матрицы твердых гидрофобных полимеров, содержащие терапевтический агент. Различные вещества для замедленного высвобождения обнаружены и известны специалистам в данной области техники. Капсулы с замедленным высвобождением могут, в зависимости от их химической природы, высвобождать соединения в течение промежутка времени от нескольких недель до более чем 100 суток. В зависимости от химической природы и биологический стабильности терапевтического реагента могут быть использованы дополнительные стратегии стабилизации белков. Фармацевтические композиции также могут содержать подходящие твердо- или гелефазные носители или эксципиенты. Примеры таких носителей или эксципиентов включают карбонат кальция, фосфат кальция, сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли. Некоторые из раскрытых соединений могут быть представлены в виде солей с фармацевтически совместимыми противоионами. Фармацевтически совместимые соли могут быть образованы многими кислотами, включая соляную, серную, уксусную, молочную, винную, яблочную, янтарную и т.д. Соли имеют тенденцию быть более растворимыми в водных или других протонных растворителях, чем соответствующие формы свободных оснований. Получение соединения по настоящему изобретению и ряда структурно близких соединений подробно описано в следующих ниже примерах, однако специалисту обычной квалификации очевидно, что описанные химические реакции можно легко адаптировать для получения ряда других протеинкиназных ингибиторов по изобретению. Например, синтез не приведенных в качестве примеров соединений согласно изобретению может быть успешно осуществлен посредством модификаций, очевидных специалистам в данной области техники, например посредством соответствующей защиты мешающих групп, путем замены на другие подходящие реагенты, известные в данной области техники, или путем осуществления стандартных модификаций реакционных условий. Альтернативно, очевидно, что другие реакции,описанные в данном описании или известные в данной области техники, применимы для получения других соединений по изобретению. Подробное описание изобретения и примеры предпочтительных воплощений В описанных ниже примерах, если не оговорено особо, все значения температуры приведены в градусах Цельсия и все доли и проценты указаны по массе. Реагенты приобретали у коммерческих поставщиков, таких как Aldrich Chemical Company или Lancaster Synthesis Ltd., и использовали без дальнейшей очистки, если не оговорено особо. Тетрагидрофуран (THF), N,N-диметилформамид (DMF), дихлорметан,толуол и диоксан были приобретены у Aldrich в надежно запечатанных бутылках и их использовали при получении. Все растворители очищали стандартными способами, хорошо известными специалистам в данной области техники, если не оговорено особо. Приведенные ниже реакции обычно проводили при положительном давлении аргона или азота, либо с осушительным патроном при температуре окружающей среды (если не оговорено особо) в безводных растворителях, и реакционные колбы были оснащены резиновыми мембранами для введения субстратов и реагентов с помощью шприца. Стеклянную посуду сушили в сушильном шкафу и/или нагреванием. Аналитическую тонкослойную хроматографию (ТСХ) проводили на пластинках силикагеля 60 F 254 на стеклянных подложках (Analtech; 0,25 мм) и элюировали смесями растворителей в соответствующих соотношениях (об./об.), указанными, где необходимо. Степень прохождения реакции оценивали посредством ТСХ и реакции останавливали исходя их расходования исходного вещества. Пластинки ТСХ визуализировали аэрозольным реагентом на основе пара-(анисового альдегида) либо реагентом на основе фосфомолибденовой кислоты (Aldrich Chemical; 20 мас.%, в этаноле) и активировали нагреванием. Обработки обычно проводили, удваивая объем реакционной смеси растворителем реакционной смеси или растворителем для экстракции и затем промывая указанными водными растворами, используемыми 25 об.% от объема экстракции, если не оговорено особо. Растворы продуктов сушили над безводным Na2SO4 перед фильтрацией и выпариванием растворителей при пониженном давлении на роторном испарителе, где указано, что растворители удалены in vacuo. Колоночную флэшхроматографию (Still et al., J. Org. Chem., 43, 2923 (1978 проводили с использованием флэш-силикагеля- 15008501 марки Baker (47-61 мкм) и соотношении силикагель:неочищенный материал приблизительно от 20:1 до 50:1, если не оговорено особо. Гидрогенолиз проводили под давлением, указанным в примерах, или при атмосферном давлении. Спектры 1H-ЯМР регистрировали на приборе Bruker при 300 МГц, а спектры 13 С-ЯМР регистрировали при 75 МГц. Спектры ЯМР получали в растворах CDCl3 (приведены в млн-1 ), используя хлороформ в качестве эталона (7,25 и 77,00 млн-1), или CD3OD (3,4 и 4,8 и 49,3 млн-1), или внутренний эталон тетраметилсилан (0,00 млн-1), как целесообразно. При необходимости использовали другие растворители для ЯМР. Когда указывается мультиплетность пиков, используются следующие сокращения: s (синглет), d(дублет), t (триплет), m (мультиплет), br (широкий), dd (дублет дублетов), dt (дублет триплетов). Константы взаимодействия, когда они приведены, указаны в герцах (Гц). Инфракрасные (ИК) спектры регистрировали на спектрометре Perkin-Elmer FT-IR на образцах в подходящих маслах, в таблетках с KBr или в растворах в CDCl3, и когда они приведены, представлены в волновых числах (см-1). Масс-спектры получали с использованием LSIMS (жидкостной мас.спектрометрии вторичных ионов) или электрораспыления. Все точки плавления (т.пл.) являются предварительными. Пример 1(a). 2-(4-Хлор-2-нитрофенил)малоновой кислоты диметиловый эфир. К перемешиваемой суспензии NaH (36,0 г; 1500 ммоль) в NMP (N-метил-2-пирролидон) (1,0 л) по каплям добавляли диметилмалонат (137,4 мл; 1200 ммоль). Реакционную смесь охлаждали, как это требовалось, для поддержания внутренней температуры ниже 30C. По окончании выделения газа к реакционной смеси добавляли 2,4-дихлорнитробензол (192 г; 1000 ммоль). Реакционную смесь аккуратно нагревали до 65C до окончания реакции, которую определяли посредством ВЭЖХ. Реакционную смесь охлаждали до комнатной температуры и затем выливали на 500 мл льда, смешанного с 150 мл концентрированной HCl. рН водного слоя доводили до нейтрального значения, используя 1 н NaOH. Твердые вещества извлекали фильтрацией через крупнозернистый фриттовый фильтр и промывали водой (3 л). Твердые вещества желтого цвета оставляли сушиться в течение ночи. Выход 261,5 г; 91%. Пример 1(б). (4-Хлор-2-нитрофенил)уксусной кислоты метиловый эфир. Раствор 2-(4-хлор-2-нитрофенил)малоновой кислоты диметилового эфира (195 г; 679,4 ммоль) в воде (100 мл) и NMP (1000 мл) нагревали до кипения с обратным холодильником в течение 3,5 ч. Растворитель удаляли выпариванием на роторном испарителе до получения масла. Масло растворяли в EtOAc и затем промывали водой (5300 мл). Водный слой затем экстрагировали EtOAc (4300 мл). Органическую фазу промывали водой. Органические слои объединяли и сушили над MgSO4. После удаления твердых веществ фильтрацией, растворитель выпаривали с получением нужного продукта в виде твердого вещества оранжевой/коричневой окраски (160,0 г; 95%). Пример 1(в). (2-Ацетиламино-4-хлорфенил)уксусной кислоты метиловый эфир. В заполненную аргоном колбу загружали (4-хлор-2-нитрофенил)уксусной кислоты метиловый эфир(40 г; 175 ммоль), 10% Pd/C (2,5 г), уксусный ангидрид (64 мл; 677 ммоль), воду (9 мл) и уксусную кислоту (150 мл). Колбу под вакуумом заполняли газообразным водородом под давлением 30 ф/кв. дюйм(206,85 кПа) и интенсивно встряхивали. Через 2 ч добавляли дополнительное количество 10% Pd/C (2 г),и реакция завершалась полностью по истечении в сумме 4 ч протекания реакции. 10% Pd/C извлекали фильтрацией, и растворитель удаляли выпариванием на роторном испарителе. Пример 1(г). 6-Хлор-1 Н-индазол-3-карбоновой кислоты метиловый эфир. К раствору (2-ацетиламино-4-хлорфенил)уксусной кислоты метилового эфира (32,0 г; 133 ммоль) в уксусной кислоте (200 мл), перемешиваемому при 90C, в течение 1 ч добавляли трет-бутилнитрил (20,5- 16008501 мл; 172,3 ммоль). Реакционную смесь вливали в воду (1,4 л), и твердые вещества извлекали фильтрацией. Желтый осадок растворяли в EtOAc, затем промывали насыщенным NaCl. Органическую фазу сушили над MgSO4, фильтровали и концентрировали до твердого вещества. Твердые вещества растирали с гексанами и фильтровали с получением нужного вещества (21,63 г; 77%). Пример 1(д). 6-Хлор-1-(тетрагидропиран-2-ил)-1H-индазол-3-карбоновой кислоты метиловый эфир. К суспензии 6-хлор-1 Н-индазол-3-карбоновой кислоты метилового эфира (8,3 г; 39,5 ммоль) в(237 мг; 1,25 ммоль). После перемешивания реакционной смеси в течение 10 мин добавляли насыщенный NaHCO3 (1 мл), и растворитель удаляли на роторном испарителе до объема 100 мл. Смесь разбавляли EtOAc, промывали водой (50 мл) и затем насыщенным NaCl (50 мл). Органический слой затем сушили над Na2SO4. После удаления твердых веществ фильтрацией, органический слой концентрировали на роторном испарителе с получением масла. Продукт осаждали из масла, используя гексаны, с получением нужного продукта (7,667 г; 66% выход). Пример 1(e). 6-(2-Метоксикарбонилфениламино)-1-(тетрагидропиран-2-ил)-1 Н-индазол-3-карбоновой кислоты метиловый эфир. К раствору 6-хлор-1 Н-индазол-3-карбоновой кислоты метилового эфира (2,94 г; 10,0 ммоль) в 1,2 диметоксиэтане (30 мл) добавляли K3PO4 (5,32 г; 25,0 ммоль), трис(дибензилиденацетон)дипалладий (459 мг; 0,05 ммоль), 2-(дициклогексилфосфино)бифенил (701 мг; 2,0 ммоль) и метилантранилат (2,59 мл; 20,0 ммоль). Раствор под вакуумом три раза продували аргоном, затем нагревали до 80C в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, и твердые вещества извлекали фильтрацией. После промывания твердых веществ этилацетатом, растворитель удаляли на роторном испарителе. Оставшееся масло хроматографировали (150 г силикагеля; 10-30% смесь EtOAc/Нех) с получением 1,23 г К раствору 6-(2-метоксикарбонилфениламино)-1-(тетрагидропиран-2-ил)-1 Н-индазол-3-карбоновой кислоты метилового эфира (2,05 г; 5 ммоль) в метаноле (18 мл) и тетрагидрофуране (8 мл) добавляли раствор гидроксида натрия (0,30 г; 7,5 ммоль) в воде (2,7 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем нейтрализовали 1 н. HCl до рН 1. Смесь разбавляли EtOAc(25 мл) и водой (25 мл). После разделения слоев водный слой промывали CH2Cl2 (325 мл). Объединенные органические экстракты промывали насыщенным NaCl (100 мл) и затем сушили над Na2SO4. Твердые вещества отфильтровывали, и жидкость концентрировали до масла. Продукт кристаллизовали изEtOAc и гексанов с получением нужного продукта (1,616 г; 82%). Пример 1(з). 2-[3-Метилкарбамоил-1-(тетрагидропиран-2-ил)-1H-индазол-6-иламино]бензойной кислоты метиловый эфир.- 17008501 кислоты (0,50 г; 1,27 ммоль) в DMF добавляли триэтиламин (0,42 мл; 3,04 ммоль), метиламин (1,9 мл; 3,81 ммоль) и HATU (0,578 г; 1,52 ммоль). Реакционную смесь перемешивали в течение 3 ч и затем концентрировали на роторном испарителе. Неочищенное масло хроматографировали (50 г силикагеля, 2550% смесь EtOAc/гексаны) с получением нужного продукта (214 мг; 42%). Пример 1(и). 2-[3-Метилкарбамоил-1-(тетрагидропиран-2-ил)-1 Н-индазол-6-иламино]бензойная кислота. К раствору 2-[3-метилкарбамоил-1-(тетрагидро-пиран-2-ил)-1 Н-индазол-6-иламино]-бензойной кислоты метилового эфира (0,20 г; 0,49 ммоль) в метаноле (1,4 мл) и тетрагидрофуране (0,6 мл) добавляли раствор гидроксида натрия (59 мг; 1,47 ммоль) в воде (0,3 мл). Реакционную смесь нагревали до 60C в течение 1 ч и затем охлаждали до комнатной температуры. рН доводили 2 н. HCl до рН 2. ДобавлялиEtOAc (30 мл) и воду (30 мл), и слои разделяли. Водную фазу экстрагировалим EtOAc (320 мл), и органические слои объединяли. После промывания водой (15 мл) органический слой сушили над Na2SO4 Твердые вещества отфильтровывали, и органическую фазу упаривали с получением твердого вещества желтого цвета (193 мг; 100%). Пример 1(к). 6-(2-Проп-2-инилкарбамоил-фениламино)-1-(тетрагидропиран-2-ил)-1H-индазол-3 карбоновой кислоты метиламид.(триэтиламин) (0,264 мл; 1,90 ммоль) и HATU (217 мг; 0,571 ммоль). Реакционную смесь перемешивали в течение 4 ч и затем разбавляли EtOAc (30 мл) и водой (30 мл). Слои разделяли, и водный слой экстрагировали EtOAc (220 мл). Объединенные органические слои промывали насыщенным NaCl (15 мл) и затем сушили над Na2SO4. Твердые вещества удаляли фильтрацией, и жидкость концентрировали на роторном испарителе до желтого масла (164 мг; 100%). Пример 1(л). 6-(2-Проп-2-инилкарбамоилфениламино)-1 Н-индазол-3-карбоновой кислоты метиламид. Растворяли 6-(2-проп-2-инилкарбамоилфениламино)-1-(тетрагидропиран-2-ил)-1H-индазол-3-карбоновой кислоты метиламид (30 мг) в 1,5 мл смеси CH2Cl2:TFA:триэтилсилан (90:10:1) и нагревали до температуры дефлегмации в течение 2 ч. Разбавляли раствор толуолом (40 мл) и концентрировали на роторном испарителе до масла. Разбавляли масло в DMF (1 мл) и фильтровали, используя 0,2-микронный шприцевой фильтр. Для выделения нужного соединения использовали препаративную ВЭЖХ (12 мг; 50%). 1 Н ЯМР (CDCl3-d)9.96 (1H, s), 8.28 (1H, d, J=8,85 Гц), 7.47 (1 Н, m), 7.34 (1 Н, m), 7.22 (1 Н, m), 7.15 К раствору 6-хлор-1 Н-индазол-3-карбоновой кислоты метилового эфира (2,94 г; 10,0 ммоль) в безводном CH2Cl2 (50 мл), охлажденному до -78C, медленно добавляли DIBAL-H (диизобутилалюминия гидрид) (3,56 мл; 20,0 ммоль). По завершении добавления реакционную смесь оставляли нагреваться до комнатной температуры, после чего ВЭЖХ показала, что осталось 10% исходного вещества. Затем добавляли дополнительное количество DIBAL-H (0,35 мл) и перемешивали в течение 10 мин. Реакционную смесь разбавляли EtOAc (1000 мл) и промывали 1 н. HCl (2 100 мл). Реакционную смесь затем промывали 1 н. NaHCO3 (100 мл) и затем насыщенным NaCl (100 мл). Органическую фазу сушили над MgSO4,фильтровали и затем концентрировали до твердого вещества белого цвета (2,65 г; 99,5 %). Пример 2(б). 6-Хлор-1-(тетрагидропиран-2-ил)-1 Н-индазол-3-карбальдегид. Раствор [6-хлор-1-(тетрагидропиран-2-ил)-1 Н-индазол-3-ил]метанола (1,75 г; 6,58 ммоль), IBX (2,76 г; 9,87 ммоль) и DMSO (27 мл) перемешивали в течение ночи. Реакционную смесь разбавляли EtOAc и водой. Слои разделяли, и водный слой экстрагировали EtOAc (3100 мл). Органические слои объединяли и промывали насыщенным NaCl (100 мл). Органическую фазу сушили над MgSO4, фильтровали и затем концентрировали до твердого вещества. Твердое вещество растворяли в CH2Cl2 и фильтровали. Органическую фазу упаривали с получением нужного продукта (1,707 г; 92%). Пример 2(в). 1-(6-Хлор-1H-индазол-3-ил)-2-(5-этилпиридин-2-ил)этанол. К перемешиваемому раствору 4-этил-2-метилпиридина (0,458 г; 3,79 ммоль) в THF (4 мл) при -50C медленно добавляли бутиллитий (1,5 мл; 2,5 М; 3,79 ммоль) и перемешивали в течение 10 мин. К реакционной смеси медленно добавляли раствор 6-хлор-1 Н-индазол-3-карбальдегида (0,5 г; 1,89 ммоль) в THF(4 мл). После перемешивания в течение 10 мин реакцию гасили 1 н. лимонной кислотой (10 мл). Смесь разбавляли EtOAc (50 мл), водой (20 мл) и насыщенным NaCl (10 мл). Слои разделяли, и водный слой экстрагировали EtOAc (315 мл). Органические слои объединяли и промывали насыщенным NaCl (20 мл). После высушивания органического слоя над Na2SO4 твердые вещества удаляли фильтрацией, и жидкость концентрировали до масла на роторном испарителе. Хроматография (40 г силикагеля, 60-100% смесь EtOAc/hex) дала нужный продукт (142 мг; 32%) и полученный обратно 6-хлор-1 Н-индазол-3 карбальдегид (348 мг). Пример 2(г). 6-Хлор-3-[2-(5-этилпиридин-2-ил)винил]-1 Н-индазол. К перемешиваемому раствору 1-(6-хлор-1 Н-индазол-3-ил)-2-(5-этилпиридин-2-ил)этанола (232 мг; 0,60 ммоль) в CH2Cl2 добавляли TEA (0,25 мл; 1,81 ммоль) и мезилхлорид (0,070 мл; 0,90 ммоль). Реакционную смесь перемешивали в течение 30 мин и затем добавляли DBU (1,8-диазабицикло[5.4.0]ундек 7-ен) (2 мл). Реакционную смесь кипятили с обратным холодильником в течение 18 ч, и затем реакцию гасили 40 мл 1 н. лимонной кислоты. Слои разделяли и водный слой экстрагировали 20 мл CH2Cl2. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе. Очистка хроматографией (12 г силикагеля, 50-70% смесь EtOAc/гексаны) дала нужное соединение 1,2-Диметоксиметан (2 мл) добавляли к 6-хлор-3-[2-(5-этилпиридин-2-ил)винил]-1 Н-индазолу (130 мг; 0,354 ммоль), трис(дибензилиденацетон)дипалладию (16 мг; 0,018 ммоль), 2-(дициклогексилфосфино)бифенилу (25 мг; 0,071 ммоль), K3 РО 4 (0,188 г; 0,885 ммоль) и метилантранилату (0,092 мл; 0,71 ммоль). Реакционную смесь под вакуумом продували аргоном (4) и затем нагревали до 80C в течение 19 ч. Реакционную смесь разбавляли EtOAc (20 мл) и фильтровали через набивку с силикагелем. После промывания EtOAc (50 мл) растворитель удаляли на роторном испарителе. Неочищенное масло очищали хроматографией (40 г силикагеля, 30-40%-ная смесь EtOAc/гексаны) с получением нужного продукта (54 мг; 32%). Пример 2(e). 2-3-[2-(5-Этилпиридин-2-ил)винил]-1H-индазол-6-иламинобензойная кислота. К раствору 2-3-[2-(5-этилпиридин-2-ил)винил]-1 Н-индазол-6-иламинобензойной кислоты метилового эфира (50 мг; 0,104 ммоль) в метаноле (0,42 мл) и THF (0,10 мл) добавляли раствор гидроксида натрия (12 мг; 0,311 ммоль) в воде (0,05 мл). Раствор нагревали до 60C в течение 3,5 ч и затем нейтрализовали насыщенным NH4Cl. Реакционную смесь разбавляли водой (20 мл) и затем экстрагировали EtOAc(220 мл). Объединенные экстракты сначала сушили над Na2SO4, а затем твердые вещества удаляли фильтрацией. Нужный продукт (48,7 мг; 100%) извлекали после упаривания на роторном испарителе для удаления растворителей. Пример 2(ж). 2-3-[2-(5-Этилпиридин-2-ил)винил]-1 Н-индазол-6-иламино-N-проп-2-инилбензамид. К 2-3-[2-(5-этилпиридин-2-ил)винил]-1 Н-индазол-6-иламинобензойной кислоте (49 мг; 0,105 ммоль) добавляли 2 мл смеси CH2Cl2:TFA:TES(N-трис-[гидроксиметил]метил-2-аминоэтансульфоновая кислота) (90:10:1). Реакционную смесь перемешивали при кипении с обратным холодильником в течение 1 ч и затем разбавляли толуолом (20 мл). Растворитель удаляли на роторном испарителе с получением густого масла. Масло растворяли в DMF (1 мл) и к этому раствору добавляли TEA (0,072 мл; 0,52 ммоль), пропаргиламин (0,014 мл; 0,208 ммоль) и HATU (59 мг; 0,156 ммоль). Реакционную смесь перемешивали в течение 3 ч и затем очищали препаративной ВЭЖХ с получением нужного продукта (29 мг; 66%). 1 Н ЯМР (CDCl3-d):9.83 (1 Н, s), 8.63 (2 Н, s), 8.04 (2 Н, m), 7.68 (2 Н, s), 7.47 (1H, m), 7.32 (1H, d,J=1,51 Гц), 7.10 (1H, dd, J1=8,67 Гц, J2=1,88 Гц), 6.93 (1 Н, m), 6.07 (2 Н, dd, J1=5,09 Гц, J2=2,26 Гц), 3.15 Указанное в заголовке соединение получали аналогично 2-3-[2-(5-этилпиридин-2-ил)винил]-1 Ниндазол-6-иламино-N-проп-2-инилбензамиду, описанному выше, заменяя 2,4-диметил-пиридином 4 этил-2-метилпиридин на стадии получения 1-(6-хлор-1 Н-индазол-3-ил)-2-(5-этилпиридин-2-ил)этанола, и заменяя циклопропиламином пропаргиламин на конечной стадии последовательности операций. 1DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 21,6 мг (67%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (DMSO-d6):9.23 (1 Н, s), 8.71 (1 Н, d, J=2,2), 8.05 (4 Н, m), 7.51 (5 Н, m), 7.25 (1H, s), 7.10 Раствор 2-[3-(2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензойной кислоты (50,0 мг; 0,084 ммоль), О-аллил-гидроксиламина гидрохлорида (18,3 мг; 0,17 ммоль), триэтиламина (58 мкл; 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 25,5 мг (74%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (DMSO-d6):9.28 (1 Н, s), 8.67 (2 Н, d, J=3,4), 8.05 (4 Н, m), 7.48 (5 Н, m), 7.23 (1H, s), 7.04 Раствор 2-[3-(2-пиридин-2-ил-винил)-1 Н-индазол-6-иламино]-бензойной кислоты (50,0 мг; 0,084 ммоль), О-изопропилгидроксиламина гидрохлорида (18,7 мг; 0,17 ммоль), триэтиламина (58 мкл; 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи,затем очищали ВЭЖХ на обращенной фазе с получением 17,4 мг (50%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (DMSO-d6):9.23 (1 Н, s), 8.69 (Н, d,J=2,1), 8.03 (4 Н, m), 7.50 (5 Н, m), 7.23 (1H, s), 7.04 (1 Н,d, J=6,7 Гц), 6.92 (1 Н, m), 5.98 (1 Н, m), 4.13 (1 Н, m), 1.29 (6 Н, d, J=8,1). ESIMS (M+H+): 414,1. Пример 3(г). N-Циклопропил-2-[3-Е)-2-пиридин-2-ил-винил)-1H-индазол-6-иламино]бензамид.- 21008501 ммоль), циклопропиламина (11,6 мкл; 0,17 ммоль), триэтиламина (58 мкл; 0,25 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 11,7 мг (35%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (DMSO-d6):9.81 (1 Н, s), 8.68 (1 Н, d, J=1,7), 8.51 (1H, s), 8.01 (4 Н, m), 7.50 (5 Н, m), 7.24 Раствор 2-[3-(2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензойной кислоты (50,0 мг; 0,084 ммоль), 1-метил-1 Н-пиррол-2-карбоновой кислоты гидразида (23,3 мг; 0,17 ммоль), триэтиламина (58 мкл; 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 16,1 мг (40%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (DMSO-d6):10.39 (1 Н, s), 10.00 (1 Н, s), 9.52 (1H, s), 8.67 (1H, d, J=2,4). 8.07 (4 Н, m), 7.77 Раствор 2-[3-(2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензойной кислоты (50,0 мг; 0,084 ммоль), бензиламина (18,2 мкл; 0,17 ммоль), триэтиламина (58 мкл; 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 45,2 мг (76%) указанного в заголовке соединения в виде соли TFA (1,5 H2O; 2,1 TFA; эффективное значение МW(молекулярной массы) = 711,98). 1 Н ЯМР (DMSO-d6):9.86 (1 Н, s), 9.14 (1 Н, t, J=5,4), 8.73 (1H, d, J= 4,8), 8.29 (4H, m), 7.56 (1H, d,J=7,0), 7.74 (2H, m), 7.89 (2H, m), 7.31 (5H, m), 7.16 (1H, d, J=7,8), 6.93 (1H, t, J=7,3), 4.46 (2H, d, J=6,1). Раствор 2-[3-(2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензойной кислоты (50,0 мг; 0,084 ммоль), ортометоксибензиламина (21,8 мкл; 0,17 ммоль), триэтиламина (58 мкл, 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 46 мг (81%) указанного в заголовке соединения в виде соли- 22008501 Раствор 2-[3-(2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензойной кислоты (50,0 мг; 0,084 ммоль), С-фуран-2-ил-метиламина (19 мкл; 0,17 ммоль), триэтиламина (58 мкл; 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 45 мг (85%) указанного в заголовке соединения в виде соли Раствор 2-[3-(2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензойной кислоты (50,0 мг; 0,084 ммоль), циклобутиламина (18,2 мкл; 0,17 ммоль), триэтиламина (58 мкл; 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 43,2 мг (92%) указанного в заголовке соединения в виде соли TFA Раствор 2-[3-(2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензойной кислоты (50,0 мг; 0,084 ммоль), 2-метилаллиламина (16,4 мкл; 0,17 ммоль), триэтиламина (58 мкл; 0,42 ммоль) в DMF (0,8 мл) обрабатывали HATU (48 мг; 0,13 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 45 мг (91%) указанного в заголовке соединения в виде соли TFA (1,6 Н 2O; 1,3 TFA; эффективное значение MW = 586,53). 1 Н ЯМР (DMSO-d6):9.78 (1 Н, s), 8.72 (2 Н, m), 8.13 (4 Н, m), 7.70 (1H, d, J=7,1), 7.58 (2 Н, m), 7.41 Смесь 3-йод-6-нитро-1-(2-триметилсиланилэтоксиметил)-1 Н-индазола (838 мг; 2,0 ммоль), 2 этинилпиридина (242 мкл; 2,4 ммоль) и триэтиламина (6,0 мл) дегазировали и продували аргоном, затем обрабатывали CuI (8 мг; 0,042 ммоль) и Pd(PPh3)2Cl2 (16 мг; 0,023 ммоль). Полученную смесь перемешивали в течение ночи при комнатной температуре, по окончании чего по данным ВЭЖХ все исходное вещество было израсходовано. Смесь очищали, удаляя летучие соединения в высоком вакууме, затем пропуская через набивку диоксида кремния с элюированием этилацетатом. Полученный продукт использовали на следующей стадии без дальнейшей очистки. ESIMS (М+Н+): 395,1. Пример 3(н). 3-Пиридин-2-илэтинил-1-(2-триметилсиланил-этоксиметил)-1H-индазол-6-иламин. Смесь 6-нитро-3-пиридин-2-илэтинил-1-(2-триметилсиланилэтоксиметил)-1 Н-индазола (2 ммоль),SnCl2 (1,37 г; 6,0 ммоль), воды (0,5 мл) и МеОН (10 мл) перемешивали в масляной бане при 60C в течение 30 мин, по окончании чего по данным ВЭЖХ восстановление полностью завершалось. Из полученной смеси удаляли метанол, смесь суспендировали в EtOAc (50 мл) и разбавляли 1 М NaOH (18 мл). Полученную эмульсию осторожно экстрагировали EtOAc (1025 мл). Объединенные органические фазы экстрагировали 1 М Na2CO3, соляным раствором, сушили над MgSO4, концентрировали и фильтровали через набивку диоксида кремния с элюированием EtOAc. Выход неочищенного продукта с двух стадий составлял 701 мг; 96% выход по массе. ESIMS (М+Н+): 365,1. Пример 3(о). 2-[3-Пиридин-2-илэтинил-1-(2-триметилсиланилэтоксиметил)-1 Н-индазол-6-иламино] бензойной кислоты метиловый эфир. Смесь 3-пиридин-2-илэтинил-1-(2-триметилсиланилэтоксиметил)-1 Н-индазол-6-иламина (560 мг; 1,54 ммоль), 2-бромметилбензоата (647,5 мкл; 4,61 ммоль), бифенил-2-илдициклогексилфосфана (107,8 мг; 0,308 ммоль), Pd2(dba)3 (70,5 мг; 0,0768 ммоль), K3 РО 4 (816 мг; 3,844 ммоль) и диметоксиэтана (1,7 мл) под вакуумом продували азотом, затем нагревали в масляной бане при 70C в течение 24 ч. Черную смесь разбавляли метиленхлоридом, фильтровали, концентрировали и хроматографировали (20-40% смесь этилацетат/гексаны). Выход желто-оранжевого масла составлял 260 мг; 35% за три стадии. Пример 3(п). 2-[3-Пиридин-2-илэтинил-1-(2-триметилсиланил-этоксиметил)-1H-индазол-6-иламино]бензойная кислота. 2-[3-Пиридин-2-илэтинил-1-(2-триметилсиланилэтоксиметил)-1H-индазол-6-иламино]бензойной кислоты метиловый эфир (253 мг; 0,517 ммоль) добавляли к раствору NaOH (62 мг; 1,55 ммоль) в THF(1,0 мл), МеОН (2,25 мл) и воде (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, по окончании чего по данным ВЭЖХ все исходное вещество было израсходовано. Реакционную смесь нейтрализовали 1 н. HCl, экстрагировали этилацетатом, который затем промывали соляным раствором и сушили с MgSO4. После концентрирования под вакуумом получали 249 мг твердого вещества желтого цвета (99% выход по массе). Это вещество использовали без дальнейшей очистки. ESIMS (МН-): 483,0. Пример 3(р). 2-[3-Пиридин-2-илэтинил-1H-индазол-6-иламино]бензойная кислота. Раствор 2-[3-пиридин-2-илэтинил-1-(2-триметилсиланилэтоксиметил)-1 Н-индазол-6-иламино] бензойной кислоты (231 мг; 0,477 ммоль), 1 М тетрабутиламмония фторида в THF (3,8 мл; 3,816 ммоль) и этилендиамина (127 мкл; 1,908 ммоль) перемешивали в масляной бане при 80 С в течение 6 ч. Реакцию гасили уксусной кислотой (218 мкл; 3,816 ммоль), реакционную смесь разбавляли водой и экстрагирова- 24008501 ли EtOAc (1050 мл). Объединенные органические слои промывали соляным раствором и сушили надMgSCO4. После концентрирования образовывались твердые формы, которые растирали с CH2Cl2 с получением продукта в виде порошка желтого цвета (124 мг; 73%). ESIMS(M-H-1): 353,0. Пример 3(c). N-Проп-2-инил-2-[3-Е)-2-пиридин-2-илвинил)-1 Н-индазол-6-иламино]бензамид.HATU (89 мг; 0,233 ммоль). Смесь перемешивали в течение ночи, затем очищали ВЭЖХ на обращенной фазе с получением 27 мг (59%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (DMSO-d6):9.78 (1H, s), 8.99 (1H, m), 8.61 (1H, d, J=2,1), 7.88 (1 Н, s), 7.72 (3H, m), 7.43 Раствор 48% HBr (водн.) (Aldrich; 65 мл; 1,2 моль; 10 экв.) охлаждали до -5 С и обрабатывали 4,6 диметилпиридин-2-иламином (Aldrich; 15,0 г; 0,12 моль; 1,0 экв.). Густую белую солевую смесь перемешивали механической мешалкой, добавляя по каплям бром (Aldrich; 19,7 мл; 0,38 моль; 3,1 экв.). Полученную в результате красную смесь обрабатывали водным раствором (32 мл H2O) NaNO2 (Aldrich; 22,1 г; 0,32 моль; 2,6 экв.) в течение 1 ч. Температуру во время добавления нитрита поддерживали ниже 5 С, а затем постепенно повышали до 20 С в течение 2 ч. Реакционную смесь доводили до рН 14 с использованием NaOH (водн.) и экстрагировали МТВЕ (метил-трет-бутиловый эфир). Органические экстракты промывали водой, соляным раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт (29 г красного масла) очищали флэш-хроматографией(диоксид кремния; 350 г) и элюировали смесью 2-7% этилацетат-циклогексан с получением оранжевого масла (11,0 г; 48%). 1 Н ЯМР (DMSO-d6, 300 МГц):7.30 (1H, s), 7.13 (1 Н, s), 2.39 (3 Н, s), 2.26 (3 Н, s). 13C ЯМР (DMSOd6, 75 МГц)159.4, 151.3, 140.9, 125.7, 124.0, 23.7, 20.3. ESI m/z 186/188 (М+Н)+. Пример 4(б). 3-[2-(4,6-Диметилпиридин-2-ил)винил]-6-нитро-1-(тетрагидропиран-2-ил)-1Hиндазол.(0,791 г; 2,6 ммоль) и диизопропилэтиламина (2,4 мл; 13,8 ммоль) в водном DMF (85%; 34,5 мл) дегазировали барботированием аргоном в течение 5 мин с последующей обработкой ультразвуком в течение 5 мин перед нагреванием в микроволновом аппарате (300 Вт; 10% мощность) при 110 С в течение 40 мин. После охлаждения смесь по каплям вливали в холодную воду. Полученный в результате желтый осадок собирали фильтрацией. Твердые вещества растворяли в этилацетате, сушили (сульфат натрия) и концентрировали при пониженном давлении. Остаток очищали на силикагеле, используя градиент 0-20% этилацетата в смеси хлороформа и гексанов (1:1) в качестве элюента. Продукт хроматографии растирали со смесью МТВЕ/гексаны с получением чистого продукта в виде твердого вещества желтого цвета. Маточную жидкость повторно очищали аналогичным способом на силикагеле с последующим растиранием для получения более чистого продукта с 68% выходом. 1 Н ЯМР (CDCl3):8.54 (1 Н, s), 8.15 (1 Н, d, J=9,4 Гц), 8.08 (1 Н, dd, J=9,04, 1,9 Гц), 7.87 (1 Н, d, J=16,6 Гц), 7.55 (1 Н, d, J=16,6 Гц), 7.14 (1H, s), 6.90 (1 Н, s), 5.82 (1H, dd, J=9,0, 3,0 Гц), 4.08-4.01 (1H, m), 3.843.76 (1H, m), 2.56 (3 Н, s), 2.62-2.54 (1 Н, m), 2.34 (3 Н, s), 2.24-2.10 (2 Н, m), 1.88-1.68 (3 Н, m). Пример 5. 3-[2-(4,6-Диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1H-индазол-6-иламин.(4,22 г; 11,16 ммоль), порошка железа (2,71 г; 48,51 ммоль) и насыщенного водного NH4Cl (25 мл) в 25 мл этанола нагревали при 45 С в течение 18 ч. Реакционную смесь охлаждали и фильтровали через фильтровальную бумагу, промывая метанолом. Растворители удаляли при пониженном давлении, и водный слой экстрагировали EtOAc (2). Объединенные органические слои промывали соляным раствором,сушили (MgSO4) и концентрировали при пониженном давлении с получением 4,02 г (количественно) твердого вещества рыжеватой окраски, и использовали без дальнейшей очистки. 1 Н ЯМР (DMSO-d6)7.79 (1H, s), 7.74 (1H, d, J=16,4 Гц), 7.35 (1H, d, J=16,4 Гц), 7.29 (1H, s), 6.96 Перемешиваемую суспензию 3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1 Ниндазол-6-иламина (870 мг; 2,5 ммоль), 2-бромбензойной кислоты метилового эфира (0,44 мл; 3,12 ммоль), R-BINAP (78 мг; 0,125 ммоль), Pd(dba)3 (29 мг; 0,03 ммоль) и карбоната цезия (1,22 г; 3,75 ммоль) в толуоле (6 мл) дегазировали и нагревали при 100 С в течение 18 ч. Реакционную смесь охлаждали, вливали в насыщенный NaHCO3 и экстрагировали EtOAc (2). Объединенные органические слои промывали соляным раствором, сушили (MgSO4) и концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, элюируя градиентом 5-10% EtOAc в СН 2Cl2 с получением 964 мг (80%) пены желтого цвета. 1 Н ЯМР (DMSO-d6)9.49 (1 Н, s), 8.13 (1H, d, J=8,7 Гц), 7.94 (1H, dd, J=1,5, 8,0 Гц), 7.85 (1 Н, d,J=16,4 Гц), 7.58 (1H, d, J=1,5 Гц), 7.48 (1H, d, J=16,4 Гц), 7.47 (1 Н, m), 7.37 (1 Н, d, J=7,7 Гц). 7.34 (1H, s),7.19 (1 Н, dd, J=1,7, 8.7 Гц), 6.99 (1H, s), 6.89 (1 Н, t, J=8,1 Гц), 5.83 (1H, d, J=7,2 Гц), 3.88 (3H, s), 3.75 (1H,m), 2.48 (3H, s), 2.41 (2 Н, m), 2.31 (3H, s), 2.02 (2 Н, m), 1.75 (1H, m), 1.59 (2 Н, m). Анализ. Рассчитано для К перемешиваемому раствору 2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)1 Н-индазол-6-иламино]бензойной кислоты метилового эфира (1,98 г; 4,11 ммоль) в смеси THF:MeOH (12 мл; 3:1) добавляли гидроксид калия (1,15 г; 20,5 ммоль), растворенный в H2O (3 мл). Реакционную смесь нагревали при 70 С в течение 2 ч, охлаждали, концентрировали при пониженном давлении до приблизительно 5 мл и разбавляли дополнительным количеством воды. Раствор нейтрализовали 2 н. HCl, осадок собирали фильтрацией и промывали водой с получением 2,00 г (количественно) твердого вещества яркожелтой окраски. 1 Н ЯМР (DSMO-d6):13.12 (1 Н, широкий s), 9.82 (1 Н, s), 8.13 (1 Н, d, J=8,7 Гц), 7.95 (1H, dd, J=1,5,8,0 Гц), 7.89 (1H, d, J=16,4 Гц), 7.60 (1H, s), 7.50 (1H, d, J=16,4 Гц), 7.46 (1H, d, J=6,9 Гц), 7.37 (1 Н, d, J=7,7 Гц), 7.20 (1 Н, d, J=8,7 Гц), 7.06 (1 Н, s), 6.86 (1 Н, t, J=6,9 Гц), 5.85 (1H, d, J=7,3 Гц), 3.82 (2 Н, m), 2.50 (3H,- 26008501(90%; 20 мл) перемешивали при 70 С в течение 18 ч. После охлаждения полученную в результате густую желтую суспензию фильтровали, и твердые вещества промывали метанолом с получением 2-3-[2-(4,6 диметилпиридин-2-ил)винил]-1 Н-индазол-6-иламинобензойной кислоты в виде тозилатной соли с 85%ным выходом в виде твердого вещества бледно-желтой окраски. 1 Н ЯМР (DMSO-d6):13.43 (1 Н, s), 9.78 (1 Н, s), 8.24-8.19 (2 Н, m), 8.09 (1 Н, d, J=9,04 Гц), 7.95 (1 Н,dd, J=7,9, 1,1 Гц), 7.62-7.55 (2 Н, m), 7.49-7.38 (5 Н, m), 7.20 (1H, dd, J= 9,0,1,9 Гц), 7.09 (2 Н, d, J=8,3 Гц),6.86 (1 Н, dt, J=7,9,1,1 Гц), 2.67 (3H, s), 2.54 (3H, s), 2.27 (3H, s). Пример 9. N-[4-(трет-Бутнлдиметилсиланилокси)-бут-2-инил]-2-[3-[2-(4,6-диметилпиридин-2-ил) винил]-1-(тетрагидропиран-2-ил)-1H-индазол-6-иламино]бензамид. Получали способом, аналогичным описанному для стадии (v) примера 33(a) в заявке на патент США 09/609335, поданной 30 июня 2000 г., включенной в данное описание ссылкой во всей своей полноте для всех назначений, за исключением использования 4-(трет-бутил-диметил-силанилокси)-бут 2-иниламина и 2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1 Н-индазол-6-иламино]бензойной кислоты. 1 Перемешиваемый раствор N-[4-(трет-бутилдиметилсиланилокси)-бут-2-инил]-2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1 Н-индазол-6-иламино]бензамида (737 мг; 1,13 ммоль) и паратолуолсульфоновой кислоты (8,2 мл; 12% в НОАс) нагревали при 70 С в течение 2 ч. Реакционную смесь охлаждали, аккуратно вливали в насыщенный NaHCO3 и экстрагировали EtOAc (2x). Объединенные органические слои промывали соляным раствором (2), сушили (MgSO4) и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесьюCH2Cl2:EtOAc:MeOH (1:1:0,1) с получением 225 мг (44%) твердого вещества белого цвета. 1 К охлажденному во льду перемешиваемому раствору известного 4-(трет-бутилдиметилсиланилокси)-бут-2-ин-1-ола (3,14 г; 15,7 ммоль) в THF (50 мл) добавляли DBU (2,6 мл; 17,4 ммоль) иDPPA (дифенилфосфорилазид) (3,8 мл; 17,6 ммоль). Раствор нагревали до комнатной температуры и перемешивали в атмосфере инертного газа в течение ночи. Реакционную смесь вливали в насыщенныйNaHCO3, и слои разделяли. Водный слой повторно экстрагировали EtOAc (2), объединенные органические слои сушили (Na2SO4) и концентрировали под вакуумом. К этому неочищенному азиду, растворенному в THF (50 мл), добавляли трифенилфосфин (4,61 г; 17,6 ммоль), затем H2O (0,44 мл). Полученный в результате раствор перемешивали в течение ночи при комнатной температуре, концентрировали при пониженном давлении, и остаток суспендировали в смеси 1:1 Еt2O/петролейный эфир. Твердые вещества удаляли, фильтрат концентрировали и очищали флэш-хроматографией на силикагеле, элюируя смесьюCH2Cl2/МеОН (19:1) с получением масла янтарной окраски. 1 Получали способом, аналогичным описанному выше для рримера 6, за исключением использования 2-[3-[2-(4,6-диметилпиридин-2-ил)-винил]-1-(тетрагидропиран-2-ил)-1 Н-индазол-6-иламино]бензойной кислоты и пропаргиламина. 1 Н ЯМР (DMSO-d6)9.87 (1 Н, s), 9.04 (1 Н, t, J=5,8 Гц), 8.08 (1 Н, d, J=8,7 Гц), 7.83 (1 Н, d, J=16,4 Гц),7.69 (1 Н, d, J=7,5 Гц), 7.44 (4 Н, m), 7.34 (1 Н, s), 7.12 (1H, dd, J=1,7, 8,7 Гц), 6.99 (1H, s), 6.91 (1H, t, J=5,8 Гц), 5.81 (1 Н, dd, J=2,4, 9,2 Гц), 4.07 (2 Н, dd, J=2,5, 5,7 Гц), 3.88 (1H, m), 3.74 (1 Н, m), 3.12 (1 Н, t, J - 2,5 Гц), 2.48 (3H, s), 2.43 (1H, m), 2.31 (3H, s), 2.01 (2 Н, m), 1.74 (1H, m), 1.58 (2 Н, m). Анализ. Рассчитано для C31H31N5O21,1 Н 2O0,3 ТВМЕ: С 70,73; Н 6,72; N 12,69. Обнаружено: С 70,56; Н 6,45; N 12,49. Пример 13. N-(Проп-2-инил)-2-3-[(Е)-2-(2,4-диметилпиридин-2-ил)винил]-1H-индазол-6-иламино бензамид. Получали способом, аналогичным описанному для примера 7, за исключением использования N-(3 циклопропил-проп-2-инил)-2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1Hиндазол-6-иламино]бензамида вместо N-[4-(трет-бутилдиметилсиланилокси)-бут-2-инил)-2-[3-[2-(4,6 диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1H-индазол-6-иламино]бензамида. 1 Н ЯМР (DMSO-d6):12.90 (1 Н, s), 9.78 (1H, s), 9.01 (1 Н, t, J - 5,3 Гц), 8.06 (1 Н, d, J=8,3 Гц), 7.84 Получали способом, аналогичным описанному выше для примера 6, за исключением использования 2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1 Н-индазол-6-иламино]бензойной кислоты и 2-метилаллиламина. 1 Н ЯМР (DMSO-d6):9.87 (1H, s), 8.82 (1 Н, t, J=5,8 Гц), 8.07 (1H, d, J=8,7 Гц), 7.82 (1H, d, J=16,4 Гц), 7.74 (1 Н, d, J=7,3 Гц), 7.43 (4 Н, m), 7.33 (1H, s), 7.10 (1 Н, d, J=8,7 Гц), 6.99 (1 Н, s), 6.92 (1H, t, J=7,8 Гц), 5.80 (1H, dd, J=2,2, 9,2 Гц), 4.83 (2 Н, d, J=11,8 Гц), 3.83 (4 Н, m), 2.47 (3H, s), 2.44 (1 Н, m), 2.31 (3H, s),2.00 (2 Н, m), 1.75 (1 Н, m), 1.73 (3H, s), 1.58 (2 Н,m). Анализ. Рассчитано для C32H35N5O21,09 Н 2O: С 71,00; Н 6,92; N 12,94. Обнаружено: С 71,40; Н 6,89; Получали способом, аналогичным описанному для примера 7, за исключением того, что использовали N-(2-метилаллил)-2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1H-индазол 6-иламино]бензамид вместо N-[4-(трет-бутилдиметилсиланилокси)бут-2-инил)-2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1]-индазол-6-иламино]бензамида. 1 Н ЯМР (DMSO-d6):12.89 (1 Н, s), 9.75 (1H, s), 8.79 (1 Н, t, J=5,6 Гц), 8.05 (1 Н, d, J=8,7 Гц), 7.85 Пример 16(a). Циклопропил-проп-2-ин-1-ол. В круглодонную колбу, содержащую 70 мл безводного THF, охлажденного до -10 С на ледяной бане, добавляли 65,6 мл 1,6 М BuLi в гексанах (105 ммоль). Медленно вводили 5-хлор-пент-1-ин (5,13 г; 50 ммоль), поддерживая температуру от -10 до 0 С. Смесь перемешивали при 0 С в течение 2 ч в атмосфере аргона. Добавляли параформальдегид (3 г; 100 ммоль) в виде твердого вещества. Смесь медленно нагревали до комнатной температуры и перемешивали в течение ночи в атмосфере аргона. На следующий день добавляли воду и приблизительно 50 мл 1 н. водного HCl. Смесь экстрагировали этилацетатом, и объединенные органические слои промывали соляным раствором, сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали на колонке, элюируя 20% Et2O в гексанах с получением 3 г 3-циклопропил-проп-2-ин-1-ола в виде масла (62% выход). 1 Н ЯМР (CDCl3):4.22 (dd, 2H, J=6,04, 2,01 Гц), 1.46 (t, 1H, J=6,04 Гц), 1.26 (m, 1H), 0.77 (m, 2H),0.70 (m, 2H). Пример 16(б). 3-Циклопропил-проп-2-инилазид. 3-Циклопропил-проп-2-ин-1-ол (3,28 г; 34,1 ммоль) растворяли в 40 мл толуола, добавляли DPPA(11,26 г; 40,9 ммоль), затем DBU (6,24 г; 40,9 ммоль), поддерживая температуру на водяной бане. Смесь перемешивали при комнатной температуре в течение одного часа и разбавляли 100 мл гексана и 15 млCH2Cl2. Смесь четыре раза промывали водой и один раз соляным раствором, сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе на холодной водяной бане для удаления почти всего органического растворителя, оставляя некоторое количество толуола (летучий продукт). Оставшееся масло использовали на следующей стадии. 1 Н ЯМР (CDCl3)3.85 (s, 2 Н), 1.26 (m, 1H), 0.80 (m, 2H), 0.72 (m, 2H). Пример 16(б): 3-Циклопропил-проп-2-иниламин. 3-Циклопропил-проп-2-инилазид (приблизительно 34 ммоль) растворяли в 100 мл THF, добавляли 1 мл воды, затем добавляли PPh3 (13,37 г; 51 ммоль) в виде твердого вещества, поддерживая температуру на водяной бане. Смесь перемешивали при комнатной температуре в течение 1 ч. К смеси добавляли 150 мл 1 н. водного HCl. Смесь три раза промывали метиленхлоридом. Водный слой подщелачивали 5 н.NaOH до рН 10-12. Смесь экстрагировали этилацетатом. Водный слой проверяли с использованием ТСХ,окрашивая для контроля за ходом экстракции амина в органическую фазу. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали с получением 1,62 г нужного продукта (летучий продукт, содержит остаточный растворитель EtOAc) (50% выход после двух стадий). 1 Н ЯМР (CDCl3):3.37 (d, 2 Н, J=2 Гц), 1.22 (m, 1H), 0.74 (m, 2H), 0.65 (m, 2H). Пример 17. N-(3-Циклопропил-проп-2-инил)-2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1H-индазол-6-иламино]бензамид. Получали способом, аналогичным описанному выше для примера 6, за исключением того, что использовали 2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1H-индазол-6-иламино] бензойную кислоту Е и 3-циклопропилпроп-2-иниламин. 1 Н ЯМР (CDCl3):9.51 (1H, s), 7.97 (1H, d, J=8,7 Гц), 7.81 (1 Н, d, J=16,6 Гц), 7.51-7.42 (3H, m), 7.347.29 (2 Н, m), 7.16 (1H, s), 7.11 (1 Н, dd, J=9,0, 1,9 Гц), 6.85 (1 Н, s), 6.81 (1H, dt, J=7,2, 1,1 Гц), 6.23 (1 Н, t,J=7,2 Гц), 5.61 (1 Н, dd, J=9,0, 2,6 Гц), 4.17 (2 Н, dd, J=5,3, 2,3 Гц), 4.07-4.00 (1H, m), 3.75-3.66 (1 Н, m),2.63-2.50 (1 Н, m), 2.54 (3H, s), 2.32 (3H, s), 2.20-2.02 (2 Н, m), 1.79-1.62 (3H, m), 1.29-1.19 (1H, m), 0.770.67 (4 Н, m). Пример 18. N-(3-Циклопроп-2-инил)-2-3-[(Е)-2-(4,6-диметилпиридин-2-ил)винил]-1 Н-индазол-6 иламинобензамид. Получали способом, аналогичным описанному выше для примера 7, за исключением того, что использовали 2-[3-[2-(4,6-диметилпиридин-2-ил)винил]-1-(тетрагидропиран-2-ил)-1 Н-индазол-6-иламино]N-проп-2-инилбензамид вместо К раствору бутин-1,4-диола (5 г; 58 ммоль) в безводном THF при комнатной температуре порциями добавляли гидрид натрия (60%-ная дисперсию в масле; 2,32 г; 58 ммоль). Через 4,3 ч добавляли ацетил- 30
МПК / Метки
МПК: C07D 401/14, A61P 35/00, C07D 403/14, C07D 405/14, C07D 231/56, C07D 401/06, A61P 27/02, A61K 31/416, C07D 403/12
Метки: лечения, 2-(1н-индазол-6-иламино)бензамидные, полезные, ингибиторы, офтальмологических, соединения, заболеваний, протеинкиназ
Код ссылки
<a href="https://eas.patents.su/30-8501-2-1n-indazol-6-ilaminobenzamidnye-soedineniya-kak-ingibitory-proteinkinaz-poleznye-dlya-lecheniya-oftalmologicheskih-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">2-(1н-индазол-6-иламино)бензамидные соединения как ингибиторы протеинкиназ, полезные для лечения офтальмологических заболеваний</a>












