Соединения, полезные для использования в качестве нейрозащитных средств
Номер патента: 1713
Опубликовано: 27.08.2001
Авторы: Филлипс Майкл Л., Шэдл Джон К., Панетта Джилл Э., Хайнц Лоренс Дж.
Формула / Реферат
1. Соединение формулы (III)
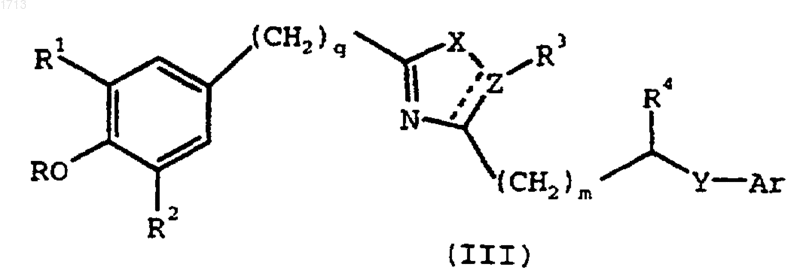
где Аr представляет фенил, пиридил, тетрагидронафтил, бензофуранил или хроманил, замещенный заместителями в количестве от нуля до двух, выбранными из группы, состоящей из -(C1-C6)алкила, гидрокси и галогена; и замещенный либо
(i) одним или двумя заместителями, выбранными из группы, состоящей из -O(CH2)tR6, 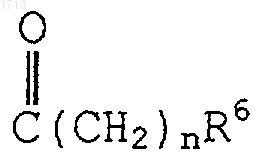 и -(С1-С6алкил)R6; либо
и -(С1-С6алкил)R6; либо
(ii) двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо пиридила или тетрагидропиридила;
при условии, что, когда присутствует модель заместителя (i), фенильная или пиридильная группа Аr дополнительно может быть замещена двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо фенила;
где R6 представляет -NR7R8, морфолин-1-ил, имидазол-1-ил, 4,5-дигидро-1Н-имидазол-2-ил, тиоморфолин-1-ил, пиперазин-1-ил или пиперазин-1-ил, замещенный -(С1-С4)алкилом или
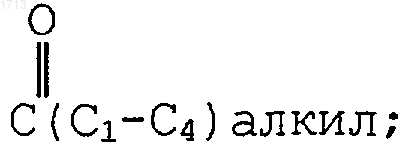 и R7 и R8, каждый индивидуально, представляют водород, -(С1-С6)алкил, -(СН2)рОН,
и R7 и R8, каждый индивидуально, представляют водород, -(С1-С6)алкил, -(СН2)рОН, 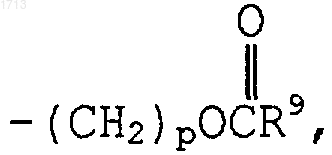 -(СН2)р-пиперидил, -(СН2)рS(С1-С6)алкил, -(СН2)рО(С1-С6)алкил,
-(СН2)р-пиперидил, -(СН2)рS(С1-С6)алкил, -(СН2)рО(С1-С6)алкил, 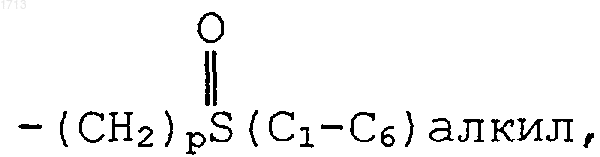
где R9 представляет (С1-С6)алкил;
---- представляет двойную или одинарную связь;
Х представляет -О- или -S-;
Y представляет -CR5'R5-, -О- или -S-, где R5' представляет Н и R5 представляет -Н или -ОН или R5 и R5', взятые вместе, обозначают =O;
Z представляет -СН2- или -N-;
R представляет Н или -(С1-С6)алкил;
R1 и R2, каждый индивидуально, представляют -(С1-С6)алкил, -(С1-С6)алкокси или фенил;
R3 представляет Н или -(С1-С6)алкил или R3 и R4, взятые вместе, образуют фенильную группу с кольцом, к которому они присоединены;
R4 представляет водород или -ОН или, когда Y представляет -CHR5, R4 и R5, каждый индивидуально, обозначает Н или, когда они взяты вместе, образуют связь;
m - целое число от 0 до 2 включительно;
q - 0 или 1;
n - целое число от 0 до 4 включительно;
р - целое число от 1 до 6 включительно; и
t - целое число от 1 до 4 включительно;
или его фармацевтически приемлемая соль, гидрат или оптический изомер.
2. Соединение формулы (II)
где Ar представляет фенил, пиридил или тетрагидронафтил, замещенный заместителями в количестве от нуля до двух, выбранными из группы, состоящей из -(С1-С6)алкила, гидрокси и галогена; и замещенный либо
(i) одним или двумя заместителями, выбранными из группы, состоящей из -O(CH2)tR6, 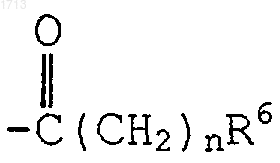 и -(С1-С6алкила)R6; либо
и -(С1-С6алкила)R6; либо
(ii) двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо пиридила или тетрагидропиридила;
при условии, что, когда присутствует модель заместителя (i), фенильная или пиридильная группа Ar дополнительно может быть замещена двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо фенила;
где R6 представляет -NR7R8, морфолин-1-ил, имидазол-1-ил, 4,5-дигидро-1Н-имидазол-2-ил, тиоморфолин-1-ил, пиперазин-1-ил или пиперазин-1-ил, замещенный -(С1-С4)алкилом,  и R7 и R8, каждый индивидуально, представляют водород, -(С1-С6)алкил, -(СН2)рОH, -(СН2)р-пипериридил, -(CH2)pS(С1-С6)алкил или
и R7 и R8, каждый индивидуально, представляют водород, -(С1-С6)алкил, -(СН2)рОH, -(СН2)р-пипериридил, -(CH2)pS(С1-С6)алкил или 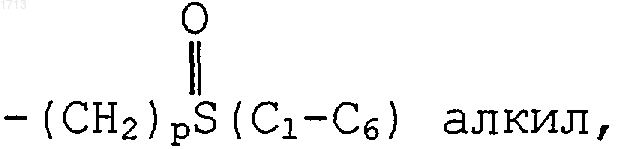
---- представляет двойную или одинарную связь;
Х представляет -О- или -S-;
Y представляет -CHR5-, -О- или -S-;
Z представляет -СН- или -N-;
R представляет Н или -(С1-С6)алкил;
R1 и R2, каждый индивидуально, представляют -(С1-С6)алкил или -(С1-С6)алкокси;
R3 представляет Н или -(С1-С6)алкил или R3 и R4, взятые вместе, образуют фенильную группу с кольцом, к которому они присоединены;
R4 представляет водород или, когда Y представляет -CHR5, R4 и R5, каждый индивидуально, представляют Н или, взятые вместе, образуют связь;
m равно целому числу от 0 до 2, включительно оба;
q равно 0 или 1;
n равно целому числу от 0 до 4, включительно оба;
р равно целому числу от 1 до 6, включительно оба; и t равно целому числу от 1 до 4, включительно оба;
или его фармацевтически приемлемая соль, гидрат или оптический изомер.
3. Соединение формулы (I)
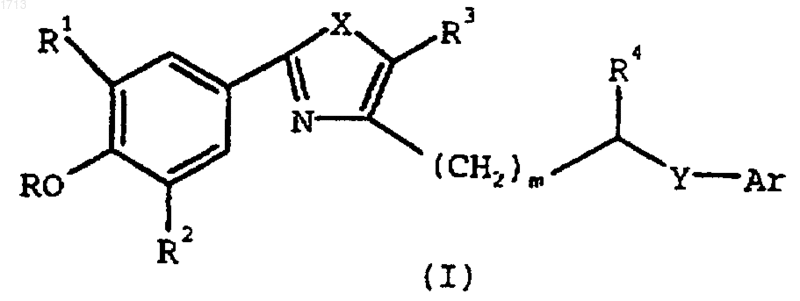
где Аr представляет фенил или пиридил, замещенный заместителями в количестве от нуля до двух, выбранными из группы, состоящей из -(С1-С6)алкила, гидрокси и галогена; и замещенный либо
(i) одним или двумя заместителями, выбранными из группы, состоящей из 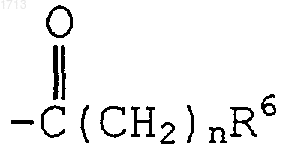 и -(С1-С6алкил)R6; либо
и -(С1-С6алкил)R6; либо
(ii) двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо пиридила или тетрагидропиридила;
при условии, что, когда присутствует модель заместителя (i), фенильная или пиридильная группа Аr дополнительно может быть замещена двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо фенила;
где R6 представляет -NR7R8, морфолин-1-ил, имидазол-1-ил, 4,5-дигидро-1Н-имидазол-2-ил, тиоморфолин-1-ил, пиперазин-1-ил или пиперазин-1-ил, замещенный -(С1-С4)алкилом или 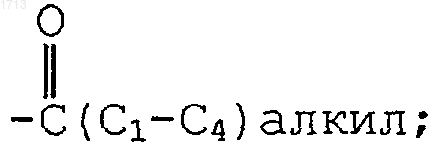 и R7 и R8, каждый индивидуально, представляют водород, -(С1-С6)алкил, -(CH2)pOH или -(СН2)р-пиперидил,
и R7 и R8, каждый индивидуально, представляют водород, -(С1-С6)алкил, -(CH2)pOH или -(СН2)р-пиперидил,
Х представляет -О- или -S-;
Y представляет -CHR5-, -О- или -S-;
R представляет Н или -(С1-С6)алкил;
R1 и R2, каждый индивидуально, представляют -(С1-С6)алкил;
R3 представляет Н или -(С1-С6)алкил;
R4 представляет водород или, когда Y представляет -CHR5, R4 и R5, каждый индивидуально, обозначают Н или, когда взяты вместе, образуют связь;
m равно 0 или 1;
n равно целому числу от 0 до 4, включительно оба; и
р равно целому числу от 1 до 6, включительно оба
или его фармацевтически приемлемая соль, гидрат или оптический изомер.
4. Соединение по п.3, где Аr представляет фенил, замещенный одним или двумя заместителями, выбранными из -(CH2)nR6, 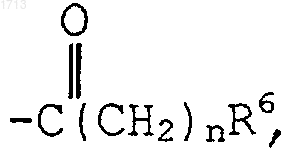 -(С1-С6алкил)R6; где R6 представляет -NR7R8 и R7 и R8 представляют Н или -(С1-С6)алкил;
-(С1-С6алкил)R6; где R6 представляет -NR7R8 и R7 и R8 представляют Н или -(С1-С6)алкил;
и одним или двумя заместителями, выбранными из водорода, -(С1-С6)алкила, гидрокси; или двумя заместителями, которые, когда взяты вместе, образуют фенильную группу,
R1 и R2 представляют -(С1-С6)алкил;
R, R3, R4 и R представляют Н;
Х представляет -О-;
Y представляет -О- или -S-.
5. Соединение по п.4, где R1 и R2 представляют 1,1-диметилэтил.
6. Соединение по п.5, где Аr представляет фенил, замещенный одной или двумя заместителями, выбранными из -(CH2)nR6 или -(С1-С6-алкил)R6 и одним или двумя заместителями, выбранными из водорода или -(С1-С6)алкила.
7. Соединение по п.6, где Аr представляет фенил, замещенный -(СН2)nR6.
8. Соединение по п.4, которое представляет собой 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-метилэтиламинометилфенилокси) этил)оксазол; гидрохлорид 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-((4-N-метил-N-этиламинометил)феноксиметил)оксазола; гидрохлорид 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-((4-N-этил-N-пропиламиноэтилфенокси)метил) оксазола или 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-этилпропиламиноэтилфенокси) этил)оксазол.
9. Способ лечения болезни, выбранной из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза или церебральной травмы, у млекопитающего, нуждающегося в таком лечении, который включает введение млекопитающему терапевтически эффективного количества соединения по любому из пп.1, 2, 3 или 8.
10. Способ ингибирования перокисления липидов у млекопитающего, нуждающегося в таком лечении, который включает введение млекопитающему терапевтически эффективного количества соединения по любому из пп.1, 2, 3 или 8.
11. Способ профилактики индуцируемого ишемией повреждения клеток у млекопитающих введением млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по любому из пп.1, 2, 3 или 8.
12. Фармацевтическая композиция, включающая соединение по п.1 вместе с одним или несколькими его фармацевтически приемлемыми разбавителями, носителями или наполнителями.
Текст
1 Данное изобретение относится к новым фенилоксазолам, тиазолам, оксазолинам, оксадиазолам и бензоксазолам, которые можно использовать в качестве нейрозащитных средств. Нейродегенеративные процессы могут включать разные зоны центральной нервной системы (ЦНС). Нейродегенерация проявляется клинически как распад функционально связанных нейронных циклов с соответствующими изменениями в системе нейротрансмиттеров и морфологической организацией системы пораженных клеток. Нормальное функционирование ЦНС предполагает хорошо сбалансированное взаимодействие между разными биохимическими и структурно связанными нейронными системами. Когда один член нейронного цикла изменяется в его структурной или биохимической сущности, образуется дисбаланс в функциональной системе и для поддержания физиологического равновесия должен быть активирован компенсаторный механизм. Возможно наиболее тяжелой формой нейродегенерации является форма, которая наблюдается после удара. Эта форма церебральной ишемии приводит к гибели нейронов, а также глиальных клеток и васкулярных элементов головного мозга. Очень часто удар приводит к параличу, потере памяти, неспособности к общению и даже гибели. Считается, что реакционноспособные кислородные промежуточные продукты играют большую роль в омертвлении головного мозга у индивидуумов, перенесших удар. Другой формой церебральной ишемии,которая может быть полным уничтожением важных групп селективно восприимчивых нейронов, является глобальная ишемия. Глобальная церебральная ишемия обычно наблюдается у жертв остановки сердца во время периода, когда сердце подвергается фибрилляции. Гибель нервных клеток из-за глобальной ишемии является обычным случаем у жертв сердечного приступа, которые претерпевают остановку сердца,и остановка сердца представляет собой обычный случай у пациентов с сердечным приступом. Считается, что реакционноспособные кислородные промежуточные разновидности являются одним из причинных факторов в гибели нервных клеток во время фазы реперфузии после глобальной ишемии. Повреждение ишемияреперфузия, вызванное глобальной или локальной ишемией или во время трансплантации,может также действовать на другие основные органы тела, такие как почки, печень и сердце. Считается, что реакционноспособные кислородные промежуточные разновидности, которые образуются во время фазы реперфузии в этих органах, вызывают значительное повреждение. Считается, что другие дегенеративные болезни центральной нервной системы обостряются или инициируются процессами, которые 2 приводят к образованию реакционноспособных кислородных промежуточных разновидностей. Болезнь Паркинсона (БП) характеризуется пониженной динамикой и скоростью движения. В болезни Альцгеймера (БА) ухудшение познавательной способности является кардинальным клиническим симптомом. В болезни мотонейронов (например, боковой амиотрофический склероз, БАС) дегенерация центральной пирамидальной системы, периферической моторной системы или обоих является причиной клинической картины. Идиопатическая БП представляет собой нарушение движения, в которой симптоматология определяется тремя кардиальными симптомами: дрожанием в покое, ригидностью и акинезией (Fahn, 1989). Течение болезни прогрессирующее. В течение долгого времени антихолинергические лекарственные средства были единственным эффективным лечением симптомов Паркинсона. Благотворное действие терапии L-3,4-дигидрофениланином (L-ДОФА) в значительной степени удлиняло ожидаемую продолжительность жизни пациента. Однако,осложнения при терапии L-ДОФА и отсутствие восприимчивости к L-ДОФА доминируют по сравнению с улучшенной стадией болезни. Лимитирующим фактором в терапии БП является психотический потенциал многих лекарственных средств против болезни Паркинсона. БАС представляет собой хроническое прогрессирующее дегенеративное нарушение, которое в его классической форме проявляется спорадически. Наиболее известным патологическим изменением у пациентов с БАС является потеря большого числа мотонейронов в двигательной области коры головного мозга, стволе мозга и спинном мозге. Ухудшение познавательной способности представляет собой существенный клинический критерий для БА, проявляемый путем потери памяти, дезориентировки и связанной с ними сопутствующей потерей наслаждения жизни. Только после смерти диагноз можно подтвердить патологически по присутствию многочисленных амилоидных и невритных бляшек в головном мозге. В настоящее время фармакологическая терапия нейродегенеративных нарушений ограничивается симптоматическими лечениями, которые не изменяют течение основной болезни. Между тем, по причине неудовлетворенности известными в настоящее время лечениями для вышеописанных показаний у пораженной популяции, продолжает существовать потребность в безопасных, лучше выверенных лекарственных средствах, которые либо будут замедлять процесс нейродегенерации, ассоциированный с локальной или глобальной ишемией,БАС, болезнью Альцгеймера и Паркинсона, либо даже вообще предотвращать такую нейродегенерацию. 3 Данное изобретение предлагает новые соединения фенилоксазола и фенилтиазола, которые можно использовать для лечения нейродегенерации и повреждения при реперфузии периферических органов. Соединения изобретения ингибируют образование реакционноспособных кислородных разновидностей у млекопитающего, и, вследствие этого, их можно использовать для лечения состояний и болезней, которые, как считают, индуцируются повышенным продуцированием свободных радикалов, таких как глобальная или церебральная ишемия, болезнь Паркинсона, болезнь Альцгеймера, синдром Дауна, БАС и повреждение ишемия/реперфузия периферических органов.Malamas, et al., патент Соединенных Штатов 54280478, описывает фенилоксазолы,которые можно использовать для лечения болезней: воспаления, аллергических реакций и артериосклероза, тогда как Panetta, et аl., заявка на Европейский патент 677517, сообщает о применении бензилиденроданинов для лечения болезни Альцгеймера. Краткое изложение сущности изобретения Данное изобретение предлагает соединения формулы III где Аr представляет фенил, пиридил, тетрагидронафтил, бензофуранил или хроманил, замещенный заместителями от нуля до двух, выбранных из группы, состоящей из -(C1-С 6) алкила, гидрокси и галогена; и замещенный либо(i) одним или двумя заместителями, выбранными из группы, состоящей из -O(CH2)tR6, и(ii) двумя заместителями, которые, когда взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо пиридила или тетрагидропиридила; при условии, что, когда присутствует модель заместителя (i), фенильная или пиридильная группа Аr дополнительно может быть замещена двумя заместителями, которые, когда взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо фенила; где R6 представляет -NR7R8, морфолин-1 ил, имидазол-1-ил, 4,5-дигидро-1 Н-имидазол-2 ил, тиоморфолин-1-ил, пиперазин-1-ил или пиперазин-1-ил, замещенный -(C1-С 4)алкилом или и R7 и R8, каждый индивидуально, представляют водород, -(C1-С 6)алкил, -(СН 2)рОН, 001713-(CH2)pS(C1-С 6)алкил, где R9 представляет (C1-С 6)алкил;представляет двойную или одинарную связь; Х представляет -О- или -S-;R и R4, взятые вместе, образуют фенильную группу с кольцом, к которому они присоединены;R4 представляет водород или -ОН или, когда Y представляет -CHR5, R4 и R5, каждый индивидуально, обозначают Н или, когда взяты вместе, образуют связь;m равно целому числу от 0 до 2, включительно оба;n равно целому числу от 0 до 4, включительно оба; р равно целому числу от 1 до 6, включительно оба; иt равно целому числу от 1 до 4, включительно оба; или их фармацевтически приемлемые соли, гидраты или оптические изомеры. В соответствии со следующим аспектом данного изобретения предлагаются фармацевтические композиции, включающие в качестве активного ингредиента соединение формулы III или его фармацевтически приемлемую соль,гидрат или оптический изомер в ассоциации с одним или несколькими его фармацевтически приемлемыми разбавителями, носителями и наполнителями. Данное изобретение, помимо этого, предлагает способ ингибирования образования реакционноспособных кислородных разновидностей у млекопитающего, который включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулыIII. Данное изобретение предлагает также способ ингибирования перокисления липидов у млекопитающего, нуждающегося в таком лечении, который включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы III. Кроме того, было обнаружено, что соединения формулы I можно также использовать для профилактики индуцированного ишемией по 5 вреждения клеток, такого, которое может быть вызвано ударами, инфарктом миокарда, остановкой сердца или во время трансплантации. Ишемия представляет собой феномен, в котором ткань лишается либо частичного, либо общего кровотока в связи с гипоксией. Реперфузия такой ткани вызывает дополнительное повреждение ткани, связанное с ишемическими случаями, вплоть до жизненно важных органов,таких как легкие, печень, почки, сердце и тонкая кишка. Это изобретение поэтому предлагает способ профилактики индуцируемого ишемией повреждения клеток у млекопитающих путем введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества соединения формулы III. Кроме того, данное изобретение предлагает способ лечения болезни Паркинсона у млекопитающего, нуждающегося в таком лечении,который включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I. В другом аспекте данного изобретения предлагается способ лечения болезни Альцгеймера у млекопитающего, нуждающегося в таком лечении, который включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы III. Еще один аспект данного изобретения предлагает способ лечения бокового амиотрофического склероза (БАС) у млекопитающего,нуждающегося в таком лечении, который включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы III. Другие цели, отличительные признаки и преимущества данного изобретения станут очевидны из последующего описания и прилагаемой формулы изобретения. Подробное описание изобретения Используемый здесь термин "C1-С 6 алкил" представляет неразветвленную или разветвленную алкильную цепь, имеющую от одного до шести атомов углерода. Типичные C1-С 6 алкильные группы включают метил, этил, нпропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, гексил и тому подобное. Термин "галоген" означает хлор, фтор,бром или йод. Термин "(C1-С 6)алкокси" означает группу,такую как метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, н-пентокси,изопентокси, неопентокси, гексокси и подобные группы, присоединенные к остальной части молекулы посредством атома кислорода. Термин "фармацевтически приемлемые соли" относится к солям соединений вышеуказанных формул, которые, по существу, нетоксичны для живых организмов. Типичные фармацевтически приемлемые соли включают такие соли, полученные реакцией соединений 6 вышеуказанных формул с фармацевтически приемлемой минеральной или органической кислотой или фармацевтически приемлемым основанием щелочного металла или органическим основанием, в зависимости от типов заместителей, присутствующих на соединениях указанных формул. Примеры фармацевтически приемлемых минеральных кислот, которые можно использовать для получения фармацевтически приемлемых солей, включают хлористо-водородную кислоту, фосфорную, серную, бромистоводородную кислоту, йодисто-водородную кислоту, фосфористую кислоту и тому подобное. Примеры фармацевтически приемлемых органических кислот, которые можно использовать для получения фармацевтически приемлемых солей, включают алифатические моно- и дикарбоновые кислоты, такие как щавелевая кислота,угольная кислота, лимонная кислота, янтарная кислота, фенилзамещенные алкановые кислоты,алифатические и ароматические сульфокислоты и тому подобное. Такие фармацевтически приемлемые соли, полученные из минеральных или органических кислот, таким образом, включают гидрохлорид, гидробромид, нитрат, сульфат,пиросульфат, бисульфат, сульфит, бисульфат,фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, гидройодид, гидрофторид, ацетат, пропионат, формиат, оксалат, цитрат, лактат, п-толуолсульфонат, метансульфонат, малеат и тому подобное. Следует признать, что конкретный анион или катион, образующий часть любой соли этого изобретения, некритический, поскольку соль в целом фармацевтически приемлема и поскольку анионная или катионная часть не придает соли нежелательные свойства. Термин "аминозащитная группа", используемый здесь так, как его часто используют в синтетической органической химии, относится к группе, которая будет предотвращать участие аминогруппы в реакции, проводимой на некоторой другой функциональной группе молекулы,но которую можно удалить от амино, когда нужно это сделать. Аналогичным образом, термин "гидроксизащитная группа" относится к удаляемой группе, которая будет предотвращать участие гидроксигруппы в реакции, проводимой на молекуле. Такие группы обсуждаются Т.W.Press, New York, 1973, которые включаются здесь в качестве ссылки во всей их полноте. Примеры аминозащитных групп включают бензил и замещенный бензил, такой как 3,4 диметоксибензил, о-нитробензил, и трифенилметил; группы формулы -COOR, где R включает такие группы, как метил, этил, пропил, изопропил, 2,2,2-трихлорэтил, 1-метил-1-фенилэтил, 7 изобутил, трет-бутил, трет-амил, винил, аллил,фенил, бензил, п-нитробензил, о-нитробензил и 2,4-дихлорбензил; ацильные группы и замещенный ацил, такие как формил, ацетил, хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, бензоил и п-метоксибензоил; и другие группы, такие как метансульфонил, п-толуолсульфонил, п-бромбензолсульфонил, п-нитрофенилэтил и птолуолсульфониламинокарбонил. Предпочтительной аминозащитной группой является третбутоксикарбонил. Примеры гидроксизащитных групп включают группы, образующие простой эфир и замещенный эфир, такие как метил, метоксиметил, трет-бутоксиметил, 1-этоксиэтил и бензил; группы, образующие силиловый простой эфир,такие как триметилсилил, триэтилсилил и метилдиизопропилсилил; группы, образующие сложный эфир, такие как формиат, ацетат и трихлорацетат, и карбонатные группы, такие как метил-, 2,2,2-трихлорэтилкарбонат и пнитрофенилкарбонат. Соединения данного изобретения могут существовать в разных изомерных формах, например, когда Аr представляет фенил или пиридил, замещенный одной или двумя группами-С(ОН)Н-. Это изобретение не относится к любому конкретному изомеру, но включает все возможные индивидуальные изомеры и рацематы. Специалисты в данной области должны понимать, что, когда Z представляет азот и представляет двойную связь между Z и углеродом, к которому он присоединен, N не имеет заместитель R3. Многие из соединений формулы I могут соединяться с водой, образуя гидраты. Это изобретение включает гидраты формулы I. Предпочтительные соединения изобретения Предпочтительная группа включает следующие соединения:(а) Аr представляет фенил, замещенный одним или двумя заместителями, выбранными из и -(C1-С 6-алкил)R6, или двумя заместителями,которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо пиридила или тетрагидропиридила;-(C1-С 6)алкилом, гидрокси, галогеном или двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо фенила;-(C1-С 6)алкилом, гидрокси, галогеном или двумя заместителями, которые, когда они взяты вместе(j) R7 и R8, каждый индивидуально, представляют водород или -(C1-С 6)алкил;(р) р равно целому числу от 1 до 3, включительно оба. Предпочтительная группа соединений включает соединения формулы (II) где Аr представляет фенил, пиридил или тетрагидронафтил, замещенный заместителями от нуля до двух, выбранных из группы, состоящей из -(C1-С 6)алкила, гидрокси и галогена; и замещенный либо(i) одним или двумя заместителями, выбранными из группы, состоящей из -O(CH2)tR6,и -(C1-С 6)алкила; либо(ii) двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо пиридила или тетрагидропиридила; при условии, что, когда присутствует модель заместителя (i), фенильная или пиридильная группа Аr дополнительно может быть замещена двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо фенила; где R6 представляет -NR7R8, морфолин-1 ил, имидазол-1-ил, 4,5-дигидро-1 Н-имидазол-2 ил, тиоморфолин-1-ил, пиперазин-1-ил или пиперазин-1-ил, замещенный -(C1-С 4)алкилом или представляет двойную или одинарную связь; Х представляет -О- или -S-;R и R4, взятые вместе, образуют фенильную группу с кольцом, к которому они присоединены;m равно целому числу от 0 до 2, включительно оба;n равно целому числу от 0 до 4, включительно оба; р равно целому числу от 1 до 6, включительно оба; иt равно целому числу от 1 до 4, включительно оба; или их фармацевтически приемлемые соли, гидраты или оптические изомеры. Другая предпочтительная группа соединений включает соединения формулы (I) где Аr представляет фенил или пиридил, замещенный заместителями от нуля до двух, выбранных из группы, состоящей из -(C1-С 6) алкила, гидрокси и галогена; и замещенный либо(i) одним или двумя заместителями, выбранными из группы, состоящей из и -(C1-С 6 алкил)R6; либо(ii) двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо пиридила или тетрагидропиридила; при условии, что, когда присутствует модель заместителя (i), фенильная или пиридильная группа Аr дополнительно может быть замещена двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют кольцо фенила; где R6 представляет -NR7R8, морфолин-1 ил, имидазол-1-ил, 4,5-дигидро-1 Н-имидазол-2 001713n равно целому числу от 0 до 4, включительно оба; и р равно целому числу от 1 до 6, включительно оба или их фармацевтически приемлемые соли, гидраты или оптические изомеры. Должно быть понятно, что вышеуказанные классы можно комбинировать с образованием дополнительных предпочтительных классов. Предпочтительный род соединений включает те соединения, где Аr представляет фенил,замещенный одним или двумя заместителями,выбранными изR7 и R8 представляют Н или -(C1-С 6)алкил; и одним или двумя заместителями, выбранными из водорода, -(C1-С 6)алкила и гидрокси; или двумя заместителями, которые, когда они взяты вместе с атомами углерода, к которым они присоединены, образуют фенильную группу,R1 и R2 представляют -(C1-С 6)алкил;Y представляет -О- или -S-. Из этого предпочтительного рода соединения, у которых R1 и R2 представляют 1,1 диметилэтил, более предпочтительны. Из этого более предпочтительного рода те соединения, у которых Аr представляет фенил,замещенный одной или двумя группами -(C1-С 6 алкил)R6 и одним или двумя заместителями,выбранными из водорода и -(C1-С 6)алкила, особенно предпочтительны. Из этого особенно предпочтительного рода те соединения, у которых Аr представляет фенил, замещенный -(C1-С 6-алкил)R6, очень предпочтительны. Другие типичные примеры соединений формулы I, которые можно использовать в данном изобретении, включают:Z-2-(3,5-ди-трет-бутил-4-гидроксифенил)4-(3-(4-N-метил-N-этиламинометилфенил)-2 пропенил)оксазол; Е-2-(3,5-ди-трет-бутил-4-гидроксифенил)4-(3-(4-N-метил-N-этиламинометилфенил)-2 пропенил)оксазол. Способы синтеза Соединения формулы I, где Аr представляет фенил, замещенный одной или двумя группами -(C1-С 6 алкил)R6, где алкильная группа представляет -CH2-, X и Y представляют кислород, R4 представляет водород и m равно 1, получают в соответствии со следующей общей реакционной схемой I(а). В стадии (а) вышеуказанной реакционной схемы соответственно замещенную бензойную кислоту превращают в бензамид (1) кипячением с обратным холодильником с активирующим агентом, таким как 1,1'-карбонилдиимидазол,затем охлаждением до комнатной температуры и обработкой концентрированным водным аммиаком. Реакцию можно проводить в апротонном полярном растворителе, таком как тетрагидрофуран, в течение периода от 1 до 24 ч. Соединение оксазолуксусной кислоты (2) получают в стадии (b) циклизацией бензамида(1) реагентом, таким как этил-4-хлорацетоацетат, в атмосфере инертного газа, такого как азот, при температуре от около 50 до 130 С в течение около от одного до двух часов и затем гидролизом с образованием кислоты. Получение фенилоксазола (3) достигают в стадии (с) восстановлением кислоты (2) восстанавливающим агентом, таким как борантетрагидрофуран. Реакцию можно проводить в апротонном полярном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение около от 1 до 24 ч. В стадии (d) фенилоксазол (3) можно сочетать с гидроксизамещенным бензальдегидом с образованием альдегида (4) сначала мезилированием (3) мезилирующим агентом, таким как метансульфонилхлорид, и затем сочетанием мезилированного соединения с бензальдегидом. Реакцию сочетания можно проводить в апротонном полярном растворителе, таком как диметилсульфоксид, в присутствии трет-бутоксида калия при нагревании до температуры около 70 С в течение вплоть до 24 ч. Когда R1 и R2 представляют самые низшие алкильные заместители, такие как метил или этил, гидрокси кольца фенила, предпочтитель 001713 14 но, защищают гидроксизащитной группой для предотвращения мезилирования фенола. Защитную группу можно затем удалить после стадии сочетания. Когда R1 и R2 представляют объемные алкильные заместители, такие как трет-бутил, мезилирование, предпочтительно, имеет место на спирте, присоединенном к кольцу оксазола или тиазола, поэтому нет необходимости защищать гидрокси. Альтернативно, получение (4) можно выполнить сочетанием по Mitsunobu, которое можно проводить в апротонном полярном растворителе, таком как тетрагидрофуран, при комнатной температуре. Восстановительное аминирование альдегида для получения целевого продукта (5) выполняют в стадии (е) реакцией соединения (4) с соответственно замещенным амином и изопропоксидом титана IV (Ti(OiPr)4) с использованием восстанавливающего агента, такого как борогидрид натрия. Реакцию предпочтительно проводят при комнатной температуре в спирте с низкой молекулярной массой, таком как этанол. Реакция по существу завершается в течение от 16 ч до 3 дней. Альтернативно, стадию восстановления (е) можно выполнять растворением альдегида (4) в спирте с низкой молекулярной массой, таком как метанол, подкислением раствора избытком органической кислоты, такой как уксусная кислота, затем реакцией альдегида (4) с соответственно замещенным амином с использованием восстанавливающего агента, такого как цианоборогидрид натрия (цианоборогидрид натрия). Реакцию проводят при комнатной температуре в атмосфере инертного газа, такого как азот, и реакция, по существу, завершается в течение около шести часов. Соединения формулы I, где R представляет-(C1-С 6)алкил, можно получить алкилированием фенола соединения (4) схемы I(а) после стадии сочетания (d) с использованием подходящего-(C1-С 6)алкилгалогенида, такого как метилйодид, и гидрида натрия в апротонном полярном растворителе или смеси растворителей, такой как тетрагидрофуран и диметилформамид. Реакцию можно проводить при комнатной температуре, она, по существу, завершается в пределах 31 ч. Восстановительное аминирование можно затем выполнить, как описано в схемеI(а), стадия (е). Соединения формулы I, где R7 или R8 представляют -(СН 2)p-пиперидил, -(CH2)рS(C1 С 6)алкил или можно получить, как показано на схеме I(b),приведенной ниже, реакцией альдегида (4) с амином или гидрохлоридной солью амина формулы H2NR10, где R10 представляет Н или -(C1 С 6)алкил, с образованием свободного амина (6), 15 который можно затем алкилировать алкилирующим агентом, таким как аминозащищенный пиперидин, например, N-трет-бутоксикарбонил 3-(3-бромпропил)пиперидин, или 2-хлорэтилметилсульфид, с использованием гидрида натрия в апротонном полярном растворителе, таком как диметилформамид, с образованием (7). Предпочтительны температуры от около 20 С до 80 С, и реакция, по существу, завершается в пределах 4 ч. Освобождение пиперидильной группы от защитной группы можно выполнить методиками, знакомыми специалисту в данной области, такими как обработка (7) кислотой,такой как хлористо-водородная кислота. Превращение в сульфоксид можно достичь обработкой окисляющим агентом, таким как мхлорпербензойная кислота. Схема I(b) алкил. Соединения формулы I, где Аr представляет фенил, замещенный одной или двумя группами -(C2-С 6 алкил)R6 с неразветвленной цепью у алкила и X, Y и R4 такие, как определено в приведенной выше схеме I(а), можно получить,как описано в приведенных ниже схемах I(c-e). Схема I(с) илиRc представляет (CH2)q, где q равно целому числу от 2 до 6;Rd представляет Н или -(C1-С 5)алкил. В схеме I(с) аминозамещенный фенол, исходный материал (8), подвергают реакции с ацилирующим агентом, таким как уксусный ангидрид и метоксид натрия, в спирте с низкой молекулярной массой, таком как метанол, с образованием соединения (9). Восстановление карбонила можно достичь с использованием восстанавливающего агента, такого как литийалюминийгидрид, в апротонном растворителе,таком как тетрагидрофуран, для получения соединения (10). Ацилирование (10) можно выполнить реакцией 1,1-карбонилдиимидазола с карбоновой кислотой в апротонном полярном растворителе, таком как тетрагидрофуран, при температурах от около 0 С до около 20 С, затем обработкой N-этил-п-гидроксифенетиламином(10). Реакция, по существу, завершается в течение от 2 до 24 ч. Соединение (11) можно затем сочетать с соответственно замещенным фенилоксазолом по реакции Mitsunobu для получения (12). Реакцию можно проводить в полярном апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре. Приблизительно через 24 ч реакция, по существу, завершается. Соединение (12) можно затем восстановить с использованием восстанавливающего агента, такого как гидрид алюминия, в апротонном растворителе, таком как тетрагидрофуран, для получения(13). Реакцию целесообразно проводят при комнатных температурах и завершают в течение,около трех часов. В альтернативной методике, как показано на приведенной ниже схеме I(d), исходный материал, соответственно замещенный фенилалканол (14), растворенный в органическом растворителе, таком как метиленхлорид, подвергают реакции с галогенирующим агентом, таким как дибромтрифенилфосфоран, для получения соединения (15). Реакцию можно проводить при комнатной температуре, и реакционную смесь можно оставить для протекания в течение около четырех часов. Галогенированное соединение (15) затем сочетают с соответственно замещенным фенилоксазолом по реакции Mitsunobu для получения (16) с последующей заменой галогена на амин формулы -NR7R8 в полярном апротонном растворителе, таком как диметилформамид, при температуре около 80 С в течение около пяти часов для получения целевого конечного продукта.Re представляет (C2-С 6 алкил); А представляет галоген. В приведенной ниже схеме I(е) описывается третья методика получения соединений формулы I, где Аr представляет фенил, замещенный одной или двумя группами -(C2-С 6 алкил)R6 с неразветвленной цепью у алкила. В реакции Mitsunobu соединение (17) сначала сочетают с соответственно замещенным фенилоксазолом для получения промежуточного оксазола (18). Восстановлением цианогруппы с последующим гидролизом получают соединение (19). Аминирование соединения (19) достигается также способом, описанным в схеме I(а),стадия (е). Схема I(е)Rh представляет (C1-С 5)алкил. Соединения формулы I, где Аr представляет фенил, замещенный одной или двумя группами и Х и Y такие, как определено в приведенной выше схеме I(а-е), можно получить, как показано в приведенной ниже схеме II. Схема II 18 А представляет галоген. В приведенной выше реакционной схеме II соответственно замещенный фенилоксазол (20),растворенный в апротонном полярном растворителе, таком как тетрагидрофуран, сочетают с соответственно замещенным фенолом (21) по реакции Mitsunobu для получения (22). При комнатных температурах реакция, по существу,завершается в течение 5 ч. Соединение (22) затем обрабатывают йодидом натрия для получения йодкетона, который затем замещают с использованием соответственно замещенного амина при нагревании до около 50-80 С. Аминирование можно проводить в неполярном органическом растворителе, таком как толуол,оно, по существу, завершается в течение около трех часов. Соединения формулы I, где Аr представляет фенил, замещенный одной или двумя группами разветвленный -(C1-С 6 алкил)R6, и Х и Y такие, как описано в приведенной выше схемеI(а-е), можно получить в соответствии с приведенной ниже схемой III. Схема IIIRa представляет оксозамещенный -(C1-С 6) алкил. Соответственно замещенный фенилоксазол (24), растворенный в апротонном полярном растворителе, таком как тетрагидрофуран, сочетают с соответственно замещенным кетоном(25) по реакции Mitsunobu для получения соединения (26). Восстановительное аминирование (26) можно достичь любым из способов,описанных в схеме I(а), стадия (е). Соединения схем I, II или III, где Аr представляет фенил, дополнительно замещенный одним или двумя заместителями, выбранными из -(C1-С 6)алкила, галогена и гидрокси, можно получить, как показано на приведенной ниже схеме IV. Схема IV 19 Соответственно замещенный фенилоксазол и соответственно замещенный фенол (27) сочетают по реакции Mitsunobu, как описано в схеме I(а), стадия (d), для получения промежуточного соединения (28), которое можно затем аминировать с использованием любого из двух способов, описанных в схеме I(а), стадия (е). Если нужно, гидрокси можно затем освободить от защитной группы. Соединения схемы I, II или III, где Аr представляет фенил, замещенный двумя заместителями, которые, когда взяты вместе, образуют кольцо фенила, можно получить, как показано на приведенной ниже схеме V. Схема VRf представляет водород, -(C1-С 6)алкил, галоген или защищенный гидрокси. С использованием сочетания по Mitsunobu исходному фенилоксазолу дают реагировать с соответственно замещенным гидроксинафтальдегидом (29). Получаемый продукт можно затем подвергнуть восстановительному аминированию с использованием любого способа схемы I,стадия (е) и, где нужно, освободить гидрокси от защитной группы. Соединения схемы I, II или III, где Аr представляет фенил, замещенный и/или -(C1-С 6 алкил)R6; где R6 представляет морфолин-1-ил, пиперазин-1-ил, тиоморфолин 1-ил или замещенный пиперазин-1-ил, получают в соответствии с реакционной схемой VI. Схема VIRa представляет оксозамещенный -(C1-С 6) алкил и Rb представляет -(C1-С 6)алкил. Соответственно замещенный исходный материал (30) сочетают восстановительным аминированием с соответственно замещенным фенилоксазолом в соответствии с реакциями схемы I(а), стадия (е), то есть с использованием любого восстанавливающего агента, такого как цианоборогидрид натрия, в апротонном полярном растворителе, таком как тетрагидрофуран, 001713 20 или изопропоксид титана IV (Ti(OiPr)4) и борогидрида натрия, в спирте с низкой молекулярной массой, таком как этанол, для получения(31). Соединения формулы I, где R6 представляет пиперазин-1-ил, можно получить обработкой соединения (31) схемы VI, где В представляет избытком неорганической кислоты, такой как хлористо-водородная кислота. Соединения формулы I, где R6 представляет имидазол-1-ил, получают в соответствии со следующей схемой VII. Схема VII(32). Реакция, проводимая в полярном органическом растворителе, таком как ацетонитрил, по существу, завершается в течение около 16 ч. Деметилирование (32) достигают обработкой таким агентом, как трибромид бора, для получения соединения (33). По реакции сочетанияMitsunobu соединение (33) можно сочетать с фенилоксазолом (34) для получения целевого продукта (35). Соединения формулы I, где R6 представляет 4,5-дигидро-1 Н-имидазол-2-ил, получают в соответствии со схемой VIII. Схема VIIIRa представляет -(C1-С 6)алкил. Исходный материал, фенилоксазол, сочетают с гидроксифенилалкилцианидным соединением в реакции Mitsunobu. Циклизацию цианогруппы для образования дигидроимидазола(37) можно достичь сначала обработкой (36) 21 газообразным хлоридом водорода в этаноле при низких температурах в течение около четырех часов, затем кипячением с обратным холодильником с этилендиамином в течение дополнительного периода вплоть до 32 ч. Соединения формулы I, где Аr представляет фенил, замещенный двумя заместителями,которые, когда они взяты вместе с углеродами,к которыми они присоединены, образуют пиридил или тетрагидропиридил, можно получить в соответствии с приведенными ниже схемамиRf представляет водород, -(C1-С 6)алкил, галоген или защищенный гидрокси. Схема IX(b)Rf представляет водород, -(C1-С 6)алкил, галоген или защищенный гидрокси. В вышеуказанных реакционных схемахIX(а) и IX(b) исходный материал (38) циклизуют с подходящим альдегидом в кислотном растворе для получения промежуточного продукта(39) можно сначала деметилировать кипячением с обратным холодильником оксалатной соли(38) с бромидом водорода и затем защитить его азот аминозащищающим агентом, таким как дитрет-бутилдикарбонат, для получения (40). В схеме IX(b) свободный амин (39) можно ароматизировать в присутствии дегидрирующего реагента путем нагревания с палладиевой чернью с последующим деметилированием, как обсуждено выше, для получения (42). Соединение (40) или (42) можно затем сочетать с соответственно замещенным фенилоксазолом по реакции Mitsunobu для получения целевых продуктов (41) или (43). Удаление защитной группы азота можно достичь стандарт 001713 22 ной методологией, например, обработкой трифторуксусной кислотой и подходящим акцептором трет-бутилкатиона, таким как тиофенол. Если используют гидроксизащитную группу,гидроксигруппу можно освободить от защитной группы, например, гидролизом или обработкой кислотой, в зависимости от выбранной защитной группы. Соединения, где Аr представляет замещенный пиридил, можно получить по следующей общей реакционной схеме X. Схема XRf представляет водород, -(C1-С 6)алкил, галоген или защищенный гидрокси. С использованием соответственно замещенного пиридонкарбоксальдегида и соответственно замещенного фенилоксазола по реакции сочетания Mitsunobu получают соединение (44). Когда Rf представляет защищенную гидроксигруппу, ее можно освободить от защитной группы после стадии сочетания. Соединение(44) можно затем подвергнуть восстановительному аминированию с использованием любого способа, описанного в вышеприведенной схемеI(а), стадия (е). Соединения формулы I, где Y представляет серу, можно получить, как показано на нижеприведенной схеме XI. Схема XIRa представляет оксозамещенный -(C1 С 6)алкил. Соответственно замещенный фенилоксазол сочетают с соответственно замещенным меркаптобензальдегидом (45) по реакции Mitsunobu. Получаемый промежуточный продукт(46) можно затем восстановить в целевой амин с использованием любой из реакций восстановительного аминирования, описанных в схеме I(а),стадия (е). Соединения формулы I, где R3 представляет -(C1-С 6)алкил и R, R1, R2, R4, Х и Y такие, как А представляет галоген; Ra представляет оксозамещенный -(C1-С 6)алкил. Этилмалонат калия перемешивают с галогенидом металла, таким как хлорид магния, и основанием, таким как триэтиламин, в апротонном полярном растворителе, таком как ацетонитрил, в атмосфере инертного газа, такого как азот, при комнатной температуре, затем подвергают реакции с галогенангидридом, таким как-хлорпропионилхлорид для получения исходного галогенида (47). Промежуточный продукт (48) получают реакцией галогенида (47) с соответственно замещенным бензамидом (1), полученным, как описано в вышеприведенной схеме I(а). Реакционную смесь оставляют для протекания при температурах около от 100 до 150 С в атмосфере инертного газа, такого как азот, в течение около от 1 до 8 ч. Восстановление промежуточного продукта(48) восстанавливающим агентом, таким как литийалюминийгидрид, дает соединение (49). Восстановление проводят в атмосфере инертного газа, такого как азот, в апротонном полярном растворителе или простом эфире, таком как тетрагидрофуран, в течение периода от 1 до 24 ч. С использованием сочетания по Mitsunobu замещенный группой Ra фенол связывают с промежуточным продуктом (49) для получения соединения (50), которое можно восстановить восстановительным аминированием, как описано а вышеуказанной схеме I(а), стадия (е), для получения целевого продукта. Соединения формулы I, где Х представляет S, можно получить cледующим образом:Ra представляет оксозамещенный -(C1 С 6)алкил. Бензамид (52) получают кипячением с обратным холодильником соответственно замещенной бензойной кислоты с активирующим агентом, таким как карбонилдиимидазол, в атмосфере инертного газа, такого как азот, с последующей реакцией с метиламином, как описано в вышеуказанной схеме I, стадия (а). При использовании апротонного полярного растворителя, такого как тетрагидрофуран, реакция, по существу, завершатся в течение около 2-24 ч. Превращение в тиобензамид (53) достигается реакцией (52) с реагентом Лавессона при температурах от 80 до 120 С в органическом растворителе, таком как гексаметилфосфорамид, в атмосфере инертного газа, такого как азот, в течение приблизительно от 1 до 2 ч. Синтез промежуточного продукта (55) выполняют кипячением с обратным холодильником тиоамида (53) в атмосфере инертного газа,такого как азот, с -галогенкетоном, таким как этил-4-хлорацетоацетат, в присутствии йодида калия. Предпочтителен апротонный полярный растворитель или простой эфир, такой как тетрагидрофуран, и реакция завершается в течение до 1 до 6 ч. Циклизацию для получения тиазола (56) достигают реакцией сложного тиоэфира (55) с избытком ацетата аммония в кислоте, такой как уксусная кислота, в атмосфере инертного газа,такого как азот, в течение от 1 до 5 ч. Восстановление сложного эфира тиазола(56) выполняют восстанавливающим агентом,таким как литийалюминийгидрид. Восста 25 новление, предпочтительно, проводят в атмосфере инертного газа, такого как азот, в апротонном полярном растворителе, таком как тетрагидрофуран. Реакция, по существу, завершается в течение от 1 до 2 ч. С использованием реакции Mitsunobu промежуточный продукт, тиазол (57), можно сочетать с замещенным группой Ra фенолом для получения (58), который можно выделить и очистить и восстановить в целевой амин восстановительным аминированием, как описано в вышеуказанной схеме I(а), стадия (е). Соединения формулы I, где Y представляет CHR5, где R4 и R5, индивидуально, представляют водород или R4 и R5 вместе образуют связь, можно получить в соответствии со схемой XIV следующим образом. Схема XIVAPG представляет защищенный альдегид. При комнатной температуре, в полярном растворителе, таком как метиленхлорид, соответственно замещенный исходный спирт (59) галогенируют обработкой галогенирующим агентом, таким как трифенилфосфин и бром в присутствии основания или акцептора кислоты,такого как имидазол. Реакция по существу завершается в течение 1-24 ч. В реакции замещения галогенированное соединение (60) кипятят с обратным холодильником с трифенилфосфином в неполярном растворителе, таком как ксилол, в течение около 24 ч для получения активированного промежуточного продукта (61). Промежуточный продукт (62) получают реакцией Виттига с использованием сильного 26 основания, такого как гексаметилдисилазан натрия, и соответственно защищенного альдегида,такого как моно(диэтилацеталь)терефталевого альдегида. Реакцию, предпочтительно, проводят в апротонном полярном растворителе, таком как тетрагидрофуран, при температурах от около-20 С до около 0 С и по существу завершают в течение около от 3 до 10 ч. Специалист в данной области может легко понять, что промежуточный продукт (62) образует изомеры Е и Z, которые можно легко разделить общепринятыми хроматографическими методиками. Целевой альдегид (63) можно затем освободить от защитной группы обработкой водной кислотой, такой как хлористо-водородная кислота, в течение около 24 ч. Удаление защитной группы, предпочтительно, проводят в полярном растворителе или простом эфире, таком как диэтиловый эфир, при комнатной температуре. Восстановительное аминирование можно выполнить с использованием любой из методик,описанных в схеме 1(а), стадия (е). Соединения формулы I, где Y представляет -CHR5 и R5 представляет водород, можно получить гидрированием соединения (64) газообразным водородом и 5% палладием на угле. Восстановление, предпочтительно, проводят в неполярном растворителе, таком как толуол,при комнатной температуре и завершают, по существу, в течение приблизительно четырех часов. Соединения формулы I, где Аr, Х и Y и R4 такие, как определено в вышеприведенной схеме I(а), и m=0, можно получить, как показано на приведенной ниже схеме XV. Схема XV А представляет галоген. Исходный материал (66) получают обработкой соответственно замещенной бензойной кислоты реагентом сочетания пептидов, таким как 1,1'-карбонилдиимидазол, для образования активированного ацилирующего агента, затем реакцией с соответственно замещенным соединением серина. Метиловый сложный эфир (66) циклизуют в оксазолин (67) реакцией с бромирующим агентом, таким как трифенилфосфин и тетрабромид углерода, в присутствии основания. 27 Реакцию можно проводить в апротонном полярном растворителе, таком как ацетонитрил,при комнатной температуре в течение от около 1 до 24 ч. Оксазолин (67) окисляют в соединение(68) обработкой окисляющим агентом, таким как активированный оксид марганца, при температуре приблизительно от 20 до 50 С в течение приблизительно от 1 до 24 ч в органическом растворителе, таком как ацетон. Оксазол (68) можно затем восстановить восстанавливающим агентом, таким как восстанавливающая система борогидрид литияметанол, в апротонном полярном растворителе,таком как тетрагидрофуран. Реакцию, предпочтительно, начинают при комнатных температурах и затем кипятят с обратным холодильником в течение от 30 мин до 12 ч. Галогенирование (69) выполняют обработкой галогенирующим агентом, таким как трифенилфосфин и тетрабромид углерода, в апротонном полярном растворителе, таком как ацетонитрил. Реакцию можно проводить при комнатных температурах в течение от 1 до 24 ч. В реакции замещения в условиях Финкельштейна галоген заменяют на соответственно замещенный бензальдегид. Восстановительное аминирование (70), как описывается в вышеприведенной схеме I(а),стадия (е), дает целевой продукт (71). Соединения формулы I, где Аr, Х и Y и R4 такие, как определено в вышеприведенной схеме I(с-е), и m=0, можно получить так, как показано в приведенной ниже схеме XVI. Схема XVIRc представляет (CH2)q, где q равно целому числу от 2 до 6;Rd представляет Н или C1-С 5 алкил, А представляет галоген. Исходный материал (11) сочетают с исходным материалом, оксазолом (70), в присутствии основания, такого как гидрид натрия. Реакцию, предпочтительно, проводят при комнатной температуре в течение от 1 до 24 ч для получения промежуточного продукта (72). Восстановление промежуточного продукта(72) для получения (73) можно выполнить обра 001713 А представляет галоген. Исходному материалу (59) дают реагировать с галогенирующим агентом, таким как трифенилфосфин и йод, в присутствии слабого основания. Реакцию можно проводить в апротонном полярном растворителе при комнатных температурах в течение от 1 до 24 ч. В реакции замещения галогенированное соединение (60) нагревают с цианидом натрия в апротонном полярном растворителе, таком как диметилсульфоксид, в течение приблизительно от 1 до 2 ч для получения промежуточного цианосоединения (74). Цианосоединение (74) можно затем восстановить восстанавливающим агентом, таким как гидрид диизобутилалюминия, в неполярном растворителе, таком как толуол. Реакцию, предпочтительно, начинают при -78 С и реакционную смесь затем оставляют для нагревания до комнатной температуры в течение от 1 до 2 ч. Формилсоединение (75) можно затем восстановить восстанавливающим агентом, таким как борогидрид натрия, в растворителе, таком как диэтиловый простой эфир, для получения промежуточного продукта (76). Сочетание промежуточного продукта (76) по реакции Mitsunobu с соответственно замещенным гидроксибензальдегидом дает (77), который можно выделить, очистить и превратить в целевой амин (78) восстановительным аминированием. Получение соединений, где R1 и R2, каждый независимо, представляют -(C1-С 6)алкокси,получают так, как описано в приведенной ниже схеме XVIII.PG представляет защитную группу; Rb представляет -(C1-С 6)алкил. По методике, описанной в вышеприведенной схеме I(а), стадия (а), соответственно замещенную бензойную кислоту (79) превращают в промежуточный бензамид (80). Промежуточный бензамид (80) можно затем циклизовать с образованием сложного эфира (81) нагреванием при температурах от 50 до 130 С с 4-хлорацетоацетатом в атмосфере инертного газа. Восстановление сложного эфира с использованием, например, литийалюминийгидрида дает первичный спирт (82). По методике, показанной на схеме I(а),стадии (d) и (е), получают амин (84). Удаление защитной группы, например, гидролизом, дает целевой продукт (85). Соединения, где R3 и R4, взятые вместе с кольцом, к которому они присоединены, образуют группу бензоксазола, получают, как описано в приведенной ниже схеме XIX. Схема XIX 30 Соответственно замещенную бензойную кислоту (81) сочетают с 2-гидрокси-5-метоксианилином в присутствии кислоты, такой как борная кислота, для образования промежуточного бензоксазола (87). Деметилирование (87) с использованием,например, трибромида бора дает спирт (88). Реакцию, предпочтительно, проводят в органическом растворителе, таком как метиленхлорид,при температурах около от -10 до -70 С. Получение (89) достигают по реакции Ульмана нагреванием (88), предпочтительно,при температурах около 140 С, с соответственно замещенным арилгалогенидом, таким как 4 бромбензальдегид, в присутствии карбоната калия и йодида меди. Восстановительное аминирование, как описано в схеме I(а), стадия (е), дает (90). Соединения, где Х представляет -О- и Y представляет -N-, получают, как показано на схеме XX. Схема XX Оксадиазол (91) получают, сначала, обработкой соответственно замещенной бензойной кислотой (86) тионилхлоридом для получения хлорангидридного промежуточного продукта,который можно затем подвергнуть реакции с соответственно замещенным алкиламидоксимом, таким как метилэтиламидоксим. По стадиям (b)-(d), как описано в вышеприведенной схеме XIX, получают целевой продукт (94). Соединения, где Х представляет -О- и означает одинарную связь, можно получить так,как описано в приведенной ниже схеме XXI. Схема XXI 31 Восстановление (95) выполняют обработкой восстанавливающим агентом, таким как литийалюминийгидрид. Реакцию, предпочтительно, проводят в апротонном полярном растворителе, таком как тетрагидрофуран, при температурах около -10 С для получения промежуточного спирта (96). Сочетанием по Mitsunobu, как описано в схеме I(а), стадия (d), получают альдегид (97). Восстановительное аминирование, как описано в схеме I(а), стадия (е), дает (98). Соединения, где Аr представляет тетрагидронафтил, получают, как показано на схеме(99). Гидролиз сложного эфира выполняют обработкой основанием, таким как гидроксид лития, для получения кислоты (100). Циклизацию в тетрагидронафтил (101) достигают превращением кислоты сначала в хлорангидрид обработкой, например, тионилхлоридом, затем реакцией хлорангидридного промежуточного продукта с газообразным этиленом. Целевой продукт (102) получают восстановительным аминированием, как описано в схеме I, стадия (е). Промежуточные продукты и конечные продукты можно выделить и очистить общепринятыми методиками, например, удалением растворителей для концентрирования с последующим промыванием остатка водой, затем очисткой общепринятыми методиками, такими как хроматография или перекристаллизация. 32 Когда Аr представляет фенил, замещенный одной или двумя группами (C1-С 6 алкил)R6, соединения данного изобретения могут иметь один или два стереоцентра. Способы, готовые препаративные формы и соединения данного изобретения включают диастереомеры и рацематы и их индивидуальные стереоизомеры. Диастереомерные пары можно получить по методикам, известным в данной области. Например, образование диастереомерной соли из рацемического амина можно выполнить обработкой хиральной кислотой, такой как винная кислота или диизопропилиденкетогулоновая кислота. Специалист в данной области должен легко понять, что исходные соединения, такие как замещенная бензойная кислота, амид, амин,спирт, альдегид, гетероциклическое соединение,имидазол и тиофенол, либо имеются на рынке,либо их можно легко получить известными методиками из промышленных исходных материалов. Все остальные реагенты, используемые для получения соединений данного изобретения, также имеются на рынке. Следующие примеры далее иллюстрируют получение соединений этого изобретения. Данные примеры только иллюстративные и никоим образом не предназначены для ограничения объема изобретения. Пример 1. Дигидрат гидрохлорида 2-(3,5 ди-трет-бутил-4-гидроксифенил)-4-(2-(4-этиламинометилфенокси)этил)оксазола. А. Получение 3,5-бис-(1,1-диметилэтил)-4 гидроксибензамида. В колбе Нортона на 22 л смешивали 749 г(3,0 моль) 3,5-бис(1,1-диметилэтил)-4-гидроксибензойной кислоты, 533 г (3,3 моль) карбонилдиимидазола и тетрагидрофуран (ТГФ) и медленно нагревали до кипячения и оставляли для кипячения с обратным холодильником в течение 2,5 ч. Реакционную смесь охлаждали до 26 С и добавляли концентрированный водный аммиак. Перемешивание продолжали в течение 2 ч и реакционную смесь оставляли для стояния в течение ночи. Содержимое переносили в колбу и споласкивали тетрагидрофураном (250 мл). Смесь перемешивали, слои разделяли и водный слой сохраняли. Органический слой промывали солевым раствором (2,5 л), затем смесью солевой раствор/деионизированная (ДИ) вода (1 л/1,5 л). Органический слой промывали смесью 9,7 М хлористо-водородная кислота (НСl)/ деионизированная вода (0,25 л/2,25 л), затем смесью 9,7 М хлористо-водородная кислота (НСl)/ деионизированная вода (0,5 л/2,8 л) и смесью 9,7 М хлористо-водородная кислота (НСl)/деионизированная вода/солевой раствор (0,5 л/1,5 л/1,5 л). Органический слой отставляли, тогда как объединенные водные слои экстрагировали тетрагидрофураном. Объединенные органические слои промывали солевым раствором, сушили сульфатом натрия (855 г) и фильтровали. 33 Фильтрат выпаривали до получения 1011 г влажного (вода) белого твердого продукта. Добавляли метиленхлорид и удаляли в вакууме. Эту процедуру повторяли с этилацетатом (6 л,затем 2 л), получая твердый остаток (779 г). Остаток суспендировали в этилацетате и гептане,фильтровали и сушили в вакуумном сушильном шкафу, получая целевой амид (736 г, 98,7%) в виде белого твердого продукта. Т. пл. 257260 С. 1(18 Н, с). В. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(карбоксиметил)оксазола. К 24,90 г (100 ммоль) соединения стадии А добавляли 55 мл (407 ммоль) этил-4 хлорацетоацетата. Смесь нагревали до 130 С в атмосфере азота в течение 2 ч. Реакционную смесь охлаждали до 90 С и летучие компоненты отгоняли из реакционной смеси в вакууме до тех пор, пока температура в колбе не достигала 130 С. Густой остаток оставляли для охлаждения до 60 С под вакуумом. Вакуум освобождали и к смеси добавляли 100 мл метанола. Раствор охлаждали до 25 С и затем по каплям добавляли 50% раствор гидроксида натрия (50 мл). Температуру реакционной смеси повышали до 55 С. Смесь перемешивали 25 мин, затем к реакционной смеси по каплям добавляли концентрированную водную хлористо-водородную кислоту(25 мл, 300 ммоль) до установления рН 7-8. Смесь фильтровали и фильтровальную лепешку промывали метанолом (2 х 50 мл). Метанол удаляли в вакууме и затем добавляли 1 н. хлористо-водородную кислоту (100 мл) и воду (100 мл). Образовался смолистый осадок. Осадок растворяли добавлением 500 мл смеси 1:1 третбутилметилового простого эфира (МТБЭ) и этилацетата. Получаемая эмульсия разделялась в течение ночи на три слоя. Верхний слой, содержащий целевой продукт (по ВЭЖХ), сушили сульфатом натрия и концентрировали в вакууме, получая 30,8 г рыжевато-коричневого твердого продукта. Этот твердый продукт растворяли в смеси 2:1 метанол:вода (225 мл) при 75 С. Перемешиваемую смесь оставляли для охлаждения до 25 С в течение 1 ч и перемешивали в течение еще 2,5 ч. Смесь фильтровали и фильтровальную лепешку промывали всего 120 мл смеси 2:1 метанол:вода. Сушка в вакууме при 40 С давала 21,94 г указанного в подзаголовке продукта. 19,9 г часть кислоты перекристаллизовывали из 300 мл смеси 1:1 гептан:толуол,получая 17,77 г (общий выход 62%) указанного в подзаголовке соединения в виде белого твердого материала. Т. пл. 166-68 С. 1 34 Элементный анализ для C19H25NO4: Вычислено: С 68,86; Н 7,60; N 4,23. Найдено: С 68,86; Н 7,59; N 4,32. МСПД (FDMS, МС с полевой десорбцией) 331 (М+). С. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-гидроксиэтил)оксазола. В колбу на 22 л 757 г (2,28 моль) соединения стадии В растворяли в тетрагидрофуране. К раствору добавляли, сначала очень медленно и с охлаждением водяной баней, 1 М раствор борантетрагидрофуран (4,8 мл). Через 1 ч реакционную смесь очень медленно из-за выделения водорода гасили метанолом (650 мл). Смесь оставляли для перемешивания в течение ночи. Раствор помещали в роторный испаритель и выпаривали до пены (995 г). Остаток растворяли в трет-бутилметиловом простом эфире (11 л) и добавляли деионизированную воду (4,9 л) и 50% гидроксид натрия (130 мл) и перемешивали, затем добавляли солевой раствор (3,6 л). Слои оставляли для разделения, получая три слоя. Нижние два слоя показали, что не содержат продукт, поэтому они были отброшены. Слой трет-бутилметилового простого эфира промывали смесью 1 н. гидроксида натрия (100 мл), деионизированной воды (2 л) и солевого раствора (2 л). Органический слой сушили сульфатом натрия, фильтровали и выпаривали,получая 802 г вязкого остатка. К остатку добавляли толуол (1,4 л) и смесь нагревали до 80 С для получения раствора. Добавляли гептан (6 л),раствор нагревали до 93 С и затем охлаждали в течение 1,5 ч до 0-10 С ледяной баней. Смесь фильтровали и фильтровальную лепешку промывали смесью 60:40 гептан/толуол (2 л). Твердый продукт сушили в вакуумном сушильном шкафу, получая 670 г указанного в подзаголовке продукта. Этот твердый продукт перекристаллизовывали из толуола (2 л) и гептана (5,5 л),получая 627 г (выход 87%) продукта в виде белого твердого материала. Т. пл. 119,5-21 С. 1D. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-формилфенилокси) этил)оксазола. Соединение стадии С (204,3 г, 644 ммоль),триэтиламин (100 мл, 716 ммоль) и метиленхлорид (1,7 л) перемешивали, получая раствор. В течение 15 мин добавляли метансульфонилхлорид (81,3 г, 710 ммоль) и для поддерживания температуры в колбе ниже 31 С использовали водяную баню. Реакционную смесь перемешивали и оставляли для охлаждения до 23 С в течение 1,5 ч. Реакционную смесь выливали в делительную воронку на 4 л и колбу споласкивали метиленхлоридом (0,5 л). Органический слой промывали 1 н. хлористо-водородной кислотой(3 х 1 л) и объединенные водные слои обратно экстрагировали метиленхлоридом (0,3 л). Объе 35 диненные органические слои промывали солевым раствором (0,5 л) и деионизированной водой (0,5 л). Органические слои сушили сульфатом натрия, фильтровали и выпаривали, получая 254 г мезилата в виде масляной пены. К промежуточному мезилатному соединению добавляли диметилсульфоксид (ДМСО, 0,7 л), получая раствор. В отдельной колбе смешивали 4 гидроксибензальдегид (89,6 г, 734 ммоль), третбутоксид калия (79,98 г, 0,713 моль) и диметилсульфоксид (1,2 л) и нагревали до 45 С, получая коричневый раствор. Мезилатное соединение в диметилсульфоксиде добавляли все сразу. Реакционную смесь нагревали при 60-65 С в течение 15 ч. Добавляли дополнительные 0,5 л диметилсульфоксида. Температуру реакции повышали до 70 С и поддерживали ее в течение 2 ч. Затем к реакционной смеси добавляли 4-гидроксибензальдегид (3,92 г) и трет-бутоксид калия(3,59 г). После 7 ч выдерживания при 70 С реакционной смеси давали охладиться до комнатной температуры. К реакционной смеси добавляли трет-бутилметиловый простой эфир (3,3 л). Раствор промывали 1 н. гидроксидом натрия (4 х 2 л). Водные слои объединяли, обратно экстрагировали трет-бутилметиловым простым эфиром (2 х 1 л) и затем отбрасывали. Объединенные органические слои промывали деионизированной водой (2 л), смесью деионизированная вода/солевой раствор (2 л) и солевым раствором(2 л). Органический слой сушили сульфатом натрия, фильтровали и выпаривали, получая темный остаток (267,3 г). Остаток растворяли в смеси метиленхлорида (150 мл) и гептана (100 мл) и пропускали через хроматографическую установку с колонкой с силикагелем (2,5 кг). Колонку элюировали смесью 1:1 гептан/ метиленхлорид (16 л), метиленхлоридом (12 л) и 6% раствором этилацетат/метиленхлорид. Фракции,содержащие продукт в качестве основного компонента, объединяли и выпаривали, получая 196 г янтарного масла. Масло растворяли в хлороформе (200 мл) и переносили в колбу с механической мешалкой. Колбу споласкивали смесью гексан/хлороформ (100 мл/25 мл) и гексаном(100 мл) и промывочные жидкости добавляли к раствору. После добавления гексана (1,8 л) раствор нагревали до кипячения с обратным холодильником и собирали 100 мл дистиллята. Смесь охлаждали до 35 С в течение 1,5 ч и затем происходила кристаллизация. С использованием бани лед/вода раствор охлаждали до 6 С в течение 1,5 ч. Продукт фильтровали, промывали 10% раствором хлороформ/гексан (300 мл) и сушили в вакуумном сушильном шкафу, получая 153 г (выход 56%) указанного в подзаголовке продукта в виде белого твердого материала. Т. пл. 110-112 С. Анализ ВЭЖХ показывал 99,4% (по площади) целевого соединения. 1(д, J = 7 Гц, 2 Н), 7,82 (с, 2 Н), 9,85 (с, 1 Н). Е. Получение полугидрата гидрохлорида 2(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4 этиламинометилфенокси)этил)оксазола. К 5,05 г (12 ммоль) соединения стадии D,растворенного в 50 мл сухого метанола в атмосфере азота добавляли 7,85 мл (120 ммоль) моноэтиламина. Раствор перемешивали в течение 5 мин, затем добавляли 6,8 мл (120 ммоль) уксусной кислоты и смесь перемешивали в атмосфере азота в течение 30 мин. Добавляли 795 мг(12,6 ммоль) цианоборогидрид натрия, и реакционную смесь перемешивали в течение 3 ч. Добавляли дополнительные 500 мг цианоборогидрида натрия и снова перемешивали в течение дополнительного часа. Затем добавляли этилацетат и смесь промывали водой, насыщенным бикарбонатом натрия и снова водой. Органический слой сушили, фильтровали и затем выпаривали, получая 5,44 г сырого продукта, который хроматографировали на 300 мл диоксида кремния,элюируя смесью метиленхлорид/метанол/концентрированный аммиак(90:10:1). Фракции, содержащие целевой продукт, концентрировали в вакууме, затем растворяли в простом диэтиловом эфире. Через раствор барботировали газообразный хлорид водорода, получая масло, которое растворяли в ацетоне и отпаривали досуха, получая 3,4 г (54%) указанного в заголовке продукта в виде белой пены. МСПД - M+ 450; Элементный анализ для (C28H38N2O3HCl 0,5 Н 2 О): Вычислено: С 67,79; Н 8,13; N 5,65. Найдено: С 67,97; Н 7,99; N 5,74. ЯМР (CDCl3):1,40 (т, 3 Н, J = 7 Гц), 1,49(с, 18 Н), 2,92 (к, 2 Н, J = 4 Гц), 3,30 (т, 2 Н, J = 7 Гц), 3,95 (т, 2 Н, J = 7 Гц), 4,31 (т, 2 Н, J = 7 Гц),6,10 (шир. с, 1 Н), 6,85 (д, 2 Н, J= 9 Гц), 7,49 (д,2 Н, J= 9 Гц), 7,87 (с, 1 Н), 8,21 (с, 2 Н), 9,59 (шир. с, 2 Н). Пример 2. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-диметиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали из 1,26 г (3 ммоль) соединения примера 1D,по существу, в соответствии с методикой вышеуказанного примера 1 Е с использованием 200 мг(3,15 ммоль) цианоборогидрида натрия и 3,37 мл (30 ммоль) 40% водного диметиламина. Такая реакция давала 1,31 г (90%) указанного в заголовке продукта в виде белой пены. МСПД M+ 450; Элементный анализ для (C28H38N2O3HCl): Вычислено: С 69,05; Н 8,07; N 5,75. Найдено: С 68,75; Н 7,94; N 5,56. ЯМР (CDCl3):1,49 (с, 18 Н), 2,71 (д, 2 Н, J= 3 Гц), 3,38 (т, 2 Н, J = 7 Гц), 4,10 (д, 2 Н, J = 7 Гц), 4,44 (т, 2 Н, J = 7 Гц), 6,08 (c, 1 Н), 6,95 (д, 37 2 Н, J = 9 Гц), 7,50 (д, 2 Н, J = 9 Гц), 7,74 (c, 1 Н),8,23 (с, 2 Н). Пример 3. Гидрат гидрохлорида 2-(3,5-дитрет-бутил-4-гидроксифенил)-4-(2-(4-метилэтиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали из 3,36 г (7,98 ммоль) соединения примера 1D, по существу в соответствии с методикой вышеуказанного примера 1 Е с использованием 0,5 г (7,98 ммоль) цианоборогидрида натрия и 6,9 мл (79,8 ммоль) метилэтиламина. Органический слой хроматографировали на силикагеле с использованием градиента метиленхлорид/ метанол, получая свободное основание (2,79 г,75%). Свободное основание растворяли в метиленхлориде, обрабатывали газообразным хлоридом водорода и выпаривали, получая 2,8 гH ЯМР (CDCl3):8,0 (с, 2 Н), 7,6 (с, 1 Н),7,5 (д, J = 9 Гц, 2 Н), 6,95 (д, J = 9 Гц, 2 Н), 5,7 (с,1 Н), 4,35 (т, J = 7 Гц, 2 Н), 4,1 (м, 2 Н), 3,2 (м,3 Н), 2,9 (м, 1 Н), 2,6 (д, J = 4 Гц, 3 Н), 1,5 (с, 18 Н),1,45 (т, J = 7 Гц, 3 Н). МСПД 464 (M+-HCl); Элементный анализ для (С 29 Н 41ClN2 О 3 Н 2 О): Вычислено: С 67,10; Н 8,35; N 5,40. Найдено: С 66,99; Н 7,96; N 5,29. Пример 4. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(3-диметиламинометилфенокси)этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(3-формилфенокси)этил) оксазола. К 4,44 г (14 ммоль) соединения примера 1 С, растворенного в тетрагидрофуране (ТГФ),добавляли 1,94 г (16 ммоль) 3-гидроксибензальдегида и 4,18 г (16 ммоль) трифенилфосфина (РРh3) в атмосфере азота. Раствор охлаждали до -50 С и в течение 10 мин при перемешивании добавляли раствор 2,51 мл (16 ммоль) диэтилдиазодикарбоксилата (ДЭАД) в 15 мл тетрагидрофурана. Баню убирали и реакционную смесь перемешивали в атмосфере азота в течение 4 ч. Добавляли пероксид водорода(0,89 мл, 30%) и реакционную смесь перемешивали в течение 15 мин, отпаривали, растворяли в 40 мл метиленхлорида и помещали в морозильник. Диэтоксикарбонилгидразин затем отделяли фильтрованием и фильтрат хроматографировали, элюируя градиентом от 5 до 20% ацетон/ гексан в течение 30 мин. Подходящие фракции объединяли и отпаривали, получая 3,2 г (54%) указанного в подзаголовке продукта. ЯМР (CDCl3):1,49 (с, 18 Н), 3,10 (т, 2 Н, J 38 Указанное в заголовке соединение получали из 3,2 г (7,6 ммоль) соединения стадии А, по существу, в соответствии с методикой примера 1 Е с использованием 503 мг (8,0 ммоль) цианоборогидрида натрия и 9,5 мл (76 ммоль) 40% диметиламина. Такая реакция давала 1,82 г белой пены (49%), которую растирали со смесью метиленхлорид/изопропиловый простой эфир,получая 1,25 г указанного в заголовке соединения. МСПД - М+ 450; Элементный анализ для (C28H38N2O3 НСl): Вычислено: С 69,05; Н 8,07; N 5,75. Найдено: С 69,31; Н 8,13; N 5,84. ЯМР (CDCl3):1,50 (с, 18 Н), 2,77 (д, 2 Н, J= 5 Гц), 3,33 (т, 2 Н, J = 7 Гц), 4,15 (д, 2 Н, J = 4 Гц), 4,48 (т, 2 Н, J = 7 Гц), 5,95 (с, 1 Н), 6,98 (дд,1 Н, J = 2 Гц, 9 Гц), 7,12 (д, 1 Н, J = 9 Гц), 7,32 (т,1 Н, J = 9 Гц), 7,53 (д, 1 Н, J = 2 Гц), 7,88 (с, 1 Н),8,16 (с, 2 Н). Пример 5. Гидрохлорид 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-н-пропиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали из 3,0 г (7,13 ммоль) соединения примера 1D,по существу, в соответствии с методикой вышеуказанного примера 1 Е с использованием 471 мг цианоборогидрида натрия и 5,82 мл (71,3 ммоль) монопропиламина. Такая реакция давала 1,67 г указанного в заголовке соединения в виде белой пены (47%). МСПД - М+ 464; Элементный анализ для (C28H38N2O3HCl): Вычислено: С 69,51; Н 8,25; N 5,59. Найдено: С 69,80; Н 8,24; N 5,46. ЯМР(т, 2 Н, J = 7 Гц), 3,94 (т, 2 Н, J = 7 Гц), 4,30 (т,2 Н, J = 7 Гц), 6,00 (с, 1 Н), 6,87 (д, 2 Н, J = 9 Гц),7,50 (д, 2 Н, J = 9 Гц), 7,74 (с, 1 Н), 8,17 (с, 2 Н),9,70 (шир. с, 2 Н). Пример 6. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-н-гексиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали, по существу так, как описано в примере 1 Е,за исключением того, что использовали Nгексиламин. Реакционную смесь концентрировали в вакууме, затем обрабатывали смесью 1:1 этилацетат:вода (100 мл). Фазы разделяли и органическую фазу промывали водным насыщенным бикарбонатом натрия (50 мл), затем промывали солевым раствором (50 мл). Органическую фазу концентрировали в вакууме, затем обрабатывали диэтиловым простым эфиром и силикагелем (10 г) и получаемый материал концентрировали в вакууме до получения сыпучего порошка. Порошок подвергали флэшхроматографии на силикагеле, элюируя метиленхлоридом (3 х 200 мл), смесью метиленхлорид/1% метанол (5 х 100 мл), смесью 94:5:1 метиленхлорид:метанол:гидроксид аммония (10 х(75 мл), затем газообразной хлористоводородной кислотой. Получаемый раствор концентрировали в вакууме, получая пену, которую обрабатывали горячим метиленхлоридом(10 мл), затем диизопропиловым простым эфиром (10 мл) и концентрировали до тех пор, пока не наблюдали помутнение. Мутный раствор помещали в морозильник приблизительно на 2,5 ч. Нерастворимую часть собирали фильтрованием, промывали диизопропиловым простым эфиром и сушили в вакуумном сушильном шкафу при 40 С в течение ночи, получая 1,46 г указанного в заголовке соединения. Масс-спектр(м, 2 Н), 2,75 (м, 2 Н), 1,85 (м, 2 Н), 1,50 (м, 18 Н),1,24 (м, 6 Н), 0,82 (т, J = 6,6 Гц, 3 Н). Элементный анализ для (С 32 Н 47 СlN2O3): Вычислено: С 70,76; Н 8,72; N 5,16. Найдено: С 70,68; Н 8,61; N 5,16. Пример 7. Дигидрат гидрохлорида 2-(3,5 ди-трет-бутил-4-гидроксифенил)-4-(2-(4-диэтиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали из 4,21 г (10 ммоль) соединения примера 1D,по существу, в соответствии с методикой в примере 1 Е с использованием 0,63 г (10 ммоль) цианоборогидрида натрия и диэтиламина (10,3 мл,100 ммоль). Реакционную смесь оставляли для продолжения реакции в течение 21 ч. Органический слой хроматографировали на силикагеле с использованием градиента метиленхлорид/метанол, получая свободное основание, которое затем растворяли в метиленхлориде, обрабатывали газообразным хлоридом водорода и выпаривали, получая 2,68 г (52%) указанного в заголовке продукта. 1(т, J = 7 Гц, 6 Н); МСПД 478 (M+-HCl); Элементный анализ для С 30 Н 43 СlN2O3 2 Н 2O: Вычислено: С 64,32; Н 8,64; N 5,00. Найдено: С 63,94; Н 8,46; N 4,80. Пример 8. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-N-н-пропил-Nметиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали, по существу, так, как описано в примере 1 Е,за исключением того, что использовали Nметил-N-н-пропиламин и хроматографию с ис 001713 40 пользованием градиента от 0 до 10% (метанол: 1% гидроксид аммония):хлороформ в течение периода тридцати минут. Фракции, содержащие целевой продукт, концентрировали в вакууме,обрабатывали хлороформом (100 мл) и сульфатом магния, фильтровали и фильтрат насыщали газообразным хлоридом водорода. Раствор концентрировали в вакууме до пены, получая 3,40 г(т, J = 7,3 Гц, 3 Н). Элементный анализ для С 30 Н 43 СlN2O3 Н 2O: Вычислено: С 67,58; Н 8,51; N 5,25. Найдено: С 67,65; Н 8,34; N 5,33. Пример 9. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-N-н-пропил-Nэтиламинометилфенокси)этил)оксазола. Раствор(29,5 ммоль, 2,58 г) в хлороформе (10 мл) насыщали газообразным хлоридом водорода. Этот раствор концентрировали в вакууме, затем обрабатывали этанолом (11 мл), триэтиламином (29,5 ммоль, 2,99 г), изопропоксидом титана IV (29,5 ммоль, 8,40 г) и 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-формилфенокси)этил) оксазолом (14,8 ммоль, 6,22 г), полученным, как описано в вышеуказанном примере 1D. Суспензию перемешивали при комнатной температуре в течение 4 часов, затем осторожно обрабатывали борогидридом натрия (22,2 ммоль, 0,84 г),чтобы избежать вспенивания. Реакционную смесь перемешивали приблизительно 3 дня до обработки 2 н. гидроксидом аммония (23 мл). К этой смеси добавляли метиленхлорид (150 мл) и диатомовую землю (20 г) и смесь фильтровали через подушку диатомовой земли и промывали метиленхлорид (100 мл). Фильтрат промывали солевым раствором (1 х 50 мл) и органический слой концентрировали в вакууме до масла, обрабатывали хлороформом и подвергали препаративной хроматографии. Материал элюировали с градиентом от 0 до 10% (1% гидроксид аммония:метанол):хлороформ в течение периода тридцати минут. Фракции, содержащие целевой продукт, концентрировали в вакууме до масла. Масло обрабатывали хлороформом и насыщали газообразным хлоридом водорода. Этот раствор концентрировали в вакууме, получая 4,78 г 41 Элементный анализ для C31H45ClN2O3: Вычислено: С 70,36; Н 8,57; N 5,29. Найдено: С 70,08; Н 8,32; N 5,30. Пример 10. Дигидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(2,4-бис(метилэтиламинометил)фенокси)этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(2,4-бис-формилфенокси) этил)оксазола. В колбе 4,75 г (15 ммоль) соединения примера 1 С, 2,36 г (15,75 ммоль) 3-формил-4 гидроксибензальдегида и 3,93 г (15 ммоль) трифенилфосфина растворяли в 45 мл тетрагидрофурана при перемешивании в атмосфере азота. Раствор охлаждали до -10 С и при перемешивании в течение 10 мин добавляли раствор 2,36 мл(15 ммоль) диэтилазодикарбоксилата в 15 мл тетрагидрофурана. Реакция была экзотермической и реакционная смесь нагревалась до +1 С. Баню убирали и реакционную смесь перемешивали в атмосфере азота в течение 18 ч. Реакционную смесь затем отпаривали, растворяли в минимальном количестве метиленхлорида и помещали в морозильник. Диэтоксикарбонилгидразин затем отделяли фильтрованием и фильтрат хроматографировали, Prep 500, две колонки, элюируя с градиентом от 0 до 20% этилацетат/толуол в течение 30 мин. Подходящие фракции объединяли и выпаривали, получая 3,3 г (49%) продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):1,48 (с, 18 Н), 3,17 (т, 2 Н, J(д, 1 Н, 9 Гц), 7,53 (с, 1 Н), 7,84 (с, 2 Н), 8,11 (дд,1 Н, J = 2 Гц, 9 Гц), 8,32 (д, 1 Н, J = 2 Гц), 9,94 (с,1 Н), 10,48 (с, 1 Н). В. Получение гидрата дигидрохлорида 2(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(2,4 бис(метилэтиламинометил)фенокси)этил)оксазола. Гидрохлорид указанного в заголовке соединения получали из 1,5 г (3,34 ммоль) продукта стадии А, по существу, в соответствии с методикой в примере 9, используя 4,0 мл (13,4 ммоль) изопропоксида титана IV и 1,15 мл (13,4 ммоль) метилэтиламина и 0,38 г (10 ммоль) борогидрида натрия. Органическую часть хроматографировали на 100 мл диоксида кремния,элюируя смесью метиленхлорид/метанол и концентрированным аммиаком (90:10:1). Подходящие фракции концентрировали и растворяли в смеси метиленхлорид/изопропиловый простой эфир. Барботировали газообразный хлорид водорода и получаемый остаток растирали с изопропиловым простым эфиром, получая 1,10 г(54%) указанного в заголовке продукта в виде белой пены. МСПД - М+ 536; Элементный анализ для (C33H49N3O32 НСl(25 мл) добавляли изопропоксид титана IV (5,9 мл, 20 ммоль), затем соединение примера 1D(4,21 г, 10 ммоль). Реакционную смесь перемешивали в течение 4 ч, затем добавляли борогидрид натрия (0,57 г, 15 ммоль). После выдерживания 20 ч при комнатной температуре реакционную смесь выливали в 75 мл 2 н. гидроксида аммония и разбавляли метиленхлоридом. Смесь фильтровали через диатомовую землю и фильтрат экстрагировали солевым раствором. Органический слой сушили над сульфатом натрия,выпаривали досуха и хроматографировали на силикагеле с использованием градиента метиленхлорид/метанол, получая свободное основание (3,56 г, 72%). Свободное основание растворяли в метиленхлориде (86 мл), обрабатывали газообразным хлоридом водорода и выпаривали, получая целевой продукт (3,92 г, 100%): 1H ЯМР (CDCl3):8,0 (С, 2 Н), 7,6 (с, 1 Н),7,5 (д, J = 9 Гц, 2 Н), 6,95 (д J = 9 Гц, 2 Н), 5,7 (с,1 Н), 4,35 (т, J = 7 Гц, 2 Н), 4,2 (м, 2 Н), 3,9 (м,2 Н), 3,2 (т, J = 7 Гц, 2 Н), 3,15 (м, 4 Н), 1,5 (м,21 Н); МСПД 494 (M+-НСl); Элементный анализ для C30H43ClN2O40,5 Н 2O: Вычислено: С 66,71; Н 8,21; N 5,19. Найдено: С 66,47; Н 8,10; N 5,20. Пример 12. Гидрохлорид 2-(3,5-ди-третбутил-4-метоксифенил)-4-(2-(4-N-бис[гидроксиэтил]аминометилфенокси)этил)оксазола. Указанное в заголовке соединение получали, по существу, так, как описано в примере 11,за исключением того, что использовали диэтаноламин. Материал подвергали препаративной хроматографии, элюируя с градиентом от 0 до 10% (1% гидроксид аммония/метанол): хлороформ в течение периода тридцати минут. Фракции, содержащие указанное в заголовке соединение, объединяли и концентрировали в вакууме, получая масло. Масло обрабатывали хлороформом, затем газообразным хлоридом водорода и концентрировали в вакууме, получая 817 мг указанного в заголовке соединения в виде пены. Масс-спектр (МСПД): m/z 510 (М-НСl). 1 43 Элементный анализ для C30H43ClN2O5 + 0,3 моль Н 2 О: Вычислено: С 65,21; Н 7,95; N 5,07. Найдено: С 65,18; Н 7,95; N 4,67. Пример 13. Дигидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-[N-метил-N-(3 пиперидин-3-ил)пропил)аминометил]фенокси) этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-N-метил-N-аминометилфенокси)этил)оксазола. Указанное в подзаголовке соединение получали по существу так, как описано в примере 11, за исключением того, что использовали гидрохлоридную соль метиламина. Сырой материал подвергали препаративной хроматографии. Материал элюировали с градиентом от 0 до 10%(1% гидроксид аммония: метанол):хлороформ в течение периода тридцати минут. Фракции, содержащие целевой продукт, концентрировали в вакууме, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 6,74 г (62%) указанного в заголовке соединения. Масс-спектр (МСПД): m/z 436 (М),1H ЯМР (CDCl3):7,83 (с, 2 Н), 7,46 (с,1 Н), 7,42 (д, J = 8,3 Гц, 2 Н), 6,92 (д, J = 8,3 Гц,2 Н), 5,30 (шир. с, 1 Н), 4,22 (т, J = 6,5 Гц, 2 Н),3,93 (с, 2 Н), 3,03 (т, J = 6,5 Гц, 2 Н), 2,46 (с, 3 Н),1,48 (с, 18 Н); Элементный анализ для С 27 Н 36N2O3: Вычислено: С 74,28; Н 8,31; N 6,42. Найдено: С 74,39; Н 8,51; N 6,47. В. Получение 2-3,5-ди-трет-бутил-4 гидроксифенил)-4-[N-метил-N-(3-(N'-трет-бутоксикарбонилпиперид-3-ил)пропил)аминометил] фенокси)этил)оксазола. Красный раствор соединения стадии А (9,2 ммоль, 4,01 г) в диметилформамиде (диметилформамид, 18 мл) обрабатывали 60% (мас./мас.) гидридом натрия (20,2 ммоль, 808 мг). Суспензию перемешивали в течение 30 мин при 24 С,затем обрабатывали раствором N-трет-бутоксикарбонил-3-(3-бромпропил)пиперидина(8,4 ммоль, 2,56 г) в диметилформамиде (5 мл). Затем суспензию нагревали при 80 С в течение 4 ч, затем охлаждали до 24 С. Реакционную смесь обработали 10% водным бисульфатом натрия(25 мл), водой (10 мл) смесью 3/2 этилацетат:гексан (50 мл). Фазы разделяли и водную фракцию экстрагировали смесью 3:2 этилацетат:гексан (2 х 50 мл). Объединенную органическую часть промывали солевым раствором(2 х 50 мл), сушили над сульфатом натрия,фильтровали и концентрировали в вакууме, получая 6,67 г масла. Сырой материал подвергали препаративной хроматографии. Материал элюировали с градиентом от 0 до 10% (1% гидроксид аммония:метанол):хлороформ в течение периода тридцати минут. Фракции, содержащие целевой продукт,уменьшали в объеме в вакууме, сушили над сульфатом натрия, фильтровали и концентриро 001713 44 вали в вакууме, получая 4,19 г указанного в заголовке соединения. Этот материал, содержащий некоторое количество примесей, использовали в следующей стадии без дальнейшей очистки. Масс-спектр (МСПД): m/z 662 (М+1). 1H ЯМР (CDCl3):7,83 (с, 2 Н), 7,50 (с,1 Н), 7,19 (д, J = 8,4 Гц, 2 Н), 6,88 (д, J = 8,4 Гц,2 Н), 5,49 (с, 1 Н), 4,27 (т, J = 6,6 Гц, 2 Н), 3,91 (м,1 Н), 3,40 (с, 2 Н), 3,07 (т, J = 6,6 Гц, 2 Н), 2,72 (м,1 Н), 2,32 (т, J = 7,3 Гц, 2 Н), 2,15 (с, 3 Н), 1,80 (м,1 Н), 1,37-1,69 (м, 26 Н), 1,22 (м, 2 Н). С. Получение гидрохлорида 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-[N-метил-N-(3(N'-трет-бутоксикарбонилпиперид-3-ил)пропил) аминометил]фенокси)этил)оксазола. Раствор соединения стадии В (3,15 ммоль,2,09 г) в диэтиловом простом эфире (20 мл) обрабатывали газообразным хлоридом водорода в течение приблизительно 10 мин. Получаемую густую суспензию перемешивали дополнительно 20 минут, фильтровали и промывали диэтиловым простым эфиром (20 мл), получая 2,01 гH ЯМР (CDCl3):8,13 (с, 2 Н), 7,66 (с,1 Н), 7,50 (д, J = 8,5 Гц, 2 Н), 6,96 (д, J = 8,5 Гц,2 Н), 5,91 (с, 1 Н), 4,41 (т, J = 5,9 Гц, 2 Н), 4,10 (м,2 Н), 3,84 (с, 2 Н), 3,30 (т, J = 5,8 Гц, 2 Н), 2,96 (м,1 Н), 2,78 (м, 2 Н), 2,63 (м, 3 Н), 2,49 (дд, J = 9,9,12,9 Гц, 1 Н), 1,85 (м, 2 Н), 1,50 (с, 27 Н). Элементный анализ для C40H60ClN3O5: Вычислено: С 68,89; Н 8,53; N 6,03. Найдено: С 68,65; Н 8,45; N 6,02.D. Получение дигидрохлорида 2-(3,5-дитрет-бутил-4-гидроксифенил)-4-(2-(4-[N-метилN-(3-(пиперидин-3-ил)пропил)аминометил]фенокси)этил)оксазола. К раствору соединения стадии С (3,0 ммоль, 2,01 г) в хлороформе (20 мл) добавляли тиофенол (6,07 ммоль, 0,67 г). Затем через этот раствор в течение приблизительно 30 мин пропускали газообразный хлорид водорода, затем перемешивали в течение ночи при 24 С до концентрирования в вакууме до пены. Материал растворяли в горячем метиленхлориде (10 мл),затем при нагревании раствора добавляли тетрагидрофуран (15 мл). Раствор упаривали приблизительно до общего объема 12 мл, охлаждали приблизительно до -22 С до добавления тетрагидрофурана (10 мл), что приводило к образованию осадка. Суспензию фильтровали, нерастворимую часть переносили с метиленхлоридом и объем снижали приблизительно до 5 мл. Добавляли тетрагидрофуран (20 мл) и раствор упаривали приблизительно до 5 мл. Затем к горячему раствору добавляли диэтиловый простой эфир(20 мл), что приводило к образованию смолы. Суспензию охлаждали до 24 С, смолу растирали и нерастворимую часть собирали титрованием и промывали диэтиловым простым эфиром(20 мл). Нерастворимую часть ресуспен 45 дировали с перемешиванием в горячем диэтиловом простом эфире (150 мл). После нагревания в течение приблизительно 30 мин (поддерживая объем между 100-150 мл) нерастворимую часть собирали фильтрованием и промывали горячим диэтиловым простым эфиром (100 мл). Нерастворимый продукт сушили в вакуумном сушильном шкафу при 60 С в течение ночи, получая 1,32 г (72%) указанного в заголовке соединения. Масс-спектр (МСПД): m/z 562 (М+1). 1(м, 1 Н), 3,37 (м, 1 Н), 3,20 (м, 2 Н), 3,04 (м, 1 Н),2,66-2,89 (м, 4 Н), 2,55 (м, 1 Н), 1,80-2,25 (м, 7 Н),1,49 (с, 18 Н), 1,11-1,41 (м, 3 Н). Элементный анализ для C35H53Cl2N3O3: Вычислено: С 66,23; Н 8,42; N 6,62. Найдено: С 66,47; Н 8,67; N 6,39. Пример 14. Гептагидрат гидрохлорида 2(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-Nметил-N-этиламиноэтилфенокси)этил)оксазола. А. Получение N-формил-N-этил-п-гидроксифенетиламина. К суспензии 1,1'-карбонилдиимидазола(326 ммоль, 52,81 г) в тетрагидрофуране (164 мл), охлажденной до 0 С, добавляли по каплям 96% муравьиную кислоту (326 ммоль, 14,99 г) в течение периода 26 мин. Реакционную смесь перемешивали при 0 С в течение 30 мин, затем в течение периода 10 мин добавляли легкую суспензию(102 ммоль, 16,88 г) в тетрагидрофуране (66 мл). Реакционную смесь затем перемешивали при 22 С в течение 170 мин до того, как обрабатывали метанолом (10 мл). После перемешивания в течение 90 мин, реакционную смесь концентрировали в вакууме до масла, содержащего кристаллы. Смесь растворяли в метиленхлориде и подвергали препаративной хроматографии,элюируя с градиентом от 0 до 5% метанол:метиленхлорид в течение периода тридцати минут. Фракции, содержащие указанное в заголовке соединение, объединяли, концентрировали в вакууме, получая 13,46 г масла, которое медленно кристаллизовалось. Фракции, содержащие указанное в заголовке соединение и примеси, были повторно подвергнуты препаративной колоночной хроматографии в тех же самых условиях, описанных выше, получая дополнительные 2,61 г указанного в заголовке соединения. Т. пл. (С): 85 Масс-спектр (МСПД): m/z 193 (М). 1(дт, J = 7,2 Гц, 2 Н), 1,04 (дт, J = 7,1 Гц, 2 Н). Элементный анализ для С 11 Н 15NО 2: Вычислено: С 68,37; Н 7,82; N 7,25. Найдено: С 68,56; Н 7,81; N 7,49. 46 В. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-N-формил-N-этиламиноэтилфенокси)этил)оксазола. Указанное в заголовке соединение получали по существу так, как описано в вышеприведенном примере 4, за исключением того, что использовалиN-формил-N-этил-п-гидроксифенетиламин и в качестве реакционного раствора 0,7 М (ммоль спирта/мл тетрагидрофурана). После перемешивания при 24 С приблизительно в течение 22 ч реакционную смесь концентрировали в вакууме. Фильтрат концентрировали в вакууме до масла, обрабатывали этилацетатом и подвергали препаративной хроматографии. Материал элюировали 45% этилацетатом. Фракции, содержащие целевой продукт, концентрировали в вакууме, затем снова подвергали препаративной хроматографии. Материал элюировали с градиентом от 0 до 20% этилацетат (93% хлороформ:гексан) в течение периода тридцати минут. Фракции, содержащие целевой продукт, концентрировали в вакууме, затем снова подвергали препаративной хроматографии. Материал элюировали с градиентом от 5 до 30% ацетон/гексан в течение периода тридцати минут. Фракции, содержащие целевой продукт, концентрировали в вакууме, получая 3,01 г (19%) указанного в подзаголовке соединения в виде пены. Масс-спектр (МСПД): m/z 493 (М+1). 1(дт, J = 7,1 Гц, 3 Н). Элементный анализ для C30H40N2O4: Вычислено: С 73,14; Н 8,18; N 5,69. Найдено: С 73,30; Н 8,44; N 5,90. С. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-N-метил-N-этиламиноэтилфенокси)этил)оксазола. Серную кислоту (6,0 ммоль, 0,597 г) осторожно добавляли по каплям в течение периода восьми минут к охлажденной суспензии литийалюминийгидрида (12,2 ммоль, 0,462 г) в тетрагидрофуране (ТГФ, 18 мл). После того, как добавление было завершено, ледяную баню убирали. Приблизительно через один час после добавления реакционную смесь охлаждали до 0 С,затем в течение периода десяти минут добавляли раствор соединения стадии В в тетрагидрофуране (4 мл). Реакционную смесь перемешивали при 24 С в течение 3 ч, затем гасили водой(12,2 ммоль, 214 мкл). Затем добавляли хлороформ (200 мл), после чего 5 н. хлористоводородную кислоту (50 мл). Фазы разделяли и водную фазу экстрагировали хлороформом (2 х 50 мл). Объединенные органические фазы промывали солевым раствором (1 х 50 мл), затем сушили над хлоридом натрия, фильтровали и 47 концентрировали в вакууме, получая 5,8 г масла, которое содержит некоторое количество твердого компонента. Материал обрабатывали этилацетатом (250 мл), затем промывали насыщенным водным бикарбонатом натрия (2 х 50 мл). Органический слой сушили над сульфатом натрия, фильтровали, затем концентрировали в вакууме, получая 2,77 г масла. Материал обрабатывали хлороформом и подвергали препаративной хроматографии. Материал элюировали с элюентом от 0 до 10% (1% гидроксид аммония:метанол):хлороформ в течение периода 30 минут. Фракции, содержащие целевой продукт,концентрировали в вакууме, концентрировали в вакууме до масла. Этот материал растворяли в хлороформе, затем насыщали газообразным хлоридом водорода. Раствор концентрировали в вакууме, получая 1,35 г (43%) указанного в заголовке соединения в виде пены. Масс-спектрH ЯМР (ДМСО-d6):7,92 (с, 1 Н), 7,72 (с,2 Н), 7,54 (с, 1 Н), 7,21 (д, J = 8,6 Гц, 2 Н), 6,93 (д,J = 8, 6 Гц, 2 Н), 4,22 (т, J= 6,6 Гц, 2 Н), 3,19 (м,4 Н), 2,98 (м, 4 Н), 2,76 (д, J = 4,9 Гц, 3 Н), 1,41 (с,18 Н), 1,22 (т, J = 7,2 Гц, 3 Н). Элементный анализ для С 30 Н 40N2O40,7H2O: Вычислено: С 68,28; Н 8,48; N 5,31. Найдено: С 68,20; Н 8,41; N 5,35. Пример 15. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-N-этил-Nметиламинобутил)феноксиэтил)оксазола. А. Получение 4-(4-гидроксифенил)-нбутилбромида. Раствор трифенилфосфина (144,1 ммоль,37,80 г) в метиленхлориде (556 мл) обрабатывали бромом (144,1 ммоль, 23,03 г) до тех пор,пока не был получен устойчивый бледножелтый цвет. После перемешивания приблизительно 15 мин, в течение периода 15 мин добавляли раствор 4-(4-гидроксифенил)бутанола(96,1 ммоль, 15,97 г) и имидазола (192,2 ммоль,13,08 г) в метиленхлориде (355 мл). Приблизительно через 4 ч реакционную суспензию фильтровали и фильтрат уменьшали в объеме. К этому концентрированному фильтрату добавляли силикагель и суспензию концентрировали досуха. Этот материал фильтровали и первые шесть фракций элюировали 10% смесью этилацетат:гексан. Фракции от 7 до 12 элюировали 20% смесью этилацетат:гексан. Фракции от 7 до 10 объединяли, уменьшали в объеме, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 19,32 г (88%) указанного в заголовке соединения в виде масла. Масс-спектр (МСПД): m/z 230 (М+1). 1H ЯМР (CDCl3):7,03 (д, J = 8,4 Гц, 2 Н),6,75 (д, J = 8,4 Гц, 2 Н), 4,59 (с, 1 Н), 3,40 (т, J = 6,7 Гц, 2 Н), 2,56 (м, 2 Н), 1,83-1,90 (м, 2 Н), 1,701,77 (м, 2 Н). Элементный анализ для С 10 Н 13 ВrО: 48 Вычислено: С 52,42; Н 5,72. Найдено: С 52,24; Н 5,61. В. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-(4-бромбутил) феноксиэтил)оксазола. Указанное в заголовке соединение получали по существу так, как описано в примере 4, за исключением того, что использовали соединение стадии А. Реакционную смесь концентрировали в вакууме до масла. Масло обрабатывали хлороформом (25 мл), растирали, затем обрабатывали диатомовой землей и фильтровали через подушку диатомовой земли. Фильтрат уменьшали в объеме, затем подвергали препаративной хроматографии. Материал элюировали с градиентом от 20 до 35% диэтиловый простой эфир: гексан в течение периода 30 мин. Фракции 4-15 объединяли, концентрировали в вакууме, затем снова хроматографировали, элюируя с градиентом от 20 до 35% диэтиловый простой эфир:гексан в течение периода 30 мин. Фракции 8-16 объединяли, концентрировали в вакууме,затем снова хроматографировали, элюируя с градиентом от 5 до 20% этилацетат:(33% хлороформ:67% гексан) в течение периода 30 мин. Фракции 7-9 объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 10,51 г (49%) указанного в заголовке соединения. Масс-спектр (МСПД):= 7,4 Гц, 2 Н), 1,88 (м, 2 Н), 1,72 (м, 2 Н), 1,49 (с,18 Н). Элементный анализ для С 29 Н 38 ВrNО 3: Вычислено: С 65,90; Н 7,25; N 2,65. Найдено: С 66,14; Н 7,26; N 2,36. С. Получение гидрохлорида 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-N-этил-Nметиламинобутил)феноксиэтил)оксазола. Раствор N-метилэтиламина (7,8 ммоль,0,46 г) в диметилформамиде (21 мл) обрабатывали гидридом натрия (7,8 ммоль, 0,68 г). Суспензию нагревали при 35 С в течение 15 мин. Затем суспензию обрабатывали раствором соединения стадии В (8,5 ммоль, 4,51 г) в диметилформамиде (21 мл). Суспензию затем нагревали при 70 С в течение приблизительно 4,5 ч до того, как был добавлен дополнительный Nметилэтиламин (15,6 ммоль, 0,92 г). Через сорок пять минут реакционную смесь охлаждали до 22 С, обрабатывали этилацетатом (50 мл), гексаном (25 мл) и 10% водным сульфатом натрия(50 мл). Фазы разделяли и водную фазу экстрагировали смесью 2:1 этилацетат:гексан (3 х 75 мл). Объединенные органические слои промывали солевым раствором (2 х 100 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 4,16 г масла. Масло обрабатывали хлороформом, фильтрова 49 ли через подушку диатомового диоксида кремния и промывали хлороформом. Фильтрат подвергали препаративной хроматографии на силикагеле. Материал элюировали с градиентом от 0 до 10% (1% гидроксид аммония: метанол):хлороформ в течение периода тридцати минут. Фракции, содержащие целевой продукт,объединяли, концентрировали в вакууме, растворяли в хлороформе (100 мл), промывали смесью 1:1 насыщенный водный бикарбонат натрия:вода (50 мл), затем солевым раствором(50 мл). Органическую часть сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 1,6 г масла. Масло обрабатывали хлороформом (50 мл), затем насыщали газообразным хлоридом водорода. Этот раствор концентрировали в вакууме до пены. Пену обрабатывали тетрагидрофураном (ТГФ) и кипятили на паровой бане при медленном добавлении диизопропилового простого эфира. Тетрагидрофуран выпаривали, что приводило к выделению масляного продукта. Оставшийся растворитель декантировали и добавляли изопропиловый простой эфир (10 мл). Двухфазный раствор кипятили на паровой бане, растворитель декантировали и оставшийся материал выдерживали в высоком вакууме в течение ночи, получая 1,38 г указанного в заголовке соединения в виде пены. Масс-спектр (МСПД): m/z 506 (М). 1(с, 1 Н), 4,26 (т, J = 6,5 Гц, 2 Н), 3,08 (т, J = 6,5 Гц,2 Н), 2,88 (м, 3 Н), 2,67 (д, J = 4,9 Гц, 3 Н), 2,60 (т,J = 7,3 Гц, 2 Н), 1,66-1,85 (м, 3 Н), 1,38-1,48 (м,24 Н). Элементный анализ для С 32 Н 47 СlN2O3: Вычислено: С 70,76; Н 8,72; N 5,16. Найдено: С 70,52; Н 8,56; N 5,41. Пример 16. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(3-N-этил-Nметиламинопропил)фенокси)этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-(2-цианоэтил)феноксиэтил)оксазола. Указанное в заголовке соединение получали по существу так, как описано в примере 4, за исключением того, что использовали 3-(4 гидроксифенил)пропионитрил. Реакционную смесь концентрировали в вакууме до масла. Масло обрабатывали хлороформом (75 мл), растирали и фильтровали. Фильтрат промывали насыщенным водным бикарбонатом натрия (2 х 250 мл) и 10% бисульфатом натрия (1 х 250 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая темное масло. Масло обрабатывали метиленхлоридом и подвергали препаративной хроматографии на силикагеле. Материал элюировали с градиентом от 10 до 25% этилацетат:гексан в течение периода тридцать минут. Фракции, содержащие указанное в заголовке соединение, объединяли и концентрировали в вакууме, получая 29,57 г масла. Этот материал 50 снова подвергали препаративной хроматографии на силикагеле, элюируя с градиентом от 15 до 35% диэтиловый простой эфир:гексан в течение периода тридцать минут. Фракции, содержащие указанное в заголовке соединение,объединяли и концентрировали в вакууме, получая 20,57 г пены. Этот материал снова подвергали препаративной хроматографии на силикагеле, элюируя с градиентом от 10 до 30% ацетон:гексан в течение периода тридцать минут. Фракции, содержащие указанное в заголовке соединение, объединяли и концентрировали в вакууме, получая 14,71 г пены. Этот материал,содержащий следовое количество примесей,использовали в следующей стадии без дальнейшей очистки. Масс-спектр (МСПД): m/z 446 (М). 1H ЯМР (ДМСО-d6):7,92 (с, 1 Н), 7,73 (с,2 Н), 7,52 (с, 1 Н), 7,19 (д, J = 8,6 Гц, 2 Н), 6,91 (д,J = 8,6 Гц, 2 Н), 4,23 (т, 2 Н), 2,96 (т, 2 Н), 2,78 (м,4 Н), 1,42 (с, 18 Н). В. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-(2-формилэтил)феноксиэтил)оксазола. К охлажденному раствору соединения стадии А (32,9 ммоль, 14,68 г) в толуоле (105 мл) при -78 С добавляли 1,0 молярный раствор диизобутилалюминийгидрида (42,7 ммоль, 42,7 мл) в течение периода семнадцати минут. Затем реакционную смесь перемешивали при 22 С в течение 1 ч и гасили метанолом (4,1 мл). Суспензию охлаждали до 0 С и обрабатывали насыщенным раствором гидроксида аммония (300 мл). После перемешивания в течение 1,5 ч реакционную смесь обрабатывали 50% серной кислотой до тех пор, пока не получали двухфазный раствор. Смесь затем обрабатывали этилацетатом (250 мл) и фазы разделяли. Водную фазу экстрагировали этилацетатом (3 х 100 мл). Объединенные органические фазы промывали солевым раствором (2 х 200 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме до масла. Масло подвергали препаративной хроматографии на силикагеле. Материал элюировали с градиентом от 0 до 10% метанол: толуол в течение периода тридцать минут. Фракции, содержащие указанное в подзаголовке соединение, объединяли, концентрировали в вакууме, получая 11,76 г масла. Этот материал использовали в следующей стадии без дальнейшей очистки. Масс-спектр (МСПД): m/z 449 (М). 1 51 Указанное в заголовке соединение получали по существу так, как описано в примере 11,за исключением того, что использовали соединение стадии В и N-метилэтиламин. Материал подвергали препаративной хроматографии,элюируя с градиентом от 0 до 5% (1% гидроксид аммония:метанол):хлороформ в течение периода тридцать минут. Остальные фракции элюировали 5% (1% гидроксид аммония: метанол):хлороформ. Фракции, содержащие целевой продукт, объединяли, концентрировали в вакууме, растворяли в хлороформе (100 мл) и промывали насыщенным бикарбонатом натрия(10 мл) и водой (15 мл), затем водой (25 мл). Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат насыщали газообразным хлоридом водорода и концентрировали в вакууме, получая 1,61 г указанного в заголовке соединения в виде пены. Масс-спектр (МСПД): m/z 492 (М-НСl). 1(с, 18 Н), 1,39 (т, J = 7,3 Гц, 3 Н). Элементный анализ для С 31H45 Сl2 О 3 + 0,2 моль Н 2 О: Вычислено: С 69,89; Н 8,58; N 5,26. Найдено: С 69,88; Н 8,73; N 5,32. Пример 17. Гидрохлорид 2-(3,5-ди-третбутил-4-метоксифенил)-4-(2-(4-N-этил-Nметиламинометилфенокси)этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 метоксифенил)-4-(2-(4-формилфенокси)этил) оксазола. Раствор соединения примера 1D (8,4 ммоль, 3,54 г) и метилйодида (67,3 ммоль, 9,54 г) в тетрагидрофуране (40 мл) и диметилформамиде (4 мл) обрабатывали гидридом натрия (60% мас./мас., 16,8 ммоль, 0,67 г). После перемешивания в течение 31 ч при 22 С реакционную смесь обрабатывали водой (10 мл) и рН устанавливали от 12,6 до 5,4 1 н. хлористоводородной кислотой. Двухфазный раствор уменьшали в объеме для удаления тетрагидрофурана, затем добавляли этилацетат(50 мл). Фазы разделяли и органическую фазу сушили над сульфатом натрия и фильтровали. Фильтрат подвергали препаративной хроматографии на силикагеле, элюируя с градиентом от 20 до 45% этилацетат:гексан в течение периода тридцать минут. Фракции, содержащие указанное в подзаголовке соединение, объединяли и концентрировали в вакууме, получая 3,57 г масла. Материал использовали в следующей стадии без дальнейшей очистки. Масс-спектр (МСПД):J = 8,8 Гц, 2 Н), 4,36 (т, J = 6,5 Гц, 2 Н), 3,70 (с,3 Н), 3,11 (т, J = 6,5 Гц, 2 Н), 1,46 (с, 18 Н). В. Получение гидрохлорида 2-(3,5-ди-третбутил-4-метоксифенил)-4-(2-(4-N-этил-N-метиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали по существу так, как описано в примере 11,за исключением того, что использовали соединение стадии А. Материал подвергали препаративной хроматографии, элюируя с градиентом от 0 до 10% (1% гидроксид аммония: метанол):хлороформ в течение периода тридцати минут. Фракции, содержащие указанное в заголовке соединение, объединяли и концентрировали в вакууме, получая пену. Пену обрабатывали хлороформом, затем насыщали газообразным хлоридом водорода. Этот раствор концентрировали в вакууме, получая 2,2 г указанного в заголовке соединения в виде пены. Масс-спектр (МСПД): m/z 478 (М-НСl). 1(дд, J = 8,6 Гц, 2 Н), 4,09-4,31 (м, 4 Н), 3,68 (с,3 Н), 2,92-3,11 (м, 4 Н), 2,57 (д, J = 4,8 Гц, 3 Н),1,42 (с, 18 Н), 1,25 (т, J = 7,2 Гц, 3 Н). Элементный анализ для C30H43ClN2O3 + 0,2 моль Н 2 О: Вычислено: С 69,46; Н 8,43; N 5,40. Найдено: С 69,23; Н 8,47; N 5,53. Пример 18. Гидрохлорид 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-(4-диметиламинобутирил)фенилокси)этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-(4-хлорбутирил)фенилокси)этил)оксазола. К перемешиваемому раствору соединения примера 1 С (5,68 г, 17,92 ммоль) в тетрагидрофуране (54 мл) добавляли 4-хлор-4'-гидроксибутирофенон (3,56 г, 17,92 ммоль) и трифенилфосфин (5,16 г, 19,71 ммоль). После охлаждения до -20 С добавляли по каплям в течение 15 мин диэтилазодикарбоксилат (3,1 мл, 19,71 ммоль) в тетрагидрофуране (18 мл). Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 5 ч, в это время ее разбавляли диэтиловым простым эфиром и экстрагировали водой и солевым раствором. Органический слой сушили над сульфатом натрия, выпаривали досуха и хроматографировали на силикагеле, с использованием градиента гексан-ацетон, получая промежуточный хлоркетон (4,77 г, 53%). 1(5,09 г, 10,2 ммоль) в ацетоне (51 мл) добавляли йодид натрия (7,66 г, 51 ммоль). Реакционную смесь нагревали при 50 С в течение 28 ч, выпаривали досуха и снова растворяли в метиленхлориде и воде. Органический слой промывали солевым раствором, сушили над сульфатом натрия и выпаривали досуха, получая промежуточный йодкетон, который использовали без дополнительной очистки. Йодкетон растворяли в толуоле (30 мл), охлаждали до 0 С и обрабатывали безводным диметиламином (0,79 мл, 12 ммоль). Реакционную смесь нагревали до 80 С в течение 3 ч, затем оставляли для охлаждения до комнатной температуры. Белый осадок фильтровали, и фильтрат разбавляли этилацетатом и насыщенным бикарбонатом натрия. Органический слой промывали 0,1 н. тиосульфатом натрия и солевым раствором, сушили над сульфатом натрия, выпаривали досуха и хроматографировали на силикагеле с использованием градиента метиленхлорид/метанол, получая свободное основание (1,82 г, 35%). Свободное основание растворяли в метиленхлориде (50 мл),обрабатывали газообразным хлоридом водорода и выпаривали, получая целевой продукт (1,87 г,96%). 1(д, J = 4 Гц, 6 Н), 2,25 (м, 2 Н), 1,5 (с, 18 Н); МСПД 506 (M+-HCl); Элементный анализ для C31H43ClN2O4: Вычислено: С 68,55; Н 7,98; N 5,16. Найдено: С 68,36; Н 7,90; N 5,34. Пример 19. Моногидрат гидрохлорида 2(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-(1 диметиламиноэтил)фенилокси)этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-ацетилфенилокси)этил) оксазола. К перемешиваемому раствору 10 г (31,5 ммоль) соединения вышеуказанного примера 1 С в тетрагидрофуране (95 мл) добавляли 4 гидроксиацетофенон (4,29 г, 31,5 ммоль) и трифенилфосфин (9,09 г, 34,7 ммоль). После охлаждения до -20 С добавляли по каплям в течение 15 мин диэтилазодикарбоксилат (5,5 мл, 34,7 ммоль) в тетрагидрофуране (31 мл). Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 2,5 ч, в это время ее разбавляли диэтиловым простым эфиром и экстрагировали водой и солевым раствором. Органический слой сушили над сульфатом натрия, выпаривали досуха и хроматографировали на силикагеле, с использованием градиента толуол-этилацетат, получая указанное в подзаголовке соединение (8,5 г, 62%). 1(с, 1 Н), 4,35 (т, J = 7 Гц, 2 Н), 3,1 (т, J = 7 Гц, 2 Н),2,55 (с, 3 Н), 1,5 (с, 18 Н); МСПД 435 (М+). В. Получение гидрохлорида 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-(1-диметиламиноэтил)фенилокси)этил)оксазола. Указанное в заголовке соединение получали, по существу, по методике в вышеописанном примере 1 Е с использованием соединения стадии А, 1,23 г (19,5 ммоль) цианоборогидрида натрия и диметиламина (19,4 мл, 293 ммоль),нагревания до 60 С в течение 24 ч. Органический слой хроматографировали на силикагеле с использованием градиента метиленхлорид/метанол, получая свободное основание, которое растворяли в метиленхлориде, обрабатывали газообразным хлоридом водорода и выпаривали, получая 8,31 г (80%) указанного в заголовке соединения. 1(с, 2 Н), 7,6 (с, 1 Н), 7,45 (д, J = 9 Гц, 2 Н), 6,95 (д,J = 9 Гц, 2 Н), 5,8 (с, 1 Н), 4,4 (т, J = 7 Гц, 2 Н),4,15 (м, 1 Н), 3,25 (т, J = 7 Гц, 2 Н), 2,7 (д, J = 4 Гц, 3 Н), 2,55 (д, J = 4 Гц, 3 Н), 1,85 (д, J = 7 Гц,3 Н), 1,5 (с, 18 Н). МСПД 464 (M+-HCl); Элементный анализ для С 29 Н 41 СlN2O3H2O: Вычислено: С 67,10; Н 8,35; N 5,40. Найдено: С 67,00; Н 8,04; N 5,24. Пример 20. Гидрат гидрохлорида 2-(3,5 ди-трет-бутил-4-гидроксифенил)-4-(2-(4-N-метил-N-этиламинометил-3-метилфенокси)этил) оксазола. А. Получение 3-метилаллилоксибензола. м-Крезол, 10,4 мл (100 ммоль), 10,8 мл(125 ммоль) аллил-бромида и 16,56 г (120 ммоль) карбоната калия перемешивали в 50 мл ацетона и кипятили с обратным холодильником при перемешивании в атмосфере азота в течение 18 ч. Реакционную смесь охлаждали, нерастворимую неорганическую часть отделяли фильтрованием и фильтрат выпаривали, получая 14,0 г (95%) указанного в подзаголовке продукта,который использовали без дополнительной очистки. ЯМР (CDCl3):2,33 (с, 3 Н), 4,51-4,54 (м,2 Н), 5,26-5,45 (м, 2 Н), 6,00-6,13 (м, 1 Н), 6,726,78 (м, 2 Н), 7,17 (т, 1 Н, J = 9 Гц). В. Получение 4-аллилокси-2-метилбензальдегида.N-метилформанилид, 19,4 мл (158 ммоль),охлаждали до 13 С, когда он начинал отверждаться. При перемешивании в атмосфере азота добавляли 13,7 мл (147 ммоль) оксихлорида фосфора. Через 25 мин температура была 45 С,и реакционная смесь снова начинала отверждаться. Добавляли 14 г (95 ммоль) соединения стадии А, и смесь перемешивали и нагревали на масляной бане с 70 С. Реакция была экзотермической и реакционная смесь нагревалась до 95 С. Перемешивание продолжали в атмосфере азота в течение 30 мин. Баню удаляли и, когда 55 температура достигала 35 С, смесь растворяли в хлороформе. Добавляли лед и слои разделяли и промывали один раз водой, два раза насыщенным бикарбонатом натрия, снова один раз водой и один раз солевым раствором. Органический слой хроматографировали на 450 мл диоксида кремния с элюированием хлороформом, получая 13,54 г (81%) указанного в подзаголовке продукта, который использовали без дополнительной очистки. ЯМР (CDCl3):2,64 (с, 3 Н), 4,61 (м, 2 Н),5,30-5,49 (м, 2 Н), 6,00-6,12 (м, 1 Н), 6,74-6,87 (м,2 Н), 7,73 (м, 1 Н), 10,11 (с, 1 Н). С. Получение 2-метил-4-гидроксибензальдегида. Соединение стадии В, 13,54 г (76,9 ммоль),1,72 г (7,69 ммоль) ацетата палладия и 12,09 г(46,2 ммоль) трифенилфосфина смешивали в колбе на 250 мл. Добавляли 3,2 мл (84,6 ммоль) муравьиной кислоты и реакционную смесь перемешивали с завихрением. В пределах 15 с реакционная смесь вспенивалась, проявляла экзотермичность и образовывала смолу, которую растворяли в этилацетате, промывали один раз бикарбонатом натрия и один раз солевым раствором. Органический слой хроматографировали на 350 мл диоксида кремния, элюируя 20%, затем 40% смесью этилацетат/гексан. Фракции объединяли, и продукт кристаллизовали из смеси метиленхлорид/гексан, получая 3,61 г (35%) продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):2,50 (с, 3 Н), 6,70 (д, 1 Н, J = 2 Гц), 6,78 (дд, 1 Н, J = 2 Гц, 9 Гц), 7,75 (д, 1 Н, JD. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-формил-3-метилфенилокси)этил)оксазола. Указанное в подзаголовке соединение получали из 8,0 г (25,2 ммоль) соединения примера 1 С по существу в соответствии с методикой в примере 4 А, используя 3,61 г (26,5 ммоль) соединения стадии С, 6,62 г (25,2 ммоль) трифенилфосфина и 3,97 мл (25,2 ммоль) диэтилазодикарбоксилата. Сырой продукт хроматографировали на диоксиде кремния, элюируя метиленхлоридом. Подходящие фракции объединяли и выпаривали, получая 5,05 г (46%) указанного в подзаголовке продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):1,48 (с, 18 Н), 2,64 (с, 3 Н, J= 5 Гц), 3,11 (т, 2 Н, J = 5 Гц), 4,35 (т, 2 Н, J = 5 Гц), 5,54 (с, 1 Н), 6,77 (д, 1 Н, J = 2 Гц), 6,86 (дд,1 Н, J = 2 Гц, 9 Гц), 7,51 (с, 1 Н), 7,74 (д, 1 Н, J = 9 Гц), 7,86 (с, 1 Н), 10,11 (с, 1 Н). Е. Получение гидрата гидрохлорида 2-(3,5 ди-трет-бутил-4-гидроксифенил)-4-(2-(4-N-метил-N-этиламинометил-3-метилфенокси) этил)оксазола. Указанное в заголовке соединение получали из 4,54 г (10,4 ммоль) соединения стадии D, 001713 56 по существу, в соответствии с методикой вышеописанного примера 1 Е с использованием 8,9 мл(104 ммоль) метилэтиламина, 5,59 мл (104 ммоль) уксусной кислоты и 693 мг (11 ммоль) цианоборогидрида натрия. Такая реакция давала 1,89 г (35%) указанного в заголовке продукта в виде белой пены. МСПД - M+ 478; Элементный анализ для (C30H42N2O3HCl 0,75 H2O): Вычислено: С 68,02; Н 8,48; N 5,35. Найдено: С 68,16; Н 8,48; N 5,30. ЯМР (CDCl3):1,41 (т, 3 Н, J = 7 Гц), 1,48(м, 1 Н), 3,24 (м, 2 Н), 4,07-4,27 (м, 3 Н), 5,84 (с,1 Н), 6,80 (м, 2 Н), 7,63 (м, 2 Н), 8,07 (с, 2 Н). Пример 21. Полугидрат гидрохлорида 2(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(3 хлор-4-N-метил-N-этиламинометилфенокси) этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(3-хлор-4-формилфенокси) этил)оксазола. Указанное в подзаголовке соединение получали из 6,34 г (20 ммоль) соединения примера 1 С по существу в соответствии с методикой в примере 4 А, используя 3,60 г (23 ммоль) 2-хлор 4-гидроксибензальдегида, 6,03 г (23 ммоль) трифенилфосфина и 3,62 мл (23 ммоль) диэтилазодикарбоксилата. Сырой продукт хроматографировали, элюируя метиленхлоридом. Подходящие фракции объединяли и выпаривали,получая 5,64 г (62%) указанного в подзаголовке продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):1,48 (с, 18 Н), 3,09 (т, 2 Н, J(дд, 1 Н, J = 2 Гц, 9 Гц), 6,97 (д, 1 Н, J = 2 Гц),7,49 (с, 1 Н), 7,84 (с, 2 Н), 7,87 (д, 1 Н, J = 9 Гц),10,32 (с, 1 Н). В. Получение полугидрата гидрохлорида 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(3 хлор-4-N-метил-N-этиламинометилфенокси) этил)оксазола. Указанное в заголовке соединение получали из 4,58 г (10 ммоль) соединения стадии А по существу в соответствии с методикой вышеописанного примера 1 Е с использованием 6,54 мл(100 ммоль) метилэтиламин а, 5,75 мл (100 ммоль) уксусной кислоты и 661 мг (10,5 ммоль) цианоборогидрида натрия. Такая реакция давала 1,24 г (23%) указанного в заголовке соединения в виде белой пены. МСПД - М+ 498; Элементный анализ для (С 29 Н 39N2O3 Сl НСl0,5H2O): Вычислено: С 63,96; Н 7,59; N 5,14. Найдено: С 63,83; Н 7,83; N 5,10. ЯМР (CDCl3):1,47 (с, 21 Н), 2,65 (д, 3 Н, J 57 Пример 22. Полугидрат гидрохлорида 2(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(3 гидрокси-4-N-метил-N-этиламинометилфенокси)этил)оксазола. А. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(3-гидрокси-4-формилфенокси)этил)оксазола. Указанное в подзаголовке соединение получали из 12,68 г (40 ммоль) соединения примера 1 С по существу в соответствии с методикой в вышеописанном примере 4 А, используя 6,35 г(46 ммоль) 2,4-дигидроксибензальдегида, 12,05 г (46 ммоль) трифенилфосфина и 7,24 мл (46 ммоль) диэтилазодикарбоксилата. Сырой продукт хроматографировали на диоксиде кремния,элюируя метиленхлоридом. Подходящие фракции объединяли и выпаривали растворитель,получая 9,2 г (53%) указанного в подзаголовке продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):1, 49 (с, 18 Н), 3,09 (т, 2 Н, J(д, 1 Н, J = 2 Гц), 6,55 (дд, 1 Н, J = 2 Гц, 9 Гц),7,42 (д, 1 Н, J = 9 Гц), 7,50 (с, 1 Н), 7,84 (с, 2 Н),9,71 (с, 1 Н), 11,47 (с, 1 Н). В. Получение полугидрата гидрохлорида 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(3 гидрокси-4-N-метил-N-этиламинометилфенокси)этил)оксазола. Указанное в заголовке соединение получали из 3,18 г (7,28 ммоль) соединения стадии А по существу в соответствии с методикой вышеописанного примера 1 Е с использованием 4,76 мл (72,8 ммоль) метилэтиламина, 4,16 мл (72,8 ммоль) уксусной кислоты и 481 мг (7,64 ммоль) цианоборогидрида натрия, и реакционную смесь оставляли для протекания реакции в течение 2 дней. Такая реакция давала 1,23 г (33%) указанного в заголовке продукта в виде белой пены. МСПД - М+ 480; Элементный анализ для (C29H40N2O4HCl 0,5H2O): Вычислено: С 66,21; Н 8,05; N 5,32. Найдено: С 66,01; Н 8,49; N 5,09. ЯМР (CDCl3):1,41 (т, 3 Н, J = 7 Гц), 1,48(м, 2 Н), 4,07-4,27 (м, 3 Н), 6,01 (с, 1 Н), 6,36 (д,1 Н, J = 9 Гц), 6,94 (д, 1 Н, J = 2 Н), 7,26 (м, 1 Н),7,84 (с, 1 Н), 8,13 (с, 2 Н), 10,75 (шир. с, 1 Н). Пример 23. Гидрат гидрохлорида 2-(3,5 ди-трет-бутил-4-гидроксифенил)-4-(2-(4-Nметил-N-этиламинометил-3,5-диметилфенилокси)этилоксазола. А. Получение 3,5-диметилаллилоксибензола. 3,5-Диметилфенол, 12,2 г (100 ммоль), 10,8 мл (125 ммоль) аллилбромида и 16,56 г (120 ммоль) карбоната калия растворяли и затем кипятили с обратным холодильником в 50 мл ацетона при перемешивании в атмосфере азота в течение 18 ч. Реакционную смесь охлаждали, 001713 58 нерастворимую неорганическую часть отделяли фильтрованием и фильтрат выпаривали, получая 16,2 г (100%) указанного в подзаголовке продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):2,29 (с, 6 Н), 4,50 (м, 2 Н),5,25-5,44 (м, 2 Н), 5,99-6,12 (м, 1 Н), 6,56 (с, 2 Н),6,60 (с, 1 Н). В. Получение 4-аллилокси-2,6-диметилбензальдегида.N-Метилформанилид, 20,5 мл (166 ммоль),охлаждали до 13 С, когда он начинал отверждаться. При перемешивании в атмосфере азота добавляли 14,4 мл (155 ммоль) оксихлорида фосфора. Через 25 мин температура была 45 С. При перемешивании добавляли 16,2 г (100 ммоль) 3,5-диметилаллиоксибензола, полученного, как описано выше, и нагревали на масляной бане с 70 С. Реакция была экзотермической и температура повысилась до 93 С, и перемешивание продолжали в атмосфере азота в течение 30 мин. Баню удаляли и, когда температура достигала 35 С, продукт растворяли в хлороформе. Добавляли лед, слои разделяли и промывали один раз водой, два раза бикарбонатом натрия, один раз водой и один раз солевым раствором. Продукт хроматографировали на 500 мл диоксида кремния с элюированием хлороформом, получая 9,67 г (51%) указанного в подзаголовке продукта, который использовали без дополнительной очистки. ЯМР (CDCl3):2,60 (с, 6 Н), 4,59 (м, 2 Н),5,29-5,45 (м, 2 Н), 6,01-6,11 (м, 1 Н), 6,60 (с, 2 Н),10,47 (с, 1 Н). С. Получение 2,6-диметил-4-гидроксибензальдегида. 4-Аллилокси-2,6-диметилбензальдегид,9,67 г (50,9 ммоль), 1,14 г (5,09 ммоль), ацетата палладия II и 8,00 г (30,5 ммоль) трифенилфосфина смешивали в колбе. Добавляли 2,11 мл (56 ммоль) муравьиной кислоты и смесь перемешивали с завихрениями на масляной бане с 80 С. В пределах 15 с реакционная смесь проявляла экзотермичность и становилась очень темной. Смолу растворяли в этилацетате, промывали один раз бикарбонатом натрия, один раз водой и один раз солевым раствором, затем хроматографировали на 350 мл диоксида кремния, используя 20%, затем 40% этилацетат/гексан. Фракции объединяли и кристаллизовали из смеси метиленхлорид/гексан, получая 3,90 г (51%) указанного в подзаголовке продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):2,64 (с, 6 Н), 6,74 (с, 2 Н),7,26 (шир. с, 1 Н), 10,09 (с, 1 Н).D. Получение 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-формил-3,5-диметилфенилокси)этил)оксазола. Указанное в заголовке соединение получали из 7,85 г (24,8 ммоль) соединения примера 1 С по существу в соответствии с методикой в(24,8 ммоль) диэтилазодикарбоксилата. Реакционную смесь перемешивали в атмосфере азота в течение 18 ч. Добавляли 1,38 мл 30% пероксида водорода и реакционную смесь перемешивали в течение дополнительных 30 мин, выпаривали,растворяли в 40 мл метиленхлорида и помещали в морозильник. Затем фильтрованием отделяли диэтоксикарбонилгидразин и фильтрат хроматографировали, элюируя метиленхлоридом. Подходящие фракции объединяли и выпаривали, получая 6,73 г (60%) указанного в подзаголовке продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):1,48 (с, 18 Н), 2,59 (с, 6 Н),3,12 (т, 2 Н, J = 9 Гц), 4,34 (т, 2 Н, J = 9 Гц), 5,58(с, 1 Н), 6,61 (с, 2 Н), 7,52 (с, 1 Н), 7,89 (с, 2 Н),10,47 (с, 1 Н). Е. Получение моногидрата гидрохлорида 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4N-метил-N-метиламинометил-3,5-диметилфенилокси)этил)оксазола. Указанное в заголовке соединение получали, по существу, в соответствии с методикой вышеописанного примера 1 Е с использованием 5,02 г (11,2 ммоль) 2-(3,5-ди-трет-бутил-4 гидроксифенил)-4-(2-(4-формил-3,5-диметилфенилокси)этил)оксазола, 9,59 мл (112 ммоль) метилэтиламина, 6,40 мл (112 ммоль) уксусной кислоты и 741 мг (11,76 ммоль) цианоборогидрида натрия. Добавляли этилацетат и смесь промывали один раз водой, один раз насыщенным бикарбонатом натрия, два раза водой и один раз солевым раствором. Смесь сушили,выпаривали для удаления органических компонентов и хроматографировали, элюируя смесью 92:8 метиленхлорид/метанол. Фракции объединяли, выпаривали для удаления органических компонентов и растворяли в смеси метиленхлорид/изопропиловый простой эфир. Через раствор барботировали газообразный хлорид водорода и смесь концентрировали и растирали с изопропиловым простым эфиром, получая 4,47 г(69%) белой пены. МСПД - М+ 492; Элементный анализ для C31H44N2O3HCl 60 А. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-формил-2-хлорфенилокси) этил)оксазола. Указанное в подзаголовке соединение получали из 3,17 г (10 ммоль) соединения примера 1 С, 1,72 г (11 ммоль) 3-хлор-4-гидроксибензальдегида, 2,62 г (10 ммоль) трифенилфосфина и 1,57 мл (10 ммоль) диэтилазодикарбоксилата, по существу, в соответствии с методикой в вышеописанном примере 4 А, продукт реакции хроматографировали, элюируя 4% смесью метанол/метиленхлорид. Подходящие фракции объединяли и выпаривали, получая 3,51 г (77%) продукта, который использовали без дальнейшей очистки. ЯМР (CDCl3):1,48 (с, 18 Н), 3,17 (т, 2 Н, J(с, 1 Н). В. Получение гидрохлорида 2-(3,5-ди-третбутил-4-гидроксифенил)-4-(2-(4-N-метил-Nэтиламинометил-2-хлорфенилокси)этил)оксазола. Указанное в заголовке соединение получали из 1,75 г соединения стадии А, по существу,в соответствии с методикой в примере 9 с использованием 0,66 мл (7,7 ммоль) метилэтиламина, 2,28 мл (7,7 ммоль) изопропоксида титанаIV и 220 мг (5,74 ммоль) борогидрида натрия, за исключением того, что восстановление проводили при перемешивании в течение 18 ч. Добавляли аммиак (6,3 мл, 2 н.), получая густую суспензию. Добавляли метиленхлорид и диатомовую землю и суспензию фильтровали через диатомовую землю. Фильтрат промывали один раз солевым раствором, сушили и выпаривали для удаления органических компонентов и хроматографировали, элюируя смесью 90:5:0,5 метиленхлорид/метанол/концентрированный аммиак. Фракции объединяли, выпаривали для удаления растворителя и растворяли в смеси метиленхлорид/изопропиловый простой эфир. Через раствор барботировали газообразный хлорид водорода и материал концентрировали и растирали с изопропиловым простым эфиром, получая 1,21 г (59%) белой пены. МСПД - М+ 498; Элементный анализ для С 29 Н 39N2O3 СlНСl: Вычислено: С 65,04; Н 7,53; N 5,23. Найдено: С 65,30; Н 7,72; N 5,22. ЯМР (CDCl3):1, 48 (м, 21 Н), 2,63 (д, 3 Н,J = 5 Гц), 2,88-2,92 (м, 1 Н), 3,15 (м, 3 Н, J = 5 Гц),3,97-4,16 (м, 2 Н), 4,34 (т, 2 Н, J = 5 Гц), 5,53 (с,1 Н), 7,03 (д, 1 Н, J = 9 Гц), 7,48 (д, 1 Н, J = 2 Н),7,60 (с, 1 Н), 7,65 (дд, 1 Н, J = 2 Гц, 9 Гц), 7,85 (с,1 Н). Пример 25. Полугидрат гидрохлорид 2(3,5-ди-трет-бутил-4-гидроксифенил)-4-(2-(4-Nметил-N-этиламинометил-1-нафтилокси)этил)оксазола.
МПК / Метки
МПК: A61K 31/427, C07D 271/12, A61P 25/16
Метки: полезные, соединения, средств, нейрозащитных, использования, качестве
Код ссылки
<a href="https://eas.patents.su/30-1713-soedineniya-poleznye-dlya-ispolzovaniya-v-kachestve-nejjrozashhitnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, полезные для использования в качестве нейрозащитных средств</a>
Предыдущий патент: Способ загрузки или дозагрузки величины денежной суммы на карту-носитель информации
Следующий патент: Производные 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола
Случайный патент: Адгезионная композиция на основе привитого полиэтилена












