Непептидные ингибиторы vla-4-зависимого клеточного связывания, полезные в лечении воспалительных, аутоиммунных и респираторных заболеваний
Номер патента: 4792
Опубликовано: 26.08.2004
Авторы: Даплантир Аллен Джейкоб, Чупак Луи Стэнли, Майлиси Энтони Джон
Формула / Реферат
1. Соединение формулы (1.0.0)
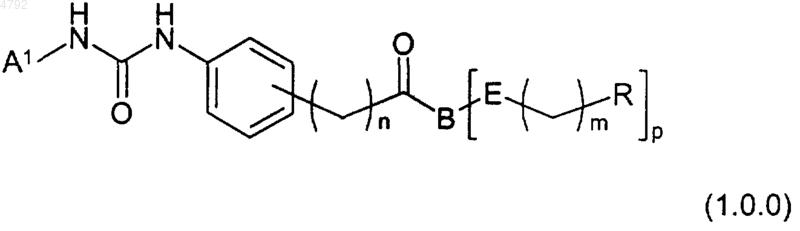
и его фармацевтически приемлемые соли и другие пролекарственные производные,
где A1 представляет собой фенил или пиридил, каждый возможно замещенный R10 в количестве от 1 до 2;
B независимо выбран из группы, состоящей из следующего:
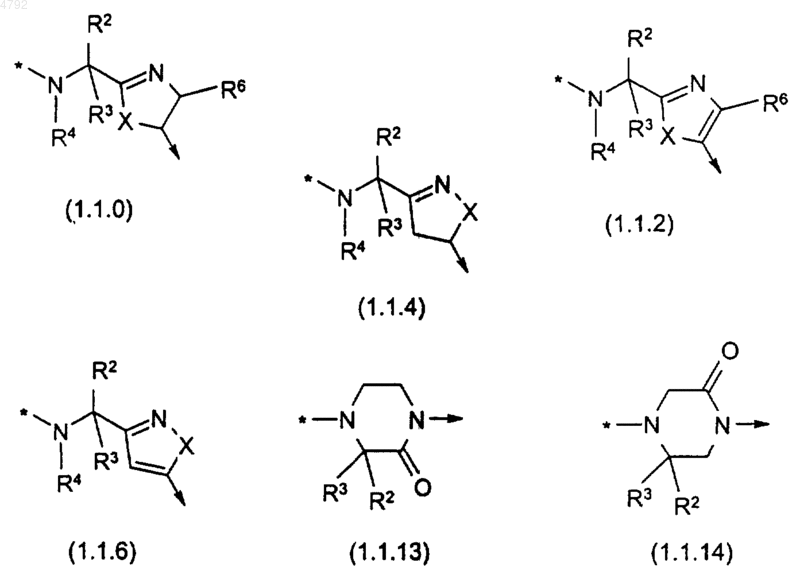
где символ * указывает место присоединения группировки, представленной каждой формулой с (1.1.0) по (1.1.14) к группировке
в формуле (1.0.0), а символ R показывает место присоединения группировки, представленной каждой формулой с (1.1.0) по (1.1.14) к группировке E в формуле (1.0.0);
E представляет собой одинарную связь, -CH=CH- или группировку формулы (1.9.0)
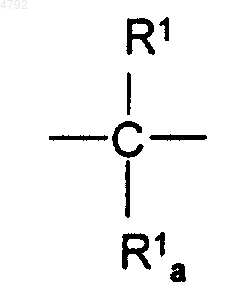
где R1a представляет собой водород, когда R1 имеет значение одновалентного заместителя, и R1a представляет собой одинарную связь, когда R1 имеет значение двухвалентного заместителя;
X представляет собой -O- или -S(=O)q-;
m равно целому числу, которое независимо выбрано из 0, 1 и 2;
n равно целому числу, которое независимо выбрано из 1 и 2;
p равно целому числу, которое независимо выбрано из 1 и 2, при условии, что p должно быть выбрано как 1, если B выбрано как формула (1.1.2), (1.1.6), (1.1.13) или (1.1.14);
q равно целому числу, которое независимо выбрано из 0 и 2;
R независимо выбран из группы, состоящей из тетразолила, -C(=O)-OR5, -C(=O)(CH2)kC(=O)OR5, -C(=O)-NH-S(=O)2R5;
где k равно целому числу, которое независимо выбрано из 0, 1 и 2;
R1 независимо выбран из группы, состоящей из водорода или (C1-C6)алкила;
R2 и R3, каждый независимо, выбраны из группы, состоящей из водорода; (C1-C4)алкила, замещенного R13 в количестве от 0 до 1; или R2 и R3, взятые вместе, образуют (C3-C7)карбоциклическое кольцо; или R2 или R3, взятые вместе с R4 и атомами углерода и азота, к которым они соответственно присоединены, образуют 5-членный насыщенный азотсодержащий гетероцикл;
R4 представляет собой водород;
R5 представляет собой водород или (C1-C4)алкил;
R6 представляет собой водород;
R10 независимо выбран из группы, состоящей из F, Cl, -OH, (C1-C4)алкила или (C1-C4)алкокси; и
R13 представляет собой фенил.
2. Соединение по п.1, где n равно целому числу 1, что дает метиленовый мостик.
3. Соединение по п.1, где указанный компонент
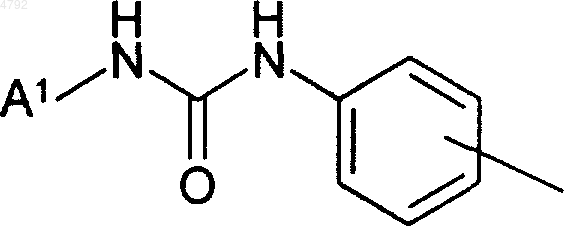
и указанный метиленовый мостик, присоединенный к нему, образуют группировку, выбранную из группы, состоящей из 3-метокси-4-(N'-фенилмочевина)фенилметила-, 4-(N'-фенилмочевина)фенилметила-, 4-(N'-(2-метилфенил)мочевина)фенилметила-, 4-(N'-(2-метоксифенил)мочевина)фенилметила-, 3-метокси-4-(N'-(2-метилфенил)мочевина)фенилметила-, 4-(N'-(2-пиридил)мочевина)фенилметила-, 4-(N'-(2-фторфенил)мочевина)фенилметила-, 4-(N'-(2-хлорфенил)мочевина)фенилметила-, 4-(N'-(2-хлорфенил)мочевина)-3-метоксифенилметила-, 4-(N'-(4-изопропилфенил)мочевина)фенилметила- и 4-(N'-(о-толил)мочевина)пирид-5-илметила-.
4. Соединение по п.1, где B выбран из группы, состоящей из группировок формул (1.1.2) и (1.1.6)
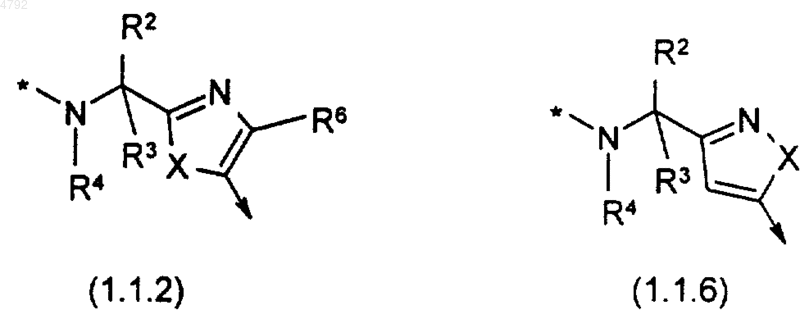
где символ * и символ R такие, как определено ранее; и где X представляет собой кислород или серу.
5. Соединение по п.1, где один из R2 и R3 представляет собой водород, а другой представляет собой изобутил.
6. Соединение по п.1, где R представляет собой COOH.
7. Соединение по п.1, где указанное соединение представляет собой
3-(3-изобутил-2-оксо-4-{[4-(3-о-толилуреидо)фенил]ацетил}пиперазин-1-ил)масляную кислоту,
3-[3-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)изоксазол-5-ил]пропионовую кислоту.
[2-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}-415-дигидро)оксазол-5-ил]уксусную кислоту,
(3-бензил-2-оксо-4-{[4-(3-о-толилуреидо)фенил]ацетил}пиперазин-1-ил)пропионовую кислоту,
3-бензо[1,3]диоксол-5-ил-3-(3-изобутил-2-оксо-4-{[4-(3-о-толилуреидо)фенил]ацетил}пиперазин-1-ил)пропионовую кислоту,
3-[5-(2-карбоксиэтил)-3-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)-4,5-дигидроизоксазол-5-ил]пропионовую кислоту,
3-[3-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)-4,5-дигидроизоксазол-5-ил]пропионовую кислоту,
[2-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)оксазол-5-ил]пропионовую кислоту,
3-[3-(1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)изоксазол-5-ил]пропионовую кислоту,
[3-(3-метил-1-{2-[4-(3-пиридин-2-илуреидо)фенил]ацетиламино}бутил)изоксазол-5-ил]пропионовую кислоту,
[2-(3-метил-1-{2-[3-пиридин-2-илуреидо]фенил}ацетиламино)тиазол-5-ил]пропионовую кислоту,
4-[3-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)изоксазол-5-ил]масляную кислоту,
3-[2-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)тиазол-5-ил]пропионовую кислоту,
3-(3-[3-метил-1-2-{4-[3-(4-метилпиридин-3-ил)уреидо]фенил}бутил]изоксазол-5-ил)пропионовую кислоту,
3-{2-[1-(2-{4-[3-(2-хлорфенил)уреидо]фенил}ацетиламино)-3-метилбутил]тиазол-5-ил}пропионовую кислоту,
3-{2-[1-(2-{4-[3-(2-метоксифенил)уреидо]фенил}ацетиламино)-3-метилбутил]тиазол-5-ил}пропионовую кислоту,
3-{2-[1-(2-{4-[3-(2-фторфенил)уреидо]фенил}ацетиламино)-3-метилбутил]тиазол-5-ил}пропионовую кислоту,
3-[3-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)изоксазол-5-ил]акриловую кислоту,
3-{2-[1-(2-{4-[3-(2,6-дихлорфенил)уреидо]фенил}ацетиламино)-3-метилбутил]тиазол-5-ил}пропионовую кислоту,
3-{2-[1-(2-{4-[3-(2,6-диметилфенил)уреидо]фенил}ацетиламино)-3-метилбутил]тиазол-5-ил}пропионовую кислоту,
3-{2-[1-(2-{4-[3-(2-хлор-6-метилфенил)уреидо]фенил}ацетиламино)-3-метилбутил]тиазол-5-ил}пропионовую кислоту,
3-[2-(3-метил-1-{2-[4-(3-фенилуреидо)фенил]ацетиламино}бутил)тиазол-5-ил]пропионовую кислоту,
N-гидрокси-3-[2-(3-метил-1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)тиазол-5-ил]пропионовую кислоту,
3-{3-[1-(2-{4-[3-(2-хлорфенил)уреидо]фенил}ацетиламино)-3-метилбутил]изоксазол-5-ил}пропионовую кислоту,
3-[2-(1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}-бут-3-енил)тиазол-5-ил]пропионовую кислоту,
этиловый эфир 3-{3-[1-(2-{4-[3-(2-хлорфенил)уреидо]фенил}ацетиламино)-3-метилбутил]изоксазол-5-ил}-3-оксопропионовой кислоты,
3-[2-(1-{2-[4-(3-о-толилуреидо)фенил]ацетиламино}бутил)тиазол-5-ил]пропионовую кислоту,
N-{1-[5-(3-метансульфониламино-3-оксопропил)тиазол-2-ил]-3-метилбутил}-2-[4-(3-о-толилуреидо)фенил]ацетамид,
2-{4-[3-(2-хлорфенил)уреидо]фенил}-N-{1-[5-(3-метансульфониламино-3-оксопропил)тиазол-2-ил]-3-метилбутил}ацетамид,
3-[2-({2-[4-(3-о-толилуреидо)фенил]ацетиламино}метил)тиазол-5-ил]пропионовую кислоту,
3-{2-[(2-{4-[3-(2-хлорфенил)уреидо]фенил}ацетиламино)метил]тиазол-5-ил}пропионовую кислоту,
3-[2-(1-{2-[4-(3-о-толилуреидо)фенил]ацетил}пирролидин-2-ил)тиазол-5-ил]пропионовую кислоту.
8. Фармацевтическая композиция для предупреждения, ингибирования, подавления или уменьшения клеточной адгезии и являющихся ее результатом или ассоциированных с ней последующих патогенных процессов, опосредованных VLA-4 (очень поздним антигеном-4), содержащая соединение формулы (1.0.0) по п.1 в качестве активного ингредиента вместе с фармацевтически приемлемым носителем для указанного соединения.
9. Фармацевтическая композиция по п.8 для лечения астмы, рассеянного склероза, ревматоидного артрита, остеоартрита, воспалительного кишечного заболевания, псориаза, отторжения трансплантата органа у хозяина, атеросклероза и других заболеваний, опосредованных VLA-4 или связанных с ним.
10. Фармацевтическая композиция по п.8, дополнительно содержащая один или более чем один терапевтический агент.
11. Фармацевтическая композиция по п.8, где указанный один или более чем один терапевтический агент выбран(ы) из группы, состоящей по существу из противовоспалительных кортикостероидов, нестероидных противовоспалительных агентов, бронхолитических средств, антиастматических агентов, иммунодепрессантов, иммуностимуляторов, антиметаболитов, противопсориазных средств и противодиабетических средств.
12. Фармацевтическая композиция по п.8, где указанный терапевтический агент выбран из группы, состоящей по существу из теофиллина, сульфасалазина, аминосалицилатов, циклоспорина, FK-506, рапамицина, циклофосфамида, метотрексата и интерферонов.
Текст
1 Настоящее изобретение относится к соединениям, которые являются непептидильными по структуре и обладают активностью сильнодействующих ингибиторов связывания очень позднего антигена-4 (VLA-4, 41, CD49d/CD29) с такими белками, как фактор васкулярной клеточной адгезии-1 (VCAM-1), домен HepII/IIICS(область CS-1) фибронектина и остеопонтин. Как таковые, они полезны в ингибировании клеточной адгезии и являющихся ее результатом или ассоциированных с ней последующих патогенных процессов, опосредованных VLA-4. Соединения и фармацевтические композиции по настоящему изобретению можно применять для лечения многих воспалительных, аутоиммунных и респираторных заболеваний, особенно астмы. Предпосылки изобретения Одним из наиболее фундаментальных процессов, необходимых для нормальной защиты хозяина, является регулируемая направленная миграция лейкоцитов из сосудистой сети. Эта система построена таким образом, чтобы обеспечить нормальную рециркуляцию лейкоцитов, а также обеспечивает быструю экстравазацию лейкоцитов в участки поражения, что является одним из центральных патогенных механизмов воспалительных, респираторных и аутоиммунных заболеваний у млекопитающих. Клеточная адгезия является ключевым фактором в этом процессе и имеет самое непосредственное отношение к настоящему изобретению,касающемуся связывания типа клетка/клетка и клетка/матрикс гемопоэтических клеток, содержащих VLA-4.VLA-4 является членом обширного суперсемейства клеточных поверхностных макромолекулярных рецепторов, называемых интегринами, которые представляют собой не ковалентные гетеродимерные комплексы, состоящие из субъединицыи субъединицы(Hemler,Ann. Rev. Immunol., 8, p 365, 1990). Восемнадцать различных субъединицбыли идентифицированы и обозначены как 110, L, M, X,D, LRI, IIB, V и E; и девять субъединицбыли идентифицированы и обозначены как 19. Каждую молекулу интегрина в зависимости от типа ее - и -субъединиц можно отнести к одному из подсемейств. Интегрин 41, VLA-4, представляет собой интегрин, который конститутивно экспрессируется всеми лейкоцитами (например, моноцитами, лимфоцитами, базофилами, эозинофилами,тучными клетками и макрофагами), за исключением полиморфонуклеарных лейкоцитов. Связывание этого интегрина с одним из его лигандов выполняет ряд известных функций клеточной адгезии и активации (Hemler, Ann. Rev. Immunol., 8, p. 365, 1990; Walsh et al., Clin. and Exp. 2 ся рецептором для цитокининдуцибельного поверхностного белка эндотелиальной клетки,который известен как фактор васкулярной клеточной адгезии-1 (VCAM-1), и для подвергнутых альтернативному сплайсингу форм внеклеточного матриксного белка фибронектина (FN),содержащего домен CS-1 (Ruegg et al., J. CellBiol, 177, p. 179, 1991; Wayner et al., J. Cell Biol. 105, p. 1873, 1987; Kramer et al., J. Biol. Chem.,264, p. 4684, 1989; Gehlsen et al., Science, 24, p. 1228, 1988). Значение VLA-4 клеточных адгезионных взаимодействий было установлено при помощи специфичных антагонистов моноклональных антител (mAb) к -субъединице VLA4, которые показали, что ингибиторы VLA-4 зависимой клеточной адгезии предупреждают или ингибируют многочисленные воспалительные, респираторные и аутоиммунные патологические состояния (Chisholm et al., Eur. J. Immunol., 23, p. 682, 1993; Lobb et al., J. Clin. Invest,94, p. 1722, 1994; Richards et al., Am. J. Respir.Fryer et al., J. Clin. Invest, 99, p. 2036, 1997). Кроме того, подтверждение тому, что эти патологические процессы можно ингибировать агентами иными, чем антитела, было получено в результате наблюдений на животных моделях после лечения синтетическим пептидом CS-1 или имеющим малый размер молекулы пептидным ингибитором VLA-4 (Ferguson et al., Proc.J. Respir. Crit. Care Med., 156, p. 696, 1997; Jackson et al., J. Med. Chem., 40, p. 3359,1997). Описание уровня техники Об исследованиях mAb и пептидных антагонистов VLA-4 в данной области техники уже было упомянуто выше. При определении сайта связывания для 41 было установлено, что лимфоидные клетки могут связываться с двумя разными сайтами на фибронектине (Bernardi etal., J. Cell Biol., 105, p. 489, 1987). Одна составляющая такой активности клеточного связывания ранее была идентифицирована как трипептид Arg-Gly-Asp (RGD), который связывается с интегрином 51 (VLA-5). Впоследствии была определена минимальная аминокислотная последовательность, требуемая для связывания и антагонизации активности VLA-4 на лейкоцитах в отношении подвергнутого альтернативному сплайсингу сайту в фибронектине (Humphries etal., J. Biol. Chem., 266, p. 6886, 1987; GarciaPardo et al., J. Immunol., 144, p. 3361, 1990; Komoriya et al., J. Biol. Chem., 266, p. 15075, 1991). Было обнаружено, что домен связывания VLA-4 в области CS-1 фибронектина (FN) представляет собой октапептид Glu-Ile-Leu-Asp-Val-Pro-SerThr, а также два перекрывающихся пентапепти 3 да Glu-Ile-Leu-Asp-Val и Leu-Asp-Val-Pro-Ser. Все эти пептиды ингибировали FN-зависимую клеточную адгезию, и это подтверждает сделанное ранее заключение, что минимальная аминокислотная последовательность, требуемая для ингибирования, представляет собой Leu-Asp-Val(LDV). Фактически было установлено, что в связывании активированной формы VLA-4 минимальная ингибирующая последовательностьLDV была столь же эффективна, как и полноразмерный фрагмент CS-1 (Waynеr et al., J. CellBiol., 116, p. 489, 1992). Считается, что различные интегрины связываются с внеклеточными матриксными белками на сайте узнавания Arg-Gly-Asp (RGD). Были созданы циклические пептиды на основеRGD, которые, как было сказано, способны ингибировать связывание как 41, так и 51 с FNPCT/US 91/04862), даже если первичным сайтом узнавания на FN для 41 является LDV. Этот циклический пептид представляет собой где ТРrо обозначает 4-тиопролин. Другими пептидильными ингибиторамиVLA-4 являются ингибиторы, о которых сообщается в Arrhenius, T.S.; Elices, M.J.; Gaeta,F.C.A.; "CS-1 Peptidomimetics", WO 95/15973, и представителем соединений этого типа является следующее соединение:N-Фенилацетил-Leu-Asp-Phe-NCy3,где NCy3 выбран, среди прочего, из морфолинамидо, тиоморфолинамидо, 4-(тиадиоксо)пиперидинамидо и D-2-(карбоксамид)пирролидинамидо, пиперидинамидо и замещенного пиперидинамидо. Трипептид Leu-Asp-Val был использован в качестве ядра группы ингибиторов VLA-4 зависимой клеточной адгезии, имеющих формулу где R1 может представлять собой 4-(N'-(2 метилфенил)мочевина)фенилметил; Y может представлять собой С=О; R2 может представлять собой Н; R3 может представлять собой изобутил; и R14 может представлять собой 1,3 бензодиоксол-5-ил. См. Adams, S.P.; Lin, K.-C.; 4 Другие пептидильные ингибиторы VLA-4 зависимой клеточной адгезии, о которых сообщалось, включают ингибиторы формулыZ-(Y1)-(Y2)-(Y3)n-X,где Z может представлять собой 4-(N'-(2 метилфенил)мочевина)фенилацетил;(Y1)-(Y2)-(Y3)n представляет собой ряд аминокислот, образующих пептидную цепь; иX может представлять собой ОН. См. Lin, K.-C.; Adams, S.P.; Castro, А.С.;Adams, S.P.; WO 98/04247) ингибиторы клеточной адгезии, содержащие соединение формулы А-В, где А включает в себя детерминанту специфичности, которая не придает значительнойIIb/IIIa активности, а В включает в себя каркас интегрина. Их представителем является следующее соединение: Известна также (Singh, J.; Zheng, Z.; Sprague, P.; Van Vlijmen, H.W.Т.; Castro, A.; Adams,S.P.; "Molecular Model for VLA-4 Inhibitors", WO 98/04913) трехмерная фармакофорная модель соединения, имеющего ингибиторную активность в отношении VLA-4, включающая характеристики, определяемые по таблице толерантности и пространственным координатам х, у и z. Представителем таких соединений является следующее соединение: Несмотря на описанные выше успехи в области ингибиторов VLA-4-опосредованной клеточной адгезии, специалист сразу признает, что эти пептидильные ингибиторы склонны к плохой абсорбции, малой растворимости и подвержены метаболизму in vivo (как системно, так и местно при введении непосредственно в легкое),что снижает возможность ощутимо воздействовать на ход воспалительных, респираторных или аутоиммунных заболеваний. Соответственно, в данной области все еще имеется потребность в непептидильных или полупептидильных терапевтических агентах, которые могут эффектив 5 но лечить или предупреждать такие патологические состояния. Сущность изобретения Согласно изобретению предложены соединения и композиции, которые ингибируютVLA-4-зависимую клеточную адгезию у млекопитающего. Так, настоящее изобретение относится к соединениям формулы (1.0.0) и его фармацевтически приемлемым солям и другим пролекарственным производным, где А 1 представляет собой фенил или пиридил,каждый возможно замещен R10 в количестве от 1 до 2; В независимо выбран из группы, состоящей из следующего: где символуказывает место присоединения группировки, представленной каждой формулой с (1.1.0) по (1.1.14), к группировке в формуле (1.0.0), а символпоказывает место присоединения группировки, представленной каждой формулой с (1.1.0) по (1.1.14), к группировке Е в формуле (1.0.0); Е представляет собой одинарную связь,-СН=СН- или группировку формулы (1.9.0) где R1a представляет собой водород, когда R1 имеет значение одновалентного заместителя; иR1a представляет собой одинарную связь, когдаR1 имеет значение двухвалентного заместителя;m равно целому числу, которое независимо выбрано из 0, 1 и 2;n равно целому числу, которое независимо выбрано из 1 и 2; р равно целому числу, которое независимо выбрано из 1 и 2, при условии, что р должно быть выбрано как 1, если В выбрано как формула (1.1.2), (1.1.6), (1.1.13) или (1.1.14);q равно целому числу, которое независимо выбрано из 0 и 2;R независимо выбран из группы, состоящей из тетразолила,-C(=O)-OR5,5-C(=O)(CH2)kC(=O)OR , -C(=O)-NH-S(=O)2R5; где k равно целому числу, которое независимо выбрано из 0, 1 и 2;R1 независимо выбран из группы, состоящей из водорода или (С 1-С 6)алкила;R2 или R3, взятый вместе с R4 и атомами углерода и азота, к которым они соответственно присоединены, образует 5-членный насыщенный азотсодержащий гетероцикл;R5 представляет собой водород или (С 1 С 4)алкил;R10 независимо выбран из группы, состоящей из F, Cl, -ОН, (С 1-С 4)алкила или (С 1 С 4)алкокси; иR13 представляет собой фенил. Настоящее изобретение также относится к фармацевтической композиции для предупреждения, ингибирования, подавления или уменьшения клеточной адгезии и являющихся ее результатом или ассоциированных с ней последующих патогенных процессов, опосредованных VLA-4 (очень поздним антигеном-4), содержащим соединение формулы (1.0.0) в качестве активного ингредиента вместе с фармацевтически приемлемым носителем для указанного соединения. Фармацевтическая композиция по изобретению помимо соединения по настоящему изобретению дополнительно может содержать один или более чем один терапевтический агент, выбранный из группы, состоящей по существу из противовоспалительных кортикостероидов, нестероидных противовоспалительных агентов, бронхолитических средств, антиастматических агентов и иммунодепрессантов. Фармацевтические композиции по настоящему изобретению можно применять в лечении многих воспалительных, аутоиммунных и респираторных заболеваний, включая, без ограничений, астму, рассеянный склероз, ревматоидный артрит, остеоартрит, воспалительное кишечное заболевание, псориаз, отторжение трансплантата органа у хозяина, атеросклероз и другие заболевания, опосредованные VLA-4 или ассоциированные с ним. Подробное описание изобретения Настоящее изобретение относится к соединениям, которые ингибируют клеточную адгезию и являющиеся ее результатом патогенные процессы, опосредованные VLA-4. Эти соединения, которые, таким образом, полезны в лечении многих воспалительных, аутоиммун 7 ных и респираторных заболеваний, иллюстрируются формулой (1.0.0) Для соединений формулы (1.0.0) концевая группа, обозначенная как А 1, представляет собой фенил или пиридил, каждый возможно замещенный R10 в количестве от 1 до 2. При наличии замещения, предпочтительно наличие двух заместителей R10, а более предпочтительно наличие только одного заместителяR10. При наличии заместителя R10, он независимо выбран из группы, состоящей из F, Cl,-ОН, (С 1-С 4)алкила или (С 1-С 4)алкокси. Предпочтительно, чтобы был один заместитель и чтобы этим заместителем был F, Cl, ОН, метил или метокси. Термин "алкил", используемый применительно к заместителям R10 на группе А 1, а также в других контекстах настоящего описания, и используемый один или в комбинации с другими терминами, относится к алкильному радикалу с прямой цепью или с разветвленной цепью,содержащему указанное число атомов углерода,обычно от 1 до 6, но часто от 1 до 4 атомов углерода. Примеры таких радикалов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втop-бутил, трет-бутил, пентил, изоамил и гексил. Термин "алкокси", используемый применительно к заместителям R10 на группе А 1, а также в других контекстах настоящего описания, вне зависимости от того, используется ли он один или в комбинации с другими терминами, относится к алкилэфирному радикалу, где термин "алкил" такой, как определено выше. Примеры подходящих алкилэфирных радикалов включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изо-бутокси, втор-бутокси и трет-бутокси. Компонент соединений формулы (1.0.0),который непосредственно связан с компонентом 8 мочевина)фенилметила-, 4-(N'-(2-метилфенил) мочевина)фенилметила-,4-(N'-(2-метоксифенил)мочевина)фенилметила-, 3-метокси-4-(N'(2-метилфенил)мочевина)фенилметила-, 4-(N'(2-пиридил)мочевина)фенилметила-,4-(N'-(2 фторфенил)мочевина)фенилметила-,4-(N'-(2 хлорфенил)мочевина)фенилметила-,4-(N'-(2 хлорфенил)мочевина)-3-метоксифенилметила-,4-(N'-(4-изопропилфенил)мочевина)фенилметила- и 4-(N'-(о-толил)мочевина)пирид-5-илметила-. Эти наиболее предпочтительные группировки могут быть представлены формулами представляет собой метиленовый или этиленовый мостиковый элемент, где n = 1 или 2 соответственно. Предпочтительно n равен целому числу 1, что дает метиленовый мостик. Предпочтительно компонент и указанный метиленовый мостик, присоединенный к нему, образуют группировку, выбранную из группы, состоящей из 3-метокси-4-(N'фенилмочевина)фенилметила-,4-(N'-фенил Как видно из приведенных структурных формул, предпочтительный метиленовый мостик предпочтительно присоединен к группеN,N'-дифенилуреидо в пара-положении по отношению к месту присоединения двухвалентной уреидогруппы к имеющейся фенильной группе. Следующий компонент, группа В соединений формулы (1.0.0), представляет собой одну из наиболее важных частей молекулы и является ключевым звеном в обеспечении неожиданно хороших биологических свойств, которыми обладают соединения по настоящему изобретению. Группа В выбрана из группы, состоящей из группировок формул с (1.1.0) по (1.1.14) где символуказывает место присоединения группировки, представленной каждой формулой с (1.1.0) по (1.1.14), к группировке в формуле (1.0.0), а символпоказывает место присоединения группировки, представленной каждой формулой с (1.1.0) по (1.1.14) к группировке Е в формуле (1.0.0). Все вышеуказанные формулы с (1.1.0) по(1.1.14) проиллюстрированы как фрагменты,описанные выше, где места присоединения на обоих концах данного фрагмента указаны символамии . В вышеуказанных формулах, определяющих компонент В соединений формулы (1.0.0),группировка X представляет собой кислород,серу или серу, к которой присоединены два атома кислорода (q = 2), то есть сульфонил. Однако предпочтительно X представляет собой просто кислород или серу. Предпочтительными являются соединения формулы (1.0.0), где В выбран из группы, состоящей из группировок формул (1.1.2) и (1.1.6) где символи символтакие, как определено ранее; и где X представляет собой кислород или серу. В вышеуказанных формулах, определяющих компонент В соединения формулы (1.0.0),R2 и R3, каждый независимо, выбраны из группы, состоящей из водорода; (С 1-С 4)алкила, за 004792(С 3-С 7) карбоциклическое кольцо; или R2 или R3, взятый вместе с R4 и атомами углерода и азота, к которым они соответственно присоединены,образует 5-членный насыщенный азотсодержащий гетероцикл. Например, в том случае, когда R2 и R3 взяты вместе с образованием карбоциклического циклопропильного, циклобутильного или циклопентильного кольца, полученное соединение по настоящему изобретению включает в себя такие группировки, как группировки формул с Другой предпочтительной подгруппой соединений по настоящему изобретению является подгруппа, которая образована либо R2, либо R3 вместе с R4 и атомами углерода и азота, к которым они соответственно присоединены, с образованием 5-членного насыщенного азотсодержащего гетероцикла. Эта подгруппа может быть представлена следующей формулой (1.3.0): где символуказывает место присоединения группировки, представленной формулой (1.3.0),к группировке в формуле (1.0.0), а символуказывает место присоединения группировки, представленной формулой (1.3.0), к остальной части группировки В в формуле (1.0.0),которая определена формулами с (1.1.0) по(1.1.14). Заместитель R2/3 указывает на наличие либо заместителя R2, либо заместителя R3. Они не могут присутствовать оба одновременно, так как уже выбрано, что один или другой из них вместе с R4 и атомами углерода и азота, к которым они соответственно присоединены, образует 5-членный насыщенный азотсодержащий гетероцикл формулы (1.3.0) представленной ниже Следует иметь в виду, что если присутствует группа R2 или R3, то она имеет значение водород или метил. Соответственно эта подгруппа группы В,представленная формулой (1.3.0), включает, без ограничений, воплощения, которые представлены формулами (1.3.1), (1.3.10) и (1.3.14) где символуказывает место присоединения группировки, представленной каждой из формул (1.3.1), (1.3.10) и (1.3.14), к группировке в формуле (1.0.0), а символуказывает место присоединения группировки, представленной каждой из формул (1.3.1), (1.3.10) иR13, который может присутствовать на заместителях R2 и R3 компонента В, следует отметить,что если выбрано 0, то R13 отсутствует. Предпочтительно, чтобы R13 либо отсутствовал, либо присутствовал как единственный заместитель,который представляет собой фенил. Используемый в отношении В, а также в других контекстах настоящего описания, один или в комбинации с другими терминами, термин"(С 3-С 7)карбоциклическое кольцо" относится к циклоалкильной и циклоалкенильной группам,содержащим от трех до семи атомов углерода. Термин "циклоалкил" означает циклический алкильный радикал, содержащий от 3 до 7,предпочтительно от 3 до 6 атомов углерода. Примеры таких циклоалкильных радикалов включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термин "циклоалкенил" относится к циклическому карбоциклу, содержащему от 4 до 7, предпочтительно 5 или 6, атомов углерода и одну или более чем одну двойную связь. Примеры таких циклоалкенильных радикалов включают, без ограничений, циклопентенил, циклогексенил и циклопентадиенил. Предпочтительно, чтобы в том случае, когда один из R2 и R3 представляет собой водород,другой был выбран из группы, состоящей, по существу, из изопропила, втор-бутила, изобутила и трет-бутила. В предпочтительном воплощении один изR2 и R3 представляет собой водород, а другой представляет собой изобутил. Присоединенные к компоненту В в соединениях формулы (1.0.0) остальные структурные элементы могут быть представлены формулой Прежде всего, следует отметить, что группировка, представленная формулой (1.4.0), непосредственно присоединена к компоненту В в соединении формулы (1.0.0), и что р равно целому числу, независимо выбранному из 1 и 2,так что либо одна, либо две группировки формулы (1.4.0) могут быть присоединены к компо 004792 12 ненту В. Обычно в предпочтительных воплощениях соединений формулы (1.0.0) р выбрано как целое число 1. Кроме того, некоторые определения В в формулах (1.1.2) и т.д. не допускают,чтобы р было выбрано как целое число 2. Соответственно определение р налагает условие,согласно которому р должно быть равно 1, когда В выбран как группировка формулы (1.1.2),(1.1.4), (1.1.6), (1.1.13) или (1.1.14). Тем не менее, имеются воплощения соединений формулы(1.0.0), в которых р выбрано как целое число 2. Пример такого соединения представлен формулой (1.6.0) Е представляет собой одинарную связь,-СН=СН- или мостиковую группировку формулы (1.9.0) Если Е представляет собой одинарную связь, то соответствующая ей группа соединений формулы (1.0.0) характеризуется меньшим размером концевой карбоновой кислоты или фрагмента карбоновой кислоты. Таким образом,если m выбрано как целое число 0, концевая группировка, присоединенная к компоненту В,содержит группировку [-R]p, где р предпочтительно выбрано как целое число 1. Однако в наиболее предпочтительных воплощениях по настоящему изобретению Е представляет собой мостиковую группировку формулы (1.9.0), которая приведена выше. Эта мостиковая группировка содержит замещенную метиленовую группу, к которой присоединены заместители R1 и R1a, где R1a представляет собой водород, когда R1 имеет значение одновалентного заместителя, и R1a представляет собой одинарную связь, когда R1 имеет значение двухвалентного заместителя. В наиболее предпочтительных воплощениях, когда R1 является двухвалентным заместителем, он имеет значение =O. Представителем соединения по настоящему изобретению, в котором Е имеет значение группировки формулы (1.9.0), R1a представляет собой одинарную связь, a R1 имеет значение двухвалентного заместителя =O, является соединение, представленное формулой (1.4.2) 13 Во фрагментах соединений по настоящему изобретению, представленных вышеуказанной формулой (1.4.0), после группировки Е следует возможный метиленовый или этиленовый мостик (-СН 2-)m, где m равно целому числу, независимо выбранному из 0, 1 и 2. Предпочтительно наличие этиленового мостика и еще более предпочтительно наличие метиленового мостика. Таким образом, в сущности, предпочтительные соединения по настоящему изобретению имеют этиленовый или пропиленовый мостик между компонентами В и R формулы (1.0.0), а заместитель R1, следовательно, присоединен в положении к этому этиленовому или пропиленовому мостику. Возможно отсутствие заместителя R1, то есть R1 может представлять собой водород, и это является предпочтительной структурой для многих соединений формулы(1.0.0). Вместе с тем, имеется ряд других соединений формулы (1.0.0), для которых предпочтительно присутствие заместителя R1. Помимо водорода, R1 выбран (С 1 С 6)алкила. Группа (С 1-С 6)алкил уже была подробно определена выше. В пределах значений этой группы R1 предпочтительно представляет собой метил, этил, изопропил, трет-бутил. Наконец, компонент R формулы (1.0.0) независимо выбран из группы, состоящей изC(=O)OR , -C(=O)-NH-S(=O)2R5. Предпочтительно R представляет собой С(=О)-ОН. Однако в дополнение к таким простым карбоновым кислотам, другие предпочтительные воплощения R включают в себя -, - и-C(=O)(CH2)kC(=O)OR5. В случае если k равно 0,R включает -кетокислоту, такую как пировиноградная кислота. В случае если k равно 1, R включает -кетокислоту, такую как ацетоуксусная кислота. В случае если k равно 2, R включает -кетокислоту, такую как левулиновая кислота. Компонент R также включает сульфонамидокарбонильные группировки, которые определены формулой -C(=O)-NH-S(=O)2R5. В объем настоящего изобретения входят фармацевтически приемлемые производные соединений формулы (1.0.0). Используемое в настоящем описании выражение "фармацевтически приемлемое производное" означает любую фармацевтически приемлемую соль соединения формулы (1.0.0). Далее в объем настоящего изобретения входит любое другое соединение, которое при введении пациенту способно прямо или косвенно дать соединение формулы (1.0.0). Такие соединения называются пролекарствами, и для приготовления таких пролекарственных форм соединений формулы (1.0.0) имеется ряд общепринятых методик. 14 Используемый выше и ниже в настоящем описании термин "пациент" относится к млекопитающим, включая человека. Используемый термин "клетка" относится к клеткам млекопитающих, включая клетки человека, если иное не оговорено особо. В объем настоящего изобретения также входят метаболиты или остатки соединений формулы (1.0.0), которые обладают биологической активностью, заключающейся в том, что они способны ингибировать клеточную адгезию и последующие или ассоциированные патогенные процессы, впоследствии опосредованныеVLA-4. После синтеза ингибиторная активность и VLA-4-специфичность соединений формулы(1.0.0) по настоящему изобретению могут быть определены с использованием анализов in vitro и in vivo, которые дополнительно подробно описаны ниже. Желаемая биологическая активность соединений формулы (1.0.0) может также быть также улучшена введением в него соответствующих функциональных групп, которые функционируют, улучшая имеющиеся биологические свойства соединения, повышая селективность соединения по отношению к имеющейся биологической активности или дополняя имеющуюся биологическую активность еще одной желаемой биологической активностью. Такие модификации известны специалистам, и они включают такие модификации, которые улучшают биологическое проникание в данную биологическую систему, например в кровь, в лимфатическую систему и в центральную нервную систему; повышают пероральную доступность; повышают растворимость, давая возможность осуществлять введение инъекцией; изменяют метаболизм; и изменяют скорость экскреции соединения формулы (1.0.0). В соответствии с вышеупомянутыми определениями и другими определениями используемые в настоящем описании иные химические и биологические термины будут понятны специалистам в данной области. Некоторые термины могут быть использованы одни или в любой комбинации. Предпочтительные и более предпочтительные длины цепей радикалов, которые были конкретно указаны в этом документе, относятся ко всем таким комбинациям. Наиболее предпочтительные соединения по изобретению представляют собой 3-(3-изобутил-2-оксо-4-[4-(3-о-толилуреидо)фенил]ацетилпиперазин-1-ил)масляную кислоту,3-[3-(3-метил-1-2-[4-(3-о-толилуреидо) фенил]ацетиламинобутил)изоксазол-5-ил] пропионовую кислоту,[2-(3-метил-1-2-[4-(3-о-толилуреидо) фенил]ацетиламино-4,5-дигидрооксазол-5-ил] уксусную кислоту, 15 16 3-3-[1-(2-4-[3-(2-хлорфенил)уреидо] фенилацетиламино)-3-метилбутил]изоксазол 5-илпропионовую кислоту,3-[2-(1-2-[4-(3-о-толилуреидо)фенил] ацетиламино-бут-3-енил)тиазол-5-ил]пропионовую кислоту,этиловый эфир 3-3-[1-(2-4-[3-(2-хлорфенил)уреидо]фенилацетиламино)-3-метилбутил]изоксазол-5-ил-3-оксопропионовой кислоты,3-[2-(1-2-[4-(3-о-толилуреидо)фенил]ацетиламинобутил)тиазол-5-ил]пропионовую кислоту,N-1-[5-(3-метансульфониламино-3-оксопропил)тиазол-2-ил]-3-метилбутил-2-[4-(3-отолилуреидо)фенил]ацетамид,2-4-[3-(2-хлорфенил)уреидо]фенил-N1-[5-(3-метансульфониламино-3-оксопропил) тиазол-2-ил]-3-метилбутилацетамид,3-[2-(2-[4-(3-о-толилуреидо)фенил]ацетиламинометил)тиазол-5-ил]пропионовую кислоту,3-2-[(2-4-[3-(2-хлорфенил)уреидо]фенилацетиламино)метил]тиазол-5-илпропионовую кислоту,3-[2-(1-2-[4-(3-о-толилуреидо)фенил] ацетилпирролидин-2-ил)тиазол-5-ил]пропионовую кислоту. Вышеописанные соединения по настоящему изобретению можно применять в форме кислот, эфиров или в форме химических соединений других классов, к которым описанные соединения относятся. Также в объем настоящего изобретения входит применение этих соединений в форме фармацевтически приемлемых солей, получаемых из различных органических и неорганических кислот и оснований в соответствии с методиками, которые хорошо известны специалистам. Такие общеизвестные фармацевтически приемлемые соли включают, без ограничений, ацетат, адипат, альгинат, аспартат,бензоат, бензолсульфонат, безилат, бисульфат,бутират, цитрат, камфорат, камфорсульфонат,циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глюконат, глицерофосфат, гемисукцинат,гемисульфат, гептаноат, гексаноат, гиппурат,гидрохлорид, гидробромид, гидроиодид, 2 гидроксиэтансульфонат, изотионат, лактат, лактобионат, малеат, манделат, метансульфонат, 2 нафталинсульфонат, никотинат, нитрат, оксалат,олеат, памоат, пектинат, персульфат, 3 фенилпропионат, фосфонат, пикрат, пивалат,пропионат, салицилат, натрийфосфат, стеарат,сукцинат, сульфат, сульфосалицилат, тартрат,тиоцианат, тиомалат, тозилат и ундеканоат. Основные соли соединений по настоящему изобретению включают, без ограничений, аммониевые соли; соли щелочных металлов, таких как натрий и калий; соли щелочно-земельных металлов, таких как кальций и магний; соли с органическими основаниями, такими как ди 17 циклогексиламин, меглумин, N-метил-D-глюкамин, трис-(гидроксиметил)метиламин (трометамин), и соли с аминокислотами, такими как аргинин, лизин и т.д. Соединения по настоящему изобретению, которые содержат основные азотсодержащие группы, могут быть кватернизированы такими агентами, как (С 1-С 4)алкилгалогениды, например метил-, этил-, изопропили трет-бутилхлориды, -бромиды и -йодиды; ди(С 1-С 4)алкилсульфаты, например диметил-,диэтил- и диамилсульфаты; (С 10-С 18)алкилгалогениды, например децил-, додецил-, лаурил-,миристил- и стеарилхлориды, -бромиды и-йодиды; и арил-(С 1-С 4)алкилгалогениды, например бензилхлорид и фенетилбромид. Такие соли позволяют получать как водорастворимые,так и маслорастворимые соединения по настоящему изобретению. Среди вышеупомянутых фармацевтических солей предпочтительные соли включают,без ограничений, ацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изотионат, манделат,меглуминная соль, нитрат, олеат, фосфонат,пивалат, натрийфосфат, стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометаминная соль. Настоящее изобретение охватывает множественные солевые формы, если соединение по настоящему изобретению содержит более чем одну группу, способную образовывать такие фармацевтически приемлемые соли. Примеры типичных множественных солевых форм включают, без ограничений, битартрат, диацетат, дифумарат, димеглуминную соль, дифосфат, динатриевую соль и тригидрохлорид. Фармацевтические композиции по настоящему изобретению содержат любое одно или более чем одно описанное выше ингибиторное соединение по настоящему изобретению или также описанную выше их фармацевтически приемлемую соль вместе с фармацевтически приемлемым носителем согласно свойствам и ожидаемой функции таких носителей, которые общеизвестны в данной области. Используемый здесь термин "носитель" включает в себя приемлемые разбавители, эксципиенты, адъюванты и растворителей. Фармацевтически приемлемые носители, которые можно использовать в фармацевтических композициях по настоящему изобретению, включают, без ограничений, ионообменные составы; оксид алюминия; стеарат алюминия; лецитин; сывороточные белки, например сывороточный альбумин человека; фосфаты; глицин; сорбиновую кислоту; сорбат калия; смеси глицеридов насыщенных растительных жирных кислот; воду; соли или электролиты, например проламинсульфат, динатрийгидрофосфат, гидрофосфат калия, хлорид натрия и соли цинка; коллоидный диоксид кремния; трисиликат магния; поливинилпирролидон; вещества на основе целлюлозы, 004792 18 например натрийкарбоксиметилцеллюлозу; полиэтиленгликоль; полиакрилаты; воски; полиэтиленполиоксипропилен-блокполимеры; и ланолин. Более конкретно, разбавители, эксципиенты, адъюванты и растворители, используемые в фармацевтических композициях по настоящему изобретению, выбирают из групп, состоящих,по существу, из следующего: подкисляющие и подщелачивающие агенты, которые добавляют для достижения желаемого или заданного значения рН, в том числе такие подкисляющие агенты, как уксусная кислота, ледяная уксусная кислота, яблочная кислота и пропионовая кислота, и такие подщелачивающие агенты, как эдэтол, карбонат калия, гидроксид калия, борат натрия, карбонат натрия и гидроксид натрия; аэрозольные пропелленты, которые требуются,когда фармацевтическая смесь предназначена для введения в виде аэрозоля под значительным давлением, например приемлемые галогенированные углеводороды, азот или летучий углеводород, такой как бутан, пропан, изобутан или их смеси; противомикробные агенты, в том числе антибактериальные, противогрибковые и антипротозойные агенты, которые добавляют, когда фармацевтическую композицию применяют местно, например такие антимикробные агенты,как бензиловый спирт, хлорбутанол, фенилэтиловый спирт, фенилмеркуроацетат, сорбат калия и сорбиновая кислота; и такие противогрибковые агенты, как бензойная кислота, бутилпарабен, этилпарабен, метилпарабен, пропилпарабен и бензоат натрия; противомикробные консерванты, добавляемые в фармацевтические композиции для защиты их от роста потенциально вредных микроорганизмов, например алкиловые эфиры п-гидроксибензойной кислоты, соли пропионовой кислоты, феноксиэтанол, метил парабен-натрий, пропилпарабен-натрий, дегидроацетат натрия, бензалконийхлорид, бензэтоний хлорид и бензиловый спирт; антиоксиданты, добавляемые для защиты всех ингредиентов фармацевтической композиции от разрушения или деструкции под воздействием окислителей,которые присутствуют в самой композиции или имеются в окружающей среде, например аноксомер, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, гипофосфорная кислота, метабисульфит калия, пропилоктил и додецилгаллат, метабисульфит натрия, диоксид серы и токоферолы; буферные агенты, используемые для поддержания требуемого значения рН композиции после его установления, например ацетат кальция,метафосфат калия, фосфат калия одноосновный и винно-каменная кислота; и хелатирующие агенты, используемые для поддержания ионной силы фармацевтической композиции и для связывания и эффективного удаления деструктивных соединений и металлов, например дикалия эдэтат, динатрия эдэтат и эдэтовая кислота. 19 В фармацевтические композиции по настоящему изобретению, предназначенные для местного применения, добавляют дерматологически активные агенты, например агенты для заживления ран, такие как пептидные производные, дрожжи, пантенол, гексилрезорцин, фенол,тетрациклина гидрохлорид, ламин и кинетин; глюкокортикостероиды агенты для лечения воспаления, например гидрокортизон, дексаметазон, бетаметазон, триамцинолон, флюоциналон и метилпреднизолон; ретиноиды для лечения апне, псориаза, старения кожи и рака кожи,например ретинол, третиноин, изотретиноин,этретинат, ацитреин и аротиноид; иммунодепрессанты для лечения воспаления, например дапсон и сульфасалазин; мягкие антибактериальные агенты, например резорцин, салициловая кислота, бензоилпероксид, эритромицинбензоилпероксид, эритромицин, клиндамицин и мупироцин; противогрибковые агенты, например гризеофулвин, азолы, такие как миконазол,эконазол, итраконазол, флюконазол и кетоконазол, и аллиламины, такие как нафтифин и терфинафин; противовирусные агенты, например ацикловир, фамцикловир и вапацикловир; антигистамины, например дифенгидрамин, терфенадин, астемизол, лоратадин, цетиризин, акривастин и темеластин; местные анестезирующие средства, например бензокаин, лидокаин, дибукаин и прамоксина гидрохлорид; местные аналгетики, например метилсалицилат, камфора,ментол и резорцин; местные антисептики для предупреждения инфекции, например бензалконийхлорид и повидон-иод; витамины и их производные, такие как токоферол, токоферола ацетат, ретиновая кислота и ретинол. Дополнительные примеры разбавителей,эксципиентов, адъювантов и растворителей,используемых в фармацевтических композициях по настоящему изобретению, выбирают из групп, состоящих, по существу, из следующего: диспергирующие и суспендирующие агенты,например полигинан, повидон и диоксид кремния; мягчительные средства, например углеводородные масла и воски, триглицеридные эфиры, ацетилированные моноглицериды, метиловые и другие алкиловые эфиры С 10-С 20 жирных кислот, С 10-С 20 жирные кислоты, С 10-С 20 жирные спирты, ланолин и производные, эфиры многоатомных спиртов, такие как полиэтиленгликоль (200-600), эфиры полиоксиэтиленсорбитановых жирных кислот, эфиры восков, фосфолипиды и стеролы; эмульгирующие агенты, используемые для приготовления эмульсий маслов-воде; эксципиенты, например лаурокапрам и монометиловый эфир полиэтиленгликоля; смачивающие средства, например сорбит, глицерин и гиалуроновая кислота; мазевые основы, например вазелин, полиэтиленгликоль, ланолин и полоксамер; агенты, улучшающие проникание,например диметилизосорбид диэтилгликольмоноэтилэфир, 1-додецилазациклогептан-2-он и 20 диметилсульфоксид (ДМСО); консерванты, например бензалконийхлорид, бензэтонийхлорид,алкиловые эфиры п-гидроксибензойной кислоты, производные гидантоина, цетилпиридинийхлорид, пропилпарабен, четвертичные аммониевые соединения, такие как бензоат калия и тимеросал; пассивирующие агенты, содержащие циклодекстрины; растворители, например ацетон, спирт, амиленгидрат, бутиловый спирт,кукурузное масло, хлопковое масло, этилацетат,глицерин, гексиленгликоль, изопропиловый спирт, изостеариловый спирт, метиловый спирт,метиленхлорид, минеральное масло, арахисовое масло, фосфорная кислота, полиэтиленгликоль,полиоксипропилен 15 стеариловый эфир, пропиленгликоль, пропиленгликольдиацетат, кунжутное масло и очищенная вода; стабилизаторы, например сахарат кальция и тимол; поверхностно-активные вещества, например хлорид лапирия, лаурет 4, то есть додецил-гидроксиполи(окси-1,2-этандиил) или монододециловый эфир полиэтиленгликоля. В соответствии с данным изобретением фармацевтические композиции могут быть в форме стерильных препаратов для инъекций,например стерильной водной или масляной суспензии для инъекций. Такая суспензия может быть приготовлена в соответствии со способами, известными в данной области, с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Приемлемыми разбавителями и растворителями, которые можно использовать, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, обычно в качестве растворителя или суспендирующей среды традиционно используют стерильные нелетучие масла. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, полезны в приготовлении инъецируемых препаратов, также как и натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно их полиоксиэтилированные виды. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спирт-разбавитель или диспергирующий агент, такой как Rh, HCIX или аналогичный спирт. Фармацевтические композиции по настоящему изобретению можно вводить перорально в любой приемлемой для перорального введения лекарственной форме, включая, без ограничений, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для 21 перорального применения носители, которые обычно используют, включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул пригодные разбавители включают лактозу и высушенный кукурузный крахмал. В случае,когда для перорального применения требуются водные суспензии, активный ингредиент объединяют с эмульгаторами и суспендирующими агентами. При желании, можно добавлять также определенные подсластители, корригенты или красящие агенты. Альтернативно, фармацевтические композиции по настоящему изобретению можно вводить в форме суппозиториев для ректального введения. Их можно приготовить путем смешивания агента с подходящим не раздражающим эксципиентом, который при комнатной температуре является твердым веществом, а при ректальной температуре является жидким и, следовательно, плавится в прямой кишке с высвобождением лекарственного средства. Такие материалы включают масло какао,пчелиный воск и полиэтиленгликоли. Фармацевтические композиции по настоящему изобретению можно также вводить местно, особенно если мишенью лечения являются области или органы, легкодоступные для местного применения, в том числе заболевания глаз, кожи или нижнего отдела кишечного тракта. Подходящие препараты для местного применения легко можно приготовить для каждой такой области или для каждого такого органа. Местное применение для нижнего отдела кишечного тракта может быть осуществлено с использованием ректального суппозиторного препарата, такого как описано выше, или препарата, подходящего для клизмы. Также можно использовать действующие местно трансдермальные пластыри. Для местного применения фармацевтические композиции могут быть приготовлены в виде препарата в форме подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более чем одном носителе. Носители для местного введения соединений по настоящему изобретению включают, без ограничений, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий воск и воду. Альтернативно, фармацевтические композиции могут быть приготовлены в виде препарата в форме подходящего лосьона или крема,содержащего активные компоненты, суспендированные или растворенные в одном или более чем одном фармацевтически приемлемом носителе. Подходящие носители включают, без ограничений, минеральное масло, сорбитанмоностеарат, полисорбат, цетилэфирный воск, цетеарильный спирт, 2-октилдодеканол, бензиловый спирт и воду. 22 Для офтальмического применения фармацевтические композиции могут быть приготовлены в виде препарата в форме микронизированной суспензии в изотоническом стерильном солевом растворе с установленным значением рН или предпочтительно в форме растворов в изотоническом стерильном солевом растворе с установленным значением рН, с использованием консерванта, такого как бензилалконийхлорид, либо без консерванта. Альтернативно, для офтальмических применений фармацевтические композиции могут быть приготовлены в виде препарата в форме мази, например, на основе вазелина. Фармацевтические композиции по настоящему изобретению можно вводить также посредством назального аэрозоля или ингаляции с использованием распылителя, ингалятора для сухого порошка или дозирующего ингалятора. Такие композиции готовят согласно способам, общеизвестным в области фармацевтических препаратов, иони могут быть приготовлены в виде растворов в солевом растворе, с использованием бензилового спирта или других подходящих консервантов, промоторов абсорбции для улучшения биодоступности, фторуглеводородов и/или других традиционных солюбилизирующих или диспергирующих агентов. Количество активного ингредиента, которое может быть объединено с носителем для получения разовой лекарственной формы, будет меняться в зависимости от субъекта лечения и конкретного способа введения. Однако следует иметь в виду, что конкретная схема дозирования и лечения для любого конкретного пациента будет зависеть от множества факторов, в том числе от активности применяемого конкретного соединения, возраста, веса тела, общего состояния здоровья, пола, диеты, времени введения,скорости выведения, комбинации лекарственных средств, мнения лечащего врача и серьезности конкретного заболевания, которое лечат. Количество активного ингредиента может также зависеть от терапевтических или профилактических агентов, если таковые имеются, с которыми данный ингредиент совместно вводят. Дозировка и величина дозы соединения по настоящему изобретению, эффективные для предупреждения, ингибирования, подавления или уменьшения клеточной адгезии и являющихся ее результатом или ассоциированных с ней последующих патогенных процессов, опосредованных VLA-4, будет зависеть от множества факторов, таких как природа ингибитора,комплекция пациента, цель лечения, природа патологии, которую надо лечить, конкретная применяемая фармацевтическая композиция и наблюдения и заключения лечащего врача. Например, если лекарственная форма является пероральной, например таблетка или капсула, подходящие уровни дозировки соединений формулы (1.0.0) находятся между при 23 близительно 1,0 мкг и приблизительно 10,0 мг/кг веса тела в сутки, предпочтительно между приблизительно 5,0 мкг и приблизительно 5,0 мг/кг веса тела в сутки, более предпочтительно между приблизительно 10,0 мкг и приблизительно 1,0 мг/кг веса тела в сутки и наиболее предпочтительно между приблизительно 20,0 мкг и приблизительно 0,5 мг/кг веса тела в сутки активного ингредиента. Если лекарственную форму вводят местно в бронхиолы и легкие, например, при помощи порошкового ингалятора или распылителя, подходящие уровни дозировки соединений формула (1.0.0) находятся между приблизительно 0,1 мкг и приблизительно 1,0 мг/кг веса тела в сутки, предпочтительно между приблизительно 0,5 мкг и приблизительно 0,5 мг/кг веса тела в сутки, более предпочтительно между приблизительно 1,0 мкг и приблизительно 0,1 мг/кг веса тела в сутки и наиболее предпочтительно между приблизительно 2,0 мкг и приблизительно 0,05 мг/кг веса тела в сутки активного ингредиента. Используя примеры веса тела 10 кг и веса тела 100 кг, для иллюстрации пределов суточных местных дозировок, которые можно применять как описано выше, подходящие уровни дозировки соединений формулы (1.0.0) составляют между приблизительно 1,0-10,0 мкг и 10,0100,0 мг в сутки, предпочтительно между приблизительно 5,0-50,0 мкг и 5,0-50,0 мг в сутки,более предпочтительно между приблизительно 100-100,0 мкг и 1,0-10,0 мг в сутки и наиболее предпочтительно между приблизительно 20,0200,0 мкг и приблизительно 0,5-5,0 мг в сутки активного ингредиента, представляющего собой соединение формулы (1.0.0). Эти пределы дозируемых количеств представляют собой общие дозируемые количества активного ингредиента в сутки для данного пациента. Количество раз в сутки, в течение которых вводят дозу, будет зависеть от таких фармакологических и фармакокинетических факторов, как период полувыведения активного ингредиента, который отражает скорость его катаболизма и клиренса, а также минимальные и оптимальные уровни указанного активного ингредиента в плазме крови или в других жидкостях организма, наблюдаемые у пациента, которому требуется терапевтическое воздействие. При решении вопроса о количестве доз в сутки и о количестве активного ингредиента на дозу, которую будут вводить, необходимо также учитывать другие многочисленные факторы. Немаловажное значение таких других факторов имеет индивидуальная реакция пациента, которого лечат. Так, например, если активный ингредиент применяют для лечения или предупреждения астмы и вводят местно посредством аэрозольной ингаляции в легкие, от одной до четырех доз, состоящих из порций, выдаваемых диспергирующим устройством, то есть "пшиков" ингалятора, вводят ежесуточно, причем 24 каждая доза содержит от приблизительно 50,0 мкг до приблизительно 10,0 мг активного ингредиента. В объем настоящего изобретения входят воплощения, представляющие собой композиции, которые в дополнение к соединению по настоящему изобретению в качестве активного ингредиента содержат дополнительные терапевтические агенты - активные ингредиенты, выбираемые из группы, состоящей по существу из противовоспалительных кортикостероидов,бронхолитических средств, антиастматических средств, нестероидных противовоспалительных средств, иммунодепрессантов, иммуностимуляторов, антиметаболитов, противопсориазных средств и противодиабетических средств. Конкретные соединения в пределах каждого из этих классов могут быть выбраны из соединений,перечисленных под соответствующими заголовками в Comprehensive Medicinal Chemistry, Pergamon Press, Oxford, England, pp. 970-986 (1990) и Goodman and Gilman's The PharmocologicalLimbird, L.E., eds., McGraw-Hill, 1996, полное описание которых включено в настоящий документ ссылкой. Особенно предпочтительными активными ингредиентами, которые предназначены для применения в комбинации с соединениями формулы (1.0.0), являются противовоспалительные соединения, такие как теофиллин,сульфасалазин и аминосалицилаты; иммунодепрессанты, такие как циклоспорин, FK-506 и рапамицин; антиметаболиты, такие как циклофосфамид и метотрексат; и иммуномодуляторы,такие как интерфероны. Как уже было отмечено, связанная с VLA4 клеточная адгезия играет центральную роль в различных воспалительных, иммунных и аутоиммунных заболеваниях. Поэтому ингибирование клеточной адгезии соединениями по настоящему изобретению можно использовать в способах лечения или предупреждения воспалительных, иммунных и аутоиммунных заболеваний. Предпочтительные заболевания, которые можно лечить соединениями и композициями по настоящему изобретению, выбраны из астмы,псориаза, отторжения трансплантата органа у хозяина, рассеянного склероза, диабета и воспалительного кишечного заболевания. В способах лечения указанных заболеваний соединения формулы (1.0.0) можно применять в виде монотерапии, а также в виде комплексной терапии, при которой одно или более чем одно соединение формулы (1.0.0) совместно вводят в комбинации с известными противовоспалительными агентами, иммуномодуляторами,иммуностимуляторами или иммунодепрессантами. Используемые здесь термины "совместно введенный" или "совместное введение" означают терапевтическое использование одного или более чем одного соединения формулы (1.0.0) в комбинации с одним или более чем одним до 25 полнительным терапевтическим агентом, включая, без ограничений, введение комбинации терапевтически активных агентов в виде однократной лекарственной формы или в виде многократных лекарственных форм, соответствующих одному и тому же или разным путям введения, причем указанные многократные лекарственные формы вводят, по существу, в одно и то же время или в разное время. После синтеза любых вышеуказанных предпочтительных соединений по настоящему изобретению или любых других соединений в пределах объема настоящего изобретения может быть определена биологическая активность указанных соединений относительно VLA-4 специфичности с использованием одного или более чем одного из многочисленных in vitro иin vivo анализов, которые прежде были описаны в технической литературе, относящейся к данной области. Например, некоторые из очень хорошо зарекомендовавших себя методов анализа и моделей основаны на измерении VLA-4 активности путем определения концентрации тестируемого ингибитора-кандидата, которая требуется для блокирования связывания клеток,экспрессирующих VLA-4, на планшетах, лунки которых покрыты фибронектином или CS-1. В этом анализе лунки для микротитрования покрыты либо фибронектином (содержащим последовательность CS-1), CS-1 пептидом, либо растворимым VCAM-1. После того, как лунки были покрыты, в них добавляют тестируемое соединение в различных концентрациях вместе с соответственно мечеными клетками, экспрессирующими VLA-4. Альтернативно, вначале можно добавить тестируемое соединение и оставить его для инкубации с покрытыми лунками до добавления клеток. Клетки оставляют инкубироваться в лунках в течение по меньшей мере 30 мин. После инкубации лунки опорожняют и промывают. Ингибирование связывания измеряют количественным определением флуоресценции или радиоактивности, связанной на планшете для каждого значения концентрации тестируемого соединения, а также для контролей, не содержащих тестируемого соединения. Однако только что описанный анализ менее предпочтителен, чем другие анализы, описанные ниже для определения VLA-4-активности соединений формулы (1.0.0). Экспрессирующие VLA-4 клетки, которые могут быть использованы в этом анализе, включают клетки Рамоса (Ramos cells), клетки Джарката (Jurkat cells), клетки меланомы А 375, а также периферические лимфоциты крови (ПЛК) человека. Клетки, используемые в этом анализе,могут быть флуоресцентно или радиоактивно мечеными. Чтобы оценить ингибиторную в отношении VLA-4 специфичность тестируемых соединений, можно провести анализы с другими основными группами интегринов, т.е. 2 и 3, аVLA-5, VLA-6 и 47. Эти анализы могут быть проведены аналогично описанным выше анализам на ингибирование адгезии и прямого связывания с использованием соответствующей интегрин-экспрессирующей клетки и соответствующего лиганда. Например, полиморфонуклеарные клетки (PMNs) экспрессируют на свою поверхность интегрины 2 и связываются с фактором межклеточной адгезии (ICAM), тогда как интегрины 3 вовлечены в агрегацию тромбоцитов, и ингибирование может быть измерено в стандартном анализе на агрегацию тромбоцитов. VLA-5 специфично связывается с последовательностями Arg-Gly-Asp, a VLA-6 связывается с ламинином. Далее, недавно было установлено, что 47 представляет собой гомологVLA-4, который также связывает фибронектин и VCAM, а также MAdCAM-1. В анализе на связывание с использованием CS-1, VCAM илиRPMI-8866, была установлена специфичность по отношению к 47. После идентификации VLA-4-специфичных ингибиторов они далее могут быть охарактеризованы в анализах in vivo. В одном из таких анализов исследуют ингибирование вызванной аллергеном гиперчувствительности дыхательных путей и поступления клеток (Henderson etmouse model of asthma", J. Clin. Invest., 100(12),pp. 3083-92 (1997. В этом анализе мышей сенсибилизируют внутрибрюшинным воздействием раздражающего средства, такого как овальбумин. После восстановительного периода мышей подвергают воздействию аэрозоля аллергена. До воздействия аэрозоля мышам дают различные дозы ингибитора VLA-4 путем интратрахеальной инъекции. In vivo ингибирование воспаления, ассоциированного с клеточной адгезией, оценивается путем измерения числа клеток и цитокинов в бронхиальной альвеолярной лаважной жидкости. Этим способом можно идентифицировать те ингибиторы по настоящему изобретению, которые лучше всего подходят для ингибирования воспаления. Другим анализом in vivo может служить анализ на астму у приматов. В сущности, этот анализ проводят как описано в Turner, С. R., etResearch, 45(5), pp. 239-45 (1996), полное описание которого включено в данное описание изобретения ссылкой. В этом анализе измеряют ингибирование в дыхательных путях реакций в поздней фазе, вызванных антигеном Ascaris, и гиперчуствительность дыхательных путей к 27 аллергену у приматов после введения противоаллергических/противоастматических агентов. Соединения по настоящему изобретению могут быть введены в состав фармацевтических композиций, которые можно вводить перорально, парентерально, ингаляцией (дозирующий ингалятор, ингалятор для сухого порошка или распылитель), местно, ректально, назально, интраокулярно, буккально, вагинально или посредством имплантированного резервуара. Используемый здесь термин "парентеральный" включает в себя подкожный, внутривенный,внутримышечный, внутрисуставной, интрасиновиальный, интрастернальный, внутриоболочечный, внутрипеченочный, интралезиональный и интракраниальный способы инъецирования или инфузии. Соединения формулы (1.0.0) могут быть получены в соответствии с общеизвестными методиками проведения синтеза органических соединений, которые имеют непептидильную или полупептидную природу. Имеется ряд различных методик, которые полностью раскрыты в технической литературе и которые известны специалистам. Описание, которое сопровождает несколько таких схем синтеза, является лишь иллюстрацией и не налагает какиелибо ограничения. Использование сокращений в указанном описании предназначено для экономии места. Хотя эти сокращения также хорошо известны специалистам, они приводятся ниже для ясности и удобства БОФ - бензотриазол-1-илокси-трис(диметиламино)фосфония гексафторфосфат ДАСТ - диэтиламиносеры трихлорид ДИЭА - диизопропилэтиламин ДМФ - диметилформамид ЭКДИ - 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид ГОБТ - 1-гидроксибензотризол ТГФ - тетрагидрофуран Группа предпочтительных компонентов соединений формулы (1.0.0) была описана выше и иллюстрируется формулами (4.1.1)-(4.1.6) и(4.1.11)-(4.1.16). Среди этих компонентов самым важным является компонент формулы (4.1.2),т.е. 4-(N'-фенилмочевина)фенилметил. Следующая ниже схема синтеза иллюстрирует общий способ получения соединений с указанными выше компонентами: Схема синтеза I - стадия А Исходное соединение Ar-NCO представляет собой изоцианат, в котором Аr имеет такое же определение, что и компонент А 1 в формуле(1.0.0). Исходные изоцианаты для получения компонентов,представленных формулами(4.1.1)-(4.1.6) и (4.1.11)-(4.1.16) коммерчески доступны, например от фирмы Aldrich Chemical(1.4.15) Пиридильные аналоги вышеуказанных фенилизоцианатов могут быть использованы для получения соответствующих соединений формулы (1.0.0), где указанный выше компонент содержит пиридильную группу. Один из вышеописанных изоцианатов подвергают взаимодействию с арилуксусной кислотой, имеющей аминогруппу в положении 4. Присоединение аминов к изоцианатам является общеизвестной реакцией, которая с легкостью обеспечивает получение замещенных мочевин. Эту реакцию можно проводить в растворителе, таком как метиленхлорид, с триэтиламином при слегка повышенных температурах. Реагент, используемый для получения большинства компонентов, иллюстрируемых формулами(4.1.1)-(4.1.6) и (4.1.11)-(4.1.16), представляет собой 4-аминофенилуксусную кислоту, коммерчески доступную от вышеупомянутой фирмыAldridge Chemical Company. Дизамещенную мочевину (2.1.2), полученную по вышеуказанной реакционной схеме, которая образует реагент, в конечном счете дающий компонент соединения формулы (1.0.0), затем подвергают взаимодействию с реагентом, в конечном счете дающим компонент В одной из формул с (1.1.0) по (1.1.14). Например, реагент для получения компонента В может быть реагентом формулы Реагенты для получения компонента В типа реагента, проиллюстрированного формулой(1.7.0), могут быть получены в соответствии с методиками, которые хорошо известны из технической литературы, относящейся к данной области. Например, см. Bhatt, U. Mohamed, N.; и реагентом, приводящим к образованию компонента В, известна специалисту, имеющему дело с ацилированием амина карбоновой кислотой, и может быть проведена с хорошим выходом при комнатной или слегка повышенной температуре с использованием агентов сочетания, таких как 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид (ЭКДИ) и 1 гидроксибензотриазол (ГОБТ); дициклогексилкарбодиимид(БОФ). Эта реакция может быть проиллюстрирована следующей схемой синтеза, которая представляет собой общий способ получения соединений формулы (1.0.0). Схема синтеза I-стадия Б Пиперазинильный реагент (2.1.3) для компонента В используют в форме (С 1-С 4) алкилового эфира кислоты, который служит блокирующей группой для предотвращения реакции карбоксильной кислотной группы с вторичной аминогруппой, образующей часть пиперазинильной группировки других реагентов(2.1.3), присутствующих в реакционной смеси. Агенты сочетания промотируют конденсацию реагентов (2.1.2) и (2.1.3) с образованием промежуточного соединения (2.1.4), которое представляет собой соединение формулы (1.0.0), гдеR определен как О(С 1-С 6)алкил. Для получения конечного продукта формулы (1.0.0) в форме кислоты требуется дополнительная стадия, которая показана на следующей реакционной схеме. Схема синтеза I-стадия В Как указано, омыление водным гидроксидом проводят в спиртовом растворителе, предпочтительно в трет-бутаноле. Последующую нейтрализацию предпочтительно проводят с использованием 1 н. HCl в качестве водной неорганической кислоты, и эту реакцию проводят при комнатной температуре. 30 Вышеописанный синтез пригоден для соединений формулы (1.0.0) вообще. Для большей ясности ниже приведена схема синтеза I-, стадии с А по В, со ссылкой на конкретное соединение по настоящему изобретению. Схема синтеза I Соединения формулы (1.0.0), в которых компонент В представляет собой группировку формулы (1.1.4), т.е. изоксазолильную группу,могут быть получены способом, при котором две последние стадии аналогичны двум последним стадиям, стадиям Б и В, способа, показанного на схеме синтеза I. Получение аминного реагента, который продуцирует компонент В формулы (1.4.4), в общем виде показано для соединений формулы (1.0.0) на следующей ниже схеме синтеза II-стадия А. Схема синтеза II-стадия А На стадии А этого синтеза исходный материал представляет собой 1-формильное производное карбаминовой кислоты, имеющее защитную группу R и имеющее желаемые заместители R2 и R3, формулы ROC(=O)NHC(R2)(R3)CH(=O). Этот исходный альдегид подвергают взаимодействию с гидроксиламина гидрохлоридом и ацетатом натрия в подходящем растворителе, таком как вода и метанол, с образованием соответствующего оксима в соответствии с общеизвестной методикой, включающей в себя присоединение карбонила и удаление воды, при этом поддерживают оптимальное значение рН приблизительно 4. Схема синтеза II-стадия Б 31 Промежуточный оксим (гидроксииминометил) (2.1.7) превращают в желаемый изоксазолилсодержащий компонент В формулы (IIIе),промежуточное соединение (2.1.8), окислением(2.1.7) до образования его соответствующего нитрил-N-оксида гипохлоритом натрия в подходящем растворителе, таком как ТГФ или метиленхлорид; и взаимодействием этого нитрил-Nоксида in situ с соответствующим концевым алкилалкеноатом. Эта реакция [2+3] циклоприсоединения общеизвестна из литературы как способ получения изоксалиновой кольцевой структуры. См., например, Synthesis, 508-9,1982. Схема синтеза II-стадия В Бензилкарбамат (2.1.8) превращают в первичный амин (2.1.9) по методикам, опубликованным в литературе, используя один из следующих реагентов: H2/Pd-C (Ber., 65, р. 1192,1932); НВr, АсОН (J. Org. Chem., 17, p. 1564,1952); 70% HF, пиридин (J. Chem. Soc, Chem.Soc, Chem. Commun., p. 107, 1974). Описанный выше синтез пригоден для соединений формулы (1.0.0) вообще. Для большей ясности ниже приведена схема синтеза II, стадии с А по Г, со ссылкой на конфетное соединение по настоящему изобретению (при этом стадия Г аналогична стадиям Б и В на схеме I). Схема синтеза II Соединения формулы (1.0.0), в которых компонент В представляет собой группировку формулы (1.1.6), т.е. изоксазольную группу,могут быть получены способом, при котором последние две стадии аналогичны стадиям Б и В способа, представленного на схеме синтеза I. 32 Получение аминного реагента, который продуцирует компонент В формулы (1.1.6), в общем виде представлено для соединений формулы(1.0.0) на следующей ниже схеме синтеза. Схема синтеза III-стадия А Промежуточный оксим (гидроксииминометил) (2.1.7) превращают в желаемый изоксазолсодержащий компонент В формулы (1.1.6),промежуточное соединение (2.1.11), окислением(2.1.7) до образования его соответствующего нитрил-N-оксида гипохлоритом натрия в подходящем растворителе, таком как ТГФ или метиленхлорид, и взаимодействием этого нитрил-Nоксида in situ с соответствующим концевым алкилалкиноатом. Эта реакция [2+3] циклоприсоединения общеизвестна из литературы как способ получения изоксазольной кольцевой структуры. См., например, Synthesis, 508-9,1982. Схема синтеза III-стадия Б Бензилкарбамат (2.1.11) превращают в первичный амин (2.1.12) по методикам, опубликованным в литературе, используя один из следующих реагентов: H2/Pd-C (Ber, 65, p. 1192,1932); HBr, AcOH (J. Org. Chem., 17, p. 1564,1952); 70% HF, пиридин (J. Chem. Soc, Chem.Soc, Chem. Commun., p. 107,1974). Описанный выше синтез применим к соединениям формулы (1.0.0) вообще. Для большей ясности ниже приведена схема синтеза III,стадии с А по В, со ссылкой на конфетное соединение по настоящему изобретению (при этом стадия В аналогична стадиям Б и В на схеме I). Соединения формулы (1.0.0), в которых компонент В представляет собой группировку формулы (1.1.0), т.е. оксазолиновую группу,могут быть получены способом, который в общем виде представлен на следующей ниже схеме синтеза. Схема синтеза IV-стадия А На стадии А показана конденсация карбоновой кислоты (2.1.2) и амина (2.1.14) с образованием трет-бутилового эфира (2.1.15), которая аналогична реакции на схеме синтеза 1, стадия Б. трет-Бутиловый эфир превращают в соответствующую кислоту, (2.1.16), подвергая его воздействию кислотных условий, например путем обработки HCl в растворителе, таком как диоксан, при комнатной или близкой к комнатной температуре. Превращение (2.1.15) в (2.1.16) показано ниже на стадии Б. Схема синтеза IV-стадия Б Амид 19 (2.1.18) подвергают циклизации с образованием оксазолина (2.1.19) в присутствии диэтиламиносеры трифторида (ДАСТ), как показано ниже на стадии Г, используя известные методики (Pinto et at., Tetrahedron Lett. 30, p. 3349, 1989; Jones et al. Tetrahedron Lett. 31, p. 3649, 1989). Наконец, желаемую кислоту (2.1.20) получают из эфира (2.1.19) в присутствии водного основания, как показано ниже на стадии Д, которая аналогична реакции, представленной на схеме синтеза 1, стадия В. Схема синтеза IV-стадия Д Описанный выше синтез применим к соединениям формулы (1.0.0) вообще. Для большей ясности ниже приведена схема синтеза IV,стадии с А по Д, со ссылкой на конкретное соединение по настоящему изобретению. Схема синтеза IV Соединения формулы (1.0.0), в которых компонент В представляет собой группировку формулы (1.1.2), т.е. оксазольную группу, могут быть получены способом, который в общем ви 35 де иллюстрируется следующей ниже схемой синтеза. Схема синтеза V-стадия А Промежуточную кислоту (2.1.22) подвергают конденсации с амином (2.1.23) с образованием амида, (2.1.24), как показано на стадии А,которая аналогична реакции, приведенной на схеме синтеза I, стадия Б. Промежуточный амид(2.1.25) в присутствии оксихлорида фосфора(V) в растворителе, таком как толуол, при температуре между комнатной температурой и 110 С,как показано ниже на стадии В (J. Оrg. Chem. 55, р. 386, 1990). Схема синтеза V-стадия Б Бензилкарбамат (2.1.25) превращают в первичный амин (2.1.26) по методикам, опубликованным в литературе, используя один из следующих реагентов: H2/Pd-C (Ber, 65. p. 1192,1932); HBr, AcOH (J. Org. Chem., 17, р. 1564,1952); 70% HF, пиридин (J. Chem. Soc, Chem.Soc, Chem. Commun., p. 107, 1974). Промежуточный амин (2.1.26) превращают в соединения формулы (1.0.0) по реакциям, аналогичным реакциям на схеме синтеза I, стадии Б и В. Схема синтеза V-стадия В Описанный выше синтез применим к соединениям формулы (1.0.0) вообще. Для большей ясности ниже приведена схема синтеза V,стадии с А по В, со ссылкой на конкретное промежуточное соединение по настоящему изобретению. Схема синтеза V Соединения формулы (1.0.0), в которых компонент В представляет собой группировку формулы (1.1.2), т.е. тиазольную группу, могут быть получены способом, который в общем виде представлен на следующей схеме синтеза. Схема синтеза VI-стадия А Промежуточный амид (2.1.24) подвергают циклизации с тиазолом (2.1.27) в известных из литературы условиях с использованием реагента Лавессона [2,4-бис(4-метоксифенил)-1,3 дитиа-2,4-дифосфэтан-2,4-дисульфид] в растворителе, таком как толуол, при температурах между комнатной температурой и 110 С, как показано на стадии А. Бензилкарбамат (2.1.27) превращают в первичный амин (2.1.28), как показано на стадии Б, по методикам, опубликованным в литературе, используя один из следующих реагентов: H2/Pd-C (Ber, 65, р. 1192, 1932); НВr,АсОН (J. Org. Chem., 17, р. 1564, 1952); 70% HF,пиридин (J. Chem. Soc, Chem. Commun., p. 451,1976) или CF3SO3H (J. Chem. Soc, Chem. Commun., p. 107, 1974). Промежуточный амин(1.0.0) по реакциям, аналогичным реакциям,приведенным на схеме синтеза I, стадии Б и В. Схема синтеза VI-стадия Б Описанный выше синтез применим к соединениям формулы (1.0.0) вообще. Для большей ясности синтеза ниже приведена схема синтеза VI, стадии А и Б, со ссылкой на конкретное промежуточное соединение по настоящему изобретению. Схема синтеза VI Соединения формулы (1.0.0), в которых компонент В представляет собой группировку формулы (1.3.0), т.е. пирролидин-2-ил-тиазол-5 ильную группу, могут быть получены способом,который в общем виде показан на следующей схеме синтеза. Схема синтеза VII-стадия А(2.3.0) в виде защищенного диэфира подвергают конденсации с амином (2.3.1) с получением амида (2.3.2) в реакционных условиях, аналогичных условиям, которые были описаны выше на схеме синтеза I, стадия Б. Этот амид (2.3.2) затем подвергают циклизации с тиазолом(2.3.3), используя реагент Лавессона, в условиях, которые общеизвестны в данной области и подробно описаны ниже. Эта реакция иллюстрируется следующей ниже схемой синтеза VII,стадия Б. Схема синтеза VII-стадия Б Тиазол (2.3.3), полученный как описано выше, теперь содержит пирролидин-2-илтиазол-5-ильный компонент, который является ключевой частью соединений формулы (1.0.0), в которых компонент В представляет собой группировку формулы (1.3.0). Остальные компоненты соединений формулы (1.0.0) получают на последующих стадиях, показанных ниже. С атома азота пирролидинильной группы удаляют защиту с получением пирролидинилтиазола(2.3.4), а затем проводят конденсацию (2.3.4) с реагентом о-толилуреидофенилуксусная кислота (2.3.5), который обеспечивает получение левой части соединения по настоящему изобретению. В результате образуется R эфир соединения формулы (1.0.0), (2.3.6), как показано на следующей ниже схеме синтеза VII, стадия В. На конечной стадии эфир (2.3.6) восстанавливают с получением соответствующей карбоновой кислоты (2.3.7) по общеизвестным методикам. Эта стадия иллюстрируется следующей ниже схемой синтеза VII, стадия Г. Схема синтеза VII-стадия Г Примеры предпочтительных воплощений Приведенные ниже примеры иллюстрируют изобретение, но они не должны рассматриваться как ограничивающие объем настоящего изобретения. В приведенных ниже примерах для экономии места используется ряд сокращений. Несмотря на то, что эти сокращения хорошо известны специалистам, они приведены ниже для большей ясности и удобства читателя БОФ - бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат ДАСТ - диэтиламиносеры трифторид ДИЭА - диизопропилэтиламин ДМФ - диметилформамид ЭКДИ - 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид ГОБТ - 1-гидроксибензотриазол ТГФ - тетрагидрофуран Пример 1. А. 3-(3-Изобутил-2-оксо-4-[4-(3-о-толилуреидо)фенил]ацетилпиперазин-1-ил)масляная кислота. Раствор метилового эфира 3-(3-изобутил 2-оксо-4-[4-(3-о-толилуреидо)фенил]ацетил пиперазин-1-ил)масляной кислоты (20 мг, 0,038 ммоль) в смеси 1 мл 0,1 н. NaOH и 1 мл третбутанола перемешивают при комнатной температуре в течение 16 ч. Затем реакционную смесь концентрируют при пониженном давлении, растворяют в воде (5 мл) и экстрагируют эфиром (5 мл 2). Затем водную часть подкисляют 1 н. HCl 39 до рН 3 и экстрагируют этилацетатом. Объединенные органические экстракты промывают солевым раствором, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 16 мг указанного в заголовке соединения в виде желтого вязкого масла. МС [М+1]+509,3; 1 Н ЯМР (400 МГц, CD3OD)0,88-1,70 (m,12H), 2,25 (s, 3H), 2,34-4,96 (m, 10H), 6,98 (t, J = 7,4 Гц, 1H), 7,11-7,40 (m, 6H), 7,59 (d, J = 7,5 Гц,1H). Б. Метиловый эфир 3-(3-изобутил-2-оксо 4-[4-(3-о-толилуреидо)фенил]ацетил)пиперазин-1-ил)масляной кислоты.(86 мг, 0,19 ммоль) в ДМФ (1 мл) добавляют метиловый эфир 3-(3-изобутил-2-оксопиперазин-1-ил)масляной кислоты (50 мг, 0,19 ммоль). После перемешивания в течение 16 ч при комнатной температуре этот раствор разбавляют водой и экстрагируют этилацетатом. Объединенные органические экстракты промывают 5% лимонной кислотой, насыщенным раствором NaHCО 3 и солевым раствором, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. После колоночной хроматографии на силикагеле с элюированием смесью 2% MeOH/CH2Cl2 получают 20 мг указанного в заголовке соединения в виде желтого аморфного твердого вещества. МС [М+1]+ 523,3. В.(10,2 мл) в CH2Cl2 (200 мл) добавляют триэтиламин (13,8 мл). Через 1 ч полученный гомогенный раствор концентрируют при пониженном давлении и перекристаллизовывают из ЕtOАс(800 мл) с получением 22 г указанного в заголовке соединения в виде белого твердого вещества. Т.пл. 221-2 С; МС [М+1]+285,2. Анализ: Вычислено для C16H16N2O3: С-(3-Изобутил-2-оксопиперазин-1-ил) масляной кислоты метиловый эфир: МС [М+1]+ 257,3. Указанное в заголовке соединение может быть получено специалистами с использованием одной из следующих литературных ссылок: Смесь метилового эфира 3-[3-(3-метил-12-[4-(3-о-толилуреидо)фенил]ацетиламино бутил)изоксазол-5-ил]пропионовой кислоты (17 мг) в трет-ВuОH (1 мл) и 0,1 н. NaOH (1 мл) перемешивают при комнатной температуре. Через 20 ч эту смесь концентрируют при пониженном давлении, растворяют в воде (5 мл) и экстрагируют ЕtOАс (5 мл 3). Затем водный слой подкисляют до рН 3 1 н. HCl и экстрагируют ЕtOАс. Объединенные органические экстракты промывают солевым раствором, сушат над Na2SO4,фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде белого аморфного твердого вещества. МС [М+1]+ 493,2; 1 Н ЯМР (400 МГц, CD3OD)0,87 (d, 3 Н),0,91 (d, 3H), 1,53-1,66 (m, 3 Н), 2,26 (s, 3 Н), 2,64 К перемешиваемому раствору [4-(3-отолилуреидо)фенил]уксусной кислоты (305 мг,1,07 ммоль), ДИЭА (1,3 мл), ГОБТ (120 мг 0,89 ммоль) и ЭКДИ (170 мг 0,89 ммоль) в CH2Cl2 (8 мл) при комнатной температуре добавляют раствор гидробромида метилового эфира 3-[3-(1 амино-3-метилбутил)изоксазол-5-ил]пропионовой кислоты (272 мг 0,85 ммоль) в CH2Cl2 (12 41 мл). После перемешивания в течение 16 часов при комнатной температуре эту смесь разбавляют CH2Cl2 (20 мл) и вливают в воду. Слои разделяют и водный слой экстрагируют CH2Cl2(20 мл 3). Объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш 40 хроматографией, используя колонку с силикагелем и элюируя смесью 65% ЕtOАс/гексан, с получением 220 мг указанного в заголовке соединения в виде белого аморфного твердого вещества. Т.пл. 153-4 С; МС [М+1]+507,2; 1 Н ЯМР (400 МГц, CDCl3)0,88 (d, J = 6,4 Гц, 6 Н), 1,53-1,66 (m, 3 Н), 2,21 (s, 3 Н), 2,66 (t, J= 7,6 Гц, 2 Н), 3,00 (t, J = 7,6 Гц, 2 Н), 3,49 (s, 2 Н),3,68 (s, 3 Н), 5,15 (dt, J = 6,2 и 8,7 Гц, 1 Н), 5,85 (s,1H), 6,11 (d, J = 8,5 Гц, 1 Н), 6,65 (s, 1H), 7,00 (s,1H), 7,05-7,24 (m, 7H), 7,53 (d, 1H); Анализ: Вычислено для C28H34N4O5: С(66,29), Н (7,11), N (11,11). В. -[3-(1-Амино-3-метилбутил)изоксазол 5-ил]пропионовой кислоты метилового эфира гидробромид. Перемешиваемую суспензию метилового эфира 3-[3-(1-бензилоксикарбониламино-3 метилбутил)изоксазол-5-ил]пропионовой кислоты (320 мг, 0,85 ммоль) в 30% НВr/АсОН (3 мл) осторожно нагревают до гомогенного состояния. Через 4 ч при комнатной температуре оранжевый раствор концентрируют с получением 275 мг указанного в заголовке соединения в виде ярко-оранжевого аморфного твердого вещества. МС [М+1]+ 241,2. Г. Метиловый эфир 3-[3-(1-бензилоксикарбониламино-3-метилбутил)изоксазол-5-ил] пропионовой кислоты. К перемешиваемому раствору бензилового эфира [1-(гидроксииминометил)-3-метилбутил] карбаминовой кислоты (6,0 г, 22,7 ммоль) и метилового эфира пент-4-иновой кислоты (3,8 г 34 ммоль) в СН 2 Сl2 (80 мл) добавляют триэтиламин (0,2 мл), а затем отбеливатель Хлорокс(Clorox) (80 мл). После 4 ч при комнатной температуре органическую фазу отделяют, а водную фазу экстрагируют CH2Cl2 (25 мл 3). Объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют при 42 пониженном давлении с получением желтого масла. Проводят очистку флэш 40 хроматографией, используя колонку с силикагелем и элюируя смесью 65% ЕtOАс/гексан, с получением 2,5 г указанного в заголовке соединения в виде воскообразного светло-желтого твердого вещества. МС [М+1]+ 375,3; 1 Н ЯМР (400 МГц, CDCl3)0,91 (m, 6H),1,51-1,76 (m, 3 Н), 2,67 (t, J = 7,4 Гц, 2H), 3,02 (t,J = 7,5 Гц, 2 Н), 3,67 (s, 3H), 4,89 (m, 1H), 5,08 Смесь бензилового эфира (1-формил-3 метилбутил)карбаминовой кислоты (2,13 г, 8,5 ммоль), гидроксиламина гидрохлорида (0,71 г,10,2 ммоль) и NaOAc (2 г, 24,4 ммоль) в МеОН(20 мл) и воде (20 мл) энергично перемешивают. Через 24 ч эту смесь разбавляют водой (60 мл) и экстрагируют ЕtOАс (50 мл 3). Объединенные органические экстракты промывают водой и солевым раствором, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. После очистки флэш 40 хроматографией с использованием колонки с силикагелем и с элюированием смесью 15-25% ЕtOАс/гексан получают 1,4 г указанного в заголовке соединения в виде белого воскообразного твердого вещества. МС [М+1]+ 265. Пример 3. А. [2-(3-Метил-1-2-[4-(3-о-толилуреидо) фенил]ацетиламинобутил)-4,5-дигидрооксазол 5-ил]уксусная кислота. Смесь бензилового эфира [2-(3-метил-1-2[4-(3-о-толилуреидо)фенил]ацетиламинобутил)-4,5-дигидрооксазол-5-ил]уксусной кислоты(120 мг) и гидроксида палладия (40 мг) в 10 мл ТГФ и 10 мл МеОН встряхивают на аппарате Парра в течение 2 ч при давлении Н 2 30 фунтов/кв.дюйм (206,85 кПа). Смесь фильтруют через целит, и фильтрат концентрируют при пониженном давлении. Остаток суспендируют вEtOAc и концентрируют при пониженном давлении. После растирания с горячим ЕtOАс получают 93 мг указанного в заголовке соединения в виде светло-розового твердого вещества. МС [М+1]+ 481,3; 1 Н ЯМР (400 МГц, ДМСО-d6)0,77-0,87 К перемешиваемой суспензии бензилового эфира 3-гидрокси-4-(4-метил-2-2-[4-(3-о-толилуреидо)фенил]ацетиламинопентаноиламино) масляной кислоты (0,73 г) в СН 2 Сl2 (100 мл) и ТГФ (100 мл) при комнатной температуре добавляют ДАСТ (0,245 мл). Через 2 ч добавляют еще 0,245 мл ДАСТ. Через 2 ч полученный гомогенный раствор разбавляют CH2Cl2 (600 мл),промывают 100 мл насыщенного раствораNaHCO3, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. После очистки флэш 40 хроматографией с использованием колонки с силикагелем и элюирования смесью 5% МеОН/СН 2 Сl2, получают твердое вещество, которое перекристаллизовывают из ЕtOАс с получением 0,255 г указанного в заголовке соединения в виде светло-желтого твердого вещества. МС [М+1]+571,2; 1 Н ЯМР (400 МГц, ДМСО-d6)0,73-0,81 К перемешиваемому раствору 4-метил-22-[4-(3-о-толилуреидо)фенил]ацетиламино пентановой кислоты (3,6 г), гидрохлорида бензилового эфира 4-амино-3-гидроксимасляной кислоты (1,6 г) триэтиламина (1 мл) и ГОБТ(1,06 г) в ДМФ (50 мл) при комнатной температуре добавляют ЭКДИ (1,63 г). После перемешивания в течение 16 ч эту смесь вливают в 1500 мл воды со льдом и перемешивают в течение 20 мин. Полученный осадок отфильтровывают и высушивают с получением твердого вещества кремового цвета. После перекристаллизации из ЕtOАс получают 2,1 г указанного в заголовке соединения в виде белого твердого вещества.(m, 1 Н), 5,05 (s, 2 Н), 6,88 (t, 1 Н), 7,06-7,12 (m,4 Н), 7,26-7,34 (m, 6 Н), 7,75 (d, J = 8,1 Гц, 1 Н),7,92 (dt, 1 Н), 8,06 (s, 1 Н), 8,10 (d, J = 8,1 Гц, 1 Н),9,13 (s, 1H). Г. Гидрохлорид бензилового эфира амино 3-гидроксимасляной кислоты. 1 Смесь бензилового эфира 4-трет-бутоксикарбониламино-3-гидроксимасляной кислоты(2,1 г) в смеси 4 н. HCl/диоксан перемешивают при комнатной температуре в течение 1 ч. Эту смесь концентрируют при пониженном давлении с получением 1,6 г указанного в заголовке соединения в виде белого аморфного твердого вещества. МС [М+1]+ 210,1; 1 Н ЯМР (400 МГц, ДМСО-d6)2,44-2,50 К перемешиваемому раствору 4-третбутоксикарбониламино-3-гидроксимасляной кислоты (2,0 г) в сухом ДМФ (30 мл) при комнатной температуре добавляют K2 СО 3 (2,8 г). Через 15 мин добавляют бензилбромид (1,7 г). Через 16 ч эту смесь вливают в 200 мл воды и экстрагируют EtOAc (200 мл 2). Объединенные органические экстракты промывают 1 н.NaOH (40 мл), водой (40 мл 2) и солевым раствором (40 мл), сушат над MgSO4, фильтруют и концентрируют при пониженном давлении с получением масла. После очистки флэш 40 хроматографией с использованием колонки с силикагелем и с элюированием смесью 30% Смесь 4-амино-3-гидроксимасляной кислоты (2,9 г), 1 н. NaOH (72 мл) и дитрет 45 бутилдикарбоната (6,6 г) в диоксане (72 мл) перемешивают при комнатной температуре. Через 16 ч эту смесь вливают в 200 мл воды и экстрагируют EtOAc (200 мл 2). Водный слой подкисляют до рН 4 3 н. HCl и экстрагируют CH2Cl2(200 мл 2). Объединенные органические экстракты промывают водой (40 мл), сушат над МgSO4, фильтруют и концентрируют при пониженном давлении с получением 2,05 г указанного в заголовке соединения в виде бесцветного масла. МС (М-1) 218,2; 1 Н ЯМР (400 МГц, ДМСО-d6)1,33 (s,9 Н), 2,07 (dd, 1 Н), 2,30 (dd, J = 4,1 и 15,3 Гц,1 Н), 2,87 (t, J = 5,9 Гц, 2 Н), 3,79 (m, 1 Н), 6,70 Смесь бензилового эфира 4-метил-2-2-[4(3-о-толилуреидо)фенил]ацетиламинопентановой кислоты (4,0 г) и гидроксида палладия на углероде (1,0 г) в 200 мл МеОН и 200 мл ТГФ встряхивают на аппарате Парра при давлении Н 2 30 фунтов/кв.дюйм (206,85 кПа). Через 2 ч эту смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении с получением 3,6 г указанного в заголовке соединения в виде белого твердого вещества. МС [М+1]+ 398,3; 1 Н ЯМР (400 МГц, ДМСО-d6)0,79 (d, J = 6,4 Гц, 3H), 0,86 (d, J = 6,4 Гц, 3H), 1,44-1,63 (m,3H), 2,21 (s, 3H), 3,36-3,40 (m, 2 Н), 4,15-4,20 (m,1 Н), 6,91 (t, 1 Н), 7,09-7,14 (m, 4 Н), 7,33 (d, 2H),7,81 (d, 1H), 7,89 (s, 1H), 8,26 (d, 1H) 8,97(s, 1H). З. Бензиловый эфир метил-2-2-[4-(3-отолилуреидо)фенил]ацетиламинопентановой кислоты. К перемешиваемому раствору [4-(3-отолилуреидо)фенил]уксусной кислоты (3,0 г),бензилового эфира L-лейцина (4,2 г), триэтиламина (1,6 мл) и ГОБТ (1,6 г) в сухом ДМФ (50 мл) при комнатной температуре добавляют ЭКДИ (2,4 г). Через 16 ч эту смесь вливают в воду (400 мл) и экстрагируют EtOAc (400 мл 2). Объединенные органические экстракты промывают 5% лимонной кислотой (100 мл), насыщенным NаНСО 3 (100 мл), водой (100 мл) и солевым раствором (100 мл), сушат над MgSO4,фильтруют и концентрируют при пониженном 46 давлении до приблизительно 100 мл. Полученную суспензию фильтруют с получением 4,0 г указанного в заголовке соединения в виде белого твердого вещества. МС [М+1]+ 488,2; 1 Н ЯМР (400 МГц, ДMCO-d6),0,79 (d, J = 6,4 Гц, 3H), 0,86 (d, J = 6,4 Гц, 3H), 1,45-1,63 (m,3H), 2, 21 (s, 3H), 3,37 (s, 2H), 4,26-4,31 (m, 1H),5,07 (s, 2H), 6,91 (t, 1H), 7,09-7,15 (m, 4H), 7,297,37 (m, 7H), 7,81 (d, 1H), 7,86 (s, 1H), 8,44 (d,1H), 8,93 (s, 1H). Пример 4. А. (3-Бензил-2-оксо-4-[4-(3-о-толилуреидо)фенил]ацетилпиперазин-1-ил)пропионовая кислота.(0,7 г) в 10 мл смеси 4 н. HCl/диоксан перемешивают при комнатной температуре. Через 2 ч этот раствор концентрируют при пониженном давлении и остаток растворяют в 1 н. NaOH (50 мл) и экстрагируют EtOAc (20 мл 2). Водную фазу подкисляют до рН 2 6 н. HCl и экстрагируютEtOAc (20 мл 3). Объединенные органические экстракты промывают солевым раствором, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 0,54 г указанного в заголовке соединения в виде белого аморфного твердого вещества. Т.пл. 103-5 С; МС (М-1) 527. Б. трет-Бутиловый эфир (3-бензил-2-оксо 4-[4-(3-о-толилуреидо)фенил]ацетилпиперазин-1-ил)пропионовой кислоты. Указанное в заголовке соединение (белое аморфное твердое вещество; МС (М-1) 583,4) получают аналогично примеру 1 Б, используя в качестве амина трет-бутиловый эфир 3-(3 бензил-2-оксопиперазин-1-ил)пропионовой кислоты, который может быть получен специалистами по методике, приведенной в примере 1 Г. Пример 5. 3-Бензо[1,3]диоксол-5-ил-3-(3 изобутил-2-оксо-4-[4-(3-о-толилуреидо)фенил]ацетилпиперазин-1-ил)пропионовая кислота. Указанное в заголовке соединение (белое аморфное твердое вещество; МС [М+1]+ 615) получают аналогично примеру 4, используя в качестве амина трет-бутиловый эфир 3 бензо[1,3]диоксол-5-ил-3-(3-изобутил-2-оксопиперазин-1-ил)пропионовой кислоты, который может быть получен специалистами по методике, приведенной в примере 1 Г. Пример 6. 3-[5-(2-Карбоксиэтил)-3-(3 метил-1-2-[4-(3-о-толилуреидо)фенил]ацетиламинобутил)-4,5-дигидроизоксазол-5-ил]пропионовая кислота. Указанное в заголовке соединение [М+1]+ получают аналогично примеру 2, используя на стадии Г в качестве исходных соединений бензиловый эфир [1-(гидроксииминометил)-3 метилбутил]карбаминовой кислоты и диэтиловый эфир 4-метиленгептандикарбоновой кислоты. Белое аморфное твердое вещество. Т.пл. 173-5 С; МС [М+1]+567,2; Анализ: Вычислено для C30H38N4O7: С Указанное в заголовке соединение получают аналогично примеру 2, используя в качестве исходных соединений на стадии Г бензиловый эфир [1-(гидроксииминометил)-3-метил] бутил]карбаминовой кислоты и метиловый эфир 4-пентеновой кислоты. Светло-янтарное твердое вещество. 1 Н ЯМР (400 МГц, ДМСО-d6)0,79 (d, J = 6,0 Гц, 3H), 0,84 (d, J = 5,8 Гц, 3H), 1,48-1,67 (m,5 Н), 2,19-2,24 (m, 2 Н), 2,20 (s, 3H), 2,46-2,54 (m,1 Н), 2,93 (dt, J = 10,6 и 17,1 Гц, 1 Н), 3,32 (s, 2 Н),4,43 (m, 1 Н), 4,62 (m, 1 Н), 6,90 (t, J = 7,5 Гц, 1 Н),7,08-7,13 (m, 4 Н), 7,33 (d, J = 8,1 Гц, 2 Н), 7,80 (d, Указанное в заголовке соединение получают аналогично примеру 2 А-В, используя в качестве исходного соединения метиловый эфир 3-[2-(1-бензилкарбониламино-3-метилбутил) оксазол-5-ил]пропионовой кислоты. Белое твердое вещество; т.пл. 168-170 С; 1 Н ЯМР (400 МГц, ДМСО-d6)0,77 (d, J = 6,4 Гц, 3H), 0,83 (d, J = 6,6 Гц, 3H), 1,44-1,63 (m,3H), 2,19 (s, 3H), 2,50 (t, J = 7,4 Гц, 2 Н), 2,79 (t, J Смесь метилового эфира 5-(2-бензилоксикарбониламино-4-метилпентаноиламино)4-оксопентановой кислоты (300 мг) и РОСl3 (351 мг) в толуоле (10 мл) нагревают с обратным холодильником в течение 3 ч. Затем добавляют еще 351 мг РОСl3, и эту смесь нагревают с обратным холодильником в течение последующих 2 ч. Смесь охлаждают до комнатной температуры, вливают в водный раствор бикарбоната и экстрагируют EtOAc (2100 мл). Объединенные органические экстракты промывают водой(20 мл) и солевым раствором (20 мл) и сушат над MgSO4. Полученную смесь фильтруют и концентрируют при пониженном давлении с получением масла. После очистки флэш 40 хроматографией с использованием колонки с силикагелем и с элюированием смесью 2,5% МеОН в К перемешиваемому раствору 2-бензилоксикарбониламино-4-метилпентановой кислоты (1,3 г), гидрохлорида метилового эфира 5 амино-4-оксопентановой кислоты (0,90 г) и ГОБТ (0,67 г) в ДМФ (15 мл) при комнатной температуре добавляют TEA (0,7 мл), а затем ЭКДИ (1,05 г). После перемешивания в течение 16 ч смесь вливают в воду (100 мл) и экстрагируют EtOAc (2100 мл). Объединенные органические экстракты промывают 5% лимонной кислотой (20 мл), насыщенным водным раствором бикарбоната (20 мл) и водой (20 мл), сушат над MgSO4, отфильтровывают и концентрируют при пониженном давлении с получением масла. После очистки флэш 40 хроматографией с использованием колонки с силикагелем и с элюированием смесью 2,5% МеОН/СН 2 Сl2 получают 0,53 г указанного в заголовке соединения в виде масла. МС [М+1]+ 393. Пример 9. 3-[3-(1-2-[4-(3-о-Толилуреидо) фенил]ацетиламиноциклопентил)изоксазол-5 ил]пропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 2, используя на стадии Г в качестве исходных соединений бензиловый эфир [1-(гидроксииминометил)циклопентил]карбаминовой кислоты и метилпент-4 ионат. Белое твердое вещество; т.пл. 195-7 С; МС [М+1]+ 491,3; Анализ: Вычислено для C27H30N4O5: С Указанное в заголовке соединение получают аналогично примеру 2, используя на стадии Б [4-(3-пиридин-2-илуреидо)фенил]уксусную кислоту. Белое твердое вещество; т.пл. 159-161 С; 1 Н ЯМР (400 МГц, CD3OD)0,87 (d, J = 6,0 Гц, 3H), 0,91 (d, J = 6,2 Гц, 3H), 1,56-1,73 (m, 004792 Указанное в заголовке соединение получают аналогично примеру 1 В, используя в качестве исходных соединений 2-пиридилизоцианат и 4-аминофенилуксусную кислоту. МС [М+1]+ 272,2. Пример 11. А. [2-(3-Метил-1-2-[4-(3-пиридин-2-илуреидо)фенил]ацетиламинобутил)тиазол-5-ил] пропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 2 А-В, используя [4(3-пиридин-2-илуреидо)фенил]уксусную кислоту на стадии 2 Б и метиловый эфир 3-[2-(1 бензилоксикарбониламино-3-метилбутил)тиазол-5-ил]пропионовой кислоты на стадии 2 В. Не совсем белое твердое вещество; т.пл. 173-5 С; 1 Н ЯМР (400 МГц, CD3OD)0,88 (d, J = 6,6 Гц, 3H), 0,92 (d, J = 6,6 Гц, 3H), 1,60-1,77 (m,3H), 2,59 (t, J = 7,3 Гц, 2 Н), 3,05 (t, J = 7,3 Гц,2 Н), 3,50 (s, 2 Н), 5,19 (q, 1H), 6,96-6,99 (m, 1H),7,14(d, 1H), 7,24 (d, 2H), 7,38 (s, 1H), 7,46 (d,2 Н), 7,67-7,71 (m, 1H), 8,25 (d, 1H), 8,69 (d, 1H); МС [М+1]+ 496,2. Б. Метиловый эфир [2-(1-бензилоксикарбониламино-3-метилбутил)тиазол-5-ил]пропионовой кислоты. Смесь метилового эфира 5-(2-бензилоксикарбониламино-4-метилпентаноиламино)4-оксопентановой кислоты (0,96 г) и реагента Лавессона [2,4-бис(4-метоксифенил)-1,3-дитиа 2,4-дифосфэтан-2,4-дисульфид] (2,4 г) в 20 мл безводного толуола нагревают с обратным холодильником. Через 5 ч смесь вливают в воду(200 мл) и экстрагируют EtOAc (2200 мл). Объединенные органические экстракты промывают водой (40 мл) и солевым раствором (40 мл), сушат над MgSO4, фильтруют и концентрируют при пониженном давлении до образования Указанное в заголовке соединение получают аналогично примеру 2, используя в качестве исходных соединений бензиловый эфир Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; 1 Н ЯМР (400 МГц, ДMCO-d6),0,81 (d, J = 6,4 Гц, 3H), 0,87 (d, J = 6,4 Гц, 3H), 1,56-1,74 (m,3H), 2,21 (s, 3H), 2,53 (t, J = 7,3 Гц, 2 Н), 2,96 (t, J Указанное в заголовке соединение получают аналогично примеру 2, используя 4-[3-(4 метилпиридин-3-ил)уреидо]фенилуксусную кислоту на стадии Б. Белое твердое вещество; МС [М-1]+ 492. Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 173-5 С; МС [М-1]+ 527. Анализ: Вычислено для C26H29ClN4O4S: С Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 197-198 С; МС [М-1]+ 523. Анализ: Вычислено для C27H32N4O5S: С Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 83-85 С; МС [М-1] 511,1. Пример 18. А. 3-[3-(3-Метил-1-2-[4-(3-о-толилуреидо)фенил]ацетиламинобутил)изоксазол-5-ил] акриловая кислота. Указанное в заголовке соединение получают аналогично примеру 2, используя на стадии В в качестве исходного соединения этиловый эфир 3-[3-(1-бензилоксикарбониламино-3 метилбутил)изоксазол-5-ил]акриловой кислоты. Белое твердое вещество; т.пл. 136-8 С; МС [М-1]+ 489. Б. Этиловый эфир 3-[3-(1-бензилоксикарбониламино-3-метилбутил)изоксазол-5-ил]акриловой кислоты. Перемешиваемую смесь бензилового эфира [1-(5-формилизоксазол-3-ил)-3-метилбутил] карбаминовой кислоты (407 мг, 1,3 ммоль), пиридина (10 мл) и этилгидромалоната (255 мг, 1,9 ммоль) нагревают до 55 С. Через 2 дня смесь охлаждают до комнатной температуры, вливают в воду и экстрагируют EtOAc (3 х). Объединенные органические экстракты промывают 1 н.NaSO4, фильтруют и концентрируют при пониженном давлении с получением 480 мг желтого масла. После очистки флэш 40 (малой) хроматографией с элюированием смесью 1:3 EtOAc/ гексан получают 220 мг указанного в заголовке соединения в виде светло-желтого масла. МС [М+1]+ 387. В. Бензиловый эфир [1-(5-формилизоксазол-3-ил)-3-метилбутил]карбаминовой кислоты. Перемешиваемую смесь бензилового эфира [1-(5-диэтоксиметилизоксазол-3-ил)-3-метилбутил]карбаминовой кислоты (920 мг, 24 ммоль), ацетона (50 мл) и H2SO4 (10 капель) нагревают с обратным холодильником. Через 35 мин смесь охлаждают до комнатной температуры, нейтрализуют твердым NaHCO3 и концентрируют при пониженном давлении. Полученную пасту переносят в EtOAc, промывают водой и солевым раствором, сушат над Na2SO4, фильт 004792 54 руют и концентрируют при пониженном давлении с получением светло-желтого масла. После очистки флэш 40 (малой) хроматографией с элюированием смесью 1:3 EtOAc/гексан получают 407 мг указанного в заголовке соединения в виде светло-желтого масла. МС [М+1]+ 317. Г. Бензиловый эфир [1-(5-диэтоксиметилизоксазол-3-ил)-3-метилбутил]карбаминовой кислоты. Смесь бензилового эфира [1-(гидроксииминометил)-3-метилбутил]карбаминовой кислоты (1,2 г 4,5 ммоль), 3,3-диэтоксипропина(1,5 г 11,4 ммоль), СН 2 Сl2 (40 мл) и ТЭА (триэтиламин) (6 капель) перемешивают до гомогенного состояния, затем добавляют отбеливатель Хлорокс (20 мл). После энергичного перемешивания в течение 12 ч слои разделяют и водный слой экстрагируют СН 2 Сl2 (3 х). Объединенные органические экстракты сушат надNa2SO4, фильтруют и концентрируют при пониженном давлении с получением желтого масла. После очистки флэш 40 (малой) хроматографией с элюированием 10% EtOAc в гексане,получают 920 мг указанного в заголовке соединения в виде бесцветного масла. МС [М+1]+ 391. Пример 19. 3-2-[1-(2-4-[3-(2,6-Дихлорфенил)уреидо]фенилацетиламино)-3-метилбутил]тиазол-5-илпропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 148-50 С; МС [М-1]+ 561. Пример 20. 3-2-[1-(2-[4-[3-(2,6-Диметилфенил)уреидо]фенил]ацетиламино)-3-метилбутил]тиазол-5-илпропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 11, используя соот 55 ветствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 125-7 С; МС [М-1]+ 521. Пример 21. 3-2-[1-(2-4-[3-(2-Хлор-6-метилфенил)уреидо]фенилацетиламино)-3-метилбутил]тиазол-5-илпропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 160-2 С; МС [М-1]+ 541. Пример 22. 3-[2-(3-Метил-1-2-[4-(3 фенилуреидо)фенил]ацетиламинобутил) тиазол-5-ил]пропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 146-8 С,МС [М+1]+ 495,3. Пример 23. N-Гидрокси-3-[2-(3-метил-12-[4-(3-о-толилуреидо)фенил]ацетиламино бутил)тиазол-5-ил]пропионамид. Гидроксиламина гидрохлорид (6,96 г) суспендируют в метаноле (35 мл) и нагревают до 90 С. Этот раствор добавляют к гидроксиду калия (8,34 г) и растворяют в метаноле (21 мл). После 15 мин перемешивания этот раствор фильтруют и добавляют метиловый эфир 3-[2(3-метил-1-2-[4-(3-о-толилуреидо)фенил]ацетиламинобутил)тиазол-5-ил]пропионовой кислоты (0,80 г, 1,53 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин, добавляют 1 н. HCl (50 мл) и метанол удаляют под вакуумом. Остаток распределяют между этилацетатом и хлористоводородной кислотой (1 н.). Органическую часть 56 сушат над сульфатом натрия и растворитель удаляют под вакуумом. Указанное в заголовке соединение (0,175 г, 17%) выделяют кристаллизацией из смеси этилацетата и метанола. МС [М+1] 524,1. Пример 24. 3-3-[1-(2-4-[3-(2-Хлорфенил) уреидо]фенилацетиламино)-3-метилбутил] изоксазол-5-илпропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 2, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; т.пл. 143-5 С,МС [М-1]+ 511,2. Пример 25. 3-[2-(1-2-[4-(3-о-Толилуреидо)фенил]ацетиламинобут-3-енил)тиазол-5-ил] пропионовя кислота. Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое аморфное твердое вещество; МС [M+l]+ 493. Пример 26. А. Этиловый эфир 3-3-[1-(2-4-[3-(2-хлорфенил)уреидо]фенилацетиламино)-3-метилбутил]изоксазол-5-ил-3-оксопропионовой кислоты. Указанное в заголовке соединение получают аналогично примеру 2, используя на стадии Б гидрохлорид этилового эфира 3-[3-(1 амино-3-метилбутил)изоксазол-5-ил]-3-оксопропионовой кислоты. Белое твердое вещество; т.пл. 150-2 С,МС [М+1]+ 555,5. Б. Гидрохлорид этилового эфира 3-[3-(1 амино-3-метилбутил)изоксазол-5-ил]3-оксопропионовой кислоты. 57 Раствор этилового эфира 3-[3-(1-третбутоксикарбониламино-3-метилбутил)изоксазол-5-ил]-3-оксопропионовой кислоты (1,4 г, 3,9 ммоль) в 4 М HCl в диоксане (5 мл) перемешивают при комнатной температуре. Через 3 ч эту смесь концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде светло-желтого твердого вещества. МС [М+1]+ 269,0. В. Этиловый эфир 3-[3-(1-трет-бутоксикарбониламино-3-метилбутил)изоксазол-5-ил]3-оксопропионовой кислоты. Указанное в заголовке соединение получают из 3-(1-трет-бутоксикарбониламино-3 метилбутил)изоксазол-5-карбоновой кислоты путем обработки карбонилдиимидазолом с последующей обработкой магниевой солью моноэтилмалоната, как описано в Angew. Chem. Int Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; МС [М+1]+ 493. Пример 28. N-1-[5-(3-Метансульфониламино-3-оксопропил)тиазол-2-ил]-3-метилбутил-2-[4-(3-о-толилуреидо)фенил]ацетамид. Смесь 3-[2-(3-метил-1-2-[4-(3-о-толилуреидо)фенил]ацетиламинобутил)тиазол-5-ил] пропионовой кислоты (пример 13) (91 мг, 0,2 ммоль), ДМФ (5 мл), ЭКДИ (48 мг, 0,2 ммоль) и ДМАП (диметиламинопиридин) (26 мг, 0,2 ммоль) перемешивают при комнатной температуре. Через 10 мин добавляют метансульфонамид (51 мг, 0,5 ммоль). После перемешивания в течение 16 ч раствор разбавляют EtOAc и промывают 1 н. HCl (2 х). Органический слой сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученное твердое вещество очищают флэш 12 хроматографией,элюируя 10% АсОН в EtOAc, с получением 30 58 мг указанного в заголовке соединения в виде белого аморфного вещества. МС [М-1]+ 584. Пример 29. 2-4-[3-(2-Хлорфенил)уреидо]фенил-N-1-[5-(3-метансульфониламино-3 оксопропил)тиазол-2-ил]-3-метилбутил ацетамид. Указанное в заголовке соединение получают аналогично примеру 28 из 3-2-[1-(2-4-[3(2-хлорфенил)уреидо]фенилацетиламино)-3 метилбутил]тиазол-5-илпропионовой кислоты. Бесцветное масло; МС [М+1]+ 607. Пример 30. 3-[2-(2-[4-(3-о-Толилуреидо) фенил]ацетиламинометил)тиазол-5 ил]пропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; МС [М+1]+ 453. Пример 31. 3-2-[(2-4-[3-(2-Хлорфенил) уреидо]фенилацетиламино)метил]тиазол-5-ил пропионовая кислота. Указанное в заголовке соединение получают аналогично примеру 11, используя соответствующие исходные соединения и реагенты. Белое твердое вещество; МС [М+1]+ 473. Пример 32. А. 3-[2-(1-[4-(3-о-Толилуреидо)фенил] ацетилпирролидин-2-ил)тиазол-5-ил]пропионовая кислота. Готовят раствор метилового эфира 3-[2-(1[4-(3-о-толилуреидо)фенил]ацетилпирролидин-2-ил)тиазол-5-ил]пропионовой кислоты(2 М, 4 мл). Этот раствор перемешивают в течение 4 ч и распределяют между водной хлористоводородной кислотой (1 н., 30 мл) и этилацета 59 том (100 мл). Водную часть экстрагируют этилацетатом (50 мл). Объединеные органические части экстрагируют солевым раствором (20 мл),и растворитель удаляют под вакуумом с получением указанного в заголовке соединения (0,3 г, 94%). 1 Н ЯМР (400 МГц, CD3OD):7,60 (d, J = 7,3 Гц, 1 Н), 7,46 (s, 0,3H), 7,39 (d, J = 8,5 Гц,2,7 Н), 7,29 (d, J = 8,5 Гц, 0,6), 7,18 (m, 3H), 6,99 Готовят раствор метилового эфира 3-(2 пирролидин-2-илтиазол-5-ил)пропионовой кислоты (приблизительно 1,09 ммоль) в диметилформамиде. К этому раствору добавляют [4-(3 о-толилуреидо)фенил]уксусную кислоту (0,38 г,13 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (0,33 г, 17 ммоль) и 1-гидроксибензотриазол (0,24 г, 18 ммоль). Реакционную смесь перемешивают 1 ч и добавляют триэтиламин (0,15 г, 1,46 ммоль). Затем реакционную смесь оставляют перемешиваться в течение ночи (приблизительно 16 ч), а затем ее вливают в воду (100 мл) и экстрагируют этилацетатом (350 мл). Объединенные органические части экстрагируют насыщенным раствором бикарбоната натрия (30 мл), водой (215 мл) и солевым раствором (20 мл), затем сушат над сульфатом магния. Растворитель удаляют под вакуумом и остаток хроматографируют на колонке с диоксидом кремния, элюируя смесью метанол:уксусная кислота:этилацетат (1:1:98), с получением указанного в заголовке соединения 60 температуре в течение 1 ч. Затем растворитель удаляют под вакуумом, а остаток растворяют в метиленхлориде. Метиленхлорид удаляют под вакуумом, а остаток вновь растворяют в метиленхлориде. Растворитель удаляют под вакуумом, а остаток используют без очистки. МС: Вычислено для C11H16N2O2S: 240,09. Обнаружено: (М+1): 241,2. Г. трет-Бутиловый эфир 2-[5-(2-метоксикарбонилэтил)тиазол-2-ил]пирролидин-1-карбоновой кислоты. Готовят раствор трет-бутилового эфира 2(4-метоксикарбонил-2-оксобутилкарбамоил) пирролидин-1-карбоновой кислоты (0,57 г, 1,66 ммоль) в толуоле (15 мл), а затем добавляют реагент Лавессона (0,405 г, 1,0 ммоль). Реакционную смесь нагревают с обратным холодильником в течение 3 ч и вливают в воду (150 мл). Эту смесь экстрагируют этилацетатом (350 мл). Объединенные органические части экстрагируют насыщенным раствором бикарбоната натрия (230 мл) и солевым раствором (30 мл),затем сушат над сульфатом магния. Растворитель удаляют под вакуумом, а остаток хроматографируют на колонке Biotage 40s, элюируя смесью этилацетат:гексан (1:1), с получением указанного в заголовке соединения (0,37 г,65%). 1 Н ЯМР (400 МГц, CDCl3):7,37 (s, 1H,тиазол), 5,18 (m, 0,4H), 5,05 (m, 0,6 Н), 3,67 (s,3H), 3,35-3,60 (m, 2 Н), 3,10 (m, 2 Н), 2,64 (t, J=7,5 Гц, 2 Н), 2,20 (m, 2 Н), 1,90 (m, 2 Н), 1,62 (bs, 1H),1,46 (bs, 4H), 1,31 (bs, 5H); МС: Вычислено для C16H24N2O4S: 340,15. Обнаружено: (М+1): 341,0. Д. трет-Бутиловый эфир 2-(4-метоксикарбонил-2-оксобутилкарбамоил)пирролидин-1 карбоновой кислоты.(30 мл) и добавляют гидрохлоридную соль метилового эфира 5-амино-4-оксопентановой кислоты (0,60 г, 33 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Затем добавляют триэтиламин и перемешивание продолжают в течение ночи(приблизительно 16 ч). Реакционную смесь вливают в воду (300 мл) и экстрагируют этилацета
МПК / Метки
МПК: A61K 31/42, A61P 29/00, C07D 241/08
Метки: связывания, ингибиторы, респираторных, vla-4-зависимого, аутоиммунных, непептидные, полезные, заболеваний, лечении, воспалительных, клеточного
Код ссылки
<a href="https://eas.patents.su/30-4792-nepeptidnye-ingibitory-vla-4-zavisimogo-kletochnogo-svyazyvaniya-poleznye-v-lechenii-vospalitelnyh-autoimmunnyh-i-respiratornyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Непептидные ингибиторы vla-4-зависимого клеточного связывания, полезные в лечении воспалительных, аутоиммунных и респираторных заболеваний</a>
Предыдущий патент: Композиции на основе слитого белка ов и способы их применения
Следующий патент: Химерный белок растворимого рецептора интерлейкина-6/лиганда, его аналоги и способы применения
Случайный патент: Новое применение гетероциклических соединений, активных в качестве ингибиторов бета-лактамаз, и содержащие их фармацевтические композиции












