4-,5-, 6-и 7-индольные производные, полезные при лечении заболеваний центральной нервной системы
Формула / Реферат
1. 4-, 5-, 6- или 7-Метилензамещенное индолильное производное формулы I
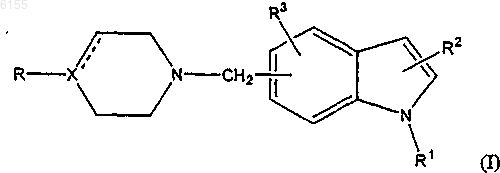
где заместитель R представляет собой арил или гетероарил, где указанная арильная или гетероарильная группа может быть замещена один или несколько раз заместителями, выбранными из атома галогена, циано-, нитрогруппы, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C3-8-циклоалкила, C3-8-циклоалкил-C1-6-алкила, C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-C1-6-алкила, трифторметила, трифторметилсульфонила, C1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди-(C1-6-алкил) аминогруппы, ацильной, аминокарбонильной и метилендиоксигруппы;
X представляет собой N, C или CH при условии, что пунктирная линия указывает на связь, когда X представляет собой C, и на отсутствие связи, когда X представляет собой N или CH;
заместитель R1 представляет собой атом водорода, C1-6-алкил, C2-6-алкенил, C2-6-алкинил, C3-8-циклоалкил, C3-8-циклоалкил-C1-6-алкил, арил, арил-C1-6-алкил-, ацил, тиоацил, C1-6-алкилсульфонил, трифторметилсульфонил или арилсульфонил; и
заместители R2 и R3 независимо друг от друга выбраны из атома водорода, атома галогена, циано-, нитрогруппы, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C3-8-циклоалкила, C3-8-циклоалкил-C1-6-алкила, C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-C1-6-алкила, трифторметила, трифторметилсульфонила, C1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди-(C1-6-алкил)аминогруппы, ацила и аминокарбонила;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где индол присоединен к группе
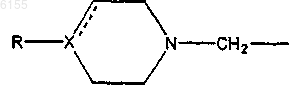
через положение 5 или положение 6 индола, в особенности через положение 5.
3. Соединение по пп.1 и 2, где заместитель R представляет собой необязательно замещенный фенил.
4. Соединение по пп.1 и 2, где заместитель R представляет собой группу формулы
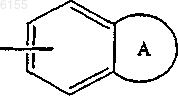
где A представляет собой необязательно замещенное, насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать один или два гетероатома, выбранных из N, O и S.
5. Соединение по п.4, где заместитель R представляет собой необязательно замещенный индолил или фенил, замещенный метилендиоксигруппой.
6. Соединение по пп.1 и 2, где X представляет собой N.
7. Соединение по пп.1 и 2, где X представляет собой C, а пунктирная линия представляет собой связь.
8. Соединение по пп.1 и 2, где X представляет собой CH, а пунктирная линия указывает на отсутствие связи.
9. Соединение по п.3, где фенильная группа R необязательно замещена один или несколько раз заместителями, выбранными из атома галогена, трифторметила, нитро-, цианогруппы, C1-6-алкила, C1-6-алкокси-, гидрокси- и метилендиоксигруппы.
10. Соединение по п.4, где группа R необязательно замещена один или несколько раз заместителями, выбранными из атома галогена, трифторметила, нитро-, цианогруппы, C1-6-алкила, C1-6-алкокси- и гидроксигруппы.
11. Соединение по п.1, которое представляет собой
5-[[4-(4-хлорфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(5-индолил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-метоксифенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-фенилпиперазин-1-ил]метил]-1H-индол,
5-[4-(4-хлорфенил)-3,6-дигидро-2H-пиридин-1-илметил]-1H-индол,
6-[[4-(4-хлорфенил)пиперазин-1-ил]метил]-1H-индол,
6-[[4-(4-метоксифенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-фторфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-хлорфенил)пиперидин-1-ил]метил]-1H-индол,
5-[[4-(2-хлорфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(3-хлорфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(2,3-дихлорфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(3,4-дихлорфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-бромфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-йодфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-гидроксифенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(2-метоксифенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(3-метоксифенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(3,4-диметоксифенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-метилфенил)пиперазин-1-ил]метил]-1H-индол,
5-[[4-(4-метилфенил)пиперидин-1-ил]метил]-1H-индол,
6-[[4-(4-метилфенил)пиперазин-1-ил]метил]-1H-индол,
6-[[4-(4-метилфенил)пиперидин-1-ил]метил]-1H-индол,
5-[[4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1H-ндол,
6-[[4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1H-индол,
5-[[(4-бензо[1,3]диоксол-5-ил)пиперазин-1-ил]метил]-1H-индол
или их фармацевтически приемлемую соль.
12. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по любому из пп.1-11 в терапевтически эффективном количестве вместе с одним или несколькими фармацевтически приемлемыми носителями или разбавителями.
13. Применение соединения по любому из пп.1-11 при производстве медикаментов, полезных для лечения психозов, положительных симптомов шизофрении, нарушений познавательной способности, ADHD и дискинезии, являющейся результатом лечения болезни Паркинсона с помощью L-Dopa.
14. Способ лечения положительных симптомов шизофрении, других психозов, нарушений познавательной способности, включающий введение терапевтически приемлемого количества соединения по любому из пп.1-11.
Текст
006155 Настоящее изобретение относится к новому классу 4-, 5-, 6-и 7-индольных производных, обладающих сродством к рецептору допамина D4. Эти соединения могут быть использованы при лечении некоторых психических и неврологических заболеваний, в частности, психозов. Рецепторы допамина D4 принадлежат к подсемейству рецепторов допамина D2, которые, как считается, отвечают за антипсихотический эффект нейролептиков. Побочные эффекты нейролептических лекарственных средств, которые проявляют свое действие через подавление рецепторов D2, как известно,обусловлены D2-рецепторным антагонизмом в стриарной области головного мозга. Однако рецепторы допамина D4 расположены преимущественно в областях головного мозга, не относящихся к неостатуму,что подтверждает тот факт, что селективные антагонисты рецепторов допамина D4 будут свободны от экстрапирамидальных побочных эффектов. Это утверждение иллюстрируется антипсихотическим действием клозапина, который проявляет более высокое сродство к рецепторам D4, чем к рецепторам D2, и не имеет экстрапирамидальных побочных эффектов (Van Tol et al., Nature 1991, 350, 610; Hadley, MedicinalResearch Reviews 1996, 16, 507-526, и Sanner, Exp. Opin. Ther. Patents 1998, 8, 383-393). Ряд лигандов D4, которые, как было постулировано, являются селективными антагонистами рецепторов D4 (L-745879 и U-101958), представлен как обладающий антипсихотической активностью (Mansbach et al., Psychopharmacology 1998, 135, 194-200). Однако недавно было сообщено, что эти соединения являются неполными агонистами рецепторов D4 при различных оценках эффективности in vitro (Gazi etal., Br. J. Pharmacol. 1998, 124, 889-896; и Gazi et al., Br. J. Pharmacol. 1999, 128, 613-620). Кроме того, было показано, что клозапин, который представляет собой эффективное антипсихотическое средство, является слабым антагонистом D4 (Gazi et al., Br. J. Pharmacol. 1999, 128, 613-620). Таким образом, лиганды D4, которые являются неполными агонистами или антагонистами рецепторов D4, могут оказывать положительный эффект в отношении психозов. Антагонисты допамина D4 также могут быть использованы при лечении нарушений познавательной способности (Jentsch et al., Psychopharmacology, 1999, 142, 78-84). Также был подтвержден тот факт, что селективные антагонисты допамина D4 могут быть полезны при ослаблении дискинезии, возникающей в результате лечения болезни Паркинсона с помощью L-Dopa(Tahar et al., Eur. J. Pharmacol. 2000, 399, 183-186). Кроме того, опубликовано доказательство генетической связи между подтипом "первоначальная невнимательность" повышения дефицита внимания (ADHD, attention deficit hyperactivity disorder) и полиморфизмом тандемных дупликаций при генном кодировании рецептора допамина D4 (McCracken et al.,Mol. Psychiat. 2000, 5, 531-536). Это ясно указывает на связь между рецептором допамина D4 и повышением дефицита внимания, и лиганд, влияющий на этот рецептор, может быть полезным при лечении этого конкретного заболевания. Таким образом, лиганды рецептора допамина D4 являются потенциальными лекарственными средствами для лечения психозов, положительных симптомов шизофрении, нарушений познавательной способности, повышенного дефицита внимания (ADHD) и дискинезии, являющейся результатом лечения болезни Паркинсона с помощью L-Dopa. В частности, соединения настоящего изобретения считаются полезными при лечении положительных симптомов шизофрении в отсутствие экстрапирамидальных побочных эффектов. Ряд лигандов допамина D4, которые могут быть описаны общей формулой где Het представляет собой 3-пирроло[2,3-b]пиридинил, 2-бензимидазолил, 3-индазолил, 2-индолил, 3 индолил, 3-бензофуранил, имидазо[1,2-а]пиридинил, 3-фуро[2,3-b]пиридинил и 3-бензофуранил, а Аr представляет собой необязательно замещенный фенил или гетероарил, описан в публикациях WO 94/20459, WO 94/20497, WO 94/22839, WO 94/21630, WO 94/24105, WO 99/09025, WO 95/29911, WO 96/25414, US 5700802 и J. Med. Chem. 1996, 39(19), 1941-2. Патентная публикация ЕР 164633 относится к соединениям формулы где Аr представляет собой необязательно замещенный фенил или тиенил, n равно 2-4 и Ind представляет собой необязательно замещенный 4-индолил. Эти соединения, как сказано, ингибируют связывание агонистов и антагонистов допамина со стриарными рецепторами и обладают седативным, успокаивающим, антидепрессантным, нейролептическим, обезболивающим и противогипертензивным действием. В заявке не представлено никаких результатов биологических испытаний. Патент ЕР 372667 относится к соединениям, имеющим формулу где Ar представляет собой 2-метоксифенил или 1-нафтил, n равно 2-4, a R представляет собой различные гетероциклические кольца, например, 5-оксиндол. Указано, что соединения обладают нейролептической активностью, и в заявке представлены данные, иллюстрирующие способность соединений связываться с рецепторами допамина D2. В патенте ЕР 0281309 описаны некоторые пиперазинилгетероциклические соединения формулы где фрагмент А вместе с фенилом, к которому он присоединен, образует хинолил, 2-гидроксихинолил,бензотиазолил, 2-аминобензотиазолил, бензизотиазолил, индазолил, 3-гидроксииндазолил, индолил, и др., и Ar представляет собой необязательно замещенный нафтил, хинолил, изохинолил, индолил и др. Особенно n равно 1 или 2. Соединения, как сказано, могут быть использованы для лечения психозов, а механизм действия реализуется главным образом через модулирование рецептора допамина D2, серотонинового 5-НТ 2A-рецептора и альфа-адренергического рецептора (J. Med. Chem., 1996, 39, pp. 143-148) . В соответствии с настоящим изобретением предложена новая группа соединений, которые являются селективными лигандами допамина D4. Задачей настоящего изобретения является разработка соединений, которые являются неполными агонистами или антагонистами рецептора допамина D4. Таким образом, настоящее изобретение относится к 4-, 5-, 6- или 7-метилензамещенным индолильным производным формулы I где заместитель R представляет собой арил или гетероарил, где указанная арильная и гетероарильная группы могут быть замещены один или несколько раз заместителями, выбранными из атома галогена,циано-, нитрогруппы, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8-циклоалкила, С 3-8-циклоалкил-С 1-6 алкила, C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-С 1-6-алкила, трифторметила, трифторметилсульфонила, C1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди-(C1-6-алкил)аминогруппы, ацильной, аминокарбонильной и метилендиоксигруппы;X представляет собой N, С или СН при условии, что пунктирная линия указывает на связь, когда X представляет собой С, и на отсутствие связи, когда X представляет собой N или СН; заместитель R1 представляет собой атом водорода, C1-6-алкил, С 2-6-алкенил, С 2-6-алкинил, С 3-8 циклоалкил, С 3-8-циклоалкил-С 1-6-алкил, арил, арил-С 1-6-алкил-, ацил, тиоацил, C1-6-алкилсульфонил,трифторметилсульфонил или арилсульфонил; и заместители R2 и R3 независимо друг от друга выбраны из атома водорода, атома галогена, циано-,нитрогруппы, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8-циклоалкила, С 3-8-циклоалкил-С 1-6-алкила,C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-С 1-6-алкила, трифторметила, трифторметилсульфонила, С 1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди-(C1-6-алкил)-аминогруппы, ацила и аминокарбонила. Предпочтительные соединения изобретения выбраны из следующих соединений: 5-4-(4-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(5-индолил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-фенилпиперазин-1-ил]метил]-1 Н-индол,5-[4-(4-хлорфенил)-3,6-дигидро-2 Н-пиридин-1-илметил]-1 Н-индол,6-4-(4-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,6-4-(4-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-фторфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-хлорфенил)пиперидин-1-ил]метил]-1 Н-индол,5-4-(2-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(2,3-дихлорфенил)пиперазин-1-ил]метил]-1 Н-индол,-2 006155 5-4-(3,4-дихлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-бромфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-йодфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-гидроксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4- (2-метоксифенил) пиперазин-1-ил] метил]-1 Н-индол,5-4-(3-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3,4-диметоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метилфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метилфенил)пиперидин-1-ил]метил]-1 Н-индол,6-4-(4-метилфенил)пиперазин-1-ил]метил]-1 Н-индол,6-4-(4-метилфенил)пиперидин-1-ил]метил]-1 Н-индол,5-4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1 Н-индол,6-4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1 Н-индол,5-(4-бензо[1,3]диоксол-5-ил)пиперазин-1-ил]метил]-1 Н-индол,или их фармацевтически приемлемая соль. В одном из вариантов осуществления настоящее изобретение относится к таким соединениям, в которых индол присоединен к группе через положение 5 или положение 6 индола, в особенности через положение 5. В другом варианте осуществления настоящее изобретение относится к таким соединениям, в которых заместитель R представляет собой необязательно замещенный фенил. В еще одном конкретном варианте осуществления изобретение относится к описанным выше соединениям, где заместитель R представляет собой группу формулы где А представляет собой необязательно замещенное, насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать один или два гетероатома, выбранных из N, О и S. Заместители могут представлять собой один или несколько заместителей, выбранных из атома водорода, атома галогена,циано-, нитрогруппы, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8-циклоалкила, С 3-8-циклоалкил-С 1-6 алкила, C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-С 1-6-алкила, трифторметила, трифторметилсульфонила, C1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди-(C1-6-алкил)аминогруппы, ацила и аминокарбонила. В особенно предпочтительном варианте осуществления изобретения заместитель R представляет собой необязательно замещенный индолил или фенил, замещенный метилендиоксигруппой. В другом конкретном варианте осуществления настоящее изобретение относится к таким соединениям, в которых заместитель R представляет собой необязательно замещенный 5- или 6-индолил. Изобретение включает в особенности такие соединения, в которых X представляет собой N, а пунктирная линия означает отсутствие связи. Соединения в соответствии с настоящим изобретением также включают соединения, в которых X представляет собой С, а пунктирная линия означает связь. Изобретение также включает соединения, в которых X представляет собой СН, а пунктирная линия означает отсутствие связи. В еще одном варианте осуществления изобретение относится к соединениям, где заместитель R представляет собой фенил, который необязательно замещен один или несколько раз заместителями, выбранными из атома галогена, трифторметила, нитро-, цианогруппы, C1-6-алкила, C1-6-алкокси-, гидроксии метилендиоксигруппы. В другом варианте осуществления изобретение относится к соединениям, где заместитель R представляет собой индолил, который необязательно замещен один или несколько раз заместителями, выбранными из атома галогена, трифторметила, нитро-, цианогруппы, C1-6-алкила, C1-6-алкокси- и гидроксигруппы. Соединения изобретения являются неполными агонистами или антагонистами рецепторов допамина D4. Таким образом, соединения изобретения считаются полезными при лечении психозов, положительных симптомов шизофрении, нарушений познавательной способности, ADHD и дискинезии, являющейся результатом лечения болезни Паркинсона с помощью L-Dopa. В частности, соединения настоящего изобретения считаются полезными при лечении положительных симптомов шизофрении без экстрапирамидальных побочных эффектов. Таким образом, в соответствии с другим аспектом, настоящее изобретение предлагает фармацевти-3 006155 ческую композицию, содержащую по меньшей мере одно соединение формулы I, которая определена выше, или его фармацевтически приемлемую кислотно-аддитивную соль в терапевтически эффективном количестве и в комбинации с одним или несколькими фармацевтически приемлемыми носителями или разбавителями. В соответствии с другим аспектом настоящее изобретение предлагает применение соединения формулы I, определенное выше, или его кислотно-аддитивной соли при производстве фармацевтического препарата для лечения названных выше заболеваний. Подробное описание изобретения Соединения общей формулы I могут существовать в виде их оптических изомеров, и такие оптические изомеры также охвачены настоящим изобретением. Определение C1-6-алкил относится к разветвленной или неразветвленной алкильной группе, содержащей от одного до шести атомов углерода, включая такие группы, как метил, этил, 1-пропил, 2-пропил,1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Аналогично, определения С 2-6-алкенил и С 2-6-алкинил соответственно обозначают такие группы,содержащие от двух до шести атомов углерода, в том числе одну двойную и одну тройную связь, такие,как этенил, пропенил, бутенил, этинил, пропинил и бутинил. Определение С 3-8-циклоалкил означает моноциклический или бициклический карбоцикл, содержащий три-восемь С-атомов, такой, как циклопропил, циклопентил, циклогексил и др. Атом галогена означает атомы фтора, хлора, брома или йода. В данной работе используемое определение ацил относится к таким группам, как формильная, С 1-6 алкилкарбонильная, ацилкарбонильная, арил-С 1-6-алкилкарбонильная, С 3-8-циклоалкилкарбонильная или С 3-8-циклоалкил-С 1-6-алкилкарбонильная группа, а определение тиоацил означает соответствующую ацильную группу, в которой карбонильная группа замещена тиокарбонильной группой. Определения C1-6-алкокси-, С 3-8-циклоалкил-С 1-6-алкил, C1-6-алкилсульфонил, C1-6-алкиламиногруппа, C1-6-алкилкарбонил и т.д. обозначают такие группы, в которых алкильная группа представляет собой C1-6-алкильную и С 3-8-циклоалкильную группы, определенные выше. Определение арил относится к карбоциклической ароматической группе, такой как фенил или нафтил, в особенности фенил. Определение гетероарил относится к 5-членным моноциклическим циклам, таким как 1 Нтетразолил, 3 Н-1,2,3-оксатиазолил, 3 Н-1,2,4-оксатиазолил, 3 Н-1,2,5-оксатиазолил, 1,3,2-оксатиазолил,1,3,4-оксатиазолил, 1,4,2-оксатиазолил, 3 Н-1,2,4-диоксазолил, 1,3,2-диоксазолил, 1,4,2-диоксазолил, 3 Н 1,2,3-дитиазолил, 3 Н-1,2,4-дитиазолил, 1,3,2-дитиазолил, 1,4,2-дитиазолил, 1,2,3-оксадиазолил, 1,2,4 оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5 тиадиазолил, 1,3,4-тиадиазолил, 1 Н-1,2,3-триазолил, 1 Н-1,2,4-триазолил, изоксазолил, оксазолил, изотиазолил, тиазолил, 1 Н-имидазолил, 1 Н-пиразолил, 1 Н-пирролил, фуранил, тиенил, 1 Н-пентазол; к 6 членным моноциклическим циклам, таким как 1,2,3-оксатиазинил, 1,2,4-оксатиазинил, 1,2,5 оксатиазинил, 4 Н-1,3,5-оксатиазинил, 1,4,2-оксатиазинил, 1,4,3-оксатиазинил, 1,2,3-диоксазинил, 1,2,4 диоксазинил, 4 Н-1,3,2-диоксазинил, 4 Н-1,3,5-диоксазинил, 1,4,2-диоксазинил, 2 Н-1,5,2-диоксазинил,1,2,3-дитиазинил, 1,2,4-дитиазинил, 4 Н-1,3,2-дитиазинил, 4 Н-1,3,5-дитиазинил, 1,4,2-дитиазинил, 2 Н 1,5,2-дитиазинил, 2 Н-1,2,3-оксадиазинил, 2 Н-1,2,4-оксадиазинил, 2 Н-1,2,5-оксадиазинил, 2 Н-1,2,6 оксадиазинил, 2 Н-1,3,4-оксадиазинил, 2 Н-1,3,5-оксадиазинил, 2 Н-1,2,3-тиадиазинил, 2 Н-1,2,4 тиадиазинил, 2 Н-1,2,5-тиадиазинил, 2 Н-1,2,6-тиадиазинил, 2 Н-1,3,4-тиадиазинил, 2 Н-1,3,5-тиадиазинил,1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 2 Н-1,2-оксазинил, 2 Н-1,3-оксазинил, 2 Н-1,4 оксазинил, 2 Н-1,2-тиазинил, 2 Н-1,3-тиазинил, 2 Н-1,4-тиазинил, пиразинил, пиридазинил, пиримидил,пиридил, 2 Н-пиранил, 2 Н-тиинил; или к бициклическим циклам, таким как 3 Н-1,2,3-бензоксатиазолил,1,3,2-бензодиоксазолил, 3 Н-1,2,3-бензодитиазолил, 1,3,2-бензодитиазолил, бензофуразанил, 1,2,3 бензоксадиазолил,1,2,3-бензотиадиазолил,2,1,3-бензотиадиазолил,1 Н-бензотриазолил,1,2 бензизоксазолил, 2,1-бензизоксазолил, бензоксазолил, 1,2-бензизотиазолил, 2,1-бензизотиазолил, бензотиазолил, 1 Н-бензимидазолил, 1 Н-индазолил, 3 Н-1,2-бензоксатиолил, 1,3-бензоксатиолил, 3 Н-2,1 бензоксатиолил, 3 Н-1,2-бензодиоксолил, 1,3-бензодиоксолил, 3 Н-1,2-бензодитиолил, 1,3-бензодитиолил,1 Н-индолил, 2 Н-изоиндолил, бензофуранил, изобензофуранил, 1-бензотиенил, 2-бензотиенил, 1 Н-2,1 бензоксазинил,1 Н-2,3-бензоксазинил,2 Н-1,2-бензоксазинил,2 Н-1,3-бензоксазинил,2 Н-1,4 бензоксазинил,2 Н-3,1-бензоксазинил,1 Н-2,1-бензотиазинил,1 Н-2,3-бензотиазинил,2 Н-1,2 бензотиазинил, 2 Н-1,3-бензотиазинил, 2 Н-1,4-бензотиазинил, 2 Н-3,1-бензотиазинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, изохинолил, хинолил, 1 Н-2-бензопиранил, 2 Н-1-бензопиранил, 1 Н-2 бензотиопиранил или 2 Н-1-бензотиопиранил. В конкретном варианте осуществления настоящее изобретение относится к соединению, описанному выше, где заместитель R представляет собой группу формулы-4 006155 где А представляет собой необязательно замещенное, насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать один или два гетероатома, выбранных из N, О и S. Формула охватывает, например, такие бициклические кольца, которые упомянуты в представленном выше списке. Заместители на фрагменте А могут представлять собой один или несколько заместителей, выбранных из атома водорода, атома галогена, циано-, нитрогруппы, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8 циклоалкила, С 3-8-циклоалкил-С 1-6-алкила, C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-С 1-6 алкила, трифторметила, трифторметилсульфонила, C1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди(C1-6-алкил)аминогруппы, ацила и аминокарбонила. Кислотно-аддитивные соли соединений настоящего изобретения представляют собой фармацевтически приемлемые соли, образованные нетоксичными кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глютаминовой, бензолсульфоновой и теофиллинуксусной кислотами, а также 8-галогентеофиллинами, например 8 бромтеофиллином. Примерами таких неорганических солей являются соли с соляной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислотами. Фармацевтические композиции настоящего изобретения или композиции, полученные в соответствии с настоящим изобретением, могут быть введены любым подходящим способом, например, перорально в форме таблеток, капсул, порошков, сиропов и др., или парентерально в форме растворов для инъекций. Для получения таких композиций могут быть использованы способы, хорошо известные в данной области, и могут быть использованы любые фармацевтически приемлемые носители, разбавители, наполнители или другие добавки, обычно используемые в данной области. Обычно соединения настоящего изобретения вводят в стандартной дозированной лекарственной форме, содержащей указанные соединения в количестве приблизительно от 0,01 до 100 мг. Суммарная дневная доза обычно находится в интервале приблизительно от 0,05 до 500 мг, и наиболее предпочтительно приблизительно от 0,1 до 50 мг активного соединения изобретения. Соединения настоящего изобретения получают следующим образом а) восстановление амидной группы соединения формулы II где заместители R, R1, R2, R3, X и пунктирная линия имеют определенные выше значения;b) восстановительное алкилирование амина формулы III с помощью альдегида формулы IV где заместители R, R1, R2, R3, X и пунктирная линия имеют определенные выше значения; с) восстановление двойной связи в тетрагидропиридинильном кольце в производных формулы V где заместители R, R1, R2, R3, X и пунктирная линия имеют определенные выше значения. Восстановление в соответствии со способом а) предпочтительно проводят в инертном органическом растворителе, таком как диэтиловый эфир или тетрагидрофуран, в присутствии алана или алюмогидрида лития при температуре от 0 С до температуры кипения с обратным холодильником. Исходные соединения формулы (II) обычно готовят путем сочетания амина формулы (III) с соответствующим образом замещенной индолилкарбоновой кислотой стандартными способами через хлорангидрид карбоновой кислоты, активированные сложные эфиры или путем использования карбоновых кислот в комбинации с сочетающим агентом, таким как, например,дициклогексилкарбодиимид. Амины формулы (III) являются или коммерчески доступными или могут быть получены стандартными описанными в литературе способами (см., например, J. Med. Chem., 1991, 34, 2014-2023; J.-5 006155 Восстановление в соответствии со способом b) проводят по стандартной методике в одном сосуде,например, используя восстановительное аминирование аминов формулы (III) и альдегидов формулы(IV). Исходные соединения формулы (IV) и соответствующим образом замещенные индолилкарбоновые кислоты являются коммерчески доступными или могут быть синтезированы способами, описанными в литературе или в стандартных публикациях, таких как Houben-Weyl, Methoden der organischen ChemieNew York, при реакционных условиях, которые являются стандартными и подходящими для таких реакций. Восстановление двойной связи в соответствии со способом с) обычно проводят путем каталитического гидрирования при низком давлении (3 атм) в аппарате Парра или при использовании восстанавливающих агентов, таких как диборан или гидроборные производные, получаемые in situ из NaBH4 в трифторуксусной кислоте, в инертных растворителях, таких как тетрагидрофуран (ТГФ), диоксан или диэтиловый эфир. Экспериментальная часть Температуры плавления определяют на приборе BUchi SMP-20, и они являются не скорректированными. Аналитические данные ЖХ-МС получены на приборе РЕ Sciex API 150EX, оборудованном источником ионного потока и системой Shimadzu LC-8A/SLC-10A LC. Условия ЖХ (колонка С 18 4,6x30 мм с размером частиц 3,5 мкм) представляют собой элюирование с линейным градиентом от смеси вода/ацетонитрил/трифоруксусная кислота (90:10:0,05) до смеси вода/ацетонитрил/трифторуксусная кислота (10:90:0,03) за 4 мин при скорости 2 мл/мин. Чистоту определяют путем интегрирования следовых количеств в УФ (254 нм). Время удерживания, Rt, выражено в минутах. Масс-спектр получают методом переменного сканирования с получением информации о молекулярной массе. Молекулярный ион, МН+, получают при низком напряжении ввода (5-20 В) и фрагментации при высоком напряжении ввода (100-200 В). Препаративное разделение ЖХ-МС проводят на том же приборе. Условия ЖХ (колонка С 18 2050 мм с размером частиц 5 мкм) представляют собой элюирование с линейным градиентом от смеси вода/ацетонитрил/трифоруксусная кислота (80:20:0,05) до смеси вода/ацетонитрил/трифторуксусная кислота (5:95:0,03) за 7 мин при скорости 22,7 мл/мин. Фракционный отбор проводят путем МС детектирования с расщеплением потока. Спектры 1H ЯМР записаны при 500,13 МГц на приборе Bruker Avance DRX500 или при 250,13 МГц на приборе Bruker AC 250. В качестве растворителей используют дейтерированный хлороформ (99,8% D) или диметилсульфоксид (99,9% D). В качестве внутреннего стандарта используют ТМС. Величины химических сдвигов выражают в миллионных долях (м.д.). Для описания мультиплетности сигналов ЯМР используют следующие сокращения: с = синглет, д = дублет, т = триплет, кв = квартет, квин = квинтет, г= гептет, дд = дублет дублетов, дт = дублет триплетов, тт = триплет триплетов, м = мультиплет. Сигналы ЯМР, соответствующие кислым протонам, обычно не рассматривают. Для колоночной хроматографии используют силикагель типа Kieselgel 60, 230-400 меш по ASTM. Для ионообменной хроматографии (SCX, 1 г Varian Mega Bond Elut, Chrompack cat.220776). SCX-Колонки перед использованием предварительно кондиционируют с помощью 10%-ного раствора уксусной кислоты в метаноле (3 мл). Примеры 1a. 5-4-(4-хлорфенил)пиперазин-1-ил]метил]-1H-индол В сухом ТГФ (20 мл) растворяют индол-5-карбоновую кислоту (1,62 г). Добавляют карбонилдиимидазол (1,62 г) и смесь перемешивают при комнатной температуре 60 мин. Добавляют в одну порцию 4(4-хлорфенил)пиперазин (1,9 г), растворенный в сухом ТГФ (20 мл), и смесь перемешивают при комнатной температуре 5 ч. Растворитель упаривают в вакууме, остающееся твердое вещество растворяют вEtOAc (400 мл), промывают 10% водным раствором карбоната натрия (100 мл), 1 М уксусной кислотой(100 мл), рассолом (100 мл), сушат (MgSO4) и упаривают в вакууме, получают белое твердое вещество(2,3 г). Твердое вещество растворяют в сухом ТГФ (40 мл) и затем по каплям добавляют к охлажденному раствору алана в ТГФ (готовят осторожным добавлением 0,6 г конц. серной кислоты к суспензии 0,47 г алюмогидрида лития в 20 мл сухого ТГФ). Смесь перемешивают при 15 С в течение 2 ч, останавливают реакцию добавлением воды (1 мл), конц. раствора NaOH (0,5 мл) и воды (2 мл). Белый осадок отфильтровывают и ТГФ удаляют в вакууме, получают продукт в виде белого твердого вещества. После перекристаллизации из MeCN получают 1,8 г 5-4-(4-хлорфенил)пиперазин-1-ил]метил]-1 Н-индола в виде белых кристаллов. Т.пл. 175-176 С. Элементный анализ: Вычислено, %: С 70,04, Н 6,19, N 12,90;(C19H20ClN3). Найдено, %: С 69,94, Н 6,25, N 12,90. 1 Н ЯМР (DMSO-d6): 3,10 (м, 4 Н); 3,40 (м, 4 Н); 3,50 (с, 2 Н); 6,40 (с, 1 Н); 6,90 (д, 2 Н); 7,10 (д, 1 Н); 7,21 (д, 2 Н); 7,30 (м, 2 Н); 7,45 (с, 1 Н). Следующие вещества получают аналогичным образом: 1b. 5-4-(5-индолил)пиперазин-1-ил]метил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,55 (м, 4 Н); 3,00 (м, 4 Н); 3,50 (с, 2 Н); 6,25 (с, 1 Н), 6,45 (с, 1 Н); 6,85 (м, 1 Н);-6 006155 6,95 (м, 1 Н); 7,05 (м, 1 Н); 7,20 (м, 3 Н); 7,30 (м, 2 Н); 7,45 (с, 1 Н); 10,80 (с, 1 Н); 11,00 (с, 1 Н). 1 с. 5-4-(4-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,60 (м, 4 Н); 3,10 (м, 4 Н); 3,60 (с, 2 Н); 3,70 (с, 3 Н); 6,40 (с, 1 Н); 6,80 (д, 2 Н); 6,90 (м, 2 Н), 6,95 (д, 1 Н); 7,30 (м, 2H); 7,45 (м, 1 Н), 11,00 (с, 1 Н). 1d. 5-4-фенилпиперазин-1-ил]метил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,60 (м, 4 Н); 3,10 (м, 4 Н); 3,60 (с, 2 Н); 6,35 (с, 1 Н); 6,75 (м, 1 Н); 6,90 (м, 2 Н); 7,05 (м, 1 Н); 7,15 (м, 2 Н); 7,35 (м, 2 Н); 7,45 (с, 1 Н); 11,00 (с, 1 Н). 1 е. 5-[4-(4-хлорфенил)-3,6-дигидро-2 Н-пиридин-1-илметил]-lH-индол 1 Н ЯМР (DMSO-d6): 2,45 (м, 2 Н); 2,65 (м, 2 Н), 3,05 (м, 2 Н); 3,60 (с, 2 Н); 6,20 (м, 1 Н), 6,40 (с, 1 Н); 7,10 (м, ' 1 Н); 7,30-7,40 (м, 4 Н); 7,40-7,50 (м, 3 Н); 11,00 (с, 1 Н). 1f. 6-4-(4-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,55 (м, 4 Н); 3,10 (м, 4 Н); 3,60 (с, 2 Н); 6,40 (с, 1 Н); 6,90 (д, 2 Н); 7,10 (д, 1 Н); 7,20 (д, 2 Н); 7,30 (м, 2 Н); 7,45 (с, 1 Н), 11,00 (с, 1 Н). 1g. 6-4-(4-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,55 (м, 4 Н); 3,00 (м, 4 Н); 3,60 (с, 2 Н); 3,70 (с, 3 Н); 6,40 (с, 1 Н); 6,80 (д, 2 Н); 6,90 (м, 2 Н), 6,95 (д, 1 Н); 7,30 (м, 2 Н); 7,45 (м, 1 Н), 11,00 (с, 1 Н). 1h. 5-4-(4-фторфенил)пиперидин-1-ил]метил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 1,60 (м, 2 Н); 1,70 (м, 2 Н), 2,00 (м, 2 Н); 2,95 (м, 2 Н); 3,50 (с, 2 Н), 6,40 (с, 1 Н); 7,10 (м, 3 Н); 7,30-7,40 (м, 4 Н); 7,45 (м, 1 Н); 11,00 (с, 1 Н). 1i. 6-[4-(4-хлорфенил)пиперазин-1-илметил]-1-метил-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,55 (м, 4 Н); 3,10 (м, 4 Н); 3,60 (с, 2 Н); 3,70 (с, 3 Н), 6,40 (с, 1 Н); 6,90 (д, 2 Н); 7,10 (д, 1 Н); 7,20 (д, 2 Н); 7,30 (м, 2 Н); 7,45 (с, 1 Н), 11,00 (с, 1 Н). 1j. 6-[4-(4-фторфенил)пиперидин-1-илметил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 1,60 (м, 2 Н); 1,70 (м, 2 Н), 2,00 (м, 2 Н); 2,95 (м, 2 Н); 3,50 (с, 2 Н), 6,40 (с, 1 Н); 6,95 (д, 1 Н), 7,10 (м, 2 Н); 7,30-7,40 (м, 4 Н); 7,45 (м, 1 Н); 11,00 (с, 1 Н). 1k. 5-[4-(4-хлорфенил)пиперазин-1-илметил]-1-метил-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,55 (м, 4 Н); 3,10 (м, 4 Н); 3,60 (с, 2 Н); 3,70 (с, 3 Н), 6,40 (с, 1 Н); 6,90 (д, 2 Н); 7,10 (д, 1 Н); 7,20 (д, 2 Н); 7,30 (м, 1 Н); 7,40 (м, 1 Н), 7,50 (с, 1 Н), 11,00 (с, 1 Н). 1l. 5-[4-(4-хлорфенил)пиперидин-1-илметил]-1 Н-индол 1 Н ЯМР (DMSO-d6): 2,55 (м, 4 Н); 3,10 (м, 4 Н); 3,60 (с, 2 Н); 6,40 (с, 1 Н); 6,90 (д, 2 Н); 7,10 (д, 1 Н); 7,20 (д, 2 Н); 7,30 (м, 1 Н); 7,40 (м, 1 Н), 7,50 (с, 1 Н), 11,00 (с, 1 Н). Следующие соединения также могут быть получены в соответствии с настоящим изобретением: 5-4-(4-фторфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-хлорфенил)пиперидин-1-ил]метил]-1 Н-индол,5-4-(2-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(2,3-дихлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3,4-дихлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-бромфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-йодфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-гидроксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(2-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3,4-диметоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метилфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метилфенил)пиперидин-1-ил]метил]-1 Н-индол,6-4-(4-метилфенил)пиперазин-1-ил]метил]-1 Н-индол,6-4-(4-метилфенил)пиперидин-1-ил]метил]-1 Н-индол,5-4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1 Н-индол,6-4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1 Н-индол,5-(4-бензо[1,3]диоксол-5-ил)пиперазин-1-ил]метил]-1 Н-индол. Фармакологические испытания Соединения настоящего изобретения проверены с помощью хорошо изученных и надежных испытаний. Эти испытания представлены ниже. Ингибирование связывания [3 Н]YM-09151-2 с рецепторами D4.2 С помощью этого метода определено in vitro ингибирование лекарством связывания [3 Н]YM-091512 (0,06 нМ) с мембранами клонированных рецепторов допамина D4.2 человека, экспрессированными в СНО-клетках. Способ модифицирован в NEN Life Science Products, Inc., сертификат технических данных РС 2533-10/96. Ингибирование связывания [3 Н]спиперона с рецепторами D2 Соединения испытаны на сродство к рецептору допамина D2 путем определения их способности ингибировать связывание [3 Н]спиперона с рецепторами D2 по методу Hyttel et al., J. Neurochem., 1985, 44,-7 006155 1615. Полученные результаты представлены ниже в табл. 2: Установлено, что испытанные соединения эффективно ингибируют связывание меченного тритиемYM-09151-2 с рецепторами допамина D4. Соединения также испытаны с помощью функционального анализа, описанного Gazi at al., Br. J.Pharmacol. 1999, 128, 613-629. В этом испытании показано, что соединения являются неполными агонистами или антагонистами рецепторов допамина D4. Установлено, что соединения не обладают значительным сродством или имеют только слабое сродство к рецептору допамина D2. Таким образом, соединения настоящего изобретения могут быть использованы при лечении психозов, положительных симптомов шизофрении, нарушений познавательной способности, повышенного дефицита внимания (ADHD) и дискинезии, являющейся результатом лечения болезни Паркинсона с помощью L-Dopa. В частности, соединения настоящего изобретения считаются полезными при лечении положительных симптомов шизофрении в отсутствие экстрапирамидальных побочных эффектов. Примеры рецептур Фармацевтические препараты настоящего изобретения могут быть приготовлены по обычным для данной области методикам. Например, таблетки могут быть получены смешением активного ингредиента с обычными вспомогательными веществами и/или разбавителями с последующим прессованием смеси в обычной таблетирующей машине. Примеры вспомогательных веществ или разбавителей включают: кукурузный крахмал,картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и т.д. Любые другие вспомогательные вещества или добавки, обычно используемые для таких целей, такие как красители, отдушки,консерванты и др., могут быть использованы при условии совместимости с активными ингредиентами. Растворы для инъекций могут быть приготовлены путем растворения активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно в стерильной воде, и доведением раствора до желаемого объема, стерилизацией раствора и наполнением им подходящих ампул или пузырьков. Могут быть использованы любые подходящие обычные добавки, такие как тонические агенты,консерванты, антиоксиданты и т.д. Типичными примерами рецептур настоящего изобретения являются следующие: 1) Таблетки, содержащие 5,0 мг соединения настоящего изобретения из расчета на свободное основание: Соединение 1 а или 1b 5,0 мг Лактоза 60 мг Кукурузный крахмал 30 мг Гидроксипропилцеллюлоза 2,4 мг Микрокристаллическая целлюлоза 19,2 мг Натрийкроскармелоза тип А 2,4 мг Стеарат магния 0,84 мг 2) Таблетки, содержащие 0,5 мг соединения настоящего изобретения из расчета на свободное основание: Соединение 1 а или 1b 0,5 мг Лактоза 46,9 мг Кукурузный крахмал 23,5 мг Повидон 1,8 мг Микрокристаллическая целлюлоза 14,4 мг Натрийкроскармелоза тип А 1,8 мг Стеарат магния 0,63 мг 3) Сироп, содержащий на миллилитр: Соединение 1 а или 1b 25 мг Сорбит 500 мг-8 006155 Гидроксипропилцеллюлоза Глицерин Метилпарабен Пропилпарабен Этанол Отдушка Натриевая соль сахарина Вода 4) Раствор, содержащий на миллилитр: Соединение 1 а или 1b Сорбит Уксусная кислота Натриевая соль сахарина Вода ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 4-, 5-, 6- или 7-Метилензамещенное индолильное производное формулы I где заместитель R представляет собой арил или гетероарил, где указанная арильная или гетероарильная группа может быть замещена один или несколько раз заместителями, выбранными из атома галогена,циано-, нитрогруппы, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8-циклоалкила, С 3-8-циклоалкил-С 1-6 алкила, C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-С 1-6-алкила, трифторметила, трифторметилсульфонила, C1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди-(С 1-6-алкил)аминогруппы, ацильной, аминокарбонильной и метилендиоксигруппы;X представляет собой N, С или СН при условии, что пунктирная линия указывает на связь, когда X представляет собой С, и на отсутствие связи, когда X представляет собой N или СН; заместитель R1 представляет собой атом водорода, C1-6-алкил, С 2-6-алкенил, С 2-6-алкинил, С 3-8 циклоалкил, С 3-8-циклоалкил-С 1-6-алкил, арил, арил-С 1-6-алкил-, ацил, тиоацил, C1-6-алкилсульфонил,трифторметилсульфонил или арилсульфонил; и заместители R2 и R3 независимо друг от друга выбраны из атома водорода, атома галогена, циано-,нитрогруппы, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8-циклоалкила, С 3-8-циклоалкил-C1-6-алкила,C1-6-алкокси-, C1-6-алкилтио-, гидроксигруппы, гидрокси-С 1-6-алкила, трифторметила, трифторметилсульфонила, C1-6-алкилсульфонила, амино-, C1-6-алкиламино-, ди-(C1-6-алкил)аминогруппы, ацила и аминокарбонила; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где индол присоединен к группе через положение 5 или положение 6 индола, в особенности через положение 5. 3. Соединение по пп.1 и 2, где заместитель R представляет собой необязательно замещенный фенил. 4. Соединение по пп.1 и 2, где заместитель R представляет собой группу формулы где А представляет собой необязательно замещенное, насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать один или два гетероатома, выбранных из N, О и S. 5. Соединение по п.4, где заместитель R представляет собой необязательно замещенный индолил или фенил, замещенный метилендиоксигруппой. 6. Соединение по пп.1 и 2, где X представляет собой N. 7. Соединение по пп.1 и 2, где X представляет собой С, а пунктирная линия представляет собой связь. 8. Соединение по пп.1 и 2, где X представляет собой СН, а пунктирная линия указывает на отсутствие связи. 9. Соединение по п.3, где фенильная группа R необязательно замещена один или несколько раз заместителями, выбранными из атома галогена, трифторметила, нитро-, цианогруппы, C1-6-алкила, C1-6-9 006155 алкокси-, гидрокси- и метилендиоксигруппы. 10. Соединение по п.4, где группа R необязательно замещена один или несколько раз заместителями, выбранными из атома галогена, трифторметила, нитро-, цианогруппы, C1-6-алкила, C1-6-алкокси- и гидроксигруппы. 11. Соединение по п.1, которое представляет собой 5-4-(4-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(5-индолил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-фенилпиперазин-1-ил]метил]-1 Н-индол,5-[4-(4-хлорфенил)-3,6-дигидро-2 Н-пиридин-1-илметил]-1 Н-индол,6-4-(4-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,6-4-(4-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-фторфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-хлорфенил)пиперидин-1-ил]метил]-1 Н-индол,5-4-(2-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3-хлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(2,3-дихлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3,4-дихлорфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-бромфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-йодфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-гидроксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(2-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3-метоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(3,4-диметоксифенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метилфенил)пиперазин-1-ил]метил]-1 Н-индол,5-4-(4-метилфенил)пиперидин-1-ил]метил]-1 Н-индол,6-4-(4-метилфенил)пиперазин-1-ил]метил]-1 Н-индол,6-4-(4-метилфенил)пиперидин-1-ил]метил]-1 Н-индол,5-4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1 Н-индол,6-4-(4-хлорфенил)пиперазин-1-ил]метил]-1-метил-1 Н-индол,5-(4-бензо[1,3]диоксол-5-ил)пиперазин-1-ил]метил]-1 Н-индол,или их фармацевтически приемлемую соль. 12. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по любому из пп.1-11 в терапевтически эффективном количестве вместе с одним или несколькими фармацевтически приемлемыми носителями или разбавителями. 13. Применение соединения по любому из пп.1-11 при производстве медикаментов, полезных для лечения психозов, положительных симптомов шизофрении, нарушений познавательной способности,ADHD и дискинезии, являющейся результатом лечения болезни Паркинсона с помощью L-Dopa. 14. Способ лечения положительных симптомов шизофрении, других психозов, нарушений познавательной способности, включающий введение терапевтически приемлемого количества соединения по любому из пп.1-11.
МПК / Метки
МПК: A61K 31/4045, A61P 25/06, C07D 401/14
Метки: системы, центральной, 4-,5, заболеваний, лечении, производные, нервной, 7-индольные, полезные
Код ссылки
<a href="https://eas.patents.su/11-6155-4-5-6-i-7-indolnye-proizvodnye-poleznye-pri-lechenii-zabolevanijj-centralnojj-nervnojj-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">4-,5-, 6-и 7-индольные производные, полезные при лечении заболеваний центральной нервной системы</a>
Предыдущий патент: N-фенпропилциклопентил-замещенные производные глутарамида в качестве nep ингибиторов при fsad
Следующий патент: Способ получения ( е )-5-(2-бромвинил )-2′-дезоксиуридина
Случайный патент: Способ получения этанола и кормопродукта












