Лиганды рецепторов 5-нт и их применение
Номер патента: 7183
Опубликовано: 25.08.2006
Авторы: Чьянг Юан-Чинг Фиби, Уэлч Уиллард Маккауэн, Новомайсл Уильям Альберт
Формула / Реферат
1. Соединение формулы (IA)
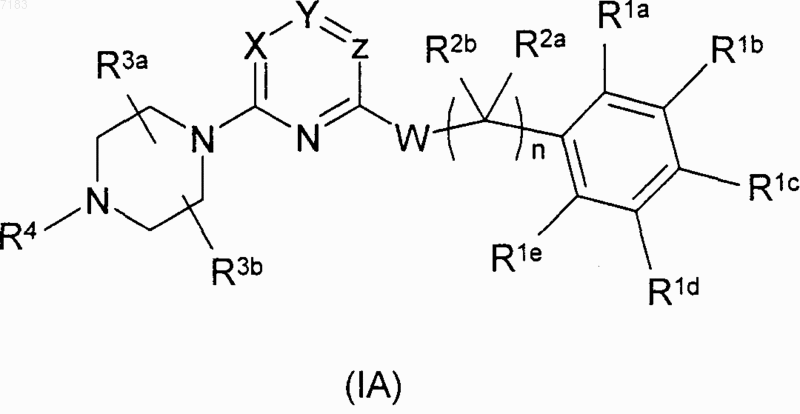
где X и Y представляют собой CR, a Z представляет собой N или X представляет собой N, a Y и Z представляют собой CR, где R для каждого случая представляет собой водород;
W представляет собой окси;
по меньшей мере один из R1a, R1b, R1d и R1e независимо выбран из группы, состоящей из галогена, нитро, амино, циано, -C(O)NH2 и (C1-C4)алкила, либо R1a и R1b, взятые вместе, образуют пяти- или шестичленное ароматическое или частично, или полностью насыщенное конденсированное кольцо, либо R1a, взятый вместе с R2a или R2b, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;
R1c представляет собой водород;
R2a и R2b, каждый независимо, представляют собой водород, (C1-C4)алкил, частично или полностью насыщенный (C3-C6)циклоалкил либо один из них, взятый вместе с R1a, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;
n равно 0, 1 или 2;
R3a и R3b, каждый независимо, представляют собой водород, (C1-C4)алкил или (C1-C4)алкил, замещенный гидрокси, фторо, или (C1-C4)алкокси;
R4 представляет собой водород, гидрокси, (C1-C4)алкил, (C1-C4)алкил, замещенный гидрокси или циано, (C1-C4)алкилкарбонил, (C1-C4)алкокси, (C1-C4)алкоксикарбонил или (C3-C4)алкенил;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
2. Соединение по п.1, где
X и Y представляют собой CR, a Z представляет собой N или X представляет собой N, a Y и Z представляют собой CR, где R для каждого случая представляет собой водород;
(i) R1a представляет собой галоген, (C1-C4)алкил или циано, a R1b, R1d и R1e, каждый, представляют собой водород,
(ii) R1b представляет собой галоген, метил, циано или метокси, a R1a, R1d и R1e, каждый, представляют собой водород,
(iii) R1a и R1b, каждый независимо, представляют собой галоген или метил, a R1d и R1e, каждый, представляют собой водород,
(iv) R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1a и R1e, каждый, представляют собой водород,
(v) R1a и R1d, каждый независимо, представляют собой галоген или метил, a R1b и R1e, каждый, представляют собой водород,
(vi) R1a и R1e, каждый независимо, представляют собой галоген или метил, a R1b и R1d, каждый, представляют собой водород или
(vii) R1a, R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1e представляет собой водород;
W представляет собой окси;
n равно 1 или 2;
R2a и R2b, каждый независимо, представляют собой (C1-C4)алкил или водород;
R3a и R3b, каждый независимо, представляют собой водород или (C1-C2)алкил и
R4 представляет собой водород или (C1-C4)алкил;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
3. Соединение по п.1, где Z представляет собой N; X представляет собой СН;
Y представляет собой CR, где R представляет собой водород или метил;
(i) R1a представляет собой галоген, (C1-C4)алкил или циано, a R1b, R1d и R1e, каждый, представляют собой водород,
(ii) R1b представляет собой галоген, метил или циано, a R1a, R1d и R1e, каждый, представляют собой водород,
(iii) R1a и R1b, каждый независимо, представляют собой галоген или метил, a R1d и R1e, каждый, представляют собой водород,
(iv) R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1a и R1e, каждый, представляют собой водород,
(v) R1a и R1d, каждый независимо, представляют собой галоген или метил, a R1b и R1e, каждый, представляют собой водород,
(vi) R1a и R1e, каждый независимо, представляют собой галоген или метил, a R1b и R1d, каждый, представляют собой водород или
(vii) R1a, R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1e представляет собой водород;
W представляет собой окси;
n равно 1;
R2a и R2b, каждый независимо, представляют собой (C1-C4)алкил или водород;
R3a представляет собой водород, (2R)-мeтил или (2R)-этил, а
R3b представляет собой водород и
R4 представляет собой водород или (C1-C4)алкил;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
4. Соединение по п.1, выбранное из группы, состоящей из
2-(2-хлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-фторбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-хлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-[1-(3-фторфенил)этокси]-4-пиперазин-1-илпиримидина,
2-[1-(2-хлорфенил)этокси]-4-пиперазин-1-илпиримидина,
2-[1-(3-хлорфенил)этокси]-4-пиперазин-1-илпиримидина,
2-(2,3-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(2,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дихлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(3,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3,5-дифторбензилокси)-4-пиперазин-1-илпиримидина и
4-пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидина;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
5. Соединение по п.1, выбранное из группы, состоящей из
2-(3-хлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(2,3-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(2,5-дихлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(3,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина и
4-пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидина;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
6. Соединение по п.1, выбранное из группы, состоящей из
гидрохлорида 2-(2-хлорбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(3-фторбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(3-хлорбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
гидрохлорида 2-(2,3-дифторбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(2,5-дифторбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(2,3-дихлорбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(3,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина и
гидрохлорида 2-(3,5-дифторбензилокси)-4-пиперазин-1-илпиримидина.
7. Соединение формулы (IA)
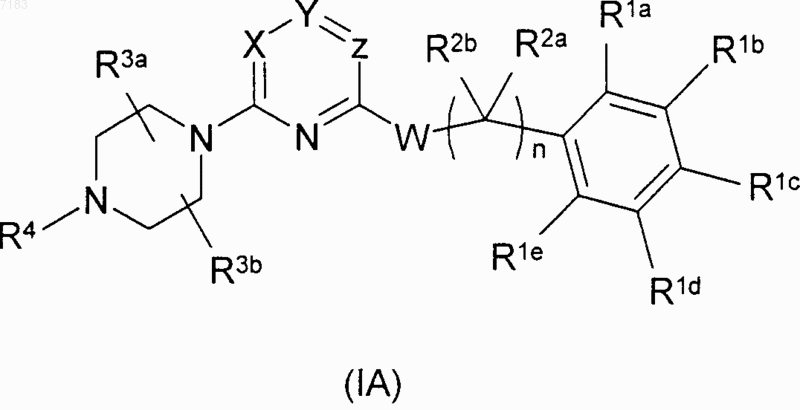
где X и Y представляют собой CR, a Z представляет собой N, или X представляет собой N, a Y и Z представляют собой CR; или
когда Z представляет собой N, тогда X представляет собой СН, a Y представляет собой CR, или X представляет собой CR, a Y представляет собой СН; или
когда X представляет собой N, тогда Y представляет собой СН, a Z представляет собой CR, или Y представляет собой CR, a Z представляет собой СН,
где R для каждого случая представляет собой галоген, (С1-С4)алкил, амино или (C1-C4)алкиламино;
W представляет собой окси;
по меньшей мере один из R1a, R1b, R1d и R1e независимо выбран из группы, состоящей из галогена, нитро, амино, циано, -C(O)NH2, (C1-C4)алкила, замещенного галогеном (C1-C4)алкила, (C1-C4)алкокси и замещенного галогеном (C1-C4)алкокси, либо R1a и R1b, взятые вместе, образуют пяти- или шестичленное ароматическое или частично или полностью насыщенное конденсированное кольцо, либо R1a, взятый вместе с R2a или R2b, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;
R1c представляет собой водород;
R2a и R2b, каждый независимо, представляют собой водород, (C1-C4)алкил, частично или полностью насыщенный (С3-С6)циклоалкил, либо один из них, взятый вместе с R1a, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;
n равно 0, 1 или 2;
R3a и R3b, каждый независимо, представляют собой водород, (C1-C4)алкил или (C1-C4)алкил, замещенный гидрокси, фторо, или (C1-C4)алкокси;
R4 представляет собой водород, гидрокси, (C1-C4)алкил, (C1-C4)алкил, замещенный гидрокси или циано, (C1-C4)алкилкарбонил, (C1-C4)алкокси, (C1-C4)алкоксикарбонил или (C3-C4)алкенил;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
8. Соединение формулы (IA)
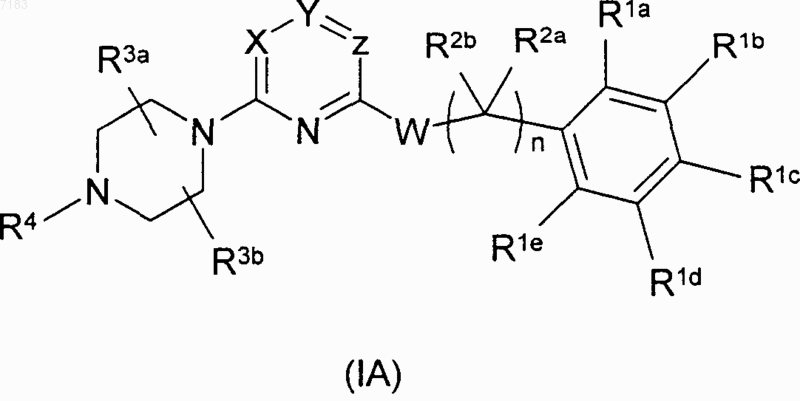
где X и Y представляют собой CR, a Z представляет собой N или X представляет собой N, a Y и Z представляют собой CR, где R для каждого случая представляет собой водород, галоген, (C1-C4)алкил, амино или (C1-C4)алкиламино;
W представляет собой тио, амино, (C1-C4)алкиламино или ацетиламино;
по меньшей мере один из R1a, R1b, R1d и R1e независимо выбран из группы, состоящей из галогена, нитро, амино, циано, -C(O)NH2, (C1-C4)алкила, замещенного галогеном (C1-C4)алкила, (C1-C4)алкокси и замещенного галогеном (C1-C4)алкокси, либо R1a и R1b, взятые вместе, образуют пяти- или шестичленное ароматическое или частично или полностью насыщенное конденсированное кольцо, либо R1a, взятый вместе с R2a или R2b, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;
R1c представляет собой водород;
R2a и R2b, каждый независимо, представляют собой водород, (C1-C4)алкил, частично или полностью насыщенный (C3-C6)циклоалкил, либо один из них, взятый вместе с R1a, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;
n равно 0, 1 или 2;
R3a и R3b, каждый независимо, представляют собой водород, (C1-C4)алкил или (C1-C4)алкил, замещенный гидрокси, фторо, или (C1-C4)алкокси;
R4 представляет собой водород, гидрокси, (C1-C4)алкил, (C1-C4)алкил, замещенный гидрокси или циано, (C1-C4)алкилкарбонил, (C1-C4)алкокси, (C1-C4)алкоксикарбонил или (C3-C4)алкенил; его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
9. Соединение по п.8, где
X и Y представляют собой CR, a Z представляет собой N или X представляет собой N, a Y и Z представляют собой CR, где R для каждого случая представляет собой водород, галоген или (C1-C4)алкил;
(i) R1a представляет собой галоген, (C1-C4)алкил, трифторметил, метокси, циано или трифторметокси, a R1b, R1d и R1e, каждый, представляют собой водород,
(ii) R1b представляет собой галоген, метил, циано или метокси, a R1a, R1d и R1e, каждый, представляют собой водород,
(iii) R1a и R1b, каждый независимо, представляют собой галоген, циано или метил, a R1d и R1e, каждый, представляют собой водород,
(iv) R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1a и R1e, каждый, представляют собой водород,
(v) R1a и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1e, каждый, представляют собой водород,
(vi) R1a и R1e, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1d, каждый, представляют собой водород, или
(vii) R1a, R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1e представляет собой водород;
W представляет собой амино;
п равно 1 или 2;
R2a и R2b, каждый независимо, представляют собой метил или водород;
R3a и R3b, каждый независимо, представляют собой водород или (С1-С2)алкил и
R4 представляет собой водород или (C1-C4)алкил;
его оксид азютр, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида, либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
10. Соединение по п.8, где
Z представляет собой N;
X представляет собой СН;
Y представляет собой CR, где R представляет собой водород или метил;
(i) R1a представляет собой галоген, (C1-C4)алкил, трифторметил, циано, метокси или трифторметокси, a R1b, R1d и R1e, каждый, представляют собой водород,
(ii) R1b представляет собой галоген, метил, циано или метокси, a R1a, R1d и R1e, каждый, представляют собой водород,
(iii) R1a и R1b, каждый независимо, представляют собой галоген, циано или метил, a R1d и R1e, каждый, представляют собой водород,
(iv) R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1e, каждый, представляют собой водород;
(v) R1a и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1e, каждый независимо, представляют собой водород,
(vi) R1a и R1e, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1d, каждый независимо, представляют собой водород, или
(vii) R1a, R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1e представляет собой водород,
W представляет собой амино;
n равно 1;
R2a и R2b, каждый независимо, представляют собой метил или водород; и
R3a представляет собой водород, (2R)-метил или (2R)-этил, a
R3b представляет собой водород и
R4 представляет собой водород или (C1-C4)алкил;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
11. Соединение по п.8, где
X представляет собой N;
Y представляет собой CR, где R представляет собой водород или метил;
Z представляет собой СН;
(i) R1a представляет собой галоген, (C1-C4)алкил, трифторметил, метокси или трифторметокси, a R1b, R1d и R1e, каждый, представляют собой водород,
(ii) R1b представляет собой галоген, циано, метил или метокси, a R1a, R1d и R1e, каждый, представляют собой водород,
(iii) R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1a и R1e, каждый, представляют собой водород, или
(iv) R1a и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1e, каждый, представляют собой водород;
W представляет собой амино;
n равно 1;
R2a и R2b, каждый независимо, представляют собой (C1-C4)алкил или водород;
R3a представляет собой водород, (2R)-метил или (2R)-этил, а
R3b представляет собой водород; и
R4 представляет собой водород или (C1-C4)алкил;
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
12. Соединение по п.8, выбранное из группы, состоящей из
(3-хлорбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
(3-хлорбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
(3-фторбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина и
(3-фторбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
его оксид азота, эфир или амид указанного соединения или указанного оксида азота, фармацевтически приемлемая соль указанного соединения, указанного оксида азота или указанного эфира или амида, либо сольват или гидрат указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
13. Соединение по п.8, выбранное из группы, состоящей из
гидрохлорида (3-хлорбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
гидрохлорида (3-хлорбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
гидрохлорида (3-фторбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина и
фумарата (3-фторбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина.
14. Фармацевтическая композиция, содержащая
(1) соединение по п.1, 7 или 8; и
(2) фармацевтически приемлемый эксципиент, разбавитель или носитель.
15. Фармацевтическая композиция по п.14, где указанное соединение выбрано из группы, состоящей из
2-(2-хлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-фторбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-хлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
(3-хлорбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
(3-хлорбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
(3-фторбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
(3-фторбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
2-[1-(3-фторфенил)этокси]-4-метил-6-пиперазин-1-илпиримидина,
2-[1-(3-фторфенил)этокси]-4-пиперазин-1-илпиримидина,
2-[1-(2-хлорфенил)этокси]-4-пиперазин-1-илпиримидина,
2-[1-(3-хлорфенил)этокси]-4-пиперазин-1-илпиримидина,
2-[1-(3-хлорфенил)этокси]-4-метил-6-пиперазин-1-илпиримидина,
2-(2,3-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(2,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дихлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(3,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3,5-дифторбензилокси)-4-пиперазин-1-илпиримидина и
4-пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидина,
его оксида азота, эфира или амида указанного соединения или указанного оксида азота, фармацевтически приемлемой соли указанного соединения, указанного оксида азота или указанного эфира или амида либо сольвата или гидрата указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
16. Фармацевтическая композиция по п.14, где указанное соединение выбрано из группы, состоящей из
2-(3-хлорбензилокси)-4-пиперазин-1-илпиримидина,
2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
(3-хлорбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
(3-хлорбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
(3-фторбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
(3-фторбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
2-(2,3-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-пиперазин-1-илпиримидина,
2-(2,5-дифторбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(2,5-дихлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
2-(3,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина и
4-пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидина;
его оксида азота, эфира или амида указанного соединения или указанного оксида азота, фармацевтически приемлемой соли указанного соединения, указанного оксида азота или указанного эфира или амида, либо сольвата или гидрата указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли.
17. Фармацевтическая композиция по п.14, где указанное соединение выбрано из группы, состоящей из
гидрохлорида 2-(2-хлорбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(3-фторбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(3-хлорбензилокси)-4-пиперазин-1-ил-пиримидина,
гидрохлорида 2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина,
гидрохлорида (3-хлорбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
гидрохлорида (3-хлорбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
гидрохлорида (3-фторбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина,
фумарата (3-фторбензил)-(2-пиперазин-1-илпиримидин-4-ил)амина,
гидрохлорида 2-(2,3-дифторбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(2,5-дифторбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(2,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина,
гидрохлорида 2-(3,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина и
гидрохлорида 2-(3,5-дифторбензилокси)-4-пиперазин-1-илпиримидина.
18. Фармацевтическая композиция по п.14, дополнительно содержащая по меньшей мере один иной фармацевтический агент, выбранный из группы, состоящей из ингибитора аро-В/МТР, агониста MCR-4, агониста ССК-А, ингибитора обратного захвата моноаминов, симпатомиметического агента, агониста адренергического рецептора b3, агониста дофамина, аналогарецептора меланоцит-стимулирующего гормона, антагониста рецептора каннабиноида 1, антагониста меланин-концентрирующего гормона, лептина, аналога лептина, агониста рецептора лептина, антагониста галанина, ингибитора липазы, агониста бомбезина, антагониста нейропептида-Y, тиреомиметического агента, дегидроэпиандростерона или его аналога, агониста или антагониста рецепторов глюкокортикоидов, антагониста рецептора орексина, антагониста урокортин-связывающего белка, агониста рецептора глюкагонподобного пептида-1, цилиарного нейротрофического фактора, человеческого агутиродственного белка, антагониста рецептора грелина, антагониста или обратного агониста рецептора гистамина 3 и агониста рецептора нейромедина U.
19. Фармацевтическая композиция по п.18, где указанный агент против ожирения выбран из группы, состоящей из орлистата, сибутрамина, бромокриптина, эфедрина, лептина и псевдоэфидрина.
Текст
007183 Область изобретения Настоящее изобретение относится к пиримидиновым соединениям, которые действуют как лиганды рецепторов 5-НТ, в частности лиганды рецептора 5-НТ 2 с, и к их применению в предупреждении или лечении заболеваний, связанных с активацией рецепторов 5-НТ 2 с, у животных. Уровень техники Рецепторы к серотонину (5-гидрокситриптамину, 5-НТ) являются важным классом рецепторов, сопряженных с G-белком. Считается, что серотонин играет определенную роль в процессах, связанных с обучением и памятью, сном, терморегуляцией, настроением, двигательной активностью, болью, сексуальным поведением, агрессивным поведением, аппетитом, нейродегенеративной регуляцией и биологическими ритмами. Как ожидалось, серотонин связан с патофизиологическими состояниями, такими как тревога, депрессия, обсессивно-компульсивные расстройства, шизофрения, суицид, аутизм, мигрень,рвота, алкоголизм и нейродегенеративные расстройства. В настоящее время рецепторы серотонина делят на семь подсемейств (5-HT1 - 5-НТ 7) [Hoyer, D. etRev., 56, 157-203 (1994)]. Эти подсемейства дополнительно делят на подтипы. Например, рецепторы 5 НТ 2 в настоящее время делят на три подтипа: 5-НТ 2 а, 5-НТ 2b и 5-НТ 2 с. Эти три подтипа рецепторов 5-НТ 2 связываются с фосфолипазой С с образованием двух вторичных мессенджеров - диацилглицерина (который активирует протеинкиназу С) и инозитолтрифосфата (который высвобождает внутриклеточные запасы Са 2+). Рецепторы 5-НТ 2 с характеризуются очень высокой плотностью в хориоидальном сплетении,эпителиальной ткани, которая является первичным сайтом продуцирования спинно-мозговой жидкостиYork, NY (1996)]. Julius, et аl, выделили и охарактеризовали рецептор 5-НТ 2 с и позже сообщили, что у трансгенных мышей, у которых отсутствует рецептор 5-НТ 2 с, наблюдаются припадки и пищевые расстройства, приводящие к повышенному потреблению пищи [патенты США 4985352 и 5698766 соответственно]. Следовательно, соединения, избирательные в отношении рецепторов 5-НТ 2 с, могут представлять собой полезные терапевтические средства для лечения припадков и пищевых расстройств без побочных эффектов, связанных обычно с неизбирательностью лиганда. Некоторые соединения были предложены в качестве агонистов или антагонистов рецепторов 5-НТ 2 с для применения в лечении ожирения и других родственных заболеваний, связанных с пониженной нейротрансмиссией серотонина у млекопитающих [например, ЕР 863136 (производные азетидина и пирролидина); ЕР 657426 (трициклические производные пиррола); ЕР 655440 (замещенные 1 аминоэтилиндолы); ЕР 572863 (производные пиразиноиндола); WO 98/030548 (аминоалкилиндазольные соединения); WO 98/56768 (трициклические производные пиррола и пиразола); WO 99/43647 (производные азетидина и пирролидина); WO 99/58490 (производные арил-гидронафталиналканамина); WO 00/12475 (производные индолина); WO 00/12482 (производные индазола); WO 00/12502 (производные пирролохинолина); WO 00/12510 (производные пирролоиндола, пиридоиндола и азепиноиндола); WO 00/28993 (производные нафтилацетилпиперазина); WO 00/44737 (производные аминоалкилбензофурана); и WO 00/76984 (2,3-дизамещенные пиразины). Неизбирательность лигандов к различным рецепторам 5-НТ остается проблемой. Предполагается,что неизбирательность некоторых лигандов вносит определенный вклад в различные вредные побочные эффекты, такие как галлюцинации и сердечно-сосудистые осложнения. Следовательно, потребность в избирательных лигандах рецепторов 5-НТ 2 состается. Краткое изложение сущности изобретения Согласно настоящему изобретению предложены соединения формулы (IA), которые полезны как лиганды рецепторов 5-НТ 2 (в частности, лиганды рецепторов 5-НТ 2 а и 5-НТ 2 с) где X и Y представляют собой CR, a Z представляет собой N, или X представляет собой N, a Y и Z представляют собой CR, где R для каждого случая представляет собой водород;W представляет собой окси; по меньшей мере один из R1a, R1b, R1d и R1e независимо выбран из группы, состоящей из галогена,нитро, амино, циано, -C(O)NH2 и (C1-C4)алкила, либо R1a и R1b, взятые вместе, образуют пяти- или шестичленное ароматическое или частично или полностью насыщенное конденсированное кольцо, либо R1a,-1 007183 взятый вместе с R2a или R2b, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;R2a и R2b, каждый независимо, представляют собой водород, (C1-C4)алкил, частично или полностью насыщенный (С 3-С 6)циклоалкил, либо один из них, взятый вместе с R1a, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;R4 представляет собой водород, гидрокси, (C1-C4)алкил, (C1-C4)алкил, замещенный гидрокси или циано, (C1-C4)алкилкарбонил, (C1-C4)алкокси, (C1-C4)алкоксикарбонил или (C3-C4)алкенил; их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота, фармацевтически приемлемые соли указанных соединений, указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота, указанных эфиров или амидов или указанных солей. Предпочтительными соединениями формулы (IA) являются соединения, в которых X и Y представляют собой CR, a Z представляет собой N, или X представляет собой N, a Y и Z представляют собой CR,где R для каждого случая представляет собой водород; (i) R1a представляет собой галоген, (C1-C4)алкил или циано, a R1b, R1d и R1e, каждый, представляют собой водород, (ii) R1b представляет собой галоген,метил, циано или метокси, a R1a, R1d и R1e, каждый, представляют собой водород, (iii) R1a и R1b, каждый независимо, представляют собой галоген или метил, a R1d и R1e, каждый, представляют собой водород,(iv) R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1a и R1e, каждый, представляют собой водород, (v) R1a и R1d, каждый независимо, представляют собой галоген или метил, a R1b иR1e, каждый, представляют собой водород, (vi) R1a и R1e, каждый независимо, представляют собой галоген или метил, a R1b и R1d, каждый, представляют собой водород, или (vii) R1a, R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1e представляет собой водород; W представляет собой окси; n равно 1 или 2; R2a и R2b, каждый независимо, представляют собой (C1-C4)алкил или водород; R3a иR3b, каждый независимо, представляют собой водород или (C1-C2)алкил; и R4 представляет собой водород или (C1-C4)алкил; их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота, фармацевтически приемлемые соли указанных соединений, указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота,указанных эфиров или амидов или указанных солей. Когда Z представляет собой N, тогда X предпочтительно представляет собой СН; Y представляет собой CR, где R для каждого случая представляет собой водород или метил; (i) R1a представляет собой галоген, (C1-C4)алкил или циано, a R1b, R1d и R1e, каждый, представляют собой водород, (ii) R1b представляет собой галоген, метил или циано, a R1a, R1d и R1e, каждый, представляют собой водород, (iii) R1a и R1b,каждый независимо, представляют собой галоген или метил, a R1d и R1e, каждый, представляют собой водород, (iv) R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1 а и R1e, каждый,представляют собой водород, (v) R1a и R1d, каждый независимо, представляют собой галоген или метил, aR1b и R1e, каждый, представляют собой водород, (vi) R1a и R1e, каждый независимо, представляют собой галоген или метил, a R1b и R1d, каждый, представляют собой водород, или (vii) R1a, R1b и R1d, каждый независимо, представляют собой галоген или метил, a R1e представляет собой водород; W представляет собой окси; n равно 1; R2a и R2b, каждый независимо, представляют собой (C1-C4)алкил или водород; R3a представляет собой водород, (2R)-мeтил или (2R)-этил, a R3b представляет собой водород; и R4 представляет собой водород или (C1-C4)алкил. Не ограничивающие примеры предпочтительных соединений формулы (IA) включают 2-(2-хлорбензилокси)-4-пиперазин-1-ил-пиримидин, 2-(3-фторбензилокси)-4-пиперазин-1-ил-пиримидин, 2-(3 хлорбензилокси)-4-пиперазин-1-ил-пиримидин, 2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидин, 2-[1-(3-фторфенил)этокси]-4-пиперазин-1-ил-пиримидин, 2-[1-(2-хлорфенил)этокси]-4-пиперазин-1-ил-пиримидин,2-[1-(3-хлорфенил)этокси]-4-пиперазин-1-ил-пиримидин,2-(2,3-дифторбензилокси)-4-пиперазин-1-ил-пиримидин, 2-(2,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидин, 2-(2,5 дифторбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидин, 2-(2,5-дихлорбензилокси)-4-пиперазин-1 ил-пиримидин, 2-(2,5-дихлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)-пиримидин, 2-(3,5-дихлорбензилокси)-4-пиперазин-1-ил-пиримидин, 2-(3,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидин и 4 пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидин; их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота, фармацевтически приемлемые соли указанных соединений,указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота, указанных эфиров или амидов или указанных солей. Не ограничивающие примеры более предпочтительных соединений формулы (IA) включают 2-(3 хлорбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина, 2-(2,3-дифторбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(2,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(2,5-дифтор-бензилокси)-4-(2(R)-метил-пиперазин-1-ил)-пиримидина, 2-(2,5-2 007183 дихлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина, 2-(3,5-дихлорбензилокси)-4-пиперазин-1 ил-пиримидина и 4-пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидина; их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота, фармацевтически приемлемые соли указанных соединений, указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота, указанных эфиров или амидов или указанных солей. Предпочтительные соли соединений формулы (IА) включают гидрохлорид 2-(2-хлорбензилокси)-4 пиперазин-1-ил-пиримидина, гидрохлорид 2-(3-фторбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорид 2-(3-хлорбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорид 2-(3-хлорбензилокси)-4-(2(R)метилпиперазин-1-ил)пиримидина, гидрохлорид 2-(2,3-дифторбензилокси)-4-пиперазин-1-илпиримидина, гидрохлорид 2-(2,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорид 2-(2,3-дихлорбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорид 2-(3,5-дихлорбензилокси)-4-пиперазин-1-илпиримидина и гидрохлорид 2-(3,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидина. Согласно настоящему изобретению предложены также соединения формулы (IA): где X и Y представляют собой CR, a Z представляет собой N, или X представляет собой N, a Y и Z представляют собой CR; или когда Z представляет собой N, тогда X представляет собой СН, a Y представляет собой CR, или X представляет собой CR, a Y представляет собой СН; или когда X представляет собой N, тогда Y представляет собой СН, a Z представляет собой CR, или Y представляет собой CR, a Z представляет собой СН,где R для каждого случая представляет собой галоген, (C1-C4)алкил, амино или (C1-C4)алкиламино;W представляет собой окси; по меньшей мере один из R1a, R1b, R1d и R1e независимо выбран из группы, состоящей из галогена,нитро, амино, циано, -C(O)NH2, (C1-C4)алкила, замещенного галогеном (C1-C4)алкила, (C1-C4)алкокси и замещенного галогеном (C1-C4)алкокси, либо R1a и R1b, взятые вместе, образуют пяти- или шестичленное ароматическое или частично или полностью насыщенное конденсированное кольцо, либо R1a, взятый вместе с R2a или R2b, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;R2a и R2b, каждый независимо, представляют собой водород, (C1-C4)алкил, частично или полностью насыщенный (C3-C6)циклоалкил, либо один из них, взятый вместе с R1a, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;R4 представляет собой водород, гидрокси, (C1-C4)алкил, (C1-C4)алкил, замещенный гидрокси или циано, (C1-C4)алкилкарбонил, (C1-C4)алкокси, (C1-C4)алкокси-карбонил или (С 3-С 4)алкенил; их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота, фармацевтически приемлемые соли указанных соединений, указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота, указанных эфиров или амидов или указанных солей. Согласно настоящему изобретению предложены также соединения формулы (IA)-3 007183 где X и Y представляют собой CR, a Z представляет собой N, или X представляет собой N, a Y и Z представляют собой CR, где R для каждого случая представляет собой водород, галоген, (C1-C4)алкил,амино или (C1-C4)алкиламино;W представляет собой тио, амино, (C1-C4)алкиламино или ацетиламино; по меньшей мере один из R1a, R1b, R1d и R1e независимо выбран из группы, состоящей из галогена,нитро, амино, циано, -C(O)NH2, (C1-C4)алкила, замещенного галогеном (C1-C4)алкила, (C1-C4)алкокси и замещенного галогеном (C1-C4)алкокси, либо R1a и R1b, взятые вместе, образуют пяти- или шестичленное ароматическое или частично или полностью насыщенное конденсированное кольцо, либо R1a, взятый вместе с R2a или R2b, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;R2a и R2b, каждый независимо, представляют собой водород, (C1-C4)алкил, частично или полностью насыщенный (C3-C6)циклоалкил, либо один из них, взятый вместе с R1a, образует пяти- или шестичленное полностью насыщенное конденсированное кольцо;R4 представляет собой водород, гидрокси, (C1-C4)алкил, (C1-C4)алкил, замещенный гидрокси или циано, (C1-C4)алкилкарбонил, (C1-C4)алкокси, (C1-C4)алкокси-карбонил или (C3-C4)алкенил; их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота, фармацевтически приемлемые соли указанных соединений, указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота, указанных эфиров или амидов или указанных солей. Предпочтительными соединениями указанных выше соединений формулы (IA) являются соединения, в которых X и Y представляют собой CR, а Z представляет собой N, или X представляет собой N, aY и Z представляют собой CR, где R для каждого случая представляет собой водород, галоген или (C1C4)алкил; (i) R1a представляет собой галоген, (C1-C4)алкил, трифторметил, метокси, циано или трифторметокси, a R1b, R1d и R1e, каждый, представляют собой водород, (ii) R1b представляет собой галоген, метил, циано или метокси, а R1a, R1d и R1e, каждый, представляют собой водород, (iii) R1a и R1b, каждый независимо, представляют собой галоген, циано или метил, a R1d и R1e, каждый, представляют собой водород, (iv) R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1a и R1e, каждый, представляют собой водород, (v) R1a и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1e, каждый, представляют собой водород, (vi) R1a и R1e, каждый независимо, представляют собой галоген, циано или метил, a R1b и R1d, каждый, представляют собой водород, или (vii) R1a,R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1e представляет собой водород; W представляет собой амино; n равно 1 или 2; R2a и R2b, каждый независимо, представляют собой метил или водород; R3a и R3b, каждый независимо, представляют собой водород или (C1-C2)алкил; иR4 представляет собой водород или (C1-C4)алкил; их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота, фармацевтически приемлемые соли указанных соединений, указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота, указанных эфиров или амидов или указанных солей. Когда Z представляет собой N, X предпочтительно представляет собой СН; Y представляет собойCR, где R представляет собой водород или метил; (i) R1a представляет собой галоген, (C1-C4)алкил, трифторметил, циано, метокси или трифторметокси, a R1b, R1d и R1e, каждый, представляют собой водород, (ii)R1b представляет собой галоген, метил, циано или метокси, a R1a, R1d и R1e, каждый, представляют собой водород, (iii) R1a и R1b, каждый независимо, представляют собой галоген, циано или метил, a R1d и R1e,каждый, представляют собой водород, (iv) R1b и Rld, каждый независимо, представляют собой галоген,циано или метил, a R1b и R1e, каждый, представляют собой водород; (v) R1a и R1d, каждый независимо,представляют собой галоген, циано или метил, a R1b и R1e, каждый независимо, представляют собой водород, (vi) R1a и R1e, каждый независимо, представляют собой галоген, циано или метил, а R1b и R1d, каждый независимо, представляют собой водород, или (vii) R1a, R1b и R1d, каждый независимо, представляют собой галоген, циано или метил, a R1e представляет собой водород, W представляет собой амино; n равно 1; R2a и R2b, каждый независимо, представляют собой метил или водород; и R3a представляет собой водород, (2R)-метил или (2R)-этил, a R3b представляет собой водород; и R4 представляет собой водород или(C1-C4)алкил. Когда X представляет собой N, предпочтительно Y представляет собой CR, где R представляет собой водород или метил; Z представляет собой СН; (i) R1a представляет собой галоген, (C1-C4)алкил,трифторметил, метокси или трифторметокси, a R1b, R1d и R1e, каждый, представляют собой водород, (ii)-4 007183 равно 1; R2a и R2b, каждый независимо, представляют собой (C1-C4)алкил или водород; R3a представляет собой водород, (2R)-мeтил или (2R)-этил, a R3b представляет собой водород; и R4 представляет собой водород или (C1-C4)алкил. Не ограничивающие примеры наиболее предпочтительных соединений включают (3-хлорбензил)(4-пиперазин-1-ил-пиримидин-2-ил)амин, (3-хлорбензил)-(2-пиперазин-1-ил-пиримидин-4-ил)амин, (3 фторбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амин и (3-фторбензил)-(2-пиперазин-1-ил-пиримидин 4-ил)амин, их оксиды азота, эфиры или амиды указанных соединений или указанных оксидов азота,фармацевтически приемлемые соли указанных соединений, указанных оксидов азота или указанных эфиров или амидов, либо сольваты или гидраты указанных соединений, указанных оксидов азота, указанных эфиров или амидов или указанных солей. Предпочтительными солями вышеуказанных соединений формулы (IA) являются гидрохлорид (3 хлорбензил)-(2-пиперазин-1-ил-пиримидин-4-ил)амина, гидрохлорид (3-хлорбензил)-(4-пиперазин-1-илпиримидин-2-ил)амина, гидрохлорид (3-фторбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина и фумарат (3-фторбензил)-(2-пиперазин-1-ил-пиримидин-4-ил)амина. Некоторые описанные здесь соединения содержат по меньшей мере один хиральный центр; следовательно, специалистам в данной области техники будет понятно, что все стереоизомеры (например энантиомеры и диастереоизомеры) соединений, проиллюстрированных и описанных здесь, входят в объем настоящего изобретения. Кроме того, таутомерные формы соединений также входят в объем настоящего изобретения. Соединения по изобретению, которые действуют как лиганды рецепторов 5-НТ 2 (предпочтительно как лиганды рецепторов 5-НТ 2 с и/или 5-НТ 2 а), полезны для лечения или предупреждения опосредованных рецепторами 5-НТ 2 заболеваний, состояний или расстройств. В другом аспекте настоящего изобретения предложена фармацевтическая композиция, которая содержит (1) соединение формулы (IA), как определено выше, и (2) фармацевтически приемлемый эксципиент, разбавитель или носитель. В одном препочтительном воплощении фармацевтическая композиция по настоящему изобретению содержит соединение, выбранное из группы, состоящей из 2-(2-хлорбензилокси)-4-пиперазин-1-илпиримидина, 2-(3-фторбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(3-хлорбензилокси)-4-пиперазин-1 ил-пиримидина, 2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)-пиримидина, (3-хлорбензил)-(2 пиперазин-1-ил-пиримидин-4-ил)амина, (3-хлорбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина, (3 фторбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина, (3-фторбензил)-(2-пиперазин-1-ил-пиримидин-4 ил)амина,2-[1-(3-фторфенил)этокси]-4-метил-6-пиперазин-1-ил-пиримидина,2-[1-(3-фторфенил)этокси]-4-пиперазин-1-ил-пиримидина, 2-[1-(2-хлорфенил)этокси]-4-пиперазин-1-ил-пиримидина, 2-[1(3-хлорфенил)этокси]-4-пиперазин-1-ил-пиримидина, 2-[1-(3-хлорфенил)этокси]-4-метил-6-пиперазин-1 ил-пиримидина, 2-(2,3-дифторбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(2,5-дифторбензилокси)-4 пиперазин-1-ил-пиримидина, 2-(2,5-дифторбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина, 2(2,5-дихлорбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(2,5-дихлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)-пиримидина, 2-(3,5-дихлорбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(3,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидина и 4-пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидина, его оксида азота, эфира или амида указанного соединения или указанного оксида азота, фармацевтически приемлемой соли указанного соединения, указанного оксида азота или указанного эфира или амида, либо сольвата или гидрата указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли. В другом предпочтительном воплощении фармацевтическая композиция по изобретению содержит соединение, выбранное из группы, состоящей из 2-(3-хлорбензилокси)-4-пиперазин-1-ил-пиримидина, 2(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина, (3-хлорбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина, (3-хлорбензил)-(2-пиперазин-1-ил-пиримидин-4-ил)амина, (3-фторбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина, (3-фторбензил)-(2-пиперазин-1-ил-пиримидин-4-ил)амина, 2-(2,3-дифторбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(2,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидина, 2-(2,5-дифторбензилокси)-4-(2(R)-метилпиперазин-1-ил)пиримидина, 2-(2,5-дихлорбензилокси)-4(2(R)-метилпиперазин-1-ил)пиримидина, 2-(3,5-дихлорбензилокси)-4-пиперазин-1-ил-пиримидина и 4 пиперазин-1-ил-2-(2,3,5-трифторбензилокси)пиримидина; его оксида азота, эфира или амида указанного соединения или указанного оксида азота, фармацевтически приемлемой соли указанного соединения,указанного оксида азота или указанного эфира или амида, либо сольвата или гидрата указанного соединения, указанного оксида азота, указанного эфира или амида или указанной соли. В другом предпочтительном воплощении фармацевтическая композиция по изобретению содержит соединение, выбранное из группы, состоящей из гидрохлорида 2-(2-хлорбензилокси)-4-пиперазин-1-илпиримидина, гидрохлорида 2-(3-фторбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорида 2-(3 хлорбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорида 2-(3-хлорбензилокси)-4-(2(R)-метилпиперазин-1-ил)-пиримидина, гидрохлорида (3-хлорбензил)-(2-пиперазин-1-ил-пиримидин-4-ил)амина,гидрохлорида (3-хлорбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина, гидрохлорида (3-фторбензил)(4-пиперазин-1-ил-пиримидин-2-ил)амина, фумарата (3-фторбензил)-(2-пиперазин-1-ил-пиримидин-4-5 007183 ил)амина, гидрохлорида 2-(2,3-дифторбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорида 2-(2,5 дифторбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорида 2-(2,5-дихлорбензилокси)-4-пиперазин-1-ил-пиримидина, гидрохлорида 2-(3,5-дихлорбензилокси)-4-пиперазин-1-ил-пиримидина и гидрохлорида 2-(3,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидина. В еще одном воплощении фармацевтическая композиция по изобретению дополнительно содержит по меньшей мере один иной фармацевтический агент, выбранный из группы, состоящей из ингибитора аро-В/МТР, агониста MCR-4, агониста ССК-А, ингибитора обратного захвата моноаминов, симпатомиметического агента, агониста адренергического рецептора 3, агониста дофамина, аналога рецептора меланоцит-стимулирующего гормона, антагониста рецептора каннабиноида 1, антагониста меланин-концентрирующего гормона, лептина, аналога лептина, агониста рецептора лептина, антагониста галанина, ингибитора липазы, агониста бомбезина,антагониста нейропептида-Y, тиреомиметического агента, дегидроэпиандростерона или его аналога, агониста или антагониста рецепторов глюкокортикоидов, антагониста рецептора орексина, антагониста урокортин-связывающего белка, агониста рецептора глюкагонподобного пептида-1, цилиарного нейротрофического фактора, человеческого агути-родственного белка (AGRP), антагониста рецептора грелина,антагониста или обратного агониста рецептора гистамина 3 и агониста рецептора нейромедина U. Предпочтительно, указанный агент против ожирения выбран из группы, состоящей из орлистата,сибутрамина, бромокриптина, эфедрина, лептина и псевдоэфидрина. Терапевтическую комбинацию можно вводить в виде (а) одной фармацевтической композиции, которая содержит соединение по настоящему изобретению, по меньшей мере один дополнительный фармацевтический агент, описанный выше, и фармацевтически приемлемый эксципиент, разбавитель или носитель; или (б) двух отдельных фармацевтических композиций, включающих (i) первую композицию,содержащую соединение формулы (IA) и фармацевтически приемлемый эксципиент, разбавитель или носитель, и (ii) вторую композицию, содержащую по меньшей мере один дополнительный фармацевтический агент, описанный выше, и фармацевтически приемлемый эксципиент, разбавитель или носитель. Эти фармацевтические композиции можно вводить одновременно или последовательно и в любом порядке. Соединения и композиции по настоящему изобретению могут быть предоставлены в фармацевтическом наборе для применения для лечения или предупреждения опосредованных рецептором 5-НТ 2 заболеваний, состояний или расстройств у животного (предпочтительно заболеваний, состояний или расстройств, опосредованных рецептором 5-НТ 2 с). Такой набор включает в себя а) подходящую лекарственную форму, содержащую соединение по настоящему изобретению, и б) инструкции, в которых описан способ применения этой лекарственной формы для лечения или предупреждения заболевания, состояния или расстройства, опосредованного рецептором 5-НТ 2. Фармацевтический набор также может включать в себя: а) первую лекарственную форму, содержащую (i) соединение по настоящему изобретению, и (ii) фармацевтически приемлемый эксципиент, разбавитель или носитель; б) вторую лекарственную форму, содержащую (i) дополнительный фармацевтический агент, описанный выше, и (ii) фармацевтически приемлемый эксципиент, разбавитель или носитель; и в) контейнер. Соединения или фармацевтические композиции по настоящему изобретению можно применять для лечения женской сексуальной дисфункции (FSD). Соединения по изобретению можно вводить в комбинации с дополнительными активными агентами для лечения FSD. Эти дополнительные активные агенты могут быть выбраны из группы, состоящей из (1) модуляторов рецепторов эстрогенов, агонистов эстрогенов, антагонистов эстрогенов или их комбинаций; (2) агента замещения тестостерона, тестостернона(Tostrelle), дигидротестостерона, дегидроэпиандростерона (DHEA), имплантата тестостерона или их комбинаций; (3) эстрогена, комбинации эстрогена и медроксипрогестерона или ацетата медроксипрогестерона (МРА), либо эстрогена и метилтестостеронового агента гормональной заместительной терапии;(4) одного или более чем одного дофаминергического агента; (5) одного или более чем одного ингибитора NPY (нейропептида Y); (6) одного или более чем одного агониста рецептора или модулятора меланокортина или энхансера меланокортина; (7) одного или более чем одного ингибитора NEP; (8) одного или более чем одного ингибитора PDE; и (9) одного или более чем одного антагониста или модулятора рецептора бомбезина. FSD включает расстройство полового возбуждения женщин (FSAD), женское оргазмическое расстройство (FOD), расстройство, представляющее собой гипоактивное половое влечение(HSDD), или половое болевое расстройство. Соединения или фармацевтические композиции по изобретению можно также применять для лечения мужской эректильной дисфункции (MED). Соединения или фармацевтические композиции по изобретению можно также применять для увеличения доли постного мяса у годного в пищу животного. Соединения по настоящему изобретению можно вводить годному в пищу животному в комбинации с любым дополнительным фармацевтическим агентом, описанным выше. Определения Используемый здесь термин алкил относится к углеводородному радикалу общей формулы СnН 2n+1. Этот алкановый радикал может быть нормальным или разветвленным. Например, термин (C1-6 007183C4)алкил относится к одновалентной нормальной или разветвленной алифатической группе, содержащей от 1 до 4 атомов углерода, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил и другие структурные изомеры, содержащие от 1 до 4 атомов углерода (включая стереоизомеры). Алкановый радикал может быть незамещенным или замещенным одним или более чем одним заместителем. Например, замещенный галогеном алкил относится к алкильной группе, замещенной одним или более чем одним атомом галогена (например фторметил, дифторметил, трифторметил, перфторэтил, хлорметил, бромометил и тому подобное). Подобным образом, алкильная часть алкокси, алкиламино, диалкиламино или алкилтиогруппы имеет такое же значение, как и алкил, определенный выше, а замещенная галогеном алкильная часть замещенной галогеном алкокси, алкиламино, диалкиламино или алкилтиогруппы имеет такое же значение, как и замещенный галогеном алкил, определенный выше. Термин частично или полностью насыщенный циклоалкил относится к неароматическим кольцам, которые либо частично, либо полностью гидрогенизированы. Например, частично или полностью насыщенный (C3-C6)циклоалкил включает такие группы, как циклопропил, циклопропенил, циклобутил,циклобутенил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогексадиенил и тому подобные. Если не указано иное, термин конденсированное кольцо относится к частично или полностью насыщенным, а также к ароматическим карбоциклическим и гетероциклическим кольцевым системам. Предпочтительно, гетероциклическое кольцо содержит 1 или 2 гетероатома, независимо выбранные из азота, кислорода и серы (возможно окисленной до соответствующего сульфона или сульфоксида). Не ограничивающие примеры конденсированных кольцевых систем включают нафталин, индан, инден, изоинден, бензофуран, изобензофуран, бензо[b]тиофен, бензо[с]тиофен, индол, 3 Ниндол, 1H-изоиндол, индазол, индоксазин, бензоксазол, антранил, тетралин, 2 Н-1-бензофуран, хинолин,изохинолин, циннолин, хиназолин, 2H-1,3-бензоксазин, 2H-1,4-бензоксазин, 1H-2,3-бензоксазин, 4H-2,1 бензоксазин, 2H-1,2-бензоксазин, 4 Н-1,4-бензоксазин и тому подобные. Термин гетероарил относится к ароматическим моноциклическим или бициклическим кольцевым системам, содержащим 1, 2 или 3 гетероатома, независимо выбранных из азота, кислорода и серы. Гетероарильная группа может быть незамещенной или замещенной заместителями в количестве от 1 до 3. Предпочтительные заместители включают галогено (Br, Cl, I или F), (C1-C4)алкил и (C1-C4)алкокси. Подходящие гетероарильные группы включают пиридин-2-ил, пиридин-3-ил, фуран-3-ил, фуран-2-ил, тиофен-2-ил, тиофен-3-ил, тиазол-2-ил, пиррол-2-ил, пиррол-3-ил, пиразол-3-ил, хинолин-2-ил, хинолин-3 ил, изохинолин-3-ил, бензофуран-2-ил, бензофуран-3-ил, изобензофуран-3-ил, бензотиофен-2-ил, бензотиофен-3-ил, индол-2-ил, индол-3-ил, 2 Н-имидазол-2-ил, оксазол-2-ил, изоксазол-3-ил, 1,2,4-оксадиазол 3-ил, 1,2,4-триазол-3-ил, 1,2,4-оксатиазол-3-ил и тому подобные. Термин замещенный означает, что атом водорода на молекуле замещен другим атомом или молекулой. Атом или молекулу, замещающие атом водорода, называют заместителем. Термин замещенный прямо предполагает и учитывает замещения, которые являются общепринятыми в данной области техники. Однако обычно специалистам в данной области техники ясно, что заместители должны быть выбраны таким образом, чтобы не оказывать вредного воздействия на фармакологические характеристики соединения или неблагоприятным образом препятствовать применению лекарства. Термин оксид азота, или N-оксид, относится к окислению по меньшей мере одного из атомов азота в пиримидиновом или пиразиновом кольце соединений формулы (IA), (IB) или (IС) (например моно- или диоксид). Монооксиды азота могут существовать в виде единственного изомера положения или в виде смеси изомеров положения (например смесь 1-N-оксида и 3-N-оксида пиримидинов или смеси l-Nоксида и 4-N-оксида пиразинов). Термин защитная группа, или Pg, относится к заместителю, который обычно используют для блокирования или защиты конкретной функциональной группы при взаимодействии других функциональных групп на соединении. Например, защитная группа для амино представляет собой присоединенный к аминогруппе заместитель, который блокирует или защищает функциональную аминогруппу в соединении. Подходящие защитные группы для амино включают ацетил, трифторацетил, третбутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-флюоренилметиленоксикарбонил (Fmoc). Подобным образом, защитная группа для гидрокси относится к заместителю гидроксигруппы, который блокирует или защищает функциональную гидроксигруппу. Подходящие защитные группы включают ацетил и силил. Защитная группа для карбокси относится к заместителю карбоксигруппы, который блокирует или защищает функциональную карбоксигруппу. Широко распространенные защитные группы для карбокси включают -CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(паратолуолсульфонил)этил, 2-(пара-нитрофенилсульфенил)этил, 2-(дифенилфосфино)этил,нитроэтил и тому подобные. Общее описание защитных групп и их использования см. в Т.W. Greene,Protective Groups in Organic Synthesis, John WileySons, New York, 1991. Термин лиганд относится к соединению, которое связывается с рецептором. Используемый здесь лиганд может обладать частичной или полной агонистической или антагонистической активностью. Выражение терапевтически эффективное количество означает количество соединения по настоящему изобретению, которое (i) лечит или предупреждает конкретное заболевание, состояние или рас-7 007183 стройство, (ii) ослабляет, облегчает или устраняет один или более чем один симптом конкретного заболевания, состояния или расстройства или (iii) предупреждает или замедляет появление одного или более чем одного симптома конкретного заболевания, состояния или расстройства, которые здесь описаны. Термин животное относится к людям, животным-компаньонам (например собакам, кошкам и лошадям), животным, являющимся источником продуктов питания, животным зоопарков, морским животным, птицам и другим подобным видам животных. Термин годные в пищу животные относится к животным, являющимся источником продуктов питания, таким как коровы, свиньи, овцы и домашняя птица. Выражение фармацевтически приемлемый указывает на то, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, входящими в препарат, и/или с млекопитающим, которое лечат этим препаратом. Термины лечение, лечить или терапия охватывают как превентивное, то есть профилактическое, так и паллиативное лечение. Термин соединения по настоящему изобретению (если конкретно не указано иное) относится к соединениям формулы (IА), их оксидам азота, эфирам или амидам этих соединений или оксидов азота,фармацевтически приемлемым солям этих соединений, оксидов азота и/или эфиров или амидов и к гидратам или сольватам этих соединений, оксидов азота, солей и/или эфиров или амидов, а также ко всем стереоизомерам (включая диастереоизомеры и энантиомеры), таутомерам и соединениям, меченным изотопами. Подробное описание изобретения Согласно настоящему изобретению предложены соединения формулы (IA), которые действуют как лиганды рецепторов 5-НТ 2 (предпочтительно как лиганды рецепторов 5-НТ 2 а и 5-НТ 2 с), где X, Y, Z, W, R1a-R1e, R2a, n, R3a, R3b и R4 такие, как определено выше в разделе "Краткое изложение сущности изобретения". Соединения по настоящему изобретению можно синтезировать способами, которые включают в себя процессы, аналогичные способам, известным в области химии, в частности в свете приведенного описания. Исходные вещества, как правило, доступны из коммерческих источников, таких как AldrichChemicals (Milwaukee, WI), или легко могут быть получены способами, общеизвестными специалистам в данной области техники (например способами, описанными в Louis F. Fieser and Mary Fieser, Reagents forChemie, 4, Aufl. Ed. Springer-Verlag, Berlin, включая приложения (также доступные через текущую базу данных Beilstein. Для иллюстрации ниже приведены реакционные схемы, на которых показаны возможные пути синтеза соединений по настоящему изобретению, а также ключевых промежуточных соединений. Более подробное описание отдельных реакционных стадий приведено в разделе Примеры. Специалистам в данной области техники должно быть понятно, что для получения соединений по изобретению можно использовать другие пути синтеза. Хотя на этих схемах изображены конкретные исходные вещества и реагенты, и они обсуждаются ниже, их легко можно заменить другими исходными веществами и реагентами для получения различных производных и/или обеспечения условий реакций. Кроме того, многие соединения, полученные описанными ниже способами, можно дополнительно модифицировать в свете данного описания, используя общепринятые химические методики, хорошо известные специалистам в данной области техники. Например, сульфидный мостик (то есть W = S) легко можно окислить до соответствующей сульфинильной или сульфонильной группы (то есть W = SO или SO2), используя общепринятые методики окисления (например, окисление метахлорпербензойной кислотой). При получении соединений по настоящему изобретению может быть необходима защита отдельной функциональной группы (например первичного или вторичного амина) промежуточных соединений. Необходимость такой защиты будет зависеть от природы этой функциональной группы и условий способов получения. Подходящие защитные группы для амино (NH-Pg) включают ацетил, трифторацетил,трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-фторенилметиленоксикарбонил (Fmoc). Специалист в данной области техники легко сможет решить вопрос о необходимости такой защиты. Общее описание защитных групп и их использования см. в Т. W. Greene, Protective Groups in Organic-8 007183 Схема I иллюстрирует получение соединений по настоящему изобретению, где W представляет собой О, S, амино или (C1-C4)алкиламино. Схема IW = -O, -S, -NH или (C1-C4)алкиламин,Ph = замещенный или незамещенный фенил. В результате взаимодействия дигалогензамещенного гетероарильного соединения формулы II с соединением формулы III (R4 возможно может представлять собой защитную группу для амино) в подходящем растворителе (например в этаноле, трет-бутаноле, н-бутаноле, толуоле, диоксане, ТГФ, ДМФ или ацетонитриле) в присутствии подходящего основания (например карбоната натрия, карбоната калия,карбоната цезия, гидроксида натрия (NaOH), гидроксида калия, 1,8-диазабицикло-[5.4.0]ундец-7-ена(ДБУ), триэтиламина (ТЭА) или пиридина) при температуре от примерно 25 С до примерно 200 С в течение времени от примерно 1 ч до примерно 168 ч образуется промежуточное соединение IV. В результате обработки промежуточного соединения IV избытком соответствующего амина в растворителе (например в EtOH, t-BuOH, диоксане, ТГФ или ДМФ) в присутствии подходящего основания (например карбоната натрия, карбоната калия, карбоната цезия, NaOH, гидрида натрия, ДБУ, ТЭА или пиридина) при температуре от примерно 25 С до примерно 200 С в течение времени от примерно 1 до примерно 7 суток образуется промежуточное соединение V, где W представляет собой связывающую аминогруппу или замещенную (C1-C4 )алкилом связывающую аминогруппу. Подходящие амины включают бензиламин, 3-хлорбензиламин, 3-фторбензиламин и тому подобные. Альтернативно промежуточное соединение IV можно подвергнуть взаимодействию с анионом соответствующего спирта или тиола в растворителе (например в ТГФ, толуоле, диоксане, ДМФ, бензоле или в смеси бензола и воды) в присутствии или в отсутствие катализатора, такого как 18-краун-6 при температуре от примерно 25 С до примерно 200 С в течение времени от примерно 1 ч до примерно 48 ч с образованием соединения формулы V, где W представляет собой О или S. Анион можно получить путем обработки соответствующего спирта или тиола основанием (например карбонатом калия, гидридом натрия, гидроксидом натрия, гидроксидом калия, трет-бутоксидом калия или металлическим натрием) в инертном растворителе (например в толуоле, диоксане, ДМФ, ТГФ или бензоле) при температуре от примерно 25 С до примерно 200 С в течение времени от примерно 1 ч до примерно 24 ч.-9 007183 Подходящие спирты включают бензиловый спирт, -фенетиловый спирт, -фенетиловый спирт, 3 фторбензиловый спирт, 3-хлорбензиловый спирт, 3-метоксибензиловый спирт, 2-хлорбензиловый спирт,3-фторфенетиловый спирт, 2-хлорфенетиловый спирт, 3-хлорфенетиловый спирт, 2,5-дифторбензиловый спирт, 2,5-дихлорбензиловый спирт, 3,5-дифторбензиловый спирт, 3,5-дихлорбензиловый спирт, 2-гидроксиметилпиридин, 2-гидроксиметил-6-хлор-пиридин, 2-гидроксиметил-6-метил-пиридин и т.п. Подходящие тиолы включают -толуолтиол, (2-метилфенил)метантиол, 3-(трифторметил)толуолтиол, 2-хлортолуолтиол, (3-метилфенил)метантиол, 2-хлор-6-фторбензилмеркаптан, ортофторбензилмеркаптан, метахлорбензилмеркаптан, 2,4,6-триметилбензилмеркаптан и т.п. Сульфидный мостик можно окислить до соответствующего сульфинила или сульфонила, используя стандартные методики окисления, хорошо известные специалистам в данной области техники. Когда R4 представляет собой защитную группу для амино, промежуточное соединение V лишают защиты с образованием амина VI. Например, ВОС-защищенный амин можно лишить защиты путем обработки трифторуксусной кислотой (ТФУ) в CH2Cl2. Вторичный амин VI затем можно алкилировать до амина VII способами, хорошо известными специалистам в данной области техники. Предпочтительным способом является восстановительное алкилирование. Как правило, реакции восстановительного алкилирования превращают промежуточное соединение VI в основание Шиффа, подвергая взаимодействию с желаемым альдегидом или кетоном в полярном растворителе при температуре от примерно 10 С до примерно 140 С в течение времени от примерно 2 до примерно 24 ч в присутствии 3 молекулярных сит. Обычно к амину добавляют один эквивалент или небольшой избыток альдегида или кетона. Подходящие полярные растворители включают метиленхлорид, 1,2-дихлорэтан, диметилсульфоксид, диметилформамид, спирты (например метанол или этанол) или их смеси. Предпочтительным растворителем является метанол. После этого в том же реакционном сосуде имин восстанавливают до третичного амина в присутствии восстанавливающего агента при температуре от примерно 0 С до примерно 10 С, а затем нагревают до температуры от примерно 20 С до примерно 40 С в течение времени от примерно 30 мин до примерно 2 ч. Подходящие восстанавливающие агенты включают комплекс пиридинборан и боргидриды металлов, такие как боргидрид натрия, триацетоксиборгидрид натрия и цианоборгидрид натрия. Подходящие альдегиды или кетоны включают параформальдегид, ацетальдегид, ацетон и т.п. Альтернативно, амин VI можно ацилировать или превратить в карбамат способами, общеизвестными специалистам в данной области техники. Соединения по настоящему изобретению, где W представляет собой связывающую аминогруппу(NH) или связывающую алкиламиногруппу, также могут быть получены путем восстановительного алкилирования аминогруппы, присоединенной к пиримидиновому или пиразиновому кольцу, как это показано ниже на Схеме II. Методики синтеза аналогичны методикам, описанным выше на схеме I для восстановительного алкилирования промежуточного соединения VI. Схема II- 10007183 Соединение формулы VIII можно превратить в бензиламин XI способами, общеизвестными в данной области техники. Предпочтительным способом является восстановительное алкилирование как показано выше на cхеме I, где основание Шиффа образуют с промежуточным соединением IX, а затем восстанавливают соответствующим восстанавливающим агентом. Подходящие альдегиды и кетоны (то есть соединение формулы IX) включают 3-хлорбензальдегид, 3-фторбензальдегид, мета-хлорацетофенон, метахлорпропиофенон, ортохлорацетофенон, 2-фторбензальдегид, 2-хлорбензальдегид, 2,6-дихлорбензальдегид, 2,5-дихлорацетофенон, 2-хлор-5-метилацетофенон, 2,5-дифторацетофенон, 2,5-дифторпропиофенон, 2,3-дихлорбензальдегид, 2,3-дифторбензальдегид, 2,5-дифторбензальдегид, 2-хлор-5 фторацетофенон, 5-хлор-2-метоксибензальдегид, 2-фтор-5-метоксибензальдегид, 2,5-дихлорбензальдегид, 3,5-дихлорбензальдегид, 3,5-дихлорацетофенон, 3,5-дифторбензальдегид, 2,3,5-трифторбензальдегид, 2,3,5-трифторацетофенон, 2,3,5-трифторпропиофенон, 2,3,5-трихлорбензальдегид, 2,3,6 трифторбензальдегид и т.п. В результате обработки полученного соединения формулы X пиперазином III в подходящем растворителе (например в этаноле, трет-бутаноле, н-бутаноле, толуоле, диоксане, ТГФ,ДМФ или ацетонитриле) в присутствии подходящего основания (например карбоната натрия, карбоната калия, гидроксида натрия, ТЭА, ДБУ или пиридина) при температуре от примерно 25 С до примерно 200 С в течение времени от примерно 1 суток до примерно семи суток образуется соединение формулыXI. Общепринятые способы и/или методы разделения и очистки, известные специалисту средней квалификации, можно использовать для выделения соединений по настоящему изобретению, а также различных родственных им промежуточных соединений. Такие методы хорошо известны специалисту средней квалификации и могут включать, например, все виды хроматографии (жидкостную хроматографию высокого давления (ВЭЖХ), колоночную хроматографию с использованием обычных адсорбентов,таких как силикагель, и тонкослойную хроматографию), перекристаллизацию и методы фракционной (то есть жидкость-жидкость) экстракции. Соединения по настоящему изобретению можно выделить и использовать сами по себе или в форме их фармацевтически приемлемых солей, сольватов и/или гидратов. Термин соли относится к неорганическим и к органическим солям соединения по настоящему изобретению. Эти соли могут быть получены in situ в процессе конечного выделения и очистки соединения или отдельно взаимодействием соединения, N-оксида или пролекарства с подходящей органической или неорганической кислотой и выделения образовавшейся таким образом соли. Типичные соли включают гидробромид, гидрохлорид, гидройодид, сульфат, бисульфат, нитрат, ацетат, трифторацетат, оксалат, безилат, пальмитат, памоат, малонат, стеарат, лаурат, малат, борат, бензоат, лактат, фосфат, гексафторфосфат, бензолсульфонат, тозилат,формиат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и лаурилсульфат и т.п. Эти соли могут включать катионы щелочных и щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний и т.п., а также нетоксичные аммониевые, четвертичные аммониевые и аминные катионы, включая, но не ограничиваясь ими, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. [см., например,Berge et al., J. Pharm. Sci., 66, 1-19(1977)]. Термин оксид азота, или N-оксид, относится к окислению по меньшей мере одного из атомов азота в пиримидиновом или пиразиновом кольце. Окисление ароматических атомов азота хорошо известно в данной области техники. Типичные окисляющие агенты включают такие реагенты, как пероксид водорода, трифторперуксусная кислота, метахлорпербензойная кислота и т.п. Обычно окисление проводят в инертном растворителе (например, в метиленхлориде или в хлороформе). Положение Nокисления может меняться в зависимости от стерического затруднения из-за наличия заместителей на соседнем атоме углерода. N-оксид или смесь N-оксидов можно выделить или разделить, используя общепринятые методики, такие как жидкостная хроматография и/или селективная кристаллизация. Термин пролекарство означает соединение, которое in vivo преобразуется в соединение формулы(IA, IB или IС) или фармацевтически приемлемую соль, гидрат или сольват этого соединения. Это преобразование может происходить по различным механизмам, например в результате гидролиза в крови. Обсуждение применения пролекарств приведено в Т. Higuchi and W. Stella, Pro-drugs as Novel DeliverySystems, Vol. 14, A. C. S. Symposium Series, и в Bioreversible Carriers in Drug Design, ed. Edward B. Roche,American Pharmaceutical Association and Pergamon Press, 1987. Например, если соединение по настоящему изобретению содержит функциональную группу карбоновой кислоты, пролекарство может представлять собой сложный эфир, образованный путем замещения атома водорода кислотной группы такой группой, как (С 1-С 8)алкил, (С 2-С 12)алканоилоксиметил, 1(алканоилокси)этил, имеющий от 4 до 9 атомов углерода, 1-метил-1-(алканоилокси)этил, имеющий от 5 до 10 атомов углерода, алкоксикарбонилоксиметил, имеющий от 3 до 6 атомов углерода, 1(алкоксикарбонилокси)этил, имеющий от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этил,имеющий от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометил, имеющий от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил)амино)этил, имеющий от 4 до 10 атомов углерода, 3-фталидил, 4-кротонолактонил, гамма-бутиролактон-4-ил, ди-N,N-(C1-C6)алкиламино(С 2-С 3)алкил (такой как -диметил- 11007183 аминоэтил), карбамоил-(C1-C2)алкил, N,N-ди(C1-C2)алкилкарбамоил-(C1-C2)алкил, а также пиперидино-,пирролидино- или морфолино(C2-C3)алкил. Подобным образом, если соединение по настоящему изобретению содержит спиртовую функциональную группу, пролекарство может быть образовано путем замещения атома водорода спиртовой группы такой группой, как (C1-C6)алканоилоксиметил, 1-C1-C6)алканоилокси)этил, 1-метил-1-C1-C6) алканоилокси)этил, (C1-C6)алкоксикарбонилоксиметил, N-(C1-C6)алкоксикарбониламинометил, сукциноил, (C1-C6)алканоил, -амино(С 1-С 4)алканоил, арилацил и -аминоацил или -аминоациламиноацил, где каждая -аминоацильная группа независимо выбрана из встречающихся в природе Lаминокислот, Р(O)(ОН)2, -Р(O)(O(C1-C6)алкил)2 или гликозил (радикал, образованный в результате удаления гидроксильной группы гемиацеталевой формы углевода). Если соединение по настоящему изобретению содержит аминную функциональную группу, пролекарство может быть образовано путем замещения атома водорода в аминной группе такой группой, какR-карбонил, RO-карбонил, NRR'-карбонил, где R и R', каждый независимо, представляет собой (C1-C10) алкил, (С 3-С 7)циклоалкил, бензил, либо R-карбонил представляет собой природный -аминоацил или природный -аминоацилприродный -аминоацил, -С(ОН)С(O)ОY', где Y' представляет собой Н, (C1C6)алкил или бензил, -C(OY0)Y1, где Y0 представляет собой (C1-C4)алкил, a Y1 представляет собой (С 1 С 6)алкил, карбокси(C1-C6)алкил, амино(С 1-С 4)алкил, либо моно-N- или ди-N,N-(C1-C6)алкиламиноалкил,-C(Y2)Y3, где Y2 представляет собой Н или метил, a Y3 представляет собой моно-N- или ди-N,N-(C1-C6) алкиламино, морфолино, пиперидин-1-ил или пирролидин-1-ил. Соединения по настоящему изобретению могут содержать асимметрические или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Следует иметь в виду, что все стереоизомерные формы соединений по настоящему изобретению, а также их смеси, включая рацемические смеси, входят в объем настоящего изобретения. Кроме того, настоящее изобретение охватывает все геометрические изомеры и изомеры положения. Например, если соединение по настоящему изобретению включает в себя двойную связь или конденсированное кольцо, как цис-, так и транс- формы, а также их смеси, входят в объем изобретения. Как отдельные изомеры положения, так и смесь изомеров положения, образованных в результате N-окисления пиримидиновых и пиразиновых колец, также находятся в пределах объема настоящего изобретения. Диастереомерные смеси можно разделить на их индивидуальные диастереоизомеры, основываясь на их физико-химических различиях, способами, общеизвестными в данной области техники, например хроматографией и/или фракционной кристаллизацией. Энантиомеры можно разделить путем превращения энантиомерной смеси в диастереомерную смесь взаимодействием с подходящим оптически активным соединением (например с хиральным вспомогательным соединением, таким как хиральный спирт или хлорангидрид Мошера), разделения диастереоизомеров и превращения (например гидролиза) индивидуальных диастереоизомеров в соответствующие чистые энантиомеры. Некоторые из соединений по настоящему изобретению также могут быть атропизомерами (например замещенные биарилы), и они входят в объем данного изобретения. Энантиомеры также можно разделить путем использования хиральной колонки ВЭЖХ. Соединения по настоящему изобретению могут существовать как в несольватированных, так и в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобные, и следует иметь в виду, что изобретение включает в себя как сольватированные, так и несольватированные формы. Также возможно, что соединения по настоящему изобретению могут существовать в различных таутомерных формах, и все такие формы входят в объем изобретения. Например, все таутомерные формы имидазольной группировки входят в объем изобретения. Например, в объем изобретения также входят все кетоенольные и иминенаминные формы соединений. Настоящее изобретение также охватывает меченные изотопами соединения по настоящему изобретению, которые идентичны соединениям, перечисленным здесь, за исключением того, что один или более чем один атом заменен атомом, имеющим атомную массу или массовое число, отличные от атомной массы или массового числа, обычно обнаруживаемых в природе. Примеры изотопов, которые могут быть введены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 18O, 17O, 31 Р, 32 Р, 35S, 18F и 36Cl соответственно. Некоторые меченные изотопами соединения по настоящему изобретению (например соединения,меченные 3 Н и 14 С) пригодны для использования в анализах на тканевое распределение соединения и/или субстрата. Тритиевый (то есть 3 Н) и углерод-14 (то есть 14 С) изотопы особенно предпочтительны благодаря простоте их получения и обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий (то есть 2 Н), также может дать некоторые терапевтические преимущества благодаря более высокой метаболической стабильности (то есть увеличение периода полураспада in vivo или снижение требований к дозировке) и, следовательно, может быть предпочтительно при некоторых обстоятельствах. Меченные изотопами соединения по настоящему изобретению, как правило, могут быть получены по мето- 12007183 дикам, аналогичным методикам, показанным на схемах и/или в примерах здесь ниже, путем замены немеченого изотопом реагента на меченный изотопом реагент. Соединения по настоящему изобретению являются полезными частичными агонистами или антагонистами 5-НТ 2 (предпочтительно частичными агонистами или антагонистами 5-НТ 2 а или 5-НТ 2 с), поэтому другим воплощением настоящего изобретения является фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый эксципиент, разбавитель или носитель. Типичный препарат готовят путем смешения соединения по настоящему изобретению и носителя,разбавителя или эксципиента. Подходящие носители, разбавители и эксципиенты общеизвестны специалистам в данной области техники и включают такие вещества, как углеводы, воски, растворимые и/или набухающие в воде полимеры, гидрофильные или гидрофобные вещества, желатин, масла, растворители,вода и тому подобные. Конкретный используемый носитель, разбавитель или эксципиент будет зависеть от способа и назначения, согласно которым следует применять соединение по настоящему изобретению. Растворители обычно выбирают из растворителей, признанных специалистами в данной области техники безопасными (GRAS) для введения млекопитающему. В общем, безопасными растворителями являются нетоксичные водные растворители, такие как вода и другие нетоксичные растворители, которые растворимы в воде или смешиваются с водой. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например ПЭГ 400, ПЭГ 300) и т.д., а также их смеси. В состав препаратов можно также включать один или более чем один буфер, стабилизирующий агент, поверхностноактивное вещество, увлажняющий агент, смазывающий агент, эмульгатор, суспендирующий агент, консервант, антиоксидант, матирующий агент, глидант, вещество, способствующее процессингу, краситель,подсластитель, ароматизирующий агент, корригирующий агент, а также другие известные добавки для предоставления превосходного лекарственного средства (то есть соединения по настоящему изобретению или его фармацевтической композиции) или содействия в производстве фармацевтического продукта (то есть лекарства). Препараты могут быть приготовлены по общепринятым методикам растворения и смешения. Например, общий объем лекарственного вещества (то есть соединения по настоящему изобретению или стабилизированной формы этого соединения (например комплекса с производным циклодекстрина или другим известным комплексообразующим агентом растворяют в подходящем растворителе в присутствии одного или более чем одного из эксципиентов, описанных выше. Обычно соединение по изобретению вводят в состав фармацевтических лекарственных форм, чтобы обеспечить легкость регулирования дозировки лекарственного средства и предоставить пациенту превосходный и простой в обращении продукт. Фармацевтическая композиция (или препарат) для применения может быть упакована самыми разными путями в зависимости от способа, используемого для введения лекарства. Изделие для продажи обычно имеет контейнер, в который помещен фармацевтический препарат в соответствующей форме. Подходящие контейнеры общеизвестны специалистам в данной области техники и включают такие упаковочные средства, как флаконы (пластиковые и стеклянные), саше, ампулы, пластиковые пакеты, металлические баллоны и тому подобное. Контейнер может также иметь защищающий от неумелого обращения блок для предотвращения неосторожного доступа к содержимому упаковки. Контейнер также имеет этикетку, на которой указано содержимое контейнера. На этой этикетке могут быть указаны также соответствующие предупреждения. Для лечения опосредованных рецепторами 5-НТ 2 заболеваний, состояний или расстройств у животного, нуждающегося в таком лечении, этому животному вводят терапевтически эффективное количество соединения по настоящему изобретению или фармацевтической композиции, содержащей эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый эксципиент, разбавитель или носитель. Соединения по настоящему изобретению особенно полезны для лечения опосредованных рецепторами 5-НТ 2 с заболеваний, состояний или расстройств. Предпочтительно, соединения по настоящему изобретению действуют как частичные агонисты в сайте рецептора 5-НТ 2 с. Более предпочтительно, соединения по настоящему изобретению действуют как частичные агонисты в сайте рецептора 5-НТ 2 с и как антагонисты в сайте рецептора 5-НТ 2 а. Предпочтительно, опосредованное рецепторами 5-НТ 2 заболевание, состояние или расстройство выбрано из группы, состоящей из похудания (например снижения потребления калорий), ожирения, булимии, предменструального синдрома или синдрома поздней лютеиновой фазы, депрессии, атипичной депрессии, биполярных расстройств, психозов, шизофрении, мигрени, алкоголизма, злоупотребления табаком, панического расстройства, тревоги, посттравматического синдрома, потери памяти, старческой деменции, социальной фобии, гиперактивности при дефиците внимания, разрушительного поведенческого расстройства, расстройства импульсного контроля, пограничного личностного расстройства, обсессивно-компульсивного расстройства, синдрома хронического утомления, мужской сексуальной дисфункции (например преждевременной эякуляции и затруднения эрекции), женской сексуальной дисфункции, нервной анорексии, расстройств сна (например апноэ во сне), аутизма, припадков, эпилепсии,мутизма, спинно-мозговой травмы, повреждения центральной нервной системы (например травмы, уда- 13007183 ра, нейродегенеративных заболеваний или токсических или инфекционных заболеваний ЦНС (например энцефалита или менингита, сердечно-сосудистых расстройств (например тромбоза), желудочнокишечных расстройств (например дисфункции желудочно-кишечной перистальтики), несахарного диабета и диабета типа II. Соответственно, соединения по настоящему изобретению, описанные здесь, полезны в лечении опосредованных рецептором 5-НТ 2 заболеваний, состояний или расстройств. Следовательно, соединения по настоящему изобретению (включая композиции и способы, использованные здесь) можно использовать в производстве лекарства для терапевтических применений, описанных здесь. Соединения по настоящему изобретению можно вводить пациенту при уровнях дозировки в пределах от примерно 0,7 мг до примерно 7000 мг в сутки. Для нормального взрослого человека, имеющего массу тела примерно 70 кг, обычно достаточна дозировка в пределах от примерно 0,01 мг до примерно 100 мг на килограмм массы тела. Однако могут потребоваться некоторые изменения обычных пределов дозировки в зависимости от возраста и массы субъекта, которого лечат, от назначенного пути введения,от конкретного соединения, которое вводят, и тому подобного. Определение пределов дозировки и оптимальных дозировок для конкретного пациента полностью находится в пределах компетенции специалиста с учетом преимущества настоящего открытия. Следует также отметить, что соединения по настоящему изобретению можно использовать в препаратах пролонгированного высвобождения, регулируемого высвобождения и замедленного высвобождения, формы которых также хорошо известны специалисту. Соединения по данному изобретению можно применять также в сочетании с другими фармацевтическими агентами для лечения заболеваний/состояний, описанных здесь. Поэтому предложены также способы лечения, которые включают введение соединений по настоящему изобретению в комбинации с другими фармацевтическими агентами. Подходящие фармацевтические агенты, которые можно применять в комбинации с соединениями по настоящему изобретению, включают агенты против ожирения,такие как ингибиторы белка секреции аполипопротеина В/переноса микросомных триглицеридов(ароВ/МТР), агонисты MCR-4, агонисты холецистокинина-А (ССК-А), ингибиторы обратного захвата моноаминов (такие как сибутрамин), симпатомиметические агенты, агонисты адренергического рецептора 3, агонисты дофамина (такие как бромокриптин), аналоги рецептора меланоцит-стимулирующего гормона, антагонисты рецептора каннабиноида 1, антагонисты меланин-концентрирующего гормона,лептины (белок ОВ), аналоги лептинов, агонисты рецепторов лептинов, антагонисты галанина, ингибиторы липазы (такие как тетрагидролипстатин, то есть орлистат), аноректические агенты (такие как агонист бомбезина), антагонисты нейропептида-Y, тиреомиметические агенты, дегидроэпиандростерон или его аналог, агонисты или антагонисты рецепторов глюкокортикоидов, антагонисты рецептора орексина,антагонисты урокортин-связывающего белка, агонисты рецептора глюкагонподобного пептида-1, цилиарные нейротрофические факторы (такие как Axokine, доступный от Regeneron Pharmaceuticals, Inc.,Tarrytown, NY и ProcterGamble Company, Cincinnati, ОН), человеческие агути-родственные белки(AGRP), антагонисты рецепторов грелина, антагонисты или обратные агонисты рецепторов гистамина 3 и агонисты рецепторов нейромедина U. Другие агенты против ожирения, включая предпочтительные агенты, перечисленные ниже, общеизвестны или будут очевидны обычному специалисту в данной области техники в свете настоящего описания. Особенно предпочтительными являются агенты против ожирения, выбранные из группы, состоящей из орлистата, сибутрамина, бромокриптина, эфедрина, лептина и псевдоэфедрина. Предпочтительно,соединения и комбинации по настоящему изобретению вводят в сочетании с физическими упражнениями и целесообразной диетой. Типичные агенты против ожирения для использования в комбинациях, фармацевтических композициях и способах по изобретению можно получить, используя способы, известные специалисту в данной области техники. Например, сибутрамин можно получить как описано в патенте США 4929629; бромокриптин можно получить как описано в патентах США 3752814 и 3752888; и орлистат можно получить как описано в патентах США 5274143; 5420305; 5540917 и 5643874. Все перечисленные выше патенты США включены в данное описание посредством ссылки на них. Дозировка дополнительного фармацевтического агента (например агента против ожирения) обычно также будет зависеть от ряда факторов, включая состояние здоровья субъекта, которого лечат, степень желаемого лечения, природу и вид конкурентной терапии, если она есть, а также частоту лечения и природу желаемого эффекта. В общем случае, интервал дозировки агента против ожирения составляет от примерно 0,001 мг до примерно 100 мг на килограмм массы тела индивидуума в сутки, предпочтительно от примерно 0,1 мг до примерно 10 мг на килограмм массы тела индивидуума в сутки. Однако могут потребоваться некоторые изменения этого общего интервала дозировки в зависимости от возраста и массы субъекта, которого лечат, от назначенного пути введения, от конкретного агента против ожирения, который вводят, и тому подобного. Определение пределов дозировки и оптимальных дозировок для конкретного пациента полностью находится в компетенции специалиста с учетом преимуществ настоящего открытия. В другом воплощении настоящего изобретения соединения по настоящему изобретению полезны в лечении сексуальной дисфункции. Сексуальная дисфункция (SD) является значительной клинической- 14007183 проблемой, которая может воздействовать как на мужчин, так и на женщин. Причины SD могут быть как органическими, так и физиологическими. Органические аспекты SD обычно обусловлены основными сосудистыми заболеваниями, такими как заболевания, связанные с гипертензией или сахарным диабетом, прописанным лекарством и/или психиатрическим заболеванием, таким как депрессия. Психологические факторы включают страх, функциональную тревогу и межличностный конфликт. SD нарушает функцию совершения полового акта, снижает самооценку и прерывает личные взаимоотношения и вследствие этого вызывает личностный дистресс. SD расстройства делятся на расстройства, представляющие собой женскую сексуальную дисфункцию (FSD), и расстройства, представляющие собой мужскую сексуальную дисфункцию (MSD) (Melman et ai, 1999). FSD лучше всего определить как затруднение или неспособность женщины находить удовлетворение в сексуальном выражении. Мужская сексуальная дисфункция (MSD) обычно связана с эректильной дисфункцией, известной также как мужская эректильная дисфункция (MED) (Benet et al. 1994 - Male Erectile dysfunction assЭИsment and treatmentoptions. Comp. Ther. 20: 669-673). Соединения по изобретению особенно полезны для профилактики и/или лечения сексуальной дисфункции у мужчины (например мужской эректильной дисфункции - MED) и у женщины - женской сексуальной дисфункции (FSD), например расстройство полового возбуждения женщины (FSAD). Известно, что некоторые индивидуумы могут страдать мужской эректильной дисфункцией (MED).MED определяют как неспособность достижения и/или поддержания эрекции пениса для совершения удовлетворительного полового акта (NIH Consensus Development Panel on Impotence, 1993). Установлено, что распространенность эректильной дисфункции (ED) всех степеней (минимальной,умеренной и полной импотенции) составляет 52% у мужчин в возрасте от 40 до 70 лет с более высокой вероятностью у мужчин старше 70 лет (Melman, А.Gingell, J. С. (1999). The epidemiology andpathophysiology of erectile dysfunction. J. Urology 161: 5-11). Это состояние оказывает значительное отрицательное воздействие на качество жизни пациента и его партнера, результатом чего часто являются повышенная тревога и напряжение, приводящие к депрессии и низкой самооценке. Хотя два десятилетия назад MED считали прежде всего психологическим расстройством (Benet, A. E. Et al. (1994), Male erectiledysfunction assessment and treatment options. Соmр. Ther. 20: 669-673), в настоящее время известно, что для большинства пациентов существует органическая причина. В результате был достигнут большой прогресс в идентификации механизма нормальной эрекции пениса и патофизиологии MED. Эрекция пениса является гемодинамическим событием, которое зависит от баланса сокращения и расслабления гладкой мускулатуры пещеристого тела и сосудистой сети пениса (Lerner, S. Е. et al. (1993).A review of erectile dysfunction: new insights and more questions. J. Urology 149: 1246-1255). Гладкую мускулатуру пещеристого тела также называют здесь корпоральной гладкой мускулатурой или, в общем смысле, пещеристым телом. Расслабление гладкой мускулатуры пещеристого тела приводит к усилению кровотока в трабекулярные пространства пещеристого тела, вызывая их расширение в направлении окружающей оболочки и сдавливание дренирующих вен. Это приводит к значительному повышению кровяного давления, в результате чего возникает эрекция (Naylor, A. M. (1998). Endogenous neurotransmittersmediating penile erection. Br. J. Urology 81: 424-431). Изменения, которые происходят в процессе эрекции, сложны и требуют высокой степени координированной регуляции, в которую вовлечены периферическая и центральная нервные системы, а также эндокринная система (Naylor, 1998). Сокращение корпоральной гладкой мускулатуры модулируется симпатической норадренергической иннервацией посредством активации постсинаптических адреноцепторов 1. MED может быть связана с повышением тонуса эндогенной гладкой мускулатуры пещеристого тела. Однако процесс расслабления корпоральной гладкой мускулатуры частично опосредован неадренергической нехолинергической нейротрансмиссией (NANC). Существует ряд других NANC нейротрансмиттеров, обнаруженных в пенисе, иных чем NO, таких как пептид, кодируемый геном кальцитонина (CGRP), и вазоактивный интестинальный пептид (VIP). Главным релаксирующим фактором, ответственным за опосредование этой релаксации, является оксид азота (NO), который синтезируется из Lаргинина синтазой оксида азота (NOS) (Taub, H. С. et al. (1993). Relationship between contraction andrelaxation in human and rabbit corpus cavernosum. Urology 42: 698-704). Считается, что снижение тонуса корпоральной гладкой мускулатуры может помогать NO индуцировать релаксацию пещеристого тела. Во время полового возбуждения у мужчины NO высвобождается из нейронов и эндотелия и связывается с растворимой гуанилатциклазой (sGC), локализованной в гладкомышечных клетках и в эндотелии, и активирует ее, приводя к повышению внутриклеточных уровней циклического гуанозин-3',5'-монофосфата(cGMP). Это повышение cGMP приводит к релаксации пещеристого тела вследствие снижения внутриклеточной концентрации кальция ([Са 2+]) через неизвестные механизмы, в которые, как полагают, вовлечена активация протеинкиназы G (возможно благодаря активации Са 2+ насосов и Са 2+-активируемых К+ каналов). Категории женской сексуальной дисфункции (FSD) лучше всего определять по фазам нормальной половой реакции женщины: влечения, возбуждения и оргазма (см. S. R. Leiblum (1998). Definition andClassification of Female Sexual Disorders. Int. J. Impotence Res., 10, S104-S106). Влечение, или либидо, является двигателем сексуального выражения. Его проявления часто включают в себя сексуальные мысли- 15007183 либо в обществе заинтересованного партнера, либо под воздействием других эротических стимулов. Возбуждение включает сосудистую реакцию на половую стимуляцию, важным компонентом которой является гиперемия влагалища и усиленная смазка влагалища, растяжение влагалища и повышенная восприимчивость/чувствительность гениталий, и последующая реакция возбуждения. Оргазм представляет собой высвобождение полового напряжения, которое достигает кульминации во время возбуждения. Следовательно, FSD возникает, когда у женщины отсутствует реакция, либо имеется неадекватная или неудовлетворительная реакция в любой одной или более чем одной из этих фаз, обычно в фазе желания,возбуждения или оргазма. Американская Психиатрическая Ассоциация (the American Psychiatric Association) делит женскую сексуальную дисфункцию (FSD) на четыре класса: FSAD, расстройство, представляющее собой гипоактивное половое влечение (HSDD), женское оргазмическое расстройство (FOD) и болевые половые расстройства (например диспареуния и вагинизм) [см. Диагностическое и Статистическое Руководство по Психическим Расстройствам Американской Психиатрической Ассоциации, 4-е издание (AmericanDSM-IV определяет эти четыре класса следующим образом:HSDD - Устойчивая или рецидивирующая недостаточность (или отсутствие) сексуальных фантазий и желания половой активности. Оценку недостаточности или отсутствия проводит врач с учетом факторов, влияющих на функционирование, таких как возраст и жизненное окружение человека.FSAD - Устойчивая или рецидивирующая неспособность достигать или поддерживать до завершения половой активности адекватную реакцию смазки-набухания при половом возбуждении.FOD - Устойчивая или рецидивирующая задержка или отсутствие оргазма после нормальной фазы полового возбуждения. Женщины проявляют широкую вариабельность по типу или интенсивности стимуляции, которая запускает оргазм. Диагноз FOD должен быть основан на мнении врача о том, что способность женщины к оргазму меньше, чем может объясняться ее возрастом, сексуальным опытом и адекватностью половой стимуляции, которую она получает. Половые болевые расстройства, такие как диспареуния и вагинизм. Диспареуния - устойчивая или рецидивирующая боль в половых органах, связанная с половым контактом. Вагинизм - устойчивый или рецидивирующий инволюционный спазм мускулатуры наружной трети влагалища, который препятствует половому сношению.HSDD присутствует, если женщина не имеет или имеет слабое желание быть сексуальной, либо не имеет или имеет мало сексуальных мыслей или фантазий. Этот тип FSD может быть вызван низкими уровнями тестостерона вследствие либо естественной менопаузы, либо хирургической менопаузы. Другими причинами и у женщин в пременопаузе (то есть у женщины, которая находится в пременопаузе и у которой не было гистерэктомии), и у женщин в постменопаузе являются болезнь, лекарства, утомление,депрессия и/или тревога. Факторы, оказывающие потенциальное (сознательное или подсознательное) физиологическое воздействие, такие как трудности взаимоотношений или религиозные факторы, можно отнести к наличию/развитию HSDD у женщин. Диагностическое и Статистическое Руководство (DSM)IV Американской Психиатрической Ассоциации определяет Расстройство Полового Возбуждения Женщины (FSAD) как устойчивую или рецидивирующую неспособность достигать или поддерживать до завершения половой активности адекватной реакции смазки-набухания при половом возбуждении. Это нарушение должно вызывать значительный дистресс или межличностные трудности Реакция возбуждения состоит из сосудистой гиперемии тазовых органов, смазки влагалища, а также растягивания и набухания наружных половых органов. Ее нарушение вызывает значительный дистресс и/или межличностные трудности.FSAD является широко распространенным сексуальным расстройством, поражающим женщин в пре-, пери- и постменопаузе (при гормональной заместительной терапии (HRT) или без нее). Оно связано с сопутствующими расстройствами, такими как депрессия, сердечно-сосудистые заболевания, диабет и мочеполовые (UG) расстройства. Первичными последствиями FSAD являются отсутствие гиперемии/набухания, отсутствие смазки и отсутствие приятного ощущения в гениталиях. Вторичными последствиями FSAD являются снижение полового влечения, боль во время полового контакта и затруднение достижения оргазма. Недавно по данным на животных, подтверждающим эту точку зрения (Park et al.,Int. J. Impot. Res., 9, 27-37, 1997), была выдвинута гипотеза, что по меньшей мере у части пациентов симптомы FSAD имеют сосудистую природу (Goldstein et al., Int. J. Impot. Res., 10, S84-S90, 1998). Лекарствами-кандидатами для лечения FSAD, которые находятся в процессе исследования на эффективность, прежде всего являются терапии эректильной дисфункции, которые способствуют кровообращению в мужских половых органах. Они состоят из двух типов препаратов, пероральных или подъязычных лекарств (Апоморфина, Фентоламина), ингибиторов фосфодиэстеразы типа 5 (PDE5) (например Силденафила), и простагландина (PGE1), которые инъецируют или вводят трансуретрально мужчинам и местно в гениталии женщинам. Соединения по изобретению обладают преимуществом, представляя собой средства для восстановления нормальной реакции полового возбуждения, а именно: усиления кровообращения в гениталиях,приводящего к гиперемии влагалища, клитора и губ. Это приводит к усилению смазки влагалища через- 16007183 транссудацию плазмы, повышению податливости влагалища и повышению чувствительности гениталий. Следовательно, согласно настоящему изобретению предложены средства для восстановления или усиления нормальной реакции полового возбуждения. Под термином "женские гениталии" подразумевается: гениталии состоят из внутренней и наружной группы. Внутренние органы расположены в пределах таза и состоят из яичников, маточных труб,матки и влагалища. Наружные органы располагаются поверхностно относительно мочеполовой диафрагмы и ниже тазового пояса. Они включают лобок, большие половые губы и малые половые губы,клитор, преддверие, луковицу преддверия и большие железы преддверия [Gray's Anatomy,C.D.Clemente, 13rh American Edition]. R. J. Levin сообщает: "мужские и женские гениталии эмбриологически развиваются из общего тканевого зачатка, что свидетельстует о том, что структуры мужских и женских гениталий гомологичны друг другу. Так, клитор является гомологом пениса, а половые губы гомологичны мошонке" [Levin, R. J. (1991), Exp. Clin. Endocrinol., 98, 61-69]. В кратком изложении, FSAD характеризуется неадекватной реакцией гениталий на половую стимуляцию. Гениталии не претерпевают гиперемию, которая характеризует нормальное половое возбуждение. Стенки влагалища плохо смазываются, поэтому половое сношение становится болезненным. Оргазмы могут быть затруднены. Расстройство возбуждения может быть вызвано снижением эстрогена при менопаузе или после родов и в период лактации, а также заболеваниями с сосудистыми компонентами,такими как диабет и атеросклероз. Другими причинами являются результаты лечения диуретиками, антигистаминными агентами, антидепрессантами, например избирательными ингибиторами обратного захвата серотонина (SSRI), или гипотензивными агентами.FOD представляет собой устойчивые или рецидивирующие затруднение, задержку или отсутствие достижения оргазма после достаточной половой стимуляции и возбуждения, что вызывает личностный дистресс. Половые болевые расстройства (которые включают в себя диспареунию и вагинизм) характеризуются болью в результате проникновения и половой активности и могут быть вызваны лекарствами, которые уменьшают смазывание, эндометриозом, воспалительным заболеванием тазовых органов, воспалительным кишечным заболеванием или проблемами мочевого тракта. Соединения по изобретению можно также применять для лечения и/или предупреждения мужской сексуальной дисфункции (MSD), в частности мужской эректильной дисфункции (MED). Лечение и/или предупреждение мужской сексуальной дисфункции можно осуществлять комбинацией соединения по настоящему изобретению, как оно определено здесь выше, и одного или более чем одного соединения, которое ингибирует активность PDE, в частности соединения, которое ингибирует активность cGMP PDE5, и/или одного или более чем одного соединения, которое ингибирует активностьNEP (нейтральной эндопептидазы). Для мужчин, у которых проявляется недостаточная реакция или отсутствует реакция на лечениеViagra, может быть полезна либо терапия, основанная только на соединениях по настоящему изобретению, либо комбинированная терапия, основанная на соединении(ях) по настоящему изобретению и инибиторе cGMP PDE5, таком как, например, силденафил. Пациентам со слабой или умеренной MED будет полезна комбинированная терапия, основанная на соединении(ях) по настоящему изобретению исключительно или в комбинации с ингибитором NEP, и пациенты с тяжелой MED также могут реагировать на это лечение. Слабая, умеренная и тяжелая MED - это термины, которые должны быть известны специалисту в данной области техники, но руководство можно найти в: The Journal of Urology, vol. 151,54-61 (Jan 1994). Группы пациентов с MED, которые описаны более подробно в Clinical Andrology vol. 23, no. 4, p. 773-782, и в главе 3 книги I. Eardley and К. Sethia "Erectile Dysfunction - Current Invybitigation andManagement", опубликованной Mosby-Wolfe, следующие: психогенная, эндокринологическая, нейрогенная, артериогенная, индуцированная лекарствами сексуальная дисфункция (лактогенная) и сексуальная дисфункция, связанная с кавернозными факторами, в частности веногенными причинами. Подходящие ингибиторы cGMP PDE5 для применения в комбинации с соединением по настоящему изобретению для лечения MED согласно настоящему изобретению включают: пиразоло[4,3-d]пиримидин-7-оны, раскрытые в ЕР-А-0463756; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной заявке WO 01/27112; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной заявке WO 01/27113; индол-1,4-дионы, раскрытые в WO 95/19978, и триазин-4-оны,раскрытые в опубликованной международной заявке WO 99/24433. Более предпочтительными являются соединения: 5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он (силденафил), также известный как 1-3-(6,7-дигидро-1-метил-7-оксо-3 пропил-1 Н-пиразоло[4,3-d]пиpимидин-5-ил)-4-этoкcифeнил]cyльфoнил]-4-мeтилпипepaзин (см. ЕР-А 0463756); 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он, также известный как 1-6-этокси-5-[3-этил-6,7-дигидро-2- 17007183[3,4-b]индол-1,4-дион (IC-351, тадалафил), то есть соединение примеров 78 и 95 опубликованной международной заявки WO 95/19978, а также соединение примеров 1, 3, 7 и 8; и 2-[2-этокси-5-(4-этил-пиперазин-1-ил-1-сульфонил)-фенил]-5-метил-7-пропил-3 Н-имидазо[5,1-f][1,2,4]триазин-4-он (варденафил), также известный как 1-3-(3,4-дигидро-5-метил-4-оксо-7-пропилимидазо[5,1-f]-as-триазин-2-ил)-4-этоксифенил]сульфонил]-4-этилпиперазин, то есть соединение примеров 20, 19, 337 и 336 опубликованной международной заявки WO 99/24433; и их фармацевтически приемлемые соли. Для лечения MED можно использовать композицию, содержащую соединение по настоящему изобретению и силденафил. Пригодность любого конкретного ингибитора cGMP PDE5 для применения в комбинации с соединением по настоящему изобретению можно легко определить путем оценки его эффективности и избирательности с использованием описанных в литературе способов и последующей оценки его токсичности,всасывания, метаболизма, фармакокинетики и т.д. в соответствии со стандартной фармацевтической практикой. Предпочтительные ингибиторы cGMP PDE5 для использования согласно настоящему изобретению имеют IC50 менее 100 наномоль, более предпочтительно менее 50 наномоль, еще более предпочтительно менее 10 наномоль. Предпочтительно, ингибиторы cGMP PDE5 для использования в фармацевтических комбинациях согласно настоящему изобретению являются избирательными по отношению к ферментуPDE5. Предпочтительно, их избирательность к PDE5 относительно PDE3 больше в 100 раз, более предпочтительно больше в 300 раз. Более предпочтительно, избирательность к PDE5 относительно как PDE3,так и PDE4 больше в 100 раз, более предпочтительно больше в 300 раз. Специалист легко может определить соотношения избирательности. Значения IС 50 для ферментовet a/., Journal of Urology, 1998, vol, 159, pp. 2164-2171]. Предпочтительными здесь являются ингибиторы NEP, где указанная NEP представляет собой ЕС 3.4.24.11, и более предпочтительно, где указанный ингибитор NEP является избирательным в отношении ЕС 3.4.24.11 ингибитором, более предпочтительно избирательный ингибитор NEP является избирательным в отношении ЕС 3.4.24.11 ингибитором, который имеет IC50 менее 100 нМ (например омпатрилат,кандоксатрил, кандоксатрилат, сампатрилат). Подходящие соединения-ингибиторы NEP описаны в ЕРА-1097719. Особенно предпочтительными соединениями-ингибиторами NEP в качестве вспомогательных агентов для применения в лечении MED согласно настоящему изобретению являются соединения, описанные в находящейся на совместном рассмотрении Международной патентной заявке PCT/IB02/00807, поданной 18 марта 2002. Особенно предпочтительна (S)-2-[(1-[3-(4-хлорфенил)пропил]карбамоилциклопентил)метил]-4 метоксибутановая кислота или ее фармацевтически приемлемая соль, такая как натриевая соль, как подробно описано в примере 22 в PCT/IB02/00807. Подробное описание синтеза этого соединения и его натриевой соли приведено в экспериментальном разделе здесь ниже. Для лечения MED можно использовать композицию, содержащую соединение по настоящему изобретению и (S)-2-[(1-[3-(4-хлорфенил)пропил]карбамоилциклопентил)метил]-4-метоксибутановую кислоту. Соединения по настоящему изобретению пригодны для применения для лечения женской сексуальной дисфункции (FSD). Соединение по настоящему изобретению можно применять в комбинации с одним или более чем одним дополнительным активным агентом для лечения женской сексуальной дисфункции женщин(FSD). Предпочтительно, один или более чем один дополнительный активный агент выбирают из группы,состоящей из: 1) модуляторов рецепторов эстрогенов, и/или агонистов эстрогенов, и/или антагонистов эстрогенов; 2) агента замещения тестостерона и/или тестостернона (Tostrelle) и/или дигидротестостерона и/или дегидроэпиандростерона (DHEA) и/или имплантата тестостерона; 3) эстрогена, эстрогена и медроксипрогестерона или ацетата медроксипрогестерона (МРА) (в виде комбинации), либо эстрогена и метилтестостеронового агента гормональной заместительной терапии; 4) одного или более чем одного дофаминергического агента; 5) одного или более чем одного ингибитора NPY (нейропептида Y); 6) одного или более чем одного агониста рецептора или модулятора меланокортина или энхансера меланокортина;- 18007183 7) одного или более чем одного ингибитора NEP (нейтральной эндопептидазы); 8) одного или более чем одного ингибитора PDE (фосфодиэстеразы); и 9) одного или более чем одного антагониста или модулятора рецептора бомбезина. Предпочтительно, указанная FSD представляет собой расстройство полового возбуждения женщин(FSAD). В другой альтернативе указанная FSD представляет собой женское оргазмическое расстройство(FOD). В еще одной альтернативе указанная FSD является расстройством, представляющим собой гипоактивное половое влечение (HSDD). Еще в одной альтернативе указанная FSD представляет собой половое болевое расстройство, предпочтительно диспареунию или вагинизм. Примерами модуляторов рецепторов эстрогенов и/или агонистов эстрогенов и/или антагонистов эстрогенов являются ралоксифен или лазофоксифен, (-)-цис-6-фенил-5-[4-(2-пирролидин-1-илэтокси) фенил]-5,6,7,8-тетрагидронафталин-2-ол и его фармацевтически приемлемые соли (приведенное ниже соединение (а, получение которого подробно описано в WO 96/21656. Соединение (а) Примером агента замещения тестостерона является дегидроандростендион. Примеры агента гормональной заместительной терапии включают Премарин, Сенестин, Эстрофеминал, Эхин, Эстраце, Эстрофем, Эллесте Соло, Эстринг, Эстрадерм TTS, Эстрадерм Матрикс, Дерместрил, Премфаза, Преэмпро, Премпак, Премик, Эстратест, Эстратест HS и Тиболон. Примеры дофаминергических агентов включают апоморфин или избирательный агонист D2, D3 или D2/D3, такой как прамипексол и ропиринол (как заявлено в WO-0023056), L-Допа или карбидопа,PNU95666 (как раскрыто в WO-0040226). Примеры ингибиторов NPY (нейропептида Y) включают ингибиторы NPY1 или NPY5, предпочтительно ингибитор NPY1. Предпочтительно, указанные ингибиторы NPY (включая NPY Y1 и NPY Y5) имеют IC50 менее 100 нМ, более предпочтительно менее 50 нМ. Подходящие соединения-ингибиторыNPY, в частности ингибиторы NPY1, описаны в ЕР-А-1097718. Примеры агониста рецептора меланокортина или модулятора меланокортина или энхансера меланокортина включают меланотан II, РТ-14, РТ-141 или соединения, раскрытые в WO-09964002, WO00074679, WO-09955679, WO-00105401, WO-00058361, WO-00114879, WO-00113112 или WO-09954358. Подходящие ингибиторы NEP являются такими, как описано здесь выше. Композиция для лечения FSD может содержать соединение по настоящему изобретению и (S)-2-[(1[3-(4-хлорфенил)пропил]карбамоилциклопентил)метил]-4-метоксибутановую кислоту. Предпочтительные ингибиторы PDE включают ингибитор PDE 2, 3, 4, 5, 7 или 8, предпочтительно ингибитор PDE2 или PDE5 и более предпочтительно ингибитор PDE5 (как описано здесь выше), наиболее предпочтительно силденафил. Композиция для лечения FSD может содержать соединение по настоящему изобретению и силденафил. Предпочтительными примерами одного или более чем одного антагониста или модулятора рецептора бомбезина являются антагонисты или модуляторы для BB1, включая те, которые описаны вPCT/GB01/05018 (поданной 14 ноября 2001) и в PCT/GB00/04380 (поданной 17 ноября 2000). Также предпочтительны антагонисты рецепторов бомбезина ВВ 2, ВВ 3 или ВВ 4. Предпочтительные антагонисты рецепторов бомбезина также упомянуты как вспомогательные агенты в PCT/IB01/02399 (поданной 10 декабря 2001). Следует отметить, что полный перечень возможных дополнительных активных агентов можно найти в PCT/IB01/02399 (поданной 10 декабря 2001), и там они описаны как вспомогательные агенты. Можно использовать другие агонисты рецептора 5-НТ 2 с в дополнение к соединению по настоящему изобретению. Такие агонисты рецептора 5-НТ 2 с включают, но не ограничены ими, те, которые раскрыты в Chaki and Nakazato -Expert Opin. Ther. Patents (2001), 11 (11): 1677-1692 (см. в частности раздел 3.9-5 НТ 2 с на странице 1687 и фиг. 7 на странице 1686), или Isaac - Drugs of the Future (2001), 26 (4): 383-393(см. в частности фиг. 2 на странице 385). Во избежание сомнений вышеупомянутые публикации во всей их полноте включены в данную заявку путем ссылки. Предпочтительно, указанные агонисты рецептора 5-НТ 2 с являются избирательными агонистами рецептора 5-НТ 2 с.- 19007183 Данные по связыванию рецептора или данные по избирательности связывания не всегда могут коррелировать с функциональными данными или данными по функциональной избирательности или не всегда отражать их. Например, соединение может быть агонистом рецептора 5-НТ 2 с по данным анализов на связывание, но функционально это соединение может иметь такую же эффективность в отношении других рецепторов 5-НТ. Таким образом, термин избирательный, как его используют здесь в связи с настоящим изобретением в отношении способов лечения сексуальной дисфункции, означает функционально избирательный. Таким образом, предложено применять агонисты рецептора 5-НТ 2 с, предпочтительно избирательные агонисты рецептора 5-НТ 2 с, для лечения FSD, предпочтительно FSAD, FOD, HSDD или полового болевого расстройства (такого как диспареуния или вагинизм). Соединение по настоящему изобретению или комбинацию соединения по настоящему изобретению и по меньшей мере одного дополнительного фармацевтического агента вводят субъекту, нуждающемуся в лечении, предпочтительно в форме фармацевтической композиции. В комбинационном аспекте изобретения соединение по настоящему изобретению и по меньшей мере один иной фармацевтический агент (например агент против ожирения, описанный выше) можно вводить либо по отдельности, либо в фармацевтической композиции, содержащей оба агента. Как правило, предпочтительно, чтобы такое введение было пероральным. Однако если субъект, которого лечат, не способен глотать, либо пероральное введение по какой-либо иной причине наносит ущерб или является нежелательным, подходящим может быть парентеральное или чрескожное введение. Когда комбинацию соединения по настоящему изобретению и по меньшей мере одного иного фармацевтического агента вводят вместе, такое введение по времени может быть последовательным или одновременным, причем одновременный способ, как правило, предпочтителен. При последовательном введении соединение по настоящему изобретению и дополнительный фармацевтический агент можно вводить в любом порядке. Как правило, предпочтительно, чтобы такое введение было пероральным. Особенно предпочтительно, чтобы такое введение было пероральным и одновременным. Когда соединение по настоящему изобретению и дополнительный фармацевтический агент вводят последовательно,введение каждого можно осуществлять одинаковыми или различными способами. Согласно изобретению соединение по настоящему изобретению или комбинацию соединения по настоящему изобретению и по меньшей мере одного дополнительного фармацевтического агента (называемую здесь комбинация) предпочтительно вводят в форме фармацевтической композиции. Соответственно, соединение по настоящему изобретению или комбинацию можно вводить пациенту по отдельности или вместе в любой общепринятой пероральной, ректальной, чрескожной, парентеральной (например, внутривенной, внутримышечной или подкожной), интрацистернальной, интравагинальной,внутрибрюшинной, интравезикальной, местной (например, порошок, мазь или капли) или трансбуккальной или назальной лекарственной форме. Композиции, подходящие для парентеральной инъекции, обычно включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для растворения в стерильных инъекционных растворах или дисперсиях. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол,полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и тому подобные), их подходящие смеси, растительные масла (такие как оливковое масло) и инъекционные органические эфиры, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания необходимого размера частиц в случае дисперсий и путем использования поверхностно-активных веществ. Эти композиции могут также содержать адъюванты, такие как консервирующие, увлажняющие,эмульгирующие и диспергирующие агенты. Предотвращать заражение композиций микроорганизмами можно, используя различные антибактериальные и противогрибковые агенты, например парабены, хлорбутанол, фенол, сорбиновую кислоту и тому подобное. Также может быть целесообразным включать в состав изотонические агенты, например сахара, хлорид натрия и тому подобное. Пролонгированное всасывание инъекционных фармацевтических композиций можно обеспечить, используя агенты, способные замедлять всасывание, например моностеарат алюминия и желатин. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, порошки и гранулы. В таких твердых лекарственных формах соединение по настоящему изобретению или комбинацию смешивают с по меньшей мере одним традиционным инертным фармацевтическим эксципиентом(или носителем), таким как цитрат натрия или дикальцийфосфат, или (а) наполнители или увеличители объема (например крахмалы, лактоза, сахароза, маннит, кремниевая кислота и тому подобные); (б) связующие агенты (например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза, аравийская камедь и тому подобные); (в) увлажнители (например глицерин и тому подобные); (г) разрыхляющие агенты (например агар-агар, карбонат кальция, картофельный или тапиоковый крахмал,альгиновая кислота, некоторые комплексные силикаты, карбонат натрия и тому подобные); (д) вещества,поддерживающие растворы (например парафин и тому подобные); (е) ускорители всасывания (например четвертичные аммониевые соединения и тому подобные); (ж) смачивающие агенты (например цетило- 20007183 вый спирт, моностеарат глицерина и тому подобные); (з) адсорбенты (например каолин, бентонит и тому подобные) и/или (и) смазывающие агенты (например тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и тому подобные). В случае капсул и таблеток в лекарственные формы можно также включать буферные агенты. Твердые композиции подобного типа можно также использовать в качестве наполнителей в мягких или твердых желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и тому подобное. Твердые лекарственные формы, такие как таблетки, драже, капсулы и гранулы, могут быть приготовлены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие, хорошо известные в данной области техники. Они также могут содержать матирующие агенты, а также иметь такой состав, который позволяет высвобождать соединение по настоящему изобретению и/или дополнительный фармацевтический агент с задержкой. Примерами герметизирующих веществ, которые можно использовать, являются полимерные вещества и воски. Лекарство также может быть в микрокапсулированной форме, если это целесообразно, с одним или более чем одним вышеупомянутым эксципиентом. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к соединению по настоящему изобретению или комбинации жидкая лекарственная форма может содержать инертные разбавители, обычно используемые в данной области техники, такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, например этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (например хлопковое масло, арахисовое масло, кукурузное масло, оливковое масло, касторовое масло, кунжутное масло и тому подобные), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и эфиры жирных кислот и сорбитана или смеси этих веществ и тому подобные. Кроме таких инертных разбавителей, в композицию можно также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие, корригирующие и ароматизирующие агенты. В суспензии в дополнение к соединению по настоящему изобретению или комбинации могут быть включены также суспендирующие агенты, например этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси этих веществ и тому подобные. Композиции для ректального или вагинального введения включают предпочтительно суппозитории, которые можно изготовить путем смешивания соединения по настоящему изобретению или комбинации с подходящими не раздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при обычной комнатной температуре, но жидкими при температуре тела и, следовательно, плавятся в полости прямой кишки или влагалища, высвобождая таким образом активный компонент (активные компоненты). Лекарственные формы для местного введения соединений по настоящему изобретению и комбинаций соединений по настоящему изобретению с агентами против ожирения могут представлять собой мази, порошки, спреи и средства для ингаляции. Лекарственные средства смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми консервантами, буферами или пропеллентами,которые могут быть необходимы. Глазные препараты, глазные мази, порошки и растворы также входят в объем настоящего изобретения. В следующих абзацах описаны примеры препаратов, дозировок и т.д., полезные для животных, не являющихся людьми. Введение соединений по настоящему изобретению и комбинаций соединений по настоящему изобретению с агентами против ожирения можно осуществлять перорально или не перорально (например путем инъекции). Вводят такое количество соединения по настоящему изобретению или комбинации соединения по настоящему изобретению с агентом против ожирения, которое обеспечивает получение эффективной дозы. Как правило, суточная доза, которую вводят перорально животному, составляет примерно 0,01 1000 мг/кг массы тела, предпочтительно примерно 0,01 - 300 мг/кг массы тела. Соединение по настоящему изобретению (или комбинацию) удобно вносить в питьевую воду, так чтобы терапевтическая дозировка соединения была проглочена с суточным запасом воды. Соединение можно дозировать непосредственно в питьевую воду, предпочтительно в форме жидкого растворимого в воде концентрата (такого как водный раствор растворимой в воде соли). Соединение по настоящему изобретению (или комбинацию) удобно добавлять непосредственно в корм, само по себе или в форме кормовой добавки для животных, также называемой премиксом или концентратом. Премикс или концентрат соединения в носителе чаще используют для введения агента в корм. Подходящие носители представляют собой жидкости или твердые вещества, где как подходит,такие как вода, различные виды муки, такие как люцерновая мука, соевая мука, мука из хлопковых масличных жмыхов, мука из льняных масличных жмыхов, мука из сердцевины кукурузного початка и кукурузная мука, меласса, мочевина, костная мука и минеральные смеси, такие как смеси, которые обычно используют в кормах для домашней птицы. Особенно эффективным носителем является сам соответст- 21007183 вующий корм животного, то есть небольшая часть этого корма. Этот носитель способствует однородному распределению соединения в готовом корме, с которым смешивают премикс. Предпочтительно, соединение тщательно перемешивают в премиксе, а затем в корме. В этом отношении, соединение можно диспергировать или растворить в подходящем масляном носителе, таком как соевое масло, кукурузное масло, хлопковое масло и тому подобное, или в летучем органическом растворителе, а затем смешать с носителем. Понятно, что долю соединения в концентрате можно менять в широких пределах, так как количество соединения в готовом корме можно корректировать путем примешивания соответствующей доли премикса в корм для получения желаемого уровня соединения. Высокоэффективные концентраты могут быть смешаны производителем корма с протеинизированным носителем, таким как мука из соевых масличных жмыхов и другие виды муки, как описано выше,для получения концентрированных добавок, которые сразу пригодны для кормления животных. В таких случаях животным дают возможность употреблять обычный рацион. Альтернативно, такие концентрированные добавки можно добавлять непосредственно в корм для получения питательного, сбалансированного готового корма, содержащего терапевтически эффективный уровень соединения по настоящему изобретению. Эти смеси тщательно смешивают обычными способами, например в двухкорпусном смесителе, для обеспечения однородности. Если добавку используют в качестве поверхностной подкормки для корма, она, вероятно, помогает обеспечить однородность распределения соединения по поверхности подкормленного корма. Питьевую воду и корм, эффективные для увеличения отложения постного мяса и для повышения соотношения постное мясо/жир, обычно готовят путем смешивания соединения по настоящему изобретению с достаточным количеством корма животных, чтобы обеспечить от примерно 10-3 до примерно 500 миллионных долей соединения в корме или в воде. Предпочтительный лекарственный корм для свиней, крупного рогатого скота, овец и коз содержит,как правило, от примерно 1 до примерно 400 г соединения по настоящему изобретению (или комбинации) на тонну корма, причем оптимальное количество для этих животных обычно составляет от примерно 50 до примерно 300 г на тонну корма. Предпочтительные корма для домашней птицы и домашних питомцев обычно содержат от примерно 1 до примерно 400 г, и предпочтительно от примерно 10 до примерно 400 г соединения по настоящему изобретению (или комбинации) на тонну корма. Для парентерального введения животным соединения по настоящему изобретению (или комбинации) можно приготовить в форме пасты или гранулы и вводить в виде имплантата, обычно под кожу головы илиуха животного, у которого добиваются повышения отложения постного мяса и улучшения соотношения постное мясо/жир. В общем случае парентеральное введение включает инъекцию достаточного количества соединения по настоящему изобретению (или комбинации) для обеспечения животного количеством лекарства от примерно 0,01 до примерно 20 мг/кг/сутки массы тела. Предпочтительная дозировка лекарства для домашней птицы, свиней, крупного рогатого скота, овец, коз и домашних питомцев находится в пределах от примерно 0,05 до примерно 10 мг/кг/сутки массы тела. Препараты в виде пасты можно приготовить путем диспергирования лекарства в фармацевтически приемлемом масле, таком как арахисовое масло, кунжутное масло, кукурузное масло или подобное. Гранулы, содержащие эффективное количество соединения по настоящему изобретению, фармацевтической композиции или комбинации, можно приготовить путем смешивания соединения по настоящему изобретению или комбинации с разбавителем, таким как карбовоск, карнаубский воск и тому подобные, и для улучшения процесса грануляции можно добавить смазывающий агент, такой как стеарат магния или кальция. Разумеется понятно, что животному можно вводить более чем одну гранулу для достижения необходимого уровня дозировки, который обеспечит повышение отложения постного мяса и улучшение соотношения постное мясо/жир. Кроме того, имплантаты можно также ставить периодически в течение периода обработки животного, чтобы поддерживать точный уровень лекарства в организме животного. Настоящее изобретение обладает несколькими полезными для ветеринарии признаками. Для хозяина домашнего питомца или ветеринара, который желает увеличить стройность или удалить нежелательный жир у домашних питомцев, настоящее изобретение обеспечивает способы, с помощью которых можно это осуществить. Хозяевам домашней птицы и свиней использование способа по настоящему изобретению дает более постных животных, которые идут по более высоким продажным ценам по сравнению с мясной промышленностью. Воплощения настоящего изобретения проиллюстрированы приведенными ниже примерами. Должно быть понятно, однако, что воплощения изобретения не ограничены конкретными деталями этих Примеров, поскольку другие их варианты известны или очевидны специалистам в данной области техники в свете настоящего описания. Примеры Если не указано иное, исходные вещества, как правило, доступны из коммерческих источников, таких как Aldrich Chemicals Co. (Milwaukee, WI), Lancaster Synthesis, Inc. (Windham, NH), Acros OrganicsAstraZeneca Pharmaceuticals (London, England). Общие экспериментальные методики Спектры ЯМР записывали на Varian Unity 400 (доступен от Varian Inc., Palo Alto, CA) при комнатной температуре при 400 МГц для протона. Химические сдвиги выражены в миллионных доляхотносительно остаточного растворителя в качестве внутреннего стандарта. Формы пиков обозначены следующим образом: s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; bs, широкий синглет; 2s,два синглета. Масс-спектры, химическая ионизация при атмосферном давлении (ХИАД), были получены на спектрометре Fisions Platform II (газ-носитель: ацетонитрил; доступен от Micromass Ltd, Manchester,UK). Масс-спектры при химической ионизации (ХИ) были получены на приборе Hewlett-Packard 5989(ионизация аммиаком, РВМС (масс-спектрометрия с использованием пучков ускоренных частиц); доступен от Hewlett-Packard Company, Palo Alto, CA). Масс-спектры при электрораспылительной ионизации(ЭИ) были получены на приборе Waters ZMD (газ-носитель: ацетонитрил; доступен от Waters Corp.,Milford, MA). Если описана интенсивность хлор- или бром-содержащих ионов, то определяли ожидаемое соотношение интенсивностей (примерно 3:1 для 35Cl/37Cl-содержащих ионов и 1:1 для 79Br/81Brсодержащих ионов), при этом приводится интенсивность только иона более низкой массы. В некоторых случаях приведены только характерные пики 1 Н ЯМР. Пики МС приведены для всех примеров. Оптическое вращение определяли на поляриметре PerkinElmer 241 (доступен от PerkinElmer Inc., Wellesley,MA), используя спектральную линию D натрия ( = 589 нм) при указанной температуре, и оно представлено следующим образом: []Dтемп, концентрация (с = г/100 мл) и растворитель. Колоночную хроматографию выполняли с использованием либо силикагеля Baker (40 мкм; J. Т.Baker, Phillipsburg, NJ), либо Silica Gel 50 (EM Sciences, Gibbstown, NJ) в стеклянных колонках или в колонках Flash 40 Biotage (ISC, Inc., Shepton, CT) при низком давлении азота. Пример 1. Получение промежуточного трет-бутилового эфира 4-(2-хлорпиримидин-4-ил)пиперазин-1-карбоновой кислоты (I-1 а). К раствору 2,4-дихлорпиримидина (3,00 г, 20,1 ммоль) в 100 мл этанола добавляли порошкообразный карбонат натрия (2,1 г, 20,1 ммоль) и трет-бутиловый эфир пиперазин-1-карбоновой кислоты (3,75 г,20,1 ммоль). Эту реакционную смесь нагревали до образования флегмы в течение 5 ч, затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток растворяли в 400 мл этилацетата и экстрагировали водой (100 мл) и рассолом (100 мл). Органическую фазу высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме до прозрачного масла. После колоночной флэшхроматографии (силикагель, градиентное элюирование от 10% этилацетата-гексаны до 50% этилацетатагексаны) получили 4,63 г указанного в заголовке соединения (I-1 а). 1 Н ЯМР (400 МГц, CDCl3)8.06 (d, 1H), 6.39 (d, 1H), 3.65-3.50 (m, 8H), 1.46 (s, 9H). МС (ЭИ+) Вычислено: 298; Обнаружено: 299,1 (М+1). Получение промежуточного трет-бутилового эфира 4-[2-(3,5-дифторбензилокси)пиримидин-4-ил] пиперазин-1-карбоновой кислоты (I-1b). 3,5-Дифторбензиловый спирт (227,5 мкл, 2,01 ммоль) растворяли в 15 мл безводного тетрагидрофурана и обрабатывали гидридом натрия (80,3 мг, 60% дисперсия в минеральном масле, 2,01 ммоль). Эту смесь перемешивали в атмосфере азота в течение 15 мин при температуре окружающей среды, затем эту реакционную смесь обрабатывали трет-бутиловым эфиром 4-(2-хлорпиримидин-4-ил)пиперазин-1 карбоновой кислоты (I-1 а) (500 мг, 1,67 ммоль) одной порцией. Полученную смесь кипятили с обратным холодильником в атмосфере азота в течение 4 ч. После охлаждения до комнатной температуры реакционную смесь вливали в воду (50 мл) и экстрагировали этилацетатом (2x50 мл). Объединенные органические экстракты промывали рассолом (20 мл), затем высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией (силикагель, 1:1 этилацетат: гексаны) с получением 605,2 мг указанного в заголовке продукта (I-1b). 1 Н ЯМР (400 МГц, CDCl3)8.04 (d, 1H); 6.96 (d, 2H); 6.72 (t, 1H); 6.20 (d, 1 Н); 5.33 (s, 2H); 3.63 (bs,4H); 3.50 (m, 4H); 1.47 (s, 9H). МС (ЭИ+). Вычислено: 406,4; обнаружено: 407,3 (М+1). Получение 2-(3,5-дифтор-бензилокси)-4-пиперазин-1-ил-пиримидина (1-А). К раствору трет-бутилового эфира 4-[2-(3,5-дифторбензилокси)пиримидин-4-ил]пиперазин-1 карбоновой кислоты (I-1b) (605,2 мг, 1,49 ммоль) в 5 мл дихлорметана добавляли трифторуксусную кислоту (1,72 мл, 22,33 ммоль), и эту смесь перемешивали в течение 3 ч при температуре окружающей среды. Реакционную смесь концентрировали в вакууме, и остаток растворяли в 1 М HCl (водн.) (70 мл). Этот раствор экстрагировали этилацетатом (40 мл), разделяли, и рН водного слоя доводили до 12, используя 5 М КОН (водн.). Эту водную смесь экстрагировали дихлорметаном (2x100 мл), и объединенные органические экстракты высушивали над сульфатом натрия и концентрировали с получением 414,3 мг прозрачного бесцветного масла, которое, как было определено, является указанным в заголовке соединением (1-А). 1 Н ЯМР (400 МГц, CD3OD)7.94 (d, 1H); 7.02 (dd, 2H); 6.84 (dt, 1H); 6.37 (d, 1H); 5.34 (s, 2H); 3.62- 23007183 Получение гидрохлорида 2-(3,5-дифтор-бензилокси)-4-пиперазин-1-ил-пиримидина (1-В). 2-(3,5-Дифторбензилокси)-4-пиперазин-1-ил-пиримидин (1-А) (27,5 мг, 0,09 ммоль) растворяли в 1 мл дихлорметана, обрабатывали 1 М хлороводородом в эфире (89,8 мкл, 0,09 ммоль) и встряхивали в течение одной минуты. Затем эту реакционную смесь концентрировали в потоке азота с получением 30,8 мг указанного в заголовке соединения (1-В) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, CD3OD)8.09 (d, 1H); 7.05 (dd, 2H); 6.88 (dt, 1H); 6.54 (d, 1 Н); 5.39 (s, 2 Н); 3.93(m, 4 Н); 3.28 (m, 4 Н). МС (ХИАД+). Вычислено: 306,3; Обнаружено: 307,1 (М+1). Получение фумарата 2-(3,5-дифторбензилокси)-4-пиперазин-1-ил-пиримидина (1-С). 2-(3,5-Дифторбензилокси)-4-пиперазин-1-ил-пиримидин (1-А) (414,3 мг, 1,35 ммоль) растворяли в 10 мл смеси метанол:изопропиловый эфир, обрабатывали раствором 0,5 М фумаровой кислоты в метаноле (2,70 мл, 1,35 ммоль) и перемешивали в течение 1 ч. Полученную суспензию разбавляли 35 мл изопропилового эфира и перемешивали в течение 10 мин. После фильтрования и последующего высушивания на воздухе получили 549,4 мг указанного в заголовке соединения (1-С). 1 Н ЯМР (400 МГц, CD3OD)8.06 (d, 1H); 7.03 (dd, 2H); 6.86 (dt, 1H); 6.67 (s, 2 Н); 6.49 (d, 1 Н); 5.37(s, 2 Н); 3.87 (m, 4 Н); 3.19 (m, 4 Н). МС (ХИАД+). Вычислено: 306,3; обнаружено: 307,1 (М+1). Используя соответствующие исходные вещества, перечисленные в табл. 1 соединения были получены способом, аналогичным последовательности реакций, описанной выше для получения соединения- 25007183 Пример 2. Получение промежуточного трет-бутилового эфира 4-(4-хлорпиримидин-2-ил)пиперазин-1-карбоновой кислоты (I-2 а). К суспензии 2,4-дихлорпиримидина (1,00 г, 6,71 ммоль) в 13,4 мл толуола добавляли третбутиловый эфир 4-метилпиперазин-1-карбоновой кислоты (1,34 г, 6,71 ммоль). Эту реакционную смесь нагревали до образования флегмы в течение ночи, затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток растворяли в 20 мл воды и экстрагировали этилацетатом (2x40 мл). Объединенные органические слои промывали рассолом (25 мл), затем высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме до не совсем белого твердого вещества. После колоночной флэш-хроматографии (силикагель, градиентное элюирование от 5% этилацетата-гексаны до 20% этилацетата-гексаны) получили 1,14 г указанного в заголовке соединения (I-2 а). 1 Н ЯМР (400 МГц, CDCl3)8.15 (d, 1H); 6.52 (d, 1H); 3.80 (m, 4H); 3.48 (m, 4 Н); 1.47 (s, 9H). МС(ХИАД+). Вычислено: 298; обнаружено: 299,1 (М+1). Получение промежуточного трет-бутилового эфира 4-4-[1-(2-хлорфенил)этокси]пиримидин-2 илпиперазин-1-карбоновой кислоты (I-2b). 1-(2-Хлорфенил)этанол (31,4 мг, 0,20 ммоль) растворяли в 1,7 мл безводного тетрагидрофурана и обрабатывали гидридом натрия (8,0 мг, 60% дисперсия в минеральном масле, 0,20 ммоль). Эту смесь перемешивали в атмосфере азота в течение 1 ч при температуре окружающей среды, затем эту реакционную смесь обрабатывали трет-бутиловым эфиром 4-(4-хлорпиримидин-2-ил)пиперазин-1-карбоновой кислоты (I-2a) (50 мг, 0,17 ммоль) одной порцией. Полученную в результате смесь кипятили с обратным холодильником в атмосфере азота в течение 4 ч. После охлаждения до комнатной температуры реакционную смесь вливали в воду (20 мл) и экстрагировали этилацетатом (2x25 мл). Объединенные органические экстракты промывали рассолом (20 мл), затем высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ТСХ (7:13 этилацетат:гексаны) с получением 64,3 мг указанного в заголовке продукта (I-2b). 1 Н ЯМР (400 МГц, CDCl3)8.00 (d, 1H); 7.38-7.13 (m, 4H); 6.35 (q, 1H); 6.02 (d, 1H); 3.62 (m, 4H); 3.30 (m, 4H); 1.57 (d, 3H); 1.45 (s, 9H). МС (ХИАД+). Вычислено: 418; обнаружено: 419,1 (М+1). Получение 4-[1-(2-хлорфенил)этокси]-2-пиперазин-1-ил-пиримидина (2-А). К раствору трет-бутилового эфира 4-4-[1-(2-хлорфенил)этокси]пиримидин-2-илпиперазин-1 карбоновой кислоты (I-2b) (64,3 мг, 0,15 ммоль) в 2,0 мл дихлорметана добавляли трифторуксусную кислоту (177,4 мкл, 2,30 ммоль), и эту смесь перемешивали в течение 1,5 ч при температуре окружающей среды. Реакционную смесь концентрировали, и остаток растворяли в 1 М HCl (водн.) (10 мл). Эту смесь экстрагировали этилацетатом (10 мл), разделяли, и рН водного слоя доводили до 12, используя 5 М КОН(водн.). Эту водную смесь экстрагировали этилацетатом (2x15 мл), и объединенные органические экстракты высушивали над сульфатом натрия и концентрировали с получением 58,2 мг указанного в заголовке продукта (2-А). 1 Н ЯМР (400 МГц, CDCl3)8.01 (d, 1H); 7.38 (dd, 1H); 7.28 (d, 1H); 7.18-7.11 (m, 2H); 6.36 (q, 1H); 6.00 (d, 1H); 3.68 (bs, 4H); 2.82 (bs, 4H); 1.56 (d, 3 Н). МС (ХИАД+). Вычислено: 318; обнаружено: 319,1(М+1). Получение трифторацетата 4-[1-(2-хлорфенил)этокси]-2-пиперазин-1-ил-пиримидина (2-В). К раствору трет-бутилового эфира 4-4-[1-(2-хлорфенил)этокси]пиримидин-2-илпиперазин-1 карбоновой кислоты (I-2b) (64,3 мг, 0,15 ммоль) в 2,0 мл дихлорметана добавляли трифторуксусную кислоту (177,4 мкл, 2,30 ммоль), и эту смесь перемешивали в течение 1,5 ч при температуре окружающей среды. Реакционную смесь концентрировали, и остаточный растворитель заменяли 6x4 мл гексанов. Обнаружили, что остаток составляет 62,1 мг указанного в заголовке соединения (2-В). 1 Н ЯМР (400 МГц, CDCl3)8.01 (d, 1H); 7.38 (dd, 1H); 7.28 (d, 1H); 7.18-7.11 (m, 2H); 6.36 (q, 1H); 6.00 (d, 2H); 3.68 (bs, 4H); 2.82 (bs, 4H); 1.56 (d, 3 Н). МС (ХИАД+). Вычислено: 318; обнаружено: 319,1(М+1). Используя соответствующие исходные вещества, перечисленные в табл. 2 соединения были получены способом, аналогичным последовательности реакций, описанной выше для получения соединения(2-А) и его соли: трифторацетата (2-В). Соль гидрохлорид образовали аналогично методике, описанной для образования (1-В) в примере 1.(5 мл) нагревали с обратным холодильником в течение 7 суток. Реакционную смесь охлаждали до комнатной температуры, вливали в Н 2O (15 мл) и экстрагировали EtOAc (2x20 мл). Объединенные органические экстракты промывали Н 2O (3x15 мл), рассолом, высушивали (Na2SO4) и концентрировали в вакууме. Остаток очищали препаративной ТСХ (10% МеОН в CH2Cl2) с получением желтого твердого вещества. Это желтое твердое вещество растирали с МеОН (1 мл), и твердое вещество собирали фильтрованием с получением промежуточного соединения I-3 а в виде белого твердого вещества (48,5 мг). 1 Н ЯМР (400 МГц, CD3OD)7.74 (bs, 1H); 7.35-7.17 (m, 4H); 6.01 (bs, 1H); 4.45 (s, 2H); 3.54 (bs, 4H); 3.37 (bs, 4H); 1.44 (s, 9H). МС (ЭИ+). Вычислено: 403,2; обнаружено: 404,1 (М+1). Получение гидрохлорида (3-хлорбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина (3-А). К раствору трет-бутилового эфира 4-[2-(3-хлорбензиламино)пиримидин-4-ил]пиперазин-1-карбоновой кислоты (I-3 а) (48,5 мг, 0,12 ммоль) в CH2Cl2 (1 мл) добавляли трифторуксусную кислоту (139 мкл,1,8 ммоль). После перемешивания при комнатной температуре в течение 3 ч эту смесь вливали в 1 н.NaOH (10 мл) и экстрагировали CH2Cl2 (1x35 мл). Органический слой промывали рассолом, высушивали и концентрировали с получением указанного в заголовке соединения в виде свободного амина. Этот свободный амин в CH2Cl2 (1 мл) добавляли к 1 М HCl в эфире (0,10 мл, 0,10 ммоль). После перемешивания в течение 10 мин при комнатной температуре раствор концентрировали в вакууме с получением гидрохлорида (3-А) (32,4 мг) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, CD3OD)7.82 (d, 1H); 7.38 (s, 1H); 7.35-7.26 (m, 3 Н); 6.51 (d, 1H); 4.60 (s, 2H); 4.04 (bs, 4H); 3.29 (bs, 4H). МС (ХИАД+) Вычислено: 303,2; обнаружено: 304,1 (М+1). Получение фумарата (3-хлорбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина (3-В). К раствору промежуточного соединения (I-3a) (274,2 мг, 0,90 ммоль) в 10 мл смеси 10:1 метанол:изопропиловый эфир добавляли раствор 0,5 М фумаровой кислоты в метаноле (1,80 мл, 0,90 ммоль) и перемешивали в течение 1 ч. Полученную в результате суспензию разбавляли 35 мл изопропилового эфира и перемешивали в течение 10 мин. После фильтрования и последующего высушивания на воздухе получили 356,8 мг указанного в заголовке соединения (3-В). 1 Н ЯМР (400 МГц, CD3OD)7.81 (d, 1H); 7.32-7.18 (m, 4 Н); 6.67 (s, 2H); 6.16 (d, 1H); 4.50 (s, 2H); 3.80 (bs, 4H); 3.11 (bs, 4H). МС (ХИАД+). Вычислено: 303,2; обнаружено: 304,3 (М+1). Используя соответствующие исходные вещества, приведенные ниже соединения были получено способом, аналогичным последовательности реакций, описанной выше для получения соединения (3-А). Гидрохлорид (3-фторбензил)-(4-пиперазин-1-ил-пиримидин-2-ил)амина (3-С).(5 мл) нагревали с обратным холодильником в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры, вливали в Н 2O (15 мл) и экстрагировали EtOAc (2x18 мл). Объединенные органические экстракты промывали Н 2O (2x10 мл), рассолом, высушивали (Na2SO4) и концентрировали в вакууме. Остаток очищали хроматографией, используя 40% EtOAc в гексане в качестве элюирующего растворителя,с получением указанного в заголовке соединения I-4a (93 мг) в виде бесцветного масла. 1 Н ЯМР (400 МГц, CD3OD)7.69 (d, 1H); 7.32 (s, 1H); 7.28-7.19 (m, 3 Н); 5.88 (d, 1 Н); 4.49 (s, 2 Н); 3.64-3.61 (m, 4 Н); 3.37-3.29 (m, 4H); 1.45 (s, 9H). МС (ЭИ+). Вычислено: 403,2; обнаружено: 404,0 (М+1). Получение гидрохлорида (3-хлорбензил)-(2-пиперазин-1-ил-пиримидин-4-ил)амина (4-А). Указанное в заголовке соединение (4-А) было получено из трет-бутилового эфира 4-[4-(3-хлорбензиламино)пиримидин-2-ил]пиперазин-1-карбоновой кислоты (1-4 а) и ТФУ (трифторуксусной кислоты) по методике, аналогичной методике, описанной в примере 3. 1 Н ЯМР (400 МГц, CD3OD)7.74 (d, 1H); 7.35-7.25 (m, 4H); 6.15 (d, 1H); 4.60 (s, 2 Н); 3.97-3.94 (m,4 Н); 3.27-3.23 (m, 4 Н). МС (ХИАД+). Вычислено: 303,2; обнаружено: 304,1 (М+1). Используя соответствующие исходные вещества, соединение (4-В) было получено последовательностью реакций, аналогичной описанной выше для соединения (4-А), а соответствующая соль фумарат(4-С) была получена по методике, аналогичной методике получения фумарата, описанной в примере 3(s, 3 Н); 5.94 (d, 1H); 4.53 (s, 2H); 3.87 (m, 4H); 3.13-3.11 (m, 4H). МС (ХИАД+) Вычислено: 287,2; Обнаружено: 288,1 (М+1). Гидрохлорид бензил-(2-пиперазин-1-ил-пиримидин-4-ил)амина (4-D). МС (ХИАД+) Вычислено: 305,3; Обнаружено: 306,2 (М+1). Пример 5. Получение промежуточного соединения (6-хлорпиридин-2-ил)метанол (I-5 а). В сухую колбу загружали 25 мл безводного тетрагидрофурана и 6-хлорпиридин-2-карбоновую кислоту (2,00 г, 12,69 ммоль), а затем охлаждали до 10 С. Эту смесь обрабатывали по каплям тетрагидрофуранбораном (1,0 М раствор в ТГФ, 38,1 мл) в течение 10 мин в атмосфере азота. Эту смесь перемешивали при охлаждении в течение 15 мин, затем при температуре окружающей среды в течение 4 ч. Затем реакционную смесь охлаждали до 0 С и медленно добавляли 10 мл воды. Полученную смесь вливали в 50 мл 1 М водного гидроксида натрия и экстрагировали 2x75 мл этилацетата. Органические экстракты объединяли и промывали рассолом, затем высушивали над сульфатом натрия и фильтровали. После концентрирования в вакууме получили 589,1 мг указанного в заголовке соединения (I-5 а) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)7.67 (t, 1H); 7.25 (m, 2H); 4.74 (s, 2H). МС (ЭИ+). Вычислено: 143; обнаружено: 144,3 (М+1). Получение промежуточного трет-бутилового эфира 4-[2-(6-хлорпиридин-2-илметокси)пиримидин 4-ил]пиперазин-1-карбоновой кислоты (I-5b). Указанное в заголовке соединение (I-5b) было получено из (6-хлорпиридин-2-ил)метанола (I-5 а) и трет-бутилового эфира 4-(2-хлорпиримидин-4-ил)-1-карбоновой кислоты (I-1 а) по методике, аналогичной описанной в примере 1. 1 Н ЯМР (400 МГц, CDCl3)8.03 (d, 1H); 7.63 (t, 1H); 7.43 (d, 1H); 7.21 (d, 1 Н); 6.16 (d, 1H); 5.42 (s,2H); 3.59 (m, 4H); 3.45 (m, 4H); 1.46 (s, 9H). МС (ЭИ+) Вычислено: 405; Обнаружено: 406,1 (М+1). Получение гидрохлорида 2-(6-хлорпиридин-2-илметокси)-4-пиперазин-1-ил-пиримидина (5-А). Указанное в заголовке соединение (5-А) было получено из трет-бутилового эфира 4-[2-(6-хлорпиридин-2-илметокси)пиримидин-4-ил]-пиперазин-1-карбоновой кислоты (I-5b) и ТФУ по методике,аналогичной описанной в примере 3. 1 Н ЯМР (400 МГц, CD3OD)8.08 (d, 1H); 7.80 (t, 1H); 7.46 (d, 1H); 7.36 (d, 1 Н); 6.53 (d, 1H); 5.41 (s,2H); 3.91 (m, 4H); 3.27 (m, 4H). МС (ЭИ+). Вычислено: 305; обнаружено: 306,0 (М+1).- 28007183 Используя соответствующие исходные вещества, перечисленные в таблице 4 соединения были получены последовательностью реакций, аналогичной описанной выше для получения соединения (5-А). Таблица 4 Пример 6. Пример 6 иллюстрирует синтез ингибитора NEP - (S)-2-[(1-[3-(4-хлорфенил)пропил] карбамоилциклопентил)метил]-4-метоксибутановой кислоты, упомянутого здесь ниже для применения в комбинации с соединениями по настоящему изобретению для лечения женской сексуальной дисфункции. Получение промежуточной 1-[2-(трет-бутоксикарбонил)-4-метоксибутил]-циклопентанкарбоновой кислоты (I-6 а). Раствор трет-бутил-3-(1-карбоксициклопентил)пропаноата (12 г, 49,5 ммоль) (см. ЕР 274234 В 1,пример 35) в сухом тетрагидрофуране (100 мл) добавляли к перемешиваемому раствору диизопропиламида лития (130 мл) в смеси гексана (52 мл) и тетрагидрофурана (200 мл) при -78 С в атмосфере азота. Через 1 ч добавляли раствор 2-бромэтилметилового эфира в тетрагидрофуране (100 мл), поддерживая температуру при -78 С. Этой реакционной смеси давали нагреться до комнатной температуры в течение ночи. Смесь гасили водой (100 мл), подкисляли до рН 1 2 М соляной кислотой и экстрагировали этилацетатом (2x150 мл). Объединенные органические слои высушивали над сульфатом магния и концентрировали в вакууме с получением сырой кислоты, которую подвергали хроматографии на силикагеле. В результате элюирования возрастающими долями метанола в дихлорметане (от чистого дихлорметана до 1:50) получили масло (7,7 г, 25,6 ммоль, 52%); Rf 0.3 метанол, дихлорметан 1:20. 1 Н ЯМР (CDCl3, 400 МГц) : 1.4 (s, 9 Н), 1.4-1.7 (m, 7 Н), 1.75-1.95 (m, 2 Н), 2.0-2.15 (m, 3 Н), 2.3-2.4(m, 1 Н), 3.3 (s, 3 Н), 3.3-3.4 (m, 2 Н); МСНР (масс-спектр низкого разрешения): m/z 299 (М-Н+). Получение промежуточной 1-[(2S)-2-(трет-бутоксикарбонил)-4-метоксибутил]-циклопентанкарбоновой кислоты (I-6b). Промежуточное соединение I-6 а и (+)-псевдоэфедрин перекристаллизовали девять раз из гексана с получением белого кристаллического твердого вещества. Эту соль растворяли в этилацетате, промывали 0,5 М соляной кислотой, высушивали над сульфатом магния и концентрировали в вакууме с получением(S)-кислоты с выходом 31% в виде бледно-желтого масла при 90% ее (энантиомерный избыток) на основании ЯМР анализа пика 3.3 соли (+)-псевдоэфедрина; 1 Н ЯМР (CDCl3, 400 МГц) : 1.4 (s, 9 Н), 1.4-1.7 (m, 7 Н), 1.75-1.9 (m, 2 Н), 2.0-2.15 (m, 3 Н), 2.35-2.45(m, 1 Н), 3.3 (s, 3 Н), 3.3-3.4 (m, 2 Н); []D -5,2 (EtOH, с 1,2). Получение промежуточного трет-бутил-(2S)-2-[1-([3-(4-хлорфенил)-пропил]аминокарбонил) циклопентил]метил-4-метоксибутаноата (I-6 с). К раствору 1,1'-карбонилдиимидазола (73,9 г, 0,45 моль) в азеотропно высушенном изопропилацетате (339 мл) добавляли раствор промежуточного соединения I-6b в изопропилацетате при перемешивании при 60 С в атмосфере N2 в течение 1,5 ч. Затем перекачивающие линии промывали сухим изопропилацетатом (50 мл). Затем полученный раствор перемешивали при 60 С в течение еще 4,5 ч, после чего реакционной смеси давали возможность охладиться до комнатной температуры и перемешивали в течение 15 ч. К полученному раствору добавляли триэтиламин (46,1 г, 0,46 моль), а затем гидрохлорид 3-(4 хлорфенил)-пропиламина (J. Med. Chem., 1996, 39, 4942-51) (94,3 г, 0,46 моль). Затем полученную смесь нагревали до 60 С в течение 7 ч, после чего охлаждали ее до комнатной температуры. К реакционной смеси при перемешивании добавляли деионизованную воду (100 мл), а затем водную соляную кислоту(190 мл 5 М раствора) до рН водного слоя между рН 2 и 3. После этого водный слой отделяли, и органический слой промывали водным карбонатом калия (50 мл 0,5 М раствора). Водную фазу отделяли, и органическую фазу промывали насыщенным рассолом (100 мл). Затем водный слой отделяли, и органическую фазу концентрировали путем дистилляции в вакууме с получением указанного в заголовке соединения в виде желтого масла (200,3 г, 443 ммоль, выход 98%); 1 Н ЯМР (CDCl3, 300 МГц) : 1.45 (s, 9 Н), 1.45-1.56 (m, 1 Н), 1.56-1.74 (m, 6 Н), 1.74-2.11 (m, 7 Н),2.32-2.43 (m, 1 Н), 2.64 (t, 2 Н), 3.22-3.30 (m, 2 Н), 3.27 (s, 3 Н), 3.30-3.38 (m, 2 Н), 5.75-5.85 (m, br, 1H), 7.13(d, 2H), 7.26 (d, 2H); МСНР (ЭИ положительная): m/z 452 [M+H]+ (35Cl). Получение (2S)-2-[1-([3-(4-хлорфенил)пропил]аминокарбонил)циклопентил]метил-4-метоксибутановой кислоты и ее натриевой соли (6-А). К раствору промежуточного соединения I-6 с (9,6 г, 21,2 ммоль) в дихлорметане (52 мл) добавляли трифторуксусную кислоту (16,3 мл, 212 ммоль), и полученный раствор перемешивали при комнатной- 29007183 температуре в течение 3,75 ч в атмосфере N2. Затем к реакционной смеси добавляли водный раствор карбоната натрия (95 мл 10% раствора мас./об.) при перемешивании до рН водного слоя между рН 2 и 3. После этого слои разделяли, и органический слой экстрагировали водным раствором карбоната натрия(2x20 мл 10% раствора мас./об). Водные слои объединяли, а затем добавляли насыщенный рассол (80 мл) с последующим добавлением 2-бутанона (40 мл). Слои разделяли, и водный слой снова экстрагировали 2-бутаноном (2x50 мл). Затем объединенные органические слои высушивали путем азеотропной дистилляции при атмосферном давлении до объема 70 мл, вследствие чего происходила кристаллизация, и эту смесь разбавляли 2-бутаноном (70 мл). Затем продукт собирали фильтрованием и высушивали при 50 С в течение 65 ч в вакууме с получением сырой натриевой соли указанного в заголовке соединения в виде белого твердого вещества (5,76 г), которое затем очищали путем перекристаллизации, как описано ниже. К сырому продукту добавляли этилацетат (87 мл) и этанол (13 мл), и остаточное нерастворимое вещество удаляли фильтрованием. Затем этанол удаляли путем азеотропной дистилляции при атмосферном давлении (до удаления 110 мл растворителя) и заменяли этилацетатом (145 мл), вследствие чего происходила кристаллизация. Затем полученный кристаллизованный продукт собирали фильтрованием в вакууме с получением чистой натриевой соли указанного в заголовке соединения в виде белого кристаллического твердого вещества (4,51 г, 10,8 ммоль, 51%); т. пл. (этилацетат) 214-216 С; 1 Н ЯМР (ДMCO-d6, 300 МГц) : 1.26-1.58 (m, 8H), 1.62-1.74 (m, 3 Н), 1.74-1.86 (m, 1 Н), 1.91-2.07 (m,3 Н), 2.57 (t, 2H), 3.03 (q, 2H), 3.10 (s, 3 Н), 3.13-3.27 (m, 2 Н), 7.22 (d, 2H), 7.29 (d, 2H), 9.16 (t, br, 1H); МСНР (ЭИ отрицательная): 789 [2 М-Н]- (35Cl), 394 [М-Н]- (35Cl). Для аналитических целей указанный в заголовке продукт (то есть свободную кислоту) получали путем растворения этой натриевой соли в воде, подкисленной 5 М соляной кислотой, и экстракции дихлорметаном. После удаления растворителя путем продувания потоком азота над образцом получили указанный в заголовке продукт; 1 Н ЯМР (ДМСО-d6, 300 МГц) : 1.22-1.80 (m, 11H). 1.81-1.96 (m, 2 Н), 1.96-2.08 (m, 1 Н), 2.93-2.27(m, 1 Н), 2.53 (t, 2H), 3.03 (q, 2H), 3.11 (s, 3 Н), 3.16-3.25 (m, 2 Н), 7.20 (d, 2H), 7.30 (d, 2H), 7.51 (t, 1H); МСНР (ЭИ отрицательная): 789 [2 М-Н]-(35Cl), 394 [М-Н]- (35Cl); ВЭЖХ (колонка ChiralPak AS (25x0,46 см); подвижная фаза: гексан/изопропилацетат/уксусная кислота (95/5/0,5 об./об./об.); скорость потока: 1,0 мл/мин; температура окружающей среды; впрыскиваемый объем: 20 мкл; детекция: УФ 220 нм; концентрация образца: 1,0 мг/мл, приготовлен в подвижной фазе). Время удерживания: неосновной энантиомер 11,4 мин (5,7%), основной энантиомер 14,3 мин (94,3%). Получение моногидрата натриевой соли 6-А. К натриевой соли 6-А (200 мг) добавляли до 1 мл 3,9% воды в растворе изопропанола. Полученную суспензию перемешивали в течение 12 суток, после чего выделяли фильтрованием. Продукт дал следующую картину дифракции рентгеновских лучей на порошке, приведенную ниже в табл. 5. Таблица 5
МПК / Метки
МПК: A61P 25/28, C07D 401/12, A61K 31/506, C07D 239/46
Метки: лиганды, 5-нт, рецепторов, применение
Код ссылки
<a href="https://eas.patents.su/30-7183-ligandy-receptorov-5-nt-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Лиганды рецепторов 5-нт и их применение</a>
Предыдущий патент: Способ идентификации низкомолекулярных веществ, имитирующих эпитопы млекопитающих, и способ получения специфических анти-идиотипических моноклональных антител
Следующий патент: Производные пиразола для лечения инфекции вируса иммунодефицита человека (вич)
Случайный патент: Способ инжекции потока подаваемого газа в вытянутый по вертикали столб жидкости












